1,4-пиперазиновые производные в качестве средства от вирусного гриппа
Номер патента: 23258
Опубликовано: 31.05.2016
Авторы: Пирс Бредли С., Пендри Аннапурна, Ши Шухао, Чжу Шижун, Герритц Самюэл, Чжай Вэйсюй, Ли Гуо, Сианси Кристофер В.
Формула / Реферат
1. Соединение формулы I, в том числе его фармацевтически приемлемая соль
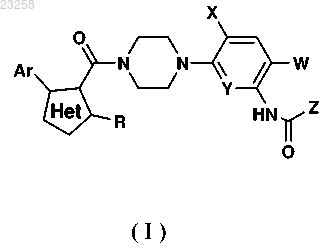
в котором Het представляет собой изоксазол-4-ил, пиразол-4-ил, пиразол-3-ил, 1,2,3-триазол-5-ил или имидазол-5-ил;
Ar представляет собой нафт-1-ил; фенил, необязательно замещенный одним заместителем, выбранным из С1-С4 алкокси, -F, -Cl или гидроксила;
R представляет собой -СН3 или -CH2F;
W представляет собой -NO2, -Cl, -Br, -СНО, -СН3, гидроксиметил, -СН=СН2, гидроксииминометил или -CN;
X представляет собой -Cl, -Br или -CN;
Y представляет собой -СН или -N и
Z представляет собой фенил, необязательно замещенный 1-3 заместителями, выбранными из C1-С2 алкила, C1-С2 алкокси, дифторметокси, трифторметил, фтор, нитро, циано, ди(С1-С2)алкиламино, мезиламино, мезил(метил)амино, метиламино, метиламинометил, диметиламинометил, диметилкарбамоил, метоксикарбоксил, ацетиламино, тетразол-1-ил, 2,4-диоксоимидазолидин-1-ил, 2-оксоимидазолидин-1-ил, 1,2,4-триазол-1-ил, 5-метил-1,3,4-оксадиазол-2-ил, 1,1-диоксоизотиазолидин-2-ил, 1,2,3-триазол-2-ил, пирролидин-1-ил, 2-оксопирролидин-1ил, 2,5-диоксопирролидин-1-ил, 2-оксопиперидин-1ил, азетин-1-ил, 2-оксо-1,3-оксазан-3-ил, при этом, если в фенильном кольце присутствуют два или три заместителя, один или два из них являются галогенами; тиен-2-ил, возможно замещенный заместителем метил или хлор; пиридин-2-ил, возможно замещенный заместителем трифторметил или бром; фуран-2-ил, тиазол-2-ил, 5-метилизоксазол-3-ил, бензодиоксол-5-ил, пиразин-2-ил или С3-С4 циклоалкил.
2. Соединение по п.1, в котором Het выбран из группы
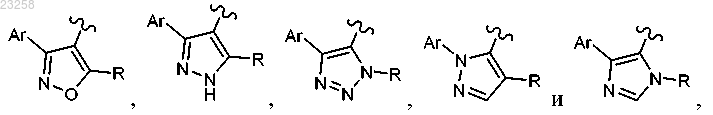
3. Соединение по п.1, в котором Ar представляет собой
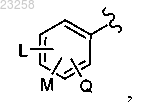
в котором L представляет собой Н, -F, -Cl, гидроксил или С1-С4 алкокси;
М представляет собой Н, -F, -Cl, гидроксил или С1-С4 алкокси;
Q представляет собой Н, -F, -Cl, гидроксил или С1-С4 алкокси.
4. Соединение по п.3, в котором Ar представляет собой фенил.
5. Соединение по п.4, в котором Ar представляет собой фенил, замещенный гидроксилом.
6. Соединение по п.1, в котором W представляет собой -NO2, -Cl, -Br или -CN.
7. Соединение по п.1, в котором X представляет собой -Cl или -CN.
8. Соединение по п.1, в котором Y представляет собой -СН или -N и Ar представляет собой фенил, замещенный гидроксилом.
9. Соединение по п.1, в котором Z представляет собой замещенный арил или замещенный гетероарил, выбранный из группы
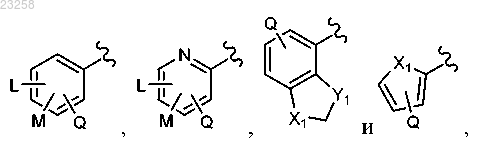
где L представляет собой Н, галоген, циано, гидроксил, амино, С1-С6алкил, С1-С6алкокси, С1-С6алкиламино или амидо;
М представляет собой Н, галоген, циано, гидроксил, амино, С1-С6алкил, С1-С6алкокси, С1-С6алкиламино или амидо;
Q представляет собой Н, галоген, циано, гидроксил, амино, С1-С6алкил, С1-С6алкокси, С1-С6алкиламино или амидо;
X1 представляет собой О, NH, N- С1-С6алкил, N-арил, S или СН2 и
Y1 представляет собой О, NH, N- С1-С6алкил, N-арил, S или СН2.
10. Соединение по п.9, в котором Z представляет собой замещенный фенил.
11. Соединение по п.1, в котором R представляет собой -СН3 или -CH2F.
12. Соединение по п.6, в котором W представляет собой -NO2, -Сl или -Br.
13. Соединение по п.7, в котором X представляет собой -Cl.
14. Соединение по п.8, в котором Y представляет собой -СН или -N.
15. Соединение по п.11, в котором R представляет собой -СН3.
16. Соединение по п.12, в котором W представляет собой -NO2 или -Br.
17. Соединение по п.14, в котором Y представляет собой -СН.
18. Соединение, выбранное из группы, состоящей из
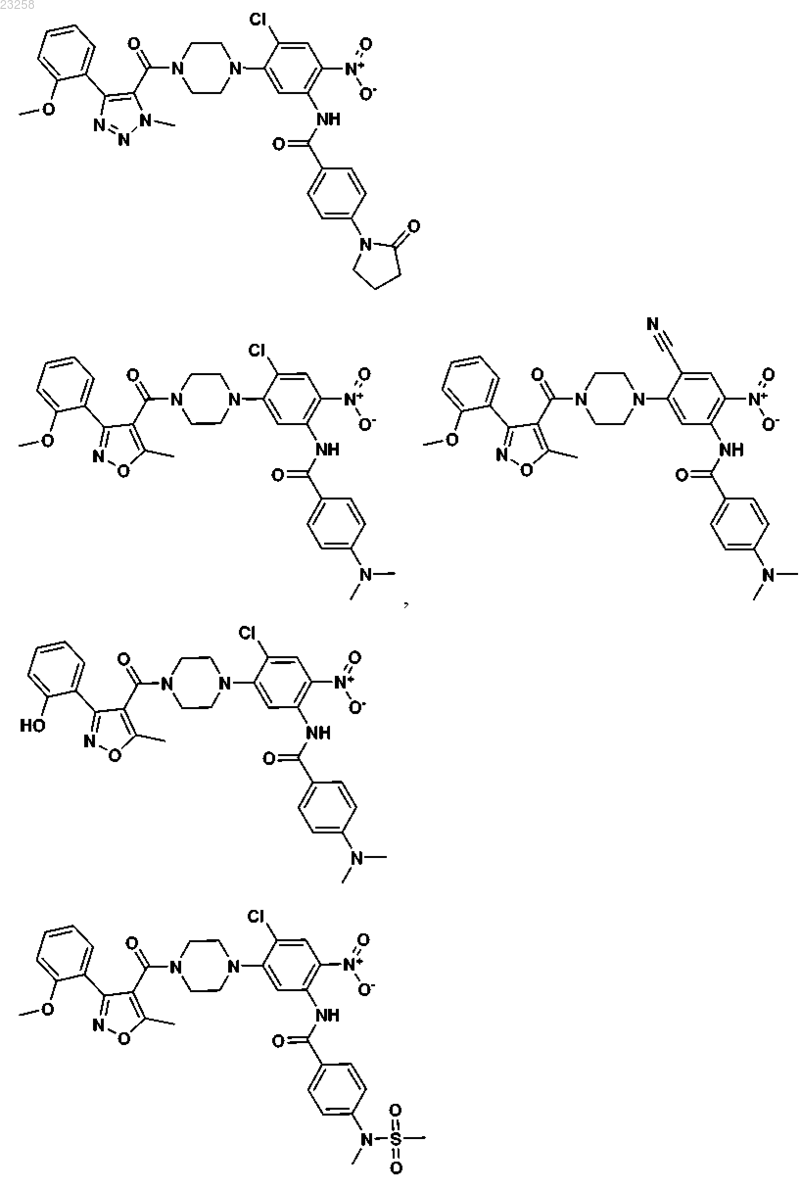
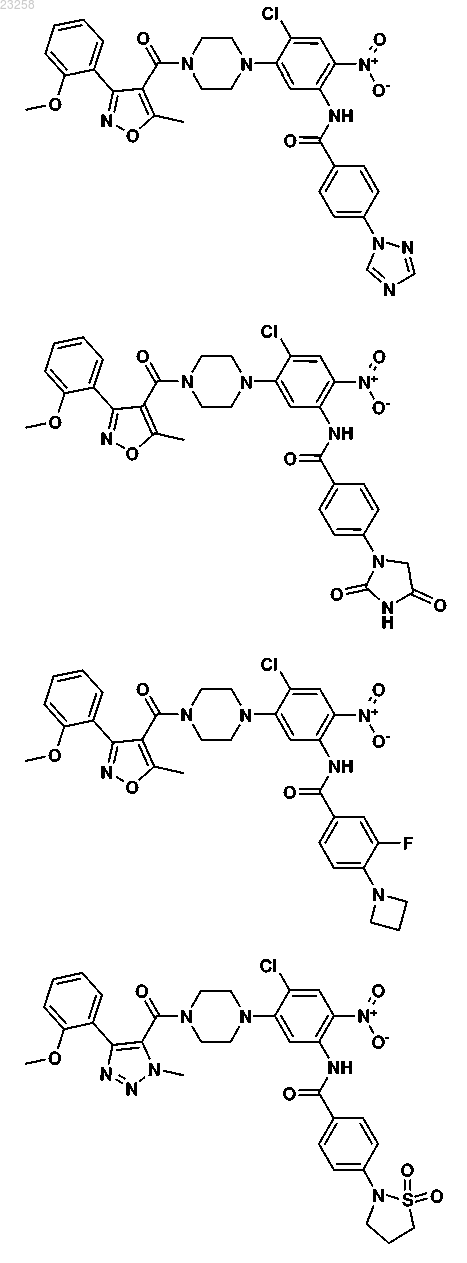
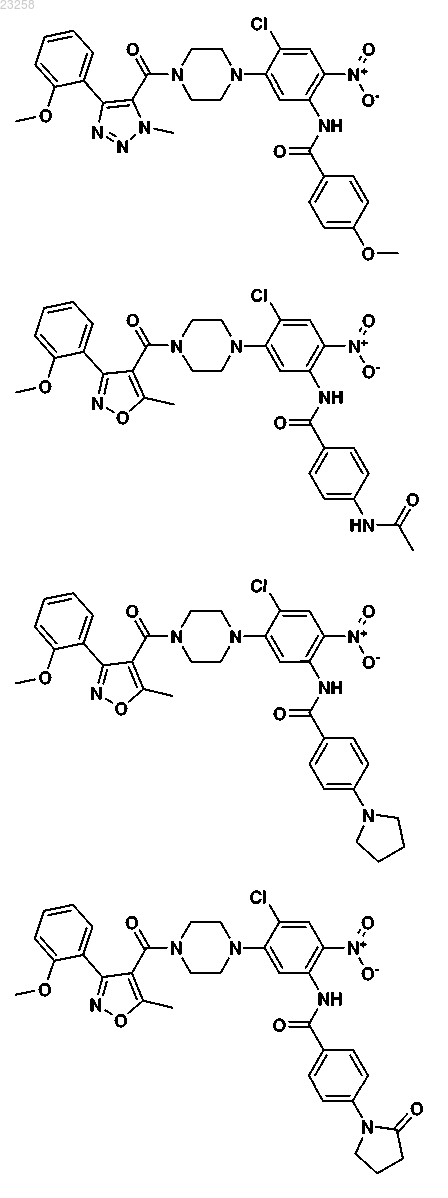
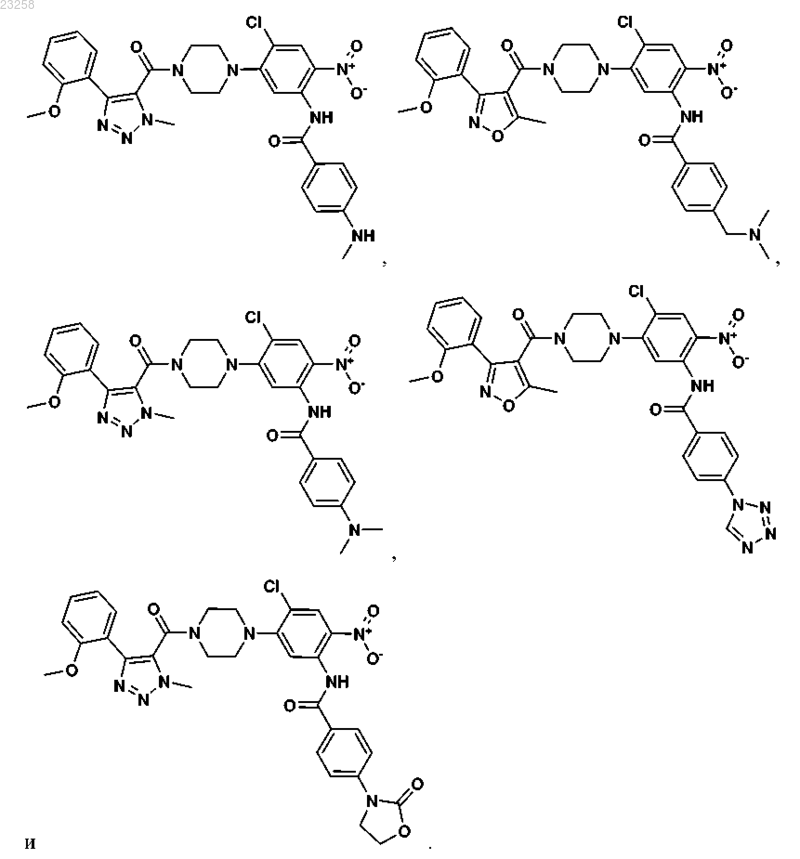
19. Фармацевтическая композиция, содержащая противовирусное эффективное количество одного или более соединений формулы I по п.1 совместно с одним или более фармацевтически приемлемыми носителями, эксципиентами или растворителями.
20. Способ лечения млекопитающего, инфицированного вирусом гриппа, включающий введение противовирусного эффективного количества соединения формулы I по п.1 и одного или более фармацевтически приемлемых носителей, эксципиентов или растворителей.
Текст
1,4-ПИПЕРАЗИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ СРЕДСТВА ОТ ВИРУСНОГО ГРИППА Предложено соединение формулы I, в том числе его фармацевтически приемлемые соли в котором Het представляет собой изоксазол-4-ил, пиразол-4-ил, пиразол-3-ил, 1,2,3-триазол-5 ил или имидазол-5-ил; Ar представляет собой нафт-1-ил; фенил, необязательно замещенный одним заместителем, выбранным из С 1-С 4 алкокси, -F, -Cl или гидроксила; R представляет собой -СН 3 или -CH2F; W представляет собой -NO2, -Cl, -Br, -СНО, -СН 3, гидроксиметил,-СН=СН 2, гидроксииминометил или -CN; X представляет собой -Cl, -Br или -CN; Y представляет собой -СН или -N; и Z представляет собой фенил, необязательно замещенный 1-3 заместителями, выбранными из C1-С 2 алкила, C1-С 2 алкокси, дифторметокси, трифторметил,фтор, нитро, циано, ди(С 1-С 2)алкиламино, мезиламино, мезил(метил)амино, метиламино,метиламинометил, диметиламинометил, диметилкарбамоил, метоксикарбоксил, ацетиламино,тетразол-1-ил, 2,4-диоксоимидазолидин-1-ил, 2-оксоимидазолидин-1-ил, 1,2,4-триазол-1-ил, 5 метил-1,3,4-оксадиазол-2-ил, 1,1-диоксоизотиазолидин-2-ил, 1,2,3-триазол-2-ил, пирролидин-1 ил, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, 2-оксопиперидин-1-ил, азетин-1-ил, 2 оксо-1,3-оксазан-3-ил, при этом если в фенильном кольце присутсвуют два или три заместителя один или два из них являются галогенами; тиен-2-ил, возможно замещенный заместителем метил или хлор; пиридин-2-ил, возможно замещенный заместителем трифторметил или бром; фуран-2 ил, тиазол-2-ил, 5-метилизоксазол-3-ил, бензодиоксол-5-ил, пиразин-2-ил, или С 3-С 4 циклоалкил. Данное соединение в составе композиций пригодно для предупреждения и лечения вируса гриппа. Область техники Настоящее изобретение относится к новым соединениям, пригодным для профилактики и лечения гриппа, а также к композициям и препаратам, содержащим эти соединения. Изобретение также относится к способам профилактики и лечения гриппозной инфекции с использованием описанных здесь соединений. Уровень техники Вирус гриппа является серьезным возбудителем острой инфекции нижних дыхательных путей у человека. Он легко передается, приводя к ежегодным эпидемическим заболеваниям, которые могут проявляться в виде тяжелой болезни и приводить к смерти среди населения высокого риска. Это один из РНКсодержащих вирусов семейства Orthomyxoviridae, который поражает птиц и млекопитающих, и ответственен за болезнь, обычно называемую как "грипп". Наиболее распространенными симптомами гриппа являются озноб, лихорадка, боль в горле, боли в мышцах, сильная головная боль, кашель, слабость/усталость и общее недомогание. Боль в горле, лихорадка и кашель являются наиболее частыми симптомами. В более серьезных случаях грипп вызывает пневмонию, которая может быть смертельной,особенно для юных и пожилых людей. Несмотря на то, что его часто путают с другими гриппоподобными заболеваниями, особенно с простудой, грипп является более тяжелым заболеванием, чем обычная простуда, и вызывается другим типом вируса. Грипп может привести к тошноте и рвоте, особенно у детей, хотя эти симптомы более характерны для не связанного с гриппом гастроэнтерита, который иногда называют "желудочным гриппом" или "24-часовым гриппом". Как правило, вирус гриппа передается по воздуху при кашле или чихании, создавая содержащие вирус аэрозоли. Грипп может передаваться при непосредственном контакте с птичьим пометом или с выделениями из носа, либо через контакт с зараженными поверхностями. Переносимые по воздуху аэрозоли считаются основной причиной заражения, хотя какие именно средства передачи являются наиболее важным, не совсем ясно. Постоянная опасность гриппа остается, так как сезонно появляются новые варианты. Ежегодные эпидемии приносят экономические потери в результате снижения производительности труда, наряду с расходами средств здравоохранения. Кроме того, вирус гриппа ответственен за основные пандемии, происходящие каждые 10-50 лет. В 2009 го. в Северной Америке в результате тройной реассортации свиного гриппа появился новый вирус H1N1, который достиг уровня пандемии (Zimmer и Burke, 2009). Способность вируса гриппа к мутациям (антигенный дрейф), также как и реассортация с другими вирусами гриппа от разных видов млекопитающих (антигенная изменчивость) представляют собой механизмы,вызывающие сезонные эпидемические колебания и пандемические вирусные вспышки, соответственно(Chen и Deng, 2009). Помимо этого, возрастает резистентность к доступным противогриппозным препаратам. Большинство штаммов H3N2 и 2009 H1N1 устойчивы к М 2 ингибиторам ионных каналов на основе адамантана (Deyde и др., 2009). Кроме того, 2008 H1N1 проявляют резистентность к ингибитору нейраминидазы Тамифлю (Озельтамивир), стандарту медицинской помощи (Moscona, 2009). Ни один класс препаратов не проявляет эффективность против высокопатогенного H5N1 птичьего вируса (Soepandi, 2010). Таким образом, в настоящее время существует потребность в многочисленных новых терапевтических и профилактических средствах против вируса гриппа. Также необходимы новые композиции и препараты, содержащие эти средства, также как и новые способы профилактики и лечения гриппа с использованием этих средств. Сущность изобретения Изобретение в первом варианте осуществления обеспечивает соединение формулы I, в том числе его фармацевтически приемлемые соли:Ar представляетнафт-1-ил; фенил, необязательно замещенный одним заместителем,выбранным из С 1-С 4 алкокси, -F, -Cl или гидроксила;Z представляет собой фенил необязательно замещенный 1-3 заместителями, выбранными из C1-С 2 алкила, C1-С 2 алкокси, дифторметокси, трифторметил, фтор, нитро, циано, ди(С 1-С 2)алкиламино, мези-1 023258 ламино, мезил(метил)амино, метиламино, метиламинометил, диметиламинометил, диметилкарбамоил,метоксикарбоксил, ацетиламино, тетразол-1-ил, 2,4-диоксоимидазолидин-1-ил, 2-оксоимидазолидин-1 ил, 1,2,4-триазол-1-ил, 5-метил-1,3,4-оксадиазол-2-ил, 1,1-диоксоизотиазолидин-2-ил, 1,2,3-триазол-2-ил,пирролидин-1-ил, 2-оксопирролидин-1 ил, 2,5-диоксопирролидин-1-ил, 2-оксопиперидин-1 ил, азетин-1 ил, 2-оксо-1,3-оксазан-3-ил, при этом если в фенильном кольце присутсвуют два или три заместителя один или два из них являются галогенами; тиен-2-ил, возможно замещенный заместителем метил или хлор; пиридин-2-ил, возможно замещенный заместителем трифторметил или бром; фуран-2-ил, тиазол-2 ил, 5-метилизоксазол-3-ил, бензодиоксол-5-ил, пиразин-2-ил, или С 3-С 4 циклоалкил. Также в части изобретения предусмотрена фармацевтическая композиция, которая содержит противовирусное эффективное количество одного или более соединений формулы I, в том числе их фармацевтически приемлемых солей, вместе с одним или более фармацевтически приемлемых носителей, эксципиентов или растворителей. Кроме того, предусматривается способ лечения млекопитающего, инфицированного вирусом гриппа, включающий введение указанному млекопитающему эффективного противовирусного количества соединения формулы I, в том числе его фармацевтически приемлемой соли, и одного или более фармацевтически приемлемых носителей, эксципиентов или растворителей. Настоящее изобретение направлено на эти и другие важные цели, описанные ниже. Подробное описание изобретения Поскольку соединения по настоящему изобретению могут иметь асимметричные центры и, следовательно, встречаются в виде смеси диастереомеров и энантиомеров, настоящее изобретение включает отдельные диастереомерные и энантиомерные формы соединения формулы I в дополнение к их смесям. Определения Если в каком-либо месте заявки специально не указано иное, могут быть использованы один или более нижеуказанных терминов, которые следует трактовать следующим образом: Термин "C1-6 алкил" при использовании здесь означает прямую или разветвленную цепь алкильных групп, таких как метил, этил, пропил, изопропил, бутил, изобутил, t-бутил, амил, гексил и т.п."Н" или "Водород" относится к водороду, включая его изотопы, такие как дейтерий. Группа "арил" относится ко всем углеродным моноциклическим или конденсированным полициклическим (т.е. к кольцам, имеющим смежные пары атомов углерода) группам, имеющим полностью сопряженную пи-электронную систему. Неограничивающими примерами арильных групп являются фенил,нафталенил и антраценил. Арильная группа может быть замещенной или незамещенной. В случае замещения замещенная(-ые) группа(-ы) предпочтительны представляет(-ют) собой одну или более групп,выбранных из алкила, циклоалкила, арила, гетероарила, гетероалицикла, гидрокси, алкокси, арилокси,гетероарилокси, гетероалициклокси, тиогидрокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галоген, нитро, карбонил, О-карбамил, N-карбамил, С-амидо, N-амидо, С-карбокси, Окарбокси, сульфинила, сульфонила, сульфонамидо, тригалометил, уреидо, амино и -NRxRy, где Rx и Ry независимо выбирают из группы, состоящей из водорода, алкила, циклоалкила, арила, карбонила, Скарбокси, сульфонила, тригалометила и объединенных в пяти- или шестичленные гетероалициклические кольца. При использовании здесь группа "гетероарил" относится к моноциклической или конденсированной кольцевой (т.е. к кольцам, имеющим смежные пары атомов углерода) группе, имеющей в кольце(-ах) один или более атомов, выбранных из группы, состоящей из азота, кислорода и серы, и в дополнении имеющей полностью сопряженную пи-электронную систему. Если не указано иное, гетероарильная группа может быть присоединена либо к атому углерода, либо к атому азота в гетероарильной группе. Следует отметить, что термин гетероарил должен охватывать N-оксид исходного гетероарила, если такойN-оксид химически возможен, как известно в данной области. Неограничивающими примерами гетероарильных групп являются фурил, тиенил, бензотиенил, тиазолил, имидазолил, оксазолил, оксадиазолил,тиадиазолил, бензотиазолил, триазолил, тетразолил, изоксазолил, изотиазолил, пирролил, пиранил, тетрагидропиранил, пиразолил, пиридил, пиримидинил, хинолинил, изохинолинил, пуринил, карбазолил,бензоксазолил, бензимидазолил, индолил, изоиндолил, пиразинил, диазинил, пиразин, триазинил, тетразинил и тетразолил. В случае замещения предпочтительно одна или более замещенная(ые) группа(ы) выбрана(ы) из алкила, циклалкила, арила, гетероарила, гетероалицикла, гидрокси, алкокси, арилокси,гетероарилокси, гетероалициклокси, тиоалкокси, тиогидрокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, пиано, галогена, нитро, карбонила, О-карбамила, N-карбамила, С-амидо, N-амидо, Скарбокси, О-карбокси, сульфинила, сульфонила, сульфонамидо, тригалометила, уреидо, амино и -NRxRy,где Rx и Ry определены выше. При использовании здесь группа "гетероалицикл" относится к моноциклической или конденсированной кольцевой группе, имеющей в составе кольца(колец) один или более атомов, выбранных из группы, состоящей из азота, кислорода и серы. Кольца выбирают из тех, которые обеспечивают стабильные структуры связей, и не должны рассматриваться как охватывающие системы, которые не могут быть осуществлены. Кольца также могут иметь одну или несколько двойных связей. Тем не менее, кольца не имеют полностью сопряженную пи-электронную систему. Неограничивающими примерами гетероалициклических групп являются азетидинил, пиперидил, пиперазинил, имидазолинил, тиазолидинил, 3 пирролидин-1-ил, морфолинил, тиоморфолинил и тетрагидропиранил. В случае замещения один или более замещенных групп предпочтительно выбраны из алкила, циклоалкила, арила, гетероарила, гетероалицикла, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоалкокси,тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, тиокарбонила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, С-тиоамидо, N-амидо, Скарбокси, О-карбокси, сульфинила, сульфонила, сульфонамидо, тригалометансульфонамидо, тригалометансульфонила, силила, гуанила, гуанидино, уреидо, фосфонила, амино и -NRxRy, где Rx и Ry определены выше."Алкил" группа относится к насыщенному алифатическому углеводороду, включая группы прямых и разветвленных цепей. Предпочтительно алкильная группа имеет от 1 до 20 атомов углерода (в любом месте данной заявки в случае указания числового диапазона, например, "1-20", это означает, что группа,в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атомов углерода и т.д. вплоть до 20 атомов углерода). Более предпочтителен алкил среднего размера, имеющий от 1 до 10 атомов углерода. Наиболее предпочтителен низший алкил, имеющий от 1 до 4 атомов углерода. Алкильные группы могут быть замещенными или незамещенными. В случае замещения предпочтительно одна или более замещенных групп независимо выбирают из тригалоалкила, циклоалкила, арила, гетероарила, гетероалицикла, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси,тиоалкокси, тиарилокси, тиогетероарилокси, тиогетероалициклокси, циано, гало, нитро, карбонила, тиокарбонила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, С-тиоамидо, Nамидо, С-карбокси, О-карбокси, сульфинила, сульфонила, сульфонамидо, тригалометансульфонамидо,тригалометансульфонила и их комбинации в пяти- или шестичленные гетероалициклические кольца."Циклоалкил" группа относится к полностью углеродной моноциклической или конденсированной кольцевой (т. е. кольцам, имеющим общие и смежные пары атомов углерода) группе, в которой одно или более колец не имеют полностью сопряженной пи-электронной системы. Неограничивающими примерами циклоалкильных групп являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексадиен, циклогептан, циклогептатриен и адамантан. Циклоалкильная группа может быть замещенной или незамещенной. В случае замещения предпочтительно одну или более замещающих групп независимо выбирают из алкила, арила, гетероарила, гетероалицикла, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоалкокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, тиокарбонила, О-карбамила, N-карбамила, Отиокарбамила, N-тиокарбамила, С-амидо, С-тиоамидо, N-амидо, С-карбокси, О-карбокси, сульфинила,сульфонила, сульфонамидо, тригалометансульфонамидо, тригалометансульфонила, силила, гуанила, гуанидино, уреидо, фосфонила, амино и -NRxRy с Rx и Ry, как определено выше."Алкенил" группа относится к алкильной группе, как определено здесь, имеющей по меньшей мере два атома углерода и по меньшей мере одну углерод-углерод двойную связь."Алкинил" группа относится к алькильной группе, как определено здесь, имеющей по меньшей мере два атома углерода и по меньшей мере одну углерод-углерод тройную связь."Алкокси" группа относится как к -О-алкил, так и к -О-циклоалкил группе, как определено здесь."Арилокси" группа относится как к -О-арил, так и к -О-гетероарил группе, как определено здесь."Тиоалкокси" группа относится как к S-алкил, так и к -S-циклоалкил группе, как определено здесь."Тиоарилокси" группа относится как к -S-арил, так и к -S-гетероарил группе, как определено здесь."Кето" группа относится к -СС(=О)С- группе, в которой углерод с одной или обеих сторон С=О может быть алкилом, циклоалкилом, арилом или углеродом гетероарильной или гетероалициклической группы."S-сульфонамидо" группа относится к -S(=O)2NRXRY с RX и RY, независимо представляющими собой Н или (С 1-6)алкил."О-карбамил" группа относится к -OC(=O)NRxRy группе с Rx и RY, независимо представляющими собой Н или (С 1-6)алкил."N-карбамил" группа относится к RxOC(=O)NRy группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."О-тиокарбамил" группа относится к -OC(=S)NRxRy группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."N-тиокарбамил" группа относится к RxOC(=S)NRy- группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."Амидо" группа относится к одновалентному радикалу -NH2, в случае присоединения через карбоксильную группу"С-амидо" группа относится к -C(=O)NRxRy группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."С-тиоамидо" группа относится к -C(=S)NRxRy группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."N-амидо" группа относится к RxC(=O)NRy-группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."Уреидо" группа относится к -NRxC(=O)NRyRy2 группе с Rx, Ry и Ry2, независимо представляющими собой Н или (С 1-6)алкил."Гуанидино" группа относится к -RxNC(=N)NRyRy2 группе с Rx, Ry и Ry2, независимо представляющими собой Н или (С 1-6)алкил."Гуанил" группа относится к RxRyNC(=N)-группе с Rx и Ry, независимо представляющими собой Н или (С 1-6)алкил."Гидразино" группа относится к -NRxNRyRy2 группе с Rx, Ry и Ry2, независимо представляющими собой Н или (С 1-6)алкил. Любые две смежные R группы могут быть объединены с образованием дополнительного арила,циклоарила, гетероарила или гетероциклического конденсированного в кольцо, изначально несущего такие R группы. Как известно в данной области, атомы азота в составе гетероарильной системы могут "принимать участие в двойной связи гетероарильного кольца", и это относится к форме двойных связей в двух таутомерных структурах, которые состоят из пятичленных кольцевых гетероарильных групп. Это указывает на то, может ли азот быть замещен, как хорошо понятно химикам в данной области. Описание и формула настоящего изобретения основаны на общеизвестных принципах образования химических связей. Понятно, что формула не включает в себя структуры, известные как нестабильные или не способные к существованию, как следует из литературы. Физиологически приемлемые соли и пролекарства соединений, описанных здесь, входят в объем данного изобретения. Термин "фармацевтически приемлемая соль" при использовании здесь и в формуле изобретения предполагает нетоксичные основно-аддитивные соли. Подходящие соли включают соли,полученные из органических и неорганических кислот, таких как, без ограничения, соляная кислота,бромистоводородная кислота, фосфорная кислота, серная кислота, метансульфоновая кислота, уксусная кислота, винная кислота, молочная кислота, сульфиновая кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, сорбиновая кислота, аконитовая кислота, салициловая кислота, фталевая кислота и т.п. Термин "фармацевтически приемлемая соль", используемый здесь, также относится к солям кислотных групп, таких как карбоксилат, с такими противоионами как аммоний, соли щелочных металлов,-4 023258 в частности натрия или калия, соли щелочно-земельных металлов, в частности кальция или магния, и соли подходящих органических оснований, таких как низшие алкиламины (метиламин, этиламин, циклогексиламин и т.п.) или замещенные низшие алкиламины (например, гидроксилзамещенные алкиламины,такие как диэтаноламин, триэтаноламин или трис (гидроксиметил)аминометан), либо с основаниями,такими как пиперидин или морфолин. Как указано выше, настоящее изобретение относится к соединениям формулы I, включая их фармацевтически приемлемые соли:Ar представляет собой арил или гетероарил;Z представляет собой C1-С 6 алкил, С 3-С 6 циклоалкил, замещенный арил, замещенный гетероарил,OR1 или NHR1, где R1 выбран из группы Н, арила, гетероарила, C1-С 6 алкила и С 3-С 6 циклоалкила. В предпочтительном варианте воплощения изобретения заместитель Het выбран из группы: В частности, предпочтительно, чтобы Het представлял собой 5 или 6-членный гетероцикл с -N,смежным с точкой присоединения -Ar компонента. Даже более предпочтительно, чтобы Het был выбран из группы: особенно предпочтительны. В дополнительных вариантах соединений формулы I предпочтительно, чтобы Ar был выбран из группы:Y1 представляет собой О, NH, N-алкил, N-арил, S или СН 2. Даже более предпочтительно, чтобы Ar заместитель был выбран из группы: Еще более предпочтительно, чтобы Ar был выбран из группы: Особенно предпочтительно, чтобы Ar представлял собой фенил или фенил, который замещен метоксигруппой или гидроксилом. Как указано выше, заместитель R представляет собой -СН 3, -CH2F или -СН=СН 2. Предпочтительно Заместитель W определяется как выбранный из группы -NO2, -Cl, -Br, -CHO, -СН=СН 2 и -CN. Более предпочтительно, чтобы W представлял собой -NO2, -Cl, -Br или CN. Особенно предпочтительно, чтобы W представлял собой -NO2, -Cl или -Br, где -NO2 и -Br даже более предпочтительны. Заместитель X представляет собой -Cl, -СН 3 или -CN. Даже более предпочтительно, чтобы X представлял собой -Cl или -CN, где -Cl еще более предпочтителен. Заместитель Y может представлять собой -СН или -N. В некоторых вариантах воплощения предпочтительно, чтобы Y представлял собой -СН. В некоторых других вариантах воплощения предпочтительно, чтобы Y представлял собой -СН и чтобы Ar заместитель представлял собой фенил, который замещен либо метокси, либо гидроксил группой. Как указано выше, заместитель Z представляет собой С 1-6 алкил, С 3-С 6 циклоалкил, замещенный арил, замещенный гетероарил, OR1 или NHR1, где R1 выбран из группы Н, арила, гетероарила, С 1-6 алкила и С 3-С 6 циклоалкила. Предпочтительно, чтобы Z представлял собой замещенный арил или замещенный гетероарил, который выбран из группы:Y1 представляет собой О, NH, N-алкил, N-арил, S или СН 2. Даже более предпочтительно, чтобы Z представлял собой замещенный фенил. Особенно предпочтительно, чтобы Z представлял собой фенил, замещенный азотсодержащим компонентом. Азотсодержащий компонент может представлять собой группу амина, гетероарильное кольцо по меньшей мере с одним азотом или гетероцикл по меньшей мере с одним азотом, например. Предпочтительные соединения формулы I, включая их фармацевтически приемлемые соли, включают следующие варианты: Соединения по настоящему изобретению могут быть введены перорально, парентерально (включая подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или инфузии), путем ингаляции или ректально, либо посредством других средств, доступных в данной области, в составе дозированных препаратов, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и растворители. Таким образом, в соответствии с настоящим изобретением дополнительно предусмотрен способ лечения и фармацевтическая композиция для лечения вирусных инфекций, таких как вирус гриппа. Лечение касается введения пациенту, нуждающемуся в таком лечении, фармацевтической композиции, содержащей фармацевтический носитель и терапевтически эффективное количество соединения по настоящему изобретению. Фармацевтическая композиция может быть представлена в форме перорально вводимой суспензии или таблеток; назальных спреев, стерильных инъецируемых препаратов, например, в виде стерильных инъецируемых водных или масляных суспензий или суппозиториев. При введении перорально в виде суспензии такие композиции приготавливают в соответствии с технологиями, описанных в уровне техники фармацевтических композиций, и могут содержать микрокристаллическую целлюлозу для придания объема, альгиновую кислоту или альгинат натрия в качестве суспензирующего агента, метилцеллюлозу для улучшения вязкости и подсластители/ароматизирующие агенты, известные в уровне техники. В случае таблеток немедленного высвобождения такие композиции могут содержать микрокристаллическую целлюлозу, дифосфат кальция, крахмал, стеарат магния и лактозу и/или другие эксципиенты, связующие вещества, наполнители, разрыхлители, растворители и смазочные материалы, известные в данной области. Инъецируемые растворы или суспензии могут быть образованы в соответствии с уровнем техники,используя подходящие нетоксичные, парентерально приемлемые разбавители или растворители, такие как маннитол, 1,3-бутандиол, вода, раствор Рингера или изотонический раствор хлорида натрия, либо подходящие диспергирующие или увлажняющие и суспендирующие агенты, такие как стерильные, мягкие, нелетучие масла, включая синтетические моно- или диглицериды, и жирные кислоты, в том числе олеиновую кислоту. Соединения, описанные здесь, могут быть введены людям перорально в диапазоне доз от 1 до 100 мг/кг веса тела, возможно разделенными дозами. Один предпочтительный диапазон доз составляет от 1 до 10 мг/кг веса тела перорально в разделенных дозах. Другой предпочтительный диапазон доз составляет от 1 до 20 мг/кг веса тела в разделенных дозах. Будет понятно, однако, что конкретное значение дозы и частота введения для любого конкретного пациента может варьировать и будет зависеть от множества факторов, включая активность конкретного работающего соединения, метаболическую стабильность и продолжительность действия соединения, возраст, вес тела, общее состояние здоровья, пол, режим питания, способ и время введения, скорости выведения, сочетание с другими лекарствами, тяжесть конкретного состояния и хозяина, подвергающегося терапии. В композициях и способах по настоящему изобретению, описанных здесь, термин "противовирусное эффективное количество" означает общее количество каждого активного соединения или компонента композиции или способа, которое достаточно для того, чтобы вызвать заметное улучшение у пациента, например, предупреждение заражения вирусом гриппа или излечивание острых состояний или симптомов, характеризующих гриппозную инфекцию. Термины "лечить, лечение", используемые здесь и в формуле, означают предотвращение или улучшение болезни и симптомов, связанных с инфекцией гриппа. Применительно к отдельному активному ингредиенту, вводимому отдельно, термин относится к одному такому ингредиенту. В случае комбинации термин относится к комбинированному количеству активных ингредиентов, обеспечивающих терапевтический эффект, независимо от того, вводятся они в комбинации, последовательно или одновременно. Настоящее изобретение также относится к комбинациям соединений, описанных здесь, с одним или более других агентов, используемых в лечении гриппа. Например, соединения по настоящему изобретению могут быть введены эффективно либо в периоды до воздействия и/или после воздействия, в комбинации с эффективными количествами других препаратов против вируса гриппа, иммуномодуляторов,антибактериальных средств или вакцин, описанных в уровне техники. Следующие схемы обобщают процедуры получения соединений по изобретению специалистами в этой области. Схема 1 Соединения формулы I получали из соединений формулы II через два комплементарных пути, как показано на схеме 1. В первом пути промежуточные соединения формулы II обрабатывали трифторуксусной кислотой, получая промежуточные соединения формулы III. Соединения формулы II могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Промежуточные соединения формулы III обрабатывают карбоновой кислотой формулы IV и формирующим амидную связь реагентом (т.е. EDC), обеспечивая соединения формулы V. Карбоновые кислоты формулы IV могут быть получены коммерчески,могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Промежуточные соединения формулы V обрабатывали хлорангидридами формулы VI и сильным основанием, получая соединения формулы I. Хлорангидриды VI могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Во втором пути проводят стадии синтеза, описанные в первом пути, в обратном порядке. Промежуточные соединения формулы II обрабатывают хлорангидридами формулы VI и сильным основанием, получая промежуточные соединения VII. Как было описано ранее, промежуточные соединения формулы II могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Кроме того, промежуточные соединения формулы II могут быть получены путем присоединения Вос-защитной группы к атому азота пиперазина формулы III. Хлорангидриды формулы VI могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Промежуточные соединения формулыVII обрабатывали трифторуксусной кислотой, получая промежуточные соединения формулы VIII. Промежуточные соединения формулы VIII обрабатывали карбоновыми кислотами формулы IV и формирующим амидную связь реагентом (т.е. EDC), обеспечивая соединения I. Карбоновые кислоты формулыIV могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе,или могут быть легко приготовлены специалистами в данной области. Схема 2 Соединения формулы IVa получали так, как показано на Схеме 2 и как описано в литературе [см.:Gerald W.Zamponi, Стадияпаше С. Stotz, Richard J. Staples, Tina M. Andro, Jared K. Nelson, Victoria Hulubei, Alex Blumenfeld, and Nicholas R. Natale, J. Med. Chem., 2003, 46, 87-96]. Последовательная обработка производных арил альдегидов формулы IX гидроксиламин гидрохлоридом, затем n- хлорсукцинимидом, обеспечивает промежуточные соединения формулы X. Альдегид производные формулы IX могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Этил 3-(пирролидин-1-ил)бут-2-еноат обрабатывали хлороксимами формулы X, получая изоксазолы формулы XI. Гидролиз метилового эфира изоксазолов формулы XI обеспечивал получение соединений формулы IVa. Схема 3 Соединения формулы IVb получали так, как показано на схеме 3. Производные арилйодидов формулы XII соединяли с метилпропиолатом в присутствии оксида меди (I) [см.: Liliebris, С; Larsen, S.D;XIII. Производные арил йодида формулы XII могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Производные соединения формулы XIII обрабатывали азидом натрия и метилйодидом, получая триазолы формулы XIV после хроматографического отделения от нежелательного региоизомера. Обработка триазолов формулы XIV гидроксидом натрия обеспечивала получение соединений формулы IVb. Схема 4 Соединения формулы IVc получали так, как показано на Схеме 4 и как описано в литературе [см.:Martins, M.A.P. et al. J. Molecular Catalysis A: Chemical, 2007, 266, 100]. Арилгидразины формулы XV обрабатывали (E)-1,1,1-трихлор-4-этокси-3-метилбут-3-ен-2-оном, получая пиразолы формулы XVI после хроматографического отделения от нежелательного региоизомера. Арилгидразины формулы XV могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Обработка пиразолов формулы XVI гидроксидом натрия обеспечивала получение соединений формулы IVc. Схема 5 Соединения формулы IVd получали так, как показано на схеме 5 и как описано в литературе [см.:Grigg R.; Savic V. Chem. Commun. 2000, (10), 873-874]. Бета-кетоэфиры формулы XVII обрабатывали аммиаком, получая енамины формулы XVIII. Бета-кетоэфиры формулы XVII могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Обработка енаминов формулы XVIII 2,3-дибромпроп-1-еном обеспечивала получение промежуточных соединений формулы XIX, которые при обработке ацетатом палладия (II) давали пирролы формулы XX. Обработка пирролов формулы XX гидроксидом лития обеспечивала получение соединений формулы IVd. Схема 6 Соединения формулы IVe получали так, как показано на схеме 6 и как описано в литературе [см.:XXII. Изоцианаты формулы XXI могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Последовательная обработка имидазолов формулы XXII оксидом марганца (IV) и перманганатом калия обеспечивала получение соединений формулы IVe. Схема 7 Соединения формулы IVf получали так, как показано на схеме 7. Изоксазолы формулы XXIII бромировали в свободнорадикальных условиях, получая промежуточные соединения формулы XXIV. Изоксазолы формулы XXIV могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, могут быть получены по аналогии со схемой 2 или могут быть легко приготовлены специалистами в данной области. Промежуточные соединения формулы XXIV обрабатывали фторидом тетрабутиламмония, получая промежуточные соединения формулы XXV [см.:Sun H.; DiMagno S. G., J.Am. Chem. Soc. 2005, 127, 2050-2051]. Обработка промежуточных соединений формулы XXV трифторуксусной кислотой обеспечивала получение соединений формулы IVf. Схема 8 Соединения формулы IVg получали так, как показано на схеме 8 и как описано в литературе [см.: El тилгидразидом, получая гидразоны формулы XXVII. Альдегиды формулы XXVI могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Обработка гидразонов формулы XXVII этил ацетацетатом в щелочных условиях обеспечивала получение пиразолов формулы XXVIII, которые гидролизовали на следующей стадии, получая соединения формулы Ivg Схема 9 Соединения формул IIa (Y=CH) и IIb (Y=N) получали так, как показано на схеме 9. Обработка промежуточных соединений формулы XXIXa или XXIXb BOC-защищенным пиперазином обеспечивала получение соединений формулы IIa и IIb, соответственно. Промежуточные соединения формулы XXIXa могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе, или могут быть легко приготовлены специалистами в данной области. Промежуточные соединения формулыXXIXa могут быть получены коммерчески, могут быть приготовлены методами, известными в литературе [см.: Micheli F.; Cugola A.; Donati D.; Missio A.; Pecunioso A.; Reggiani A.; Tarzia, G. Bioorg. Med.Chem., 1997, 5(12), 2129], или могут быть легко приготовлены специалистами в данной области. Схема 10 Соединения формулы IIIa-d получали так, как показано на схеме 10. Обработка 3-бром-4 хлоранилина (XXX) Boc ангидридом обеспечивала получение ВОС-анилина формулы XXXI. Обработка ВОС-анилина формулы XXXI ВОС-пиперазином и катализатором Pd(II) обеспечивала получение промежуточных соединений формулы XXXII, последующей обработкой которых N-хлорсукцинимидом и трифторуксусной кислотой получали соединение формулы IIIa. Альтернативно, промежуточное соединение формулы XXXII обрабатывали N-бромсукцинимидом, получая промежуточное соединение формулыXXXIII. Обработка промежуточного соединения формулы XXXIII трифторуксусной кислотой обеспечивала получение соединения формулы IIIb. Альтернативно, обработка промежуточного соединения формулы XXXIII винил пинаколборонатом и катализатором Pd(0), а затем трифторуксусной кислотой обеспечивала получение соединения формулы IIIc. Альтернативно, обработка промежуточного соединения формулы XXXIII цианидом Zn(II) и катализатором Pd(0), a затем трифторуксусной кислотой обеспечивала получение соединения формулы IIId. Соединения формулы IIIe-f получали так, как показано на схеме 11. Вос-защищенный анилин формулы XXXIV обрабатывали ВОС-пиперазином и катализатором Pd(II), получая промежуточное соединений формулы XXXV. Последующая обработка промежуточного соединения формулы XXXV Nхлорсукцинимидом и трифторуксусной кислотой обеспечивала получение соединения формулы IIIe. Альтернативно, обработка промежуточного соединения формулы XXXV N-бромсукцинимидом и трифторуксусной кислотой обеспечивала получение соединения формулы IIIf. Схема 12 Соединение формулы IIIg получали так, как показано на схеме 12. Вос-пиперазин нагревали вместе с 1,3-дициано-2-пропанолом, получая промежуточное соединение формулы XXVI. Последующая обработка промежуточного соединения формулы XXXVI N-хлорсукцинимидом и трифторуксусной кислотой обеспечивала получение соединения формулы IIIg. Схема 13 Соединение формулы IIc получали так, как показано на схеме 13. Обработка 2,4-дифтор-5 нитробензонитрила спиртовым раствором аммиака обеспечивала получение промежуточного соединения формулы XXVII [см.: Ohmori J.; Sakamoto S.; Kubota, H.; Shimizu-Sasamata, M. et. al. J.Med.Chem., 1994,37(4), 467-475]. Обработка промежуточного соединения формулы XXXVII Вос-пиперазином обеспечивала получение соединения формулы IIc. Схема 14 Соединение формулы IIIh получали так, как показано на схеме 14. Обработка 3-бром-2- 14023258 хлоранилина Boc ангидридом обеспечивала получение ВОС-анилина формулы XXXVIII. Обработка ВОС-анилина формулы XXXVIII ВОС-пиперазином и катализатором Pd(II) обеспечивала получение промежуточного соединения формулы XXXIX, обработка которого N-бромсукцинимидом обеспечивала получение промежуточного соединения формулы ХХХХ. Обработка промежуточного соединения формулы ХХХХ цианидом Zn(II) и катализатором Pd(0) обеспечивала получение соединения формулыXXXXI, обработкой которого трифторуксусной кислотой получали соединение формулы IIIh. Примеры Соединения, описанные здесь, и их получение дополнительно могут быть понятны из следующих рабочих примеров. Эти примеры предназначены для иллюстрации настоящего изобретения и не должны быть истолкованы как ограничивающие его объем. Химические аббревиатуры, использованные в примерах, определяются следующим образом:"Ас" для ацетата,"APCI" для химической ионизации при атмосферном давлении,"ВЕМР" для 2-трет-бутимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорина,"Boc" или "ВОС" для t-бутилоксикарбонила,"ВОР" для бензотриазол-1-илокситрис-(диметиламино)фосфония гексафторфосфата,"Cbz" для бензилоксикарбонила,"CDI" для 1,1'-карбонилдиимидазола,"CD3OD" для дейтерометанола,"CDCl3" для дейтерохлороформа,"DCC" для 1,3-дициклогексилкарбодиимида,"DCE" для 1,2-дихлорэтана,"DCM" для дихлорметана,"DEAD" для диэтил азодикарбоксилата,"DIEA", "основание Хунига" или "DIPEA" для N,N-диизопропилэтиламина,"DMF" для N,N-диметилформамида,"DMAP" для 4-диметиламинопиридина,"DMPU" для 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидона,"DMSO" для диметилсульфоксида,"DPPA" для дифенилфосфорилазида,"EDC" или "EDCI" для 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида,"Et" для этила,"EtOAC" для этил ацетата,"НОАс" для уксусной кислоты,"HOBt" для 1-гидроксибензотриазол гидрата,"HATU" для О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата,"НМРА" для гексаметилфосфорамида, "LDA" для литий диизопропиламида,"LiHMDS" для литий бис(триметилсилил)амида,"NaHMDS" для натрий бис(триметилсилил)амида,"NBS" для N-бромсукцинимида,"NCS" для N-хлорсукцинимида,"NMM" для 4-метилморфолина,"РуВОР" для бензотриазол-1-ил-окси-трис-пирролидинофосфоний гексафторфосфата,"TMSCH2N2" для (триметилсилил)диазометана,"TMSN3" для азидотриметилсилана,"TBTU" для О-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторбората,"TEA" для триэтиламина,"TFA" для трифторуксусной кислоты и"THF" для тетрагидрофурана. Аббревиатуры, использованные в примерах, определяются следующим образом: "С" для градусов Цельсия, "МС" для масс-спектрометрии, "ESI" для масс-спектрометрии с ионизацией распылением в электрическом поле, "HR" для высокого разрешения, "ЖХ-МС" для жидкостной хромато-массспектрометрии, "экв" для эквивалента или эквивалентов, "г" для грамма или грамм, "ч" для часа или часов, "мг" для миллиграмма или миллиграмм, "мл" для миллилитра или миллилитров, "ммоль" для миллимолярного, "М" для молярного, "мин" для минуты или минут, "комн.темп." для комнатной температуры, "ЯМР" для спектроскопии ядерного магнитного резонанса, "ТСХ" для тонкослойной хроматографии,"атм" для атмосферного, и , , "R", "S", "Е" и "Z" представляют собой стереохимические обозначения, принятые специалистами в данной области."ВЭЖХ" является аббревиатурой, используемой здесь для жидкостной хроматографии высокого давления. Обратно-фазовая ВЭЖХ может быть осуществлена с использованием колонки Vydac C-18 с градиентом элюирования от 10 до 100% буфера В в буфере А (буфер А: вода, содержащая 0,1% трифторуксусной кислоты, буфер В: 10% воды, 90% ацетонитрила, содержащего 0,1% трифторуксусной кисло- 15023258 ты). При необходимости органический слой может быть высушен над сульфатом натрия, если не указано иное. Тем не менее, если не указано иное, следующие условия являются общепринятыми. "ЖХ-МС" относится к жидкостной хроматографии высокого давления, которая осуществляется в соответствии с определением ВЭЖХ с масс-спектрометрическим детектором. Температуры плавления определяли на аппарате Mel-Temp II и больше не корректировались. ИКспектры были получены на однолучевом Nicolet Nexus ИК-Фурье спектрометре с использованием 16 накоплений с разрешением 4,00 см-1 на образцах, приготовленных в прессованном диске KBr или в виде пленки на пластинах KBr. Протонные ЯМР-спектры (300 МГц, относящийся к тетраметилсилану) были получены на Varian INOUA 300, Bruker Avance 300, Avance 400 или Avance 500-спектрометре. Данные сверялись со стабилизирующим растворителем. Эксперименты с ионизацией распылением в электрическом поле (ESI) проводились на одноквадрупольном масс-спектрометре Micromass II Platform или на масс-спектрометре Finnigan SSQ7000. Все градиенты ВЭЖХ брали от 0 до 100% В. Препаративная ВЭЖХ: Когда описывается как выполняемая "в стандартных условиях". Образцы (примерно 20 мг) растворяли в метаноле (10 мг/мл) и очищали на 25 мм 50 мм Vydac C18 колонке с 5-минутным градиентом элюирования от 10 до 100 % буфера В в буфере А (буфер А: вода, содержащая 0,1% трифторуксусной кислоты,буфер В: 10% воды, 90% ацетонитрила, содержащий 0,1% трифторуксусной кислоты) при 10 мл/мин. Синтез промежуточных соединений Препарат А: 3-(2-метоксифенил)-5-метилизоксазол-4-карбоновая кислотаBlumenfeld A.; Natale N. R. J. Med. Chem. 2003, 46, 87-96]. Стадия A2. Реакционную смесь этил 3-(2-метоксифенил)-5-метилизоксазол-4-карбоксилата (12,85 г, 49,2 ммоль) и гидроксида натрия (9,84 г, 246 ммоль) в МеОН (100 мл) и воде (10 мл) перемешивали при 65 С в течение 20 ч в 500-мл колбе с круглым дном. МеОН удаляли в вакууме, затем концентрированную реакционную смесь пропускали через 500-мл разделительную воронку с 150 мл воды и 100 мл эфира. Органический слой отбрасывали. Водный слой подкисляли добавлением концентрированной НС 1 (26 мл). Продукт осаждался, и его отделяли путем фильтрации и высушивали в условиях высокого вакуума, получая 10,63 г (93%, теоретический выход 11,47 г). 1 Н ЯМР (400 МГц, CD3OD)2,69 (s, 3 Н, CH3), 3,77 (s, 3 Н, OCH3), 7,00-7,07 (m, 2 Н, арил), 7,32-7,34 1 Указанное в заголовке соединение получали по аналогии с препаратом А, заменяя 2 метоксибензальдегид на 1-нафтальдегид. 1 Н-ЯМР (DMSO, 400 МГц):7,83-8,22 (m, 3 Н), 7,4-7,7 (m, 4 Н), 3,5 (2 Н, bs), 2,74 (3 Н, s). m/е 254 Указанное в заголовке соединение получали по аналогии с препаратом А, заменяя 2 метоксибензальдегид на 2-хлор-6-метоксибензальдегид. 1 Н ЯМР (CD3OD, 500 МГц,)7,41 (1 Н, t, J=8,4 Гц), 7,09 (1 Н, d, J=7,6 Гц), 7,03 (1 Н, d, J=8,2 Гц), 3,76 Указанное в заголовке соединение получали в соответствии с методами, описанными в литературе: Указанное в заголовке соединение получали по аналогии с препаратом D. 1 Н-ЯМР (CDCl3, 400 МГц):7,45-7,55(1H, m), 7,28-7,40 (2 Н, m), 7,25-7,27 (1H,m), 2,44 (3 Н, s). Препарат F: 2-(2-хлорфенил)-4-метил-1 Н-пиррол-3-карбоновая кислота Указанное в заголовке соединение получали в соответствии с методами, описанными в литературе: Ссылка: Martins, M.A.P. et al. J. Molecular Catalysis A: Chemical, 2007, 266,100. Стадия G1. Смесь (Е)-1-этоксипроп-1-ена (6,41 мл, 57,9 ммоль) и пиридина (4,68 мл, 57,9 ммоль) была добавлена к раствору 2,2,2-трихлорацетил хлорида (10,53 г, 57,9 ммоль) в DCM (15 мл) при -10 С со скоростью 6-10 капель в минуту. После окончания добавления смесь перемешивали при комнатной температуре в течение 24 ч. Фильтровали и фильтрат концентрировали при пониженном давлении (сначала температура водяной бани была комнатной, затем большая часть DCM выпаривалась и водяная баня нагревалась до 50 С, получая (Е)-1,1,1-трихлор-4-этокси-3-метилбут-3-ен-2-он (2,55 г, 10,79 ммоль, выход 18,64%). 1H-ЯМР (500 МГц, CDCl3): : 7,96 (s, 1H), 4,21 (q, J=7,l Гц, 2 Н), l,94 (s, 3 Н), l,41 (t, J=7,2 Гц, 3 Н). Этот материал использовали в стадии G2 без дополнительной очистки. Стадия G2. Смесь (Е)-1,1,1-трихлор-4-этокси-3-метилбут-3-ен-2-он (279 мг, 1,205 ммоль) и (2 метоксифенил)гидразина, HCl (253 мг, 1,446 ммоль) в EtOH (5 мл) нагревали до кипения в течение 3 ч. Охлаждали до комн.темп., затем разделяли с помощью Пре-ВЭЖХ, получая этил 1-(2-метоксифенил)-4 метил-1H-пиразол-5-карбоксилат (фракция А, 30 мг, 0,113 ммоль, выход 9,37%) и этил 1-(2 метоксифенил)-4-метил-1H-пиразол-3-карбоксилат (фракция В, 41 мг, 0,154 ммоль, выход 12,81%). 1 Н-ЯМР фракции А: (500 МГц, CD3OD): : 7,58 (s, 1H), 7,48-7,44 (m, 1H), 7,35 (d, J=7 Гц, 1H), 7,14(d, J=7,2 Гц), 7,10-7,07 (m, 1H), 4,16 (q, J=7,l Гц, 2 Н), 3,76 (s, 3 Н), 2,34 (s, 3 Н), 1,11 (t, J=7 Гц, 3 Н). 1 Н-ЯМР изомера В: (500 МГц, CD3OD): : 7,91 (s, 1H), 7,61 (d, J=8,2 Гц, 1H), 7,36 (d, J=7 Гц, 1H),7,23 (d, J=8,2 Гц, 1H), 7,12-7-08 (m, 1H), 4,41 (q, J=7 Гц, 2 Н), 3,76 (s, 3 Н), 2,35 (s, 3 Н), 1,42 (t, J=7 Гц, 3 Н). Стадия G3. Гидролиз фракции А: К раствору этил 1-(2-метоксифенил)-4-метил-1H-пиразол-5-карбоксилата (30 мг, 0,115 ммоль) в МеОН (2 мл) был добавлен 3 N гидроксид натрия (2 мл, 6,00 ммоль). Полученная смесь перемешивалась при комнатной температуре в течение 2 ч, затем выпаривалась до удаления растворителя. Остаток растворяли в EtOAc и воде, подкисленной 6N HCl до рН=2, разделяли и экстрагировали с помощью EtOAc. Органический слой высушивали (Na2SO4) и выпаривали, получая 1-(2 метоксифенил)-4-метил-1H-пиразол-5-карбоновую кислоту (23 мг, 0,094 ммоль, выход 82 %), который использовали в следующей реакции без дополнительной очистки. Препарат Н: 4-(2-метоксифенил)-1-метил-1 Н-имидазол-5-карбоновая кислота Ссылка: Luke R.W.A.; Jones CD.; McCoull, W; Hayter B.R. патентная заявка WO 2004013141, 2004. Стадия H1. К раствору 1,4-диоксан-2,5-диола (120 мг, 0,995 ммоль) в THF (8 мл) добавляли метиламин (2,8 мл, 0,664 ммоль) при комн.темп. Полученную смесь перемешивали при комн.темп. в течение 75 мин. Затем добавляли 1-(изоциано(тозил)метил)-2-метоксибензен (200 мг, 0,664 ммоль), поддерживая реакционную смесь при 30 С на водяной бане. Реакционную смесь перемешивали при комн.темп. в течение ночи. Выпаривали до получения белого твердого вещества, растворяли в DMF и очищали с помощью пре-ВЭЖХ, получая (4-(2-метоксифенил)-1-метил-1H-имидазол-5-ил)метанол (84 мг, 0,377 ммоль,выход 38,6%) в виде бесцветного масла. 1(1H, t, J=7,5 Гц), 4,67 (2H, s), 4,05 (3H, s), 3,89 (3H, s). Стадия Н 2. К раствору (4-(2-метоксифенил)-1-метил-1H-имидазол-5-ил)метанола (84 мг, 0,385 ммоль) в 1,4-диоксане (5 мл) добавляли MnO2 (147 мг, 1,693 ммоль). Смесь нагревали до 90 С в течение 4 ч или до тех пор, пока ЖХ/МС не покажет завершение реакции. Реакционную смесь фильтровали через целит и выпаривали, получая 4-(2-метоксифенил)-1-метил-1 Н-имидазол-5-карбальдегид (78 мг, 0,325 ммоль, выход 84 %), который использовался в следующей реакции без очистки. Стадия Н 3. К раствору 4-(2-метоксифенил)-1-метил-1H-имидазол-5-карбальдегида (78 мг, 0,361 ммоль) в ацетоне (5 мл) и воде (1 мл) добавляли карбонат калия (100 мг, 0,721 ммоль). После растворения калия добавляли KMnO4 (123 мг, 0,776 ммоль) при комнатной температуре. Смесь перемешивали в течение 24 ч. ЖХ/МС показал завершение. Смесь фильтровали через целит, промывали водой. Ацетон выпаривали из фильтрата, который экстрагировали с помощью EtOAc (2). Водный слой подкисляли НОАс до рН=5, уменьшали объем наполовину, замораживали и лиофилизировали, получая твердое вещество, которое очищали посредством пре-ВЭЖХ, получая целевое соединение (41 мг, 0,173 ммоль, выход 48 %). 1 Указанное в заголовке соединение получали в сумме 61% аналогично с препаратом Н. Стадия J1: Ссылка: Liliebris С.; Larsen S.D.; Ogg, D.; Palazuk B.J. и Pleasdale J.E. J.Med.Chem., 2002,45, 1785. К суспензии метил пропиолата (2, 1,314 мл, 15,41 ммоль) и оксида меди(I) (1,086 г, 7,59 ммоль) вDMF (20 мл) добавляли 1-йод-2-метоксибензол (1, 1,262 мл, 9,48 ммоль). Полученную смесь нагревали в микроволновом реакторе до 110 С в течение 2 ч. Реакционную смесь фильтровали через тонкий слой силикагеля и промывали EtOAc. Органический слой промывали 1 М HCl, насыщенным раствором солиH-ЯМР (500 МГц, CD3OD), : 7,49-7,46 (m, 2 Н), 7,10-7,07 (m, 2 Н), 4,32 (s, 3H), 3,79 (s, 3H), 3,78 (s,3H). Стадия J3: К раствору метил 4-(2-метоксифенил)-1-метил-1H-1,2,3-триазол-5-карбоксилата (183 мг,0,74 ммоль) в МеОН (5 мл) добавляли гидроксид натрия (1,3 мл, 3 М водный раствор). Смесь перемешивали при комн.темп. в течение 2 ч, затем концентрировали в вакууме. Остаток растворяли в воде, промывали эфиром (3), удаляя возможные примеси. Водную фазу подкисляли 6 М HCl до рН 3, экстрагировали с помощью EtOAc (4). Объединенный органический слой высушивали и выпаривали, получая соединение, указанное в заголовке (164 мг, 0,703 ммоль, выход 95%). 1 Стадия К 1: Раствор трет-бутил 3-(2-метоксифенил)-5-метилизоксазол-4-карбоксилата (0,795 г, 2,75 ммоль), NBS (0,978 г, 5,50 ммоль) и бензоил пероксида (0,033 г, 0,137 ммоль) в CCl4 (10 мл) перемешивали при 90 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и твердую фазу отфильтровывали. Растворитель удаляли в вакууме. Продукт очищали посредством флэш-хроматографииTFA/DCM (1:1) при комнатной температуре в течение одного часа с последующим выпариваниемDCM/TFA в вакууме обеспечивала получение указанного в заголовке соединения. 1 Н-ЯМР (CD3OD, 400 МГц):7,53-7,44 (1H, m), 7,42-7,35 (1H, m), 7,13-6,98 (2 Н, m), 5,74 (2 Н, d, J= 47,2 Гц), 3,78 (3 Н, s). Препарат Смесь 3-(2-метоксифенил)-5-метилизоксазол-4-карбоновой кислоты (363 мг, 1,558 ммоль, препарат А), 4-хлор-2-нитро-5-(пиперазин-1-ил)анилина (400 мг, 1,558 ммоль, полученный в соответствии с описанным в [El-Abadelah M. M.; Nazer M. Z.; El-Abadla N. S.; Awadallah, A. M. Asian Journal of Chemistry 1999, 11(4), 1463-1468].), EDC (448 мг, 2,337 ммоль) и N,N-диметилпиридин-4-амина (571 мг, 4,67 ммоль) в DCM (5 мл)/DMF (3 мл) перемешивали в течение ночи. Раствор разбавляли DCM, затем промывали водой три раза. Очистка с помощью флэш-хроматографии с 20% EtOAc в DCM обеспечивала получение указанного в заголовке соединения (286 мг, 0,606 ммоль, выход 38,9 %). 1 Н-ЯМР (CDCl3, 400 МГц):8,11 (1H, s), 7,59 (1H, d, J=7,53 Гц), 7,47 (1H, t, J=8,53 Гц), 7,08 (1H, t,J=7,53 Гц), 6,99 (1H, d, J=7,28 Гц), 6,03 (1H, s), 3,80 (3 Н, s), 3,8 (2 Н, s) 3,22 (2H, s), 3,01 (2 Н, s), 2,57 (3 Н,s), 2,46 (2H, s). Стадия M1: К раствору 3-бром-4-хлоранилина (2,26 г, 10,95 ммоль) в DCM (20 мл) добавляли триэтиламин (3,32 г, 32,8 ммоль). Раствор охлаждали до 0 С с последующим добавлением ди-трет-бутил дикарбоната (2,87 г, 13,14 ммоль). Водяную баню со льдом убирали и добавляли N,N-диметилпиридин-4 амин (1,337 г, 10,95 ммоль). Полученную реакционную смесь перемешивали при комн.темп. в течение ночи. Продукт очищали посредством флэш-хроматографии (гексаны/DCM, 1:1, Rf 0,45), получая 2,96 г(выход 88%). Н 1-ЯМР (CDCl3, 400 МГц):7,79 (1H, d, J= 2,5 Гц), 7,34 (1H, d, J= 8,8 Гц), 7,21 (1H, dd, J1 = 8,8 Гц,J2 = 2,5 Гц), 6,44 (1H, s), 1,53 (9 Н, s). Стадия М 2: Реакционную смесь трет-бутил 3-бром-4-хлорфенилкарбамата (1,39 г, 4,53 ммоль),mpem-бутил пиперазин-1-карбоксилата (1,689 г, 9,07 ммоль), диацетоксипалладия (0,127 г, 0,567 ммоль), 2,2'-бис(дифенилфосфино)-1,1 -бинафтила (0,282 г, 0,453 ммоль) и карбоната цезия (1,847 г, 5,67 ммоль) в толуоле (10 мл) перемешивали при 110 С в течение ночи. Добавляли воду (150 мл) после того, как реакционную смесь охлаждали до комн.темп., и продукт экстрагировали DCM (3120 мл). Продукт очищали посредством флэш-хроматографии (5% EtOAc/DCM, Rf 0,45), получая 1,11 г (выход 59%). Н 1-ЯМР (CDCl3, 400 МГц):7,27-7,22 (2 Н, m), 6,86 (1H, dd, J1 = 8,5 Гц, J2 = 2,5 Гц), 6,45 (1H, s),3,60 (4 Н, t, J= 5,0 Гц), 3,00 (4 Н, t, J= 5,0 Гц), 1,52 (9 Н, s), 1,49 (9H, s). Стадия М 3: К раствору трет-бутил 4-(3-(трет-бутоксикарбониламино)-4-хлорфенил)пиперазин-1 карбоксилата (570 мг, 1,384 ммоль) в DCM (3 мл) и метанола (6 мл) при -40 С добавляли раствор трифторуксусной кислоты (0,107 мл, 1,384 ммоль) в 1,5 мл DCM. Добавляли NCS (222 мг, 1,661 ммоль) и позволяли температуре медленно подняться до комнатной. Реакционную смесь перемешивали при комн.темп. в течение ночи. Добавляли насыщенный NaHCO3 водный раствор (50 мл) и продукт экстрагировали DCM (350 мл). Продукт очищали посредством флэш-хроматографии (5% EtOAc/DCM,Rf0,73), получая 0,452 г (выход 73%). Н 1-ЯМР (CDCl3, 400 МГц):7,98 (1H, s), 7,34 (1H, s), 6,94 (1H, s), 3,60 (4 Н, t, J= 5,0 Гц), 3,01 (4 Н, t,J= 5,0 Гц), 1,54 (9 Н, s), 1,49 (9H, s). Стадия М 4: Раствор трет-бутил 4-(5-(трет-бутоксикарбониламино)-2,4-дихлорфенил)пиперазин-1 карбоксилата (94,8 мг, 0,212 ммоль) в трифторуксусной кислоте (0,5 мл, 6,49 ммоль) и DCM (0,5 мл) перемешивали при комн.темп. в течение одного часа. Растворитель выпаривали, получая 97 мг продукта(0,131 г, 0,561 ммоль), 2,4-дихлор-5-(пиперазин-1-ил)анилина, 2 TFA (0,253 г, 0,534 ммоль), EDC (0,123 г, 0,641 ммоль) и DMAP (0,130 г, 1,07 ммоль) в DCM (4 мл) перемешивали при комн.темп. в течение ночи. Сырой продукт очищали посредством флэш-хроматографии (MeOH/DCM, градиент 2% - 4%, Rf0,31 с 3% МеОН), получая 0,221 г указанного в заголовке соединения (выход 90%),1 Стадия N1: К раствору трет-бутил 4-(5-(трет-бутоксикарбониламино)-2-хлорфенил)пиперазин-1 карбоксилата (363 мг, 0,881 ммоль, полученного на стадии М 2 для препарата М) в DCM (10 мл) и метаноле (5 мл) добавляли NBS (157 мг, 0,881 ммоль). Полученную реакционную смесь перемешивали при комн.темп. в течение одного часа. ВЭЖХ показала завершение реакции. Растворитель выпаривали в вакууме и продукт очищали посредством флэш-хроматографии (5% EtOAc/DCM), получая 435 мг (выход 82%). 1 Н-ЯМР (CDCl3, 400 МГц):7,97 (1H, s), 7,50 (1H, s), 6,93 (1H, s), 3,60 (4 Н, t, J = 5,0 Гц), 3,02 (4 Н, t,J = 5,0 Гц), 1,54 (9 Н, s), 1,49 (9 Н, s). Стадия N2: Эту реакцию осуществляли аналогично стадии М 4 для препарата М. Н 1-ЯМР (CD3OD, 400 МГц):7,37 (1H, s), 6,63 (1H, s), 3,37 (4 Н, t, J=5,0 Гц), 3,22 (4 Н, t, J=5,0 Гц). Стадия N3: Эту реакцию проводили аналогично стадии М 5 для препарата М, получая указанное в заголовке соединение. 1(0,552 г, 5,45 ммоль) в DCM (50 мл) перемешивали в течение 2 ч. После удаления растворителя смесь очищали на силикагелевой колонке с 2% EtOAc в DCM, получали трет-бутил 4-(5-амино-2-хлор-4 нитрофенил)пиперазин-1-карбоксилат (1,8 г, 91%). 1 Н-ЯМР (CDCl3, 500 МГц): 58,16 (1H,s), 6,22 (1H, s), 3,61 (4 Н, m), 3,09 (4H, m), 1,49 (9H, s). Стадия О 2: Смесь трет-бутил 4-(5-амино-2-хлор-4-нитрофенил)пиперазин-1-карбоксилата (1,2 г,3,36 ммоль), 4-(N,N-диметиламино)бензоил хлорида (803 мг, 4,37 ммоль), ВЕМР (1846 мг, 6,73 ммоль) иDMAP (411 мг, 3,36 ммоль) в DCE (Объем: 15 мл) нагревали при 85 С в течение 4 ч. Охлаждали и обрабатывали несколькими каплями пиперидина в течение 1 ч. После удаления растворителя и разбавления смеси МеОН образовывался оранжевый осадок. Фильтрация и промывка МеОН дала трет-бутил 4-(2 хлор-5-(4-(диметиламино)бензамидо)-4-нитрофенил)пиперазин-1-карбоксилат (1,2 г, 2,381 ммоль, выход 70,8%). 1 Н-ЯМР (CDCl3, 500 МГц):11,53 (1H, s), 8,82 (1H, s), 8,31 (1H, s), 7,89 (2 Н, d, J=8,85 Гц), 6,74 (1H,d, J=8,85 Гц), 3,64 (4 Н, m), 3,27 (4 Н, т), 3,09 (6H, s), 1,50 (9H, s). Стадия О 3: Трет-бутил 4-(2-хлор-5-(4-(диметиламино)бензамидо)-4-нитрофенил)пиперазин-1 карбоксилат (1,2 г, 2,381 ммоль) перемешивали в TFA/DCM (50%, 10 мл) в течение 1 ч. После удаления растворителя и высушивания остатка в вакууме получали указанное в заголовке соединение в виде его Стадия Р 1: К смеси трет-бутил 4-(4-бром-5-(трет-бутоксикарбониламино)-2-хлорфенил)пиперазин 1-карбоксилата (1,11 г, 2,26 ммоль, полученного на стадии N1 для Препарата N) и дицианоцинка (159 мг,1,36 ммоль) добавляли DMF (22 мл) и воду (0,30 мл). Смесь барботировали азотом в течение 5 мин с последующим добавлением Pd2(dba)3 (2,69 мг, 2,94 мкмоль) и DPPF (2,0 мг, 3,61 мкмоль). Полученную смесь нагревали при 120 С в течение 4 ч. Продукт очищали посредством флэш-хроматографии(EtOAc/DCM, градиент 5%-10%), получая 0,35 г целевого соединения (5% EtOAc/ DCM, Rf 0,31). 1 Н-ЯМР (CDCl3, 400 МГц):7,35 (1H, s), 6,28 (1H, s), 4,38 (2 Н, s), 3,60 (4 Н, t, J= 5,0 Гц), 3,03 (4 Н, t,J= 5,0 Гц), 1,49 (9 Н, s). Стадия Р 2: Раствор трет-бутил 4-(5-амино-2-хлор-4-цианофенил)пиперазин-1-карбоксилат (14 мг,0,042 ммоль) и TFA (0,2 мл, 2,60 ммоль) в DCM (0,2 мл) перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали в вакууме, получая требуемый продукт. 1(9,59 мг, 0,050 ммоль) и DMAP (8,73 мг, 0,071 ммоль) в DCM (1 мл) перемешивали при комнатной температуре в течение ночи. Продукт очищали с помощью препаративной ВЭЖХ (0,1% TFA МеОН/ Н 2 О),получая 11 мг (выход 52%) указанного в заголовке соединения. 1 Препарат Q получали по аналогии со стадией М 5 для препарата М, заменяя 3-(2-метоксифенил)-5 метилизксазол-4-карбоновую кислоту на препарат К. Н 1-ЯМР (CD3OD, 400 МГц):7,60-7,51 (2 Н, m), 7,20-7,07 (3 Н, m), 6,41 (1H, s), 5,57 (2 Н, d, J=47,4 Гц), 3,82 (3 Н, s), 3,75 (2 Н, m), 3,24 (2 Н, m), 2,89 (2 Н, m), 2,36 (2 Н, m). Препарат R. 4-амино-5-хлор-2-(4-(3-(2-метоксифенил)-5-метилизоксазол-4-карбонил)пиперазин-1 ил)бензонитрил(5,91 мл, 42,4 ммоль). Реакцию охлаждали до 0 С и добавляли ди-трет-бутил дикарбонат (3,94 мл, 16,95 ммоль). Реакция нагревалась до температуры окружающей среды, и добавляли DMAP (1,726 г, 14,13 ммоль). Наблюдалось интенсивное выделение газа и осадка в течение одной минуты. Реакционная смесь перемешивалась при комн.темп. в течение 16 ч. Продукт очищали с помощью флэш-хроматографии(DCM/гексаны 1:1, Rf 0,61), получая 4,21 г (выход 97%). 1 Н-ЯМР (CDCl3, 400 МГц):8,43 (1H, d,J= 2,0 Гц), 7,19 (1H, d, J= 8,5 Гц), 7,09 (1H, dd, J1 = 8,5 Гц,J2 = 2,5 Гц), 6,99 (1H, s), 1,55 (9 Н, s). Стадия R2: Реакционная смесь трет-бутил 5-бром-2-хлорфенилкарбамата (0,598 г, 1,951 ммоль),трет-бутил пиперазин-1-карбоксилата (0,727 г, 3,90 ммоль), диацетоксипалладия (0,055 г, 0,244 ммоль), 2,2'-бис(дифенилфосфино)-1,1 -бинафтила (0,121 г, 0,195 ммоль) и карбоната цезия (0,794 г, 2,438 ммоль) в толуоле (15 мл) перемешивали при 110 С в течение ночи. Добавляли воду (150 мл) после того, как реакционную смесь охлаждали до комн.темп., и продукт экстрагировали DCM (3120 мл). Продукт очищали с помощью флэш-хроматографии (5% EtOAc/DCM, Rf 0,45), получая 0,56 г (выход 69%). 1 Н-ЯМР (CDCl3, 400 МГц):7,87 (1H, d, J=2,8 Гц), 7,19 (1H, d, J=9,0 Гц), 6,98 (1H, s), 6,52 (1H, dd,J1 = 9,0 Гц, J2 = 2,8 Гц), 3,57 (4 Н, t, J = 5,3 Гц), 3,15 (4 Н, t, J= 5,3 Гц), 1,54 (9 Н, s), 1,49 (9 Н, s). СтадияR3: Реакционную смесь трет-бутил 4-(3-(трет-бутоксикарбониламино)-4 хлорфенил)пиперазин-1-карбоксилата (190 мг, 0,461 ммоль) и NBS (82 мг, 0,461 ммоль) в DCM (4 мл) и МеОН (2 мл) перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали и продукт очищали с помощью флэш-хроматографии (5% EtOAc/ DCM), получая 216 мг (выход 95%). 1H-ЯМР (CDCl3, 400 МГц):7,99 (1H, s), 7,53 (1H, s), 6,94 (1H, s), 3,61 (4 Н, t, J= 4,9 Гц), 3,00 (4 Н, t, J= 4,9 Гц), 1,54 (9H, s), 1,49 (9H, s). Стадия R4: Технология соответствовала описанному в [Maligres, P. E. Tetrahedron Lett. 1999, 40,8193-8195]. Продукт очищали с помощью препаративной ВЭЖХ (0,1% TFA МеОН/ Н 2 О), получая 60 мг(9 Н, s). Стадия R5: Раствор трет-бутил 4-(5-амино-4-хлор-2-цианофенил)пиперазин-1-карбоксилата (144 мг,0,428 ммоль) и TFA (2 мл, 26,0 ммоль) в DCM (2 мл) перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали в вакууме, получая требуемый продукт. 1H-ЯМР (CD3OD, 400 МГц):7,47 (1H, s), 6,53 (1H, s), 3,42-3,37 (4 Н, m), 3,37-3,32 (4 Н, m). Стадия R6: К смеси 3-(2-метоксифенил)-5-метилизоксазол-4-карбоновой кислоты (25,09 мг, 0,108 ммоль), 4-амино-5-хлор-2-(пиперазин-1-ил)бензонитрила, 2 TFA (50 мг, 0,108 ммоль) и HATU (49,1 мг,0,129 ммоль) в NMP (1,5 мл) добавляли DIEA (0,045 мл, 0,258 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Сырой продукт очищали с помощью препаративной ВЭЖХ Стадия S1: трет-бутил 4-(4-бром-5-(трет-бутоксикарбониламино)-2-хлорфенил)пиперазин-1 карбоксилат (162 мг, 0,330 ммоль, полученный на стадии N1 для Preparation N) растворяли в DMF (4 мл) в 100-мл колбе с круглым дном с последующим добавлением 4,4,5,5-тетраметил-2-винил-1,3,2 диоксаборолана (50,8 мг, 0,330 ммоль) и трикалия фосфата (0,495 мл, 0,990 ммоль). Раствор барботировали азотом в течение 10 мин. Добавляли Pd(Ph3P)4 (19,07 мг, 0,017 ммоль) и реакционную смесь перемешивали при 85 С в течение 16 ч. Реакционную смесь охлаждали до комн.темп. с последующим добавлением 30 мл воды. Продукт экстрагировали этилацетатом (330 мл). Объединенный экстракт высушивали над безводным сульфатом натрия, который удаляли с помощью фильтрации. Продукт очищали посредством флэш-хроматографии (силикагель, 5% EtOAc/ DCM, Rf 0,67), получая 75 мг (выход 52%). 1 Н-ЯМР (CDCl3, 400 МГц):7,63 (1H, s), 7,37 (1H, s), 6,68 (1H, dd, J1 = 17,3 Гц, J2= 11,0 Гц), 6,42 (1H, s), 5,60 (1H, d, J= 17,3 Гц), 5,39 (1H, d, J= 11,0 Гц), 3,60 (4 Н, t, J= 5,0 Гц), 3,03 (4 Н, t,J= 5,0 Гц), 1,52 (9 Н, s), 1,49 (9 Н, s). Стадия S2: трет-бутил 4-(5-(трет-бутоксикарбониламино)-2-хлор-4-винилфенил)пиперазин-1 карбоксилат обрабатывали 1:1 смесью трифторуксусной кислоты и DCM при комнатной температуре в течение одного часа, получая незащищенный продукт. 1 Н-ЯМР (CD3OD, 400 МГц):7,61 (1H, s), 6,94 (1H, s), 6,80 (1H, dd, J1=17,3 Гц, J2=11,0 Гц), 5,76(1H, d, J=17,1 Гц), 5,42 (1H, d, J=11,0 Гц), 3,41 (4 Н, t, J=5,0 Гц), 3,31 (4 Н, m). Стадия S3: К смеси 3-(2-метоксифенил)-5-метилизоксазол-4-карбоновой кислоты (0,182 г, 0,779 ммоль), 4-хлор-5-(пиперазин-1-ил)-2-виниланилина, 2 TFA (0,279 г, 0,599 ммоль) и HATU (0,296 г, 0,779 ммоль) в 100-мл колбе с круглым дном добавляли NMP (5,5 мл) и триэтиламин (0,145 г, 1,438 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 13 ч. Добавляли к реакционной смеси воду (50 мл) и DCM (50 мл) и две фазы разделяли в разделительной воронке. Водную фазу экстрагировали DCM (240 мл). Растворитель выпаривали с помощью роторного испарителя. Продукт очищали с помощью препаративной ВЭЖХ (ацетонитрил/вода -10 нМ ацетата аммония), получая 0,146 г 4-(1H-1,2,4-триазол-1-ил)бензойную кислоту (100 мг, 0,529 ммоль) в сернистом дихлориде (2 мл) кипятили при 110 С в течение 2 ч. После того, как избыток SOCl2 удаляли, остаток высушивали в вакууме, получая 4-(1H-1,2,4-триазол-1-ил)бензоилхлорид (110 мг, 0,529 ммоль, выход 100%) в виде белого твердого вещества, которое используется в последующих реакциях без дополнительной очистки. Препарат U. 4-(1 Н-тетразол-1-ил)бензоилхлорид Указанное в заголовке соединение получали по аналогии с препаратом Т. Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат W. 4-(1,1-диоксидизотиазолидин-2-ил)бензоилхлорид Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат X. 4-(1 Н-1,2,3-триазол-1-ил)бензоилхлорид(50%, 3 мл) кипятили при 120 С в течение 4 ч. Охлаждали, разбавляли водой и корректировали рН до 4 с помощью NaOH и Na2CO3, затем экстрагировали этил ацетатом. После удаления растворителя получали белое твердое вещество 4-(1H-1,2,3-триазол-1-ил)бензойную кислоту (180 мг, 0,952 ммоль, выход 81%). 1 Н-ЯМР (DMSO-d6, 500 МГц):8,80 (1H,s), 8,13 (2 Н, d, J=8,55 Гц), 8,01 (2 Н, d, J=8,55 Гц), 7,98 (H, s). Стадия Х 2: Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат Y. 4-(1H-1,2,4-триазол-1-ил)бензойная кислота Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат Z. 4-(2,4-диоксимидазлидин-1-ил)бензойная кислота Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат АА. 4-(2 Н-1,2,3-триазол-2-ил)бензойная кислота(50%, 5 мл) кипятили при 120 С на масляной бане в течение 4 ч. Охлаждали и вливали смесь в воду, корректировали рН до 3-4 посредством NaOH и Na2CO3. Образовывался белый осадок. Экстрагировали этилацетатом и осушали, получая целевое соединение (170 мг, 0,899 ммоль, выход 90%). 1H-ЯМР (CD3ODd4, 500 МГц):8,18 (4 Н ,d, J=1,22 Гц), 7,89 (2H,s). Стадия АА 2: Указанное в заголовке соединение получали по аналогии с препаратом Т. Препарат АВ. 4-(2-оксопирролидин-1-ил)бензоилхлорид К суспензии 4-(2-оксопирролидин-1-ил)бензойной кислоты (19,94 мг, 0,097 ммоль) в DCM (5 мл) добавляли оксалил хлорид (2 М раствор в DCM, 0,058 мл, 0,117 ммоль) и 2 капли DMF. Полученную смесь перемешивали при комн.темп. в течение 1 ч, затем концентрировали в вакууме. Остаток (белое твердое вещество) использовали в последующих реакциях без дополнительной очистки. Препарат АС: 4-(6-амино-3,5-дихлорпиридин-2-ил)пиперазин-1-ил)(3-(2-метоксифенил)-5 метилизоксазол-4-ил)метанонCuCI. Фильтрацию усиливали и остаток очищали с помощью силикагелевой колонки с DCM, затем 3%EtOAC/DCM, получая белое твердое вещество, трет-бутил 1-(2-аминопиридин-5-ил)пиперазин-4 илкарбоксилат (2,5 г, 5,59 ммоль, выход 24,07%). Использовали флэш-хроматографию с 10%H-ЯМР (CD3OD-d4, 500 МГц):7,67 (1H, t, J=8,55 Гц), 6,21 (1H, d, J=2,75 Гц), 6,19 (1H, d, J=2,75 Гц), 3,49 (4 Н, m), 3,31 (4 Н, m), 1,49 (9H, s). Стадия АС 2: Смесь трет-бутил 4-(6-аминопиридин-2-ил)пиперазин-1-карбоксилата (320 мг, 1,150 ммоль) и NCS (307 мг, 2,299 ммоль) в четыреххлористом углероде (10 мл)/CH2Cl2 (5,00 мл) выдерживали при 40 С в течение 2 ч. Очистка на силикагелевой колонке с DCM, затем 2% EtOAc в DCM дала третбутил 4-(6-амино-3,5-дихлорпиридин-2-ил)пиперазин-1-карбоксилат (110 мг, 0,305 ммоль, выход 26,5%). 1 Н-ЯМР (CDCl3, 500 МГц):7,39 (1H, s), 4,71 (2 Н, s), 3,53 (4H, m), 3,21 (4H, m), l,47 (9H, s). Стадия АС 3: трет-бутил 4-(6-амино-3,5-дихлорпиридин-2-ил)пиперазин-1-карбоксилат (110 мг,0,305 ммоль) обрабатывали 50% TFA/DCM в течение 1 ч, затем фильтровали и высушивали в вакууме,получая 3,5-дихлор-6-(пиперазин-1-ил)пиридин-2-амин (110 мг, 0,305 ммоль). 1 Н-ЯМР (CD3OD-d4, 500 МГц):7,51 (1H, s), 3,51 (4H, m), 3,31 (4H, m). Стадия АС 4: Смесь 3-(2-метоксифенил)-5-метилизоксазол-4-карбоновой кислоты (71,0 мг, 0,305 ммоль, Препарат А), 3,5-дихлор-6-(пиперазин-1-ил)пиридин-2-амина (110 мг, 0,305 ммоль), EDC (76 мг,0,396 ммоль) и DMAP (112 мг, 0,914 ммоль) в DCM (2 мл) перемешивали при комн.темп. в течение 3 ч. ВЭЖХ очистка дала указанное в заголовке соединение (91 мг, 0,193 ммоль, белое твердое вещество, выход 63,3%). 1 Н-ЯМР (CDCl3, 500 МГц):7,58(1H, d, J=7,53 Гц), 7,46 (1H, J=7,53 Гц), 7,43 (1H,s), 7,06 (1H, t,J=7,53 Гц), 6,99 (1H, d, J=8,28 Гц), 3,80 (3 Н, s), 3,78 (2H, m), 3,23 (4H, m), 2,72 (2 Н, s), 2,56 (3H, s). Препарат(CS2CO3) в толуоле (45 мл) нагревали при 100-110 С в течение 2 дней. После удаления растворителя остаток растворяли в этилацетате и промывали водой. После удаления EtOAc остаток очищали с помощью колонки с DCM, затем EtOAc/DCM(2%), получая трет-бутил 4-(3-(трет-бутоксикарбониламин)-4 метилфенил)пиперазин-1-карбоксилат (2,5 г, 6,39 ммоль, выход 65,3%, белое твердое вещество). 1(1H, s), 3,56 (4H, m), 3,09 (4H, m), 2,15 (3H, s), l,52 (9H, s), l,48 (9H, s). Стадия AD2: Смесь трет-бутил 4-(3-(трет-бутоксикарбониламино)-4-метилфенил)пиперазин-1 карбоксилата (100 мг, 0,255 ммоль) и NCS (37,5 мг, 0,281 ммоль) в DCM (2 мл) перемешивали в течение ночи. ВЭЖХ очистка дала трет-бутил 4-(5-(трет-бутоксикарбониламино)-2-хлор-4 метилфенил)пиперазин-1-карбоксилат, TFA (100 мг, 0,185 ммоль, выход 72,5%). 1(3H, s), 1,52 (9H, s), 1,48 (9H, s). Стадия AD3: трет-бутил 4-(5-(трет-бутоксикарбониламино)-2-хлор-4-метилфенил)пиперазин-1 карбоксилат, TFA (100 мг, 0,185 ммоль ) обрабатывали 50% TFA/DCM в течение 1 ч. После удаления растворителя остаток высушивали в вакууме. Стадия AD4: Указанное в заголовке соединение получали по аналогии с препаратом L, заменяя 4 хлор-2-нитро-5-(пиперазин-1-ил)анилин на продукт со Стадии AD3. 1 Н-ЯМР (CDCl3, 500 МГц):8,25 (2H, s), 7,50 (1H, dd, J=7,63 Гц, 1,53 Гц), 7,41 (1H, td, J=8,24 Гц,1,53 Гц), 7,13 (1H, s), 7,01 (1H, t, J=7,63 Гц), 6,94 (1H, d, J=8,55 Гц), 6,66 (1H, s), 3,77 (2 Н, s), 3,74 (3H,s),3,20 (2H, s), 2,85 (2 Н, s), 2,49 (3H, s), 2,37 (2H, s), 2,15 (3H, s). Препарат АЕ. Получали по аналогии с препаратом AD, заменяя NCS на NBS в стадии AD2. Н-ЯМР (CDCl3, 500 МГц):8,44 (2H, s), 7,47 (1H, dd, J=7,63 Гц, 1,53 Гц), 7,40 (1H, td, J=8,24 Гц,1,53 Гц), 7,35 (1H, s), 6,98 (1H, t, J=7,63 Гц), 6,94 (1H, d, J=8,55 Гц), 6,76 (1H,s), 3,74 (2 Н, s), 3,72 (3H, s),3,20 (2H, s), 2,83 (2 Н, s), 2,46 (3H, s), 2,36 (2H, s), 2,16 (3H, s). Препарат AF. (4-(6-амино-3-хлор-5-нитропиридин-2-ил)пиперазин-1-ил)(3-(2-метоксифенил)-5 метилизоксазол-4-ил)метанон 1Bioorg. Med. Chem., 1997, 5(12), 2129]) и трет-бутил пиперазин-1-карбоксилата (43,0 мг, 0,231 ммоль) добавляли CH2Cl2 (5 мл), затем DIEA (0,050 мл, 0,288 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель выпаривали при пониженном давлении и продукт напрямую использовали в следующей стадии без дополнительной очистки. 1H-ЯМР (500 МГц, MeOD)ppm 8,30 (1 Н, s), 3,64-3,71 (4 Н, m), 3,57 (4 Н, br, s.), 1,50 (9 Н, s). Стадия AF2: t-бутил 4-(6-амино-3-хлор-5-нитропиридин-2-ил)пиперазин-1-карбоксилат (0,192 ммоль) обрабатывали 50% TFA в дихлорметане (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1/2 ч. Растворитель выпаривали и остаток высушивали в вакуумном насосе,получая 5-хлор-3-нитро-6-(пиперазин-1-ил)пиридин-2-амин, TFA соль. ЖХМС - Phenomenex Luna C18 3,050 мм S от 10, 0 до 100% В при 2,0 минутном градиенте, 1-минутном времени выдержки, А = 10% ацетонитрила/90% воды/0,1% TFA, В = 90% ацетонитрила/10% воды/0,1% TFA Скорость потока: 4 мл/мин. Время удержания: 0,630 мин, m/е 258,02 (М+1)+.DMF (2 мл) добавляли DIEA (0,134 мл, 0,768 ммоль), 3-(2-метоксифенил)-5-метилизоксазол-4 карбоновую кислоту (44,8 мг, 0,192 ммоль) и HATU (73,0 мг, 0,192 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь очищали с помощью препаративной ВЭЖХ, получая 69 мг (73,7% для 3 стадий) указанного в заголовке соединения. 1 Стадия AG1: К смеси 2,4-дифтор-5-нитробензонитрила (2 г, 10,86 ммоль, полученного в соответствии с описанным в: [Ohmori J.; Sakamoto S. et. al. J.Med.Chem., 1994, 37(4), 467-475]) в этаноле (1,25 мл) добавляли аммиак (6,25 мл, 10,86 ммоль) при комн.темп. Смесь перемешивали в течение ночи. Фильтровали, собирая остаток, промывали Н 2 О (3). Твердое вещество высушивали в вакууме в течение 24 ч,получая 1,9 г 4-амино-2-фтор-5-нитробензонитрила (1,8 г, 9,44 ммоль, выход 87%), который использовали в следующей реакции без дополнительной очистки. 1H-ЯМР (CD3OD, 500 МГц):8,55 (1H, s), 6,82 (1H, s). m/e (M+H): 182,1. Стадия AG2: К раствору 4-амино-2-фтор-5-нитробензонитрила (132 мг, 0,730 ммоль) и трет-бутил пиперазин-1-карбоксилата (136 мг, 0,730 ммоль) в DMF (3 мл) добавляли триэтиламин (0,102 мл, 0,730 ммоль). Смесь нагревали до 80 С в микроволновом реакторе в течение 50 мин, охлаждали до комн.темп.,очищали с помощью преп-ВЭЖХ, получая трет-бутил 4-(5-амино-2-циано-4-нитрофенил)пиперазин-1 карбоксилат (120 мг, 0,328 ммоль, выход 44,9%). 1 Н-ЯМР (CD3OD, 500 МГц):8,42 (1H, s), 6,45 (1H, s), 3,65-3,61 (4H, m), 3,28-3,25 (4H, m), 1,51 (9H,s). m/e (M+H): 348,3. Стадия AG3: 4-амино-5-нитро-2-(пиперазин-1-ил)бензонитрил получали аналогично стадии AF2 для препарата AF, заменяя t-бутил 4-(6-амино-3-хлор-5-нитропиридин-2-ил)пиперазин-1-карбоксилат наt-бутил 4-(5-амино-2-циано-4-нитрофенил)пиперазин-1-карбоксилат. Стадия AG4: Указанное в заголовке соединение получали аналогично стадии AF3 для препарата
МПК / Метки
МПК: C07D 233/90, C07D 231/14, A61P 31/16, C07D 261/18, C07D 249/06, C07D 417/12, C07D 207/327, C07D 413/12, C07D 403/12
Метки: вирусного, гриппа, средства, производные, 1,4-пиперазиновые, качестве
Код ссылки
<a href="https://eas.patents.su/30-23258-14-piperazinovye-proizvodnye-v-kachestve-sredstva-ot-virusnogo-grippa.html" rel="bookmark" title="База патентов Евразийского Союза">1,4-пиперазиновые производные в качестве средства от вирусного гриппа</a>
Предыдущий патент: Водопроводящий бытовой прибор с вентилируемой рабочей зоной
Следующий патент: Индольные соединения или их аналоги, полезные для лечения возрастной макулярной дегенерации (amd)
Случайный патент: Система для обмена данными путем бесконтактной связи между терминалом и дистанционно запитываемыми портативными объектами.












