Производные 3,4,4a,10b-тетрагидро-1h-тиопирано[4,3-c]изохинолина
Номер патента: 23212
Опубликовано: 31.05.2016
Авторы: Омер Харальд, Цитт Кристоф, Кюльцер Раймунд, Штенгель Томас, Хесслинген Кристиан, Хатцельманн Армин, Фишер Штефан, Манн Александер, Вайнбреннер Штеффен, Дункерн Торстен, Флоккерци Дитер, Тенор Германн, Каутц Ульрих, Браун Клеменс, Маркс Дегенхард, Майер Томас
Формула / Реферат
1. Соединение формулы (1)
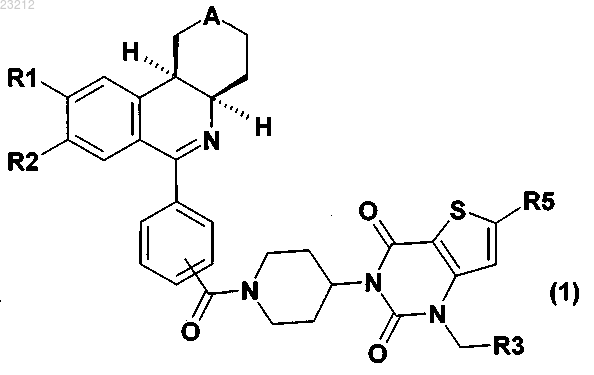
в которой А обозначает S, S(O) или S(O)2,
R1 обозначает метоксигруппу или этоксигруппу,
R2 обозначает метоксигруппу,
R3 обозначает 1-метил-1Н-имидазол-2-ил, 5-этилтиофен-2-ил, 3-метилтиофен-2-ил, 1-этилпиразол-3-ил, 2-этилпиразол-4-ил, 4-этил-1,3-оксазол-2-ил, 5-этил-1,3-оксазол-2-ил, 2-этил-1,3-оксазол-4-ил, 2-этил-1,3-оксазол-5-ил, 4-метил-1,3-оксазол-5-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 4-метил-1,3-тиазол-2-ил, 5-метил-1,3-тиазол-2-ил, 2-метил-1,3-тиазол-4-ил, 2-метил-1,3-тиазол-5-ил, 3-метоксиметил-1,2,4-оксадиазол-5-ил, 3-метоксипропил-1,2,4-оксадиазол-5-ил, 3-пропоксиметил-1,2,4-оксадиазол-5-ил, 3-метилсульфанилметил-1,2,4-оксадиазол-5-ил, 3-этил-1,2,4-оксадиазол-5-ил, 5-этил-1,3,4-оксадиазол-2-ил, 5-трет-бутил-1,3,4-оксадиазол-2-ил, 5-метоксиметил-1,3,4-оксадиазол-2-ил, 5-метил-1,2,4-оксадиазол-3-ил, 3-этил-1,2,4-тиадиазол-5-ил, 2-этил-1,2,3-триазол-4-ил, 1-этил-1,2,3-триазол-4-ил, 1-метил-1Н-1,2,4-триазол-3-ил, 1-этил-1Н-тетразол-5-ил, 2-этил-2Н-тетразол-5-ил, 5-этил-2Н-тетразол-2-ил, 1-метоксиметил-1Н-тетразол-5-ил или 2-метоксиметил-2Н-тетразол-5-ил, и
R5 обозначает фенил, 1,3-бензодиоксол-5-ил, 2-фторфенил, 4-фторфенил, 2,3-дифторфенил, 3,4-дифторфенил, 2-метокси-4-фторфенил, 2-метокси-5-фторфенил или 2,5-диметоксифенил,
или стереоизомер соединения.
2. Соединение формулы (1) по п.1,
в которой А обозначает S, S(O) или S(O)2,
R1 обозначает метоксигруппу или этоксигруппу,
R2 обозначает метоксигруппу,
R3 обозначает 1-этилпиразол-3-ил, 2-этилпиразол-4-ил, 4-этил-1,3-оксазол-2-ил, 5-этил-1,3-оксазол-2-ил, 2-этил-1,3-оксазол-4-ил, 2-этил-1,3-оксазол-5-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 4-метил-1,3-тиазол-2-ил, 5-метил-1,3-тиазол-2-ил, 2-метил-1,3-тиазол-4-ил, 2-метил-1,3-тиазол-5-ил, 3-метоксиметил-1,2,4-оксадиазол-5-ил, 3-метилсульфанилметил-1,2,4-оксадиазол-5-ил, 3-этил-1,2,4-оксадиазол-5-ил, 5-этил-1,3,4-оксадиазол-2-ил, 5-метоксиметил-1,3,4-оксадиазол-2-ил, 5-метил-1,2,4-оксадиазол-3-ил, 3-этил-1,2,4-тиадиазол-5-ил, 2-этил-1,2,3-триазол-4-ил, 1-этил-1,2,3-триазол-4-ил, 1-этил-1Н-тетразол-5-ил, 2-этил-2Н-тетразол-5-ил, 1-метоксиметил-1Н-тетразол-5-ил или 2-метоксиметил-2Н-тетразол-5-ил, и
R5 обозначает незамещенный фенил,
или стереоизомер соединения.
3. Соединение формулы (1) по п.1,
в которой А обозначает S, S(O) или S(O)2,
R1 обозначает этоксигруппу,
R2 обозначает метоксигруппу,
R3 обозначает 5-этил-1,3-оксазол-2-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 2-метил-1,3-тиазол-5-ил, 3-метоксиметил-1,2,4-оксадиазол-5-ил, 3-метилсульфанилметил-1,2,4-оксадиазол-5-ил, 3-этил-1,2,4-оксадиазол-5-ил, 5-метил-1,2,4-оксадиазол-3-ил, 1-этил-1Н-тетразол-5-ил, 2-этил-2Н-тетразол-5-ил, 1-метоксиметил-1Н-тетразол-5-ил или 2-метоксиметил-2Н-тетразол-5-ил, и
R5 обозначает незамещенный фенил,
или стереоизомер соединения.
4. Соединение по п.1, выбранное из группы, включающей
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(5-этил-1,3-оксазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(5-метил-1,2,4-оксадиазол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(3-этилизоксазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(5-этил-1,3,4-оксадиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1H,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(4-этил-1,3-оксазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(5-метилизоксазол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-{4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]бензоил}пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-{[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]метил}-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-1,3-оксазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-метил-1,3-тиазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-({3-[(метилсульфанил)метил]-1,2,4-оксадиазол-5-ил}метил)-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(5-метил-1,3-тиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(4-метил-1,3-тиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-{4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]бензоил}пиперидин-4-ил]-1-{[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]метил}-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-1,3-оксазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(1-этил-1Н-пиразол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(1-этил-1Н-пиразол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-2,2-диоксидо-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-метил-1,3-тиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-1,2,3-триазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-тиадиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(1-этил-1Н-1,2,3-триазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(2R,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(2S,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-{[2-(метоксиметил)-2Н-тетразол-5-ил]метил}-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион;
3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-{[1-(метоксиметил)-1H-тетразол-5-ил]метил}-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион.
5. Соединение формулы (1) по п.1, которое представляет собой 3-[1-({4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион.
6. Соединение формулы (1) по п.1, которое представляет собой 3-[1-({3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4а,10b-тетрагидро-1Н-тиопирано[4,3-с]изохинолин-6-ил]фенил}карбонил)пиперидин-4-ил]-1-[(2-этил-2Н-тетразол-5-ил)]метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1Н,3H)дион.
7. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении фосфодиэстеразы типа 4 и типа 5, включающая соединение формулы (1) или его стереоизомер по любому из пп.1-3 вместе с фармацевтически приемлемыми вспомогательными веществами.
8. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении фосфодиэстеразы типа 4 и типа 5, включающая соединение формулы (1) по п.4 вместе с фармацевтически приемлемыми вспомогательными веществами.
9. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении фосфодиэстеразы типа 4 и типа 5, включающая соединение формулы (1) по любому из пп.5 или 6 вместе с фармацевтически приемлемыми вспомогательными веществами.
10. Фармацевтическая композиция по п.7, дополнительно включающая одно или два терапевтических средства, выбранных из группы, включающей кортикостероиды, антихолинергетики, агонисты β2-адренорецептора, антагонисты рецептора H1, антагонисты лейкотриенового рецептора, ингибиторы 5-липоксигеназы, антагонисты эндотелинового рецептора, простациклины, блокаторы кальциевых каналов, бета-блокаторы, ингибиторы фосфодиэстеразы типа 4, ингибиторы фосфодиэстеразы типа 5, иммуносупрессанты, аналоги витамина D, ингибиторы HMG-CoA редуктазы, легочные сурфактанты, антибиотики, активаторы/стимуляторы гуанилатциклазы, тетрагидробиоптерин и производные тетрагидробиоптерина, антикоагулянты, диуретики, пирфенидон и гликозиды дигиталиса.
11. Фармацевтическая композиция по п.8, дополнительно включающая одно или два терапевтических средства, выбранных из группы, включающей кортикостероиды, антихолинергетики, агонисты β2-адренорецептора, антагонисты рецептора H1, антагонисты лейкотриенового рецептора, ингибиторы 5-липоксигеназы, антагонисты эндотелинового рецептора, простациклины, блокаторы кальциевых каналов, бета-блокаторы, ингибиторы фосфодиэстеразы типа 4, ингибиторы фосфодиэстеразы типа 5, иммуносупрессанты, аналоги витамина D, ингибиторы HMG-CoA редуктазы, легочные сурфактанты, антибиотики, активаторы/стимуляторы гуанилатциклазы, тетрагидробиоптерин и производные тетрагидробиоптерина, антикоагулянты, диуретики, пирфенидон и гликозиды дигиталиса.
12. Фармацевтическая композиция по п.9, дополнительно включающая одно или два терапевтических средства, выбранных из группы, включающей кортикостероиды, антихолинергетики, агонисты β2-адренорецептора, антагонисты рецептора H1, антагонисты лейкотриенового рецептора, ингибиторы 5-липоксигеназы, антагонисты эндотелинового рецептора, простациклины, блокаторы кальциевых каналов, бета-блокаторы, ингибиторы фосфодиэстеразы типа 4, ингибиторы фосфодиэстеразы типа 5, иммуносупрессанты, аналоги витамина D, ингибиторы HMG-CoA редуктазы, легочные сурфактанты, антибиотики, активаторы/стимуляторы гуанилатциклазы, тетрагидробиоптерин и производные тетрагидробиоптерина, антикоагулянты, диуретики, пирфенидон и гликозиды дигиталиса.
13. Применение соединения формулы (1) или его стереоизомера по любому из пп.1-3 для приготовления фармацевтической композиции, предназначенной для лечения или профилактики острого или хронического заболевания дыхательных путей.
14. Применение соединения формулы (1) по любому из пп.4-6 для приготовления фармацевтической композиции, предназначенной для лечения или профилактики острого или хронического заболевания дыхательных путей.
15. Применение по любому из пп.13 или 14, в котором острое или хроническое заболевание дыхательных путей выбрано из группы, включающей интерстициальное заболевание легких, фиброз легких, муковисцидоз, бронхиальную астму, хронический бронхит, эмфизему, хроническое обструктивное заболевание легких (ХОЗЛ) и ХОЗЛ, связанное с легочной гипертензией.
16. Применение по п.14, в котором острое или хроническое заболевание дыхательных путей представляет собой бронхиальную астму.
17. Применение по п.14, в котором острое или хроническое заболевание дыхательных путей представляет собой хроническое обструктивное заболевание легких (ХОЗЛ).
18. Применение по п.14, в котором острое или хроническое заболевание дыхательных путей выбрано из группы, включающей интерстициальное заболевание легких, фиброз легких и муковисцидоз.
Текст
В изобретении представлены соединения формулы (1), в которой A, R1, R2, R3 и R5 обладают значениями, приведенными в описании, которые являются новыми эффективными ингибиторами фосфодиэстеразы типов 4 и 5 Область техники, к которой относится изобретение Настоящее изобретение относится к новым 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолинам, которые используются в фармацевтической промышленности для производства фармацевтических композиций. Уровень техники В заявке на международный патент WO 2006027345 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолины описаны как ингибиторы фосфодиэстеразы типа 4. Описание изобретения Согласно изобретению было установлено, что 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолины, которые подробно описаны ниже, обладают неожиданными и особенно полезными характеристиками. Настоящее изобретение относится к соединению формулы 1 где А обозначает S, S(O) или S(O)2,R1 обозначает метоксигруппу или этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 1-метил-1 Н-имидазол-2-ил, 5-этилтиофен-2-ил, 3-метилтиофен-2-ил, 1-этилпиразол 3-ил, 2-этилпиразол-4-ил, 4-этил-1,3-оксазол-2-ил, 5-этил-1,3-оксазол-2-ил, 2-этил-1,3-оксазол-4-ил, 2 этил-1,3-оксазол-5-ил, 4-метил-1,3-оксазол-5-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 4-метил 1,3-тиазол-2-ил,5-метил-1,3-тиазол-2-ил,2-метил-1,3-тиазол-4-ил,2-метил-1,3-тиазол-5-ил,3 метоксиметил-1,2,4-оксадиазол-5-ил, 3-метоксипропил-1,2,4-оксадиазол-5-ил, 3-пропоксиметил-1,2,4 оксадиазол-5-ил, 3-метилсульфанилметил-1,2,4-оксадиазол-5-ил, 3-этил-1,2,4-оксадиазол-5-ил, 5-этил 1,3,4-оксадиазол-2-ил, 5-трет-бутил-1,3,4-оксадиазол-2-ил, 5-метоксиметил-1,3,4-оксадиазол-2-ил, 5 метил-1,2,4-оксадиазол-3-ил, 3-этил-1,2,4-тиадиазол-5-ил, 2-этил-1,2,3-триазол-4-ил, 1-этил-1,2,3 триазол-4-ил, 1-метил-1 Н-1,2,4-триазол-3-ил, 1-этил-1 Н-тетразол-5-ил, 2-этил-2 Н-тетразол-5-ил, 5-этил 2 Н-тетразол-2-ил, 1-метоксиметил-1 Н-тетразол-5-ил или 2-метоксиметил-2 Н-тетразол-5-ил, иC1-C4-Алкил означает обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами являются бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил, этил и метил.C1-C4-Алкил означает обладающую линейной цепью алкильную группу, содержащую от 1 до 2 атомов углерода. Примерами являются этил и метил.C1-C4-Алкоксигруппа означает группу, которая в дополнение к атому кислорода содержит обладающий линейной или разветвленной цепью алкильный радикал, содержащий от 1 до 4 атомов углерода. Алкоксигруппами, содержащими от 1 до 4 атомов углерода, которые можно отметить в этом контексте,являются, например, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пропоксигруппа, изопропоксигруппа, этоксигруппа и метоксигруппа.C1-C2-Алкоксигруппа означает группу, которая в дополнение к атому кислорода содержит обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 2 атомов углерода. Примерами являются этоксигруппа и метоксигруппа.C1-C4-Алкоксигруппа, которая полностью или преимущественно замещена фтором, представляет собой, например, 2,2,3,3,3-пентафторпропоксильный, перфторэтоксильный, 1,2,2-трифторэтоксильный и предпочтительно 1,1,2,2-тетрафторэтоксильный, 2,2,2-трифторэтоксильный, трифторметоксильный и дифторметоксильный радикал, из которых дифторметоксильный радикал является предпочтительным."Преимущественно" в этом контексте означает, что более половины атомов водорода C1-C4 алкоксигруппы заменены атомами фтора.C1-C4-Алкоксигруппа, которая полностью или преимущественно замещена фтором, представляет собой, например, перфторэтоксильный, 1,2,2-трифторэтоксильный, 1,1,2,2-тетрафторэтоксильный, 2,2,2 трифторэтоксильный, трифторметоксильный и дифторметоксильный радикал, из которых дифторметоксильный радикал является предпочтительным. "Преимущественно" в этом контексте означает, что более половины атомов водорода C1-C2-алкоксигруппы заменены атомами фтора.C3-С 5-Циклоалкилметоксигруппа означает циклопропилметоксигруппу, циклобутилметоксигруппу или циклопентилметоксигруппу. Галоген означает фтор, хлор, бром или йод, причем фтор, хлор или бром являются предпочтительными. Часть соединения формулы 1, которая через карбонильную группу присоединена к фенильной группе в положении 6 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолиновой кольцевой системы,может быть присоединена в орто-, мета- или пара-положении по отношению к связи с 3,4,4 а,10bтетрагидро-1 Н-тиопирано[4,3-с]изохинолиновой кольцевой системы. Предпочтительным является присоединение в мета- или пара-положение, особенно предпочтительным является присоединение в параположение."Стереоизомер" в качестве части выражения "или к стереоизомеру соединения" означает, что для соединений формулы 1 в случае, если А обозначает S(O), существуют 2 стереоизомера и оба эти 2 стереоизомера входят в объем настоящего изобретения (соответственно в объем конкретного пункта формулы изобретения). Абсолютная конфигурация соединений формулы 1 по стереогенным центрам в положениях 4 а и 10b зафиксирована и является R-конфигурацией в положении 4 а и R-конфигурацией в положении 10b. В предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает метоксигруппу или этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 1-этилпиразол-3-ил, 2-этилпиразол-4-ил, 4-этил-1,3-оксазол-2-ил, 5-этил-1,3-оксазол 2-ил, 2-этил-1,3-оксазол-4-ил, 2-этил-1,3-оксазол-5-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 4 метил-1,3-тиазол-2-ил, 5-метил-1,3-тиазол-2-ил, 2-метил-1,3-тиазол-4-ил, 2-метил-1,3-тиазол-5-ил, 3 метоксиметил-1,2,4-оксадиазол-5-ил,3-метилсульфанилметил-1,2,4-оксадиазол-5-ил,3-этил-1,2,4 оксадиазол-5-ил, 5-этил-1,3,4-оксадиазол-2-ил, 5-метоксиметил-1,3,4-оксадиазол-2-ил, 5-метил-1,2,4 оксадиазол-3-ил, 3-этил-1,2,4-тиадиазол-5-ил, 2-этил-1,2,3-триазол-4-ил, 1-этил-1,2,3-триазол-4-ил, 1 этил-1H-тетразол-5-ил, 2-этил-2 Н-тетразол-5-ил, 1-метоксиметил-1 Н-тетразол-5-ил или 2-метоксиметил 2 Н-тетразол-5-ил, иR5 обозначает незамещенный фенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает метоксигруппу или этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 3-метоксипропил-1,2,4-оксадиазол-5-ил, 3-этил-1,2,4-оксадиазол-5-ил или 2-этил-2 Нтетразол-5-ил,R5 обозначает 1,3-бензодиоксол-5-ил, 2-фторфенил, 4-фторфенил, 2,3-дифторфенил, 3,4 дифторфенил, 2-метокси-4-фторфенил, 2-метокси-5-фторфенил или 2,5-диметоксифенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает метоксигруппу или этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 3-метоксипропил-1,2,4-оксадиазол-5-ил, 1-метил-1 Н-1,2,4-триазол-3-ил, 1-метил-1Hимидазол-2-ил, 5-этилтиофен-2-ил, 3-метилтиофен-2-ил, 4-метил-1,3-оксазол-5-ил, 5-трет-бутил-1,3,4 оксадиазол-2-ил, 3-пропоксиметил-1,2,4-оксадиазол-5-ил или 5-этил-2 Н-тетразол-2-ил, иR5 обозначает незамещенный фенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 2-этил-2 Н-тетразол-5-ил или 3-метоксиметил-1,2,4-оксадиазол-5-ил,-2 023212R5 обозначает 1,3-бензодиоксол-5-ил, 2-фторфенил, 2-метокси-4-фторфенил или 2-метокси-5 фторфенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 5-этил-1,3-оксазол-2-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 2-метил-1,3 тиазол-5-ил, 3-метоксиметил-1,2,4-оксадиазол-5-ил, 3-метилсульфанилметил-1,2,4-оксадиазол-5-ил, 3 этил-1,2,4-оксадиазол-5-ил, 5-метил-1,2,4-оксадиазол-3-ил, 1-этил-1 Н-тетразол-5-ил, 2-этил-2 Н-тетразол 5-ил, 1-метоксиметил-1 Н-тетразол-5-ил или 2-метоксиметил-2 Н-тетразол-5-ил,R5 обозначает незамещенный фенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, S(O) или S(O)2,R1 обозначает этоксигруппу,R2 обозначает метоксигруппу,R3 обозначает 5-этил-1,3-оксазол-2-ил, 3-этилизоксазол-5-ил, 5-метилизоксазол-3-ил, 2-метил-1,3 тиазол-5-ил,3-метоксиметил-1,2,4-оксадиазол-5-ил,3-этил-1,2,4-оксадиазол-5-ил,5-метил-1,2,4 оксадиазол-3-ил, 1-этил-1H-тетразол-5-ил, 2-этил-2 Н-тетразол-5-ил, 1-метоксиметил-1H-тетразол-5-ил или 2-метоксиметил-2 Н-тетразол-5-ил,R5 обозначает незамещенный фенил,или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m в которой A, R1, R2, R3 и R5 являются такими, как определено выше, или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой R5 обозначает незамещенный фенил и A, R1, R2 и R3 являются такими, как определено выше, или к стереоизомеру соединения. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой A, R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой R5 обозначает незамещенный фенил и A, R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой A, R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой R5 обозначает незамещенный фенил и A, R1, R2 иR3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соедине-3 023212 нию формулы 1, в которой А обозначает S, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу иR3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу,R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу,R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу,R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S(O) и R1, R2, R3 и R5 являются такими,как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S(O), R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S(O) и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S(O), R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S(O) и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S(O), R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S(O), и R1, R2, R3 и R5 являются таки-4 023212 ми, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S(O), R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S(O), R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S(O)2, и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S(O)2, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S(O)2, и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S(O)2, R5 обозначает незамещенный фенил и R1, R2 иR3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S(O)2, и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S(O)2, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S(O)2 и R1, R2, R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S(O)2, R5 обозначает незамещенный фенил и R1, R2 и R3 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соедине-5 023212 нию формулы 1 р или lm, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу и R3 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m, в которой А обозначает S(O)2, R1 обозначает этоксигруппу, R2 обозначает метоксигруппу, R5 обозначает незамещенный фенил и R3 является таким, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-этил 1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-этил 1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-этил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-этил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 этил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 этил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 этил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 этил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-метил-1,3-тиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-метил-1,3-тиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метил-1,3-тиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-этил 2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-этил 2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-этил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-этил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 этил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 этил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 этил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществлениянастоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 этил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метоксиметил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метоксиметил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-метоксиметил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-метоксиметил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими,как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метоксиметил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метоксиметил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2-7 023212 метоксиметил-2 Н-тетразол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 2 метоксиметил-2 Н-тетразол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими,как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-метоксиметил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3-метоксиметил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1 р или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими,как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил и R1, R2 и R5 являются такими, как определено выше. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы 1m или его стереоизомеру, в которой А обозначает S, S(O) или S(O)2, R3 обозначает 3 метоксиметил-1,2,4-оксадиазол-5-ил, R5 обозначает незамещенный фенил и R1 и R2 являются такими,как определено выше. Соединения формулы 1 содержат стереогенные центры в положениях 4 а и 10b тиофенантридиновой кольцевой системы. Дополнительный стереогенный центр может находится в положении 2 тиофенантридиновой кольцевой системы, в случае, если А обозначает S(O). Абсолютная конфигурация по стереогенным центрам в положениях 4 а и 10b зафиксирована и является R-конфигурацией в положении 4 а и Rконфигурацией в положении 10b (обозначения "R" и "S" соответствуют правилам Кана, Ингольда и Прелога). Соответственно только один стереоизомер существует в случае, если А обозначает S или S(O)2. Абсолютная конфигурация по стереогенным центрам 4 а и 10b этого стереоизомера является Rконфигурацией в положении 4 а и R-конфигурацией в положении 10b. Два стереоизомера существуют в случае, если А обозначает S(O). Абсолютная конфигурация по стереогенным центрам 2, 4 а и 10b может представлять собой конфигурацию (2R, 4aR, 10bR) или (2S,4aR, 10bR). Нумерация тиофенантридиновой кольцевой системы приведена ниже в формуле (1) В объем настоящего изобретения также входят чистые стереоизомеры, указанные выше, а также все смеси стереоизомеров, указанных выше, независимо от их соотношения. Соединения, предлагаемые в настоящем изобретении, можно получить по схемам реакций 1-9. Как показано на схеме реакций 1 соединения формулы 1, в которой A, R1, R2 и R3 обладают указанными выше значениями и R5 обозначает незамещенный фенил, можно получить по реакции сочетания бензойной кислоты формулы 2, в которой A, R1 и R2 обладают указанными выше значениями, со вторичным амином формулы 3, в которой R3 обладает указанными выше значениями и R5 обозначает незамещенный фенил с использованием любой стандартной методики сочетания с образованием амид-8 023212 ной связи, такой как, например, использование реагентов сочетания или использование активированных производных кислот, таких как ангидриды или эфиры кислот. Обзор подходящих методик сочетания с образованием амидной связи приведен, например, в публикации С.A. G.N. Montalbetti, V. Falque, Tetrahedron, 61 (2005), 10827-10852. Получение бензойных кислот формулы 2 описано ниже на схеме реакций 6. Вторичный амин формулы 3, в которой R3 обладает указанными выше значениями и R5 обозначает незамещенный фенил, можно получить из соответствующих содержащих N-трет-бутоксикарбонильную защитную группу соединений формулы 4 путем использования стандартных условий для удаления третбутоксикарбонильной группы, таких как, например, использование хлорида водорода или трифторуксусной кислоты в подходящем растворителе, таком как диоксан или дихлорметан, и при необходимости в присутствии поглотителя катионов, такого как, например, анизол или тиофенол. Дополнительные альтернативные условия для удаления трет-бутоксикарбонильной группы приведены, например, в публикации Greene and Wuts, Protective Groups in Organic Synthesis, 3rd edition, John WileySons, New York,1999. Содержащие N-трет-бутоксикарбонильную защитную группу соединения формулы 4, в которой R3 обладает указанными выше значениями и R5 обозначает незамещенный фенил, можно получить по реакции трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилата (экспериментальная часть - пример В 50) с соединением формулы 5, в которой R3 обладает указанными выше значениями и LG означает подходящую отщепляющуюся группу, такую как, например,галогенид, предпочтительно хлорид или бромид, или мезильную или тозильную группу. Реакцию проводят в подходящем растворителе, таком как диметилсульфоксид или N,N-диметилформамид, в присутствии основания, такого как, например, карбонат калия, карбонат натрия, диизопропилэтиламин или триэтиламин, и предпочтительно при повышенной температуре, предпочтительно при 100 С. Получение трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилата описано на схеме реакций 3, а также в экспериментальной части настоящей заявки. Соединения формулы 5 имеются в продаже или можно получить по методикам, известным в данной области техники, или по аналогичным методикам. Дополнительная информация о получении соединений формулы 5 приведена в экспериментальной части настоящей заявки. Альтернативная методика получения содержащих N-трет-бутоксикарбонильную защитную группу соединений формулы 4, в которой R3 обозначает тетразол-5-ильное кольцо, замещенное с помощью R4,R4 обладает указанными выше значениями и R5 обозначает незамещенный фенил, приведена на схеме реакций 2. В соответствии со схемой реакций 2 гетероциклическая группа R3 не вводится по реакции с соединением формулы 5, как показано на схеме реакций 1, а образуется по многостадийной методике. На первой стадии трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилат (экспериментальная часть - пример В 50) вводят в реакцию с хлорацетонитрилом в подходящем растворителе, таком как хлороформ, тетрагидрофуран, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, в присутствии основания, такого как карбонат калия, карбонат натрия, диизопропилэтиламин или триэтиламин, предпочтительно при повышенной температуре, предпочтительно при 100 С и получают трет-бутил-4-[1-(цианометил)-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2d]пиримидин-3(2 Н)-ил]пиперидин-1-карбоксилат (экспериментальная часть - пример В 14 а). Превращение цианогруппы трет-бутил-4-[1-(цианометил)-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин 3(2 Н)-ил]пиперидин-1-карбоксилата в соответствующий тетразольный фрагмент (трет-бутил-4-[2,4 диоксо-6-фенил-1-(1 Н-тетразол-5-илметил)-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил]пиперидин-1 карбоксилат и трет-бутил-4-[2,4-диоксо-6-фенил-1-(2 Н-тетразол-5-илметил)-1,4-дигидротиено[3,2d]пиримидин-3(2 Н)-ил]пиперидин-1-карбоксилат (экспериментальная часть - пример 14b) можно провести путем превращения с использованием азида натрия в присутствии триэтилхлорида аммония в подходящем растворителе, таком как, например, N,N-диметилформамид, при повышенной температуре,предпочтительно при 100 С. На последующей стадии реакции таутомерные соединения трет-бутил-4-[2,4-диоксо-6-фенил-1-(1 Нтетразол-5-илметил)-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил]пиперидин-1-карбоксилат и третбутил-4-[2,4-диоксо-6-фенил-1-(2 Н-тетразол-5-илметил)-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил]пиперидин-1-карбоксилат алкилируют соединением формулы 6, в которой R4 обладает указанными выше значениями и LG означает подходящую отщепляющуюся группу, такую как, например, галогенид,предпочтительно хлорид или бромид, или мезильную или тозильную группу в присутствии основания,такого как, например, гидрид лития, гидрид натрия или карбонат калия, карбонат натрия, диизопропилэтиламин, триэтиламин, в подходящем растворителе, таком как, например, N,N-диметилформамид или диметилсульфоксид, при повышенной температуре, предпочтительно при 40 С, и получают трет-бутил 4-1-[(2-(R4)-2 Н-тетразол-5-ил)метил]-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)илпиперидин-1-карбоксилат и 4-1-[(1-(R4)-1H-тетразол-5-ил)метил]-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-илпиперидин-1-карбоксилат. Методика получения соединения В 50 приведена на схеме реакций 3. На первой стадии метил-3 амино-5-фенилтиофен-2-карбоксилат вводят в реакцию с трифосгеном, затем с трет-бутил-4-9 023212 аминопиперидин-1-карбоксилатом в подходящем растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, при низкой температуре,предпочтительно при 0 С. Обработка полученного трет-бутил-4-([2-(метоксикарбонил)-5-фенил-3 тиенил]карбамоиламино)пиперидин-1-карбоксилата (экспериментальная часть - пример В 51) метоксидом натрия в подходящем растворителе, таком как метанол, в присутствии основания, такого как карбонат калия, карбонат натрия, диизопропилэтиламин или триэтиламин, при повышенной температуре,предпочтительно при 65 С, дает трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин 3(2 Н)-ил)пиперидин-1-карбоксилат (экспериментальная часть - пример В 50). На схеме реакций 4 описан альтернативный путь получения соединений формулы 1, в которой A,R1, R2 и R3 обладают указанными выше значениями и R5 обозначает незамещенный фенил. Кроме того,путь получения, описанный на схеме 4, является особенно подходящим для получения соединений формулы 1, в которой A, R1, R2 и R3 обладают указанными выше значениями и R5 обозначает фенил, замещенный с помощью R6, или фенил, замещенный с помощью R6 и R7. В соответствии со схемой реакций 4 соединения формулы 1, в которой А, R1, R2 R3 и R5 обладают указанными выше значениями, можно получить по реакции сочетания бензойной кислоты формулы 2, в которой A, R1 и R2 обладают указанными выше значениями, со вторичным амином формулы 3, в которой R3 обладает указанными выше значениями и R5 обозначает незамещенный фенил или фенил, замещенный с помощью R6, или фенил, замещенный с помощью R6 и R7, с использованием любой стандартной методики сочетания с образованием амидной связи, такой как, например, использование реагентов сочетания или использование активированных производных кислот, таких как ангидриды или эфиры кислот. Получение бензойных кислот формулы 2 описано ниже на схеме реакций 6. Вторичный амин формулы 3 можно получить из соответствующих содержащих N-третбутоксикарбонильную защитную группу соединений формулы 4 путем использования стандартных условий для удаления трет-бутоксикарбонильной группы, таких как, например, использование хлорида водорода или трифторуксусной кислоты в подходящем растворителе, таком как диоксан или дихлорметан, и при необходимости в присутствии поглотителя катионов, такого как, например, анизол или тиофенол. Содержащие N-трет-бутоксикарбонильную защитную группу соединения формулы 4, в которой R3 и R5 обладают указанными выше значениями, можно получить, например, по катализируемой палладием реакции сочетания. Соединения формулы 8, в которой R3 обладает указанными выше значениями, вводят в реакцию с фенилбороновой кислотой или эфиром фенилбороновой кислоты формулы 7, в которой R5 обладает указанными выше значениями и R может обозначать водород, C1-C4-алкил или две группы R могут вместе образовать алкиленовый мостик, необязательно дополнительно замещенный метальными группами (например, с образованием пинаколинового эфира), в инертном растворителе, таком как, например, 1,2 диметоксиэтан или 1,4-диоксан, в присутствии водного раствора основания, такого как, например, карбонат калия, карбонат цезия или фосфат калия, и палладиевого катализатора, такого как, например, дихлорбис(трициклогексилфосфин)палладий, при температуре в диапазоне от 60 до 160 С, предпочтительно примерно при 150 С и дополнительно при нагревании микроволновым излучением. Содержащие N-трет-бутоксикарбонильную защитную группу соединения формулы 8 можно получить, как это показано на схеме реакций 1, по реакции трет-бутил-4-(6-бром-2,4-диоксо-1,4 дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилата (экспериментальная часть - пример В 53) с соединением формулы 5, в которой R3 обладает указанными выше значениями и LG означает подходящую отщепляющуюся группу, такую как, например, галогенид, предпочтительно хлорид или бромид, или мезильную или тозильную группу. Реакцию проводят в подходящем растворителе, таком как N,N-диметилформамид, в присутствии основания, такого как, например, карбонат калия, карбонат натрия, диизопропилэтиламин или триэтиламин, и предпочтительно при повышенной температуре,предпочтительно при 100 С. Явно не представленная на схеме реакций 4 существует другая альтернативная методика получения соединений формулы 4. В этой альтернативной методике в качестве исходного вещества также используют соединение В 53, но последовательность введения группы R3-CH2- и группы R5 является обратной по сравнению со схемой реакций 4. Подходящие условия проведения реакции для этой альтернативной методики описаны в экспериментальной части в методике получения соединений В 63 и В 62. На схеме реакций 5 описан синтез соединения В 53. Промежуточный продукт, метиловый эфир 3 амино-5-бромтиофен-2-карбоновой кислоты (соединение В 54b), получают по описанной в литературе методике (BioorganicMedicinal Chemistry Letters 17 (2007) 2535-2539) путем превращения метил-3 аминотиофен-2-карбоксилата в метил-3-[(трифторацетил)амино]тиофен-2-карбоксилат с помощью ангидрида трифторуксусной кислоты с последующей последовательностью литиирование/бромирование с использованием н-бутиллития и 1,2-дибромэтана и получают метил-5-бром-3-[(трифторацетил)амино]тиофен-2-карбоксилат, который гидролизуют в щелочной среде с использованием карбоната калия и получают метиловый эфир 3-амино-5-бромтиофен-2-карбоновой кислоты (соединение В 54b). Синтез соединения В 53 проводят аналогично тому, как уже описано на схеме реакций 3: Соединение В 54b вводят в реакцию с трифосгеном, затем с трет-бутил-4-аминопиперидин-1 карбоксилатом в подходящем растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, при низкой температуре, предпочтительно при 0 С. Обработка полученного трет-бутил-4-([5-бром-2-(метоксикарбонил)тиофен-3-ил]карбамоиламино)пиперидин-1-карбоксилата (экспериментальная часть - пример В 54 а) метоксидом натрия в подходящем растворителе, таком как метанол, в присутствии основания, такого как карбонат калия, карбонат натрия, диизопропилэтиламин или триэтиламин, при повышенной температуре, предпочтительно при 65 С, дает трет-бутил-4-(6-бром-2,4-диоксо-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин 1-карбоксилат (экспериментальная часть - пример В 53). Схема реакций 1 На схеме реакций 6 представлено получение кислот формулы 2, в которой А обозначает S и R1 и R2 обладают указанными выше значениями. Превращение производного тетрагидротиопиранона формулы 15, в которой R1 и R2 обладают указанными выше значениями, с помощью (1R)-1-(C1-C4-алкоксизамещенного или незамещенного)арилэтанамина, такого как предпочтительно (1R)-1-(4-метоксифенил)этанамин или (1R)-1 фенилэтанамин, проводят по стандартным методикам реакций конденсации, известным специалисту в данной области техники, предпочтительно в присутствии подходящего катализатора, например, птолуолсульфоновой кислоты, при условиях, необходимых для отделения воды, в подходящем растворителе, таком как, например, н-гексан, бензол или толуол, при повышенных температурах, предпочтительно при температуре кипения использующегося растворителя. Гидрирование полученного имина/енамина формул 14 а/14b, в которых R1 и R2 обладают указанными выше значениями, проводят по стандартным методикам, известным специалисту в данной области техники, например, в присутствии платины на угле в качестве катализатора с использованием подходящего растворителя, такого как, например, метанол, этанол, ТГФ или 1,4-диоксан, в атмосфере водорода при давлении примерно 100 мбар и при повышенной температуре предпочтительно от 40 до 80 С. Альтернативно, гидрирование полученного имина/енамина формул 14a/14b, в которых R1 и R2 обладают указанными выше значениями, проводят в присутствии реагентов - переносчиков водорода, таких как борогидрид щелочного металла, цианоборогидрид щелочного металла, триацетоксиборогидрид щелочного металла или ацилоксиборогидриды щелочных металлов с использованием дихлорметана, толуола или ТГФ в качестве растворителя, предпочтительно при КТ. Ацилоксиборогидриды щелочных металлов получают, например, из NaBH4 и различных карбоновых кислот (например, 2-метилгексановой кислоты) по методикам, известным специалисту в данной области техники, например, как это описано в публикации Tetrahedron Letters, 37 (1996), 3977-3980. Удаление (1R)-1-(C1-С 4-алкоксизамещенной или незамещенной)арилэтильной группы путем гидрирования из соединений формулы 13 также проводят по стандартным методикам, известным специалисту в данной области техники, предпочтительно в присутствии от 1 до 1,2 эквивалентом концентрированной хлористо-водородной кислоты и палладия на угле в качестве катализатора с использованием спирта, такого как метанол или этанол, в качестве растворителя, в атмосфере водорода при давлении примерно от 0,1 до 10 бар, предпочтительно от 0,1 до 1 бар и при повышенной температуре предпочтительно от 40 до 60 С. Альтернативно, удаление (1R)-1-(С 1-С 4-алкоксизамещенной или незамещенной)арилэтильной группы проводят в кислой среде с использованием неразбавленной трифторуксусной кислоты или неразбавленной муравьиной кислоты при повышенной температуре предпочтительно от 50 до 100 С. Полученные соединения формулы 12, в которой R1 и R2 обладают указанными выше значениями,вводят в реакцию с соединением формулы 11, в которой X обозначает подходящую отщепляющуюся группу, например, галогенид, предпочтительно хлорид или бромид. Это бензоилирование проводят, например, по методике Айнхорна в варианте Шоттена-Баумана или как это описано в публикации J. Chem.Soc С, 1971, 1805-1808. Циклоконденсацию соединений формулы 10 проводят по методике, известной специалисту в данной области техники, например, по методике Бишлера-Напиральского (например, как это описано в публикации J. Chem. Soc., 1956, 4280-4282) или по варианту методики Бишлера-Напиральского (например,как это описано в публикации Heterocycles 60 (2003), . 12, 2707-2715) в присутствии подходящего конденсирующего реагента, такого как, например, полифосфорная кислота, пентахлорид фосфора, трихлорид фосфора, пентаоксид фосфора, тионилхлорид или ангидрид трифторметансульфоновой кислоты и 4 диметиламинопиридин, в подходящем инертном растворителе, например в хлорированном углеводороде,таком как дихлорметан, или в циклическом углеводороде, таком как толуол или ксилол, или в другом инертном растворителе, таком как ацетонитрил, предпочтительно при повышенной температуре, предпочтительно при температуре кипения использующегося растворителя. В заключение соединения формулы 9, в которой R1 и R2 обладают указанными выше значениями,омыляют и получают соответствующие кислоты формулы 2 в присутствии подходящего основания, такого как, например, гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия или карбонат цезия, в подходящем растворителе, таком как, например, вода, вода-метанол, водадиоксан или вода-2-пропанол. На схемах реакций 7 и 8 представлено получение соединений формулы 2, в которой А обозначаетS(O) или S(O)2 и R1 и R2 обладают указанными выше значениями. На схеме реакций 7 показано, что соединения формулы 9, в которой А обозначает S(O) или S(O)2 иR1 и R2 обладают указанными выше значениями, можно получить по реакции соответствующих соединений формулы 2, в которой А обозначает S, с м-пероксибензойной кислотой в подходящем растворителе, таком как дихлорметан при низких температурах предпочтительно от -50 до 0 С. Разделение диастереоизомерных сульфоксидов и сульфонов проводят с помощью флэш-хроматографии с использованием подходящей элюирующей системы, такой как в случае метил-4-[(2R,4aR,10bR)-9-этокси-8-метокси-2 оксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензоата, метил-4-[(2S,4aR,10bR)-9- 13023212 этокси-8-метокси-2-оксидо-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензоата и метил-4-[(4aR,10bR)-9-этокси-8-метокси-2,2-диоксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензоата - смесь EtOAc/MeOH/н-гексан от 19/1/6 до 19/1/0 (об./об./об.). В заключение соединения формулы 9, в которой А обозначает S(O) или S(O)2 и R1 и R2 обладают указанными выше значениями, превращают в соответствующие соединения формулы 2 путем омыления сложноэфирной группы, которое проводят в присутствии подходящего основания, такого как LiOH,NaOH или KOH, в растворителе, таком как 1,4-диоксан, 2-пропанол или тетрагидрофуран, предпочтительно при комнатной температуре. Для соединений формулы 2, в которой А обозначает S(O)2 и R1 и R2 обладают указанными выше значениями, более предпочтительная методика получения приведена на схеме реакций 8. В этом случае соединения формулы 10, в которой А обозначает S и R1 и R2 обладают указанными выше значениями,вводят в реакцию с м-пероксибензойной кислотой в подходящем растворителе, таком как дихлорметан,при низких температурах предпочтительно при 0 С (баня со льдом) и получают соответствующие соединения формулы 16, в которой А обозначает S(O)2. Последующие стадии реакции (циклоконденсациясоответствующее соединение формулы 9 и омыление-соответствующее соединение формулы 2) проводят так, как это описано для аналогичных стадий реакций на схеме реакций 6. На схеме реакций 9 представлено получение производного тетрагидротиопиранон формулы 15, в которой R1 и R2 обладают указанными выше значениями. Превращение рацемической смеси 3-(3-алкокси-4-алкоксифенил)-1-(С 1-С 4-алкил)-пиперидин-4-она формулы 17 в тетрагидротиопиранон формулы 15 начинают с кватернизации атома азота пиперидин-4 онового кольца по реакции с подходящим алкилирующим реагентом, таким как, например, метилйодид,этилйодид, метиловый эфир трифторметановой кислоты или этиловый эфир трифторметановой кислоты,в подходящем растворителе, таком как, например, толуол, дихлорметан, диэтиловый эфир и предпочтительно 4-метилпентан-2-он, при низкой температуре предпочтительно от 0 до 20 С. На второй стадии реакции четвертичный атом азота заменяют на атом серы по реакции с Na2S или одним из его гидратов,таким как, например, нонагидрат, в присутствии гидросульфида натрия или одного из его гидратов,предпочтительно моногидрата в смеси вода/толуол, вода/диэтиловый эфир, вода/дихлорметан, или предпочтительно в системе растворителей вода/4-метилпентан-2-он при кипячении с обратным холодильником. Способ получения соединений формулы 15, в которой R1 и R2 обладают указанными выше значениями, отличается тем, что (а) кольцевой атом азота соединения формулы (17) в которой R1 обозначает C1-C4-алкоксигруппу, C3-C7-циклоалкоксигруппу, С 3-С 7-циклоалкилметоксигруппу или C1-C4-алкоксигруппу, преимущественно или полностью замещенную фтором, иR2 обозначает C1-C4-алкоксигруппу, С 3-С 7-циклоалкоксигруппу, С 3-С 7-циклоалкилметоксигруппу или C1-C4-алкоксигруппу, преимущественно или полностью замещенную фтором, илиR1 обозначает C1-C2-алкоксигруппу или C1-C2-алкоксигруппу, преимущественно или полностью замещенную фтором, иR2 обозначает C1-C2-алкоксигруппу или C1-C2-алкоксигруппу, преимущественно или полностью замещенную фтором, илиR2 обозначает метоксигруппу,и R обозначает C1-C4-алкил, предпочтительно метил, кватернизуют по реакции с алкилирующим реагентом, предпочтительно метиловым эфиром трифторметановой кислоты, и (b) четвертичный атом азота заменяют на атом серы по реакции с Na2S или одним из гидратов Na2S в присутствии гидросульфида натрия или одного из гидратов гидросульфида натрия. Альтернативная методика получения соединений формулы 15 описана в заявке на международный патент WO 2006027345. Соединения формулы 17 можно получить, как это описано в US 3899494, или по аналогичным методикам. Как можно видеть на схеме реакций 1, соединения формулы 2, в которой R1, R2 и А обладают указанными выше значениями, являются ключевыми промежуточными продуктами. D соединения формулы 1 можно ввести структуру 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолина. Хотя соединения формулы 2, в которой R1, R2 и А обладают указанными выше значениями, в общем виде раскрыты в WO 2006027345, в WO 2006027345 не раскрыты конкретные примеры таких соединений формулы 2. Примерами соединений формулы 2, которые можно отметить в связи с этим, являются 4-[(2R,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойная кислота; Специалисту в данной области техники известно, что, если в исходных или промежуточных соединениях имеется целый ряд реакционноспособных центров, то, чтобы реакция протекала именно по необходимому реакционноспособному центру, может быть необходимым временное блокирование одного или большего количества реакционноспособных центров с помощью защитных групп. Подробное описание использования известных защитных групп приведено, например, в публикациях Т.W. Greene, Protective Groups in Organic Synthesis, John WileySons, 1999, 3rd Ed. или Р. Kocienski, Protecting Groups,Thieme Medical Publishers, 2000. Соединения, предлагаемые в настоящем изобретении, выделяют и очищают по известным методикам, например путем отгонки растворителя в вакууме и перекристаллизации полученного остатка из подходящего растворителя или использования одной из обычных методик очистки, таких как колоночная хроматография на подходящем носителе. Как должны понимать специалисты в данной области техники, настоящее изобретение не ограничивается конкретными вариантами осуществления, описанными в настоящем изобретении, а включает все модификации указанных вариантов осуществления, которые входят в сущность и объем настоящего изобретения, определенные прилагаемой формулой изобретения. Приведенные ниже примеры подробнее иллюстрируют настоящее изобретение без его ограничения. Дополнительные соединения, предлагаемые в настоящем изобретении, получение которых не описано подробно, можно получить аналогичным образом. Соединения, которые указаны в примерах, представляют собой предпочтительные варианты осуществления настоящего изобретения. Примеры Используются следующие аббревиатуры:t пл - температура плавления. Если не указано иное, очистку соединений проводят с помощью колоночной флэш-хроматографии,препаративной ТСХ и препаративной ВЭЖХ. Очистку с помощью ВЭЖХ проводят с использованием колонки Phenomenex Gemini 5 мкм С 18 (7530 мм) или Phenomenex Gemini 5 мкм C6-Phenyl (7530 мм) или Phenomenex Gemini 5 мкм С 18 Axia (7530 мм), в двойном градиентном режиме (растворитель А: вода, растворитель В: ацетонитрил), при скорости потока, равной 40 мл/мин, с использованием в качестве буфера муравьиной кислоты или буферной системы, содержащей муравьиную кислоту и формиат аммония, и с УФ-детектированием при 240 нм. Все масс-спектры снимают с использованием методики ИЭР. Данные МСВР для примеров 1-59 приведены в виде МН+. Конечные продукты. Химические названия образованы с помощью программного обеспечения ACD/NAME Library DLL:HBTU (167 мг) в ДХМ (3 мл) добавляют ДИПЭА (0,28 мл) и смесь перемешивают в течение 1 ч при КТ. Через 1 ч добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10bтетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (40 мг) и смесь перемешивают в течение 15 мин для завершения реакции. Затем растворитель удаляют и остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент:EtOAc/MeOH, 97,5/2,5 (об./об.)] и затем с помощью препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C45H46N5O6S2]: рассчитано 816,2884, найдено 816,2887. 2. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-метил-1,2,4-оксадиазол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(5-метил-1,2,4-оксадиазол-3-ил)метил]-6-фенил-3-пиперидин-4-илтиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (200 мг; соединение В 27), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (188 мг; соединение С 10) и HBTU (196 мг) в ДХМ (7,5 мл) добавляют ДИПЭА (0,33 мл). Реакционную смесь перемешивают при КТ в течение 14 ч. Добавляют дополнительное количество ДХМ (10 мл) и насыщенного водного раствора бикарбоната натрия (10 мл) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэшхроматографии [силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)],затем с помощью препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C43H43N6O6S2]: рассчитано 803,2680, найдено 803,2659. 3. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этилизоксазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин 2,4(1 Н,3H)дион. 1-[(3-Этилизоксазол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (200 мг; соединение В 28) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (168 мг; соединение С 10) и HBTU (191 мг) в ДХМ (10 мл) в присутствии ДИПЭА (0,29 мл) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 3/1 до 0/1 (об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H46N5O6S2]: рассчитано 816,2884, найдено 816,2887. 4. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-этил-1,3,4-оксадиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(5-Этил-1,3,4-оксадиазол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (200 мг; соединение В 29) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (168 мг; соединение С 10) и HBTU (191 мг) в ДХМ (10 мл) в присутствии ДИПЭА (0,29 мл) по методике, описанной в примере 2, и после очистки с помощью двукратной колоночной флэш-хроматографии [силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 3/2 до 0/1 и ДХМ/МеОН от 1/0 до 1/1 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O6S2]: рассчитано 817,2837, найдено 817,2827. 5. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(4-этил-1,3-оксазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(4-этил-1,3-оксазол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (200 мг; соединение В 30) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (168 мг; соединение С 10) и HBTU (191 мг) в ДХМ (10 мл) в присутствии ДИПЭА (0,29 мл) по методике, описанной в примере 2, и после очистки с помощью двукратной колоночной флэш-хроматографии [силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 3/1 до 0/1 (об./об.) и ДХМ/МеОН от 1/0 до 1/1 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C45H46N5O6S2]: рассчитано 816,2884, найдено 816,2887. 6. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-метилизоксазол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(5-Метилизоксазол-3-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (250 мг; соединение В 31) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (238 мг; соединение С 10) и HBTU (246 мг) в ДХМ (15 мл) в присутствии ДИПЭА (0,38 мл) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 3/2 (об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H44N5O6S2]: рассчитано 802,2728, найдено 802,2728. 7. 3-(1-4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]бензоилпиперидин-4-ил)-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин 2,4(1 Н,3H)дион. К смеси 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]бензойной кислоты (99,4 мг; соединение C10), 1-(3-этил-[1,2,4]оксадиазол-5-илметил)-6-фенил-3 пиперидин-4-ил-1 Н-тиено[3,2-d]пиримидин-2,4-диона (109 мг; соединение В 52) и НОВТ (38 мг) в ДХМ(2,5 мл) добавляют EDCI (48,9 мг). Смесь перемешивают в течение 2,5 ч при КТ. EtOAc (25 мл) добавляют и смесь экстрагируют 1 М водным раствором хлорида водорода (5 мл) (трижды). Объединенные водные фазы промывают с помощью EtOAc (15 мл) и затем объединенные органические фазы промывают водой (5 мл) (трижды) и затем насыщенным раствором бикарбоната натрия (10 мл) (трижды). Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и полученный остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: EtOAc/циклогексан от 0/100 до 20/80 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O6S2]: рассчитано 817,2837, найдено 817,2826. 8. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]метил-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[5-(Метоксиметил)-1,3,4-оксадиазол-2-ил]метил-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (250 мг; соединение В 33) вводят в реакцию с 4-[(4aR, 10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (223 мг; соединение C10) и HBTU (232 мг) в ДХМ (15 мл) в присутствии ДИПЭА (0,36 мл) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 3/2 (об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O7S2]: рассчитано 833,2786, найдено 833,2784. 9.3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-1,3-оксазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1, с использованием 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (167 мг; соединение C10), 1-[(2-этил-1,3-оксазол-5-ил)метил]-6-фенил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорида (200 мг; соединение В 34), HBTU (175 мг),ДИПЭА (0,29 мл) и ДХМ (3 мл). Очистка с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент: EtOAc/метанол 97,5/2,5 (об./об.)] и затем с помощью препаративной ВЭЖХ дает искомое соединение в виде твердого вещества. МСВР [C45H46N5O6S2]: рассчитано 816,2884, найдено 816,2873. 10. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-метил-1,3-тиазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1, с использованием 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10), 1-[(2-метил-1,3-тиазол-4-ил)метил]-6-фенил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (190 мг; соединение В 35), HBTU (167 мг), ДИПЭА (0,28 мл) и ДХМ (3 мл). Неочищенный продукт последовательно 3 раза очищают с помощью колоночной флэш-хроматографии (модифицированный аминогруппами силикагель, элюент: EtOAc) и получают искомое соединение в виде твердого вещества. МСВР [C44H44N5O5S3]: рассчитано 818,2499, найдено 818,2499. 11. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-(3-[(метилсульфанил)метил]-1,2,4-оксадиазол-5-илметил)-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-(3-[(метилсульфанил)метил]-1,2,4-оксадиазол-5-илметил)-6-фенил-3-(пиперидин 4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (202,4 мг; соединение В 36), 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10) и HBTU (167 мг) в ДХМ (8 мл) добавляют ДИПЭА (207 мг). Реакционную смесь перемешивают в течение 3 ч при КТ. Добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (80 мг; соединение C10) и HBTU (84 мг) для завершения реакции. Добавляют насыщенный водный раствор бикарбоната натрия (5 мл) и смесь экстрагируют с помощью ДХМ (25 мл). Фазы разделяют и водную фазу экстрагируют дополнительным количеством ДХМ (10 мл). Органические фазы объединяют и фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток дважды очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O6S3]: рассчитано 849,2557, найдено 849,2555. 12. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-метил-1,3-тиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1 (однако перемешивание проводят в течение 12 ч при КТ), с использованием 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10bтетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10), 1-[(5 метил-1,3-тиазол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорида (190 мг; соединение В 37), HBTU (167 мг), ДИПЭА (207 мг) и ДХМ (10 мл). Неочищенный продукт трижды очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100(об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H44N5O5S3]: рассчитано 818,2499, найдено 818,2503. 13. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(4-метил-1,3-тиазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1, с использованием 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10), 1-[(4-метил-1,3-тиазол-2-ил)метил]-6-фенил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (190 мг; соединение В 38), HBTU (167 мг) (через 90 мин дополнительно добавляют 76 мг HBTU), ДИПЭА (0,28 мл) и ДХМ (3 мл). Неочищенный продукт очищают с помощью колоночной флэш-хроматографии (модифицированный аминогруппами силикагель,элюент: EtOAc) и затем с помощью препаративной тонкослойной хроматографии [элюент: ДХМ/МеОН/триэтиламин, 95/5/0,5 (об./об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H44N5O5S3]: рассчитано 818,2499, найдено 818,2494. 14. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохино- 19023212 лин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоте (160 мг; соединение C10), растворенной в ДХМ (20 мл), добавляют HBTU (167 мг) и ДИПЭА (0,21 мл) и реакционную смесь перемешивают в течение 30 мин при КТ. Затем добавляют 1-[(2 этил-2 Н-тетразол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион (175 мг; соединение В 39) и реакционную смесь перемешивают в течение 24 ч при КТ. После экстракции насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия органическую фазу отделяют и сушат над Na2SO4. После фильтрования растворитель удаляют при пониженном давлении и получают неочищенный искомый продукт. После очистки с помощью колоночной флэшхроматографии (силикагель, элюент: EtOAc) получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O5S2]: рассчитано 817,2949, найдено 817,2981. 15. 3-(1-4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин 6-ил]бензоилпиперидин-4-ил)-1-[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]метил-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. 1-[3-(Метоксиметил)-1,2,4-оксадиазол-5-ил]метил-6-фенил-3-пиперидин-4-илтиено[3,2-d]пиримидин-2,4(1H,3H)-дионгидрохлорид (148 мг; соединение В 40) вводят в реакцию с 4-[(4aR, 10bR)-9-этокси 8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (120 мг; соединение C10) и HBTU (126 мг) в ДХМ (8 мл) в присутствии ДИПЭА (155 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 1/1,5 до 0/1 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O7S2]: рассчитано 833,2786, найдено 833,2799. 16. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-1,3-оксазол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 11, с использованием 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10), 1-[(2-этил-1,3-оксазол-4-ил)метил]-6-фенил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (190 мг; соединение В 41), HBTU (167 мг), ДИПЭА (207 мг) и ДХМ (8 мл). Через 3 ч добавляют дополнительное количество HBTU (91 мг) и 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (20 мг; соединение C10) и смесь перемешивают в течение 22 ч при КТ. Добавляют насыщенный водный раствор бикарбоната натрия (2,5 мл) и смесь дважды экстрагируют с помощью ДХМ (25 мл). Объединенные органические слои вводят в фазовый разделитель и растворитель удаляют в вакууме. Полученный остаток трижды очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100(об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C45H46N5O6S2]: рассчитано 816,2884, найдено 816,2879. 17. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(1-этил-1 Н-пиразол-4-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(1-этил-1H-пиразол-4-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (300 мг; соединение В 42), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (253 мг; соединениеC10), EDCI (122 мг) и гидрата НОВТ (86 мг) в ДХМ (10 мл) добавляют ДИПЭА (0,28 мл). Через 45 мин добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (126 мг; соединение C10) и реакционную смесь перемешивают в течение 14 ч при КТ. Добавляют воду и водный раствор гидросульфата калия (10% мас./мас.) и смесь экстрагируют с помощью ДХМ. Объединенные органические слои сушат (сульфат натрия) и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной флэшхроматографии [силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)] и препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C45H47N6O5S2]: рассчитано 815,3044, найдено 815,3044. 18. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(1-этил-1 Н-пиразол-3-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(1-этил-1H-пиразол-3-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионтрифторацетата (250 мг; соединение В 43), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (181 мг; соединениеC10), EDCI (87 мг) и гидрата НОВТ (61 мг) в ДХМ (15 мл) добавляют ДИПЭА (0,24 мл). Через 14 ч при КТ добавляют дополнительное количество EDCI (87 мг) и гидрата НОВТ (61 мг) и реакционную смесь перемешивают в течение еще 3 дней при КТ. Добавляют водный раствор гидросульфата калия (10% мас./мас.) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [силикагель,элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C45H47N6O5S2]: рассчитано 815,3044, найдено 815,3036. 19. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-2,2-диоксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1 (однако перемешивание проводят в течение 12 ч при КТ), с использованием 4-[(4aR,10bR)-9-этокси-8-метокси-2,2-диоксидо 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (330 мг; соединение С 4),1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (365 мг; гидрохлорид соединения В 39), HBTU (322 мг), ДИПЭА (0,65 мл) и ДХМ (20 мл). Неочищенный продукт очищают с помощью колоночной флэш-хроматографии [силикагель, элюент: ДХМ/МеОН 19/1 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O7S2]: рассчитано 849,2847, найдено 849,2838. 20. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-метил-1,3-тиазол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Раствор 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6 ил]бензойной кислоты (199 мг; соединение C10), TOTU (213 мг) и HOAT (102 мг) в ДИПЭА (259 мг) перемешивают в течение 50 мин при КТ. Затем добавляют 1-[(2-метил-1,3-тиазол-5-ил)метил]-6-фенил-3(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионтрифторацетат (276 мг; соединение В 44) и реакционную смесь перемешивают в течение еще 60 мин при КТ. Растворитель удаляют при пониженном давлении и к полученному остатку добавляют ДХМ (15 мл) и насыщенный водный раствор бикарбоната натрия (3 мл). Органическую фазу отделяют и водную фазу экстрагируют с помощью ДХМ (10 мл). Объединенные органические фазы вводят в фазовый разделитель, сушат над сульфатом магния, растворитель удаляют при пониженном давлении и получают неочищенное искомое соединение. Остаток сначала очищают с помощью флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100 (об./об.)]. После второй стадии очистки с помощью препаративной ТСХ [пластины для ТСХ 2020 см толщиной 0,5 мм, элюент:EtOAc/триэтиламин 97/3 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C44H44N5O5S3]: рассчитано 818,2499, найдено 818,2495. 21. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-1,2,3-триазол-4-ил)метил]-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(2-этил-2 Н-1,2,3-триазол-4-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионтрифторацетата (300 мг; соединение В 45), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (217 мг; соединениеC10), EDCI (104 мг) и гидрата НОВТ (74 мг) в ДХМ (10 мл) добавляют ДИПЭА (0,24 мл). Через 14 ч при КТ добавляют воду и водный раствор гидросульфата калия (10% мас./мас.) и смесь экстрагируют с помощью ДХМ. Объединенные органические слои сушат (сульфат натрия) и концентрируют при пониженном давлении. Остаток очищают с помощью двукратной колоночной флэш-хроматографии [силикагель,элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)] и препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C44H46N7O5S2]: рассчитано 816,2996, найдено 816,2997. 22. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-тиадиазол-5-ил)метил]-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(3-этил-1,2,4-тиадиазол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионтрифторацетат (250 мг; соединение В 46), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (175 мг; соединениеC10), EDCI (84 мг) и гидрата НОВТ (60 мг) в ДХМ (15 мл) добавляют ДИПЭА (0,23 мл). Через 14 ч при КТ добавляют дополнительное количество EDCI (84 мг) и гидрата НОВТ (60 мг) и реакционную смесь перемешивают в течение еще 3 дней при КТ. Добавляют водный раствор гидросульфата калия (10% мас./мас.) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [силикагель,элюирование в градиентном режиме: ДХМ/МеОН от 17/3 до 1/1 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O5S3]: рассчитано 833,2608, найдено 833,2607. 23. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохино- 21023212C10), EDCI (174 мг) и гидрата НОВТ (123 мг) в ДХМ (12 мл) добавляют ДИПЭА (0,24 мл). Через 1,5 ч при КТ добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро 1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (100 мг; соединение C10) и реакционную смесь перемешивают в течение еще 5 дней при КТ. Добавляют водный раствор гидросульфата калия (10% мас./мас.) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [силикагель,элюент: ДХМ/МеОН 95/5 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H46N7O5S2]: рассчитано 816,2996, найдено 816,2993. 24. 3-[1-(4-[(2R,4aR,10bR)-9-Этокси-8-метокси-2-оксидо-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион или 3-[1-(4-[(2S,4aR,10bR)-9-этокси-8-метокси-2-оксидо 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2 этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К раствору диастереоизомера кислоты 1 (которым является 4-[(2R,4aR,10bR)-9-этокси-8-метокси-2 оксидо-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойная кислота или 4[(2S,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4 а,10b-тетрагидро-1H-тиопирано [4,3-с]изохинолин-6 ил]бензойная кислота; 249 мг; соединение С 2) и HBTU (240 мг) в ДХМ (30 мл) добавляют ДИПЭА (0,31 мл) и раствор перемешивают в течение 24 ч при КТ. К этому раствору добавляют 1-[(2-этил-2 Н-тетразол 5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион (260 мг; соединение В 39) и реакционную смесь перемешивают в течение еще 12 ч при КТ. Растворитель удаляют при пониженном давлении и полученный остаток растворяют в ДХМ (5 мл) и очищают с помощью колоночной флэш-хроматографии [силикагель, элюент: ДХМ/триэтиламин 19/1 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O6S2]: рассчитано 833,2898, найдено 833,2923 или 833,2930. 25. 3-[1-(4-[(2R,4aR,10bR)-9-Этокси-8-метокси-2-оксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион или 3-[1-(4-[(2S,4aR,10bR)-9-этокси-8-метокси-2-оксидо 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2 этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. По методике, аналогичной описанной в примере 14, диастереоизомер кислоты 2 (которым является 4-[(2R,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6 ил]бензойная кислота или 4-[(2S,4aR,10bR)-9-этокси-8-метокси-2-оксидо-3,4,4a, 10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]бензойная кислота, 249 мг; соединение С 3) вводят в реакцию с HBTU(240 мг),1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионом (260 мг; соединение В 39) и ДИПЭА (0,31 мл) в ДХМ (30 мл). После очистки с помощью колоночной флэш-хроматографии [силикагель, элюент: ДХМ/триэтиламин 19/1 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O6S2]: рассчитано 833,2898, найдено 833,2923 или 833,2930. 26. 3-[1-(3-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. По методике, аналогичной описанной в примере 14, 3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10bтетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойную кислоту (120 мг; соединение С 8) вводят в реакцию с HBTU (120 мг), 1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2 с 1]пиримидин-2,4(1 Н,3H)дионом (132 мг; соединение В 39) и ДИПЭА (0,16 мл) в ДХМ (10 мл). После очистки с помощью колоночной флэш-хроматографии (силикагель, элюент: EtOAc) получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O5S2]: рассчитано 817,2949, найдено 817,2968. 27. 3-[1-(3-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 1, с использованием 3[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение С 8), 1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-фенил-3-пиперидин-4 илтиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорида (190 мг; соединение В 32), HBTU (167 мг), ДИПЭА (0,28 мл) и ДХМ (3 мл). Неочищенный продукт очищают с помощью колоночной флэшхроматографии (модифицированный аминогруппами силикагель, элюирование в градиентном режиме:EtOAc/метанол от 98/2 до 95/5 (об./об. и затем с помощью препаративной ТСХ [силикагель, элюент:EtOAc/МеОН/триэтиламин 92,5/5/2,5 (об./об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C44H45N6O6S2]: рассчитано 817,2837, найдено 817,2831. 28. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[2-(метоксиметил)-2 Н-тетразол-5-ил]метил-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Смесь 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4a,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6 ил]бензойной кислоты (251 мг; соединение C10), TOTU (270 мг), НОАТ (129 мг), ДИПЭА (327 мг) в ДХМ (8 мл) перемешивают в течение 1 ч при КТ. К этой смеси добавляют 1-[2-(метоксиметил)-2 Нтетразол-5-ил]метил-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионтрифторацетат (359 мг; соединение В 25) и реакционную смесь перемешивают в течение еще 3 ч при КТ. Добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3 с]изохинолин-6-ил]бензойной кислоты (125 мг; соединение C10), TOTU (207 мг) и НОАТ (86 мг) для завершения реакции. После перемешивания в течение 1 ч при КТ реакцию останавливают путем добавления ДХМ (10 мл) и насыщенного водного раствора бикарбоната натрия (10 мл). Органическую фазу отделяют и водную фазу экстрагируют с помощью ДХМ (5 мл). Объединенные органические фазы вводят в фазовый разделитель и растворитель удаляют в вакууме. Полученный остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100 (об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O6S2]: рассчитано 833,2898, найдено 833,2897. 29. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[1-(метоксиметил)-1 Н-тетразол-5-ил]метил-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Искомое соединение получают аналогично тому, как описано в примере 28, с использованием 1[1-(метоксиметил)-1 Н-тетразол-5-ил]метил-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионтрифторацетата (соединение В 48) (235 мг), 4-[(4aR, 10bR)-9-этокси-8-метокси-3,4,4 а,10bтетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (165 мг; соединение C10), TOTU(177 мг), НОАТ (85 мг) и ДИПЭА (214 мг) в ДХМ (8 мл). После перемешивания в течение 4,5 ч при КТ добавляют дополнительное количество 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (82,5 мг; соединение C10), TOTU (177 мг) и НОАТ(85 мг). Очистка с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100 (об./об.)] дает искомое соединение в виде твердого вещества. МСВР [C43H45N8O6S2]: рассчитано 833,2898, найдено 833,2897. 30. 6-(1,3-Бензодиоксол-5-ил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(1,3-Бензодиоксол-5-ил)-1-[(2-этил-2 Н-тетразол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (94 мг; соединение В 77) вводят в реакцию с 4-[(4aR, 10bR)-9-этокси 8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (72 мг; соединение C10) и HBTU (151 мг) в ДХМ/ДМФ (15 мл/1 мл) в присутствии ДИПЭА (188 мг) по методике,описанной в примере 2, и после очистки с помощью двукратной колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 65/30/5, до 30/60/10, до 0/90/10 (об./об./об.)] получают искомое соединение. МСВР [C44H45N8O7S2]: рассчитано 861,2847, найдено 861,2844. 31. 6-(1,3-Бензодиоксол-5-ил)-3-[1-(3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(1,3-Бензодиоксол-5-ил)-1-[(2-этил-2 Н-тетразол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (94 мг; соединение В 77) вводят в реакцию с 3-[(4aR, 10bR)-9-этокси 8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (72 мг; соединение С 8) и HBTU (151 мг) в ДХМ/ДМФ (14 мл/1 мл) в присутствии ДИПЭА (188 мг) по методике,описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H45N8O7S2]: рассчитано 861,2847, найдено 861,2848. 32. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(4-фтор-2-метокси- 23023212 фенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(4-фтор-2-метоксифенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (191 мг; соединение В 78) вводят в реакцию с 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (145 мг; соединение C10) и HBTU (304 мг) в ДХМ/ДМФ (14 мл/1 мл) в присутствии ДИПЭА (377 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 65/30/5, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H46FN8O6S2]: рассчитано 865,2960, найдено 865,2956. 33. 3-[1-(3-[(4aR, 10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(4-фтор-2-метоксифенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(4-фтор-2-метоксифенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (191 мг; соединение В 78) вводят в реакцию с 3-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (145 мг; соединение С 8) и HBTU (304 мг) в ДХМ/ДМФ (14 мл/1 мл) в присутствии ДИПЭА (377 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H46FN8O6S2]: рассчитано 865,2960, найдено 865,2961. 34. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(5-фтор-2-метоксифенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(5-фтор-2-метоксифенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (190 мг; соединение В 79) вводят в реакцию с 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (145 мг; соединение C10) и HBTU (304 мг) в ДХМ/ДМФ (15 мл/2 мл) в присутствии ДИПЭА (377 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и дважды с помощью препаративной ТСХEtOAc/метанол/триэтиламин 91/5/4 (об./об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C44H46FN8O6S2]: рассчитано 865,2960, найдено 865,2954. 35. 3-[1-(3-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(5-фтор-2-метоксифенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(5-фтор-2-метоксифенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (190 мг; соединение В 79) вводят в реакцию с 3-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (145 мг; соединение С 8) и HBTU (304 мг) в ДХМ/ДМФ (15 мл/2 мл) в присутствии ДИПЭА (377 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H46FN8O6S2]: рассчитано 865,2960, найдено 865,2963. 36. 6-(2,5-Диметоксифенил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(2,5-Диметоксифенил)-1-[(2-этил-2 Н-тетразол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (137 мг; соединение В 80) вводят в реакцию с 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (145 мг; соединение C10) и HBTU (102 мг) в ДХМ (10 мл) в присутствии ДИПЭА (264 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H49N8O7S2]: рассчитано 877,3160, найдено 877,3158. 37. 6-(2,5-Диметоксифенил)-3-[1-(3-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)ме- 24023212 тил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(2,5-Диметоксифенил)-1-[(2-этил-2 Н-тетразол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (137 мг; соединение В 80) вводят в реакцию с 3-[(4aR,10bR)-9-этокси 8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (102 мг; соединение С 8) и HBTU (213 мг) в ДХМ (10 мл) в присутствии ДИПЭА (264 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H49N8O7S2]: рассчитано 877,3160, найдено 877,3158. 38. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(2-фторфенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(2-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (154 мг; соединение В 81) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (124 мг; соединение C10) и HBTU (261 мг) в ДХМ/ДМФ (15 мл/1 мл) в присутствии ДИПЭА (324 мг) по методике,описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C43H44FN8O5S2]: рассчитано 835,2855, найдено 835,2869. 39. 1-(3,5-Дифтор-4-метоксибензил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро 1H-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-6-(4-фтор-2-метоксифенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(2-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (154 мг; соединение В 81) вводят в реакцию с 3-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (124 мг; соединение С 8) и HBTU (261 мг) в ДХМ/ДМФ (15 мл/1 мл) в присутствии ДИПЭА (324 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C43H44FN8O5S2]: рассчитано 835,2855, найдено 835,2854. 40. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(4-фторфенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(4-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1H,3H)дионгидрохлорид (108 мг; соединение В 82) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (88 мг; соединение C10) и HBTU (183 мг) в ДХМ/ДМФ (18 мл/1 мл) в присутствии ДИПЭА (227 мг) по методике,описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 60/40 до 40/60 (об./об.)] и с помощью препаративной ТСХ [пластины для ТСХ 2020 см толщиной 0,5 мм, элюирование в градиентном режиме: EtOAc/метанол/триэтиламин 91/5/4 (об./об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C43H44FN8O5S2]: рассчитано 835,2855, найдено 835,2851. 41. 3-[1-(3-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-(4-фторфенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(2-Этил-2 Н-тетразол-5-ил)метил]-6-(4-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (108 мг; соединение В 82) вводят в реакцию с 3-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (88 мг; соединение С 8) и HBTU (183 мг) в ДХМ/ДМФ (10 мл/1 мл) в присутствии ДИПЭА (227 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 50/40/10, до 30/60/10, до 0/90/10 (об./об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C43H44FN8O5S2]: рассчитано 835,2855, найдено 835,285. 42. 6-(2,3-Дифторфенил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(2,3-Дифторфенил)-1-[(2-этил-2 Н-тетразол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пирими- 25023212 дин-2,4(1 Н,3H)дионгидрохлорид (40 мг; соединение В 83) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (31 мг; соединение C10) и HBTU (33 мг) в ДХМ/ДМФ (15 мл/1 мл) в присутствии ДИПЭА (41 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc/ДХМ от 100/0/0 до 65/30/5, до 30/60/10, до 0/90/10 (об./об./об.)] и с помощью препаративной ТСХ пластины для ТСХ 20x20 см толщиной 0,5 мм, элюирование в градиентном режиме: EtOAc/метанол/триэтиламин 91/5/4(об./об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C43H43F2N8O5S2]: рассчитано 853,2760, найдено 853,2770. 43. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-(4-фтор-2-метоксифенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(3-Этил-1,2,4-оксадиазол-5-ил)метил]-6-(4-фтор-2-метоксифенил)-3-(пиперидин-4-ил)тиено[3,2d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (250 мг; соединение В 85) вводят в реакцию с 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (205 мг; соединение C10) и HBTU (215 мг) в ДХМ (7 мл) в присутствии ДИПЭА (0,36 мл) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H46FN6O7S2]: рассчитано 865,2848, найдено 865,2849. 44. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-6-(4-фтор-2-метоксифенил)-1-[3-(метоксиметил)-1,2,4 оксадиазол-5-ил]метилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(4-Фтор-2-метоксифенил)-1-[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]метил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (415 мг; соединение В 84) вводят в реакцию с 4[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (383 мг; соединение C10) и HBTU (322 мг) в ДХМ (10 мл) в присутствии ДИПЭА (498 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0/до 0/100 (об./об.)] и с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H46FN6O8S2]: рассчитано 881,2797, найдено 881,2804. 45. 3-[1-(3-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-6-(4-фтор-2-метоксифенил)-1-[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]метилтиено[3,2-с 1]пиримидин-2,4(1 Н,3H)дион. 6-(4-Фтор-2-метоксифенил)-1-[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]метил-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (415 мг; соединение В 84) вводят в реакцию с 3[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (408 мг; соединение С 8) и HBTU (322 мг) в ДХМ (10 мл) в присутствии ДИПЭА (498 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: циклогексан/EtOAc от 100/0 до 0/100 (об./об.)] и с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C45H46FN6O8S2]: рассчитано 881,2797, найдено 881,2799. 46. 6-(1,3-Бензодиоксол-5-ил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Нтиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К раствору 6-(1,3-бензодиоксол-5-ил)-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-3-(пиперидин-4 ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорида (232 мг; соединение В 86) и 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (191 мг; соединение C10) в ДМФ (10 мл) добавляют HOBt (74 мг) и EDCI (92 мг) и реакционную смесь перемешивают при КТ в течение 48 ч. Один дополнительный эквивалент EDCI (92 мг) добавляют для завершения реакции. Реакционную смесь экстрагируют трижды смесью ДХМ/H2O/насыщенный раствор хлорида натрия (150/100/35 мл). Органическую фазу отделяют и сушат над Na2SO4. После фильтрования и выпаривания всех летучих веществ полученный остаток очищают с помощью колоночной флэшхроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: ДХМ/этанол от 100/0/до 95/5 (об./об.)] и с помощью препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C45H45N6O8S2]: рассчитано 861,2735, найдено 861,2754. 47. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-(4-фторфенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(3-Этил-1,2,4-оксадиазол-5-ил)метил]-6-(4-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (310 мг; соединение В 87) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (216 мг; соединение C10) и HOBt (83 мг) и EDCI (104 мг) в ДМФ (10 мл) по методике, описанной в примере 46, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель,элюирование в градиентном режиме: ДХМ/этанол от 100/0/до 90/10 (об./об.)] и с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H44FN6O6S2]: рассчитано 835,2742, найдено 835,2754. 48. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-6-(2-фторфенил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(3-Этил-1,2,4-оксадиазол-5-ил)метил]-6-(2-фторфенил)-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (272 мг; соединение В 88) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (237 мг; соединение C10) и HBTU (249 мг) в ДХМ (7 мл) в присутствии ДИПЭА (0,42 мл) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: ДХМ/МеОН от 1/0 до 1/1 (об./об.)] и препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H44FN6O6S2]: рассчитано 835,2742, найдено 835,2747. 49. 6-(3,4-Дифторфенил)-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]тиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 6-(3,4-Дифторфенил)-1-[(3-этил-1,2,4-оксадиазол-5-ил)метил]-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (228 мг; соединение В 89) вводят в реакцию с 4-[(4aR,10bR)-9-этокси 8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (191 мг; соединение C10) и HOBt (74 мг) и EDCI (92 мг) в ДМФ (10 мл) по методике, описанной в примере 46, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: ДХМ/этанол от 100/0/до 95/5 (об./об.)] и с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C44H43F2N6O6S2]: рассчитано 853,2648, найдено 853,2651. 50. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[3-(3-метоксипропил)-1,2,4-оксадиазол-5-ил]метил-6 фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[3-(3-Метоксипропил)-1,2,4-оксадиазол-5-ил]метил-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)-дионгидрохлорид (210 мг; соединение В 90) вводят в реакцию с 4-[(4aR,10bR)-9 этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (159 мг; соединение C10) и HBTU (167 мг) в ДХМ (3,5 мл) в присутствии ДИПЭА (207 мг) по методике, описанной в примере 2, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент: EtOAc] получают искомое соединение в виде твердого вещества. МСВР [C46H49N6O7S2]: рассчитано 861,3099, найдено 861,3089. 51. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-6-фенил-1-[3-(пропоксиметил)-1,2,4-оксадиазол-5-ил]метилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. Раствор 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6 ил]бензойной кислоты (159 мг; соединение C10), TOTU (131 мг), HOAt (54 мг) и ДИПЭА (0,21 мл) в ДМФ (4 мл) перемешивают в течение 0,5 ч при КТ. Затем добавляют 6-фенил-3-(пиперидин-4-ил)-1-[3(пропоксиметил)-1,2,4-оксадиазол-5-ил]метилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дионтрифторацетат(238 мг; соединение В 91) и реакционную смесь перемешивают в течение 1 ч при КТ. Добавляют насыщенный водный раствор бикарбоната натрия (2 мл) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюирование в градиентном режиме: EtOAc/MeOH от 100/0 до 97/3 (об./об.)], затем с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C46H49N6O7S2]: рассчитано 861,3099, найдено 861,3098. 52. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-дометил-1H-1,2,4-триазол-3-ил)метил]-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(1-метил-1 Н-1,2,4-триазол-3-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (249 мг, соединение В 92), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4a,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (210 мг; соединение C10) и HATU (267 мг) в ДХМ (7,0 мл) добавляют ДИПЭА (0,28 мл). Реакционную смесь перемешивают при КТ в течение 14 ч. Добавляют водный раствор бисульфата калия (10% мас./мас., 10 мл) и смесь экстраги- 27023212 руют с помощью ДХМ. После фильтрования с помощью фазового разделителя органический слой концентрируют при пониженном давлении, остаток очищают с помощью препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C43H44N7O5S2]: рассчитано 802,284, найдено 802,2847. 53. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(1-метил-1 Н-имидазол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(1-Метил-1H-имидазол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (251 мг; соединение В 93) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (218 мг; соединение C10) и HATU (271 мг) в ДХМ (7 мл) в присутствии ДИПЭА (0,29 мл) по методике, описанной в примере 52, и получают искомое соединение после очистки с помощью препаративной ВЭЖХ в виде твердого вещества. МСВР [C44H45N6O5S2]: рассчитано 801,2890, найдено 801,2876. 54. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(4-метил-1,3-оксазол-5-ил)метил]-6-фенилтиено[3,2d]пиримидин-2,4(1 Н,3H)дион. 1-[(4-Метил-1,3-оксазол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (253 мг; соединение В 94) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (207 мг; соединениеC10) и HATU (257 мг) в ДХМ (7 мл) в присутствии ДИПЭА (0,27 мл) по методике, описанной в примере 52, и после очистки с помощью препаративной ВЭЖХ получают искомое соединение в виде твердого вещества. МСВР [C46H47N4O5S3]: рассчитано 831,2703, найдено 831,269. 55. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-этилтиофен-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(5-этилтиофен-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорида (198 мг, соединение В 95) 4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10bтетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (159 мг; соединение C10) и HBTU(167 мг) в ДХМ (4,0 мл) добавляют ДИПЭА (0,28 мл). Реакционную смесь перемешивают при КТ в течение 1 ч. Добавляют насыщенный водный раствор бикарбоната натрия (2 мл) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают дважды с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент: EtOAC] и получают искомое соединение в виде твердого вещества. МСВР [C46H47N4O5S3]: рассчитано 831,2703, найдено 831,269. 56. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(3-метилтиофен-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(3-Метилтиофен-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорид (191 мг; соединение В 96) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (159 мг; соединениеC10) и HBTU (167 мг) в ДХМ (4 мл) в присутствии ДИПЭА (0,28 мл) по методике, описанной в примере 55, и после очистки с помощью колоночной флэш-хроматографии получают искомое соединение в виде твердого вещества. МСВР [C45H45N4O5S3]: рассчитано 817,2547, найдено 817,2545. 57. 3-[1-(4-[(4aR,10bR)-9-Этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано [4,3-с] изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-1-[(5-этил-2 Н-тетразол-2-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. К суспензии 1-[(5-этил-2 Н-тетразол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (170 мг, соединение В 97), 4-[(4aR,10bR)-9-этокси-8-метокси 3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (143 мг; соединение C10) и COMU (167 мг) в ДХМ (3,0 мл) добавляют ДИПЭА (0,25 мл). Реакционную смесь перемешивают при КТ в течение 1 ч. Добавляют насыщенный водный раствор бикарбоната натрия (2 мл) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент: EtOAc] и с помощью препаративной ВЭЖХ и получают искомое соединение в виде твердого вещества. МСВР [C43H45N8O5S2]: рассчитано 817,2949, найдено 817,2941. 58. 1-[(5-трет-Бутил-1,3,4-оксадиазол-2-ил)метил]-3-[1-(4-[(4aR,10bR)-9-этокси-8-метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]фенилкарбонил)пиперидин-4-ил]-6-фенилтиено[3,2-d]пиримидин-2,4(1 Н,3H)дион. 1-[(5-трет-Бутил-1,3,4-оксадиазол-2-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин 2,4(1 Н,3H)дионгидрохлорид (1,63 г; соединение В 98) вводят в реакцию с 4-[(4aR,10bR)-9-этокси-8 метокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислотой (1,39 г; соединение C10) и HBTU (1,48 г) в ДХМ (40 мл) в присутствии ДИПЭА (2,38 мл) по методике, описанной в примере 55, и после очистки с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель, элюент: EtOAc/циклогексан 90/10 (об./об.)] получают искомое соединение в виде твердого вещества. МСВР [C46H49N6O6S2]: рассчитано 845,3150, найдено 845,3138. 59. 3-[1-(4-[(4aR,10bR)-8,9-Диметокси-3,4,4 а,10b-тетрагидро-1 Н-тиопирано[4,3-с]изохинолин-6 ил]фенилкарбонил)пиперидин-4-ил]-1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенилтиено[3,2-d]пиримидин-2,4(1H,3H)дион. К суспензии 1-[(2-этил-2 Н-тетразол-5-ил)метил]-6-фенил-3-(пиперидин-4-ил)тиено[3,2-d]пиримидин-2,4(1 Н,3H)дионгидрохлорида (190 мг, соединение В 39), 4-[(4aR,10bR)-8,9-диметокси-3,4,4 а,10bтетрагидро-1H-тиопирано[4,3-с]изохинолин-6-ил]бензойной кислоты (220 мг; соединение С 16) и HBTU(167 мг) в ДХМ (4,0 мл) добавляют ДИПЭА (0,28 мл). Реакционную смесь перемешивают при КТ в течение 1 ч. Добавляют насыщенный водный раствор бикарбоната натрия (2 мл) и смесь фильтруют с помощью фазового разделителя. Органический слой концентрируют при пониженном давлении и остаток очищают с помощью колоночной флэш-хроматографии [модифицированный аминогруппами силикагель,элюент: EtOAc] и затем с помощью препаративной ВЭЖХ и препаративной ТСХ [пластины для ТСХ 2020 см толщиной 0,5 мм, элюент: EtOAc/МеОН/триэтиламин 91/5/4 (об./об./об.)] и получают искомое соединение в виде твердого вещества. МСВР [C42H43N8O5S2]: рассчитано 803,2792, найдено 803,2785. Промежуточные и исходные соединения. Общая методика 1 (GP1). Алкилирование соединения В 50. К раствору трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилата (соединение В 50) в ДМФ добавляют карбонат калия и одно из соединений D1-D21,D25, D27-D29, D31 и D32. Смесь перемешивают при 100 С (полное превращение исходных веществ обычно происходит за 2-4 ч). Если не указано иное, то обработку реакционной смеси и выделение искомых соединений можно провести по методике обработки 1 (WU1) или по методике обработки 2 (WU2). Методика обработки 1 (WU1). Реакционную смесь выливают в охлажденную льдом воду. Полученный осадок отфильтровывают,промывают водой, сушат при пониженном давлении и получают соединение формулы 4, которое можно использовать без дополнительной очистки на следующей стадии синтеза, если не указано иное. Методика обработки 2 (WU2). Все летучие вещества удаляют в вакууме и остаток очищают с помощью колоночной флэшхроматографии на силикагеле и получают соединение формулы 4. В 1. трет-Бутил-4-1-[(5-этил-1,3-оксазол-2-ил)метил]-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2d]пиримидин-3(2 Н)-илпиперидин-1-карбоксилат. К раствору трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-ил)пиперидин-1-карбоксилата (800 мг; соединение В 50) в ДМФ (15 мл) добавляют карбонат калия (520 мг) и 2(хлорметил)-5-этил-1,3-оксазол (270 мг; соединение D1). После перемешивания в течение 1 ч при 100 С к реакционной смеси дополнительно добавляют 2-(хлорметил)-5-этил-1,3-оксазол (200 мг; соединениеD1) и карбонат калия (400 мг). Смесь перемешивают в течение еще 30 мин при 100 С. Затем все летучие вещества удаляют в вакууме и остаток очищают с помощью флэш-хроматографии [силикагель, элюент: циклогексан/EtOAc 3/2 (об./об.)] и получают искомое соединение в виде твердого вещества. МС: рассчитано C28H32N4O5S (536,65), найдено [МН+]=536,73; [МН+-Boc]=437,20.B2. трет-Бутил-4-1-[(5-метил-1,2,4-оксадиазол-3-ил)метил]-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-илпиперидин-1-карбоксилат. В соответствии с GP1 трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)ил)пиперидин-1-карбоксилат (200 мг; соединение В 50) вводят в реакцию с 3-(хлорметил)-5-метил-1,2,4 оксадиазолом (62 мг; соединение D2) в присутствии карбоната калия (65 мг) в ДМФ (5 мл). С помощьюWU1 получают искомое соединение в виде твердого вещества. МС: рассчитано C26H29N5O5S (523,61), найдено [МН+]=523,62; [МН+-Boc]=424,07.B3. трет-Бутил-4-1-[(3-этилизоксазол-5-ил)метил]-2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)-илпиперидин-1-карбоксилат. В соответствии с GP1 трет-бутил-4-(2,4-диоксо-6-фенил-1,4-дигидротиено[3,2-d]пиримидин-3(2 Н)ил)пиперидин-1-карбоксилат (750 мг; соединение В 50) вводят в реакцию с 5-(хлорметил)-3 этилизоксазолом (255 мг; соединение D3) в присутствии карбоната калия (242 мг) в ДМФ (10 мл). С помощью WU1 получают искомое соединение в виде твердого вещества. МС: рассчитано C28H32N4O5S (536,65), найдено [МН+]=536,78
МПК / Метки
МПК: A61P 11/08, A61K 31/519, C07D 519/00, A61P 11/06, A61P 11/00
Метки: производные, 3,4,4a,10b-тетрагидро-1h-тиопирано[4,3-c]изохинолина
Код ссылки
<a href="https://eas.patents.su/30-23212-proizvodnye-344a10b-tetragidro-1h-tiopirano43-cizohinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3,4,4a,10b-тетрагидро-1h-тиопирано[4,3-c]изохинолина</a>
Предыдущий патент: Гибридная система охлаждения
Следующий патент: Противотуберкулезное лекарственное средство на основе 4-тиоуреидоиминометилпиридиния перхлората, способ его получения и способ лечения
Случайный патент: Способ получения дисульфида углерода












