Трициклические производные изохинолина для лечения ожирения
Номер патента: 16592
Опубликовано: 30.06.2012
Авторы: Ангбрант Йохан, Рингом Руне, Линдквист Бенгт, Брандт Петер
Формула / Реферат
1. Соединение формулы (I)
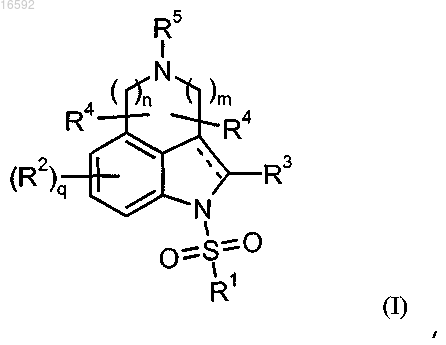
или его фармацевтически приемлемые соли,
гдеобозначает двойную связь;
m и n, каждый независимо, выбраны из 1 и 2 при условии, что m + n ≤ 3;
R1 представляет собой группу, выбранную из фенила, пиридила, фуранила, тиенила, тиадиазолила, оксазолила, бензофуранила, бензотиенила, бензотиазолила, имидазолила, имидазотиазолила и дигидрофуранила, каждый из которых необязательно независимо замещен по одному или нескольким положениям заместителем, выбранным из следующих:
(a) галоген,
(b) C1-4-алкил,
(c) C1-4-алкокси,
(d) -CF3 и
(e) -CN;
q выбран из 0, 1 и 2;
каждый R2 независимо выбран из следующих:
(a) галоген,
(b) C1-4-алкил,
(c) фтор-С1-2-алкил,
(d) C1-2-алкокси,
(e) фтор-С1-2-алкокси,
(f) гидрокси,
(g) -OSO2CF3 и
(h) ацетил;
R3 представляет собой водород,
каждый R4 независимо выбран из следующих:
(a) водород,
(b) метил,
(c) оксо и
(d) гидрокси,
при условии, что когда R4 представляет собой оксо, то m или n равно 2, и R4 не присоединен к углероду в альфа-положении относительно атома азота в кольце;
R5 представляет собой группу, выбранную из следующих:
(a) водород,
(b) C1-3-алкил,
(c) -N(R6)2-С2-4-алкил,
(d) имидазолилметил и
(e) пирролидинилметил;
каждый R6 представляет собой группу, независимо выбранную из следующих:
(a) водород и
(b) метил.
2. Соединение по п.1, в котором
R1 является группой, выбранной из:
(a) фенила или
(b) бензотиенила,
где фенил не замещен или независимо замещен по одному или двум положениям заместителем, выбранным из следующих:
(a) трифторметил,
(b) хлор,
(c) метил и
(d) метокси;
R3 и R4 обозначают водород;
R5 является группой, выбранной из следующих:
(a) водород,
(b) метил,
(c) этил,
(d) диметиламино,
(e) имидазолилметил и
(f) пирролидинилметил.
3. Соединение по п.1, которое выбрано из следующих:
1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
4-метил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
4-(1Н-имидазол-2-илметил)-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
N,N-диметил-2-[1-(фенилсульфонил)-1,5-дигидропирроло[4,3,2-de]изохинолин-4(3Н)-ил]этанамин,
4-этил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
1-(фенилсульфонил)-4-(пирролидин-2-илметил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
1-(фенилсульфонил)-4-(пирролидин-3-илметил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
1-[(2-хлорфенил)сульфонил]-4-этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
4-этил-1-{[2-(трифторметил)фенил]сульфонил}-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,
1-(1-бензотиен-2-илсульфонил)-4-этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин и
4-этил-1-[(2-метокси-5-метилфенил)сульфонил]-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин.
4. Соединение по п.1, которое выбрано из следующих:
4-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[3,4,5-cd]индол,
4-этил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[3,4,5-cd]индол,
1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
5-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[3,4,5-cd]индол,
7-метокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-7-ол,
6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-7-илтрифторметансульфонат,
7-метокси-5,6-диметил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
7-этокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-хлор-6-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3-хлор-2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3-хлор-4-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,6-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,5-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3,5-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,4-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3,4-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,5-диметил-3-тиенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,5-диметилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3,5-диметилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-{[4-фтор-3-(трифторметил)фенил]сульфонил}-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(1-бензофуран-2-илсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(1,3-бензотиазол-6-илсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(1-метил-1Н-имидазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-{[2-(трифторметил)фенил]сульфонил}-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(1-бензотиен-2-илсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(5-фтор-2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-{[3-(трифторметил)фенил]сульфонил}-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-{[4-(трифторметил)фенил]сульфонил}-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
4-метил-2-(3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,
1-[(4,5-дихлор-2-тиенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-трет-бутилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,5-диметил-3-фурил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2,4-диметил-1,3-тиазол-5-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(3,5-диметилизоксазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(5-хлор-2-тиенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
4-(3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,
3-(3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,
1-[(4-метоксифенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-метокси-6-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-метокси-5-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-метокси-4-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(1-бензотиен-3-илсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-изопропилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(4-пропилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(5-этил-2-метоксифенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(5-бром-2,3-дигидро-1-бензофуран-7-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-[(2-этокси-5-изопропилфенил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
1-(фенилсульфонил)-1,4,5,6-тетрагидро-3Н-азепино[5,4,3-cd]индол-3-он,
1-[(1,2-диметил-1Н-имидазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол,
2-фтор-5-(3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,
1-(пиридин-3-илсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол и
1-(фенилсульфонил)-3,4,5,6-тетрагидро-1Н-азепино[5,4,3-cd]индол-3-ол.
5. Применение соединения по любому из пп.1-4 для изготовления лекарственного средства для лечения или профилактики заболевания, связанного с 5-НТ6-рецептором.
6. Применение соединения по любому из пп.1-4 для изготовления лекарственного средства для снижения массы тела или уменьшения прибавления массы тела.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 в качестве активного компонента в комбинации с фармацевтически приемлемым разбавителем или носителем.
Текст
ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА ДЛЯ ЛЕЧЕНИЯ ОЖИРЕНИЯ Настоящее изобретение относится к новым соединениям формулы (I) в которой значения R1, R2, R3, R4 и R5 приведены в настоящем описании, фармацевтическим композициям, включающим указанные соединения, способам их получения, а также к применению соединений для приготовления лекарственного средства против заболеваний, связанных с 5-НТ 6 рецептором. 016592 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, к фармацевтическим композициям, включающим указанные соединения, а также к применению указанных соединений для получения лекарственного средства от заболеваний, связанных с 5-НТ 6-рецептором. Уровень техники Ожирение представляет собой заболевание, характеризуемое увеличением содержания жира в организме, что приводит к избыточной массе тела, превышающей общепринятые нормы. Ожирение является основным заболеванием, связанным с нарушением питания в западных странах, и представляет главную угрозу здоровью во всех промышленно развитых странах. Данное заболевание приводит к повышенной смертности из-за повышения частоты возникновения таких заболеваний, как сердечнососудистые заболевания, нарушения пищеварения, заболевания органов дыхания, рак и диабет II типа. Поиск соединений, которые снижают массу тела, продолжался в течение многих десятилетий. Одно из направлений исследования было связано с активацией серотонинергических систем, либо путем прямой активации подтипов серотониновых рецепторов, либо путем ингибирования обратного захвата серотонина. Однако точный требуемый профиль подтипа рецептора пока не известен. Серотонин (5-гидрокситриптамин или 5-НТ), ключевой нейромедиатор периферической и центральной нервной системы, модулирует широкий диапазон физиологических и патологических функций,включая страх, регуляцию сна, агрессию, питание и депрессию. Были идентифицированы и клонированы многочисленные подтипы серотонинового рецептора. Один из них, 5-НТ 6-рецептор, был клонирован несколькими группами в 1993 (Ruat, M. et al. (1993) Biochem. Biophys. Res. Commun. 193: 268-276; Sebben,M. et al. (1994) NeuroReport 5: 2553-2557). Указанный рецептор положительно соединен с аденилатциклазой и обладает аффинностью к таким антидепрессантам, как клозапин. Сообщалось об эффекте антагониста 5-НТ 6 и 5-НТ 6-антисмысловых олигонуклеотидов, вызывающих уменьшение потребления пищи у крыс (Bentley, J.C. et al. (1999) Br. J. Pharmacol. Suppl. 126, P66; Bentley, J.C. et al. (1997) J. Psychopharmacol. Suppl. A64, 255; Woolley M.L. et al. (2001) Neuropharmacology 41: 210-219). Соединения с повышенной аффинностью и селективностью к 5-НТ 6-рецептору были идентифицированы, например, в WO 00/34242, а также в работе Isaac, M. et al. (2000) 6-Bicyclopiperazinyl-1arylsulphonylindoles and 6-Bicyclopiperidinyl-1-arylsulphonylindoles derivatives as novel, potent and selective 5-HT6 receptor antagonists. BioorganicMedicinal Chemistry Letters 10: 1719-1721 (2000), BioorganicMedicinal Chemistry Letters 13: 3355-3359 (2003), Expert Opinion Therapeutic Patents 12(4) 513-527 (2002). Описание изобретения Неожиданно обнаружили, что соединения согласно настоящему изобретению обладают аффинностью к 5-НТ 6-рецептору в наномолярном диапазоне. Соединения согласно настоящему изобретению, а также их фармацевтически приемлемые соли обладают антагонистической, агонистической и частичной агонистической активностью в отношении 5-НТ 6-рецептора, предпочтительно антагонистической активностью, и могут найти применение в лечении или профилактике заболеваний, связанных с 5-НТ 6 рецептором. Одним из объектов настоящего изобретения является соединение формулы (I)R1 представляет собой группу, выбранную из фенила, пиридила, фуранила, тиенила, тиадиазолила,оксазолила, бензофуранила, бензотиенила, бензотиазолила, имидазолила, имидазотиазолила и дигидрофуранила, каждый из которых необязательно независимо замещен по одному или нескольким положениям заместителем, выбранным из следующих:q выбран из 0, 1 и 2; каждый R2 независимо выбран из следующих:R3 представляет собой водород,каждый R4 независимо выбран из следующих:(d) гидрокси,при условии, что когда R4 представляет собой оксо, то m или n равно 2, и R4 не присоединен к углероду в альфа-положении относительно атома азота в кольце;(e) пирролидинилметил; каждый R6 представляет собой группу, независимо выбранную из следующих:(b) метил,а также его фармацевтически приемлемые соли. Предпочтительные соединения формулы (I) включают такие соединения, в которых R1 является группой, выбранной из:(b) бензотиенила,где фенил не замещен или независимо замещен по одному или двум положениям заместителем, выбранным из следующих:(f) пирролидинилметил. Особо предпочтительными соединениями формулы (I) являются следующие: 1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,4-метил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,4-(1 Н-имидазол-2-илметил)-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,N,N-диметил-2-[1-(фенилсульфонил)-1,5-дигидропирроло[4,3,2-de]изохинолин-4(3 Н)-ил]этанамин,4-этил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,1-(фенилсульфонил)-4-(пирролидин-2-илметил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,1-(фенилсульфонил)-4-(пирролидин-3-илметил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,1-[(2-хлорфенил)сульфонил]-4-этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,4-этил-1-[2-(трифторметил)фенил]сульфонил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин,1-(1-бензотиен-2-илсульфонил)-4-этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин и 4-этил-1-[(2-метокси-5-метилфенил)сульфонил]-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин. Еще одну предпочтительную группу соединений формулы (I) составляют 4-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индол,4-этил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индол,1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,5-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индол,7-метокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,-2 016592 6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7-ол,6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7-илтрифторметансульфонат,7-метокси-5,6-диметил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,7-этокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-хлор-6-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3-хлор-2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3-хлор-4-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1H-азепино[5,4,3-cd]индол,1-[(3-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-хлорфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-фторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,6-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,5-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3,5-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,4-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3,4-дифторфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,5-диметил-3-тиенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,5-диметилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3,5-диметилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[4-фтор-3-(трифторметил)фенил]сульфонил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(1-бензофуран-2-илсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(1,3-бензотиазол-6-илсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(1-метил-1 Н-имидазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[2-(трифторметил)фенил]сульфонил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(1-бензотиен-2-илсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(5-фтор-2-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[3-(трифторметил)фенил]сульфонил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[4-(трифторметил)фенил]сульфонил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,4-метил-2-(3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,1-[(4,5-дихлор-2-тиенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-трет-бутилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,5-диметил-3-фурил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2,4-диметил-1,3-тиазол-5-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(3,5-диметилизоксазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(5-хлор-2-тиенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,4-(3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,3-(3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,1-[(4-метоксифенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-метокси-6-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-метокси-5-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-метокси-4-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(1-бензотиен-3-илсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-изопропилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(4-пропилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(5-этил-2-метоксифенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(5-бром-2,3-дигидро-1-бензофуран-7-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3cd]индол,1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-[(2-этокси-5-изопропилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,1-(фенилсульфонил)-1,4,5,6-тетрагидро-3 Н-азепино[5,4,3-cd]индол-3-он,1-[(1,2-диметил-1 Н-имидазол-4-ил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол,2-фтор-5-(3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-1-илсульфонил)бензонитрил,1-(пиридин-3-илсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол и 1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-3-ол. Соединения формулы (I) могут быть агонистами, частичными агонистами или антагонистами 5 НТ 6-рецептора. Предпочтительно соединения действуют как частичные агонисты или антагонисты 5-3 016592 НТ 6-рецептора. Более предпочтительно соединения действуют как антагонисты 5-НТ 6-рецептора. Термин "частичный агонист 5-НТ 6-рецептора" означает соединение, которое связывается с 5-НТ 6 рецептором человека и не полностью препятствует образованию 5-НТ-индуцированного цАМФ в анализе собственной активности, описанном в настоящем документе (см. "Биологические тесты"). Другим объектом настоящего изобретения является применение соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики заболевания, связанного с 5-НТ 6 рецептором. Предпочтительно лекарственное средство предназначено для снижения массы тела или уменьшения прибавления массы тела. Примеры связанных с 5-HT6-рецептором заболеваний включают ожирение, диабет II типа, расстройства центральной нервной системы, такие как тревожное состояние, депрессия, приступы паники,нарушения памяти, когнитивные расстройства, эпилепсия, расстройства сна, мигрень, анорексия, булимия, психогенное переедание, обсессивно-компульсивное расстройство, психозы, болезнь Альцгеймера,болезнь Паркинсона, хорея Хантингтона, шизофрения, синдром дефицита внимания с гиперактивностью(СДВГ), синдром отмены при наркотической зависимости (например, кокаиновой, амфетаминовой зависимости и/или никотиновой зависимости), нейродегенеративные заболевания, характеризуемые нарушением роста нейронов, а также боль. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение формулы (I) в качестве активного компонента, в комбинации с фармацевтически приемлемым разбавителем или носителем. Способ получения соединения согласно формуле (I) изобретения включает следующие стадии: и необязательно, после этого, образование фармацевтически приемлемой соли соединения формулы(I). Еще один способ получения соединения согласно формуле (I) изобретения включает следующие стадии: и необязательно, после этого, образование фармацевтически приемлемой соли соединения формулы(I). Способы выполнения вышеуказанных реакций известны специалистам в данной области техники и/или приведены в настоящем описании. Химические вещества, используемые в путях синтеза, описанных в настоящем документе, могут включать, например, растворители, реагенты, катализаторы, а также защитные группы и реагенты для удаления защитной группы. Способы, описанные выше, могут также дополнительно включать стадии,либо до, либо после стадий, конкретно описанных в настоящем документе, с целью введения или удаления подходящих защитных групп, чтобы, в конечном счете, обеспечить синтез соединений. Кроме того, различные стадии синтеза могут быть выполнены в альтернативной последовательности или другом порядке с получением требуемых соединений. Превращения синтетической химии, кото-4 016592 рые могут применяться в синтезе соответствующих соединений, известны из уровня техники и включают, например, реакции, описанные в R. Larock, Comprehensive Organic Transformations, VCH Publishers(1994); а также L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующие выпуски перечисленных изданий. В химических структурах на схемах, приведенных в настоящем описании, показаны переменные,которые настоящим определены соответствующими химическими группами (молекулами, атомами и т.д.) в соответствующем положении в формулах соединения в настоящем описании, и либо обозначены переменной с одним и тем же названием (например, любой группой R (R1, R2 и т.д., либо нет. Пригодность химической группы в структуре соединения для применения в синтезе соединения с другой структурой находится в компетенции среднего специалиста в данной области техники. Соединения формулы (I) могут содержать один или несколько хиральных атомов углерода и, таким образом, они могут быть получены в форме оптических изомеров, например в виде чистого энантиомера или в виде смеси энантиомеров (рацемата) либо в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров с целью получения чистых энантиомеров известно из уровня техники и может, например, быть достигнуто посредством фракционной кристаллизации солей с оптически активными (хиральными) кислотами или с помощью хроматографического разделения на хиральных колонках. Все возможные изомерные формы (чистые энантиомеры, диастереомеры, таутомеры, рацемические смеси и неравные смеси двух энантиомеров) описанных соединений включены в объем настоящего изобретения. Когда соединения, описанные в настоящем документе, содержат олефиновые двойные связи с геометрической асимметрией, они включают и транс-, и цис- (E и Z) геометрические изомеры. Соединения формулы (I) могут применяться как таковые или, при необходимости, в виде соответствующих фармакологически приемлемых солей (солей присоединения кислот или оснований). Вышеуказанные фармакологически приемлемые соли присоединения включают терапевтически активные нетоксичные соли присоединения кислот и оснований, которые соединения могут образовывать. Соединения, которые обладают основными свойствами, могут быть превращены в соответствующие фармацевтически приемлемые соли присоединения кислот путем взаимодействия основной формы с соответствующей кислотой. Примеры кислот включают неорганические кислоты, такие как хлористо-водородную,бромисто-водородную, иодоводородную, серную кислоту, фосфорную кислоту; и органические кислоты,такие как муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гидроксиуксусную кислоту,молочную кислоту, пировиноградную кислоту, гликолевую кислоту, малеиновую кислоту, малоновую кислоту, щавелевую кислоту, бензолсульфоновую кислоту, толуолсульфоновую кислоту, метансульфоновую кислоту, трифторуксусную кислоту, фумаровую кислоту, янтарную кислоту, яблочную кислоту,винную кислоту, лимонную кислоту, салициловую кислоту, п-аминосалициловую кислоту, памовую кислоту, бензойную кислоту, аскорбиновую кислоту и т.п. Примеры солей присоединения основания включают соли натрия, калия, кальция, а также соли с фармацевтически приемлемыми аминами, такими как, например, аммиак, алкиламин, бензатин, и аминокислотами, такими как, например, аргинин и лизин. Термин "соль присоединения", используемый в настоящем описании, также включает сольваты, которые соединения и их соли способны образовывать, такие как, например, гидраты, алкоголяты и т.п. В целях клинического применения соединения изобретения вводят в фармацевтические композиции для перорального, ректального, парентерального или другого способа введения. Фармацевтические композиции обычно приготавливают, смешивая активное вещество или его фармацевтически приемлемую соль с обычными фармацевтическими наполнителями. Примерами наполнителей является вода, желатин, гуммиарабик, лактоза, микрокристаллическая целлюлоза, крахмал, натриевая соль гликолята крахмала, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п. Такие композиции могут также содержать другие фармакологически активные агенты, а также обычные добавки,такие как стабилизаторы, смачивающие агенты, эмульгаторы, ароматизаторы, буферы и т.п. Обычно количество активных соединений составляет 0,1-95 мас.% препарата, предпочтительно 0,2-20 мас.% в препаратах для парентерального применения и более предпочтительно 1-50 мас.% в препаратах для перорального введения. Композиции могут быть также приготовлены с помощью известных способов, таких как гранулирование, прессование, микрокапсулирование, нанесение покрытия распылением и т.д. Композиции могут быть приготовлены обычными способами в виде таких лекарственных форм, как таблетки, капсулы, гранулы, порошки, сиропы, суспензии, суппозитории или препараты для инъекций. Жидкие композиции могут быть приготовлены путем растворения или суспендирования активного вещества в воде или других подходящих средах. Таблетки и гранулы могут быть покрыты оболочкой обычным способом. Уровень дозы и частота введения конкретного соединения изменяются в зависимости от различных факторов, включающих активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия указанного соединения, возраст пациента, массу тела, общее состояние здоровья, пол, питание, способ и время введения, скорость выделения, комбинацию лекарственных средств, тяжесть подвергаемого лечению заболевания, а также в зависимости от пациента, подвергаемого терапии. Ежедневная доза может, например, варьировать приблизительно от 0,001 до приблизи-5 016592 тельно 100 мг на 1 кг массы тела, и может быть введена однократно или многократно дозами по, например, приблизительно от 0,01 до приблизительно 25 мг каждая. Обычно такую дозировку применяют перорально, но также может быть выбрано парентеральное введение. Определения Следующие определения должны применяться по всему тексту описания и прилагаемой формулы. Если не указано или оговорено иное, термин "C1-6-алкил" обозначает линейную или разветвленную алкильную группу, включающую от 1 до 6 атомов углерода. Примеры указанного C1-6-алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, т-бутил, а также линейный или разветвленный пентил и гексил. В качестве элементов ряда "C1-6-алкила" рассматриваются все его подгруппы, например С 1-5-алкил, C1-4-алкил, C1-3-алкил, C1-2-алкил, С 2-6-алкил, С 2-5-алкил, С 2-4-алкил, С 2-3-алкил,С 3-6-алкил, С 4-5-алкил и т.д. Если не указано иное, "фтор-С 1-6-алкил" обозначает C1-6-алкильную группу, замещенную одним или несколькими атомами фтора. Примеры указанного фтор-С 1-6-алкила включают 2-фторэтил, фторметил,трифторметил и 2,2,2-трифторэтил. Если не указано или оговорено иное, термин "C1-6-алкокси" обозначает линейную или разветвленную алкоксигруппу, включающую от 1 до 6 атомов углерода. Примеры указанного С 1-6-алкокси включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, т-бутокси, а также линейный или разветвленный пентокси и гексокси. В качестве элементов ряда "C1-6-алкокси" рассматриваются все его подгруппы, такие как C1-5-алкокси, С 1-4-алкокси, C1-3-алкокси, С 1-2-алкокси, С 2-6-алкокси,С 2-5-алкокси, С 2-4-алкокси, С 2-3-алкокси, С 3-6-алкокси, С 4-5-алкокси и т.д. Если не указано или оговорено иное, "фтор-С 1-6-алкокси" обозначает С 1-6-алкоксигруппу, замещенную одним или несколькими атомами фтора. Примеры указанного фтор-С 1-6-алкокси включают трифторметокси, дифторметокси, монофторметокси, 2-фторэтокси, 2,2,2-трифторэтокси и 1,1,2,2 тетрафторэтокси. Если не указано или оговорено иное, термин "галоген" должен означать фтор, хлор, бром или иод. Если не указано или оговорено иное, термин "оксо" обозначает =O (то есть атом кислорода, присоединенный к атому углерода через двойную связь)."Необязательный" или "необязательно" означает, что впоследствии описанное событие или обстоятельство могут, но не должны непременно произойти, и что описание включает случаи, когда событие или обстоятельство происходят, и случаи, в которых они не происходят."Фармацевтически приемлемый" означает пригодный в приготовлении фармацевтической композиции, то есть в целом безопасный, нетоксичный и не являющийся ни биологически, ни как-либо иначе неблагоприятным, и включает применимость в ветеринарии, а также в фармацевтике. Используемое в настоящем описании "лечение" включает профилактику указанного заболевания или патологического состояния либо уменьшение тяжести или устранение заболевания после его развития."Эффективное количество" относится к количеству соединения, которое оказывает терапевтическое действие в отношении субъекта, подвергаемого лечению. Терапевтическое действие может быть объективным (то есть измеряемым с помощью некоторого анализа или маркера) или субъективным (то есть субъект демонстрирует проявления действия или чувствует эффект). Использовали следующие сокращения:CV - означает коэффициент вариаций,ДХМ - означает дихлорметан,ДМСО - означает диметилсульфоксид,ЭДТА - означает этилендиаминтетрауксусную кислоту,ЭГТА - означает этилен-бис-(оксиэтиленнитрил)тетрауксусную кислоту,HEPES - означает 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту,ВЭЖХ - означает высокоэффективную жидкостную хроматографию,LSD - означает диэтиламид лизергиновой кислоты,MeCN - означает ацетонитрил,SPA - означает сцинтилляционный анализ сближения,ТФУ - означает трифторуксусную кислоту,ТГФ - означает тетрагидрофуран,УФ - означает ультрафиолет,МеОН - означает метанол,MW - означает микроволновую печь,Boc - означает т-бутоксикарбонил,LAH - означает алюмогидрид лития,ТЭА - означает триэтиламин. Все возможные изомерные формы (чистые энантиомеры, диастереомеры, таутомеры, рацемические-6 016592 смеси и неравные смеси двух энантиомеров) описанных соединений включены в объем настоящего изобретения. Такие соединения могут также существовать в виде цис- или транс-, Е- или Z-изомерных форм по двойной связи. Рассматриваются все изомерные формы. Соединения формулы (I) могут применяться как таковые или, при необходимости, в виде соответствующих фармакологически приемлемых солей (солей присоединения кислот или оснований). Вышеуказанные фармакологически приемлемые соли присоединения включают терапевтически активные нетоксичные соли присоединения кислот и оснований, которые соединения могут образовывать. Соединения, которые обладают основными свойствами, могут быть превращены в соответствующие фармацевтически приемлемые соли присоединения кислот путем взаимодействия основной формы с соответствующей кислотой. Примеры кислот включают неорганические кислоты, такие как хлористо-водородную,бромисто-водородную, иодисто-водородную, серную кислоту, фосфорную кислоту; и органические кислоты, такие как муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гидроксиуксусную кислоту, молочную кислоту, пировиноградную кислоту, гликолевую кислоту, малеиновую кислоту, малоновую кислоту, щавелевую кислоту, бензолсульфоновую кислоту, толуолсульфоновую кислоту, метансульфоновую кислоту, трифторуксусную кислоту, фумаровую кислоту, янтарную кислоту, яблочную кислоту, винную кислоту, лимонную кислоту, салициловую кислоту, п-аминосалициловую кислоту, памовую кислоту, бензойную кислоту, аскорбиновую кислоту и т.п. Примеры солей присоединения основания включают соли натрия, калия, кальция, а также соли с фармацевтически приемлемыми аминами,такими как, например, аммиак, алкиламин, бензатин, и аминокислотами, такими как, например аргинин и лизин. Термин соль присоединения, используемый в настоящем описании, также включает сольваты,которые соединения и их соли способны образовывать, такие как, например, гидраты, алкоголяты и т.п. В целях клинического применения соединения изобретения вводят в фармацевтические композиции для перорального, ректального, парентерального или другого способа введения. Фармацевтические композиции обычно приготавливают, смешивая активное вещество или его фармацевтически приемлемую соль с обычными фармацевтическими наполнителями. Примерами наполнителей является вода, желатин, гуммиарабик, лактоза, микрокристаллическая целлюлоза, крахмал, натриевая соль гликолята крахмала, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п. Такие композиции могут также содержать другие фармакологически активные агенты, а также обычные добавки,такие как стабилизаторы, смачивающие агенты, эмульгаторы, ароматизаторы, буферы и т.п. Обычно количество активных соединений составляет 0,1-95 мас.% препарата, предпочтительно 0,2-20 мас.% в препаратах для парентерального применения и более предпочтительно 1-50 мас.% в препаратах для перорального введения. Композиции могут быть также приготовлены с помощью известных способов, таких как гранулирование, прессование, микрокапсулирование, нанесение покрытия распылением и т.д. Композиции могут быть приготовлены обычными способами в виде таких лекарственных форм, как таблетки, капсулы, гранулы, порошки, сиропы, суспензии, суппозитории или препараты для инъекций. Жидкие композиции могут быть приготовлены путем растворения или суспендирования активного вещества в воде или других подходящих средах. Таблетки и гранулы могут быть покрыты оболочкой обычным способом. Соединения формулы (I) выше могут быть получены с помощью стандартных методов или по аналогии с ними. Способы могут быть выполнены с целью получения соединения изобретения в форме свободного основания или в форме соли присоединения кислоты. Фармацевтически приемлемая соль присоединения кислоты может быть получена путем растворения свободного основания в подходящем органическом растворителе и обработки раствора кислотой в соответствии со стандартными методами получения солей присоединения кислоты из основных соединений. Примеры кислот, образующих соли присоединения,приведены выше. Соединения формулы (I) могут содержать один или несколько хиральных атомов углерода и, таким образом, они могут быть получены в форме оптических изомеров, например в виде чистого энантиомера или в виде смеси энантиомеров (рацемата) либо в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров с целью получения чистых энантиомеров известно из уровня техники и может, например, быть достигнуто посредством фракционной кристаллизации солей с оптически активными (хиральными) кислотами, или с помощью хроматографического разделения на хиральных колонках. Химические вещества, используемые в путях синтеза, описанных в настоящем документе, могут включать, например, растворители, реагенты, катализаторы, а также защитные группы и реагенты для удаления защитной группы. Способы, описанные выше, могут также дополнительно включать стадии либо до, либо после стадий, конкретно описанных в настоящем документе, с целью введения или удаления подходящих защитных групп, чтобы, в конечном счете, обеспечить синтез соединений. Кроме того, различные стадии синтеза могут быть выполнены в альтернативной последовательности или другом порядке с получением требуемых соединений. Превращения синтетической химии, которые могут применяться в синтезе соответствующих соединений, известны из уровня техники и включают, например, реакции, описанные в R. Larock, Comprehensive Organic Transformations, VCH Publishers(1994); а также L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующие выпуски перечисленных изданий. Необходимые исходные вещества для получения соединения формулы (I) либо являются известными, либо могут быть получены по аналогии с получением известных соединений. Уровень дозы и частота введения конкретного соединения изменяются в зависимости от различных факторов, включающих активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия указанного соединения, возраст пациента, массу тела, общее состояние здоровья, пол, питание,способ и время введения, скорость выделения, комбинацию лекарственных средств, тяжесть подвергаемого лечению заболевания, а также в зависимости от пациента, подвергаемого терапии. Ежедневная доза может, например, варьировать приблизительно от 0,001 до приблизительно 100 мг на 1 кг массы тела, и может быть введена однократно или многократно дозами по, например, приблизительно от 0,01 мг до приблизительно 25 мг каждая. Обычно такую дозировку применяют перорально, но также может быть выбрано парентеральное введение. Далее изобретение описано посредством следующих неограничивающих примеров. Конкретные примеры, приведенные ниже, следует рассматривать лишь в качестве иллюстративных и не ограничивающих настоящее описание каким-либо образом. Без дополнительного уточнения предполагается, что специалист в данной области, на основании описания, приведенного в настоящем документе, сумеет применить настоящее изобретение в наиболее полном объеме. Все публикации, процитированные в настоящем документе, настоящим включены путем отсылки в полном объеме. Методы Спектры 1 Н ядерного магнитного резонанса (ЯМР) и 13 С ЯМР регистрировали на спектрометреVarian Inova 400 при 400 и 100,5 МГц соответственно, или, альтернативно, на спектрометре Bruker NMR 500 при 500,1 и 125,1 МГц соответственно, или, альтернативно, на спектрометре JEOL eclipse 270 при 270,0 и 67,5 МГц соответственно. Все спектры регистрировали, используя в качестве внутреннего стандарта остатки растворителя. Препаративную ВЭЖХ/МС выполняли с помощью системы Waters/Micromass Platform ZQ, а препаративную ВЭЖХ/УФ выполняли на приборе Gilson в соответствии с описанием экспериментов, приведенных в примерах. Аналитическую ВЭЖХ-МС выполняли с использованием жидкостного хроматографа/масс-селективного детектора (МСД) Agilent 1100 с получением псевдомолекулярного [М + Н]+ иона целевых молекул. Препаративную флеш-хроматографию выполняли на силикагеле Merck 60 (230-400 меш). Соединения называли с использованием ACD Name 6.0 (или более поздней версии). Реакции под воздействием микроволн выполняли с помощью Personal Chemistry Smith Creator, используя Smith Process Vials 0,5-2 или 2-5 мл, снабженные алюминиевыми крышками с мембраной. Промежуточное соединение 1. 3,4-Дигидропирроло[4,3,2-de]изохинолин-5(1 Н)-он. Данное промежуточное соединение получали согласно методике, описанной в литературе (М.Е. Промежуточное соединение 2. 1-(Фенилсульфонил)-3,4-дигидропирроло[4,3,2-de]изохинолин 5(1 Н)-он. Бензолсульфонилхлорид (140 мг, 0,79 ммоль), NBu4HSO4 (24 мг, 0,07 ммоль) и 4 М водн. NaOH (2 мл), в таком же порядке, добавляли к 3,4-дигидропирроло[4,3,2-de]изохинолин-5(1 Н)-ону, промежуточному соединению 1 (124 мг, 0,7 2 ммоль) в ДХМ (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем экстрагировали водой и ДХМ (2). Продукт, как оказалось, был только частично растворим в ДХМ, и некоторое количество твердого вещества отфильтровывали из водного слоя и добавляли к слою ДХМ, который концентрировали и сушили, получив 227 мг соединения,соответствующего заголовку, в виде светло-коричневого твердого вещества. МС m/z 313 [М + Н]+. Пример 1. 1-(Фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин ВН 3:SMe2 (205 мкл, 2,2 ммоль) добавляли по каплям через 5 мин при кипячении с обратным холодильником к смеси 1-(фенилсульфонил)-3,4-дигидропирроло, [4,3,2-de]изохинолин-5(1 Н)-она, промежуточного соединения 2 (225 мг, 0,72 ммоль), в безводном ТГФ (10 мл) с непрерывным кипячением с обратным холодильником в течение 2,5 ч. Затем добавляли (2,5 ч кипячения с обратным холодильником между добавлениями) две дополнительные части BH3:SMe2 (100 мкл 2). Кипячение с обратным холо-8 016592 дильником продолжали в течение 5 ч после последнего добавления, после чего оставляли на ночь при комнатной температуре. Реакцию останавливали добавлением HCl в МеОН (1,25 М, 4 мл), а затем кипятили в течение 1 ч. Растворитель выпаривали, а неочищенную смесь экстрагировали ДХМ (2) и нас.Na2CO3 (водн.). Органические слои объединяли, высушивали и концентрировали. Очистку выполняли с помощью колоночной флеш-хроматографии (3-5% МеОН в ДХМ), получив 66 мг соединения, соответствующего заголовку, в виде бежевого твердого вещества. МС m/z 299 [М + Н] +. Пример 2. 4-Метил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолина трифторацетат Формальдегид (37% раствор в воде, 55 мкл, 0,76 ммоль) и NaBH3CN (104 мг, 1,65 ммоль) добавляли к 1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолину, пример 1 (23 мг, 0,07 ммоль), в безводном MeCN (3 мл). Реакционную смесь облучали микроволнами в течение 10 мин при 130 С,фильтровали и концентрировали. Неочищенный продукт очищали с помощью препаративной ВЭЖХ(YMCcolumn 15030 мм, 20-50% MeCN, 0,1% ТФУ). Это привело к получению 17 мг соединения, соответствующего заголовку, в виде коричневой клейкой массы. МС m/z 313 [М + Н]+. Пример 3. 4-(1 Н-Имидазол-2-илметил)-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2de]изохинолин-бис-(трифторацетат) Эксперимент после примера 2 продолжали, используя 1H-имидазол-2-карбальдегид (16 мг, 0,18 ммоль), АсОН (46 мкл, 0,81 ммоль), Na(OAc)3BH3 (51 мг, 0,24 ммоль) и 1-(фенилсульфонил)-1,3,4,5 тетрагидропирроло[4,3,2-de]изохинолин, пример 1 (27 мг, 0,08 ммоль), в безводном ТГФ (4 мл). Препаративная ВЭЖХ (YMCcolumn 15030 мм, 32-62% MeCN, 0,1% ТФУ). В результате получили 1,7 мг соединения, соответствующего заголовку, в виде коричневой клейкой массы. МС m/z 379 [М + Н]+. Промежуточное соединение 3. 1,3,4,5-Тетрагидропирроло[4,3,2-de]изохинолин.LAH (1 M в ТГФ, 8,7 мл, 8,7 ммоль) добавляли к 3,4-дигидропирроло[4,3,2-de]изохинолин-5(1 Н)ону, промежуточное соединение 1 (300 мг, 1,72 ммоль), в безводном ТГФ (только частично растворился) под атмосферой N2. Смесь перемешивали с кипячением в течение 2 ч и через 1 ч наблюдали изменение цвета от светло-коричневого до зеленого. Воду (330 мкл), NaOH (водн., 15%, 330 мкл) и воду (1,0 мл), в таком же порядке, добавляли и полученный осадок отфильтровывали. Элюат сушили (Na2SO4), фильтровали и концентрировали с получением неочищенного продукта. Вещество использовали без дальнейшей очистки. Пример 4. N,N-Диметил-2-[1-(фенилсульфонил)-1,5-дигидропирроло[4,3,2-de]изохинолин-4(3 Н)ил]этанамин-бис-(трифторацетат) 1,3,4,5-Тетрагидропирроло[4,3,2-de]изохинолин, промежуточное соединение 3 (45 мг, 0,28 ммоль),NEt3 (236 мкл, 1,71 ммоль) и гидрохлорид N,N-диметилглицилхлорида (90 мг, 0,57 ммоль) растворяли в безводном ДХМ (10 мл) при обработке ультразвуком и перемешивали при комнатной температуре в течение 1,5 ч. Смесь экстрагировали ДХМ (2) и водн. нас. Na2CO3/NaCl. Органические слои объединяли,сушили (Na2SO4), фильтровали и концентрировали с получением 69 мг неочищенного вещества. 2/5 полученного вещества (28 мг, 0,12 ммоль) добавляли к безводному ТГФ (3 мл, без растворения), а затем добавляли LAH (1 M в ТГФ, 0,575 мл, 0,575 ммоль). Смесь перемешивали при кипячении с обратным холодильником в течение 60 мин (прозрачный раствор). Затем добавляли воду (22 мкл), 15%-ный водн.NaOH (22 мкл) и воду (66 мкл), после чего полученный осадок удаляли с помощью фильтрования. Элюат-9 016592 сушили (Na2SO4), фильтровали и концентрировали с получением 26 мг неочищенного вещества. Половину полученного вещества (13 мг, 0,057 ммоль) растворяли в безводном ТГФ (2 мл) и добавляли NaH(60%-ная дисперсия в минеральном масле, 11 мг, 0,28 ммоль). Смесь перемешивали при температуре окружающей среды в течение 50 мин, затем добавляли фенилсульфонилхлорид (8 мл, 0,06 ммоль) в безводном ТГФ (0,5 мл) с непрерывным перемешиванием в течение 1 ч. Затем реакционную смесь охлаждали в ледяной бане и вливали 2 капли воды, подкисленной 1 каплей конц. HCl, после чего концентрировали. Неочищенный продукт очищали с помощью препаративной ВЭЖХ (ACEcolumn 5021,1 мм, 16-46%MeCN, 0,1% ТФУ). В результате получили 15 мг соединения, соответствующего заглавию, в виде бесцветного твердого вещества. МС m/z 370 [M + Н]+. Пример 5. 4-Этил-1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолина трифторацетат Ацетальдегид (11 мкл, 0,18 ммоль), АсОН (34 мкл, 0,60 ммоль) и Na(OAc)3BH3 (52 мг, 0,24 ммоль) добавляли к 1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолину, пример 1 (18 мг, 0,06 ммоль), в безводном ТГФ (3 мл). Реакционную смесь облучали микроволнами в течение 12 мин при 130 С, фильтровали и концентрировали. Неочищенный продукт очищали с помощью препаративной ВЭЖХ (ACEcolumn 5021,1 мм, 15-45% MeCN, 0,1% ТФУ). В результате получили 8 мг соединения,соответствующего заголовку, в виде бесцветной клейкой массы. МС m/z 127 [М + Н]+. Пример 6. 1-(Фенилсульфонил)-4-(пирролидин-2-илметил)-1,3,4,5-тетрагидропирроло[4,3,2de]изохинолин-бис-(трифторацетат)Na(OAc)3BH3 (26 мг, 0,12 ммоль) добавляли к 1-(фенилсульфонил)-1,3,4,5-тетрагидропирроло[4,3,2de]изохинолину, пример 1 (9 мг, 0,03 ммоль), в безводном ТГФ (3 мл). Реакционную смесь облучали микроволнами в течение 12 мин при 130 С, фильтровали и концентрировали. Осадок растворяли в МеОН/конц. HCl (4:1, 1,5 мл) и облучали микроволнами в течение 3 мин при 100 С, фильтровали и концентрировали. Неочищенный продукт очищали с помощью препаративной ВЭЖХ (АСЕ колонка 5021,1 мм, 11-41% MeCN, 0,1% ТФУ). В результате получили 11 мг соединения, соответствующего заголовку, в виде светло-желтой клейкой массы. МС m/z 382 [М + Н]+. Пример 7. 1-(Фенилсульфонил)-4-(пирролидин-3-илметил)-1,3,4,5-тетрагидропирроло[4,3,2de]изохинолина трифторацетат Эксперимент после примера 6 продолжали, используя трет-бутил 3-формилпирролидин-1 карбоксилат (18 мг, 0,09 ммоль). Препаративная ВЭЖХ (АСЕ колонка 5021,1 мм, 9-39% MeCN, 0,1% ТФУ). В результате получили 11 мг соединения, соответствующего заголовку, в виде бесцветной клейкой массы. МС m/z 382 [М + Н]+. Промежуточное соединение 4. 4-Этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин.LiAlH4 (0,440 г, 11,6 ммоль) добавляли по частям к раствору 3,4-дигидропирроло[4,3,2de]изохинолин-5(1 Н)-она, промежуточное соединение 1 (0,4 г, 2,32 ммоль), в безводном ТГФ (20 мл). Смесь кипятили с обратным холодильником в течение 3 ч, охлаждали, разбавляли водным ТГФ и фильтровали. Твердый фильтрационный осадок промывали ТГФ (2), а фильтрат выпаривали с получением светло-коричневого твердого вещества. Указанное коричневое твердое вещество растворяли в МеОН (20 мл), а затем добавляли ацетальдегид (0,334 г, 7,6 ммоль) и триацетоксиборгидрид натрия (0,482 г, 2,3- 10016592 ммоль). Смесь перемешивали в течение 1 ч, выпаривали до половины объема и разделяли между 1 н.Na2CO3 и дихлорметаном. Органическую фазу промывали солевым раствором, сушили (MgSO4) и выпаривали. Неочищенный продукт очищали с помощью флеш-хроматографии с использованием градиента 10% МеОН до 50% МеОН в дихлорметане с 1% NEt3. Выход: 142 мг. Серое твердое вещество. МС m/z 187 [М + Н]+. Общая методика сульфонилирования, используемая в примерах 8-11. 4-Этил-1,3,4,5-тетрагидропирроло[4,3,2-de]изохинолин, промежуточное соединение 4 (0,015 г, 0,081 ммоль), требуемый сульфонилхлорид (0,16 ммоль) и гидросульфат тетрабутиламмония (5 мг, 0,016 ммоль) растворяли в дихлорметане (1 мл), а затем добавляли NaOH (0,01 г, 0,24 ммоль) в воде (0,3 мл). Смесь перемешивали при комнатной температуре в течение ночи, после чего в каждый флакон добавляли воду (1 мл), а затем отбирали органическую фазу, выпаривали и очищали, как описано ниже. Пример 8. 1-[(2-Хлорфенил)сульфонил]-4-этил-1,3,4,5-тетрагидропирроло-[4,3,2-de]изохинолин Сульфонилхлорид: 2-хлорфенилсульфонилхлорид (34 мг, 0,16 ммоль). Очищенные с помощью обращено-фазовой препаративной ВЭЖХ с использованием XTerra Prep MS C18 5 мкм 1950 мм, поток 25 мл/мин, 50 мМ рН 10 NH3HCO3/ACN фракции собрали на основе УФ-сигнала (254 нм). Начальная точка препаративного градиента 37. Конечная точка препаративного градиента 67. Наиболее чистые фракции объединяли и выпаривали ацетонитрил. Выход: 8,6 мг. Светло-желтое твердое вещество. МС m/z 361 [M Сульфонилхлорид: 2-(трифторметил)бензолсульфонилхлорид (39 мг, 0,16 ммоль). Очищали с помощью обращено-фазовой препаративной ВЭЖХ с использованием XTerra Prep MS C18 5 мкм 1950 мм,поток 25 мл/мин, 50 мМ pH10 NH4HCO3/ACN, фракции собрали на основе УФ-сигнала (254 нм). Начальная точка препаративного градиента 39. Конечная точка препаративного градиента 69. Наиболее чистые фракции объединяли и выпаривали. Выход: 6,7 мг. Коричневое твердое вещество. МС m/z 395 [М + Н]+. Пример 10. 1-(1-Бензотиен-2-илсульфонил)-4-этил-1,3,4,5-тетрагидропирроло-[4,3,2-de]изохинолин Сульфонилхлорид: 1-бензотиофен-2-сульфонилхлорид (38 мг, 0,16 ммоль). Очищали с помощью обращено-фазовой препаративной ВЭЖХ с использованием XTerra Prep MS C18 5 мкм 1950 мм, поток 25 мл/мин, 50 мМ pH10 NH4HCO3/ACN, фракции собрали на основе УФ-сигнала (254 нм). Начальная точка препаративного градиента 44. Конечная точка препаративного градиента 74. Наиболее чистые фракции объединяли и выпаривали. Выход: 1,1 мг. Желтое твердое вещество. МС m/z 383 [М + Н]+. Пример 11. 4-Этил-1-[(2-метокси-5-метилфенил)сульфонил]-1,3,4,5-тетрагидропирроло[4,3,2de]изохинолин- 11016592 Сульфонилхлорид: 6-метокси-м-толуолсульфонилхлорид (0,035 г, 0,16 ммоль). Очищали с помощью обращено-фазовой препаративной ВЭЖХ с использованием XTerra Prep MS C18 5 мкм 1950 мм,поток 25 мл/мин, 50 мМ pH10 NH4HCO3/ACN, фракции собрали на основе УФ-сигнала (254 нм). Начальная точка препаративного градиента 36. Конечная точка препаративного градиента 66. Наиболее чистые фракции объединяли и выпаривали. Выход: 0,5 мг. Грязно-белое твердое вещество. МС m/z 371 [М + Н]+. Промежуточное соединение 5. 1-(Фенилсульфонил)-1 Н-индол-4-карбальдегид. 1 Н-Индол-4-карбальдегид (24,8 г, 0,17 моль) растворяли в безводном ДМФА (500 мл), охлаждали в ледяной бане и добавляли NaH (7,5 г (60%-ная суспензия в масле), 0,19 моль, 1,1 eq.). После перемешивания в течение нескольких минут холодную баню убирали и перемешивали rn смесь при комнатной температуре в течение 40 мин под атмосферой Ar. Нерастворимые комки NaH переводили в раствор посредством обработки ультразвуком в течение нескольких минут. Смесь охлаждали в ледяной бане и по каплям с интервалом 3 мин добавляли бензолсульфонилхлорид (23,9 мл, 0,188 моль, 1.1 eq.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, а затем медленно вливали в смесь воды (1 л) и EtOAc (200 мл). Водную фазу экстрагировали EtOAc (5100 мл), органическую фазу промывали солевым раствором (200 мл), сушили над Na2SO4 и выпаривали. Сухой остаток очищали с помощью флеш-колонки на силикагеле, используя петролейный эфир/EtOAc (1:1), получив продукт в виде бесцветного прозрачного твердого вещества. Выход: 45,5 г. МС m/z 286 [M + Н]+. Промежуточное соединение 6. 4-[(Е)-2-Нитровинил]-1-(фенилсульфонил)-1 Н-индол. 1-(Фенилсульфонил)-1 Н-индол-4-карбальдегид, промежуточное соединение 5 (45,4 г, 0,159 моль) растворяли в нитрометане (300 мл) и добавляли ацетат аммония (4,9 г, 0,064 моль, 0,4 экв.). Смесь кипятили с обратным холодильником в течение 4 ч и оставляли на ночь при комнатной температуре. Затем добавляли воду (150 мл) и отделяли органическую фазу. Водную фазу экстрагировали ДХМ (350 мл). Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Неочищенное вещество (чистота ВЭЖХ 85%) пропускали через колонку с силикагелем, используя в качестве элюента смесь ДХМ/EtOAc (8:1). Фракции, содержащие продукт, выпаривали до небольшого объема, пока не начиналась кристаллизация. Желтые кристаллы отфильтровывали, промывали смесью петролейного эфира/EtOAc (2:1) и сушили в вакууме. Выход: 33,1 г. МС m/z 329 [М + Н]+. Промежуточное соединение 7. 2-[1-(Фенилсульфонил)-1 Н-индол-4-ил]этанамин. 4-[(Е)-2-нитровинил]-1-(фенилсульфонил)-1 Н-индол, промежуточное соединение 6 (32,1 г, 97,8 ммоль), смешивали с безводным ТГФ (100 мл), перемешивали в течение 5 мин, а затем добавляли безводный МеОН (400 мл). Смесь охлаждали в ледяной бане и добавляли боргидрид натрия (14,8 г, 0,39 моль) маленькими порциями в течение 30 мин. Получение NiB2 катализатора: гексагидрат хлорида никеля(II) (46,5 г, 0,196 моль) растворяли в МеОН (200 мл), раствор охлаждали в ледяной бане и при интенсивном перемешивании в течение 30 мин маленькими порциями добавляли боргидрид натрия (22,3 г, 0,587 моль) (важно: реакция чрезвычайно экзотермическая, с мощным выделением газов). Черную суспензию перемешивали еще в течение 15 мин при комнатной температуре. Полученную суспензию катализатора добавляли к основной реакционной смеси при 0 С, после чего осторожно, маленькими порциями в течение 1 ч добавляли боргидрид натрия (38 г, 1,0 моль). Реакционную смесь перемешивали в течение еще 2 ч при комнатной температуре, фильтровали через слой силикагеля, пропитанного MeOH/NH3 (водн.). Слой силикагеля промывали МеОН/NH3 (водн.), а затем из фильтрата выпаривали в вакууме МеОН. К остатку добавляли воду (500 мл) и экстрагировали смесь диэтиловым эфиром. Органический слой промывали солевым раствором, сушили над Na2SO4, выпаривали,а остаток очищали на силикагеле, используя ДХМ/МеОН/NH3 (водн.) (40:8:0,5), получив требуемый амин в виде густой жидкости. Выход: 12,2 г. МС m/z 301 [М + Н]+. Пример 12. 1-(Фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индола гидрохлорид 2-[1-(Фенилсульфонил)-1 Н-индол-4-ил]этанамин, промежуточное соединение 7 (7,05 г, 23,5 ммоль),растворяли в муравьиной кислоте (70 мл) и добавляли раствор формальдегида (14 мл, в виде 37% раствора в воде, 187 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч,вливали в воду (700 мл) и экстрагировали ДХМ. ДХМ экстракт промывали 2%-ным раствором NaOH в воде (500 мл), солевым раствором, сушили над Na2SO4 и выпаривали. Остаток очищен на силикагеле,используя ДХМ/МеОН/NH3 (водн.) (50:5:0,5), получив требуемый амин в виде густой жидкости. Полученное вещество растворяли в EtOAc и по каплям добавляли насыщенный раствор HCl в диоксане,пока осаждение не было завершено. Раствор разбавляли диэтиловым эфиром, соль выделяли с помощью- 12016592 фильтрования, промывали диэтиловым эфиром и сушили. Сухую соль растворяли в смеси i-PrOH/MeOH при нагревании, МеОН удаляли на роторном испарителе и добавляли диэтиловый эфир, в результате чего медленно выпадал кристаллический грязно-белый осадок целевого продукта, который фильтровали,промывали эфиром и сушили в вакууме. Выход: 4,2 г. МС m/z 313 [М + Н]+. Пример 13. 4-Метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индола гидрохлорид 1-(Фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индола гидрохлорид, пример 12 (100 мг, 0,3 ммоль), растворяли в ТГФ (4 мл) перед добавлением триацетоксиборгидрида натрия (203 мг, 1,0 ммоль) и уксусной кислоты (191 мг, 3,2 ммоль). Затем добавляли водный формалин (37%, 1 мл) и нагревали реакционную смесь в MW при 70 С в течение 300 с. Реакционную смесь выпаривали и неочищенный продукт очищали с помощью препаративной ВЭЖХ с использованием системы В, 100 мМNH4HCO3/MeCN (36-66% MeCN). Продукт выделяли и превращали в гидрохлорид. 15,2 мг чистого продукта выделяли в виде желтого масла, выход 12%. МС m/z 327 [М + Н]+. Пример 14. 4-Этил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индола гидрохлорид 1-(Фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[3,4,5-cd]индола гидрохлорид, пример 12 (70 мг,0,2 ммоль), растворяли в ТГФ (4 мл) перед добавлением триацетоксиборгидрида натрия (142 мг, 0,7 ммоль) и уксусной кислоты (13 4 мг, 2,2 ммоль). Затем добавляли ацетальдегид (14,7 мг, 0,3 ммоль) и нагревали реакционную смесь в MW при 70 С в течение 600 с. Реакционную смесь выпаривали и очищали неочищенный продукт с помощью препаративной ВЭЖХ (33-63), используя колонку Xterra. Продукт выделяли и превращали в гидрохлорид. 12,9 мг чистого выделяли в виде прозрачного масла. МС m/z 341[М + Н]+. Промежуточное соединение 8. 2-Нитроэтилацетат. Данное соединение получали согласно методике М.Е. Flaugh, Т.A. Crowell, J.A. Clemens, В.D. Sawyer J. Med. Chem., 1979, 22, p. 63-68. Уксусный ангидрид (8,06 г, 79,0 ммоль) и NaOAc (1,45 г, 17,7 ммоль) смешивали и нагревали. Добавляли две капли пиридина. 2-нитроэтанол (6,45 г, 70,8 ммоль) осторожно добавляли к суспензии при 30-35 С в течение 30 мин. После этого смесь перемешивали в течение ночи при комнатной температуре. На следующее утро смесь содержала нерастворенный NaOAc и новый оранжевый осадок. Реакционную смесь разделяли между CHCl3 и водой, промывали 1 водой, 1 солевым раствором и сушили MgSO4. Затем растворитель выпаривали при пониженном давлении при 40 С. Оставшееся оранжевое масло подвергали совместному выпариванию сначала с хлороформом, а затем пять раз с толуолом и, наконец, с хлороформом, получив 6,90 г чистого соединения. Промежуточное соединение 9. Метил-3-(2-нитроэтил)-1 Н-индол-4-карбоксилат. Раствор метил-1 Н-индол-4-карбоксилата (7,34 г, 41,9 ммоль), 2-нитроэтилацетат (6,90 г, 51,9 ммоль) и 4-трет-бутилкатехина (0,026 г, 0,16 ммоль) в ксилоле (50 мл) кипятили с обратным холодильником в течение 6 ч. Растворитель выпаривали при пониженном давлении с получением в остатке темного маслянистого неочищенного продукта, который очищали с помощью хроматографии на короткой колонке с силикагелем, используя в качестве элюента смесь этилацетата и петролейного эфира. Продукт получали в виде желтоватого твердого вещества с выходом 79%. Тп: 103 С. МС m/z 249 [M + Н]+. Промежуточное соединение 10. 1,3,4,5-Тетрагидро-6 Н-азепино[5,4,3-cd]индол-6-он. Метил-3-(2-нитроэтил)-1 Н-индол-4-карбоксилат, промежуточное соединение 9 (7,38 г, 29,8 ммоль),растворяли в метаноле (200 мл) при нагревании и добавляли водный раствор 2 М HCl (460 мл). Цинковый порошок (46,2 г, 706 ммоль) добавляли порциями при интенсивном перемешивании. Полученную смесь кипятили с обратным холодильником в течение 2 ч. Горячую реакционную смесь фильтровали, а фильтрат обрабатывали водным раствором 2 М NaOH (560 мл) и снова фильтровали. Фильтрационный осадок промывали метанолом. Метанол удаляли при пониженном давлении, а водную смесь трижды экстрагировали этилацетатом. Органический раствор промывали водой и солевым раствором, сушили суль- 13016592 фатом магния, фильтровали и выпаривали досуха. В результате получали желтоватое кристаллическое вещество с выходом 4,62 г. После перекристаллизации из смеси дихлорметана и метанола получали продукт очень высокой чистоты. Тп.: 234 С. МС m/z 187 [М + Н]+. Промежуточное соединение 11. 1,3,4, 5-Тетрагидро-6 Н-азепино[5,4,3-cd]индол и 2,2 а,3,4,5,6 гексагидро-1 Н-азепино[5,4,3-cd]индол. Промежуточное соединение 10 (175 мг, 0,94 ммоль) добавляли к фосфорилхлориду (1 мл) при комнатной температуре. Раствор перемешивали в течение 15 мин, а затем удаляли избыток фосфорилхлорида при комнатной температуре под вакуумом. Полученное масло помещали в высокий вакуум на 20 мин,чтобы удалить остаточный фосфорилхлорид, а затем растворяли в глиме (4 мл). Раствор охлаждали во льду и при интенсивном перемешивании добавляли боргидрид натрия (114 мг, 3 ммоль). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 1 ч и охлаждали во льду, после чего по каплям добавляли 10% хлористо-водородную кислоту (2 мл). Глим выпаривали и добавляли воду. После экстрагирования эфиром к водному раствору добавляли гидроокись натрия (приблизительно до рН 10), после чего снова экстрагировали эфиром. Основные экстракты сушили над MgSO4 и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (SiO2;CHCl3:MeOH:NH3 95:4,5:0,5) и использовали непосредственно в следующей стадии. При указанном разделении возвращали 30% исходного вещества. Промежуточное соединение 12. трет-Бутил-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5 карбоксилат. Чистую смесь (1:1) 1,3,4,5-тетрагидро-6 Н-азепино[5,4,3-cd]индола и 2,2 а,3,4,5,6-гексагидро-1 Назепино[5,4,3-cd]индола, промежуточное соединение 11 (172 мг, 1 ммоль), растворяли в ДХМ (10 мл) и добавляли ди-трет-бутилдикарбонат (436 мг, 2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли, а остаток очищали с помощью хроматографии(SiO2, этилацетат:циклогексан 1:5). Ожидаемый продукт трет-бутил-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3cd]индол-5-карбоксилат выделяли из неочищенной смеси продуктов, при этом он был достаточно чистым для следующей стадии синтеза. Пример 15. 1-(Фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индолNaH (60% в минеральном масле, 66 мг, 0,4 ммоль) добавляли к раствору трет-бутил-1,3,4,6 тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилата, промежуточное соединение 12 (51 мг, 0,2 ммоль),в 800 мкл безводного ДМФА. Реакционную смесь встряхивали при комнатной температуре в течение 10 мин, а затем добавляли фенилсульфонилхлорид (66,2 мг, 0,4 ммоль, в 600 мкл безводного ДМФА). Реакционную смесь встряхивали при комнатной температуре в течение 10-20 мин. Реакцию останавливали добавлением 4 мл смеси метанола и уксусной кислоты (1:1). Удаление Вос-группы выполняли путем добавления 4 мл раствора ТФУ/ДХМ (1:1). 2 М NH3 в МеОН добавляли к неочищенной реакционной смеси(210 мл) и удаляли растворитель под вакуумом. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с использованием системы В, 100 мМ NH4HCO3/MeCN (10-50% MeCN). 50 мг чистого продукта выделяли в виде грязно-белого твердого вещества. МС m/z 313 [М + Н]+. Пример 16. 5-Метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол 1-(Фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол, пример 15 (34,4 мг, 0,11 ммоль), растворяли в ДМЭА (2 мл) и добавляли формальдегид (37 мас.% водный раствор, 0,1 мл, 1,1 ммоль), уксусную кислоту (0,05 мл, 0,7 ммоль) и триацетоксиборгидрид натрия (156 мг, 0,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакцию останавливали добавлением 1 М NaOH (5 мл). Водную фазу (рН приблизительно 14) отделяли, а затем экстрагировали ДХМ (35 мл). Объединенные органические фазы промывали водой и солевым раствором и сушилиMgSO4. Растворитель удаляли под вакуумом. Чистый продукт (20 мг) получали в виде грязно-белого твердого вещества. МС m/z 327 [М + Н]+. Промежуточное соединение 13. 6-Метил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7-ол К раствору серотонинаHCl (5,02 г, 23,6 ммоль) в МеОН (200 мл) добавляли ТЭА (200 мл), и перемешивали смесь при комнатной температуре в течение 30 мин. Затем реакционную смесь помещали в атмосферу кислорода (баллон) и перемешивали при температуре кипячения с обратным холодильником(68 С) в течение 24 ч. Растворитель из коричневой смеси выпаривали при пониженном давлении, а полученное масло (10 г) наносили слоем на колонку с силикагелем (L=90 мм, q=60 мм) и элюировали первоначально смесью CHCl3/МеОН/(водн. 25% NH3) 90/10/1, приблизительно два объема колонки, а затем 80/20/2. Чистые фракции объединяли и выпаривали растворитель при пониженном давлении, получив 0,41 г коричневого твердого вещества. МС m/z 203 [М + Н]+. Промежуточное соединение 14. трет-Бутил-7-(ацетилокси)-6-метил-1,3,4,6-тетрагидро-5 Назепино[5,4,3-cd]индол-5-карбоксилат К раствору 6-метил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7-ола, промежуточное соединение 13 (340 мг, 1,7 ммоль), в МеОН (10 мл) добавляли (ВОС)2 О (513 мг, 2,4 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 30 мин (95%-ное превращение). Затем добавляли пиридин (0,5 мл) и оставляли смесь при комнатной температуре на ночь. Растворитель выпаривали при пониженном давлении, а полученный остаток растворяли в пиридине (4 мл), охлаждали на ледяной бане,добавляли Ас 2 О (1 мл) и оставили перемешиваемую смесь медленно нагреваться до комнатной температуры на ночь. Смесь концентрировали при пониженном давлении, а остаток подвергали дважды совместному выпариванию с толуолом. Темно-коричневое масло (0,9 г) очищали с помощью хроматографии на колонке с силикагелем, первоначально 100%-ным CHCl3, а затем смесью CHCl3/МеОН 99,5/0,5. Выпаривание чистых объединенных фракций привело к получению 241 мг соединения, соответствующего заголовку, в виде светло-желтого масла. МС m/z 289 [М + Н-изобутен]+. Промежуточное соединение 15. трет-Бутил-7-гидрокси-6-метил-1-(фенилсульфонил)-1,3,4,6 тетрагидро-5H-азепино[5,4,3-cd]индол-5-карбоксилат Раствор трет-бутил-7-(ацетилокси)-6-метил-1,3,4,6-тетрагидро-5H-азепино[5,4,3-cd]индол-5 карбоксилата, промежуточное соединение 14 (241 мг, 0,7 ммоль) в безводном ДМФА (4 мл) охлаждали в ледяной бане, добавляли бензолсульфонилхлорид (210 мг, 1,2 ммоль), а затем небольшими порциями в течение 1 мин NaH (34 мг, 1,4 ммоль). Смесь перемешивали в течение 2 мин, после чего добавляли 2 МNaOH (0,5 мл) и оставляли смесь при комнатной температуре на ночь. Смесь разбавляли водой (10 мл) и к коричневому мутному раствору осторожно добавляли НОАс (0,5 мл), что привело к осаждению грязнобелого твердого вещества. Затем добавляли еще воды (20 мл), после чего твердые частицы выделяли путем фильтрования и сушили, получив 245 мг грязно-белых кристаллов. МС m/z 343 [М + Н-Вос]+. Пример 17. 7-Метокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индола трифторацетат К раствору трет-бутил-7-гидрокси-6-метил-1-(фенилсульфонил)-1,3,4,6-тетрагидро-5 Назепино[5,4,3-cd]индол-5-карбоксилата, промежуточное звено 15 (39 мг, 0,079 ммоль), в ацетоне (10 мл) добавляли K2CO3 (110 мг, 0,79 ммоль), а затем MeI (79 мг, 0,55 ммоль), и кипятили смесь с обратным холодильником в течение ночи. Растворитель из отфильтрованного раствора выпаривали при понижен- 15016592 ном давлении, а полученное масло растворяли в ДХМ/ТФУ 50/50 (1 мл) и оставляли при комнатной температуре на ночь. Растворитель выпаривали при пониженном давлении, полученное масло растворяли в МеОН с каплей 25%-ного водного раствора NH3, а неочищенный продукт очищали с помощью препаративной ВЭЖХ (Xterra C18, 10 мМ NH4CO3 (рН 10) - CH3CN), получив 11,9 мг соединения, соответствующего заголовку, в виде коричневого масла. МС m/z 357 [М + Н]+. Пример 18. 6-Метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7-ол Смесь 50/50 ДХМ/ТФУ (1 мл) добавляли к трет-бутил-7-гидрокси-6-метил-1-(фенилсульфонил)1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилату, промежуточное соединение 15 (16 мг,0,036 ммоль), и перемешивали смесь при комнатной температуре в течение 1 ч. Растворитель выпаривали при пониженном давлении, а неочищенный продукт очищали с помощью препаративной ВЭЖХ(129 мг, 0,36 ммоль), ДХМ (3 мл) и N,N-диизопропилэтиламин (ДИПЭА) (70 мг, 0,54 ммоль) смешивали в 16-мм пробирке с завинчивающейся крышкой. Реакционную смесь перемешивали при комнатной температуре в течение ночи, добавлен дополнительный эквивалент N-фенилтрифторметансульфонимида и ДИПЭА вместе с дополнительным количеством ДХМ (6 мл), после чего мутную смесь перемешивали в течение еще двух дней. Прозрачный раствор промывали подкисленной (рН 1, HCl) ледяной водой и солевым раствором. Растворитель выпаривали при пониженном давлении, а полученное твердое вещество растирали с малым количеством холодного МеОН (1 мл). Белые кристаллы удаляли фильтрованием и сушили с получением 60 мг продукта. МС m/z 519 [М + Н-изобутен]+. Пример 19. 6-Метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-7 илтрифторметансульфоната трифторацетат трет-Бутил-6-метил-1-(фенилсульфонил)-7-[(трифторметил)-сульфонил]окси-1,3,4,6-тетрагидро 5 Н-азепино[5,4,3-cd]индол-5-карбоксилат, промежуточное соединение 16 (12,6 мг, 0,022 ммоль), растворяли в смеси 50/50 ДХМ/ТФУ (1 мл) и оставляли при комнатной температуре на 1 ч. Выпаренный неочищенный продукт очищали с помощью препаративной ВЭЖХ (АСЕ С 8 5 мм, вода, содержащая 0,1% ТФУ - CH3CN), получив 7,2 мг соединения, соответствующего заголовку, в виде светло-коричневого масла. МС m/z 474 [М + Н]+. Пример 20. 7-Метокси-5,6-диметил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3cd]индол- 16016592 К 7-Метокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индолу, пример 17 (11,4 мг, 0,032 ммоль), в ДХЭ (2 мл) добавляли триацетоксиборгидрид натрия (20 мг, 0,096 ммоль) с последующим добавлением капли водного раствора формальдегида (11 мг, 0,10 ммоль) и перемешивали смесь при 40 С в течение 1 ч. Органическую фазу дважды промывали 0,1 М NaOH, а масло от выпаренной органической фазы очищали с помощью препаративной ВЭЖХ (Xterra C18, 10 мМ NH4CO3 (рН 10) CH3CN), получив 7,5 мг соединения, соответствующего заголовку, в виде грязно-белого масла. МС m/z 371 [М + Н]+. Пример 21. 7-Этокси-6-метил-1-(фенилсульфонил)-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол трет-Бутил-7-гидрокси-6-метил-1-(фенилсульфонил)-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол 5-карбоксилат, промежуточное соединение 15 (16 мг, 0,036 ммоль), ацетон (5 мл), K2CO3 (50 мг, 0,36 ммоль) и EtI (34 мг, 0,22 ммоль) добавляли в 16-мм пробирку с завинчивающейся крышкой, после чего суспензию перемешивали при 62 С в течение ночи. Растворитель из фильтрованной смеси выпаривали при пониженном давлении, а остаток растворяли в ДХМ/ТФУ 50/50 (1 мл) и оставляли при комнатной температуре на 2 ч. Растворитель выпаривали при пониженном давлении, а неочищенный продукт очищали с помощью препаративной ВЭЖХ (Xterra C18, 10 мМ NH4CO3 (рН 10) - CH3CN), получив 9,0 мгNaH (95%; приблизительно 3 мг, 0,125 ммоль, 2,5 экв.) добавляли к суспензии трет-бутил-1,3,4,6 тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилата, промежуточное соединение 12 (14 мг, 0,050 ммоль), в безводном CH3CN (350 мкл). Флакон сразу наполняли N2, запечатывали и встряхивали при комнатной температуре в течение 1,5 ч. К реакционной смеси добавляли (через мембрану) раствор сульфонилхлорида (0,75 ммоль, 1,5 экв.), растворенного в безводном CH3CN (150 мкл), после чего встряхивание продолжали в течение 3 ч. ТФУ (100 мкл) добавляли к реакционной смеси с получением в результате деблокированного продукта через 2-16 ч реакции. Реакционную смесь разбавляли H2O (100 мкл) и МеОН (1000 мкл) и очищали с помощью препаративной обращенно-фазовой ВЭЖХ (АСЕ С 8, 5 мкм 2150 мм, поток 25 мл/мин, 0,1% ТФУ в Н 2 О (MilliQ) - CH3CN), получив продукт в форме соответствующей трифторацетатной соли. Сульфонилхлориды, которые не были растворимы в CH3CN, добавляли непосредственно в реакционные смеси в твердом виде. Пример 22. 1-[(2-Хлор-6-метилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индола трифторацетат- 26016592 9,5 мг продукта. Спектр ЯМР содержит сигналы, по-видимому, от двух региоизомеров в соотношении 3:1. МС (ESI) m/z 355 [М + Н]+. Пример 64. 1-[(4-Пропилфенил)сульфонил]-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индола трифторацетат- 28016592 ммоль) в МеОН (4 мл) осторожно добавляли в 16 мм пробирку, содержащую Pd/C (35 мг). Суспензию продували N2, затем в один прием добавляли формиат аммония (88 мг, 1,4 ммоль), продували смесь N2 еще раз и перемешивали смесь при комнатной температуре в течение двух дней. Промежуточное соединение после удаления трифлатной группы очищали с помощью препаративной ВЭЖХ (АСЕ С 85 мм, вода, содержащая 0,1% ТФУ - CH3CN). Чистую фракцию выпаривали при пониженном давлении, добавляли ДХМ/ТФУ 50/50 (1 мл) и оставляли смесь при комнатной температуре на 1 ч. Неочищенный продукт очищали с помощью препаративной ВЭЖХ (Xterra С 18, 10 мМ NH4CO3 (рН 10) - CH3CN), получив 0,8 мг соединения, соответствующего заголовку, в виде белого масла. МС (ESI) m/z 326 [М + Н]+. Промежуточное соединение 17. трет-Бутил-3-оксо-1,2,3,4-тетрагидро-5 Н-азепино [5,4,3-cd]индол-5 карбоксилат трет-Бутил-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилата, промежуточное соединение 12 (100 мг, 0,37 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ) (167 мг, 0,73 ммоль) в смеси ТГФ/вода 9/1 (8 мл) перемешивали под N2 в течение ночи при комнатной температуре. Соединение очищали на препаративной флеш-колонке Biotage, используя в качестве элюента EtOAc 15-100% в петролейном эфире 40-65 С. Получали 58 мг титульного соединения. МС (ESI +) m/z 231 [М + Н-изобутен]+. Промежуточное соединение 18. трет-Бутил-3-оксо-1-(фенилсульфонил)-1,3,4,6-тетрагидро-5Hазепино[5,4,3-cd]индол-5-карбоксилат трет-Бутил-3-оксо-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилат, промежуточное соединение 17 (50 мг, 0,17 ммоль), гидросульфат тетрабутиламмония (8 мг, 0,01 ммоль) и бензолсульфонилхлорид (25 мкл, 0,19 ммоль) растворяли в ДХМ (2 мл). Добавляли 2,5 М NaOH (77 мкл). Смесь перемешивали в течение 1 ч при комнатной температуре. Фазу ДХМ отбирали и промывали NaHCO3 (нас.) и водой. После выпаривания получали остаток, который очищали на силикагеле, используя в качестве элюента 8-66% EtOAc в петролейном эфире 45-60 С. В результате получали 42,4 мг титульного соединения в виде прозрачной стекловидной массы. МС (ESI+) m/z 371 [М + Н-изобутен]+. Пример 73. 1-(Фенилсульфонил)-1,4,5,6-тетрагидро-3 Н-азепино[5,4,3-cd]индол-3-она трифторацетат трет-Бутил-3-оксо-1-(фенилсульфонил)-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилат, промежуточное соединение 18 (5,0 мг, 0,012 ммоль), растворяли в ДХМ (1 мл). Затем добавляли ТФУ (0,5 мл) и нагревали раствор до кипения. Растворитель выпаривали. Получали 5,2 мг соли ТФУ. МС К раствору трет-бутил-1,3,4,6-тетрагидро-5 Н-азепино[5,4,3-cd]индол-5-карбоксилата, промежуточное соединение 12 (25 мг, 0,092 ммоль) в ДХМ (2 мл) добавляли гидросульфат тетрабутиламмония (6,4
МПК / Метки
МПК: A61P 3/04, C07D 487/06, A61K 31/4745, C07D 471/06
Метки: производные, изохинолина, ожирения, лечения, трициклические
Код ссылки
<a href="https://eas.patents.su/30-16592-triciklicheskie-proizvodnye-izohinolina-dlya-lecheniya-ozhireniya.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические производные изохинолина для лечения ожирения</a>
Предыдущий патент: Модуль, система и способ для образования пульпы бурового шлама высокой плотности
Следующий патент: Твердая фармацевтическая композиция, включающая производное бензимидазол-7-карбоксилата и ph регулирующий агент
Случайный патент: Амидное пролекарство гемцитабина, композиции на его основе и его применение












