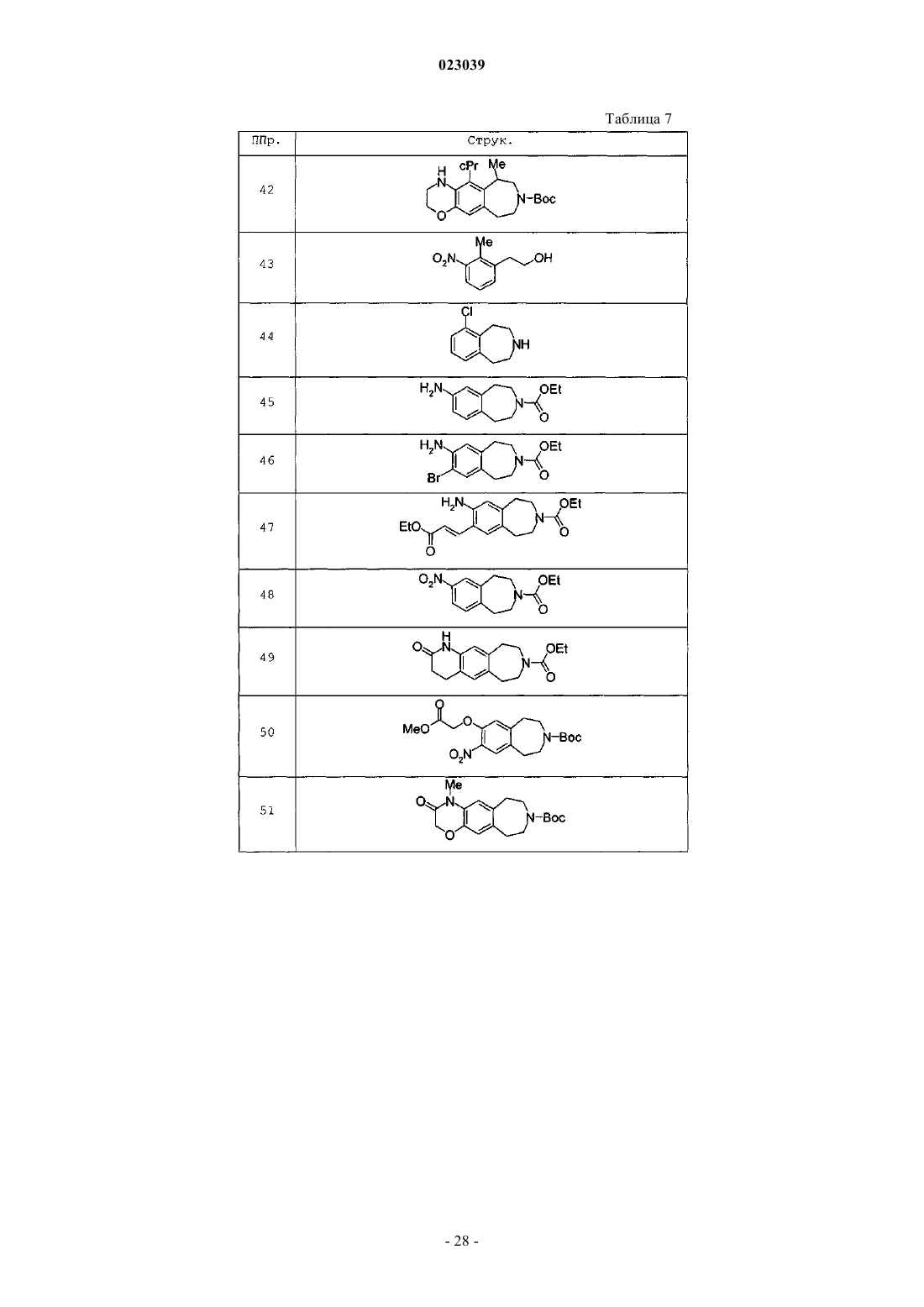
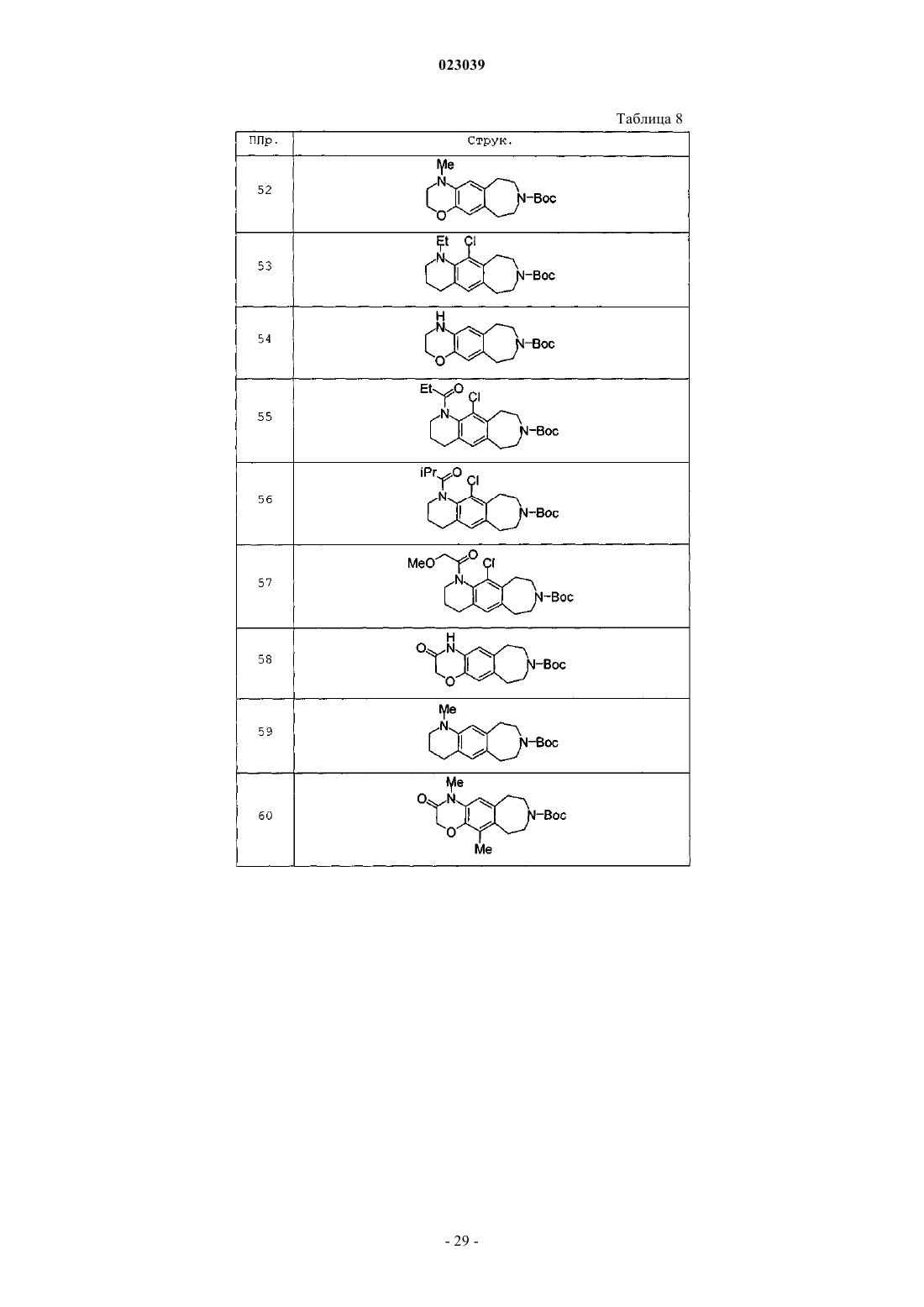
Бензазепиновое соединение, фармацевтическая композиция, включающая его, и его применение
Номер патента: 23039
Опубликовано: 29.04.2016
Авторы: Кавабата Кейко, Асаи Норио, Такахаси Тайсуке, Тор Карл Брюс, Нагаи Ясухито, Косио Хироюки, Симидзу Такафуми
Формула / Реферат
1. Соединение или его соль, которое представляет собой
11-циклопропил-1-(2-метоксиэтил)-2,3,4,6,7,8,9,10-октагидро-1Н-азепино[4,5-g]хинолин,
4-(3-метоксипропил)-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин,
5-циклопропил-4-[(2R)-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин или
5-циклопропил-4-[(2S)-3-фтор-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин.
2. 11-Циклопропил-1-(2-метоксиэтил)-2,3,4,6,7,8,9,10-октагидро-1Н-азепино[4,5-g]хинолин или его соль.
3. 4-(3-Метоксипропил)-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин или его соль.
4. 5-Циклопропил-4-[(2R)-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин или его соль.
5. 5-Циклопропил-4-[(2S)-3-фтор-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин или его соль.
6. Фармацевтическая композиция для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C, содержащая соединение или его соль по п.1 и фармацевтически приемлемый инертный наполнитель.
7. Фармацевтическая композиция по п.6, которая представляет собой фармацевтическую композицию для профилактики или лечения недержания мочи при стрессе и смешанного недержания мочи.
8. Применение соединения или его соли по п.1 для получения фармацевтической композиции для профилактики или лечения недержания мочи при стрессе и смешанного недержания мочи.
9. Способ профилактики или лечения недержания мочи при стрессе и смешанного недержания мочи, включающий введение субъекту эффективного количества соединения или его соли по п.1.
Текст
Предложены бензазепиновые соединение, а именно 11-циклопропил-1-(2-метоксиэтил)2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолин, 4-(3-метоксипропил)-2,3,4,6,7,8,9,10 октагидро[1,4]оксазино[2,3-h][3]бензазепин,5-циклопропил-4-[(2R)-2-метоксипропил]2,3,4,6,7,8,9,10-октагидро[1,4]оксазино-[2,3-h][3]бензазепин или 5-циклопропил-4-[(2S)-3-фтор-2 метоксипролил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин или их соли, которые используются в качестве средства для лечения или профилактики заболеваний, связанных с рецептором 5-HT2C, в частности недержания, такого как стрессовое недержание мочи, ургентное недержание мочи, смешанное недержание мочи и т.п., половой дисфункции, такой как синдром эректильной дисфункции и т.п., ожирения и т.п. Изобретение также относится к фармацевтической композиции для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C, в частности для лечения или профилактики недержания, такого как стрессовое недержание мочи при стрессе и смешанное недержание мочи. Изобретение раскрывает применение бензазепиновых соединений для получения фармацевтической композиции для профилактики или лечения недержания мочи при стрессе и смешанного недержания мочи. Также изобретение относится к способу профилактики или лечения недержания мочи при стрессе и смешанного недержания мочи. Косио Хироюки, Асаи Норио, Такахаси Тайсуке, Симидзу Такафуми, Нагаи Ясухито, Кавабата Кейко (JP), Тор Карл Брюс (US) Область техники Настоящее изобретение относится к бензазепиновому соединению, которое используют в качестве активного ингредиента фармацевтической композиции, в частности фармацевтической композиции для лечения или профилактики заболеваний, связанных с рецептором 5-HT2C, в частности недержания, такого как стрессовое недержание мочи, ургентное недержание мочи, смешанное недержание мочи и т.п.,половой дисфункции, такой как синдром эректильной дисфункции и т.п., ожирения и т.п. Уровень техники Рецептор серотонина 2C (5-HT2C) является одним из рецепторов серотонина, трансмиттера, связанного с различными физиологическими функциями в биологическом организме. Его экспрессия была определена, главным образом, в центральной нервной системе (головной мозг/спинной мозг). Анорексигенное действие является, как известно, физиологической функцией центрального рецептора 5-HT2C, и сообщалось о действии различных агонистов рецептора 5-HT2C, снижающем потребление корма у крыс (непатентные документы 1 и 2). Кроме того, было подтверждено, что действие, направленное против ожирения у людей, проявляется в результате анорексигенного действия агониста рецептора 5-HT2C (непатентный документ 3). Центральный рецептор 5-HT2C вовлечен в контролирование функций периферического нерва, и сообщалось, что пениальная эрекция у крыс вызывается агонистом рецептора 5-HT2C (непатентный документ 4) и что промежуток времени от введения до эякуляции увеличивается в эксперименте исследования поведения обезьян при спаривании (непатентный документ 5). Кроме того, сообщалось, что агонист рецептора 5-HT2C увеличивает уретральную резистентность в случае, когда внутрибрюшное давление у крыс повышено (непатентный документ 6). При этом сообщалось, что в моделях болезни с нейропатической/воспалительной болью у крыс эффективность демонстрируется при интраспинальном введении агониста рецептора 5-HT2C (непатентные документы 7 и 8). Для агониста рецептора 5-HT2C рассматривались различные клинические применения, в частности в качестве лекарственных средств, направленных против ожирения, лекарственных средств для лечения эректильной дисфункции у мужчин, лекарственных средств для лечения преждевременной эякуляции, лекарственных средств для лечения недержания мочи при напряжении, лекарственных средств для лечения нейропатической/воспалительной боли или т.п. В качестве агониста рецептора 5-HT2C сообщалось о производном бензазепина и в качестве производного трициклического бензазепина известны, например, соединение А (патентный документ 1) и соединение В (патентный документ 2). Химическая структура 1 В качестве других агонистов рецептора 5-HT2C сообщалось о бициклических производных бензазепина (патентные документы 3-5). Как 2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолиновое производное или 3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепиновое производное, представляющие собой трициклическое производное бензазепина, соединение формулы (АА) является известным в качестве модулятора допамина D3 и используется для лечения от злоупотребления основными наркотическими веществами и от наркотической зависимости (патентный документ 6). Химическая структура 2 Кроме того, в настоящем документе следующие соединения описаны в качестве промежуточных соединений в синтезе соединения формулы (АА). Химическая структура 3 Кроме того, имеется сообщение о взаимосвязи структуры и активности конкретного соединения формулы (АА) (непатентный документ 9), и в этом сообщении указано, что следующее соединение использовали в получении соединения формулы (АА). Более того, имеется сообщение об антагонисте рецептора 5-HT6 (непатентный документ 10), в которомуказано, что для соединения, приведенного ниже, эффективность в отношении рецептора 5-HT6 утрачивается при преобразовании кольца, конденсированного с бензазепином, из 5-членного кольца в 6-членное кольцо. Химическая структура 5 Однако в документах, в которых описаны такие трициклические производные бензазепина, отсутствует списание активности 2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолинового производного или 3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепинового производного в качестве агониста рецептора 5-HT2C. Документы известного уровня техники[Непатентный документ 10] BioorganicMedicinal Chemistry Letters, 2008, vol. 18, p. 5698-5700. Сущность изобретения Задачи, решаемые с помощью изобретения Предложено бензазепиновое соединение, которое может быть использовано в качестве активного ингредиента фармацевтической композиции, в частности фармацевтической композиции для лечения или профилактики заболеваний, связанных с рецептором 5-HT2C, в частности недержания, такого как стрессовое недержание мочи, ургентное недержание мочи, смешанное недержание мочи и т.п., половой дисфункции, такой как синдром эректильной дисфункции и т.п., ожирения и т.п. Средства решения задачи Авторы настоящего изобретения тщательно изучили соединения, обладающие активностью агониста рецептора 5-HT2C, и в результате обнаружили, что бензазепиновое соединение по настоящему изобретению обладает активностью агониста рецептора 5-HT2C, что позволило оформить настоящее изобретение. То есть, настоящее изобретение относится к фармацевтической композиции, включающей бензазепиновое соединение, выбранное из 11-циклопропил-1-(2-метоксиэтил)-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолина,4-(3-метоксипропил)-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепина,5-циклопропил-4-[(2R)-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепина или 5-циклопропил-4-[(2S)-3-фтор-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3h][3]бензазепина,или его соль и фармацевтически приемлемый инертный наполнитель. Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C, содержащей бензазепиновое соединение или его соль. В связи с этим фармацевтическая композиция включает средство для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C, содержащей бензазепиновое соединение или его соль. Более того, настоящее изобретение относится к применению бензазепинового соединения или его соли для получения фармацевтической композиции для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C; бензазепиновому соединению или его соли для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C; и способу профилактики или лечения заболеваний, связанных с рецептором 5-HT2C, включающему введение субъекту эффективного количества бензазепиновое соединения или его соли. При этом "субъектом" является человек или другие животные, нуждающиеся в профилактике или лечении, и в одном варианте осуществления является человек, нуждающийся в профилактике или лечении. Эффекты изобретения Соединение настоящего изобретения, а именно 11-циклопропил-1-(2-метоксиэтил)-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолин,4-(3-метоксипропил)-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин,5-циклопропил-4-[(2R)-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино-[2,3-h][3]бензазепин или 5-циклопропил-4-[(2S)-3-фтор-2-метоксипропил]-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепин,или его соль обладают активностью агониста рецептора 5-HT2C и могут быть использованы в качестве средства для профилактики или лечения заболеваний, связанных с рецептором 5-HT2C. В настоящем документе примеры заболеваний, связанных с рецептором 5-HT2C, включают недержание, такое как стрессовое недержание мочи, ургентное недержание мочи, смешанное недержание мочи и т.п., половую дисфункцию, такую как синдром эректильной дисфункции и т.п., ожирение и т.п. В одном из воплощений настоящее изобретение относится к 11-циклопропил-1-(2-метоксиэтил)2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолину. В другом воплощении настоящее изобретение относится к 4-(3-метоксипропил)-2,3,4,6,7,8,9,10 октагидро[1,4]оксазино[2,3-h][3]бензазепину. В следующем воплощении изобретение относится к 5-циклопропил-4-[(2R)-2-метоксипропил]2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепину. Также изобретение относится к 5-циклопропил-4-[(2S)-3-фтор-2-метоксипропил]-2,3,4,6,7,8,9,10 октагидро[1,4]оксазино[2,3-h][3]бензазепину. Соединение настоящего изобретения может существовать в форме таутомеров или геометрических изомеров. В настоящем описании бензазепиновое соединение представлено только в виде одного изомера, хотя настоящее изобретение включает и другой изомер, такой как выделенные формы изомеров или их смеси. Кроме того, в некоторых случаях соединение настоящего изобретения может существовать в виде оптических изомеров. Настоящее изобретение включает обе выделенные формы оптических изомеров соединения по изобретению или их смесь. Кроме того, соль бензазепинового соединения представляет собой фармацевтически приемлемую соль и может образовывать соль, полученную добавлением кислоты, или соль, полученную с помощью основания, в зависимости от типа заместителей. Конкретные примеры включают соли добавления неорганических кислот, таких как хлористо-водородная, бромисто-водородная, йодисто-водородная, серная,азотная, фосфорная кислоты и т.п., и органических кислот, таких как муравьиная, уксусная, пропионовая, щавелевая, малоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, миндальная, винная,дибензоилвинная, дитолуоилвинная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, аспарагиновая, глутаминовая кислоты и т.п., и соли с неорганическими основаниями, такими как натрий, калий, магний, кальций, алюминий и т.п., или с органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин, орнитин и т.п., соли с различными аминокислотами или производными аминокислот, таких как ацетиллейцин и т.п., соли аммония и т.д. Кроме того, соединения настоящего изобретения также могут находиться в форме различных гидратов или сольватов и полиморфных кристаллических веществ. Способы получения. Бензазепиновое соединение и его соль могут быть получены при использовании свойств, основанных на основной структуре или типе его заместителей, и применении различных известных способов синтеза. В процессе получения на стадии преобразования исходного вещества в промежуточное соединение может быть эффективной замена релевантной функциональной группы на подходящую защитную группу (группа, которая может быть легко преобразована в функциональную группу), в зависимости от типа функциональной группы в способе получения в некоторых случаях. Защитная группа для такой функциональной группы может включать, например, защитные группы, описанные в "Greene's ProtectiveGroups in Organic Synthesis (4th Ed., 2006)", P.G.M. Wuts and T.W. Greene, и одна из них может быть выбрана и использована по мере необходимости в зависимости от реакционных условий. В этом виде метода желаемое соединение может быть получено введением защитной группы, проведением взаимодейст-3 023039 вия и, при необходимости, удалением защитной группы. Далее в настоящем документе описаны типичные способы получения соединений настоящего изобретения. Каждый из способов получения может также быть осуществлен согласно ссылкам, прилагаемым к настоящему описанию. Кроме того, способы получения, приведенные в настоящем изобретении,не ограничиваются приведенными ниже примерами. Соединения настоящего изобретения могут быть получены удалением защитной группы для аминогруппы соответствующего защищенного соединения настоящего изобретения. Защитной группой может быть любая защитная группа для аминогруппы, обычно используемая специалистом в данной области,обычно используют карбонил, такой как трифторацетил и т.п.; оксикарбонил, такой как третбутилкарбоксил, этилкарбоксил, бензилкарбоксил и т.п.; или сульфонил, такой как метансульфонил,п-толуолсульфонил, трифторметансульфонил, п-нитрофенилсульфонил, 2,4-динитрофенилсульфонил и т.п. Для удаления защитных групп на определенной стадии могут быть использованы условия удаления защитных групп, обычно используемые специалистом в данной области. Например, получение может быть осуществлено путем обработки кислотой, гидролиза, гидрирования или т.п. Для обработки кислотой может быть использована, например, трифторуксусная кислота, газообразная хлористо-водородная кислота, серная кислота или т.п. В случае щелочного гидролиза могут быть использованы неорганические основания (например, NaOH, KOH, NaHCO3, Cs2CO3 и т.п.). В случае кислотного гидролиза могут быть использованы соляная кислота и т.п. Что касается температуры реакции, то взаимодействие может быть осуществлено в условиях от охлаждения льдом до нагревания с обратным холодильником и в условиях, которые не позволяют субстрату разлагаться. В качестве растворителя могут быть использованы,но этим не ограничиваются, диоксан, тетрагидрофуран, дихлорметан, хлороформ, этилацетат, спирты(MeOH, EtOH и т.п.), N,N-диметилформамид (ДМФ), диметилсульфоксид (ДМСО), вода или растворитель, состоящий из смеси этих веществ, и т.п. В случае гидрирования взаимодействие обычно может быть осуществлено в атмосфере водорода в присутствии катализатора на основе палладия. Обычно взаимодействие может быть осуществлено в условиях от комнатной температуры до нагревания с обратным холодильником и в условиях, которые не позволяют субстрату разлагаться. В качестве растворителя могут быть использованы, но этим не ограничиваются, ДМФ или спирты (MeOH, EtOH и т.п.). Кроме того,могут быть использованы условия для реакции удаления карбоксамидной группы, реакции удаления карбаматной группы, реакции удаления сульфонамидной группы, описанные в "Greene's ProtectiveGroups in Organic Synthesis (4th Ed., 2006)", выше. Соединения настоящего изобретения могут быть выделены и очищены в виде свободных соединений, солей, гидратов, сольватов или их полиморфных кристаллических продуктов. Соли соединения могут быть получены с помощью обычной образующей соли реакции. Выделение и очистку выполняют, используя обычные химические методы, такие как экстракция,фракционная кристаллизация, различные виды фракционной хроматографии и т.п. Различные изомеры могут быть получены путем подбора соответствующего исходного соединения или могут быть разделены, используя различия в физико-химических свойствах изомеров. Например,оптические изомеры могут быть получены общим методом оптического расщепления рацемических продуктов (например, фракционная кристаллизация диастереомерных солей с оптически активными основаниями или кислотами, хроматография с использованием хиральной колонки или т.п. и др.), кроме того,изомеры могут также быть получены из соответствующего оптически активного исходного вещества. Фармакологическая активность бензазепинового соединения была подтверждена приведенными ниже тестами. Тестовый пример 1. Оценка активности агониста рецептора 5-HT2C. Агонистическая активность соединения настоящего изобретения в отношении рецептора 5-HT2C была подтверждена способом, показанным ниже. Активность агониста рецептора 5-HT2C человека оценивали, измеряя увеличение лигандзависимой внутриклеточной концентрации кальция. Использовали клетки CHO, которые устойчиво экспрессируют человеческий рецептор 5-HT2C. Экспрессирующие рецептор клетки получали, трансфицируя гены человеческого рецептора 5-HT2C (номер доступа: AF498983 (5-HT2C в клетки CHO (штамм с дефицитом дигидрофолевой кислоты, DS Pharma Biomedical Co., Ltd., используя вектор pEF-BOS (Nucleic AcidsResearch, vol. 18, No. 17). После транскрипции 5-HT2C, как известно, подвергается "редактированию" РНК, чтобы обеспечить различия в трех видах аминокислот, что дает 14 изоформ рецептора. В том числе использовали клетки, стабильно экспрессирующие тип INI рецептора 5-HT2C, который не подвергался редактированию. Клетки, используемые для оценки, культивировали в среде, содержащей 10% фетальную телячью сыворотку (FBS) (торговое наименование: -МЕМ, Invitrogen) при 37C и в 5%-ном диоксиде углерода. (В день перед оценкой клетки суспендировали в среде без сыворотки (торговое наименование: CD-CHO, Invitrogen), содержащей 8 мМ L-глутамина (торговое наименование: L-глутамин 200 мМ, Invitrogen, добавленный к среде при конечной концентрации 8 мМ) и высеивали в 96-луночный планшет, покрытый поли-D-лизином (торговое наименование: Biocoat PDL96W Black/Clear, Japan Becton,-4 023039Dickinson and Company, при концентрации 4104 клетки/лунка и культивировали при 37C и в 5%-ном диоксиде углерода в течение ночи. Раствор, включая промывной раствор (смесь сбалансированный солевой раствор Хенкса (HBSS) гидроксид натрия (NaOH), 20 мМ 2-[4-(2-гидроксиэтил)-1 пиперазинил]этансульфоновой кислоты (HEPES) - гидроксид натрия (NaOH), 2,5 мМ робенецида и 0,1% бычьего сывороточного альбумина (BSA и 4 мкМ флуоресцентного реагента (торговая марка: Fluo4 АМ, Dojindo Co., Ltd.), использовали в качестве загрузочного буфера и среду 96-луночного планшета,которую культивировали в течение ночи, заменяли на загрузочный буфер. После того как клетки оставляли (с защитой от светового излучения) при комнатной температуре в течение 3 ч, их промывали в машине для промывки планшета (торговая марка: EL405, BioTek Instruments, Inc.) со встроенным модулем для промывочного раствора. Планшеты с промытыми клетками помещали в систему для измерения концентрации кальция (Са) в клетке (торговое наименование: FLIPR, Molecular Devices, Inc.). В это устройство помещали исследуемое соединение, которое было растворено в диметилсульфоксиде и разбавлено в промывочном растворе в заранее определенной концентрации и подготавливали для измерения концентраций Са в клетке. Определяли разницу между максимальным значением и минимальным значением изменения внутриклеточной концентрации Са и сохраняли в виде данных измерений. Принимая максимальный отклик 5-HT (агонистическое действие путем добавления 5-HT 10 мкМ) за 100%, а отклик одного только растворителя за 0%, получали эффективность (Emax (% соединения по настоящему изобретению относительно максимального отклика 5-HT, и вычисляли концентрацию (ЕС 50(нМ методом логистической регрессии в качестве активности агониста. Результаты по нескольким соединениям (как соединениям настоящего изобретения, так и сравнительным соединениям, приведенных в качестве иллюстративных соединений) показаны в табл. 1,где Пр. обозначает номер соединения по примеру. Таблица 1 Тестовый пример 2. Измерение активности внешнего уретрального сфинктера с помощью электромиографии. Активирующее действие соединения формулы (I) в отношении активности уретрального сфинктера, измеряемой с помощью электромиографии, было подтверждено описанным далее методом. Самок морских свинок Hartley массой тела 250-350 г анестезировали уретаном (Sigma). Морских свинок фиксировали в положении лежа на спине и в яремную вену вводили катетеры (РЕ-50; ClayAdams) для введения исследуемого соединения. Далее, через рассечение в куполе мочевого пузыря вводили катетеры (РЕ-160; Clay Adams) для вливания физиологического раствора в мочевой пузырь и изме-5 023039 рения интравезикального давления. Затем для электромиографического измерения активности внешнего уретрального сфинктера вводили два электрода в обе, левую и правую, стороны мочеиспускательного канала до уретрального сфинктера. Электроды для измерения базовых напряжений размещали под кожей задней части. Катетер мочевого пузыря разветвляли с помощью трехходового запорного крана и одну ветвь соединяли с 50 мл шприцем (Terumo), прикрепленным к насосу для вливания (Terumo). Другую соединяли с трансдуктором давления (DX-100; Nihon Kohden Corporation) для передачи сигнала преобразователя через усилитель (AP-630G; Nihon Kohden Corporation) и систему получения и накопления данных (PowerLab; AD Instruments) на компьютер и записи на жесткий диск. Электроды для электромиографического измерения соединяли с блоком управления (JB-101J; Nihon Kohden Corporation) для передачи сигнала через усилитель (АР-651J; Nihon Kohden Corporation) и систему получения и накопления данных(PowerLab; AD Instruments) на компьютер и записи на жесткий диск. Далее данные анализировали с помощью компьютера с использованием программного обеспечения (Chart; AD Instruments). В мочевой пузырь непрерывно вводили со скоростью 18 мл/ч физиологический солевой раствор, используя насос для вливания, и подтверждали, что рефлексы мочеиспускания вызываются устойчиво. Анализировали электромиографическую активность, принимая самую низкую амплитуду потенциалов в качестве стандарта в течение периода стабилизации и используя в качестве индикатора частоты активизации выше стандартной амплитуды. В промежутках между соответствующими актами мочеиспускания (фаза наполнения мочи) анализировали электромиографическую активность уретрального сфинктера и вычисляли ее среднее значение. После периода стабилизации через катетер, помещенный в яремную вену, вводили растворитель и исследуемое соединение в увеличенной дозе с интервалом 40 мин. После введения растворителя электромиографическую активность уретрального сфинктера принимали за 100%, а после введения исследуемого соединения электромиографическую активность уретрального сфинктера выражали в виде процентных значений (%) от электромиографической активности после введения растворителя. В результате соединения настоящего изобретения по примерам 81, 59, 266 и 287, как показано ниже, показали электромиографическую активность внешнего уретрального сфинктера, составляющую 200% или больше, при внутривенном введении в дозе 3 мг/кг. В результате каждого теста, описанного выше, было подтверждено, что каждое из соединений настоящего изобретения обладает активностью агониста рецептора 5-HT2C, и соединение по изобретению в виде фармацевтического препарата может быть использовано для лечения или профилактики заболеваний, связанных с рецептором 5-HT2C, в частности недержания, такого как стрессовое недержание мочи,ургентное недержание мочи, смешанное недержание мочи и т.п., половой дисфункции, такой как синдром эректильной дисфункции и т.п., ожирения и т.п. Согласно результатам, полученным с помощью описанных выше тестов, обнаружили, что соединение обладает активностью агониста рецептора 5-HT2C и соответственно имеет, по существу, такое же или даже более высокое значение активности, чем разрабатываемый препарат против ожирения Lorcaserin(The Journal of Pharmacology и Experimental Therapeutics vol. 325, No. 2, p. 577-587 (2008. Фармацевтическая композиция, содержащая один или два или более видов соединения по изобретению или его соли в качестве активного ингредиента, может быть получена с применением наполнителей, которые обычно используют в данной области, т.е. наполнителей для получения фармацевтических препаратов, носителей для получения фармацевтических препаратов и т.п., обычно используемыми способами. Введение может быть осуществлено либо путем перорального введения посредством таблеток, пилюль, капсул, гранул, порошков, растворов и т.п., либо инъекций для парентерального введения, такой как внутрисуставная, внутривенная или внутримышечная инъекции и т.п., свечей, офтальмических растворов, глазных мазей, трансдермальных жидких препаратов, мазей, трансдермальных пластырей,трансмукозальных жидких препаратов, трансмукозальных пластырей, лекарственных форм для ингаляции и т.п. Твердая композиция для перорального введения может быть в виде таблеток, порошков, гранул или т.п. В такой твердой композиции один или несколько активных ингредиентов смешаны по крайней мере с одним инертным наполнителем. В соответствии с обычным способом композиция может содержать инертные добавки, такие как смазывающие вещества, разрыхляющие вещества, стабилизаторы и повышающие растворимость вещества. При необходимости, таблетки или пилюли могут быть покрыты сахаром или пленкой из гастро- или энтеросолюбильного вещества. Жидкая композиция для перорального введения включает фармацевтически приемлемые эмульсии,растворы, суспензии, сиропы, эликсиры или т.п. и также содержит обычно используемые инертные разбавители, например очищенную воду или этанол. Помимо инертного разбавителя, жидкая композиция может также содержать вспомогательные вещества, такие как вещество, способствующее растворению,увлажняющее вещество и суспендирующее вещество, а также подсластители, отдушки, ароматизаторы и антисептические средства. Инъекции для парентерального введения содержат стерильные водные или неводные растворы,суспензии или эмульсии. Примеры водного растворителя включают дистиллированную воду для инъекций и физиологический солевой раствор. Примеры неводного растворителя включают спирты, такие как этанол. Такая композиция дополнительно может содержать вещество, придающее тоничность, антисептик, увлажняющее вещество, эмульгатор, диспергирующее вещество, стабилизатор и вещество, повышающее растворимость. Их стерилизуют фильтрованием через задерживающий бактерии фильтр, смешиванием с бактерицидным средством или облучением. Кроме того, они могут также быть получены в виде твердых стерильных композиций и перед их применением растворены или суспендированы в стерильной воде или стерильном растворителе для инъекций. Примеры композиции для наружного применения включают мази, гипсовые повязки, крема, желе,пластыри, спреи, лосьоны, глазные капли, глазные мази и т.п. Лекарственное средство содержит обычно используемые основы для мази, основы для лосьона, водные или неводные жидкие препараты, суспензии, эмульсии или т.п. Трансмукозальные средства, такие как ингаляторы, трансназальные средства и т.п., используют в виде твердых, жидких или полутвердых веществ и могут быть получены общеизвестными способами. Например, известные наполнители и, дополнительно, регулирующие рН вещества, антисептики, поверхностно-активные вещества, смазывающие вещества, стабилизаторы, загустители или т.п. могут также быть добавлены в случаях, когда это целесообразно. Для введения могут быть использованы подходящие устройства для ингаляции или инсуффляции. Например, используя известные устройства и распылители,такие как ингалятор отмеренных доз, соединение может быть введено самостоятельно или в виде предписанных порошковых смесей. Кроме того, соединение, объединенное с фармацевтически приемлемыми носителями, может также быть введено в виде растворов или суспензий. Ингаляторы с сухими порошками и т.п. могут представлять собой устройства для однократного введения или многократных введений и могут также быть использованы сухие порошки или капсулы, содержащие порошки. Кроме того, устройства могут быть в форме находящегося под давлением аэрозольного баллона или т.п., в котором используются подходящие вещества для выброса, например хлорфторалкан, гидрофторалкан или подходящий газ, такой как диоксид углерода и т.п. Обычно в случае перорального введения дневная доза подходящим образом составляет от 0,001 до 100 мг/кг массы тела, предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг и вводится одной частью или ее делят на 2-4 части. В случае внутривенного введения ежедневная доза составляет обычно от около 0,0001 до 10 мг/кг массы тела и вводится один раз в день или два или больше раз в день. Кроме того, трансмукозальное средство вводят в дозе от около 0,001 до 100 мг/кг массы тела и вводится один раз в день или два или больше раз в день. В каждом конкретном случае величина дозы будет зависеть, соответственно, от симптомов, возраста, пола и т.п. Несмотря на изменения в зависимости от способов введения, лекарственных форм, участков введения или типов наполнителей и добавок, фармацевтическая композиция по настоящему изобретению содержит от 0,01 до 100 мас.% и в конкретном варианте осуществления от 0,01 до 50 мас.% одного или нескольких видов соединения настоящего изобретения или его соли, которое является активным ингредиентом. Соединение настоящего изобретения может быть использовано в сочетании с различными средствами для лечения или профилактики заболеваний, в которых данное соединение оценивают как эффективное, как описано выше. Комбинированный препарат может быть введен одновременно или раздельно и непрерывно или в желаемом временном интервале. Препараты для совместного введения могут быть получены каждый в отдельности или они могут представлять собой фармацевтическую композицию,включающую различные средства для лечения или профилактики заболеваний, в которых соединение настоящего изобретения оценивают как эффективное, как описано выше, и соединение настоящего изобретения. Примеры Здесь и далее, способы получения соединения настоящего изобретения и исходных соединений описаны более подробно с отсылкой к примерам. Настоящее изобретение не ограничивается соединениями, описанными в примерах, представленных ниже. Причем данный раздел описания, помимо примеров получения соединений настоящего изобретения, включает иллюстративные примеры, которые даны только для сведения. Кроме того, способы получения исходных соединений описаны в препаративных примерах. Способы получения соединения настоящего изобретения не ограничиваются способами получения конкретных примеров, указанных далее, и соединение настоящего изобретения может быть получено любым сочетанием способов получения или способами, которые ясны специалисту в данной области. Кроме того, в препаративных примерах, примерах и таблицах в некоторых случаях могут быть использованы следующие аббревиатуры. ППр.: Препаративный пример ,Пр.: Пример ,ПСин.: препаративный пример , полученный тем же способом,Син.: пример , полученный тем же способом,: соединение ,Струк.: структурная формула,-7 023039 Дан.: физико-химические данные,EI: m/z значения в масс-спектроскопии (EI ионизации, представленное (M)+, если не указано иного),ESI+: m/z значения в масс-спектроскопии (ESI ионизации, представленное (М+Н)+, если не указано иного),ESI-: m/z значения в масс-спектроскопии (ESI ионизации, представленное (M-Н)-, если не указано иного),FAB+: m/z значения в масс-спектроскопии (FAB ионизации, представленное (М+Н)+, если не указано иного),FAB-: m/z значения в масс-спектроскопии (FAB ионизации, представленное (М-Н)-, если не указано иного),APCI+: m/z значения в масс-спектроскопии (APCI ионизации, представленное (М+Н)+, если не указано иного),ЯМР:(м.д.) в 1 Н ЯМР в ДМСО-d6,ЯМР-А:(м.д.) в 1H ЯМР в ДМСО-d6 (с добавлением трифторуксусной кислоты),ЯМР-С:(м.д.) в 1 Н ЯМР в CDCl3,с: синглет (спектр),д: дублет (спектр),т: триплет (спектр),кв.: квартет (спектр),шир.: широкая линия (спектр) (например: шир. с),т.пл.: точка плавления (C).HCl в структурной формуле конкретного соединения по настоящему изобретению указывает, что соединение по примеру выделено в виде гидрохлорида. Далее, аналогично для соединения в виде фумарата, в виде оксалата, в виде сукцината. Более того, в случае, когда цифра предваряет HCl, она означает мольное соотношение соединения и хлористо-водородной кислоты. Например, 2HCl представляет собой дигидрохлорид. Далее, в соединении по примеру, в котором структурная формула фумаровой кислоты представлена вместе со структурной формулой соединения, "М", указанное под примером , указывает, что соединение по примеру выделено в виде монофумарата, "Н", указанное как таковое, указывает, что соединение по примеру выделено в виде гемифумарата, и "S", указанное как таковое, указывает, что соединение по примеру выделено в виде сесквифумарата. Также "Т" указывает, что соединение выделено в виде 0,75 фумарата. Далее, описания указанных "М", "Н" и "S" имеют те же значения в соединении по примеру, в котором структурная формула щавелевой кислоты представлена вместе со структурной формулой соединения, и в соединении по примеру, в котором структурная формула янтарной кислоты представлена вместе со структурной формулой соединения. Более того, для удобства концентрация моль/л изображается как M. Например, 1 M водный раствор гидроксида натрия обозначает 1 моль/л водный раствор гидроксида натрия. Препаративный пример 1. К раствору 27,11 г 3-хлор-о-ксилола в 300 мл тетрахлорида углерода добавляли 75 гN-бромсукцинимида и 0,81 г азаизобутиронитрила с последующим нагреванием и кипячением с обратным холодильником в течение 2 ч. Реакционную смесь промывали водой и насыщенным водным раствором гидрокарбоната натрия, органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении с получением 63,297 г 1,2-бис-(бромметил)-3-хлорбензола в виде маслянистого вещества красновато-оранжевого цвета. Препаративный пример 2. К раствору 9,5 г цианида натрия в 120 мл воды добавляли раствор 57,533 г 1,2-бис-(бромметил)-3 хлорбензола в 120 мл EtOH с последующим нагреванием и кипячением с обратным холодильником в течение 30 мин. Реакционную смесь выливали на лед, затем перемешивали и выпавший осадок собирали путем фильтрации с получением 32,941 г 2,2'-(3-хлор-1,2-фенилен)диацетонитрила в виде твердого вещества желтовато-коричневого цвета. Препаративный пример 3. К суспензии 32,94 г 2,2'-(3-хлор-1,2-фенилен)диацетонитрила в 100 мл уксусной кислоты добавляли по каплям 100 мл раствора смеси 33% бромистый водород-уксусная кислота в течение 1,5 ч, поддерживая внутреннюю температуру при 20C или ниже. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем в реакционную смесь добавляли диэтиловый эфир и ацетон. Полученное похожее на леденец твердое вещество темно-коричневого цвета и суспензию отделяли, суспензию концентрировали при пониженном давлении и похожее на леденец вещество измельчали в ацетоне с получением суспензии. Концентрированный остаток и ацетоновую суспензию объединяли и концентрировали при пониженном давлении и к остатку добавляли EtOAc, затем перемешивали. Твердый продукт собирали путем фильтрации. Полученный твердый продукт суспендировали в 400 мл воды, которую нагревали до 80C, и добавляли 31,2 г ацетата натрия, затем перемешивали при температуре 90C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и затем твердый продукт собирали путем фильтрации с получением 22,506 г 6-хлор-1 Н-3-бензазепин-2,4(3 Н,5 Н)диона в виде твердого вещества коричневого цвета. Препаративный пример 4. К раствору 22,5 г 6-хлор-1 Н-3-бензазепин-2,4(3 Н,5 Н)диона в 200 мл ТГФ добавляли по каплям 38 мл 10 М комплекса боран-диметилсульфид при температуре 0C в течение 20 мин, затем перемешивали в течение 2,5 ч. Реакционную смесь нагревали и кипятили с обратным холодильником и затем перемешивали. В реакционную смесь добавляли по каплям 30 мл MeOH при охлаждении льдом, затем перемешивали и далее добавляли по каплям 30 мл 4 М соляной кислоты с последующим нагреванием и кипячением с обратным холодильником в течение 1 ч после существенного ослабления образования пузырьков. Смесь подщелачивали путем добавления водного аммиака и 1 М водного раствора гидроксида натрия, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении, остаток растворяли в EtOH и добавляли активированный углерод с последующим нагреванием и кипячением с обратным холодильником и далее фильтровали на аминосиликагеле, фильтрат концентрировали при пониженном давлении. К раствору 18,7 г образовавшегося остатка в 180 мл дихлорметана добавляли 17 мл пиридина, затем охлаждали с помощью льда и добавляли по каплям 13 мл этил хлоркарбоната, затем перемешивали в течение 1,5 ч. Реакционную смесь концентрировали при пониженном давлении, остаток разбавляли с помощью EtOAc, затем промывали 1 М соляной кислотой и водой, сушили над безводным сульфатом натрия,затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 9,653 г этил 6 хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде маслянистого вещества рыжеватокоричневого цвета. Препаративный пример 5. Раствор 11,86 г этил 6-хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в 30 мл хлороформа охлаждали льдом и, поддерживая внутреннюю температуру 10C или ниже, добавляли 60 мл концентрированной серной кислоты. Затем добавляли по каплям 3,2 мл концентрированной азотной кислоты,далее перемешивали в течение 30 мин. Реакционную смесь выливали на лед, затем экстрагировали хлороформом, органический слой сушили над безводным сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: НЕХ-EtOAc) с получением 6,442 г этил 6-хлор-7-нитро-1,2,4,5-тетрагидро 3 Н-3-бензазепин-3-карбоксилата в виде вязкого вещества рыжевато-оранжевого цвета и 5,201 г этил 6-хлор-9-нитро-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого вещества бледножелтого цвета.EtOH, затем перемешивали при температуре 60C для растворения и добавляли 12,15 г восстановленного железа и 60 мл 1 М соляной кислоты с последующим нагреванием и кипячением с обратным холодильником в течение 1 ч. Реакционную смесь подщелачивали путем добавления 1 М водного раствора гидроксида натрия и затем фильтровали через целит, затем органический растворитель концентрировали при пониженном давлении. Остаток экстрагировали с помощью хлороформа, органический слой сушили над безводным сульфатом натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении с получением 5,743 г этил 7-амино-6-хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде вязкого вещества рыжевато-оранжевого цвета. Препаративный пример 7. К раствору 5,74 г этил 7-амино-6-хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в 100 мл дихлорметана добавляли порциями 3,9 г N-бромсукцинимида при охлаждении льдом, затем перемешивали в течение 40 мин. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 5,769 г этил 7-амино-8-бром-6-хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого вещества коричневого цвета. Препаративный пример 8. К раствору 4,37 г этил 7-амино-8-бром-6-хлор-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в 40 мл ДМФ добавляли 2,1 мл этилакрилата, 230 мг трис-о-толилфосфина, 85 мг ацетата палладия(II) и 3,6 мл триэтиламина, затем перемешивали при температуре 120C в течение 3 ч. Реакционную смесь разбавляли с помощью EtOAc, промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении. Полученный твердый продукт желтого цвета перемешивали и промывали диизопропилэтиловым эфиром с получением 3,125 г этил 7-амино-6-хлор-8-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в виде твердого вещества бледно-желтого цвета. Препаративный пример 9. К раствору 2,12 г этил 7-амино-6-хлор-8-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-1,2,4,5-тетрагидро 3 Н-3-бензазепин-3-карбоксилата в 20 мл хлороформа и 20 мл MeOH добавляли 65 мг оксида платины(IV), затем перемешивали в течение 20 ч при давлении 1 атм в атмосфере водорода. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением 2,256 г этил 11-хлор-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде твердого вещества молочно-белого цвета. Препаративный пример 10. К суспензии 1,403 г 11-хлор-1,3,4,6,7,8,9,10-октагидро-2 Н-азепино[4,5-g]хинолин-2-она в 15 мл диоксана добавляли 12 мл триэтиламина и 1,5 г ди-трет-бутилдикарбоната, затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 1,779 г трет-бутил 11-хлор-2-оксо-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин-8 карбоксилата в виде твердого вещества молочно-белого цвета. Препаративный пример 11. К раствору 1,772 г трет-бутил 11-хлор-2-оксо-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин 8-карбоксилата в 10 мл ТГФ добавляли 10,1 мл 1 М раствора комплекса боран-ТГФ в ТГФ при охлаждении льдом с последующим повышением температуры до комнатной и перемешиванием в течение 3 ч. В реакционную смесь добавляли по каплям 10 мл EtOH и после этого добавляли по каплям 10 мл 1 М водного раствора гидроксида натрия, затем перемешивали. Перемешиваемый раствор разбавляли водой,затем экстрагировали с помощью EtOAc. Органический слой сушили над безводным сульфатом натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 2,0707 г трет-бутил 11-хлор-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного вязкого вещества. Препаративный пример 12. К раствору 205 мг трет-бутил 11-хлор-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 3 мл ацетонитрила добавляли 0,077 мл 36% формалина, 58 мг цианборгидрида натрия и 0,5 мл уксусной кислоты, затем перемешивали при комнатной температуре. В реакционную смесь добавляли воду, затем экстрагировали с помощью EtOAc, органический слой сушили над безводным сульфатом натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 96 мг трет-бутил 11-хлор-1-метил-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин-8-карбоксилата в виде вязкого вещества оранжевого цвета. Препаративный пример 13. К раствору 193 мг трет-бутил 11-хлор-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 2 мл толуола добавляли 0,121 мл хлорангидрида изобутановой кислоты, затем перемешивали при температуре 60C. Реакционную смесь очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 80 мг трет-бутил 1-ацетил-11-хлор-1,2,3,4,6,7,9,10 октагидро-8H-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного твердого продукта. Препаративный пример 14. К раствору 1,75 г 2,3,4,5-тетрагидро-1 Н-3-бензазепина в 20 мл дихлорметана добавляли 2,884 мл пиридина. Реакционную смесь охлаждали льдом и добавляли по каплям 1,705 мл этилхлорформиата,растворенного в 5 мл дихлорметана, затем перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 2,15 г этил 1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата в виде маслянистого вещества бледно-желтого цвета. Препаративный пример 15. 287 мг этил 2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата растворяли в 5 мл ДМФ и, охлаждая на ледяной бане, добавляли 65 мг 60%-ного гидрида натрия, затем перемешивали в течение 1 ч. Добавляли 0,3 мл метилйодида, затем перемешивали при комнатной температуре в течение 3 ч. Далее добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали хлороформом. Растворитель концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 94 мг этил 1-метил-2 оксо-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного твердого продукта. Препаративный пример 16. К 5 г этил 2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата добавляли 40 мл этиленгликоля и 28 мл 4 М водного раствора гидроксида натрия, затем перемешивали при температуре 150C. После перемешивания в течение ночи реакционную смесь охлаждали льдом, затем подкисляли путем добавления концентрированной соляной кислоты и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и затем остаток подщелачивали путем добавления 1 М водного раствора гидроксида натрия, затем экстрагировали хлороформом. Растворитель концентрировали при пониженном давлении и затем полученный остаток темно-коричневого цвета растворяли в дихлорметане, затем добавляли 4 г ди-трет-бутил дикарбоната и 3,5 мл триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и концентрировали при пониженном давлении, остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: хлороформ-MeOH) с получением 3,39 г трет-бутил 2-оксо-1,2,3,4,6,7,9,10 октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 17. К раствору 250 мг трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 2,5 мл дихлорэтана добавляли 0,175 мл хлорангидрид изобутановой кислоты и 0,4 мл триэтиламина, затем повышали температуру до 60C и перемешивали в течение 30 мин. Реакционную смесь разбавляли с помощью EtOAc и промывали 1 M соляной кислотой, водой, 1 М водным раствором гидроксида натрия и насыщенным солевым раствором и растворитель концентрировали. К образовавшемуся остатку, охлаждая на ледяной бане, добавляли 2 мл ТГФ и 3,5 мл 1 М раствора комплекса боран-ТГФ в ТГФ, затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь охлаждали льдом и добавляли EtOH, затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали и образовавшийся остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc) с получением 213 мг трет-бутил 1-изобутил-1,2,3,4,6,7,9,10-октагидро-8 Назепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 18. К раствору 460 мг трет-бутил 11-бром-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 9 мл диоксана добавляли 1,6 мл 2 М водного раствора карбоната калия в атмосфере аргона и после этого 449 мг триметилбороксина и 70 мг тетракистрифенилфосфин палладия, затем перемешивали при температуре 90C в течение 13 ч. Реакционной смеси давали охладиться, фильтровали и затем концентрировали при пониженном давлении, образовавшийся остаток разбавляли с помощью EtOAc и органический слой промывали водой и насыщенным солевым раствором. Растворитель концентрировали при пониженном давлении и образовавшийся остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: HEX-EtOAc) с получением 380 мг трет-бутил 11-метил-1,2,3,4,6,7,9,10 октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 19. К раствору 670 мг трет-бутил 11-изопропенил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин 8-карбоксилата в 10 мл MeOH добавляли 200 мг палладия на углероде, затем перемешивали при комнатной температуре в течение 3,5 ч при нормальном давлении в атмосфере водорода. Затем после перемешивания в течение ночи под давлением 4,5 атм в атмосфере водорода реакционную смесь фильтровали через целит и растворитель концентрировали при пониженном давлении. Образовавшийся остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 512 мг трет-бутил 11-изопропил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 20. К раствору 140 мг трет-бутил 11-этил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 1,86 мл ацетонитрила добавляли 0,12 мл глицидилметилового эфира, затем насыщали аргоном. Охлаждая на ледяной бане, добавляли 9 мг трифторметансульфоната иттербия(III), затем перемешивали при комнатной температуре в течение 2 ч, далее повышали температуру до 50C и перемешивали в течение ночи. В реакционную смесь добавляли EtOAc и водный раствор бикарбоната натрия и органический слой промывали водой и насыщенным солевым раствором. Растворитель концентрировали при пониженном давлении и образовавшийся остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: HEX-EtOAc) с получением 147 мг трет-бутил 11-этил-1-(2-гидрокси-3 метоксипропил)-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 21. К раствору 215 мг трет-бутил 7-гидрокси-8-(тетрагидро-2 Н-пиран-4-иламино)-1,2,4,5-тетрагидро 3 Н-3-бензазепин-3-карбоксилата в 4 мл ДМФ добавляли 98 мг карбоната калия и 0,062 мл метил бромацетата, затем перемешивали при комнатной температуре в течение 6 ч. В реакционную смесь добавляли воду, затем дважды экстрагировали с помощью EtOAc. Объединенный органический слой три раза промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем фильтровали, растворитель концентрировали при пониженном давлении. К раствору 259 мг образовавшегося остатка в 7 мл EtOH добавляли 1,2 мл 1 М водного раствора гидроксида натрия, затем перемешивали при температуре 50C в течение ночи. Далее добавляли 1,2 мл 1 М водного раствора соляной кислоты при охлаждении льдом, затем дважды экстрагировали хлороформом и объединенный органический слой сушили над безводным сульфатом натрия и затем фильтровали. Растворитель концентрировали при пониженном давлении. К раствору 239 мг образовавшегося остатка в 4 мл ДМФ при комнатной температуре добавляли 120 мг гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 84 мгHOBt, затем перемешивали при комнатной температуре в течение ночи. Добавляли воду, затем дважды экстрагировали с помощью EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, затем фильтровали и растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 153 мг трет-бутил 3-оксо-4-(тетрагидро-2 Н-пиран-4-ил)3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества белого цвета. Препаративный пример 22. К раствору 828 мг трет-бутил 7-гидрокси-6-метил-8-нитро-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата в 25 мл ДМФ добавляли 0,268 мл метил бромацетата и 390 мг карбоната калия, затем перемешивали при температуре 55C в течение 13 ч. Реакционной смеси давали охладиться и добавляли воду,затем дважды экстрагировали с помощью EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, органический слой сушили над безводным сульфатом натрия и затем фильтровали, растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 1,076 г трет-бутил 7-(2-метокси-2-оксоэтокси)-6-метил-8-нитро-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого вещества желтовато-белого цвета. Препаративный пример 23. В смесь 967 мг трет-бутил 7-(2-метокси-2-оксоэтокси)-6-метил-8-нитро-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в 25 мл EtOH в атмосфере аргона добавляли 97 мг 10% палладия на углероде,затем перемешивали в течение 2 ч при нормальном давлении в атмосфере водорода. В реакционную смесь добавляли 200 мл ТГФ, затем удаляли катализатор с использованием целита и растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 629 мг трет-бутил 11-метил-3-оксо-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества белого цвета. Препаративный пример 24. К раствору 120 мг трет-бутил 2-метил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 4 мл ДМФ добавляли 0,026 мл метилйодида и 104 мг карбоната калия при комнатной температуре, затем перемешивали в течение 13 ч. В реакционную смесь добавляли 0,012 мл метилйодида и 26 мг карбоната калия с последующим дополнительным перемешиванием в течение 3 ч. В реакционную смесь добавляли воду, затем дважды экстрагировали с помощью EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем фильтровали, растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 55 мг третбутил 2,4-диметил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества коричневого цвета. Препаративный пример 25. К раствору 120 мг трет-бутил 2-метил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 4 мл ДМФ добавляли 0,113 мл изопропилйодида и 0,197 мл диизопропилэтиламина, затем перемешивали при температуре 100C в течение 6,5 ч. Далее в реакционную смесь добавляли 0,113 мл изопропилйодида и 0,197 мл диизопропилэтиламина, затем перемешивали при температуре 100C в течение 4 ч. Затем в реакционную смесь добавляли 0,226 мл изопропилйодида и 0,394 мл диизопропилэтиламина, затем перемешивали при температуре 100C в течение 19 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, затем дважды экстрагировали с помощью EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, органический слой сушили над безводным сульфатом натрия и затем фильтровали, растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc) с получением 90 мг трет-бутил 4-изопропил-2-метил-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества бледнокоричневого цвета. Препаративный пример 26. К раствору 130 мг трет-бутил 3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)карбоксилата в 4 мл дихлорметана при охлаждении льдом добавляли 0,036 мл метансульфонилхлорида и 0,089 мл диизопропилэтиламина, затем перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли 0,036 мл метансульфонилхлорида и 0,089 мл диизопропилэтиламина, затем перемешивали при комнатной температуре в течение еще 9 ч. В реакционную смесь добавляли воду, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и затем фильтровали, и растворитель концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 152 мг трет-бутил 4-(метилсульфонил)-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде бесцветного твердого продукта. Препаративный пример 27. В смесь 5 г боргидрида натрия и 30 мл безводного ТГФ при охлаждении льдом добавляли раствор 10,27 г 2-метил-3-нитрофенилуксусной кислоты в 60 мл безводного ТГФ и затем добавляли по каплям раствор 35 мл метансульфоновой кислоты в 10 мл безводного ТГФ. Реакционную смесь нагревали до 70C и затем перемешивали в течение 30 мин, затем добавляли при охлаждении льдом 80 мл 3 M соляной кислоты и затем перемешивали. Смешанную жидкость экстрагировали с помощью хлороформа и органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 9,701 г вязкого вещества оранжевого цвета. К раствору 9,53 г полученного вещества в 100 мл дихлорметана добавляли при охлаждении льдом по каплям 22 мл диизопропилэтиламина и 4,75 мл хлорметилметилового эфира, затем перемешивали в течение 24 ч. Добавляли 10 мл хлорметилметилового эфира с последующим дополнительным перемешиванием в течение 24 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 11,26 г маслянистого вещества желтого цвета. К раствору 11,26 г полученного вещества в 200 мл EtOH добавляли 340 мг диоксида платины(IV), затем перемешивали при комнатной температуре в течение 1 ч в атмосфере водорода под давлением 4 атм. Реакционную смесь удаляли с использованием целита и фильтрат концентрировали при пониженном давлении с получением 9,21 г вязкого вещества оранжевого цвета. К раствору остатка в 200 мл дихлорметана и 40 мл MeOH добавляли 14,2 г карбоната кальция и 36,5 г дихлорйодата бензилтриметиламмония, затем перемешивали при комнатной температуре в течение 13 ч. Нерастворимые продукты удаляли путем фильтрации и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 15,93 г 4,6-дийод-3-[2-(метоксиметокси)этил]-2-метиланилина в виде вязкого вещества темнокрасного цвета. Препаративный пример 28. В перемешиваемый раствор 400 мг ацетата палладия(II), 934 мг трифенилфосфина, 9,91 г тетрабутиламмоний хлорида и 7 г ацетата калия в 150 мл ДМФ добавляли раствор 15,93 г 4,6-дийод-3-[2(метоксиметокси)этил]-2-метиланилина в 150 мл ДМФ и добавляли 16 мл этилакрилата, затем перемешивали при температуре 80C в течение 3 ч. Реакционную смесь разбавляли с помощью EtOAc, промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 12,11 г твердого продукта желтого цвета. К раствору 12,11 г полученного продукта в 250 мл EtOH и 250 мл ТГФ добавляли 701 мг оксида платины(IV), затем перемешивали при комнатной температуре в течение 4 ч в атмосфере водорода под давлением 4 атм. Реакционную смесь удаляли с использованием целита и фильтрат концентрировали при пониженном давлении с получением 11,39 г этил 3-7-[2-(метоксиметокси)этил]-6-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-илпропаноата в виде твердого вещества молочно-белого цвета. Препаративный пример 29. К раствору 10,81 г этил 3-7-[2-(метоксиметокси)этил]-6-метил-2-оксо-1,2,3,4-тетрагидрохинолин 6-илпропаноата в 100 мл EtOH и 100 мл ТГФ добавляли 100 мл 1 М водного раствора гидроксида натрия, затем перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь нейтрализовали путем добавления соляной кислоты, затем концентрировали при пониженном давлении до 1/3 жидкого количества жидкости и остаток экстрагировали с помощью хлороформа. Органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. К раствору образовавшегося остатка в 300 мл трет-бутанола добавляли 90 мл триэтиламина и 70 мл DPPA с последующим нагреванием и кипячением с обратным холодильником в течение 24 ч. Реакционную смесь концентрировали при пониженном давлении, остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) и затем полученный твердый продукт промывали с помощью HEX с получением 8,006 г трет-бутил (2-7-[2-(метоксиметокси)этил]-8-метил-2-оксо 1,2,3,4 тетрагидрохинолин-6-илэтил)карбамата в виде твердого вещества молочно-белого цвета. Препаративный пример 30 К суспензии 1,01 г трет-бутил (2-7-[2(метоксиметокси)этил]-8-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-илэтил) карбамата в 10 мл ТГФ добавляли 10 мл 6 М соляной кислоты, затем перемешивали при температуре 50C в течение 1 ч. Реакционную смесь подщелачивали путем добавления гидроксида натрия и затем добавляли 675 мг ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 15 ч. Реакционную смесь экстрагировали с помощью хлороформа, и органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1,105 г трет-бутил 2-[7-(2-гидроксиэтил)-6-метил-2 оксо-1,2,3,4-тетрагидрохинолин-6-ил]этилкарбамата в виде пенистого вещества белого цвета. Препаративный пример 31 К раствору 1,793 г трет-бутил 2-[7-(2-гидроксиэтил)-6-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6 ил]этилкарбамата в 30 мл ТГФ добавляли 0,48 мл метансульфонилхлорида и 15 мл триэтиламина при охлаждении льдом, затем перемешивали в течение 30 мин. В реакционную смесь добавляли порциями 1,8 г трет-бутоксид калия при охлаждении льдом, затем перемешивали в течение 1,5 ч. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали с помощьюEtOAc. Органический слой сушили над безводным сульфатом магния и затем фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: HEX-EtOAc) с получением 1,06 г трет-бутил 11-метил-2-оксо 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде пенистого вещества белого цвета. Препаративный пример 32. К раствору 167 мг трет-бутил 11-метилоксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 2 мл дихлорметана добавляли 0,221 мл триэтиламина и 0,062 мл этилизоцианата, затем перемешивали при комнатной температуре в течение 15 ч. В реакционную смесь добавляли 3 мл толуола и 0,062 мл этилизоцианата с последующим нагреванием до температуры 60C и перемешивали в течение 15 ч. Затем реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 200 мг трет-бутил 1-(этилкарбамоил)-11-метил-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного вязкого вещества. Препаративный пример 33. К раствору 201 мг трет-бутил 11-метил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 2 мл пиридина добавляли 0,1 мл этилхлорформиата, затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 261 мг 8-трет-бутил 1-этил 11-метил-3,4,6,7,9,10-гексагидро-1 Н-азепино[4,5-g]хинолин 1,8(2 Н)дикарбоксилата в виде бесцветного вязкого вещества. Препаративный пример 34. К суспензии 2 г 3-(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)пропионовой кислоты в 40 мл трет-бутанола добавляли 2,1 мл DPPA и 2,6 мл триэтиламина с последующим нагреванием и кипячением с обратным холодильником при температуре 100C в течение 18 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH) с получением 1,832 г трет-бутил [2-(2-оксо-1,2,3,4-тетрагидрохинолин-7 ил)этил]карбамата в виде твердого продукта оранжевого цвета. Препаративный пример 35. В перемешиваемый раствор 770 мг трет-бутил [2-(1,2,3,4-тетрагидрохинолин-7-ил)этил]карбамата в 15 мл дихлорметана и 3 мл MeOH добавляли 420 мг карбоната кальция и 970 мг дихлорйодат бензилтриметиламмония, затем перемешивали при комнатной температуре в течение 2 ч. Нерастворимые продукты удаляли путем фильтрации и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 595 мг трет-бутил [2-(6-йод-1,2,3,4-тетрагидрохинолин-7-ил)этил]карбамата в виде вязкого вещества красновато-коричневого цвета. Препаративный пример 36. К раствору 595 мг трет-бутил [2-(6-йод-1,2,3,4-тетрагидрохинолин-7-ил)этил]карбамата в 3 мл дихлорметана добавляли 3 мл воды и 376 мг гидрокарбоната натрия и по каплям при охлаждении льдом добавляли раствор 0,273 мл бензил хлорформиата в 3 мл дихлорметана при перемешивании, затем перемешивали в течение еще 5 ч. Реакционную смесь экстрагировали с помощью EtOAc, органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении с получением 877 мг бензил 7-2-[(трет-бутоксикарбонил)амино]этил-6-йод-3,4 дигидрохинолин-1(2 Н)-карбоксилата в виде твердого продукта красновато-оранжевого цвета. Препаративный пример 37. К раствору 793 мг бензил 7-2-[(трет-бутоксикарбонил)амино]этил-6-йод-3,4-дигидрохинолин 1(2 Н)-карбоксилата в 10 мл ТГФ при охлаждении льдом добавляли по каплям 1,8 мл 1 М раствора бис-триметилсилиламида натрия в ТГФ, затем перемешивали в течение 5 мин. Далее добавляли 0,166 мл аллилбромида, затем перемешивали в течение 18 ч, при этом медленно повышали температуру до комнатной. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония и воду, затем экстрагировали с помощью EtOAc, органический слой сушили над безводным сульфатом магния и потом фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc) с получением 788 мг бензил 7-2-[аллил(трет-бутоксикарбонил)амино]этил-6-йод-3,4-дигидрохинолин-1(2 Н)-карбоксилата. Препаративный пример 38. К смеси 403 мг ацетата калия, 441 мг тетрабутиламмоний бромида, 9 мг трифенилфосфина и 4 мг ацетата палладия(II) добавляли раствор 788 мг бензил 7-2-[аллил(трет-бутоксикарбонил) амино]этил-6 йод-3,4-дигидрохинолин-1(2 Н)-карбоксилата в 25 мл ДМФ, затем насыщали аргоном и перемешивали при температуре 80C в течение 4 ч. Реакционную смесь разбавляли с помощью EtOAc, промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. К 25 мл раствора образовавшегося остатка в MeOH добавляли 36 мг оксида платины(IV), затем перемешивали при комнатной температуре в течение ночи в атмосфере водорода под давлением 4 атм. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением 570 мг 1-бензил 8-трет-бутил 6-метил-3,4,6,7,9,10-гексагидро-1 Н-азепино[4,5-g]хинолин-1,8(2 Н)дикарбоксилата в виде пенистого продукта оранжевого цвета. Препаративный пример 39. В перемешиваемый раствор 9,3 г хлорида алюминия в 30 мл дихлорметана при охлаждении льдом добавляли по каплям 1,6 мл ацетилхлорид, затем перемешивали. Затем добавляли раствор 5 г 7-метокси-1-метил-3-(трифторацетил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина в 70 мл дихлорметана, затем перемешивали в течение 13 ч при медленном повышении температуры до комнатной. Реакционную смесь охлаждали льдом и добавляли по каплям 30 мл 1 М соляной кислоты, затем добавляли воду и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем флэшхроматографии (элюирующий растворитель: HEX-EtOAc) с получением 5,137 г 1-[8-гидрокси-5-метил-3(трифторацетил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил]этанона в виде твердого вещества бледнокоричневого цвета. Препаративный пример 40. К суспензии 5,13 г 1-[8-гидрокси-5-метил-3-(трифторацетил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил]этанона в 50 мл MeOH добавляли 50 мл 1 М водного раствора гидроксида натрия, затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении до половинного количества и к остатку добавляли 50 мл диоксана и 4,27 г ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь нейтрализовали путем добавления 1 М соляной кислоты и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc) с получением 4,385 г трет-бутил 8-ацетил-7-гидрокси-1-метил-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в виде вязкого вещества желтого цвета. Препаративный пример 41. К раствору 1,715 г трет-бутил 8-ацетил-7-(2-этокси-2-оксоэтокси)-1-метил-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в 20 мл EtOH добавляли 325 мг гидрохлорида гидроксиламина с последующим нагреванием и кипячением с обратным холодильником в течение 3 ч. Добавляли 500 мг гидрохлорида гидроксиламина с последующим дополнительным нагреванием и кипячением с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфа- 15023039 том натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении. К 10 мл раствора образовавшегося остатка в ацетонитриле добавляли 24 мг хлоридангидрида циануровой кислоты и 33 мг хлорида цинка(II) с последующим нагреванием и кипячением с обратным холодильником в течение 12 ч. Реакционную смесь концентрировали при пониженном давлении. К образовавшемуся остатку добавляли 10 мл диоксана, 10 мл 1 М водного раствора гидроксида натрия и 1,2 г ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали при пониженном давлении до половинного количества, делали слабокислой путем добавления 1 М соляной кислоты и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. К образовавшемуся остатку добавляли 60 мл 17% водного раствора серной кислоты, затем перемешивали при температуре 100C в течение 1 ч. Реакционную смесь охлаждали льдом, подщелачивали путем добавления 15 г гидроксида натрия и добавляли 50 мл диоксана и 1,21 г ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Органический слой сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 735 мг трет-бутил 6-метил-3-оксо 3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества бледно-желтого цвета. Препаративный пример 42. К раствору 704 мг трет-бутил 6-метил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 15 мл дихлорметана добавляли порциями 438 мг N-бромсукцинимида при охлаждении льдом, затем перемешивали в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель:HEX-EtOAc) с получением 446 мг пенистого продукта бледно-желтого цвета. К смеси 445 мг полученного соединения, 144 мг циклопропилборной кислоты, 724 мг фосфата калия, 65 мг трициклогексилфосфина и 28 мг ацетата палладия(II) добавляли 10 мл толуола и 0,5 мл воды, затем перемешивали при температуре 110C в течение 12 ч. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 379 мг трет-бутил 5-циклопропил-6-метил-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде пенистого вещества бледнокоричневого цвета. Препаративный пример 334. К раствору 500 мг трет-бутил 3-оксо-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 10 мл ДМФ добавляли 250 мкл 1-(бромметил)-3-фторбензола и 800 мг карбоната цезия, затем перемешивали при температуре 50C в течение 16 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, затем дважды экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель упаривали и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 609 мг трет-бутил 4-(3-фторбензил)-3-оксо 3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата. Препаративный пример 339. К раствору 600 мг трет-бутил 2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 9 мл ДМФ добавляли 426 мг трет-бутоксида калия и 451 мкл бензилбромида, охлаждая на ледяной бане, затем перемешивали при комнатной температуре в течение 3 ч. Добавляли воду и этилацетат и органический слой концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 644 мг трет-бутил 1-бензил-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде твердого вещества бледно-желтого цвета. Препаративный пример 344. К раствору 3,83 г трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 40 мл дихлорметана добавляли 1,3 мл пиридина и 1,29 г трифосгена при охлаждении льдом, затем перемешивали в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, разбавляли этилацетатом, промывали водой и водным раствором хлорида аммония, сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. К остатку добавляли гексан, затем перемешивали и твердый продукт собирали путем фильтрации и сушили с получением 3,07 г трет-бутил 1-(хлоркарбонил)-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в виде твердого вещества белого цвета. Препаративный пример 345. К раствору 200 мг трет-бутил 1-(хлоркарбонил)-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5g]хинолин-8-карбоксилата в 2 мл пиридина добавляли 140 мкл фенетилового спирта, затем перемешивали при температуре 100C в течение 5,5 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 68 мг 8-трет-бутил 1-(2-фенилэтил) 3,4,6,7,9,10-гексагидро-1 Н-азепино[4,5-g]хинолин 1,8(2 Н)-карбоксилата в виде вязкого вещества желтого цвета. Препаративный пример 349. К раствору 200 мг трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата и 318 мг 2-(2-метоксифенил)этил 4-нитрофенилкарбоната в 5 мл дихлорэтана добавляли 0,11 мл пиридина, затем перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (элюирующий растворитель: HEX-EtOAc) и хроматографией на основном силикагеле (элюирующий растворитель:HEX-EtOAc) с получением 243 мг 8-трет-бутил 1-[2-(метоксифенил)этил]-3,4,6,7,9,10-гексагидро-1 Назепино[4,5-g]хинолин-1,8(2 Н)-карбоксилата в виде вязкого вещества бледно-желтого цвета. Препаративный пример 367. К раствору 150 мг трет-бутил 11-хлор-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 3 мл тетрагидрофурана добавляли 1,5 мл 1 М водного раствора гидрокарбоната натрия, затем охлаждали с помощью льда и добавляли по каплям 64 мкл этилхлорформиата, затем перемешивали. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc) с получением 149 мг 8-трет-бутил 4-этил-11-хлор-2,3,6,7,9,10 гексагидро[1,4]оксазино[2,3-g] [3]бензазепин-4,8-дикарбоксилата в виде бесцветного пенистого вещества. Препаративный пример 375. К 500 мг трет-бутил 11-бром-1-метил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата, 350 мг карбоната калия, 290 мг йодида меди, 173 мг 1 Н-пиразола и 313 мгN,N-диметилглицина добавляли 6,25 мл диметилсульфоксида в атмосфере аргона, затем перемешивали при температуре 135C в течение 36 ч. В реакционную смесь добавляли воду и этилацетат, затем перемешивали и далее твердый продукт отделяли путем фильтрации. Органический слой промывали водным раствором бикарбоната натрия и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 43 мг трет-бутил 1-метил-11-(1 Н-пиразол-1-ил)-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветной вязкой жидкости. Препаративный пример 376. Раствор 200 мг трет-бутил 11-бром-1-(2-метоксиэтил)1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5g]хинолин-8-карбоксилата, 34 мг цианида цинка, 13 мг бис-(три-трет-бутилфосфин)палладия и 10 мг порошка цинка в 4 мл ДМФ насыщали аргоном и затем перемешивали при температуре 100C в течение 15 ч. Реакционную смесь очищали путем хроматографии на силикагеле (элюирующий растворитель:HEX-EtOAc) с получением 132 мг трет-бутил 11-циано-1-(2-метоксиэтил)-1,2,3,4,6,7,9,10-октагидро-8 Назепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного вязкого вещества. Препаративный пример 377. 1,1946 г 1-[11-бром-1-(2-метоксиэтил)-1,2,3,4,6,7, 9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-ил]2,2,2-трифторэтанона, 2,2395 г трифторацетата натрия и 1,568 г йодида меди добавляли к 24 млN-метилпирролидона в атмосфере аргона, затем перемешивали при температуре 170C в течение 18 ч. В реакционную смесь добавляли воду и этилацетат и осуществляли фильтрование через целит. Фильтрат подвергали жидкофазному разделению, органический слой промывали насыщенным солевым раствором,сушили над безводным сульфатом магния и затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель:Hex-AcOEt) с получением 239 мг 2,2,2-трифтор-1-[1-(2-метоксиэтил)-11-(трифторметил)-1,2,3,4,6,7,9,10 октагидро-8H-азепино[4,5-g]хинолин-8-ил]этанона в виде твердого вещества бледно-желтого цвета. Препаративный пример 379. К 7,87 г 3-(6-йод-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)пропановой кислоты добавляли 25 мл трет-бутанола, 1,1 мл триэтиламина и 0,83 мл дифенилфосфорил азида с последующим нагреванием и кипячением с обратным холодильником в течение 70 ч. Реакционную смесь охлаждали до комнатной температуры, затем разбавляли путем добавления воды и перемешивали и твердый продукт собирали путем фильтрации и сушили с получением 1,40 г трет-бутил [2-(6-йод-2-оксо-1,2,3,4-тетрагидрохинолин 7-ил)этил]карбамата в виде твердого вещества бледно-коричневого цвета. Затем твердый продукт, выпавший в осадок из фильтрата, собирали путем фильтрации с получением 665 мг трет-бутил [2-(6-йод-2 оксо-1,2,3,4-тетрагидрохинолин-7-ил)этил]карбамата в виде твердого вещества белого цвета. Препаративный пример 380. 168 мг трет-бутил 1-[(бензилокси)метил]-6-метил-2-оксо-1,2,3,4,6,7,9,10-октагидро-8H-азепино[4,5g]хинолин-8-карбоксилата перемешивали при комнатной температуре в течение 3,5 ч в 48% водном растворе бромисто-водородной кислоты. Реакционную смесь экстрагировали с помощью гексана и побочный продукт, бензилбромид, удаляли. Затем водный слой подщелачивали путем добавления 1 М водного раствора гидроксида натрия и добавляли 20 мл тетрагидрофурана. К перемешиваемой жидкости добав- 17023039 ляли 500 мг ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь экстрагировали с помощью этилацетата и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и далее фильтровали. Фильтрат концентрировали при пониженном давлении с получением 513 мг трет-бутил 6-метил-2-оксо-1,2,3,4,6,7,9,10 октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в виде бесцветного пенистого вещества. Препаративный пример 381. В атмосфере аргона к раствору 1,7 г этил 7-бром-8-гидрокси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата в 30 мл ДМФ добавляли 283 мг гидрида натрия при охлаждении льдом, затем перемешивали при той же температуре в течение 10 мин. Затем добавляли 1,54 г трет-бутил (4R)-4-метил-1,2,3 оксатиазолидин-3-карбоксилата, потом перемешивали при комнатной температуре в течение 18 ч. В реакционную смесь последовательно добавляли воду и 1 М водный раствор соляной кислоты, затем перемешивали и выпавший осадок собирали путем фильтрации. К 20 мл суспензии полученного твердого продукта в этаноле добавляли 10 мл раствор 4 М соляная кислота-этилацетат при охлаждении льдом,затем перемешивали при температуре 60C в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли хлороформ и насыщенный водный раствор бикарбоната натрия. После экстракции хлороформом объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением 2,26 г этил 7-[(2R)-2-аминопропил]окси-8-бром-1,2,4,5-тетрагидро-3 Н 3-бензазепин-3-карбоксилата в виде непрозрачного маслянистого вещества кремового цвета. Препаративный пример 383. В атмосфере аргона к раствору 1,64 г этил 7-[(2R)-2-аминопропил]окси-8-бром-1,2,4,5 тетрагидро-3 Н-3-бензазепин-3-карбоксилата в 41 мл толуола добавляли 509 мг трет-бутоксида натрия,275 мг 2,2'-бис-(дифенилфосфино)-1,1'-бинафтила и 202 мг трис-(дибензилиденацетон)дипалладия (0), в таком порядке, с последующим нагреванием при температуре 100C в течение 24 ч. Затем добавляли 509 мг трет-бутоксида натрия, 275 мг 2,2'-бис-(дифенилфосфино)-1,1'-бинафтила и 202 мг трис-(дибензилиденацетон)дипалладия(0), потом перемешивали при температуре 100C в течение еще 24 ч. Реакционную смесь охлаждали вновь до комнатной температуры, затем фильтровали через целит и промывали этилацетатом и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: Нех-AcOEt) с получением 610 мг этил(3R)-3-метил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата. Препаративный пример 385. В атмосфере аргона к раствору 1,032 г этил 7-[(3-метилбут-2-еноил)амино]-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в 10,5 мл дихлорметана при комнатной температуре добавляли 870 мг хлорида алюминия, затем перемешивали при комнатной температуре в течение 3 ч. Далее добавляли 435 мг хлорида алюминия, затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали на смесь лед-вода, затем экстрагировали хлороформом. Объединенный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: Hex-AcOEt) с получением 431 мг этил 4,4-диметил-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Назепино[4,5-g]хинолин-8-карбоксилата в виде твердого вещества белого цвета. Препаративный пример 386. В атмосфере аргона к раствору 1 г этил 7-амино-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата и 539 мг 1,1-диметилпроп-2-ин-1-ил ацетата в 10 мл тетрагидрофурана добавляли 43 мг хлорида меди с последующим нагреванием при температуре 90C в течение 5 ч. Реакционную смесь концентрировали при пониженном давлении, добавляли этилацетат и промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором. Водный слой дважды экстрагировали с помощью этилацетата, объединенный органический слой промывали насыщенным солевым раствором,сушили над безводным сульфатом магния и затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью препаративной тонкослойной хроматографии с получением 272 мг этил 2,2-диметил-1,2,6,7,9,10-гексагидро-8H-азепин[4,5-g]хинолин-8-карбоксилата. Препаративный пример 387. К этил 7-амино-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилату добавляли 5%-ный водный раствор серной кислоты, затем перемешивали при охлаждении льдом. Добавляли по каплям водный раствор(30 мл) 10,22 г нитрита натрия порциями и затем перемешивали при той же температуре в течение 0,5 ч и затем перемешивали при температуре 60C в течение 3 ч. Реакционную смесь экстрагировали с помощью этилацетата, органический слой сушили над безводным сульфатом магния и затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: HEX-EtOAc) с получением сырого очищенного продукта, содержащего в качестве основного компонента этил 7-гидрокси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат. Сырой очищенный продукт дважды перекристаллизовывали из этилацетата с получением 15,66 г этил 7-гидрокси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата. Препаративный пример 388. К раствору 30 г этил 7-нитро-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в 300 мл этанола добавляли 3 г 10%-ого палладия на углероде, затем перемешивали при комнатной температуре в течение 16 ч в атмосфере водорода под давлением 4 атм. Реакционную смесь фильтровали через целит и фильтрат охлаждали льдом и затем добавляли по каплям 21,6 мл безводной уксусной кислоты, затем перемешивали в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли диэтиловый эфир для промывки твердого продукта, получая таким образом 26,45 г этил 7-ацетамид-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого вещества белого цвета. Препаративный пример 389. Перемешиваемый раствор 12 г этил 7-ацетамид-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3 карбоксилата, 1,93 г йодида меди, 1,89 г 1,10-фенантролина и 33,12 г карбоната цезия в 240 мл диоксана насыщали аргоном, затем перемешивали при температуре 100C в течение 18 ч. Реакционную смесь разбавляли этилацетатом, нерастворимые продукты удаляли с использованием целита и фильтрат концентрировали при пониженном давлении с получением твердого продукта молочно-белого цвета. Образовавшийся остаток суспендировали в 240 мл диоксана и добавляли 1,93 г йодида меди, 1,89 г 1,10-фенантролина и 33,1 г карбоната цезия, затем перемешивали при температуре 100C в течение 3 дней. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит для удаления твердого продукта и фильтрат концентрировали при пониженном давлении с получением 9,245 г этил 2-метил-5,6,8,9-тетрагидро-7 Н-[1,3]оксазоло[4,5-h][3]бензазепин-7 карбоксилата в виде твердого вещества молочно-белого цвета. Препаративный пример 390. К раствору 7 г этил 2-метил-5,6,8,9-тетрагидро-7 Н-[1,3]оксазоло[4,5-h][3]бензазепин-7 карбоксилата в 130 мл этанола добавляли 130 мл 1 М водного раствора соляной кислоты, затем перемешивали в течение 16 ч. Этанол концентрировали при пониженном давлении, сушили, растворяли в хлороформе и промывали водой. Органический слой сушили над безводным сульфатом натрия и затем растворитель концентрировали при пониженном давлении с получением 6,84 г этил 7-ацетамид-8-гидрокси 1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого продукта коричневато-белого цвета. Препаративный пример 408. К раствору 860 мг трет-бутил 4-этил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин 8(2 Н)-карбоксилата в 2 5 мл дихлорметана добавляли 1,1 г гидрокарбоната натрия и далее в течение около 30 мин добавляли по каплям раствор 200 мкл брома в 5 мл дихлорметана, затем перемешивали при комнатной температуре. В реакционную смесь медленно добавляли 3%-ный водный раствор тиосульфата натрия, затем энергично перемешивали и дважды экстрагировали хлороформом. Объединенный органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель упаривали и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 490 мг трет-бутил 5-бром-4-этил-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата. Препаративный пример 409. В атмосфере аргона в перемешиваемый раствор 5,0 г этил 7-гидрокси-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-карбоксилата в 100 мл дихлорметана и 20 мл метанола при охлаждении льдом добавляли порциями 8,05 г трибромида N,N,N-триметиланилиния, затем перемешивали при той же температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, остаток экстрагировали путем добавления этилацетата и воды и органический слой промывали 1 н. водным раствором соляной кислоты и насыщенным солевым раствором, сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении с получением 6,67 г этил 7-бром-8 гидрокси-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилата в виде твердого продукта бежевого цвета. Препаративный пример 411. К раствору трет-бутил 1-(3-метоксипропил)-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5g]хинолин-8-карбоксилата в 4,2 мл ацетонитрила добавляли 107 мг N-бромсукцинимида и 3,7 мг нитрата аммония, затем перемешивали при комнатной температуре в течение 3,5 ч. Реакционную смесь концентрировали до 1/4 и добавляли этилацетат, водный раствор тиосульфата натрия и водный раствор бикарбоната натрия. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом магния. Растворитель упаривали с получением 198 мг трет-бутил 11-бром-1-(3 метоксипропил)-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата. Препаративный пример 426. К раствору этил 3-(6-йод-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)пропаноата в 200 мл этанола добавляли 150 мл 1 М водного раствора гидроксида натрия, затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь делали слабокислой путем добавления по каплям концентрированной соляной кислоты и разбавляли путем добавления воды. Выпавший осадок собирали путем фильтрации и сушили с получением 8,88 г 3-(6-йод-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)пропановой кислоты в виде твердого вещества бледно-коричневого цвета. Препаративный пример 427. К 3,421 г этил 8-ацетамид-6-бром-7-(2-этокси-2-оксоэтокси)-1,2,4,5-тетрагидро-3 Н-бензазепин-3 карбоксилата добавляли 30 мл уксусной кислоты и 30 мл 8 М соляной кислоты, затем перемешивали при температуре 150C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в 35 мл ТГФ и подщелачивали путем добавления 35 мл 1 M водного раствора гидроксида натрия. Добавляли 2 г ди-трет-бутил дикарбоната, затем перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали с помощью этилацетата, органический слой сушили над безводным сульфатом магния и затем фильтровали, и фильтрат концентрировали при пониженном давлении с получением 1,373 г трет-бутил 11-бром-3-оксо-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3h][3]бензазепин-8(2 Н)-карбоксилата. Препаративный пример 495. К раствору 590 мг трет-бутил 4-бензил-3-оксо-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3h][3]бензазепин-8(2 Н)-карбоксилата в 10 мл тетрагидрофурана при охлаждении льдом добавляли 3,5 мл 1 М раствора комплекса боран-ТГФ в ТГФ, затем перемешивали при комнатной температуре в течение 14 ч. Реакционную смесь охлаждали и добавляли MeOH и 1 М водный раствор гидроксида натрия, затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали, к остатку добавляли этилацетат и воду и органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали и к раствору 578 мг образовавшегося остатка в 10 мл дихлорметана добавляли 620 мг гидрокарбоната натрия. Далее в течение около 30 мин добавляли по каплям раствор 280 мг брома в 5 мл дихлорметана, затем перемешивали при комнатной температуре. В реакционную смесь медленно добавляли 3% водный раствор тиосульфата натрия, затем энергично перемешивали и дважды экстрагировали хлороформом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 518 мг трет-бутил 4-бензил-5 бром-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата. Препаративный пример 540. К раствору 1,10 г 2,4,5-трифторбензонитрила и 500 мг трет-бутил 5-циклопропил-4-(2 гидроксиэтил)-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в 15 мл ТГФ добавляли порциями 150 мг трет-бутоксида калия, затем перемешивали при температуре -30C в течение 2 ч. Далее в реакционную смесь добавляли 0,15 мл MeOH и затем добавляли порциями 150 мг трет-бутоксида калия, затем повышали температуру до -10C и перемешивали в течение 15 ч. Далее в реакционную смесь добавляли 0,15 мл MeOH и затем добавляли порциями 150 мг трет-бутоксида калия,после чего повышали температуру до 0C и перемешивали в течение еще 14 ч. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и затем фильтровали, фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc с получением 726 мг трет-бутил 4-[2-(4-циано-2-фтор-5-метоксифенил)этил]-5-циклопропил-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде бесцветного вязкого вещества. Препаративный пример 543. К раствору 270 мг трет-бутил 5-циклопропил-4-[2-(2,6-дифтор-4-формилфенокси)этил]-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в 6 мл MeOH добавляли 30 мг боргидрида натрия, затем перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc с получением 220 мг трет-бутил 5-циклопропил-4-2-[2,6-дифтор-4(гидроксиметил)фенокси]этил-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)карбоксилата в виде твердого вещества белого цвета. Препаративный пример 545. К раствору 400 мг трет-бутил 5-циклопропил-4-(2-гидроксиэтил)-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h] [3]бензазепин-8(2 Н)-карбоксилата в 4 мл дихлорметана добавляли 217 мг п-толуолсульфонил хлорида, 0,22 мл триэтиламина и 12 5 мкл N-метилимидазола в таком порядке, затем перемешивали в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 541 мг трет-бутил 5-циклопропил-4-(2-[(4-метилфенил)сульфонил]оксиэтил)-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде твердого вещества белого цвета. Препаративный пример 549. К 400 мг трет-бутил 5-циклопропил-4-[(2R)-2-метокси-3-[(4-метилфенил)сульфонил]оксипропил]-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата добавляли 7 мл 1 М раствора фторида трет-бутиламмония в ТГФ с последующим нагреванием и перемешиванием при температуре 60C в течение 13 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор гидрокарбоната натрия, затем дважды экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия и затем фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 257 мг трет-бутил 5-циклопропил-4-[(2R)-3-фтор-2-метоксипропил]-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2H)-карбоксилата в виде пенистого твердого продукта белого цвета. Препаративный пример 565. К раствору 300 мг трет-бутил 5-циклопропил-4-(2-гидрокси-3-метоксипропил)-3,4,6,7,9,10 гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в 3 мл толуола добавляли 0,1 мл о-фторфенола и 250 мг цианометилентрибутилфосфорана, затем перемешивали при температуре 80C в течение 20 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc) с получением 277 мг трет-бутил 5-циклопропил-4-[2-(2-фторфенокси)-3-метоксипропил]-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3-h][3]бензазепин-8(2 Н)-карбоксилата в виде вязкого вещества бледно-желтого цвета. Тем же способом, что и способами по препаративным примерам выше, были получены соединения препаративных примеров, как показано в таблице ниже. Для соединений по препаративным примерам структуры показаны в табл. 2-81, а способы получения и физико-химические данные представлены в табл. 82-96. Пример 1. К 1,865 г этил 1-метил-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилату добавляли 20 мл этиленгликоля и 20 мл 40%-ного водного раствора гидроксида калия с последующим нагреванием до температуры 120C в течение 18 ч. Реакционную смесь охлаждали льдом и устанавливали рН равным 1 путем добавления концентрированной соляной кислоты, затем перемешивали в течение 1 ч. Реакционную смесь подщелачивали путем добавления 1 М водного раствора гидроксида натрия, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и после этого фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1,451 г 11-хлор-1,3,4,6,7,8,9,10-октагидро-2 Н-азепино[4,5-g]хинолин-2-она в виде твердого вещества коричневого цвета. К 60 мг 11-хлор-1,3,4,6,7,8,9,10-октагидро-2 Н-азепино[4,5-g]хинолин-2-она добавляли 1 млEtOAc и затем EtOH, далее растворяли при нагревании. Выпавший осадок собирали путем фильтрации с получением 29,5 мг 11-хлор-1,3,4,6,7,8,9,10-октагидро-2 Н-азепино[4,5-g]хинолин-2-она в виде твердого вещества белого цвета. Пример 2. К 47 мг трет-бутил 11-хлор-1-изобутил-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата добавляли 1 мл 4 М раствор хлористого водорода в EtOAc, затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH). 26 мг полученного вязкого вещества бледно-желтого цвета растворяли в EtOH, затем добавляли 10,3 мг фумаровой кислоты и перемешивали. Выпавший осадок собирали путем фильтрации с получением 23,2 мг монофумарата 11-хлор-1-изобутил-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолина в виде твердого вещества белого цвета. Пример 3. К раствору 200 мг трет-бутил 2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8 карбоксилата в 2 мл ТГФ при охлаждении льдом добавляли 1,9 мл 1 М раствора комплекса боран-ТГФ в ТГФ, затем повышали температуру до комнатной и перемешивали в течение 6 ч, после этого повышали температуру до 45C. После перемешивания в течение 3 ч добавляли 1,9 мл 1 М раствора комплекса боран-ТГФ в ТГФ, охлаждая на ледяной бане. Спустя еще 2 ч добавляли по каплям MeOH, затем перемешивали в течение 20 мин. Перемешиваемый раствор разбавляли водой, далее экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в 1,6 мл дихлорметана и добавляли 0,4 мл трифторуксусной кислоты, затем перемешивали при комнатной температуре в течение 1 ч и после этого концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле(элюирующий растворитель: НЕХ-EtOAc) и полученный твердый продукт растворяли в 0,25 мл горячегоEtOH, затем добавляли 21 мг фумаровой кислоты. При перемешивании полученный раствор охлаждали до комнатной температуры и выпавший осадок фильтровали с получением 36 мг монофумарата 2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолина в виде твердого вещества бледно-желтого цвета. Пример 4. К 150 мг этил 1-метил-2-оксо-1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата добавляли 4 мл этиленгликоля и 2 мл 40% водного раствора гидроксида калия с последующим нагреванием при температуре 120C и перемешиванием в течение 18 ч. Реакционную смесь охлаждали льдом и жидкость подкисляли путем добавления концентрированной соляной кислоты, затем перемешивали в течение еще 1 ч. Реакционную смесь нейтрализовали с помощью 1 M водного раствора гидроксида натрия и далее экстрагировали хлороформом, органический слой сушили над безводным сульфатом натрия и затем фильтровали, фильтрат концентрировали при пониженном давлении. После этого остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH-водный рас- 21023039 твор аммиака). К раствору образовавшегося остатка в 2 мл EtOAc добавляли 0,2 мл 4 М раствор хлористого водорода в EtOAc, затем перемешивали. Растворитель концентрировали при пониженном давлении и полученный твердый продукт растворяли в 2 мл EtOH при нагревании, затем перемешивали при комнатной температуре. Выпавший осадок собирали путем фильтрации с получением 43,7 мг моногидрохлорида 1-метил-1,3,4,6,7,8,9,10-октагидро-2 Н-азепино[4,5-g]хинолин-2-она в виде твердого вещества бледно-желтого цвета. Пример 5. К раствору 140 мг трет-бутил 11-циклопропил-1-(метоксиацетил)-1,2,3,4,6,7,9,10-октагидро-8 Назепино[4,5-g]хинолин-8-карбоксилата в 1 мл EtOH добавляли 2 мл 4 М раствора хлористого водорода вEtOAc, затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в 1 М водный раствор гидроксида натрия, водный слой экстрагировали с помощью хлороформа и органический слой сушили над сульфатом натрия. Растворитель концентрировали при пониженном давлении и образовавшийся остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH-водный раствор аммиака) с получением 102 мг 11-циклопропил-1-(метоксиацетил)2,3,4,6,7,8,9,10-октагидро-8 Н-азепино[4,5-g]хинолина в виде маслянистого вещества бледно-желтого цвета. Пример 6. К раствору 200 мг трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 2,13 мл дихлорэтана добавляли 0,553 мл триэтиламина и 0,19 мл этилхлорформиата, затем перемешивали при температуре 60C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и далее реакционную смесь разбавляли с помощью EtOAc, промывали 1 М соляной кислотой, водой, 1 M водным раствором гидроксида натрия и насыщенным солевым раствором, концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc). Полученный продукт растворяли в хлороформе, затем добавляли 0,005 мл трифторуксусной кислоты и перемешивали в течение 30 мин. После концентрирования при пониженном давлении полученный продукт растворяли в EtOH, нейтрализовали путем добавления триэтиламина и затем концентрировали при пониженном давлении. Далее остаток очищали с помощью колоночной хроматографии на силикагеле(элюирующий растворитель: хлороформ-MeOH-водный раствор аммиака). Полученный продукт растворяли в EtOH и добавляли 76 мг фумаровой кислоты. Полученный твердый продукт белого цвета собирали путем фильтрации и сушили с получением 79 мг гемифумарата этил 2,3,4,6,7,8,9,10-октагидро-1 Назепино[4,5-g]хинолин-1-карбоксилата. Пример 7. К раствору 300 мг трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 5,26 мл пиридина добавляли 0,455 мл N,N-диметилкарбамоил хлорида, затем перемешивали при температуре 80C в течение 3 ч. В реакционную смесь добавляли 1 M соляную кислоту, затем экстрагировали с помощью EtOAc. Органический слой промывали насыщенным солевым раствором и растворитель упаривали. Образовавшийся остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: НЕХ-EtOAc). Полученный продукт растворяли в 6 мл хлороформа, затем добавляли 3 мл трифторуксусной кислоты и перемешивали в течение 30 мин. После концентрирования при пониженном давлении полученный продукт растворяли в 4,5 мл EtOH, нейтрализовали путем добавления триэтиламина и затем концентрировали при пониженном давлении. После этого остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOHводный раствор аммиака). Полученный продукт растворяли в 4,5 мл EtOH и добавляли 115 мг фумаровой кислоты. Полученный твердый продукт белого цвета собирали путем фильтрации и сушили с получением 120 мг фумарата N,N-диметил-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолин-1-карбоксамида. Пример 8. К раствору 300 мг трет-бутил 1,2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 6 мл толуола добавляли 1,16 мл этилизоцианата, затем перемешивали при температуре 90C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и затем очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc). Полученный продукт растворяли в 7,5 мл хлороформа, затем добавляли 3 мл трифторуксусной кислоты и перемешивали в течение 30 мин. После концентрирования при пониженном давлении полученный продукт растворяли в 4,5 мл EtOH, нейтрализовали путем добавления триэтиламина и затем концентрировали при пониженном давлении. Затем остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH-водный раствор аммиака). Полученный продукт растворяли в EtOH и добавляли 115 мг фумаровой кислоты. Полученный твердый продукт белого цвета собирали путем фильтрации и сушили с получением 247 мг монофумарата N-этил-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5g]хинолин-1-карбоксамида. Пример 9. К раствору 200 мг трет-бутил 1, 2,3,4,6,7,9,10-октагидро-8 Н-азепино[4,5-g]хинолин-8-карбоксилата в 6 мл дихлорметана при охлаждении льдом добавляли 0,148 мл триэтиламина, 0,093 мл этансульфонилхлорида и 54 мг 1-метилимидазола, затем перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли EtOAc и насыщенный солевой раствор и органический слой промывали насыщенным солевым раствором и затем концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюирующий растворитель: HEX-EtOAc). Полученный продукт растворяли в 4 мл хлороформа, затем добавляли 2 мл трифторуксусной кислоты и перемешивали в течение 30 мин. После концентрирования при пониженном давлении полученный продукт растворяли в 4,5 мл EtOH, нейтрализовали путем добавления триэтиламина и затем концентрировали при пониженном давлении. Затем остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: хлороформ-MeOH-водный раствор аммиака). Полученный продукт растворяли в EtOH и добавляли 76 мг фумаровой кислоты. Полученный твердый продукт белого цвета собирали путем фильтрации и сушили с получением 61 мг монофумарата 1-(этилсульфонил)-2,3,4,6,7,8,9,10-октагидро-1 Назепино[4,5-g]хинолина. Пример 112. К раствору 283 мг трет-бутил 4-(3-хлорбензил)-3-оксо-3,4,6,7,9,10-гексагидро[1,4]оксазино[2,3h][3]бензазепин-8(2 Н)-карбоксилата в 1,8 мл тетрагидрофурана добавляли 1,46 мл 1 М раствора комплекса боран-ТГФ в ТГФ, затем перемешивали при температуре 50C в течение 4 ч. Реакционную смесь охлаждали льдом и добавляли MeOH, затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении и добавляли MeOH, затем вновь концентрировали. Остаток растворяли в 2,8 мл EtOH и добавляли 1 М соляную кислоту, затем перемешивали в течение ночи. После концентрирования при пониженном давлении полученный продукт растворяли в EtOH, нейтрализовали путем добавления полученного этиламина и концентрировали при пониженном давлении. Затем остаток очищали с помощью колоночной хроматографии на силикагеле (элюирующий растворитель: CHCl3-MeOH). Полученный продукт растворяли в этаноле и добавляли фумаровую кислоту, затем перемешивали в течение некоторого времени. Образовывался твердый продукт, далее его растворяли одноразовым нагреванием и перемешивали при комнатной температуре в течение 3 ч. Полученный твердый продукт белого цвета собирали путем фильтрации и сушили с получением 23 мг фумарата 4-(3-хлорбензил)-2,3,4,6,7,8,9,10-октагидро[1,4]оксазино[2,3-h][3]бензазепина. Пример 282. К раствору 606 мг трет-бутил 11-бром-1-(2-метоксиэтил)-10-метил-1,2,3,4,6,7,9,10-октагидро-8 Назепино[4,5-g]хинолин-8-карбоксилата в 6 мл дихлорметана добавляли 3 мл трифторуксусной кислоты,затем перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на основном силикагеле (элюирующий растворитель: CHCl3-MeOH). Собирали 150 мг образовавшегося остатка, отделяя с использованиемDAICEL CHIRALPAK AD-H (2 см 25 см) с получением 51 мг слабополярного вещества и 45 мг сильнополярного вещества. Каждое растворяли в этаноле и добавляли фумаровую кислоту для образования соли. Выпавший осадок перекристаллизовывали из этанола с получением 42 г и 36 мг энантиомеров фумарата 11-бром-1-(2-метоксиэтил)-10-метил-2,3,4,6,7,8,9,10-октагидро-1 Н-азепино[4,5-g]хинолина в виде твердых продуктов белого цвета соответственно. В этом отношении, хотя продукты показаны в таблицах ниже с одной пространственной структурой, что касается соединений по примеру 282, примеру 280 и примеру 281, получение которых проводилось, как в примере 282, каждый из двух видов энантиомеров были выделены и получены так же, как описано выше, но стереохимическая идентификация не проводилась. Тем же способом, что и в способах по примерам выше, были получены соединения по примерам,показанным в таблицах ниже. Структуры соединений по примерам представлены в табл. 97-147, а способы получения и физико-химические данные показаны в табл. 148-181. Более того, структуры других соединений по настоящему изобретению показаны в табл. 182-190. Они могут быть легко синтезированы способами, описанными в препаративных способах и примерах выше, способами, понятными специалисту в данной области, или их модифицированными способами.
МПК / Метки
МПК: A61P 15/10, A61P 43/00, A61K 31/55, C07D 487/04, C07D 498/04, A61P 3/04, A61P 13/02, A61P 13/00
Метки: применение, фармацевтическая, его, композиция, соединение, включающая, бензазепиновое
Код ссылки
<a href="https://eas.patents.su/30-23039-benzazepinovoe-soedinenie-farmacevticheskaya-kompoziciya-vklyuchayushhaya-ego-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Бензазепиновое соединение, фармацевтическая композиция, включающая его, и его применение</a>
Предыдущий патент: Соединения – ингибиторы фермента
Следующий патент: Ингибиторы киназ, регулирующих апоптозный сигнал
Случайный патент: Способ получения производных 2-оксо-1-пирролидина внутримолекулярным аллилированием