Бeнзимидазоловые ингибиторы респираторно-синцитиального вируса
Номер патента: 22972
Опубликовано: 31.03.2016
Авторы: Рабуассон Пьер Жан-Мари Бернар, Ху Лили, Йонкерс Тим Хьюго Мария, Демэн Самюэль Доминик, Коиманс Людвиг Поль, Вендевилль Сандрин Мари Элен, Тахри Абделлах
Формула / Реферат
1. Соединение, представленное формулой (I), его фармацевтически приемлемая соль присоединения кислот и оснований или стереохимический изомер
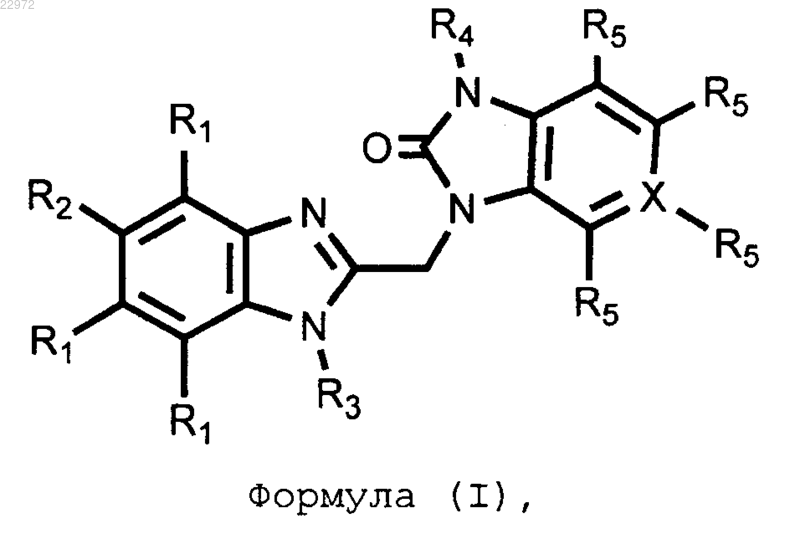
где X представляет собой С или N;
R1 представляет собой Н;
R2 выбран из группы, состоящей из Br и Cl;
R3 представляет собой -(CR6R7)n-R8;
R4 выбран из группы, состоящей из С3-С7циклоалкила, С2-С10алкенила, CH2CF3 или -SO2CH3;
R5 присутствует в том случае, когда X представляет собой С, где каждый R5 выбран независимо из группы, состоящей из Н, С1-С6алкила, C1-С6алкокси, галогена и CN;
R5 отсутствует, если X представляет собой N;
R6 и R7 независимо выбраны из H и C1-С10алкила, С3-С7циклоалкила или R6 и R7, взятые вместе, образуют 5- или 6-членное алифатическое или ароматическое кольцо, которое необязательно содержит один или несколько гетероатомов, выбранных из группы N, S, О;
R8 выбран из группы, состоящей из Н, ОН, CF3, CHF2, F, Cl, SO2CH3, SO2C3-С7циклоалкила, NR6SO2R6, SO2NR6R7, NR6SO2C3-С7циклоалкила, CN, NR6R7, COOH, COOR6, CONR6R7, ОСОС1-С6алкила, CONR6SO2R7, CONR6-SO2NR6R7, фталимида или 5- или 6-членного алифатического или ароматического кольца, которое необязательно содержит один или несколько гетероатомов, выбранных из группы N, S, О;
n представляет собой целое число со значением от 1 до 6.
2. Соединение по п.1, где R2 представляет собой Br.
3. Соединение по п.1, где R2 представляет собой Cl.
4. Соединение по любому из предшествующих пунктов, где R6 и R7 представляют собой Н.
5. Соединение по любому из предшествующих пунктов, где n составляет 2-4.
6. Соединение по любому из предшествующих пунктов, где R8 выбран из группы, состоящей из F, CN, ОН, CF3 и SO2CH3.
7. Соединение по любому из предшествующих пунктов, где R8 выбран из группы, состоящей из F, CN, ОН и SO2CH3.
8. Соединение по любому из предшествующих пунктов, где R4 представляет собой С3-С7циклоалкил или CH2CF3.
9. Соединение по любому из предшествующих пунктов, где R4 представляет собой циклопропил или CH2CF3.
10. Соединение по любому из предшествующих пунктов, где X представляет собой N.
11. Соединение по п.1, где соединение представляет собой
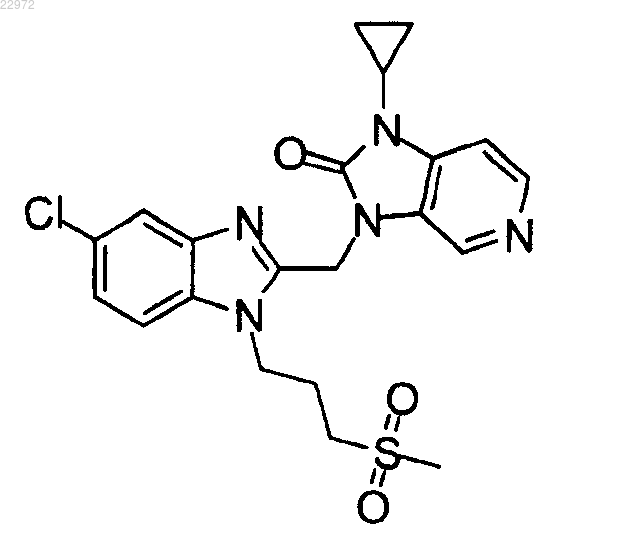
или его фармацевтически приемлемая соль присоединения кислот и оснований.
12. Соединение по п.11, где соединение представляет собой
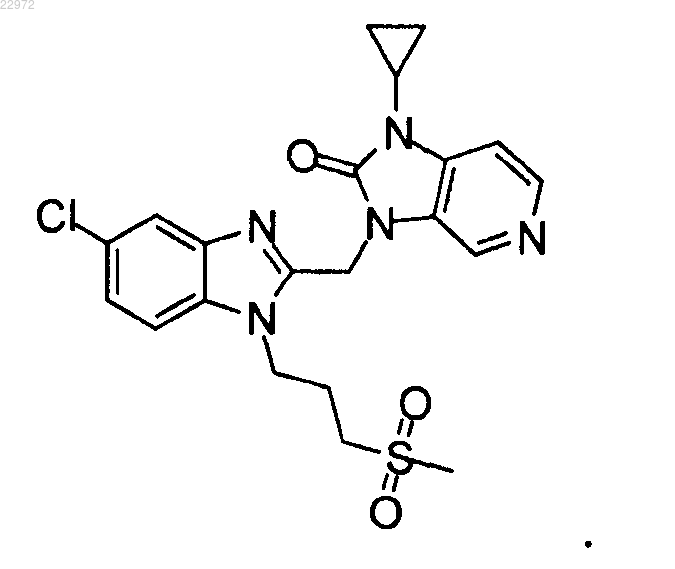
13. Лекарственное средство для ингибирования репликации респираторно-синцитиального вируса человека (RSV), содержащее терапевтически эффективное количество соединения по любому из пп.1-12.
14. Фармацевтическая композиция для ингибирования репликации RSV, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-12 в качестве активного соединения.
15. Способ получения фармацевтической композиции по п.14, где указанный способ включает непосредственное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения по любому из пп.1-12.
16. Применение соединения по любому из пп.1-12 для получения лекарственного средства для ингибирования репликации RSV.
Текст
В изобретении представлены бензимидазолы, обладающие ингибиторной активностью по отношению к репликации RSV, характеризующиеся формулой (I) Коиманс Людвиг Поль, Демэн Самюэль Доминик, Ху Лили, Йонкерс Тим Хьюго Мария, Рабуассон Пьер Жан-Мари Бернар, Тахри Абделлах,Вендевилль Сандрин Мари Элен (BE) их фармацевтически приемлемые соли присоединения кислот и оснований и стереохимические изомеры, композиции, содержащие эти соединения в качестве активного ингредиента, и способы получения этих соединений и композиций.(71)(73) Заявитель и патентовладелец: ЯНССЕН Ар ЭНД Ди АЙРЛЭНД (IE) Область техники, к которой относится изобретение Изобретение относится к бензимидазолам, обладающим противовирусной активностью, в частности обладающим ингибиторным воздействием на репликацию респираторно-синцитиального вируса(RSV). Изобретение также описывает получение этих бензимидазолов, композиции, содержащие эти соединения, и композиции для применения в лечении респираторно-синцитиальной инфекции. Уровень техникиRSV человека или респираторно-синцитиальный вирус представляет собой крупный РНК-вирус,который относится к семейству Paramyxoviridae и подсемейству Pneumoviridae наряду с бычьим вирусомRSV. RSV человека вызывает ряд заболеваний дыхательных путей у людей всех возрастов по всему миру. Он является основной причиной заболеваний нижних дыхательных путей в младенчестве и детстве. Более половины всех младенцев заражаются RSV на первом году жизни и почти все на протяжении первых двух лет жизни. У маленьких детей инфекция может вызывать повреждения легких, которые сохраняются в течение многих лет и могут позже приводить к хроническим заболеваниям легких (хронические хрипы, астма). Дети старшего возраста и взрослые часто страдают от (тяжелой) вирусной инфекции верхних дыхательных путей, вызванной заражением RSV. В пожилом возрасте восприимчивость к вирусу снова возрастает, и RSV бывает вовлечен в ряд вспышек пневмонии у пожилых людей, которые вносят существенный вклад в смертность. Инфицирование вирусом определенной подгруппы не защищает от последующего инфицированияRSV-изолятом той же подгруппы в следующий зимний сезон. Повторное инфицирование RSV, таким образом, является распространенным, несмотря на существование всего двух подтипов А и В. На сегодняшний день для применения против инфекции RSV одобрены только три лекарственных средства. Первое представляет собой рибавирин, нуклеозидный аналог, который предусматривает аэрозольное лечение тяжелой инфекции RSV у госпитализированных детей. Аэрозольный способ введения,токсичность (риск тератогенности), высокая стоимость и сильно варьирующая эффективность ограничивают его применение. Два других лекарственных средства RespiGam (RSV-IG) и Synagis (паливизумаб), иммуностимуляторы поликлональных и моноклональных антител, предназначены для применения в качестве профилактических средств. Оба лекарственных средства являются очень дорогостоящими и требуют парентерального введения. Другие попытки разработать безопасную и эффективную вакцину против RSV до настоящего времени оканчивались неудачей. Инактивированные вакцины не защищали от заболевания и в некоторых случаях даже усиливали заболевание во время последующей инфекции. Испытания живых аттенуированных вакцин не имели заметного успеха. Очевидно, что существует необходимость в эффективном,нетоксичном и легком для введения лекарственном средстве против репликации RSV. Особенно предпочтительным является предоставление лекарственных средств против репликации RSV, которые можно вводить перорально. Ссылка на бензимидазоловые противовирусные средства представляет собой WO 01/95910. В этом документе представлены соединения с противовирусной активностью со значениями ЕС 50 в диапазоне от 0,001 до 50 мкМ (обычно такие соединения не демонстрируют желаемой биологической активности). Другая ссылка, в которой представлены замещенные 2-метилбензимидазоловые средства против RSV с тем же диапазоном активности, представляет собой WO 03/053344. Другая связанная ссылка на соединения с тем же диапазоном активности представляет собой WO 02/2 6228 и предоставляет бензимидазоловые противовирусные средства. Ссылка на взаимоотношения структуры и активности в отношении ингибирования RSV 5-замещенными бензимидазоловыми соединениями представляет собой Х.А. Wang etal., Bioorganic and Medicinal Chemistry Letters 17 (2007) 4592-4598. Необходимо предоставить лекарственные средства с противорусной активностью. В частности, необходимо предоставить новые лекарственные средства, обладающие ингибиторной активностью в отношении репликации RSV. Кроме того, необходимо раскрыть структуру соединений, которые позволят получить более высокие уровни биологической активности, чем известные в данной области, и в особенности уровни активности, представленные значениями ЕС 50 ниже 0,001 мкМ. Кроме того, необходимо раскрыть соединения с пероральной противовирусной активностью. Сущность изобретения Для достижения одной или нескольких из приведенных выше целей изобретение в одном из аспектов предоставляет противовирусные бензимидазоловые соединения, представленные формулой I, соль присоединения, или стереохимический изомерR5 присутствует в том случае, когда X представляет собой С, в то время как каждый R5 независимо выбран из группы, состоящей из Н, С 1-С 6 алкила, С 1-С 6 алкокси, галогена и CN;R6 и R7 независимо выбраны из H и C1-С 10 алкила, С 3-С 7 циклоалкила или R6 и R7, взятые вместе, образуют 5-6-членное алифатическое или ароматическое кольцо, которое необязательно содержит один или несколько гетероатомов, выбранных из группы N, S, О;R8 выбран из группы, состоящей из Н, ОН, CF3, CHF2, F, Cl, SO2CH3, SO2C3-С 7 циклоалкила,NR6SO2R6, SO2NR6R7, NR6SO2C3-С 7 циклоалкила, CN, NR6R7, COOH, COOR6, CONR6R7, OCOC1 С 6 алкила, CONR6SO2R7, CONHR6SO2NR6R7, фталимида или 5-6-членного алифатического или ароматического кольца, необязательно содержащего один или несколько гетероатомов, выбранных из группы N,S, О;n представляет собой целое число со значением от 1 до 6. В другом варианте осуществления каждый X представляет собой С или N;R5 присутствует в том случае, когда X представляет собой С, в то время как каждый R5 независимо выбран из группы, состоящей из Н, С 1-С 6 алкил, С 1-С 6 алкокси, галогена и CN;R6 и R7 независимо выбраны из H и C1-С 10 алкила или R6 и R7, взятые вместе, образуют 5-6-членное алифатическое кольцо, которое необязательно содержит один или несколько гетероатомов, выбранных из группы N, S, О;n представляет собой целое число со значением от 2 до 6. В другом аспекте изобретение относится к приведенным выше соединениям для применения в лечении инфекций RSV у теплокровных животных, предпочтительно человека. В другом аспекте изобретение предоставляет способ лечения вирусных инфекций RSV y нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества приведенного выше соединения. В другом аспекте изобретение относится к применению приведенного выше соединения для получения лекарственного средства для лечения инфекций RSV. В дополнительном аспекте изобретение относится к фармацевтической композиции, содержащей приведенное выше соединение и фармацевтически приемлемый эксципиент. Еще в одном дополнительном аспекте изобретение относится к способам получения представленных выше соединений. Подробное описание изобретения Изобретение основано на неожиданном обнаружении того, что в определенных 5-замещенных бензимидазоловых соединениях специфический заместитель R2, представляющий собой хлор или бром, предоставляет соединения с неожиданно высокой биологической активностью против RSV. Даже в научном изложении активности структур (ссылка на Wang, приведенная выше) комбинации по настоящему изобретению не представлены. Ни один из результатов, представленных Wang, не предполагает биологической активности, превосходящей указанный выше диапазон 0,001-50 мкм. В настоящем изобретении далее представлены конкретные варианты осуществления со ссылками на конкретные примеры, однако изобретение не ограничено ими и ограничено только формулой изобретения. Термин "содержащий", применяемый в настоящем описании и формуле изобретения, не исключа-2 022972 ет других элементов или этапов. Употребление существительных в форме единственного числа включает также формы множественного числа, если не указано иное. Термин "пролекарственное средство", как применяется на протяжении всего документа, означает фармакологически приемлемые производные, например сложные эфиры и амиды, продукт биотрансформации которых представляет собой активное лекарственное средство, как определено для соединений формулы (I). Документ Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed.,McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), описывающий пролекарственные средства, включен в настоящий документ. Пролекарственные средства характеризуются хорошей растворимостью в воде и биодоступностью и легко метаболизируются in vivo в активные ингибиторы. Как применяют в настоящем документе, С 1-С 6 алкил в качестве группы или части группы представляет собой насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, такой как метил, этил, пропил, 1-метилэтил, бутил, пентил, гексил, 2-метилбутил и т.п.;C1-С 10 алкил в качестве группы или части группы представляет собой насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 10 атомов углерода, такой как группы,указанные для C1-С 6 алкила и гептила, октила, нонила, 2-метилгексила, 2-метилгептила, децила, 2 метилнонила и т.п.; термин "С 2-С 10 алкенил", применяемый в настоящем документе по отношению к группе или части группы, включает ненасыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие по меньшей мере одну двойную связь и предпочтительно содержащие одну двойную связь, и от 2 до 10 атомов углерода, такие как этенил, пропенил, бутен-1-ил, бутен-2-ил, пентен-1-ил, пентен-2-ил,гексен-1-ил, гексен-2-ил, гексен-3-ил, 2-метилбутен-1-ил, гептен-1-ил, гептен-2-ил, гептен-3-ил, гептен 4-ил, 2-метилгексен-1-ил, октен-1-ил, октен-2-ил, октен-3-ил, октен-4-ил, 2-метилгептен-1-ил, нонен-1 ил, нонен-2-ил, нонен-3-ил, нонен-4-ил, нонен-5-ил, 2-метилоктен-1-ил, децен-1-ил, децен-2-ил, децен-3 ил, децен-4-ил, децен-5-ил, 2-метилнонен-1-ил и т.п. Термин -(CR6R7)n, применяемый в настоящем документе, означает n-кратное повторение подгруппыCR6R7, где каждая из этих подгрупп определена независимо. Если группа С 2-С 10 алкенил связана с гетероатомом, она предпочтительно связана через насыщенный атом углерода. С 1-С 6 Алкокси в качестве группы или части группы представляет собой O-С 1-С 6 алкильный радикал,где C1-С 6-алкил представляет собой соединение, описанное выше. С 3-С 7 Циклоалкил представляет собой обобщенное название для циклопропила, циклобутила, циклопентила, циклогексила или циклогептила. Термин галоген представляет собой обобщенное название для фтора, хлора, брома и йода. Следует отметить, что позиции радикалов в любой молекулярной группе, применяемые в определениях, могут быть заменены на любую позицию в такой молекулярной группе при условии, что соединение является химически стабильным. Радикалы, применяемые в определениях групп, включают все возможные изомеры, если не указано иное. Например, пентил включает 1-пентил, 2-пентил и 3-пентил. Если группа встречается в сложном соединении более одного раза, то каждое ее определение является независимым. Далее в настоящем документе термин "соединения формулы (I)" или "настоящие соединения", или сходные термины включают соединения общей формулы (I), их пролекарственные производные, Nоксиды, соли присоединения, четвертичные амины, комплексные соединения с металлами и стереохимические изомеры. Следует понимать, что некоторые соединения формулы (I) могут иметь один или несколько хиральных центров и существовать в качестве стереохимических изомеров. Как применяют в настоящем документе, термин "стереохимические изомеры" означает все возможные соединения, построенные из тех же атомов, связанных в той же последовательности, но имеющие трехмерные структуры, которые не являются взаимозаменимыми, которыми могут обладать соединения формулы (I). Если не указано иное, химическое обозначение соединения описывает смесь всех возможных стереохимических изомеров, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимические изомеры соединений по настоящему изобретению как в чистой форме, так и в виде смеси друг с другом включены в объем настоящего изобретения. Чистые стереохимические формы соединений и промежуточных соединений, как применяется в настоящем документе, представляют собой изомеры, по существу, свободные от других энантиомерных или диастереомерных форм основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереохимически чистый" обозначает соединения или промежуточные соединения, которые характеризуются стереоизометрическим избытком, составляющим от не менее 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) до 100%(т.е. 100% одного изомера и отсутствие других), более конкретно, соединения или промежуточные соединения, которые характеризуются стереоизометрическим избытком, составляющим от 90 до 100%,более конкретно стереоизометрическим избытком от 94 до 100% и наиболее конкретно стереоизометрическим избытком от 97 до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать так же, однако, в отношении энантиомерного избытка и диастереомерного избытка представляющей интерес смеси соответственно. Чистые стереоизомерные формы соединений и промежуточных соединений по настоящему изобретению можно получать посредством известных в данной области способов. Например, энантиомеры можно отделять друг от друга посредством селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Примеры включают винную кислоту, дибензоилвинную кислоту, дитолуолвинную кислоту и камфорсульфоновую кислоту. Альтернативно, энантиомеры можно разделять посредством способов хроматографии с применением хиральных неподвижных фаз. Указанные чистые стереохимические изомеры можно также получать из соответствующих чистых стереохимических изомеров подходящих исходных веществ при условии, что реакция является стереоспецифической. Предпочтительно при необходимости получения определенного стереоизомера указанное соединение получают стереоспецифическими способами. В этих способах предпочтительно применяют энантиомерно чистые исходные вещества. Диастереомерные рацематы формулы (I) можно получать раздельно с применением традиционных способов. Подходящие способы физического разделения, применение которых является предпочтительным, включают, например, селективную кристаллизацию и хроматографию, например колоночную хроматографию. Для некоторых соединений формулы (I), их пролекарственных производных, N-оксидов, солей,сольватов, четвертичных аминов или комплексных соединений с металлами и промежуточных соединений, применяемых для их получения, точная стереохимическая конфигурация не определена. Специалист в данной области может определить точную конфигурацию таких соединений с применением способов, известных в данной области, таких как, например, рентгенодифракция. Настоящее изобретение также включает все изотопы атомов, содержащихся в представленных соединениях. Изотопы включают атомы с тем же атомным числом, но с разными массовыми числами. В качестве общего примера, не подразумевающего ограничение, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Для терапевтического применения соли соединения формулы (I) включают те, которые содержат фармацевтически приемлемый противоположно заряженный ион. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также можно применять, например, при получении или очистке фармацевтически приемлемого соединения. Все соли как фармацевтически приемлемые, так и фармацевтически неприемлемые включены в объем по настоящему изобретению. Фармацевтически приемлемые соли присоединения кислот и оснований, как указано выше, содержат терапевтически активные нетоксичные формы солей присоединения кислот и оснований, которые могут образовать соединения формулы (I). Фармацевтически приемлемые соли присоединения кислот можно легко получать посредством обработки основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородная кислота или бромисто-водородная кислота, серная, азотная, фосфорная и другие кислоты; или органические кислоты,такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандикислота), малоновая, янтарная (т.е. бутандикислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандикислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая,п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и другие кислоты. И напротив, указанные формы солей можно переводить в форму свободного основания посредством обработки подходящим основанием. Соединения формулы (I), содержащие кислотный протон, также можно переводить в форму нетоксичных солей присоединения металла или амина посредством обработки подходящими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, аммонийные соли, соли щелочных и щелочно-земельных металлов, например лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например бензатина, N-метил-S-глюкамина, гидрабаминовые соли и соли аминокислот, таких как, например, аргинин, лизин и т.п. Как применяют в настоящем документе, термин соль присоединения также включает сольваты, которые соединения формулы (I) и их соли могут образовать. Такие сольваты включают, например, гидраты, алкоголяты и т.п. Как применяют в настоящем документе, термин "четвертичный амин" обозначает четвертичные соли аммония, которые соединения формулы (I) могут образовать посредством реакции между азотистым основанием соединения формулы (I) и подходящим кватернизирующим агентом, таким как, например,необязательно замещенный алкилгалид, арилгалид или арилалкилгалид, например метилйодид или бен-4 022972 зилйодид. Можно применять также другие реактивы с подходящими уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион можно вводить в реакцию с применением ионообменных смол. Формы N-оксида представленных соединений включают соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида. Следует понимать, что соединения формулы (I) могут обладать свойствами связывания с металлом,образования хелатных и комплексных соединений и, таким образом, могут существовать в виде комплексных соединений с металлами или металло-хелатов. Такие металатные производные соединений формулы (I) включены в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в таутомерной форме. Такие формы,хотя и не указаны ясно в приведенной выше формуле, включены в объем настоящего изобретения. Определенные варианты осуществления, не ограничивающие объем изобретения, более детально рассмотрены ниже. В некоторых вариантах осуществления R2 представляет собой Br. В других вариантах осуществления R2 представляет собой Cl. В наиболее предпочтительных вариантах осуществления R2 представляет собой Br. С учетом того, что R3 представляет собой -(CR6R7)n-R8, как определено выше, в предпочтительном варианте осуществления R6 и R7 представляют собой Н. Далее, n представляет собой 2-4 и наиболее предпочтительно n представляет собой 3 или 4.R8 предпочтительно выбран из группы, состоящей из Н, ОН, F, CF3, CN и SO2CH3.R4 предпочтительно выбран из группы, состоящей из С 3-С 7 циклоалкила, С 2-С 10 алкенила, CH2CF3 иR4 представляет собой С 3-С 7 циклоалкил или CH2CF3. Наиболее предпочтительно R4 представляет собой циклопропил или CH2CF3. В предпочтительном варианте осуществления и более предпочтительно в сочетании с другими предпочтительными вариантами осуществления один X представляет собой N, а другие X представляют собой С. В наиболее предпочтительном варианте осуществления тот X, который представляет собой N,находится в пара-положении по отношению к N-R4. Как правило, предпочтительно один R5 выбран из группы, состоящей из C1-С 6 алкила, С 1-С 6 алкокси,галогена и CN. Наиболее предпочтительно все R5 представляют собой Н. В другом предпочтительном варианте осуществления R2 представляет собой Cl; один X представляет собой N, a другие X представляют собой С, где N находится в пара-положении по отношению к N-R4; и R4 представляет собой циклопропил или CH2CF3. Предпочтительные соединения представляют собой соединения, приведенные в табл. 1 и 2 ниже. Самыми предпочтительными являются соединения Р 1, Р 2, РЗ, Р 4, Р 5, Р 6, Р 7, Р 8, Р 9, Р 10, Р 11, Р 12, Р 13,Р 14, Р 15, Р 16, Р 17, Р 22, Р 23, Р 24, Р 25, Р 26 и Р 27. Более предпочтительно соединения представляют собой Р 1, Р 2, Р 3, Р 4, Р 6 и Р 24. Наиболее предпочтительные соединения представляют собой Р 1, Р 2, Р 3 и Р 4. Соединения формулы (I) можно получать, например, посредством способов, показанных на схеме 1. Как правило, фрагмент А или В при объединении с фрагментом С приводит к получению производных формулы (I). Способ 1. Общий способ получения соединений формулы (I). Для способа 1 пример подходящих условий реакции для взаимодействия фрагмента А с фрагментом С с получением соединений формулы (I) представляет собой реакцию Мицунобу. Подходящий растворитель для такого типа реакции представляет собой THF (тетрагидрофуран). Альтернативно (но не ограничиваясь этим), соединения типа фрагмента В, где Z=Cl, Br, OTos илиOMs могут взаимодействовать с соединениями типа фрагмента С в ходе реакции связывания с применением основания (способ 2). Возможные основания для применения в этой реакции (но не ограничиваясь этим) включают K2CO3, Cs2CO3, триэтиламин и гидрид натрия. Подходящий растворитель (но не ограничиваясь этим) для такого типа реакций связывания с применением основания представляет собой DMF(диметилформамид). Соединения типа фрагмента А можно, как правило, получать способом, представленным на схеме 2. Схема 2 Общий способ получения соединений типа фрагмента А. Как правило, соединения типа фрагмента В можно получать из соединений типа фрагмента А посредством реакции с такими веществами (но не ограничиваясь этим), как SOCl2, PBr3, p-TsCl, MsCl. Схема 3 Общий способ получения соединений типа фрагмента В. Соединения типа фрагмента С можно получать способом, представленным на схеме 4. Схема 4 Общий способ получения соединений типа фрагмента В. Соединения формулы (I) можно переводить в соответствующие формы N-оксида посредством известных в данной области способов превращения тривалентного азота в форму N-оксида. Указанная реакция N-окисления, как правило, включает взаимодействие исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают,например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать надкислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например 3-хлорбензолкарбопероксикислота, пероксоалкановые кислоты, например пероксоуксусная кислота,алкилгидропероксиды, например третбутила гидропероксид. Подходящие растворители включают, например, воду, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Чистые стереохимические изомеры соединений формулы (I) можно получать посредством применения известных в данной области способов. Диастереомеры можно разделять физическими способами,такими как селективная кристаллизация и способы хроматографии, например противоточная хроматография, жидкостная хроматография и т.п. Соединения формулы (I), полученные приведенными выше способами, как правило, представляют собой рацемические смеси энантиомеров, которые можно разделять посредством других известных в данной области способов. Рацемические соединения формулы (I), которые проявляют значительные основные или кислотные свойства, можно переводить в форму соответствующих диастереомерных солей посредством реакции с подходящей хиральной кислотой или подходящим хиральным основанием. Указанные формы диастереомерых солей затем разделяют, например, посредством селективной или фракционной кристаллизации, и энантиомеры выделяют с применением щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматогра-6 022972 фию, в частности жидкостную хроматографию с применением хиральных неподвижных фаз. Указанные чистые стереохимические изомеры можно также получать из соответствующих чистых стереохимических изомеров подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Предпочтительно для получения определенного стереоизомера указанное соединение получают стереоспецифическими способами. Эти способы включают применение энантиомерно чистых исходных веществ. В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как определено в настоящем документе, или соединения, построенного из любых подгрупп соединения формулы (I), как определено в настоящем документе, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в данном контексте представляет собой количество, достаточное для профилактики, стабилизации или сокращения вирусной инфекции, в частности инфекции вируса RSV, у инфицированных индивидуумов или индивидуумов, которые характеризуются риском заражения. В другом аспекте настоящее изобретение относится к способу получения фармацевтической композиции, как определено в настоящем документе, который включает непосредственное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), как определено в настоящем документе, или соединения, построенного из любых подгрупп соединения формулы (I), как определено в настоящем документе. Таким образом, из соединений по настоящему изобретению или любому варианту его осуществления можно составлять различные фармацевтические формы для введения внутрь. В качестве подходящих композиций можно приводить все композиции, которые, как правило, применяют для систематического введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество определенного соединения, необязательно в форме соли присоединения или комплекса с металлом, применяемое в качестве активного ингредиента, непосредственно смешивают с фармацевтически приемлемым носителем, где носитель может быть представлен в виде широкого диапазона форм в зависимости от формы композиции, применяемой для введения. Эти фармацевтические композиции предпочтительно представлены лекарственными формами для однократного применения,которые подходят, в частности, для перорального, ректального, чрескожного или парентерального введения. Например, при получении композиций в лекарственной форме для перорального введения можно применять любой из обычных фармацевтических носителей, такой как, например, вода, гликоли, масла,спирты и т.п. в случае жидких препаратов для перорального введения, таких как суспензии, сиропы,эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазочные средства, связывающие средства, дезинтегрирующие средства и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные стандартные лекарственные формы, в которых применяют твердые фармацевтические носители. В случае композиций для парентерального введения носитель, как правило, содержит стерильную воду, которая составляет, по меньшей мере, значительную часть композиции, хотя может включать другие ингредиенты, например, увеличивающие растворимость. Можно получать, например,растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно получать также суспензии для инъекций,в которых применяют подходящие жидкие носители, суспендирующие средства и т.п. Также применяют препараты в твердой форме, которые предназначены для перевода их в препараты в жидкой форме непосредственно перед применением. В композициях, подходящих для чрескожного введения, носитель необязательно содержит агент, облегчающий введение, и/или подходящий увлажнитель, необязательно в сочетании с подходящими добавками любого состава в незначительном количестве, где добавки не оказывают существенного вредного воздействия на кожу. Соединения по настоящему изобретению также можно вводить посредством пероральной ингаляции или вдувания с применением способов и составов, применяемых в данной области для введения таким способом. Таким образом, как правило, соединения по настоящему изобретению можно вводить в легкие в форме раствора, суспензии или сухого порошка, причем раствор является предпочтительным. Любые системы, разработанные для доставки растворов, суспензий или сухих порошков посредством пероральной ингаляции или вдувания, являются подходящими для введения представленных соединений. Таким образом, настоящее изобретение также относится к фармацевтической композиции, разработанной для введения посредством ингаляции или вдувания через ротовую полость и содержащей соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно соединения по настоящему изобретению доставляют посредством ингаляции раствора в распыленной или аэрозольной форме. Особенно предпочтительно формулировать указанные выше фармацевтические композиции в стандартной лекарственной форме для облегчения введения и однородности единиц дозирования. Стандартная лекарственная форма, как применяют в настоящем документе, относится к физически дискретным единицам, подходящим в качестве однократных доз, где каждая единица содержит определенное количество активного ингредиента, вычисленное таким образом, чтобы обеспечивать желаемый терапевтиче-7 022972 ский эффект в сочетании с необходимым фармацевтическим носителем. Примеры таких стандартных лекарственных форм включают таблетки (включая делимые таблетки или покрытые оболочкой таблетки), капсулы, пилюли, суппозитории, порошки, пластинки, растворы или суспензии для инъекций и т.п. и их кратно увеличенные дозы. Соединения формулы (I) демонстрируют противовирусные свойства. Вирусные инфекции, на которые можно воздействовать и применением соединений и способов по настоящему изобретению, включают инфекции, вызванные орто- и парамиксовирусами и, в частности, респираторно-синцитиальным вирусом (RSV) человека и копытных. Ряд соединений по настоящему изобретению, кроме того, проявляют активность против мутированных штаммов RSV. Кроме того, многие соединения по настоящему изобретению имеют подходящий фармакокинетический профиль и обладают привлекательными свойствами в отношении биодоступности, включая приемлемый период полувыведения, значения AUC и пикового значения и отсутствие неблагоприятных свойств, таких как недостаточно быстрое действие и задержка в тканях. Противовирусную активность представленных соединений по отношению к RSV in vitro оценивали в тесте, описанном в экспериментальной части описания изобретения, и ее также можно демонстрировать посредством анализа урожая вируса. Противовирусную активность представленных соединений по отношению к RSV in vivo можно демонстрировать на экспериментальной модели с применением хлопковых хомяков, как описано в Wyde etal. (Antiviral Research (1998), 38, 31-42). Благодаря противовирусным свойствам, и особенно направленной против RSV активности соединения формулы (I) или любые варианты их осуществления, их пролекарственные производные, Nоксиды, соли присоединения, четвертичные амины, комплексные соединения с металлами и стереохимические изомеры можно применять в лечении индивидуумов, страдающих от вирусной инфекции, особенно инфекции RSV, и для профилактики этих инфекций. Как правило, соединения по настоящему изобретению можно применять в лечении теплокровных животных, зараженных вирусами, в частности респираторно-синцитиальным вирусом. Таким образом, соединения по настоящему изобретению или любой вариант их осуществления можно применять в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способа лечения включает системное введение зараженным вирусом субъектам или субъектам, чувствительным к вирусным инфекциям, количества, эффективного для борьбы с состоянием, ассоциированным с вирусной инфекцией, в частности инфекцией RSV. Настоящее изобретение также относится к применению представленных соединений или любых вариантов их осуществления в получении лекарственного средства для лечения или профилактики вирусных инфекций, особенно инфекции RSV. Настоящее изобретение, кроме того, относится к способу лечения теплокровных животных, зараженных вирусом или характеризующегося риском заражения вирусом, в частности вирусом RSV, где указанный способ включает введение эффективного против вируса количества соединения формулы (I),как определено в настоящем документе, или соединения, построенного из любых подгрупп соединения формулы (I), как определено в настоящем документе. Как правило, предполагают, что эффективное против вируса суточное количество составляет от 0,01 до 500 мг/кг массы тела, более предпочтительно от 0,1 до 50 мг/кг массы тела. Часто предпочтительно доставлять необходимую дозу в виде двух, трех, четырех или более частей дозы через подходящие интервалы времени на протяжении суток. Указанные части дозы можно формулировать в виде стандартных лекарственных форм, например, содержащих от 1 до 1000 мг, в частности от 5 до 200 мг активного ингредиента на стандартную лекарственную форму. Точная дозировка и частота введения зависят от конкретного применяемого соединения формулы(I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста,массы тела, пола, степени нарушения и общего физического состояния конкретного пациента, а также от других лекарственных средств, которые может принимать пациент, как известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное суточное количество можно уменьшать или увеличивать в зависимости от восприимчивости подлежащего лечению индивидуума и/или в зависимости от оценки врача, выписывающего композиции по настоящему изобретению. Диапазоны эффективного суточного количества, приведенные выше, таким образом, имеют рекомендательный характер. Кроме того, в качестве лекарственного средства также можно применять комбинации других противовирусных веществ и соединения формулы (I). Таким образом, настоящее изобретение также относится к композиции, содержащей (а) соединение формулы (I) и (b) другое противовирусное соединение,которую применяют в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в противовирусном лечении. В одном препарате можно комбинировать различные лекарственные средства с фармацевтически приемлемыми носителями. Например, соединения по настоящему изобретению можно комбинировать с бета-интерфероном или фактором некроза опухоли альфа для лечения или предотвращения инфекций RSV. Далее в настоящем документе изобретение проиллюстрировано следующими неограничивающими примерами. Пример 1. Подробное описание получения 3-(5-бром-1-[3-(метилсульфонил)пропил]-1 Нбензимидазол-2-илметил)-1-циклопропил-1,3-дигидро-2 Н-имидазо[4,5-с]пиридин-2-она (Р 2), типичный пример по изобретению представлен на схеме 5. Схема 5 В 100-мл сухой колбе фрагмент А 2 (750 мг, 2,14 ммоль), трифенилфосфин (645 мг, 2,46 ммоль, 1,15 экв.) и фрагмент Cl (393 мг, 2,25 ммоль, 1,05 экв.) растворяли в тетрагидрофуране (THF) (60 мл). Раствор помещали в атмосферу N2 и посредством шприца добавляли диизопропилазодикарбоксилат (DIAD)(0,484 мл, 2,4 6 ммоль, 1,15 экв.). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Смесь выпаривали досуха и предварительно очищали посредством ВЭЖХ на колонке RP Vydac Denali C18 (10 мкм, 250 г, 5 см) с применением 0,25% NH4HCO3 в растворе водаCH3CN, применяемом в качестве элюента. После выпаривания и высушивания в вакууме получали 620 мг (1,23 ммоль, 57,5%) белого твердого вещества. Получение 5-бромо-1-[3-(метилсульфонил)пропил]-1 Н-бензимидазол-2-илметанола (фрагмент А 2) проводили способом, представленным на схеме 6. Схема 6 Соединение 1 (7,6 г, 35 ммоль), 3-(метилсульфонил)пропан-1-амин гидрохлорид (6 г, 35 ммоль) и диизопропилэтиламин (DIEA) (13,5 г, 105 ммоль) растворяли в этаноле (70 мл) и нагревали с обратным холодильником в течение 14 ч. Смесь охлаждали до 20 С. Осадок фильтровали и промывали этанолом. Получали 11 г (94%) соединения 2 в виде оранжевого порошка. Соединение 2 (10 г, 29,7 ммоль) в метаноле (200 мл), EtOAc (200 мл) и THF (200 мл) гидрогенизировали с применением Ni Ренея (10 г) в качестве катализатора при 20 С (1 атм.) в течение 3 ч. После поглощения Н 2 (3 эвк.) отфильтровывали катализатор и выпаривали фильтрат. Получали 10 г (90%) соединения 3 в виде черного твердого вещества. Соединение 3 (10 г, 2 9,7 ммоль) и метилдиметоксиацетат (9,2 г, 68,31 ммоль) в 24 мас.% KOEt в этаноле (13,5 г, 38,5 ммоль) перемешивали и нагревали с обратным холодильником в течение ночи. Смесь выпаривали в вакууме. Добавляли воду (200 мл). Добавляли уксусную кислоту для нейтрализации смеси. Смесь экстрагировали этилацетатом (2100 мл). Объединенные органические слои промывали насыщенным NaHCO3, насыщенным солевым раствором и высушивали над Na2SO4. Растворитель удаляли в вакууме с получением 12,3 г (90%) соединения 4 в виде темного масла. Соединение 4 (12,3 г, 29,3 ммоль) в THF (100 мл) перемешивали в течение 0,5 ч при 20 С до растворения. Добавляли концентрированную HCl (21 мл) и H2O (42 мл). Смесь кипятили с обратным холодильником в течение 6 ч и затем охлаждали до -10 С. Добавляли СН 3 ОН (50 мл) с последующим аккуратным добавлением NaBH4 (24 г, 629 ммоль). Смесь перемешивали в течение 0,5 ч при 10 С и концентрировали в вакууме. Добавляли воду (200 мл). Смесь экстрагировали этилацетатом (2100 мл). Объединенные органические слои промывали насыщенным солевым раствором и высушивали над Na2SO4. Растворитель удаляли в вакууме. Полученное твердое вещество промывали этилацетатом (25 мл) и высушивали в вакууме. Получали 6,8 г (60%) фрагмента А 2 в виде белесого твердого вещества, масса/заряд=347349 (М+Н)+Br. 1 Н ЯМР (400 МГц,DMSO-d6)м.д. 2,20 (дкв, J=7,8, 7,5 Гц, 2 Н), 2,98 (с, 3 Н), 3,16-3,24 (м, 2 Н), 4,42 (т, J=7,4 Гц, 2 Н), 4,73 (д,J=6,0 Гц, 2 Н), 5,73 (т, J=5,8 Гц, 1 Н), 7,42 (дд, J=8,7, 1,9 Гц, 1 Н), 7,63 (д, J=8,5 Гц, 1 Н), 7,79-7,83 (м, 1 Н). Получение 1-(циклопропил)-1,3-дигидро-2 Н-имидазо[4,5-с]пиридин-2-она (фрагмент Cl) проводили способом, представленным на схеме 7. Схема 7 В круглодонную колбу помещали 3-нитро-4-хлорпиридин (600 г, 3,8 моль), абсолютный EtOH (3 л),диизопропилэтиламин (DIPEA) (1320 мл, 7,6 моль) и циклопропиламин (432 г, 7,6 моль). Полученный раствор кипятили с обратным холодильником в течение 10 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрацией. Отфильтрованный осадок промывали холодным этанолом (2500 мл) с получением соединения 6. Остаточную жидкость концентрировали и разделяли между водой (1000 мл) и этилацетатом (1000 мл). Водный слой экстрагировали этилацетатом (2500 мл),высушивали над MgSO4, фильтровали и концентрировали с получением второй партии продукта (всего 650 г, 96%). Суспензию соединения 6 (650 г, 3,65 моль) и 10% Pd/C (50% воды; 163 г) в EtOH (7 л) гидрогенизировали при 50 фунт/дюйм 2 Н 2 в течение 16 ч при комнатной температуре. Суспензию фильтровали через Целит и концентрировали. Остаток сушили в вакууме с получением соединения 7 (490 г, 90,6%). В раствор соединения 7 (490 г, 3,29 моль) в CH3CN (4 л) при 0 С добавляли карбонилдиимидазол (CDI)(559 г, 3,45 моль, 1,05 экв.), получившуюся смесь нагревали до комнатной температуры и встряхивали в течение 16 ч при комнатной температуре. Осадок собирали фильтрацией и твердое вещество промывали холодным CH3CN (21000 мл). Твердое вещество сушили в вакууме с получением фрагмента Cl (450 г,78,2%). Масса/заряд=176 (М+Н). 1H ЯМР (400 МГц, DMSO-d6)м.д. 0,84-0,91 (м, 2 Н), 0,98-1,06 (м, 2H),2,89 (тт, J=7,0, 3,5 Гц, 1 Н), 7,18 (д, J=5,5 Гц, 1H), 8,16 (с, 1 Н), 8,19 (д, J=5,5 Гц, 1 Н), 10,98 (ушир. с, 1 Н). Примеры 2-27. Производные P1 и Р 3-Р 27 получали способами, описанными выше для получения Р 2. Соединения Р 1-Р 27 тестировали на ингибиторную активность по отношению к RSV (табл. 1). Пример 28. Получение 3-5-хлор-1-(4-фторбутил)-1 Н-бензо[d]имидазол-2-ил)метил)-1(метилсульфонил)-1 Н-имидазо[4,5-с]пиридин-2(3 Н)-она (Р 34) К раствору спирта 8 (363 мг, 1,414 ммоль) в 30 мл дихлорметана добавляли по каплям раствортионилхлорида (336 мг, 2 экв.) в 10 мл дихлорметана. Реакционную смесь перемешивали в течение 1 ч при 45 С. Затем ее концентрировали в вакууме с получением желаемого промежуточного соединения 9(440 мг, 99%) в виде соли HCl, которое использовали на следующем этапе. Этап 2. К раствору 1-(метилсульфонил)-1 Н-имидазо[4,5-с]пиридин-2(3 Н)-он гидрохлорида 10 (720 мг,2,626 ммоль) в 10 мл дополнительного сухого DMF добавляли гидрид натрия (210 мг, 5,253 ммоль, 60% коллоидный раствор в масле) порционно при комнатной температуре. Через 20 мин капельно добавляли раствор 5-хлор-2-(хлорметил)-1-(4-фторбутил)-1 Н-бензо[d]имидазол гидрохлорида 9 (440 мг, 1,313 ммоль) в 5 мл DMF. В течение ночи при комнатной температуре проводили встряхивание. Затем реакционную смесь разводили водой (50 мл) и экстрагировали с применением EtOAc (250 мл). Органические слои объединяли, промывали насыщенным солевым раствором, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Полученное бледно-оранжевое масло растирали в DCM и осадок отфильтровывали. Далее его промывали DCM и простым эфиром изопропила и высушивали в условиях сильного разрежения с получением титульного продукта 3-5-хлор-1-(4-фторбутил)-1 Н-бензо[d]имидазол-2 ил)метил)-1-(метилсульфонил)-1 Н-имидазо[4,5-с]пиридин-2(3 Н)-она Р 34 в виде белого твердого вещества с выходом 40%; масса/заряд=452 (М+Н)+. Пример 29. Получение 4-(5-хлор-2-1-циклопропил-2-оксо-1 Н-имидазо[4,5-с]пиридин-3(2 Н)ил)метил)-1 Н-бензо[d]имидазол-1-ил)бутановой кислоты (Р 45)(556 мг, 23 ммоль), растворенный в воде (25 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь вливали в воду, подкисленную до рН 4 посредством 1 М водного раствора соляной кислоты. Полученную смесь экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали. Остаток очищали посредством колоночной хроматографии с применением дихлорметана и метанола с получением указанного в заголовке соединения Р 45 в виде белого порошка (2,37 г, 84%); масса/заряд=426 (М+Н)+. Пример 30. Получение 3-5-бром-1-(4-морфолино-4-оксобутил)-1 Н-бензо [d]имидазол-2-ил)метил)1-циклопропил-1 Н-имидазо[4,5-с]пиридин-2(3 Н)-она (Р 48) К карбоновой кислоте Р 84 (500 мг, 1 ммоль), растворенной в ацетонитриле (50 мл), однократно добавляли карбонилдиимидазол (207 мг, 2,3 ммоль). Смесь перемешивали при 50 С в течение ночи. Затем смеси позволяли остыть до комнатной температуры и добавляли морфолин (278 мг, 3,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, затем вливали в воду (50 мл) и экстрагировали дихлорметаном (30 мл). Органический слой сушили над MgSO4 и затем концентрировали. Остаток очищали посредством колоночной хроматографии с применением дихлорметана и метанола. Продукт Р 48 выделяли в виде белого порошка (200 мг, 34%); масса/заряд=540 (М+Н)+. Пример 31. Получение 4-(5-хлор-2-1-циклопропил-2-оксо-1 Н-имидазо[4,5-с]пиридин-3(2 Н)ил)метил)-1 Н-бензо[d]имидазол-1-ил)-N-(циклопропилсульфонил)бутанамида (Р 49) К раствору Р 45 (500 мг, 1,17 ммоль) в ацетонитриле (50 мл) добавляли карбонил диимидазол (210 мг, 1,3 ммоль). Полученную смесь перемешивали при 50 С в течение 2 ч. Затем смеси позволяли остыть до комнатной температуры и добавляли последовательно циклопропан сульфонамид (157 мг, 1,29 ммоль) и DBU (268 мг, 1,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь вливали в воду (50 мл) и затем добавляли дихлорметан (50 мл). Смесь подкисляли 1 М раствором соляной кислоты до рН 4 и затем экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и затем концентрировали. Остаток очищали посредством колоночной хроматографии с получением Р 49 (487 мг, 78%) в виде белого порошка; масса/заряд=544 (М+Н)+. Пример 32. Получение 3-(5-хлор-1-[3-(1 Н-имидазол-1-ил)пропил]-1 Н-бензимидазол-2-илметил)1-циклопропил-1,3-дигидро-2 Н-имидазо[4,5-с]пиридин-2-она (Р 51) 4-Хлор-N-[3-(1 Н-имидазол-1-ил)пропил]-2-нитроанилин (11, 5 г, 17,8 ммоль) растворяли в 100 мл метанола (МеОН) и добавляли палладий на активированном угле (10%, 120 мг, 0,1 экв.) в атмосфере азота. Раствор гидрогенизировали при 1 бар в течение 16 ч. Реакционную смесь фильтровали через целит,фильтрат концентрировали в вакууме и очищали посредством флэш-хроматографии (от 0 до 10% метанола в CH2Cl2) с получением 4-хлор-N1-[3-(1 Н-имидазол-1-ил)пропил]бензол-1,2-диамина (12, 2,18 г,49%) в виде твердого вещества; LCMS масса/заряд=251 (М+Н)+. Стадия 2. Гликолевую кислоту (1,98 г, 26 ммоль, 3 экв.) добавляли в раствор 4-хлор-N1-[3-(1 Н-имидазол-1 ил)пропил]бензол-1,2-диамина (12, 2,18 г, 8,7 ммоль) в HCl (бы, 20 мл) при комнатной температуре. Реакционную смесь нагревали до 90 С в течение 16 ч. После охлаждения до температуры окружающей среды реакционную смесь разбавляли 100 мл воды с последующим добавлением NaHCO3 до достижения рН, составляющего приблизительно 7. Добавляли CH2Cl2 (30 мл), отделяли органический слой и экстрагировали водный слой дополнительным CH2Cl2 (20 мл). Объединенные органические слои сушили(MgSO4), фильтровали, концентрировали в вакууме и очищали посредством флэш-хроматографии (от 0 до 10% МеОН в CH2Cl2) с получением 5-хлор-1-[3-(1 Н-имидазол-1-ил)пропил]-1 Н-бензимидазол-2 илметанола (13, 740 мг, 30%) в виде белого твердого вещества; LCMS масса/заряд=291 (М+Н)+. Этап 3.(THF) (60 мл). Раствор помещали в атмосферу N2 и посредством шприца добавляли диизопропилазодикарбоксилат (DIAD) (0,752 мл, 3,8 ммоль, 1,5 экв.). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 ч. Смесь выпаривали досуха и предварительно очищали посредством ВЭЖХ на колонке RP SunFire Prep C18 (OBD-10 мкм, 30150 мм) с применением 0,25%NH4HCO3 в растворе вода-CFBCN, применявшемся в качестве элюента. После выпаривания и высушивания в вакууме получали 3-(5-хлор-1-[3-(1 Н-имидазол-1-ил)пропил]-1 Н-бензимидазол-2-илметил)-1 циклопропил-1,3-дигидро-2 Н-имидазо[4,5-с]пиридин-2-он (Р 51, 635 мг, 58%) в виде белого твердого вещества; LCMS масса/заряд=448 (М+Н)+. Пример 33. Получение 4-(5-хлор-2-1-циклопропил-2-оксо-1 Н-имидазо[4,5-с]пиридин-3(2 Н)ил)метил)-1 Н-бензо[d]имидазол-1-ил)-N-(циклопропилсульфонил)-N-метилбутанамида К раствору Р 49 (500 мг, 0,94 ммоль) в DMF (50 мл) добавляли карбонат цезия (616 мг, 1,9 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и затем добавляли метилйодид (0,059 мл, 1,9 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь вливали в воду и экстрагировали дихлорметаном, высушивали над MgSO4 и концентрировали. Остаток очищали посредством колоночной хроматографии с применением дихлорметана и метанола с получением Р 59 (120 мг, 21%) в виде белого порошка; масса/заряд=544 (М+Н)+. Пример 34. Получение (3-[5-хлор-1-(4-фторбутил)-1 Н-бензимидазол-2-ил]метил-2-оксо-2,3 дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)уксусной кислоты В 100-мл сухой колбе трет-бутил(3-[5-хлор-1-(4-фторбутил)-1 Н-бензимидазол-2-ил]метил-2-оксо 2,3-дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)ацетат (Р 33) (1,74 г, 3,49 ммоль) растворяли в 50 мл смеси тетрагидрофуран/вода (3/1). В раствор добавляли гидроксид лития (167,3 мг, 6,98 ммоль, 2 экв.) и смесь перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь разбавляли водой (20 мл) с последующим добавлением водной HCl (1 М) до достижения рН, составляющего приблизительно 6. В реакционную смесь добавляли дихлорметан (40 мл) и отделяли органический слой. Водный слой выпаривали досуха и высушивали в печи в течение 16 ч с получением (3-[5-хлор-1-(4-фторбутил)-1 Нбензимидазол-2-ил]метил-2-оксо-2,3-дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)уксусной кислоты (Р 67,1,6 г, 100%) в виде белого твердого вещества; LCMS масса/заряд=432 (М+Н)+. Пример 35. Получение 2-(3-[5-хлор-1-(4-фторбутил)-1 Н-бензимидазол-2-ил]метил-2-оксо-2,3 дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)-N-циклопропилацетамида (Р 68) В 100-мл сухой колбе (3-[5-хлор-1-(4-фторбутил)-1 Н-бензимидазол-2-ил]метил-2-оксо-2,3 дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)уксусную кислоту (Р 67, 300 мг, 0,69 ммоль), диизопропилэтиламин (0,29 мл, 2,08 ммоль, 3 экв.), циклопропиламин (60 мкл, 0,83 ммоль, 1,2 экв.) и 2-(1H-7 азабензотриазол-1-ил)-1,1,3,3-тетраметилурониум гексафторфосфат метанаминиум (HATU, 316,9 мг, 0,83 ммоль, 1,2 экв.) растворяли в DMF (50 мл). Раствор помещали в атмосферу N2 и встряхивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали дихлорметаном (50 мл). Органический слой сушили над MgSO4 и выпаривали. Остаток далее кристаллизовали в диизопропиловом эфире/ацетонитриле. Твердое вещество отфильтровывали и высушивали в печи в течение 16 ч с получением 2-(3-[5-хлор-1-(4-фторбутил)-1 Н-бензимидазол-2-ил]метил-2-оксо-2,3 дигидро-1 Н-имидазо[4,5-с]пиридин-1-ил)-N-циклопропилацетамида (Р 68, 86 мг, 26%) в виде белого твердого вещества; LCMS масса/заряд=471 (М+Н)+. Пример 36. Получение 4-(5-бром-2-1-циклопропил-2-оксо-1 Н-имидазо[4,5-с]пиридин-3(2 Н)ил)метил)-1 Н-бензо[d]имидазол-1-ил)-N-сульфамоилбутанамида (Р 76) Соединение Р 36 (4,5 г, 9,57 ммоль), DCC (2,0 г, 9,57 ммоль) и SuOH (1,4 г, 12,4 ммоль) в DMF (50 мл) перемешивали в течение 14 ч при 20 С. Затем смесь вливали в ледяную воду (100 мл). Смесь экстрагировали посредством CH2Cl2 (2100 мл). Органические слои промывали насыщенным солевым раствором, высушивали над MgSO4, фильтровали и выпаривали в вакууме с получением 4,5 г промежуточного соединения, которое использовали в следующем этапе без дальнейшей очистки. Предыдущее промежуточное соединение (1,0 г, 1,76 ммоль), сульфонамид (0,51 г, 5,3 ммоль) иDMAP (0,65 г, 5,3 ммоль) в CH2Cl2 (10 мл) перемешивали и нагревали с обратным холодильником в течение 14 ч. Затем смесь выпаривали в вакууме. Остаток очищали посредством высокоэффективной жидкостной хроматографии (С 18, элюент: CH3CN/H2O от 15/85 до 35/65 с 10 ммоль/л HCl в качестве буфера). Собирали чистые фракции и выпаривали органический растворитель. Добавляли 10% NaHCO3 до рН 8. Смесь отфильтровывали и твердое вещество промывали H2O (210 мл). Продукт получали посредством лиофилизации (80 мг, выход 10%). 1 Н ЯМР (400 МГц, ДМСО-d)м.д. 0,88-0,94 (м, 2 Н), 1,03-1,10 (м,2 Н), 1,82-1,92 (м, 2 Н), 2,20-2,28 (м, 2 Н), 2,97 (кв, J=3,47 Гц, 1 Н), 4,34 (т, J=7,98 Гц, 2 Н), 5,42 (с, 2 Н), 7,29(д, J=5,20 Гц, 1 Н), 8,38 (с, 1 Н). Примеры 37-85. Производные Р 28-33, Р 35-44, Р 46,47,50, Р 52-58, Р 60-66, Р 69-75 и Р 77-Р 85 получали способами,описанными выше. Все соединения Р 28-83 тестировали на ингибиторную активность по отношению к RSV (табл. 2). Примеры 86-89. Производные Р 86-Р 89 получали способами, описанными выше, и/или известными в данной области способами (табл. 3). Общие экспериментальные характеристики Анализ ВЭЖХ-МС проводили одним из следующих способов. Способ 1. Измерения по ВЭЖХ проводили с применением модуля Agilent 1100, который включает насос, детектор на диодной матрице (DAD) (применяемая длина волны 220 нм), нагреватель колонки и колонку,как определено ниже. Поток в колонке разделяли для направления в Agilent MSD Series G1946C иG1956A. Детектор MS был снабжен API-ES (устройство для ионизации электрораспылением при атмосферном давлении). Масс-спектры получали посредством сканирования от 100 до 1000. Напряжение капиллярной иглы составляло 2500 В для режима положительной ионизации и 3000 В для режима отрицательной ионизации. Напряжение фрагментации составляло 50 В. Температуру осушки газа поддерживали на уровне 350 С при потоке 10 л/мин. Обратно-фазовую ВЭЖХ проводили на колонке YMC-PackODS-AQ, 502,0 мм 5 мм со скоростью потока 0,8 мл/мин. Применяли две подвижные фазы (подвижная фаза А: вода с 0,1% TFA; подвижная фаза В: ацетонитрил с 0,05% TFA). Сначала 100% А удерживали в течение 1 мин. Затем применяли градиент к 40% А и 60% В за 4 мин и удерживали в течение 2,5 мин. Применяли типичный объем вводимой пробы, составляющий 2 мл. Температура печи составляла 50 С.(Полярность МС: положительная.) Способ 2. Измерения по ВЭЖХ проводили с применением модуля Agilent 1100, который включает насос, детектор на диодной матрице (DAD) (применяемая длина волны 220 нм), нагреватель колонки и колонку,как определено ниже. Поток в колонке разделяли для направления в Agilent MSD Series G1946C иG1956A. Детектор MS был снабжен API-ES (устройство для ионизации электрораспылением при атмосферном давлении). Масс-спектры получали посредством сканирования от 100 до 1000. Напряжение капиллярной иглы составляло 2500 В для режима положительной ионизации и 3000 В для режима отрицательной ионизации. Напряжение фрагментации составляло 50 В. Температуру осушки газа поддерживали на уровне 350 С при потоке 10 л/мин. Обратно-фазовую ВЭЖХ проводили на колонке YMC-PackODS-AQ, 502,0 мм 5 мм со скоростью потока 0,8 мл/мин. Применяли две подвижные фазы (подвижная фаза А: вода с 0,1% TFA; подвижная фаза В: ацетонитрил с 0,05% TFA). Сначала 90% А и 10% В удерживали в течение 0,8 мин. Затем применяли градиент к 20% А и 80% В за 3,7 мин и удерживали в течение 3 мин. Применяли типичный объем вводимой пробы, составляющий 2 мл. Температура печи составляла 50 С. (Полярность МС: положительная.) Способ 3. Колонка: XTerra MS C18 2,5 мкм, 4,650 мм, подвижная фаза А: 10 ммоль NH4OOCH+0,1% НСООН в H2O, подвижная фаза В: МеОН при температуре колонки 50 С с применением скорости потока 1,5 мл/мин. Условия градиента: t=0 мин: 65% А, 35% В; t=3,5 мин, 5% А, 95% В; t=5,5 мин, 5% А, 95% В;H2O, подвижная фаза В: МеОН при температуре колонки 50 С с применением скорости потока 1,5 мл/мин. Условия градиента: t=0 мин: 65% А, 35% В; t=7 мин, 5% А, 95% В; t=9,6 мин, 5% А, 95% В; t=9,8 мин: 65% А, 35% В; t=12 мин, 65% А, 35% В. Спектры ЯМР записывали на спектрометре Bruker 400 при 400 МГц в течение 1 ч. Химические сдвиги приведены в м.д, а значения J в Гц. Мультиплетности представлены следующими сокращениями: Черные 96-луночные планшеты с прозрачным дном для микротитрования (Corning, Amsterdam, TheNetherlands) заполняли в двух опытах с применением специально настроенной автоматической системы серийными 4-кратными разведениями соединения в конечном объеме 50 мкл среды для культивирования[среда RPMI без фенолового красного, 10% FBS, 0,04% гентамицина (50 мг/мл) и 0,5% DMSO]. Затем в каждую лунку добавляли 100 мкл клеточной суспензии HeLa (5104 клеток/мл) в среде для культивирования с последующим добавлением 50 мкл rgRSV224 (MOI=0,02) вируса в среде для культивирования с применением многоканальной пипетки (Thermo Scientific, Erembodegem, Belgium). Вирус rgRSV224 представляет собой полученный способами генной инженерии вирус, который содержит дополнительный ген GFP (Hallak et al., 2000) и приобретен с лицензией в NIH (Bethesda, MD, USA). Среду, зараженные вирусом контроли и ложнозараженные контроли включали в каждый тест. Клетки инкубировали при 37 С в атмосфере 5% СО 2. Через трое суток после инфицирования вирусную репликацию оценивали посредством измерения экспрессии GFP в клетках с применением лазерного микроскопа MSM (Tibotec,Beerse, Belgium). ЕС 50 определяли как 50% ингибиторную концентрацию по отношению к экспрессииGFP. Параллельно соединения инкубировали в течение трех суток в белых 96-луночных планшетах для микротитрования (Corning) и определяли цитотоксичность соединений в клетках HeLa посредством измерения содержания АТФ в клетках с применением набора ATPlite (PerkinElmer, Zaventem, Belgium) согласно инструкциям производителя. СС 50 определяли как 50% цитотоксичную концентрацию. Ссылки.Hallak L.K., Spillmann D., Collins P.L., Peeples M.E. Glycosaminoglycan sulfation requirements for respiratory syncytial virus infection. J. Virol. 740, 10508-10513 (2000) (Оценка сердечно-сосудистой безопасности). Воздействие соединений, описанных в настоящем изобретении, и связанных соединений BMS433771 на кардио-гемодинамические и кардио-электрофизиологические характеристики оценивали у анестезированных морских свинок. Для этой цели измеряли параметры электрокардиограммы с поверхности тела (ECG), частоту сердечных сокращений и среднее артериальное давление в двух экспериментальных группах. В первой группе (n=7) возрастающие дозы подлежащего оценке соединения (0,32, 0,64,1,25, 2,5, 5 и 10 мг/кг) вводили внутривенно в течение 5 мин с 15-минутными интервалами. Во второй группе (n=7) вводили соответствующие объемы носителя по той же схеме. Известно, что данная экспериментальная модель позволяет легко обнаруживать эффект, который оказывают на ECG соединения,вызывающие электрофизиологические изменения сердца, включая удлинение интервала QTc, аналогичные ожидаемым изменениям у человека (De Clerck, F., Fundam. Clin. Pharm.; 2002; 16: 125-139; Testai J.Appl. Toxicol; 2004; 24: 217-222). Концентрации, приводившие к значительному удлинению QTcB (р 0,05) в модели на анестезированных морских свинках, составляли 3,5 мкМ для связанных соединений BMS-433771, в то время как соответствующие соединения по настоящему изобретению вызывали значительное удлинение только при концентрации выше 18 мкМ (Р 6). Таблица 1
МПК / Метки
МПК: C07D 235/26, C07D 471/04, A61K 31/4188, A61P 11/00
Метки: бeнзимидазоловые, респираторно-синцитиального, ингибиторы, вируса
Код ссылки
<a href="https://eas.patents.su/30-22972-benzimidazolovye-ingibitory-respiratorno-sincitialnogo-virusa.html" rel="bookmark" title="База патентов Евразийского Союза">Бeнзимидазоловые ингибиторы респираторно-синцитиального вируса</a>
Предыдущий патент: Дверной доводчик, в частности, для стеклянных дверей
Следующий патент: Фторированные арилалкиламинокарбоксамидные производные
Случайный патент: Способ антивич/спид экспресс-терапии и устройство для его осуществления ("марс-3")












