Фторированные арилалкиламинокарбоксамидные производные
Формула / Реферат
1. Соединение общей формулы I
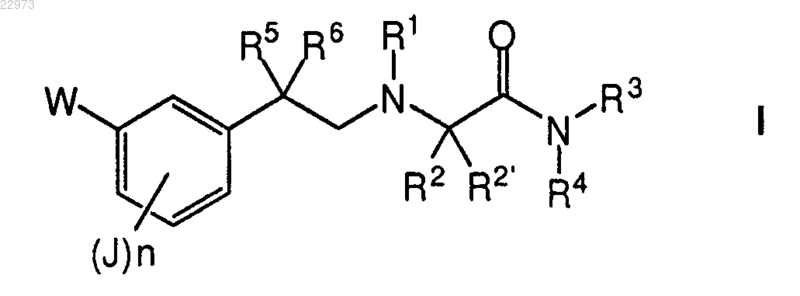
где W обозначает группу А-[(СН2)m-O]-, где m равно 0, 1, 2 или 3; А обозначает (C1-C4) алкил, необязательно замещенный одним-тремя атомами фтора; (С3-С6) циклоалкил; фенил, необязательно замещенный группой, выбранной из атома галогена, метила, метокси, трифторметила, ацетиламино и диметиламинометила; тиенил, необязательно замещенный атомом хлора; фуранил; изоксазолил; тиазолил; пиперидинил; морфолинил; пиридинил или пиримидинил, причем пиридинильный и пиримидинильный цикл необязательно является замещенным одной или двумя метоксигруппами;
J независимо обозначает атом водорода; (C1-C4) алкил; (С1-С4) алкокси или атом галогена;
n равно 1 или 2;
R1 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный гидроксигруппой или (C1-C4) алкоксигруппой; или (С3-С8) циклоалкил;
R2 и R2' независимо обозначают атом водорода; (C1-C4) алкил, необязательно замещенный (С1-С4) алкоксигруппой; фенил, необязательно замещенный (C1-C4) алкилом, (С1-С4) алкокси или атомом галогена; бензил, необязательно замещенный (С1-С4) алкилом, (C1-C4) алкокси или атомом галогена по бензольному циклу; или R2 и R2', взятые вместе с соседним атомом углерода, образуют (С3-С6) циклоалкилиденовую группу;
R3 обозначает атом водорода или (C1-C4) алкил;
R4 обозначает атом водорода; (C1-C4) алкил; фенил; циклогексил или бензил; или
R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный, морфолинильный, пиперидинильный или пиперазинильный цикл, причем пиперидинильный цикл необязательно является замещенным одной или двумя (C1-C2) алкильной(алкильными) группой(группами), и пиперазинильный цикл необязательно является замещенным по другому N-атому (С1-С4) алкильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл, конденсированный с бензольным циклом;
R5 обозначает атом водорода или фтора и
R6 обозначает атом фтора;
либо в виде отдельного выделенного энантиомера или диастереомера, либо в виде их смеси при любом соотношении и его фармацевтически приемлемая соль.
2. Соединение по п.1, где
W обозначает группу А-[(СН2)m-O]-, где m равно 0, 1, 2 или 3; А обозначает (C1-C4) алкил, необязательно замещенный одним-тремя атомами фтора; (С3-С6) циклоалкил; фенил, необязательно замещенный атомом галогена; или тиазолил;
J независимо обозначает атом водорода; (C1-C4) алкил; атом хлора или фтора;
n равно 1 или 2;
R1 обозначает атом водорода; (С1-С4) алкил, необязательно замещенный гидроксигруппой или (C1-C4) алкоксигруппой; или (С3-С6) циклоалкил;
R2 обозначает атом водорода или (С1-С4) алкил;
R2' обозначает атом водорода; (C1-C4) алкил, необязательно замещенный (C1-C4)алкокси; или фенильную группу, причем фенильная группа необязательно является замещенной (C1-С4) алкоксигруппой;
R3 обозначает атом водорода или (C1-C4) алкил;
R4 обозначает атом водорода; (C1-C4) алкил; фенил или циклогексил; или
R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный, морфолинильный, пиперидинильный или пиперазинильный цикл, причем пиперидинильный цикл необязательно является замещенным одной или двумя (С1-С2) алкильной(алкильными) группой(группами), и пиперазинильный цикл необязательно является замещенным по другому N-атому (C1-C4) алкильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл, конденсированный с бензольным циклом;
R5 обозначает атом водорода или фтора и
R6 обозначает атом фтора;
либо в виде отдельного выделенного энантиомера или диастереомера, либо в виде их смеси при любом соотношении и его фармацевтически приемлемая соль.
3. Соединение по любому из пп.1 и 2, где
W обозначает группу А-[(СН2)m-O]-, где m равно 1 или 2; А обозначает (C1-C4) алкил, необязательно замещенный одним-тремя атомами фтора; фенил, необязательно замещенный атомом хлора или фтора; или тиазолил;
J независимо обозначает атом водорода; метил или атом фтора;
n равно 1-2;
R1 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный гидроксигруппой или (C1-C4) алкоксигруппой;
R2 обозначает атом водорода или метил;
R2' обозначает атом водорода; (C1-C4) алкил, необязательно замещенный метокси; или фенильную группу, причем фенильная группа необязательно является замещенной метоксигруппой;
R3 обозначает атом водорода или (C1-C4) алкил;
R4 обозначает атом водорода; (C1-C4) алкил; фенил или циклогексил; или
R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный, морфолинильный, пиперидинильный или пиперазинильный цикл, причем пиперидинильный цикл необязательно является замещенным одной или двумя метильной(метильными) группой(группами), и пиперазинильный цикл необязательно является замещенным по другому N-атому метильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл, конденсированный с бензольным циклом;
R5 обозначает атом водорода или фтора и
R6 обозначает атом фтора;
либо в виде отдельного выделенного энантиомера или диастереомера, либо в виде их смеси при любом соотношении и его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1-3, выбранное из следующих:
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-дипропилацетамид;
2-[2,2-дифтор-2-(3-бутокси-4-метилфенил)этиламино]-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-дибутилацетамид;
2-[2,2-дифтор-2-(3-гексилоксифенил)этиламино]-N,N-диметилацетамид;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-пентилоксифенил)этиламино]-N,N-дипропилацетамид;
2-{2,2-дифтор-2-[3-(3-(3-фторфенил)пропокси)фенил]этиламино}-N,N-диметилацетамид;
2-{2,2-дифтор-2-[3-(3-(3-хлорфенил)пропокси)фенил]этиламино}-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бутокси-2-фторфенил)этиламино]-N,N-диметилацетамид;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-N,N-диметилацетамид;
2-{2,2-дифтор-2-[3-(3-тиазол-2-ил-пропокси)фенил]этиламино}-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(пирролидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N-метил-N-фенилацетамид;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-1-(пирролидин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-1-(пирролидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-1-(морфолин-4-ил)этанон;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-1-(морфолин-4-ил)этанон;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-1-(морфолин-4-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(2Н-бензо[b][1,4]оксазин-4(3Н)-ил)этанон;
2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-1-(пирролидин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-N-метил-N-фенилацетамид;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-N-метил-N-фенилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(4-метилпиперазин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-1-(4-метилпиперазин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-1-(4-метилпиперазин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(пиперидин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино}-1-(пиперидин-1-ил)этанон;
2-{2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-1-(пиперидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диэтилацетамид;
2-{2,2-дифтор-2-[3-(2-фторбензилокси)фенил]этиламино}-N,N-диметилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(цис-3,5-диметилпиперидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(3,4-дигидроизохинолин-2(1Н)-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диизопропилацетамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N-циклогексил-N-метилацетамид;
2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-1-(пиперидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-[4-(фенилсульфонил)пиперазин-1-ил]этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(индолин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(4-бензилпиперазин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(азетидин-1-ил)этанон;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-3-метокси-N,N-диметилпропанамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-3-(4-метоксифенил)-N,N-диметилпропанамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-2-N,N-триметилпропанамид;
2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-4-N,N-триметилпентанамид;
2-{[2,2-дифтор-2-(3-бутоксифенил)этил]метиламино}-N,N-диметилацетамид;
2-{[2,2-дифтор-2-(3-бутоксифенил)этил](3-метоксипропил)амино}-N,N-диметилацетамид;
2-{[2,2-дифтор-2-(3-бутоксифенил)этил](2-метоксиэтил)амино}-N,N-диметилацетамид;
2-[2-фтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид
либо в виде отдельного выделенного энантиомера, либо их смеси в любых пропорциях, и его фармацевтически приемлемая соль.
5. Соединение по п.4, которое выбрано из 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида, 2-[2-фтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида, их отдельных выделенных энантиомеров или их смеси в любых пропорциях и их фармацевтически приемлемых солей.
6. Соединение по п.5, которое представляет собой 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид или его фармацевтически приемлемую соль.
7. Соединение по любому из пп.1-6, где фармацевтически приемлемая соль представляет собой гидрохлорид.
8. Соединение по п.7, которое представляет собой соль гидрохлорид 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида.
9. Лекарственное средство, действующее в качестве активного модулятора натриевых и/или кальциевых каналов, для лечения расстройств, вызванных дисфункциями потенциалзависимых натриевых и/или кальциевых каналов, содержащее соединение по любому из пп.1-8 в терапевтически эффективном количестве.
10. Лекарственное средство по п.9, где нарушение, вызванное дисфункциями потенциалзависимых натриевых и/или кальциевых каналов, выбрано из следующих: невропатическая боль, хроническая боль, острая боль, головные боли, неврологические состояния, нейродегенеративные расстройства, когнитивные расстройства, психиатрические расстройства, головокружение, шум в ушах, мышечный спазм, сердечно-сосудистые заболевания, эндокринные расстройства, вызванные чрезмерной или гиперсекреторной клеточной секрецией эндогенного вещества, болезни печени, воспалительные процессы, желудочно-кишечные заболевания (GI), мочеполовые заболевания, глазные заболевания и расстройства питания.
11. Лекарственное средство по любому из пп.9 или 10 для лечения невропатической боли, хронической боли и/или острой боли.
12. Лекарственное средство по любому из пп.9 или 10 для лечения головных болей.
13. Лекарственное средство по любому из пп.9 или 10 для лечения неврологических состояний.
14. Лекарственное средство по п.13, где неврологическое состояние представляет собой эпилепсию.
15. Лекарственное средство по любому из пп.9 или 10 для лечения когнитивных и/или психиатрических расстройств.
16. Лекарственное средство по любому из пп.9 или 10 для лечения воспалительных процессов, желудочно-кишечных заболеваний, мочеполовых заболеваний, глазных заболеваний, болезней печени, сердечно-сосудистых и/или нейродегенеративных заболеваний, вызванных дисфункциями потенциалзависимых натриевых и/или кальциевых каналов.
17. Лекарственное средство для лечения нарушения, вызванного дисфункцией потенциалзависимых натриевых и/или кальциевых каналов, у пациентов, которые являются плохими метаболизаторами, имеющие плохую (или не имеющих) функцию CYP2D6 или принимающих лекарства, представляющие собой CYP2D6-ингибиторы, содержащее соединение по любому из пп.1-8 в терапевтически эффективном количестве.
18. Применение соединения по любому из пп.1-8 в сочетании с одним или несколькими другими терапевтическими агентами, выбранными из габапентина, прегабалина, L-допы, агонистов дофамина, галоперидола, рисперидона, клозапина, для лечения нарушения, вызванного дисфункцией потенциалзависимых натриевых и/или кальциевых каналов.
19. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-8 в качестве активного ингредиента вместе с фармацевтически приемлемым наполнителем.
20. Фармацевтическая композиция по п.19, содержащая дополнительный терапевтический агент, выбранный из габапентина, прегабалина, L-допы, агонистов дофамина, галоперидола, рисперидона, клозапина.
21. Фармацевтическая композиция по любому из пп.19 и 20, где соединение представляет собой соль гидрохлорид 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида.
22. Способ лечения нарушения, вызванного дисфункциями потенциалзависимых натриевых и/или кальциевых каналов у пациента, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-8.
23. Способ по п.22, где нарушение, вызванное дисфункциями потенциалзависимых натриевых и/или кальциевых каналов, выбрано из следующих: невропатическая боль, хроническая боль, острая боль, головные боли, неврологические состояния, нейродегенеративные расстройства, когнитивные расстройства, психиатрические расстройства, головокружение, шум в ушах, мышечный спазм, сердечно-сосудистые заболевания, эндокринные расстройства, вызванные чрезмерной или гиперсекреторной клеточной секрецией эндогенного вещества, болезни печени, воспалительные процессы, желудочно-кишечные заболевания (GI), мочеполовые заболевания, глазные заболевания и расстройства питания.
24. Способ по любому из пп.22 и 23, где нарушение представляет собой невропатическую боль, хроническую боль и/или острую боль.
25. Способ по любому из пп.22 и 23, где нарушение представляет собой головную боль.
26. Способ по любому из пп.22 и 23, где нарушение представляет собой когнитивное и/или психиатрическое нарушение.
27. Способ по любому из пп.22 и 23, где нарушение представляет собой неврологическое состояние.
28. Способ по п.27, где неврологическое состояние представляет собой эпилепсию.
29. Способ по любому из пп.22 и 23, где нарушение представляет собой воспалительный процесс, желудочно-кишечные заболевания, мочеполовые заболевания, глазное заболевание, болезнь печени, сердечно-сосудистое и/или нейродегенеративное нарушение, вызванное дисфункциями потенциалзависимых натриевых и/или кальциевых каналов.
30. Способ по любому из пп.22-23, где пациент является плохим метаболизатором, имеющим очень низкую (или не имеющий) CYP2D6-функцию или принимающий лекарство(лекарства), представляющее собой ингибитор(ингибиторы) CYP2D6.
31. Способ по любому из пп.22 и 23, где соединение представляет собой соль гидрохлорид 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида.
Текст
Описаны фторированные арилалкиламинокарбоксамидные производные формулы (I), где W, J,n, R1, R2, R2', R3, R4, R5 и R6 имеют значения, которые определены в спецификации, и их фармацевтически приемлемые соли, фармацевтические композиции, содержащие их в качестве активных ингредиентов, и их применение в качестве модуляторов натриевых и/или кальциевых каналов, применимых для предупреждения, облегчения и лечения патологий в широком диапазоне,в том числе неврологических, психиатрических, сердечно-сосудистых, воспалительных, глазных,урологических и желудочно-кишечных заболеваний, где указанные выше механизмы описаны как играющие патологическую роль. Настоящее изобретение относится к фторированным арилалкиламинокарбоксамидным производным, их фармацевтически приемлемым солям, содержащим их фармацевтическим композициям и их применению в качестве модуляторов натриевых и/или кальциевых каналов. Фторированные арилалкиламинокарбоксамидные производные как объект изобретения активны в качестве модуляторов ионных каналов (в частности, натриевых и/или кальциевых каналов) и, следовательно, применимы для предупреждения, облегчения и лечения патологий в широком диапазоне, включая, но не ограничиваясь этим, неврологические, психиатрические, сердечно-сосудистые, воспалительные, глазные, мочеполовые и желудочно-кишечные заболевания, где указанные выше механизмы описаны как играющие патологическую роль. Уровень техники Химические предпосылки В WO 2007/071311 описаны замещенные 2-фенилэтиламинопроизводные как модуляторы потенциалзависимых кальциевых и/или натриевых каналов общей формулы IJ обозначает группу А-[(СН 2)nO]r- в пара-положении относительно этиламиноцепи, где n равно 0 или 1; r равно 1; А обозначает трифторметил, циклопентил или фенил, необязательно замещенный галогеновой группой;R0 обозначает атом водорода или (C1-C2) алкил;R1 обозначает атом водорода, (С 1-С 4) алкил, необязательно замещенный гидроксигруппой; циклопропилметил; 2-пропин-1-ил; бензил, необязательно замещенный одной или двумя (C1-С 2 оксигруппами по бензольному циклу; тиазолил; 5-6-членный насыщенный гетероциклил, содержащий атом азота, необязательно замещенный (C1-C2) алкильной группой; или гетероциклилметил, в котором гетероциклическая группа представляет собой 5-6-членный гетероциклил, содержащий от 1 до 3 гетероатомов, выбранных из атомов азота, кислорода и серы, необязательно замещенный одной или двумя группами, выбранными из (C1-C2) алкила, гидроксиметила и (C1-С 2) алкокси;R3 обозначает атом водорода или (C1-C4) алкил;R4 обозначает атом водорода, (C1-C4) алкил, необязательно замещенный группой, выбранной из амино, (C1-C4) алкиламино, ди-(C1-C4) алкиламино, имидазолила и пирролидинила, где имидазолильная и пирролидинильная группа необязательно является замещенной (C1-C2) алкильной группой; или бензил; илиR3 и R4, взятые вместе с соседним атомом азота, образуют пирролидинильный, морфолинильный или пиперазинильный цикл, необязательно замещенный (C1-C2) алкильной группой; илиJ обозначает группу А-[(СН 2)n-O]r- в пара-положении относительно этиламиноцепи, где n равно 1; r равно 1; А обозначает фенил или фенил, замещенный галогеновой группой;R3 обозначает атом водорода или (C1-C4) алкил иR4 обозначает атом водорода или (С 1-С 4) алкил; илиW обозначает группу А-[(СН 2)n-O]r-, где n равно 0, 1 или 2; r равно 0 или 1; А обозначает (С 1-С 4) алкил, трифторметил; циклопропил; циклопентил; фенил, необязательно замещенный группой, выбранной из атома галогена, метила, метокси, трифторметила, ацетиламино и диметиламинометила; тиенил, необязательно замещенный атомом хлора; фуранил; изоксазолил, необязательно замещенный одной или двумя метильными группами; пиперидинил; морфолинил; пиридинил или пиримидинил, в которых пиридинильный и пиримидинильный цикл необязательно замещен одной или двумя метоксигруппами;R обозначает атом водорода или фтора;R0 обозначает атом водорода или (C1-C2) алкил;R2 обозначает атом водорода или (C1-C4) алкил;R3 обозначает атом водорода или (C1-C4) алкил;R4 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный группой, выбранной из (C1C2) алкокси, амино, (C1-С 4) алкиламино и ди-(C1-C4) алкиламино; или гетероциклил, где гетероциклил выбран из изоксазолила, пиразолила, имидазолила, тиазолила и 1,3,4-тиадиазолила, и может быть необязательно замещен (C1-С 2) алкильной группой; илиR3 и R4, взятые вместе с соседним атомом азота, образуют пирролидиновый цикл; при условии, что если А обозначает (C1-C4) алкил, трифторметил, циклопропил или циклопентил,то r равно 1; и при дополнительном условии, что если R1 обозначает изопропил, то А представляет собой трифторметил и n равно 1; пригодные для производства лекарственного средства, активного в качестве модулятора кальциевых и/или натриевых каналов, против нарушений, вызванных дисфункциями потенциалзависимых кальциевых и/или натриевых каналов. В WO 2008/151702 описаны замещенные 2-[2-(фенил)этиламино]алканамидные производные в качестве модуляторов потенциалзависимых кальциевых и/или натриевых каналов общей формулы (I)R1 и R2 независимо обозначают атом водорода, гидрокси, (C1-C8) алкокси, (С 3-С 8) алкилтио, галоген, трифторметил или 2,2,2-трифторэтил; или один из R1 и R2 находится в орто-положении к R-X- и,взятый вместе с таким же R-X-, представляет группу где R0 обозначает (С 2-С 9) алкил;R3 и R'3 независимо обозначают атом водорода или (C1-С 4) алкил;R4 и R5 независимо обозначают атом водорода, (C1-C4) алкил; или R4 обозначает атом водорода и R5 обозначает группу, выбранную из -СН 2-ОН, -СН 2-O-(C1-C6) алкила, -СН(СН 3)-ОН, - (СН 2)2-S-CH3, бензила и 4-гидроксибензила; или R4 и R5, взятые вместе с соседним атомом углерода, образуют (С 3-С 6) циклоалкильный остаток;R6 и R7 независимо обозначают атом водорода или (C1-С 6) алкил или, взятые вместе с соседним атомом азота, образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбранный из -О-, -S- и -NR8-, где R8 обозначает атом водорода или (C1-С 6) алкил; при условии, что если X обозначает -S- или -SO2-, то Y не является ОН или О(С 1-С 4) алкилом; в виде отдельного оптического изомера в изолированной форме или смеси изомеров с любым соотношением и его фармацевтически приемлемые соли. Фторированные соединения, описанные в данной заявке, не включены в WO 2007/071311 или WO 2008/151702. Биологические предпосылки Натриевые каналы играют важную роль в нейронной сети, быстро передавая электрические импульсы по клеткам и клеточным сетям, координируя тем самым высшие процессы от движения до познания. Эти каналы представляют собой большие транс-мембранные белки, которые способны переключаться между различными биофизическими состояниями, делая возможной селективную проницаемость для ионов натрия. Чтобы происходил этот процесс, требуется потенциал действия для деполяризации мембраны, и, следовательно, эти каналы называются потенциалзависимыми. Потенциалзависимые натриевые каналы первоначально классифицировали в зависимости от их чувствительности к тетродотоксину, от низконаномолярных (тетродотоксин-чувствительных, TTXs) до высокомикромолярных (тетродотоксин-устойчивых, TTXr). Пока идентифицировано 10 различных субъединиц натриевых каналов, классифицированных как Nav1.1 до Nav1.9.Nav1.1-Nav1.4, Nav1.6 и Nav1.7 представляют собой TTXs, тогда как Nav1.5, Nav1.8 и Nav1.9 представляют собой TTXr с различными степенями чувствительности. Nav1.1-Nav1.3 и Nav1.6 в основном экспрессируются в ЦНС, тогда как Nav1.4 и Nav1.5 экспрессируются, главным образом, в мышцах (скелетных и сердечных соответственно) и Nav1.8 и Nav1.9 преимущественно экспрессируются в мелких дорсальных корешковых ганглиях (DRG).Nav1.3, натриевый канал TTXs, обычно отсутствующий во взрослых нейронах, подвергается повышающей регуляции после поражения нерва, как наблюдают на сенсорных нейронах и нейронах спинного мозга грызунов после хронических поражений нервов (Waxman S.G., Kocsis J.D., Black J.А.: "мРНК натриевого канала типа III экспрессируется в спинно-мозговых сенсорных нейронах эмбриона, но не взрослого, и повторно экспрессируется после аксотомии", J. Neurophysiol. 72, 466-470 (1994). Hains B.C., KleinJ.P., Saab C.Y. и др.: "Повышающая регуляция натриевого канала Nav1.3 и функциональное вовлечение в повышенную нейронную возбудимость, связанную с центральной невропатической болью после повреждения спинного мозга", J. Neurosci. 23, 8881-8892 (2003). Hains B.C., Saab C.Y., Klein J.P. и др.: "Измененная экспрессия натриевого канала в спинно-мозговых сенсорных нейронах второго порядка вносит вклад в боль после повреждения периферического нерва", J. Neurosci. 24, 4832-4839 (2004 и подтверждают на поврежденных нервах человека после периферической аксотомии (Coward K., Aitken A., Powell А. и др.: "Пластичность ТТХ-чувствительных натриевых каналов PNI и головного мозга III в поврежденных нервах человека", Neuroreport 12, 495-500 (2001 и на болезненных невромах человека (Black J.A.,Nikolajsen L., Kroner K. и др.: "В болезненных невромах человека присутствует множество изоформ натриевого канала и митоген-активированные протеинкиназы", Ann. Neurol. 64(6), 644-653 (2008. КаналыNav1.3 демонстрируют некоторые свойства, которые могут вносить вклад в повышенную нейронную возбудимость. Быстрое восстановление после инактивации и способность продуцировать постоянный ток и пилообразные отклики на небольшую/медленную деполяризацию может поддерживать высокочастотное возбуждение. Интересно, что описаны более высокие скорости восстановления после повреждения нерва, которые способствуют повышению возбудимости нейронов при болезненных состояниях(Cummins T.R., Waxman S.G.: "Понижающая регуляция тетродотоксин-резистентных натриевых токов и повышающая регуляция быстрозаряжаемого тетродотоксин-чувствительного натриевого тока в малых спинно-мозговых сенсорных нейронах после повреждения нерва", J. Neurosci. 17, 3503-3514 (1997).Cummins T.R., Aglleco F., Renganathan M. и др.: "Nav1.3 натриевые каналы: быстрая зарядка и медленная инактивация в закрытом состоянии демонстрируют количественные различия после экспрессии на клеточной линии млекопитающего и в спинно-мозговых сенсорных нейронах", J. Neurosci. 21, 5952-5961(2001). Lampert A., Hains B.C., Waxman S.G.: "Повышающая регуляция постоянного и пилообразного натриевого тока в нейронах серого вещества спинного мозга после повреждения спинного мозга", Exp.Brain Res. 174, 660-666 (2006. Общая специфическая экспрессия и биофизические свойства Nav1.3 вовлекают этот канал в генерацию ТТХ-чувствительных эктопических разрядов, связанных с хронической болью. Канал Nav1.7 представляет собой TTXs канал, преимущественно экспрессируемый в первичных ноцицепторных DRG нейронах и симпатических ганглиозных нейронах. Он демонстрирует медленные кинетики перехода к и от состояния инактивации, что определяет возможность генерации токов в ответ на небольшие подпороговые деполяризации и позволяет каналу действовать в качестве порогового канала, усиливая, таким образом, генераторные потенциалы (Catterall W.A., Goldin A.L., Waxman S.G.: "Международный союз фармакологии. XLVII. Номенклатура и структурно-функциональные соотношения потенциалзависимых натриевых каналов", Pharmacol. Rev. 57, 397-409 (2005. За последние несколько летNav1.7 приобрел заметную роль в исследовании боли, потому что генетические исследования человека напрямую связали точечные мутации гена SCN9A, кодирующего для Nav1.7, со специфическими болевыми синдромами. Увеличение функциональных мутаций, которые снижают порог активации канала,связано с доминантной наследственной невропатией, наследственной эритромелалгией (IEM), отличительным симптомом которой является сильная жгучая боль в ногах и руках в ответ на мягкое тепло и физические упражнения (Dib-Hajj S.D., Rush A.M., Cummins T.R. и др.: "Увеличение функциональных мутаций в Nav1.7 при семейной эритромелалгии индуцирует разрушение сенсорных нейронов", Brain 128(8), 1847-1854 (2005). Dib-Hajj S.D., Rush A.M., Cummins T.R., Waxman S.G.: "Мутации в натриевом канале Nav1.7 лежат в основе наследственной эритромелалгии", Drug Discovery Today: Disease Mechanisms 3(3), 343-350 (2006. Одним из наиболее убедительных свидетельств, которое побудило многие компании осуществлять программы исследования в отношении специфических ингибиторов Nav1.7, было открытие того, что отсутствие функциональных мутаций гена Nav1.7 определяет врожденную нечувствительность к боли(CIP), Сох J.J., Reimann F., Nicholas А.K. и др.: "SCN9A каналопатия является причиной врожденной неспособности испытывать боль", Nature 444, 894-8 (2006).TTXr канал Nav1.8 исключительно экспрессируется в периферических сенсорных нейронах. Медленная кинетика инактивации, быстрая зарядка, деполяризованный порог активации и инактивации делают его идеальным для поддержания возникновения потенциала действия в деполяризованных волокнах (Elliott A.A., Elliott J.R.: "Характеристика ТТХ-чувствительных и ТТХ-резистентных натриевых то-3 022973 ков в малых клетках из дорсальных корешковых ганглий взрослых крыс", J. Physiol. 463, 39-56 (1993).Akopian A.N., Souslova V., England S. и др.: "Тетродотоксин-резистентный натриевый канал SNS имеет специализированную функцию на болевых путях", Nat. Neurosci. 2, 541-548 (1999). Renganathan M.,Cummins T.R., Waxman S.G.: "Вклад натриевых каналов Nav1.8 в электрогенез потенциала действия вDRG нейронах", J. Neurophysiol. 86, 629-640 (2001. Однако, при иммуногистохимических исследованиях на животных и в последнее время на людях, наблюдают специфическую транслокацию и перераспределение белка Nav1.8 на периферическом сайте повреждения (Novakovic S.D., Tzoumaka E., McGivernJ.G. и др.: "Распределение тетродотоксин-резистентных натриевых каналов PN3 в сенсорных нейронах крыс при нормальных и невропатических состояниях", J. Neurosci. 15, 18(6) 2174-2187 (1998). Black J.A.,Nikolajsen L., Kroner K. и др.: "В болезненных невромах человека присутствует множество изоформ натриевого канала и митоген-активированных протеинкиназ", Ann. Neurol. 64(6), 644-653 (2008; или перераспределение и изменения его активности в остальных непораженных нейронах (Gold M., WeinreichD., Kim С.S. и др. : "Перераспределение Nav1.8 в непораженных аксонах делает возможной невропатическую боль", J. Neurosci. 23, 158-166 (2003, предполагает динамическое вовлечение данного канала в генерацию и поддержание ноцицептивных импульсов. Другой TTXr канал Nav1.9 исключительно экспрессируется в DRG нейронах малого диаметра. Это еще один из наименее понятных членов семейства потенциал-зависимых натриевых каналов (VGSC),вследствие сложности экспрессии рекомбинантной формы в гетерологичных экспрессионных системах. Характеристика биофизических свойств данного канала выполнена на сенсорных нейронах от Nav1.8 нулевых мышей (Cummins T.R., Dib-Hajj S.D., Black J.А. и др.: "Новый постоянный тетродотоксинрезистентный натриевый ток в малых первичных сенсорных нейронах, SNS-нулевых и дикого типа", J.Neurosci. 19 (24): RC43 (1999. Показано, что эти нейроны экспрессируют постоянный (неинактивационный) TTXr ток при существенном перекрывании порога активации и инактивации в стабильном состоянии, центрированных рядом с потенциалом покоя (Roza С, Laird J.M.A., Souslova V. и др.: "Тетродотоксин-резистентный Na+ канал Nav1.8 является существенным для выражения спонтанной активности в поврежденных сенсорных аксонах мышей", J. Physiol. 550, 921-926 (2003. Вследствие этих свойств, каналы Nav1.9 ведут себя как строгие регуляторы возбудимости в клетках, где они присутствуют, играя ключевую роль в установке мембранного потенциала покоя, а также внося вклад в подпороговый электрогенез в малых DRG нейронах. Стало ясно, что ряд лекарств, имеющих неизвестный ранее механизм действия, фактически работают, модулируя проводимость натриевого канала, в том числе анестетики местного действия (LA), антиаритмические агенты класса I и противосудорожные препараты. Блокаторы нейронных натриевых каналов нашли применение для лечения эпилепсии (фенитоин и карбамазепин), биполярного нарушения(ламотригин), предупреждения нейродегенерации и для уменьшения невропатической боли. Различные антиэпилептические лекарства, которые стабилизируют нейронную возбудимость, даже по другим механизмам действия, одобрены для различных форм невропатической боли (габапентин, прегабалин и карбамазепин). Кроме того, повышение экспрессии и/или активности натриевого канала также наблюдают на некоторых моделях воспалительной боли, предполагая роль натриевых каналов при воспалительной боли. Кальциевые каналы представляют собой трансмембранные белки, состоящие из множества субъединиц, которые позволяют контролировать вхождение ионов кальция в клетки из внеклеточной жидкости. Обычно кальциевые каналы зависимы от напряжения и обозначаются как потенциалзависимые кальциевые каналы (VGCC). VGCC обнаружены везде в нервной системе млекопитающих, где они регулируют уровни внутриклеточных ионов кальция, что важно для жизнеспособности и функции клеток. Внутриклеточные концентрации ионов кальция вовлечены в ряд жизненно важных процессов у животных, таких как высвобождение нейротрансмиттеров, сокращение мышц, активность кардиостимулятора и секреция гормонов. Все "возбудимые" клетки у животных, такие как нейроны центральной нервной системы (ЦНС), клетки периферических нервов и мышечные клетки, в том числе клетки скелетных мышц, сердечных мышц, венозных и артериальных гладких мышц, имеют зависимые от напряжения кальциевые каналы. Кальциевые каналы составляют большое семейство с большим количеством генетически, физиологически и фармакологически различных подтипов. По биофизическим свойствам токов кальция, регистрируемых от индивидуальных нейронов, описаны два суперсемейства: активируемые высоким напряжением (HVA) и активируемые низким напряжением (LVA) кальциевые каналы. Токи кальция, обозначаемые как L-тип, Р-тип, Q-тип, N-тип, R-тип, представляют собой HVA, и обозначаемые как Т-тип, представляют собой LVA. В частности, термин "L-тип" первоначально применяли к каналам с высокой проводимостью отдельного канала и длительным временем открытия, и "Т-тип" применяли к каналам с очень низкой проводимостью отдельного канала и кратким временем открытия. Дополнительное исследование функционального многообразия кальциевых каналов идентифицирует канал "N-типа", экспрессируемый в нейронах, и канал "Р-типа", который является доминантным типом, экспрессируемым в церебеллярных нейронах Пуркинье, и фармакологически резистентным к известным блокаторам кальциевых каналов L-типа и N-типа. По молекулярной идентичности распознаны десять различных подтипов(Cav 1,1, 1,2, 1,3, 1,4) функционально относится к L-типу Са-тока; семейство Cav2 (Cav 2,1, 2,2, 2,3) функционально относится к P/Q, N, R-типу токов, и семейство Cav3 (Cav 3,1, 3,2, 3,3) функционально относится к току Т-типа. Считают, что кальциевые каналы существенны при некоторых болезненных состояниях. Считается,что ряд соединений, применимых при лечении различных сердечно-сосудистых заболеваний у млекопитающих, включая людей, оказывает влияние на их благотворные эффекты, модулируя функции потенциалзависимых кальциевых каналов, присутствующих в сердечных и/или сосудистых гладких мышцах. Также подразумевают применение соединений с активностью относительно кальциевых каналов для лечения боли. В частности, считают, что кальциевые каналы N-типа (Cav 2,2), ответственные за регуляцию высвобождения нейротрансмиттеров, играют существенную роль в ноцицептивной трансмиссии, вследствие их распределения в ткани, а также по результатам некоторых фармакологических исследований. Как обнаружено на моделях невропатической боли, кальциевые каналы N-типа повышающе регулируются в ипсилатеральном сером веществе спинного мозга при повреждении (Cizkova D., Marsala J., LukacovaN., Marsala M., Jergova S., Orendacova J., Yaksh T.L. Exp. Brain Res. 147: 456-463 (2002. На моделях невропатической боли показано, что специфические блокаторы кальциевых каналов N-типа являются эффективными при снижении болевых реакций (Mattews E.A., Dickenson A.H., Pain 92: 235-246 (2001 на фазе II формалинового теста (Diaz A., Dickenson A.H., Pain 69: 93-100 (1997 и при гиперальгезии, инициированной воспалением коленного сустава (Nebe J., Vanegas H., Schaible H.G. Exp. Brain Res. 120: 6169 (1998. Обнаружено, что мутантные мыши, не имеющие кальциевых каналов N-типа, имеют пониженную реакцию на постоянную боль, как видно по снижению болевой реакции в течение фазы II формалинового теста (Kim С, Jun K., Lee T., Kim S.S., Mcenery M.W., Chin H., Kim H.L, Park J.M., Kim D.K.,Jung S.J., Kim J., Shin H.S., Mol. Cell. Neurosci. 18: 235-245 (2001); Hatakeyama S., Wakamori M., Ino M.,Miyamoto N., Takahashi E., Yoshinaga T., Sawada K., Imoto K., Tanaka I., Yoshizawa T., Nishizawa Y., MoriY., Nidome T., Shoji S., Neuroreport 12:2423-2427 (2001, а также на невропатическую боль, оцениваемую по снижению механической аллодинии и термической гиперальгезии на модели лигирования спинномозговых нервов (Yamamoto T., Takahara A.: "Последние усовершенствования блокаторов кальциевых каналов N-типа с терапевтическим потенциалом для невропатической боли и инсульта", Curr. Top. Med.Chem. 9, 377-395 (2009. Интересно, что мыши также демонстрируют более низкие уровни тревоги по сравнению с диким типом (Saegusa H., Kurihara T., Zong S., Kazuno A., Matsuda Y. Nonaka T., Han W.,Toriyama H., Tanabe T., EMBO J. 20: 2349-2356 (2001. Участие кальциевых каналов N-типа в боли дополнительно подтверждено клиническим применением циконотида, пептида, производного яда морского брюхоногого моллюска Conus Magnus (Williams J.A., Day M., Heavner J.E.: "Циконотид: усовершенствование и обзор", Expert Opin. Pharmacother. 9(9), 1575-1583 (2008. Ограничение при терапевтическом применении данного пептида состоит в том, что его вводят людям интратекально (Bowersox S.S. и Luther(2008. Недавно был опубликован полный обзор роли и применимости модуляторов ионных каналов при лечении невропатической боли (Е. Colombo и др.: "Модуляторы ионных каналов для лечения невропатической боли", Future Medicinal Chemistry, 2(5): 803-842 (2010. Все эти открытия показывают, что соединения, способные блокировать натриевые и/или кальциевые каналы, обладают важным терапевтическим потенциалом для предупреждения, облегчения и лечения патологий в широком диапазоне, в том числе неврологических, психиатрических, сердечнососудистых, мочеполовых, желудочно-кишечных и воспалительных заболеваний, где указанные выше механизмы описаны как играющие патологическую роль. Имеется много работ и патентов, в которых описаны модуляторы натриевых каналов и/или кальциевых каналов или антагонисты для лечения или модуляции множества нарушений, например, их применение в качестве локальных анестетиков, антиаритмических препаратов, противорвотных средств,противоманиакальных антидепрессантов, агентов для лечения униполярной депрессии, тревоги, сердечно-сосудистых заболеваний, недержания мочи, диареи, воспаления, эпилепсии, нейродегенеративных состояний, гибели нервных клеток, невропатической боли, мигрени, острой гипералгезии и воспаления,болезни почек, аллергии, астмы, бронхоспазма, дисменореи, спазмы пищевода, глаукомы, болезней мочевых путей, нарушений моторики желудочно-кишечного тракта, преждевременных родов, ожирения,нарушения иммунной и эндокринной систем, включая множественный склероз. Неисчерпывающий список патентов/патентных заявок, описывающих блокаторы натриевых и/или кальциевых каналов и их применения, включает ссылки, показанные ниже. Патент США 5051403 касается способа снижения нейронного поражения, связанного с ишемическим состоянием, таким как инсульт, посредством введения связывающего/ингибирующего пептида омега-конотоксина, где пептид характеризуется специфическим ингибированием потенциалзависимых токов кальциевых каналов селективно в нейронных тканях. Патент США 5587454 касается композиций и способов проведения обезболивания, в частности для лечения боли и невропатической боли. Патент США 5863952 касается антагонистов кальциевых каналов для лечения ишемического инсульта. Патент США 6011035 касается блокаторов кальциевых каналов, применимых для лечения таких состояний, как инсульт и боль. Патент США 6117841 касается блокаторов кальциевых каналов и их применения для лечения инсульта, церебральной ишемии, боли, травм головы или эпилепсии. Патент США 6362174 касается блокаторов кальциевых каналов N-типа для лечения инсульта, церебральной ишемии, боли, эпилепсии и травм головы. Патент США 6380198 касается применения блокатора кальциевых каналов флунаризина для локального лечения глаукомы. Патент США 6420383 и патент США 6472530 касаются новых блокаторов кальциевых каналов,применимых для лечения и предупреждения ряда нарушений, таких как гиперчувствительность, аллергия, астма, бронхоспазм, дисменорея, спазм пищевода, глаукома, преждевременные роды, болезни мочевых путей, нарушения моторики желудочно-кишечного тракта и сердечно-сосудистые заболевания. Патент США 6458781 касается соединений, которые действуют, блокируя кальциевые каналы, и их применения для лечения инсульта, церебральной ишемии, боли, травм головы или эпилепсии. Патент США 6521647 касается применения блокаторов кальциевых каналов для лечения болезни почек у животных, в особенности хронической почечной недостаточности.WO 97/10210 касается трициклических гетероциклических производных и их применения в терапии, в частности, в качестве антагонистов кальциевых каналов, например для лечения ишемии, в частности ишемического инсульта.WO 03/018561 касается хинолиновых соединений как антагонистов кальциевых каналов N-типа и способов применения таких соединений для лечения или предупреждения боли или ноцицепции.WO 03/057219 касается блокаторов натриевых каналов, применимых в качестве агентов для лечения или модуляции расстройства центральной нервной системы, такого как невропатическая боль, воспалительная боль, боль, связанная с воспалением, или эпилепсия. В WO 99/14199 раскрыты замещенные 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцин-10-олы в качестве сильнодействующих блокаторов натриевых каналов, применимых для лечения таких заболеваний,как инсульт, нейродегенеративные заболевания, болезнь Альцгеймера, болезнь Паркинсона и сердечнососудистые заболевания. В WO 01/74779 раскрыты новые аминопиридиновые блокаторы натриевых каналов и их применение в качестве противосудорожных средств, местных анестетиков, антиаритмических средств для лечения или предупреждения нейродегенеративных состояний, таких как боковой амиотрофический склероз(ALS), для лечения или предупреждения острой или хронической боли и для лечения или предупреждения диабетической невропатии. В WO 04/087125 раскрыты производные аминокислот в качестве ингибиторов натриевых каналов млекопитающих, применимых для лечения хронической и острой боли, шума в ушах, заболеваний кишечника, дисфункции мочевого пузыря и демиелинизирующих заболеваний.WO 06/028904 касается хиназолинов, применимых в качестве модуляторов ионных каналов, их получения, фармацевтических композиций и применения в качестве ингибиторов потенциалзависимых натриевых каналов, которые применимы при лечении различных заболеваний. В WO 06/024160 раскрыто получение производных пиперазин-1-карбоксамида в качестве блокаторов кальциевых каналов. В WO 06/110917 описаны спирооксиндольные соединения и их получение, фармацевтические композиции и применение в качестве блокаторов натриевых каналов. В WO 06/027052 описано применение отобранных (R)-2-[(галогенбензилокси)бензиламино]пропанамидов и их фармацевтически приемлемых солей для производства лекарственных препаратов, которые селективно активны в качестве модуляторов натриевых и/или кальциевых каналов и, следовательно,применимы для предупреждения, облегчения и лечения патологий в широком диапазоне, в том числе боли, мигрени, периферических заболеваний, сердечно-сосудистых заболеваний, воспалительных процессов, затрагивающих все системы организма, нарушений, затрагивающих кожу и связанные ткани,нарушений дыхательной системы, нарушений иммунной и эндокринной систем, желудочно-кишечных,мочеполовых, метаболических и припадочных расстройств, где указанные выше механизмы описаны как играющие патологическую роль. В WO 07/145922 раскрыто получение бензазепиноновых аминокислот в качестве блокаторов натриевых каналов.WO 07/021941 касается получения N-тиазолилбензолсульфонамидов в качестве ингибиторов потенциалзависимых натриевых каналов. В WO 08/141446 раскрыты производные аминокислот в качестве блокаторов кальциевых каналов. В WO 09/005460 описано получение и применения ингибиторов Nav1.7 натриевых каналов для лечения болевых расстройств. В WO 09/039328 раскрыты пиридилсулфонамиды в качестве модуляторов натриевых каналов, их получение, фармацевтические композиции и применение для лечения различных заболеваний.WO 09/045381 касается N-замещенных оксиндолиновых производных в качестве блокаторов кальциевых каналов. В WO 10/007073 раскрыто получение пиперазиновых производных в качестве модуляторов кальциевых каналов Cav2,2. В WO 10/014257 описано получение тетрагидропиридиновых и дигидропиррольных соединений в качестве блокаторов кальциевых каналов для лечения боли и других нарушений. Суперсемейство цитохрома Р 450 (аббревиатура CYP) представляет собой большую и многообразную группу ферментов, и функцией большинства CYP ферментов является катализ окисления органических веществ. Вещества CYP ферментов включают ксенобиотические вещества, такие как лекарства и другие токсические химические реагенты. CYP являются основными ферментами, вовлеченными в метаболизм лекарств и биоактивацию, отвечая по меньшей мере за 75% общего метаболизма. ЧеловеческиеCYP в основном представляют собой белки, связанные с мембраной, расположенные либо во внутренней мембране митохондрий, либо в эндоплазматическом ретикулуме клеток (Smith G., Stubbins M.J.Xenobiotica 28 (12): 1129-65 (1998. Многие лекарства могут повышать или понижать активность различных CYP изоэнзимов, либо индуцируя биосинтез изоэнзима (индукция фермента), либо непосредственно ингибируя активность CYP (ингибирование фермента). Это основной источник вредных взаимодействий лекарств, так как изменения активности CYP фермента могут влиять на метаболизм и клиренс различных лекарств. Например, если одно лекарство ингибирует CYP-опосредованный метаболизм другого лекарства, то второе лекарство может аккумулироваться в организме до токсических уровней. Следовательно, исключение взаимодействий лекарств, может сделать необходимой регулировку дозировки или выбор лекарств, которые не взаимодействуют с CYP-системой. Цитохром Р 450 2D6 (CYP2D6), член смешанно-функциональной оксидазной системы цитохром Р 450, является одним из наиболее важных ферментов, вовлеченных в метаболизм ксенобиотиков в организме (Wolf C.R., Smith G. IARC Sci. Publ.; 148: 209-29 (1999. Пока CYP2D6 вовлечен в окисление широкого диапазона субстратов всех CYP, имеется существенная вариабельность в его экспрессии в печени. Ген расположен рядом с двумя псевдогенами цитохром Р 450 на хромосоме 22q13.1. Для этого гена обнаружены альтернативно срощенные варианты транскриптов кодирующие различные изоформы.CYP2D6 демонстрирует большую фенотипическую вариабельность среди CYP, в значительной степени благодаря генетическому полиморфизму. Генотип отвечает за нормальную, пониженную и несущественную функцию CYP2D6 у субъектов. Функцию CYP2D6 у любого конкретного субъекта можно описать как одну из следующих: плохие метаболизаторы - эти субъекты имеют слабую функцию CYP2D6 или не имеют ее; промежуточные метаболизаторы - эти субъекты метаболизируют лекарства со скоростью примерно между плохими и экстенсивными метаболизаторами; экстенсивные метаболизаторы - эти субъекты имеют нормальную функцию CYP2D6; ультрабыстрые метаболизаторы - эти субъекты имеют множество копий экспрессированного генаCYP2D6 и, следовательно, функцию CYP2D6 выше нормальной. Следовательно, пациентов, подвергающихся любому терапевтическому лечению, можно классифицировать согласно приведенному выше определению субъектов. Многие антипсихотические лекарства, применяемые для лечения шизофрении, представляют собой субстраты CYP2D6: примеры этих лекарств включают галоперидол, рисперидон, перфеназин, тиоридазин, арипипразол и сертиндол. Если лекарство способно сильно ингибировать CYP2D6, то субъект, принимающий указанное лекарство может стать плохим метаболизатором, т.е. может испытывать повышение в плазме уровней принимаемого совместно CYP2D6-метаболизируемого лекарства. Хинидин, пароксин, бупропион и флуоксетин являются сильнодействующими ингибиторами CYP2D6, и применение сильнодействующих ингибиторов может приводить пациента, который является экстенсивным CYP2D6 метаболизатором, к состоянию фенотипически плохого метаболизатора (De Leon J., Armstrong S.С., Cozza K.L. Psychosomatics; 47(1): 75-85 (2006. Фенотип плохого CYP2D6-метаболизатора может играть основную роль в персонифицировании доз рисперидона (De Leon J., Susce M.T., Pan R.M., Wedlun P.J.,Orrego M.L., Diaz F.J. Pharmacopsychiatry; 40(3), 93-102 (2007. Еще один пример, сертиндол, претерпевает экстенсивный печеночный метаболизм посредством CYP2D6 и 3 А 4 до двух основных метаболитов. Плохие CYP2D6-метаболизаторы могут иметь клиренс сертиндола, сниженный на 50-67%. Сопутствующее введение сертиндола и ингибиторов CYP2D6 следует применять с предельной осторожностью (Murdoch D., Knutanui G.M. ЦНС. Лекарства; 20(3): 233-255 (2006. Следовательно, высоко желательно с точки зрения исключения чрезмерных взаимодействий лекарство-лекарство иметь соединения, которые не способны ингибировать основные человеческие CYP, в частности CYP2D6, например, в состоянии психоза и шизофрении, а также при любой патологии, когда применяют лечение лекарством, которое представляет собой субстрат CYP2D6 (Foster А. МоЫеу Е.,Wang Z. Pain Practice; 7(4): 352-356 (2007. Описание изобретения Целью данного изобретения является новый класс фторированных арилалкиламинокарбоксамидных производных, которые являются высокоэффективными в качестве модуляторов натриевых и/или кальциевых каналов и, следовательно, применимы для предупреждения, облегчения и лечения патологий в широком диапазоне, в том числе, но не ограничиваясь этим, психиатрических, неврологических, сердечно-сосудистых, воспалительных, глазных, мочеполовых, желудочно-кишечных заболеваний, где указанные выше механизмы описаны как играющие патологическую роль. Указанные соединения также характеризуются тем, что они, по существу, не имеют никакого CYP2D6-ингибирующего эффекта или демонстрируют существенно пониженный CYP2D6-ингибирующий эффект. В данном описании и формуле изобретения выражение "модулятор(ы) натриевых и/или кальциевых каналов" обозначает соединения, способные блокировать натриевые и/или кальциевые токи зависимым от напряжения и/или применения образом. В данном описании и формуле изобретения выражение "по существу, не имеют никакого CYP2D6 ингибирующего эффекта" означает, что соединение демонстрирует значение IC50 [мкМ] в тесте цитохром-ингибирования in vitro по примеру 10, которое равно более 40, тогда как выражение "пониженныйCYP2D6-ингибирующий эффект" означает, что соединение демонстрирует значение IC50 [мкМ] более 20. В частности, предметом настоящего изобретения является соединение общей формулы I где W обозначает группу А-[(СН 2)m-O]-, где m равно 0, 1, 2 или 3; А обозначает (С 1-С 4) алкил, необязательно замещенный одним-тремя атомами фтора; (С 3-С 6) циклоалкил; фенил, необязательно замещенный группой, выбранной из атома галогена, метила, метокси, трифторметила, ацетиламино и диметиламинометила; тиенил, необязательно замещенный атомом хлора; фуранил; изоксазолил; тиазолил; пиперидинил; морфолинил; пиридинил или пиримидинил, причем пиридинильный и пиримидинильный цикл необязательно является замещенным одной или двумя метоксигруппами;J независимо обозначает атом водорода; (C1-C4) алкил; (С 1-С 4) алкокси или галогеновую группу;R1 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный гидроксигруппой или (C1C4) алкоксигруппой; или (С 3-С 8) циклоалкил;R2 и R2' независимо обозначают атом водорода; (С 1-С 4) алкил, необязательно замещенный (С 1-С 4) алкоксигруппой; фенил, необязательно замещенный (С 2-С 4) алкильной, (С 1-С 4) алкокси или галогеновой группой; бензил, необязательно замещенный (C1-С 4) алкильной, (С 1-С 4) алкокси или галогеновой группой по бензольному циклу; или R2 и R2', взятые вместе с соседним атомом углерода, образуют (С 3-С 6) циклоалкилиденовую группу;R3 обозначает атом водорода или (С 1-С 4) алкил;R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный,морфолинильный, пиперидинильный или пиперазинильный цикл, причем пиперидинильный цикл необязательно является замещенным одной или двумя (C1-С 2) алкильными группами, и пиперазинильный цикл необязательно является замещенным по другому N-атому (C1-С 4) алкильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл, конденсированный с бензольным циклом;R5 обозначает атом водорода или фтора;R6 обозначает атом фтора; либо в виде отдельного выделенного оптического изомера, либо в виде смеси изомеров при любом соотношении и его фармацевтически приемлемая соль. Используемый в данном описании и формуле изобретения термин "(С 1-С 4) алкил" или "(С 1-С 4) алкильный фрагмент" в других заместителях (например, в обозначениях алкокси), если не определено подругому, определяет линейный или разветвленный алкильный радикал или фрагмент; примеры указанных радикалов или фрагментов включают, соответственно, метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил или метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси. Термин "(С 1-С 4) алкил", если алкил замещен "одним-тремя атомами фтора", определяет линейный или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода, в котором от одного до трех атомов водорода, присоединенных к одному или разным атомам углерода, независимо замещены атомами фтора. Предпочтительными типичными примерами соединений, обозначенных данным термином, являются трифторметил, 2,2,2-трифторэтил, 3,3,3-трифторпропил и 4,4,4-трифторбутил. Используемые в данном описании и формуле изобретения термины "(С 3-С 6) циклоалкил" и "(С 3-С 6) циклоалкилиден", если не указано по-другому, определяют циклообразующий алкильный или алкилиде-8 022973 новый радикал или фрагмент; примеры указанных радикалов или фрагментов включают, соответственно,циклопропил, циклобутил, циклопентил и циклогексил или циклопропилиден, циклобутилиден, циклопентилиден и циклогексилиден. Термин "галоген", если не указано по-другому, обозначает здесь галогеновый радикал, такой как атом фтора, хлора, брома и йода. Если соединения по данному изобретению содержат по меньшей мере один асимметрический атом углерода, то они могут существовать в виде отдельных энантиомеров или диастереоизомеров или в виде их смеси, данное изобретение включает в свою область все возможные отдельные оптические изомеры в виде выделенных форм указанных соединений и в виде их смесей в любых пропорциях, например рацемические смеси. Примерами фармацевтически приемлемых солей соединений формулы I являются соли с органическими и неорганическими кислотами, такими как соляная, бромисто-водородная, йодисто-водородная,азотная, серная, фосфорная, уксусная, пропионовая, винная, фумаровая, лимонная, бензойная, янтарная,коричная, миндальная, салициловая, гликолевая, молочная, щавелевая, яблочная, малеиновая, малоновая,фумаровая, винная, п-толуолсульфоновая, метансульфоновая, глутаровая кислота и подобные. Соединения формулы I активны в качестве модуляторов кальциевых и/или натриевых каналов и,следовательно, применимы для предупреждения, облегчения и лечения патологий в широком диапазоне,включая, но не ограничиваясь этим, психиатрические, неврологические, сердечно-сосудистые, воспалительные, глазные, мочеполовые и желудочно-кишечных заболевания, где указанные выше механизмы описаны как играющие патологическую роль, причем указанные соединения характеризуются тем, что они, по существу, не имеют никакого CYP2D6-ингибирующего эффекта или демонстрируют существенно пониженный CYP2D6-ингибирующий эффект. Предпочтительная группа соединений формулы I по данному изобретению содержит соединения, в которыхW обозначает группу А-[(СН 2)m-O]-, где m равно 0, 1, 2 или 3; А обозначает (С 1-С 4) алкил, необязательно замещенный одним-тремя атомами фтора; (С 3-С 6) циклоалкил; фенил, необязательно замещенный галогеновой группой, или тиазолил;J независимо обозначает атом водорода; (С 1-С 4) алкил; атом хлора или фтора;R1 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный гидроксигруппой или (С 1 С 4) алкоксигруппой; или (С 3-С 6) циклоалкил;R2 обозначает атом водорода или (C1-C4) алкил;R2' обозначает атом водорода; (C1-C4) алкил, необязательно замещенный (C1-C4) алкокси; или фенильную группу, причем фенильная группа необязательно является замещенной (C1-С 4) алкоксигруппой;R3 обозначает атом водорода или (C1-C4) алкил;R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный,морфолинильный, пиперидинильный или пиперазинильный цикл, необязательно замещенный одной или двумя (C1-C2) алкильными группами, и пиперазинильный цикл необязательно является замещенным по другому N-атому (C1-C4) алкильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл, конденсированный с бензольным циклом;R5 обозначает атом водорода или фтора; иR6 обозначает атом фтора; либо в виде отдельного выделенного оптического изомера, либо в виде смеси изомеров при любом соотношении и их фармацевтически приемлемые соли. Более предпочтительная группа соединений формулы I содержит соединения, в которыхW обозначает группу А-[(СН 2)m-O]-, где m равно 1 или 2; А обозначает (C1-C4) алкил, необязательно замещенный одним-тремя атомами фтора; фенил, необязательно замещенный атомом хлора или фтора, или тиазолил;J независимо обозначает атом водорода; метил или атом фтора;R1 обозначает атом водорода; (C1-C4) алкил, необязательно замещенный гидроксигруппой или (C1C4)алкоксигруппой;R2 обозначает атом водорода или метил;R2' обозначает атом водорода; (C1-C4) алкил, необязательно замещенный метокси; или фенильную группу, причем фенильная группа необязательно является замещенной метоксигруппой;R3 обозначает атом водорода или (C1-C4) алкил;R3 и R4, взятые вместе с соседним атомом азота, образуют азетидинильный, пирролидинильный,морфолинильный, пиперидинильный или пиперазинильный цикл, причем пиперидинильный цикл является необязательно замещенным одной или двумя метильными группами, и пиперазинильный цикл не-9 022973 обязательно является замещенным по другому N-атому метильной, бензильной или фенилсульфонильной группой; или пирролидинильный, пиперидинильный, морфолинильный или пиперазинильный цикл,конденсированный с бензольным циклом;R5 обозначает атом водорода или фтора;R6 обозначает атом фтора; либо в виде отдельного выделенного оптического изомера, либо в виде смеси изомеров при любом соотношении и их фармацевтически приемлемые соли. Наиболее предпочтительно, если соединение формулы I по данному изобретению выбрано из группы, включающей следующие соединения: 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид (пример 1-1); 2-[2,2-дифтор-2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамид (пример 1-2); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-дипропилацетамид (пример 1-3); 2-[2,2-дифтор-2-(3-бутокси-4-метилфенил)этиламино]-N,N-диметилацетамид (пример 1-4); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-дибутилацетамид (пример 1-5); 2-[2,2-дифтор-2-(3-гексилоксифенил)этиламино]-N,N-диметилацетамид (пример 1-6); 2-2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-N,N-диметилацетамид (пример 1-7); 2-[2,2-дифтор-2-(3-пентилоксифенил)этиламино]-N,N-дипропилацетамид (пример 1-8); 2-2,2-дифтор-2-[3-(3-(3-фторфенил)пропокси)фенил]этиламино-N,N-диметилацетамид (пример 1-9); 2-2,2-дифтор-2-[3-(3-(3-хлорфенил)пропокси)фенил]этиламино-N,N-диметилацетамид (пример 1-10); 2-[2,2-дифтор-2-(3-бутокси-2-фторфенил)этиламино]-N,N-диметилацетамид (пример 1-11); 2-2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино-N,N-диметилацетамид (пример 1-12); 2-2,2-дифтор-2-[3-(3-тиазол-2-илпропокси)фенил]этиламино-N,N-диметилацетамид (пример 1-13); 2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-N,N-диметилацетамид (пример 1-14); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(пирролидин-1-ил)этанон (пример 1-15); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N-метил-N-фенилацетамид (пример 1-16); 2-2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино-1-(пирролидин-1-ил)этанон (пример 1-17); 2-2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-1-(пирролидин-1-ил)этанон (пример 1-18); 2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-1-(морфолин-4-ил)этанон (пример 1-19); 2-2,2-дифтор-2-[3- (3-фенилпропокси)фенил]этиламино-1-(морфолин-4-ил)этанон (пример 1-20); 2-2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-1-(морфолин-4-ил)этанон (пример 1-21); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(2 Н-бензо[b][1,4]оксазин-4(3 Н)-ил)этанон (пример 1-22); 2-[2,2-дифтор-2-(3-бензилоксифенил)этиламино]-1-(пирролидин-1-ил)этанон (пример 1-23); 2-2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино-N-метил-N-фенилацетамид (пример 1-24); 2-2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-N-метил-N-фенилацетамид (пример 1-25); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-1-(4-метилпиперазин-1-ил)этанон (пример 1-26); 2-2,2-дифтор-2-[3-(3-фенилпропокси)фенил]этиламино-1-(4-метилпиперазин-1-ил)этанон (пример 1-27); 2-2,2-дифтор-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-1-(4-метилпиперазин-1-ил)этанон 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-2-N,N-триметилпропанамид (пример 2-4); 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-4-N,N-триметилпентанамид (пример 2-5); 2-[2,2-дифтор-2-(3-бутоксифенил)этил]метиламино-N,N-диметилацетамид (пример 3-1); 2-[2,2-дифтор-2-(3-бутоксифенил)этил](3-метоксипропил)амино-N,N-диметилацетамид (пример 3-2); 2-[2,2-дифтор-2-(3-бутоксифенил)этил](2-метоксиэтил)амино-N,N-диметилацетамид (пример 3-3); 2-[2-фтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид (пример 4-1); 2-2-фтор-2-[3-(3-хлорбензилокси)фенил]этиламино-N,N-диметилацетамид (пример 4-2); 2-2-фтор-2-[3-(3-фторбензилокси)фенил]этиламино-N,N-диметилацетамид (пример 4-3),либо в виде отдельного выделенного оптического изомера, либо в виде смеси изомеров в любых пропорциях и их фармацевтически приемлемых солей. Соединения формулы I, предмет настоящего изобретения, получают синтетическим способом, который включает: а) взаимодействие соединения формулы II где J, W и n имеют такие же значения, как определено выше для формулы I, с подходящим агентом фторирования, таким как N-фторбензолсульфонамид, с получением соединения формулы III где J, W, n, R5 и R6 имеют такие же значения, как определено выше для формулы I;b) взаимодействие соединения формулы III с подходящим восстановителем, таким как литийалюминийгидрид, с получением соединения формулы IV где W, J, n, R5 и R6 имеют такие же значения, как определено выше для формулы I; с) введение защиты для аминогруппы соединения формулы IV, используя подходящий защитный агент, такой как ди-трет-бутоксидикарбонат, с получением соединения формулы V где W, J, n, R5 и R6 имеют такие же значения, как определено выше для формулы I, и PROT обозначает подходящую N-защитную группу, например трет-бутоксикарбонильную группу;d) взаимодействие соединения формулы V с подходящим галогеналкиламидом формулы VI где X обозначает атом галогена и R2, R2', R3 и R4 имеют такие же значения, как определено выше в формуле I, в результате которого получают соединение формулы I, где R1 обозначает атом водорода. Соединение формулы I, в котором J, W, n, R2, R2', R3, R4, R5 и R6 имеют такие же значения, как определено выше, и R1 имеет такие же значения, как определено выше, за исключением атома водорода,можно получить посредством взаимодействия соединения формулы VII- 11022973 где J, W, n, R2, R2', R3, R4, R5, и R6 имеют такие же значения, как определено выше в формуле I, с соединением R1-Z, где R1 имеет значения, приведенные выше, за исключением атома водорода, и Z обозначает атом галогена или подходящую уходящую группу, например метансульфонилокси, паратолуолсульфонилокси или трифторметансульфонилокси, в присутствии основания, или с карбонильным соединением формулы R7R8CO в присутствии восстановителя, где R7 и R8, оба, представляют атом водорода, или, взятые вместе с соседней карбонильной группой, представляют (С 2-С 4) алифатический альдегид или (С 3-С 4) алифатический кетон, необязательно замещенный гидроксильной группой или (C1-С 4) алкоксигруппой,или R7 и R8, взятые вместе с соседней карбонильной группой, представляют (С 3-С 8) алициклический кетон. Соединение по изобретению можно преобразовать в другое соединение по изобретению. Например,соединение формулы I, где W обозначает бензилокси-радикал, можно трансформировать в соответствующее гидроксипроизводное посредством каталитического гидрирования и затем провести взаимодействие с подходящим реагентом, заменяя исходный бензильный фрагмент другой группой, например трифторметилбензилом, фенилэтилом, трифторэтилом, циклопентилом и циклопропилметилом. Если требуется, соединение по изобретению можно преобразовать в фармацевтически приемлемую соль,и/или, если требуется, соль можно преобразовать в свободное соединение, и/или, если требуется, смесь энантиомеров или диастереоизомеров соединений по изобретению можно разделить на соответствующие отдельные оптические изомеры. Соединения формулы II и VI коммерчески доступны или их получают из коммерчески доступных соединений хорошо известными способами. Если получают соединение формулы I, где R1 обозначает атом водорода (т.е. соединение формулыVII), введение определенного выше радикала R1, который отличен от атома водорода, выполняют обычными способами, получая вторичные или третичные амины, например, способами алкилирования или восстановительного аминирования, как описано выше. Согласно предпочтительному варианту изобретения указанную реакцию алкилирования проводят в присутствии основания, и более предпочтительно выбирать указанное основание из K2CO3, триэтиламина и диизопропилэтиламина. Согласно другому предпочтительному варианту изобретения указанное восстановительное аминирование соединением R7R8CO, где R7 и R8 имеют такие же значения, как определено выше, проводят в присутствии восстановителя, выбранного из NaBH4, NaBH3CN и (полистирилметил)-триметиламмонийцианборгидрида. При получении описанных здесь соединений формулы I, исходных материалов и/или промежуточных соединений может быть полезно ввести защиту некоторых групп, которые чувствительны к реакционным условиям. Оценка полезности необязательного введения защиты, а также выбор подходящего защитного агента в соответствии с проводимым взаимодействием и подлежащей защите функциональной группой при получении соединений по изобретению известны специалистам в данной области. Удаление необязательных защитных групп выполняют по общеизвестным методикам. Основную справочную информацию по применению защитных групп в органической химии см. в работе Theodora W. Greene и Peter G.M. Wuts "Protective groups in organic synthesis", John WileySons,Inc., II Ed., 1991. Получение солей соединений формулы I выполняют известными способами. Для получения отдельных энантиомеров или диастереоизомеров соединения формулы I, если необходимо, указанное соединение можно получить, стерически контролируя синтез или используя реагенты,имеющие подходящую хиральность, или выделяя требуемый изомер из энантиомерной или диастереоизомерной смеси изомеров по обычным методикам. Например, отдельные оптически активные энантиомеры можно получить из их рацематов методом хиральной хроматографии или преобразованием их в смесь диастереоизомерных производных, выделением диастереоизомерных производных и восстановлением соответствующих энантиомеров. Диастереоизомеры можно выделять из смесей общеизвестными способами на основании различия их физико-химических свойств, например, методом хроматографии, дистилляции или фракционной кристаллизации. Фармакология Соединения по изобретению можно использовать для производства лекарственных средств, активных в качестве модуляторов натриевых и/или кальциевых каналов против расстройств, вызванных дисфункциями потенциалзависимых кальциевых и/или натриевых каналов, характеризующихся тем, что они, по существу, не имеют никакого CYP2D6-ингибирующего эффекта или демонстрируют существенно пониженный CYP2D6-ингибирующий эффект. Активность модуляции натриевых каналов фторированных фенилалкиламинопроизводных определяют в исследовании притока натрия, основанном на флуоресценции (табл. 1), применяя пэтч-кламп методики на конститутивных и/или Nav1.3 трансфицированных клеточных линиях (табл. 2) и кортикальных нейронах.CYP2D6-ингибирование оценивают, проводя исследования in vitro ингибирования с использованием суперсом, микросом из бакуловирусинфицированных клеток насекомых; бакуловирусы сконструированы для экспрессии одной или более кДНК ферментов, метаболизирующих лекарства (табл. 3).In vivo аналитическую активность указанных выше соединений оценивают на "крысиной модели с использованием полного адъюванта Фрейнда" и на "модели Беннетта невропатической боли у крыс".In vivo блокаду натриевого канала и противосудорожную активность определяют, применяя "тест с максимальным электрошоком" на мышах (табл. 4). Антиманиакальную активность определяют, применяя модель "амфетамин- и хлордиазепоксидиндуцированной гиперлокомоторной активности у мышей". Антишизофреническую и антинаркотическую активности оценивают, применяя "тест на когнитивное ухудшение при шизофрении" и "тест на кокаининдуцированную поведенческую сенсибилизацию" у крыс. Тесты на "острое раздражение уксусной кислотой мочевого пузыря крыс" и "промежуточное раздражение циклофосфамидом мочевого пузыря крыс" применяют в качестве моделей урологических заболеваний. Активность против мигрени определяют, применяя "тест на мигрень" у крыс. Такие вещества демонстрируют также "зависимость от применения и частоты", т.е. усиление блокады при высокочастотной стимуляции, когда происходит большая аккумуляция каналов в инактивированном состоянии, например, при нейропатологических состояниях. Функционально зависимая от применения блокада дает в результате подавление нейронной активности при высокой частоте возбуждения и меньшую блокирующую способность при нормальной скорости возбуждения, предполагая, что соединения по данному изобретению могут селективно подавлять аномальную активность кальциевых и/или натриевых каналов, не оказывая воздействия на физиологическую активность и снижая, таким образом,эффекты ЦНС-депрессантов (Catterall W.A., Trends Pharmacol. Sci. 8: 57-65 (1987. Соединения по изобретению являются in vivo активными при пероральном или интраперитонеальном введении при дозе в диапазоне от 0,1 до 100 мг/кг на различных животных моделях, описанных здесь далее. С точки зрения описанных выше механизмов действия, соединения по настоящему изобретению применимы для предупреждения или лечения невропатической боли. Невропатические болевые синдромы включают, и не ограничены этим, диабетическую невропатию; ишиалгию; неспецифическую боль в нижней части спины; боль при множественном склерозе; фибромиалгию; ВИЧ-связанную невропатию; невралгию, например, пост-герпетическую невралгию и тригеминальную невралгию, невралгию Мортона, каузалгию; и боль в результате физической травмы, ампутации, фантомную боль, боль, вызванную раковым заболеванием, токсинами или хроническими воспалительными состояниями; центральную боль, наблюдаемую, например, при таламических синдромах, смешанные центральные и периферические формы болей, например, комплексные локальные болевые синдромы (CRPS), также называемые рефлекторными симпатическими дистрофиями. Соединения по изобретению также применимы для лечения хронической боли. Хроническая боль включает, и не ограничена этим, хроническую боль, вызванную воспалением или связанным с воспалением состоянием, остеоартритом, ревматоидным артритом, острым поражением или травмой, боль в верхней части спины или боль в нижней части спины (в результате системного, локального или основного заболевания спины, такого как радикулопатия), боль в костях (вследствие остеоартрита, остеопороза,метастазов в кости или неизвестных причин), тазовую боль, боль, связанную с повреждениями спинного мозга, сердечную грудную боль, несердечную грудную боль, центральную постинсультную боль, миофасциальную боль, серповидно-клеточную боль, боль при раковом заболевании, болезни Фабри, СПИДе,гериатрическую боль или боль, вследствие головной боли, синдрома височно-нижнечелюстного сустава,подагры, фиброзного синдрома или синдрома торакального выхода, в частности ревматоидного артрита и остеоартрита. Соединения по изобретению также применимы для лечения острой боли, вследствие острого повреждения, заболевания, спортивно-медицинских повреждений, синдрома канала запястья, ожогов, растяжения и переутомления костно-мышечных связок, мышечно-сухожильного растяжения, шейноплечевых болевых синдромов, диспепсии, язвы желудка, язвы двенадцатиперстной кишки, дисменореи,эндометриоза или оперативного вмешательства (например, операции на открытом сердце или шунтирования), постоперационной боли, боли, связанной с почечными камнями, боли в желчном пузыре, боли,связанной с желчными конкрементами, родильной боли или зубной боли. Соединения по изобретению также применимы для лечения головных болей, таких как мигрень, головная боль напряжения, видоизмененная мигрень или развивающаяся головная боль, кластерная головная боль, а также вторичной головной боли, такой как головная боль вследствие инфицирования, метаболических нарушений или других системных заболеваний, и других острых головных болей, пароксизмальной гемикрании и подобных, являющихся результатом ухудшения упоминаемых выше первичных и вторичных головных болей. Соединения по изобретению также применимы для лечения неврологических состояний, таких как эпилепсия, включая простой частичный эпилептический припадок, комплексный частичный эпилептический припадок, вторичный генерализованный эпилептический припадок, также включая отсутствие припадков, миоклонический припадок, клонический припадок, тонический припадок, тонический клонический припадок и атонический припадок. Соединения по изобретению также применимы для лечения нейродегенеративных заболеваний различной природы, таких как болезнь Альцгеймера и другие состояния слабоумия, деменция с тельцами Леви, лобно-височная деменция и таупатии; боковой амиотрофический склероз, болезнь Паркинсона и другие паркинсоновские синдромы; наследственный тремор; другая спиноцеребеллярная дегенерация и невропатия Шарко-Мари-Тута. Соединения по изобретению также применимы для лечения когнитивных нарушений и психиатрических нарушений. Психиатрические нарушения включают, и не ограничены этим, глубокую депрессию, дистимию,манию, биполярное нарушение (например, биполярное нарушение типа I, биполярное нарушение типаII), циклотимное нарушение, быструю цикличность, ультрадианную цикличность, манию, гипоманию,шизофрению, шизофреноформные расстройства, шизоаффективные расстройства, изменение личности,расстройство внимание при гиперактивном поведении или без оного, галлюцинаторные расстройства,краткие психотические расстройства, совместные психотические расстройства, психотическое расстройство, вследствие общего медицинского состояния, индуцированные веществами психотические расстройства или психотическое нарушение, не определенное по-другому, тревожные расстройства, такие как генерализованное тревожное расстройство, панические расстройства, расстройство, связанное с посттравматическим стрессом, расстройства импульсного контроля, фобические расстройства, диссоциативные состояния и, кроме того, курение, наркотическую зависимость и алкоголизм. В частности биполярные нарушения, психоз, тревогу и зависимость. Соединения по изобретению также применимы для лечения таких заболеваний как головокружение, шум в ушах, мышечный спазм и другие расстройства, включающие, но не ограниченные этим, сердечно-сосудистые заболевания (например, сердечную аритмию, сердечный инфаркт или стенокардию,гипертонию, сердечную ишемию, церебральную ишемию) эндокринные заболевания (например, акромегалию или несахарный диабет), заболевания, при которых патофизиология нарушения включает чрезмерную, или гиперсекреторную, или, другим образом, несоответствующую клеточную секрецию эндогенного вещества (такого как катехоламин, гормон или фактор роста). Соединения по изобретению также применимы при селективном лечении болезней печени, таких как воспалительные заболевания печени, например хронический вирусный гепатит В, хронический вирусный гепатит С, алкогольные поражения печени, первичный билиарный цирроз, аутоиммунный гепатит, неалкогольный стеатогепатит и отторжение трансплантата печени. Соединения по изобретению ингибируют воспалительные процессы, воздействуя на все системы организма. Следовательно, применимы для лечения воспалительных процессов скелетно-мышечной системы, перечень примеров которых приведен далее, но не является полным перечнем всех целевых расстройств: артритные состояния, такие как анкилозирующий спондилит, цервикальный артрит, фибромиалгия, подагра, ювенильный ревматоидный артрит, пояснично-крестцовый артрит, остеоартрит, остеопороз, псориатический артрит, ревматоидное заболевание; расстройства, затрагивающие кожу и связанные ткани: экзема, псориаз, дерматит и воспалительные состояния, такие как солнечный ожог; расстройства дыхательной системы: астма, аллергический ринит и респираторный дистресс-синдром, болезни легких,которые включают воспаление, такие как астма и бронхит; хроническая обструктивная болезнь легких; расстройства иммунной и эндокринной систем: узелковый периартериит, тироидит, апластическая анемия, склеродерма, астенический бульбарный паралич, множественный склероз и другие демиелинизационные заболевания, энцефаломиелит, саркоидоз, почечный синдром, синдром Бехчета, полимиозит, гингивит. Соединения по изобретению также применимы для лечения заболеваний желудочно-кишечного(GI) тракта, таких как воспалительные заболевания кишечника, включая, но не ограничиваясь этим, язвенный колит, болезнь Крона, илеит, проктит, глютеновую болезнь, энтеропатии, микроскопический или коллагеновый колит, эозинофильный гастроэнтерит, или паучит, приобретенный после проктоколэктомии и после илеонатального анастомоза, и синдром раздраженного кишечника, в том числе любые расстройства, связанные с абдоминальной болью и/или абдоминальным дискомфортом, такие как пилороспазм, нервное расстройство пищеварения, спастическая толстая кишка, спастический колит, спастический кишечник, кишечный невроз, функциональный колит, слизистый колит и послабляющий колит,функциональная диспепсия, а также для лечения атрофического гастрита, вариолиформного гастрита,язвенного колита, язвы желудка, изжоги и других поражений желудочно-кишечного тракта, например,бактериями Helicobacter pylori, гастроэзофагеальной рефлюксной болезни, пареза желудка, такого как диабетический парез желудка, и других функциональных заболеваний кишечника, таких как неязвенная диспепсия (NUD), рвота, диарея и висцеральное воспаление. Соединения по изобретению также применимы для лечения заболеваний мочеполового тракта, таких как гиперактивный мочевой пузырь, простатит (хронический бактериальный и хронический небактериальный простатит), простадиния, интерстициальный цистит, недержание мочи и доброкачественная гиперплазия простаты, аднексит, тазовое воспаление, бартолинит и вагинит. В частности гиперактивного мочевого пузыря и недержания мочи. Соединения по изобретению также применимы для лечения глазных заболеваний, таких как ретинит, ретинопатии, увеит и острые повреждения глазной ткани, макулярной дегенерации или глаукомы,конъюнктивита. Соединения по изобретению также применимы для лечения расстройств питания, таких как нервная анорексия, в том числе подтипы типа ограничения и типа переедание/очищение; нервная булемия, в том числе подтипы с очищением и без очищения; ожирение; компульсивные расстройства питания; нарушение с перееданием и нарушение питания, не определенное по-другому. С учетом того факта, что соединения по данному изобретению, по существу, не оказывают никакого CYP2D6-ингибирующего эффекта или демонстрируют существенно пониженный CYP2D6 ингибирующий эффект, соединения по данному изобретению особо полезны для лечения описанных выше расстройств, вызванных дисфункциями потенциалзависимых натриевых и/или кальциевых каналов у пациентов, которых определяют как плохих метаболизаторов, или которые принимают лекарства,представляющие собой CYP2D6-ингибиторы. Будет понятно, что соединения по изобретению можно с пользой применять вместе с одним или большим количеством других терапевтических агентов. Примеры подходящих агентов для дополнительной терапии включают модуляторы серотониновых рецепторов, в том числе 5 НТ 1 В/1D-агонист, такой как триптан (например, суматриптан или наратриптан); агонист аденозиновых рецепторов A1; антагонист аденозиновых рецепторов А 2; пуринергический антагонист Р 2 Х, ЕР лиганд; модулятор NMDA, такой как антагонист глицина; модулятор АМРА; антагонист вещества Р (например, антагонист NK1); каннабиноид; агонист никотиновых рецепторов; -1 или -2 адренергический агонист; ацетаминофен или фенацетин; ингибитор 5-липоксигеназы; антагонист лейкотриеновых рецепторов; DMARD (например,метотрексат); габапентин, прегабалин и родственные соединения; L-допа и/или агонисты дофамина; ингибитор катехол-О-метилтрансферазы; трициклический антидепрессант (например, амитриптилин); нейрон-стабилизирующее антиэпилептическое лекарство; моноаминергический ингибитор захвата (например, венлафаксин); ингибитор матриксной металлопротеиназы; ингибитор синтазы оксида азота (NOS),например, ингибитор iNOS или nNOS; поглотитель свободных радикалов; ингибитор агрегации синуклеина; ингибитор холинэстеразы, холестеринснижающий агент; модулятор -секретазы; модулятор-секретазы; ингибитор агрегации -амилоида; ингибитор высвобождения или действия -фактора некроза опухолей; терапия антителами, например терапия моноклональными антителами; антивирусный агент, такой как нуклеозидный ингибитор (например, ламивудин) или модулятор иммунной системы(например, интерферон); опиоидный анальгетик, такой как морфин; антагонист ванилоидных рецепторов; анальгетик, такой как ингибитор циклооксигеназы-1 и/или циклооксигеназы-2; локальный анестетик, такой как лидокаин и его производные; стимулятор, в том числе кафеин; Н 2-антагонист (например,ранитидин); ингибитор протонового насоса (например, омепразол); антацид (например, гидроксид алюминия или магния; средство, устраняющее метеоризм (например, симетикон); противоотечное средство(например, фенилэфрин, фенилпропаноламин, псевдоэфедрин, оксиметазолин, эпинефрин, нафазолин,ксилометазолин, пропилгекседрин или леводезоксиэфедрин); средство против кашля (например, кодеин,гидрокодон, кармифен, карбетапентан или декстраметорфан); диуретик или седативное или неседативное антигистаминное средство; антипсихотический агент, в том числе типичные и атипичные антипсихотические средства (например, галоперидол, рисперидон, клозапин); антидепрессант, такой как селективные ингибиторы повторного захвата серотонина, ингибиторы повторного захвата серотонина и норадреналина, ингибиторы МАО и трициклические антидепрессантные лекарства; стабилизатор настроения (например, литий, ламотригин, вальпроат); транквилизатор (например, бензодиазепины, буспирон), антагонисты -адренергических рецепторов, морфин или производные морфина, другие блокаторы кальциевых или натриевых каналов. Следует понимать, что настоящее изобретение охватывает также применение соединения формулы (I) или его фармацевтически приемлемой соли в сопряжении с одним или большим количеством других терапевтических агентов. Для указанного применения соединения формулы (I) и другой терапевтический агент(ы) можно вводить совместно или последовательно. Соединения по настоящему изобретению применимы в медикаментах для людей и в ветеринарных медикаментах. Следует понимать, что используемые здесь термины "лечение" или "обработка" всякий раз, когда специально не определено по-другому, включают предупреждение, облегчение и излечение патологического поражения, в частности они включают лечение устоявшихся симптомов и профилактическую обработку. Соединения по настоящему изобретению для терапевтического или превентивного их применения при упоминаемых выше патологиях предпочтительно используют в качестве активных ингредиентов в фармацевтической композиции. Следовательно, еще одной целью настоящего изобретения являются фармацевтические композиции, содержащие терапевтически эффективное количество соединения по изобретению или его соли в смеси с фармацевтически приемлемым носителем. Таким образом, выражение "терапевтически эффективное" относительно "количества", "дозы" или"дозировки" соединений по данному изобретению обозначает "количество", "дозу" или "дозировку" любых указанных соединений, достаточную для лечения установленных симптомов и профилактики, указанных выше патологических заболеваний. Фармацевтические композиции, составляющие предмет настоящего изобретения, можно вводить в виде разнообразных дозированных форм с непосредственным или модифицированным высвобождением,например перорально в виде таблеток, пилюль, капсул, таблеток с сахарным или пленочным покрытием,жидких растворов, эмульсий или суспензий; ректально в виде суппозиториев; парентерально, например в виде внутримышечных препаратов и/или депо-препаратов; внутривенной инъекции или вливания; локально и трансдермально в виде пластыря, геля и крема. Подходящие фармацевтически приемлемые, терапевтически инертные органические и/или неорганические материалы носителей, применимых при получении такой композиции, включают, например,воду, желатин, гуммиарабик, лактозу, крахмал, целюлозу, стеарат магния, тальк, растительные масла,циклодекстрины, полиалкиленгликоли и подобное. Композици, содержащие фторированные арилалкиламинокарбоксамидные производные формулы I,которые определены выше, можно стерилизовать, и они могут дополнительно содержать хорошо известные компоненты, такие как, например, консерванты, стабилизаторы, смачивающие или эмульгирующие агенты, например парафиновое масло, манит моноолеат, соли для регуляции осмотического давления,буферы и подобное. Например, твердые формы для перорального приема могут содержать вместе с активным ингредиентом разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; лубриканты, например диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие агенты, например крахмалы, гуммиарабики, желатин,метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, например крахмал, альгиновую кислоту, альгинаты или натрийкрахмалгликолят; шипучие смеси; красители; подсластители; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; вообще нетоксические и фармакологически неактивные вещества, используемые в фармацевтических препаратах. Указанные фармацевтические препараты можно производить известным способом, например посредством смешивания, гранулирования, таблетирования, нанесения сахарного или пленочного покрытия. Получение целевых фармацевтических композиций по изобретению можно осуществлять по общеизвестным методикам. Пероральные препараты содержат препараты с длительным высвобождением, которые можно получить общеизвестным способом, например нанося энтеросолюбильное покрытие на таблетки и гранулы. Жидкие дисперсии для перорального введения могут представлять собой, например, сиропы,эмульсии и суспензии. Сиропы могут содержать в качестве носителя, например, сахарозу или сахарозу с глицерином,и/или маннитом, и/или сорбитом. Суспензии и эмульсии могут содержать в качестве носителя, например, природную камедь, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль и, если требуется, подходящее количество лидокаингидрохлорида. Растворы для внутривенных инъекций или вливаний могут содержать носитель, например стерильную воду,или предпочтительно они могут быть в виде стерильных водных изотонических физиологических растворов. Суппозитории могут содержать вместе с активным ингредиентом фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активное вещество, сложный эфир полиоксиэтиленсорбита и жирной кислоты или лецитин. Фармацевтические композиции, содержащие фторированные арилалкиламинокарбоксамидные производные формулы I, которые определены выше, содержат примерно от 0,1 до примерно 500 мг одного или большего количества активных ингредиентов, наиболее предпочтительно от 1 до 10 мг на стандартную дозу, например капсулу, таблетку, порошковую инъекцию, чайную ложку, суппозиторий и подобную форму. Специалист в данной области может легко определить оптимальные терапевтически эффективные дозы, предполагаемые для введения, и варьирует в основном в зависимости от сложности получения,способа введения и развития подвергаемого лечению состояния или нарушения. Кроме того, факторы,связанные с конкретным субъектом, принимающим лечение, в том числе возраст субъекта, масса, диета и время введениия, обуславливают необходимость регулирования дозы до подходящего терапевтически эффективного уровня. Экспериментальная часть 1 Н-ЯМР спектры записывают в растворе CDCl3 или ДМСО-d6 на спектрометре Varian Gemini 200 МГц. Химические сдвиги определяют как d с CDCl3 или ДМСО-d6 и D2O в качестве внутренних стандартов. ВЭЖХ/МС анализы выполняют на приборе Gilson, используя колонку X-Terra RP18 (5 мкм, 4,650 мм), соединенную с УФ-детектором (220 нм), и масс-спектрометр Finnigan Aqa (электрораспыление, положительная ионизация). Общие условия, применяемые для анализов: поток 1,2 мл/мин; температура колонки 50 С; А/В градиент элюирования (элюент А: 0,1% муравьиная кислота в воде; элюент В: 0,1% муравьиная кислота в ацетонитриле): 5-95% В от 0 до 8,0 мин, 95% В от 8,0 до 9,5 мин. Далее приведены сокращения, используемые в описании схем и примеров. ДХМ - дихлорметан;RT - комнатная температура; Вос 2 О - ди-трет-бутилдикарбонат. Примеры Для лучшей иллюстрации изобретения приведены следующие примеры. Пример 1-1. Гидрохлорид 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамидаH-ЯМР (300 МГц, ДМСО-d6)м.д.: 9,58 (шир. с, 2 Н), 7,47 (т, 1 Н), 6,98-7,29 (м, 3 Н), 4,08 (с, 2 Н),4,04 (т, 2 Н), 3,86 (т, 2 Н), 2,93 (с, 3 Н), 2,91 (с, 3 Н), 1,62-1,82 (м, 2 Н), 1,34-1,54 (м, 2 Н), 0,95 (т, 3 Н). Указанное выше соединение синтезируют по схеме 1. Схема 1 Стадия А. К раствору 2-(3-метоксифенил)ацетонитрила (2 г; 13,59 ммоль) в 13 мл сухого ДХМ, охлаждаемому при 0 С в атмосфере азота, медленно по капле добавляют 1 М раствор BBr3 в ДХМ (28,54 ммоль; 28,54 мл). Смесь перемешивают при комнатной температуре в течение 20 ч. Затем реакционную смесь выливают на лед, добавляют воду и органическую фазу экстрагируют три раза ДХМ, промывают насыщенным раствором соли и сушат над безводным Na2SO4. После выпаривания сырую смесь хроматографируют на силикагеле, используя смесь ПЭ/EtAc (80/20) в качестве элюента и получая 1,28 г (71%) 2-(3 гидроксифенил)ацетонитрила. Стадия В. К раствору 2-(3-гидроксифенил)ацетонитрила (2,29 г; 17,11 ммоль) в сухом ДМФА (25 мл) добав- 17022973 ляют K2CO3 (7,08 г; 51,33 ммоль), KI (0,61 г; 3,70 ммоль) и 1-бромбутан (4,69 г; 3,69 мл; 34,22 ммоль),перемешивают смесь при 60 С в течение 5 ч и затем при комнатной температуре в течение ночи. Реакционную смесь экстрагируют EtAc (150 мл) и промывают насыщенным раствором соли (150 мл): водную фазу подкисляют 0,1N HCl и снова экстрагируют этилацетатом. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и выпаривают. Сырую смесь очищают методом флэш-хроматографии(элюент: ПЭ/EtAc 99/1), получая после выпаривания 3,07 г (95%) 2-(3-бутоксифенил)ацетонитрила. Стадия С. Раствор 2-(3-бутоксифенил)ацетонитрила (903 мг; 4,80 ммоль) в сухом ТГФ (75 мл) охлаждают при-78 С и добавляют по капле трет-бутиллитий (1,6 М в пентане; 6,6 мл; 10,56 ммоль), поддерживая внутреннюю температуру от -75 до -78 С. Раствор перемешивают в течение 10 мин при -78 С, затем добавляют за 15 мин раствор N-фторбензолсульфонамида (N-FSI; 3,78 г; 12,00 ммоль) в сухом ТГФ (12 мл). Реакционную смесь перемешивают при -78 С в течение 2 ч, затем гасят 0,01N HCl при -78 С и доводят до комнатной температуры. Затем добавляют этилацетат (50 мл) и смесь выпаривают. Отфильтровывают 1,79 г осадка побочного продукта бензолсульфонамида (белое твердое вещество). Раствор промывают насыщенным раствором соли и сушат над безводным Na2SO4. После выпаривания сырой остаток флэшхроматографируют (элюент: петролейный эфир/этилацетат, 99,5/0,5, затем ПЭ/EtAc, 99/1), получая 559 мг (52%) чистого 2,2-дифтор-[2-(-3-метоксифенил)]ацетонитрила, и дополнительно очищают еще 355 мг того же продукта. Стадия D. Раствор AlCl3 (400 мг; 3,00 ммоль) в сухом этиловом эфире (6 мл) перемешивают при 0 С в течение 30 мин. К этой смеси добавляют предварительно охлажденную (0 С) суспензию LiAlH4 (1M в ТГФ; 3,00 мл; 3,00 ммоль) . Через 5 мин добавляют предварительно охлажденный (0 С) раствор 2,2-дифтор-[2-(3 метоксфенил)]ацетонитрила в сухом ТГФ (9 мл). Через 2 ч при 0 С взаимодействие завершается. Раствор гасят несколькими каплями насыщенного NaHCO3, экстрагируют три раза EtAc, сушат над безводнымNa2SO4, фильтруют и выпаривают. Получают 2,2-дифтор-2-(3-бутоксифенил)этиламин (587 мг) и используют его как сырой остаток далее на стадии Е. Стадия Е. 509 мг (2,22 ммоль) 2,2-дифтор-2-(3-бутоксифенил)этиламина в 41 мл сухого ТГФ перемешивают при комнатной температуре, добавляя при этом ди-трет-бутилдикарбонат (Вос 2 О) и Et3N. Смесь перемешивают при комнатной температуре в течение 24 ч. Растворитель выпаривают и сырой остаток очищают методом флэш-хроматографии, используя в качестве элюента ПЭ/EtAc, 97/3. Получают N-(третбутоксикарбонил)-2,2-дифтор-2-(3-бутоксифенил)этиламин в виде не совсем белого твердого вещества(481 мг, 66%). Стадия F. 150 мг (0,46 ммоль) N-(трет-бутоксикарбонил)-2,2-дифтор-2-(3-бутоксифенил)этиламина растворяют в сухом ДМФА (2,5 мл) и раствор охлаждают до 0 С. Добавляют NaH (60% в минеральном масле; 22 мг; 0,55 ммоль) и реакционную смесь перемешивают в течение 10 мин при 0 С и еще 10 мин при комнатной температуре. Реакционную смесь снова охлаждают при 0 С, затем добавляют N,Nдиметилхлорацетамид (73 мг; 0,60 ммоль) и перемешивание продолжают при комнатной температуре в течение 24 ч. Взаимодействие гасят водой, экстрагируют три раза EtAc, промывают насыщенным раствором соли. Органические фазы сушат над безводным Na2SO4, фильтруют и выпаривают. Остаток флэш-хроматографируют на силикагеле (элюент: ДХМ/EtAc, от 98/2 до 95/5). Получают 2-[N-(третбутоксикарбонил)-2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид (165 мг; 87%) в виде белого твердого вещества. Стадия G. 2-[N-(трет-бутоксикарбонил)-2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид(160 мг; 0,39 ммоль) растворяют в ДХМ (5 мл), затем добавляют 0,6 мл (2,4 ммоль) 4M HCl в диоксане и реакционную смесь оставляют стоять в течение ночи. Еще добавляют 2 экв. (0,2 мл) 4M HCl в диоксане(всего 0,8 мл) и смесь перемешивают в течение ночи. Растворитель выпаривают, добавляют диэтиловый эфир и затем выпаривают, получая 139 мг (100%) белого твердого гидрохлорида 2-[2,2-дифтор-2-(3 бутоксифенил)этиламино]-N,N-диметилацетамида (пример 1-1). Примеры с 1-2 по 1-42. Эти соединения получают по той же методике, которая описана на схеме 1,используя подходящие реагенты. Пример 1-2. Гидрохлорид 2-[2,2-дифтор-2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамидаMM: 328,41. Соотношение масса/заряд: 329,02 (МН+, ESI положит., 3,2KV, 25V, 350 С). 1 Н-ЯМР (300 МГц, ДМСО-d6)м.д.: 9,48 (шир. с, 1 Н), 7,47 (т, 1 Н), 7,04-7,24 (м, 3 Н), 4,24-4,51 (м,1 Н), 4,03 (т, 2 Н), 3,71-3,95 (м, 1 Н), 3,51-3,71 (м, 1 Н), 2,98 (с, 3 Н), 2,89 (с, 3 Н), 1,62-1,82 (м, 2 Н), 1,42 (д,3 Н), 1,34-1,54 (м, 2 Н), 0,95 (т, 3 Н). Указанное выше соединение синтезируют по схеме 2. Схема 2 Стадия A. Растворяют 75 мг (0,23 ммоль) N-трет-бутоксикарбонил-2,2-дифтор-2-(3-бутоксифенил)этиламина в сухом ДМФА (5 мл). Раствор охлаждают до 0 С и добавляют NaH (6,7 мг; 1,2 экв.). Раствор перемешивают при комнатной температуре в течение 10 мин, затем снова охлаждают до 0 С и добавляют 2-хлорN,N-диметилпропанамид (31 мг; 0,23 ммоль). Через 4 ч добавляют еще 1,2 экв. NaH (6,7 мг). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем гасят водой, выпаривают,остаток переносят в воду и EtAc. Органический слой отделяют и водный слой экстрагируют три разаEtAc. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и выпаривают. Результирующий сырой остаток флэш-хроматографируют (элюент: петролейный эфир/EtAc, от 9/1 до 8/2). Получают 2-[N-трет-бутоксикарбонил-2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамид (84 мг; 81%) в виде бледно-желтого масла. Стадия В. Растворяют 84 мг (0,196 ммоль) 2-[N-трет-бутоксикарбонил-2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамида в 3 мл ДХМ и добавляют 0,49 мл (1,96 ммоль; 10 экв.) 4M раствораHCl в диоксане. Через 8 ч добавляют еще 10 экв. (0,49 мл) 4M HCl в диоксане и смесь перемешивают в течение ночи. Добавляют еще 5 экв. (0,245 мл) 4M HCl в диоксане и смесь перемешивают далее в течение 24 ч. Раствор выпаривают, затем белый остаток дважды суспендируют в диэтиловом эфире и выпаривают. Остаток флэш-хроматографируют на силикагеле (в качестве элюента смесь ДХМ/МеОН 1/1, а затем МеОН/конц.NH3 95/5) и выделяют свободное основание 2-[2,2-дифтор-2-(3 бутоксифенил)этиламино]-N,N-диметилпропанамид в виде бледно-желтой жидкости. Соединение растворяют в ДХМ (3 мл) и добавляют 4M HCl в диоксане, доводя раствор до рН 2. Смесь перемешивают в течение 10 мин и затем выпаривают. Белый остаток дважды извлекают эфиром и выпаривают. Получают 45 мг (49%) гидрохлорида 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамида (пример 2-1). Примеры с 2-2 по 2-5. Эти соединения получают по методике, описанной на схеме 2. Пример 2-2. 2-[2,2-Дифтор-2-(3-бутоксифенил)этиламино]-3-метокси-N,N-диметилпропанамидH-ЯМР (300 МГц, ДМСО-d6)м.д.: 7,45 (т, 1 Н), 7,04-7,18 (м, 3 Н), 4,03 (т, 2 Н), 3,73-3,91 (м, 2 Н),3,70-4,13 (м, 2 Н), 2,86 (с, 3 Н), 2,84 (с, 3 Н), 2,80 (с, 3 Н), 1,62-1,82 (м, 2 Н), 1,37-1,57 (м, 2 Н), 0,94 (т, 3 Н). Указанное выше соединение синтезируют по схеме 3. Примеры с 3-2 по 3-3. Эти соединения получают по методике, описанной на схеме 3. Стадия A. Растворяют 107,5 мг (0,34 ммоль) свободного основания 2-[2,2-дифтор-2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида (см. пример 1-1) в сухом ТГФ (10 мл). К этому раствору добавляют последовательно формальдегид (36,5% водный раствор, 52,1 мкл; 0,69 ммоль), уксусную кислоту (2,5 мл) иMP-CNBH3 (2,3 ммоль/г; 325 мг; 0,75 ммоль). Через 1 ч перемешивания взаимодействие завершается. Еще через 1,5 ч перемешивания реакционную смесь выпаривают. Сырой остаток флэшхроматографируют на силикагеле, используя в качестве элюента смесь ДХМ/МеОН (99,5/0,5). Получают 73,1 мг (65%) бледно-желтого жидкого 2-[2,2-дифтор-2-(3-бутоксифенил)этил]метиламино-N,Nдиметилацетамида. Стадия В. Раствор 73,1 мг 2-[2,2-дифтор-2-(3-бутоксифенил)этил]метиламино-N,N-диметилацетамида в ДХМ (3 мл) перемешивают и добавляют несколько капель 4M HCl в диоксане до достижения рН 2. Реакционную смесь перемешивают в течение 5 мин и затем выпаривают. Белый твердый остаток дважды суспендируют в Et2O и выпаривают, получая 77,4 мг (96%) белого твердого гидрохлорида 2-[2,2 дифтор-2-(3-бутоксифенил)этил]метиламино-N,N-диметилацетамида (пример 3-1). Пример 3-2. Гидрохлорид 2-[2,2-дифтор-2-(3-бутоксифенил)этил](3-метоксипропил)амино-N,Nдиметилацетамида(ддд, 1 Н), 4,10 (с, 2 Н), 4,004 (т, 2 Н), 3,55 (тд, 1 Н), 3,33-3,47 (м, 1 Н), 2,95 (с, 3 Н), 2,91 (с, 3 Н), 1,56-1,78 (м,2 Н), 1,29-1,54 (м, 2 Н), 0,94 (т, 3 Н). Указанное выше соединение синтезируют по схеме 4 Схема 4(ДХМ), охлаждаемому при 0 С в инертной атмосфере, добавляют медленно по капле 1 М раствор BBr3 в ДХМ (28,54 ммоль; 28,54 мл). Смесь перемешивают при комнатной температуре в течение 20 ч. Затем реакционную смесь выливают на лед, добавляют воду и органическую фазу экстрагируют три раза дихлорметаном, промывают насыщенным раствором соли и сушат над безводным Na2SO4. После выпаривания сырую смесь очищают методом флэш-хроматографии на силикагеле, используя в качестве элюента смесь петролейный эфир/EtAc (80/20) и получая 1,28 г (71%) 2-(3-гидроксифенил)ацетонитрила. Стадия В. К раствору 2-(3-гидроксифенил)ацетонитрила (2,29 г; 17,11 ммоль) в сухом ДМФА (25 мл) добавляют K2CO3 (7,08 г; 51,33 ммоль), KI (0,61 г; 3,70 ммоль) и 1-бромбутан (4,69 г; 3,69 мл; 34,22 ммоль) и смесь перемешивают при 60 С в течение 5 ч и затем при комнатной температуре в течение ночи. ТСХ(ДХМ/EtAc 95/5) показывает отсутствие исходного материала. После выпаривания реакционную смесь экстрагируют этилацетатом (150 мл) и промывают насыщенным раствором соли (дважды по 150 мл): водную фазу подкисляют 0,1N HCl и снова экстрагируют этилацетатом. Объединенные органические слои сушат над безводным Na2SO4, фильтруют и выпаривают. Сырую смесь очищают методом флэшхроматографии (элюент: смесь петролейный эфир/этилацетат 99/1), получая после выпаривания 3,07 г(95%) 2-(3-бутоксифенил)ацетонитрила в виде бледно-желтого масла. Стадия С. К раствору 2-(3-бутоксифенил)ацетонитрила (371 мг; 1,96 ммоль) в ТГФ (16 мл) при -78 С добавляют по капле в атмосфере азота трет-бутиллитий (1268 мкл; 2,16 ммоль). Светло-желтый раствор меняет цвет на оранжевый, перемешивание продолжают в течение 1 ч. Добавляют по капле раствор Nфторбензолсульфонамида (618 мг; 1,96 ммоль) в ТГФ (2 мл) и перемешивают реакционную смесь при-78 С в течение 2 ч. ТСХ (петролейный эфир/EtAc 9:1) показывает отсутствие исходного материала и два более неполярных пятна. Далее реакционную смесь гасят, добавляя 0,01N HCl, затем еще добавляют воду и экстрагируют ДХМ (три раза). Объединенные органические слои сушат над Na2SO4, фильтруют и выпаривают. Сырой остаток очищают методом флэш-хроматографии (петролейный эфир/EtAc, 99/1),получая 217 мг (53%) 2-(3-бутоксифенил)-2-фторацетонитрила в виде бесцветного масла. Стадия D. К раствору 2-(3-бутоксифенил)-2-фторацетонитрила (109 мг, 0,53 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (2,10 мл; 2,10 ммоль) и реакционную смесь перемешивают при 0 С в течение 2 ч и затем при комнатной температуре в течение 6 ч. ЖХ/МС показывает почти полную конверсию. Реакционную смесь гасят, медленно добавляя несколько капель EtOH и несколько ка- 29
МПК / Метки
МПК: C07D 295/185, A61K 31/165, C07D 295/182, C07D 209/08, C07C 237/06, A61P 25/00, C07D 265/36, C07D 217/06
Метки: арилалкиламинокарбоксамидные, производные, фторированные
Код ссылки
<a href="https://eas.patents.su/30-22973-ftorirovannye-arilalkilaminokarboksamidnye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Фторированные арилалкиламинокарбоксамидные производные</a>
Предыдущий патент: Бeнзимидазоловые ингибиторы респираторно-синцитиального вируса
Следующий патент: Серосвязанные соединения для лечения офтальмологических заболеваний и расстройств
Случайный патент: Шланг с использованием высокопрочной проволоки некруглого сечения с повышенной усталостной выносливостью












