Производные сульфамоилфенил-уреидо-бензамидина в качестве противомалярийных агентов
Формула / Реферат
1. Соединение формулы (I)
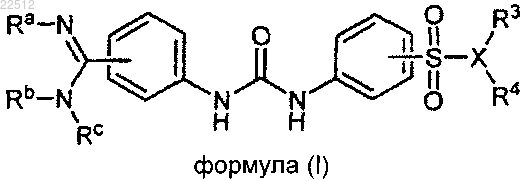
или его фармацевтически приемлемая соль,
где Ra представляет собой водород, гидроксил, C(O)-C1-C8-алкил, C(O)-C2-C8-алкенил или C(O)-C2-C8-алкинил;
Rb и Rc независимо представляют собой C1-C2-алкил, C1-C2-алкокси, гидрокси-C1-C2-алкил, C1-C2-алкокси-C1-C2-алкил, C1-C2-алкиламино-C1-C2-алкил или галогено-C1-C2-алкил или
Rb вместе с Rc образует гетероциклическое кольцо, выбранное из группы, состоящей из пиперидинила, пиперазинила, морфолинила, пирролидинила, тиазолидинила и тиоморфолинила, которое, возможно, имеет 1 заместитель R", или, где это химически приемлемо, два R", взятые вместе, могут образовывать 1 или 2 группы =O;
R' независимо представляет собой водород, -CN, C1-C4-алкил, C2-C4-алкенил, C2-C4-алкинил, циклопропил, пиридинил, пирролидинил, 1,3-диоксоланил или тетрагидрофуранил;
R" независимо представляет собой -(CH2)mR', -CO2R', -CON(R')2, -CR'O, C1-C8-алкил, C2-C8-алкенил, C2-C8-алкинил, диметиламино, C1-C2-алкокси-C1-C2-алкил, гидроксил или гидрокси-C1-C2-алкил, где группы R' являются такими, как определено выше, и могут быть выбраны независимо друг от друга;
m равно 1 или 2;
X вместе с R3 и R4 образуют фенильное кольцо, возможно замещенное галогеном, NO2 или
амино или X представляет собой N, где R3 представляет собой водород или гидрокси-C1-C2-алкил, R4 представляет собой водород, гидрокси-C1-C2-алкил, C1-C3-алкил или группу, выбранную из фенила, бензила, фенилэтила, фениламино или хинолинила, где каждая группа, возможно, замещена 1-3 атомами галогена или сульфонамидной группой; или R3 вместе с R4 образуют морфолиновое или изоиндолиновое кольцо, где каждое кольцо, возможно, замещено сульфонамидной группой.
2. Соединение или его фармацевтически приемлемая соль по п.1, где Ra представляет собой водород, Rb вместе с Rc образует пиперазиновое кольцо, которое, возможно, замещено R", X представляет собой N, R3 представляет собой водород и R4 представляет собой бензил, возможно, замещенный сульфонамидной группой.
3. Соединение по п.1, выбранное из группы, состоящей из
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамида;
4-(3-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамида;
4-(3-(3-(имино(пиперазин-1-ил)метил)фенил)уреидо)бензолсульфонамида;
1-(4-(4-бромфенилсульфонил)фенил)-3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)мочевины;
1-(4-(4-бромфенилсульфонил)фенил)-3-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевины;
1-(3-(имино(морфолино)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины;
1-(3-(имино(пирролидин-1-ил)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины;
1-(3-(имино(4-метилпиперазин-1-ил)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины;
1-(3-(имино(тиазолидин-3-ил)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины;
1-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины;
1-(4-(4-хлорфенилсульфонил)фенил)-3-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевины;
1-(4-(4-бромфенилсульфонил)фенил)-3-(3-((4-(гидроксиметил)пиперидин-1-ил)(имино)метил)фенил)мочевины;
3-(3-(4-(4-бромфенилсульфонил)фенил)уреидо)-N,N-бис-(2-метоксиэтил)бензимидамида;
1-(4-(4-бромфенилсульфонил)фенил)-3-(3-(имино(тиоморфолино)метил)фенил)мочевины;
1-(4-(4-бромфенилсульфонил)фенил)-3-(3-(имино(пирролидин-1-ил)метил)фенил)мочевины;
1-((3-(3-(4-(4-бромфенилсульфонил)фенил)уреидо)фенил)(имино)метил)пиперидин-4-карбоксамида;
1-(4-(4-аминофенилсульфонил)фенил)-3-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевины;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-метилбензолсульфонамида;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-пропилбензолсульфонамида,
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N,N-бис-(2-гидроксиэтил)бензолсульфонамида;
1-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)-3-(4-(морфолиносульфонил)фенил)мочевины;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(7-хлорхинолин-4-ил)бензолсульфонамида;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида;
метил-4-(имино(3-(3-(4-(N-(4-сульфамоилфенил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
4-(3-(3-(имино(морфолино)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида;
4-(3-(3-(имино(4-метилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида;
4-(3-(3-(имино(4-оксопиперидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-(2-гидроксиэтил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-(гидроксиметил)пиперидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
N-этил-N-(2-гидроксиэтил)-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамида;
4-(3-(3-(имино(тиоморфолино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
N,N-бис-(2-метоксиэтил)-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамида;
1-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперидин-4-карбоксамида;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(2,3,6-трифторбензил)бензолсульфонамида;
N-бензил-4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамида;
4-(3-(3-((4-этилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-пропилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-аллилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(2-(4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонил)гидразинил)бензолсульфонамида;
2-(4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонил)изоиндолин-5-сульфонамида;
4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(1-(4-сульфамоилфенил)этил)бензолсульфонамида;
4-(3-(3-(имино(морфолино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((1,1-диоксидотиоморфолино)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-(пиридин-4-илметил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(пирролидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
N-(2-(диэтиламино)этил)-N-метил-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамида;
4-(3-(3-((4-гидроксипиперидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((3-(диметиламино)пирролидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(2-(пирролидин-1-илметил)пирролидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
трет-бутил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
4-(3-(3-(имино(пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-метилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-изопропилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-пентилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-гептилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-ацетилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-пропионилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-пентаноилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
метил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
этил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
пропил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
4-(3-(3-((4-бутил-3-оксопиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
N,N-диметил-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамида;
4-(3-(3-((4-(2-цианоэтил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-(циклопропилметил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-((4-((1,3-диоксолан-2-ил)метил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-((тетрагидрофуран-2-ил)метил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
4-(3-(3-(имино(4-(2-метоксиэтил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
5-((4-(3-(3-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонамидо)метил)тиофен-2-сульфонамида;
4-(3-(4-((4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида;
метил-4-((ацетилимино)(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата;
метил-4-((октаноилимино)(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата и
метил-4-((гидроксиимино)(4-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилата,
или его фармацевтически приемлемая соль.
4. Фармацевтическая композиция для лечения малярии, содержащая соединение по п.1 и фармацевтически приемлемый носитель или разбавитель.
5. Способ лечения, или предупреждения, или облегчения малярии у субъекта, включающий введение соединения по п.1.
6. Способ по п.5, где малярия представляет собой малярию, вызванную штаммом Plasmodium falciparum.
Текст
где Ra, Rb, Rc, R3, R4 и X являются такими, как они определены в формуле изобретения, или их фармацевтически приемлемым солям, которые являются подходящими для терапии инфекций,вызванных простейшими, и, в частности, неосложненной или тяжелой малярии, вызванной плазмодиями. Настоящее изобретение относится к соединениям, которые являются подходящими для терапии инфекций, вызванных простейшими, и, в частности, неосложненной или тяжелой малярии, вызванной плазмодиями. Малярия представляет собой опасное для жизни паразитарное заболевание, передаваемое от человека к человеку посредством укуса самки малярийного комара (Tuteja R.; Malaria - an overview. FEBS J.,274 (2007), 4670-4679). Заболевание представляет собой проблему здравоохранения более чем в 90 странах, и более 2 млрд человек находится в группе риска, большинство из которых живут в тропической Африке. Повышенные группы риска включают детей, беременных женщин, рабочих-мигрантов и туристов или командированных, попадающих в эндемические области (Snow R.W., et al.; The global distribution of clinical episodes of Plasmodium falciparum malaria. Nature, 434 (2005), 214-217). В настоящее время зарегистрирован новый рост этого серьезного заболевания. Это вызвано несколькими факторами, такими как повышенная резистентность паразитов к лекарственному средству, повышенная резистентность москитов к инсектицидам, демографические или экологические изменения, вызванные человечеством. Общепризнанно, наиболее важным фактором для возрождения малярии в Африке к югу от сахары и Юго-Восточной Азии является развитие резистентности Plasmodium falciparum к дешевым и эффективным лекарственным средствам, находящимся в употреблении, особенно хлорохину и сульфадоксину/пириметамину. Также наблюдались летальные штаммы Plasmodium falciparum, резистентные к амодиахину, мефлохину и хинину (Hyde J.E.; Drug-resistant malaria - an insight. FEBS J., 274 (2007), 46884698). В настоящее время рекомендованными новыми видами лечения малярии в этих местах земного шара является так называемая ACT (комбинационная терапия на основе артемизинина), которая объединяет быстрый эффект артемизининового соединения с лекарственным средством, имеющим более длительный период полувыведения, выбранным из пула известных лекарственных средств. Например, Coartem объединяет артеметер и люмефантрин, тогда как Coarsucam объединяет артесунат и амодиахин; другие лекарственные средства данного типа выпускаются в настоящее время или находятся на последней стадии клинических испытаний (Wells T.N.C., et al.; New medicines to improve control и contribute tothe eradication malaria. Nature Reviews Drugs Discovery, 8 (2009), 879-891). Недавно Всемирной Организацией Здравоохранения (WHO) была одобрена ACT в качестве "стандартной линии поведения" для всех малярийных инфекций в тех областях, где Plasmodium falciparum является доминирующим инфицирующим видом. Широкое применение ACT и положительные зарегистрированные результаты укрепляют надежду на достижение в течение нескольких лет цели контролирования распространения малярии. В 2007 фонд Билла и Мелинды Гейтс обратил внимание на необходимость нового глобального усилия для искоренения малярии во всем мире (Mills A., et al.; Malaria eradication: the economic, financial andinstitutional challenge. Malaria Journal, 7(Suppl 1):S11 (2008. Инициативы ликвидировать малярию критическим образом зависят от эффективности таких АСТ-терапий. К сожалению, получены недавние тревожные доказательство того, что появилась резистентность к артемизинину на границе ТаиландКамбоджа (Dondrop A.M., et al.; Artemisinin Resistance in Plasmodium falciparum Malaria. New EnglandJournal of Medicine, 361 (2009) 455-467). Область границы Таиланд-Камбоджа исторически является источником мирового рассеяния резистентности к противомалярийному лекарственному средству. Резистентность к хлорохину и сульфадоксин-пириметамину у Plasmodium falciparum, возникающая там, распространяется через Азию и Африку и вызывает миллионы смертей. Очевидно, что для достижения цели контролирования и искоренения малярии поиск противомалярийных лекарственных средств должен продолжать выполнение работ по разработке новых лекарственных веществ для лечения малярии, в основном нацеленных на бесполые стадии развития паразита в крови. Предпочтительно такие новые лекарственные средства будут обладать механизмом действия, отличным от всех известных и используемых лекарственных средств, для предупреждения явления резистентности и для открытия возможности комбинированных терапий. Авторами изобретения обнаружены соединения на основе диарил-мочевины, которые обладают противопаразитарными свойствами (Leban J., et al.; Sulfonyl-phenyl-ureido benzamidines: a novel structuraltheir use as drugs. PCT Int. Appl. (2002) WO 02/070467). Некоторые из этих соединений были способны убивать хлорохин-устойчивый штамм Plasmodium falciparum, культивируемый in vitro. К сожалению, у таких соединений отсутствует способность полностью удалять паразитов из циркулирующей крови инфицированных животных моделей и это относили к недостаточным физико-химическим и фармакокинетическим свойствам. Неожиданно авторы изобретения обнаружили новый класс соединений с улучшенными свойствами: абсорбцией, распределением, метаболизмом и выделением ("ADME"), а также с лучшими физико-химическими характеристиками, которые, тем не менее, демонстрировали высокую противопаразитарную и противомалярийную активность наиболее вероятно с новым механизмом действия. Настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли,где Ra представляет собой водород, гидроксил, C(O)-C1-C8-алкил, C(O)-C2-C8-алкенил или C(O)-C2C8-алкинил;Rb и Rc независимо представляют собой C1-C2-алкил, C1-C2-алкокси, гидрокси-C1-C2-алкил, C1-C2 алкокси-C1-C2-алкил, C1-C2-алкиламино-C1-C2-алкил или галогено-C1-C2-алкил илиRb вместе с Rc образует гетероциклическое кольцо, выбранное из группы, состоящей из пиперидинила, пиперазинила, морфолинила, пирролидинила, тиазолидинила и тиоморфолинила, которое, возможно, имеет 1 заместитель R", или, где это химически приемлемо, два R", взятые вместе, могут образовывать 1 или 2 группы =O;R' независимо представляет собой водород, -CN, C1-C4-алкил, C2-C4-алкенил, C2-C4-алкинил, циклопропил, пиридинил, пирролидинил, 1,3-диоксоланил или тетрагидрофуранил;R" независимо представляет собой -(CH2)mR', -CO2R', -CON(R')2, -CR'O, C1-C8-алкил, C2-C8-алкенил,C2-C8-алкинил, диметиламино, C1-C2-алкокси-C1-C2-алкил, гидроксил или гидрокси-C1-C2-алкил; где группы R' являются такими, как определено выше, и могут быть выбраны независимо друг от друга;X вместе с R3 и R4 образуют фенильное кольцо, возможно, замещенное галогеном, NO2 или амино,или X представляет собой N, где R3 представляет собой водород или гидрокси-C1-C2-алкил, R4 представляет собой водород, гидрокси-C1-C2-алкил, C1-C3-алкил или группу, выбранную из фенила, бензила, фенилэтила, фениламино или хинолинила, где каждая группа, возможно, замещена 1-3 атомами галогена или сульфонамидной группой; или R3 вместе с R4 образуют морфолиновое или изоиндолиновое кольцо,где каждое кольцо возможно замещено сульфонамидной группой. Предпочтительно Ra представляет собой водород; Rb вместе с Rc образует пиперазиновое кольцо,которое возможно замещено R"; X представляет собой N; R3 представляет собой водород и R4 представляет собой бензил, возможно, замещенный сульфонамидной группой. В еще одном предпочтительном воплощении настоящее изобретение относится к соединению формулы (I), выбранному из группы, состоящей из или его фармацевтически приемлемой соли. Еще одно воплощение изобретения представляет собой фармацевтическую композицию для лечения малярии, содержащую соединение формулы (I) и фармацевтически приемлемый носитель или разбавитель. Еще одно воплощение изобретения представляет собой способ лечения, или предупреждения, или облегчения малярии у субъекта, включающий введение соединения формулы (I). В предпочтительном воплощении малярия представляет собой малярию, вызванную штаммомPlasmodium falciparum. В контексте настоящего изобретения алкильная группа, если не указано иное, означает линейный или разветвленный C1-C8-алкил, предпочтительно линейную или разветвленную цепь из одного-пяти атомов углерода; алкенильная группа, если не указано иное, означает линейный или разветвленный C2C8-алкенил и алкинильная группа, если не указано иное, означает линейную или разветвленную C2-C8-6 022512 алкинильную группу; C1-C8-алкильный, C2-C8-алкенильный и C2-C8-алкинильный остаток может быть выбран из группы, состоящей из группа алкокси означает O-алкильную группу, где алкильная группа такая, как определено выше; группа алкокси предпочтительно представляет собой метокси, этокси, изопропокси, трет-бутокси или пентокси-группу; галогеноалкильная группа означает алкильную группу, как определено выше, замещенную одним или более атомами галогена, предпочтительно замещенную одним-пятью атомами галогена, где галогеноалкильная группа предпочтительно представляет собой представляют собой F, Cl, Br или I, предпочтительно F; гидроксиалкильная группа означает HO-алкильную группу, где алкильная группа такая, как определено выше; алкиламиноалкильная группа означает алкил-NH-алкильную или алкил-N-диалкильную группу, где алкильная группа такая, как определено выше; галогено или галогеновая группа означает фтор, хлор, бром или йод; предпочтительно хлор или фтор. Компоненты, которые возможно замещены, как указано в данном описании изобретения, могут быть замещены, если не указано иное, в любом химически возможном положении. Если не указано иное, предполагается, что любой гетероатом гетероциклического кольца с незаполненными валентностями, указанный в данном описании изобретения, имеет атом(ы) водорода для заполнения валентностей. Когда какая-либо переменная встречается более одного раза в любом компоненте, каждое определение является независимым. Специалист в данной области техники, вследствие его/ее компетенции, осознает, что некоторые комбинации переменных характеристик, упомянутых в описании данного изобретения, приводят к химически менее стабильным соединениям. Это можно применить, например, к некоторым соединениям, в которых неблагоприятным для химической стабильности образом два гетероатома (S, N или O) будут непосредственно соприкасаться или будут отделены только одним атомом углерода. Те соединения по данному изобретению, в которых комбинация вышеуказанных переменных заместителей не приводит к химически менее стабильным соединениям, являются, следовательно, предпочтительными. В изобретении также раскрыта фармацевтическая композиция, содержащая соединение формулы (I) в свободной форме или в форме фармацевтически приемлемых солей и физиологически функциональных производных, вместе с фармацевтически приемлемым разбавителем или носителем. В еще одном аспекте настоящего изобретения также раскрыт способ лечения или профилактики заболеваний, которые имеют место вследствие поражения людей простейшими, который включает введе-7 022512 ние эффективного количества соединения формулы (I) и его физиологически приемлемых солей или физиологически функциональных производных. Изобретение также направлено на применение соединений формулы (I) и их фармакологически допустимых солей или физиологически функциональных производных для изготовления лекарственного средства для предупреждения и лечения заболеваний, при которых полезно подавление паразитов. Подходящие соли соединений формулы (I) согласно данному изобретению - в зависимости от замещения - представляют собой все соли присоединения кислоты или все соли с основаниями. Особенно можно отметить фармакологически приемлемые неорганические и органические кислоты и основания,обычно применяемые в фармации. Такие подходящие кислоты и основания представляют собой, с одной стороны, водонерастворимые и особенно водорастворимые соли присоединения кислоты с кислотами,такими как, например, соляная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота,2-(4-гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтойная кислота, где кислоты используют в получении соли - в зависимости от того, рассматривается одно- или многоосновная кислота, и в зависимости от того, какая соль является желательной - в эквимолярном количественном соотношении или в соотношении, отличном от него. С другой стороны, соли с основаниями являются, в зависимости от замещения, также подходящими. В качестве примеров солей с основаниями упоминаются соли лития, натрия, калия, кальция, алюминия, магния, титана, аммония, меглумина или гуанидиния, и здесь также основания используются в получении соли в эквимолярном количественном соотношении или в соотношении, отличном от него. Фармакологически неприемлемые соли, которые могут быть получены, например, в качестве продуктов в процессе получения соединений формулы (I) согласно данному изобретению в промышленном масштабе, превращают в фармакологически приемлемые соли способами, известными специалисту в данной области техники. Как известно специалисту, соединения формулы (I) согласно данному изобретению, а также их соли, могут содержать, например, при выделении в кристаллической форме, различные количества растворителей. Соответственно в объем изобретения включены все сольваты и, в частности, все гидраты соединений формулы (I) согласно данному изобретению, а также все сольваты и, в частности, все гидраты солей соединений формулы (I) согласно данному изобретению. Например, охвачены моно-, ди-, три- и тетрагидраты формулы (I). Соединения формулы (I) и их фармакологически приемлемые соли могут быть введены животным,предпочтительно млекопитающим, и, в частности, людям в качестве терапевтических средств сами по себе, в виде смесей друг с другом или в форме фармацевтических препаратов, которые обеспечивают возможность entreat или парентерального применения и которые в качестве активного компонента содержат эффективную дозу по меньшей мере одного соединения формулы (I) или его соли в дополнение к обычным фармацевтически безвредным эксципиентам и добавкам. Соединения формулы (I) также могут быть введены в форме их солей, которые можно получить путем приведения во взаимодействие соответствующих соединений с физиологически приемлемыми кислотами и основаниями. Терапевтические средства могут быть введены перорально, например в форме пилюль, таблеток,покрытых оболочкой таблеток, покрытых сахаром таблеток, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий или суспензий или в виде аэрозольных смесей. Введение, однако, можно также выполнять ректально, например в форме суппозиториев, или парентерально, например в форме инъекций или вливаний, или чрескожно, например в форме мазей, кремов или настоек. Кроме активных соединений формулы (I), фармацевтическая композиция может содержать дополнительные обычные, как правило, инертные вещества-носители или эксципиенты. Так, фармацевтические препараты могут также содержать добавки, такие как, например, наполнители, добавки, разрыхлители, связывающие вещества, скользящие вещества, увлажняющие агенты, стабилизаторы, эмульгаторы,консерванты, подсластители, красители, вкусовые вещества или ароматизаторы, буферные вещества, и,кроме того, растворители, или солюбилизаторы, или агенты для достижения депо-эффекта, а также соли для изменения осмотического давления, покровные вещества или антиоксиданты. Они также могут содержать два или более соединений формулы (I) или их фармакологически приемлемые соли, а также другие терапевтически активные вещества. Таким образом, соединения по настоящему изобретению можно применять в форме одного вещества самого по себе или в комбинации с другими активными соединениями, например с лекарственными средствами, уже известными для лечения вышеупомянутых заболеваний, в соответствии с чем в последнем случае отмечают благоприятный аддитивный, усиливающий эффект. Для получения фармацевтических препаратов можно использовать фармацевтически инертные неорганические или органические эксципиенты. Для получения пилюль, таблеток, покрытых оболочкой таблеток и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и так далее. Эксципиентами для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие полиолы, натуральные или отвержденные масла и так далее. Подходящими эксципиентами для получения растворов и сиропов являются, например, вода, сахароза, инвертный сахар, глюкоза, полиолы и так далее. Подходящими эксципиентами для получения инъекционных растворов являются, например, вода, спирты, глицерин, полиолы или растительные масла. Физиологически функциональные производные также включают пролекарства соединений по изобретению. Такие пролекарства могут метаболизироваться in vivo в соединение по изобретению. Эти пролекарства сами могут быть или могут не быть активными. Пролекарства соединений по настоящему изобретению включают, без ограничения ими: сложные эфиры, которые превращаются in vivo в соответствующий активный спирт, сложные эфиры, которые превращаются in vivo в соответствующую активную кислоту, имины, которые превращаются in vivo в соответствующие амины, имины, которые метаболизируют in vivo в соответствующее активное карбонильное производное (например, альдегид или кетон), 1-карбоксиамины, которые декарбоксилируются invivo в активный амин, фосфорилокси-соединения, которые дефосфорилируются in vivo фосфотазами в активные спирты, амидоксимы, которые превращаются в соответствующий амидин, и амиды, которые метаболизируют в соответствующий активный амин или кислоту соответственно. Определение пролекарств смотри, например, в Han Han H.K., Amidon G.L; Targeted Prodrug DesignMetabolism Reviews, 34 (2002), 565-579. Физиологически функциональные производные включают также,например, глюкурониды, эфиры серной кислоты, гликозиды и рибозиды. Соединения формулы (I) также можно применять в форме предшественника (пролекарства) или подходящим образом модифицированной форме, которая высвобождает активное соединение in vivo. Соединения согласно изобретению и лекарственные средства, полученные с ними, как правило,подходят для лечения заболеваний, которые имеют место в результате поражения людей или животных простейшими. Патогенные для животных и людей протозойные такого типа представляют собой преимущественно внутриклеточно активные паразиты классов Apicomplexa и Zoomastigophora, в частности трипаносомы, плазмодии (малярийные паразиты), лейшманиоз, бабезиоз и тейлериоз, Cryptosporidiidae,Sarcocystidae, Amoebae, Coccidia и трихомонады. Соединения или соответствующие лекарственные средства предпочтительно являются особенно подходящими для лечения заболеваний, вызванных плазмодиями, в частности для лечения тропической малярии, которую вызывает Plasmodium falciparum, для лечения доброкачественной трехдневной малярии, вызванной Plasmodium vivax и Plasmodium ovale и для лечения четырехдневной малярии, вызванной Plasmodium malariae; наиболее предпочтительным является применение соединений согласно изобретению для лечения кокцидиоза или малярийных заболеваний или для изготовления лекарственного средства или, если это приемлемо, пищи для лечения кокцидиозов или малярийных заболеваний. Лечение в таком случае можно осуществлять профилактически или куративно. Таким образом, в изобретении создаются доступные новые лекарственные средства для лечения различных форм малярии, в частности для лечения тропической малярии. Неожиданно, для соединений была доказана активность не только против штаммов Plasmodium falciparum, чувствительных к хлорохину, но также и против штаммов, резистентных к хлорохину. Соединения по настоящему изобретению также являются полезными для лечения заболеваний, которые вызывают эукариотические протисты рода Plasmodium. Данное изобретение относится к применению композиции по изобретению для изготовления лекарственного средства. Соединения по настоящему изобретению можно применять сами по себе или в комбинации с другими противомалярийными соединениями, такими как хлорохин, сульфадоксин/пириметамин, дапсон/пириметамин, сульфонамиды, галофантрин, амодиахин, мефлохин, хинин, хинидин, доксициклин,лумефантрин, примахин, прогуанил, атовахон, пиронаридин, хлорпрогуанил, артемизинин, артефлен,артеметер, артесунат или триметоприм. Типичные соединения согласно данному изобретению могут включать любое соединение, выбранное из следующих: Экспериментальная часть Указатель сокращений. В настоящее время используются следующие сокращения: DCM=дихлорметан; DMF=N,N'диметилформамид; MeOH=метанол; EtOH=этанол; DIEA=диизопропилэтиламид; TFA =трифторуксусная кислота; MeCN=ацетонитрил; HPLC=высокоэффективная жидкостная хроматография; к.т.=комнатная температура; экв.=молярные эквиваленты; ч=часы; ТСХ=тонкослойная хроматография; DMSOd6=дейтерированный метилсульфоксид; HPLC-MS=высокоэффективная жидкостная хроматография/масс-спектрометрия. Используемые реагенты. Следующие химические вещества были получены от Fisher Scientific, Германия: изопропанол,DMA, DCM, DMF, DIEA, 3-нитробензамидин, 3-аминобензамидин; дихлорид олова(II) дигидрат, муравьиная кислота, ацетонитрил, 4-трифторметиланилин, 3-хлоранилин, 2-броманилин, 2 аминобензонитрил, 2-бром-4,6-дифторанилин, 3-трифторметил-4-хлоранилин, 3-трифторметиланилин, 2 бром-4-трифторметиланилин, 3,6-бис-трифторметиланилин, 2,4-диброманилин, бутиламин, бензиламин,адамантиламин, оксаламид и сульфамид. Следующие химические вещества были получены от Acros Organics, Бельгия: 4-аминосульфонамид,3-изоцианатобензонитрил, н-бутилпиперазин, N-хлорсукцинимид, 4-гидроксипиперидин, пиперазин,гидроксиламин,3-нитробензальдегид,силикагель,4-(4-бромфенилсульфонил)анилин,4-(4 нитрофенилсульфонил)анилин, 4-(4-хлорфенилсульфонил)анилин, метилсульфоксид-d6. Следующие химические вещества были получены от Sigma-Aldrich Chemie GmbH, Germany: 4(хлорсульфонил)фенилизоцианат и 4-нитросульфонил-4-анилин, пирролидин, 1-метилпиперазин, тиазолидин, пиперидин-4-ил-метанол, бис-(2-метоксиэтил)амин, тиоморфолин, пиперидин-4-карбоксамид,метилпиперазин-1-карбоксилат,морфолин,4-пиперидон,2-(пиперазин-1-ил)этанол,2(этиламино)этанол,1-этилпиперазин,н-пропилпиперазин,1-аллилпиперазин,1-(пиридин-4 илметил)пиперазин, трет-бутилпиперазин-1-карбоксилат, 1-изопропилпиперазин, н-пентилпиперазин, н- 14022512 гептилпиперазин, 1-бутилпиперазин-2-он, N,N-диметиламин. Следующие химические вещества получали от Maybridge Chemical Comp. Ltd., Великобритания: 1,1-диоксо-1H-бензотиофен-6-иламин, 4-бензол-сульфонилфениламин и 3H-бензимидазол-5-иламин. Аналитическое определение. Аналитические определения HPLC-MS выполняли при помощи Waters 2700 Autosampler, Waters 1525 Multisolvent Delivery System и одинарного квадрупольного масс-спектрометра Micromass ZQ с электрораспылительным источником. Колонка: Chromolith Fast Gradient C18 (Merck), 502 мм, с предварительным фильтром из нержавеющей стали 2 мкм. Элюент А, Н 2 О+0,1% HCOOH; элюент В, MeCN. Препаративную HPLC-MS выполняли при помощи Waters 2700 Autosampler, Waters 600 Multisolvent Delivery System с препаративными насосными насадками (500 мкл), Waters 600S Controller и одинарного квадрупольного масс-спектрометра Waters ZQ электрораспылительным источником. Колонка:H-ЯМР выполняли при помощи Bruker AV300 (300,13 МГц) при температуре 305 К. Сокращения,использованные для идентификации пика, представляли собой: s=синглет; d=дублет; t=триплет;q=квартет; m=мультиплет; J=1H-1H константа взаимодействия. Способ получения. Соединения, описанные в данном документе, получали способами, описанными в следующих способах синтеза. Способ А. Общий способ синтеза соединений 1-3 1 экв. 4-аминосульфонамида(II) растворяли в DCM/DMF (раствор 3:1). 1 экв. 3 изоцианатобензонитрила(I) добавляли порциями при комнатной температуре и реакционную смесь оставляли перемешиваться в течение ночи. Осаждался 4-(3-(3-цианофенил)уреидо)бензолсульфонамид(III) и его отфильтровывали. Сухое цианосоединение (III) в атмосфере аргона растворяли в растворе 4 М HCl в смеси диоксан/MeOH 5:1 и оставляли перемешиваться в течение ночи при комнатной температуре. Растворитель удаляли, остаток промывали диэтиловым эфиром и полученный метил-3-(3-(4 сульфамоилфенил)уреидо)бензимидат приводили затем во взаимодействие с соответствующим вторичным амином в DMF при температурах в диапазоне от 55 до 75C. Продукт (1-3) получали после препаративной HPLC, используя колонку с обращенной фазой и градиент ацетонитрила в 0,1% НСООНводн. Способ В 1. Общий способ синтеза соединений 4-17 с синтезом 4-(замещенного)сульфониланилина Многостадийные способы синтеза данных соединений следуют способам, уже описанным в литературе (например, Е.D. Amstutz, et al., J. Am. Chem. Soc, 69 (8), p. 1922-1925, 1947), и требуется получение 4-(замещенного)сульфониланилина, который затем приводят во взаимодействие с 3-изоцианатобензонитрилом (I) для образования мочевины, которую в заключение превращают в целевые продукты. Стадия 1. Синтез (4-бромфенил)(4-нитрофенил)сульфана. 1 экв. 1-йодо-4-нитробензола(IV) и 4-бромбензолтиола (или соответствующего 4-замещенногобензолтиола) (V) растворяли в EtOH. Добавляли 8 экв. бикарбоната натрия и смесь перемешивали при температуре дефлегмации в течение 22 ч. Растворитель удаляли и остаток суспендировали в воде. Осадок фильтровали и промывали 1 М гидроксида натрия и водой. Конечный продукт получали после перекристаллизации из смеси этанол/вода (выход: 60%). Стадия 2. Синтез 1-бром-4-(4-нитрофенилсульфонил)бензола(VI).(4-замещенный)(4 нитрофенил)сульфан)] растворяли в концентрированной уксусной кислоте и медленно добавляли 30% водный раствор перекиси водорода (18 мл для 12 г сульфана). Раствор нагревали с обратным холодильником в течение 2 ч. При охлаждении раствора до комнатной температуры и добавления EtOH образовывался осадок. Осадок фильтровали, промывали ледяным EtOH и сушили (выход: 91%). Стадия 3. Синтез 4-(4-бромфенилсульфонил)анилина(VII). Суспензию хлорида олова(II) дигидрата. в концентрированной уксусной кислоте (66,1 г в 180 мл) обрабатывали 3 М раствором соляной кислоты в MeOH в течение 30 мин. Полученную суспензию добавляли порциями в течение 40 мин к суспензии 1-бром-4-(4-нитрофенилсульфонил)бензольного(IV) соединения (28,6 г) [или соответствующего 1-замещенного-4-(4-нитрофенилсульфонил)бензола], растворенного в уксусной кислоте, и перемешивали при 80C в течение 2 ч. Добавляли 2 л воды и в течение ночи образовывался осадок, который отфильтровывали и промывали 10% водным гидроксидом натрия и водой. Продукт кристаллизовали из горяче-холодного EtOH (выход: 69%). Стадия 4. Синтез 1-(4-(4-бромфенилсульфонил)фенил)-3-(3-цианофенил)мочевины(VIII). 4-(4-Бромфенилсульфонил)анилин(VII) [или соответствующий (4-замещенный)сульфониланилин](1 экв.) растворяли в растворе DCM/DMF 3:1. Добавляли по каплям раствор 3 изоцианатобензонитрила(I) (1 экв.) в DCM. Раствор перемешивали в течение ночи при комнатной температуре и после удаления растворителя продукт кристаллизовали из горяче-холодного MeOH (выход: 97%). Стадия 5. Синтез 1-(4-(4-бромфенилсульфонил)фенил)-3-(3-4-гидроксипиперидин-1 ил)(имино)метил)фенил)мочевины (4-17). 1 экв. 1-(4-(4-бромфенилсульфонил)фенил)-3-(3-цианофенил)мочевины(VIII) [или соответствующей 1-(4-(4-замещенной-фенилсульфонил)фенил)-3-(3-цианофенил)мочевины] в атмосфере аргона растворяли в 4 М HCl в смеси диоксан/MeOH 5:1. Раствор перемешивали в течение ночи при комнатной температуре, затем растворитель удаляли в вакууме. Остаток промывали диэтиловым эфиром, сушили в вакууме, растворяли в безводном MeOH (или DMF) и приводили во взаимодействие с 1,1-2 экв. пиперидин-4-ола (или 1,1-2 экв. соответствующего вторичного амина) при температуре от 55 до 70C в течение минимум 4 ч и максимум 22 ч. Продукты очищали либо флэш-хроматографией, используя колонку с силикагелем и подходящий градиент MeOH в DCM в качестве элюента, либо препаративной HPLC, используя колонку с обращенной фазой и градиент ацетонитрила в 0,1% НСООНводн. Способ В 2. Общий способ синтеза соединений 4-17, где 4-(замещенный)сульфониланилин имеется в продаже. Если 4-(замещенный)сульфониланилин (VII) имеется в продаже у коммерческого источника, синтезы выполняли, как описано в способе В 1, стадия 4 и стадия 5. Способ С. Общий способ синтеза соединений 18-71 Стадия 1. Получение цианомочевинного соединения (XII) 28 ммоль 3-аминобензонитрила (IX) растворяли в 40 мл DCM. Добавляли порциями 27 ммоль 4-изоцианатобензол-1-сульфонилхлорида (X) в течение 20 мин и смесь оставляли перемешиваться при комнатной температуре в течение ночи. Мочевинный продукт (XI) осаждали, фильтровали, промывали холодным DCM и использовали непосредственно на следующей стадии (выход 93%). Подходящее аминное или анилиновое соединение растворяли в MeCN и добавляли DIEA (от 1,2 до 3 экв., в зависимости от того, является соединение аминным или анилиновым). Раствор охлаждали до 0C и при интенсивном перемешивании добавляли порциями 1 экв. уреидо-сульфонилхлоридного соединения (XI). Реакционную смесь оставляли перемешиваться в течение ночи, позволяя температуре увеличиваться до к.т. Растворитель выпаривали и получали продукт (XII) посредством осаждения смесью этилацетат/петролейный эфир или смесью MeOH/диэтиловый эфир. При необходимости продукт затем очищали флэш-хроматографией, используя градиент MeOH в смесях DCM в качестве элюента. Стадия 2. Превращение цианосоединения в функционализированный бензамидин. 1 экв. цианоуреидо-соединения (XII) в атмосфере аргона растворяли с помощью 20 мл безводногоMeOH. Добавляли 4 М HCl в диоксане и раствор перемешивали в течение ночи при к.т. Растворитель удаляли; остаток собирали в диэтиловом эфире, который выпаривали. Эту операцию повторяли три раза до получения либо твердого, либо масляного продукта. 1 экв. сухого бензимидата растворяли в DMF и добавляли варьирующиеся количества выбранного вторичного амина (от 1,1 до 3 экв.). Раствор перемешивали в течение ночи при температурах в диапазоне от 55 до 70C. Растворитель удаляли и продукт очищали посредством препаративной HPLC и в градиенте ацетонитрила в 0,1% НСООНводн. Способ D. Общий способ синтеза соединения 74. Соединение 74 и аналоги могут быть получены посредством многостадийного синтеза, следуя способам, известным и описанным в литературе (например, Liu K.-C, et al., A particularly convenient preparation of benzohydroximinoyl chlorides (nitrile oxide precursors). Journal of Organic Chemistry, 45 (1980), 39163918; Johnson J.E., et al.; Bisamidoximes: Synthesis и Complexation with Iron(III). Australian Journal of Chemistry, 60 (2007), 685-690; Moehrle H., et al.; Assistance of N,N-disubstituted amidoximes in cyclodehydrogenation reactions. Zeitschrift fuer Naturforschung, B: Chemical Sciences, 47 (1992), 1333-1340). 0,13 моль соединения XIII растворяли в безводном DMF. Добавляли по 0,14 моль ацетата натрия и гидроксиламина гидрохлорида и смесь перемешивали в течение ночи при к.т. После удаления растворителя оксим осаждался из смеси MeOH/диэтиловый эфир (выход 70%). Данное соединение растворяли в безводном DMF и добавляли порциями в течение 30 мин 1,1 экв. N-хлорсукцинимида. Смесь перемешивали в течение ночи при к.т., затем ее вливали в ледяную воду. Суспензию экстрагировали этилацетатом и органический раствор промывали водой и рассолом. Соединение XIV получали после удаления органического растворителя. Соединению XIV растворяли в DCM и добавляли 1 экв. метилпиперазин-1 карбоксилата (или другого вторичного амина) в присутствии 2,1 экв. DIEA. Смесь перемешивали в течение 24 ч при к.т., растворитель удаляли и остаток переносили в этилацетат. Органический раствор промывали водой и рассолом и упаривали. Полученное масло очищали флэш-хроматографией с силикагелем и смесью DCM/MeOH 95:5 в качестве элюента. Нитросоединение XV восстанавливали посредством гидрирования с палладиевым катализатором с получением соответствующего аминосоединения XVI. Соединение XVI приводили во взаимодействие с 1 экв. соединения X в DCM вплоть до полного превращения в соответствующую диарилмочевину. Растворитель удаляли и остаток растворяли в безводном DMF. К данному раствору добавляли 1 экв. соответствующего аминосоединения и 1 экв. DIEA. Раствор перемешивали при 70C в течение ночи, затем растворитель удаляли и после очистки препаративной HPLC получали соединение 74. Перечень соединений. 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамид (1). Указанное в заголовке соединение получали, следуя способу А и используя 3 экв. нбутилпиперазина в качестве вторичного амина. Выход: 15%. [M+H]+: 459,1. 1H ЯМР (DMSO-d6): 11.45 (s, 1H, NH), 11.44 (s, 1H, NH), 7.87 (t уширенный, 1H, ArH), 7.77-7.68 (m,5H, ArH), 7.49 (t, 1H, J=7,9 Гц, ArH), 7.14 (s, 2H, NH2), 7.10 (d, 1H, J=7,1 Гц, ArH), сигнал воды частично закрывает группу сигналов, 2.34 (t, 2H, J=7,2 Гц, NCH2), 1.40 (m, 2H, СН 2), 1.29 (m, 2H, СН 2), 0.88 (t, 3H,J=7,2, CH3). 4-(3-(3-4-Гидроксипиперазин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамид (2). Указанное в заголовке соединение получали, следуя способу А и используя 2 экв. 4 гидроксипиперидина в качестве вторичного амина. Выход: 2%. [M+H]+: 418,0. 4-(3-(3-(Имино(пиперазин-1-ил)метил)фенил)уреидо)бензолсульфонамид (3). Указанное в заголовке соединение получали, следуя способу А и используя 2 экв. пиперазина в качестве вторичного амина. Выход: 13%. [M+H]+: 403,0. 1-(4-(4-Бромфенилсульфонил)фенил)-3-(3-4-бутилпиперазин-1-ил)(имино)метил)фенил)мочевина(4). Указанное в заголовке соединение получали, следуя способу В 2 (с 4-(4-бромфенилсульфонил)анилином) и используя 1,14 экв. 4-гидроксипиперидина в качестве вторичного амина. Продукт очищали флэш-хроматографией. Выход: 27%. [M+H]+: 599,1. 1-(4-(4-Бромфенилсульфонил)фенил)-3-(3-4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевина (5). Указанное в заголовке соединение получали, следуя способу В 1 или В 2 (с 4-(4 бромфенилсульфонил)анилином) и используя 2 экв. 4-гидроксипиперидина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 9%. [M+H]+: 556,6. 1(m, HH, Ar-H), 7.13 (m, 1H, Ar-H), 4.88 (d, 1H, J=3.5 Гц, OH), 3.84-3.13 (m, 5H, CH+2CH2) сигнал воды частично закрывает данную группу сигналов, 1.92-1.34 (m, 4H, 2 СН 2).H ЯМР (DMSO-d6): 10.09 (s, 1H, NH), 9.86 (s, 1H, NH), 9.25-8.65 (уширенный, 2 Н, NH2), 8.31 (m,2H, Ar-H), 8.10 (m, 2H, Ar-H), 7.85 (m, 2H, Ar-H), 7.73 (m, 1H, Ar-H), 7.63 (m, 2 Н, Ar-H), 7.52 (m, 1H, ArH), 7.43 (m, 1H, Ar-H), 7.14 (m, 1H, Ar-H), 3.46-3.28 (уширенный, 4 Н, 2NCH2) сигнал воды частично закрывает данную группу сигналов, 1.96-1.80 (уширенный, 4 Н, 2CH2). 1-(3-(Имино(4-метилпиперазин-1-ил)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевинаH ЯМР (DMSO-d6): 10.18 (уширенный, 1H, NH), 9.96 (уширенный, 1H, NH), 9.51 (уширенный, 1H,NH), 9.26 (уширенный, 1H, NH), 8.39 (m, 2 Н, Ar-H), 8.18 (m, 2 Н, Ar-H), 7.94 (m, 2 Н, Ar-H), 7.76 (m, 1H,Ar-H), 7.71 (m, 2 Н, Ar-H), 7.63 (m, 1H, Ar-H), 7.53 (m, 1H, Ar-H), 7.18 (m, 1H, Ar-H), 3.76-3.28 (уширенный, 4 Н, 2NCH2) сигнал воды частично закрывает данную группу сигналов, 2.55-2.38 (уширенный, 4 Н,2NCH2), сигнал DMSO частично закрывает данную группу сигналов, 2.23 (s, 3H, СН 3). 1-(3-(Имино(тиазолидин-3-ил)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевина (9). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-нитрофенилсульфонил)анилином и используя 1,5 экв. тиазолидина в качестве вторичного амина. Продукт очищали флэш-хроматографией. Выход: 1%. [M+H]+: 512,1. 1-(3-4-Гидроксипиперидин-1-ил)(имино)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевина (10). Указанное в заголовке соединение получали, следуя способу В 1 или В 2 с 4-(4 нитрофенилсульфонил)анилином и используя 1,5 экв. 4-гидроксипиперидина в качестве вторичного амина. Продукт очищали флэш-хроматографией. Выход: 10%. [M+H]+: 524,1. 1H ЯМР (DMSO-d6): 10.13 (s, 1H, NH), 9.91 (s, 1H, NH), 9.37-9.16 (уширенный, 2 Н, NH), 8.29 (AB,4 Н, J=63,3 Гц, 8,9 Гц, Ar-H), 7.82 (AB, 4 Н, J=67,0 Гц, 8,9 Гц, Ar-H), 7.78 (s, 1H, Ar-H), 7.61 (m, 1H, Ar-H),7.52 (t, 1H, J=7,9 Гц, Ar-H), 7.19 (m, 1H, Ar-H), 4.95 (d, 1H, J=3,6 Гц, OH), 3.87-3.83 (уширенный, 1H, СН),3.60-3.10 (уширенный, 4 Н, 2NCH2) сигнал воды частично закрывает данную группу сигналов, 2.00-1.40(уширенный, 4 Н, 2 СН 2). 1-(4-(4-Хлорфенилсульфонил)фенил)-3-(3-4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевина (11). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-хлорфенилсульфонил)анилином и используя 1,2 экв. пиперидин-4-ола в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 14%. [M+H]+: 513,0. 1H ЯМР (DMSO-d6): 10.44 (s, 1H, NH), 9.33 (уширенный, 1H, NH), 9.26 (s, 1H, NH), 9.05 (уширенный, 1H, NH), 7.91-7.80 (m, 5 Н, Ar-H), 7.70-7.64 (m, 4 Н, Ar-H), 7.56-7.47 (m, 2 Н, Ar-H), 7.18-7.16 (m, 1H,Ar-H), 4.91 (d, 1H, J=3,6 Гц, OH), 3.86-3.79 (уширенный, 1H, СН), сигнал воды закрывает группу сигналов 2NCH2, 1.84-1.52 (уширенный, 4 Н, 2 СН 2). 1-(4-(4-Бромфенилсульфонил)фенил)-3-(3-4-(гидроксиметил)пиперидин-1-ил)(имино)метил)фенил)мочевина (12). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-бромфенилсульфонил)анилином и используя 1,14 экв. пиперидин-4-илметанола в качестве вторичного амина. Остаток переносили в этилацетат и промывали 5%-ным NaHCO3, водой и рассолом. Продукт получали после кристаллизации со смесью метанол/этиловый эфир. Выход: 20%. [M+H]+: 570,9. 1H ЯМР (DMSO-d6): 10.22 (уширенный, 1H, NH), 10.03 (уширенный, 1H, NH), 9.40 (уширенный, 2 Н,NH), 8.11-7.86 (m, 9H, Ar-H), 7.84-7.79 (m, 1H, Ar-H), 7.76-7.68 (m, 1H, Ar-H), 7.39-7.35 (m, 1H, Ar-H),4.76 (t, 1H, J=5,0 Гц, OH), 4.07-4.02 (уширенный, 2 Н, СН 2), сигнал воды частично закрывает группу сигналов 2NCH2, 2.01-1.94 (уширенный, 3H, СН+СН 2), 1.50-1.40 (уширенный, 2 Н, СН 2). 3-(3-(4-(4-Бромфенилсульфонил)фенил)уреидо)-N,N-бис-(2-метоксиэтил)бензимидамид (13). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-бромфенилсульфонил)анилином и используя 1,14 экв. бис-(2-метоксиэтил)амина в качестве вторичного амина. Остаток переносили в этилацетат и промывали 5% NaHCO3, водой и рассолом. Продукт получали кристаллизацией со смесью MeOH/этиловый эфир. Выход: 30%. [M+H]+: 589,1. 1-(4-(4-Бромфенилсульфонил)фенил)-3-(3-(имино(тиоморфолино)метил)фенил)мочевина (14). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-бромфенил- 18022512(16). Указанное в заголовке соединение получали, следуя способу В 2 с 4-(4-бромфенилсульфонил)анилином и используя 1,14 экв. пиперидин-4-карбоксамида в качестве вторичного амина. Продукт осаждали непосредственно из реакционной смеси и отфильтровывали, промывали холодным диэтиловым эфиром и сушили. Выход: 54%. [M+H]+: 584,0. 1-(4-(4-Аминофенилсульфонил)фенил)-3-(3-4-гидроксипиперидин-1-ил)(имино)метил)фенил)мочевина (17). Суспензию хлорида олова(II) дигидрата (3 экв.) в концентрированной уксусной кислоте обрабатывали 3 М раствором соляной кислоты в метаноле в течение 30 мин. Полученную суспензию добавляли порциями к раствору 1-(3-4-гидроксипиперидин-1-ил)(имино)метил)фенил)-3-(4-(4-нитрофенилсульфонил)фенил)мочевины (10) в уксусной кислоте. Полученный раствор перемешивали 2 ч при 85C. Реакционную смесь гасили 5% водным раствором NaOH и экстрагировали этилацетатом. Указанное в заголовке соединение получали после препаративной HPLC. Выход: 18%. [M+H]+: 494,1. 1H ЯМР(DMSO-d6): 11.30 (s, 1H, NH), 11.22 (s, 1H, NH), 7.81 (m, 1H, Ar-H), 7.72-7,66 (m, 5H, Ar-H), 7.52-7.41 (m,3H, Ar-H), 7.10-7.06 (m, 1H, Ar-H), 6.62-6.57 (m, 2H, Ar-H), 6.05 (s уширенный, 2H, NH2), 3.87-3.76 (m,1H, CH), 3.75-3.67 (m, 2H, NCH2), сигнал воды частично закрывает группу сигналов, 1.90-1.78 (уширенный, 2 Н, СН 2), 1.58-1.44 (уширенный, 2 Н, СН 2). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-метилбензол-сульфонамид (18). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-Nметилбензолсульфонамида, следуя способу С и используя 2,2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 1%. [M+H]+: 473,2. 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-пропилбензол-сульфонамид (19). Указанное в заголовке соединение получали из 3-(3-(4-(N-пропилсульфамоил)фенил)уреидо)бензимидамида, следуя способу С и используя 2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 13%. [M+H]+: 501,3. 1H ЯМР (DMSO-d6): 9.77-9.27 (m уширенный, 3H, NH), 7.86 (уширенный, 1H, Ar-Н), 7.66-7.46 (m,6 Н, NH+Ar-H), 7.32 (m, 1H, Ar-H), 7.18-7.13 (m, 1H, Ar-H), сигнал воды частично закрывает а группу сигналов, 2.65-2.57 (m, 2H, СН 2), 1.58-1.44 (уширенный, 2 Н, СН 2), 1.36-1.20 (m, 4H, 2 СН 2), 0.84 (t, 3H,J=7,3 Гц, СН 3), 0.72 (t, 3H, J=7,4 Гц, СН 3). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N,N-бис-(2-гидроксиэтил)бензолсульфонамид (20). Указанное в заголовке соединение, получали из 4-(3-(3-цианофенил)уреидо)-N,N-бис-(2 гидроксиэтил)бензолсульфонамида, следуя способу С и используя 2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 18%. [M+H]+: 547,2. 1H ЯМР (DMSO-d6): 9.81 (уширенный, 2 Н, NH), 9.48 (уширенный, 1H, NH), 7.97 (уширенный, 1H,Ar-H), 7.79-7.57 (m, 6H, Ar-H), 7.29-7.24 (m, 1H, Ar-H), 3.55 (t, 4H, J=6,3 Гц, 2 СН 2), 3.18 (t, 4H, J=6,3 Гц,2 СН 2), сигнал воды частично закрывает группу сигналов, 1.68-1.56 (уширенный, 2 Н, СН 2), 1.43-1.31 (m,2H, СН 2), 0.95 (t, 3H, J=7,3 Гц, СН 3). 1-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)-3-(4-(морфолиносульфонил)фенил)мочевина(21). Указанное в заголовке соединение получали из 1-(3-цианофенил)-3-(4-(морфолиносульфонил)фенил)мочевины, следуя способу С и используя 2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 72%. [M+H]+: 529,2. 1H ЯМР (DMSO-d6): 9.83-9.13 (уширенный, 3H, 3NH), 7.90 (уширенный, 1H, Ar-H), 7.80-7.56 (m, 6 Н,Ar-H), 7.28-7.22 (m, 1H, Ar-H), 3.67 (m, 4 Н, 2 СН 2), 2.89 (m, 4 Н, 2 СН 2), сигнал воды частично закрывает группу сигналов, 1.60-1.42 (уширенный, 2 Н, СН 2), 1.41-1.28 (m, 2H, СН 2), 0.93 (t, 3H, J=7,2 Гц, СН 3). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(7-хлорхинолин-4-ил)бензолсульфонамид (22). Указанное в заголовке соединение получали из N-(7-хлорхинолин-4-ил)-4-(3-(3-цианофенил)уреидо)бензолсульфонамида, следуя способу С и используя 2,2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 25%. [M+H]+: 620,2. 1H ЯМР (DMSO-d6): 9.78-9.59 (уширенный, 2 Н, 2NH), 8.38 (d, 1H, J=8,9 Гц, Quin-Н), 8.26 (s, 1H,NH), 8.14 (d, 1H, J=6,1 Гц, Quin-H), 7.83 (m, 1H, Ar-H), 7.72 (m, 2H, Ar-H), 7.64 (d, 1H, J=2,1 Гц, Quin-H),7.62-7.46 (m, 4 Н, Ar-H), 7.33 (dd, 1H, J=8,9 Гц, 2,2 Гц, Quin-H), 7.13 (m, 1H, Ar-H), 6.91 (d, 1H, J=6,1 Гц,Quin-H), сигнал воды частично закрывает группу сигналов, 1.46-1.22 (m, 4H, 2 СН 2), 0.88 (t, 3H, J=7,2 Гц,- 19022512CH3). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамид (23). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида, следуя способу С и используя 1,2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 16,5%. [M+H]+: 614,2. 1H ЯМР (DMSO-d6): 10.10-9.31 (уширенный, 3H, 3NH), 7.82-7.48 (m, 9H, Ar-H), 7.25-7.16 (m, 3H, ArH), 7.15 (s уширенный, 2 Н, NH2), сигнал воды частично закрывает группу сигналов,2.33 (t, 2H, J=7,2 Гц,СН 2), 1.46-1.22 (2m, 4H, 2 СН 2), 0.88 (t, 3H, J=7,2 Гц, СН 3). Метил-4-(имино(3-(3-(4-(N-(4-сульфамоилфенил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (24). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида, следуя способу С и используя 1 экв. метилпиперазин-1-карбоксилата в качестве вторичного амина и 1 экв. DIEA в качестве основания. Продукт очищали препаративной HPLC. Выход: 5,3%. [M+H]+: 616,0. 4-(3-(3-(Имино(морфолино)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамид (25). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида, следуя способу С и используя 1 экв. морфолина в качестве вторичного амина и 0,5 экв. DIEA в качестве основания. Продукт очищали препаративной HPLC. Выход: 31,6%. [M+H]+: 559,1. 1H ЯМР (DMSO-d6): 10.69-9.10 (уширенный, 3H, 3NH), 8.44 (уширенный, 1H, NH), 7.81 (m, 1H, ArH), 7.75-7.59 (m, 7H, Ar-H), 7.49 (m, 1H, Ar-H), 7.22-7.08 (m, 5H, Ar-H+NH2), 3.73 (уширенный, 4 Н, 2 СН 2),3.54 (уширенный, 4 Н, 2 СН 2), сигнал воды интерферирует с этими двумя сигналами. 4-(3-(3-(Имино(4-метилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамид (26). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилфенил)бензолсульфонамида, следуя способу С и используя 1 экв. 1-метилпиперазина в качестве вторичного амина и 1 экв. DIEA в качестве основания. Продукт очищали препаративной HPLC. Выход: 33,8%.H ЯМР (DMSO-d6): 10.45 (уширенный, 1H, NH), 10.34 (уширенный, 1H, NH), 8.21 (s, 1H, NH), 7.777.60 (m, 8 Н, Ar-H), 7.51 (m, 1H, Ar-H), 7.27-7.21 (m, 2 Н, Ar-H), 7.19-7.12 (m, 3H, Ar-H+NH2), сигнал воды частично закрывает группу сигналов, 2.23 (s, 3H, СН 3). 4-(3-(3-(Имино(4-оксопиперидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (27). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 4-пиперидона в качестве вторичного амина и DIEA в качестве основания. Продукт очищали сначала препаративной HPLC и в заключение препаративной ТСХ (элюент: петролейный эфир/DCM/MeOH 2:3:1, содержащий 2% 7 М раствора NH3 вH ЯМР (DMSO-d6):9.69 (уширенный, 1H, NH), 9.62 (уширенный, 1H, NH), 8.08 (t, 1H, J-6,3 Гц, NH),7.92 (m, 1H, Ar-H), 7.77-7.52 (m, 8H, Ar-H), 7.46-7.41 (m, 2H, Ar-Н), 7.30-7.23 (m, 3H, Ar-H+NH2), 4.03 (d,2 Н, J=6,3 Гц, СН 2), 3.82 (уширенный, 4 Н, 2 СН 2), 2.64 (уширенный, 4 Н, 2 СН 2). 4-(3-(3-4-(2-Гидроксиэтил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (28). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,2 экв. 2-(пиперазин-1 ил)этанола в качестве вторичного амина. Продукт очищали препаративной ТСХ (элюент: петролейный эфир/DCM/MeOH 2:3:1, содержащий 2% 7 М раствора NH3 в MeOH). Выход: 2%. [M+H]+: 616,1. 1H ЯМР (DMSO-d6): 10.12 (уширенный, 1H, NH), 10.05 (уширенный, 1H, NH), 8.09 (t, 1H, J=6,2 Гц,NH), 7.79-7.62 (m, 8H, Ar-H), 7.53 (m, 1H, Ar-H), 7.47-7.41 (m, 2H, Ar-H), 7.29 (s уширенный, 2H, NH2),7.19-7.15 (m, 1H, Ar-H), 4.47 (t, 1H, J=5,3 Гц, OH), 4.03 (d, 2H, J=6,0 Гц, CH2), 3.51 (m, 2H, OCH2), сигнал воды частично закрывает группу сигналов, 2.59 (уширенный, 4 Н, 2 СН 2). 4-(3-(3-4-(Гидроксиметил)пиперидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (29). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 4-пиперидинилметанола в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 40%.H ЯМР (DMSO-d6): 9.61 (уширенный, 1H, NH), 9.54 (уширенный, 1H, NH), 8.08 (t, 1H, J=6,2 Гц,NH), 7.83 (m, 1H, Ar-H), 7.79-7.41 (m, 11H, Ar-H), 7.28 (s уширенный, 2 Н, NH2), 7.20-7.16 (m, 1H, Ar-H),4.57 (t, 1H, J=5,1 Гц, OH), 4.03 (d, 2H, J=6,1 Гц, СН 2), сигнал воды частично закрывает группу сигналов,- 20022512N-Этил-N-(2-гидроксиэтил)-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамид (30). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,1 экв. 2-(этиламино)этанола в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 7%. [M+H]+: 575,1. 4-(3-(3-(Имино(тиоморфолино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид(31). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,1 экв. тиоморфолина в качестве вторичного амина. Продукт очищали препаративной ТСХ (элюент DCM/MeOH 8:2). Выход: 28%.H ЯМР (DMSO-d6): 9.74 (уширенный, 1H, NH), 9.67 (уширенный, 1H, NH), 8.08 (t, 1H, J=6,3 Гц,NH), 7.87 (m, 1H, Ar-H), 7.77-7.51 (m, 8H, Ar-H), 7.46-7.41 (m, 2H, Ar-H), 7.28 (s уширенный, 2H, NH2),7.24-7.20 (m, 1H, Ar-H), 4.03 (d, 2H, J=6,2 Гц, CH2), сигнал воды частично закрывает группу сигналов,2.85-2.80 (m, 4H, 2 СН 2).N,N-бис-(2-Метоксиэтил)-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамид (32). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,1 экв. бис-(2 метоксиэтил)амина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 11%.H ЯМР (DMSO-d6): 9.62 (уширенный, 1H, NH), 9.56 (уширенный, 1H, NH), 8.07 (t, 1H, J=6,3 Гц,NH), 7.79-7.41 (m, 13H, Ar-H), 7.28 (s уширенный, 2 Н, NH2), 7.14-7.1 1 (m, 1H, Ar-H), 4.03 (d, 2 Н, J=6,2 Гц, СН 2), 3.82-3.48 (уширенный, 8 Н, 4 СН 2), сигнал воды частично закрывает группу сигналов. 1-(Имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперидин-4 карбоксамид (33). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. пиперидин-4 карбоксамида в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 40%.H ЯМР (DMSO-d6): 9.63 (уширенный, 1H, NH), 9.56 (уширенный, 1H, NH), 8.08 (уширенный, 1H,NH), 7.84 (m, 1H, Ar-H), 7.77-7,42 (m, 10H, Ar-H), 7.32 (уширенный, 1H, NH2), 7.28 (уширенный, 2 Н,NH2), 7.21-7.18 (m, 1H, Ar-H), 6.87 (уширенный, 1H, NH2), 4.04-4.02 (уширенный, 2 Н, СН 2), сигнал воды частично закрывает группу сигналов, 1.92-1.62 (уширенный, 4 Н, Ar-H). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (34). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,1 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 21%. [M+H]+: 628,1. 1(уширенный, 2 Н, NH2), 7.25-7.21 (m, 1H, Ar-H), 4.03 (d, 2H, J=6,3 Гц, СН 2), сигнал воды частично закрывает группу сигналов, 1.64-1.53 (уширенный, 2 Н, СН 2), 1.33 (m, 2H, СН 2), 0.91 (t, 3H, J=7,3 Гц, СН 3). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(2,3,6-трифторбензил)бензолсульфонамид (35). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(2,3,6 трифторбензил)бензолсульфонамида, следуя способу С и используя 3 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход (8%). [M+H]+: 603,2. 1(уширенный, 2 Н, СН 2), сигнал воды частично закрывает группу сигналов, 2.33 (m, 2 Н, СН 2), 1.46-1.23 (m,4 Н, 2 СН 2), 0.88 (t, 3H, J=7,2 Гц, СН 3).N-Бензил-4-(3-(3-4-бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)бензолсульфонамид (36). Указанное в заголовке соединение получали изN-бензил-4-(3-(3-цианофенил)уреидо)бензолсульфонамида, следуя способу С и используя 3 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 6%. [M+H]+: 549,2. 1(уширенный, 1H, NH), 7.83 (m, 1H, Ar-H), 7.75-7.67 (m, 5 Н, Ar-H), 7.47 (m, 1H, Ar-H), 7.32-7.19 (m, 5 Н,Ar-H), 7.11-7.07 (m, 1H, Ar-H), 3.95 (s уширенный, 2 Н, СН 2), сигнал воды частично закрывает группу сигналов, 2.33 (m, 2 Н, СН 2), 1.46-1.23 (m, 4 Н, 2 СН 2), 0.88 (t, 3H, J=7,2 Гц, СН 3). 4-(3-(3-4-Этилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (37). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)6 ензолсульфонамида, следуя способу С и используя 1,5 экв. 1-этилпиперазина в качестве вторичного амина. Продукт очищали флэш-хроматографией на силикагеле. Выход: 30%. [M+H]+: 600,1. 4-(3-(3-(Имино(4-пропилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (38). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. н-пропилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 30%. [M+H]+: 614,1. 1(d, 2H, J=6,3 Гц, СН 2), сигнал воды частично закрывает группу сигналов, 1.70-1.58 (m, уширенный, 2 Н,СН 2), 0.92 (t, 3H, J=7,4 Гц, СН 3). 4-(3-(3-4-Аллилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (39). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 5 экв. 1-аллилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 3%. [M+H]+: 612,1. 4-(2-(4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонил)гидразинил)бензолсульфонамид (40). Указанное в заголовке соединение получали из 4-(2-(4-(3-(3-цианофенил)уреидо)фенилсульфонил)гидразинил)бензолсульфонамида, следуя способу С и используя 2 экв. нбутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 10%.[M+H]+: 629,1. 2-(4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонил)изоиндолин-5 сульфонамид (41). Указанное в заголовке соединение получали из 2-(4-(3-(3-цианофенил)уреидо)фенилсульфонил)изоиндолин-5-сульфонамида, следуя способу С и используя 3 экв. нбутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 12%.H ЯМР (DMSO-d6): 11.37-11.17 (уширенный, 2 Н, 2NH), 7.81-7.87 (m, 7H, Ar-H), 7.50-7.41 (m, 2 Н,Ar-H), 7.28 (уширенный, 2 Н, NH2), 7.12-7.09 (m, 1H, Ar-H), 4.64-4.59 (m, 4 Н, 2 СН 2), сигнал воды частично закрывает группу сигналов, 2.33 (m, 2 Н, СН 2), 1.45-1.22 (m, 4 Н, 2 СН 2), 0.88 (t, 3H, J=7,2 Гц, СН 3). 4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(1-(4-сульфамоилфенил)этил)бензолсульфонамид (42). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(1-(4 сульфамоилфенил)этил)бензолсульфонамида, следуя способу С и используя 2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 8%. [M+H]+: 642,2. 4-(3-(3-(Имино(морфолино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (43). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. морфолина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 38%. [M+H]+: 573,1. 1H ЯМР (DMSO-d6): 9.81 (s уширенный, 1H, NH), 9.74 (s уширенный, 1H, NH), 9.37 (уширенный,1H, NH), 8.07 (t, 1H, J=6,2 Гц, NH), 7.85 (m, 1H, Ar-H), 7.76-7.62 (m, 7 Н, Ar-H), 7.55-7.42 (m, 3H, Ar-H),7.28 (s уширенный, 2 Н, NH2), 7.28-7.18 (m, 3H, NH2+Ar-H), 4.03 (d, 2 Н, J=6,0 Гц, СН 2), 3.74-3.72 (m уширенный, 4 Н, 2 СН 2), 3.54-3.58 (m уширенный, 4 Н, 2 СН 2). 4-(3-(3-(Имино(1,1-диоксидотиоморфолин)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (44). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,5 экв. 1,1-диоксотиоморфолина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 13%. [M+H]+: 621,1. 4-(3-(3-(Имино(4-(пиридин-4-илметил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (45). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. 1-(пиридин-4 илметил)пиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 11%. нал воды частично закрывает группу сигналов, 2.80-2.57 (m, 4H, 2 СН 2). 4-(3-(3-(Имино(пирролидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (46). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. пирролидина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 16%.N-(2-(Диэтиламино)этил)-N-метил-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамид (47). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. N1,N1-диэтил-N2 метилэтан-1,2-диамина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 12%. [M+H]+: 616,2. 1H ЯМР (DMSO-d6): 9.87-9.17 (очень уширенный, 4 Н, 4NH), 8.09 (t, 1H, J=6,3 Гц, NH), 7.96 (m, 1H,Ar-H), 7.77-7.55 (m, 8 Н, Ar-H), 7.45-7.41 (m, 2 Н, Ar-H), 7.28 (уширенный, 2 Н, NH2), 7.25-7.21 (m, 1H, ArH), 4.04 (d, 2H, J=6,3 Гц, СН 2), сигнал воды частично закрывает группу сигналов, 1.07 (m уширенный,6 Н, 2CH3). 4-(3-(3-4-Гидроксипиперидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (48). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,3 экв. 4-гидроксипиперидина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 42%. [M+H]+: 587,1. 1(d уширенный, 1H, J=3,4 Гц, OH), 4.03 (d, 2H, J=6,2 Гц, СН 2), 3.90-3.83 (m уширенный, 1H, CH), сигнал воды частично закрывает группу сигналов, 1.94-1.48 (уширенный, 4 Н, 2 СН 2). 4-(3-(3-3-(Диметиламино)пирролидин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (49). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. N,N-диметилпирролидин 3-амина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 9%. [M+H]+: 600,2. 1H ЯМР (DMSO-d6): 9.80-9.55 (уширенный, 3H, 3NH), 9.04 (уширенный, 1H, NH), 8.08 (t, 1H, J=6,4 Гц, NH), 7.94 (m, 1H, Ar-H), 7.76-7.51 (m, 8 Н, Ar-H), 7.45-7.41 (m, 2 Н, Ar-H), 7.28 (уширенный, 2 Н, NH2),7.25-7.21 (m, 1H, Ar-H), 4.03 (d, 2H, J=6,2 Гц, СН 2), 3.84-3.54 (уширенный, 4 Н, 2 СН 2), сигнал воды частично закрывает группу сигналов, 2.84-2.70 (уширенный, 6 Н, 2 СН 3), 2.37-2.01 (уширенный, 2 Н, СН 2). 4-(3-(3-(Имино(2-(пирролидин-1-илметил)пирролидин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (50). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. 1-(пирролидин-2 илметил)пирролидина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 12%.[M+H]+: 640,2. трет-Бутил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (51). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. трет-бутилпиперазин-1 карбоксилата в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 15%.H ЯМР (DMSO-d6): 9.58 (s уширенный, 1H, NH), 9.52 (s уширенный, 1H, NH), 9.45 (уширенный,1H, NH), 9.22 (s уширенный, 1H, NH), 8.08 (t, 1H, J=6,4 Гц, NH), 7.89 (m, 1H, Ar-H), 7.76-7.41 (m, 10H, ArH), 7.28 (s уширенный, 2 Н, NH2), 7.23-7.20 (m, 1H, Ar-H), 4.03 (d, 2 Н, J=6,3 Гц, СН 2), 3.74 (m уширенный,2 Н, СН 2), 3.63 (m уширенный, 2 Н, CH2), сигнал воды частично закрывает группу сигналов, 1.42 (s, 9H,3CH3). 4-(3-(3-(Имино(пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид(52). Указанное в заголовке соединение получали после удаления трет-бутилкарбоксилатной группы из соединения 51. 60 мг N-защищенного соединения растворяли в 5 мл тетрагидрофурана и медленно добавляли при перемешивании при 0C 5 мл 4 М HCl в диоксане. Через 2 ч перемешивания при к.т. растворитель удаляли. Продукт очищали препаративной HPLC. Выход: 85%. [M+H]+: 572,1. 1H ЯМР (DMSO-d6): 9.83-9.41 (очень уширенный, 4 Н, 4NH), 8.09 (t, 1H, J=6,4 Гц, NH), 7.93 (уширенный, 1H, Ar-H), 7.76-7.53 (m, 8 Н, Ar-H), 7.45-7.41 (m, 2 Н, Ar-H), 7.29 (s уширенный, 2 Н, NH2), 7.277.23 (m, 1H, Ar-H), 4.04 (d, 2H, J=6.3 Гц, СН 2), 3.95 (m уширенный, 2 Н, СН 2), 3.58 (m уширенный, 2 Н,СН 2), сигнал воды частично закрывает группу сигналов. 4-(3-(3-(Имино(4-метилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (53). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. N-метилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 12%. [M+H]+: 586,1. 1H ЯМР (DMSO-d6): 9.79 (s уширенный, 1H, NH), 9.66 (s уширенный, 1H, NH), 9.61 (уширенный,1H, NH), 9.44 (s уширенный, 1H, NH), 8.09 (t, 1H, J=6,3 Гц, NH), 7.93 (m, 1H, Ar-H), 1.16-1.54 (m, 8 Н, ArH), 7.45-7.41 (m, 2 Н, Ar-H), 7.29 (s уширенный, 2 Н, NH2), 7.24-7.21 (m, 1H, Ar-H), 4.04 (d, 2H, J=6,2 Гц,СН 2), сигнал воды частично закрывает группу сигналов. 4-(3-(3-(Имино(4-изопропилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (54). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,5 экв. 1-изопропилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 3%. [M+H]+: 614,2. 4-(3-(3-(Имино(4-пентилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (55). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. н-пентилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 13%. [M+H]+: 642,1. 1H ЯМР (DMSO-d6): 9.75 (очень уширенный, 1H, NH), 9.54 (уширенный, 1H, NH), 9.50 (уширенный,1H, NH), 9.40 (очень уширенный, 1H, NH), 8.08 (t, 1H, J=6,3 Гц, NH), 7.92 (уширенный, 1H, Ar-H), 7.767.53 (m, 8 Н, Ar-H), 7.44-7.40 (m, 2 Н, Ar-H), 7.27 (уширенный, 2 Н, NH2), 7.25-7.20 (m, 1H, Ar-H), 4.03 (d,2H, J=6,3 Гц, СН 2), сигнал воды частично закрывает группу сигналов, 1.65-1.53 (уширенный, 2 Н, СН 2),1.35-1.24 (m, 4H, 2 СН 2), 0.88 (t, 3H, J=6,8 Гц, СН 3). 4-(3-(3-4-Гептилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (56). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1,5 экв. н-гептилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 10%. [M+H]+: 670,1. 4-(3-(3-4-Ацетилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (57). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1 экв. 1-(пиперазин-1-ил)этанона в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 14%. [M+H]+: 614,1. 4-(3-(3-(Имино(4-пропионилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (58). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1 экв. 1-(пиперазин-1-ил)пропан 1-она в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 16%. [M+H]+: 628,0. 1H ЯМР (DMSO-d6): 10.52 (очень уширенный, 2 Н, 2NH), 9.38 (уширенный, 1H, NH), 8.05 (t уширенный, 1H, NH), 7.85 (уширенный, 1H, Ar-H), 7.76-7.66 (m, 7H, Ar-H), 7.54-7.41 (m, 3H, Ar-H), 7.29 (уширенный, 2 Н, NH2), 7.19-7.14 (m, 1H, Ar-H), 4.03 (d уширенный, 2 Н, СН 2), 3.67-3.50 (уширенный, 8 Н, 4 Н 2),2.35 (q, 2H, J=7,4 Гц, CH2), 1.00(t, 3H, J=7,4 Гц, СН 3). 4-(3-(3-(Имино(4-пентаноилпиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (59). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1 экв.1-(пиперазин-1-ил)пентан 1-она в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 9%. [M+H]+: 656,0. 1H ЯМР (DMSO-d6): 10.05-9.32 (очень уширенный, 4 Н, 4NH), 8.07 (t, 1H, J=6,3 Гц, NH), 7.85 (уширенный, 1H, Ar-H), 7.76-7.62 (m, 7 Н, Ar-H), 7.57-7.51 (m, 1H, Аг-Н), 7.46-7.40 (m, 2 Н, Ar-H), 7.29 (уширенный, 2 Н, NH2), 7.23-7.19 (m, 1H, Ar-H), 4.03 (d, 2 Н, J=5,9 Гц, СН 2), 3.69-3.52 (уширенный, 8 Н, 4 Н 2),2.33 (t, 2H, J=7,4 Гц, СН 2), 1.49 (m, 2 Н, 7,4 Гц, СН 2), 1.30 (m, 2 Н, 7,4 Гц, СН 2), 0.88 (t, 3H, J=7,4 Гц, СН 3). Метил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (60). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4- 24022512 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1 экв. метилпиперазин-1 карбоксилата в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 13%.H ЯМР (DMSO-d6): 10.87 (s уширенный, 1H, NH), 10.81 (s уширенный, 1H, NH), 8.05 (t уширенный,1H, NH), 7.85 (m уширенный, 1H, Ar-H), 7.77-7.69 (m, 7H, Ar-H), 7.53-7.42 (m, 3H, Ar-H), 7.30 (уширенный, 2H, NH2), 7.17-7.13 (m, 1H, Ar-H), 4.03 (d уширенный, 2 Н, CH2), 3.63 (s, 3H, CH3), сигнал воды закрывает группу сигналов. Этил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (61). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2 экв. этилпиперазин-1 карбоксилата в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 8%. [M+H]+: 644,1. 1H ЯМР (DMSO-d6): 9.61-9.21 (очень уширенный, 4 Н, 4NH), 8.08 (t, 1H, NH), 7.89-7.87 (m, 1H, ArH), 7.77-7.52 (m, 8 Н, Ar-H), 7.45-7.41 (m, 2 Н, Ar-H), 7.28 уширенный, 2 Н, NH2), 7.24-7.20 (m, 1H, Ar-H),4.12-4.02 (m, 4 Н, СН 2+ОСН 2), 3.82-3.40 (уширенный, 8 Н, 4 СН 2), 1.20 (t, 3H, J=7,1 Гц, СН 3). Пропил-4-(имино(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (62). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 1 экв. пропилпиперазин-1 карбоксилата. Продукт очищали препаративной HPLC. Выход (5%). [M+H]+: 658,1. 1H ЯМР (DMSO-d6): 11.06-10.71 (s уширенный, 2 Н, 2NH), 8.03 (t, 1H, J=6,1 Гц, NH), 7.85-7.81 (m уширенный, 1H, Ar-H), 7.77-7.66 (m, 7 Н, Ar-H), 7.51-7.41 (m, 3H, Ar-H), 7.29 (уширенный, 2 Н, NH2), 7.147.10 (m, 1H, Ar-H), 4.03 (d, 2H, J=6,0 Гц, СН 2), 3.98 (t, 2H, J=6,6 Гц, ОСН 2), сигнал воды закрывает группу сигналов, 1.59 (m, 2H, СН 2), 0.89 (t, 3H, J=7,4 Гц, СН 3). 4-(3-(3-4-Бутил-3-оксопиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (63). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 1-бутилпиперазин-2-она в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 35%. [M+H]+: 642,1. 1H ЯМР (DMSO-d6): 10.59 (очень уширенный, 2 Н, 2NH), 8.06 (t уширенный, 1H, NH), 7.85-7.82 (m уширенный, 1H, Ar-H), 7.77-7.66 (m, 7 Н, Ar-H), 7.54-7.41 (m, 3H, Ar-H), 7.29 (s уширенный, 2 Н, NH2),7.18-7.13 (m, 1H, Ar-H), 4.16 (уширенный, 1H, CO-CH2-N), 4.03 (d уширенный, 2 Н, СН 2), 3.68-3.44 (уширенный, 4 Н, 2 СН 2), 3.35 (t, 2H; J=7,2 Гц, СН 2), сигнал воды закрывает группу сигналов, 1.54-1.21 (m, 4H,2 СН 2), 0.90 (t, 3H; J=7,3 Гц, СН 3).N,N-Диметил-3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)бензимидамид (64). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. N,N-диметиламина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 54%. [M+H]+: 531,1. 1H ЯМР (DMSO-d6): 10.90 (s уширенный, 1H, 1NH), 10.85 (s уширенный, 1H, 1NH), 10.85 (s уширенный, 1H, 1NH), 9.14 (уширенный, 1H, NH), 8.05 (t уширенный, 1H, NH), 7.83 (m уширенный, 1H, ArH), 7.76-7.68 (m, 7 Н, Ar-H), 7.54-7.41 (m, 3H, Аг-Н), 7.30 (s уширенный, 2 Н, NH2), 7.16-7.11 (m, 1H, Ar-H),4.03 (уширенный, 2 Н, СН 2), 3.1 1 (s уширенный, 6 Н, 2 СН 3). 4-(3-(3-4-(2-Цианоэтил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (65). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида,следуя способу С и используя 2,2 экв. 3 пиперазинопропионитрила в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 57%. [M+H]+: 625,1. 4-(3-(3-4-(Циклопропилметил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (66). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида,следуя способу С и используя 2,2 экв. 1(циклопропилметил)пиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 57%. [M+H]+: 625,1. 1H ЯМР (DMSO-d6): 11.52 (s, 1H, 1NH), 11.50 (s уширенный, 1H, 1NH), 8.03 (t уширенный, 1H, NH),7.86 (m уширенный, 1H, Ar-H), 7.79-7.67 (m, 7 Н, Ar-H), 7.52-7.41 (m, 3H, Ar-H), 7.30 (s уширенный, 2 Н,NH2), 7.14-7.09 (m, 1H, Ar-H), 4.03 (уширенный, 2 Н, СН 2), 3.57 (уширенный, 4 Н, 2 СН 2), 2.60 (уширенный,4 Н, 2 СН 2), 2.26 (d, 2 Н, J=6,6 Гц, СН 2), 0.84 (m, 1H, СН), 0.47 (m, 2 Н, СН 2), 0.09 (m, 2 Н, СН 2). 4-(3-(3-4-1,3-Диоксолан-2-ил)метил)пиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (67). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4- 25022512 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 1-(1,3-диоксолан-2 илметил)пиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 43%.H ЯМР (DMSO-d6): 11.53 (s, 1H, 1NH), 11.49 (s уширенный, 1H, INH), 8.02 (t уширенный, 1H, NH),7.83 (m уширенный, 1H, Ar-H), 7.78-7.67 (m, 7 Н, Ar-H), 7.50-7.40 (m, 3H, Ar-H), 7.30 (s уширенный, 2 Н,NH2), 7.11-7.06 (m, 1H, Ar-H), 4.93 (t, 1H, J=4,4 Гц, СН), 4.02 (уширенный, 2 Н, СН 2), 3.90-3.74 (m, 4 Н,2 СН 2), 3.51 (уширенный, 4 Н, 2 СН 2), 2.65 (уширенный, 4 Н, 2 СН 2), 2.57 (d, 2H, J=4,4 Гц, СН 2). 4-(3-(3-(Имино(4-тетрагидрофуран-2-ил)метил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (68). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 1-(тетрагидро-2 фурилметил)пиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход; 48%. [M+H]+: 656,1. 1H ЯМР (DMSO-d6): 11.38 (s, 1H, 1NH), 11.35 (s уширенный, 1H, 1NH), 8.03 (t уширенный, 1H, NH),7.85 (m уширенный, 1H, Ar-H), 7.77-7.67 (m, 7 Н, Ar-H), 7.52-7.41 (m, 3H, Ar-H), 7.30 (s уширенный, 2 Н,NH2), 7.13-7.09 (m, 1H, Ar-H), 4.02 (уширенный, 2 Н, СН 2), 3.98-3.90 (m, 1H, СН), 3.77-3.50 (группа сигналов, 6 Н, OCH2+2pipCH2); DMSO сигнал закрывает группу сигналов, 1.98-1.41 (группа мультиплетов, 4 Н,2 СН 2). 4-(3-(3-(Имино(4-(2-метоксиэтил)пиперазин-1-ил)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (69). Указанное в заголовке соединение получали из 4-(3-(3-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 2,2 экв. 1-(2 метоксиэтил)пиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 41,5%. [M+H]+: 630,1. 1H ЯМР (DMSO-d6): 11.43 (s, 1H, 1NH), 11.40 (s уширенный, 1H, 1NH), 8.03 (t уширенный, 1H, NH),7.85 (m уширенный, 1H, Ar-H), 7.78-7.67 (m, 7 Н, Ar-H), 7.52-7.41 (m, 3H, Ar-H), 7.30 (s уширенный, 2 Н,NH2), 7.13-7.09 (m, 1H, Ar-H), 4.03 (уширенный, 2 Н, СН 2), 3.55 (уширенный, 4 Н, 2 СН 2), 3.45 (t, 2H; J=5,6 Гц, ОСН 2), 3.23 (s, 3H, CH3), 2.62-2.53 (уширенный+q, 6 Н, 3CH2). 5-4-(3-(3-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)фенилсульфонамидо)метил)тиофен-2-сульфонамид (70). Указанное в заголовке соединение получали из 5-4-(3-(3-цианофенил)уреидо)фенилсульфонамидо)метил)тиофен-2-сульфонамида, следуя способу С и используя 2,2 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 58%. [M+H]+: 634,1. 1H ЯМР (DMSO-d6): 11.22 (s, 1H, 1NH), 11.17 (s уширенный, 1H, 1NH), 8.23 (уширенный, 1H, NH),7.84 (m уширенный, 1H, Ar-H), 7.76-7.47 (m, 8 Н, NH2+6 Ar-Н), 7.33 (d, 1H, J=3,7 Гц, CH), 7.14-7.10 (m,1H, Ar-H), 6.91 (d, 1H, J=3,7 Гц, CH), 4.17 (уширенный, 2 Н, CH2), 3.55 (уширенный, 4 Н, 2CH2), DMSO сигнал закрывает группу сигналов, 2.34 (t, 2H, J=7,2 Гц, CH2), 1.46-1.23 (m, 4H, 2CH2), 0.88 (t, 3H, J=7,2 Гц, CH3). 4-(3-(4-4-Бутилпиперазин-1-ил)(имино)метил)фенил)уреидо)-N-(4-сульфамоилбензил)бензолсульфонамид (71). Указанное в заголовке соединение получали из 4-(3-(4-цианофенил)уреидо)-N-(4 сульфамоилбензил)бензолсульфонамида, следуя способу С и используя 3 экв. н-бутилпиперазина в качестве вторичного амина. Продукт очищали препаративной HPLC. Выход: 2,4%. [M+H]+: 628,1. Метил-4-ацетилимино)(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (72). 100 мг соединения 60 растворяли в 2 мл раствора DCM/DMF 1:1, содержащего 2 экв. DIEA. При перемешивании и при 0C добавляли порциями 6 экв. ацетилхлорида в течение 30 мин. Раствор перемешивали в течение ночи при комнатной температуре, затем добавляли воду и образовывался осадок. Осадок отделяли и указанное в заголовке соединение получали после очистки препаративной HPLC. Выход: 19%. [M+H]+: 672,2. Метил-4-октаноилимино)(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (73). Указанное в заголовке соединение получали, как описано для соединения 72 и используя 4 экв. октаноилхлорида. Продукт очищали препаративной HPLC. Выход: 1%. [M+H]+: 756,3. Метил-4-гидроксиимино)(3-(3-(4-(N-(4-сульфамоилбензил)сульфамоил)фенил)уреидо)фенил)метил)пиперазин-1-карбоксилат (74). Указанное в заголовке соединение получали, следуя способу D, начиная с 3-нитробензальдегида и используя 1 экв. 4-(аминометил)бензолсульфонамида в качестве конечного аминореагента. Продукт очищали препаративной HPLC. Выход: 1% (суммарно за 6 стадий). [M+H]+: 646,2. Типичные соединения формулы (I) по настоящему изобретению включают, без ограничения, следующие. Таблица 1
МПК / Метки
МПК: C07D 211/46, C07D 241/08, C07D 215/42, C07D 277/04, C07D 207/09, C07D 279/12, C07D 213/36, C07D 207/14, C07D 295/13, C07D 211/62, C07D 295/26, C07D 211/74, C07D 295/205, C07D 209/44, C07D 211/22
Метки: качестве, противомалярийных, сульфамоилфенил-уреидо-бензамидина, производные, агентов
Код ссылки
<a href="https://eas.patents.su/30-22512-proizvodnye-sulfamoilfenil-ureido-benzamidina-v-kachestve-protivomalyarijjnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные сульфамоилфенил-уреидо-бензамидина в качестве противомалярийных агентов</a>
Предыдущий патент: Оборудование и способы улучшенного регулирования объема подводной добычи
Следующий патент: Способ и реактор для биологической очистки сточных вод
Случайный патент: Система автоматической идентификации языка для многоязычного оптического распознавания символов












