Соединения хинолинамида в качестве положительных аллостерических модуляторов мускаринового рецептора m1
Формула / Реферат
1. Соединение формулы (I)
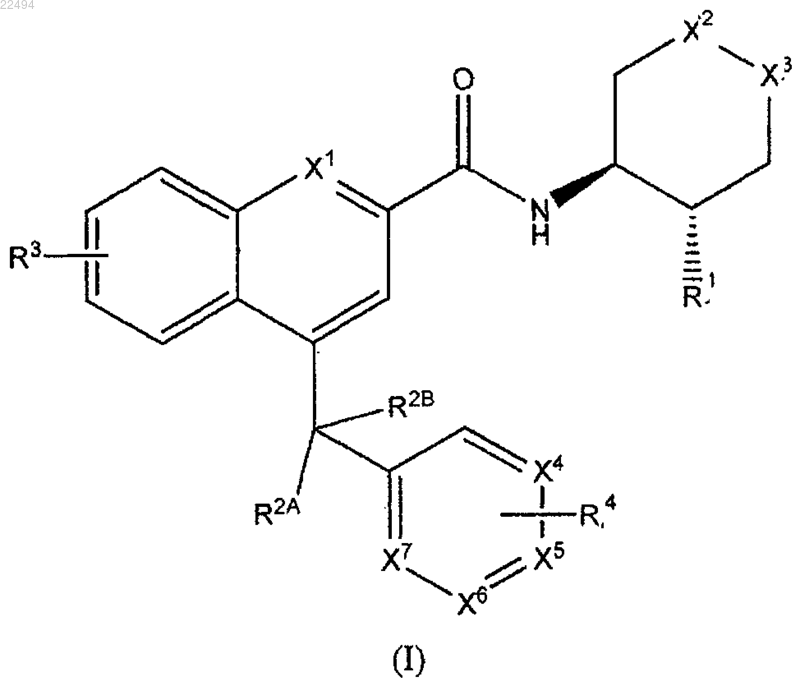
где X1 выбран из группы, состоящей из:
(1) N и
(2) N®O;
Х2-Х3 выбраны из группы, состоящей из:
(1) -CH2-CH2-,
(2) -O-CH2-,
(3) -CH2-O- или
(4) -CH2-;
X4, X5, X6 и X7, каждый, выбраны из группы, состоящей из:
(1) N,
(2) N®O,
(3) CH,
(4) O,
при условии, что один из X4, X5, Х6 и X7 может отсутствовать, таким образом образуя пятичленное кольцо;
R1 выбран из группы, состоящей из:
(1) водорода,
(2) галогена,
(3) -C1-6 алкила,
(4) -C2-6 алкинила,
(5) фенила,
(6) =O,
(7) =CH2,
(8) гидроксила,
причем R1 алкил, алкинил или фенил может быть замещен одним или более из:
(a) гидроксила или
(b) галогена;
R2A и R2B независимо выбраны из группы, состоящей из:
(1) водорода, и
(2) галогена,
или R2A и R2B вместе образуют =O;
R3 в случае необходимости присутствует на одном или более кольцевых атомов углерода и независимо выбран из группы, состоящей из:
(1) галогена,
(2) -O-C1-6 алкила,
(3) -S-C1-6 алкила или
(4) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из C, O, N, N®O или S, по меньшей мере один из которых представляет собой O, N, N®O или S, причем гетероарил может быть замещен C1-6 алкилом;
R4 в случае необходимости присутствует на одном или более кольцевых атомов и выбран из группы, состоящей из:
(1) гидроксила,
(2) галогена,
(3) -C1-6 алкила,
(4) -O-C1-6 алкила,
(5) -S-C1-6 алкила,
(6) -C3-8 циклоалкила,
(7) -CN,
(8) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из C, O, N, N®O или S, по меньшей мере один из которых представляет собой O, N, N®O или S,
(9) -O-гетероциклила,
и алкил, циклоалкил, арил или гетероарил в значении группы R4 может быть замещен одним или более из:
(a) галогена,
(b) гидрокси,
(c) -O-C1-6 алкила,
(d) -C1-6 алкила,
(e) -S-C1-6 алкила или
(f) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N, N®O или S, по меньшей мере один из которых представляет собой О, N, N®O или S,
причем алкил, арил или гетероарил может быть замещен одним или более из:
(i) галогена,
(ii) гидрокси,
(iii) -O-C1-6 алкила или
(iv) -C1-6 алкила,
или две группы R4 связаны вместе, образуя конденсированную гетероарильную группу с тремя или четырьмя кольцевыми атомами, причем указанные кольцевые атомы выбраны из С, О, N, N®O или S, по меньшей мере один из которых представляет собой О, N, N®O или S,
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его фармацевтически приемлемая соль, в котором один или два из X4, X5, X6 и X7 обозначает N или N®O и другие обозначают, каждый, CH или C, замещенный R4.
3. Соединение по одному из пп.1 или 2 или его фармацевтически приемлемая соль, в котором X1 обозначает N.
4. Соединение по одному из пп.1-3 или его фармацевтически приемлемая соль, в котором Х2-Х3 обозначают -CH2-CH2-, -O-CH2- или -CH2-O-.
5. Соединение по одному из пп.1-4 или его фармацевтически приемлемая соль, в котором X4 обозначает N и X5, X6 и X7 обозначают, каждый, CH или X4, X6 и X7 обозначают, каждый, CH и X5 обозначает N, или X4 и X6 обозначают, каждый, N, X7 обозначает CH, и X5 обозначает C, замещенный R4.
6. Соединение по одному из пп.1-5 или его фармацевтически приемлемая соль, в котором R1 обозначает галоген.
7. Соединение по одному из пп.1-6 или его фармацевтически приемлемая соль, в котором R2A и R2B обозначают, каждый, водород или R2A обозначает водород и R2B обозначает галоген.
8. Соединение по одному из пп.1-7 или его фармацевтически приемлемая соль, в котором R3A и R3B обозначают, каждый, водород или R3A обозначает галоген и R3B обозначает водород.
9. Соединение по одному из пп.1-8 или его фармацевтически приемлемая соль, в котором каждый из R2A, R2B, R3A и R3B обозначает водород.
10. Соединение по одному из пп.1-9 или его фармацевтически приемлемая соль, в котором R4 присутствует на одном из кольцевых атомов и выбран из группы, состоящей из:
(1) галогена,
(2) -C1-6 алкила или
(3) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N, N®O или S, по меньшей мере один из которых представляет собой О, N, N®O или S,
причем указанный алкил или гетероарил R4 в случае необходимости замещен одним или более из:
(a) галогена,
(b) гидрокси,
(c) -O-C1-6 алкила,
(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или
(е) -S-C1-6 алкила.
11. Соединение по п.1, причем соединение формулы (I) является соединением формулы (II)
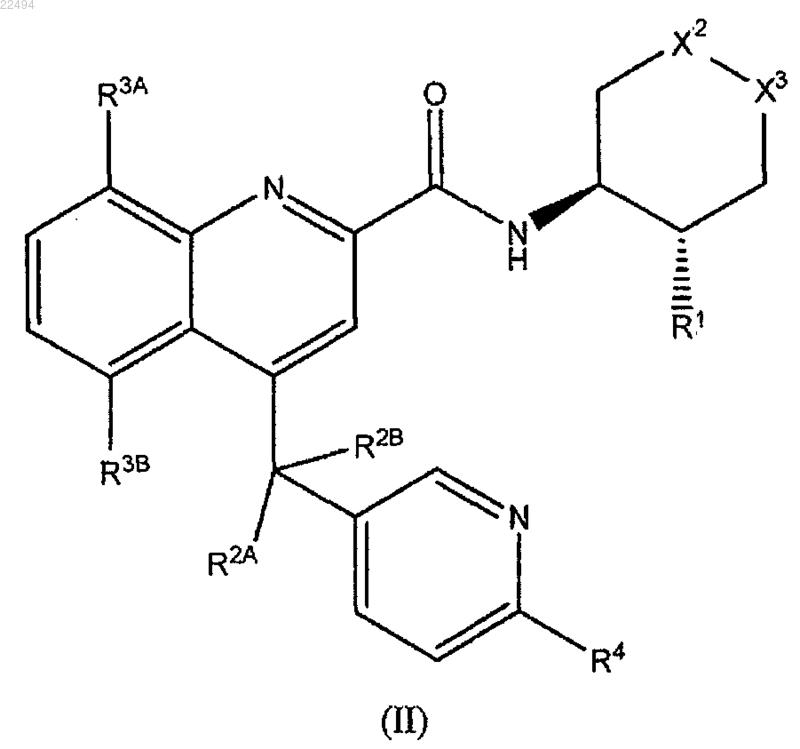
или его фармацевтически приемлемая соль, в которой X2, X3, R1, R2A, R2B, R3A, R3B и R4 имеют значения, определенные в п.1.
12. Соединение по п.11 или его фармацевтически приемлемая соль, в котором Х2-Х3 обозначают -CH2-CH2-, -O-CH2- или -CH2-O-.
13. Соединение по п.11 или его фармацевтически приемлемая соль, в котором R1 обозначает галоген.
14. Соединение по п.11 или его фармацевтически приемлемая соль, в котором R2A и R2B обозначают, каждый, водород или R2A обозначает водород и R2B обозначает галоген.
15. Соединение по п.11 или его фармацевтически приемлемая соль, в котором R4 выбран из группы, состоящей из:
(1) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N или S, по меньшей мере один из которых представляет собой О, N или S,
(2) галогена,
(3) гидрокси,
(4) -O-C1-6 алкила,
(5) -C1-6 алкила или
(6) -S-C1-6 алкила,
причем указанный алкил или гетероарил R4 могут быть замещены одним или более из:
(a) галогена,
(b) гидрокси,
(c) -O-C1-6 алкила,
(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или
(e) -S-C1-6 алкила.
16. Соединение по п.1, причем соединение формулы (I) является соединением формулы (III)
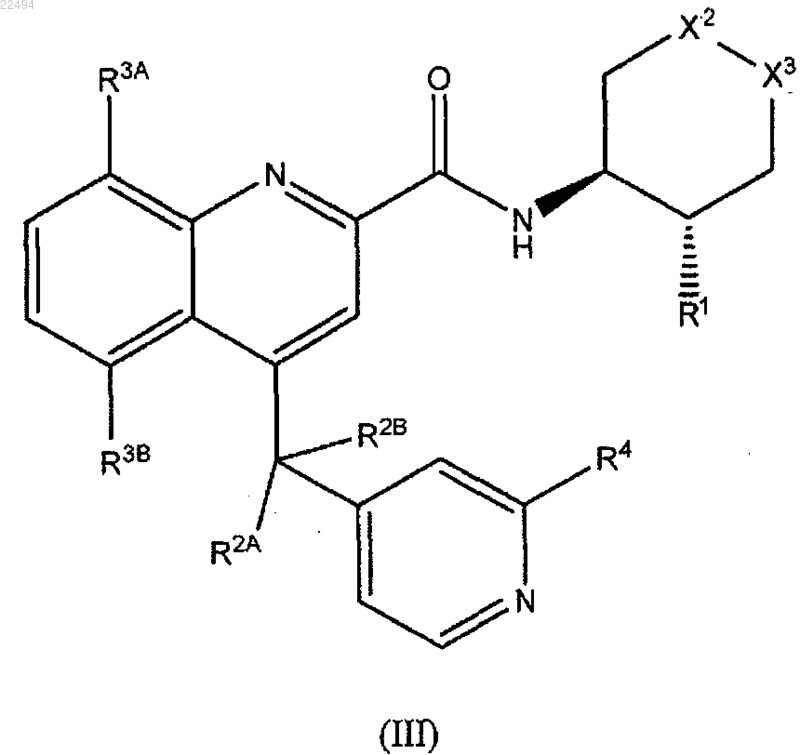
или его фармацевтически приемлемая соль, в котором X2, X3, R1, R2A, R2B, R3A, R3B и R4 имеют значения, описанные выше.
17. Соединение по п.16 или его фармацевтически приемлемая соль, в котором Х2-Х3 обозначают -CH2-CH2-,
-O-CH2- или -CH2-O-.
18. Соединение по одному из пп.1-17, которое выбрано из группы, состоящей из следующих соединений:
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(6-метилпиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид-1-оксид;
4-[(6-циклопропилпиридин-3-ил)метил]-N-[(1,2)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(пиридин-3-илметил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(метилсульфанил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)-1-оксидопиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-фторциклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-этоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[2-(метилсульфанил)пиримидин-5-ил]метил}хинолин-2-карбоксамид;
4-[фтор(6-метоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид гидрат;
4-[(6-хлорпиридин-3-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-{[6-(дифторметил)пиридин-3-ил]метил}-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[фтор(6-метоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-8-метоксихинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
8-фтор-4-[(6-гидроксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метокси-1-оксидопиридин-3-ил)метил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метокси-1-оксидопиридин-4-ил)метил]хинолин-2-карбоксамид;
5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(6-метилпиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1R,2R)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-(тетрагидро-2H-пиран-3-ил)хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2R)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-(тетрагидро-2H-пиран-4-ил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(4-метоксибензил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(4-метоксибензил)хинолин-2-карбоксамид-1-оксид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-({6-[(6-хлорпиридин-3-ил)метил]пиридин-3-ил}метил)-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(пиридин-3-илметил)хинолин-2-карбоксамид;
1,5-ангидро-3-[({4-[(6-хлорпиридин-3-ил)метил]хинолин-2-ил}карбонил)амино]-2,3-дидеокси-L-трео-пентитол;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-(гидроксиметил)циклогексил]хинолин-2-карбоксамид;
4-[(6-циклопропилпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-фторциклогексил]хинолин-2-карбоксамид;
4-[(6-этилпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(6'-метил-2,3'-бипиридин-5-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(пиридин-4-илметил)хинолин-2-карбоксамид;
4-[(6-цианопиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(1H-пиразол-1-ил)бензил]хинолин-2-карбоксамид;
4-[(3,5-диметилизоксазол-4-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6'-фтор-2,3'-бипиридин-5-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(5'-фтор-2,3'-бипиридин-5-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-{[6-(3,5-диметилизоксазол-4-ил)пиридин-3-ил]метил}-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(тиофен-3-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(пиразин-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1,3-тиазол-5-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1,3-оксазол-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1H-пиразол-1-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(трифторметил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(6-фторпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-8-фтор-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-(4-цианобензил)-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-5-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(пиримидин-5-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(2-метоксипиримидин-5-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(1H-1,2,4-триазол-1-ил)бензил]хинолин-2-карбоксамид;
4-(4-хлорбензил)-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-(4-хлорбензил)-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-5,8-дифтор-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-(4-хлорбензил)-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(пиримидин-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(пиридазин-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(3-метоксипиразин-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1,3-тиазол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(6'-метокси-2,3'-бипиридин-5-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(2'-метокси-2,3'-бипиридин-5-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(5'-метокси-2,3'-бипиридин-5-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-имидазол-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-имидазол-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(4'-метокси-2,3'-бипиридин-5-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-(4-хлорбензил)-5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(метилсульфанил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1,3-тиазол-2-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-7,8-дифтор-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-8-(метилсульфанил)хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[4-(1-метил-1H-пиразол-4-ил)бензил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[4-(1-метил-1H-пиразол-5-ил)бензил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[4-(1H-пиразол-1-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(1-метил-1H-бензотриазол-5-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид-1-оксид;
4-(4-хлорбензил)-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид-1-оксид;
4-(4-цианобензил)-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(имидазо[1,2-а]пиридин-6-илметил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-([1,2,4]триазоло[1,5-а]пиридин-6-илметил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(5-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[фтор(6-метоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-8-метоксихинолин-2-карбоксамид;
4-(3,4-дифторбензил)-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
4-(4-хлор-3-фторбензил)-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(трифторметил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(5-метил-1,2,4-оксадиазол-3-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(2-метил-1,3-тиазол-4-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(3-метил-1,2,4-оксадиазол-5-ил)бензил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[4-(1-метил-1H-пиразол-4-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(пиримидин-2-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(1-метил-1H-пиразол-3-ил)бензил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[4-(1,3-тиазол-2-ил)бензил]хинолин-2-карбоксамид;
4-[(4-хлорфенил)(фтор)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(4-метоксибензил)-8-(1-метил-1H-пиразол-4-ил)хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2R)-2-гидроксициклопентил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклопентил]хинолин-2-карбоксамид;
4-[фтор(6-метоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
8-хлор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-8-фтор-N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
8-хлор-4-[(2-хлорпиридин-4-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-{[6-(3-хлор-1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
8-хлор-N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(2-хлорпиридин-4-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[(2-хлорпиридин-4-ил)карбонил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)-1-оксидопиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(2-хлорпиридин-4-ил)метил]-N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]хинолин-2-карбоксамид;
N-[(3S,4S)-4-гидроксигептан-3-ил]-4-{[2-(1-метил-1H-пиразол-4-ил)пиридин-4-ил]метил}хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метилпиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-циклогексилхинолин-2-карбоксамид;
4-[(2-хлорпиридин-4-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид;
5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(2-метилпиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(3S,4S)-4-гидроксигептан-3-ил]-4-{[2-(1-метил-1H-пиразол-4-ил)пиридин-4-ил]метил}хинолин-2-карбоксамид;
5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(трифторметил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-(пиразин-2-илметил)хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-(пиразин-2-илметил)хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
4-{[6-(дифторметил)пиридин-3-ил]метил}-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метокси-1-оксидопиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(2-хлорпиридин-4-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метилпиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-фторциклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(1S,2S)-2-гидроксициклогексил]-4-{[2-(метилсульфанил)пиримидин-5-ил]метил}хинолин-2-карбоксамид;
4-[(6-хлорпиридин-3-ил)метил]-N-[(1S)-2-оксоциклогексил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[2-(метилсульфанил)пиримидин-5-ил]метил}хинолин-2-карбоксамид;
8-фтор-4-[(6-гидроксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[(6-гидроксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[(2-гидроксипиридин-4-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-(2-метилциклогексил)-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метокси-1-оксидопиридин-4-ил)метил]хинолин-2-карбоксамид;
8-фтор-4-[(2-гидроксипиридин-4-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}-N-[(1R,2S)-2-фенилциклогексил]хинолин-2-карбоксамид;
N-[(1R,2R)-2-этинилциклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
5,8-дифтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид;
N-[(1S,2S)-2-(гидроксиметил)циклогексил]-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(6-этоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(2,2,2-трифторэтокси)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(тетрагидро-2H-пиран-4-илокси)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-(2-метилиденциклогексил)-4-{[6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метокси-1-оксидопиридин-3-ил)метил]хинолин-2-карбоксамид;
4-[(2-этоксипиридин-4-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(2,2,2-трифторэтокси)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(6-фторпиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[6-(метилсульфанил)пиридин-3-ил]метил}хинолин-2-карбоксамид;
4-[(2-этоксипиридин-4-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
4-[(6-этоксипиридин-3-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид;
N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-{[2-(метилсульфанил)пиридин-4-ил]метил}хинолин-2-карбоксамид;
или их фармацевтически приемлемых солей.
19. Фармацевтическая композиция для лечения заболевания или нарушения, опосредуемого мускариновым рецептором M1, включающая терапевтически эффективное количество соединения по одному из пп.1-18 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
20. Фармацевтическая композиция по п.19, где указанное заболевание или нарушение выбраны из группы, состоящей из болезни Альцгеймера, шизофрении, боли или расстройств сна.
21. Применение фармацевтической композиции по п.19 в лечении заболевания или нарушения, опосредуемого мускариновым рецептором M1, где указанное заболевание или нарушение выбраны из группы, состоящей из болезни Альцгеймера, шизофрении, боли или расстройств сна.
22. Применение соединения по одному из пп.1-18 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения заболевания или нарушения, опосредуемого мускариновым рецептором M1, где указанное заболевание или нарушение выбраны из группы, состоящей из болезни Альцгеймера, шизофрении, боли или расстройств сна.
23. Способ лечения у пациента заболевания или нарушения, опосредуемого мускариновым рецептором M1, где указанное заболевание или нарушение выбраны из группы, состоящей из болезни Альцгеймера, шизофрении, боли или расстройств сна, включающий введение пациенту терапевтически эффективного количества соединения по одному из пп.1-18 или его фармацевтически приемлемой соли.
24. Соединение, представляющее собой N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
25. Соединение, представляющее собой 4-[(6-этоксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
26. Соединение, представляющее собой N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(2-метоксипиридин-4-ил)метил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
27. Соединение, представляющее собой 4-[(6-хлорпиридин-3-ил)метил]-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
28. Соединение, представляющее собой 4-{[6-(дифторметил)пиридин-3-ил]метил}-8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
29. Соединение, представляющее собой 8-фтор-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]-4-[(6-метоксипиридин-3-ил)метил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
30. Соединение, представляющее собой 8-фтор-4-[(6-гидроксипиридин-3-ил)метил]-N-[(3R,4S)-3-гидрокситетрагидро-2H-пиран-4-ил]хинолин-2-карбоксамид, или его фармацевтически приемлемая соль.
Текст
СОЕДИНЕНИЯ ХИНОЛИНАМИДА В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 Настоящее изобретение относится к соединениям хинолинамида формулы (I) где все заместители раскрыты в формуле изобретения, которые являются положительными аллостерическими модуляторами рецептора M1 и могут быть использованы в лечении заболеваний,в которых участвует рецептор M1, таких как болезнь Альцгеймера, шизофрения, боль или расстройства сна. Изобретение также относится к фармацевтическим композициям, включающим эти соединения, и к применению соединений и композиций в лечении заболеваний, опосредуемых рецептором M1.(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. Область изобретения Изобретение относится к классу соединений хинолинамида, к их солям, к включающим их фармацевтическим композициям и к их применению в терапии человеческого организма. В частности, изобретение относится к классу соединений хинолинамида, которые являются положительными аллостерическими модуляторами мускаринового рецептора M1 и, следовательно, могут быть использованы в лечении болезни Альцгеймера и других заболеваний, опосредуемых мускариновым рецептором M1. Уровень техники Болезнь Альцгеймера представляет собой распространенное нейродегенеративное заболевание, поражающее людей пожилого возраста, приводящее к прогрессивному ухудшению памяти, утрате речевых и визуально-пространственных способностей и к дефицитарным расстройствам поведения. Характеристики этого заболевания включают дегенерацию холинергических нейронов в коре головного мозга, гиппокампе, базальных отделах переднего мозга и других областях мозга, нейрофибриллярные клубки и аккумуляциюамилоидного пептида (А). A состоит из 39-43 аминокислот, продуцируется в мозге в результате процессинга бета-амилоидного белка-предшественника (АРР) ферментом, расщепляющим бета-амилоидный белок ("бета-секретаза" или "ВАСЕ"), и гамма-секретазой. Процессинг приводит к аккумуляции A в мозге. Холинергическая нейротрансмиссия включает связывание ацетилхолина либо на никотиновом рецепторе ацетилхолина (nAChR), либо на мускариновом рецепторе ацетилхолина (mAChR). Была выдвинута гипотеза, что холинергическая гипофункция вносит свой вклад в когнитивные расстройства у пациентов, страдающих болезнью Альцгеймера. Следовательно, ингибиторы ацетилхолинэстеразы, которые ингибируют гидролиз ацетилхолина, были апробированы в США для использования в лечении когнитивных нарушений у пациентов с болезнью Альцгеймера. В то время как ингибиторы ацетилхолинэстеразы обеспечили некоторое улучшение когнитивных функций у пациентов с болезнью Альцгеймера, не было показано, что эта терапия изменяет лежащую в основе патологию заболевания. Второй потенциальной фармакотерапевтической мишенью для противодействия холинергической гипофункции является активация мускариновых рецепторов. Мускариновые рецепторы распространены по всему организму. У млекопитающих были идентифицированы пять различных мускариновых рецепторов (M1-М 5). В центральной нервной системе мускариновые рецепторы участвуют в когнитивных,поведенческих, сенсорных, моторных и автономных функциях. Было обнаружено, что мускариновый рецептор M1, который распространен в коре головного мозга, гиппокампе и полосатом теле, играет главную роль в когнитивной обработке и, как полагают, играет роль в патофизиологии болезни Альцгеймера(см. Eglen et al., TRENDS in Pharmacological Sciences, 2001, 22:8, 409-414). Кроме того, в отличие от ингибиторов ацетилхолинэстеразы, которые, как известно, обеспечивают только симптоматическое лечение, агонисты M1 также имеют потенциал в лечении лежащего в основе заболевания механизма болезни Альцгеймера. Холинергическая гипотеза болезни Альцгеймера связана как с -амилоидом, так и с гиперфосфорилированным tau белком. Формирование -амилоида может нарушить связывание мускаринового рецептора с G-белками. Было показано, что возбуждение мускаринового рецептора M1 увеличивает формирование нейропротективного фрагмента APPs, таким образом предотвращая формирование A пептида. Таким образом, агонисты M1 могут изменить процессинг АРР и усилить секрецию APPs (см.Fisher, Jpn J Pharmacol, 2000, 84:101-112). Однако лиганды M1, которые были разработаны и изучены в отношении болезни Альцгеймера,произвели побочные эффекты, общие для других лигандов мускаринового рецептора, такие как потение,тошнота и диарея (см. Spalding et al., Mol Pharmacol, 2002, 61:6, 1297-1302). Известно, что мускариновые рецепторы содержат один или более аллостерических участков, которые могут изменить сродство, с которым мускариновые лиганды связываются с первичными связывающими или ортостерическими участками (см., например, S. Lazareno et al., Mol Pharmacol, 2002, 62:6,1491-1505; S. Lazareno et al., Mol Pharmacol, 2000, 58, 194-207). Таким образом, соединения по изобретению, которые являются положительными аллостерическими модуляторами мускаринового рецептора M1, как полагают, могут быть использованы в лечении болезни Альцгеймера и других заболеваний, опосредуемых мускариновым рецептором M1. Сущность изобретения Настоящее изобретение относится к соединениям хинолинамида общей формулы (I) или к их фармацевтически приемлемым солям, которые могут быть использованы в качестве положительного аллостерического модулятора рецептора M1. Изобретение далее относится к способам лечения пациента (предпочтительно человека) в отношении заболеваний или нарушений, в которых участвует рецептор M1, таких как болезнь Альцгеймера,когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, путем введения пациенту терапевтически эффективного количества соединения общей формулы (I) или его фармацевтически приемлемой соли. Изобретение также относится к фармацевтическим композициям, которые включают эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, и к применению соединений и фармацевтических композиций по изобретению в лечении таких заболеваний. Подробное описание изобретения В одном варианте осуществления изобретение относится к соединениям хинолинамида общей формулы (I) и к их фармацевтически приемлемым солям, в которой(1) N,(2) NO,(3) CH,(4) O,при условии, что один из X4, X5, X6 и X7 может отсутствовать, таким образом образуя пятичленное кольцо;(1) водорода,(2) галогена,(3) -C1-6 алкила,(4) -C2-6 алкинила,(5) фенила,(6) =O,(7) =CH2,(8) гидроксила,причем R1 алкил, алкинил или фенил может быть замещен одним или более изR2A и R2B независимо выбраны из группы, состоящей изR3 в случае необходимости присутствует на одном или более кольцевых атомов углерода и независимо выбран из группы, состоящей из(4) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из C, O, N, NО или S, по меньшей мере один из которых представляет собой O, N, NO или S, причем гетероарил может бытьR4 в случае необходимости присутствует на одном или более кольцевых атомов и выбран из группы, состоящей из(1) гидроксила,(2) галогена,(3) -C1-6 алкила,(4) -O-C1-6 алкила,(5) -S-C1-6 алкила,(6) -C3-8 циклоалкила,(7) -CN,(8) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N, NO или S, по меньшей мере один из которых представляет собой О, N, NO или S,(9) -O-гетероциклила,и алкил, циклоалкил, арил или гетероарил в значении группы R4 может быть замещен одним или более из(f) гетероарила, который является ароматической циклической группой, имеющей от пять до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N, NO или S, по меньшей мере один из которых представляет собой О, N, NO или S,причем алкил, арил или гетероарил может быть замещен одним или более из(iv) -C1-6 алкила,или две группы R4 связаны вместе, образуя конденсированную гетероарильную группу с тремя или четырьмя кольцевыми атомами, причем указанные кольцевые атомы выбраны из С, О, N, NO или S, по меньшей мере один из которых представляет собой О, N, NO или S. В частных вариантах соединений формулы (I) один или два из X4, X5, X6 и X7 представляет собой N или NO, и каждый из других обозначает CH (или С, замещенный группой R4). В частных вариантах соединений формулы (I) X1 обозначает N. В частных вариантах соединений формулы (I) Х 2-Х 3 обозначает -CH2-CH2-. Альтернативно, Х 2-Х 3 обозначает -O-CH2- или -CH3-O-. В частных вариантах соединений формулы (I) X4 обозначает N и каждый из X5, X6 и X7 обозначаетCH (или С, замещенный группой R4). В других вариантах осуществления каждый из X4, X6 и X7 обозначает CH (или С, замещенный группой R4), и X5 обозначает N. В других вариантах осуществления каждый из X4 и X6 обозначает N, X7 обозначает CH, и X5 обозначает C, замещенный группой R4. В частных вариантах соединений формулы (I) R1 обозначает галоген (например, фтор). В других вариантах осуществления R1 обозначает гидроксил. В частных вариантах соединений формулы (I) каждый из R2A и R2B обозначает водород. В другом варианте осуществления R2A обозначает водород, и R2B обозначает галоген (например, фтор). В частных вариантах соединений формулы (I) R3 отсутствует. В другом варианте осуществления R3 присутствует на одном или более кольцевых атомов углерода и обозначает галоген (например, фтор). В частных вариантах соединений формулы (I) каждый из R2A и R2B обозначает водород. В частных вариантах соединений формулы (I) R4 присутствует на одном из кольцевых атомов и выбран из группы, состоящей из(3) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N, NO или S, по меньшей мере один из которых представляет собой О, N, NO или S,причем указанный алкил или гетероарил R4 в случае необходимости замещен одним или более из(a) галогена,(b) гидрокси,(c) -O-C1-6 алкила,(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или В одном варианте осуществления изобретение относится к способам лечения пациента (предпочтительно человека) в отношении заболеваний, в которых участвует рецептор M1, таких как болезнь Альцгеймера, когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, путем введения пациенту терапевтически эффективного количества соединения общей формулы (I). Изобретение также относится к фармацевтическим композициям для лечения заболеваний или нарушений, в которых участвует рецептор M1, таких как болезнь Альцгеймера, когнитивное расстройство,шизофрения, болевые расстройства и расстройства сна, которые включают соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Изобретение далее относится к применению соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя для получения лекарственного средства для лечения заболевания или нарушения, опосредуемого мускариновым рецептором M1, причем указанное заболевание или нарушение выбраны из группы, состоящей из болезни Альцгеймера, шизофрении, боли или расстройств сна. В пределах рода соединений формулы (I) существует подрод соединений формулы (II) и их фармацевтически приемлемые соли, в которой X2, X3, R1, R2A, R2B, R3A, R3B и R4 имеют значения, описанные выше. В частных вариантах соединений формулы (II) Х 2-Х 3 обозначает -CH2-CH2-. Альтернативно, Х 2-Х 3 обозначает -O-CH2- или -CH2-O-. В частных вариантах соединений формулы (II) R1 обозначает галоген (например, фтор). В других вариантах осуществления R1 обозначает гидроксил. В частных вариантах соединений формулы (II) каждый из R2A и R2B обозначает водород. В другом варианте осуществления R2A обозначает водород, и R2B обозначает галоген (например, фтор). В частных вариантах соединений формулы (II) каждый из R3A и R3B обозначает водород. В другом варианте осуществления R3A обозначает галоген (например, фтор), и R3B обозначает водород. В частных вариантах соединений формулы (II) каждый из R2A, R2B, R3A и R3B обозначает водород. В частных вариантах соединений формулы (II) R4 выбран из группы, состоящей из(1) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N или S, по меньшей мере один из которых представляет собой О, N или S,(2) галогена (например, фтор или хлор),(3) гидрокси,(4) -O-C1-6 алкила (например, метокси),(5) -C1-6 алкила (например, метила) или(6) -S-C1-6 алкила,причем указанный алкил или гетероарил в значении R4 может быть замещен одним или более из(a) галогена (например, фтора или хлора),(b) гидрокси,(c) -O-C1-6 алкила,(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или(e) -S-C1-6 алкила. В частных вариантах осуществления R4 выбран из группы, состоящей из(3) -C1-6 алкила (например, метила), в случае необходимости замещенного галогеном. В одном варианте осуществления соединения формулы (I) представляют собой соединения формулы (III) в которой X2, X3, R1, R3A, R3B и R4 имеют значения, описанные выше. В частных вариантах соединений формулы (III) Х 2-Х 3 обозначает -CH2-CH2. Альтернативно, Х 2-Х 3 обозначает -O-CH2- или -CH2-O-. В частных вариантах соединений формулы (III) R1 обозначает галоген (например, фтор). В других вариантах осуществления R1 обозначает гидроксил. В частных вариантах соединений формулы (III) каждый из R3A и R3B обозначает водород. В другом варианте осуществления R3A обозначает галоген (например, фтор), и R3B обозначает водород. В частных вариантах соединений формулы (III) каждый из R2A, R2B, R3A и R3B обозначает водород. В частных вариантах соединений формулы (III) R4 выбран из группы, состоящей из(1) гетероарила, который является ароматической циклической группой, имеющей от пяти до двенадцати кольцевых атомов, причем указанные кольцевые атомы выбраны из С, О, N или S, по меньшей мере один из которых представляет собой О, N или S,(2) галогена (например, фтора или хлора),(3) гидрокси,(4) -O-C1-6 алкила (например, метокси),(5) -C1-6 алкила (например, метила) или(6) -S-C1-6 алкила,причем указанный алкил или гетероарил в значении R4 может быть замещен одним или более из(a) галогена (например, фтора или хлора),(b) гидрокси,(c) -O-C1-6 алкила,(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или(e) -S-C1-6 алкила. В частных вариантах осуществления R4 выбран из группы, состоящей из(3) -C1-6 алкила (например, метила), в случае необходимости замещенного галогеном.(d) -C1-6 алкила, в случае необходимости замещенного галогеном, или(e) -S-C1-6 алкила. Частные варианты осуществления формулы (I) описаны здесь как примеры 1-169 и их фармацевтически приемлемые соли. Изобретение также относится к способам лечения пациента (предпочтительно человека) в отношении заболеваний или нарушений, в которых участвует рецептор M1, таких как болезнь Альцгеймера,когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, путем введения пациенту терапевтически эффективного количества соединения формул (II) и (III) или его фармацевтически приемлемой соли. Изобретение также относится к применению соединения формул (II) и (III) для лечения заболевания или нарушения, в котором участвует рецептор M1, таких как болезнь Альцгеймера, когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, путем введения пациенту соединения формул (II) и (III) или его фармацевтически приемлемой соли. Изобретение также относится к лекарственным средствам или фармацевтическим композициям для лечения у пациента (предпочтительно человека) заболеваний или нарушений, в которых участвует рецептор M1, таких как болезнь Альцгеймера, когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, которые включают соединение формул (II) и (III) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Изобретение также относится к способу получения лекарственного средства или фармацевтической композиции для лечения заболеваний, в которых участвует рецептор M1, таких как болезнь Альцгеймера, когнитивное расстройство, шизофрения, болевые расстройства и расстройства сна, включающему комбинирование соединения формул (II) и (III) или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем. Если переменная встречается более одного раза в любой из формул (II) и (III) или в их заместителе,индивидуальные случаи присутствия этой переменной независимы друг от друга, если не указано иное. В рамках изобретения термин "алкил", отдельно или как часть другого заместителя, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, имеющий указанное число атомов углерода (например, C1-10 алкил означает алкильную группу, имеющую от одного до десяти атомов углерода). Предпочтительными алкильными группами для использования в изобретении являются C1-6 алкильные группы, имеющие от одного до шести атомов. Примеры алкильных групп включают метил,этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил и т.п. C0 алкил означает связь. В рамках изобретения термин "циклоалкил", отдельно или как часть другого заместителя, означает насыщенный циклический углеводородный радикал, указанное число атомов углерода (например, C3-12 циклоалкил означает циклоалкильную группу, имеющую от трех до двенадцати атомов углерода). Термин циклоалкил в рамках изобретения включает моно-, би- и трициклические насыщенные карбоциклы,спироциклы и карбоциклы с соединенными мостиковой связью и конденсированными кольцами. Предпочтительными циклоалкильными группами для использования в изобретении являются моноциклические C3-8 циклоалкильные группы, имеющие от трех до восьми атомов углерода. Примеры моноциклических циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и т.п. Примеры соединенных мостиковой связью циклоалкильных групп включают адамантил и норборнил. Примеры конденсированных циклоалкильных групп включают декагидронафталин. В рамках изобретения термин "арил", отдельно или как часть другого заместителя, означает ароматический циклический углеводородный радикал. Предпочтительные арильные группы имеют от шести до десяти атомов углерода. Термин "арил" включает множественные кольцевые системы, а также единичные кольцевые системы. Предпочтительные арильные группы для использования в изобретении включают фенил и нафтил. Термин "арил" также включает конденсированные циклические углеводородные кольца, которые являются частично ароматическими (то есть одно из конденсированных колец является ароматическим, а другое является неароматическим). Примером арильной группы, которая является частично ароматической, является инданил. В рамках изобретения термин "гетероарил", отдельно или как часть другого заместителя, означает циклическую или полициклическую группу, имеющую от пяти до двенадцати кольцевых атомов, выбранных из С, N, О и S, причем по меньшей мере один кольцевой гетероатом представляет собой О, N или S, и причем по меньшей мере одно из составляющих ее колец является ароматическим. Примеры гетероарильных групп для использования в изобретении включают карбазолил, карболинил, хроменил,циннолинил, фуранил, бензофуранил, бензофуразанил, изобензофуранил, имидазолил, бензимидазолил,бензимидазолонил, индазолил, индолил, изоиндолил, индолинил, индолазинил, индинил, оксадиазолил,оксазолил, бензоксазолил, изоксазолил, пиранил, пиразинил, пиразолил, бензопиразолил, пиридазинил,пиридил, пиримидинил, пирролил, хинолил, изохинолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, тиенил, бензотиоенил, бензотиазолил, хиноксалинил, триазинил и триазолил и их N-оксиды. Одна подгруппа гетероарильных групп имеет 5 кольцевых атомов. Примерами гетероарильных групп в этом варианте осуществления являются пиразолил, пиридил, тиазолил и имидазолил. Другая подгруппа гетероарильных групп имеет 6 кольцевых атомов. Примерами гетероарильных групп в этом варианте осуществления являются пиридинил и пиримидинил. Термин "гетероарил" также включает конденсированные циклические гетероциклические кольца,которые являются частично ароматическими (то есть одно из конденсированных колец является ароматическим, а другое является неароматическим). Примером гетероарильной группы, которая является частично ароматической, является бензодиоксол. Когда гетероарильная группа, определенная здесь, является замещенной, заместитель может быть присоединен к кольцевому атому углерода гетероарильной группы или к кольцевому гетероатому (то есть азоту, кислороду или сере), который имеет валентность, которая делает замещение возможным. Предпочтительно заместитель присоединен к кольцевому атому углерода. Точно так же, когда гетероарильная группа определена как заместитель, точка присоединения может находиться на кольцевом атоме углерода гетероарильной группы или на кольцевом гетероатоме (то есть азоте, кислороде или сере), который имеет валентность, которая делает присоединение возможным. Предпочтительно присоединение имеет место на кольцевом атоме углерода. В рамках изобретения термин "галоген" включает фтор, хлор, бром и йод. Соединения по изобретению могут иметь один или более центров асимметрии. Соединения с центрами асимметрии дают начало энантиомерам (оптические изомеры), диастереомерам (конфигурационные изомеры) или обоим типам изомеров, и все возможные энантиомеры и диастереомеры, в смесях и как чистые или частично очищенные соединения, включены в рамки этого изобретения. Настоящее изобретение охватывает все такие изомерные формы соединений формул (I)-(III). Формулы (I)-(III) показаны выше без определенной стереохимии. Настоящее изобретение включает все стереоизомеры формул (I)-(III) и их фармацевтически приемлемые соли. Независимые синтезы энантиомерно или диастереомерно обогащенных соединений или их хроматографические разделения могут быть осуществлены, как известно в данной области техники, подходящей модификацией методологии, раскрытой здесь. Их абсолютная стереохимия может быть определена рентгеновской кристаллографией кристаллических продуктов или кристаллических промежуточных соединений, которые могут быть дериватизованы, в случае необходимости, реагентом, содержащим центр асимметрии известной абсолютной конфигурации. Если желательно, рацемические смеси соединений могут быть разделены так, чтобы выделить индивидуальные энантиомеры или диастереомеры. Разделение может быть осуществлено способами, известными в данной области техники, такими как сочетание рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси с последующим разделением индивидуальных диастереомеров стандартными методами, такими как фракционная кристаллизация или хроматография. Реакция сочетания часто представляет собой формирование солей с использованием энантиомерно чистой кислоты или основания. Диастереомерные производные могут затем быть превращены в чистые энантиомеры расщеплением добавленного хирального остатка. Рацемическая смесь соединений может также быть разделена непосредственно хроматографическими способами с использованием хиральных стационарных фаз, и эти способы являются известными в данной области техники. Альтернативно, любой энантиомер или диастереомер соединения могут быть получены стереоселективным синтезом с использованием оптически чистых исходных материалов или реагентов известной конфигурации способами, известными в данной области техники. Соединения по изобретению могут быть получены согласно следующим реакционным схемам, в которых переменные имеют значения, определенные ранее, или получены с использованием легко доступных исходных материалов из реагентов и обычных синтетических процедур. Также возможно использовать варианты, которые сами по себе известны специалисту в области органического синтеза, но не упомянуты более детально. Настоящее изобретение также относится к способу синтеза соединений, которые могут быть использованы в качестве промежуточных соединений в получении соединений по изобретению. В ходе любой из вышеупомянутых последовательностей синтеза может быть необходимым или желательным защитить чувствительные или реакционноспособные группы на любой из используемых молекул. Это может быть достигнуто посредством обычных защитных групп, таких как описанные в Protective Groups in Organic Chemistry (ed. J.F.W.McOmie, Plenum Press, 1973, и T.W. GreeneP/G.M. Wuts,Protective Groups in Organic Synthesis, John WileySons, 1999). Защитные группы могут быть удалены на удобной последующей стадии с использованием способов, известных в данной области техники. Частные варианты соединений по изобретению и способов их получения описаны в примерах. В соединениях формул (I)-(III) атомы могут демонстрировать свой естественный изотопный избыток или один или более атомов могут быть искусственно обогащены специфическим изотопом, имеющим то же самое атомное число, но атомную массу или массовое число, отличное от атомной массы или массового числа, преимущественно встречающегося в природе. Настоящее изобретение включает все подходящие изотопные вариации соединений родовых формул (I)-(III). Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий представляет собой преобладающий водородный изотоп, встречающийся в природе. Обогащение дейтерием может предоставить определенные терапевтические преимущества, такие как увеличение периода полужизни in vivo или снижение требуемой дозы, или может обеспечить соединение, которое может быть использовано как стандарт для исследования биологических образцов. Изотопно обогащенные соединения в пределах родовых формул (I)(III) могут быть получены без дополнительного экспериментирования обычными методиками, известными специалисту, или способами, аналогичными описанным в схемах и примерах, с использованием подходящих изотопно обогащенных реагентов и/или промежуточных соединений. Термин "в основном чистый" означает, что выделенный материал является по меньшей мере на 90% чистым, предпочтительно на 95% чистым и еще более предпочтительно на 99% чистым при испытании аналитическими методиками, известными в данной области техники. В рамках изобретения термин "мускариновый рецептор M1" относится к одному из пяти подтипов мускариновых рецепторов ацетилхолина, который относится к суперсемейству рецепторов, связанных сG-белком. Семейство мускариновых рецепторов описано (см., например, в Pharmacol Ther, 1993, 58:319379; Eur J Pharmacol, 1996, 295:93-102, и Mol Pharmacol, 2002, 61:1297-1302). Известно, что мускариновые рецепторы содержат один или более аллостерических участков, которые могут изменить сродство, с которым мускариновые лиганды связываются с первичными связывающими или ортостерическими участками (см., например, S. Lazareno et al., Mol Pharmacol, 2002, 62:6, 1491-1505). В рамках изобретения термины "положительный аллостерический модулятор" и "аллостерическое потенцирующее средство" используются взаимозаменяемое и относятся к лиганду, который взаимодействует с аллостерическим участком рецептора, активируя первичный связывающий участок. Соединения по изобретению являются положительными аллостерическими модуляторами мускаринового рецептораM1. Например, модулятор или потенцирующее средство могут прямо или косвенно усилить ответ, вы- 12022494 званный эндогенным лигандом (таким как ацетилхолин или ксаномелин) на ортостерическом участке мускаринового рецептора M1 у животного, в частности человека. Действия лигандов в аллостерических клеточных рецепторах могут также быть поняты согласно"модели аллостерического трехкомпонентного комплекса", как известно специалисту. Модель аллостерического трехкомпонентного комплекса описана относительно семейства мускариновых рецепторов вBirdsall et al., Life Sciences, 2001, 68:2517-2524. В отношении общего описания роли аллостерических связывающих участков см. Christopoulos, Nature Reviews: Drug Discovery, 2002, 1:198-210. Предполагается, что соединения по изобретению связываются с аллостерическим связывающим участком, который отличается от ортостерического участка ацетилхолина мускаринового рецептора M1,таким образом усиливая ответ, вызванный эндогенным лигандом ацетилхолином на ортостерическом участке рецептора M1. Также предполагается, что соединения по изобретению связываются с аллостерическим участком, который отличается от ксаномелинового участка мускаринового рецептора M1, таким образом усиливая ответ, вызванный эндогенным лигандом ксаномелином на ортостерическом участке рецептора M1. Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соединения по изобретению могут быть моно-, ди- или три-солями в зависимости от числа кислых функциональных групп, присутствующих в форме свободного основания соединения. Свободные основания и соли, полученные из неорганических оснований,включают соли алюминия, аммония, кальция, меди, железа (3), железа (2), лития, магния, марганца (3),марганца (2), калия, натрия, цинка и т.п. Соли в твердой форме могут существовать в более чем одной кристаллической структуре и могут также быть в форме гидратов. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенные амины,включая натуральные замещенные амины, циклические амины и катионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2 диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурин, теобромин, триэтиламин, триметиламин, трипропиламин,трометамин и т.п. Когда соединение согласно настоящему изобретению является основным, соли могут быть получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, трифторуксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористо-водородную, изэтиновую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и т.п. Настоящее изобретение относится к применению соединений формул (I)-(III), раскрытых здесь, в качестве аллостерических модуляторов M1 у пациента или лица, такого как млекопитающее, для которого существует потребность в такой активности, включающему введение эффективного количества соединения. Помимо человека различные другие млекопитающие могут быть подвергнуты лечению способом согласно настоящему изобретению. Соединения согласно настоящему изобретению могут быть использованы в лечении или облегчении болезни Альцгеймера. Соединения могут также быть использованы в лечении или облегчении других заболеваний, опосредуемых мускариновым рецептором M1, таких как шизофрения, расстройства сна, болевые расстройства (включая острую боль, воспалительную боль и нейропатическую боль) и когнитивные нарушения (включая умеренное когнитивное нарушение). Другие состояния, которые могут быть подвергнуты лечению соединениями по изобретению, включают болезнь Паркинсона, легочную артериальную гипертензию, хроническое обструктивное заболевание легких (COPD), астму, недержание мочи, глаукому, шизофрению, трисомию 21 (синдром Дауна), церебральную амилоидную ангиопатию,дегенеративную деменцию, врожденное мозговое кровоизлияние с амилоидозом голландского типа(HCHWA-D), болезнь Крейцфельда-Якоба, прионные нарушения, боковой амиотрофический склероз,прогрессивный надъядерный паралич, травму головы, инсульт, панкреатит, миозит с тельцами включения, другие периферические амилоидозы, диабет, аутизм и атеросклероз. В предпочтительных вариантах осуществления соединения по изобретению могут быть использованы в лечении болезни Альцгеймера, когнитивных расстройств, шизофрении, болевых расстройств и расстройств сна. Например, соединения могут быть использованы для профилактики деменции типа Альцгеймера, а также для лечения ранней стадии, промежуточной стадии или поздней стадии деменции типа Альцгеймера. В предпочтительных вариантах осуществления соединения по изобретению могут быть использованы в лечении болезни Альцгеймера, когнитивных расстройств, шизофрении, болевых расстройств и расстройств сна. Например, соединения могут быть использованы для профилактики деменции типа Альцгеймера, а также для лечения ранней стадии, промежуточной стадии или поздней стадии деменции типа Альцгеймера. В общем, симптомы болезни Альцгеймера включают спутанность сознания, раздражительность и агрессию, колебание настроения, нарушения речи, потерю долговременной памяти и общую отстраненность пациента по мере угасания сознания. Языковые проблемы, связанные с болезнью Альцгеймера, включают уменьшающийся словарный запас и сниженную беглость речи. Болезнь Альцгеймера также включает ухудшение тонкой моторики, такой как письмо, рисование, одевание и другие скоординированные движения. Симптомы болезни Альцгеймера включают апраксию (трудности в планировании движения). Ранняя стадия болезни Альцгеймера характеризуется спутанностью сознания, потерей памяти и изменением других когнитивных способностей. Симптомы могут включать потерю в пространстве, проблемы в обращении с деньгами и оплате счетов, повторение вопросов, увеличение времени выполнения обычных ежедневных задач, неверные суждения и изменения настроения и личности. Промежуточная стадия болезни Альцгеймера проявляется проблемами с рассуждением, сенсорной обработкой и сознательным мышлением. Симптомы промежуточной стадии включают продолжающуюся потерю памяти и спутанность сознания. Пациенты на промежуточной стадии обычно начинают иметь проблемы с узнаванием членов семьи и друзей. Симптомы включают неспособность к изучению новых объектов, выполнению задач, которые включают множество стадий (таких как одевание), или разрешению новых ситуаций. Пациенты на промежуточной стадии могут иметь галлюцинации, бред и паранойю и могут вести себя импульсивно. Пациенты, страдающие тяжелой формой болезни Альцгеймера, обычно неспособны общаться и полностью зависят от других в плане ухода. Потенциальные шизофренические состояния или расстройства, в случае которых соединения по изобретению могут быть использованы, включают одно или более из следующих состояний или заболеваний: шизофрения или психоз, включая шизофрению (параноидальную, дезорганизованную, кататоническую или недифференцированную), шизофрениформное расстройство, шизоаффективное расстройство, бредовое расстройство, кратковременное психотическое расстройство, индуцированное психотическое расстройство, психотическое расстройство вследствие общего медицинского состояния и вызванное веществом или лекарственным средством (фенциклидином, кетанином и другим диссоциирующим анестетиком, амфетамином и другими психостимуляторами и кокаином), психозопсихотическое расстройство, психоз, связанный с аффективными расстройствами, кратковременный реактивный психоз, шизоаффективный психоз, расстройства "спектра шизофрении", такие как шизоидные или шизотипические изменения личности, или болезнь, связанную с психозом (такую как большая депрессия, маниакальное депрессивное (биполярное) расстройство, болезнь Альцгеймера и синдром посттравматического стресса), включая как позитивные, так и негативные симптомы шизофрении и других психозов; когнитивные расстройства, включая деменцию (связанную с болезнью Альцгеймера, ишемией, мультиинфарктную деменцию, деменцию, связанную с травмой, сосудистыми проблемами или инсультом, заболеванием ВИЧ, болезнь Паркинсона, болезнь Гентингтона, синдром Пика, болезнь Крейцфельда-Якоба, перинатальную гипоксию, другие общие медицинские состояния или токсикоманию); делирий, вызывающие нарушение памяти нарушения или возрастное ухудшение когнитивной функции. В другом частном варианте осуществления настоящее изобретение относится к способу лечения шизофрении или психоза, включающему введение пациенту эффективного количества соединения согласно настоящему изобретению. Частными случаями шизофренической или психотической патологии являются параноидальная, дезорганизованная, кататоническая или недифференцированная шизофрения и вызванное веществом психотическое расстройство. В настоящее время пересмотренный текст четвертого издания Диагностического и Статистического Руководства по Расстройствам Психики (DSM-IV-TR)(2000, Американская Психиатрическая Ассоциация, Вашингтон, округ Колумбия) включает диагностический способ, который включает параноидальную, дезорганизованную, кататоническую или недифференцированную шизофрению и вызванное веществом психотическое расстройство. В рамках изобретения термин "шизофрения или психоз" включают лечение расстройств психики, описанных в DSM-IV-TR. Специалисту понятно, что существуют альтернативные номенклатуры, нозологии и системы классификации в отношении расстройств психики и что эти системы эволюционируют по мере медицинского и научного прогресса. Таким образом, термин "шизофрения или психоз" включает нарушения, подобные описанным в других диагностических источниках. Примеры комбинаций соединений включают комбинации со средствами для лечения шизофрении,например в комбинации с седативными средствами, снотворными средствами, транквилизаторами, нейролептиками, успокоительными средствами, циклопирролонами, имидазопиридинами, пиразолопиримидинами, малыми транквилизаторами, агонистами и антагонистами мелатонина, метатонэргическими средствами, бензодиазепинами, барбитуратами, антагонистами 5HT-2 и т.п., такими как адиназолам, аллобарбитал, алонимид, алпразолам, амисульприд, амитриптилин, амобарбитал, амоксапин, арипипразол,бентазепам, бензоктамин, бротизолам, бупропион, бусприон, бутабарбитал, буталбитал, капурид, карбоклорал, хлоралбетаин, хлоралгидрат, кломипрамин, клоназепам, клоперидон, клоразепат, хлордиазепоксид, клоретат, хлорпромазин, клозапин, ципразепам, дезипрамин, декскламол, диазепам, дихлоралфе- 14022494 назон, дивальпроекс, дифенилгидрамин, доксепин, эстазолам, этхлорвинол, этомидат, фенобам, флунитразепам, флупентиксол, флуфеназин, флуразепам, флувоксамин, флуоксетин, фосазепам, глутетимид,галазепам, галоперидол, гидроксизин, имипрамин, литий, лоразепам, лорметазепам, мапротилин, меклохалон, мелатонин, мефобарбитал, мепрбамат, метахалон, мидафлур, мидазолам, нефазодон, низобамат,нитразепам, нортриптилин, оланзапин, оксазепам, паральдегид, пароксетин, пентобарбитал, перлапин,перфеназин, фенелзин, фенобарбитал, празепам, прометазин, пропофол, протриптилин, квазепам, кветиапин, реклазепам, рисперидон, ролетамид, секобарбитал, сертралин, супроелон, темазепам, тиоридазин, тиотиксен, траказолат, транилципромаин, тразодон, триазолам, трепипам, трицетамид, триклофос,трифлуоперазин, триметозин, тримипрамин, улдазепам, венлафаксин, залеплон, зипразидон, золазепам,золпидем и их соли, и их комбинации, и т.п., или соединение по изобретению может вводиться в сочетании с использованием физических способов, таких как светолечение или электростимуляция. В другом варианте осуществления соединение по изобретению может использоваться в комбинации с леводопой (с или без селективного экстрацеребрального ингибитора декарбоксилазы, такого как карбидопа или бенсеразид), антихолинергическими средствами, такими как бипериден (в случае необходимости в форме гидрохлоридной или лактатной соли) и тригексифенидил (бензгексол) гидрохлорид, ингибиторами COMT, такими как энтакапон, ингибиторами MOA-B, антиоксидантами, антагонистами рецептора аденозина A2a, холинергическими агонистами, антагонистами рецептора NMDA, антагонистами рецептора серотонина и агонистами рецептора допамина, такими как алентемол, бромокриптин, фенолдопам, лисурид, наксаголид, перголид и прамипексол. Следует понимать, что агонист допамина может быть в форме фармацевтически приемлемой соли, например алентемол гидробромида, бромокриптин мезилата, фенолдопам мезилата, наксаголид гидрохлорида и перголид мезилата. В другом варианте осуществления соединение по изобретению может использоваться в комбинации с соединением из классов нейролептических средств фентиазина, тиоксантена, гетероциклического дибензазепина, бутирофенона, дифенилбутилпиперидина и индолона. Подходящие примеры фентиазинов включают хлорпромазин, мезоридазин, тиоридазин, ацетофеназин, флуфеназин, перфеназин и трифлуоперазин. Подходящие примеры тиоксантенов включают хлорпротиксен и тиотиксен. Примером дибензазепина является клозапин. Примером бутирофенона является галоперидол. Примером дифенилбутилпиперидина является пимозид. Примером индолона является молиндолон. Другие нейролептические средства включают локсапин, сульпирид и рисперидон. Следует понимать, что нейролептические средства,когда они используется в комбинации с соединением по изобретению, могут быть в форме фармацевтически приемлемой соли, например хлорпромазин гидрохлорида, мезоридазин безилата, тиоридазин гидрохлорида, ацетофеназин малеата, флуфеназин гидрохлорида, флурфеназин энатата, флуфеназин деканоата, трифлуоперазин гидрохлорида, тиотиксен гидрохлорида, галоперидол деканоата, локсапин сукцината и молиндон гидрохлорида. Перфеназин, хлорпротиксен, клозапин, галоперидол, пимозид и рисперидон обычно используются в несолевой форме. Таким образом, соединение по изобретению может использоваться в комбинации с ацетофеназином, алентемолом, арипипразолом, амильсупридом, бензгексолом, бромокриптином, бипериденом, хлорпромазином, хлорпротиксеном, клозапином, диазепамом, фенолдопамом, флуфеназином, галоперидолом, леводопой, леводопой с бенсеразидом, леводопой с карбидопой, лисуридом, локсапином, мезоридазином, молиндолоном, наксаголидом, оланзапином, перголидом, перфеназином, пимозидом, прамипексолом, кветиапином, рисперидоном, сульпиридом, тетрабеназином, тригексифенидилом, тиоридазином, тиотиксеном, трифлуоперазином или зипразидоном. Потенциальные состояния или нарушения, связанные со сном, в отношении которых соединения по изобретению могут быть использованы, включают усиление качества сна; улучшение качества сна; увеличение поддержания сна; увеличение значения, вычисляемого от времени, когда пациент спит, деленного на время, когда пациент пытается заснуть; уменьшение латентности или начала сна (время, которое требуется, чтобы заснуть); уменьшение трудностей с засыпанием; увеличение непрерывности сна; уменьшение числа пробуждений в течение сна; уменьшение ночных активаций; уменьшение времени,проведенного в активном состоянии после начального периода; увеличение общего количества сна; уменьшение фрагментации сна; изменение времени, частоты или продолжительности REM фазы цикла сна; изменение времени, частоты или продолжительности медленной волны (то есть стадий 3 или 4) цикла сна; увеличение количества и процентного отношения стадии 2 сна; поддержание медленного сна; усиление дельта-активности ЭЭГ в течение сна; увеличение дневной концентрации; уменьшение дневной сонливости; лечение или уменьшение чрезмерной дневной сонливости; инсомния; гиперсомния; нарколепсия; прерванный сон; апноэ во время сна; бодрствование; ночной миоклонус; прерывание REMсна; нарушение ритма организма; расстройство сна, вызванное сменным режимом работы; диссомнии; ночные кошмары; инсомнии, связанные с депрессией, эмоциональными нарушениями/нарушениями настроения, а также снохождение и энурез, и расстройства сна, которые сопровождают старение; ночная спутанность (sundowning) Альцгеймера; состояния, связанные с циркадным ритмом, а также ментальные и физические нарушения, связанные со сменой часовых поясов и со сменным режимом работы; состояния, вызываемые лекарственными средствами, которые вызывают уменьшение REM-сна как побочный эффект; синдромы, которые проявляются невосстанавливающим сном и мышечной болью или апноэ во время сна, которое связано с респираторными расстройствами в течение сна; и состояния, являющиеся результатом ухудшения качества сна. Болевые расстройства, в отношении которых соединения по изобретению могут быть использованы, включают нейропатическую боль (такую как постгерпетическая невралгия, повреждение нерва, "динии", например, вульводиния, фантомная боль в конечности, авульсии корня, болезненная диабетическая невропатия, болезненная травматическая мононевропатия, болезненная полиневропатия); центральные болевые синдромы (потенциально вызванные фактически любым поражением на любом уровне нервной системы); постоперационные болевые синдромы (например, синдром постмастэктомии, синдром постторакотомии, постампутационная боль); боль в костях и суставах (остеоартрит), боль повторяющегося движения, зубная боль, раковая боль, миофасциальная боль (мышечное повреждение, фибромиалгия); послеоперационная боль (общая хирургия, гинекологическая), хроническая боль, дисменорея, а также боль, связанная со стенокардией, и воспалительная боль различного происхождения (например, остеоартрит, ревматоидный артрит, ревматизм, теносиновит и подагра), головная боль, мигрень и кластерная головная боль, головная боль, первичная гипералгезия, вторичная гипералгезия, первичная аллодиния,вторичная аллодиния, или другая боль, вызванная центральной сенсибилизацией. Соединения по изобретению могут также использоваться для лечения или профилактики дискинезий. Кроме того, соединения по изобретению могут использоваться для уменьшения толерантности и/или зависимости от лечения боли опиоидами и для лечения абстиненции, например алкогольной, опиоидной и кокаиновой. Лицо или пациент, которому вводят соединения согласно настоящему изобретению, обычно представляет собой человека мужского или женского пола, у которого желательна аллостерическая модуляция M1, но этот термин может также охватывать других млекопитающих, таких как собаки, кошки, мыши, крысы, рогатый скот, лошади, овцы, кролики, обезьяны, шимпанзе или другие обезьяны или приматы, для которых желательно лечение вышеупомянутых известных нарушений. Соединения согласно настоящему изобретению могут использоваться в комбинации с одним или более других лекарственных средств в лечении заболеваний или состояний, в отношении которых соединения согласно настоящему изобретению могут быть использованы, когда комбинация лекарственных средств является более безопасной или более эффективной, чем любое лекарственное средство индивидуально. Дополнительно, соединения согласно настоящему изобретению могут использоваться в комбинации с одним или более других лекарственных средств, которые лечат, предотвращают, контролируют,облегчают или уменьшают риск побочных эффектов или токсичности соединений согласно настоящему изобретению. Такие другие лекарственные средства могут вводиться путем и в количестве, обычно используемом для этого, одновременно или последовательно с соединениями согласно настоящему изобретению. Соответственно, фармацевтические композиции согласно настоящему изобретению включают такие, которые содержат один или более других активных ингредиентов, в дополнение к соединениям согласно настоящему изобретению. Эти комбинации могут вводиться как часть стандартной лекарственной формы комбинированного продукта или как набор или протокол лечения, в котором один или более дополнительных лекарственных средств вводят в отдельных лекарственных формах как часть режима лечения. Примеры комбинаций соединений согласно настоящему изобретению включают комбинации со средствами против болезни Альцгеймера, например димебоном; ингибиторы(ами) бета-секретазы; соединениями, которые стимулируют путь -секретазы; альфа 7 никотиновыми агонистами, такими какGT521, RG3487, AQ W051, AZD0328 и EVP 6124; лигандами или активаторами ADAM 10; ингибиторами гамма-секретазы и модуляторами гамма-секретазы, такими как семагацест, таренфлурбил и BMS 708163; ингибиторами фосфорилирования tau; ингибиторами транспорта глицина; агонистами LXR ; конформационными модуляторами АроЕ 4; антагонистами NR2B; модуляторами рецептора андрогена; блокаторами формирования олигомера A; агонистами 5-НТ 4; антагонистами 5-HT6; антагонистами 5-НТ 1 а, такими как лекозотан, GSK 742457, PRX 03140 и SAM 531; ингибиторами p25/CDK5; антагонистами рецептора NK1/NK3; ингибиторами СОХ-2; ингибиторами HMG-CoA редуктазы; NSAID, включая ибупрофен; витамином Е; антиамилоидными антителами (включая гуманизированные моноклональные антиамилоидные антитела), такими как бапинейзумаб; противовоспалительными соединениями, такими как (R)флурбипрофен, нитрофлурбипрофен; агонистами PPAR гамма, такими как пиоглитазон и розиглитазон; антагонистом рецептора СВ-1 или обратным агонистом рецептора СВ-1; антибиотиками, такими как доксициклин и рифампин; антагонистами рецептора N-метил-D-аспартата (NMDA), такими как мемантин, нерамексан, СХ 717 и LY 451395; ингибиторами холинэстеразы, такими как галантамин, ривастигмин, донепезил, такрин, фенсерин и ладостигил; средствами, усиливающими секрецию гормона роста,такими как ибутаморен, ибутаморен мезилат и капроморелин; антагонистами рецептора гистамина Н 3,такими как MK 0249, GSK 189254, BF 2649 и GSK 239512; агонистами АМРА или модуляторами АМРА; ингибиторами PDE IV, такими как НТ 0712 и ЕНТ 202; ингибиторами PDE10A; антагонистами и обратными агонистами GABAA; ингибиторами GSK3 ; нейрональными никотиновыми агонистами; селективными агонистами M1; ингибиторами HDAC и лигандами киназы, регулирующей аффинность микротрубочек (MAPK); или другими лекарственными средствами, которые воздействуют на рецепторы или ферменты, которые или увеличивают эффективность, безопасность, удобство, или уменьшают нежелательные побочные эффекты или токсичность соединений согласно настоящему изобретению. Примеры комбинаций этих соединений включают комбинации со средствами для лечения боли, например нестероидными противовоспалительными средствами, такими как аспирин, диклофенак, дуфлунизал, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, напроксен, оксапрозин, пироксикам, сулиндак и толметин; ингибиторами СОХ-2, такими как целекоксиб, рофекоксиб и вальдекоксиб; агонистами СВ-2; антагонистами VR-1; антагонистами рецептора брадикинина В 1; блокаторами и антагонистами натриевых каналов; ингибиторами синтазы оксиды азота (NOS) (включая iNOS и nNOS ингибиторы); антагонистами сайта глицина, включая лакозамид; нейрональными никотиновыми агонистами; антагонистами NMDA; активаторами калиевых каналов; антагонистами рецептора АМРА/каината; блокаторами кальциевых каналов, такими как зиконотид; модуляторами IO рецептораGABA-A (например, агонист рецептора GABA-A); ингибиторами матриксной металлопротеазы (ММР); тромболитическими средствами; опиоидными аналгезирующими средства, такими как кодеин, фентанил,гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, пентазоцин, пропоксифен; нейтрофилингибирующим фактором (NIF); прамипексолом, ропиниролом; антихолинергическими средствами; амантадином; ингибиторами моноаминоксидазы В 15 ("МАО-В"); агонистами или антагонистами рецептора 5HT; антагонистами mGlu5; альфа-агонистами; нейрональными никотиновыми агонистами; агонистами или антагонистами рецептора NMDA; антагонистами NKI; селективными ингибиторами обратного захвата серотонина ("SSRI") и/или селективными ингибиторами обратного захвата серотонина и норэпинефрина ("SSNRI"), такими как дулоксетин; трициклическими антидепрессантами,модуляторами норэпинефрина; литием; вальпроатом; габапентином; прегабалином; ризатриптаном; золмитриптаном; наратриптаном и суматриптаном. Соединения согласно настоящему изобретению могут вводиться в комбинации с соединениями, полезными для усиления качества сна и предотвращения и лечения расстройств сна и нарушений сна,включая, например, седативные средства, снотворные средства, транквилизаторы, нейролептики, успокоительные средства, антигистамины, бензодиазепины, барбитураты, циклопирролоны, антагонисты орексина, альфа-1 антагонисты, агонисты GABA, антагонисты 5HT-2, включая антагонисты 5HT-2 А и антагонисты 5HT-2 А/2 С, антагонисты гистамина, включая антагонисты гистамина H3, обратные агонисты гистамина H3, имидазопиридины, малые транквилизаторы, агонисты и антагонисты мелатонина,мелатонергические средства, другие антагонисты орексина, агонисты орексина, агонисты и антагонисты прокинетицина, пиразолопиримидины, антагонисты кальциевых каналов Т-типа, триазолопиридины и т.п., такие как адиназолам, аллобарбитал, алонимид, алпразолам, амитриптилин, амобарбитал, амоксапин, армодафинил, APD-125, бентазепам, бензоктамин, бротизолам, бупропион, бусприон, бутабарбитал,буталбитал, капроморелин, капурид, карбоклорал, хлоралбетаин, хлоралгидрат, хлордиазепоксид, кломипрамин, клоназепам, клоперидон, клоразепат, клоретат, клозапин, коназепам, ципразепам, дезипрамин, декскламол, диазепам, дихлоралфеназон, дивалпроекс, дифенилгидрамин, доксепин, EMD-281014,эпливансерин, эстазолам, эсзопиклон, этхлоринол, этомидат, фенобам, флунитразепам, флуразепам, флувоксамин, флуоксетин, фосазепам, габоксадол, глутетимид, галазепам, гидроксизин, ибутаморен, имипрамин, индиплон, литий, лоразепам, лорметазепам, LY-156735, мапротилин, MDL-100907, меклохалон,мелатонин, мефобарбитал, мепробамат, метахалон, метиприлон, мидафлур, мидазолам, модафинил, нефазодон, NGD-2-73, низобамат, нитразепам, нортриптилин, оксазепам, паральдегид, пароксетин, пентобарбитал, перлапин, перфеназин, фенелзин, фенобарбитал, празепам, прометазин, пропофол, протриптилин, квазепам, рамелтеон, реклазепам, ролетамид, секобарбитал, сертралин, супроклон, TAK-375, темазепам, тиоридазин, тиагабин, траказолат, транилципромаин, тразодон, триазолам, трепипам, трицетамид,триклофос, трифлуоперазин, триметозин, тримипрамин, улдазепам, венлафаксин, залеплон, золазепам,зопиклон, золпидем и их соли, и их комбинации, и т.п., или соединение согласно настоящему изобретению может вводиться в сочетании с использованием физических способов, таких как светолечение или электростимуляция. В другом варианте осуществления соединение по изобретению может использоваться в комбинации с леводопой (с или без селективного экстрацеребрального ингибитора декарбоксилазы, такого как карбидопа или бенсеразид), антихолинергическими средствами, такими как бипериден (в случае необходимости в форме его гидрохлоридной или лактатной соли) и тригексифенидил (бензгексол) гидрохлорид, ингибиторами COMT, такими как энтакапон, ингибиторами MOA-B, антиоксидантами, антагонистами рецептора аденозина A2a, холинергическими агонистами и агонистами рецептора допамина, такими как алентемол, бромокриптин, фенолдопам, лисурид, наксаголид, перголид и прамипексол. Термин "композиция" в рамках изобретения охватывает продукт, включающий определенные ингредиенты в предварительно определенных количествах или соотношениях, а также любой продукт, являющийся, прямо или косвенно, результатом комбинации указанных ингредиентов в указанных количествах. Этот термин относительно фармацевтических композиций охватывает продукт, включающий один или более активных ингредиентов и дополнительный носитель, включающий инертные ингредиенты, а также любой продукт, являющийся, прямо или косвенно, результатом комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или диссоциации одного или более ингредиен- 17022494 тов, или других типов реакций или взаимодействий одного или более ингредиентов. В общем, фармацевтические композиции получают, однородно и тесно приводя активный ингредиент в ассоциацию с жидким носителем или тонкодисперсным твердым носителем, или обоими, и затем, в случае необходимости, формируя продукт в желаемый состав. В фармацевтической композиции активное соединение, которое является соединением формул (I)-(VIII), включено в количестве, достаточном,чтобы произвести желаемый эффект на процесс или состояние заболеваний. Соответственно, фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную смешиванием соединения согласно настоящему изобретению и фармацевтически приемлемого носителя. Носитель может принимать широкую разновидность форм в зависимости от формы препарата, желательной для введения, например перорального или парентерального (включая внутривенный). Таким образом, фармацевтические композиции согласно настоящему изобретению могут быть представлены как дискретные единицы, подходящие для перорального введения, такие как капсулы, облатки или таблетки, каждая из которых содержит предварительно определенное количество активного ингредиента. Далее, композиции могут быть представлены в форме порошка, гранул, раствора, суспензии в водной жидкости, неводной жидкости, эмульсии типа "масло в воде" или как жидкой эмульсии "вода в масле". В дополнение к обычным лекарственным формам, представленным выше, соединения по изобретению или их фармацевтически приемлемые соли могут также вводиться средствами контролируемого высвобождения и/или устройствами доставки. Фармацевтические композиции, предназначенные для перорального использования, могут быть получены согласно любому способу, известному в данной области техники для получения фармацевтических композиций, и такие композиции могут содержать одно или более средств, выбранных из группы,состоящей из подсластителей, ароматизаторов, красителей и консервантов, чтобы обеспечить фармацевтически изящные и приемлемые препараты. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые являются подходящими для получения таблеток. Эти эксципиенты могут быть, например, инертными разбавителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующими средствами и дезинтеграторами, например кукурузным крахмалом или альгиновой кислотой; связующими,например крахмалом, желатином или гуммиарабиком, и лубрикантами, например стеаратом магния, стеариновой кислотой или тальком. Таблетки могут не иметь покрытия, или они могут быть покрыты известными методиками, чтобы задержать разложение и абсорбцию в желудочно-кишечном тракте и таким образом обеспечить замедленное действие за более длительный период. Таблетка, содержащая композицию по изобретению, может быть получена прессованием или формованием в случае необходимости с одним или более вспомогательными ингредиентами или адъювантами. Прессованные таблетки могут быть получены прессованием, в подходящем механизме, активного ингредиента в сыпучей форме, такой как порошок или гранулы, в случае необходимости смешанной со связующим, лубрикантом, инертным разбавителем, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть получены формованием, в подходящем механизме, смеси порошкового соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от приблизительно 0,1 мг до приблизительно 500 мг активного ингредиента, и каждая облатка или капсула предпочтительно содержит от приблизительно 0,1 мг до приблизительно 500 мг активного ингредиента. Композиции для перорального использования могут также быть представлены в форме твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в форме мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например арахисовым маслом,жидким парафином или оливковым маслом. Другие фармацевтические композиции включают водные суспензии, которые содержат активные вещества в смеси с эксципиентами, подходящими для получения водных суспензий. Кроме того, масляные суспензии могут быть составлены путем суспендирования активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут также содержать различные эксципиенты. Фармацевтические композиции по изобретению могут также быть в форме эмульсий типа"масло в воде", которые могут также содержать эксципиенты, такие как подсластители и ароматизаторы. Фармацевтические композиции могут быть в форме стерильной инъецируемой водной или масляной суспензии или в форме стерильных порошков для экстемпорального приготовления таких стерильных инъецируемых растворов или дисперсий. Во всех случаях, конечная инъецируемая форма должна быть стерильной и должна быть фактически жидкой для легкого введения с помощью шприца. Фармацевтические композиции должны быть стабильными в условиях производства и хранения; таким образом, предпочтительно должны быть предохранены против действия загрязняющих микроорганизмов,таких как бактерии и грибы. Фармацевтические композиции согласно настоящему изобретению могут быть в форме, подходящей для топического использования, такой как, например, аэрозоль, крем, мазь, лосьон, присыпка или подобной. Далее, композиции могут быть в форме, подходящей для использования в трансдермальных устройствах. Эти составы могут быть получены обычными способами обработки. Например, крем или мазь получают, смешивая гидрофильный материал и воду вместе с от приблизительно 5 вес.% до приблизительно 10 вес.% соединения, получая крем или мазь, имеющую желаемую консистенцию. Фармацевтические композиции по изобретению могут также быть в форме, подходящей для ректального введения, в которой носитель является твердым. Предпочтительно, чтобы смесь образовывала лекарственную форму суппозиториев. Подходящие носители включают масло какао и другие материалы,обычно используемые в данной области техники. Под "фармацевтически приемлемым" имеется в виду носитель, разбавитель или эксципиент, который должен быть совместим с другими ингредиентами состава и не быть вредным для реципиента. Термин "введение" соединения означает доставку соединения по изобретению пациенту в форме,которая может быть введена в организм этого пациента в терапевтически полезной форме и терапевтически полезном количестве, включая, но не ограничиваясь ими, пероральные лекарственные формы, такие как таблетки, капсулы, сиропы, суспензии и т.п.; инъецируемые лекарственные формы, такие как внутривенные, внутримышечные или внутрибрюшинные и т.п.; трансдермальные лекарственные формы,включая кремы, гели, порошки или пластыри; буккальные лекарственные формы; ингаляционные порошки, спреи, суспензии и т.п.; и ректальные суппозитории. Термины "эффективное количество" или "терапевтически эффективное количество" означают количество соединения, которое вызывает биологический или медицинский ответ на уровне ткани, системы, животного или человека, который изыскивается исследователем, ветеринаром, врачом или другим клиническим специалистом. В рамках изобретения термин "лечение" означает любое введение соединения согласно настоящему изобретению и включает (1) ингибирование заболевания у животного, которое испытывает или демонстрирует патологию или семиологию заболевания (то есть остановку дальнейшего развития патологии и/или семиологии), или (2) облегчение заболевания у животного, которое испытывает или демонстрирует патологию или семиологию заболевания (то есть обращение патологии и/или семиологии). Композиции, содержащие соединения согласно настоящему изобретению, могут быть представлены в стандартной лекарственной форме и могут быть получены любым из способов, известных в области фармации. Термин "стандартная лекарственная форма" означает отдельную дозу, в которой все активные и неактивные ингредиенты объединены в подходящей системе, такой, что пациент или лицо, вводящее лекарственное средство пациенту, может открыть единственную емкость или упаковку со всей дозой,содержащейся там, и не должны смешать никаких компонентов вместе из двух или больше емкостей или упаковок. Типичными примерами стандартных лекарственных форм являются таблетки или капсулы для перорального введения, отдельные ампулы с дозой для инъекции или суппозитории для ректального введения. Этот список стандартных лекарственных форм не ограничивает, но просто представляет типичные примеры стандартных лекарственных форм. Композиции, содержащие соединения согласно настоящему изобретению, могут быть представлены как набор, включающий два или более компонентов, которые могут быть активными или неактивными ингредиентами, носителями, разбавителями и т.п., вместе с инструкциями по получению фактической лекарственной формы пациентом или лицом, вводящим лекарственное средство пациенту. Такой набор может включать все необходимые материалы и ингредиенты, содержащиеся там, или они могут содержать инструкции по применению или получению материалов или компонентов, которые должны быть получены независимо пациентом или лицом, вводящим лекарственное средство пациенту. При лечении или облегчении нарушения или заболевания, в отношении которого показаны соединения согласно настоящему изобретению, получают, в целом, удовлетворительные результаты, когда соединения согласно настоящему изобретению вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 100 мг на кг массы тела животных, предпочтительно принимаемой как единственная суточная доза, или в виде разделенных доз от двух до шести раз в сутки, или в форме замедленного высвобождения. Полная суточная доза составляет от приблизительно 1,0 мг до приблизительно 2000 мг,предпочтительно от приблизительно 0,1 мг до приблизительно 20 мг на кг массы тела. В случае 70 килограммового взрослого человека полная суточная доза обычно составляет от приблизительно 7 мг до приблизительно 1400 мг. Этот режим дозировки может быть отрегулирован, чтобы обеспечить оптимальный терапевтический ответ. Соединения могут вводиться в режиме от 1 до 4 раз в сутки, предпочтительно несколько раз в сутки. Количество активного ингредиента, который может быть объединен с материалами-носителями для получения отдельной лекарственной формы, варьирует в зависимости от подвергаемого лечению хозяина и конкретного способа введения. Например, состав, предназначенный для перорального введения человеку, может содержать от приблизительно 0,005 мг до приблизительно 2,5 г активного средства, составленного с подходящим и удобным количеством материала-носителя. Стандартные лекарственные формы обычно содержат от приблизительно 0,005 мг до приблизительно 1000 мг активного ингредиента,обычно 0,005, 0,01, 0,05, 0,25, 1, 5, 25, 50, 100, 200, 300, 400, 500, 600, 800 или 1000 мг, вводимых один,два или три раза в сутки. Следует, однако, понимать, что определенный уровень дозы и частота дозировки для любого конкретного пациента могут быть различными и зависят от различных факторов, включая активность конкретного используемого соединения, метаболической стабильности и продолжительности действия этого соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, способа и времени введения,скорости выведения, комбинации лекарственных средств, серьезности конкретного состояния и хозяина,подвергаемого терапии. Соединения по изобретению могут быть получены согласно следующим реакционным схемам, в которых переменные имеют значения, определенные выше, или получены с использованием легко доступных исходных материалов, из реагентов и обычных процедур синтеза. Также возможно использовать варианты, которые сами по себе известны специалисту в области органического синтеза, но не упомянуты более детально. Настоящее изобретение также относится к способу синтеза соединений, которые могут быть использованы как промежуточные соединения в получении соединений по изобретению. Схема 1 Коммерчески доступный хинолин А 1 может быть превращен в бромид А 2 с использованием такого реагента, как оксибромид фосфора в растворителе, таком как толуол и/или ацетонитрил (схема 1). Гидролиз А 2 с использованием основания, такого как гидроксид натрия, в растворителе, таком как THF и/или метанол, приводит к карбоновой кислоте A3. Формирование амидной связи с (1S,2S)-2-гидроксиаминоциклогексаном с использованием сочетающего реагента, такого как BOP (бензотриазолилокситрис-(диметиламино)фосфоний гексафторфосфат) дает А 4. Перекрестное сочетание по Negishi A4 с подходящим реагентом цинка с использованием катализатора, такого как палладийтетракис(трифенилфосфин), в растворителе, таком как THF, дает пример 1. Примеры 10 и 11 могут быть получены аналогично схеме 1, кроме того, что вместо (1S,2S)-2 гидроксиаминоциклогексана используют (3R,4S)-3-аминотетрагидро-2H-пиран-4-ол и (3R,4S)-4-аминотетрагидро-2H-пиран-3-ол соответственно. Схема 2 Как может быть замечено на схеме 2, пример 2 может быть получен через перекрестное сочетание по Negishi примера 1 с подходящим реагентом цинка с использованием катализатора, такого как Промежуточное соединение А 4 может быть превращено в N-оксиды C1 с использованием окислителя, такого как метахлорпербензойная кислота, в растворителе, таком как дихлорметан. Перекрестное сочетание по Negishi C1 с подходящим реагентом цинка с использованием катализатора, такого как палладийтетракис(трифенилфосфин), в растворителе, таком как THF, дает пример 3 (схема 3). Пример 1 может подвергаться перекрестному сочетанию по Suzuki с использованием бороновой кислоты, такой как циклопропанбороновая кислота, переходного металла, такого как палладий, лиганда,такого как трихлорэтиленциклогексилфосфин, основания, такого как фосфат калия, в растворителе, таком как диоксан, давая пример 4. Схема 5 Как показано на схеме 5, пример 1 может также быть превращен в пример 7 с использованием нуклеофила, такого как тиометоксид натрия, в растворителе, таком как ДМСО. Схема 6 В схеме 6 I3 может быть получен с использованием подхода, описанного в схеме 4. Превращение гидроксильной группы в I3 во фторид может быть осуществлено с использованием перфторбутансульфонилфторида и триэтиламингидрофторида в растворителе, таком как THF, в присутствии триэтиламина, с получением примера 9. Схема 7 Альтернативно, соединения могут быть получены, как показано на схеме 7. Сокращение сложного эфира M1 с восстановителем, таким как литий-алюминийгидрид, в растворителе, таком как THF, дает М 2, который может быть превращен в бромид M3 с таким реагентом, как тионилбромид, в растворителе,таком как дихлорметан. Сочетание по Suzuki K4, который может быть получен из А 2 в схеме 1, с M3 с использованием такого реагента, как палладийтетракис(трифенилфосфин), в растворителе, таком какTHF, дает М 4. Гидролиз сложного эфира с использованием основания, такого как гидроксид натрия, дает М 5. Наконец, сочетание М 5 с амином, таким как (3R,4S)-4-аминотетрагидро-2H-пиран-3-ол, с таким реагентом, как BOP (бензотриазолилокситрис-(диметиламино)фосфоний гексафторфосфат), в присутствии основания, такого как триэтиламин, дает пример 13. Несколько способов получения соединений по изобретению проиллюстрированы в приведенных здесь схемах и примерах. Исходные материалы получали согласно процедурам, известным в данной об- 21022494 ласти техники, или как проиллюстрировано здесь. Следующие примеры приведены так, чтобы изобретение могло быть понято более полно. Пример 1 4-[(6-Хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид Раствор 4-гидроксихинолин-2-этилкарбоксилата (10,0 г, 46,0 ммоль) и бромангидрида фосфорной кислоты (13,2 г, 46,0 ммоль) в 100 мл толуола и 10,0 мл ацетонитрила нагревали при 75C в течение 1,5 ч. Реакционную смесь охлаждали до температуры окружающей среды, медленно гасили водой и экстрагировали этилацетатом. Органическую фракцию промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-50% этилацетата в гексанах, получая 4-бромхинолин-2-этилкарбоксилат, который дал ионную масс-спектрометрию (ES+) 280,11 (79Br) для M+H+. К раствору полученного выше соединения (1,0 г, 3,6 ммоль) в 7,0 мл метанола и 7,0 мл THF добавляли 1 н. водный раствор NaOH (3,6 мл, 3,6 ммоль). Немедленно образовывался белый осадок. Полученную суспензию подкисляли 1 н. водным раствором HCl. Реакционную смесь экстрагировали метиленхлоридом, высушивали над сульфатом натрия, фильтровали и концентрировали, получая 4-бромхинолин-2 карбоновую кислоту, которая дала ионную масс-спектрометрию (ES+) 254,1 (81Br) для M+H+. К раствору полученного выше соединения (1,5 г, 6,0 ммоль) в 30 мл метиленхлорида добавляли(1S,2S)-2-аминоциклогексанол (0,82 г, 7,1 ммоль), (бензотриазол-1-илокси)трис-(диметиламино)фосфоний гексафторфосфат (BOP) (3,4 г, 7,7 ммоль) и триэтиламин (2,48 мл, 17,9 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч, разбавляли CH2Cl2, промывали дважды водой, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-70% этилацетата в гексанах, получая 2,0 г(95%) 4-бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамида, который дал ионную массспектрометрию (ES+) 349,2 (79Br) для M+H+. К полученному выше соединению (0,44 г, 1,3 ммоль) и палладийтетракис(трифенилфосфину) (0,15 г, 0,13 ммоль) добавляли (2-хлор-5-пиридил)метилцинк хлорид (12,5 мл, 0,5 М в THF). Реакционную смесь нагревали до 90C в течение 4 ч, охлаждали до температуры окружающей среды и гасили насыщенным водным раствором хлорида аммония. Реакционную смесь экстрагировали дважды этилацетатом,промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 10-85% этилацетата в гексанах, получая целевое соединение. Этот материал подвергали дополнительной очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 396,1485 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,35 (с, 1H), 8,26 (шир. д, J=7,5 Гц, 1H), 8,17 (д, J=8,2 Гц, 1H), 8,15 К раствору примера 1 (94 мг, 0,237 ммоль) и PdCl2(dppf) (18 мг, 0,047 ммоль) в THF (1 мл) при температуре окружающей среды добавляли ZnMe2 в толуоле (1,2 м., 0,4 мл). Реакционную смесь перемешивали при 50C в течение 2 ч. Добавляли вторую часть ZnMe2 (0,6 мл) и PdCl2(dppf) (18 мг). Реакционную смесь нагревали при 50C в течение 3 ч, охлаждали и гасили насыщенным водным раствором NaHCO3. Смесь экстрагировали EtOAc, высушивали над Na2SO4, фильтровали и концентрировали. Очистка ВЭЖХ с обратной фазой (колонка C-18, 5-90% MeCN в H2O, где оба содержат 0,05% TFA) дала целевое соединение. 1H ЯМР (400 МГц, CDCl3)8,46 (д, J=2,0 Гц, 1H), 8,27 (д, J=7,6 Гц, 1H), 8,13 (с, 1H), 8,13 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,6 Гц, 1H), 7,75 (т, J=8,0 Гц, 1H), 7,60 (д, J=7,6 Гц, 1H), 7,30 (дд, J=2,4, 8,0 Гц, 1H),7,04 (д, J=8,0 Гц, 2H), 4,45 (с, 2H), 3,92-3,84 (м, 1H), 3,61-3,57 (м, 1H), 2,51 (с, 3H), 2,17-2,12 (м, 2H), 1,821,79 (м, 2H), 1,54-1,23 (м, 4H). HRMS (ES) [M+1]+ вычислено для C23H25N3O2: 376,2020. Найдено: 376,2010. Пример 3 4-[(6-Хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид-1-оксид 4-Бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид получали, как описано в примере 1. К раствору 4-бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамида (0,20 г, 0,57 ммоль) в 3,0 мл CH2Cl2 при температуре окружающей среды добавляли 3-хлорпербензойную кислоту (0,20 г,1,15 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. К реакционной смеси добавляли дополнительное количество 3-хлорпербензойной кислоты (0,20 г, 1,15 ммоль) и перемешивали при температуре окружающей среды в течение еще 18 ч. Реакционную смесь концентрировали и полученный остаток подвергали хроматографии на силикагеле с элюированием 075% этилацетата в гексанах, получая 4-бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид 1-оксид, который дал ионную масс-спектрометрию (ES+) 367,1 для (81Br) для M+H+. К полученному выше соединению (0,05 г, 0,14 ммоль) и палладийтетракис(трифенилфосфину) (0,03 г, 0,03 ммоль) добавляли (2-хлор-5-пиридил)метилцинк хлорид (1,4 мл, 0,5 м. в THF). Реакционную смесь нагревали до 90C в течение 5 ч, охлаждали до температуры окружающей среды и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой. Выделенный материал затем очищали препаративной TLC (2:1 этилацетат/CH2Cl2), получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 412,1424 для M+H+. 1H ЯМР (400 МГц, CDCl3)11,75 (д, J=7,3 Гц, 1H), 8,85 4-[(6-Хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид получали, как описано в примере 1. В микроволновую ампулу, содержащую 4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид (А) (40 мг, 0,10 ммоль), циклопропилбороновую кислоту (0,01 г, 0,13 ммоль), Pd2(dba)3 (1,4 мг, 1,5 мкмоль), трициклогексилфосфин (2,8 мг, 10 мкмоль) и трехосновный фосфат калия (75 мг, 0,35 ммоль), добавляли 0,53 мл толуола/воды (20:1). Полученный раствор дегазировали в течение 10 мин. Реакционную смесь нагревали до 140C в микроволновом реакторе в течение 30 мин. Реакционную смесь экстрагировали CH2Cl2, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 402,2178 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,87 (д, J=2,10 Гц, 1H), 8,25 (д, J=7,60 Гц, 1H), 8,17 (д, J=8,5 Гц, 1H), 8,11 (с, 1H), 7,93 (д, J=8,4 Гц, 1H),7,80 (т, J=7,1 Гц, 1H), 7,76 (дд, J=2,2, 8,7 Гц, 1H), 7,67 (т, J=1,2 Гц, 1H), 7,05 (д, J=8,5 Гц, 1H), 4,57 (с, 2H),3,93-3,85 (м, 1H), 3,62-3,56 (м, 1H), 2,54-2,47 (м, 1H), 2,16-2,13 (м, 2H), 1,83-1,80 (м, 2H), 1,54-1,32 (м,6H), 1,16-1,07 (м, 2H). Пример 5(1,7 мг, 6,1 мкмоль) добавляли 0,84 мл диоксана и 1,7 М водного трехосновного фосфата на 0,34 мл. Реакционную смесь нагревали до 140C в микроволновом реакторе в течение 1 ч. Реакционную смесь экстрагировали этилацетатом, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 442,2241 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,49 (д, J=2,0 Гц,1H), 8,27 (д, J=7,3 Гц, 1H), 8,19 (с, 1H), 8,14 (д, J=8,6, 1H), 8,04 (д, J=8,4 Гц, 1H), 7,88 (д, J=9,7 Гц, 2H),7,75 (т, J=7,1 Гц, 1H), 7,60 (т, J=7,7 Гц, 1H), 7,39 (дд, J=2,0, 8,1 Гц, 1H), 7,33 (д, J=8,2 Гц, 2H), 4,48 (с, 2H),3,94 (с, 3H), 3,91-3,84 (м, 1H), 3,58 (м, 1H), 3,38 (шир. с, 1H) 2,16-2,13 (м, 2H), 1,92-1,79 (м, 2H), 1,52-1,31 4-[(6-Хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид получали, как описано в примере 1. К раствору 4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамида (А) (0,15 г, 0,38 ммоль) в 3,5 мл этилацетата и нескольких каплях метанола, чтобы увеличить растворимость, добавляли триэтиламин (0,053 мл, 0,38 ммоль) и палладий на углероде (10 мол.%). Реакционную смесь помещали в атмосферу H2 (g) с баллоном на 18 ч. Реакционную смесь фильтровали через целит, промывали избытком метанола и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 362,1866 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,58 (с, 1H), 8,49 (дд, J=1,3, 4,8 Гц, 1H), 8,27 (д, J=7,7 Гц,1H), 8,17 (с, 1H), 8,15 (дд, J=0,7, 8,6 Гц, 1H), 8,01 (д, J=7,9 Гц, 1H), 7,78-7,74 (м, 1H), 7,63-7,52 (м, 1H),7,44-7,42 (м, 1H), 7,19 (дд, J=4,9, 7,9 Гц, 1H), 4,51 (с, 2H), 3,93-3,84 (м, 1H), 3,62-3,54 (м, 1H), 3,36 (д,J=4,2, 1H), 2,17-2,12 (м, 2H) 1,82-1,79 (м, 2H), 1,52-1,34 (м, 4H). Пример 7 4-[(6-Хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид получали, как описано в примере 1. В микроволновую ампулу, содержащую 4-[(6-хлорпиридин-3-ил)метил]-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид (А) (40 мг, 0,10 ммоль) и тиометоксид натрия (25 мг, 0,30 ммоль), добавляли 0,5 мл ДМСО. Реакционную смесь нагревали до 120C в течение 3 ч. Реакционную смесь разбавляли этилацетатом, промывали водой, промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 408,1743 для В микроволновую ампулу, содержащую (6-хлорпиридин-3-ил)метанол (H1) (0,25 г, 1,7 ммоль), 1 метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (63 мг, 0,30 ммоль), Pd2(dba)3 (16 мг,0,02 ммоль) и трициклогексилфосфин (12 мг, 0,04 ммоль), добавляли 7,0 мл диоксана и 2,3 мл 1,7 М водного трехосновного фосфата калия. Реакционную смесь нагревали до 140C в микроволновом реакторе в течение 1,5 ч. Реакционную смесь экстрагировали этилацетатом, высушивали над сульфатом натрия,фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-15% метанола в метиленхлориде, получая [6-(1-метил-1H-пиразол-4-ил)пиридин-3-ил]метанол (Н 2), который дал ионную масс-спектрометрию (ES+) 190,2 для M+H+. К раствору полученного выше соединения (0,20 г, 1,0 ммоль) в 2,0 мл CH2Cl2 добавляли тионилбромид (0,10 мл, 1,2 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды и тщательно гасили насыщенным водным раствором бикарбоната натрия. Полученные слои разделяли и водную часть экстрагировали дважды CH2Cl2. Объединенную органическую часть высушивали над сульфатом натрия, фильтровали и концентрировали, получая 5-(бромметил)-2-(1-метил 1H-пиразол-4-ил)пиридин (H3) в форме твердого вещества белого цвета, которое дало ионную массспектрометрию (ES+) 252,1 (79Br) для M+H+. К раствору полученного выше соединения (0,05 г, 0,20 ммоль) в 0,5 мл CH2Cl2 добавляли 3- 25022494 хлорпербензойную кислоту (0,04 г, 0,24 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч и реакционную смесь разбавляли CH2Cl2, промывали водой, промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали, получая 5(бромметил)-2-(1-метил-1H-пиразол-4-ил)-пиридин-1-оксид (Н 4) в форме твердого вещества белого цвета, которое дало ионную масс-спектрометрию (ES+) 270,2 (81Br) для М+H+. 4-Бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид (А 4) получали, как описано в примере 1. В микроволновую ампулу, содержащую 4-бром-N-[(1S,2S)-2-гидроксициклогексил]хинолин-2-карбоксамид (А 4) (0,18 г, 0,52 ммоль), бис-(пинаколято)диборон (0,14 г, 0,57 ммоль), ацетат калия (0,10 г,1,0 ммоль) и аддукт PdCl2(dppf)-CH2Cl2 (21 мг, 0,03 ммоль), добавляли 4,0 мл толуола. Реакционную смесь нагревали до 80C в течение 18 ч. Реакционную смесь фильтровали через целит, промывали этилацетатом и концентрировали, получая N-[(1S,2S)-2-гидроксициклогексил]-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин-2-карбоксамид (Н 5), который дал протонный ЯМР, совместимый с теорией. В микроволновую ампулу, содержащую полученное выше соединение (50 мг, 0,13 ммоль), 5(бромметил)-2-(1-метил-1H-пиразол-4-ил)пиридин-1-оксид (Н 4) (41 мг, 0,15 ммоль), карбонат цезия (120 мг, 0,38 ммоль) и аддукт PdCl2(dppf)-CH2Cl2 (10 мг, 0,01 ммоль), добавляли 1,4 мл THF и 140 мкл воды. Реакционную смесь нагревали до 80C в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды, гасили водой, экстрагировали этилацетатом, высушивали над сульфатом натрия,фильтровали и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение с примесями. Этот материал подвергали дополнительной очистке хроматографией на силикагеле с элюированием 0-10% метанола в метиленхлориде, получая целевое соединение,которое дало ионную масс-спектрометрию (ES+) 458,2197 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,82 (с,1H), 8,26 (д, J=7,3 Гц, 1H), 8,21 (с, 1H), 8,17 (д, J=8,5 Гц, 1H), 8,15 (с, 1H), 7,96 (д, J=7,5 Гц, 1H), 7,95 (с,1H), 7,77 (тд, J=1,2 Гц, 6,9 Гц, 1H), 7,62 (тд, J=1,2, 6,9 Гц, 1H), 7,54 (д, J=8,4 Гц, 2H), 7,06 (д, J=8,5 Гц,1H), 4,44 (с, 2H), 3,96 (с, 3H), 3,94-3,86 (м, 1H), 3,63-3,57 (м, 1H), 3,32 (д, J=3,7 Гц, 1H), 2,16 (м, 2H), 1,81 4-Бромхинолин-2-карбоновую кислоту (A3) получали, как описано в примере 1. К раствору 4-бромхинолин-2-карбоновой кислоты (A3) (0,10 г, 0,40 ммоль) в 2,0 мл CH2Cl2 добавляли (цис)-2-гидроксициклогексанаминий хлорид (0,12 г, 0,80 ммоль), реагент BOP (0,35 г, 0,80 ммоль) и триэтиламин (0,16 мл, 1,2 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч, разбавляли CH2Cl2, промывали водой, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-60% этилацетата в гексанах, получая 4-бром-N-[(цис)-2-гидроксициклогексил]хинолин-2-карбоксамид(II), который дал ионную масс-спектрометрию (ES+) 349,2 (79Br) для M+H+. К смеси полученного выше соединения (0,12 г, 0,35 ммоль) и палладийтетракис(трифенилфосфина)(0,40 г, 0,04 ммоль) добавляли (2-хлор-5-пиридил)метилцинк хлорид (3,5 мл, 0,5 м. в THF). Реакционную смесь нагревали до 90C в течение 4 ч, охлаждали до температуры окружающей среды и гасили насыщенным водным раствором хлорида аммония. Реакционную смесь экстрагировали три раза CH2Cl2, промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-100% этилацетата в гексанах, получая 4-[(6-хлорпиридин-3-ил)метил]-N-[(цис)-2-гидроксициклогексил]хинолин-2-карбоксамид(I2), который дал ионную масс-спектрометрию (ES+) 396,4 для M+H+. В микроволновую ампулу, содержащую полученное выше соединение (130 мг, 0,33 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (82 мг, 0,40 ммоль), Pd2(dba)3 (3,0 мг,3,3 мкмоль) и трициклогексилфосфин (2,2 мг, 7,9 мкмоль), добавляли 1,3 мл диоксана и 0,44 мл 1,7 М водного трехосновного фосфата калия. Реакционную смесь нагревали до 140C в микроволновом реакторе в течение 1,5 ч. Реакционную смесь экстрагировали этилацетатом, высушивали над сульфатом натрия,фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 0-100% этилацетата в гексанах, получая соединение I3, который дал ионную массспектрометрию (ES+) 442,5 для M+H+. К раствору полученного выше соединения (130 мг, 0,29 ммоль) в 1,2 мл THF добавляли TEA (0,25 мл, 1,76 ммоль), перфтор-1-бутансульфонилфторид (PBSF) (0,11 мл, 0,59 ммоль) и триэтиламинтригидрофторид (0,096 мл, 0,59 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 24 ч. Добавляли дополнительное количество PBSF (0,11 мл, 0,59 ммоль) и триэтиламинтригидрофторид (0,096 мл, 0,59 ммоль) и реакционную смесь нагревали до 50C в течение 24 ч. Добавляли дополнительное количество PBSF (0,11 мл, 0,59 ммоль) и триэтиламинтригидрофторид (0,096 мл, 0,59 ммоль) и реакционную смесь нагревали до 50C в течение 24 ч. Реакционную смесь разбавляли CH2Cl2,промывали три раза водой, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали очистке ВЭЖХ с обратной фазой, получая целевое соединение, которое дало ионную масс-спектрометрию (ES+) 444,2192 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,50 (с, 1H), 8,31 (д,J=8,4 Гц, 1H), 8,20 (с, 1H), 8,14 (д, J=8,6 Гц, 1H), 8,03 (д, J=8,5 Гц, 1H), 7,88 (д, J=10,2 Гц, 2H), 7,74 (т,J=7,0 Гц, 1H), 7,59 (т, J=7,2 Гц, 1H), 7,40 (м, 1H), 7,36 (м, 2H), 4,60 (м, 1H), 4,49 (м, 2H), 4,15 (м, 1H), 3,94 Раствор 4,4-диметоксидигидро-2H-пиран-3(4H)-она (172 г, 1,07 моль, см. пример 1) в 310 мл толуола перемешивали в толуоле в течение 30 мин, затем экстрагировали 3 водой (270 мл). К водному раствору добавляли дигидрофосфат калия (14,1 г, 0,104 моль), формиат натрия (55,1 г, 0,810 моль) и Lаланин (72,2 г, 0,810 моль). Устанавливали pH 7,8 с 5 н. NaOH и добавляли НАД (0,810 г), PLP (0,810 г),LDH (0,162 г), FDH (1,62 г) и Codexis ТА P1G5 (4,05 г). Смесь нагревали до 45C в течение 12 ч, затем охлаждали до температуры окружающей среды. Добавляли карбонат калия (324 г, 2,34 моль) и через 30 мин смесь разбавляли ацетонитрилом (810 мл). Через 30 мин реакционную смесь фильтровали через слойsolka-floc. Фильтрат разделяли и водный слой экстрагировали дополнительным количеством ацетонитрила (810 мл). Объединенные органические фракции концентрировали в вакууме, получая сырой (3S)4,4-диметокситетрагидро-2H-пиран-3-амин. Полученный выше остаток повторно растворяли в 700 мл THF и 254 мл воды и охлаждали до 0C. Добавляли гидроксид натрия (5 н., 96 мл, 0,48 моль) и реакционную смесь повторно охлаждали до -5C. Бензилхлорформиат (68,0 мл, 0,476 моль) добавляли через шприц за 30 мин и смесь затем нагревали до температуры окружающей среды. HCl (6 н., 250 мл, 1,50 моль) добавляли до pH 0,40 и смесь перемешивали с верхней мешалкой. Через 2 ч 3 М карбоната калия добавляли до pH 7,4 и реакционную смесь разбавляли THF (700 мл). Твердое вещество белого цвета удаляли фильтрацией и промывали дополнительным количеством THF (100 мл). Объединенные органические фракции концентрировали в вакууме, получая сырой бензил [(3S)-4-оксотетрагидро-2H-пиран-3-ил]карбамат. К раствору дигидрофосфата калия (62,7 г, 0,461 моль) в 3,6 л воды добавляли фосфорную кислоту до pH 7,0. К этому раствору добавляли глюкозу (112 г, 0,622 моль), НДЦФ (3,6 г), GDH-103 (1,8 г),KRED 119 (3,6 г) и сырой бензил[(3S)-4-оксотетрагидро-2H-пиран-3-ил]карбамат (103,4 г, 0,4148 моль). Через 17 ч pH реакционной смеси устанавливали на уровне pH 6,5 с помощью 5 н. NaOH. Твердое вещество белого цвета собирали фильтрацией и промывали 2 водой (200 мл). Твердое вещество суспендировали в 600 мл толуола и перемешивали с верхней мешалкой при 105C в течение 1 ч, затем охлаждали до температуры окружающей среды. Твердое вещество белого цвета собирали фильтрацией и промывали толуолом (200 мл), получая бензил[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]карбамат. К раствору полученного выше соединения (90,5 г, 0,360 моль) в 1,8 л метанола добавляли гидроксид палладия на углероде (9 г). Смесь подвергали действию 40 psi водорода при 25C в течение 15 ч,затем фильтровали через Solka Floc. Остаток после фильтрации промывали 3 метанолом (200 мл) и объединенные фильтраты концентрировали в вакууме, получая сырой (3S,4S)-3-аминотетрагидро-2H-пиран 4-ол, который дал протонные спектры ЯМР, совместимые с теорией. 6-Бром-3-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]бензо[h]хиназолин-4(3H)-он получали в соответствии с процедурой, описанной для синтеза 1-амино-4-бром-N-[(3R,4S)-3-гидрокситетрагидро 2H-пиран-4-ил]-2-нафтамида в примере 1, заменяя (3R,4S)-3-гидрокситетрагидро-2H-пиран-4-аминий хлорид (3S,4S)-3-аминотетрагидро-2H-пиран-4-олом. 4-Бромхинолин-2-карбоновую кислоту (A3) получали, как описано в примере 1. К раствору A3 (0,35 г, 1,4 ммоль) в 6,0 мл CH2Cl2 добавляли (3S,4S)-3-аминотетрагидро-2H-пиран 4-ол (0,20 г, 1,7 ммоль), реагент BOP (0,74 г, 1,7 ммоль) и триэтиламин (0,58 мл, 4,2 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч, разбавляли CH2Cl2, промывали водой, высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле с элюированием 25-100% этилацетата в гексанах, получая 4-бром-N-[(3S,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]хинолин-2-карбоксамид, который дал ионную масс-спектрометрию (ES+) 353,1 (81Br) для M+H+. Полученное выше соединение превращали в целевое соединение в соответствии с процедурой, описанной в примере 9, которое дало протонные спектры ЯМР, совместимые с теорией, и ионную массспектрометрию (ES+) 444,2038 для M+H+. 1H ЯМР (400 МГц, CDCl3)8,49 (д, J=2,19 Гц, 1H), 8,37 (д,J=7,5 Гц, 1H), 8,16 (с, 1H), 8,15 (д, J=6,0 Гц, 1H), 8,05 (дт, J=8,05 Гц, 1H), 7,88 (д, J=9,53 Гц, 2H), 7,79-7,75 В снабженную рубашкой колбу, оборудованную верхней мешалкой и термопарой, загружали 23,0 лMeOH и охлаждали до 5C. В колбу добавляли гидроксид калия (1,574 кг, 28,05 моль) и полученный раствор выдерживали до гомогенности и повторно охлаждали до 5C. Тетрагидро-4H-пиран-4-он (1,00 кг,10,0 моль) затем добавляли со стабильной скоростью за 20 мин и полученный раствор выдерживали в течение 20-30 мин. Раствор йода (2,778 кг, 10,95 моль) в 18,5 л MeOH затем добавляли через механический насос со стабильной скоростью за 90-100 мин. Еще через 30 мин раствор нагревали до температуры окружающей среды и добавляли толуол (42,0 л). Полученную суспензию концентрировали в вакууме до объема 8,4 л. Добавляли дополнительное количество толуола (8,4 л) и полученный раствор концентрировали до объема 8,4 л 2. Полученную суспензию затем фильтровали и остаток после фильтрации промывали 2 толуолом (4,0 л). Объединенные токи толуола концентрировали до 6 л и продукт экстрагировали 2 водой (3,0 л), получая 4,4-диметокситетрагидро-2H-пиран-3-ол. К раствору полученного выше соединения (1,00 кг, 6,17 моль) в 5 л воды добавляли уксусную кислоту до pH 5,2-5,4. Смесь разбавляли ацетонитрилом (4,0 л) и добавляли гидрат трихлорида рутения (6,4 г, 0,028 моль) и промывали дополнительным количеством ацетонитрила (1,0 л). Колбу помещали в водяную баню при температуре окружающей среды и раствор бромата натрия (650 г, 4,31 моль) в воде (1,95 л) добавляли медленно за 30 мин, поддерживая температуру ниже 30C. Через 2 ч последовательно добавляли бикарбонат калия (430 г, 4,30 моль), тиосульфат натрия (1,07 кг, 4,31 моль), хлорид калия (500 г,6,71 моль) и ацетонитрил (5 л). Слои разделяли и водный слой экстрагировали 3 ацетонитрилом (10 л). Объединенные органические экстракты концентрировали до 4 л. Затем добавляли толуол (5 л) и смесь повторно концентрировали до 4 л 4. Смесь разбавляли толуолом (7 л) и фильтровали, чтобы удалить твердые частицы. Остаток после фильтрации промывали 3 толуолом (2 л) и объединенные фильтрат и смывы концентрировали до полного объема 3 л, получая органический раствор 4,4-диметоксидигидро 2H-пиран-3(4H)-она. В 3-литровую 3-горлую колбу RB с верхней мешалкой, термопарой и нагревающей мантией добавляли дигидрофосфат натрия (96,0 г, 800 ммоль) в 1,6 л воды. Гидроксид натрия (29 мл, 50 вес.%) добавляли до pH 7,13 с последующим добавлением соляной кислоты (5 мл, 6 н.) до pH 7,02. Полученный выше органический раствор 4,4-диметоксидигидро-2 Н-пиран-3(4H)-она экстрагировали 3 буферизованной фосфатом водой (0,55 л). К объединенным водным экстрактам добавляли Dглюкозу (180 г, 100 ммоль) и раствор нагревали до 30C. Когда температура раствора превысила 27C после нагревания, добавляли В-НАДФ+ (1,60 г, 499 ммоль), GDH-103 (1,60 г, 499 ммоль) и KRED-130(1,60 г, 499 ммоль) и смесь перемешивали в течение 17 ч при 30C. Добавляли хлорид калия (200 г, 2,68 моль) и ацетонитрил (1,3 л). Через 30 мин реакционную смесь переносили в 6 л делительную воронку и добавляли дополнительные MeCN (0,67 л) и толуол (0,87 л). Водный слой снова экстрагировали 1 смесью ацетонитрила (1,95 л) и толуола (0,65 л) и 1 ацетонитрилом (1,5 л). Объединенные органические экстракты концентрировали в вакууме, получая (3S)-4,4-диметокситетрагидро-2H-пиран-3-ол. В 2-литровую колбу RB с верхней мешалкой, термопарой, нагревающей мантией и входом N2 добавляли раствор полученного выше соединения (72,0 г, 0,444 моль) в 750 мл THF. Через 15 ч третбутоксид натрия (48,3 г, 492 ммоль) добавляли одной порцией и смесь нагревали до 35C в течение 1 ч и выдерживали при 22C в течение 1 ч. Добавляли тетрабутиламмоний йодид (8,19 г, 22,2 ммоль) и бензилбромид (56,5 мл, 466 ммоль) и смесь нагревали до 50C в течение 2 ч. Раствор охлаждали до 25C и добавляли воду (750 мл) и MtBE (2,25 л). Органический слой отделяли от водного и концентрировали в вакууме. Полученное коричневое масло очищали хроматографией на силикагеле, элюируя 0-15% этилацетата в гексанах, получая (3S)-3-(бензилокси)-4,4-диметокситетрагидро-2H-пиран. К раствору полученного выше соединения (61,1 г, 225 ммоль) в 300 мл THF добавляли 2 н. HCl (300 мл, 0,600 моль). Через 1,5 ч насыщенный водный раствор карбоната калия (60 мл) добавляли через воронку для добавления до pH 7,4. Водный слой экстрагировали 3 MtBE (300 мл) и объединенные органические экстракты концентрировали в вакууме, получая сырой (3S)-3-(бензилокси)тетрагидро-4 Н-пиран 4-он. К раствору L-аланина (200 г, 2,24 моль), формиата натрия (76,0 г, 1,12 ммоль) и двуосновного фосфата натрия (28,7 г, 202 ммоль) в 2,25 л воды с pH 7,5 добавляли НАД (2,2 г, 3,21 ммоль), пиридоксаль-5 фосфат (2,2 г, 8,90 ммоль), LDH (0,45 г, 0,22 моль), FDH (4,5 г, 0,20 моль) и ТА P1G5 (4,5 г, 0,22 моль)[CDX ТА P1G5 = фермент группы Codex трансаминазы P1G5, который является коммерчески доступным
МПК / Метки
МПК: A61K 31/47, A01N 43/42
Метки: аллостерических, качестве, рецептора, хинолинамида, соединения, модуляторов, мускаринового, положительных
Код ссылки
<a href="https://eas.patents.su/30-22494-soedineniya-hinolinamida-v-kachestve-polozhitelnyh-allostericheskih-modulyatorov-muskarinovogo-receptora-m1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения хинолинамида в качестве положительных аллостерических модуляторов мускаринового рецептора m1</a>
Предыдущий патент: Способ конверсии пропана и бутана в ароматические углеводороды
Следующий патент: Технология удаления закиси азота из газового потока
Случайный патент: Композиция пропофола, включающая пентетат












