Новые производные циклогексиламина, обладающие агонистической активностью по отношению к β2 адренергическому рецептору и антагонистической активностью по отношению к m3 мускариновому рецептору
Номер патента: 22358
Опубликовано: 30.12.2015
Авторы: Аигуаде Бош Хосе, Пуиг-Дуран Карлос, Катурла Хавалойес Хуан Франсиско, Лумерас Амадор Венсеслао, Прат Киньонес Мария, Фонкерна Поу Сильвия
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемые соли или сольваты:
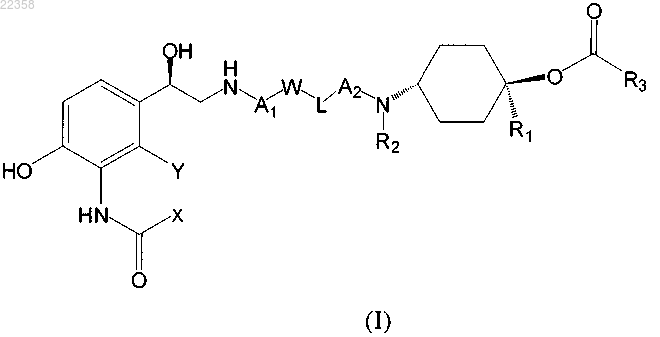
в которой X вместе с Y образуют группу -СН=СН- или -СН2-О-, где в случае -СН2-О- метиленовая группа связана с атомом углерода амидного заместителя, содержащего X, и атом кислорода связан с атомом углерода фенильного кольца, содержащего Y;
R1 и R2 независимо обозначают атом водорода или С1-С4-алкильную группу;
R3 обозначает группу формулы
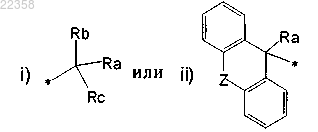
в которой Ra обозначает атом водорода, гидроксигруппу, гидроксиметильную группу или С1-С4-алкильную группу;
Rb и Rc независимо обозначают тиенильную группу, фенильную группу, бензильную группу или С4-С6-циклоалкильную группу;
Z обозначает атом кислорода;
* обозначает положение присоединения R3 к остальной части молекулы формулы (I);
А1 и А2 независимо обозначают C1-С6-алкиленовую группу, необязательно замещенную одной или более С1-С4-алкильных групп;
L обозначает непосредственную связь, группу -О-, -NH(CO)-, -(CO)NH- или -NH(CO)O-, где в случае
-NH(CO)O- атом азота связан с заместителем W и атом кислорода связан с заместителем А2; и
W обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или более заместителей, выбранных из группы, включающей атом галогена, С1-С4-алкильную группу, С1-С4-алкоксигруппу и цианогруппу.
2. Соединение по п.1, в котором X вместе с Y образует группу -СН=СН-.
3. Соединение по п.1 или 2, в котором R1 и R2 независимо обозначают атом водорода или метильную группу, предпочтительно R1 и R2, оба, обозначают атомы водорода.
4. Соединение по п.1 или 2, в котором R1 обозначает атом водорода и R2 обозначает метильную группу.
5. Соединение по любому из пп.1-4, в котором R3 обозначает группу формулы (ii), где Z обозначает атом кислорода и Ra выбран из атома водорода, гидроксигруппы и метильной группы.
6. Соединение по любому из пп.1-4, в котором R3 обозначает группу формулы (i), где Ra обозначает атом водорода, гидроксигруппу или метильную группу, предпочтительно Ra обозначает гидроксигруппу; Rb и Rc независимо обозначают тиенильную группу, циклопентильную группу или фенильную группу, предпочтительно Rb и Rc, оба, обозначают тиенильные группы.
7. Соединение по любому из предшествующих пунктов, в котором А1 и А2 независимо обозначают C1-С6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами.
8. Соединение по любому из предшествующих пунктов, в котором L обозначает группу -О-, -NH(CO)- или
-NH(CO)O-, где в случае -NH(CO)O- атом азота связан с заместителем W и атом кислорода связан с заместителем А2; предпочтительно L обозначает -О- или -NH(CO)-.
9. Соединение по любому из предшествующих пунктов, в котором W обозначает фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из группы, включающей атом хлора, метильную группу, метоксигруппу и цианогруппу, предпочтительно фениленовая группа содержит два заместителя, выбранных из группы, включающей атом хлора, метильную группу, метоксигруппу и цианогруппу.
10. Соединение по п.1, в котором
X вместе с Y образует группу -СН=СН- или -СН2-О-;
R1 обозначает атом водорода или метильную группу;
R2 обозначает атом водорода или метильную группу;
R3 обозначает группу формулы (i), где Ra обозначает гидроксигруппу и Rb и Rc независимо выбраны из фенильной группы, циклопентильной группы и тиенильной группы, или R3 обозначает группу формулы (ii), где Ra обозначает метильную группу и Z обозначает атом кислорода;
А1 и А2 независимо обозначают С1-С6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами;
L выбран из группы, включающей непосредственную связь, группы -О-, -NH(CO)- и -NH(CO)O-;
W обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из атома хлора, атома фтора, метоксигруппы и цианогруппы.
11. Соединение по п.10, в котором
X вместе с Y образует группу -СН=СН-;
R1 обозначает атом водорода;
R2 обозначает атом водорода или метильную группу;
R3 обозначает группу формулы (i), где Ra обозначает гидроксигруппу и Rb и Rc, оба, обозначают тиенильную группу;
A1 и А2 независимо обозначают C1-С6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами;
L выбран из непосредственной связи, группы -О-, -NH(CO)- и -NH(CO)O-;
W обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из атома хлора, метоксигруппы и цианогруппы.
12. Соединение по п.11, в котором R2 обозначает атом водорода, L выбран из группы -О-, -NH(CO)- и
-NH(CO)O- и W обозначает фениленовую группу, которая содержит два заместителя, выбранных из атома хлора, метильной группы, метоксигруппы и цианогруппы.
13. Соединение по п.11, в котором R2 обозначает метильную группу, L выбран из группы -О-, -NH(CO)- и
-NH(CO)O- и W обозначает фениленовую группу, которая содержит два заместителя, выбранных из атома хлора, метильной группы, метоксигруппы и цианогруппы.
14. Соединение по п.1, которым является одно из следующих соединений:
муравьиная кислота - транс-4-[(9-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}нонил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (2:1);
муравьиная кислота - транс-4-[{2-[4-(2-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}этил)фенокси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (1:1);
муравьиная кислота - транс-4-[{3-[4-(2-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}этил)фенокси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (1:1);
транс-4-[{2-[(6-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}гексил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-[{3-[(6-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}гексил)окси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
муравьиная кислота - транс-4-[{3-[4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенокси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (1:1);
транс-4-[{2-[4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенокси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-[{3-[4-(2-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}пропил)фенокси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-((3-(2-хлор-4-(((2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-5-метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-((3-(2-хлор-4-(((2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)фениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-[{3-[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенокси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид;
транс-4-[(3-{[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}-3-оксопропил)(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетат;
транс-4-[(3-{[4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[(4-{[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}-4-оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат;
транс-4-[(3-{[2-фтор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат;
транс-4-[(3-{[4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-3-метоксифенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[(3-{[2,5-дифтор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[(3-{[2-фтор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[(3-{[2-хлор-4-(2-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}этил)-5-метоксифенил]амино}-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[{3-[2-хлор-4-(2-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}этил)-5-метоксифенокси]пропил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[{2-[({[2-циано-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[{2-[({[2,5-дифтор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)фенил]амино}карбонил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[(3-{[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}-2,2-диметил-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат;
транс-4-[{4-[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенокси]бутил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2);
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гидрокси-2-(5-гидрокси-3-оксо-3,4-дигидро-2Н-1,4-бензоксазин-8-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат;
транс-4-[(9-{[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}нонил)(метил)амино]циклогексил-9-метил-9Н-ксантен-9-карбоксилат;
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексил-(2R)-циклопентил(гидрокси)фенилацетат;
транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексил-(2S)-циклопентил(гидрокси)-2-тиенилацетат,
или его фармацевтически приемлемые соли или сольваты.
15. Соединение по п.14, которое представляет собой транс-4-((3-(2-хлор-4-(((2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-5-метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид или его сольваты.
16. Соединение по п.14, которое представляет собой транс-4-[{2-[({[2-хлор-4-({[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]амино}метил)-5-метоксифенил]амино}карбонил)окси]этил}(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид или его сольваты.
17. Применение соединения по любому из пп.1-16 для приготовления лекарственного средства, предназначенного для лечения патологического состояния или заболевания, поддающегося улучшению вследствие воздействия одновременно агониста β2 адренергического рецептора и антагониста мускаринового рецептора, где состояние или заболевание выбрано из группы, включающей астму, хроническое обструктивное заболевание легких, преждевременные роды, глаукому, неврологические нарушения, нарушения сердечной деятельности, воспаление и желудочно-кишечные нарушения.
18. Применение по п.17, где патологическое состояние или заболевание выбрано из астмы и хронического обструктивного заболевания легких.
19. Фармацевтическая композиция, обладающая активностью одновременно агониста β2 адренергического рецептора и антагониста мускаринового рецептора, содержащая соединение по любому из пп.1-16 вместе с фармацевтически приемлемым разбавителем или носителем.
20. Способ лечения субъекта, страдающего от патологического состояния или заболевания, выбранного из группы, включающей заболевания легких, преждевременные роды, глаукому, неврологические нарушения, нарушения сердечной деятельности, воспаление и желудочно-кишечные нарушения, который включает введение указанному субъекту соединения по любому из пп.1-16 в эффективном количестве.
21. Способ по п.20, где патологическое состояние или заболевание, выбрано из астмы и хронического обструктивного заболевания легких.
Текст
НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСИЛАМИНА, ОБЛАДАЮЩИЕ АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К 2 АДРЕНЕРГИЧЕСКОМУ РЕЦЕПТОРУ И АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К M3 МУСКАРИНОВОМУ РЕЦЕПТОРУ Изобретение относится к новым соединениям формулы (I) Прат Кинонес Мария, Фонкерна Поу Сильвия, Пуиг Дуран Карлос,Лумерас Амадор Венсеслао, Аигуаде Бош Хосе, Катурла Хавалойес Хуан Франсиско (ES) Веселицкая И.А., Кузенкова Н.В.,Веселицкий М.Б., Каксис Р.А.,Белоусов Ю.В., Куликов А.В.,Кузнецова Е.В. (RU) обладающим двойной активностью: агонистической по отношению к 2 адренергическому рецептору и антагонистической по отношению к М 3 мускариновому рецептору, к фармацевтическим композициям, содержащим их, к способу их получения и их применению для лечения респираторных заболеваний. Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, обладающим двойной активностью: агонистической по отношению к 2 адренергическому рецептору и антагонистической по отношению к М 3 мускариновому рецептору. Настоящее изобретение также относится к содержащим их фармацевтическим композициям, к способу их получения и их применению для лечения респираторных заболеваний. Уровень техники Бронхорасширяющие средства играют очень важную роль в лечении респираторных нарушений,таких как ХОЗЛ и астма. Бета-адренергические агонисты и холинергические антагонисты являются общепринятыми бронхорасширяющими средствами и широко используются в клинической практике. Бетаадренергические агонисты, применяющиеся в настоящее время путем ингаляции, включают средства кратковременного действия, такие как салбутамол (четыре раза в сутки) или тербуталин (три раза в сутки), и средства длительного действия, такие как салметерол и формотерол (два раза в сутки). Эти средства обеспечивают расширение бронхов путем стимулирования адренергических рецепторов, находящихся в гладких мышцах дыхательных путей, обращая бронхосуживающее действие различных медиаторов, таких как ацетилхолин. Применяющиеся в настоящее время вдыхаемые мускариновые антагонисты включают обладающие кратковременным действием ипратропийбромид или окситропийбромид (четыре раза в сутки) и обладающие длительным действием тиотропий (один раз в сутки). Эти средства обеспечивают расширение бронхов путем уменьшения вагусного холинергического тонуса гладких мышц дыхательных путей. В дополнение к улучшению функции легких эти средства также улучшают качество жизни и ослабляют обострения. В клинической литературе имеется целый ряд исследований,убедительно показывающих, что введение комбинации бета-2 агониста и М 3 антагониста эффективнее для лечения ХОЗЛ, чем использование компонентов по отдельности (например, van Noord, J.A., et al.,Eur. Respir J., 26, 214-222). Фармацевтические композиции, содержащие комбинацию обоих типов бронхорасширяющих средств, также известны в данной области техники применительно к лечению респираторных заболеваний. В качестве примера в WO 2009/013244 раскрыта лечебная композиция, содержащая салметерол в качестве бета-адренергического агонистического средства и тиотропий в качестве антимускаринового средства. Одна молекула, обладающая двойной активностью по отношению к мускариновым М 3 и адренергическим 2 рецепторам (МАВА), желательна с точки зрения эффективности и уменьшения побочных эффектов при лечении ХОЗЛ. Она также предпочтительна с точки зрения приготовления препарат по сравнению с двухкомпонентной комбинацией. Ее также легче готовить вместе с другими терапевтическими средствами, такими как вдыхаемые противовоспалительные средства для проведения тройной терапии. Таким образом, необходимы новые соединения, одновременно обладающие агонистической активностью по отношению к 2 рецептору и антагонистической по отношению к мускариновому рецептору, которые применимы для лечения респираторных заболеваний, таких как астма и ХОЗЛ. Краткое изложение сущности изобретения Настоящее изобретение относится к новым соединениям, которые одновременно обладают агонистической активностью по отношению к 2 рецептору и антагонистической по отношению к мускариновому рецептору. В соответствии с этим настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемым солям или N-оксидам, или сольватам, или дейтерированным производным: в которой X и Y, оба, обозначают атом водорода илиX вместе с Y образуют группу -СН=СН-, -СН 2-О- или -S-, где в случае -СН 2-О- метиленовая группа связана с атомом углерода амидного заместителя, содержащего X, и атом кислорода связан с атомом углерода фенильного кольца, содержащего Y;R1 и R2 независимо обозначают атом водорода или С 1-С 4-алкильную группу; в которой Ra обозначает атом водорода, гидроксигруппу, гидроксиметильную группу или С 1-С 4-алкильную группу;Rb и Rc независимо обозначают тиенильную группу, фенильную группу, бензильную группу или С 4-С 6-циклоалкильную группу;Z обозначает непосредственную связь или атом кислорода иобозначает положение присоединения R3 к остальной части молекулы формулы (I);A1 и А 2 независимо обозначают С 1-С 6-алкиленовую группу, необязательно замещенную одной или более C1-С 4-алкильных групп;-NH(CO)O- атом азота связан с заместителем W и атом кислорода связан с заместителем А 2; иW обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или более заместителей, выбранных из группы, включающей атом галогена, C1-С 4-алкильную группу, C1-С 4-алкоксигруппу и цианогруппу. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение, предлагаемое в настоящем изобретении, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к комбинациям, включающим соединение, предлагаемое в настоящем изобретении, и одно или более других терапевтических средств, и к фармацевтическим композициям, включающим такие комбинации. Настоящее изобретение также относится к способу лечения заболевания или патологического состояния, связанного с двойной активностью 2 адренергического рецептора и мускаринового рецептора(например, заболевания легких, такого как астма или хроническое обструктивное заболевание легких,для задержки преждевременных родов, лечения глаукомы, неврологического нарушения, нарушения сердечной деятельности, воспаления, урологических нарушений, таких как недержание мочи, и желудочно-кишечных нарушений, таких как синдром раздраженной толстой кишки или спастический колит) у млекопитающего, включающему введение млекопитающему соединения, предлагаемого в настоящем изобретении, в терапевтически эффективном количестве. Настоящее изобретение также относится к способу лечения, включающему введение комбинации соединения, предлагаемого в настоящем изобретении, совместно с одним или более других терапевтических средств в терапевтически эффективном количестве. В других и особых вариантах осуществления настоящее изобретение также относится к способам синтеза и промежуточным продуктам, описанным в настоящем изобретении, которые применимы для получения соединений, предлагаемых в настоящем изобретении. Настоящее изобретение также относится к соединению, предлагаемому в настоящем изобретении,описанному в настоящем изобретении в качестве предназначенного для применения в терапии, а также к применению соединения, предлагаемого в настоящем изобретении, для приготовления препарата или лекарственного средства, предназначенного для лечения заболевания или патологического состояния,связанного с двойной активностью 2 адренергического рецептора и мускаринового рецептора (например, заболевания легких, такого как астма или хроническое обструктивное заболевание легких, для задержки преждевременных родов, лечения глаукомы, неврологического нарушения, нарушения сердечной деятельности, воспаления, урологических нарушений, таких как недержание мочи, и желудочнокишечных нарушений, таких как синдром раздраженной толстой кишки или спастический колит) у млекопитающего. Подробное описание изобретения При описании соединений, композиций и способов, предлагаемых в настоящем изобретении, приведенные ниже термины обладают указанными значениями, если не указано иное. При использовании в настоящем изобретении термин "C1-С 4-алкил" включает линейные или разветвленные радикалы, содержащие от 1 до 4 атомов углерода. Примеры включают метил, этил, н-пропил,изопропил, н-бутил, втор-бутил или трет-бутил. При использовании в настоящем изобретении термин "C1-С 6-алкилен" включает двухвалентные алкильные фрагменты, обычно содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Примеры C1-С 6-алкиленовых радикалов включают метиленовый, этиленовый, пропиленовый,бутиленовый, пентиленовый и гексиленовый радикалы. Указанная необязательно замещенная алкиленовая группа обычно является незамещенной или содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или разными. При использовании в настоящем изобретении термин "C1-C4-алкоксигруппа" (или алкилоксигруппа) включает необязательно замещенные линейные или разветвленные содержащие оксигруппу радика-2 022358 лы, каждый из которых включает алкильные фрагменты, содержащие от 1 до 4 атомов углерода. Примеры C1-С 4-алкоксильных радикалов включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Алкоксигруппа обычно является незамещенной или содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или разными. При использовании в настоящем изобретении термин "С 4-С 6-циклоалкильная группа" включает насыщенные моноциклические или полициклические карбоциклические радикалы, содержащие от 4 до 6 атомов углерода, предпочтительно от 4 до 5 атомов углерода. Примеры включают циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительными являются циклопропил, циклобутил и циклопентил. При использовании в настоящем изобретении термин "атом галогена" включает атомы хлора, фтора, брома и йода, обычно атом фтора, хлора или брома. Термин "галоген" при использовании в качестве префикса обладает такими же значениями. Термин "терапевтически эффективное количество" означает количество, достаточное для проведения лечения при введении пациенту, нуждающемуся в лечении. Термин "лечение" при использовании в настоящем изобретении означает лечение заболевания или патологического состояния у человека, которое включает:(а) предупреждение возникновения заболевания или патологического состояния, т.е. профилактическое лечение пациента;(b) облегчение протекания заболевания или патологического состояния, т.е. стимулирование регрессии заболевания или патологического состояния у пациента;(c) подавление заболевания или патологического состояния, т.е. замедление развития заболевания или патологического состояния у пациента; или(d) ослабление симптомов заболевания или патологического состояния у пациента. Выражение "заболевание или патологическое состояние, связанное с активностью 2 адренергического рецептора и мускаринового рецептора" включает все заболевания и/или патологические состояния,для которых известно в настоящее время или для которых в будущем будет установлено, что они связаны с активностью и 2 адренергического рецептора, и мускаринового рецептора. Такие патологические состояния включают, но не ограничиваются только ими, заболевания легких, такие как астма и хроническое обструктивное заболевание легких (включая хронический бронхит и эмфизему), а также неврологические нарушения и нарушения сердечной деятельности. Также известно, что активность 2 адренергического рецептора связана с преждевременными родами (см. патентную заявку WO 98/09632), глаукомой и некоторыми типами воспаления (см. патентную заявку WO 99/30703 и публикацию заявки на патент ЕР 1078629). С другой стороны, активность рецептора М 3 связана с нарушениями желудочно-кишечного тракта,такими как синдром раздраженной толстой кишки (СРК) (см., например, US 5397800), язвы желудочнокишечного тракта, спастический колит (см., например, US 4556653); с нарушениями мочевых путей, такими как недержание мочи (см., например, J. Med. Chem., 2005, 48, 6597-6606), поллакиурия; морская болезнь и вызванная блуждающим нервом синусовая брадикардия. Термин "фармацевтически приемлемая соль" означает соль, полученную из основания или кислоты,которая применима для введения пациенту, такому как млекопитающее. Такие соли можно получить из фармацевтически приемлемых неорганических или органических оснований и из фармацевтически приемлемых неорганических или органических кислот. Соли, полученные из фармацевтически приемлемых кислот, включают соли уксусной, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, этансульфоновой, муравьиной, фумаровой, глюконовой, глутаминовой, бромистоводородной, хлористо-водородной, фтористоводородной, молочной, малеиновой, яблочной, миндальной, метансульфоновой, слизевой, азотной, пантотеновой, фосфорной, янтарной, серной, винной, п-толуолсульфоновой, ксинафоевой (1-гидрокси-2-нафтойной), нападисиловой(1,5-нафталиндисульфоновая кислота) трифенилуксусной кислоты и т.п. Особенно предпочтительными являются соли, полученные из муравьиной, фумаровой, бромисто-водородной, хлористо-водородной,фтористо-водородной, уксусной, серной, метансульфоновой, ксинафоевой, винной, малеиновой, янтарной, нападисиловой кислоты. Соли, полученные из фармацевтически приемлемых неорганических оснований, включают соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II),калия, натрия, цинка и т.п. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и т.п., такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин,2-диэтиламиноэтанол,2-диметиламиноэтанол,этаноламин,этилендиамин,N-этилморфолин,N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин,-3 022358 триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Термин "сольват" означает комплекс или агрегат, образованный одной или более молекул растворенного вещества, т.е. соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли и одной или более молекул растворителя. Такие сольваты обычно являются кристаллическими твердыми веществами, обладающими в основном постоянным молярным соотношением растворенного вещества и растворителя. Типичные растворители включают, например, воду, метанол, этанол,изопропанол, уксусную кислоту и т.п. Если растворителем является вода, то образовавшийся сольват является гидратом. При использовании в настоящем изобретении термин "сольват" означает соединение, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, такого как вода, ацетон, этанол, метанол, дихлорметан, 2-пропанол и т.п., связанного с помощью нековалентных межмолекулярных сил. Если растворителем является вода, то вместо термина сольват используют термин "гидрат". При использовании в настоящем изобретении термин "дейтерированные" производные включает соединения, предлагаемые в настоящем изобретении, в которых в определенном положении по меньшей мере один атом водорода заменен на дейтерий. Дейтерий (D или 2 Н) является стабильным изотопом водорода, содержание которого в природе составляет 0,015 мол.%. Реакция обмена водорода на дейтерий (введение дейтерия) является химической реакцией, при которой связанный ковалентной связью атом водорода заменяется на атом дейтерия. Такая реакция обмена(введение) может протекать полностью или частично. Обычно дейтерированное производное соединения, предлагаемого в настоящем изобретении, обладает коэффициентом изотопного обогащения (отношение содержания изотопа к содержанию этого изотопа в природе, т.е. выраженное в процентах содержание дейтерия, введенного вместо водорода в определенное положение в молекуле) для каждого содержащегося атома дейтерия, находящегося в положении, обозначенном как возможное положение дейтерирования в соединении, равном не менее 3500 (содержание дейтерия равно 52,5%). В предпочтительном варианте осуществления коэффициент изотопного обогащения равен не менее 5000 (содержание дейтерия равно 75%). В более предпочтительном варианте осуществления коэффициент изотопного обогащения равен не менее 6333,3 (содержание дейтерия равно 95%). В наиболее предпочтительном варианте осуществления коэффициент изотопного обогащения равен не менее 6633,3 (содержание дейтерия равно 99,5% дейтерий). Следует понимать, что коэффициент изотопного обогащения для каждого содержащегося атома дейтерия, находящегося в положении, обозначенном как положение дейтерирования, не зависит от дейтерирования в других положениях. Коэффициент изотопного обогащения можно определить с использованием обычных аналитических методик, известных специалисту в данной области техники, включая масс-спектрометрию (МС) и ядерный магнитный резонанс (ЯМР). Термин "защитная группа аминогруппы" означает защитную группу, пригодную для исключения нежелательных реакций по аминному атому азота. Типичные защитные группы аминогруппы включают,но не ограничиваются только ими, формил; ацильные группы, например алканоильные группы, такие как ацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Вос); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Bn), тритил (Tr) и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (ТМС) и трет-бутилдиметилсилил (ТБС), и т.п. Термин "защитная группа гидроксигруппы" означает защитную группу, пригодную для исключения нежелательных реакций по гидроксигруппе. Типичные защитные группы гидроксигруппы включают, но не ограничиваются только ими, алкильные группы, такие как метил, этил и трет-бутил; ацильные группы, например алканоильные группы, такие как ацетил; арилметильные группы, такие как бензил (Bn),п-метоксибензил (ПМБ), 9-флуоренилметил (Fm), и дифенилметил (бензгидрил, ДФМ); силильные группы, такие как триметилсилил (ТМС) и трет-бутилдиметилсилил (ТБС), и т.п. Соединения, предлагаемые в настоящем изобретении, содержат по меньшей мере один хиральный центр. Если содержится более одного хирального центра, то в объем настоящего изобретения входят отдельные диастереоизомеры и смеси диастереоизомеров, в которых все диастереоизомеры могут содержаться в одинаковых количествах или которые могут быть обогащены одним или более диастереоизомеров. Обычно X вместе с Y образуют группу -СН=СН- или -СН 2-О-. Предпочтительно, если X вместе с Y образуют группу -СН=СН-. Обычно R1 и R2 независимо обозначают атом водорода или метильную группу; предпочтительно,если R1 обозначает водород и R2 обозначает метильную группу, R1 и R2, оба, обозначают метильные группы или R1 и R2, оба, обозначают атомы водорода. В особенно предпочтительном варианте осуществления R1 обозначает атом водорода и R2 обозначает метильную группу.-4 022358 Обычно R3 обозначает группу формулы ii), в которой Z обозначает атом кислорода и Ra выбран из группы, включающей атом водорода, гидроксигруппу и метильную группу. Обычно R3 обозначает группу формулы (i) в которойRa обозначает атом водорода, гидроксигруппу или метильную группу, предпочтительно, если Ra обозначает гидроксигруппу;Rb и Rc независимо обозначают тиенильную группу, циклопентильную группу или фенильную группу; предпочтительно тиенильную группу или фенильную группу и более предпочтительно Rb и Rc,оба, обозначают тиенильные группы. Обычно A1 и А 2 независимо обозначают C1-С 6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами. Обычно L выбран из группы, включающей группы -О-, -NH(CO)- и -NH(CO)O-, где в случае-NH(CO)O- атом азота связан с заместителем W и атом кислорода связан с заместителем А 2. Предпочтительно, если L выбран из группы, включающей группы -О- и -NH(CO)-. Для исключения сомнений отметим, что правая часть фрагментов, обозначенных в качестве возможных групп L, присоединена к А 2 и левая часть обозначенных фрагментов присоединена к W. Обычно W обозначает фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из группы, включающей атом хлора, метильную группу, метоксигруппу и цианогруппу, предпочтительно фениленовая группа содержит два заместителя, выбранных из атома хлора,метильной группы, метоксигруппы и цианогруппы. В одном варианте осуществления настоящего изобретения X вместе с Y образует группу -СН=СНили -СН 2-О-, R1 обозначает атом водорода или метильную группу, R2 обозначает атом водорода или метильную группу, R3 обозначает группу формулы (i), в которой Ra обозначает гидроксигруппу и Rb и Rc независимо выбраны из фенильной группы, циклопентильной группы и тиенильной группы, или R3 обозначает группу формулы (ii), в которой Ra обозначает метильную группу и Z обозначает атом кислорода,A1 и А 2 независимо обозначают C1-С 6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами, L выбран из непосредственной связи, группы -О-, -NH(CO)- и -NH(CO)O- иW обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из атома хлора, атома фтора, метоксигруппы и цианогруппы. Предпочтительно, если X вместе с Y образует группу -СН=СН-, R1 обозначает атом водорода, R2 обозначает атом водорода или метильную группу, R3 обозначает группу формулы (i), в которой Ra обозначает гидроксигруппу и Rb и Rc, оба, обозначают тиенильную группу, A1 и А 2 независимо обозначаютC1-С 6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами, L выбран из непосредственной связи, группы -О-, -NH(CO)- и -NH(CO)O-, и W обозначает непосредственную связь или фениленовую группу, которая необязательно содержит один или два заместителя, выбранных из атома хлора, метоксигруппы и цианогруппы. Более предпочтительно, если R2 обозначает атом водорода, L выбран из группы -О-, -NH(CO)- и -NH(CO)O- и W обозначает фениленовую группу, которая содержит два заместителя, выбранных из атома хлора, метила, метоксигруппы или цианогруппы. В предпочтительном варианте осуществления X вместе с Y образует группу -СН=СН-, R1 обозначает атом водорода, R2 обозначает метильную группу, R3 обозначает группу формулы (i), в которой Ra обозначает гидроксигруппу и Rb и Rc, оба, обозначают тиенильную группу, A1 и А 2 независимо обозначают С 1-С 6-алкиленовую группу, необязательно замещенную одной или двумя метильными группами, L выбран из группы -О-, -NH(CO)- и -NH(CO)O- и W обозначает фениленовую группу, которая содержит два заместителя, выбранных из атома хлора, метила, метоксигруппы или цианогруппы. Предпочтительные отдельные соединения, предлагаемые в настоящем изобретении, включают следующие соединения: муравьиная кислота - транс-4-[(9-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминононил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (2:1); муравьиная кислота транс-4-[2-[4-(2-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этил]аминоэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат (1:1); муравьиная кислота транс-4-[3-[4-(2-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этил]аминоэтил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат (1:1); транс-4-[2-[(6-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминогексил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид; транс-4-[3-[(6-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминогексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид; муравьиная кислота - транс-4-[3-[4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин 5-ил)этил]аминометил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (1:1); транс-4-[2-[4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофто-5 022358 циклопентил(гидрокси)фенилацетат и транс-4-[2-[([2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]аминокарбонил)окси]этил(метил)амино]циклогексил-(2S)циклопентил(гидрокси)-2-тиенилацетат. Особый интерес представляют соединения: муравьиная кислота - транс-4-[(9-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминононил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (2:1); муравьиная кислота транс-4-[3-[4-(2-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этил]аминоэтил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат (1:1); транс-4-[3-[(6-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминогексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид; муравьиная кислота - транс-4-[3-[4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин 5-ил)этил]аминометил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат (1:1); транс-4-3-(2-хлор-4-2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этиламино)метил)-5-метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2 тиенил)ацетат гидрофторид; транс-4-[3-[2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат гидрофторид; транс-4-[(3-[2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]амино-3-оксопропил)(метил)амино]-1 метилциклогексилгидрокси(ди-2-тиенил)ацетат; транс-4-[(4-[2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]амино-4-оксобутил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат; транс-4-[(3-[2-фтор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]амино-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат; транс-4-[(3-[2-хлор-4-(2-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминоэтил)-5-метоксифенил]амино-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат гидрофторид (1:2); транс-4-[3-[2-хлор-4-(2-[(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминоэтил)-5-метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2); транс-4-[2-[([2-циано-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]аминокарбонил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2); транс-4-[4-[2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенокси]бутил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат гидрофторид (1:2); транс-4-[2-[([2-хлор-4-([(2R)-2-гидрокси-2-(5-гидрокси-3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин 8-ил)этил]аминометил)-5-метоксифенил]аминокарбонил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат и транс-4-[2-[([2-хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]аминокарбонил)окси]этил(метил)амино]циклогексил-(2R)циклопентил(гидрокси)фенилацетат. В одном варианте осуществления настоящего изобретения фармацевтическая композиция дополнительно включает одно или более других терапевтических средств в терапевтически эффективном количестве, предпочтительно одно или более лекарственных средств, выбранных из группы, включающей кортикостероиды и ингибиторы PDE4. Вариантом осуществления настоящего изобретения также является фармацевтическая композиция,приготовленная для введения путем ингаляции. Соединения, предлагаемые в настоящем изобретении, определенные выше в настоящем изобретении, также можно объединять с одним или более других терапевтических средств, предпочтительно с одним или более лекарственных средств, выбранных из группы, включающей кортикостероиды и ингибиторы PDE4. Настоящее изобретение также относится к соединениям формулы (I), предназначенным для применения для лечения патологического состояния или заболевания, связанного одновременно с активностями 2 адренергического рецептора и мускаринового рецептора, такого как заболевание легких. В частности, заболеванием легких является астма или хроническое обструктивное заболевание легких. Соединения, предлагаемые в объеме настоящего изобретения, также можно применять для лечения заболевания или патологического состояния, выбранного из группы, включающей преждевременные роды, глаукому, неврологические нарушения, нарушения сердечной деятельности и воспаление, урологические нарушения, такие как недержание мочи, и желудочно-кишечные нарушения, такие как синдром раздраженной толстой кишки или спастический колит. Настоящее изобретение также относится к применению соединений формулы (I) для приготовления лекарственного средства, предназначенного для лечения заболевания или патологического состояния,связанного с активностью 2 адренергического рецептора или мускаринового рецептора или их обоих,такого как заболевание легких, предпочтительно астма или хроническое обструктивное заболевание легких, преждевременные роды, глаукомы, неврологических нарушений, заболеваний сердца, воспаления,урологических нарушений и желудочно-кишечных нарушений. Настоящее изобретение также относится к способу лечения этих заболеваний, который включает введение терапевтически эффективного количества фармацевтической композиции, содержащих двойные агонисты 2 адренергического рецептора и антагонисты мускаринового рецептора, предлагаемые в настоящем изобретении. Способ дополнительно включает введение терапевтически эффективного количества одного или большего количества других терапевтических средств, выбранных из группы, включающей кортикостероид и ингибитор PDE4. Настоящее изобретение также относится к способу модулирования активности 2 адренергического рецептора и/или рецептора М 3, способ включает стимулирование 2 адренергического рецептора и/или блокирование рецептора М 3 с помощью модулирующего количества соединений формулы (I). Общие методики синтеза Соединения, предлагаемые в настоящем изобретении, можно получить с использованием методик и процедур, описанных в настоящем изобретении, или с использованием аналогичных методик и процедур. Следует понимать, что если указаны типичные или предпочтительные условия осуществления способа (т.е. температура, продолжительность реакции, молярные соотношения реагентов, растворители,давление и т.п.), то, если не указано иное, можно использовать другие условия осуществления способа. Оптимальные условия проведения реакции могут меняться в зависимости от конкретных использующихся реагентов или растворителя, но такие условия специалист в данной области техники может установить с помощью стандартных методик оптимизации. Кроме того, как должно быть понятно специалистам в данной области техники, для защиты некоторых функциональных групп от вступления в нежелательные реакции может потребоваться использование обычных защитных групп. Выбор защитной группы, подходящей для конкретной функциональной группы, а также подходящих условий введения и удаления защитной группы хорошо известен в данной области техники. Например, многочисленные защитные группы и их введение и удаление описаны в публикации Т.W. Greene и G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, NewYork, 1999 и в цитированной в ней литературе. Способы получения соединений, предлагаемых в настоящем изобретении, являются другими вариантами осуществления настоящего изобретения и проиллюстрированы с помощью приведенных ниже методик. Один из самых подходящих путей получения соединений формулы (I) приведен на схеме 1. Схема 1 Соединения формулы (I) можно получить по реакции промежуточных продуктов формулы (II), в которой X1 обозначает отщепляющуюся группу, такую как атом галогена или активный сложный эфир,-8 022358 такой как мезилат или тозилат, с промежуточными продуктами формулы (III), в которой P1 и P3 независимо обозначают атом водорода или защитную группу кислорода, такую как силиловая или бензиловая простая эфирная группа и P2 обозначает атом водорода или защитную группу азота, такую как, например, бензильную группу. Эту реакцию лучше всего проводить в апротонном полярном растворителе,таком как ДМФ (диметилформамид), 1-метил-2-пирролидон или ДМСО (диметилсульфоксид), в диапазоне температур от комнатной температуры до 200C, в присутствии поглотителя кислоты, такого как гидрокарбонат натрия или третичный амин. Альтернативно, соединения формулы (I) можно получить по реакции промежуточных продуктов формулы (V) с промежуточными продуктами формулы (VI), в которой X1, P1 и Р 3 обладают такими же значениями, как указано выше, по той же методике синтеза, которая раскрыта выше; с последующим удалением любой защитной группы, содержащейся в промежуточном продукте, с получением соединения формулы (I). Такие реакции удаления защитных групп включают, например, реакцию десилилирования с использованием триэтиламинтригидрофторида, ТБАФ (тетрабутиламмоний фторид), хлорида водорода или других кислых реагентов в инертном растворителе, таком как ТГФ (тетрагидрофуран), в диапазоне температур от 0 до 50C. Удаление защитной группы также можно провести по реакции дебензилирования, например гидрированием соединения в присутствии катализатора, такого как палладий на древесном угле, в инертном растворителе, таком как этанол или ТГФ или смесь растворителей. Эту реакцию обычно проводят при давлении водорода, равном от 10 до 60 фунт-сила/дюйм 2, и в диапазоне температур от комнатной температуры до 50C. В другом альтернативном пути соединения формулы (I) также можно получить по реакции промежуточных продуктов формулы (IV), в которой A0 обозначает группу, которая вместе с вновь образовавшейся соседней метиленовой группой дает группу A1, где R0 обозначает водород или С 1-С 4-алкильную группу, с промежуточными продуктами формулы (III). Эту реакцию лучше всего проводить в растворителе или смеси растворителей, таких как ТГФ, метанол, дихлорметан или ДМСО, при температуре от 0 до 60C с использованием гидрида, такого как борогидрид натрия или триацетоксиборогидрида натрия в качестве восстановительного реагента. Промежуточные продукты формулы (II) можно получить из имеющихся в продаже исходных веществ и реагентов по хорошо известным методикам, как это показано на схеме 2. Схема 2 Промежуточные продукты формулы (II) можно получить из производных спирта формулы (VII) путем ацилирования сульфонилгалогенидами в присутствии поглотителя кислоты или галогенированием различными галогенирующими реагентами. Промежуточные продукты формулы (VII) можно получить прямым алкилированием амина формулы (VIII) соответствующим алкилирующим фрагментом (IXa), в котором Х 3 обозначает отщепляющуюся группу, такую как атом галогена или активный сложный эфир, такой как мезилат или тозилат, в присутствии поглотителя кислоты, такого как третичный амин. Альтернативно, промежуточные продукты формулы (II) можно прямо получить из промежуточных продуктов формулы (VIII) и промежуточных продуктов (IXb), в которых X1 и Х 3 являются такими, как указано выше. Сложноэфирные производные аминов формулы (VIII) можно получить путем удаления защитной группы из соединений формулы (X), в которой Р 4 обозначает защитную группу, например путем удаления трет-бутоксикарбонильной группы (BOC) в присутствии кислых сред, таких как хлорид водорода в ТГФ. Промежуточные продукты формулы (X) лучше всего получать по реакции переэтерификации с использованием в качестве исходных веществ известных из литературы производных аминоспиртов формулы (XII) и сложного метилового эфир формулы (XI), обычно в присутствии основания, такого как гидрид натрия, и путем смещения равновесия посредством отгонки растворителя, такого как толуол. Промежуточные продукты формулы (III) подробно описаны в литературе (см., например,US 2004242622, пример 6; WO 2008/149110, промежуточныйпродукт 65; US 2007249674, пример 3 В), и их можно получить по тем же методикам синтеза, которые описаны в этой литературе. Промежуточные продукты формулы (IV) можно получить путем окисления промежуточных продуктов формулы (XIII) окислительным реагентом, таким как диоксид марганца или реагент ДессаМартина, или прямым алкилированием промежуточного продукта формулы (VIII) алкилирующим реагентом формулы (XIV) в присутствии поглотителя кислоты. Соединения (IV) также можно получить путем гомологизации альдегидов (XVIII) по реакции с метоксиметилтрифенилфосфином в присутствии основания, такого как бис-(триметилсилил)амид лития, с последующим кислотным гидролизом промежуточного простого эфира енола или путем окисления винилпроизводных (XX), в свою очередь, полученных алкилированием (VIII) промежуточными продуктами (XIX). Это окисление можно провести с помощью множества различных реагентов, таких как тетраоксид осмия, в присутствии Промежуточные продукты формулы (V) можно получить из их защищенных по атому N гомологов(XV) с помощью специфической реакции удаления защитной группы, такой как обработкаN-BOC-производного кислыми средами, такими как хлорид водорода в ТГФ. Схема 4 Промежуточные продукты формулы (XV), в свою очередь, получают из промежуточных продуктов формулы (VIII) по методикам, хорошо известным в данной области техники, таким как методики алкилирования промежуточными продуктами формулы (XVI) в присутствии поглотителя кислоты, такого как третичный амин, или промежуточными продуктами формулы (XVII), в которой А 3 и еще 3 дополнительных атома углерода дают А 2. Примеры Общие положения. Имеющиеся в продаже реагенты, исходные вещества и растворители использовали в том виде, в котором они были приобретены. Концентрирование означает выпаривание в вакууме с использованием роторного испарителя Bchi. Продукты реакции при необходимости очищали с помощью флэшхроматографии на силикагеле (40-63 мкм) с использованием указанной системы растворителей или с помощью препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) (см. ниже описание двух использованных систем). Спектроскопические данные получали на спектрометре Varian Gemini 300. ВЭЖХ-МС (высокоэффективная жидкостная хроматография-масс-спектроскопия) проводили на приборе Gilson, снабженном поршневым насосом Gilson 321, вакуумным дегазирующим устройствомGilson 864, устройством для манипуляций с жидкостями Gilson 215, инжекционным блоком Gilson 189,Gilson Valvemate 7000, устройством деления проб 1/1000, подкачивающим насосом Gilson 307, детектором с диодной матрицей Gilson 170 и детектором Thermoquest Finnigan aQa. Система ВЭЖХ 1. Колонка С-18 с диоксидом кремния с обращенной фазой, выпускающаяся фирмой MERCK, смеси вода/ацетонитрил в качестве элюентов [забуференные с помощью 0,1% об./об. формиата аммония] в градиентном режиме от 0 до 100%. Система ВЭЖХ 2. Колонка С-18 с диоксидом кремния с обращенной фазой, выпускающаяся фирмой MERCK, смеси вода/ацетонитрил (без буфера) в качестве элюентов в градиентном режиме от 0 до 100%. Промежуточный продукт 1. трет-Бутил(транс-4-гидроксициклогексил)карбамат. К раствору (1R,4R)-4-аминоциклогексанола (15 г, 0,13 моль) в ацетонитриле (240 мл) порциями добавляли ди-трет-бутилдикарбонат (31,2 г, 0,14 моль). Смесь перемешивали в течение ночи при комнатной температуре. Полученный осадок промывали смесью гексан/этилацетат (3:1) и гексаном и получали искомое соединение в виде белого твердого вещества (83%). 1(br. s, 4 Н), 3,44 (br. s, 1 Н), 3,61 (br. s, 1H), 4,38 (br. s, 1H). Промежуточный продукт 2. транс-4-(Метиламино)циклогексанол. К смеси алюмогидрида лития (9 г, 0,23 моль) с тетрагидрофураном (425 мл) медленно добавляли трет-бутил(транс-4-гидроксициклогексил)карбамат (промежуточный продукт 1, 10 г, 0,046 моль). Смесь кипятили с обратным холодильником в течение ночи. После охлаждения смеси до комнатной температуры осторожно и последовательно по каплям добавляли 9 мл воды, 9 мл 4 н. раствора NaOH и 18 мл воды. Органический растворитель удаляли при пониженном давлении и полученное неочищенное вещество растворяли хлороформом и сушили над сульфатом магния. Фильтрат выпаривали досуха и выпаривали с гексаном и получали искомое соединение в виде белого твердого вещества (89%). Этот промежуточный продукт также описан в публикации JMC, 1987, 30(2), р. 313. 1H ЯМР (300 МГц, хлороформ-d)част./млн 1,04-1,20 (m, 2 Н), 1,25-1,40 (m, 2 Н), 1,97 (br. s, 4 Н),2,27-2,40 (m, 1H), 3,57-3,70 (m, 1 Н). Промежуточный продукт 3. трет-Бутил(транс-4-гидроксициклогексил)метилкарбамат. К раствору транс-4-(метиламино)циклогексанола (промежуточный продукт 2, 5,3 г, 0,04 моль) в ацетонитриле (92 мл) порциями добавляли ди-трет-бутилдикарбонат (9,9 г, 0,04 моль). Смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении и неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 75:1 до 4:1 и получали искомое соединение в виде бесцветного маслаChemica Scandinavica, 24 (1970), 1590-1596) в безводном толуоле (95 мл) сначала добавляли раствор третбутил(транс-4-гидроксициклогексил)метилкарбамата (промежуточный продукт 3; 6 г, 0,02 моль) в безводном толуоле (95 мл) и затем гидрид натрия (60%, 0,45 г, 0,01 моль). Через несколько минут смесь нагревали при 155C и растворитель отгоняли и одновременно заменяли. Эту процедуру проводили в течение 1,5 ч. Смесь охлаждали до комнатной температуры и разбавляли эфиром (300 мл). Органический слой промывали бикарбонатом натрия 4% (2200 мл) и рассолом, сушили, фильтровали и выпаривали при пониженном давлении и получали искомое соединение в виде желтого твердого вещества (69%),- 11022358 которое использовали на следующей стадии без дополнительной очистки. МСНР (масс-спектрометрия низкого разрешения) (m/z): 452 (М+1)+. Промежуточный продукт 5. транс-4-(Метиламино)циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-[(трет-бутоксикарбонил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 4; 8,1 г, 0,01 моль) в диоксане (13,5 мл) добавляли 4 М раствор хлорида водорода в диоксане (27 мл). Смесь перемешивали при комнатной температуре в течение 24 ч. Полученный осадок отфильтровывали и промывали эфиром. Неочищенное вещество растворяли в воде и добавляли карбонат калия до pH 8-9. Продукт экстрагировали этилацетатом и органический слой промывали рассолом, сушили и выпаривали досуха и получали искомое соединение в виде белого твердого вещества (78%). МСНР (m/z): 352 (М+1)+. 1H ЯМР (300 МГц, хлороформ-d)част./млн 1,14-1,30 (m, 2 Н), 1,42-1,57 (m, 2 Н), 1,88-2,11 (m, 4 Н),2,36-2,48 (m, 1 Н), 3,71 (s, 3 Н), 4,82-4,95 (m, 1 Н), 6,94-7,00 (m, 2 Н), 7,14-7,19 (m, 2 Н), 7,25-7,30 (m, 2 Н). Промежуточный продукт 6. транс-4-[(9-Бромнонил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат. транс-4-(Метиламино)циклогексилгидрокси(ди-2-тиенил)ацетат (промежуточный продукт 5, 0,5 г,0,001 моль), 1,9-дибромнонан (2,9 мл, 0,01 моль) и триэтиламин (0,44 мл, 0,003 моль) смешивали в атмосфере азота и перемешивали при 70C в течение 94 ч. Реакционную смесь выпаривали и очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 100 до 4:1) и получали искомое соединение в виде коричневого масла (55%). МСНР (m/z): 556, 558 (1Br) (М, М+2)+. Промежуточный продукт 7. транс-4-[(9-[(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8-гидрокси 2-оксо-1,2-дигидрохинолин-5-ил)этил]аминононил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат. Смесь транс-4-[(9-бромнонил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 6; 0,44 г, 0,79 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8 гидроксихинолин-2(1H)-она (получали в соответствии с синтезом 8 в US 20060035931) (0,26 г,0,79 ммоль) и бикарбоната натрия (0,08 г, 0,95 ммоль) в диметилацетамиде (9 мл) перемешивали в течение ночи при 60C. Органический растворитель удаляли при пониженном давлении и неочищенное вещество подвергали распределению между этилацетатом и водой. Органический слой промывали водой и рассолом, сушили, фильтровали и выпаривали и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 15:1 до 4:1) и получали искомое соединение в виде желтого масла (25%). МСНР (m/z): 811 (М+1)+. Пример 1. транс-4-[(9-([(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминононил)(метил)амино 1 циклогексилгидрокси(ди-2-тиенил)ацетат-формиат (2:1) К раствору транс-4-[(9-[(2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этил]аминононил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 7; 0,8 г, 0,13 ммоль) в тетрагидрофуране (5,1 мл) в атмосфере азота добавляли триэтиламинтригидрофторида (0,14 мл, 0,89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Неочищенную реакционную смесь разбавляли метиленхлоридом и органический слой промывали бикарбонатом натрия и рассолом, сушили, фильтровали и выпаривали. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 1) и получали искомое соединение в виде бесцветного твердого вещества (61%). МСНР (m/z): 696 (М+1)+. 1(15,6 мл, 1,3 моль) и карбонат калия (13 г, 0,09 моль). Смесь перемешивали при 80C в течение 48 ч. Соли отфильтровывали и смесь выпаривали. Полученное неочищенное вещество подвергали распределению в системе этилацетат/вода. Органический слой промывали гидроксидом натрия 2 н., водой и рассолом, сушили, фильтровали и растворитель удаляли при пониженном давлении и получали искомое со- 12022358 единение в виде белого твердого вещества (73%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 246 (М+1)+. Промежуточный продукт 9. транс-4-[2-[4-(2-Гидроксиэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного масла (57%) из транс-4-(метиламино)циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 5; 0,35 г, 0,001 моль), 2-[4-(2-бромэтокси)фенил]этанола (промежуточный продукт 8; 0,36 г, 0,0015 моль) и триэтиламина (0,27 мл, 0,002 моль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 75:1 до 25:1). МСНР (m/z): 516 (М+1)+. Промежуточный продукт 10. транс-4-Метил[2-(4-2-[(метилсульфонил)окси]этилфенокси)этил]аминоциклогексилгидрокси(ди-2-тиенил)ацетат. К смеси транс-4-[2-[4-(2-гидроксиэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 9; 0,22 г, 0,44 ммоль) в хлороформе (3 мл) и триэтиламина(0,09 мл, 0,66 ммоль) при 0C в течение 15 мин добавляли метансульфонилхлорид (0,03 мл, 0,5 ммоль),затем смесь перемешивали при комнатной температуре в течение 24 ч. Смесь разбавляли хлороформом и промывали 4% бикарбонатом натрия, водой и рассолом, сушили и фильтровали. Растворитель удаляли при пониженном давлении и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 50:1. Искомое соединение получали в виде желтого масла (70%). МСНР (m/z): 594 (M+1)+. Промежуточный продукт 11. транс-4-[2-[4-(2-[(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминоэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде коричневого масла (33%) из транс-4-метил[2-(4-2-[(метилсульфонил)окси]этилфенокси)этил]аминоциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 10; 0,16 г,0,27 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8-гидроксихинолин-2(1H)-она(0,03 г, 0,33 ммоль) по экспериментальной методике, описанной для промежуточного продукта 7, и полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 833 (M+1)+. Пример 2. транс-4-[2-[4-(2-[(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминоэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат-формиат Получали в виде белого твердого вещества (25%) из транс-4-[2-[4-(2-[(2R)-2-[третбутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминоэтил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 11, 0,25 г, 0,09 ммоль) и триэтиламинтригидрофторида (0,25 мл, 1,53 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 1).MCHP (m/z): 717 (M+1)+. Промежуточный продукт 12. транс-4-[3-[4-(2-Гидроксиэтил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного масла (41%) из 2-(4-(3-бромпропокси)фенил)этанол (получали в соответствии с промежуточным продуктом 26 в WO 2008/096127)(1,1 г, 0,004 моль), транс-4(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 1 г, 0,003 моль) и триэтиламина (0,78 мл, 0,005 моль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 15:1. МСНР (m/z): 530 (M+1)+.(0,1 мл, 0,001 моль) по экспериментальной методике, описанной для промежуточного продукта 10 (продолжительность реакции: 3 ч), затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 50:1 до 15:1).MCHP (m/z):608 (M+1)+. Промежуточный продукт 14. транс-4-[3-[4-(2-[(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этил]аминоэтил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат. Получали в виде коричневого масла (25%) из транс-4-метил[3-(4-2-[(метилсульфонил)окси]этилфенокси)пропил]аминоциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 13; 0,6 г,0,9 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8-гидроксихинолин-2(1H)-она(получали в соответствии с синтезом 8 в US 20060035931) (0,3 г, 0,9 ммоль) и бикарбоната натрия (0,1 г,1,2 ммоль) по экспериментальной методике, описанной для промежуточного продукта 7 (продолжительность реакции: 32 ч). Полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. Получали в виде белого твердого вещества (27%) из транс-4-[3-[4-(2-[(2R)-2-гидрокси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминоэтил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 14; 0,87 г, 0,25 ммоль) и триэтиламинтригидрофторида (0,84 мл, 5,19 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 1) и лиофилизировали.(7,18 мл, 0,02 моль) и тетрабутиламмонийбромида (0,23 г, 0,71 ммоль) по каплям добавляли гидроксид натрия (32% мас./об., 9,6 мл, 0,07 моль). Смесь энергично перемешивали в течение ночи при 70C. К смеси добавляли воду (200 мл) и неочищенное вещество экстрагировали гексаном (2100 мл), объединенные органические слои промывали водой, сушили, фильтровали и выпаривали досуха. Полученное неочищенное масло очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 50:1 до 5:1) и получали искомое соединение в виде бесцветного маслаMCHP (m/z):367 (M+l)+. Промежуточный продукт 16-2-[(6-[трет-Бутил(диметил)силил]оксигексил)окси]этанол. К раствору 13,13,14,14-тетраметил-1-фенил-2,5,12-триокса-13-силапентадекана (промежуточный продукт 15; 3,1 г, 0,008 моль) в метаноле (74 мл) добавляли палладий на древесном угле (10%, 0,3 г). Смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода (под давлением из баллона). Катализатор отфильтровывали и фильтрат выпаривали при пониженном давлении и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 9:1 до 4:1) и получали искомое соединение в виде бесцветного масла (77%). 1 Н ЯМР (300 МГц, хлороформ-d)част./млн 0,02 (s, 3H), 0,85 (s, 9 Н), 1,31 (ddd, J=7,35, 3,98, 3,78 Гц, 4 Н), 1,42-1,57 (m, 2 Н), 1,97 (t, J=6,18 Гц, 2 Н), 3,43 (t, J=6,59 Гц, 2 Н), 3,46-3,51 (m, 2 Н), 3,56 (t,- 14022358J=6,45 Гц, 2 Н), 3,68 (dt, J=5,84, 4,64 Гц, 2 Н). Промежуточный продукт 17. 2-[(6-[трет-Бутил(диметил)силил]оксигексил)окси]этилметансульфонат. Получали в виде бесцветного масла (92%) из 2-[(6-[трет-бутил(диметил)силил]оксигексил)окси]этанола (промежуточный продукт 16; 2 г, 0,007 моль), триэтиламина (3,52 мл, 0,02 моль) и метансульфонилхлорида (1,2 мл, 0,01 моль) по экспериментальной методике, описанной для промежуточного продукта 10, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 5:1 до 3:1). 1(промежуточный продукт 17; 0,45 г,1,28 ммоль),транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5, 0,3 г,0,85 ммоль) и триэтиламина (0,2 мл, 1,71 ммоль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 50/1 до 25/1).MCHP (m/z): 610 (M+1)+. Промежуточный продукт 19. транс-4-[2-[(6-Гидроксигексил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-[2-[(6-[трет-бутил(диметил)силил]оксигексил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 18; 0,1 г, 0,28 ммоль) в тетрагидрофуране (2,4 мл) добавляли хлористо-водородную кислоту (1 M, 1,13 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Смесь нейтрализовывали насыщенным раствором бикарбоната натрия и неочищенное вещество экстрагировали этилацетатом, сушили, фильтровали и выпаривали досуха. Искомое соединение получали в виде бесцветного масла (85%). МСНР (m/z): 496 (M+1)+. Промежуточный продукт 20. транс-4-Метил[2-(6-[(метилсульфонил)окси]гексилокси)этил]аминоциклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде масла(88%) из транс-4-[2-[(6-гидроксигексил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 19; 0,1 г,0,31 ммоль), триэтиламина (0,09 мл, 0,64 ммоль) и метансульфонилхлорида (0,042 мл, 0,54 ммоль) по экспериментальной методике, описанной для промежуточного продукта 10, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 50:1 до 25:1).(16%) из транс-4-метил[2-(6[(метилсульфонил)окси]гексилокси)этил]аминоциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 20; 0,16 г, 0,28 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8 гидроксихинолин-2(1H)-она (получали в соответствии с синтезом 8 в US 20060035931) (0,09 г,0,28 ммоль) и бикарбоната натрия (0,029 г, 0,35 ммоль) по экспериментальной методике, описанной для промежуточного продукта 7, полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. Получали в виде белого твердого вещества (39%) из транс-4-(12R)-12-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)-14,14,15,15-тетраметил-3,13-диокса-10-аза-14-силагексадец-1 ил](метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 20, 0,24 г,0,05 ммоль) и триэтиламинтригидрофторида (0,25 мл, 1,53 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и лиофилизировали.MCHP (m/z):699 (M+1)+. Промежуточный продукт 22. 14,14,15,15-Тетраметил-1-фенил-2,6,13-триокса-14-силагексадекан. Получали в виде бесцветного масла (67%) из 3-(бензилокси)пропан-1-ола (2 мл, 0,01 моль),(6-бромгексилокси)(трет-бутил)диметилсилан (7,1 мл, 0,02 моль), тетрабутиламмонийбромида (0,24 г,0,0007 моль) и гидроксида натрия (32% мас./об., 9,5 мл) по экспериментальной методике, описанной для промежуточного продукта 15, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат 10:1.MCHP (m/z): 381 (M+1)+. Промежуточный продукт 23. 3-[(6-[трет-Бутил(диметил)силил]оксигексил)окси]пропан-1-ол. Получали в виде бесцветного масла (95%) из 14,14,15,15-тетраметил-1-фенил-2,6,13-триокса-14 силагексадекана (промежуточный продукт 22; 3,3 г, 0,008 моль) и палладия на древесном угле (10%,0,3 г) по экспериментальной методике, описанной для промежуточного продукта 16, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат 7/1. 1(промежуточный продукт 23; 1 г, 0,003 моль), триэтиламина (1,7 мл, 0,01 ммоль) и метансульфонилхлорида (0,29 мл, 0,003 моль) по экспериментальной методике, описанной для промежуточного продукта 10,затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 100 до 50%). 1(m, 4 Н), 1,97 (br. s, 2 Н), 2,98 (s, 3 Н), 3,38 (br. s, 3 Н), 3,48 (br. s, 2H), 3,57 (br. s, 2H), 4,31 (br. s, 2H). Промежуточный продукт 25. транс-4-[3-[(6-[трет-Бутил(диметил)силил]оксигексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде коричневого масла (52%) из 3-[(6-[трет-бутил(диметил)силил]оксигексил)окси]пропилметансульфоната (промежуточный продукт 24; 0,74 г, 0,001 моль),транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5, 0,76 г,0,002 моль) и триэтиламина (0,6 мл, 0,004 моль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 20/1. МСНР (m/z): 624 (M+1)+. Промежуточный продукт 26. транс-4-[3-[(6-Гидроксигексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде коричневого твердого вещества (98%) из транс-4-[3-[(6-[третбутил(диметил)силил]оксигексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 25; 0,7 г, 0,001 моль) и хлористо-водородной кислоты (1 М, 4,3 мл) по экспериментальной методике, описанной для промежуточного продукта 19, полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки.(78%) из транс-4-[3-[(6 гидроксигексил)окси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 26; 0,57 г, 0,001 моль), триэтиламина (0,22 мл, 0,0012 ммоль) и метансульфонилхлорида (0,1 мл,0,001 моль) по экспериментальной методике, описанной для промежуточного продукта 10, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 20/1. МСНР (m/z): 588 (M+1)+. Промежуточный продукт 28. транс-4-(13R)-13-(8-Гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)15,15,16,16-тетраметил-4,14-диокса-11-аза-15-силагептадец-1-ил](метил)амино]циклогексилгидрокси(ди 2-тиенил)ацетат. Получали в виде коричневого масла(10%) из транс-4-метил[3-(6[(метилсульфонил)окси]гексилокси)пропил]аминоциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 27; 0,5 г, 0,83 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8 гидроксихинолин-2(1H)-она (получали в соответствии с синтезом 8 в US 20060035931) (0,27 г,0,83 ммоль) и бикарбоната натрия (0,09 г, 1,15 ммоль) по экспериментальной методике, описанной для промежуточного продукта 7, полученное неочищенное вещество использовали на следующей стадии без дополнительной обработки. МСНР (m/z): 827 (M+1)+. Получали в виде твердого вещества (16%) из транс-4-(13R)-13-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)-15,15,16,16-тетраметил-4,14-диокса-11-аза-15-силагептадец-1 ил](метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 28; 0,35 г,0,09 ммоль) и триэтиламинтригидрофторида (0,46 мл, 2,82 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2). МСНР (m/z): 712 (M+1)+. 1(br. s, 1H), 5,10 (br. s, 1H), 6,52 (d, J=9,89 Гц, 1H), 6,92 (d, J=8,24 Гц, 1H), 6,97 (dd, J=5,08, 3,71 Гц, 2H),7,07 (dd, J=3,57, 1,37 Гц, 2H), 7,07-7,10 (m, 1H), 7,46 (dd, J=5,08, 1,24 Гц, 2H), 8,17 (d, J=10,16 Гц, 1H). Промежуточный продукт 29. транс-4-3-(4-Формилфенокси)пропил](метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде желтого масла (66%) из 4-(3-бромпропокси)бензальдегида (получали в соответствии с примером 53 в WO 2008/096127) (0,25 г, 0,001 моль), транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 0,25 г, 0,0007 моль) и триэтиламина (0,19 мл, 0,001 моль) по экспериментальной методике, описанной для промежуточного продукта 6,затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 50/1. МСНР (m/z): 514 (M+1)+. Промежуточный продукт 30. транс-4-[3-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-3-(4-формилфенокси)пропил](метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 29; 25 мг, 0,05 ммоль) в тетрагидрофуране (0,7 мл) добавляли(2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этанаминийацетат (получали в соответствии с синтезом 8 в US 20060035931) (24 мг, 0,06 ммоль). Смесь перемешивали в атмосфере азота при 60C в течение 6 ч. Реакционную смесь охлаждали до 0C и триацетоксиборогидрида натрия (32 мг, 0,15 ммоль) добавляли. Смесь перемешивали при комнатной температуре в течение ночи. В сосуд с реакционной смесью добавляли 4% раствор бикарбоната натрия(2 мл) (pH 8) и неочищенное вещество экстрагировали этилацетатом. Органический слой промывали водой и рассолом, сушили, фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде масла (99%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 833 (M+1)+. Пример 6. транс-4-[3-[4-([(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат-формиат(промежуточный продукт 30; 0,21 г, 0,21 ммоль) и триэтиламинтригидрофторида (0,12 мл, 0,77 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 1).(6,6 г, 0,047 моль) и 1,2-дибромэтан (21 мл, 0,24 моль). Реакционную смесь перемешивали при 70C в течение 20 ч. Соли отфильтровывали и фильтрат концентрировали. Неочищенное вещество растворяли в этилацетате и органический слой промывали водой, гидроксидом натрия 2 н. и рассолом, сушили и фильтровали. Органический растворитель удаляли при пониженном давлении и получали искомое соединение в виде желто-оранжевого твердого вещества (88%), которое использовали на следующей стадии без дополнительной очистки.MCHP (m/z): 230 (M+1)+. Промежуточный продукт 32. транс-4-2-(4-Формилфенокси)этил](метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде твердого вещества (60%) из 4-(2-бромэтокси)бензальдегида (промежуточный продукт 31; 0,5 г, 0,002 моль), транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5, 0,5 г, 0,001 моль) и триэтиламина (0,39 мл, 0,002 моль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 50:1 до 25:1).MCHP (m/z):500 (M+1)+. Промежуточный продукт 33. транс-4-[2-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде желтого твердого вещества(0,37 г, 0,96 ммоль) и триацетоксиборогидрида натрия (0,5 г, 2,38 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30, полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 819 (M+1)+. Пример 7. транс-4-[2-[4-[(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетатгидрофторид. Получали в виде бледно-желтого твердого вещества (44%) из транс-4-[2-[4-([(2R)-2-[третбутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенокси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 33; 0,6 г, 0,71 ммоль) и триэтиламинтригидрофторида (0,36 мл, 2,22 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2). МСНР (m/z): 705 (M+l)+. 1H ЯМР (300 МГц, ДМСО-d6)част./млн 1,30-1,47 (m, 4 Н), 1,74 (br. s, 2 Н), 1,93 (br. s, 2 Н), 2,25 (s,3 Н), 2,42-2,48 (m, 4 Н), 2,76 (br. s, 4 Н), 3,84 (s, 1H), 3,98 (t, J=5,91 Гц, 2 Н), 4,71 (br. s, 1 Н), 5,17 (br. s, 1 Н),6,49 (d, J=9,89 Гц, 1H), 6,84-6,94 (m, 3H), 6,98 (dd, J=5,36, 3,98 Гц, 2 Н), 7,07 (br. s, 4 Н), 7,30 (d, J=8,24 Гц,2 Н), 7,47 (d, J=4,94 Гц, 1H), 8,12 (d, J=9,89 Гц, 1 Н). Промежуточный продукт 34. 1-[4-(3-Бромпропокси)фенил]ацетон. К раствору 1-(4-гидроксифенил)пропан-2-она (2,2 г, 0,01 моль) в диметилформамиде (10 мл) добавляли 1,3-дибромпропан (7,6 мл, 0,07 моль), карбонат калия (2,3 г, 0,01 моль) и йодид калия (0,7 г,0,004 моль). Смесь перемешивали при комнатной температуре в течение 72 ч. В сосуд с реакционной смесью добавляли воду и неочищенное вещество экстрагировали этилацетатом. Органический слой промывали водой и рассолом, сушили, фильтровали и выпаривали досуха. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 100 до 10%) и получали искомое соединение (54%). МСНР (m/z): 272 (M+1)+.(промежуточный продукт 5, 0,6 г, 0,002 моль) и триэтиламина (0,5 мл, 0,004 моль) по экспериментальной методике, описанной для промежуточного продукта 6, затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 25:1.MCHP (m/z): 542 (M+1)+. Промежуточный продукт 36. транс-4-[3-[4-(2-[(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминопропил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде желтого вспененного вещества (57%) из транс-4-(метил 3-[4-(2 оксопропил)фенокси]пропиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 35; 0,4 г, 0,72 ммоль), (2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этанаминийацетата (получали в соответствии с синтезом 8 в US 20060035931)(0,34 г, 0,87 ммоль) и триацетоксиборогидрида натрия (0,4 г, 1,84 моль) по экспериментальной методике,описанной для промежуточного продукта 30, полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 861 (M+1)+. Пример 8. транс-4-[3-[4-(2-[(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминопропил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетатгидрофторид. Получали в виде желтого вспененного вещества (50%) из транс-4-[3-[4-(2-[(2R)-2-[третбутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминопропил)фенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 36; 0,37 г, 0,0002 моль) и триэтиламинтригидрофторида (1 мл, 0,01 моль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и лиофилизировали. МСНР (m/z): 746 (M+1)+. 1 Н ЯМР (300 МГц, ДМСО-d6)част./млн 0,96 (br. s, 4 Н), 1,36 (br. s, 3 Н), 1,61-1,97 (m, 5 Н), 2,18 (br.(br. s, 1H). Промежуточный продукт 37. Этил-4-амино-5-хлор-2-метоксибензоат. Раствор 4-амино-5-хлор-2-метоксибензойной кислоты (6,6 г, 0,031 моль) в растворе хлорида водорода 1,25 М в этаноле (250 мл, 0,31 моль) перемешивали в сосуде высокого давления в течение 6 ч при 65C. Реакционную смесь подщелачивали гидроксидом натрия 2 н. и экстрагировали метиленхлоридом. Органический слой промывали водой, сушили и фильтровали. Растворитель удаляли при пониженном давлении и получали искомое соединение в виде белого твердого вещества (78%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 230 (M+1)+. Промежуточный продукт 38. (4-Амино-5-хлор-2-метоксифенил)метанол. К раствору алюмогидрида лития (0,96 г, 0,025 моль) в тетрагидрофуране (100 мл) при комнатной температуре по каплям добавляли раствор этил-4-амино-5-хлор-2-метоксибензоата (промежуточный продукт 37; 4,4 г, 0,019 моль) в тетрагидрофуране (25 мл). Затем смесь кипятили с обратным холодильником в течение 2 ч. Избыток гидрида разлагали путем последовательного добавления 1 мл воды, 1 мл 4 н. раствора NaOH и 2 мл воды, фильтровали через целит и промывали этилацетатом. Органический растворитель упаривали и добавляли гексан. Смесь охлаждали при 0C в течение 1 ч и затем осадок отфильтровывали и промывали гексаном. Искомое соединение получали в виде бледно-желтого твердого вещества (80%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 188 (M+1)+. Промежуточный продукт 39. 4-([трет-Бутил(диметил)силил]оксиметил)-2-хлор-5-метоксианилин. К раствору (4-амино-5-хлор-2-метоксифенил)метанола (промежуточный продукт 38; 1,5 г,0,008 моль) в диметилформамиде (35 мл) добавляли имидазол (1,7 г, 0,02 моль). Смесь охлаждали до 0C и по каплям добавляли хлор(изопропил)диметилсилан (2,5 г, 0,01 моль). Реакционную смесь перемеши- 19022358 вали в течение ночи при комнатной температуре. Растворитель удаляли и неочищенное вещество подвергали распределению между водой и гексаном, органический слой промывали водой, 4% раствором бикарбоната натрия и рассолом, сушили, фильтровали и выпаривали досуха. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (от 8/1 до 4/1). Искомое соединение получали в виде желтого твердого вещества (58%). МСНР (m/z): 302 (M+l)+. Промежуточный продукт 40.N-[4-([трет-Бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]акриламид. К раствору 4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5-метоксианилина (промежуточный продукт 39; 0,2 г, 0,68 ммоль) в метиленхлориде (2 мл) и диэтилизопропиламина (0,17 мл, 1,02 ммоль) по каплям добавляли раствор акрилоилхлорида (0,07 мл, 0,91 ммоль) в метиленхлориде (1 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли метиленхлоридом и промывали 4% раствором бикарбоната натрия и водой, растворитель удаляли при пониженном давлении и получали искомое соединение в виде твердого вещества (94%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 356 (M+1)+. Промежуточный продукт 41. транс-4-3-(4-трет-Бутил(диметил)силилокси)метил)-2-хлор-5 метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Смесь N-[4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5-метоксифенил]акриламида (промежуточный продукт 40; 0,9 г, 0,002 моль) и транс-4-(метиламино)циклогексилгидрокси(ди-2 тиенил)ацетата (промежуточный продукт 5; 0,7 г, 0,002 моль) в метиленхлориде (20 мл) перемешивали при 75C в закрытом сосуде в течение 64 ч. Растворитель выпаривали и полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (от 50/1 до 25/1) и получали искомое соединение в виде белесовато-желтого твердого вещества (49%). МСНР (m/z): 707 (М+1)+. Промежуточный продукт 42. транс-4-3-(2-Хлор-4-(гидроксиметил)-5-метоксифениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-3-(4-трет-бутил(диметил)силилокси)метил)-2-хлор-5-метоксифениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 41; 0,76 мг, 1,08 ммоль) в тетрагидрофуране (19 мл) добавляли 1 М хлористо-водородную кислоту (3,25 мл,3,25 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь нейтрализовывали насыщенным раствором бикарбоната натрия и экстрагировали этилацетатом. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол 50/1 и получали искомое соединение в виде масла (84%). МСНР (m/z): 593 (M+1)+. Промежуточный продукт 43. транс-4-3-(2-Хлор-4-формил-5-метоксифениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-3-(2-хлор-4-(гидроксиметил)-5-метоксифениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 42; 0,4 г,0,68 ммоль) в хлороформе (8,1 мл) порциями добавляли оксид марганца(IV) (0,62 мг, 7,2 ммоль). Гетерогенную смесь перемешивали при 45C в течение 3 ч. Смесь фильтровали и растворитель удаляли при пониженном давлении и получали искомое соединение в виде желтого твердого вещества (88%), которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 592 (M+1)+. Промежуточный продукт 44. транс-4-3-(4-R)-2-(трет-Бутилдиметилсилилокси)-2-(8-гидрокси-2 оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-2-хлор-5-метоксифениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бледно-желтого твердого вещества (84%) из транс-4-3-(2-хлор-4-формил-5 метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 43; 0,5 г, 0,87 ммоль), (2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо 1,2-дигидрохинолин-5-ил)этанаминийацетата (получали в соответствии с синтезом 8 в US 20060035931)(0,5 г, 1,3 ммоль) и триацетоксиборогидрида натрия (0,66 г, 3,15 ммоль) по экспериментальной методике,описанной для промежуточного продукта 30, полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 910 (M+1)+. Получали в виде белого твердого вещества (19%) из транс-4-3-(4-R)-2-(третбутилдиметилсилилокси)-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-2-хлор-5 метоксифениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 44; 0,89 г, 0,74 ммоль) и триэтиламинтригидрофторида (0,48 мл, 2,98 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и лиофилизировали. МСНР (m/z): 796 (M+1)+. 1H ЯМР (300 МГц, ДМСО-d6)част./млн 1,42 (br. s, 4 Н), 1,76 (br. s, 2 Н), 1,94 (br. s, 2 Н), 2,27 (s, 3 Н),2,45-2,50 (m, 1 Н), 2,59 (br. s, 2 Н), 2,72 (br. s, 4 Н), 3,64-3,76 (m, 5 Н), 4,69 (br. s, 1 Н), 5,06 (br. s, 1 Н), 6,48 (d,J=9,89 Гц, 1H), 6,87 -6,94 (m, 2 Н), 6,97 (dd, J=5,08, 3,71 Гц, 2 Н), 7,07 (dd, J=3,71, 1,24 Гц, 2 Н), 7,33 (s, 1 Н),7,47 (dd, J=5,08, 1,24 Гц, 2 Н), 7,79 (s, 1 Н), 8,12 (d, J=9,89 Гц, 1 Н), 10,67 (s, 1 Н). Промежуточный продукт 45-(4-Амино-3-хлорфенил)метанол. Получали в виде светло-коричневого твердого вещества (76%) с использованием в качестве исходных веществ имеющегося в продаже метил-4-амино-3-хлорбензоата (4 г; 0,021 моль) и алюмогидрида лития (1,09 г; 0,028 моль) в 144 мл тетрагидрофурана по экспериментальной методике, описанной для промежуточного продукта 38.(4-амино-3-хлорфенил)метанола (промежуточный продукт 45; 2,72 г, 0,016 моль), 4,94 г (0,033 ммоль) хлор(трет-бутил)диметилсилана и 3,35 г (0,049 моль) имидазола в 68 мл ДМФ и по экспериментальной методике, описанной для промежуточного продукта 39. МСНР (m/z): 272 (M+1)+. Промежуточный продукт 47.N-[4-([трет-Бутил(диметил)силил]оксиметил)-2 хлорфенил]акриламид. Получали в виде белого кристаллического твердого вещества (77%) с использованием в качестве исходных веществ 4-([трет-бутил(диметил)силил]оксиметил)-2-хлоранилина (промежуточный продукт 46; 2 г; 7,36 ммоль), акрилоилхлорида (0,78 мл; 9,56 ммоль) и диэтилизопропиламина (1,92 мл, 11,04 ммоль) по экспериментальной методике, описанной для промежуточного продукта 40. МСНР (m/z): 326 (M+1)+. Промежуточный продукт 48. транс-4-3-(4-трет-Бутил(диметил)силилокси)метил)-2 хлорфениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бежевого твердого вещества (45%) с использованием в качестве исходных веществN-[4-([трет-бутил(диметил)силил]оксиметил)-2-хлорфенил]акриламида (промежуточный продукт 47; 0,56 г, 1,73 ммоль) и транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 0,5 г, 1,42 ммоль) в 14 мл дихлорметана и по экспериментальной методике, описанной для промежуточного продукта 41. МСНР (m/z): 677 (M+1)+. Промежуточный продукт 49. транс-4-3-(2-хлор-4-(Гидроксиметил)фениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бежевого вспененного вещества (91%) с использованием в качестве исходных веществ транс-4-3-(4-трет-бутил(диметил)силилокси)метил)-2-хлорфениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 48; 433 мг, 0,64 ммоль) и 1 М хлористо-водородной кислоты (1,9 мл; 1,9 ммоль) в тетрагидрофуране (12 мл) по экспериментальной методике, описанной для промежуточного продукта 42.MCHP (m/z):563 (M+1)+. Промежуточный продукт 50. транс-4-3-(2-хлор-4-Формилфениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде светло-коричневого масла (94%) с использованием в качестве исходных веществ транс-4-3-(2-хлор-4-(гидроксиметил)фениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 49; 0,06 г, 0,11 ммоль) и оксида марганца(IV) (0,098 мг, 1,13 ммоль) в хлороформе (1,4 мл) по эксперимен- 21022358 тальной методике, описанной для промежуточного продукта 43. МСНР (m/z): 561 (M+1)+. Промежуточный продукт 51. транс-4-3-(4-R)-2-(трет-Бутилдиметилсилилокси)-2-(8-гидрокси-2 оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-2-хлорфениламино)-3 оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде белого твердого вещества (65%) с использованием в качестве исходных веществ транс-4-3-(2-хлор-4-формилфениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2 тиенил)ацетата(77 мг, 0,35 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (от CHCl3 до CHCl3/MeOH 95:5). МСНР (m/z): 879 (M+1)+. Пример 10. транс-4-3-(2-Хлор-4-2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этиламино)метил)фениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2 тиенил)ацетат гидрофторид Получали в виде почти белого твердого вещества (20%) из транс-4-3-(4-R)-2-(третбутилдиметилсилилокси)-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино)метил)-2 хлорфениламино)-3-оксопропил)(метил)амино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 50; 55 мг, 0,06 ммоль) и триэтиламинтригидрофторида (0,04 мл, 0,25 ммоль) в 3 мл ТГФ по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и лиофилизировали. МСНР (m/z): 765 (M+1)+. 1 Н ЯМР (300 МГц, ДМСО-d6)част./млн 1,42 (br. s, 4 Н), 1,80 (br. s, 2 Н), 1,94 (br. s, 2 Н), 2,27 (s, 3 Н),2,45-2,50 (m, 1 Н), 2,59 (br. s, 2 Н), 2,76 (br. s, 4 Н), 3,64-3,76 (m, 2 Н), 4,69 (br. s, 1H), 5,31 (br. s, 1 Н), 6,54 (d,J=9,89 Гц, 1 Н), 6,92-6,97 (m, 2 Н), 6,98-7,12 (m, 5 Н), 7,25 (s, 1 Н), 7,44 (dd, J=5,08, 1,24 Гц, 2 Н), 7,65 (s, 1 Н),9,08 (br. s, 1H), 10,47 (s, 1H). Промежуточный продукт 52. 5-Хлор-4-гидрокси-2-метоксибензойная кислота. К суспензии 4-амино-5-хлор-2-метоксибензойной кислоты (25 г; 0,12 моль) в 125 мл воды добавляли тетрафторборную кислоту (40,5 мл 48% водного раствора). Затем белый осадок на фильтре охлаждали до 0C и по каплям добавляли NaNO2 (9,41 г в 75 мл H2O) и смесь перемешивали при этой температуре в течение 30 мин. Белый осадок собирали фильтрованием. Соль диазония суспендировали в ледяной АсОН(1250 мл) и полученную суспензию перемешивали при 100C в течение 1 ч (она превращалась в коричневый раствор). Ее выдерживали при КТ в течение еще 2 ч. Растворитель удаляли при пониженном давлении и коричневый маслообразный остаток суспендировали в рассоле (1250 мл) и экстрагировали с помощью EtOAc (3400 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении и получали коричневое масло. Очистка с помощью препаративной ВЭЖХ с обращенной фазой (от Et2O/EtOH 0/100 до 40/60) давала 3,0 г (13%) красного твердого вещества. МСНР (m/z): 203 (M+1)+. Промежуточный продукт 53. Метил-5-хлор-4-гидрокси-2-метоксибензоат. К раствору 5-хлор-4-гидрокси-2-метоксибензойной кислоты (промежуточный продукт 52; 4,17 г; 13,69 ммоль) в 123 мл безводного метанола добавляли 2,2 мл ацетилхлорида. Раствор перемешивали при 60C в атмосфере азота в течение 18 ч. Раствор выпаривали при пониженном давлении, остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (Cl2CH2/EtOAc от 100/0 до 80/20) и получали 2,2 г (75%) красного твердого вещества.MCHP (m/z):217 (M+1)+. Промежуточный продукт 54. 2-Хлор-4-(гидроксиметил)-5-метоксифенол. Раствор метил-5-хлор-4-гидрокси-2-метоксибензоата (промежуточный продукт 53; 204 мг; 0,94 ммоль) в 4,6 мл безводного ТГФ перемешивали при наружном охлаждении в бане из воды со льдом. По каплям добавляли раствор 1 М LiAlH4 в ТГФ (1,9 мл; 1,9 ммоль). Через 5 мин наружную баню удаляли и перемешивание продолжали в течение еще 3 ч. при наружном охлаждении добавляли 0,072 мл воды,затем 0,072 мл 4 н. раствора NaOH и еще 0,144 мл воды. После фильтрования осадок на фильтре тщательно промывали с помощью ТГФ и фильтраты концентрировали и получали искомое соединение (выход: 34%).- 22022358 МСНР (m/z): 189 (M+1)+. Промежуточный продукт 55. [4-(3-Бромпропокси)-5-хлор-2-метоксифенил]метанол. Смесь 2-хлор-4-(гидроксиметил)-5-метоксифенола (промежуточный продукт 54; 0,5 г, 2,61 ммоль),1,3-дибромпропана (1,61 мл; 15,71 ммоль) и карбоната калия (737 мг; 5,23 ммоль) в 12 мл ацетона нагревали при 75C в герметичном сосуде и перемешивали в течение 16 ч. Твердые вещества отфильтровывали и промывали ацетоном и объединенные фильтраты концентрировали досуха, очищали с помощью препаративной ВЭЖХ с обращенной фазой (гексан/EtOAc от 0 до 40%) и получали искомое соединение(80%) в виде светло-желтого масла. МСНР (m/z): 309 (M+1)+. Промежуточный продукт 56. транс-4-[3-[2-Хлор-4-(гидроксиметил)-5 метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Смесь [4-(3-бромпропокси)-5-хлор-2-метоксифенил]метанола (промежуточный продукт 55; 386 мг; 1,25 ммоль), транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 438 мг, 1,25 ммоль) и триэтиламина 0,345 мл; 2,49 ммоль) в 12 мл ацетонитрила и 8,7 мл ТГФ перемешивали при 70C в течение 16 ч. Добавляли дополнительное количество промежуточного продукта 5(219 мг; 0,62% ммоль) и нагревание продолжали в течение 24 ч. Растворитель выпаривали в вакууме и остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (гексан/EtOAc от 0 до 40%) и получали искомое соединение (80%) в виде светло-желтого масла. МСНР (m/z): 309 (M+1)+. Промежуточный продукт 57. транс-4-3-(2-Хлор-4-формил-5 метоксифенокси)пропил](метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат Смесь транс-4-[3-[2-хлор-4-(гидроксиметил)-5-метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 56; 418 мг, 0,70 ммоль) и оксида марганца(IV) (755 мг; 7,38 ммоль) в 9 мл хлороформа перемешивали при 45C в течение 3 ч. Твердые вещества отфильтровывали и промывали хлороформом, фильтрат концентрировали досуха и получали искомое соединение в виде бесцветного масла (97%). МСНР (m/z): 307 (M+1)+. Промежуточный продукт 58. транс-4-[3-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)-2-хлор-5 метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного масла(346 мг, 0,88 ммоль) и триацетоксиборогидрида натрия (557 мг, 2,50 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (от CHCl3 до CHCl3/MeOH 95:5). МСНР (m/z): 896 (M+1)+. Пример 11. транс-4-[3-[2-Хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат гидрофторид. Получали в виде почти белого твердого вещества (72%) из транс-4-[3-[4-([(2R)-2-[третбутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)-2-хлор 5-метоксифенокси]пропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата(промежуточный продукт 58; 59 мг, 0,06 ммоль) и триэтиламинтригидрофторида (0,04 мл, 0,28 ммоль) в 3 мл ТГФ по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и лиофилизировали. МСНР (m/z): 782 (M+1)+. 1 Промежуточный продукт 59. трет-Бутил[(5-хлор-4-изоцианато-2 метоксибензил)окси]диметилсилан. Раствор 4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5-метоксианилина (промежуточный продукт 39; 300 мг, 1 ммоль) в 4 мл дихлорметана охлаждали снаружи в бане со льдом и в это время по каплям добавляли раствор трифосгена (108 мг; 0,36 ммоль) в 5 мл дихлорметана. Медленно добавляли триэтиламин (0,28 мл; 2,01 ммоль) и систему перемешивали при комнатной температуре в течение 3 ч. Затем половину растворителя выпаривали в вакууме и добавляли 25 мл пентана. Белый осадок мочевин отфильтровывали, фильтрат выпаривали досуха и получали 311 мг искомого соединения, которое использовали без дополнительной очистки на следующей стадии. Промежуточный продукт 60 транс-4-[(2-Гидроксиэтил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат. Смесь транс-4-(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 300 мг; 0,85 ммоль), 2-бромэтанола (0,145 мл; 2,05 ммоль) и триэтиламина (0,36 мл; 2,58 ммоль) в 4,5 мл ацетонитрила и 3,5 мл ТГФ перемешивали при 80C в герметичном сосуде в течение 16 ч. Добавляли дополнительные количества бромэтанола (0,145 мл; 2,05 ммоль), триэтиламина (0,36 мл; 2,58 ммоль),ацетонитрила (3,5 мл) и ТГФ (3,5 мл) и перемешивание и нагревание продолжали в течение еще 24 ч. Раствор выпаривали досуха, растворяли в дихлорметане, промывали рассолом, сушили и концентрировали. Очистка с помощью препаративной ВЭЖХ с обращенной фазой (Cl3CH/MeOH от 1:0 до 9:1) давала 76% искомого продукта в виде бесцветного масла. МСНР (m/z): 396 (M+1)+. Промежуточный продукт 61. транс-4-[2-[([4-([трет-Бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]аминокарбонил)окси]этил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Раствор транс-4-[(2-гидроксиэтил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 60; 290,6 мг; 0,73 ммоль) в 5 мл ТГФ при перемешивании при комнатной температуре по каплям добавляли к раствору трет-бутил[(5-хлор-4-изоцианато-2 метоксибензил)окси]диметилсилана (промежуточный продукт 59; 311 мг; 0,87 ммоль) в 5 мл ТГФ. Добавляли триэтиламин (0,228 мл; 1,31 ммоль) и перемешивание продолжали в течение 16 ч при 60C и в течение еще 4 ч при 80C. Раствор концентрировали и очищали с помощью препаративной ВЭЖХ с обращенной фазой (CH2Cl2/изопропанол от 10:0 до 9:1) и получали 66% искомого соединения.(промежуточный продукт 61; 315 мг; 0,44 ммоль) в 6 мл ТГФ добавляли 1,31 мл (1,31 ммоль) 1 M водного раствора HCl и систему перемешивали при комнатной температуре в течение 2,5 ч. Раствор подщелачивали 4% водным раствором гидрокарбоната натрия и трижды экстрагировали этилацетатом. Органические экстракты промывали рассолом, сушили и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (CH2Cl2/изопропанол от 10:0 до 9:1) и получали 78% искомого соединения.(промежуточный продукт 62; 200 мг; 0,33 ммоль) растворяли в 8 мл дихлорметана и перемешивали при комнатной температуре в инертной атмосфере. Порциями добавляли реагент Десса-Мартина (170 мг; 0,40 ммоль) и реакционную смесь перемешивали в течение 30 мин. Добавляли дихлорметан (15 мл), раствор промывали 4% водным раствором бикарбоната натрия и энергично перемешивали в течение 1 ч. Твердое вещество отфильтровывали и органическую фазу фильтрата промывали рассолом, сушили, концентрировали и получали 197 мг искомого соединения, достаточно чистого для использования на следующей стадии.(2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этанаминийацетата (получали в соответствии с синтезом 8 в US 20060035931) (119 мг, 0,36 ммоль) в 5 мл ТГФ перемешивали при 65C в течение 20 ч. После охлаждения реакционной смеси в бане со льдом порциями добавляли триацетоксиборогидрида натрия (195 мг; 0,92 моль). Перемешивание продолжали в течение 15 мин при 5C и в течение 45 мин при комнатной температуре. Раствор концентрировали до половины объема и добавляли 15 мл воды и 15 мл 4% водного раствора бикарбоната натрия. Смесь трижды экстрагировали этилацетатом, промывали рассолом, сушили и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (CHCl3/изопропанол от 10:0 до 9:1) и получали 47% искомого соединения.(промежуточный продукт 64; 125 мг; 0,14 ммоль) в 5 мл ТГФ добавляли триэтиламинтригидрофторида(0,04 мл, 0,28 ммоль). После перемешивания в течение 20 ч жидкий слой отбрасывали и остаток перемешивали еще с 5 мл ТГФ в течение 1 ч и отбрасывали. Затем добавляли ацетонитрил (15 мл) и перемешивание продолжали в течение 1 ч. Твердое вещество отфильтровывали и промывали ацетонитрилом и диизопропиловым эфиром. Получали чистое искомое соединение (67%).(d, J=6 Гц, 1 Н), 8,15 (d, J=12 Гц, 1 Н), 9,01 (s, 1H), 10,39 (br. s, 1H). Промежуточный продукт 65. N,N-Дибензил-1,4-диоксаспиро[4.5]декан-8-амин дибензил(1,4 диоксаспиро[4.5]дец-8-ил)амин. К раствору 1,4-диоксаспиро[4.5]декан-8-она (25 г, 0,16 моль) в 1,2-дихлорэтана (396 мл) в атмосфере азота добавляли дибензиламин (32,3 мл, 0,16 моль) и полученный раствор перемешивали в течение 2 ч при комнатной температуре. Затем порциями добавляли триацетоксиборогидрида натрия (55,4 г,0,25 моль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли смесь бикарбоната и дихлорметана (1:1) и ее перемешивали в течение 30 мин, затем органическую фазу экстрагировали и промывали бикарбонатом и рассолом, сушили, фильтровали и органический растворитель выпаривали при пониженном давлении. Полученное масло осаждали гексаном и получали искомое соединение в виде белого твердого вещества (80%), которое использовали на следующей стадии без дополнительной обработки. МСНР (m/z): 338 (М+1)+. Промежуточный продукт 66. 4-(Дибензиламино)циклогексанон.(промежуточный продукт 65; 43,6 г, 0,13 моль) суспендировали в хлористо-водородной кислоте (35%,49,4 мл, 0,59 моль), полученную смесь перемешивали при 100 С в течение 8 ч. Смесь охлаждали льдом с водой и подщелачивали до pH8 карбонатом калия, затем экстрагировали хлороформом. Органический слой выпаривали досуха и получали масло, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью гексан:этилацетат (от 98/2 до 90/10), и получали искомое соединение в виде желтого твердого вещества (72%). МСНР (m/z): 294 (М+1)+. Промежуточный продукт 67. транс-4-(Дибензиламино)-1-метилциклогексанол. К раствору 4-(дибензиламино)циклогексанона (промежуточный продукт 66; 10 г, 32 ммоль) в безводном тетрагидрофуране в атмосфере аргона при -78C медленно добавляли 1,6 М раствор метиллития в диэтиловом эфире (30 мл, 48 ммоль) и полученную смесь перемешивали при -78C в течение 4 ч. Затем добавляли насыщенный раствор хлорида аммония и смесь перемешивали в течение ночи при комнатной температуре. Органический растворитель выпаривали и полученное неочищенное вещество обрабатывали водой и хлороформом. Органический слой сушили над сульфатом натрия, фильтровали, выпаривали и получали масло, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан:этилацетат (от 0% гексана до 31% этилацетата) и получали две разные фракции. Первая соответствовала цис-продукту и вторая - транс-продукту в виде белого твердого вещества, которое являлось искомым соединением (55%). МСНР (m/z): 310 (М+1)+. Промежуточный продукт 68. транс-4-Амино-1-метилциклогексанол. К раствору транс-4-(дибензиламино)-1-метилциклогексанола (промежуточный продукт 67; 5,7 г,17,68 ммоль) в безводном этаноле (125 мл) в атмосфере азота добавляли гидроксид палладия (1,7 г,2,44 ммоль). Реакционную смесь энергично перемешивали в атмосфере водорода в течение ночи при комнатной температуре. Смесь фильтровали через целит и промывали этанолом. Растворитель выпаривали при пониженном давлении и получали искомое соединение в виде белого твердого вещества (98%),которое использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 130 (М+1)+. Промежуточный продукт 69. трет-Бутил(транс-4-гидрокси-4-метилциклогексил)карбамат. К суспензии транс-4-амино-1-метилциклогексанола (промежуточный продукт 68; 2,3 г,18,27 ммоль) в ацетонитриле (33 мл) в атмосфере аргона добавляли ди-трет-бутилдикарбонат (4,3 г,20,11 ммоль). Смесь энергично перемешивали в течение ночи при комнатной температуре. Осадок отфильтровывали, промывали смесью гексан:этилацетат (3:1) и получали твердое вещество, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан:этилацетат(от 0 до 100% этилацетата). Искомое соединение получали в виде белого твердого вещества (90%). 1H ЯМР (300 МГц, хлороформ-d). Промежуточный продукт 70. транс-1-Метил-4-(метиламино)циклогексанол. трет-Бутил(транс-4-гидрокси-4-метилциклогексил)карбамат (промежуточный продукт 69; 3,6 г,16,09 ммоль) при комнатной температуре добавляли к суспензии алюмогидрида лития (3,1 г,82,21 ммоль) в безводном тетрагидрофуран. Затем смесь кипятили с обратным холодильником в течение ночи. Смесь охлаждали до комнатной температуры и избыток гидрида разлагали и фильтровали. Растворитель удаляли при пониженном давлении и получали масло, которое затвердевало. Искомое соединение получали в виде твердого вещества (98%). 1H ЯМР (300 МГц, хлороформ-d). Промежуточный продукт 71. трет-Бутил(транс-4-гидрокси-4-метилциклогексил)метилкарбамат. Получали в виде белого твердого вещества (78%) из транс-1-метил-4-(метиламино)циклогексанола(промежуточный продукт 71; 2,5 г, 17,4 ммоль) и ди-трет-бутилдикарбоната (4,1 г, 19,2 ммоль) по экспериментальной методике, описанной для промежуточного продукта 69 (продолжительность реакции: 2 ч),затем очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (1:1). 1 Н ЯМР (300 МГц, хлороформ-d). Промежуточный продукт 72. транс-4-[(трет-Бутоксикарбонил)(метил)амино]-1 метилциклогексилоксо(2-тиенил)ацетат. К раствору 2-оксо-2-(тиофен-2-ил)уксусной кислоты (2,13 г, 13,64 ммоль) в хлороформе, стабилизированному амиленами (25 мл) и двумя каплями безводного диметилформамида, при низкой температуре по каплям добавляли раствор оксалилхлорида (1,78 мл, 20,47 ммоль) в смеси хлороформ/амилены. Смесь перемешивали в течение 15 мин при низкой температуре и в течение 2 ч при комнатной температуре. Смесь выпаривали досуха и полученное неочищенное вещество растворяли в безводном метиленхлориде (21 мл) и при низкой температуре по каплям добавляли к раствору трет-бутил(транс-4-гидрокси 4-метилциклогексил)метилкарбамата (промежуточный продукт 71; 2,77 г, 11,3 ммоль) в безводном метиленхлориде (25 мл) и триэтиламине (3,9 мл, 28,42 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Неочищенное вещество подвергали распределению между водой и метиленхлоридом и органический слой промывали 4% раствором бикарбоната и водой, фильтровали и выпаривали досуха и получали коричневое масло, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью гексан:этилацетат (1:1). Искомое соединение получали в виде оранжевого масла (62%). МСНР (m/z): 382 (M+1)+. Промежуточный продукт 73. транс-4-[(трет-Бутоксикарбонил)(метил)амино]-1 метилциклогексилгидрокси(ди-2-тиенил)ацетат. К суспензии магния (0,21 г, 8,64 ммоль) в безводном тетрагидрофуране (14,7 мл) в атмосфере аргона по каплям добавляли 20% раствор 2-бромтиофена (0,83 мл, 8,57 ммоль) в безводном тетрагидрофуране (9,8 мл), через несколько минут по каплям добавляли остаток раствора 2-бромтиофена. Смесь перемешивали при 75C в течение 1 ч и затем реакционную смесь охлаждали до комнатной температуры и при низкой температуре по каплям добавляли к раствору транс-4-[(трет-бутоксикарбонил)(метил)амино]1-метилциклогексилоксо(2-тиенил)ацетата (промежуточный продукт 72; 2,65 г, 6,6 ммоль) в безводном тетрагидрофуране (18,4 мл). После завершения добавления смесь перемешивали в течение 1 ч при комнатной температуре и в течение 1 ч кипятили с обратным холодильником. Неочищенную реакционную смесь охлаждали и добавляли насыщенный раствор хлорида аммония, затем неочищенное вещество экстрагировали эфиром и органический слой промывали рассолом, сушили и фильтровали. Органический растворитель удаляли при пониженном давлении и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан:этилацетат (1:1). Искомое соединение получали в виде оранжевого масла (92%). МСНР (m/z): 466 (M+1)+. Промежуточный продукт 74. транс-1-Метил-4-(метиламино)циклогексилгидрокси(ди-2 тиенил)ацетат. Получали в виде твердого вещества из транс-4-[(трет-бутоксикарбонил)(метил)амино]-1 метилциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 73; 0,18 г, 0,39 ммоль) и 4 М раствора хлорида водорода в диоксане (0,49 мл, 1,96 ммоль) по экспериментальной методике, описанной для промежуточного продукта 5. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (1:1). МСНР (m/z): 366 (М+1)+. Промежуточный продукт 75. транс-4-[(3-[4-([трет-Бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]амино-3-оксопропил)(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде желтого масла (69%) из транс-1-метил-4-(метиламино)циклогексилгидрокси(ди-2 тиенил)ацетатаN-[4-([третбутил(диметил)силил]оксиметил)-2-хлор-5-метоксифенил]акриламида (промежуточный продукт 40; 104 мг, 0,29 ммоль) по экспериментальной методике, описанной для промежуточного продукта 41. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/гексан (1:1). МСНР (m/z): 722 (M+1)+. Промежуточный продукт 76. транс-4-[(3-[2-Хлор-4-(гидроксиметил)-5-метоксифенил]амино-3 оксопропил)(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного масла(73%) из транс-4-[(3-[4-([третбутил(диметил)силил]оксиметил)-2-хлор-5-метоксифенил]амино-3-оксопропил)(метил)амино]-1 метилциклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 75; 119 мг, 0,16 ммоль) и 1 М раствора хлористо-водородной кислоты (0,49 мл, 0,5 ммоль) по экспериментальной методике, описанной для промежуточного продукта 42. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (15:1). МСНР (m/z): 608 (M+1)+. Промежуточный продукт 77. транс-4-[3-[(2-Хлор-4-формил-5-метоксифенил)амино]-3 оксопропил(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного масла (97%) из транс-4-[(3-[2-хлор-4-(гидроксиметил)-5 метоксифенил]амино-3-оксопропил)(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетата(промежуточный продукт 76; 432 мг, 0,7 ммоль) и оксида марганца(IV) (754 мг, 7,37 ммоль) по экспериментальной методике, описанной для промежуточного продукта 43. Полученное неочищенное вещество использовали на следующей стадии без очистки. МСНР (m/z): 606 (M+1)+. Промежуточный продукт 78. транс-4-[(3-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)-2-хлор-5-метоксифенил]амино-3 оксопропил)(метил)амино]-1-метилциклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде бесцветного маслаUS 20060035931) (0,4 г, 1,01 ммоль) и триацетоксиборогидрида натрия (0,54 г, 2,41 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30, полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (10:1). МСНР (m/z): 924 (M+1)+. Пример 13. транс-4-[(3-[2-Хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]амино-3-оксопропил)(метил)амино]-1 метилциклогексилгидрокси(ди-2-тиенил)ацетат по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2). МСНР (m/z): 809 (M+1)+. 1(dd, J=5 Гц, 2 Н), 7,68 (s, 1 Н), 8,12 (d, J=9 Гц, 1 Н), 10,36 (br. s, 2 Н). Промежуточный продукт 79. N-[4-(Гидроксиметил)фенил]акриламид. Получали в виде твердого вещества (82%) из (4-аминофенил)метанола (0,5 г, 4,06 ммоль), акрилоилхлорида (0,3 мл, 4,06 ммоль) и диэтилизопропиламина (1,4 мл, 8,1 ммоль) по экспериментальной методике, описанной для промежуточного продукта 40. Полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки.(промежуточный продукт 5; 0,5 г, 1,42 ммоль). Смесь помещали в герметизированный сосуд и перемешивали в течение 4 дней при 75C. Растворитель удаляли при пониженном давлении и полученное неочищенное вещество очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и получали искомое соединение (34%). МСНР (m/z): 529 (M+1)+. Промежуточный продукт 81. транс-4-[3-[(4-Формилфенил)амино]-3 оксопропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде масла(96%) из транс-4-[(3-[4-(гидроксиметил)фенил]амино-3 оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 80; 0,25 г, 0,47 ммоль) и оксида марганца(IV) (0,4 г, 4,7 ммоль) по экспериментальной методике, описанной для промежуточного продукта 43. Полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 527 (M+1)+. Промежуточный продукт 82. транс-4-[(3-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)фенил]амино-3 оксопропил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде вспененного вещества (31%) из транс-4-[3-[(4-формилфенил)амино]-3 оксопропил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 81; 0,24 г, 0,46 ммоль), (2R)-2-[трет-бутил(диметил)силил]окси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин 5-ил)этанаминийацетата (получали в соответствии с синтезом 8 в US 20060035931) (0,2 г, 0,68 ммоль) и триацетоксиборогидрида натрия (0,34 г, 1,64 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30, полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле. МСНР (m/z): 846 (M+1)+. Пример 14. транс-4-[(3-[4-([(2R)-2-Гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)фенил]амино-3-оксопропил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетатгидрофторид (1:2)(0,07 мл, 0,43 ммоль) по экспериментальной методике, описанной в примере 1, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2). МСНР (m/z): 731 (М+1)+. 1 Промежуточный продукт 83. 4-Бром-N-[4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]бутанамид. К раствору 4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5-метоксианилина (промежуточный продукт 39; 0,75 г, 2,48 ммоль) в тетрагидрофуране (20 мл) и триэтиламине (0,38 мл, 2,73 ммоль) в атмосфере азота при добавляли 0C 4-бромбутаноилхлорид (0,32 мл, 2,76 ммоль). Смесь перемешивали в течение 0,5 ч. К смеси добавляли этилацетат и органический слой промывали бикарбонатом и рассолом,сушили и растворитель удаляли при пониженном давлении. Получали искомое соединение (97%) и его использовали на следующей стадии без дополнительной очистки.MCHP (m/z): 451 (M+1)+. Промежуточный продукт 84. транс-4-[(4-[4-([трет-Бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]амино-4-оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде масла (4%) из 4-бром-N-[4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]бутанамида (промежуточный продукт 83; 2,2 г, 4,4 ммоль), транс-4(метиламино)циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 5; 1,03 г, 2,84 ммоль) и триэтиламин (1,2 мл, 8,82 ммоль) по экспериментальной методике, описанной для промежуточного продукта 6. Полученное неочищенное вещество очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2).MCHP (m/z):722 (M+1)+. Промежуточный продукт 85. транс-4-[(4-[2-Хлор-4-(гидроксиметил)-5-метоксифенил]амино-4 оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. К раствору транс-4-[(4-[4-([трет-бутил(диметил)силил]оксиметил)-2-хлор-5 метоксифенил]амино-4-оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 84; 90 мг, 0,12 ммоль) в тетрагидрофуране (3,5 мл) добавляли триэтиламинтригидрофторид (0,55 мл, 5,46 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и полученное неочищенное вещество очищали с помощью препаративной ВЭЖХ с обращенной фазой (система 2) и получали искомое соединение (23%). МСНР (m/z): 608 (M+1)+. Промежуточный продукт 86. транс-4-[4-[(2-Хлор-4-формил-5-метоксифенил)амино]-4 оксобутил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде масла (84%) из транс-4-[(4-[2-хлор-4-(гидроксиметил)-5-метоксифенил]амино-4 оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 85; 0,68 г,1,12 ммоль) и оксида марганца(IV) (1,95 г, 22,39 ммоль) по экспериментальной методике, описанной для промежуточного продукта 43 (продолжительность реакции: 32 ч). Полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. МСНР (m/z): 606 (M+1)+. Промежуточный продукт 87. транс-4-[(4-[4-([(2R)-2-[трет-Бутил(диметил)силил]окси-2-(8 гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)-2-хлор-5-метоксифенил]амино-4 оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетат. Получали в виде коричневого твердого вещества (47%) из транс-4-[4-[(2-хлор-4-формил-5 метоксифенил)амино]-4-оксобутил(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 86; 0,35 г, 0,4 ммоль), 5-1R)-2-амино-1-[трет-бутил(диметил)силил]оксиэтил)-8 гидроксихинолин-2(1H)-она (получали в соответствии с синтезом 8 в US 20060035931) (0,2 г, 0,51 ммоль) и триацетоксиборогидрида (0,28 г, 1,32 ммоль) по экспериментальной методике, описанной для промежуточного продукта 30. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью хлороформ/метанол (95:5). МСНР (m/z): 924 (M+1)+. Пример 15. транс-4-[(4-[2-Хлор-4-([(2R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этил]аминометил)-5-метоксифенил]амино-4-оксобутил)(метил)амино]циклогексилгидрокси(ди-2 тиенил)ацетат. Получали в виде желтого твердого вещества (50%) из транс-4-[(4-[2-хлор-4-([(2R)-2-гидрокси-2(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этил]аминометил)-5-метоксифенил]амино-4 оксобутил)(метил)амино]циклогексилгидрокси(ди-2-тиенил)ацетата (промежуточный продукт 87, 0,18 г,0,17 ммоль) и триэтиламинтригидрофторида (0,08 мл, 0,52 ммоль) по экспериментальной методике, опи- 29
МПК / Метки
МПК: C07D 409/14, A61P 11/00, A61K 31/4709
Метки: антагонистической, рецептору, новые, агонистической, обладающие, отношению, активностью, адренергическому, мускариновому, beta;2, циклогексиламина, производные
Код ссылки
<a href="https://eas.patents.su/30-22358-novye-proizvodnye-ciklogeksilamina-obladayushhie-agonisticheskojj-aktivnostyu-po-otnosheniyu-k-beta2-adrenergicheskomu-receptoru-i-antagonisticheskojj-aktivnostyu-po-otnosheniyu-k.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные циклогексиламина, обладающие агонистической активностью по отношению к β2 адренергическому рецептору и антагонистической активностью по отношению к m3 мускариновому рецептору</a>
Предыдущий патент: Контрольное цифровое устройство транспортного средства
Следующий патент: Активность катионных каналов
Случайный патент: Устройство для компоновки упаковок












