Антибактериальные хинолиновые производные
Номер патента: 22344
Опубликовано: 30.12.2015
Авторы: Мотт Магали Мадлен Симон, Андрис Кунрад Йозеф Лодевейк Марсель, Доранж Исмет, Гийемон Жером Эмиль Жорж, Коул Анил
Формула / Реферат
1. Соединение формулы (Ia)
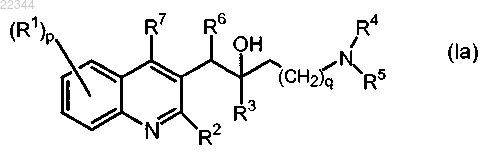
включая любую его стереохимически изомерную форму, где
р представляет собой целое число, равное 1, 2, 3 или 4;
q представляет собой целое число, равное 0, 1, 2, 3 или 4;
R1 представляет собой атом водорода, атом галогена;
R2 представляет собой С1-6алкилокси;
R3 представляет собой арилС1-6алкил, арил-О-С1-6алкил, арил, ариларил;
каждый R4 и R5 независимо представляет собой атом водорода, C1-6алкил; или
R4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С1-6алкилом;
R6 представляет собой арил1 или Het;
R7 представляет собой атом водорода, атом галогена, C1-6алкил, арил или Het;
арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, С1-6алкила, С1-6алкилокси;
арил1 представляет собой фенил, необязательно замещенный заместителем, выбранным из атома галогена, Het;
Het представляет собой пиразолил, фуранил, тиенил, пиридинил, хинолинил, бензо[1,3]диоксолил; где Het необязательно замещен С1-6алкилом;
или его фармацевтически приемлемая соль.
2. Соединение формулы (Ib)

включая любую его стереохимически изомерную форму, где
р представляет собой целое число, равное 1, 2, 3 или 4;
q представляет собой целое число, равное 0, 1, 2, 3 или 4;
R1 представляет собой атом водорода, атом галогена;
R2 представляет собой С1-6алкилокси;
R3 представляет собой арилС1-6алкил, арил-О-С1-6алкил, арил, ариларил;
каждый R4 и R5 независимо представляет собой атом водорода, С1-6алкил или
R4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С1-6алкилом;
R6 представляет собой арил1 или Het;
R7 представляет собой атом водорода, атом галогена, C1-6алкил, арил или Het;
R8 представляет собой атом водорода или С1-6алкил;
R9 представляет собой оксо или
R8 и R9 образуют вместе радикал -CH=CH-N=;
арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, С1-6алкила, С1-6алкилокси;
арил1 представляет собой фенил, необязательно замещенный заместителем, выбранным из атома галогена, Het;
Het представляет собой пиразолил, фуранил, тиенил, пиридинил, хинолинил, бензо[1,3]диоксолил, где Het необязательно замещен C1-6алкилом;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, где
R3 представляет собой арилС1-6алкил, арил-O-С1-6алкил, арил;
арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, С1-6алкила, С1-6алкилокси.
4. Соединение по любому из предшествующих пунктов, где R1 представляет собой атом галогена.
5. Соединение по любому из предшествующих пунктов, где р равно 1.
6. Соединение по любому из предшествующих пунктов, где R2 представляет собой C1-6алкилокси.
7. Соединение по п.6, где R2 представляет собой метилокси.
8. Соединение по любому из предшествующих пунктов, где R3 представляет собой арил-О-С1-6алкил, ариларил.
9. Соединение по п.8, где R3 представляет собой арил-O-C1-6алкил.
10. Соединение по любому из пп.1-7, где R3 представляет собой арил.
11. Соединение по любому из предшествующих пунктов, где q равно 1, 3 или 4.
12. Соединение по любому из предшествующих пунктов, где R4 и R5 представляют собой С1-6алкил.
13. Соединение по любому из пп.1-11, где R4 и R5 образуют вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, состоящей из пиперидинила и пиперазинила, причем каждое из упомянутых колец необязательно замещено C1-6алкилом.
14. Соединение по любому из предшествующих пунктов, где R6 представляет собой Het или необязательно замещенный фенил.
15. Соединение по любому из предшествующих пунктов, где R7 представляет собой атом водорода.
16. Соединение по п.2, где соединение представляет собой соединение формулы (Ia), где R1 представляет собой атом водорода или атом галогена; R2 представляет собой С1-6алкилокси; R3 представляет собой арил-О-С1-6алкил, арил или ариларил; R4 и R5 представляют собой С1-6алкил или R4 и R5 образуют вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, состоящей из пиперидинила и пиперазинила, причем каждый из упомянутых радикалов необязательно замещен C1-6алкилом; R6 представляет собой Het или необязательно замещенный фенил; R7 представляет собой атом водорода; q равно 1, 3 или 4; р равно 1.
17. Соединение по любому из предшествующих пунктов, где R1 находится в 6 положении хинолинового кольца.
18. Соединение по п.1, где соединение выбирают из
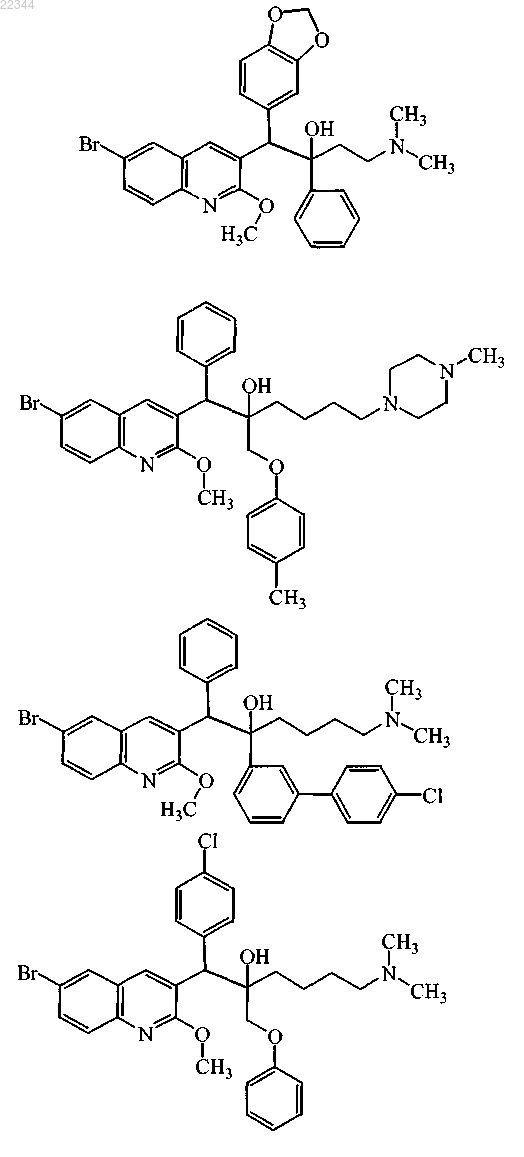
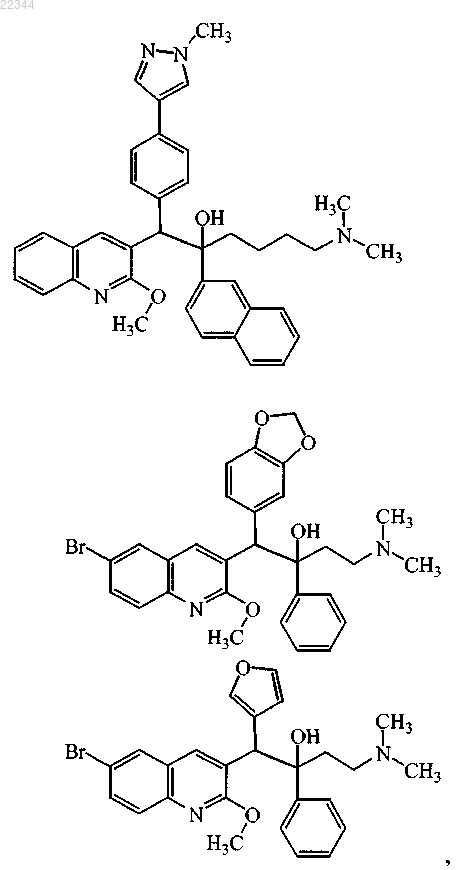
включая его стереохимически изомерную форму, его фармацевтически приемлемую соль.
19. Применение соединения по любому из пп.1-18 в качестве лекарственного средства для лечения бактериальной инфекции.
20. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-18.
21. Применение соединения по любому из пп.1-18 для получения лекарственного средства для лечения бактериальной инфекции.
22. Применение по п.21, где бактериальная инфекция представляет собой инфекцию грамположительными бактериями.
23. Применение по п.22, где грамположительная бактерия представляет собой Streptococcus pneumoniae.
24. Применение по п.22, где грамположительная бактерия представляет собой Staphylococcus aureus.
25. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (IIa) с промежуточным соединением формулы (III) в соответствии со следующей реакционной схемой
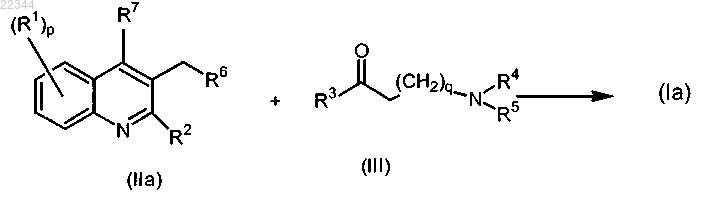
с применением nBuLi в смеси подходящего основания и подходящего растворителя, где значения всех переменных характеристик определены в п.1;
или при необходимости преобразование соединения формулы (Ia) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой, или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием, или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью, или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой.
26. Способ получения соединения по п.2, включающий
взаимодействие промежуточного соединения формулы (IIb) с промежуточным соединением формулы (III) в соответствии со следующей реакционной схемой
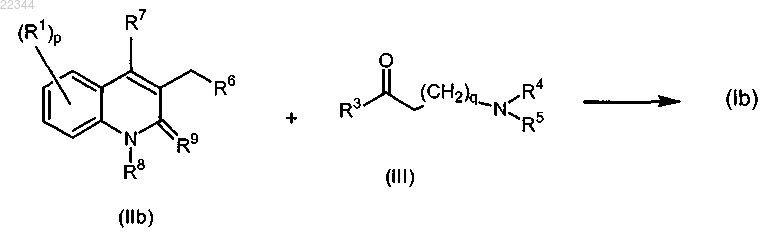
с применением nBuLi в смеси подходящего основания и подходящего растворителя, где значения всех переменных характеристик определены в п.1;
или, при необходимости, преобразование соединения формулы (Ib) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой, или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием, или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью, или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой.
27. Комбинация (а) соединения по любому из пп.1-18 и (b) одного или нескольких других бактериальных средств.
28. Набор, содержащий (а) соединение по любому из пп.1-18 и (b) одно или нескольких других бактериальных средств, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении бактериальной инфекции.
29. Применение по п.24, где Staphylococcus aureus представляет собой метициллин-резистентный Staphylococcus aureus.
30. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (IV-a), где W1 представляет собой подходящую уходящую группу, с Het-В(ОН)2 в присутствии подходящего катализатора, подходящего основания и подходящего растворителя в соответствии со следующей реакционной схемой

где значения всех переменных характеристик определены в п.1 и где R3' представляет собой арилС1-6алкил, арил;
или, при необходимости, преобразование соединений формулы (Ia) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой, или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием, или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью, или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой.
31. Способ получения соединения по п.2, включающий взаимодействие промежуточного соединения формулы (IV-b), где W1 представляет собой подходящую уходящую группу, с Het-В(ОН)2 в присутствии подходящего катализатора, подходящего основания и подходящего растворителя в соответствии со следующей реакционной схемой:
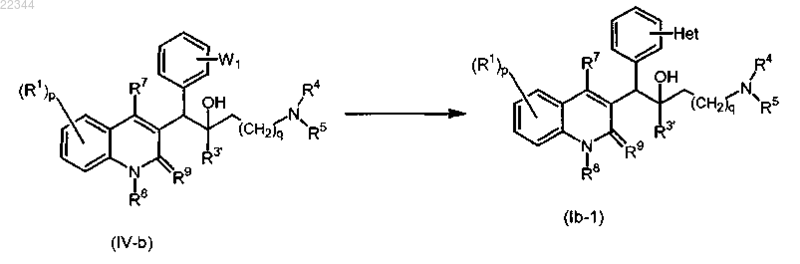
где значения всех переменных характеристик определены в п.1 и где R3' представляет собой арилС1-6алкил, арил;
или, при необходимости, преобразование соединений формулы (Ib) в терапевтически активную нетоксичную кислотно-аддитивную соль путем обработки кислотой, или в терапевтически активную нетоксичную основно-аддитивную соль путем обработки основанием, или, наоборот, преобразование кислотно-аддитивной соли в свободное основание путем обработки щелочью, или преобразование основно-аддитивной соли в свободную кислоту путем обработки кислотой.
Текст
Гийемон Жером Эмиль Жорж (FR),Доранж Исмет (SE), Мотт Магали Мадлен Симон (FR), Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил Изобретение относится к новым замещенным хинолиновым производным формулы (Ia) или формулы (Ib), включая любую их стереохимически изомерную форму, фармацевтически приемлемую соль, где р представляет собой целое число, равное 1, 2, 3 или 4; q представляет собой целое число, равное 0, 1, 2, 3 или 4; R1 представляет собой атом водорода, атом галогена; R2 представляет собой C1-6 алкилокси; R3 представляет собой арилС 1-6 алкил, арил-ОС 1-6 алкил, арил, ариларил; каждый R4 и R5 независимо представляет собой атом водорода,С 1-6 алкил; или R4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены,радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С 1-6 алкилом; R6 представляет собой арил 1 или Het; R7 представляет собой атом водорода, атом галогена, С 1-6 алкил, арил или Het; R8 представляет собой атом водорода или С 1-6 алкил; R9 представляет собой оксо; или R8 и R9 образуют вместе радикал-CH=CH-N=; арил, арил 1 и Het имеют значения, указанные в формуле изобретения. Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество заявленных соединений. Соединения могут быть использованы для получения лекарственного средства для лечения бактериальной инфекции. Изобретение относится к новым замещенным хинолиновым производным, которые применимы для лечения бактериальных заболеваний, включая без ограничения заболевания, вызванные патогенными микобактериями, такими как Mycobacterium tuberculosis, М. bovis, M. leprae, M. avium и М. marinum, или патогенными стафилококками или стрептококками. Предпосылки создания изобретенияMycobacterium tuberculosis является возбудителем туберкулеза (ТВ), опасной и потенциально смертельной инфекции, распространенной во всем мире. По оценке Всемирной организации здравоохранения более 8 миллионов человек ежегодно заболевают ТВ, а 2 миллиона человек ежегодно умирают от туберкулеза. В последнее десятилетие случаи заболевания ТВ во всем мире возросли на 20%, при этом наибольшая предрасположенность наблюдается в беднейших группах населения. Если указанная тенденция сохранится, то частота заболеваемости в течение следующих двадцати лет увеличится на 41%. Спустя пятьдесят лет после внедрения эффективной химиотерапии ТВ остается основной после СПИДа инфекционной причиной смерти взрослого населения во всем мире. Эпидемическая обстановка с ТВ осложнена увеличением количества штаммов, обладающих мультирезистентностью к лекарствам и смертоносным симбиозом с ВИЧ. Вероятность развития активной формы ТВ у ВИЧ-положительных людей, инфицированных ТВ, в 30 раз выше, чем у ВИЧ-отрицательных людей, и ТВ ответственен за смерть каждого третьего носителя ВИЧ/СПИД во всем мире. Все существующие подходы к лечению туберкулеза включают сочетание множества средств. Например, схема лечения, рекомендованная службой общественного здравоохранения США, представляет собой сочетание в течение двух месяцев изониазида, рифампицина и пиразинамида, а затем лишь изониазида и рифампицина еще в течение четырех месяцев. ВИЧ-инфицированные пациенты продолжают дополнительно принимать указанные лекарства в течение семи месяцев. Комбинированная терапия пациентов, инфицированных штаммами М. tuberculosis, обладающими мультирезистентностью к лекарствам, включает такие средства как этамбутол, стрептомицин, канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Единственного средства, эффективного при лечении туберкулеза, а также сочетания средств, позволяющего проведение лечения за период менее шести месяцев, не существует. В медицине сохраняется высокая потребность в новых лекарствах, улучшающих существующее лечение за счет применения схем лечения, которые облегчали бы соблюдение этих схем, как пациентами,так и медицинскими работниками. Лучшим путем достижения этой цели являются более короткие схемы лечения, а также схемы лечения, которые требуют менее интенсивного наблюдения. Наибольший эффект лечения достигается в первые два месяца лечения в течение интенсивной, или бактерицидной фазы, когда одновременно принимают четыре лекарства; бактериальная нагрузка значительно снижается, и пациенты перестают быть заразными. Для удаления персистирующих бацилл и минимизации риска рецидива требуется продолжение лечения в течение от 4 до 6 месяцев, то есть фаза стерилизации. Особенно полезным было бы мощное стерилизующее средство, которое сокращало бы схему лечения до 2 месяцев или менее. Также необходимы лекарства, которые облегают соблюдение схем лечения посредством снижения требований к интенсивному наблюдению. Очевидно, что наибольшей пользой обладало бы лекарство, снижающее как общую продолжительность лечения, так и частоту приема лекарства. Эпидемическая обстановка с ТВ осложнена возрастающей частотой возникновения штаммов, обладающих мультирезистентностью к лекарствам, или MDR-TB. Во всем мире до четырех процентов всех случаев связывают с MDR-TB, резистентными к наиболее эффективным лекарствам из числа стандартно применяемых четырех лекарств, изониазиду и рифампину. В отсутствие лечения MDR-TB являются смертельными, и на них невозможно адекватно воздействовать посредством проведения стандартной терапии, поэтому для лечения требует применение на протяжении до двух лет лекарств второй линии. Указанные лекарства обычно токсичны, дорогостоящи и минимально эффективны. В отсутствие эффективной терапии пациенты, инфицированные MDR-TB, продолжают распространять заболевание, вызывая новые инфекции штаммами MDR-TB. В медицине сохраняется высокая потребность в новом лекарстве с новым механизмом действия, которое способно продемонстрировать активность против резистентных к лекарствам штаммов, в частности MDR-штаммов. Термин "резистентный к лекарствам", используемый ранее и далее в этом документе, представляет собой термин, хорошо известный специалисту в области микробиологии. Резистентная к лекарствам микобактерия представляет собой микобактерию, которая более не чувствительна к действию по меньшей мере одного ранее эффективного лекарства, у которой развилась способность выдерживать атаку по меньшей мере одним ранее эффективным антибиотиком. Резистентный к лекарствам штамм может передавать своему потомству такую способность. Указанная резистентность может быть следствием случайных генетических мутаций в бактериальной клетке, которые изменяют ее чувствительность к действию одного лекарства или различных лекарств.MDR-туберкулез представляет собой специфическую форму туберкулеза, резистентного к лекарствам из-за бактерии, резистентной, по крайней мере, к изониазиду и рифампицину (обладающей или не обладающей резистентностью к другим лекарствам), которые являются двумя наиболее мощными лекарствами против ТВ в настоящее время. Таким образом, используемый ранее и далее в этом документе термин "резистентный к лекарствам" включает мультирезистентность к лекарствам. Другим фактором контроля эпидемической обстановки с ТВ является проблема латентного ТВ. Несмотря на проведение в течение десятилетий программ контроля туберкулеза (ТВ), число инфицированных М. tuberculosis, хотя и бессимптомно, составляет около 2 миллиардов человек. Около 10% этих индивидуумов в течение всей жизни подвержены риску возникновения активной формы ТВ. Глобальной эпидемии ТВ способствует инфицирование ВИЧ-пациентов ТВ и рост резистентных к лекарствам штаммов ТВ (MDR-TB). Реактивация латентного ТВ представляет собой фактор высокого риска развития заболевания и является причиной 32% смертей у ВИЧ-инфицированных людей. Для контроля эпидемической обстановки с ТВ необходима разработка новых лекарств, которые способны убивать дремлющие или латентные бациллы. Дремлющий ТВ может быть реактивирован и вызвать заболевание под действием различных факторов, таких как подавление иммунитета хозяина под действием иммуносупрессивных средств, таких как антитела против фактора некроза опухолей а или интерферона- . В случае ВИЧположительных пациентов единственно доступным профилактическим лечением латентного ТВ является схема лечения рифампицином и пиразинамидом в течение двух-трех месяцев. Эффективность указанной схемы лечения до сих пор неясна, и, кроме того, продолжительность лечения является важным ограничением в условиях недостатка ресурсов. Таким образом, существует насущная потребность в выявлении новых лекарств, которые могут действовать в качестве химиопрофилактических средств для индивидуумов-носителей латентных бацилл ТВ. Туберкулезные бациллы попадают в организм здоровых индивидуумов при вдыхании; они фагоцитируются альвеолярными макрофагами в легких. Это приводит к мощному иммунному ответу и образованию гранулем, которые состоят из инфицированных М. tuberculosis макрофагов, окруженных Тклетками. Спустя 6-8 недель иммунный ответ хозяина вызывает смерть инфицированных клеток путем некроза и накопление казеозного вещества, содержащего некоторое количество внеклеточных бацилл,окруженных макрофагами, эпителоидными клетками и слоями лимфоидной ткани по периферии. У здоровых индивидуумов большая часть микобактерий уничтожается в указанном микроокружении, но небольшая часть бацилл все же выживает, и предполагают, что она существует в нереплицируемом, гипометаболическом состоянии и толерантна к цитолизу под действием противотуберкулезных лекарств, таких как изониазид. Указанные бациллы могут оставаться в измененном физиологическом окружении даже в течение всей жизни индивидуума без проявления каких-либо клинических симптомов заболевания. Однако в 10% случаев указанные латентные бациллы могут реактивироваться с индукцией заболевания. Одна из гипотез относительно развития указанных персистирующих бактерий заключается в развитии у человека патофизиологического окружения в очагах поражения, а именно, снижения кислородного потенциала, ограничения поступления питательных средств и формирования кислых значений рН. Постулируется, что указанные факторы наделяют бактерии свойствами фенотипической толерантности к большинству антимикобактериальных лекарств. Помимо контроля эпидемической обстановки с ТВ появляется проблема резистентности к антибиотическим средствам первой линии. Некоторые важные примеры включают пенициллин-резистентныйStreptococcus pneumoniae, ванкомицин-резистентные энтерококки, метициллин-резистентный Staphylococcus aureus, мультирезистентные сальмонеллы. Последствия резистентности к антибиотическим средствам серьезны. Инфекции, вызванные резистентными микробами, не отвечают на лечение, что приводит к продолжительной болезни и повышению риска смерти. Неудачные результаты лечения также приводят к более продолжительным периодам инфицирующей способности, что повышает число инфицированных людей внутри группы населения, а потому подвергает все слои населения риску заражения инфекционным, обладающим резистентностью к лекарствам. Стационарные лечебные учреждения по всему миру представляют собой критический компонент проблемы резистентности микробов. Сочетание легко инфицируемых пациентов, интенсивного и длительного применения противомикробных средств и перекрестной инфекции привело к появлению инфекций с высокорезистентными бактериальными патогенами. Самолечение с применением противомикробных средств представляет собой другой важный фактор, вносящий вклад в развитие резистентности. Самостоятельно принимаемые противомикробные средства могут не являться необходимыми, часто применяются в неадекватной дозировке, или могут не содержать адекватного количества активного лекарства. Соблюдение пациентами рекомендованных режимов лечения представляет собой еще одну важную проблему. Пациенты забывают принять лекарство, прерывают свое лечение, когда начинают чувствовать себя лучше, или могут быть не способны позволить себе полный курс лечения, создавая тем самым условия микроокружения, идеальные скорее для адаптации микробов, чем для их уничтожения. Вследствие появления резистентности ко многим антибиотикам врачи сталкиваются с инфекциями,для которых не существует эффективного лечения. Заболеваемость, смертность и финансовые расходы на борьбу с такими инфекциями ложатся все возрастающим бременем на системы здравоохранения во всем мире. Поэтому, существует большая потребность в новых соединениях для лечения бактериальных инфекций, в особенности микобактериальных инфекций, включая инфекции мультирезистентными к ле-2 022344 карствам и латентными микобактериальными формами, а также других бактериальных инфекций, в особенности тех, которые вызываются резистентными штаммами бактерий. В WO 2004/011436, WO 2005/070924, WO 2005/070430 и WO 2005/075428 раскрываются некоторые замещенные хинолиновые производные, обладающие активностью против Mycobacteria, в частности против Mycobacterium tuberculosis. В WO 2005/117875 описаны замещенные хинолиновые производные,обладающие активностью против резистентных микобактериальных штаммов. В WO 2006/067048 описаны замещенные хинолиновые производные, обладающие активностью при латентном туберкулезе. Другое конкретное соединение из числа указанных замещенных хинолиновых производных описано вScience (2005), 307, 223-227, а его способ действия описан в WO 2006/035051. Другие замещенные хинолины раскрываются в патенте США 5965572 для лечения резистентных к антибиотикам инфекций, а в WO 00/34265 - для ингибирования роста бактериальных микроорганизмов. Цель настоящего изобретения состоит в обеспечении новыми соединениями, в частности, замещенными производными хинолина, которые обладают способностью ингибировать рост бактерий, в особенности стрептококков, стафилококков или микобактерий, а потому применимых для лечения бактериальных заболеваний, в частности заболеваний, вызванных патогенными бактериями, такими как Streptococcus pneumonia, Staphylococcus aureus или Mycobacterium tuberculosis (включая латентное заболевание и включая резистентные к лекарствам штаммы М. tuberculosis), М. bovis, M. leprae, M. avium и М. marinum. Краткое описание сущности изобретения Настоящее изобретение относится к новым замещенным хинолиновым производным в соответствии с формулой (Ia) или формулой (Ib): включая любую их стереохимически изомерную форму, где р представляет собой целое число, равное 1, 2, 3 или 4;q представляет собой целое число, равное 0, 1, 2, 3 или 4;R1 представляет собой атом водорода, атом галогена;R3 представляет собой арилС 1-6 алкил, арил-O-С 1-6 алкил, арил, ариларил; каждый R4 и R5 независимо представляет собой атом водорода, C1-6 алкил; илиR4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С 1-6 алкилом;R6 представляет собой арил 1 или Het;R7 представляет собой атом водорода, атом галогена, С 1-6 алкил, арил или Het;R8 представляет собой атом водорода или С 1-6 алкил;R8 и R9 образуют вместе радикал -CH=CH-N=; арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, С 1-6 алкила, С 1-балкилокси; арил 1 представляет собой фенил, необязательно замещенный заместителем, выбранным из атома галогена, Het;Het представляет собой пиразолил, фуранил, тиенил, пиридинил, хинолинил, бензо[1,3]диоксолил,где Het необязательно замещен С 1-6 алкилом; к их фармацевтически приемлемым солям. Подразумевается, что использованный где-либо в этом документе термин "соединения формулы(Ia) или (Ib)" или "соединения по настоящему изобретению" также включает их фармацевтически приемлемые соли. Соединения формулы (Ia) и (Ib) взаимосвязаны в том, что, например, соединение в соответствии с формулой (Ib), в котором R9 представляет собой оксо, и R8 представляет собой атом водорода, представляет собой таутомерный эквивалент соединения в соответствии с формулой (Ia), в котором R2 представляет собой гидрокси (кето-енольная таутомерия). Подразумевается, что определение Het включает все возможные изомерные формы гетероциклов. Если не указано иное, то упомянутые ранее или далее в этом документе арил, арил 1 или Het, перечисленные в определениях заместителей для соединений формулы (Ia) или (Ib) (см., например, R3), могут быть присоединены к остатку молекулы формулы (Ia) или (Ib) посредством любого соответствующего кольцевого атома углерода или гетероатома. Линии, идущие от заместителей к кольцевым системам, указывают то, что связь может быть при-3 022344 соединена к любому из подходящих кольцевых атомов. Подразумевается, что упомянутые ранее или далее в этом документе фармацевтически приемлемые соли включают терапевтически активные нетоксичные кислотно-аддитивные соли, которые способны образовать соединения формулы (Ia) или формулы (Ib). Упомянутые кислотно-аддитивные соли могут быть получены путем обработки соединений формулы (Ia) или формулы (Ib) в форме оснований подходящими кислотами, например неорганическими кислотами, такими как галогенводородная кислота, в частности соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими как, например, уксусная кислота, гидроксиуксусная кислота,пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, цикламовая кислота, салициловая кислота, парааминосалициловая кислота и памовая кислота. Соединения формулы (Ia) или (Ib), содержащие протоны кислоты, могут быть также преобразованы в их терапевтически активные нетоксичные основно-аддитивные соли путем обработки подходящими органическими или неорганическими основаниями. Подразумевается, что упомянутые ранее или далее в этом документе фармацевтически приемлемые соли включают терапевтически активные нетоксичные аддитивные соли металла или амина (основно-аддитивные соли), которые способны образовать соединения формулы (Ia) или формулы (Ib). Подходящие аддитивные соли оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия,магния и кальция, соли органических оснований, например первичных, вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-нбутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-О-глюкамин, 2-амино-2-(гидроксиметил)-1,3 пропандиол, гибрамин, и соли аминокислот, таких как, например, аргинин и лизин, и тому подобное. И наоборот, указанные кислотно-аддитивные соли и основания могут быть преобразованы в свободные формы путем обработки соответствующим основанием или кислотой. Термин "фармацевтически приемлемая соль" также включает четвертичные аммониевые соли (четвертичные амины), которые соединения формулы (Ia) или формулы (Ib) способны образовать путем взаимодействия между основным атомом азота соединения формулы (Ia) или (Ib) и подходящим кватернизирующим агентом, таким как, например, необязательно замещенный C1-6 алкилгалогенид, арилС 1-6 алкилгалогенид, С 1-6 алкилкарбонилгалогенид, арилкарбонилгалогенид, Het-C1-6 алкилгалогенид или Hetкарбонилгалогенид, например, метилйодид или бензилйодид. Предпочтительно Het представляет собой моноциклический гетероцикл, выбранный из фуранила или тиенила; или бициклический гетероцикл,представляющий собой бензодиоксолил; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен алкилом. Предпочтительно, кватернизирующий агент представляет собой C1-6 алкилгалогенид. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат, ацетат, трифлат, сульфат,сульфонат. Предпочтительным противоионом является йод. Выбранный противоион может быть введен с применением ионообменных смол. В рамках настоящей заявки предполагается, что соединение по настоящему изобретению по определению включает все его стереохимически изомерные формы. Используемый ранее и далее в этом документе термин "стереохимически изомерные формы" описывает все возможные стереоизомерные формы, которые могут принимать соединения формул (Ia) и (Ib), фармацевтически приемлемые соли или физиологически активные производные. Если иное не упоминается или не указано особо, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм. В частности, центры стереоизомерии могут принимать R- или S-конфигурацию; заместители при двухвалентных циклических (частично) насыщенных радикалах могут принимать либо цис-, либо транс-конфигурацию. Соединения, содержащие двойные связи, могут принимать либо Е-(entgegen), либо Z-(zusammen) стереохимическую конфигурацию по упомянутой двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области техники. Подразумевается, что стереохимически изомерные формы соединений формул (Ia) и (Ib) безусловно подпадают под объем настоящего изобретения. Особый интерес представляют стереохимически чистые соединения формулы (Ia) или (Ib). В соответствии с условными обозначениями по номенклатуре CAS, если в молекуле содержатся два стереогенных центра, то идентификатор R или S присваивается хиральному центру с наименьшим номером (по правилу последовательности Кана-Ингольда-Прелога), и он принимается за центр отсчета. Конфигурация второго стереогенного центра обозначается с применением относительных идентификаторов[R,R] или [R,S], где R всегда указывается как центр отсчета, [R,R] обозначает центры с одинаковой хиральностью, и [R,S] обозначает центры с разной хиральностью. Например, если хиральный центр с наименьшим номером в молекуле принимает S-конфигурацию, а второй центр принимает Rконфигурацию, то стереоидентификатор будет выглядеть как S-[R,S]. Если используются обозначения и , то заместитель с наибольшим приоритетом при асимметрическом атоме углерода кольцевой системы с наименьшим номером в кольце, произвольно всегда находится в положении срединной плоскости, определяемой кольцевой системой. Положение заместителя с наибольшим приоритетом при другом асимметрическом атоме углерода в кольцевой системе относительно положения заместителя с наибольшим приоритетом при центре отсчета обозначают как , если заместитель расположен с той же стороны срединной плоскости, определяемой кольцевой системой, или , если он расположен на другой стороне срединной плоскости, определяемой кольцевой системой. Если указана конкретная стереоизомерная форма, то это означает, что упомянутая форма является,по существу, свободной, т.е. она связана меньше чем с 50%, предпочтительно меньше чем с 20%, более предпочтительно меньше чем с 10%, еще более предпочтительно меньше чем с 5%, еще более предпочтительно меньше чем с 2% и наиболее предпочтительно меньше чем с 1% другого(их) изомера(ов). Таким образом, если соединение формулы (Ia) или (Ib), например, обозначено как (R,S), то это означает,что указанное соединение, по существу, свободно от (S,R)-изомера. Соединения любой формулы (Ia) и (Ib) и некоторые из промежуточных соединений неизменно имеют в своей структуре по крайней мере два стереогенных центра, что может привести к образованию,по крайней мере, 4 стереохимически различных структуры. Соединения как формулы (Ia), так и формулы (Ib) могут быть синтезированы в форме смесей, в частности рацемических смесей, энантиомеров, которые могут быть отделены друг от друга с помощью известных в данной области техники методов разделения. Рацемические соединения как формулы (Ia),так и формулы (Ib) могут быть преобразованы в соответствующие диастереомерные солевые формы путем осуществления взаимодействия с подходящей хиральной кислотой. Затем упомянутые диастереомерные солевые формы разделяют, например, путем селективной или фракционной кристаллизации, а энантиомеры высвобождают из них путем обработки щелочью. Альтернативный способ разделения энантиомерных форм соединений как формулы (Ia), так и формулы (Ib) включает жидкостную хроматографию с применением хиральной неподвижной фазы. Упомянутые чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Если требуется конкретный стереоизомер, то указанное соединение предпочтительно синтезируют с применением стереоспецифических способов получения. В указанных способах успешно используют энантиомерно чистые исходные вещества. Подразумевается, что таутомерные формы соединений формулы (Ia) или формулы (Ib) включают такие соединения формулы (Ia) или формулы (Ib), в которых, например, енольная группа преобразуется в кетонную группу (кетоенольная таутомерия). Подразумевается, что таутомерные формы соединений формулы (Ia) и формулы (Ib) или промежуточных соединений по настоящему изобретению подпадают под объем настоящего изобретения. В рамках настоящей заявки предполагается, что соединение по настоящему изобретению по определению включает все изотопные комбинации составляющих его химических элементов. В рамках настоящей заявки химически элемент, в частности упомянутый в связи с соединением в соответствии с формулой (Ia) или (Ib), включает все изотопы и изотопные смеси этого элементов, встречающиеся в природе или нет, с обычной распространенностью в природе или в виде насыщенной изотопами форме. В частности, если упоминается водород, то само собой разумеется, что это относится к 1 Н, 2 Н, 3 Н и их смесям; если упоминается углерод, то само собой разумеется, что это относится к 11 С, 12 С, 13 С, 14 С и их смесям; если упоминается азот, то само собой разумеется, что это относится к 13N, 14N, 15N и их смесям; если упоминается кислород, то само собой разумеется, что это относится к 14O, 15O, 16O, 17O, 18O и их смесям; и если упоминается фтор, то само собой разумеется, что это относится к 18F, 19F и их смесям. Поэтому, соединение по настоящему изобретению по определению включает соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивное соединение, также называемое меченым радиоизотопом соединением, в котором один или несколько нерадиоактивных атомов были заменены одним из его радиоактивных изотопов. Под термином "меченое радиоизотопом соединение" понимают любое соединение в соответствии с формулой (Ia) или (Ib), его фармацевтически приемлемую соль или его N-оксидную форму, которые содержат по крайней мере один радиоактивный атом. Например, соединение может быть мечено позитрон- или гамма-испускающими радиоактивными изотопами. Для методов анализа связывания радиолиганда (метод анализа мембранных рецепторов), обычно вводимыми на замену атомами являются атом 3 Н или атом 125I. Для визуализации наиболее часто используемыми позитрон-испускающими (PET) радиоактивными изотопами являются 11 С, 18F, 15O и 13N, которые все производятся в ускорителях и имеют периоды полураспады, равные 20,100, 2 и 10 мин соответственно. Поскольку периоды полураспада указанных радиоактивных изотопов столь малы, их применение единственно возможно в учреждениях, имеющих ускорители на месте эксплуатации для их получения, ограничивая тем самым их применение. Наиболее широко используемыми из них являются F, 99mTc, 201Tl и 123I. Правила обращения с указанными изотопами, их получение, выделение и включение в состав молекулы известны специалисту в данной области. В частности, радиоактивный атом выбирают из группы, состоящей из атома водорода, углерода,азота, серы, кислорода или галогена. Предпочтительно, радиоактивный атом выбирают из группы, состоящей из атома водорода, углерода и галогена. В частности, радиоактивный изотоп выбирают из группы, состоящей из 3 Н, 11C, 18F, 122I, 123I, 125I,131 75I, Br, 76Br, 77Br и 82Br. Предпочтительно, радиоактивный изотоп выбирают из группы, состоящей из 3 Н, 11 С и 18F. В рамках настоящей заявки алкил предпочтительно представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода. Предпочтительно алкил представляет собой метил или этил. Во всех использованных ранее или далее в этом документе определениях представляющий интерес вариант осуществления алкила представляет собой С 1-6 алкил,который представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил, пентил, гексил, и тому подобное. Предпочтительную подгруппу С 1-6 алкила образует С 1-4 алкил, который представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил и тому подобное. В рамках настоящей заявки галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода. Предпочтительно, галоген представляет собой бром, фтор или хлор; в частности хлор или бром. Первый представляющий интерес вариант осуществления настоящего изобретения относится к соединению формулы (Ia), где р представляет собой целое число, равное 1, 2, 3 или 4;q представляет собой целое число, равное 0, 1, 2, 3 или 4;R1 представляет собой атом водорода, атом галогена;R3 представляет собой арилС 1-6 алкил, арил-О-С 1-6 алкил, арил, ариларил; каждый R4 и R5 независимо представляет собой атом водорода, C1-6 алкил; илиR4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С 1-6 алкилом;R6 представляет собой арил 1 или Het;R7 представляет собой атом водорода, атом галогена, C1-6 алкил, арил или Het; арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, С 1-6 алкила, С 1-6 алкилокси; арил 1 представляет собой фенил, необязательно замещенный заместителем, выбранным из атома галогена, Het;Het представляет собой пиразолил, фуранил, тиенил, пиридинил, хинолинил,бензо[1,3]диоксолил; где Het необязательно замещен С 1-6 алкилом. Второй представляющий интерес вариант осуществления настоящего изобретения относится к соединению формулы (Ib), где р представляет собой целое число, равное 1, 2, 3 или 4;q представляет собой целое число, равное 0, 1, 2, 3 или 4;R1 представляет собой атом водорода, атом галогена;R3 представляет собой арилС 1-6 алкил, арил-О-С 1-6 алкил, арил, ариларил; каждый R4 и R5 независимо представляет собой атом водорода, С 1-6 алкил; илиR4 и R5 могут образовывать вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, которая включает пиперидинил, пиперазинил, где каждый радикал необязательно замещен С 1-6 алкилом;R6 представляет собой арил 1 или Het;R7 представляет собой атом водорода, атом галогена, C1-6 алкил, арил или Het;R8 представляет собой атом водорода или С 1-6 алкил;R8 и R9 образуют вместе радикал -CH=CH-N=; арил представляет собой фенил, нафтил, причем каждый из которых необязательно замещен заместителем, где заместитель независимо выбран из атома галогена, C1-6 алкила, С 1-6 алкилокси; арил 1 представляет собой фенил, необязательно замещенный заместителем, выбранным из атома галогена, Het;Het представляет собой пиразолил, фуранил, тиенил, пиридинил, хинолинил, бензо[1,3]диоксолил,где Het необязательно замещен С 1-6 алкилом. Третий представляющий интерес вариант осуществления настоящего изобретения относится к со-6 022344 единению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R1 представляет собой атом водорода, атом галогена,арил, Het, алкил или алкилалкокси; более конкретно R1 представляет собой атом водорода или атом галогена. Более предпочтительно, R1 представляет собой атом галогена, в частности, атом брома. Четвертый представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где р равно 1. Пятый представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R2 представляет собой C1-6 алкилокси. Более конкретно, R2 представляет собой C1-6 алкилокси, предпочтительно метилокси. Шестой представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R3 представляет собой арил-O-C1-6 алкил, арил, ариларил; в частности R3 представляет собой арил-O-С 1-6 алкил; или R3 представляет собой арил. Седьмой представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где q равно 1, 3 или 4. Восьмой представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R4 и R5 каждый независимо представляет собой атом водорода или С 1-6 алкил, в частности C1-6 алкил, более конкретно метил или этил. Предпочтительно R4 и R5 представляют собой метил. Девятый представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R4 и R5 образуют вместе с атомом азота, к которому они присоединены, радикал, выбранный из группы, состоящей из пиперидино, пиперазино, причем каждое из упомянутых колец необязательно замещено С 1-6 алкилом; более конкретно пиперидино или пиперазино, необязательно замещенное С 1-4 алкилом. Десятый представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R6 представляет собой Het или необязательно замещенный фенил; в частности Het или фенил, необязательно замещенный атомом галогена, Het; более конкретно Het или фенил, необязательно замещенный атомом галогена или Het, где Het предпочтительно представляет собой пиридил, тиенил, фуранил, хинолинил или пиразолил, причем каждое из представляющих Het колец необязательно замещено С 1-6 алкилом; еще более конкретно бензо[1,3]диоксолил или фенил, необязательно замещенный атомом галогена или Het, где Het предпочтительно представляет собой пиридил, тиенил, фуранил, хинолинил или пиразолил, причем каждое из представляющих Het колец необязательно замещено С 1-6 алкилом. Одиннадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или(Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R7 представляет собой атом водорода. Двенадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или(Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где соединение представляет собой соединение формулы (Ia). Тринадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или(Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где соединение представляет собой соединение формулы (Ib), и где R8 представляет собой атом водорода, и R9 представляет собой оксо. Четырнадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где соединение представляет собой соединение формулы (Ib), в частности где R8 представляет собой алкил, более предпочтительно С 1-6 алкил, например метил. Пятнадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или(Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где арил представляет собой нафтил или фенил, более предпочтительно фенил, причем каждый необязательно замещен одним или несколькими заместителями, выбранными из атома галогена,например атома хлора; алкила, например метила; или алкилокси, например метилокси. Шестнадцатый представляющий вариант осуществления относится к соединению формулы (Ia) или(Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, где R1 находится в 6-положении хинолинового кольца. В рамках настоящей заявки хинолиновое кольцо соединений формулы (Ia) или (Ib) пронумеровано следующим образом: Семнадцатый представляющий вариант осуществления относится к применению соединения формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения бактериальной инфекции грамположительными и/или грамотрицательными бактериями, предпочтительно бактериальной инфекции грамотрицательными бактериями. Восемнадцатый представляющий вариант осуществления относится к применению соединения формулы (Ia) или (Ib) или к любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения бактериальной инфекции, где соединение формулы (Ia) или (Ib) имеет значение IC9015 мкл/мл в отношении по крайней мере одной бактерии, в частности грамположительной бактерии; предпочтительно IC9010 мкл/мл; более предпочтительно IC905 мкл/мл; при этом значение IC90 определяют, как описано ниже в этом документе. Предпочтительно, в соединениях формулы (Ia) или (Ib) или в любой его подгруппе, указанной ранее в этом документе как представляющий интерес вариант осуществления, термин "алкил" представляет собой С 1-6 алкил, более предпочтительно С 1-4 алкил. Предпочтительно, соединение формулы (Ia) или (Ib) представляет собой конкретную смесь энантиомеров (указываемую здесь и далее в этом документе как конкретный А или В диастереоизомер), и следовательно, по существу, чистую от другого (других) диастереоизомера (диастереоизомеров). В том случае, если соединение формулы (Ia) или (Ib) имеет два хиральных центра, это означает, что соединение представляет собой смесь, в частности рацемическую смесь, (R,S) и (S,R) энантиомеров, или смесь, в частности рацемическую смесь, (R,R) и (S,S) энантиомеров. Здесь и далее в этом документе смеси, в частности рацемические смеси, двух энантиомеров обозначают как диастереоизомер А или В. Обозначение рацемической смеси как А или В зависит от того, первым (т.е. А) или вторым (т.е. В) оно выходит в процессе методики разделения. Более предпочтительно, соединение формулы (Ia) или (Ib) представляет собой конкретный энантиомер (по существу, свободный от других энантиомеров). В том случае, если соединение формулы (Ia) или (Ib) имеет два хиральных центра, это означает, что соединение представляет собой (R,S), (S,R), (R,R) или (S,S) энантиомер. Здесь и далее в этом документе упомянутые конкретные энантиомеры обозначают как А 1, А 2, В 1 или В 2. Обозначение энантиомера как А 1, А 2, В 1 или В 2 зависит от того, первым или вторым (1 или 2) оно выходит в процессе методики разделения и разделяется отA (Al, A2) или В (B1, B2) диастереоизомера. Предпочтительные соединения по настоящему изобретению выбирают из включая их любую стереохимически изомерную форму, их N-оксид, их фармацевтически приемлемую соль или их сольват. В частности, предпочтительными соединениями формулы (Ia) или (Ib) являются соединения 7, 9, 10 и 29 (см. представленные далее в этом документе таблицы), их фармацевтически приемлемая соль, их сольват или их N-оксидная форма; или соединения 29, 23, 34, 11, 4, 52 и 30 (см. представленные далее в этом документе таблицы), их фармацевтически приемлемая соль, их сольват или их N-оксидная форма. Фармакология Неожиданно было обнаружено, что соединения по настоящему изобретению применимы для лечения бактериальных заболеваний, включая микобактериальные заболевания, в частности заболевания,которые вызываются такими патогенными микобактериями, как Mycobacterium tuberculosis (включая его латентную и резистентную к лекарствам форму), М. bovis, M. leprae, M. avium и М. marinum. Таким образом, настоящее изобретение относится также к указанным здесь и ранее в этом документе соединениям формулы (Ia) или (Ib), их фармацевтически приемлемым солям, их сольватам или их N-оксидным формам, для применения в качестве лекарственного средства, в частности для применения в качестве лекарственного средства для лечения бактериальной инфекции, включая микобактериальную инфекцию. Кроме того, настоящее изобретение также относится к применению соединений формулы (Ia) или(Ib), их фармацевтически приемлемых солей, их сольватов или их N-оксидных форм, а также любых их фармацевтических композиций, описанных здесь и далее в этом документе, для получения лекарственного средства, предназначенного для лечения бактериальной инфекции, включая микобактериальную инфекцию. Соответственно, в соответствии с другим аспектом настоящее изобретение относится к способу лечения пациента, страдающего от бактериальной инфекцией (включая микобактериальную инфекцию) или рискующего ей заболеть, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции в соответствии с настоящим изобретением. Помимо их активности в отношении микобактерий соединения по настоящему изобретению также активны в отношении других бактерий. В общем, бактериальные патогены могут быть отнесены к грамположительным или грамотрицательным патогенам. Антибиотические соединения, активные как в отношении грамположительных, так и в отношении грамотрицательных патогенов, как правило, рассматривают в качестве соединений, обладающих широким спектром действия. Соединения по настоящему изобретению рассматривают как активные в отношении грамположительных и/или грамотрицательных бактериальных патогенов, в частности в отношении грамположительных бактериальных патогенов. В частности, соединения по настоящему изобретению активны в отношении по крайней мере одной грамположительной бактерии, предпочтительно активны в отношении нескольких грамположительных бактерий, более предпочтительно активны в отношении одной или нескольких грамположительных и/или одной или нескольких грамотрицательных бактерий. Соединения по настоящему изобретению обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и/или грамотрицательных аэробных и анаэробных бактерий включают стафилококки, например S. aureus; энтерококки, например Е. faecalis; стрептококки, например S.pneumoniae, S. mutans, S. pyogens; бациллы, например Bacillus subtilis; листерии, например Listeria monocytogenes; возбудителей гемофильной инфекции, например Н. influenza; моракселлы, например М. catarrhalis; псевдомонады, например Pseudomonas aeruginosa; и эшерихии, например Е. coli. Особенно важны грамположительные патогены, например стафилококки, энтерококки и стрептококки, вследствие развития резистентных штаммов, которые одинаково трудно подвергаются лечению и уничтожению, например, в условиях стационара после заражения ими. Примерами таких штаммов являются резистентный к метициллину Staphylococcus aureus (MRSA), резистентные к метициллину коагулаза-негативные стафилококки (MRCNS), резистентный к пенициллину Streptococcus pneumoniae и мультирезистентный к лекарствам Enterococcus faecium. Соединения по настоящему изобретению также проявляют активность в отношении резистентных бактериальных штаммов. Соединения по настоящему изобретению особенно активны в отношении Streptococcus pneumoniae,Staphylococcus aureus, включая резистентные формы Staphylococcus aureus, таких как, например, резистентный к метициллину Staphylococcus aureus (MRSA). Поэтому, настоящее изобретение также относится к применению соединений формулы (Ia) или (Ib),их фармацевтически приемлемых солей, их сольватов или их N-оксидных форм, а также любых их фармацевтических композиций, описанных здесь и далее в этом документе, для получения лекарственного средства, предназначенного для лечения бактериальной инфекции, включая инфекцию, вызванную ста-9 022344 филококками и/или стрептококками. Соответственно, в соответствии с другим аспектом настоящее изобретение относится к способу лечения пациента, страдающего от бактериальной инфекцией (включая инфекцию, вызванную стафилококками и/или стрептококками) или рискующего ей заболеть, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции в соответствии с настоящим изобретением. Не связывая себя какой-либо теорией, авторы настоящего изобретения полагают, что активность соединений по настоящему изобретению заключается в ингибировании F1F0 АТФ-синтазы, в частности в ингибировании F0-комплекса F1F0 АТФ-синтазы, более конкретно в ингибировании субъединицы сF0-комплекса F1F0 АТФ-синтазы, которое приводит к уничтожению бактерий за счет снижения содержания АТФ в бактерии. Поэтому, соединения по настоящему изобретению активны, в частности, в отношении тех бактерий, выживаемость которых зависит от правильного функционирования F1F0 АТФсинтазы. Бактериальные инфекции, которые могут подвергаться лечению соединениями по настоящему изобретению, включают, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый отит среднего уха, инфекции краниальных синусов, глазные инфекции, инфекции ротовой полости, такие как инфекции зубов, десен и слизистых оболочек, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, мочеполовые инфекции, инфекции желудочно-кишечного тракта, гинекологические инфекции, сепсис, инфекции костей и сустав, кожные инфекции и инфекции структур кожи, бактериальный эндокардит, ожоги, антибактериальную профилактику в хирургии и антибактериальную профилактику пациентов с иммуносупрессией, таких как пациенты, получающие противораковую химиотерапию, или пациенты с пересаженными органами. Вне зависимости от упоминания ранее, здесь или далее в этом документе способности соединений лечить бактериальную инфекцию, понимают, что соединения могут лечить инфекции, вызванные одним или несколькими бактериальными штаммами. Настоящее изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по настоящему изобретению в качестве активного ингредиента. Соединения по настоящему изобретению могут быть включены в состав различных фармацевтических форм для введения. В качестве подходящих композиций могут быть перечислены все композиции, обычно используемые для системного введения лекарств. Для приготовления фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения,необязательно в форме аддитивной соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, причем носитель может принимать целый ряд форм в зависимости от формы предназначенного для введения препарата. Указанные фармацевтические композиции желательны в виде стандартной лекарственной формы, в частности, для введения перорально или путем парентеральной инъекции. Например, при приготовлении композиции в виде пероральной лекарственной формы могут использоваться любые обычные фармацевтические среды, такие как, например,вода, гликоли, масла, спирты, и тому подобное, в случае жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры, эмульсии или растворы; или твердые носители, такие как крахмалы, сахара,каолин, разбавители, смазывающие средства, связующие вещества, разрыхлители и тому подобное, в случае порошков, пилюль, капсул и таблеток. Ввиду легкости их введения таблетки и капсулы являются наиболее удобными пероральными лекарственными формами, и в этом случае, безусловно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по крайней мере, в значительной части, хотя могут быть добавлены и другие ингредиенты, например, вещества, способствующие улучшению растворимости. Могут быть приготовлены, например, растворы для инъекций, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть приготовлены суспензии для инъекций,и в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты, и тому подобное. В настоящее изобретение также включены препараты в виде твердых форм, которые предназначены для преобразования в препараты в виде жидких форм непосредственно перед применением. В зависимости от способа введения фармацевтические композиции предпочтительно содержат от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активного ингредиента, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, от 50 до 99% фармацевтически приемлемого носителя, при этом содержание в процентах дано по отношению к общей массе композиции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области техники, например, смазывающее средство, стабилизатор, буферное вещество, эмульгатор, регулятор вязкости, поверхностно-активное вещество, консервант, ароматизатор или краситель. Наиболее предпочтительно приготавливать упомянутые выше фармацевтические композиции в виде стандартной лекарственной формы с целью облегчения введения и обеспечения однородности дозировки. Используемое в этом документе выражение "стандартная лекарственная форма" относится к фи- 10022344 зически дискретным единицам, пригодным в качестве однократных дозировок, при этом каждая единица содержит определенное количество активного ингредиента, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами подобных стандартных лекарственных форм являются таблетки (в том числе таблетки с насечками или таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, инъецируемые растворы или суспензии, и тому подобное, и их разделенные составные части. Суточная доза соединения по настоящему изобретению, безусловно, варьирует в зависимости от используемого соединения, способа введения, требуемого лечения и выявленного микобактериального заболевания. Однако, как правило,удовлетворительные результаты получают, если соединение по настоящему изобретению вводят в дневной дозе, не превышающей 1 г, например в диапазоне от 10 до 50 мг/кг массы тела. Учитывая, что соединения формулы (1 а) или формулы (1b) активны в отношении бактериальных инфекций, соединения по настоящему изобретению могут быть объединены с другими антибактериальными средствами для эффективной борьбы с бактериальными инфекциями. Поэтому, настоящее изобретение также относится к комбинации (а) соединения по настоящему изобретению и (b) одного или нескольких других антибактериальных средств. Настоящее изобретение также относится к комбинации (а) соединения по настоящему изобретению и (b) одного или нескольких других антибактериальных средств для применения в качестве лекарственного препарата. Настоящее изобретение также относится к применению сочетания или определенной выше фармацевтической композиции для лечения бактериальной инфекции. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество (а) соединения по настоящему изобретению и (b) одного или нескольких других антибактериальных средств в качестве активного ингредиента, также включена в настоящее изобретение. Массовое соотношение вводимых в сочетании (а) соединения по настоящему изобретению и (b) другого (других) антибактериального (антибактериальных) средства (средств) может быть установлено специалистом в данной области техники. Упомянутое соотношение и точная дозировка и частота введения зависят от конкретно используемого соединения по настоящему изобретению и другого (других) антибактериального (антибактериальных) средства (средств), подвергаемого лечению конкретного состояния, тяжести подвергаемого лечению состояния, возраста, массы, пола, рациона питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другого лекарственного средства, которое может получать пациент, что хорошо известно специалистам в данной области техники. Кроме того, очевидно, что эффективное суточное количество может быть снижено или увеличено в зависимости от ответа подвергаемого лечению пациента и/или в зависимости от оценки врача, который назначает соединения по настоящему изобретению. Конкретное массовое соотношение соединения по настоящему изобретению формулы (Ia) или (Ib) и другого антибактериального средства может варьировать от 1/10 до 10/1, более конкретно от 1/5 до 5/1, еще более конкретно от 1/3 до 3/1. Соединения по настоящему изобретению и одно или несколько других антибактериальных средств могут быть объединены в едином препарате, или могут быть включены в состав отдельных препаратов,так что они могут быть введены одновременно, раздельно или последовательно. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение по настоящему изобретению и (b) одно или несколько других антибактериальных средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении бактериальной инфекции. Другими антибактериальными средствами, которые могут быть объединены с соединениями формулы (Ia) или формулы (Ib), являются, например, известные в данной области техники антибактериальные средства. Другие антибактериальные средства включают антибиотики -лактамовой группы, такие как натуральные пенициллины, полусинтетические пенициллины, натуральные цефалоспорины, полусинтетические цефалоспорины, цефамицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как N-нуклеозиды, С-нуклеозиды, карбоциклические нуклеозиды, бластицидин S; макролиды, такие как 12-членные кольцевые макролиды, 14-членные кольцевые макролиды, 16-членные кольцевые макролиды; ансамицины; пептиды, такие как блеомицины, грамицидины, полимиксины, бацитрацины, крупные циклические пептидные антибиотики, содержащие лактоновые связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацидины, микамицин, неокарциностатин, стендомицин, биомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин А; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; монензины; пирролнитрин; фосфомицин; фузидиевую кислоту; D-(парагидроксифенил)глицин; D-фенилглицин; энедиины. Конкретными антибиотиками, которые могут быть объединены с соединениями по настоящему изобретению формулы (Ia) или формулы (Ib), являются, например, бензилпенициллин (калий, прокаин,бензатин), феноксиметилпенициллин (калий), фенетициллин калий, пропициллин, карбенициллин (динатрий, фенил натрий, инданил натрий), сульбенициллин, тикарциллин динатрий, метициллин натрий,оксациллин натрий, клоксациллин натрий, диклоксациллин, флуклоксациллин, ампициллин, мезлоцил- 11022344 лин, пиперациллин натрий, амоксициллин, циклациллин, гектациллин, сульбактам натрий, талампициллин гидрохлорид, бакампициллин гидрохлорид, пивмециллинам, цефалексин, цефаклор, цефалоглицин,цефадроксил, цефрадин, цефроксадин, цефапирин натрий, цефалотин натрий, цефацетрил натрий, цефсулодин натрий, цефалоридин, цефатризин, цефоперазон натрий, цефамандол, вефотиам гидрохлорид,цефазолин натрий, цефтизоксим натрий, цефотаксим натрий, цефменоксим гидрохлорид, цефуроксим,цефтриаксон натрий, цефтазидим, цефокситин, цефметазол, цефотетан, латамоксеф, клавулановая кислота, имипенем, азтреонам, тетрациклин, хлортетрациклин гидрохлорид, диметилхлортетрациклин, окситетрациклин, метациклин, диоксициклин, ролитетрациклин, миноциклин, даунорубицин гидрохлорид,доксорубицин, акларубицин, канамицин сульфат, беканамицин, тобрамицин, гентамицин сульфат, дибекацин, амикацин, микрономицин, рибостамицин, неомицин сульфат, паромомицин сульфат, стрептомицин сульфат, дигидрострептомицин, дестомицин А, гигромицин В, апрамицин, сизомицин, нетилмицин сульфат, спектиномицин гидрохлорид, астромицин сульфат, валидамицин, касугамицин, полиоксин, бластицидин S, эритромицин, эритромицин эстолат, олеандомицин фосфат, трацетилолеандомицин, китазамицин, джозамицин, спирамицин, тилозин, ивермектин, мидекамицин, блеомицин сульфат, пепломицин сульфат, грамицидин S, полимиксин В, бацитрацин, колистин сульфат, колистин метасульфонат натрий,энтрамицин, микамицин, виргиниамицин, капреомицин сульфат, биомицин, энвиомицин, ванкомицин,актиномицин D, неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, салиномицин, амфотерицин В, нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицин пальмитат гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникол пальмитат, митомицин С, пирролнитрин, фосфомицин, фузидиевая кислота, бикозамицин,тиамулин, сикканин. Другими микобактериальными средствами, которые могут быть объединены с соединениями формулы (Ia) или формулы (Ib), являются, например, рифампицин (=рифампин); изониазид; пиразинамид; амикацин; этионамид; этамбутол; стрептомицин; пара-аминосалициловая кислота; циклосерин; капреомицин; канамицин; тиоацетазон; РА-824; хинолоны/фторхинолоны, такие как, например, моксифлоксацин, гатифлоксацин, офлоксацин, ципрофлоксацин, спарфлоксацин; макролиды, такие как, например,кларитромицин, клофазимин, амоксициллин с клавулановой кислотой; рифамицины; рифабутин; рифапентин; раскрытые в WO 2004/011436 соединения. Общие способы получения Соединения по настоящему изобретению, как правило, могут быть получены в последовательности стадий, каждая из которых известна специалисту в данной области техники. Исходные вещества и промежуточные соединения представляют собой соединения, которые либо являются коммерчески доступными, либо могут быть получены в соответствии с традиционными методиками проведения реакций, как правило, известными в данной области техники. Например, соединения формулы (Ia) или (Ib) могут быть получены в соответствии со способами, описанными в WO 2004/011436, WO 2005/070924, WO 2005/070430 или WO 2005/075428, содержание которых включено в этот документ посредством ссылки. В частности, соединения формулы (Ia) или (Ib) могут быть получены путем осуществления взаимодействия промежуточного соединения формулы (IIa) или (IIb) с промежуточным соединением формулы(III) в соответствии со следующей реакционной схемой (1): Схема 1 с применением nBuLi в смеси подходящего основания, такого как, например, диизопропиламин, и подходящего растворителя, такого как, например, тетрагидрофуран, где все переменные характеристики определены для формулы (Ia) или (Ib). Перемешивание может увеличивать скорость реакции. Взаимодействие может быть удобным образом осуществлено при температуре в диапазоне от -20 до -70 С. Соединения формулы (Ia) или (Ib), где R6 представляет собой замещенный Het фенил и где R3 представляет собой алкил, арилалкил, арил, Het, Het-алкил или причем упомянутый R3 представлен R3', и упомянутые соединения представлены формулой (Ia-1) или (Ib-1), могут быть получены путем осуществления взаимодействия промежуточного соединения формулы (IV-a) или (IV-b), где W1 представляет собой подходящую уходящую группу, такую как, на- 12022344 пример, атом галогена, например атом хлора или брома, с Het-B(OH)2 в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, в присутствии подходящего основания, такого как, например,Na2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME), и спирта, например метанола, в соответствии со следующей реакционной схемой (2): Схема 2 Соединения формулы (Ia) или (Ib), где q равно 2, 3 или 4, причем упомянутые соединения представлены формулой (Ia-2) или (Ib-2), могут быть получены путем осуществления взаимодействия промежуточного соединения формулы (V-a) или (V-b), где q' равно 0, 1 или 2, с первичным или вторичным амином HNR4R5 в присутствии подходящего катализатора, такого как, например, Rh(cod)2BF4, необязательно в присутствии второго катализатора (для восстановления), такого как, например, Ir(cod)2BF4, в присутствии подходящего лиганда, такого как, например, Xantphos, в подходящем растворителе, таком как, например, тетрагидрофуран и спирт, например, метанол, в присутствии СО и Н 2 (под давлением) при повышенной температуре. Эту реакцию предпочтительно проводят для получения промежуточных соединений формулы (V), где q' равно 1. Соединения формулы (Ia) или (Ib) также могут быть получены путем осуществления взаимодействия промежуточного соединения формулы (VI-a) или (VI-b), где W2 представляет собой подходящую уходящую группу, такую как, например, атом галогена, например, атом хлора или брома, с подходящим первичным или вторичным амином HNR4R5, необязательно в присутствии подходящего растворителя,такого как, например, ацетонитрил. Считается, что определение подходящих температур, разбавлений и продолжительности реакций для оптимизации представленных выше схем получения желаемого соединения находится в пределах знаний специалиста в данной области техники. Соединения формулы (Ia) или (Ib), кроме того, могут быть получены путем преобразования соединений формулы (Ia) или (Ib) друг в друга в соответствии с известными в данной области техники реакциями трансформации функциональных групп. Соединения формулы (Ia) или (Ib) могут быть преобразованы в соответствующие N-оксидные формы, следуя известным в данной области техники методикам преобразования трехвалентного азота в егоN-оксидную форму. Упомянутая реакция N-окисления, как правило, может быть осуществлена путем осуществления взаимодействия исходного вещества формулы (Ia) или (Ib) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пе- 13022344 роксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например, 3 хлорбензолкарбопероксикислота, пероксоалкановые кислоты, например пероксиуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и тому подобное, углеводороды, например толуол, кетоны, например 2-бутанон, галогензамещенные углеводороды, например дихлорметан и смеси таких растворителей. Соединения формулы (Ia) или (Ib), где R1 представляет собой атом галогена, например атом брома,могут быть преобразованы в соединения формулы (Ia) или (Ib), где R1 представляет собой Het, путем осуществления взаимодействия с Het-B(OH)2 в присутствии подходящего катализатора, такого как, например, Pd(OAc)2 или Pd(PPh3)4, в присутствии подходящего основания, такого как, например, K3PO4 илиNa2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME). По аналогии соединения формулы (Ia) или (Ib), в которых R1 представляет собой атом галогена, например атом брома, могут быть преобразованы в соединения формулы (Ia) или (Ib), в которых R1 представляет собой алкил, например метил, путем обработки подходящим алкилирующим агентом, таким как СН 3 В(ОН)2 или (CH3)4Sn в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, в подходящем растворителе, таком как, например, толуол или 1,2-диметоксиэтан (DME). Соединения формулы (Ia) или (Ib), где R1 представляет собой атом галогена, в частности атом брома, могут быть преобразованы в соединения формулы (Ia) или (Ib), где R1 представляет собой атом водорода, путем осуществления взаимодействия с HCOONH4 в присутствии подходящего катализатора, такого как, например, палладированный уголь, и в присутствии подходящего растворителя, такого как, например, спирт, например, метанол. Те же условия реакции могут быть использованы для преобразования соединения формулы (Ia) или (Ib), где R4 представляет собой бензил, в соединение формулы (Ia) или (Ib),где R4 представляет собой атом водорода. Соединения формулы (Ia) или (Ib), где R6 представляет собой замещенный атомом галогена фенил,могут быть преобразованы в соединение формулы (Ia) или (Ib), где R6 представляет собой замещенныйHet фенил, путем осуществления взаимодействия с Het-B(OH)2 в присутствии подходящего катализатора,такого как, например, Pd(PPh3)4, в присутствии подходящего основания, такого как, например, Na2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME), и спирта, например метанола. Соединение формулы (Ia), где R2 представляет собой метокси, может быть преобразовано в соответствующее соединение формулы (Ib), где R8 представляет собой атом водорода, и R9 представляет собой оксо, путем гидролиза в присутствии подходящей кислоты, такой как, например, соляная кислота, и подходящего растворителя, такого как, например, диоксан. Соединения формулы (Ia) или (Ib) могут быть также преобразованы в четвертичный амин путем осуществления взаимодействия с подходящим кватеринизирующим агентом, таким как, например, необязательно замещенный С 1-6 алкилгалогенид, арилС 1-6 алкилгалогенид, С 1-6 алкилкарбонилгалогенид,арилкарбонилгалогенид, Het1C1-6 алкилгалогенид или Het1 карбонилгалогенид, например метилйодид или бензилйодид, в присутствии подходящего растворителя, такого как, например, ацетон, где Het1 представляет собой фуранил или тиенил; или бициклический гетероцикл, выбранный из бензофуранила и бензотиенила; причем каждый моноциклический или бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, при этом каждый заместитель независимо выбирают из группы, состоящей из атома галогена, С 1-6 алкила и арила. Упомянутые четвертичные амины представлены ниже формулой, где R10 представляет собой C1-6 алкил, С 1-6 алкилкарбонил, арилС 1-6 алкил, арилкарбонил,Het1C1-6 алкил или Het1 карбонил, и где А- представляет собой фармацевтически приемлемый противоион,такой как, например, йодид. Очевидно, что в предшествующих и в последующих реакциях продукты реакции могут быть выделены из реакционной среды и, при необходимости, дополнительно очищены в соответствии с общеизвестным в данной области техники методологиям, таким как экстракция, кристаллизация и хроматография. Также очевидно, что продукты реакции, которые существуют более чем в одной энантиомерной форме,могут быть выделены из их смеси при помощи известных методик, в частности препаративной хроматографии, такой как препаративная ВЭЖХ, хиральная хроматография. Отдельные диастереоизомеры или отдельные энантиомеры могут быть также получены при помощи суперкритической жидкостной хрома- 14022344 тографии (SCF). Исходные вещества или промежуточные соединения представляют собой соединения, которые либо являются коммерчески доступными, либо могут быть получены в соответствии с традиционными методиками проведения реакций, как правило, известными в данной области техники. Например, промежуточные соединения формулы (II-а) или (II-b) или (III) могут быть получены в соответствии со способами,описанными в WO 2004/011436, WO 2005/070924, WO 2005/070430 или WO 2005/075428, содержание которых включено в этот документ посредством ссылки. В частности, промежуточные соединения формулы (II-а) могут быть получены в соответствии со следующей реакционной схемой (3): Схема 3 где все переменные характеристики определены для формулы (Ia). Реакционная схема (3) включает стадию (а), на которой осуществляют взаимодействие соответствующим образом замещенного анилина с подходящим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или пара-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего инертного в отношении реагентов растворителя, такого как метиленхлорид или этилендихлорид. Взаимодействие может быть подходящим образом осуществлено при температуре в диапазоне от комнатной температуры до температуры возгонки. На следующей стадии (b) осуществляют взаимодействие аддукта, полученного на стадии (а), с фосфорилхлоридом (POCl3) в присутствии N,Nдиметилформамида (формилирование по Вильсмейеру-Хааку с последующей циклизацией). Взаимодействие может быть подходящим образом осуществлено при температуре в диапазоне от комнатной температуры до температуры возгонки. На следующей стадии (с-1) путем осуществления взаимодействия промежуточного соединения, полученного на стадии (b), с O-С 1-6 алкилом в присутствии подходящего растворителя, такого как, например, НО-С 1-6 лкил, вводят определенную группу R2, где R2 представляет собой, например, C1-6 алкилокси. Промежуточное соединение, полученное на стадии (b), также может быть преобразовано в промежуточное соединение, где R2 означает, например, С 1-6 алкилтио-радикал, путем осуществления взаимодействия с S=C(NH2)2 в присутствии подходящего растворителя, такого как,например, спирт, например этанол, или водно-спиртовой смеси, необязательно в присутствии подходящего основания, такого как, например, KOH (стадия (с-2, с последующим осуществлением взаимодействия с С 1-6 алкил-1 в присутствии подходящего основания, такого как, например, K2CO3, и подходящего растворителя, такого как, например, 2-пропанон (стадия (d. Промежуточное соединение, полученное на стадии (b), также может быть преобразовано в промежуточное соединение, где R2 представляет собойN(R2a) (алкил), где R2a представляет собой водород или алкил, путем осуществления взаимодействия с подходящей солью NH(R2a) (алкила) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя, такого как, например, ацетонитрил (стадия (с-3. Промежуточное соединение, полученное на стадии (b), также может быть преобразовано в промежуточное соединение, где R2 представляет собой С 1-6 алкилоксиС 1-6 алкилокси, необязательно замещенный С 1-6 алкилокси,причем упомянутый R2 представлен R2b, путем осуществления взаимодействия с С 1-6 алкилоксиС 1-6 алкилОН, необязательно замещенным С 1-6 алкилокси, в присутствии NaH и подходящего растворителя, такого как, например, тетрагидрофуран (стадия (с-4. Промежуточные соединения формулы (IIa), где R2 и R7 представляют собой атом водорода, причем упомянутые промежуточные соединения представлены формулой (IIa-5), могут быть получены в соот- 15022344 ветствии со следующей реакционной схемой (4), где на первой стадии (а) осуществляют взаимодействие замещенного индол-2,3-диона с необязательно замещенным 3-фенилпропиональдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция по Пфитцингеру), после чего на последующей стадии (b) карбоновую кислоту декарбоксилируют при высокой температуре в присутствии подходящего инертного в отношении реагентов растворителя, такого как дифениловый эфир. Схема 4 Промежуточные соединения формулы (На), где R6 представляет собой Het, причем упомянутые промежуточные соединения представлены формулой (IIa-6), могут быть получены в соответствии со следующей реакционной схемой 4 а: Схема 4 а Реакционная схема (4 а) включает стадию (а), в которой осуществляют взаимодействие подходящего хинолинового фрагмента с Het-C(=O)-H с применением nBuLi в смеси подходящего основания, такого как, например, 2,2,6,6-тетраметилпиперидин, и подходящего растворителя, такого как, например, тетрагидрофуран. Перемешивание может увеличивать скорость реакции. Взаимодействие может быть удобным образом осуществлено при температуре в диапазоне от -20 до -70 С. На следующей стадии (b) продукт, полученный на стадии (а), преобразуют в промежуточное соединение формулы (IIa-6) путем осуществления взаимодействия с подходящей кислотой, такой как, например, трифторуксусная кислота, и триизопропилсиланом в присутствии подходящего растворителя, такого как, например, метиленхлорид. Промежуточные соединения формулы (IIb), в частности (IIb-1) или (IIb-2), могут быть получены в соответствии со следующей реакционной схемой (5). Схема 5 Реакционная схема (5) включает стадию (а), в которой хинолиновый фрагмент преобразуют в хинолиноновый фрагмент путем осуществления взаимодействия с подходящей кислотой, такой как, например, соляная кислота. На следующей стадии (b) вводят заместитель R8 путем осуществления взаимодействия промежуточного соединения, полученного на стадии (а), с подходящим алкилирующим агентом,таким как, например, алкилйодид, например метилйодид, в присутствии подходящего основания, такого как, например, NaOH или хлорид бензилтриэтиламмония, и подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (IIb), где R8 и R9 образуют вместе радикал -CH=CH-N=, причем упомянутые промежуточные соединения представлены формулой (IIb-3), могут быть получены в соответствии со следующей реакционной схемой (6). Схема 6 Реакционная схема (6) включает стадию (а), в которой осуществляют взаимодействие промежуточного соединения с NH2-CH2-СН(ОСН 3)2. На следующей стадии (b) путем осуществления взаимодействия с уксусной кислотой в присутствии подходящего растворителя, такого как, например, ксилол, образуется конденсированный имидазолильный фрагмент. Промежуточные соединения формулы (III) представляют собой соединения, которые либо являются коммерчески доступными, либо могут быть получены в соответствии с традиционными методиками проведения реакций, как правило, известными в данной области техники. Например, промежуточные соединения формулы (III) могут быть получены в соответствии со следующей реакционной схемой (7): Реакционная схема (7) включает стадию (а), в которой в реакции Фриделя-Крафтса осуществляют взаимодействие R3, в частности подходящим образом замещенного арила, более конкретно подходящим образом замещенного фенила, с подходящим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4 хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как, например, AlCl3, FeCl3,SnCl4, TiCl4 или ZnCl2, и подходящего инертного в отношении реагентов растворителя, такого как метиленхлорид или этилендихлорид. Взаимодействие может быть удобным образом осуществлено при температуре в диапазоне от комнатной температуры до температуры возгонки. На следующей стадии (b) путем осуществления взаимодействия промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином (HNR4R5) вводят аминогруппу (-NR4R5). Промежуточные соединения формулы (III) также могут быть получены в соответствии со следующей реакционной схемой (7 а): Схема 7 а Реакционная схема (7 а) включает стадию (а), в которой осуществляют взаимодействие R-W4, гдеW4 представляет собой подходящую уходящую группу, такую как, например, атом галогена, например атом хлора или брома, в частности подходящим образом замещенного арила, более конкретно подходящим образом замещенного нафтила, например 2-бромнафталина, с подходящим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид или 5-бромпентаноилхлорди, в присутствии Mg,I2 и подходящего растворителя, такого как, например, тетрагидрофуран. Взаимодействие может быть удобным образом осуществлено при температуре в диапазоне от комнатной температуры до температуры возгонки. На следующей стадии (b) путем осуществления взаимодействия промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином (HNR4R5) в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например,K2CO3, вводят аминогруппу (-NR4R5). Промежуточные соединения формулы (III) также могут быть получены в соответствии со следующей реакционной схемой (8): Схема 8 Реакционная схема (8) включает стадию (а), в которой осуществляют взаимодействие R3-C(=O)-H,например, подходящим образом замещенного арилкарбоксальдегида, более конкретно подходящим образом замещенного фенил- или нафтилкарбоксальдегида, с подходящим промежуточным соединением,таким как, например, 1-бром-4-хлорбутан, в присутствии реактива Гриньяра и подходящего растворителя, такого как, например, диэтиловый эфир, тетрагидрофуран. Взаимодействие может быть удобным образом осуществлено при низкой температуре, например, при 5 С. На следующей стадии (b) осуществляют окисление в присутствии реактива Джонса в подходящем растворителе, таком как, например, ацетон. На следующей стадии (с) путем осуществления взаимодействия промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3, вводят аминогруппу (-NR4R5). В качестве альтернативы промежуточные соединения формулы (III) могут быть получены в соответствии со следующей реакционной схемой (9): Схема 9 Реакционная схема (9) включает стадию (а), в которой осуществляют взаимодействие подходящей кислоты с NH(CH3)(OCH3) в присутствии 1,1'-карбонилдиимидазола и подходящего растворителя, такого как, например, CH2Cl2. На следующей стадии (b) осуществляют взаимодействие продукта, полученного на стадии (а), с подходящим реактивом Гриньяра, например, с 4-хлорбутилмагнийбромидом, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. На следующей стадии (с) путем осуществления взаимодействия промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3, вводят аминогруппу (-NR4R5). В качестве альтернативы промежуточные соединения формулы (III), где q равно 1, причем упомянутые промежуточные соединения представлены формулой (III-а), могут быть получены в соответствии со следующей реакционной схемой (10): Схема 10 Реакционная схема (10) включает стадию, в которой осуществляют взаимодействие подходящего ацетил-производного R3, такого как, например, ацетилциклогексан, с параформальдегидом и подходящим первичным и вторичным амином HNR4R5, предпочтительно в форме соли, в присутствии подходящей кислоты, такой как, например, соляная кислота, и тому подобное, и подходящего растворителя, такого как, например, спирт, например, этанол. Промежуточные соединения формулы (III), где R3 представляет собой R3a' -CH2-CH2- (что возможно для тех промежуточных соединений формулы (III), где R3 представляет собой алкил, арилалкил, арил-Оалкил, арилалкил-О-алкил, Het-алкил, Het-O-алкил или Het-алкил-О-алкил, и R3a' имеет значение, аналогичное значению R3, но содержит в алкильной цепи, присоединенной к оставшейся части молекулы, на 2 атома углерода меньше, и где q равно 1, причем упомянутые промежуточные соединения представлены формулой (III-b), могут быть получены в соответствии со следующей реакционной схемой (11): Схема 11 Реакционная схема (11) включает стадию (а), в которой осуществляют взаимодействие подходящего альдегида с ацетоном в присутствии подходящего основания, такого как, например, гидроксид натрия. На следующей стадии (b) осуществляют взаимодействие продукта, полученного на стадии (а), с первичным или вторичным амином HNR4R5 в присутствии СН 2(=О), подходящей кислоты, такой как, например,соляная кислота, и тому подобное, и подходящего растворителя, такого как, например, спирт, например этанол. На следующей стадии (с) продукт, полученный на стадии (b), гидрируют (Н 2) в присутствии подходящего катализатора, такого как, например, палладированный уголь, и подходящего растворителя,такого как, например, вода и спирт, например, этанол. Промежуточные соединения формулы (III), где R3 представляет собой замещенный галогеном фенил, могут быть преобразованы в промежуточное соединение формулы (III), где R3 представляет собой замещенный арилом фенил, путем осуществления взаимодействия с арилбороновой кислотой в присутствии подходящего основания, такого как, например, фосфат калия, подходящего катализатора, такого как, например, ацетат палладия, и подходящего лиганда, такого как, например, 2-дициклогексилфосфино-2',6'-диметоксибифенил, в подходящем растворителе, таком как, например, толуол. Промежуточные соединения формулы (III), где R3 представляет собой замещенный галогеном фенил, также могут быть преобразованы в промежуточное соединение формулы (III), где R3 представляет собой фенил, замещенный С 2-6 алкенилом, необязательно замещенным фенилом, путем осуществления взаимодействия с подходящим С 2-6 алкеном, таким как, например, стирол, в присутствии подходящего основания, такого как, например, триэтиламин, подходящего катализатора, такого как, например, ацетат палладия, и подходящего лиганда, такого как, например, три-орто-толилфосфин, в подходящем растворителе, таком как, например, DMF. Промежуточные соединения формулы (IV-a) или (IV-b) могут быть получены в соответствии с методикой проведения реакций, описанной выше в этом документе для схемы (1), или в соответствии с методиками, описанными в WO 2004/011436. Промежуточные соединения формулы (V-a) могут быть получены в соответствии со следующей реакционной схемой (12): Реакционная схема (12) включает стадию осуществления взаимодействия подходящим образом замещенного хинолина, где W3 представляет собой подходящую уходящую группу, такую как, например,атом галогена, например атом брома, с подходящим образом замещенным дезоксибензоином в присутствии подходящего катализатора, такого как, например, диацетат палладия, подходящего лиганда, такого как, например, X-PHOS, подходящего основания, такого как, например, карбонат цезия, подходящего растворителя, такого как, например, ксилол, под струей N2. На следующей стадии (b) осуществляют взаимодействие продукта, полученного на стадии (а), с подходящим реактивом Гриньяра (например, СН 2 = СН-(СН 2)q-Mg-Br, таким как, например, аллилмагнийбромид) в подходящем растворителе, таком как,например, тетрагидрофуран. Промежуточные соединения формулы (V-b) могут быть получены соответствующим образом. Промежуточные соединения формулы (VI-а) могут быть получены в соответствии со следующей реакционной схемой (13): Схема 13 В реакционной схеме (13) осуществляют взаимодействие промежуточного соединения формулы (IIа) с промежуточным соединением формулы (VII) (ссылки на его синтез представлены на схемах 7, 8 и 9) в присутствии nBuLi в подходящем растворителе, таком как, например, тетрагидрофуран, и подходящего основания, такого как, например, диизопропиламин. Перемешивание может увеличивать скорость реакции. Взаимодействие может быть удобным образом осуществлено при температуре в диапазоне от -20 до-70 С. Промежуточные соединения формулы (VI-b) могут быть получены соответствующим образом. Последующие примеры описывают настоящее изобретение, не ограничивая его. Экспериментальная часть В некоторых соединениях или промежуточных соединениях абсолютная стереохимическая конфигурация содержащихся в них стереогенных атомов углерода или конфигурация двойных связей не была экспериментально определена. В этих случаях стереохимически изомерную форму, выделенную первой,обозначают как "А", а выделенную второй - как "В", без дополнительной ссылки на фактическую стереохимическую конфигурацию. Однако упомянутые изомерные формы "А" и "В" могут быть однозначно охарактеризованы специалистом в данной области техники с применением известных в данной области техники способов, таких как, например, ЯМР. Считается, что умение подобрать наиболее подходящий способ определения фактической стереохимической конфигурации находится в компетенции специалиста в данной области техники. В том случае, если "А" и "В" представляют собой смеси стереоизомеров, в частности смеси энантиомеров, то они могут быть в дальнейшем разделены, в результате чего соответствующие выделенные первыми фракции обозначают как "А 1" и "В 1" соответственно, а выделенные вторыми - как "А 2" и "В 2" соответственно, без дополнительной ссылки на фактическую стереохимическую конфигурацию. Однако упомянутые изомерные формы "А 1", "А 2", "В 1" и "В 2", в частности упомянутые энантиомерные формы"Al", "А 2", "В 1" и "В 2", могут быть однозначно охарактеризованы специалистом в данной области техники с применением известных в данной области техники способов, таких как, например, рентгенодифракционный метод анализа. В некоторых случаях, если конечное соединение или промежуточное соединение, указанные как конкретный диастереоизомер или энантиомер, преобразуются в другое конечное соединение/промежуточное соединение, то последние могут наследовать от предшественника обозначения для диастереоизомера (А, В) или энантиомера (A1, A2, B1, B2). Здесь и далее в этом документе, "DMF" означает N,N-диметилформамид, "THF" означает тетрагидрофуран, "TEMPO" означает 2,2,6,6-тетраметил-1-пиперидинилокси, "DIPE" означает диизопропиловый эфир и "DCM" означает дихлорметан. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 1 К раствору 4-бромбензамина (0,388 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) при 5 С медленно добавляли 4-хлорбензолпропаноилхлорид (0,466 моль). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли Н 2 О. Осадок отфильтровывали, промывали Н 2 О и сушили. Остаток перекристаллизовывали из диэтилового эфира. Осадок отфильтровывали и сушили. Выход: 110 г промежуточного соединения 1 (83%) (т.пл. 194 С).b. Получение промежуточного соединения 2 К DMF (35,4 мл) при 5 С медленно добавляли POCl3 (192,6 мл). Добавляли промежуточное соединение 1 (полученное в соответствии с A1.a) (0,296 моль). Смесь перемешивали при 80 С в течение 12 ч,медленно вливали на лед и экстрагировали CH2Cl2. Органический слой разделяли, сушили (MgSO4),фильтровали и выпаривали растворитель. Продукт использовали без дополнительной очистки. Выход: 150 г промежуточного соединения 2. с. Получение промежуточного соединения 3 Смесь промежуточного соединения 2 (полученного в соответствии с A1.b) (0,409 моль) в 30% растворе CH3ONa в СН 3 ОН (300 мл) и СН 3 ОН (300 мл) перемешивали и нагревали с обратным холодильником в течение 15 ч. Смесь вливали на лед и экстрагировали CH2Cl2. Органический слой разделяли, сушили (MgSO4), фильтровали, и выпаривали растворитель. Остаток (150 г) очищали по методу колоночной хроматографии на силикагеле (элюент: циклогексан/CH2Cl2 90/10; 35-70 мкм). Чистые фракции собирали, и выпаривали растворитель. Остаток выкристаллизовывали из диэтилового эфира. Осадок отфильтровывали и сушили. Выход: 27 г промежуточного соединения 3 (18%) (т.пл. 100 С).d. Получение промежуточного соединения 21 Промежуточное соединение 21 получали в соответствии с той же методикой, что и промежуточное соединение 3 (описание в Al.c). е. Получение промежуточного соединения 15(73 г) (полученного в соответствии с Al.b), 200 мл безводного метанола и 100 мл 5 М раствора метилата натрия нагревали с обратным холодильником при перемешивании в течение 2 суток. Образовавшийся осадок отфильтровывали, промывали метанолом и водой и сушили на воздухе. Остаток очищали по методу хроматографии (SiO2, элюент: хлороформ 100%). Выход: 53 г промежуточного соединения 15(87%, т.пл. 102-103 С). Пример А 2. а-1. Получение промежуточного соединения 4 К смеси феноксиуксусной кислоты (15 г, 0,0985 соль; CAS [122-59-8]) в CH2Cl2 (150 мл) при охлаждении на бане со льдом при 5 С порциями добавляли 1,1'-карбонилдиимидазол (24 г, 0,148 моль). Смесь перемешивали в течение 1 ч при 5 С, добавляли гидрохлорид N,О-диметилгидроксиламина (14,4 г, 0,148 моль) и перемешивали суспензию при комнатной температуре в течение 20 ч. Смесь вливали в 1 н. HCl и экстрагировали CH2Cl2. Органический слой промывали 10% K2CO3, сушили над MgSO4, фильтровали, и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2). Чистые фракции собирали и выпаривали растворитель. Выход: 16,6 г промежуточного со- 20022344 единения 4 (86%). а-2. Получение промежуточного соединения 5 Промежуточное соединение 5 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 4 в А 2.а-1, используя в качестве исходного вещества 4 метилфеноксиуксусную кислоту [940-64-7]. Выход: 98%. а-3. Получение промежуточного соединения 11 Промежуточное соединение 11 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 4 в А 2.а-1, используя в качестве исходного вещества бензилоксиуксусную кислоту [30379-55-6]. Выход: 95%.b-1. Получение промежуточного соединения 6 К раствору магния (2,68 г, 0,110 моль) в THF (30 мл) медленно добавляли раствор 1-бром-4 хлорбутана (12,65 мл, 0,110 моль) в THF/диэтиловом эфире (50/50, 100 мл) при температуре возгонки диэтилового эфира. Смесь перемешивали при комнатной температуре в течение 30 мин, а затем охлаждали при 5 С. Добавляли раствор промежуточного соединения 4 (16,56 г, 0,0848 моль) в THF (35 мл). Затем реакционную смесь перемешивали при 50 С в течение 4 ч и охлаждали до комнатной температуры. Смесь гидролизовали 10% NH4Cl и экстрагировали EtOAc. Органический слой сушили над MgSO4,фильтровали и выпаривали растворитель. Остаток использовали без дополнительной очистки. Выход: 19 г промежуточного соединения 6 (99%).b-2. Получение промежуточного соединения 7 Промежуточное соединение 7 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 6 в А 2.b-1, используя в качестве исходных веществ промежуточное соединение 5 и 1-бром-4-хлорбутан. Выход: 98%.b-3. Получение промежуточного соединения 12 Промежуточное соединение 12 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 6 в А 2.b-1, используя в качестве исходных веществ промежуточное соединение 11 и 1-бром-4-хлорбутан. Выход: 90%. с-1. Получение промежуточного соединения 8 Раствор промежуточного соединения 6 (9,6 г, 0,0423 моль), 1-метилпиперазина (4,7 мл, 0,0423 моль) и карбоната калия (6,4 г, 0,0465 моль) в ацетонитриле (100 мл) нагревали в течение 18 ч при 80 С, а затем охлаждали до комнатной температуры. Смесь вливали в воду и добавляли диэтиловый эфир. Органический слой подкисляли добавлением 1 н. HCl и экстрагировали диэтиловым эфиром. Затем полученный водный слой подщелачивали добавлением 3 н NaOH и экстрагировали диэтиловым эфиром. Органический слой сушили над MgSO4, фильтровали и выпаривали растворитель. Остаток использовали без дополнительной очистки. Выход: 3,82 г промежуточного соединения 8 (31%). с-2. Получение промежуточного соединения 9 Промежуточное соединение 9 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 8 в А 2.c-1, также используя в качестве исходного вещества промежуточное соединение 6. Выход: 33%. с-3. Получение промежуточного соединения 10 Промежуточное соединение 10 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 8 в А 2.С-1, используя в качестве исходного вещества промежуточное соединение 7. Выход: 33%. с-4. Получение промежуточного соединения 13 Промежуточное соединение 13 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 8 в А 2.С-1, используя в качестве исходного вещества промежуточное соединение 12. Выход: 27%. с-5. Получение промежуточного соединения 14 Промежуточное соединение 14 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 8 в А 2.c-1, используя в качестве исходного вещества промежуточное соединение 7. Выход: 31%. с-6. Получение промежуточного соединения 23 Промежуточное соединение 23 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 8 в А 2.c-1, используя в качестве исходного вещества промежуточное соединение 12. Выход: 31%. Пример A3. а. Получение промежуточного соединения 22 К перемешанному при 5 С реактиву Гриньяра, полученному из Mg стружки (0,14 моль) и 1-бром-4 хлорбутана (0,14 моль) в диэтиловом эфире (150 мл), по каплям добавляли раствор 2 нафтилкарбоксальдегида (0,0935 моль) в THF (150 мл). После перемешивания смеси в течение 4 ч при 5 С медленно добавляли раствор хлорида аммония (10% водный). Органический слой разделяли, промывали солевым раствором, сушили над сульфатом магния, фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: циклогексан/EtOAc 90/10; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Выход: 8,2 г промежуточного соединения 22 (35%).b. Получение промежуточного соединения 16 К охлажденному раствору промежуточного соединения 22 (0,061 моль) в ацетоне (120 мл) по каплям добавляли реактив Джонса (0,024 моль), полученный путем растворения 40 г CrO3 в 80 мл воды и 20 мл концентрированной серной кислоты. После добавления реакционную смесь перемешивали в течение 1 ч при 0 С. Добавляли воду и экстрагировали смесь диэтиловым эфиром. Органический слой разделяли,промывали солевым раствором, сушили над сульфатом магния, фильтровали и выпаривали растворитель. Выход: 3,8 г промежуточного соединения 16 (96%). с. Получение промежуточного соединения 17 Смесь промежуточного соединения 16 (0,0308 моль), гидрохлорида диэтиламина (0,123 моль) и карбоната калия (0,154 моль) в ацетонитриле (150 мл) перемешивали с обратным холодильником в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, вливали в воду и экстрагировали диэтиловым эфиром. Органический слой экстрагировали 1 н. HCl, полученный водный слой подщелачивали добавлением 3 н. NaOH, экстрагировали диэтиловым эфиром, промывали солевым раствором, сушили над MgSO4, фильтровали и выпаривали растворитель. Выход: 4,2 г промежуточного соеди- 22022344 нения 17 (53%). Пример А 4. Получение промежуточного соединения 20 Смесь 4-ацетил-1-бензоилпиперидина (0,0086 моль; [33037-82-0]), формальдегида (0,0133 моль),гидрохлорида диметиламина (0,026 моль) и концентрированной HCl (1 капля) в EtOH (30 мл) перемешивали при нагревании с обратным холодильником в течение 72 ч. Растворитель выпаривали. Остаток поглощали CH2Cl2/H2O/3 н. NaOH. Органический слой разделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток (11,7 г) очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 20-45 мкм). Чистые фракции собирали и выпаривали растворитель. Выход: 5,5 г промежуточного соединения 20 (44%; масло). Пример А 5. а-1. Получение промежуточного соединения 18(смесь диа А и диа В) К раствору диизопропиламида лития (коммерчески доступный, 2 М в THF/гептане, 0,00793 моль) вTHF (27 мл) при -70 С добавляли раствор промежуточного соединения 15 (0,00661 моль) в THF (20 мл). Смесь перемешивали при -70 С в течение 2 ч. Добавляли раствор промежуточного соединения 17(0,00661 моль) в THF (20 мл). Смесь перемешивали при -70 С в течение 3 ч. Добавляли воду и экстрагировали смесь EtOAc. Органический слой разделяли, промывали солевым раствором, сушили над MgSO4,фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2/СН 3 ОН 50/1; 15-40 мкм). Чистые фракции собирали и выпаривали растворитель. Выход: промежуточное соединение 18 (смесь диа А и диа В) (30%). а-2. Получение промежуточного соединения 19(смесь диа А и диа В) Промежуточное соединение 19 получали в соответствии с той же методикой, что и промежуточное соединение 18 (описание в А 5.а-1). Пример А 6. а. Получение промежуточного соединения 24N2 медленно добавляли 1,6 М nBuLi в гексане (7,8 мл, 0,0124 моль). Смесь перемешивали при -20 С в течение 20 мин, а затем охлаждали при -70 С. Медленно добавляли раствор 6-бром-2-метоксихинолина(CAS 99455-05-7) (2,5 г, 0,0104 моль) в THF (24 мл). Смесь перемешивали при -70 С в течение 90 мин. Медленно добавляли раствор 3-фуранкарбоксальдегида (1,2 г, 0,0124 моль) в THF (18 мл). Смесь перемешивали в течение ночи при комнатной температуре, гидролизовали водой со льдом и экстрагировалиEtOAc. Органический слой разделяли, сушили над MgSO4, фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: циклогексан/EtOAc 50/50; 15-40 мкм). Желаемые фракции собирали и выпаривали растворитель. Выход: 1,46 г промежуточного соединения 24 (выход: 39%) в виде белого твердого вещества.b. Получение промежуточного соединения 25 К раствору промежуточного соединения 24 (0,5 г; 0,0015 моль) и триизопропилсилана (6,1 мл; 0,003 моль) в CH2Cl2 (15 мл) добавляли трифторуксусную кислоту (2,3 мл; 0,003 моль). Смесь перемешивали в течение ночи при комнатной температуре, гидролизовали водой со льдом, и экстрагировали EtOAc. Органический слой разделяли, сушили над MgSO4, фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: циклогексан/EtOAc от 100/0 до 0/100; 15-40 мкм). Желаемые фракции собирали и выпаривали растворитель. Получали 0,30 г промежуточного соединения 25 (выход: 61%) в виде бледно-желтого твердого вещества. Пример А 7. а. Получение промежуточного соединения 26 Смесь 1-(3-бромфенил)-5-хлор-1-пентанона (18,0 г; 0,07 моль), гидрохлорида диметиламина (22,8 г; 0,28 моль) и карбоната калия (47,7 г, 0,35 моль) в ацетонитриле (25 мл) перемешивали с обратным холодильником в течение 48 ч, затем охлаждали до комнатной температуры, вливали в воду и экстрагировалиEtOAc. Органический слой разделяли, промывали солевым раствором, сушили над сульфатом магния,фильтровали и выпаривали растворитель. Неочищенный продукт поглощали DIPE, осадок отфильтровывали и сушили в вакууме. Выход: 16,8 г промежуточного соединения 26 (90%).b-1. Получение промежуточного соединения 27 В трехгорлую колбу под струей N2 вносили 4-хлорфенилбороновую кислоту (2,49 г; 15,9 ммоль),фосфат калия (4,5 г; 21,2 ммоль), ацетат палладия (72 мг; 0,32 ммоль) и 2-дициклогексилфосфино-2',6'диметоксибифенил (275 мг; 0,67 ммоль). Затем шприцом добавляли 21,2 мл безводного толуола. Спустя 2 мин добавляли промежуточное соединение 26 (3,0 г; 10,6 ммоль) и перемешивали смесь в течение 3 ч при 100 С. Реакционную смесь гасили добавлением воды и разбавляли дихлорметаном. Затем органический слой промывали водой и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали по методу хроматографии на силикагелеb-2. Получение промежуточного соединения 28 Промежуточное соединение 28 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 27 в А 7.b-1, используя в качестве исходных веществ промежуточное соединение 26 и фенилбороновую кислоту вместо 4-хлорфенилбороновой кислоты. Выход: 61%.b-3. Получение промежуточного соединения 29 Промежуточное соединение 29 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 27 в А 7.b-1, используя в качестве исходных веществ промежуточное соединение 26 и 4-метоксифенилбороновую кислоту вместо 4-хлорфенилбороновой кислоты. Выход: 85%.b-4. Получение промежуточного соединения 30 Промежуточное соединение 30 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 27 в А 7.b-1, используя в качестве исходных веществ промежуточное соединение 26 и 4-метилфенилбороновую кислоту вместо 4-хлорфенилбороновой кислоты. Вы- 24022344 ход: 79%. Пример А 8. а-1. Получение промежуточного соединения 31 В круглодонную колбу вносили ацетат палладия (71,8 мг; 0,32 ммоль); три-орто-толилфосфин (289 мг; 0,95 ммоль) и 30 мл DMF. Спустя 2 мин к перемешанному раствору добавляли 3,0 г (10,6 ммоль) промежуточного соединения 26, 1,3 г (12,7 ммоль) стирола и 2,2 мл (15,9 ммоль) триэтиламина. Затем реакционную смесь нагревали при 100 С в течение ночи. Смесь вливали в воду со льдом и разбавляли этилацетатом. Затем водный слой трижды промывали этилацетатом, собранные органические фракции промывали водой и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали по методу хроматографии на силикагеле (CH2Cl2/CH3OH/NH4OH от 97/3/0,3 до 90/10/1). Выход: 2,75 г промежуточного соединения 31 (85%; (Е)-изомер). а-2. Получение промежуточного соединения 36 Промежуточное соединение 36 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 31 в А 8.а-1, используя в качестве исходного вещества промежуточное соединение 34 (см. А 9.с). Пример А 9. а. Получение промежуточного соединения 32 В трехгорлую колбу под струей N2 вносили магний (4,8 г, 0,202 моль) в 15 мл THF и каталитическое количество I2. Добавляли несколько капель 1-бром-5-хлорментана для запуска реакции. После обесцвечивания раствора по каплям добавляли еще 1-бром-5-хлорпентан (26,6 мл, 0,2 моль) в 75 мл THF,поддерживая температуру приблизительно при 10 С. Смесь перемешивали в течение 1 ч при этой температуре. Затем при 10 С по каплям добавляли раствор 3-бромбензальдегида (15,8 мл, 1,35 моль) в 75 млTHF, и перемешивали смесь в течение полусуток при комнатной температуре. Реакционную смесь гасили добавлением водного хлорида аммония (10% раствор), разбавляли этилацетатом и фильтровали на целите. Затем органический слой промывали водой и солевым раствором, сушили над сульфатом магния,фильтровали и концентрировали. Неочищенный продукт очищали по методу хроматографии на силикагеле (циклогексан/EtOAc 80/20). Выход: 15 г промежуточного соединения 32 (38%).b. Получение промежуточного соединения 33 В круглодонной колбе перемешивали промежуточное соединение 32 (15,0 г; 51,4 ммоль) и TEMPO(80 мг; 0,51 ммоль) в 30 мл DCM. Затем к реакционной смеси, которую энергично перемешивали в течение 24 ч при комнатной температуре, добавляли водный раствор перйодата натрия (30 мл; 13,2 г; 61,7 ммоль) и бромида натрия (0,52 г; 5,1 ммоль). Реакционную смесь разбавляли водой и DCM. Затем органический слой промывали сульфатом натрия, сушили над сульфатом магния, фильтровали и концентрировали с получением 14,83 г промежуточного соединения 33 (100%). с. Получение промежуточного соединения 34 Смесь промежуточного соединения 33 (14,83 г; 51,2 ммоль), гидрохлорида диметиламина (16,7 г,0,21 моль) и карбоната калия (36,2 г, 0,26 моль) в ацетонитриле (150 мл) перемешивали с обратным холодильником в течение 48 ч, а затем охлаждали до комнатной температуры. Смесь вливали в воду и экс- 25022344 трагировали EtOAc. Органический слой разделяли, промывали солевым раствором, сушили над сульфатом магния, фильтровали и выпаривали растворитель. Неочищенный продукт поглощали DIPE, осадок отфильтровывали и сушили в вакууме. Выход: 16,8 г промежуточного соединения 34 (97%).d. Получение промежуточного соединения 35 Промежуточное соединение 35 получали в соответствии с той же методикой, что и описанная для получения промежуточного соединения 27 в А 7.b-1, используя в качестве исходных веществ промежуточное соединение 34 и фенилбороновую кислоту. Выход: 11%. В. Получение соединений. Пример В 1. Получение соединений 3 и 4 Соединение 3 (диа А) Соединение 4 (диа В) К раствору диизопропиламина (0,97 мл, 0,0069 моль) в THF (12 мл) при -20 С под струей N2 медленно добавляли 1,6 М nBuLi в гексане (4,3 мл, 0,0069 моль). Смесь перемешивали при -20 С в течение 20 минут, а затем охлаждали при -70 С. Медленно добавляли раствор промежуточного соединения 3(1,89 г, 0,00575 моль) в THF (20 мл). Смесь перемешивали при -70 С в течение 90 мин. Медленно добавляли раствор промежуточного соединения 9 (1,625 г, 0,0069 моль) в THF (17 мл). Смесь перемешивали при -70 С в течение 3 ч, гидролизовали при -30 С водой со льдом и экстрагировали EtOAc. Органический слой разделяли, сушили над MgSO4, фильтровали и выпаривали растворитель. Остаток сначала очищали по методу колоночной хроматографии на силикагеле (15-40 мкм, 90 г, CH2Cl2/CH3OH/NH4OH 95%/5%/0,5%), а затем проводили очистку по методу SFC на колонке с 2-этилпиридином (6 мкм; 20150 мм). Подвижная фаза представляла собой CO2/метанол 93/7 по объему (+0,5 об.% изопропиламина). Две фракции собирали и выпаривали растворитель. Фракции по отдельности выкристаллизовывали из диизопропилового эфира с получением 0,21 г соединения 3 (диастереоизомер А; выход: 6,2%; белая пена) и 0,23 г соединения 4 (диастереоизомер В; выход: 6,8%; т.пл. 118 С; белое твердое вещество). Пример В 2. Получение соединений 21 и 22 Соединение 21 (диа А) Соединение 22 (диа В) К раствору диизопропиламина (0,92 мл, 0,00 658 моль) в THF (11 мл) при -20 С под струей N2 медленно добавляли 1,6 М nBuLi в гексане (4,1 мл, 0,00658 моль). Смесь перемешивали при -20 С в течение 20 мин, а затем охлаждали при -70 С. Медленно добавляли раствор промежуточного соединения 3 (1,98 г, 0,00547 моль) в THF (20 мл). Смесь перемешивали при -70 С в течение 90 мин. Медленно добавляли раствор промежуточного соединения 8 (1,91 г, 0,00658 моль) в THF (19 мл). Смесь перемешивали при 70 С в течение 3 ч, гидролизовали при -30 С водой со льдом и экстрагировали EtOAc. Органический слой разделяли, сушили над MgSO4, фильтровали и выпаривали растворитель. Остаток сначала очищали по методу колоночной хроматографии на силикагеле Kromasil (5 мкм, 19150 мм; CH2Cl2/CH3OH/NH4OH 96/4/0,4 по объему), а затем на колонке Sunfire C18 производства Waters (5 мкм, 19150 мм) со скоростью потока 20 мл/мин. Две подвижные фазы (подвижная фаза А: 100% метанол; подвижная фаза В: 100% 63 мМ гидрокарбонат аммония рН 8 (в особо чистой воде) использовали для создания градиента от 87% А, 13% В до 100% А за 14 мин и заново уравновешивали колонку с исходными условиями в течение 6 мин. Две фракции собирали, и выпаривали растворитель. Две фракции по отдельности выкристаллизовывали из диизопропилового эфира с получением 0,05 г соединения 21 (диастереоизомер А; выход: Соединение 27 (диа А) Соединение 28 (диа В) К раствору диизопропиламина (1,2 мл, 0,0085 моль) в THF (15 мл) при -20 С под струей N2 медленно добавляли 1,6 М nBuLi в гексане (5,3 мл, 0,0085 моль). Смесь перемешивали при -20 С в течение 20 мин, а затем охлаждали при -70 С. Медленно добавляли раствор 6-бром-2-метокси-3-(фенилметил) хинолина (промежуточное соединение 3 (пример A3) из WO 2004/011436) (2,32 г, 0,00708 моль) в THF (23 мл). Смесь перемешивали при -70 С в течение 90 мин. Медленно добавляли раствор промежуточного соединения 23 (2,6 г, 0,0085 моль) в THF (26 мл). Смесь перемешивали при -70 С в течение 3 ч, гидролизовали при -30 С водой со льдом и экстрагировали EtOAc. Органический слой разделяли, сушили надMgSO4, фильтровали и выпаривали растворитель. Остаток дважды очищали по методу колоночной хроматографии на силикагеле (15-40 мкм, 300 г, CH2Cl2/CH3OH/NH4OH 93/7/0,1 по объему). Две фракции собирали и выпаривали растворитель. Фракции по отдельности выкристаллизовывали из DIPE с получением 0,38 г соединения 27 (диастереоизомер А; выход: 8,6%; белая пена) и 0,21 г соединения 28 (диастереоизомер В; выход: 4,8%; т.пл. 122 С; белое твердое вещество). Пример В 4. а) Получение соединений 25 и 26 Соединение 25 (диа А) Соединение 2 6 (диа В) К раствору диизопропиламина (0,0079 моль) в THF (13 мл) при -20 С под струей N2 по каплям добавляли 1,6 М nBuLi в гексане (4,99 мл, 0,0079 моль). Смесь перемешивали при -20 С в течение 20 мин, а затем охлаждали при -70 С. Добавляли раствор 6-бром-2-метокси-3-(фенилметил)хинолина (промежуточное соединение 3 (пример A3) в WO 2004/011436) (0,0065 моль) в THF (22 мл). Смесь перемешивали при -70 С в течение 90 мин. Добавляли раствор промежуточного соединения 13 (0,0079 моль) в THF (20 мл). Смесь перемешивали при -70 С в течение 2 ч, затем вливали на лед при -30 С и экстрагировалиEtOAc. Органический слой разделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток дважды очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH от 95/5/0,1 до 93/7/0,1; 15-40 мкм). Три фракции собирали и выпаривали растворитель. Выход: 0,5 г фракции 1, 0,41 г фракции 2 и 0,37 г фракции 3. Фракцию 1 и фракцию 3 выкристаллизовывали из Соединение 1 (диа А) Соединение 2 (диа В) Соединения 1 и 2 получали в соответствии с методикой получения соединений 25 и 26, описанной в В 4.а, но используя промежуточное соединение 9 (вместо промежуточного соединения 13) и используя другую методику выделения продуктов реакции. Разделенный органический слой промывали насыщенным водным NaCl, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2/СН 3 ОН/NH4OH 95/5/0,1; 15-40 мкм), а затем на Kromasil (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,4; 5 мкм). Три фракции собирали и выпаривали растворитель. Первую желаемую фракцию выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 1 (8,5%; диа А; т.пл. 148 С). Вторую желаемую фракцию выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 2 (1,9%; диа В; т.пл. 151 С). с) Получение соединений 19 и 20 Соединение 19 (диа А) Соединение 20 (диа В) Соединения 19 и 20 получали в соответствии с методикой получения соединений 25 и 26, описанной в В 4.а, но используя промежуточное соединение 8 (вместо промежуточного соединения 13) и используя другую методику выделения продуктов реакции. Разделенный органический слой промывали насыщенным водным NaCl, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 15-40 мкм), а затем на Kromasil (элюент: CH2Cl2/CH3OH/NH4OH от 96/4/0,4 до 91/9/0,9; 5 мкм). Две фракции собирали и выпаривали растворитель. Фракцию 1 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 19 (7,3%; диа А). Фракцию 2 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 20 (5,9%; диа В; т.пл. 144 С). Соединение 23 (диа А) Соединение 24 (диа В) Соединения 23 и 24 получали в соответствии с методикой получения соединений 25 и 26, описанной в В 4.а, но используя промежуточное соединение 10 (вместо промежуточного соединения 13) и используя другую методику выделения продуктов реакции. После удаления растворителя из выделенного органического слоя очищали остаток по методу колоночной хроматографии на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 95/5/0,1). Чистые фракции собирали и выпаривали растворитель. Остаток очищали по методу колоночной хроматографии на Kromasil (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,4; 5 мкм). Две фракции собирали и выпаривали растворитель. Оба остатка выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 23 (3,1%; диа А) и соединение 24 (2,1%; диа В) (т.пл. 168 С). е) Получение соединений 5 и 6 Соединение 5 (диа А) Соединение 6 (диа В) Соединения 5 и 6 получали в соответствии с методикой получения соединений 23 и 24, но используя промежуточное соединение 14 (вместо промежуточного соединения 10). Методика выделения продуктов реакции: Остаток сначала очищали по методу колоночной хроматографии на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 95/5/0,1; 15-40 мкм), а затем на колонке с Kromasil (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,4; 5 мкм). Две фракции собирали и выпаривали растворитель. Фракцию 1 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 5 (5,8%; т.пл. 146 С; диа А). Фракцию 2 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили с получением соединения 6 (1,1%; т.пл. 130 С; диа В). Пример В 5. а. Получение соединений 14 и 15 Соединение 14 (диа А) Соединение 15 (диа В) Промежуточное соединение 18 (смесь диа А и В) (0,00103 моль) растворяли в дихлорметане (1,5 мл) и СН 3 ОН (1,5 мл). К этому раствору добавляли Na2CO3 (2,0 М раствор в воде), тиофен-2-бороновую кислоту (0,00154 моль) и Pd(PPh3)2Cl2 (0,00005 моль). Реакционную смесь перемешивали в микроволновой печи при 90 С в течение 29 мин (Р=300 Вт). Затем смесь охлаждали до комнатной температуры и вливали в Н 2 О. Добавляли CH2Cl2 и фильтровали смесь через тонкий слой целита. Фильтрат декантировали, органический слой сушили (MgSO4), фильтровали и выпаривали растворитель. Очистка на колонке: Остаток очищали по методу флэш-хроматографии (элюент: CH2Cl2/СН 3 ОН 50/1). Две фракции собирали и выпаривали растворитель. Выход: 0,070 г соединения 14 (диа А, 12%) и 0,135 г соединения 15 Соединение 12 (диа В) Соединение 13 (диа А) Соединения 12 и 13 получали в соответствии с методикой получения соединений 14 и 15, описанной в В 5.а, используя в качестве исходных веществ промежуточное соединение 18 и фуран-3-бороновую кислоту. Очистка на колонке: остаток сначала очищали по методу флэш-хроматографии (элюент:CH2Cl2/СН 3 ОН 50/1), но соединения 12 и 13 не разделялись. Поэтому, эту смесь диастереоизомеров затем очищали с дополнительным разделением продуктов реакции: Остаток очищали по методу колоночной хроматографии на Kromasil (элюент: CH2Cl2/СН 3 ОН/NH4OH от 96/4/0,4 до 91/9/0,9; 10 мкм). Две фракции собирали и выпаривали растворитель. Фракцию 1 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 13 (37 мг; т.пл. 197 С; диа А). Фракцию 2 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 12 (29 мг; диа В). с. Получение соединений 10 и 11 Соединение 11 (диа А) Соединение 10 (диа В) Соединения 10 и 11 получали в соответствии с методикой получения соединений 14 и 15, описанной в В 5.а, используя в качестве исходных веществ промежуточное соединение 18 и 1-метил-4-(4,4,5,5 тетраметил-1,3,2-диоксоборолан-2-ил)-1 Н-пиразол. Очистка на колонке: Остаток сначала очищали по методу флэш-хроматографии (элюент: CH2Cl2/СН 3 ОН 50/1), но соединения 11 и 10 не разделялись. Поэтому, эту смесь диастереоизомеров затем очищали с дополнительным разделением продуктов реакции. Остаток очищали по методу колоночной хроматографии на Kromasil (элюент: CH2Cl2/СН 3 ОН/NH4OH от 96/4/0,4 до 91/9/0,9; 10 мкм). Две фракции собирали и выпаривали растворитель. Фракцию 1 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили. Выход: соединение 11 (15 мг; диа А). Фракцию 2 выкристаллизовывали из DIPE. Осадок отфильтровывали и сушили с получением соединения 10 (12 мг; т.пл. 190 С; диа В).
МПК / Метки
МПК: C07D 401/06, C07D 401/10, C07D 409/10, A61P 31/00, C07D 405/10, C07D 215/22, A61K 31/435, C07D 405/06
Метки: антибактериальные, хинолиновые, производные
Код ссылки
<a href="https://eas.patents.su/30-22344-antibakterialnye-hinolinovye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные хинолиновые производные</a>












