Антибактериальные производные хинолина
Номер патента: 16760
Опубликовано: 30.07.2012
Авторы: Виллалгордо-Сото Хосе Мануэль, Мотт Магали Мадлен Симон, Коул Анил, Доранж Исмет, Андрис Кунрад Йозеф Лодевейк Марсель, Лансуа Давид Франсис Ален, Симонне Иван Рене Фердинан, Гийемон Жером Эмиль Жорж
Формула / Реферат
1. Соединение формулы (Ia) или (Ib)
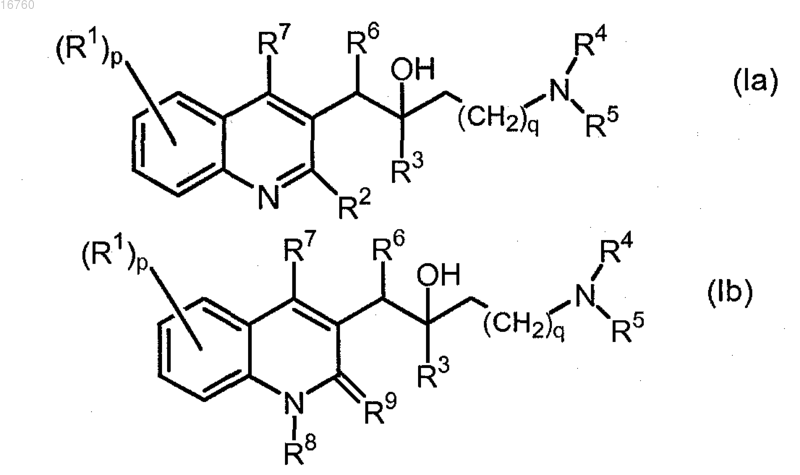
включая его любую стереохимически изомерную форму, где
р является целым числом, равным 1 или 2;
q является целым числом, равным 2, 3 или 4;
R1 представляет собой водород, галоген, С1-6алкил;
R2 представляет собой водород, С1-6алкилоксигруппу, арил, арилоксигруппу;
R3 представляет собой С1-6алкил, арилС1-6алкил, арил-O-C1-6алкил, арилС1-6алкил-О-С1-6алкил, арил или Het;
R4 представляет собой водород или С1-6алкил;
R5 представляет собой -С(=NH)-NH2; Het-C1-6алкил; моно- или ди(C1-6)алкиламиноС1-6алкил; бицикло[2.2.1]гептил; или Het; или
R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила; гексагидро-1Н-азепинила; гексагидро-1Н-1,4-диазепинила; гексагидро-1,4-оксазепинила; 2,5-диазабицикло[2.2.1]гептила; 1,1-диоксидтиоморфолинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С1-6алкила, галогенС1-6алкила, С1-6алкилкарбонила, галогена, арилС1-6алкила, гидроксигруппы, С1-6алкилоксигруппы, аминогруппы, моно- или ди(C1-6)алкиламиногруппы, моно- или ди(C1-6)алкиламиноС1-6алкила, C1-6алкилтиогруппы, С1-6алкилоксиС1-6алкила, С1-6алкилтиоС1-6алкила, арила, пиперидинила, необязательно замещенного С1-6алкилом, пирролидинила, необязательно замещенного арилС1-6алкилом, пиридила или пиримидинила; или
R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, C1-6алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС1-6алкилом;
R6 представляет собой арил1 или Het;
R7 представляет собой водород или С1-6алкил;
R8 представляет собой водород или С1-6алкил;
R9 представляет собой оксогруппу;
арил представляет собой гомоциклил, выбранный из фенила или нафтила, причем каждый необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(C1-6)алкиламиногруппы, С1-6алкила, С2-6алкенила, необязательно замещенного фенилом, галогенС1-6алкила, С1-6алкилоксигруппы, галогенС1-6алкилоксигруппы, карбоксила, С1-6алкилоксикарбонила, аминокарбонила, морфолинила или моно- или ди(C1-6)алкиламинокарбонила;
арил1 представляет собой гомоцикл, выбранный из фенила или нафтила, причем каждый необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(C1-6)алкиламиногруппы, С1-6алкила, галогенС1-6алкила, С1-6алкилоксигруппы, С1-6алкилтиогруппы, галогенС1-6алкилоксигруппы, карбоксила, С1-6алкилоксикарбонила, аминокарбонила, морфолинила, Het или моно- или ди(С1-6)алкиламинокарбонила;
Het представляет собой моноциклический гетероцикл, выбранный из пиперидинила, пиперазина или пиридинила; причем каждый гетероцикл необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из галогена, гидроксигруппы, С1-6алкила или С1-6алкилоксигруппы;
его N-оксид, его фармацевтически приемлемая соль или его сольват.
2. Соединение по п.1, где алкил представляет собой С1-4алкил.
3. Соединение по любому из предшествующих пунктов, где R1 представляет собой водород или галоген.
4. Соединение по любому из предшествующих пунктов, где р равно 1.
5. Соединение по любому из предшествующих пунктов, где R2 представляет собой С1-6алкилоксигруппу.
6. Соединение по п.5, где R2 представляет собой метоксигруппу.
7. Соединение по любому из предшествующих пунктов, где R3 представляет собой арилС1-6алкил или арил.
8. Соединение по любому из предшествующих пунктов, где q равно 3 или 4.
9. Соединение по любому из предшествующих пунктов, где R4 представляет собой водород или С1-6алкил.
10. Соединение по п.9, где R4 представляет собой С1-6алкил.
11. Соединение по п.1, где R5 представляет собой -C(=NH)-NH2; Het-С1-6алкил; бицикло[2.2.1]гептил или Het.
12. Соединение по п.1, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила, гексагидро-1Н-1,4-диазепинила, 2,5-диазабицикло[2.2.1]гептила или гексагидро-1Н-азепинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С1-6алкила или арилС1-6алкила; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, С1-6алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС1-6алкилом.
13. Соединение по п.12, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила, гексагидро-1Н-1,4-диазепинила, 2,5-диазабицикло[2.2.1]гептила или гексагидро-1Н-азепинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из C1-6алкила или арилС1-6алкила.
14. Соединение по любому из предшествующих пунктов, где R6 представляет собой фенил, необязательно замещенный галогеном.
15. Соединение по любому из предшествующих пунктов, где R7 представляет собой водород.
16. Соединение по любому из предшествующих пунктов, где соединение представляет собой соединение формулы (Ia).
17. Соединение по любому из пп.1-15, где соединение представляет собой соединение формулы (Ib) и где R8 представляет собой водород и R9 представляет собой оксогруппу.
18. Соединение по п.1, где соединение представляет собой соединение формулы (Ia), и где R1 представляет собой водород или галоген; R2 представляет собой С1-6алкилоксигруппу; R3 представляет собой арилС1-6алкил или арил; R4 представляет собой водород или С1-6алкил; R5 представляет собой -C(=NH)-NH2; Het-C1-6 алкил; моно- или ди(С1-6алкил)аминоС1-6алкил; бицикло[2.2.1]гептил или Het; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила; гексагидро-1Н-азепинила; гексагидро-1Н-1,4-диазепинила; 2,5-диазабицикло[2.2.1]гептила или 1,1-диоксидтиоморфолинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С1-6алкила, арилС1-6алкила, пиперидинила, необязательно замещенного С1-6алкилом; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, С1-6алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС1-6 алкилом; R6 представляет собой фенил, необязательно замещенный галогеном; R7 представляет собой водород; q равно 3 или 4; р равно 1.
19. Соединение по п.1, где соединение выбрано из
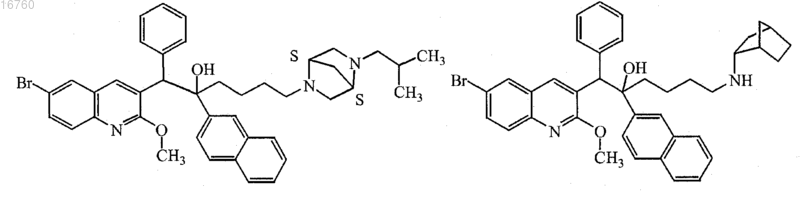

включая их любую стереохимически изомерную форму;
его N-оксид, его фармацевтически приемлемая соль или его сольват.
20. Применение соединения по любому из пп.1-19 в качестве лекарственного средства для лечения бактериальной инфекции.
21. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-19.
22. Применение соединения по любому из пп.1-19 для изготовления лекарственного средства для лечения бактериальной инфекции.
23. Применение по п.22, где бактериальная инфекция представляет собой инфекцию, вызванную грамположительной бактерией.
24. Применение по п.23, где грамположительная бактерия представляет собой Streptococcus pneumoniae.
25. Применение по п.23, где грамположительная бактерия представляет собой Staphylococcus aureus.
26. Способ получения соединения по п.1, отличающийся тем, что осуществляют взаимодействие промежуточного продукта формулы (III-а) или (III-b) с промежуточным продуктом формулы (IV) согласно следующей схеме реакции:
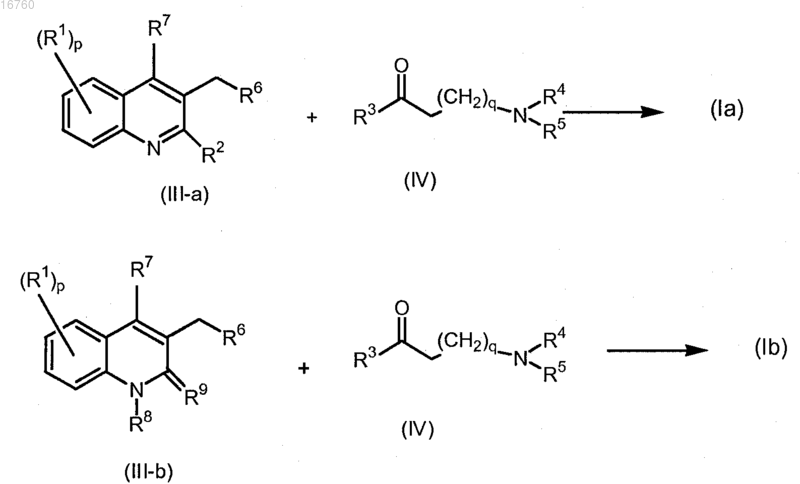
используя н-BuLi в смеси подходящего основания и подходящего растворителя, где все переменные являются такими, как определено в п.1;
и, при необходимости, преобразовывают соединения формулы (Ia) или (Ib) друг в друга, следуя известным в данной области трансформациям, и дополнительно, при необходимости, преобразовывают соединения формулы (Ia) или (Ib) в терапевтически активную нетоксичную аддитивную соль кислоты при обработке кислотой или в терапевтически активную нетоксичную аддитивную соль основания при обработке основанием или, наоборот, преобразовывают формы аддитивной соли кислоты в свободное основание при обработке щелочью или преобразовывают формы аддитивной соли основания в свободную кислоту при обработке кислотой; и, при необходимости, получают стереохимически изомерные формы, четвертичные амины или их N-оксидные формы.
27. Комбинация (а) соединения по любому из пп.1-19 и (b) одного или нескольких других антибактериальных средств.
28. Продукт, содержащий (а) соединение по любому из пп.1-19 и (b) одно или несколько других антибактериальных средств в качестве комбинированного препарата для одновременного, раздельного или последовательного применения для лечения бактериальной инфекции.
29. Применение по п.25, где Staphylococcus aureus представляет собой устойчивый к метициллину Staphylococcus aureus.
30. Применение по п.22, где бактериальная инфекция представляет собой инфекцию, вызванную Mycobacterium tuberculosis.
Текст
Мадлен Симон (FR), Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил Настоящее изобретение относится к новым производным замещенных хинолинов общей формулы(Ia) или формулы (Ib), включая любую их стереохимически изомерную форму, их фармацевтически приемлемой соли, их N-оксидной форме или их сольвату. Заявляемые соединения полезны при лечении бактериальной инфекции. Также заявляется композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество заявляемых соединений, применение заявляемых соединений или композиций для изготовления лекарственного средства для лечения бактериальной инфекции и способ получения заявляемых соединений. Гийемон Жером Эмиль Жорж (FR),Доранж Исмет (SE), Лансуа Давид Франсис Ален (FR), ВиллалгордоСото Хосе Мануэль (ES), Симонне Иван Рене Фердинан, Мотт Магали 016760 Настоящее изобретение относится к новым производным замещенных хинолинов, полезным при лечении вызванных бактериями заболеваний, включающих в качестве неограничивающих примеров заболевания, вызванные патогенными микобактериями, такими как Mycobacterium tuberculosis, M. bovis,M. leprae, M. avium и М. marinum, или патогенными стафилококками или стрептококками. Предшествующий уровень техники изобретенияMycobacterium tuberculosis является возбудителем туберкулеза (ТВ), серьезной и потенциально смертельной инфекции с распространением по всему миру. Оценки Всемирной организации здравоохранения указывают на то, что каждый год более чем 8 млн людей заражаются ТВ, и ежегодно 2 млн людей умирают от туберкулеза. В последнее десятилетие случаи заболевания ТВ возросли во всем мире на 20% с наивысшей долей в самых бедных сообществах. Если такие тенденции сохранятся, то уровень ТВ увеличится на 41% в последующие двадцать лет. Пятьдесят лет, начиная с введения эффективной химиотерапии, ТВ остается после СПИДа ведущей инфекционной причиной смертности взрослых людей в мире. Осложнением при эпидемии ТВ является возрастающее появление штаммов с множественной лекарственной устойчивостью и смертельным симбиозом с ВИЧ. Для людей, которые являются ВИЧинфицированными и заражены ТВ, в 30 раз более вероятно развитие активного ТВ, чем у людей, которые не инфицированы ВИЧ, и ТВ является причиной смерти одного из каждых трех человек с ВИЧ/СПИДом во всем мире. Все существующие подходы лечения туберкулеза предполагают комбинирование нескольких средств. Например, схема лечения, рекомендованная Службой здравоохранения США, представляет собой комбинацию изониазида, рифампицина и пиразинамида в течение двух месяцев, после чего следует прием только изониазида и рифампицина в течение дополнительных четырех месяцев. Данные лекарственные средства продолжают давать в течение дополнительных семи месяцев пациентам, инфицированным ВИЧ. Пациентам, инфицированным штаммами М. tuberculosis с множественной лекарственной устойчивостью, к способам комбинированного лечения добавляют такие средства, как этамбутол, стрептомицин,канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Не существует одного средства, которое эффективно при клиническом лечении туберкулеза, или какой-либо комбинации средств, которая дает возможность терапии продолжительностью менее чем шесть месяцев. Существует большая медицинская потребность в новых лекарственных средствах, которые улучшают лечение в настоящее время, позволяя использовать схемы лечения, которые способствуют соблюдению пациентом схемы лечения и соответствие требованиям поставщиком. Более короткие схемы лечения и схемы лечения, которые требуют меньшего контроля, являются лучшим способом достичь этого. Большая часть благоприятного эффекта от лечения наступает в первые 2 месяца во время интенсивной или бактерицидной фазы, когда дают вместе четыре лекарственных средства; доля бактерий значительно уменьшается, и пациенты становятся незаразными. Фаза продолжения от 4 до 6 месяцев, или стерилизующая фаза, необходима для того, чтобы удалить сохранившиеся бациллы и свести до минимума риск рецидива. Мощное лекарственное средство, которое сокращает лечение до 2 месяцев или менее, было бы чрезвычайно благотворно. Также необходимы лекарственные средства, которые способствуют соблюдению схемы лечения, требуя менее интенсивного контроля. Очевидно, соединение, которое уменьшает как общую продолжительность лечения, так и частоту введения лекарственного средства, обеспечило бы наибольшее преимущество. Осложнением при эпидемии ТВ является возрастающая доля штаммов с множественной лекарственной устойчивостью или MDR-TB. До четырех процентов всех случаев заболеваний во всем мире считаются MDR-TB, случаи с устойчивостью к наиболее эффективным лекарственным средствам из стандартного набора четырех лекарственных средств, изониазиду и рифампину. MDR-TB является летальным, когда его не лечат или не могут адекватно лечить при помощи стандартной терапии, по этой причине лечение требует приема лекарственных средств второго ряда вплоть до 2 лет. Такие лекарственные средства часто являются токсичными, дорогими и малоэффективными. При отсутствии эффективной терапии заразные пациенты с MDR-TB продолжают распространять заболевание, приводя к появлению новых заражений штаммами MDR-TB. Существует большая медицинская потребность в новом лекарственном средстве с новым механизмом действия, которое, вероятно, будет проявлять активность против штаммов с лекарственной устойчивостью, в частности с MDR. Используемый выше или в дальнейшем термин лекарственная устойчивость представляет собой термин, хорошо понятный специалисту в области микробиологии. Микобактерия с лекарственной устойчивостью представляет собой микобактерию, которая более не восприимчива по меньшей мере к одному ранее эффективномулекарственному средству; которая развила способность противостоять антибиотическому действию по меньшей мере одного ранее эффективного лекарственного средства. Штамм с лекарственной устойчивостью может передавать такую способность противостояния действию лекарства своему потомству. Указанная устойчивость может быть следствием случайной генетической мутации в бактериальной клетке, которая меняет ее чувствительность к одному лекарственному средству или к различным лекарственным средствам.-1 016760 Туберкулез с MDR представляет собой конкретный вид туберкулеза с лекарственной устойчивостью из-за бактерии, устойчивой, по меньшей мере, к изониазиду и рифампицину (с устойчивостью или без к другим лекарственным средствам), которые в настоящее время являются наиболее мощными лекарственными средствами против ТВ. Таким образом, всякий раз, когда используется выше или в дальнейшем, термин лекарственная устойчивость включает множественную лекарственную устойчивость. Другим фактором при контроле эпидемии ТВ является проблема латентного ТВ. Несмотря на десятилетия применения контролирующих программ в отношении туберкулеза (ТВ), приблизительно 2 млрд человек заражены М. tuberculosis, хотя и бессимптомно. Приблизительно 10% таких людей подвергаются риску развития активного ТВ во время продолжения их жизни. Глобальной эпидемии ТВ способствует инфицирование ТВ пациентов с ВИЧ и увеличение количества штаммов ТВ с множественной лекарственной устойчивостью (MDR-TB). Реактивация латентного ТВ представляет собой фактор высокого риска для развития заболевания и составляет 32% смертельных случаев у зараженных ВИЧ людей. Для того чтобы контролировать эпидемию ТВ, имеет место потребность в обнаружении новых лекарственных средств, которые могут уничтожить неактивные или латентные бациллы. Латентный ТВ может стать реактивированным, чтобы вызвать заболевание, посредством нескольких факторов, таких как подавление иммунитета хозяина, при использовании иммуносупрессирующих средств, таких как антитела против фактора некроза опухолиили интерферона-. В случае ВИЧ-инфицированных пациентов единственное профилактическое лечение, доступное для латентного ТВ, представляет собой схему лечения в течение двух-трех месяцев рифампицином, пиразинамидом. Эффективность схемы лечения все еще не ясна, и, кроме того, продолжительность лечения является важным ограничением в ресурсо-ограниченном социуме. Таким образом, существует настоятельная потребность в определении новых лекарственных средств, которые могут действовать в качестве химиопрофилактических средств для пациентов, имеющих латентные бациллы ТВ. Туберкулезные бациллы попадают к здоровым людям при вдохе; они фагоцитируются альвеолярными макрофагами легких. Это приводит к появлению сильного иммунного ответа и образованию гранулем, которые состоят из макрофагов, зараженных М. tuberculosis, окруженных Т-клетками. После периода 6-8 недель иммунный ответ хозяина вызывает гибель зараженных клеток посредством некроза и накопления казеозного вещества с некоторыми внеклеточными бациллами, окруженными макрофагами,эпителиоидными клетками и слоями лимфатической ткани по краям. В случае здоровых людей большинство микобактерий гибнет в таком окружении, но небольшая часть бацилл все же выживают и, как полагают, существуют в нереплицирующемся состоянии пониженного метаболизма, и они устойчивы в отношении гибели от лекарственных средств против ТВ, таких как изониазид. Данные бациллы могут остаться в измененном физиологическом окружении даже в течение целой жизни человека, не проявляя клинических признаков заболевания. Однако в 10% случаев такие латентные бациллы могут реактивироваться и вызвать заболевание. Одна из гипотез о развитии таких персистирующих бактерий заключается в патофизиологическом окружении в поврежденных тканях человека, а именно пониженном давлении кислорода, ограничении в питательных веществах и кислом рН. Данные факторы, как постулировалось,приводили данные бактерии в состояние фенотипически устойчивых к основным противомикобактериальным лекарственным средствам. В дополнение к контролю над эпидемией ТВ существует новая проблема устойчивости к антибиотикам первого поколения. Некоторые важные примеры включают устойчивые к пенициллину Streptococcus pneumoniae, устойчивые к ванкомицину энтерококки, устойчивые к метициллину Staphylococcusaureus, устойчивые ко многим препаратам сальмонеллы. Последствия устойчивости к антибиотикам серьезны. Инфекции, вызванные устойчивыми микробами, не в состоянии ответить на лечение, приводя к продолжительной болезни и большему риску смерти. Терапевтические неудачи также приводят к более длинным периодам инфекционности, которые увеличивают количество зараженных людей, передвигающихся в сообществе и, таким образом, подвергающих все слои населения риску заражения устойчивым штаммом. Больницы представляют собой крайне важный компонент проблемы устойчивости к антибактериальным препаратам во всем мире. Комбинация очень восприимчивых пациентов, интенсивного и продолжительного применения антибактериальных препаратов и внутрибольничная инфекция привела к появлению инфекций с очень устойчивыми бактериальными патогенами. Самолечение антибактериальными препаратами является другим основным фактором, вносящим вклад в устойчивость. Самолечение антибактериальными препаратами может быть излишним, часто неадекватно дозирующимся или, возможно, не содержит адекватного количества активного лекарственного средства. Соблюдение пациентом рекомендуемой схемы лечения является другой большой проблемой. Пациенты забывают принимать лекарственное средство, прерывают его прием, когда они начинают чувствовать себя лучше, или могут оказаться неспособными обеспечить полный курс, таким образом, создавая идеальное окружение микробам для того, чтобы приспособиться, а не подвергнуться уничтожению. Вследствие появляющейся устойчивости к множеству антибиотиков врачи сталкиваются с инфек-2 016760 циями, для которых не существует какой-либо эффективной терапии. Заболеваемость, смертность и финансовые затраты при таких инфекциях определяют увеличивающиеся затраты для систем здравоохранения во всем мире. Вследствие этого существует большая потребность в новых соединениях для лечения бактериальных инфекций, особенно вызванных микобактериями инфекций, включающих вызванные микобактериями инфекции с лекарственной устойчивостью и латентные инфекции, а также другие бактериальные инфекции, особенно вызванные устойчивыми бактериальными штаммами. В WO 2004/011436, WO 2005/070924, WO 2005/070430 и WO 2005/075428 описаны некоторые производные замещенных хинолинов, обладающие активностью в отношении Mycobacteria, в частности в отношении Mycobacterium tuberculosis. В WO 2005/117875 описаны производные замещенных хинолинов, обладающие активностью в отношении устойчивых штаммов микобактерий. В WO 2006/067048 описаны производные замещенных хинолинов, обладающие активностью в отношении латентного туберкулеза. Одно особое соединение из таких производных замещенных хинолинов описано в Science(2005), 307, 223-227 и его способ действия описан в WO 2006/035051. Другие замещенные хинолины для лечения устойчивых к антибиотикам инфекций описаны в US 5965572 (Соединенные Штаты Америки) и для ингибирования роста бактериальных микроорганизмов - вWO 00/34265. Задачей настоящего изобретения является предоставление новых соединений, в особенности производных замещенных хинолинов, обладающих свойством ингибировать рост бактерий, особенно микобактерий, а также и других бактерий, таких как стрептококки и стафилококки, и соединения вследствие этого являются полезными при лечении бактериальных заболеваний, особенно таких заболеваний, которые вызваны патогенными бактериями, такими как Streptococcus pneumonia, Staphylococcus aureus илиMycobacterium tuberculosis (включая заболевание в латентной форме и включая устойчивые к лекарствам штаммы М. tuberculosis), M. bovis, M. leprae, M. avium и М. marinum. Сущность изобретения Настоящее изобретение относится к новым производным замещенных хинолинов формулы (Ia) или включая их любые стереохимически изомерные формы, где р является целым числом, равным 1 или 2;R4 представляет собой водород или С 1-6 алкил;R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила; гексагидро-1 Н-азепинила; гексагидро-1 Н-1,4-диазепинила; гексагидро-1,4-оксазепинила; 2,5-диазабицикло[2.2.1]гептила; 1,1-диоксидтиоморфолинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С 1-6 алкила, галогенС 1-6 алкила, С 1-6 алкилкарбонила, галогена, арилС 1-6 алкила, гидроксигруппы, С 1-6 алкилоксигруппы, аминогруппы, моно- или ди(C1-6)алкиламиногруппы, моно- или ди(C1-6)алкиламиноС 1-6 алкила, С 1-6 алкилтиогруппы, С 1-6 алкилоксиС 1-6 алкила, С 1-6 алкилтиоС 1-6 алкила, арила, пиперидинила, необязательно замещенного С 1-6 алкилом, пирролидинила, необязательно замещенного арилС 1-6 алкилом, пиридила или пиримидинила; илиR4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, С 1-6 алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС 1-6 алкилом;R6 представляет собой арил 1 или Het;R7 представляет собой водород или С 1-6 алкил;R8 представляет собой водород или С 1-6 алкил;R9 представляет собой оксогруппу; арил представляет собой гомоциклил, выбранный из фенила, или нафтила, причем каждый необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(С 1-6)алкиламиногруппы, С 1-6 алкила, С 2-6 алкенила, необязательно замещенного фенилом, галогенС 1-6 алкила, С 1-6 алкилоксигруппы, галогенС 1-6 алкилоксигруппы, карбоксила, С 1-6 алкилоксикарбонила, аминокарбонила, морфолинила или моноили ди(С 1-6)алкиламинокарбонила; арил 1 представляет собой гомоцикл, выбранный из фенила или нафтила, причем каждый необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(С 1-6)алкиламиногруппы, С 1-6 алкила, галогенС 1-6 алкила, С 1-6 алкилоксигруппы, С 1-6 алкилтиогруппы, галогенС 1-6 алкилоксигруппы, карбоксила, С 1-6 алкилоксикарбонила, аминокарбонила, морфолинила, Het или моно- или ди(С 1-6)алкиламинокарбонила;Het представляет собой моноциклический гетероцикл, выбранный из пиперидинила, пиперазина или пиридинила; причем каждый гетероцикл необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из галогена, гидроксигруппы, С 1-6 алкила или С 1-6 алкилоксигруппы; их N-оксидам, их фармацевтически приемлемым солям или их сольватам. Как используется в настоящем описании, термин соединения формулы (Ia) или (Ib)или соединения по изобретению, как подразумевают, также включает их фармацевтически приемлемые соли или их N-оксидные формы, или их сольваты. Соединения формулы (Ia) и (Ib) взаимосвязаны в том смысле, что, например, соединение формулы(Ib) с R9, соответствующим оксогруппе, и R8, соответствующим водороду, представляет собой таутомерный эквивалент соединения формулы (Ia) с R2, соответствующим гидроксигруппе (кето-енольная таутомерия). В определении Het он предназначен включать все возможные изомерные формы гетероциклов. Арил, арил 1 или Het, перечисленные в определениях для заместителей соединения формулы (Ia) или(Ib) (см., например, R3 или R6), как указано выше и в дальнейшем, могут присоединяться к оставшейся части молекулы формулы (Ia) или (Ib) через любой углерод или гетероатом кольца при необходимости,если не указано иное. Таким образом, например, когда Het представляет собой пиридинил, он может представлять собой 1-пиридинил, 2-пиридинил, 4-пиридинил и т.п. Линии, проведенные от заместителей в кольцевых системах, указывают на то, что связь может присоединяться к любому из подходящих атомов кольца. Фармацевтически приемлемые соли, как указано выше или в дальнейшем, как подразумевают, также включают терапевтически активные нетоксичные формы аддитивных солей кислот, которые способны образовывать соединения формулы (Ia) или формулы (Ib). Указанные аддитивные соли кислот могут быть получены обработкой основной формы соединений формулы (Ia) или формулы (Ib) подходящими кислотами, например неорганическими кислотами, например галогенводородными кислотами, в особенности хлористо-водородной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памовой кислотой. Соединения формулы (Ia) или (Ib), содержащие кислотные протоны, можно преобразовать в их терапевтически активные формы аддитивных солей нетоксичного металла или амина обработкой соответствующими органическими и неорганическими основаниями. Фармацевтически приемлемые соли, как указано выше и в дальнейшем, как подразумевают, также включают терапевтически активные формы аддитивных солей нетоксичного металла или амина (формы аддитивной соли основания), которые способны образовывать соединения формулы (Ia) или (Ib). Подходящие аддитивные соли основания включают, например, соли аммония, соли щелочных металлов и щелочно-земельных металлов, например литиевую, натриевую, калиевую, магниевую, кальциевую соли и подобные, соли органических оснований,например первичных, вторичных и третичных алифатических и ароматических аминов, такие как соли метиламина, этиламина, пропиламина, изопропиламина, четырех изомеров бутиламина, диметиламина,диэтиламина, диэтаноламина, дипропиламина, диизопропиламина, ди-н-бутиламина, пирролидина, пиперидина, морфолина, триметиламина, триэтиламина, трипропиламина, хинуклидина, пиридина, хинолина и изохинолина, бензатина, N-метил-D-глюкамина, 2-амино-2-(гидроксиметил)-1,3-пропандиола,гидрабамина и соли аминокислот, таких как, например, аргинин, лизин и т.п. И наоборот, указанные формы аддитивных солей кислоты или основания можно преобразовать в-4 016760 свободные формы обработкой подходящими основанием или кислотой. Термин фармацевтически приемлемая соль также включает соли четвертичного аммония (четвертичных аминов), которые способны образовывать соединения формулы (Ia) или (Ib) при взаимодействии основного азота соединения формулы (Ia) или (Ib) и подходящего средства кватернизации, такого как,например, необязательно замещенный С 1-6 алкилгалогенид, С 1-6 алкилгалогенид, С 1-6 алкилкарбонилгалогенид, арилкарбонилгалогенид, HetC1-6 алкилгалогенид или Hetкарбонилгалогенид, например метилйодид или бензилйодид. Предпочтительно Het представляет собой моноциклический гетероцикл, выбранный из пиперидинила, пиперазина или пиридинила; причем каждый моноциклический гетероцикл необязательно может быть замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из группы галогена, алкила и алкилоксигруппы. Предпочтительно средство кватернизации представляет собой С 1-6 алкилгалогенид. Также можно использовать другие реагенты с хорошо удаляемыми группами, такие как С 1-6 алкилтрифторметансульфонаты, С 1-6 алкилметансульфонаты и С 1-6 алкил-птолуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат, ацетат, трифлат, сульфат, сульфонат. Предпочтительно противоион представляет собой йод. Выбранный противоион можно вводить, используя ионообменные смолы. Термин сольват включает гидраты и дополнительные виды растворителей, которые способны образовывать соединения формулы (Ia) или (Ib), а также их соли. Примеры таких форм представляют собой,например, гидраты, алкоголяты и т.п. Как использовано в данном описании, соединение по изобретению по своей природе, как предполагают, включает все его стереохимически изомерные формы. Используемый в настоящем описании выше или в дальнейшем термин стереохимически изомерные формы означает все возможные стереоизомерные формы, которыми могут обладать соединения формулы (Ia) и (Ib) и их N-оксиды, фармацевтически приемлемые соли или сольваты. Если не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут находиться либо в цис-, либо в трансконфигурации. Соединения, содержащие двойные связи, могут обладать Е (напротив) или Z (на одну сторону) стереохимией при указанной двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области. Стереохимически изомерные формы соединений формулы (Ia) и (Ib), как очевидно предполагают,входят в объем данного изобретения. Особый интерес представляют такие соединения формулы (Ia) или(Ib), которые являются стереохимически чистыми. Следуя соглашениям по номенклатуре CAS, когда в молекуле присутствуют два стереогенных центра абсолютно известной конфигурации, обозначение R или S присваивают (на основе правила последовательности Кана-Ингольда-Прелога) хиральному центру с наименьшей нумерацией, точке отсчета. Конфигурацию второго стереогенного центра указывают, используя относительные обозначения [R,R] или[R,S], где R всегда определен как точка отсчета, и [R,R] обозначает центры с одной и той же хиральностью, и [R,S] обозначает центры с противоположной хиральностью. Например, если хиральный центр с наименьшей нумерацией в молекуле имеет S-конфигурацию и второй центр представляет собойR, стереобозначение будет определено как S-[R,S]. Если используюти : положение заместителя с наивысшим приоритетом при асимметричном атоме углерода в кольцевой системе, обладающее наименьшей нумерацией в кольце, всегда произвольно находится в положениипо средней плоскости,определяемой кольцевой системой. Положение заместителя с наивысшим приоритетом при другом асимметричном атоме углерода в кольцевой системе относительно положения заместителя с наивысшим приоритетом при начальном в отсчете атоме обозначают , если он находится с той же самой стороны по средней плоскости, определяемой кольцевой системой, или , если он находится с другой стороны от средней плоскости, определяемой кольцевой системой. Когда указана конкретная стереоизомерная форма, это означает, что указанная форма, по существу,не содержит, то есть ассоциирована менее чем с 50%, предпочтительно менее чем с 20%, более предпочтительно менее чем с 10%, даже более предпочтительно менее чем с 5%, дополнительно предпочтительно менее чем с 2% и наиболее предпочтительно менее чем с 1% другого изомера(ов). Таким образом,когда соединение формулы (Ia) или (Ib), например, определено как (R,S), это означает, что соединение,по существу, не содержит изомер (S,R). Соединения как формулы (Ia), так и (Ib) и некоторые промежуточные соединения неизменно содержат по меньшей мере два стереогенных центра в своих структурах, которые могут привести к появлению по меньшей мере 4 стереохимически различных структур. Соединения как формулы (Ia), так и (Ib) можно синтезировать в виде смесей, в частности рацемических смесей, энантиомеров, которые можно отделить друг от друга, следуя известной в данной области методике разделения. Рацемические соединения как формулы (Ia), так и (Ib) можно преобразовать в со-5 016760 ответствующие формы диастереоизомерных солей путем взаимодействия с подходящей хиральной кислотой. Указанные формы диастереоизомерных солей впоследствии разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры отделяют оттуда щелочью. Альтернативный способ разделения энантиомерных форм соединений как формулы (Ia), так и (Ib) включает жидкостную хроматографию с хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция проходит стереоспецифично. Предпочтительно, если необходим конкретный стереоизомер, указанное соединение будут синтезировать при помощи стереоспецифичных способов получения. В таких способах будут предпочтительно использовать чистые исходные вещества. Таутомерные формы соединений формулы (Ia) или (Ib), как подразумевают, включают такие соединения формулы (Ia) или (Ib), где, например, енольная группа превращается в кетогруппу (кето-енольная таутомерия). Таутомерные формы соединений формулы (Ia) и (Ib) или промежуточных продуктов по настоящему изобретению, как предполагают, входят в объем данного изобретения.(Ia) или (Ib), где один или несколько третичных атомов азота окислены до так называемого N-оксида. Соединения формулы (Ia) и (Ib) можно преобразовать в соответствующие N-оксидные формы, следуя известным в данной области методикам преобразования трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления можно, как правило, проводить путем взаимодействия исходного вещества формулы (Ia) или (Ib) с подходящими органическими или неорганическими пероксидами. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота, или галогензамещенные бензолкарбопероксикислоты, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроксипероксиды, например трет-бутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Как использовано в данном описании, соединение по изобретению по своей природе, как предполагают, включает все изотопные комбинации его химических элементов. Как использовано в данном описании, химический элемент, в частности, когда упоминается в связи с соединением формулы (Ia) или(Ib), включает все изотопы и смеси изотопов данного элемента, либо встречающиеся в природе, либо полученные синтетически, либо в естественном количестве, либо в изотопно обогащенной форме. В частности, когда упоминают водород, он, как понимают, означает 1 Н, 2 Н, 3 Н и их смеси; когда упоминают углерод, он, как понимают, означает 11 С, 12 С, 13 С, 14 С и их смеси; когда упоминают азот, он, как понимают, означает 13N, 14N, 15N и их смеси; когда упоминают кислород, он, как понимают, означает 14O, 15O,16O, 17O, 18O и их смеси; и когда упоминают фтор, он, как понимают, означает 18F, 19F и их смеси. Следовательно, соединение по изобретению по своей природе включает соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивное соединение, также называемое меченное радиоизотопом соединение, где один или несколько нерадиоактивных атомов заменен одним из его радиоактивных изотопов. Под термином меченное радиоизотопом соединение понимают любое соединение формулы (Ia) или (Ib), его фармацевтически приемлемую соль или его N-оксидную форму или его сольват, который содержит по меньшей мере один радиоактивный атом. Например, соединение можно пометить испускающими позитроны или -излучение радиоактивными изотопами. Для методик радиолигандного связывания (анализ мембранного рецептора), атом 3 Н или атом 125I представляет собой атом выбора для замещения. Для формирования изображений наиболее общепринятыми позитронно-активными (PET) радиоактивными изотопами являются 11 С, 18F, 15O и 13N, все из которых получают в ускорителе и имеют период полураспада 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада данных радиоактивных изотопов настолько коротки, их возможно использовать только в учреждениях, в которых есть ускоритель на месте их получения, что, таким образом, ограничивает их применение. Наиболее широко используемыми из них являются 18F, 99mTc, 201Tl и 123I. Обращение с данными радиоактивными изотопами, их производство, выделение и включение в молекулу известны специалисту в данной области. В частности, радиоактивный атом выбирают из группы водорода, углерода, азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбирают из группы водорода, углерода и галогена. В частности, радиоактивный изотоп выбирают из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br,77Br и 82Br. Предпочтительно радиоактивный изотоп выбирают из группы 3 Н, 11 С и 18F. Как использовано в данном описании, алкил представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или он представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов-6 016760 углерода, присоединенный к неразветвленному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен цианогруппой, гидроксигруппой, С 1-6 алкилоксигруппой или оксогруппой. Предпочтительно алкил представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал,содержащий от 1 до 6 атомов углерода; или он представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углеродов; где каждый атом углерода может быть необязательно замещен гидроксилом или C1-6 алкилоксигруппой. Предпочтительно алкил представляет собой метил, этил или циклогексилметил, более предпочтительно метил или этил. Представляющим интерес вариантом осуществления алкила во всех определениях, используемых выше или в дальнейшем, является С 1-6 алкил, который представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил, пентил, гексил и т.п. Предпочтительная подгруппа С 1-6 алкил представляет собой С 1-4 алкил, который представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 4 атомов углерода, такой как,например, метил, этил, пропил, 2-метилэтил и т.п. Как использовано в данном описании, С 2-6 алкенил представляет собой неразветвленный или разветвленный углеводородный радикал, содержащий от 2 до 6 атомов углерода, содержащий двойную связь, такой как этенил, пропенил, бутенил, пентенил, гексенил и т.п.; С 2-6 алкинил представляет собой неразветвленный или разветвленный углеводородный радикал, содержащий от 2 до 6 атомов углерода,содержащий тройную связь, такой как этинил, пропинил, бутинил, пентинил, гексинил и т.п.; С 3-6 циклоалкил представляет собой циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, и является общим термином для циклопропила, циклобутила, циклопентила, циклогексила. Как использовано в данном описании, галоген представляет собой заместитель, выбранный из группы фтора, хлора, брома и йода, и галогеналкил представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к неразветвленному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена. Предпочтительно галоген представляет собой бром, фтор или хлор; в особенности хлор или бром. Предпочтительно галогеналкил представляет собой полигалогенС 1-6 алкил, который определен как моно- или полигалогензамещенный С 1-6 алкил, например метил с одним или несколькими атомами фтора, например дифторметил или трифторметил, 1,1-дифторэтил и т.п. В случае более чем одного атома галогена, присоединенного к алкилу или С 1-6 алкильной группе, в рамках определения галогеналкила или полигалогенС 1-6 алкила, они могут быть одинаковыми или различными. Первый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib), где R1 представляет собой водород или галоген. Второй представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, где р равно 1. Третий представляющий интерес вариант осуществления относится к соединению формулы (Ia) или(Ib) или любой его подгруппе, где R2 представляет собой С 1-6 алкилоксигруппу, предпочтительно метилоксигруппу. Четвертый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R3 представляет собой арилС 1-6 алкил или арил; в частности, где арил представляет собой необязательно замещенный фенил или необязательно замещенный нафтил; наиболее конкретно фенил, нафтил, арилС 1-6 алкил, где арил представляет собой фенил или нафтил. Пятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или(Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где q равно 3 или 4. Шестой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R4 представляет собой водород или C1-6 алкил; более конкретно водород или метил; наиболее конкретно метил. Седьмой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R5 представляет собой -С(=NH)-NH2; Het-C1-6 алкил; бицикло[2.2.1]гептил или Het. Восьмой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы,состоящей из азетидинила,гексагидро-1 Н-1,4-диазепинила,2,5-7 016760 диазабицикло[2.2.1]гептила или гексагидро-1 Н-азепинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С 1-6 алкила или арилС 1-6 алкила; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, C1-6 алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС 1-6 алкилом. Девятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила, гексагидро-1 Н-1,4-диазепинила, 2,5-диазабицикло[2.2.1]гептила или гексагидро-1 Н-азепинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С 1-6 алкила или арилС 1-6 алкила. Десятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R6 представляет собой фенил, необязательно замещенный галогеном. Одиннадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где R7 представляет собой водород. Двенадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где соединение представляет собой соединение формулы (Ia). Тринадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где соединение представляет собой соединение формулы (Ib) и где R8 представляет собой водород. Четврнадцатый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или (Ib) или любой его подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления, где соединение представляет собой соединение формулы (Ia), где R1 представляет собой водород или галоген; R2 представляет собой С 1-6 алкилоксигруппу; R3 представляет собой арилС 1-6 алкил или арил; R4 представляет собой водород или С 1-6 алкил; R5 представляет собой -С(=NH)-NH2; HetC1-6 алкил; моно- или ди(С 1-6 алкил)аминоС 1-6 алкил; бицикло[2.2.1]гептил или Het; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, состоящей из азетидинила; гексагидро-1 Н-азепинила; гексагидро-1 Н-1,4-диазепинила; 2,5-диазабицикло[2.2.1]гептила или 1,1-диоксидтиоморфолинила; причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями, где каждый заместитель независимо выбран из С 1-6 алкила, арилС 1-6 алкила, пиперидинила, необязательно замещенного С 1-6 алкилом; или R4 и R5 вместе с атомом азота, к которому они присоединены,образуют радикал, выбранный из группы, состоящей из пиперидинила или пиперазинила, причем каждый замещен арилом, С 1-6 алкилкарбонилом, пиперидинилом или пирролидинилом, необязательно замещенным арилС 1-6 алкилом; R6 представляет собой фенил, необязательно замещенный галогеном; R7 представляет собой водород; q равно 3 или 4; р равно 1. Пятнадцатый представляющий интерес вариант осуществления относится к соединению формулы включая их любую стереохимически изомерную форму; его N-оксид, его фармацевтически приемлемую соль или его сольват. Как использовано в данном описании, хинолиновое кольцо соединения формулы (Ia) или (Ib) нумеруется следующим образом: Шестнадцатый представляющий интерес вариант осуществления представляет собой применение соединения формулы (Ia) или (Ib) или любой его подгруппы, как указано выше, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения бактериальной инфекции, вызванной грамположительной и/или грамотрицательной бактерией, предпочтительно бактериальной инфекции, вызванной грамположительной бактерией. Семнадцатый представляющий интерес вариант осуществления представляет собой применение соединения формулы (Ia) или (Ib) или любой его подгруппы, как указано выше, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения бактериальной инфекции, где соединение формулы (Ia) или (Ib) имеет IC90 15 мкл/мл против по меньшей мере одной бактерии, в частности грамположительной бактерии; предпочтительно IC90 10 мкл/мл; более предпочтительно IC90 5 мкл/мл; причем величину IC90 определяют, как описано ниже. Предпочтительно в соединениях формулы (Ia) и (Ib) или любой их подгруппе, как указано выше, в качестве представляющего интерес варианта осуществления термин алкил представляет собой С 1-6 алкил, более предпочтительно С 1-4 алкил, и термин галогеналкил представляет собой полигалогенС 1-6 алкил. Предпочтительно соединение формулы (Ia) или (Ib) представляет собой конкретную смесь энантиомеров (в дальнейшем обозначенную как конкретный диастереоизомер А или В) и, таким образом, по существу, не содержит другого диастереоизомера(ов. В случае если соединение формулы (Ia) или (Ib) содержит два хиральных центра, это означает, что соединение представляет собой смесь, в частности рацемическую смесь, (R,S) и (S,R) энантиомеров или смесь, в частности рацемическую смесь, (R,R) и(S,S) энантиомеров. В дальнейшем смеси, в частности рацемические смеси, 2 энантиомеров обозначают как диастереоизомер А или В. Обозначают ли рацемическую смесь как А или В, зависит от того, выделена ли она первой по протоколу синтеза (то есть А) или второй (то есть В). Более предпочтительно соединение формулы (Ia) или (Ib) представляет собой конкретный энантиомер (по существу, не содержащий других энантиомеров). В случае если соединение формулы (Ia) или (Ib) содержит два хиральных центра,это означает, что соединение представляет собой (R,S), (S,R), (R,R) или (S,S) энантиомер. В дальнейшем указанные конкретные энантиомеры обозначают как А 1, А 2, В 1 или В 2. Обозначают ли энантиомер как А 1, А 2, В 1 или В 2 зависит от того, выделяли ли его первым или вторым (1 или 2) по протоколу синтеза и отделяли ли его от диастереоизомера А (А 1, А 2) или В (B1, B2). В частности, предпочтительными соединениями по настоящему изобретению являются соединения 53, 40, 47, 2, 33, 18 и 34d (см. таблицы далее); их N-оксид, их фармацевтически приемлемая соль или их сольват.-9 016760 Фармакология Соединения по изобретению, как на удивление было показано, подходят для лечения бактериальной инфекции, включая вызванную микобактериями инфекцию, особенно такие заболевания, вызванные патогенными микобактериями, такими как Mycobacterium tuberculosis (включая их латентную форму и форму с лекарственной устойчивостью), М. bovis, M. avium, M. leprae и М. marinum. Настоящее изобретение, таким образом, также относится к соединениям формулы (Ia) или (Ib), как определено выше в настоящем описании, их фармацевтически приемлемым солям или их N-оксидным формам или их сольватам для применения в качестве лекарственного средства, в частности для применения в качестве лекарственного средства для лечения бактериальной инфекции, включая вызванную микобактериями инфекцию. Дополнительно настоящее изобретение также относится к применению соединения формулы (Ia) или (Ib), их фармацевтически приемлемых солей или их N-оксидных форм или их сольватов, а также любой из их фармацевтических композиций, как описано в настоящем описании, для изготовления лекарственного средства для лечения бактериальной инфекции, включая вызванную микобактериями инфекцию. Соответственно, в другом аспекте изобретение относится к способу лечения пациента, страдающего от бактериальной инфекции или находящегося в группе риска заражения бактериальной инфекцией,включая вызванной микобактериями инфекцией, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции по изобретению. В дополнение к их активности против микобактерий соединения по изобретению также активны против других бактерий. Как правило, бактериальные патогены могут быть классифицированы как либо грамположительные, либо грамотрицательные патогены. Антибиотики с активностью против как грамположительных, так и грамотрицательных патогенов, как правило, рассматривают в качестве обладающих широким спектром активности. Соединения по настоящему изобретению рассматривают как активные против грамположительных и/или грамотрицательных бактериальных патогенов, в частности против грамположительных бактериальных патогенов. В частности, настоящие соединения активны по меньшей мере против одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, более предпочтительно против одной или нескольких грамположительных бактерий и/или одной или нескольких грамотрицательных бактерий. Настоящие соединения обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включают стафилококки, например S. aureus; энтерококки, например Е. faecalis; стрептококки, например S. pneumoniae, S. mutans, S. pyogens; бациллы, например Bacillus subtilis; листерии, например Listeria monocytogenes; Haemophilus, например H. influenza; Moraxella, например М. catarrhalis; Pseudomonas, напримерPseudomonas aeruginosa; и Escherichia, например Е. coli. Грамположительные патогены, например стафилококки, энтерококки и стрептококки, особенно важны, поскольку развитие устойчивых штаммов, которые и трудно лечить, и трудно устранить, например, из однажды установившейся больничной среды. Примеры таких штаммов представляют собой устойчивый к метициллину Staphylococcus aureus (MRSA),устойчивые к метициллину коагулазонегативный стафилококк (MRCNS), устойчивый к пенициллинуStreptococcus pneumoniae и Enterococcus faecium с множественной устойчивостью. Соединения по настоящему изобретению также проявляют активность против устойчивых бактериальных штаммов. Соединения по настоящему изобретению особенно активны против Streptococcus pneumoniae иStaphylococcus aureus, включая устойчивый Staphylococcus aureus, такой как, например, устойчивый к метициллину Staphylococcus aureus (MRSA). Следовательно, настоящее изобретение также относится к применению соединения формулы (Ia) или (Ib), его фармацевтически приемлемых солей или его N-оксидных форм или его сольватов, а также любой из его фармацевтических композиций, как описано в настоящем описании, для изготовления лекарственного средства для лечения бактериальной инфекции, включая инфекцию, вызванную стафилококками и/или стрептококками. Соответственно, в другом аспекте изобретение относится к способу лечения пациента, страдающего от бактериальной инфекции или находящегося в группе риска заражения бактериальной инфекцией,включающей инфекцию, вызванную стафилококками и/или стрептококками, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции по изобретению. Без связи с какой-либо теорией, полагают, что активность настоящих соединений состоит в ингибировании АТФ-синтазы F1F0, в частности в ингибировании комплекса F0 АТФ-синтазы F1F0, более конкретно в ингибировании субъединицы с комплекса F0 АТФ-синтазы F1F0, приводящем к уничтожению бактерий посредством снижения клеточных уровней АТФ-бактерий. Следовательно, в частности, соединения по настоящему изобретению активны в отношении тех бактерий, жизнеспособность которых зависит от правильного функционирования АТФ-синтазы F1F0. Бактериальные инфекции, которые можно лечить настоящими соединениями, включают, например,- 10016760 инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый отит среднего уха, инфекции краниальных пазух, глазные инфекции, инфекции полости рта, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, инфекции мочеполовой системы, желудочно-кишечные инфекции, гинекологические инфекции, сепсис, инфекции костей и суставов, инфекции кожи и кожных структур, бактериальный эндокардит, ожоги, антибактериальную профилактику хирургических операций и антибактериальную профилактику у пациентов с ослабленным иммунитетом, таких как пациенты, получающие химиотерапию против рака, или пациент с пересаженными органами. Как используется в настоящем описании выше или в дальнейшем, настоящие соединения могут лечить бактериальную инфекцию, означает, что соединения могут лечить инфекцию, вызванную одним или несколькими бактериальными штаммами. Изобретение также относится к композициям, содержащим фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по изобретению. Соединения по изобретению могут быть получены в различных фармацевтических формах для целей введения. При необходимости композиции, в данном случае можно указать все композиции, обычно применяют для системного введения лекарственных средств. Для того чтобы получить фармацевтические композиции по данному изобретению, эффективное количество конкретного соединения, необязательно в виде аддитивной соли, в качестве активного ингредиента объединяют в тщательно перемешанные смеси с фармацевтически приемлемым носителем, который может иметь широкое разнообразие форм в зависимости от формы препарата, необходимого для введения. Такие фармацевтические композиции необходимы в единичной дозированной форме, подходящей, в частности, для введения перорально или для парентеральной инъекции. Например, для получения композиций в дозированной форме для перорального введения можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, спирты и тому подобное, в случае жидких препаратов для перорального введения,таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие вещества, дезинтегрирующие вещества и тому подобное в случае порошков, пилюль, капсул и таблеток. Вследствие простоты их введения таблетки и капсулы представляют собой самые эффективные единичные дозированные формы для перорального введения, в случае которых очевидно используются твердые фармацевтические носители. Для композиций для парентерального введения носитель будет обычно включать, по меньшей мере в значительной степени, стерильную воду, хотя можно включать в состав другие ингредиенты, например, чтобы способствовать растворимости. Например, могут быть получены растворы, пригодные для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены суспензии, пригодные для инъекций, в случае которых можно использовать подходящие жидкие носители, суспендирующие средства и т.п. Также включенными являются препараты твердых форм, которые предназначены для преобразования непосредственно перед применением в препараты жидких форм. В зависимости от способа введения, фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, даже более предпочтительно от 0,1 до 50 мас.% активного ингредиента(ов) и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%,даже более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, причем все процентные соотношения исходят от общей массы композиции. Фармацевтическая композиция может дополнительно содержать другие различные ингредиенты,известные в данной области, например лубрикант, стабилизирующее вещество, буферное средство,эмульгатор, регулирующее вязкость средство, поверхностно-активное вещество, консервант, ароматизирующее вещество или краситель. Особенно эффективно получать указанные выше фармацевтические композиции в единичной дозированной форме для простого введения и единообразия дозирования. Единичная дозированная форма,как использовано в настоящем описании, относится к физически дискретным единицам, подходящим в качестве единичных доз, причем каждая единица содержит предварительно конкретное количество активного ингредиента, рассчитанное таким образом, чтобы оказывать требуемый терапевтический эффект, вместе с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включающие таблетки с насечкой или таблетки в оболочке), капсулы, пилюли,пакеты с порошком, пластинки, суппозитории, инъецируемые растворы или суспензии и т.п. и их раздельные части. Ежедневная дозировка соединения по изобретению будет, конечно, изменяться в зависимости от применяемого соединения, способа введения, необходимого лечения и указанного заболевания,вызванного микобактериями. Однако, как правило, удовлетворительные результаты будут получены,когда соединение по изобретению вводят при ежедневной дозировке, не превышающей 1 г, например в диапазоне от 10 до 50 мг/кг массы тела. Учитывая, что соединения формулы (Ia) или формулы (Ib) активны против бактериальных инфекций, настоящие соединения можно комбинировать с другими антибактериальными средствами для того,чтобы эффективно бороться с бактериальными инфекциями.- 11016760 Следовательно, настоящее изобретение также относится к комбинации (а) соединения по изобретению и (b) одного или нескольких других антибактериальных средств. Настоящее изобретение также относится к комбинации (а) соединения по изобретению и (b) одного или нескольких других антибактериальных средств для применения в качестве лекарственного средства. Настоящее изобретение также относится к применению комбинации или фармацевтической композиции, как непосредственно определено выше, для лечения бактериальной инфекции. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения по изобретению и (b) один или несколько других антибактериальных средств, также охвачена настоящим изобретением. Массовое соотношение (а) соединения по изобретению и (b) другого антибактериального средства(средств) при введении в виде комбинации может определить специалист в данной области. Указанное соотношение и точная дозировка и частота введения зависят от конкретного соединения по изобретению и другого используемого антибактериального средства(средств), конкретного состояния при лечении,тяжести состояния при лечении, возраста, массы, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также других лекарственных средств, возможно применяемых пациентом, как хорошо известно специалистам в данной области. Кроме того, доказано,что эффективное ежедневное количество можно снижать или повышать в зависимости от ответа получающего лечение пациента и/или в зависимости от оценки лечащего врача, предписывающего соединения по настоящему изобретению. Конкретное массовое соотношение для настоящего соединения формулы (Ia) или (Ib) и другого антибактериального средства может находиться в диапазоне от 1/10 до 10/1, более конкретно от 1/5 до 5/1,наиболее конкретно от 1/3 до 3/1. Соединения по изобретению и одно или несколько других антибактериальных средств можно объединить в один препарат или их можно получить в виде отдельных препаратов таким образом, чтобы их можно было вводить одновременно, отдельно или последовательно. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение по изобретению и (b) одно или несколько других антибактериальных средств в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении бактериальной инфекции. Другие антибактериальные средства, которые можно комбинировать с соединениями формулы (Ia) или (Ib), представляют собой, например, антибактериальные средства, известные в данной области. Другие антибактериальные средства включают антибиотики группы -лактамов, такие как природные пенициллины, полусинтетические пенициллины, природные цефалоспорины, полусинтетические цефалоспорины, цефамицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие какD-(п-гидроксифенил)глицин; D-фенилглицин; энедиины. Конкретные антибиотики, которые можно комбинировать с настоящими соединениями формулы- 12016760 натрия, энрамицин, микамицин, вигринамицин, сульфат капреомицина, биомицин, энвиомицин, ванкомицин, актиномицин D, неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, салиномицин,амфотерицин В, нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицинпальмитата гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникола пальмитат, митомицин С, пирролнитрин, фосфомицин, фусидовую кислоту, бикозамицин, тиамулин, сикканин. Другие средства против микобактерий, которые можно комбинировать с соединениями формулы(Ia) или (Ib), представляют собой, например, рифампицин (=рифампин); изониазид; пиразинамид; амикацин; этионамид; этамбутол; стрептомицин; парааминосалициловую кислоту; циклосерин; капреомицин; канамицин; тиоацетазон; РА-824; хинолоны/фторхинолоны, такие как, например, моксифлоксацин, гатифлоксацин, офлоксацин, ципрофлоксацин, спарфлоксацин; макролиды, такие как, например, кларитромицин, клофазимин, амоксициллин с клавулановой кислотой; рифамицины; рифабутин; рифапентин; соединения, описанные в WO 2004/011436. Общее получение Соединения по изобретению можно, как правило, получить последовательностью стадий, каждая из которых известна специалисту в данной области. Соединения формулы (Ia) или (Ib), где R5 представляет собой -C(=NH)-NH2, причем указанные соединения представлены формулой (Ia-1) или (Ib-1), могут быть получены взаимодействием промежуточного продукта (II-а) или (II-b) с 1 Н-пиразол-1-карбоксимидамидом в присутствии подходящего основания, такого как, например, N-этил-N-(1-метилэтил)-2-пропанамин, и подходящего растворителя, такого как, например, N,N-диметилформамид. Соединения формулы (I-а) или (Ib) также могут быть получены взаимодействием промежуточного продукта формулы (III-а) или (III-b) с промежуточным продуктом формулы (IV) согласно следующей схеме реакции: используя н-BuLi в смеси подходящего основания, такого как, например, диизопропиламин, и подходящего растворителя, такого как, например, тетрагидрофуран, где все переменные являются такими, как определено в формуле (Ia) или (Ib). Перемешивание может увеличить скорость реакции. Реакция может быть осуществлена общепринятым способом при температуре, находящейся в диапазоне от -20 до -70 С. Соединения формулы (Ia) или (Ib), где q равно 2, 3 или 4, причем указанные соединения представлены формулой (Ia-2) или (Ib-2), также могут быть получены взаимодействием промежуточного продукта формулы (V-a) или (V-b), где q' равно 0, 1 или 2, с первичным или вторичным амином HNR4R5 в при- 13016760 сутствии подходящего катализатора, такого как, например, Rh(COd)2BF4, необязательно в присутствии второго катализатора (для восстановления), такого как, например, Ir(COd)2BF4, в присутствии подходящего лиганда, такого как, например, Xantphos, в подходящем растворителе, таком как, например, тетрагидрофуран и спирт, например метанол, в присутствии СО и Н 2 (при давлении) при повышенной температуре. Данную реакцию предпочтительно проводят для промежуточных продуктов формулы (V), где q' равно 1. Соединения формулы (Ia) или (Ib) также могут быть получены взаимодействием промежуточного продукта формулы (VI-а) или (VI-b), где W2 представляет собой подходящую уходящую группу, такую как, например, галоген, например хлор или бром, с подходящим первичным или вторичным амином Полагают, что в пределах знаний специалист в данной области сможет определить подходящие температуры, разбавления и время реакций для того, чтобы оптимизировать указанные выше реакции,для получения необходимого соединения. Соединения формулы (Ia) или (Ib) могут быть дополнительно получены преобразованием соединения формулы (Ia) или (Ib) друг в друга в соответствии с известными в данной области реакциями трансформации групп. Соединения формулы (Ia) или (Ib) можно преобразовать в соответствующие N-оксидные формы,следуя известным в данной области методикам превращения трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления можно, как правило, осуществлять взаимодействием исходного вещества формулы (Ia) или (Ib) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота,или галогензамещенные бензолкарбопероксикислоты, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроксипероксиды, например третбутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие спирты,например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, например бром, можно преобразовать в соединение формулы (Ia) или (Ib), где R1 представляет собой Het, взаимодействием с HetB(OH)2 в присутствии подходящего катализатора, такого как, например, Pd(OAc)2 или Pd(PPh3)4, в присутствии подходящего основания, такого как, например, K3PO4 или Na2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME).- 14016760 Сходным образом соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, например бром, можно преобразовать в соединение формулы (Ia) или (Ib), где R1 представляет собой алкил, например метил, обработкой подходящим алкилирующим агентом, таким как СН 3 В(ОН)2 или (СН 3)4Sn, в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, в присутствии подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME). Соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, в частности бром, можно преобразовать в соединение формулы (Ia) или (Ib), где R1 представляет собой водород, взаимодействием с HCOONH4 в присутствии подходящего катализатора, такого как, например, палладий на углероде, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, в частности бром, можно также преобразовать в соединение, где R1 представляет собой формил, взаимодействием с N,Nдиметилформамидом в присутствии н-BuLi и подходящего растворителя, такого как, например, тетрагидрофуран. Данные соединения можно дополнительно преобразовать в соединение формулы (Ia) или(Ib), где R1 представляет собой -СН 2-ОН, взаимодействием с подходящим восстановителем, таким как,например, NaBH4, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол и тетрагидрофуран. Соединения формулы (Ia) или (Ib), где R1 представляет собой С 2-6 алкенил, могут быть получены взаимодействием соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, например бром и т.п., с трибутил(С 2-6 алкенил)оловом, таким как, например, трибутил(винил)олово, в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, в присутствии подходящего растворителя, такого как, например, N,N-диметилформамид. Данную реакцию предпочтительно проводят при повышенной температуре. Соединения формулы (Ia) или (Ib), где R1 представляет собой R5aR4aN-, могут быть получены из соединения формулы (Ia) или (Ib), где R1 представляет собой галоген, например бром и т.п., взаимодействием с R5aR4aNH в присутствии подходящего катализатора, такого как, например,трис(дибензилиденацетон)палладий, подходящего лиганда, такого как, например, 2-(ди-третбутилфосфино)бифенил, подходящего основания, такого как, например, трет-бутоксид натрия, и подходящего растворителя, такого как, например, толуол. Соединения формулы (Ia) или (Ib), где R1 представляет собой -C=N-OR11, могут быть получены из соединения формулы (Ia) или (Ib), где R1 представляет собой формил, взаимодействием с гидрохлоридом гидроксиламина или гидрохлоридом C1-6 алкоксиламина в присутствии подходящего растворителя, такого как, например, пиридин. Соединения формулы (Ia) или (Ib), где R1 представляет собой -CH2-NH2, могут быть получены из соединения формулы (Ia) или (Ib), где R1 представляет собой формил, восстановлением в присутствии Н 2, подходящего катализатора, такого как, например, палладий на углероде, и подходящего растворителя, такого как, например, NH3/спирт, например NH3/метанол. Соединения формулы (Ia) или (Ib), где R1 представляет собой -CH2-NH2, можно преобразовать в соединение формулы (Ia) или (Ib), где R1 представляет собой -CH2-N(С 1-6 алкил)2, взаимодействием с подходящим реагентом альдегидом или кетоном,таким как, например, параформальдегид или формальдегид, в присутствии цианоборогидрида натрия,уксусной кислоты и подходящего растворителя, такого как, например, ацетонитрил. Соединения формулы (Ia) или (Ib), где R1 представляет собой R5aR4aN-CH2-, могут быть получены взаимодействием соединения формулы (Ia) или (Ib), где R1 представляет собой формил, с подходящим реагентом формулы R5aR4aN-H в присутствии подходящего восстановителя, такого как, например,BH3CN, подходящего растворителя, такого как, например, ацетонитрил и тетрагидрофуран, и подходящего растворителя, такого как, например, уксусная кислота. Соединения формулы (Ia) или (Ib), где R1 представляет собой аминогруппу, могут быть получены взаимодействием соединения формулы (Ia) или (Ib), где R1 представляет собой карбоксил, с подходящим азидом, таким как, например, дифенилфосфорилазид (DPPA), и подходящим основанием, таким как, например, триэтиламин, в подходящем растворителе, таком как, например, толуол. Полученный продукт подвергают реакции Курциуса и добавляют триметилсилилэтанол, с получением карбаматного промежуточного продукта. На следующей стадии промежуточный продукт подвергают взаимодействию с бромидом тетрабутиламмония (ТВАВ) в подходящем растворителе, таком как, например, тетрагидрофуран, с получением аминопроизводного. Соединения формулы (Ia) или (Ib), где R1 представляет собой аминокарбонил, моно- или ди(алкил)аминокарбонил или R5aR4aN-C(=O)-, могут быть получены взаимодействием соединения формулы (Ia) или (Ib), где R1 представляет собой карбоксил, с подходящим амином, подходящим связывающим реагентом, таким как, например, гидроксибензотриазол, подходящим активирующим реагентом,таким как, например, 1,1'-карбонилдиимидазол или N,N'-дициклогексилкарбодиимид или 1-(3 диметиламинопропил)-3-этилкарбодиимид, подходящим основанием, таким как, например, триэтиламин,и подходящим растворителем, таким как, например, тетрагидрофуран и метиленхлорид. Соединения формулы (Ia) или (Ib), где R1 представляет собой арилкарбонил, могут быть получены на первой стадии (а) взаимодействием соединения формулы (Ia) или (Ib), где R1 представляет собой гало- 15016760 ген, например бром и т.п., с подходящим арилальдегидом в присутствии н-BuLi и подходящего растворителя, такого как, например, тетрагидрофуран. Данную реакцию предпочтительно проводят при низкой температуре, такой как, например, -70 С. На следующей стадии (b) продукт, полученный на стадии (а),окисляют при помощи подходящих окисляющих веществ, таких как, например, оксид марганца, в присутствии подходящего растворителя, такого как, например, метиленхлорид. Соединения формулы (Ia) или (Ib), где R4 и R5 представляют собой остаток кольца, замещенный алкилкарбонилом, могут быть получены из соответствующего соединения, где остаток кольца является незамещенным, взаимодействием с подходящим ацилхлоридом, например ацетилхлоридом, в присутствии подходящего основания, такого как, например, триэтиламин, и подходящего растворителя, такого как, например, метиленхлорид. Соединения формулы (Ia) или (Ib), где R4 и R5 представляют собой незамещенный остаток кольца,могут быть получены из соответствующего соединения, где остаток кольца замещен арилалкилом, взаимодействием с формиатом аммония в присутствии подходящего катализатора, такого как, например,палладий на углероде, и подходящего растворителя, такого как, например, спирт, например метанол. Соединения формулы (Ia) или (Ib), где R6 представляет собой фенил, замещенный галогеном, можно преобразовать в соединение формулы (Ia) или (Ib), где R6 представляет собой фенил, замещенный Het,взаимодействием с Het-B(OH)2 в присутствии подходящего катализатора, такого как, например,Pd(PPh3)4, в присутствии подходящего основания, такого как, например, Na2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME) и спирт, например метанол. Соединение формулы (Ia), где R2 представляет собой метоксигруппу, можно преобразовать в соответствующее соединение формулы (Ib), где R8 представляет собой водород и R9 представляет собой оксогруппу, посредством гидролиза в присутствии подходящей кислоты, такой как, например, хлористоводородная кислота, и подходящего растворителя, такого как, например, диоксан. Соединения формулы (Ia) или (Ib), где R4 и R5, взятые вместе с азотом, к которому они присоединены, образуют 1,1-диоксидтиоморфолинил, могут быть получены из соответствующего тиоморфолинового производного взаимодействием с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота,или галогензамещенные бензолкарбопероксикислоты, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроксипероксиды, например третбутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие спирты,например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Соединения формулы (Ia) или (Ib) можно также преобразовать в четвертичный амин взаимодействием с подходящим агентом кватернизации, таким как, например, необязательно замещенный C1-6 алкилгалогенид, арилС 1-6 алкилгалогенид, C1-6 алкилкарбонилгалогенид, арилкарбонилгалогенид, Het1C1-6 алкилгалогенид или Het1 карбонилгалогенид, например метилйодид или бензилйодид, в присутствии подходящего растворителя, такого как, например, ацетон, где Het1 представляет собой фуранил или тиенил; или бициклический гетероцикл, выбранный из бензофуранила или бензотиенила; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями,где каждый заместитель независимо выбран из группы галогена, С 1-6 алкила и арила. Указанные четвертичные амины представлены следующей формулой, где R10 представляет собой С 1-6 алкил, C1-6 алкилкарбонил, арилС 1-6 алкил, арилкарбонил, Het1C1-6 алкил или Het1 карбонил и где А- представляет собой фармацевтически приемлемый противоион, такой как, например, йодид. Очевидно, что в предшествующих и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если это необходимо, дополнительно очищены в соответствии с методами,как правило, известными в данной области, такими как экстракция, кристаллизация и хроматография. Дополнительно очевидно, что продукты реакции, которые существуют в более чем одной энантиомерной форме, могут быть выделены из их смеси известными методиками, в частности препаративной хроматографией, такой как препаративная ВЭЖХ, хиральная хроматография. Отдельные диастереоизомеры или- 16016760 отдельные энантиомеры можно также получить суперкритической жидкостной хроматографией (SCF). Исходные вещества и промежуточные продукты представляют собой соединения, которые либо коммерчески доступны, либо их можно получить в соответствии с общепринятыми реакционными методиками, как правило, известными в данной области. Например, промежуточные продукты формулы (II-а) или (II-b) или (III-а) или (III-b) могут быть получены в соответствии со способами, описанными в WO 2004/011436, WO 2005/070924, WO 2005/070430 или WO 2005/075428, содержания которых включены в настоящее описание посредством ссылки. В частности, промежуточные продукты формулы (II-а) и (II-b) могут быть получены взаимодействием промежуточного продукта формулы (III-а) или (III-b) с промежуточным продуктом формулы (VIII) согласно следующей схеме реакции (1): Схема 1 используя н-BuLi в смеси диизопропиламина и тетрагидрофурана, где все переменные являются такими,как определено в формуле (Ia) или (Ib). Перемешивание может увеличить скорость реакции. Реакция может быть осуществлена общепринятым способом при температуре в диапазоне от -20 до -70 С. Промежуточные продукты формулы (II-а) или (II-b) также могут быть получены из соответствующих промежуточных продуктов, где R5 представляет собой бензил, взаимодействием с 1-хлорэтиловым эфиром карбонохлоридной кислоты в присутствии подходящего растворителя, такого как, например,дихлорэтан. Промежуточные продукты формулы (III-а) могут быть получены согласно следующей схеме реакции (2): Схема 2- 17016760 где все переменные являются такими, как определено в формуле (Ia). Схема реакции (2) включает стадию (а), на которой соответствующим образом замещенный анилин подвергают взаимодействию с подходящим ацилхлоридом, таким как, например, 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или п-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этилендихлорид. Реакцию можно осуществлять общепринятым способом при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения с обратным холодильником. На следующей стадии(b) аддукт, полученный на стадии (а), подвергают взаимодействию с фосфорилхлоридом (POCl3) в присутствии N,N-диметилформамида (формилирование Вильсмайера-Хаака, с последующей циклизацией). Реакцию можно проводить общепринятым способом при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения обратным холодильником. На следующей стадии (с-1) конкретную R2-группу, где R2 представляет собой, например, C1-6 алкилоксирадикал, вводят при взаимодействии промежуточного соединения, полученного на стадии (b), с O-C1-6 алкилом в присутствии подходящего растворителя, такого как, например, HO-C1-6 алкил. Промежуточный продукт, полученный на стадии (b), можно также преобразовать в промежуточный продукт, где R2 представляет собой, например, C1-6 алкилтиорадикал, взаимодействием с S=C(NH2)2 в присутствии подходящего растворителя, такого как,например, спирт, например этанол, или смеси спирт/вода, необязательно в присутствии подходящего растворителя, такого как, например, KOH, (см. стадию (с-2, с последующим взаимодействием с С 1-6 алкил-1 в присутствии подходящего основания, такого как, например, K2CO3, и подходящего растворителя, такого как, например, 2-пропанон (см. стадию (d. Промежуточный продукт, полученный на стадии (b), также можно преобразовать в промежуточный продукт, где R2 представляет собой -N(R2a) (алкил), где R2a представляет собой водород или алкил, путем взаимодействия с подходящей солью NH(R2a)(алкила) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя, такого как, например, ацетонитрил (стадия (с-3. Промежуточный продукт, полученный на стадии (b), также можно преобразовать в промежуточный продукт, где R2 представляет собой С 1-6 алкилоксиС 1-6 алкилоксигруппу, необязательно замещенную С 1-6 алкилоксигруппой, причем указанный R2 представляет собой R2b, путем взаимодействия с С 1-6 алкилоксиС 1-6 алкилОН, необязательно замещенным С 1-6 алкилоксигруппой, в присутствии NaH и подходящего растворителя, такого как, например, тетрагидрофуран (стадия (с-4. Промежуточные продукты формулы (III-а), где R2 и R7 представляют собой водород, причем указанные промежуточные продукты представлены формулой (III-а-5), могут быть получены согласно следующей схеме реакции (3), где на первой стадии (а) замещенный индол-2,3-дион подвергают взаимодействию с необязательно замещенным 3-фенилпропиональдегидом в присутствии подходящего основания,такого как гидроксид натрия (реакция Пфитцингера), после чего соединение карбоновой кислоты декарбоксилируют на следующей стадии (b) при высокой температуре в присутствии подходящего реакционно-инертного растворителя, такого как дифениловый эфир. Схема 3 Промежуточные продукты формулы (III-а), где R6 представляет собой Het, причем указанные промежуточные продукты представлены формулой (III-а-6), могут быть получены согласно следующей схеме реакции 3 а. Схема 3 а Схема реакции (3 а) включает стадию (а), на которой подходящий фрагмент хинолина подвергают взаимодействию с Het-С(=O)-Н, используя н-BuLi в смеси с подходящим основанием, таким как, например, 2,2,6,6-тетраметилпиперидин, и подходящим растворителем, таким как, например, тетрагидрофуран. Перемешивание может увеличить скорость реакции. Реакцию можно осуществить общепринятым способом при температуре, находящейся в диапазоне от -20 до -70 С. На следующей стадии (b) продукт,полученный на стадии (а), преобразовывают в промежуточный продукт формулы (III-а-6) путем взаимодействия с подходящей кислотой, такой как, например, трифторуксусная кислота и триизопропилсилан,- 18016760 в присутствии подходящего растворителя, такого как, например, метиленхлорид. Промежуточные продукты формулы (III-b), в частности (III-b-1) или (III-b-2), могут быть получены согласно следующей схеме реакции (4). Схема 4 Схема реакции (4) включает стадию (а), на которой фрагмент хинолина преобразовывают во фрагмент хинолинона путем взаимодействия с подходящей кислотой, такой как, например, хлористоводородная кислота. На следующей стадии (b) заместитель R8a, представляющий собой алкил, вводят взаимодействием промежуточного продукта, полученного на стадии (а), с подходящим алкилирующим средством, таким как, например, алкилйодид, например метилйодид, в присутствии подходящего основания, такого как, например, NaOH или бензилтриэтиламмонийхлорид, подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные продукты формулы (III-b), где R8 и R9 вместе образуют радикал -CH=CH-N=, причем указанные промежуточные продукты представлены формулой (III-b-3), могут быть получены согласно следующей схеме реакции (5). Схема 5 Схема реакции (5) включает стадию (а), на которой промежуточный продукт подвергают взаимодействию с NH2-CH2-СН(ОСН 3)2. На следующей стадии (b) конденсированный имидазолильный остаток получают путем взаимодействия с уксусной кислотой в присутствии подходящего растворителя, такого как, например, ксилен. Промежуточные продукты формулы (IV) представляют собой соединения, которые либо коммерчески доступны, либо они могут быть получены в соответствии с общепринятыми реакционными методиками, как правило, известными в данной области. Например, промежуточные продукты формулы (IV) могут быть получены согласно следующей схеме реакции (6). Схема 6 Схема реакции (6) включает стадию (а), на которой R3, в частности соответствующим образом замещенный арил, более конкретно соответствующим образом замещенный фенил, подвергают реакции Фриделя-Крафтца с подходящим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4 хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как, например, AlCl3, FeCl3,SnCl4, TiCl4 или ZnCl2, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этилендихлорид. Реакция может быть осуществлена общепринятым способом при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения с обратным холодильником. На следующей стадии (b) аминогруппу (-NR4R5) вводят путем взаимодействия промежуточного продукта, полученного на стадии (а), с первичным или вторичным амином (HNR4R5) в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например,K2CO3. В зависимости от амина, который использовали на стадии (b), может быть уместно сначала подвергать взаимодействию промежуточный продукт, полученный на стадии (а), с защищенной формой амина, такой как, например, 1,1-диметилэтиловый эфир (1S,4S) 2,5-диазабицикло[2.2.1]гептан-2 карбоновой кислоты, с последующим удалением защиты из полученного продукта в присутствии подхо- 19016760 дящей кислоты, такой как, например, трифторуксусная кислота, и подходящего растворителя, такого как,например, CH2Cl2. Полагают, что в пределах знания специалист в данной области сможет оценить, когда необходимо защитить амин и определить наиболее подходящую защитную группу для конкретного амина. Промежуточные продукты формулы (IV) можно также получить согласно следующей схеме реакции (6 а). Схема 6 а Схема реакции (6 а) включает стадию (а), на которой R3-W4, где W4 представляет собой подходящую уходящую группу, такую как, например, галоген, например хлор или бром, в частности соответствующим образом замещенный арил, более конкретно соответствующим образом замещенный нафтил,например 2-бромнафталин, подвергают взаимодействию с подходящим ацилхлоридом, таким как 3 хлорпропионилхлорид или 4-хлорбутирилхлорид или 5-бромпентаноилхлорид, в присутствии Mg, I2 и подходящего растворителя, такого как, например, тетрагидрофуран. Реакцию можно осуществлять общепринятым способом при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения с обратным холодильником. На следующей стадии (b) аминогруппу (-NR4R5) вводят взаимодействием промежуточного продукта, полученного на стадии (а), с первичным или вторичным амином (HNR4R5) в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K3CO3. В зависимости от амина, который использовали на стадии (b), может быть уместно сначала подвергать взаимодействию промежуточный продукт, полученный на стадии (а) с защищенной формой амина, такой как, например, 1,1-диметилэтиловый эфир (1S,4S)(2,5-диазабицикло[2.2.1]гептан-2-карбоновой кислоты, с последующим удалением из полученного продукта в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, и подходящего растворителя, такого как, например, CH2Cl2. Полагают, что в пределах знания специалист в данной области сможет оценить, когда необходимо защитить амин и определить наиболее подходящую защитную группу для конкретного амина. Промежуточные продукты формулы (IV) можно также получить согласно следующей схеме реакции (7). Схема 7 Схема реакции (7) включает стадию (а), на которой R3-С(=O)-Н, например соответствующим образом замещенный арилкарбоксальдегид, более конкретно соответствующим образом замещенный фенилили нафтилкарбоксальдегид, подвергают взаимодействию с подходящим промежуточным соединением,таким как, например, 1-бром-4-хлорбутан, в присутствии реактива Гриньяра и подходящего растворителя, такого как, например, диэтиловый эфир, тетрагидрофуран. Реакцию можно осуществлять общепринятым способом при низкой температуре, например 5 С. На следующей стадии (b) проводят окисление в присутствии реактива Джонса в подходящем растворителе, таком как, например, ацетон. На следующей стадии (с) аминогруппу (-NR4R5) вводят взаимодействием промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3. Альтернативно, промежуточные продукты формулы (IV) могут быть получены согласно следующей схеме реакции (8). Схема реакции (8) включает стадию (а), на которой, например, подходящую кислоту подвергают взаимодействию с NH(СН 3)(ОСН 3) в присутствии 1,1'-карбонилдиимидазола и подходящего растворителя, такого как, например, CH2Cl2. На следующей стадии (b) продукт, полученный на стадии (а), подвергают взаимодействию с подходящими реактивами Гриньяра, например 4-хлорбутилмагнийбромидом, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. На следующей стадии(с) аминогруппу (-NR4R5) вводят взаимодействием промежуточного продукта, полученного на стадии (b),с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3. Альтернативно, промежуточные продукты формулы (IV), где q равно 1, причем указанные промежуточные продукты представлены формулой (IV-a), могут быть получены согласно следующей схеме реакции (9). Схема 9 Схема реакции (9) включает стадию, на которой подходящее ацетильное производное R3, такое как,например, ацетилциклогексан, подвергают взаимодействию с параформальдегидом и подходящим первичным или вторичным амином HNR4R5, предпочтительно в виде его соли, в присутствии подходящей кислоты, такой как, например, хлористо-водородная кислота и т.п., и подходящего растворителя, такого как, например, спирт, например этанол. Промежуточные продукты формулы (IV), где R3 представляет собой R3a-CH2-CH2- (который возможен для тех промежуточных продуктов формулы (VI), где R3 представляет собой алкил, арилалкил, арилО-алкил, арилалкил-О-алкил, Het-алкил, Het-O-алкил или Het-алкил-О-алкил, и R3a' является таким, какR3, но на 2 атома углерода меньше в цепи алкила, присоединенного к оставшейся части молекулы, и гдеq равно 1, причем указанные промежуточные продукты представлены формулой (IV-b), могут быть получены согласно следующей схеме реакции (10). Схема 10 Схема реакции (10) включает стадию (а), где подходящий альдегид подвергают взаимодействию с ацетоном в присутствии подходящего основания, такого как, например, гидроксид натрия. На следующей стадии (b) продукт, полученный на стадии (а), подвергают взаимодействию с первичным или вторичным амином HNR4R5 в присутствии СН 2(=O), подходящей кислоты, такой как, например, хлористоводородная кислота и т.п., и подходящего растворителя, такого как, например, спирт, например этанол. На следующей стадии (с) продукт, полученный на стадии (b), гидрогенизируют (Н 2) в присутствии подходящего катализатора, такого как, например, палладий на углероде, и подходящего растворителя, такого как, например, вода и спирт, например этанол. Промежуточные продукты формулы (IV), где R3 представляет собой замещенный галогеном фенил,можно преобразовать в промежуточный продукт формулы (IV), где R3 представляет собой фенил, замещенный арилом, путем взаимодействия с арилбороновой кислотой в присутствии подходящего основания, такого как, например, фосфат калия, подходящего катализатора, такого как, например, ацетат палладия, и подходящего лиганда, такого как, например, 2-дициклогексилфосфино-2',6'-диметоксибифенил, в подходящем растворителе, таком как, например, толуол. Промежуточные продукты формулы (IV), где R3 представляет собой замещенный галогеном фенил,можно преобразовать в промежуточный продукт формулы (IV), где R3 представляет собой фенил, замещенный С 2-6 алкенилом, необязательно замещенным фенилом, путем взаимодействия с подходящим С 2-6 алкеном, таким как, например, стирол, в присутствии подходящего основания, такого как, например,триэтиламин, подходящего катализатора, такого как, например, ацетат палладия, и подходящего лиганда,такого как, например, три-о-толилфосфин, в подходящем растворителе, таком как, например, ДМФА.- 21016760 В случае указанных выше схем реакций подходящий амин HNR4R5 представляет собой замещенный 2,5-диазабицикло[2.2.1]гептил, указанный амин может быть получен согласно следующей схеме реакции Схема реакции (11) включает стадию взаимодействия соответствующим образом защищенного 2,5 диазабицикло[2.2.1]гептила, где Р представляет собой, например, трет-бутилоксикарбонил, с подходящими реагентами формулы W-R', где W представляет собой подходящую уходящую группу, такую как,например, галоген, например бром и т.п., и где R' представляет собой заместитель, который необходимо ввести, в присутствии подходящего основания, такого как, например, K2CO3, NaHCO3 или триэтиламин,подходящего реактива фазового переноса, такого как, например, тетра-н-бутиламмонийхлорид, подходящего растворителя, такого как, например, ацетонитрил, и необязательно KI, для увеличения скорости реакции. На следующей стадии (b) защитную группу удаляют путем взаимодействия с подходящей кислотой, такой как, например, трифторуксусная кислота, в присутствии подходящего растворителя, такого как, например, метиленхлорид. Промежуточные продукты формулы (V-a) могут быть получены согласно следующей схеме реакции (12). Схема 12 Схема реакции (12) включает стадию взаимодействия соответствующим образом замещенного хинолина, где W3 представляет собой подходящую уходящую группу, такую как, например, галоген, например бром, с соответствующим образом замещенным дезоксибензоином в присутствии подходящего катализатора, такого как, например, диацетат палладия, подходящего лиганда, такого как, например, XPHOS, подходящего основания, такого как, например, карбонат цезия, подходящего растворителя, такого как, например, ксилен, в токе N2. На следующей стадии (b) продукт, полученный на стадии (а), подвергают взаимодействию с подходящими реактивами Гриньяра, например, СН 2=СН-(СН 2)q-Mg-Br, такими как, например, бромид аллилмагния, в подходящем растворителе, таком как, например, тетрагидрофуран. Таким образом могут быть получены промежуточные продукты формулы (V-b). Промежуточные продукты формулы (VI-а) могут быть получены согласно следующей схеме реакции (13). Схема 13 На схеме реакции (13) промежуточный продукт формулы (III-а) подвергают взаимодействию с промежуточным продуктом формулы (VII), для его синтеза сделана ссылка на схемы 6, 7 и 8, в присутствии н-BuLi в подходящем растворителе, таком как, например, тетрагидрофуран, и подходящем основании, таком как, например, диизопропиламин. Перемешивание может увеличить скорость реакции. Реакцию можно осуществлять общепринятым способом при температуре, находящейся в диапазоне от -20 до-70 С. Таким образом могут быть получены промежуточные продукты формулы (VI-b).- 22016760 Следующие примеры иллюстрируют настоящее изобретение, но не ограничивая его. Экспериментальная часть Для некоторых соединений или промежуточных продуктов абсолютную стереохимическую конфигурацию стереогенного атома углерода(ов) в них или конфигурацию при двойной связи экспериментально не определяли. В таких случаях стереохимически изомерную форму, которую выделяли первой, обозначали как А и вторую - как В, без дополнительной ссылки на истинную стереохимическую конфигурацию. Однако указанные А и В изомерные формы может однозначно охарактеризовать специалист в данной области, используя известные в данной области методы, такие как, например, ЯМР. Полагают, что в пределах знания специалист в данной области сможет определить наиболее подходящий способ определения истинной стереохимической конфигурации. В случае, если А и В представляют собой стереоизомерные смеси, в частности смеси энантиомеров,их можно дополнительно разделить, в соответствии с чем соответствующие первые выделенные фракции обозначают А 1, соответственно В 1, и вторые - как А 2, соответственно В 2, без дополнительной ссылки на истинную стереохимическую конфигурацию. Однако указанные изомерные формы A1, A2 и В 1, В 2, в частности указанные энантиомерные формы А 1, А 2 и В 1, В 2, сможет однозначно охарактеризовать специалист в данной области, используя известные в данной области методы, такие как, например, дифракция рентгеновских лучей. Если смесь 4 энантиомеров напрямую разделяют на 4 отдельных энантиомера(без промежуточной стадии разделения первоначально на два диастереоизомера), первый полученный энантиомер обозначают как А, второй энантиомер как В, третий энантиомер как С и четвертый энантиомер как D. В некоторых случаях, когда конечное соединение или промежуточный продукт, обозначенный в качестве конкретного диастереоизомера или энантиомера, преобразовывают в другое конечное соединение/промежуточный продукт, последний может наследовать обозначение для диастереоизомера (А, В) или энантиомера (A1, A2, B1, B2) от первого. В настоящем описании ТГФ означает тетрагидрофуран, DCE означает дихлорэтан, DIPEA означаетN-этил-N-(1-метилэтил)-2-пропанамин, DIPE означает диизопропиловый эфир, DCM означает дихлорметан, ДМФА означает N,N-диметилформамид и SFC означает суперкритическую жидкостную хроматографию. А. Получение промежуточных соединений. Пример А 1. а-1. Получение промежуточного продукта 1[103-67-3]) и K2CO3 (3,16 г, 0,023 моль) смешивали в колбе. Добавляли CH3CN (22,86 мл) и реакционную смесь нагревали при 80 С в течение 48 ч. Затем K2CO3 удаляли фильтрованием. Продукт очищали флэшхроматографией (элюент: н-гексан/EtOAc 5/1). Фракции продукта собирали и растворитель выпаривали. Выход: 1,79 г промежуточного продукта 1 (83%; желтое масло). а-2. Получение промежуточного продукта 9(1,33 г, 0,01 моль, [73579-08-5]) и K2CO3 (2,15 г, 0,015 моль) смешивали с CH3CN (15 мл) и нагревали до 80 С в течение 48 ч. Затем K2CO3 удаляли фильтрованием и неочищенный продукт очищали флэшхроматографией (элюент: CH2Cl2/MeOH 10:1). Требуемые фракции собирали и растворитель выпаривали. Выход: 0,48 г промежуточного продукта 9 (32%). а-3. Получение промежуточного продукта 10(3,19 г, 0,015 моль) и K2CO3 (3,16 г, 0,023 моль) смешивали в CH3CN (22,88 мл) и реакционную смесь кипятили с обратным холодильником в течение выходных при 80 С. Затем K2CO3 удаляли фильтрованием и продукт очищали флэш-хроматографией (элюент: н-гексан/EtOAc; исходно 5/1, продукт при 1/1).b. Получение промежуточного продукта 2 и 3 Диизопропиламин лития ([4111-54-0]) (3,81 мл 2,0 М раствора в смеси ТГФ/гептан; 0,00763 моль) растворяли в ТГФ (25,44 мл; сухой) и охлаждали на бане со льдом при -70 С. 6-Бром-2-метокси-3(фенилметил)хинолин (промежуточное соединение 3 (пример A3) в WO 2004/011436) (2,09 г, 0,00636 моль) по каплям добавляли в виде раствора в ТГФ (19,08 мл; сухой) и смесь перемешивали в течение 2 ч при -70 С. Затем промежуточный продукт 1 (1,79 г, 0,00636 моль) по каплям добавляли в виде раствора в ТГФ (19,08 мл; сухой) и реакционную смесь перемешивали в течение 3 ч при -70 С. Затем при -70 С добавляли H2O (гашение), с последующим добавлением EtOAc. Слои разделяли и органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали, с получением желтого масла. Остаток очищали флэш-хроматографией (элюент: н-гексан/EtOAc). Требуемые фракции собирали и растворитель выпаривали. Выход: 0,381 г промежуточного продукта 2 (диастереоизомер А) и 0,166 г промежуточного продукта 3 (диастереоизомер В). с. Получение промежуточного продукта 4 1-Хлорэтиловый эфир карбонохлоридной кислоты (0,001 моль) добавляли к раствору промежуточного продукта 2 (0,0009 моль) в DCE (10 мл). Смесь перемешивали при 80 С в течение 1 ч и затем растворитель выпаривали досуха. Остаток поглощали СН 3 ОН (10 мл). Смесь перемешивали при 80 С в течение 1 ч и затем растворитель выпаривали. Остаток (0,7 г) очищали колоночной хроматографией наKromasil (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,5 до 85/15/1,5; 5 мкм). Очищенные фракции собирали и растворитель выпаривали. Выход: 0,21 г промежуточного продукта 4 (45%) (т.п.: 121 С). Промежуточный продукт 5 получали согласно аналогичному протоколу, как для промежуточного продукта 4, но исходя из промежуточного продукта 3. Выход: 0,31 г промежуточного продукта 4 (52%)(т.п.: 203 С). Пример А 2. а. Получение промежуточного продукта 6(0,0122 моль) в CH3CN (40 мл) перемешивали при 80 С в течение 18 ч. Затем смесь выливали в H2O, экстрагировали 1,5 н. HCl, подщелачивали при 5 С при помощи 3 н. NaOH и экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным водным раствором NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 2,6 г промежуточного продукта 6 (78%).b. Получение промежуточного продукта 7 н-BuLi (0,0036 моль; 2,3 мл 1,6 М раствора в гексане) по каплям добавляли при -20 С к раствору гидрохлорида диизопропиламина (0,0036 моль; [819-79-4]) в ТГФ (8 мл) в токе N2. Смесь перемешивали при -20 С в течение 20 мин и затем охлаждали до -70 С. Добавляли раствор 6-бром-2-метокси-3(фенилметил)хинолина (промежуточное соединение 3 (пример A3) в WO 2004/011436) (0,003 моль) в ТГФ (10 мл). Смесь перемешивали при -70 С в течение 1 ч. Добавляли раствор промежуточного продукта 6 (0,003 моль) в ТГФ (10 мл). Смесь перемешивали при -70 С в течение 2 ч. Добавляли H2O. Смесь экстрагировали EtOAc. Органический слой промывали насыщенным водным раствором NaCl, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток (5,5 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1, затем циклогексан/EtOAc/NH4OH 65/35/0,2; 1540 мкм). Собирали четыре фракции. Растворитель из фракции требуемого продукта выпаривали. Выход: 0,18 г промежуточного продукта 7 (диастереоизомер А). (Также выделяли форму диастереоизомера В по данной методике, но его не использовали в данном контексте). с. Получение промежуточного продукта 8 1-Хлорэтиловый эфир карбонохлоридной кислоты (0,0004 моль) по каплям добавляли к раствору промежуточного продукта 7 (0,0004 моль) в DCE (3 мл). Смесь перемешивали при 80 С в течение 1 ч и затем растворитель выпаривали досуха. Остаток поглощали СН 3 ОН (10 мл). Смесь перемешивали при 50 С в течение 30 мин. Растворитель снова выпаривали и остаток (0,29 г) очищали колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,4 до 88/12/1,2; 3,5 мкм). Очищенные фракции собирали и растворитель выпаривали. Выход: 0,096 г промежуточного продукта 8 (36%; диастереоизомер А). Пример A3. а. Получение промежуточного продукта 16N,N'-Карбонилдиимидазол (0,102 моль) добавляли порциями при 5 С к раствору бензолпентановой кислоты (0,068 моль) в DCM (10 мл). Смесь перемешивали при 5 С в течение 1 ч. Гидрохлорид Nметоксиметанамина (0,102 моль) добавляли порциями. Смесь доводили до комнатной температуры, перемешивали в течение выходных, выливали в 1 н. HCl и экстрагировали CH2Cl2. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2; 15-40 мкм). Очищенные фракции собирали и растворитель выпаривали. Выход: 9,66 г промежуточного продукта 16 (65%).b-1. Получение промежуточного продукта 11(10 мл) в атмосфере N2. Смесь перемешивали и кипятили с обратным холодильником. Раствор 1-бром-4 хлорбутана (0,071 моль) в диэтиловом эфире (20 мл) добавляли по каплям. Смесь перемешивали в течение 15 мин, затем охлаждали до 5 С. Добавляли раствор N-метокси-N-метилбензолпропанамид (0,0595 моль) в ТГФ (35 мл). Смесь перемешивали при 5 С в течение 2 ч и затем перемешивали при комнатной температуре в течение 2 ч. Смесь выливали в NH4Cl и продукт экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 13,2 г промежуточно- 25016760 го продукта 11.b-2. Получение промежуточного продукта 14 Несколько капель 1-бром-4-хлорбутана при комнатной температуре добавляли к раствору Mg(0,0697 моль) в диэтиловом эфире (12 мл). Смесь перемешивали в течение 30 мин. Добавляли раствор 1 бром-4-хлорбутана (0,0697 моль) в диэтиловом эфире (35 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 30 мин, затем охлаждали до 0 С. По каплям добавляли раствор Nметокси-N-метилбензолбутанамида (0,0465 моль; [177756-65-9]) в ТГФ (35 мл). Смесь перемешивали в течение 15 мин, затем перемешивали при 50 С в течение 4 ч и выливали в NH4Cl и EtOAc. Органический слой промывали насыщенным водным раствором NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 11,2 г промежуточного продукта 14 (100%).b-3. Получение промежуточного продукта 17N2. Смесь перемешивали и кипятили с обратным холодильником. Добавляли раствор 1-бром-4 хлорбутана (0,065 моль) в диэтиловом эфире (15 мл) и ТГФ (15 мл). Смесь перемешивали в течение 30 мин, затем охлаждали до 5 С. Добавляли раствор промежуточного продукта 16 (0,0437 моль) в ТГФ (30 мл). Смесь перемешивали в течение 30 мин, затем перемешивали при 55 С в течение 3 ч, доводили до комнатной температуры, выливали в NH4Cl и экстрагировали EtOAc три раза. Органический слой промывали насыщенным водным раствором NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 11 г промежуточного продукта 17 (100%). с-1. Получение промежуточного продукта 12 Смесь промежуточного продукта 11 (0,082 моль), 1,4'-бипиперидина (0,082 моль) и K2CO3 (0,09 моль) в CH3CN (180 мл) перемешивали в течение ночи при 80 С. Затем смесь доводили до комнатной температуры и выливали в H2O. Добавляли диэтиловый эфир. Смесь подкисляли 1 н. HCl. Водный слой подщелачивали 3 н. NaOH и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали. Выход: 8 г промежуточного продукта 12 (28%). с-2. Получение промежуточного продукта 13 Смесь промежуточного продукта 11 (0,0089 моль), дигидробромида 2-(фенилметил)-2,5 диазабицикло[2.2.1]гептана, (1S,4S) (0,0089 моль) и K2CO3 (0,0267 моль) в CH3CN (23 мл) перемешивали при 80 С в течение 48 ч, затем доводили до комнатной температуры и выливали в H2O. Органический слой подкисляли 1 н. HCl. Водный слой подщелачивали 3 н. NaOH и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 1,23 г промежуточного продукта 13. с-3. Получение промежуточного продукта 15 Промежуточный продукт 15 получали согласно методике, описанной для промежуточного продукта 13 (А 3. С-2), но исходя из промежуточного продукта 14. Выход: промежуточный продукт 15. с-4. Получение промежуточного продукта 18 Смесь промежуточного продукта 17 (0,0059 моль), дигидробромида 2-(фенилметил)-2,5 диазабицикло[2.2.1]гептана (1S,4S) (0,0059 моль) и K2CO3 (0,0179 моль) в CH3CN (15 мл) перемешивали при 80 С в течение 48 ч, затем доводили до комнатной температуры, выливали в H2O, экстрагировали диэтиловым эфиром и подкисляли 3 н. HCl. Водный слой подщелачивали концентрированным NaOH и экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным водным растворомNaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 1,967 г промежуточного продукта 18 (81%). Пример А 4. а. Получение промежуточного продукта 19 Раствор 1-бром-4-хлорбутана (22,25 мл, 0,19 моль) в диэтиловом эфире (100 мл) по каплям добавляли (в атмосфере N2) к суспензии активированной стружки Mg (4,67 г, 0,19 моль) в диэтиловом эфире(100 мл). Также добавляли немного кристаллов йода. Температура в колбе увеличивалась, и оранжевый цвет менялся на белый. Как только заканчивали добавление 1-бром-4-хлорбутана, реакционную смесь охлаждали на бане со льдом и 2-нафталинкарбоксальдегид (20,00 г, 0,13 моль) по каплям добавляли в виде раствора в ТГФ (200 мл, сухой). Реакционную смесь перемешивали на бане со льдом в течение 4 ч. Затем смесь гасили 1 н. NH4Cl. Разделяли обе фазы. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали флэшхроматографией (элюент: н-гексан/EtOAc 20:1). Требуемые фракции собирали и растворитель выпаривали с получением промежуточного продукта 19.b. Получение промежуточного продукта 20 Промежуточный продукт 19 (9,97 г, 0,04 моль) растворяли в CH2Cl2 (120 мл) и колбу охлаждали на бане со льдом. Добавляли MnO2 (34,85 г, 0,40 моль), реакционную смесь перемешивали на бане со льдом в течение 1 ч и затем в течение ночи при комнатной температуре. На следующее утро добавляли дополнительное количество MnO2 (10 экв.) и днем снова добавляли дополнительное количество MnO2 (10 экв.). Смесь перемешивали в течение ночи при комнатной температуре. Затем MnO2 удаляли фильтрованием через целит. Продукт очищали флэш-хроматографией (элюент: н-гексан/EtOAc 40:1). Выход: 6,91 г промежуточного продукта 20 (70%). с-1. Получение промежуточного продукта 22(0,2 г, 0,001 моль), (2-бромэтил)бензола (0,224 г, 0,0012 моль), K2CO3 (0,279 г, 0,002 моль), KI (0,167 г,0,001 моль) и N,N,N-трибутил-1-бутанаминийхлорида (0,02 г) в CH3CN (5 мл) нагревали в течение ночи при 80 С. Затем смесь охлаждали до комнатной температуры, осадок отфильтровывали и промывалиEtOAc. Органические фазы промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт очищали колоночной флэш-хроматографей (элюент: CH2Cl2/CH3OH от 50/1 до 40/1). Фракции продукта собирали и растворитель выпаривали. Остаток сушили (вакуум, комнатная температура). Выход: 0,23 г промежуточного продукта 22 (бледно-желтое масло; 74%). Промежуточный продукт 55 получали согласно аналогичному протоколу для промежуточного продукта 22, но исходя из 1-бром-2 метилпропана вместо (2-бромэтил)бензола. Выход: 65% (бесцветное масло).- 27016760 с-2. Получение промежуточного продукта 23 Промежуточный продукт 22 (1 г, 0,0033 моль) растворяли в CH2Cl2 (10 мл) и раствор охлаждали до 0 С. Затем трифторуксусную кислоту (7,54 г, 0,0066 моль) по каплям добавляли при 0 С. После того как завершали добавление, реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Растворитель выпаривали и осадок сушили. Продукт получали в виде бесцветного масла и его использовали на следующей стадии без дополнительной очистки. Выход: промежуточный продукт 23. Промежуточный продукт 54 получали согласно аналогичному протоколу для промежуточного продукта 23, но исходя из промежуточного продукта 55. Промежуточный продукт 54 получали в виде коричневого масла и использовали как таковой на следующей стадии реакции.d-1. Получение промежуточного продукта 21 Смесь промежуточного продукта 20 (0,00571 моль), дигидробромида (1S,4S) 2-(фенилметил)-2,5 диазабицикло[2.2.1]гептана (0,00571 моль) и K2CO3 (0,0171 моль) в CH3CN (150 мл) перемешивали при кипячении с обратным холодильником в течение ночи. Затем смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали диэтиловым эфиром. Органический слой экстрагировали 1 н. HCl. Полученный водный слой подщелачивали 3 н. NaOH и экстрагировали диэтиловым эфиром. Органический слой отделяли, промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 1,7 г промежуточного продукта 21 (75%).d-2. Получение промежуточного продукта 24 Промежуточный продукт 23 (0,669 г, 0,0033 моль) растворяли в CH3CN (10 мл). Промежуточный продукт 20 (0,98 г, 0,004 моль), K2CO3 (1,14 г, 0,0083 моль), KI (0,55 г, 0,0033 моль) и N,N,N-трибутил-1 бутанаминийхлорид (0,067 г, 10% мас./мас.) добавляли в раствор и смесь перемешивали при 80 С в течение 15 ч. Затем K2CO3 отфильтровывали и промывали EtOAc. Органические фазы объединяли и промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией (элюент: CH2Cl2/CH3OH; от 50/1 до 40/1 до 30/1 до 20/1 до 10/1). Фракции продукта собирали и растворитель выпаривали. Остаток сушили (вакуум, комнатная температура), получая 0,8 г промежуточного продукта 24 (бледно-зеленый; выход продукта: 59% за две стадии).d-3. Получение промежуточного продукта 25 Смесь промежуточного продукта 20 (0,5 г, 0,00202 моль), 1-(4-метоксифенил)пиперазина (0,00405 моль) и K2CO3 (0,84 г, 0,00608 моль) в CH3CN (6,06 мл) кипятили с обратным холодильником при 80 С в течение 2 дней. Затем неорганические соли удаляли фильтрованием и очистку проводили флэшхроматографией (элюент: н-гексан/EtOAc; первоначальные условия: 5/1, продукт при 1/1). Фракции продукта собирали и растворитель выпаривали. Выход: 0,5 г промежуточного продукта 25 (61%).d-4. Получение промежуточного продукта 26 Промежуточный продукт 26 получали согласно методике для промежуточного продукта 21 (A4. d1), исходя из 1,4'-бипиперидина и промежуточного продукта 20. Выход: 0,92 г промежуточного продукта 26 (30%).d-5. Получение промежуточного продукта 33 Смесь промежуточного продукта 20 (5 г, 0,02 моль), гомопиперазина (0,06 моль) и K2CO3 (0,06 моль) в CH3CN (60 мл) перемешивали при кипячении с обратным холодильником в течение 18 ч, затем охлаждали до комнатной температуры и выливали в воду. Органический слой экстрагировали EtOAc и сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1, 15-40 мкм, 90 г). Очищенные фракции собирали и растворитель выпаривали. Выход: 2,3 г промежуточного продукта 33 (37%). Промежуточный продукт 53 получали согласно аналогичному протоколу, как для промежуточного продукта 33, но начиная с гексагидро-1 Н-азепина вместо гомопиперазина. Неочищенное соединение очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 93/7/0,6). Выход: 81%.d-6. Получение промежуточного продукта 34 Смесь промежуточного продукта 20 (1,00 г, 0,00405 моль), 1-метилгомопиперазина (1,01 мл, 0,0081 моль) и K2CO3 (1,68 г, 0,0081 моль) в CH3CN (12,16 мл) кипятили с обратным холодильником при 80 С в течение выходных. Неорганические соли удаляли фильтрованием и неочищенные продукты очищали флэш-хроматографией (элюент: н-гексан/EtOAc). Требуемые фракции собирали и растворитель выпаривали. Выход: 0,26 г промежуточного продукта 34 (20%).d-7. Получение промежуточного продукта 44 Смесь промежуточного продукта 54 1S,4S)-2-(2-метилпропил)-2,5-диазабицикло[2.2.1]гептан)(0,53 г, 0,0032 моль) и N,N,N-трибутил-1-бутанаминийхлорида (0,049 г) в CH3CN (5 мл) нагревали в течение 15 ч при 80 С. Затем смесь охлаждали до комнатной температуры, осадок отфильтровывали и промывали EtOAc. Органические фазы промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и растворитель выпаривали. Продукт очищали колоночной флэш-хроматографей (элюент:CH2Cl2/CH3OH от 50/1 до 40/1 до 30/1 до 20/1 до 10/1). Требуемые фракции собирали и растворитель выпаривали. Остаток сушили (вакуум, комнатная температура). Выход: 1,04 г промежуточного продукта 44d-8. Получение промежуточного продукта 45 Смесь 1,1-диметилэтилового эфира (1S,4S) 2,5-диазабицикло[2.2.1]гептан-2-карбоновой кислоты (1 г, 0,0050 моль), промежуточного продукта 20 (1,49 г, 0,0060 моль), K2CO3 (1,38 г, 0,01 моль), KI (0,83 г,0,005 моль) и N,N,N-трибутил-1-бутанаминийхлорида (0,1 г) в CH3CN (15 мл) нагревали в течение 15 ч при 80 С. Затем смесь охлаждали до комнатной температуры, осадок отфильтровывали и промывали
МПК / Метки
МПК: C07D 401/06, A61K 31/551, C07D 487/08, A61K 31/47, A61P 31/04, C07D 215/227, C07D 417/06, A61K 31/4995, C07D 215/22, C07D 401/12, C07D 401/14
Метки: хинолина, производные, антибактериальные
Код ссылки
<a href="https://eas.patents.su/30-16760-antibakterialnye-proizvodnye-hinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные производные хинолина</a>
Предыдущий патент: Способ получения алмотриптана высокой чистоты
Следующий патент: Упаковка
Случайный патент: Способ изготовления пластинчатого теплообменника












