Хинолиновые антагонисты лейкотриенов
Номер патента: 1797
Опубликовано: 27.08.2001
Авторы: Балани Суреш К., Бэйлли Томас А., Дюфресн Клод, Эрисон Байрон Х.
Формула / Реферат
1. Соединение формулы
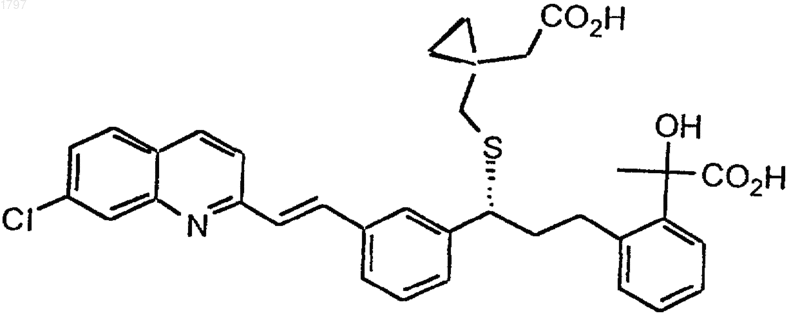
и его индивидуальные оптические изомеры или его фармацевтически приемлемое производное.
2. Выделенное и очищенное соединение по п.1, по существу свободное от других продуктов метаболизма монтелукаста натрия.
3. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
4. Способ предотвращения действия лейкотриена у млекопитающего, включающий введение вышеуказанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
5. Способ лечения или предупреждения астмы, аллергий или воспаления у млекопитающего, включающий введение вышеуказанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
6. Способ получения соединения по п.1, который включает
а) взаимодействие соединения формулы 1
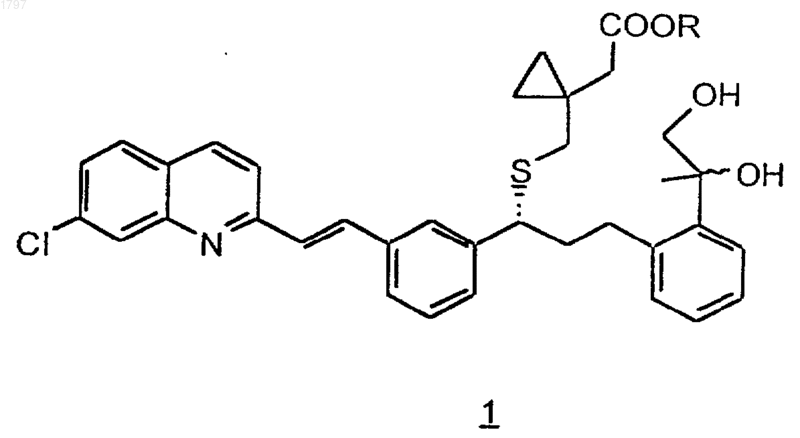
где R означает низший алкил, с диметилсульфоксидом и электрофилом с получением соединения формулы 2
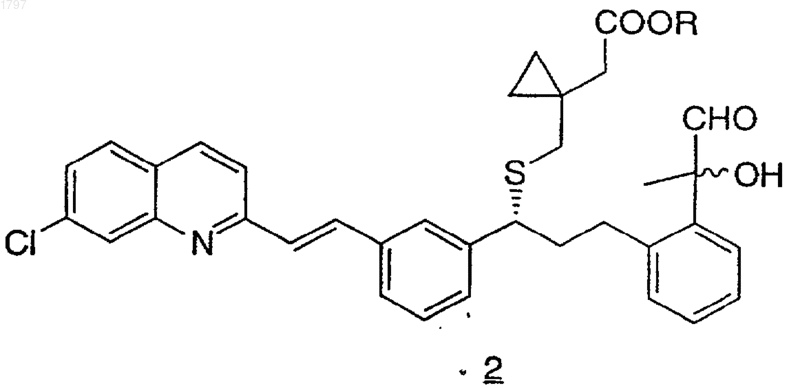
b) взаимодействие соединения формулы 2 с нитратом серебра и основанием с получением соединения по п.1.
7. Способ получения индивидуальных диастереомеров соединения по п.1, который включает
а) разделение диастереомерной смеси соединения формулы 7
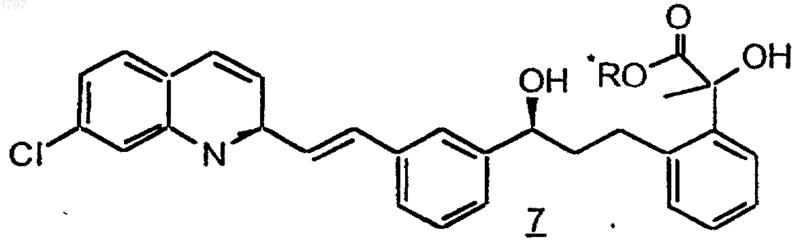
где R* означает 8-фенилментил;
b) взаимодействие индивидуального диастереомера с метансульфонилхлоридом с получением соответствующего мезилата;
c) взаимодействие мезилата из стадии b) с дианионом 1-меркаптометилциклопропануксусной кислотой с получением соединения формулы 8

d) удаление 8-фенилментильной группы с получением соединения по п.1.
Текст
1 Предпосылки к созданию изобретения Патент США 5565473 описывает соединение формулы (а) известное, в основном, как монтелукаст натрия. Монтелукаст натрия является антагонистом лейкотриенов и в настоящее время проходит клинические испытания для лечения хронической астмы. В опубликованной 19 декабря 1996 г. международной заявке РСТ WO 96/40638 описываются соединения формул (b) и (с) и их индивидуальные оптические изомеры, которые являются метаболитами монтелукаста натрия и представляют собой антагонисты лейкотриенов. Краткое изложение сущности изобретения Настоящее изобретение относится к производным хинолиновых дикислот, обладающим активностью антагонистов лейкотриенов, к способам их получения, и к способам и фармацевтическим препаратам для использования этих соединений у млекопитающих (особенно для человека). Благодаря их активности как антагонистов лейкотриенов, соединения настоящего изобретения используются в качестве противоастматических, противоаллергических, противовоспалительных и цитозащитных (защищающих клетки) агентов. Они также используются при лечении ангины, мозгового спазма, гломерулярного нефрита, гепатита, при наличии в крови эндотоксинов, увеита и при отторжении аллотрансплантата. Подробное описание изобретения Настоящее изобретение относится к соединениям формулы I: и к индивидуальным оптическим изомерам этих соединений; или к их фармацевтически приемлемым производным. В одном варианте это изобретение относится к соединению формулы I, которое выделено и очищено, т.е. к соединению формулы I,которое является, по существу, свободным от других продуктов метаболизма монтелукаста натрия. 2 В другом аспекте настоящее изобретение относится к способу предотвращения действия лейкотриенов у млекопитающих, который включает введение вышеуказанному млекопитающему терапевтически эффективного количества соединения формулы I. В еще одном аспекте настоящее изобретение относится к способу предотвращения и лечения астмы, аллергий и воспаления у млекопитающего, который включает введение вышеуказанному млекопитающему терапевтически эффективного количества соединения формулы I. Еще в другом аспекте настоящее изобретение относится к фармацевтической композиции,которая содержит соединение формулы I и фармацевтически приемлемый носитель. Еще один аспект настоящего изобретения относится к способам получения соединения формулы I. Приведенные в данном описании соединения содержат два асимметрических центра и таким образом могут давать диастереомеры и оптические изомеры. Настоящее изобретение подразумевает включить подобные возможные диастереомеры индивидуально или в виде смеси диастереомеров, а также их рацемические и разделенные, энантиомерно чистые формы и их фармацевтически приемлемые производные. Фармацевтические композиции настоящего изобретения содержат соединение формулы I в качестве активного ингредиента или фармацевтически приемлемое его производное и могут также содержать фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты. Термин композиция, как в фармацевтической композиции,предполагает включение продукта, содержащего активный ингредиент (ингредиенты) и инертный ингредиент (ингредиенты), который представляет носитель, а также любой продукт,который является, прямо или косвенно, результатом комбинирования, комплексообразования или агрегации любых двух или более ингредиентов, или результатом диссоциации одного или более ингредиентов, или результатом других типов реакции или взаимодействий одного или более ингредиентов. Таким образом, фармацевтические композиции настоящего изобретения включают любую композицию, приготовленную путем смешивания соединения настоящего изобретения и фармацевтически приемлемого носителя. Термин фармацевтически приемлемое производное относится к любой фармацевтически приемлемой соли, сложному эфиру, простому эфиру, амиду или макромолекулярным пролекарствам или их комбинациям. Изобретение также включает любые другие соединения,которые при введении реципиенту способствуют доставке (прямо или косвенно) соединения этого изобретения. 3 Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых нетоксичных неорганических и органических оснований. Соли, полученные из неорганических оснований, включают алюминиевые, аммониевые, кальциевые, медные соли,соли трехвалентного и двухвалентного железа,литиевые, магниевые соли, соли трехвалентного и двухвалентного марганца, калиевые, натриевые, цинковые соли и подобные. Особенно предпочтительными являются аммониевые,кальциевые, магниевые, калиевые и натриевые соли. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминон, включающих встречающиеся в природе замещенные амины, циклических аминов, и основных ионообменных смол, таких как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин,2-диэтиламиноэтанол,2 диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин,пиперазин, пиперидин, дициклогексиламин,полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Фармацевтически приемлемые сложные эфиры включают такие, которые образуются из гидроксильных групп соединения формулы I и органической кислоты (или ее ацилирующего эквивалента), такие как ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бутират, цитрат, камфорат, камфорсульфонат, циклопентапропионат, глюкогептаноат, глицерофосфат, глюконат, додецилсульфат, этансульфонат, фумарат, гептаноат, гексаноат, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат,оксалат, памоат, пектинат, пикрат, пивалат, сукцинат,тартрат,тозилат,имидазол-1 карбоксилат, фенилпропионат, феноксиацетат,пальмитат, лаурат, адамантоат, стеарат, октаноат, циклоалкилкарбоксилат, деканоат, меристилат, фталат, гексаноат, карбамат, аденозин-5'карбоксилат, пивалоилоксиметилат, в замещенных или незамещенных формах и тому подобное; или такие, которые образуются из карбоксильной группы соединения формулы I и спирта, такого как C1-C4 алканол или других спиртов,общеизвестных специалистам для получения эфирных пролекарств. Фармацевтически приемлемые сложные эфиры также включают такие,которые образуются из соединения формулы I с неорганическими кислотами, такие как, но не ограничиваются этими примерами, сульфаты,фосфаты, карбонаты или конъюгаты соединения формулы I с глютатионом, глюкуроновой кислотой, сахарами (подобно глюкозе) и желчными кислотами (подобно таурину) и т.д. 4 Фармацевтически приемлемые простые эфиры представляют такие, которые хорошо известны специалисту в данной области, и включают, например, от метилового до пентилового эфиров, циклоалкиловый, метоксиметиловый, 3'-гидроксипропиловый, бензиловый,аллиловый, анизилиденовый, этоксиэтиледеновый, тетрагидропираниловый, силиловый эфиры. Фармацевтически приемлемые амиды представляют такие, которые хорошо известны специалисту в данной области, и включают,например, C1-C4 амиды. Соединения формулы I могут также использовать в качестве макромолекулярного пролекарства, включающего соединение формулы I, связанное ковалентно или обратимо с моно- или поликлональными антителами, или с другими макромолекулами, такими как поливинил, полиакрил, полисахарид и поли- (аминокислота) и декстран, растворимый крахмал или с основанными на гидроксиалкилкрахмале эфирными пролекарствами, и инсулином. Следует понимать, что в обсуждении способов лечения, которое имеет место, отсылки к соединениям формулы I также включают фармацевтически приемлемые производные. Способность соединений формулы I противодействовать лейкотриенам делает их полезными для предупреждения или отмены симптомов, вызванных лейкотриенами у человека. Этот антагонизм к действию лейкотриенов указывает на то, что соединения и их фармацевтические композиции используются для лечения,предупреждения или уменьшения интенсивности симптомов заболевания у млекопитающих и особенно у человека: 1) легочные нарушения,включающие такие заболевания, как астма, хронический бронхит и родственные обструкции дыхательных путей, 2) аллергии и аллергические реакции, такие как аллергический ринит,контактный дерматит, аллергический конъюктивит и тому подобное, 3) воспаление, такое как артрит или воспалительное кишечное заболевание, 4) боль, 5) кожные нарушения, такие как атопическая экзема и тому подобное, 6) сердечно-сосудистые расстройства, такие как стенокардия, ишемия миокарда, гипертония, агрегация тромбоцитов, и тому подобное, 7) почечная недостаточность,являющаяся результатом ишемии, которая имеет иммунологическую или химическую (циклоспорин) этиологию, 8) мигрень или гистаминовая головная боль, 9) состояния глаз, такие как увеит, 10) гепатит, являющийся результатом химических, иммунологических или инфекционных стимулов, 11) травма или шоковые состояния, такие как ожоговые повреждения, наличие в крови эндотоксинов, и тому подобное, 12) отторжение аллотрансплантата, 13) предупреждение побочных эффектов, связанных с терапевтическим введением цитокинов, таких как интерлейкин II и 5 фактор некроза опухолей, 14) хронические легочные заболевания, такие как муковисцидоз,бронхит и другие заболевания верхних и нижних дыхательных путей, и 15) холецистит. Таким образом, соединения настоящего изобретения могут также использоваться для лечения или предупреждения болезненных состояний у млекопитающих (особенно у человека), таких как эрозивный гастрит; эрозивный эзофагит; диарея; мозговой спазм; преждевременные роды; спонтанный аборт; дисменорея; ишемия, вызванные агентом пагубные поражения или некроз тканей печени, поджелудочной железы, почек или миокарда; поражение паренхимы печени, вызванное гепатотоксичными агентами, такими как ССl4 и D-галактозамин; ишемическая почечная недостаточность; вызванное заболеванием поражение печени; поражение поджелудочной железы или желудка,вызванное желчной солью; вызванное травмой или стрессом клеточное нарушение; и вызванная глицерином почечная недостаточность. Соединения также проявляют цитозащитное действие. Цитозащитную активность соединения можно наблюдать как у животных, так и у человека с помощью замеченной повышенной резистентности слизистой оболочки желудочнокишечного тракта к вредному воздействию сильных раздражителей, например, действию вызывающих язву аспирина и индометацина. В дополнение к снижению действия нестероидных противовоспалительных средств на желудочнокишечный тракт, исследования на животных показывают, что цитозащитные соединения предупреждают повреждения желудка, вызванные оральным введением сильных кислот, сильных оснований, этанола, гипертонических солевых растворов и тому подобное. Используют два анализа для измерения цитозащитного эффекта. Этими анализами являются; (А) исследование нарушения, вызванного этанолом и (В) исследование язвы, вызванной индометацином, и они описаны в Европейском патенте ЕР 140684. Диапазоны доз Величина профилактической или терапевтической дозы соединения формулы I будет,конечно, изменяться в зависимости от природы тяжести состояния, которое подвергается лечению, от индивидуального соединения формулыI и от способа его введения. Она также будет изменяться в зависимости от возраста, веса и ответа индивидуального больного. Обычно суточный диапазон доз при использовании как противоастматических, противоаллергических и противовоспалительных средств, отличном от использования как цитозащитных средств, лежит в пределах диапазона от около 0,001 мг до около 100 мг на кг веса тела млекопитающего животного, предпочтительно от 0,01 мг до около 10 мг на кг, и самое предпочтительное от 0,1 6 до 1 мг на кг, в виде единичной или разделенной доз. С другой стороны, в некоторых случаях может быть необходимым использование дозировок, выходящих за пределы. При использовании композиции для внутривенного введения подходящий диапазон доз для оказания противоастматического, противовоспалительного или противоаллергического действия составляет от около 0,001 мг до около 25 мг (предпочтительно от 0,01 мг до около 1 мг) соединения формулы I на кг веса тела в день и для цитозащитного применения от около 0,1 мг до около 100 мг [предпочтительно от около 1 мг до около 100 мг и более предпочтительнее от около 1 мг до около 10 мг) соединения формулыI на кг веса тела в день. В случае применения оральной композиции для противоастматического, противовоспалительного или противоаллергического действия подходящий диапазон доз составляет от около 0,01 мг до 100 мг соединения формулы I на кг веса тела в день, предпочтительно от около 0,1 мг до около 10 мг на кг и для цитозащитного действия от 0,1 мг до около 100 мг (предпочтительно от около 1 мг до около 100 мг и более предпочтительно от около 10 мг до около 100 мг) соединения формулы I на кг веса тела в день. При лечении заболеваний глаза могут быть использованы глазные препараты для введения в глаз, содержащие 0,001-1% по весу растворы или суспензии соединений формулы I в подходящей глазной композиции. Точное количество соединения формулы 1,которое используется как цитозащитный агент,будет зависеть, между прочим, от того, вводится ли оно для заживления поврежденных клеток или во избежание будущего нарушения, от природы поврежденных клеток (например, желудочно-кишечные язвы в сравнении с нефротическим некрозом) и от природы вызывающего болезнь агента. Примером использования соединения формулы I для избежания будущего нарушения должно быть совместное введение соединения формулы I с NSAID, которое может в противном случае вызвать подобное нарушение (например, индометацин). При таком использовании соединение формулы I вводится от 30 мин раньше введения NSAID вплоть до 30 мин после введения NSAID. Предпочтительно оно вводится раньше или одновременно сNSAID (например, в комбинированной дозовой форме). Фармацевтические композиции Любой подходящий способ введения может быть применен для обеспечения млекопитающего, особенно человека, эффективной дозой соединения настоящего изобретения. Например, можно использовать оральный, ректальный, местный, парентеральный, глазной,легочный, носовой способы введения и тому подобное. Лекарственные формы включают 7 таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли, кожные пластыри (повязки), системы, способствующие секреции, и тому подобное. Фармацевтические композиции настоящего изобретения содержат соединение формулы I в качестве активного ингредиента или фармацевтически приемлемое его производное, и могут также содержать фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты. Композиции включают композиции, пригодные для орального, ректального, местного,парентерального (включая подкожное, внутримышечное и внутривенное) или носовое введение, хотя самый подходящий путь введения в любом данном случае будет зависеть от природы и тяжести состояний, которые подвергаются лечению, и от природы активного ингредиента. Они могут быть представлены подходящим образом в стандартной лекарственной форме и приготовлены любым из способов, хорошо известных в области фармации. Для введения путем ингаляции соединения настоящего изобретения подходящим образом доставляются в форме распрыскивающего аэрозоля из герметичных, находящихся под давлением упаковок или ингаляторов. Соединения могут также быть доставлены в виде порошков,которые могут быть представлены композицией, и порошковую композицию можно вдыхать с помощью вдувания через порошковый ингалятор. Предпочтительная система доставки при ингаляции представляет обмеренную ингаляционную дозу (MDI) аэрозоля, который может быть представлен в виде суспензии или раствора соединения формулы I в подходящих метательных средствах (пропеллантах), таких как фторуглероды и углеводороды. Подходящие местные композиции соединения формулы I включают трансдермальные приспособления, аэрозоли, кремы, мази, лосьоны, присыпающие порошки и тому подобное. На практике соединения формулы I могут быть скомбинированы как активный ингредиент в однородной смеси с фармацевтическим носителем согласно обычной фармацевтической технике приготовления лекарственных средств. Носитель может быть представлен широким разнообразием форм в зависимости от формы препарата, требуемой для введения, например оральной или парентеральной (включая внутривенную). При приготовлении композиций для оральной дозированной формы может быть использована любая из обычных фармацевтических сред, таких как, например, вода, гликоли,масла, спирты, ароматизаторы, консерванты,красители и тому подобное в случае оральных жидких препаратов, таких как, например, суспензий, эликсиров и растворов; или носители,такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие 8 агенты, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и тому подобное в случае оральных твердых препаратов, таких как, например, порошки, капсулы и таблетки, причем твердые оральные препараты предпочтительнее по сравнению с жидкими препаратами. Вследствие легкости их введения таблетки и капсулы представляют самую благоприятную оральную дозированную единичную форму, в случае которой используются твердые фармацевтические носители. Если желательно,то таблетки могут быть покрыты оболочкой посредством стандартного водного и неводного метода. Кроме обычных, перечисленных выше дозированных форм, соединения формулы I могут быть введены с помощью устройств, контролирующих введение доз и/или приспособлений доставки, таких как описаны в патентах СШАNos. 3845770; 3916899; 3536809; 3598123; 3630200 и 4008719, раскрытие которых представлено в данном описании в качестве ссылок. Фармацевтические композиции настоящего изобретения, пригодные для орального введения, могут быть представлены в виде раздельных единиц, таких как капсулы, крахмальные облатки или таблетки, каждая содержащая предопределенное количество активного ингредиента, в виде порошка или гранул или в виде раствора или суспензии в водной жидкости, неводной жидкости, эмульсии масла в воде или эмульсии воды в масляной жидкости. Подобные композиции могут быть получены посредством любого из способов в фармацевтическом деле,но все способы включают стадию введения в комбинацию активного ингредиента с носителем, которая составляет один или более необходимых ингредиентов. Обычно композиции приготавливаются путем равномерного и однородного смешивания активного ингредиента с жидкими носителями или тонко раздробленными твердыми носителями или с обоими и затем,если необходимо, продукту придают форму в желаемом виде. Например, таблетка может быть приготовлена путем прессования или формования, необязательно с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть приготовлены путем компрессии в соответствующем аппарате активного ингредиента в непылящей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, смазывающим веществом, инертным разбавителем, поверхностноактивным или диспергирующим агентом. Формованные таблетки могут быть приготовлены путем формования в соответствующем аппарате, смесь порошкообразного соединения увлажняют инертным жидким разбавителем. Желательно, когда каждая таблетка содержит от около 1 мг до около 500 мг активного ингредиента и каждая крахмальная облатка или капсула со 9 держит от около 1 до около 500 мг активного ингредиента. Следующие примеры характерных фармацевтических лекарственных форм для соединений формулы I представлены ниже: Инъецируемая суспензия (I.M.) Соединение формулы I Метилцеллюлоза Твин 80 Бензиловый спирт Бензалконийхлорид Вода для инъекции до общего объема Таблетка Соединение формулы I Микрокристаллическая целлюлоза Повидон предварительно Желатинированный крахмал Стеарат магния мг на таблетку 25 415 14,0 43,5 2,5/500 Капсула Соединение формулы I Лактозный порошок Стеарат магния мг на капсулу 25 573,5 1,5/600 Аэрозоль Соединение формулы I Лецитин, NF жидкий концентрат Трихлорметан, NF Дихлордифторметан, NF Комбинации с другими лекарственными препаратами Кроме соединений формулы I фармацевтические композиции настоящего изобретения могут также содержать другие активные ингредиенты, такие как ингибиторы циклооксигеназы, нестероидные противовоспалительные средства (NSAIDs), периферические анальгезирующие агенты, такие как зомепирак, дифлунизал и тому подобное. Весовое отношение соединения формулы I ко второму активному ингредиенту может изменяться и зависеть от эффективной дозы каждого ингредиента. Обычно используется эффективная доза каждого ингредиента. Таким образом, например, когда соединение формулы I комбинируют с NSAID, весовое отношение соединения формулы I к NSAID обычно находится в области от около 1000:1 до около 1:1000, предпочтительно от около 200:1 до около 1:200. Комбинации соединения формулы I и других активных ингредиентов обычно находятся также в пределах вышеупомянутой области, но в каждом случае должна быть использована эффективная доза каждого активного ингредиента. NSAIDs можно подразделить на пять групп:(5) производные бифенилкарбоновой кислоты, или фармацевтически приемлемые их соли. 10 Производные пропионовой кислоты, которые могут быть использованы, включают: алминопрофен, беноксапрофен, буклоксовую кислоту (3-хлор-4-циклогексилоксобензолбутановая к-та), карпрофен, фенбуфен, фенопрофен,флупрофен, флурбинрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен,оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен. Структурно родственные производные пропионовой кислоты, имеющие подобные анальгезирующие и противовоспалительные свойства,также предполагается включить в эту группу. Таким образом, производные пропионовой кислоты, как определено в описании, являются ненаркотическими анальгезирующими/нестероидными противовоспалительными средствами, имеющими свободную-СН(СН 3)СООН или -CH2CH2COOH группу (которая необязательно может быть в форме фармацевтически приемлемой соли, например,-СН(CH3)COO-Na+ или -CH2CH2COO-Na4, типичным образом присоединенную прямо или посредством карбонильной функции к кольцу,предпочтительно к ароматическому кольцу. Производные уксусной кислоты, которые могут быть использованы, включают: индометацин, который является предпочтительнымNSAID, ацеметацин, алклофенак, клиданак,диклофенак, фенклофенак, фенклозановую кислоту, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин,зидометацин и зомепирак. Структурно родственные производные уксусной кислоты, имеющие подобные анальгезирующие и противовоспалительные свойства, также предполагается включить в эту группу. Таким образом, производные уксусной кислоты, как определено в описании, являются ненаркотическими анальгезирующими/нестероидными противовоспалительными средствами,имеющими свободную группу (которая необязательно может быть в форме группы фармацевтически приемлемой соли, например, -СН 2 СОONа+), типичным образом присоединенную прямо к кольцу, предпочтительно к ароматическому или гетероароматическому кольцу. Производные фенамовой кислоты, которые могут быть использованы, включают: флуфенамовую кислоту, меклофенамовую кислоту, мефенамовую кислоту, нифлумовую кислоту и толфенамовую кислоту. Структурно родственные производные фенамовой кислоты, имеющие подобные анальгезирующие и противовоспалительные свойства, также предполагается включить в эту группу. Таким образом, производные фенамовой кислоты, как определено в описании, являются ненаркотическими анальгезирующими/нестероидными противовоспалительньми средствами,которые содержат основную структуру: которая может иметь множество заместителей и в которой свободная -СООН группа может быть в форме фармацевтически приемлемой соли,например -COO-Na+. Производные бифенилкарбоновой кислоты, которые могут быть использованы, включают: дифлунизал и флуфенизал. Структурно родственные производные бифенилкарбоновой кислоты, имеющие подобные анальгезирующие и противовоспалительные свойства, также предполагается включить в эту группу. Таким образом, производные бифенилкарбоновой кислоты, как определено в описании, являются ненаркотическими анальгезирующими/нестероидными противовоспалительными средствами, которые содержат основную структуру: которая может иметь множество заместителей и в которой свободная -СООН группа может быть в форме фармацевтически приемлемой соли,например -COO-Na+. Оксикамы, которые могут быть использованы в настоящем изобретении, включают: изоксикам, пироксикам, судоксикам и теноксикам. Структурно родственные оксикамы, имеющие подобные анальгезирующие и противовоспалительные свойства, также предполагается включить в эту группу. Таким образом,оксикамы, как определено в описании, являются ненаркотическими анальгезирующими/нестероидными противовоспалительными средствами, которые имеют общую формулу: где R представляет арильное или гетероарильное кольцо. Следующие NSAIDs также можно использовать: амфенак натрия, аминопрофен, анитразафен, антрафенин, ауранофин, бендазак лизинат, бензиданин, бепрозин, броперамол, буфезолак, кинметацин, кипроквазон, клоксимат,дазидамин, дебоксамет, делметацин, детомидин,дексиндопрофен, диацереин, дифисаламин, дифенпирамид, эморфазон, энфенамовую этофенамат, фанетизолмезилат, фенклорак, фендозал,фенфлумизол, фепразон, флоктафенин, флуниксин, флуноксапрофен, флупроквазон, фопиртолин, фосфосал, фурклопрофен, глюкаметацин,гуаимесал, ибупроксам, изофезолак, изониксим,изопрофен, изоксикам, лефетамин солянокислый, лефлуномид, лофемизол, лоназолак кальция, лотифазол, локсопрофен, лизин клониксинат, меклофенамат натрия, месеклазон, набуме 001797 12 тон, никтиндол, нимесулид, орпаноксин, оксаметацин, оксападол, перисоксал цитрат, пимепрофен, пиметацин, пипроксен, пиразолак, пирфенидон, проглюметацин малеат, проквазон,пиридоксипрофен, судоксикам, талметацин,талнифлумат, теноксикам, тиазолинобутазон,тиелавин В, тиарамид солянокислый, тифламизол, тимегадин, толпадол, триптамид и уфенамат. Следующие NSAIDs, обозначенные кодовыми номерами компаний (см. например, Pharmaprojects), могут также быть использованы: 480156S, АА 861, AD1590, AFP802, AFP860,AI77B, АР 504, AU8001, ВРРС, BW540C, CHINOIN 127, CN100, ЕВ 382, EL508, F1044,GV3658, ITF182, KCNTE16090, КМЕ 4, LA2851,MR714, MR897, MY309, ONО 3144, PR823,PV102, PV108, R830, RS2131, SCR152, SH440,SIR133, SPAS510, SQ27239, ST281, SY6001,ТА 60, TAI-901 (4-бензоил-1-инданкарбоновая кислота), TVX2706, U60257, UR2301 иWY41770. Наконец, NSAIDs, которые могут быть использованы, включают салицилаты, особенно ацетилсалициловую кислоту и фенилбутазоны и их фармацевтически приемлемые соли. Кроме индометацина другими предпочтительными NSAIDs являются ацетилсалициловая кислота, диклофенак, фенбуфен, фенопрофен,флурбипрофен, ибупрофен, кетопрофен, напроксен, фенилбутазон, пироксикам, сулиндак и толметин. Фармацевтические композиции, включающие соединения формулы I, также могут содержать ингибиторы биосинтеза лейкотриенов, такие, которые описаны в Европейском патенте ЕР 138481 (24 апреля 1985 г.), ЕР 115394 (8 августа 1984 г.), ЕР 136893 (10 апреля 1985 г.) и ЕР 140709 (8 мая 1985 г.), на которые ссылаются в данном описании. Соединения формулы I могут также быть использованы в комбинации с антагонистами лейкотриенов, такими, которые описаны в Европейском патенте ЕР 106565 (25 апреля 1984 г.) и ЕР 104885 (4 апреля 1984 г.), на которые ссылаются в данном описании, и другие известные в данной области, такие, которые описаны в заявке на Европейский патент Nos. 56172 (21 июля 1982 г.) и 61800 (10 июня 1982 г.); и в описании патента Великобритании No. 2058785(15 апреля 1981 г.), на которые ссылаются в данном описании. Фармацевтические композиции, включающие соединения формулы I, также содержат в качестве второго активного ингредиента антагонисты простагландинов, такие, которые описаны в Европейском патенте ЕР 11067 (28 мая 1980 г.) или антагонисты тромбоксана, такие,которые описаны в патенте США 4237160. Они также могут содержать ингибиторы гистидин декарбоксилазы, такие как -фторметилгистидин, описанный в патенте США 4325961. 13 Соединения формулы I также можно успешно комбинировать с антагонистом H1- или Н 2 рецептора, таким как, например, ацетамазол,аминотиадиазолы, описанные в Европейском патенте ЕР 40696 (2 декабря 1981 г.), бенадрил,циметидин, фамотидин, фрамамин, гистадил,фенерган, ранитидин, терфенадин, лоратадин и подобные соединения, которые описаны в патентах США Nos. 4283408; 4362736 и 4394508. Фармацевтические композиции также могут содержать ингибитор К+/H+ АТФазы, например,омепразол, описанный в патенте США 4255431 и тому подобное. Соединения формулы I также можно благоприятно комбинировать с агентами,стабилизирующими тучные клетки, такими как 1,3-бис(2-карбоксихромон-5-илокси)-2-гидроксипропан и родственными соединениями, описанными в описаниях патентов Великобритании 1144905 и 1144906. Другая фармацевтическая композиция содержит соединения формулы I в комбинации с антагонистами серотонина, такими как метисергин, антагонистами серотонина,описанными в Nature, 316, 126-131 11985), и тому подобное. Каждая из ссылок, упомянутая в этом разделе, включена в данное описание. Другие фармацевтические композиции включают соединения формулы I в комбинации с антихолинэргическими реагентами, такими как ипратропий бромид, бронходиляторами,такими как бета агонист сальбутамол, метапротеренол, тербуталин, фенотерол и тому подобное, и противоастматичeскими средствами теофиллином, теофиллинатом холина и энпрофиллином, антагонистами кальция нифедипином,дилтиаземом, нитрендипином, верацамилом,нимодипином, фелодипином и т.д. и кортикостероидами гидрокортизоном, метилпреднизолоном, бетаметазоном, дексаметазоном, беклометазоном и тому подобное. Способы получения Соединения формулы I являются желчными метаболитами монтелукаста натрия. Поэтому они могут быть выделены и очищены из желчи индивидуумов, которые принимают монтелукаст натрия, с использованием методов,которые хорошо известны в данной области,таких как хроматография. В сравнении с этим соединения настоящего изобретения могут быть получены согласно следующим химическим способам, описанным в схемах 1 и 2. В схеме 1 диоловый эфир окисляют до соответствующего альдегида 2, используя окислитель, например, диметилсульфоксид и электрофил, такой как оксалилхлорид. Реакцию проводят в инертном органическом растворителе, таком как метиленхлорид, и при температуре ниже 0 С, например, при около -60 С. Диол 1 является известным соединением и может быть получен согласно способу, описанному в J. Org.Chem., 1996, 61:8518-8525. Дальнейшее окисление альдегида 2 до дикислоты I выполняют с нитратом серебра и основанием, таким как гидроокись калия. Окисление проводят при комнатной температуре в этаноле. Схема 2 В схеме 2 защищенный гидроксикетон 3 окисляют диоксидом селена с получением соответствующего -кетоальдегида 4. Защитой для гидроксильной группы может быть, например,третбутилдиметилсилильная группа. Гидроксикетон 3 может быть получен согласно способу,описанному в J. Оrg. Сhеm., 1993, 58:3731-3735.-Кетоальдегид 4 окисляют до соответствующей -кетокарбоновой кислоты 5, из которой затем получают ее производное 8 фенилментоловый эфир 6. Обработка 6 бромметилмагнием с последующим снятием защиты приводит к диоловому эфиру 7 как диастереомерной смеси. С помощью хроматографии смесь разделяют на индивидуальные диастереомеры. Каждый диастереомер используют раздельно, чтобы получить индивидуальные диастереомеры формулы I. Таким образом, вторичную гидроксильную группу 7 мезилируют и получают производное,которое затем взаимодействует с дианионом 1 меркаптометилциклопропануксусной кислотой,реагирующей in situ с н-бутиллитием, с получением эфира 8. Гидролиз 8 основанием, таким как гидроокись лития, приводит к желаемой двухосновной кислоте формулы I. Методы определения биологической активности Свойства соединений настоящего изобретения как антагонистов лейкотриенов оценивают с использованием следующих методов: 1. [3H]LTD4 рецептор связывающий анализ в DMSO-дифференцириванных U937 клетках(моноцитарная линия клеток человека); 2. [3H]LTD4 рецепторное связывание на легочных мембранах морской свинки; 3. [3H]LTD4 рецепторное связывание на легочных мембранах человека; 4. In vitro трахея морской свинки; и 5. In vivo анализы в наркотизированных морских свинках. Вышеуказанные методы описаны T.R.Jones 16 Испытание на крысах с астмой Крыс получают из инбредной линии крыс с астмой. Используют как самок (190-250 г), так и самцов (260-400 г). Яичный альбумин (ЕА), степень чистотыgrade V, кристаллический и лиофилизированный, получают от Sigma Chemical Co., St.Louis. Гидроокись алюминия получают от RegisChemical Company, Chicago. Метисергид бималеат предоставлен Sandoz Ltd., Basel. Провокацию и последующие регистрации дыхания выполняют в прозрачном пластиковом боксе с внутренними размерами 10 х 6 х 4 дюйма. Крышка бокса является съемной; при использовании ее крепко удерживают на месте с помощью четырех зажимов, а воздухонепроницаемый затвор поддерживают с помощью мягкойрезиновой прокладки. Через центр каждого края камеры DeVilbiss вводят распылитель (No. 40) посредством воздухонепроницаемого затвора и каждый край бокса также имеет выпускное отверстие. Пневмотахограф Fleisch No. 0000 вводят в один край бокса и соединяют с Grass датчиком объемного давления (РТ 5-А), который затем соединяют с усилителем Buxco Electronics(Buxco Electronics Inc., Sharon, Conn.). Усилитель соединяют с динографом Beckman Type R и с компьютером Buxco, состоящим из волнового анализатора Data Acquisition Logger, со специальной слабой волной. Во время впрыскивания антигена выпускные отверстия открывают и пневмотахограф изолируют из камеры. Выпускные отверстия закрывают и пневмотахограф и камеру соединяют во время регистрации картины дыхания. Для провокации 2 мл 3%-ного раствора антигена в солевом растворе помещают в каждый распылитель и аэрозоль производится с воздухом из маленького мембранного насосаPotter, действующего при 10 пси и скорости 8 л в мин. Крыс сенсибилизируют путем инъекции(подкожно) 1 мл суспензии, содержащей 1 мг ЕА и 200 мг гидроокиси алюминия в солевом растворе. Их используют между 12 и 24 днями после сенсибилизации. Для того, чтобы исключить серотониновый компонент ответа, крысам предварительно вводят внутривенно за 5 мин до аэрозольной провокации 3 мг/мл метисергида,крыс затем выдерживают в атмосфере аэрозоля из 3% ЕА в солевом растворе в течение 1 мин точно, затем профили их дыхания записывают в течение дальнейших 30 мин. Продолжительность постоянной одышки измеряют с помощью компьютера Вuхсо. Соединения обычно вводят либо орально за 2-4 ч до провокации либо внутривенно за 2 мин до провокации. Их либо растворяют в солевом растворе либо в 1%-ном метоцеле или суспендируют в 1%-ном метоцеле. Вводимый объем составляет 1 мл/кг (внутривенно) или 10 мл/кг (орально). До оральной обработки крыс не кормят в течение ночи. Активность соединений 17 определяют, исходя из их способности снижать продолжительность вызванной антигеном одышки по сравнению с контрольной группой,обработанной носителем. Обычно соединения оценивают при использовании серии доз и определяют ED50. Активность выражается как доза(мг/кг), которая ингибирует продолжительность симптомов на 50%. Функционирование легких у обученных чувствительных беличьих обезьян Процедура испытания включает помещение обученных беличьих обезьян на стулья в камеры, которые обрабатывают аэрозолем. Для контрольных тестов оценку функционирования легких путем измерения дыхательных параметров производят в течение периода, составляющего около 30 мин, чтобы установить для каждой обезьяны нормальные контрольные величины в течение этого дня. Для орального введения соединения растворяют или суспендируют в 1%-ном растворе метоцела (мeтилцеллюлозы,65HG, 400 cps) и дают в объеме 1 мл/кг веса тела. Для аэрозольного введения соединений используют ультразвуковой распылитель DeVilbiss. Периоды предварительной обработки варьируют от 5 мин до 4 ч до того, как обезьян провоцируют аэрозольными дозами либо лейкотриена D4 (LTD4) либо антигена Ascaris suum,разведение 1:25. После провокации каждая минута приводит к информации, которая просчитывается с помощью компьютера как процент отклонения от контрольных величин для каждого дыхательного параметра, включая резистентность дыхательных путей (RL) и динамическую расслабленность (Cdyn). Результаты от каждого испытуемого соединения получают последовательно в течение минимального периода 60 мин после провокации, которые затем сравнивают с ранее полученными контрольными величинами для этой обезьяны. Кроме того полные величины в течение 60 мин после провокации для каждой обезьяны (величины базовой линии и полученные в результате испытаний) усредняют отдельно и используют для расчета полного процента ингибирования реакции от LTD4 или антигенаAscaris suum с помощью испытуемых соединений. Для статистики используют спаренный(двойной) t-тест. (Ссылки: McFarlane, C.S. et al.,Prostaglandins, 28, 173-182 (1984) and McFarlane,C.S. et. al., Agents Actions, 22, 63-68 (1987). Предотвращение вызванного бронхостеноза у овцы с аллергией А. Объяснение: Определенная овца с аллергией с известной чувствительностью к специфическому антигену (Ascaris suum) реагирует на ингаляционную провокацию острой и замедленной реакцией бронхов. Время течения как острой, так и замедленной реакции бронхов приближается ко времени течения, наблюдаемого у астматиков, и фармакологическая модификация обеих реакций является подобной той, 001797 18 которая обнаружена у человека. Действие антигена у этих овец в значительной степени наблюдают в верхних путях и его удобно измерять как изменение легочной резистентности или специфической легочной резистентности. В. Методы. Животный материал. Используют взрослых овец со средним весом 35 кг (диапазон от 18 до 50 кг). Все используемые животные соответствуют 2 критериям: а) они имеют природную кожную реакцию при разбавлении 1:1000 или 1:10000 экстракта Ascaris suum (Greer Diagnostics, Lenois, NC); и b) они ранее реагировали на ингаляционную провокацию с Ascaris suum как острым бронхостенозом,так и замедленной бронхиальной непроходимостью (W.M.Abraham et al., Am. Rev. Resp. Dis.,128, 839-44 (1983. Измерение функционирования дыхательных путей: Овец, на которых не воздействовали седативными средствами, удерживают в распростертом положении с неподвижными головами. После местной анестезии носовых проходов с 2%-ным раствором лизокаина баллонный катетер продвигают вперед через одну ноздрю в нижний отдел пищевода. Затем животным через другую ноздрю вводят эндотрахеальную трубку,используя гибкий волоконно-оптический бронхоскоп в качестве зонда. Определяют плевральное давление с помощью пищеводного баллонного катетера (заполненного 1 мл воздуха), который располагают так, что в результате вдоха наблюдают зубец (смещение) отрицательного давления с четко заметными кардиогенными колебаниями. Латеральное давление в трахее измеряют с помощью катетера с боковым отверстием (внутренний размер 2,5 мм), продвигаемого вперед и располагаемого периферически к верхушке (наконечнику) носотрахеальной трубки. Общее легочное давление, разницу между трахеальным давлением и плевральным давлением, измеряют с помощью дифференциального датчика давления (DP45; Validyne Corp.,Northridge, CA). Для измерения легочной резистентности (RL) максимальный конец носотрахеальной трубки соединяют с пневмотахографом (Fleisch, Dyna Sciences, Blue Bell, PA). Сигналы потока и общего легочного давления регистрируют на осциллоскопе (Model DR-12; Electronics for Medicine, White Plains, NY), который связан с компьютером PDP-11 Digital (DigitalEquipment Corp., Maynard, MA) для расчета на линейном участке RL, исходя из общего легочного давления, дыхательного объема, полученного путем интеграции, и потока. Анализ 10-15 вздохов применяют для определения RL. Грудной объем газа (Vtg) измеряют в плетизмографе для регистрации изменений объема всего тела,чтобы получить специфическую легочную резистентность (SRL=RLVtg). Аэрозольная система доставки Аэрозоли из экстракта Ascaris suum (1:20) получают, используя находящийся в распоря 19 жении медицинский распылитель (Raindrop,Puritan Bennett), который производит аэрозоль со средним аэродинамическим диаметром по большей части 6,2 мМ (геометрическое стандартное отклонение, 2,1), как определяют с помощью анализатора электрических величин(Model 3030; Thermal Systems, St.Paul, MN). Продукт из распылителя направляют на пластиковый t-участок, один конец которого прикрепляют к носотрахеальной трубке, а другой конец которого соединяют с дыхательной частью респиратора Harvard. Аэрозоль доставляют при приливно-отливном объеме 500 мл при скорости 20 в мин. Таким образом, каждая овца получает эквивалентную дозу антигена как в плацебо, так и в лекарственной пробе. Протокол эксперимента До измерения базовой линии SPL после антигенной провокации вливание испытуемого соединения начинают за 1 ч до провокации, измерения SRL повторяют и затем овцу подвергают ингаляционной провокации с антигеном Ascaris suum. Измерения SRL производят немедленно после антигенной провокации и при 1, 2,3, 4, 5, 6, 6,5, 7, 7,5 и 8 ч после антигенной провокации. Плацебо и лекарственные тесты разделяют, по крайней мере, 14 дней. При дальнейшем изучении овце дают дозу испытуемого соединения в пищевом комке с последующим вливанием испытуемого соединения за 0,5-1 ч до Ascaris провокации и в течение 8 ч после Ascaris, как описано выше. Статистический анализ Используют Kruskal-Mallis однонаправленный ANOVA тест, чтобы сравнить острую немедленную реакцию к антигену и максимум замедленной реакции у контрольных и принимающих лекарство животных. Изобретение теперь иллюстрируют следующими неограничивающими примерами, в которых если не указано особо(i) все операции выполняют при комнатной температуре или при температуре окружающей среды, т.е. при температуре в области 18-25 С;(ii) упаривание растворителя выполняют с использованием роторного испарителя при пониженном давлении (600-4000 паскалей; 4,5-30 мм Hq) с температурой в бане до 60 С;(iii) за ходом реакции следят с помощью тонкослойной хроматографии (TCX) и время реакции дается только для иллюстрации;(iv) точки плавления не поправлены и 'd' означает разложение; данные точки плавления получены для материалов, приготовленных как описано; полиморфизм может приводить к выделению материалов с различными точками плавления в некоторых препаратах;(v) структуру и чистоту всех конечных продуктов подтверждают, по крайней мере, одним из следующих методов: TCX, массспектрометрией, спектрометрией ядерного маг 001797(vi) выходы даны для иллюстрации только;(vii) когда указаны, данные ЯМР находятся в форме дельта (d) величин для главных диагностических протонов, даны в частях на миллион(viii) химические символы имеют их обычные обозначения; следующая аббревиатура также используется: об. (объем), вес (вес), т.к. (точка кипения),т.пл. (точка плавления), л (литр(ы, мл (миллилитры), г (грамм(ы, мг (миллиграммы(ы, мол(моли), ммол (миллимоли), экв. (эквивалент(ы. Пример 1. (R, R или 3)-1-[1-[3-(2-(7-хлор-2 хинолинил)-(Е)-этенил)фенил]-3-(2-(1-гидрокси-1 карбоксиэтил)фенил)пропилтио)метил]циклопропануксусная кислота. Диастереомерная смесь Стадия 1. Метил (R, R или S)-1[1-[3-(2(7-хлор-2-хинолинил)-(Е)-этенил)фенил]-3-(2(1-гидрокси-1-карбонилэтил)фенил)-пропил)тио)метил]циклопропанацетат. К смеси оксалилхлорида (0,45 ммоль, 4,3 мл) в CH2Cl2; (200 мл) при -60C добавляютOrg. Chem., 1996, 61,8518-85251 (0,041 моль, 25 мг) в CH2Cl2 (50 мл) медленно добавляют при 60 С. Реакционную смесь перемешивают в течение 15 мин и реакцию останавливают добавлением Et3N (0,2 ммоль, 28 мл). Температуру повышают до 25 С и добавляют воду (2 мл),реакционную смесь экстрагируют EtOAc (2 мл). Органические экстракты высушивают надNa2SO4 и упаривают досуха. Остаток под высоким вакуумом доводят до постоянного веса и получают 20 мг соединения, указанного в заглавии, которое используют как таковое в следующей стадии. 1 21 К раствору альдегида из стадии 1 (20 мг,0,032 ммоль) в EtOH (500 мл) и АgNО 3 (13 мг,0,76 ммоль) (предварительно растворяют в 30 мл воды) добавляют раствор КОН (0,16 ммоль,0,16 мл) по каплям. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь подкисляют уксусной кислотой. (10 мл) и разбавляют насыщенным раствором NH4Cl (2 мл) и экстрагируют EtOAc (2 мл). Органические экстракты высушивают над Na2SO4 и упаривают. Остаток очищают с помощью флеш-хроматографии на силикагеле, используя смесь растворителей МеОН/СНСl3/NН 3 = 4:8:1 и получают 5 мг вещества, которое далее очищают с помощью ВЭЖХ в колонке с силикагелем Novapak, используя смесь для элюции MeOH/H2O/AcOH(80-20-0,1%) и контролируя элюируемые фракции при 350 нм, и получают 2,8 мг соединения,указанного в заглавии. 1(FAB) m/z рассчитано для C35H34ClNO5S: 616,192448, найдено 616,19269. Пример 2. (R, R или S)-1-[1-[3-(2-(7-хлор 2-хинолинил)-Е-этенил)фенил]-3-(2-(1 гидрокси-1-карбоксиэтил)фенил)пропил)тио)метил]циклопропануксусная кислота. Главный изомер Стадия 1. (S)-2-(3-[3-(2-(7-хлор-2-хинолинил)(Е)-этенил)фенил]-3-трет-бутилдиметилсилилоксипропил)фенилэтанон. К [S-(Е)-1-[2-[3-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-гидроксипропил]фенил]этанонуOrg.Chem., 1993, 58, 3731-3735) (13,4 г, 30,35 ммоль) в CH2Cl2; (67 мл) добавляют 2,6 лутидина (5,32 мл, 45,52 ммоль). Смесь охлаждают до -78 С,затем TBDMSO Tf (7,0 мл, 30,35 ммоль) добавляют по каплям. Реакционную смесь перемешивают в течение 1 ч. Реакцию останавливают путем добавления 25% раствора NH4OAc (50 мл) и экстрагируют с EtOAc (100 мл). Органический экстракт высушивают над Na2SO4 и упаривают до остатка. Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексана и EtOAc в отношении 95:5 и получают 14,4 г соединения,указанного в заглавии. 1 22 стадии 1 (14,4 г, 26 ммоль) в растворе с диоксаном (70 мл). Реакционную смесь нагревают при 100 С в течение ночи. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют через прокладку из целита и промывают диоксаном (20 мл). После упаривания досуха получают соединение, указанное в заглавии,которое используют как таковое в следующей стадии (Сырой вес 14 г). Стадия 3. (S)-2-(3-[3-(2-(7-хлор-2-хинолинил)-(Е)-этенил)фенил]-3-трет-бутилдиметилсилилоксипропил)бензоилмуравьиная кислота. К раствору альдегида из стадии 2 (14 г,24,6 ммоль) в EtOH (118 мл) добавляют раствор АgNО 3 (10 г, 59 ммоль), предварительно растворенного в воде (23 мл), а затем добавляют раствор КОН (118 мл, 118 ммоль 1 М) по каплям. Смесь перемешивают при комнатной температуре в течение ночи. Объем EtOH удаляют упариванием, водный раствор подкисляют 1N НСl(118 мл) и экстрагируют EtOAc дважды (100 мл). Органические экстракты высушивают надNа 2SO4 и упаривают. Остаток очищают с помощью флеш-хроматографии, вначале в качестве элюента используют чистый EtOAc, а затем смесь EtOAc:АсОН-95:5 и получают 5,0 г соединения, указанного в заглавии. 1H ЯМР (СD3 СОСD3) д 0,15 (с, 6 Н), 0,95 (с,9 Н), 2,0 (м, 2 Н), 2,95-3,18 (м, 2 Н), 4,95 (т, 1 Н),7,35-7,65 (м, 8 Н), 7,75-7,97 (м, 5 Н), 8,0 (с, 1 Н),8,32 (д, 1 Н). Стадия 4. 8-фенилментил (S)-2-(3-[3-(2-(7 хлор-2-хинолил)-(Е)-этенил)фенил]-3-трет-бутилдиметилсилилоксипропил)бензоилформат. К кетокислоте из стадии 3 (5,0 г, 8,5 ммоль) в СН 2 Сl2 (40 мл) при 0 С добавляют ДМР (100 мл), а затем оксалилхлорид (1,12 мл,12,8 ммоль) по каплям. Реакционную смесь перемешивают в течение 1 ч. Затем реакционную смесь упаривают досуха и остаток оставляют под высоким вакуумом в течение 1 ч и полученный продукт используют как таковой в следующей стадии. К 8-фенилментолу (2,0 г, 8,6 ммоль) в толуоле (40 мл) и пиридине (0,7 мл, 8,5 ммоль) добавляют неочищенный хлорангидрид из предыдущей стадии в толуоле (10 мл) при комнатной температура. Смесь перемешивают в течение ночи. Реакцию останавливают путем добавления насыщенного раствора NH4Cl и НСl 1 N 1:1 (50 мл) и экстрагируют EtOAc дважды (50 мл). Органические экстракты высушивают надNa2SO4 и упаривают досуха. Остаток очищают с помощью флеш-хроматографии, в качестве элюента используют смесь толуола с EtOAc в отношении 99;1 и получают 5,0 г соединения,указанного в заглавии. 1(д, 1 Н). Стадия 5. (S, R или S) 8-фенилментил-2-[2(3-(3-(2-(7-хлор-2-хинолил)-(Е)этенил)фенил]-3 трет-бутилдиметилсилилоксипропил)фенил-2 гидроксипропионат. К кетоэфиру из стадии 4 (1,0 г, 1,25 ммоль) в эфире (25 мл) добавляют при -78 С МеМgВr 3 М (0,83 мл, 2,5 ммоль). Реакционную смесь перемешивают в течение 1,5 ч. Реакцию останавливают путем добавления 0,4 мл АсОН непосредственно в смесь, а затем добавляют насыщенный раствор NH4Cl(10 мл) и экстрагируют EtOAc (20 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Остаток очищают флешхроматографией, используя смесь гексана и(м, 23 Н), 1,35 (м, 2 Н), 1,72 (т, 1 Н), 1,80 (с, 3 Н),2,70 (т, 1 Н), 2,85 (т, 1 Н), 4,75 (м, 1 н), 5,0 (м, 1H),7,05-7,25 (м, 8 Н), 7,35-7,55 (м, 5 Н), 7,65 (с, 1 Н),7,75-8,05 (м, 5 Н), 8,35 (д, 1 Н). Стадия 6. (S, R или S) 8-фенилментил-2-[2(3-(3-(2-(7-хлор-2-хинолил)-(Е)этенил)фенил]-3 гидрокси)пропилфенил-2-гидроксипропионат. К эфирокарбинолу из стадии 5 (0,8 г, 0,98 ммоль) в ТГФ добавляют раствор TBAF (1 мл,0,98 ммоль) при комнатной температуре в течение ночи. Реакцию останавливают добавлением насыщенного раствора NH4Cl и экстрагируют сEtOAc (2 х 10 мл). Органические экстракты высушивают над Na2SО 4 и упаривают досуха. Остаток очищают флеш-хроматографией, элюируя смесью CH2Cl2 и ацетона в отношении 95:5, и получают 0,39 г главного изомера и 0,10 г минорного изомера. Главный: 1 Н ЯМР (CD3COCD3) д 0,65-1,00(м, 5 Н), 7,75-8,05 (м, 6 Н), 8,35 (д, 1 Н). Стадия 7. (S, R или S) 8-фенилментил-2-[2(3-(3-(2-(7-хлор-2-хинолил)-(Е)-этенил)фенил]3-метансульфонат)пропилфенил-2-гидроксипропионат. К главному изомеру спиртокарбинолоэфира из стадии 6 (0,3 г, 3,41 ммоль) в смеси 1:1 толуола с СН 3 СN (2,5 мл) добавляют основаниеHunig (75 мл, 0,43 ммоль). Реакционную смесь охлаждают до -40 С и добавляют метансульфонилхлорид (33 мл, 0,43 ммоль) по каплям. Температуру постепенно поднимают до -30 С в течение 1 ч. Реакцию останавливают путем добавления насыщенного раствора NаНСО 3 (3 мл) и 24 экстрагируют с EtOAc (3 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Полученное соединение, указанное в заглавии, используют как таковое в следующей стадии. 1H ЯМР (СD3 СОСD3) д 0,65-0,98 (м, 9 Н),1,0 (с, 3 Н), 1,25-1,45 (м, 2 Н), 1,75 (м, 4 Н), 1,9 (м,1 Н), 2,28 (м, 1 Н), 2,42-2,55 (м, 1 Н), 2,7-2,85 (М,2 Н), 2,95-3,05 (м, 4 Н), 4,65-4,75 (м, Н), 5,80 (т,1 Н), 7,05-7,25 (м, 8 Н), 7,45-7,60 (м, 5 Н), 7,757,82 (д, 1 Н), 7,83-8,05 (м, 5 Н), 8,35 (д, 1 Н). К дегазированному ТГФ (1 мл) под N2 добавляют 1-(меркаптометил)-1-циклопропануксусную кислоту (Bioorganic Med. Letters, 1995,5(3), 283-288) (60 мг, 0,41 ммоль). К этому раствору, охлажденному до -15 С, добавляют бутиллитий (339 мл, 0,82 ммоль). Температуру поднимают до -8 С в течение 30 мин. Затем неочищенный мезилат из предыдущей стадии(0,33 г, 0,41 ммоль), растворенный в дегазированном ТГФ (1 мл), добавляют к реакционной смеси по каплям. Смесь перемешивают при 0 С в течение ночи. Реакцию останавливают насыщенным раствором NH4Cl (2 мл) и экстрагируют с EtOAc (2 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Остаток очищают флеш-хроматографией, используя смесь для элюции гексана с EtOAc в отношении 1:1 с добавлением 1% АсОН и получают 138 мг соединения, указанного в заглавии. 1H ЯМР (СD3 СОСD3) д 0,3-0,58 (м, 4 Н),0,6-0,96 (м, 5 Н), 1,10-1,25 (м, 7 Н), 1,28-1,45 (м,1 Н), 1,62 (с, 3 Н), 1,75-1,90 (м, 1 Н), 2,09-2,20 (м,1 Н), 2,25-2,36 (м, 1 Н), 2,40-2,52 (м, 2 Н), 2,60 (с,2 Н), 2,65-2,84 (м, 2 Н), 4,02 (т, 1 Н), 4,75 (м, 1 Н),7,09 (м, 11 Н), 7,35-7,55 (3 Н), 7,62 (М, 1 Н), 7,758,05 (м, 4 Н), 8,35 (д, 1 Н). Стадия 8. (R, R или S)-1-[1-[3-(2-(7-хлор 2-хинолинил)-(Е)-этенил)фенил]-3-(2-(1-гидрокси-1-карбоксиэтил)фенил)пропил)тио)метил]циклопропануксусная кислота. К карбинолоэфиру из стадии 7 (138 мг,0,16 ммоль) в EtOH (500 мл) добавляют раствор 1N LiOH (480 мл, 0,48 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 3-х дней, реакцию останавливают добавлением насыщенного раствора NH4Cl (2 мл) и уксусной кислоты (30 мл) и экстрагируют сEtOAc (2 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Остаток очищают флеш-хроматографией, используя в качестве элюента смесь СНСl3 и МеОН в отношении 2:1, затем смесь СНСl3/МеОН/NН 4OН=2/1/0,25 и получают 65 мг соединения,указанного в заглавии, которое в дальнейшем очищают с помощью ВЭЖХ на колонке Novapak, контролируя при 350 нм, используя элюент МеОН-вода-АсОН = 80:20;0,1%, и получают 11 мг соединения, указанного в заглавии. 1(СD3 СОСD3) д 12,3, 12,3, 17,1, 27,5, 31,8, 39,2,39,5, 39,6, 50,4, 76,0, 120,7, 125,8, 126,3, 126,2,126,7, 127,1, 127,5, 128,1, 128,2, 129,0, 129,2,129,2, 130,0, 131,2, 135,3, 135,8, 137,0, 137,5,140,9, 141,7, 144,5, 149,1, 157,7, 173,1, 177,4. ВРМС (FAB; m/z рассчитано для С 35 Н 34 СlNO5S: 616,192448, найдено 616,19269. Пример 3. (R, R или S)-1-[1-[3-(2-(7-хлор 2-хинолинил)-Е-этенил)фенил]-3-(2-(1 гидрокси-1-карбоксиэтил)фенил)пропил)тио)метил]циклопропануксусная кислота. Минорный изомер Стадия 1. (S, R или S) 8-фенилментил-2-[2(3-(3-(2-(7-хлор-2-хинолил)-(Е)-этенил)фенил]3-метансульфонат)пропилфенил-2-гидроксипропионат. К минорному изомеру спиртокарбинолоэфира из примера 2, стадии 6 (0,5 г, 0,68 ммоль) в смеси толуола с СН 3 СN в отношении 1:1 (4,0 мл) добавляют основание Hunig (125 мл, 0,68 ммоль). Реакционную смесь охлаждают до 40 С. Затем добавляют по каплям метансульфонилхлорид (55 мл, 0,71 ммоль). Температуру постепенно поднимают до -30 С в течение 1 ч. Реакцию останавливают путем добавления насыщенного раствора NaHCO3 (3 мл) и экстрагируют с EtOAc (3 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха с получением соединения, указанного в заглавии,которое используют как таковое в следующей стадии. 1 Н ЯМР (СD3 СОСD3) д 0,65-0,98 (м, 9 Н),1,0 (с, 3 Н), 1,25-1,45 (м, 2 Н), 1,75 (м, 4 Н), 1,9 (м,1 Н), 2,28 (м, 1 Н), 2,42-2,55 (м, 1H), 2,7-2,85 (м,2 Н), 2,95-3,05 (м, 4 Н), 4,65-4,75 (м, Н), 5,80 (т,1 Н), 7,05-7,25 (м, 8 Н), 7,45-7,60 (м, 5 Н), 7,757,82 (д, 1 Н), 7,83-8,05 (м, 5 Н), 8,35 (д, 1 Н). К дегазированному ТГФ (1 мл) под N2 добавляют 1-(меркептометил)-1-циклопропануксусную кислоту (Bioorganic Med. Letters, 1995,5(3), 283-288) (99 мг, 0,68 ммоль). К этому раствору, охлажденному до -15 С, добавляют бутиллитий (542 мл, 1,36 ммоль). Температуру поднимают до -8 С в течение 30 мин. Затем неочищенный мезилат из предыдущей стадии(0,55 г, 0,68 ммоль), растворенный в дегазированном THG (1,6 мл), добавляют к реакционной смеси по каплям. Смесь перемешивают при 0 С в течение ночи. Реакцию останавливают насыщенным раствором NH4Cl (2 мл) и экстрагируют с EtOAc (2 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Остаток очищают флеш-хроматографией, используя смесь для элюции гексана с EtOAc в отношении 1:1 с добавлением 1% АсОН и получают 200 мг соединения, указанного в заглавии. 1 26 2 Н), 2,65-2,84 (М, 2 Н), 4,02 (т, 1 Н), 4,75 (м, 1 Н),7,09 (м, 11 Н), 7,35-7,55 (3 Н), 7,62 (м, 1 Н), 7,758,05 (м, 4 Н), 8,35 (д, 1 Н). Стадия 2. (R, R или S)-1-[1-[3-(2-(7-хлор 2-хинолинил)-(Е)-этенил)фенил]-3-(2-(1-гидрокси-1-карбоксиэтил)фенил)пропил)тио)метил]циклопропануксусная кислота. К карбинолоэфиру из стадии 7 (200 мг,0,23 ммоль) в EtOH(500 мл) добавляют раствор 1N LiOH (700 мл, 0,70 ммоль). Реакционную смесь кипятят с обратным холодильником 3 дня,реакцию останавливают добавлением насыщенного раствора NH4Cl (2 мл) и уксусной кислоты(30 мл) к экстрагируют с EtOAc (2 мл). Органические экстракты высушивают над Na2SO4 и упаривают досуха. Остаток очищают флешхроматографией, используя в качестве элюента сначала смесь СНСl3/МеОН в отношении 2-1, а затем смесь CHCl3/MeOH/MH4OH в отношении 2:1:0,25, и получают 80 мг соединения, указанного в заглавии, которое в дальнейшем очищают с помощью ВЭЖХ на колонке Novapak, контролируя при 350 нм, используя смесь для элюции МеОН-вода-АсОН в отношении 80:20:0,1% и получают 13 мг соединения, указанного в заглавии. 1(м, 4 Н), 7,62 (т, 1 Н), 7,78 (д, 1 Н), 7,80-7,98(м,3 Н), 8,01 (с, 1 Н), 8,34 (д, 1 Н). ВРМС (FAB) m/z рассчитано для С 35 Н 34 СlNO5: 616,192448, найдено 616,19269. Пример 4. Выделение 1-[1-[3-(2-(7-хлор 2-хинолинил)-(Е)-этенил)фенил]-3-(2-(2-гидрокси-2-пропионовая кислота)фенилпропил)тио)метил]циклопропануксусной кислоты из желчи человека. Здоровым субъектам вводят разовую оральную дозу, состоящую из 50 мг монтелукаста натрия, после голодания в течение ночи (3 субъекта) или через 5 ч после диеты с содержанием жира (3 субъекта). Желчь собирают посредством гастродуоденальной трубки, помещенной через рот около печеночно-желудочной ампулы, от 2 до 8 ч или от 8 до 12 ч после принятия дозы. За 2 ч до конца процедуры сбора внутривенно вводят холецистокининовый Сконцевой октапептид, чтобы стимулировать сокращения желчного пузыря и таким образом увеличить отток желчи. Субъекты голодают на протяжении всей процедуры сбора. Все образцы хранятся при -70 С в темноте до анализа, и все анализы выполняют в условиях желтого света. Образцы желчи анализируют непосредственно после центрифугирования, используя колонку CI8 Deckman (4,6 х 250 мм), элюируя со скоростью 1 мл/мин с линейными градиентами от 35% до 45% ацетонитрила в 1 мМ ацетате аммония, рН 3,5 в течение 5 мин, от 45% до 55% ацетонитрила в течение 35 мин, от 55% до 87% ацетонитрила в течение 20 мин, от 87% до 95% ацетонитрила в течение 0,3 мин. При этих условиях ВЭЖХ указанное в заглавии соединение элюируется при около 53 мин в виде диастереомерной смеси. Полученное таким образом соединение, указанное в заглавии, вновь подвергают очистке, используя колонку Zorbax-XUBEclipse C8 (4,6 х 250 мм) и элюируя 15 мин с помощью линейного градиента от 28% ацетонитрила и 28% метанола в воде до 47% ацетонитрила и 47% метанола в воде. Время удерживания указанного в заглавии соединения при этих условиях составляет 15 мин. ЯМР и массспектры повторно очищенного соединения соответствуют тем спектрам, которые получены для аутентичного образца указанного в заглавии соединения. чении, терапевтически эффективного количества соединения по п.1. 6. Способ получения соединения по п.1,который включает а) взаимодействие соединения формулы 1b) взаимодействие соединения формулы 2 с нитратом серебра и основанием с получением соединения по п.1. 7. Способ получения индивидуальных диастереомеров соединения по п.1, который включает а) разделение диастереомерной смеси соединения формулы 7 и его индивидуальные оптические изомеры или его фармацевтически приемлемое производное. 2. Выделенное и очищенное соединение по п.1, по существу свободное от других продуктов метаболизма монтелукаста натрия. 3. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 4. Способ предотвращения действия лейкотриена у млекопитающего, включающий введение вышеуказанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1. 5. Способ лечения или предупреждения астмы, аллергий или воспаления у млекопитающего, включающий введение вышеуказанному млекопитающему, нуждающемуся в таком ле где R означает низший алкил, с диметилсульфоксидом и электрофилом с получением соединения формулы 2;b) взаимодействие индивидуального диастереомера с метансульфонилхлоридом с получением соответствующего мезилата;c) взаимодействие мезилата из стадии b) с дианионом 1-меркаптометилциклопропануксусной кислотой с получением соединения формулы 8d) удаление 8-фенилментильной группы с получением соединения по п.1.
МПК / Метки
МПК: A61P 11/06, C07D 215/38, A61K 31/47, A01N 43/42
Метки: антагонисты, хинолиновые, лейкотриенов
Код ссылки
<a href="https://eas.patents.su/15-1797-hinolinovye-antagonisty-lejjkotrienov.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолиновые антагонисты лейкотриенов</a>
Предыдущий патент: Состав для порошковых покрытий на основе модифицированного акриловыми соединениями (со) полимера винилиденфторида, способ его получения и применение.
Следующий патент: Противоревматические средства
Случайный патент: Быстроразлагаемая внутрибуккально таблетка












