Антибактериальные производные хинолина
Номер патента: 15617
Опубликовано: 31.10.2011
Авторы: Гийемон Жером Эмиль Жорж, Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил, Паскье Элизабет Терез Жанн, Лансуа Давид Франсис Ален
Формула / Реферат
1. Соединение общей формулы (Ia) или формулы (Ib)
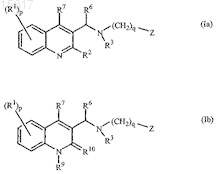
его фармацевтически приемлемая кислотно-аддитивная или основно-аддитивная соль, его четвертичный амин, его стереохимически изомерная форма, его таутомерная форма или его N-оксидная форма,
где P обозначает целое число, равное 0, 1, 2, 3 или 4;
q обозначает целое число, равное 1, 2 или 3;
Z обозначает радикал, выбранный из формул
![]()
R1 обозначает циано, атом галогена, алкил, галогеналкил, гидрокси, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, арилалкил, ди(арил)алкил, арил или Het;
R2 обозначает атом водорода, алкилокси, арил, арилокси, гидрокси, меркапто, алкилоксиалкилокси, алкилтио, моно- или ди(алкил)амино, пирролидинил или радикал формулы ![]()
где Y обозначает CH2, O, S, NH или N-алкил;
R3 обозначает алкил, арилалкил, арил, моно- или диалкиламиноалкил, Het или Het-алкил;
R4 и R5, каждый независимо, обозначает атом водорода; алкил; алкилоксиалкил; арилалкил; Het-алкил; моно- или диалкиламиноалкил; Het или арил; или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, которая включает пирролидинил, пиперидинил, пиперазинил, морфолинил, 4-тиоморфолинил, 2,3-дигидроизоиндол-1-ил, тиазолидин-3-ил, 1,2,3,6-тетрагидропиридил, 1,4-диазациклогептил, 1-аза-4-оксациклогептил, 1,2,3,4-тетрагидроизохинолин-2-ил, 2H-пирролил, пирролинил, пирролил, имидазолидинил, пиразолидинил, 2-имидазолинил, 2-пиразолинил, имидазолил, пиразолил, триазолил, пиридинил, пиридазинил, пиримидинил, пиразинил и триазинил, необязательно замещенный одним или несколькими заместителями, при этом каждый заместитель независимо выбран из алкила, галогеналкила, атома галогена, арилалкила, гидрокси, алкилокси, амино, моно- или диалкиламино, алкилтио, алкилоксиалкила, алкилтиоалкила, арила, пиридила или пиримидинила;
R6 обозначает арил или Het;
R7 обозначает атом водорода или атом галогена;
R8 обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода;
R9 обозначает атом водорода или алкил;
R10 обозначает оксо и
X обозначает -CH2- или -CO-;
алкил обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода; или обозначает циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или обозначает циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, который присоединен к насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 6 атомов углерода; где каждый атом углерода алкильной группы необязательно может быть замещен циано, гидрокси, алкилокси или оксо;
арил обозначает гомоцикл, выбранный из фенила, нафтила, аценафтила или тетрагидронафтила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, при этом каждый заместитель независимо выбран из гидрокси, атома галогена, циано, нитро, амино, моно- или диалкиламино, алкила, галогеналкила, алкилокси, карбоксила, алкилоксикарбонила, аминокарбонила, морфолинила или моно- или диалкиламинокарбонила;
Het обозначает моноциклический гетероцикл, выбранный из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила или пиридазинила; или бициклический гетероцикл, выбранный из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; при этом каждый моноциклический и бициклический гетероцикл необязательно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из атома галогена, гидрокси, алкила или алкилокси;
атом галогена выбран из атома фтора, хлора, брома или иода и
галогеналкил обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, который присоединен к насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 6 атомов углерода; где один или несколько атомов углерода замещены одним или несколькими атомами галогена.
2. Соединение по п.1, отличающееся тем, что
p равно 0 или 1;
R1 обозначает атом галогена или алкил;
R2 обозначает алкилокси или арил;
R3 обозначает арил, арилалкил или Het-алкил;
q равно 1;
R4 и R5, каждый независимо, обозначает алкил или же R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал 4-тиоморфолинил, пиперидинил или пиперазинил, замещенный алкилом или арилалкилом;
R6 обозначает арил, необязательно замещенный атомом галогена, или же R6 обозначает бензофуранил;
R7 обозначает атом водорода;
R8 обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода.
3. Соединение по любому из пп.1 и 2, отличающееся тем, что
p равно 1;
Z обозначает радикал формулы (a);
R1 обозначает атом брома или метил;
R2 обозначает метилокси или фенил;
R3 обозначает фенил, необязательно замещенный метилоксигруппой, или бензил;
q равно 1;
R4 и R5, каждый, обозначает метил, этил или изопропил или же R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал 4-тиоморфолинил, радикал пиперидинил, замещенный метилом в положении 4, или радикал пиперазинил, замещенный бензилом в положении 4;
R6 обозначает фенил или бензофуранил и
R7 обозначает атом водорода.
4. Соединение по п.2, отличающееся тем, что
p равно 0 или 1;
R1 обозначает атом брома или метил;
R2 обозначает метилокси или фенил;
R3 обозначает фенил, бензил или хинолин-5-илметил;
q равно 1;
R4 и R5, каждый, обозначает метил или же R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал пиперазинил, замещенный метилом в положении 4;
R6 обозначает фенил, необязательно замещенный атомом фтора в положении 2;
R7 обозначает атом водорода;
R8 обозначает этил.
5. Соединение по п.1, отличающееся тем, что указанное соединение выбрано из
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-N-(4-метилпиперазин-1-ил)ацетамида;
N-[(6-бром-2-метоксихинолин-3-ил)фенилметил]-N',N'-диметил-N-фенилэтан-1,2-диамина;
N-бензил-N-[(6-бром-2-фенилхинолин-3-ил)фенилметил]-N',N'-диметилэтан-1,2-диамина;
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-1-(4-метилпиперазин-1-ил)этанона;
2-{[(6-бром-2-метоксихинолин-3-ил)фенилметил]хинолин-5-илметиламино}-1-(4-метилпиперазин-1-ил)этанона;
2-{бензил-[(6-бром-2-метоксихинолин-3-ил)фенилметил]амино}-1-(4-метилпиперазин-1-ил)этанона;
N-бензил-N-[(6-бром-2-метоксихинолин-3-ил)-(2-фторфенил)метил]-N',N'-диметилэтан-1,2-диамина;
этилового эфира {бензил-[(6-бром-2-метоксихинолин-3-ил)фенилметил]амино}уксусной кислоты и
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-1-пиперидин-1-илэтанона;
их фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, их четвертичного амина, их стереохимически изомерной формы, их таутомерной формы или их N-оксидной формы.
6. Соединение по п.1, отличающееся тем, что указанное соединение выбрано из
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-1-(4-бензилпиперазин-1-ил)этанона;
N-[(6-бром-2-метоксихинолин-3-ил)фенилметил]-N-(2-метоксифенил)-N',N'-диметилэтан-1,2-диамина;
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-N,N-диметилацетамида;
N-бензил-N-[(6-бром-2-фенилхинолин-3-ил)фенилметил]-N',N'-диметилэтан-1,2-диамина;
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-1-(4-метилпиперидин-1-ил)этанона;
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-N,N-диэтилацетамида;
2-{бензил-[(6-бром-2-фенилхинолин-3-ил)фенилметил]амино}-N,N-диметилацетамида;
2-{[бензофуран-2-ил-(2-фенилхинолин-3-ил)метил]бензиламино}-N-изопропил-N-метилацетамида;
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-1-тиоморфолин-4-илэтанона и
2-{бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино}-N-изопропил-N-метилацетамида;
их фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, их четвертичного амина, их стереохимически изомерной формы, их таутомерной формы или их N-оксидной формы.
7. Применение соединения по любому из пп.1-6 в качестве лекарственного препарата.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-6.
9. Применение соединения по любому из пп.1-6 для приготовления лекарственного средства, предназначенного для лечения бактериальной инфекции.
10. Способ лечения пациента, страдающего от бактериальной инфекции или рискующего подвергнуться заражению бактериальной инфекцией, который включает введение пациенту терапевтически эффективного количества соединения по любому из пп. 1-6.
11. Применение по п.9, где бактериальная инфекция представляет собой инфекцию, вызванную стафилококками, энтерококками или стрептококками.
12. Применение по п.9, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к действию метициллина Staphylococcus aureus (MRSA), устойчивыми к действию метициллина коагулаза-негативными стафилококками (MRCNS), устойчивыми к действию пенициллина Streptococcus pneumoniae или обладающими множественной лекарственной устойчивостью Enterococcus faecium.
13. Применение по п.9, где бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus (MRSA) или Streptococcus pneumoniae.
14. Применение по п.13, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к действию метициллина Staphylococcus aureus (MRSA).
15. Применение соединения по любому из пп.1-6 для приготовления лекарственного средства, предназначенного для лечения бактериальной инфекции, вызванной Mycobacterium tuberculosis.
Текст
Дата публикации и выдачи патента Номер заявки Кунрад Йозеф Лодевейк Марсель,Коул Анил (BE) Изобретение относится к новым замещенным производным хинолина общей формулы (Ia) или формулы (Ib),их фармацевтически приемлемым кислотно-аддитивным или основно-аддитивным солям, их четвертичным аминам, их стереохимически изомерным формам, их таутомерным формам и их N-оксидным формам. Заявляемые соединения пригодны для использования при лечении бактериального заболевания, в том числе микобактериального заболевания, в частности таких заболеваний, которые вызываются патогенными микобактериями, такими как Mycobacterium tuberculosis, MM. bovis, M. avium и M. marinum. Заявляется также композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество заявляемых соединений, применение заявляемых соединений или композиций для приготовления лекарственного средства, предназначенного для лечения бактериальных заболеваний, и способ получения заявляемых соединений. Гийемон Жером Эмиль Жорж,Лансуа Давид Франсис Ален, Паскье Элизабет Терез Жанн (FR), Андрис 015617 Изобретение относится к новым замещенным производным хинолина, которые пригодны для использования при лечении бактериальных заболеваний, в том числе, однако этим не ограничиваясь, заболеваний, которые вызываются патогенными микобактериями, такими как Mycobacterium tuberculosis, M.Mycobacterium tuberculosis является возбудителем туберкулеза (ТБ), опасной и потенциально смертельной инфекции, которая распространена во всем мире. По оценке Всемирной организации здравоохранения, более чем 8 миллионов человек заражаются ТБ ежегодно, а 2 миллиона человек ежегодно умирают от туберкулеза. В последнее десятилетие случаи ТБ во всем мире возросли на 20%, при этом наибольшая предрасположенность наблюдается в беднейших сообществах. Если указанная тенденция сохранится, то частота возникновения заболевания в течение следующих двадцати лет увеличится на 41%. Через пятьдесят лет после разработки эффективной химиотерапии ТБ остается основной инфекцией после СПИДа, приводящей к смертности взрослого населения во всем мире. Эпидемическая обстановка ТБ осложняется увеличением количества штаммов, обладающих множественной лекарственной устойчивостью, и смертоносным симбиозом с ВИЧ. Вероятность развития активной формы ТБ у людей, которые являются ВИЧ-положительными и инфицированы ТБ, в 30 раз выше, чем у людей, которые являются ВИЧ-отрицательными, ТБ ответственен также за смерть каждого из трех людей с ВИЧ/СПИД во всем мире. Все существующие подходы к лечению туберкулеза включают комбинацию множества средств. Например, схема лечения, рекомендованная службой общественного здравоохранения США, представляет собой комбинацию изониазида, рифампицина и пиразинамида в течение двух месяцев, а затем только изониазида и рифампицина еще в течение четырех месяцев. ВИЧ-инфицированным пациентам указанные лекарства продолжают назначать еще в течение семи месяцев. Пациентам, инфицированным штаммами M. tuberculosis, обладающими множественной лекарственной устойчивостью, в комбинационную терапию включают такие средства как этамбутол, стрептомицин, канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Не существует единственного средства,которое было бы эффективно при лечении симптомов туберкулеза, а также не существует комбинации средств, которая позволяет провести лечение за период, меньший шести месяцев. Сохраняется высокая потребность в новых лекарствах, улучшающих существующее лечение за счет применения таких схем принятия лекарств, которые способствовали бы соблюдению режимов как пациентами, так и поставщиками. Лучшим средством достижения этой цели являются более короткие схемы принятия лекарств, а также такие схемы принятия лекарств, которые требуют меньшего наблюдения. Наибольшую пользу приносят первые два месяца лечения в течение интенсивной, или бактерицидной,фазы, когда четыре лекарства назначают одновременно; бактериальная нагрузка значительно снижается,и пациенты перестают быть заразными. Продолжение лечения в течение от 4 до 6 месяцев, или стадия стерилизации, требуется для удаления стойких бацилл и минимизации риска рецидива. Особенно полезным было бы действенное стерилизующее средство, которое сокращает лечение до 2 месяцев или меньше. Нужны также лекарства, которые способствуют соблюдению режимов и схем лечения, поскольку требуют менее интенсивного наблюдения. Очевидно, что наибольшей пользой обладает лекарство, которое снижает как общую продолжительность лечения, так и частоту приема лекарства. Эпидемическую обстановку ТБ осложняет возрастающая частота возникновения обладающих множественной лекарственной устойчивостью штаммов, или MDR-TB. До четырех процентов всех случаев связывают с MDR-TB, которые резистентны к наиболее эффективным лекарствам из указанных выше стандартных четырех средств, изониазиду и рифампину. В отсутствие лечения MDR-TB являются смертельными, и их невозможно адекватно лечить с помощью стандартной терапии, так что лечение требует применения в течение вплоть до двух лет лекарств "второго эшелона". Указанные лекарства часто являются токсичными, дорогими и вызывают минимальный эффект. В отсутствие эффективной терапии пациенты, инфицированные MDR-TB, продолжают распространять болезнь и продуцировать новые инфекции с штаммами MDR-TB. В медицине сохраняется значительная потребность в новом лекарстве, обладающем новым механизмом действия, которое обладало бы активностью против штаммов, устойчивых к действию лекарств, в частности, штаммов MDR. Термин "устойчивый к действию лекарств", который используют ранее и далее в настоящем описании, является термином, хорошо известным специалистам в области микробиологии. Устойчивая к действию лекарств микобактерия представляет собой микобактерию, которая больше не чувствительна к действию, по меньшей мере, одного ранее эффективного лекарства; микобактерию, у которой развилась способность выдерживать антибиотическую атаку, по меньшей мере, одного ранее эффективного лекарства. Штамм, резистентный к действию лекарств, может передавать способность выдерживать действие лекарства своему потомству. Указанная резистентность может быть следствием случайных генетических мутаций в клетке бактерии, которая изменяет ее чувствительность к действию одного лекарства или различных лекарств.MDR tuberculosis является специфической формой резистентного к действию лекарств туберкулеза благодаря бактерии, которая, по крайней мере, резистентна к изониазиду и рифампицину (и обладает или-1 015617 не обладает устойчивостью к действию других лекарств), которые являются в настоящее время двумя наиболее мощными лекарствами против туберкулеза. Таким образом, при использовании ранее и далее в контексте настоящего описания термин "устойчивый к действию лекарств" включает множественную лекарственную устойчивость. Другим фактором борьбы с эпидемией ТБ является проблема латентного ТБ. Несмотря на применение в течение десятилетий программ борьбы с туберкулезом (ТБ), M. tuberculosis инфицировано, хотя и бессистемно, около 2 миллиардов человек. Около 10% этих индивидов в течение всей своей жизни подвержены риску развития активной формы ТБ. Глобальная эпидемия ТБ подпитывается инфекцией ВИЧ-пациентов и ростом обладающих множественной лекарственной устойчивостью штаммов ТБ (MDR-TB). Реактивация латентного ТБ является фактором высокого риска развития болезни и ответственна за 32% смертей у ВИЧ-инфицированных людей. Для борьбы с эпидемией ТБ необходимо разработать новые лекарства, которые способны убивать дремлющие или латентные бактерии. Скрытый ТБ может быть реактивирован и может вызвать заболевание под действием ряда факторов, таких как подавление иммунитета организма-хозяина под действием иммуносупрессивных средств, таких как антитела против фактора некроза опухолейили интерферона. В случае ВИЧ-положительных пациентов единственным доступным профилактическим лечением латентного ТБ является схема принятия рифампицина, пиразинамида в течение двух-трех месяцев. Эффективность указанной схемы лечения до сих пор неясна, более того, длительность лечения является важным ограничением в условиях со стесненными ресурсами. Таким образом, сохраняется насущная потребность в разработке новых лекарств, которые могут служить химиопрофилактическими средствами для индивидов, являющихся носителями латентных бацилл ТБ. Бациллы из туберкулезных бугорков попадают в организм здоровых индивидов путем ингаляции; они уничтожаются за счет фагоцитоза альвеолярными макрофагами в легких. Это приводит к возникновению действенного иммунного ответа и образованию гранулем, которые состоят из макрофагов, инфицированных M. tuberculosis, которые окружены Т-клетками. По прошествии 6-8 недель иммунный ответ организма-хозяина вызывает смерть инфицированных клеток путем некроза и накопления казеозного вещества, содержащего некоторое количество внеклеточных бацилл, окруженных макрофагами, эпителоидными клетками и слоями лимфоидной ткани на периферии. В случае здоровых индивидов большая часть микобактерий уничтожается в указанном окружении, однако небольшая часть бацилл все же выживает и, как полагают, существует в нереплицирующемся, гипометаболическом состоянии и толерантна к уничтожению под действием лекарств против туберкулеза, таких как изониазид. Указанные бациллы могут сохраняться в изменившемся физиологическом окружении даже в течение всей жизни индивида,не проявляя каких-либо клинических симптомов заболевания. Тем не менее, в 10% случаев указанные латентные бациллы могут вновь активироваться и вызывать заболевание. Одной из гипотез развития указанных стойких бактерий является наличие патофизиологического окружения, вызванного патологическим изменением у человека, а именно сниженным кислородным потенциалом, ограничением в поступлении питательных средств и кислым значением pH. Постулируют, что данные факторы делают указанные бактерии фенотипично толерантными к действию большинства антимикобактериальных лекарств. Помимо устранения эпидемии ТБ возникает проблема устойчивости по отношению к антибиотическим средствам первого эшелона. Некоторые важные примеры включают резистентные к пенициллинуStaphylococcus aureus, обладающую множественной лекарственной устойчивостью сальмонеллу. Последствия устойчивости по отношению к антибиотическим средствам весьма серьезны. Инфекции, вызываемые резистентными микробами, не поддаются лечению, что приводит к продолжительной болезни и значительному риску смерти. Неблагоприятные исходы лечения приводят также к значительно более длинным периодам инвазивной способности, что увеличивает количество инфицированных людей,находящихся внутри сообщества и, таким образом, подвергает все население риску заразиться штаммом инфекции, обладающим лекарственной устойчивостью. Стационарные лечебные учреждения во всем мире являются критическим компонентом проблемы антимикробной резистентности. Сочетание легко подверженных воздействию инфекции пациентов, интенсивного и продолжительного применения антимикробных средств и перекрестной инфекции привело к появлению инфекций с высокорезистентными бактериальными патогенами. Самолечение с использованием антимикробных средств является другим важным фактором, который вносит свой вклад в развитие устойчивости. Используемые при самолечении антимикробные средства могут оказаться ненужными, часто их используют с несоответствующей дозировкой, или же они могут не содержать адекватное количество активного лекарства. Соблюдение пациентами рекомендованных режимов и схем лечения является еще одной важной проблемой. Пациенты забывают принять лекарство, прерывают лечение, когда они начинают чувствовать себя лучше, или же не могут позволить себе полный курс лечения и, тем самым, создают идеальные условия не для уничтожения, а для адаптации микробов. Вследствие возникновения устойчивости ко многим антибиотикам врачи сталкиваются с инфек-2 015617 циями, для которых нет эффективного лечения. Распространение заболеваний, смертность и финансовые затраты на борьбу с подобными инфекциями ложатся все большим бременем на системы здравоохранения во всем мире. Таким образом, существует настоятельная потребность в новых соединениях для лечения бактериальных инфекций, в особенности микобактериальных инфекций, включая обладающие множественной лекарственной устойчивостью и латентные микобактериальные инфекции, а также других бактериальных инфекций, в особенности таких, которые вызываются устойчивыми штаммами бактерий. В WO 2004/011436, WO 2005/070924, WO 2005/070430 и WO 2005/075428 раскрываются некоторые замещенные производные хинолина, обладающие активностью против микобактерий, в частности, против Mycobacterium tuberculosis. Конкретное соединение из указанных замещенных производных хинолина описывается в Science (2005), 307, 223-227. Другие замещенные хинолины раскрываются в патенте США 5965572 для лечения инфекций,устойчивых к действию антибиотиков, а в WO 00/34265 - для ингибирования роста бактериальных микроорганизмов. Задача, на решение которой направлено настоящее изобретение, состоит в обеспечении новых соединений, в частности, замещенных производных хинолина, обладающих способностью ингибировать рост бактерий, в частности, микобактерий, а потому пригодных для лечения микобактериальных заболеваний, в частности, заболеваний, которые вызываются патогенными микобактериями, такими как Mycobacterium tuberculosis (включая латентное заболевание и включая устойчивые к действию лекарств штаммы M. tuberculosis), M. bovis, M. avium и M. marinum. Соединения пригодны также при лечении других бактериальных инфекций, как указано ниже. Соединения по настоящему изобретению характеризуются наличием третичного атома азота в альфа-положении в боковой цепи, присоединенной в положении 3 хинолинового ядра и, таким образом, их основная структура отличается от структуры производных хинолина, описанных в вышеуказанной заявкеWO 2004/011436, которые содержат в указанном положении асимметрический атом углерода. Таким образом, соединения по настоящему изобретению обладают тем преимуществом, что они способны образовывать меньшее количество энантиомеров, чем соединения, описанные в WO 2004/011436. Сущность изобретения Настоящее изобретение относится к новым замещенным производным хинолина, а именно, к соединению общей формулы (Ia) или формулы (Ib) его фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, его четвертичному амину, его стереохимически изомерной форме, его таутомерной форме или его N-оксидной форме, гдеR2 обозначает атом водорода, алкилокси, арил, арилокси, гидрокси, меркапто, алкилоксиалкилокси,алкилтио, моно- или ди(алкил)амино, пирролидинил или радикал формулы где Y обозначает CH2, O, S, NH или N-алкил;-3 015617 группы, которая включает пирролидинил, пиперидинил, пиперазинил, морфолинил, 4-тиоморфолинил,2,3-дигидроизоиндол-1-ил, тиазолидин-3-ил, 1,2,3,6-тетрагидропиридил, 1,4-диазациклогептил, 1-аза-4 оксациклогептил, 1,2,3,4-тетрагидроизохинолин-2-ил, 2H-пирролил, пирролинил, пирролил, имидазолидинил, пиразолидинил, 2-имидазолинил, 2-пиразолинил, имидазолил, пиразолил, триазолил, пиридинил,пиридазинил, пиримидинил, пиразинил и триазинил, необязательно замещенный одним или несколькими заместителями, при этом каждый заместитель независимо выбран из алкила, галогеналкила, атома галогена, арилалкила, гидрокси, алкилокси, амино, моно- или диалкиламино, алкилтио, алкилоксиалкила,алкилтиоалкила, арила, пиридила или пиримидинила;R6 обозначает арил или Het;R7 обозначает атом водорода или атом галогена;R8 обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода,R9 обозначает атом водорода или алкил;X обозначает -CH2- или -CO-; алкил обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода; или обозначает циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или обозначает циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, который присоединен к насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 6 атомов углерода; где каждый атом углерода алкильной группы необязательно может быть замещен циано, гидрокси, алкилокси или оксо; арил обозначает гомоцикл, выбранный из фенила, нафтила, аценафтила или тетрагидронафтила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, при этом каждый заместитель независимо выбран из гидрокси, атома галогена, циано, нитро, амино, моно-или диалкиламино, алкила, галогеналкила, алкилокси, карбоксила, алкилоксикарбонила, аминокарбонила, морфолинила или моно- или диалкиламинокарбонила;[1,4]диоксинила или бензо[1,3]диоксолила; при этом каждый моноциклический и бициклический гетероцикл необязательно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из атома галогена, гидрокси, алкила или алкилокси; атом галогена выбран из атома фтора, хлора, брома или иода; и галогеналкил обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал,содержащий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерод, который присоединен к насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 6 атомов углерода; где один или несколько атомов углерода замещены одним или несколькими атомами галогена. Если не указано иное, вышеприведенные соединения формулы (Ia) или формулы (Ib), их фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли, их четвертичные амины, их стереохимически изомерные формы, их таутомерные формы или их N-оксидные формы далее в контексте настоящего описания называют соединениями по настоящему изобретению. Соединения формулы (Ia) или формулы (Ib) связаны между собой тем, что, в частности, соединение формулы (Ib), где R10 обозначает оксо, представляет собой таутомерный эквивалент соединения формулы(Ia), где R2 обозначает гидрокси (кетоенольная таутомерия). Подразумевается, что определение для Het содержит все возможные изомерные формы гетероциклов, например, пирролил включает 1H-пирролил и 2H-пирролил. Арил или Het, перечисленные в определениях заместителей для соединений формулы (Ia) или (Ib)(см., например, R3), которые указаны ранее или далее, могут быть присоединены, если не указано иное, к остатку молекулы формулы (Ia) или (Ib) посредством любого соответствующего кольцевого атома углерода или гетероатома. Так, например, в том случае, когда Het обозначает имидазолил, то он может представлять собой 1-имидазолил, 2-имидазолил, 4-имидазолил и т.п. Линии, идущие от заместителей по направлению к кольцевой системе, указывают, что связь может быть присоединена к любому подходящему атому в кольце. По определению, фармацевтически приемлемые кислотно-аддитивные соли представляют собой терапевтически активные кислотно-аддитивные солевые формы нетоксичных кислот, которые способны образовать соединения формулы (Ia) или формулы (Ib). Указанные кислотно-аддитивные соли могут быть получены обработкой соединений формулы (Ia) или формулы (Ib) в форме оснований подходящими кислотами, например, неорганическими кислотами,-4 015617 такими как галогенводородная кислота, в частности, хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими как,например, уксусная кислота, гидроксиуксусная кислота, пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламовая кислота,салициловая кислота, п-аминосалициловая кислота и памовая кислота. Соединения формулы (Ia) или формулы (Ib), содержащие кислые протоны, могут быть также превращены в их терапевтически активные не токсичные основно-аддитивные солевые формы действием подходящих органических или неорганических оснований. Подходящие соли оснований включают, например, аммониевые соли, соли с щелочными и щелочно-земельными металлами, в частности соли с литием, натрием, калием, магнием и кальцием, соли с органическими основаниями, в частности соли с бензатином, N-метил-D-глюкамином, гибрамином, и соли с аминокислотами, например с аргинином и лизином. В свою очередь, указанные кислотно-аддитивные или основно-аддитивные солевые формы могут быть превращены в свободные формы обработкой соответствующим основанием или соответствующей кислотой. Термин "аддитивная соль", используемый в контексте настоящего описания, включает также сольваты, которые могут образовать соединения формулы (Ia) или формулы (Ib), а также их соли. Подобными сольватами являются, например, гидраты и алкоголяты. Термин "четвертичный амин", использованный ранее, обозначает четвертичные аммониевые соли,которые соединения формулы (Ia) или формулы (Ib) способны образовывать путем реакции между основным атомом азота соединения формулы (Ia) или формулы (Ib) и подходящим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилалкилгалогенид, алкилкарбонилгалогенид, Ar-карбонилгалогенид, Het-алкилгалогенид или Het-карбонилгалогенид, в частности, метилиодид или бензилиодид. Het, преимущественно, представляет собой моноциклический гетероцикл, выбранный из фуранила или тиенила; или бициклический гетероцикл, выбранный из бензофуранила или бензотиенила; каждый моноциклический и бициклический гетероцикл необязательно может быть замещен 1, 2 или 3 заместителями, при этом каждый заместитель независимо выбран из группы, которая включает атом галогена, алкил или Ar. Кватернизирующим агентом, предпочтительно, является алкилгалогенид. Могут также применяться другие реагенты с легко уходящей группой, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают хлор, бром,иод, трифторацетат, ацетат, трифторацетат, сульфат, сульфонат. Предпочтительным противоионом является иод. Выбранный противоион можно ввести с помощью ионообменных смол. Приведенный выше и далее в контексте настоящего описания термин "стереохимически изомерные формы" обозначает все возможные стереоизомерные формы, которые могут иметь соединения формул(Ia) и (Ib), их N-оксиды, аддитивные соли или физиологически функциональные производные. Если иное не упоминается или не указано, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, центры стереоизомерии могут иметь R- или Sконфигурацию; заместители при двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Соединения, включающие двойные связи, могут иметь либоE-(entgegen, против), либо Z- (zusammen, вместе) стереохимическую конфигурацию по отношению к указанной двойной связи. Термины цис, транс, R, S, E и Z хорошо известны специалистам. Очевидно подразумевается, что стереохимические изомерные формы соединений формул (Ia) и (Ib) входят в объем настоящего изобретения. В соответствии с принятыми обозначениями по номенклатуре CAS, в том случае, когда в молекуле имеется два стереохимических центра, идентификатор R или S присваивается (в соответствии с правилом последовательности Кана-Ингольда-Прелога) хиральному центру, имеющему наименьший номер, и он принимается за центр сравнения. Конфигурация второго стереохимического центра обозначается с использованием относительных идентификаторов [R,R] или [R,S], где R всегда специфицируют как центр сравнения, a [R,R] обозначает центры с той же самой хиральностью, и [R,S] обозначает центры с разной хиральностью. Например, если хиральный центр с наименьшим номером в молекуле имеетS-конфигурацию, а второй центр имеет R-конфигурацию, то стереоидентификатор будет выглядеть какS-[R,S]. Если используют обозначения и , то заместитель с наибольшим приоритетом при асимметрическом атоме углерода кольцевой системы, имеющем наименьший номер в кольце, произвольно всегда находится в положении средней плоскости, определяемой кольцевой системой. Положение заместителя с наибольшим приоритетом при другом асимметрическом атоме углерода в кольцевой системе относительно положения заместителя с наибольшим приоритетом при атоме сравнения обозначают как , если заместитель располагается с той же стороны средней плоскости, определяемой-5 015617 кольцевой системой, или , если он находится по другую сторону средней плоскости, определяемой кольцевой системой. В том случае, когда указана конкретная стереоизомерная форма, то это означает, что указанная форма является в значительной степени свободной, т.е. она связана меньше чем с 50%, предпочтительно меньше чем с 20%, более предпочтительно меньше чем с 10%, еще более предпочтительно меньше чем с 5%, еще более предпочтительно меньше чем с 2% и наиболее предпочтительно меньше чем с 1% другого(их) изомера(ов). Так, когда соединение формулы (I), например, обозначено как (R,R), то это означает, что указанное соединение в значительной степени свободно от изомера (R,S). Соединения как формулы (Ia), так и формулы (Ib) могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга с помощью известных из области техники методов расщепления изомеров. Рацемические соединения как формулы (Ia), так и формулы (Ib) могут быть превращены в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяют, например,селективной или фракционной кристаллизацией, а энантиомеры высвобождают из них с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений как формулы (Ia), так и формулы (Ib) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных соединений при условии, что реакция протекает стереоспецифически. Если требуется конкретный стереоизомер, то указанное соединение,предпочтительно, синтезируют с использованием стереоспецифических способов получения. В указанных способах, преимущественно, используют энантиомерно чистые исходные вещества. Подразумевается, что таутомерные формы соединений формулы (Ia) или формулы (Ib) представляют собой такие соединения формулы (Ia) или формулы (Ib), в которых, например, енольная группа превращается в кетонную группу (кето-енольная таутомерия). Подразумевается, что N-оксидные формы соединений по настоящему изобретению представляют собой соединения формулы (Ia) или формулы (Ib), в которых один или несколько третичных атомов азота окислены с образованием так называемых N-оксидов. Соединения формулы (Ia) или формулы (Ib) могут быть превращены в соответствующие Nоксидные формы с помощью хорошо известных из области техники способов превращения трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления в общем случае можно провести путем взаимодействия исходного соединения формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящими неорганическими пероксидами являются, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, в частности, пероксид натрия, пероксид калия; подходящими органическими пероксидами могут быть надкислоты, такие как, например, бензолнадкарбоновая кислота или галогензамещенная бензолнадкарбоновая кислота, в частности, 3 хлорбензолнадкарбоновая кислота, пероксоалкановые кислоты, в частности, надуксусная кислота, алкилгидропероксиды, в частности, гидропероксид трет-бутила. Подходящими растворителями являются, например, вода, низшие спирты, в частности, этанол и т.п., углеводороды, в частности, толуол, кетоны, в частности, 2-бутанон, галогенсодержащие углеводороды, в частности, дихлорметан, и смеси подобных растворителей. Соединения по настоящему изобретению, которые имеют аминогруппу, можно функционализовать с помощью кетона или альдегида, такого как формальдегид, с образованием основания Манниха. Указанное основание гидролизуется в водном растворе по кинетике первого порядка. Алкил, преимущественно, представляет собой насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, выбранный из метила, этила, пропила или бутила; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода,который выбран из циклопропила или циклогексила, необязательно замещенного циано. Или же алкил представляет собой C1-6 алкил. C1-6 алкил представляет собой насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, такой как, например, метил,этил, пропил, 2-метилэтил, пентил, гексил и т.п. Предпочтительную подгруппу C1-6 алкила образует C1-4 алкил, который представляет собой насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил и т.п. Арил, предпочтительно, представляет собой нафтил или фенил, более предпочтительно, фенил, каждый из которых необязательно замещен одним или двумя заместителями, выбранными из атома галогена, например, атома хлора; алкила, например, метила; или алкилокси, например, метилокси.Het, преимущественно, представляет собой фуранил, пиридил, пиридинил, хинолинил или бензофуранил. Атом галогена, преимущественно, представляет собой атом брома, фтора или хлора. Галогеналкил, преимущественно, представляет собой трифторметил. В общем случае предпочтительны соединения формулы (Ia).-6 015617 Настоящее изобретение преимущественно относится к соединениям формулы (Ia) или формулы(Ib), где p равно 0 или 1; R1 обозначает атом галогена или алкил; R2 обозначает алкилокси или арил; R3 обозначает арил, арилалкил или Het-алкил; q равно 1; R4 и R5 каждый независимо обозначает алкил, или же R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал 4-тиоморфолинил,пиперидинил или пиперазинил, замещенный алкилом или арилалкилом; R6 обозначает арил, необязательно замещенный атомом галогена, или же R6 обозначает бензофуранил; R7 обозначает атом водорода; а R8 обозначает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода. Настоящее изобретение преимущественно относится к соединениям формулы (Ia) или формулы(Ib), где p равно 1; Z обозначает радикал формулы (a); R1 обозначает атом брома или метил; R2 обозначает метилокси или фенил; R3 обозначает фенил, необязательно замещенный метилоксигруппой, или бензил; q равно 1; R4 и R5 каждый обозначает метил, этил или изопропил, или же R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал 4-тиоморфолинил, радикал пиперидинил, замещенный метилом в положении 4, или радикал пиперазинил, замещенный бензилом в положении 4; R6 обозначает фенил или бензофуранил; и R7 обозначает атом водорода. Настоящее изобретение преимущественно относится к соединениям формулы (Ia) или формулы(Ib), где p равно 0 или 1; R1 обозначает атом брома или метил; R2 обозначает метилокси или фенил; R3 обозначает фенил, бензил или хинолин-5-илметил; q равно 1; R4 и R5, каждый обозначает метил, или жеR4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал пиперазинил, замещенный метилом в положении 4; R6 обозначает фенил, необязательно замещенный атомом фтора в положении 2; R7 обозначает атом водорода; a R8 обозначает этил. Наиболее предпочтительные соединения выбирают из: 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-N-(4-метилпиперазин-1 ил)ацетамида;N-бензил-N-[(6-бром-2-метоксихинолин-3-ил)-(2-фторфенил)метил]-N',N'-диметилэтан-1,2 диамина; этилового эфира бензил-[(6-бром-2-метоксихинолин-3-ил)фенилметил]аминоуксусной кислоты; и 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-1-пиперидин-1-илэтанона; их фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, их четвертичного амина, их стереохимически изомерной формы, их таутомерной формы или их N-оксидной формы. Наиболее предпочтительные соединения также выбирают из 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-1-(4-бензилпиперазин-1 ил)этанона;N-бензил-N-[(6-бром-2-фенилхинолин-3-ил)фенилметил]-N',N'-диметилэтан-1,2-диамина; 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-1-(4-метилпиперидин-1-ил)этанона; 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-N,N-диэтилацетамида; 2-бензил-[(6-бром-2-фенилхинолин-3-ил)фенилметил]амино-N,N-диметилацетамида; 2-[бензофуран-2-ил-(2-фенилхинолин-3-ил)метил]бензиламино-N-изопропил-N-метилацетамида; 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-1-тиоморфолин-4-илэтанона; и 2-бензил-[(6-метил-2-фенилхинолин-3-ил)фенилметил]амино-N-изопропил-N-метилацетамида; их фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, их четвертичного амина, их стереохимически изомерной формы, их таутомерной формы или их N-оксидной формы. Настоящее изобретение относится к применение соединений формулы (Ia) или формулы (Ib) в качестве лекарственного препарата. Настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения формулы (Ia) или формулы (Ib). Настоящее изобретение относится к применению соединений формулы (Ia) или формулы (Ib) для приготовления лекарственного средства, предназначенного для лечения бактериальной инфекции. Настоящее изобретение относится к способу лечения пациента, страдающего от бактериальной ин-7 015617 фекции, или рискующего подвергнуться заражению бактериальной инфекцией, который включает введение пациенту терапевтически эффективного количества соединения формулы (Ia) или формулы (Ib). Предпочтительно бактериальная инфекция представляет собой инфекцию, вызванную стафилококками, энтерококками или стрептококками. Предпочтительно бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к действию метициллина Staphylococcus aureus (MRSA), устойчивыми к действию метициллина коагулаза-негативными стафилококками (MRCNS), устойчивыми к действию пенициллина Streptococcus pneumoniae или обладающими множественной лекарственной устойчивостью Enterococcus faecium. Предпочтительно бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus (MRSA) или Streptococcus pneumoniae. Предпочтительно бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к действию метициллина Staphylococcus aureus (MRSA). Настоящее изобретение относится к применению соединений формулы (Ia) или формулы (Ib) для приготовления лекарственного средства, предназначенного для лечения бактериальной инфекции, вызванной Mycobacterium tuberculosis. Фармакология Было неожиданно обнаружено, что соединения по настоящему изобретению пригодны для лечения бактериальных заболеваний, в особенности включая микобактериальные заболевания, в частности, заболевания, которые вызываются такими патогенными микобактериями как Mycobacterium tuberculosis(включая его латентную и устойчивые к действию лекарств форму), M. bovis, M. avium и M. marinum. Таким образом, настоящее изобретение относится также к соединениям формулы (Ia) или формулы (Ib),как указано ранее, их фармацевтически приемлемым кислотно-аддитивным и основно-аддитивным солям, их четвертичным аминам, их стереохимически изомерным формам, их таутомерным формам, их Nоксидным формам или их пролекарствам для использования в качестве лекарственного средства. Кроме того, настоящее изобретение относится также к применению соединений формулы (Ia) или формулы (Ib), их фармацевтически приемлемых кислотно-аддитивных и основно-аддитивных солей, их четвертичных аминов, их стереохимически изомерных форм, их таутомерных форм, их N-оксидных форм или их пролекарств, а также любых их фармацевтических композиций, как указано ниже, для приготовления лекарственного средства, предназначенного для лечения бактериального заболевания, включая микобактериальное заболевание. Таким образом, в соответствии с другим аспектом, в настоящем изобретении предлагается способ лечения пациента, страдающего от бактериального заболевания, или пациента, рискующего им заболеть,включая микобактериальное заболевание, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции по настоящему изобретению. Помимо их активности по отношению к микобактериям, соединения по настоящему изобретению активны также против других бактерий. В общем случае бактериальные патогены могут быть классифицированы как грамположительные или грамотрицательные патогены. Соединения-антибиотики, активные как против грамположительных, так и грамотрицательных патогенов, в общем случае рассматривают как соединения, обладающие широким спектром действия. Соединения по настоящему изобретению рассматривают как активные против грамположительных и/или грамотрицательных бактериальных патогенов. В частности, соединения по настоящему изобретению активны против, по меньшей мере, одной грам-положительной бактерии, предпочтительно, активны против нескольких грамположительных бактерий, более предпочтительно, активны против одной или нескольких грамположительных и/или одной или нескольких грамотрицательных бактерий. Соединения по настоящему изобретению обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и/или грамотрицательных аэробных и анаэробных бактерий включают стафилококки, например, S. aureus; энтерококки, например, E. faecalis; стрептококки, например, S.pneumoniae, S.mutans, S. pyogens; бациллы, например, Bacillus subtilis; листерии, например, Listeria monocytogenes; возбудителей гемофильной инфекции, например, H. influenza; возбудителей инфекции Moraxella, например, M. catarrhalis; возбудителей псевдомоноза, например, Pseudomonas aeruginosa; и возбудителей Escherichia, например, E. coli. Особенно важны грамположительные патогены, например, стафилококки, энтерококки и стрептококки, вследствие развития устойчивых штаммов, которые одинаково трудно лечить и уничтожать, например, в условиях больницы после заражения ими. Примерами подобных штаммов являются устойчивые к действию метициллина Staphylococcus aureus (MRSA), устойчивые к действию метициллина коагулаза-негативные стафилококки (MRCNS), устойчивые к действию пенициллина Streptococcus pneumoniae и обладающие множественной лекарственной устойчивостью Enterococcus faecium. Соединения по настоящему изобретению проявляют также активность против устойчивых бактериальных штаммов. Соединения по настоящему изобретению наиболее активны против Staphylococcus aureus, в том числе устойчивых Staphylococcus aureus, таких как, например, устойчивые к действию метициллинаStaphylococcus aureus (MRSA), и Streptococcus pneumoniae. Соединения по настоящему изобретению, в частности, активны против бактерий, выживаемость которых зависит от правильной функции F1F0 АТФ-синтазы. Не связывая себя какой-либо теорией, авторы настоящего изобретения полагают, что активность соединений по настоящему изобретению заключается в ингибировании F1F0 АТФ-синтазы, в частности, в ингибировании F0 комплекса F1F0 АТФ-синтазы, в частности, ингибировании подгруппы F0 комплекса F1F0 АТФ-синтазы, которое приводит к уничтожению бактерий за счет обеднения уровней АТФ в бактерии. Бактериальные инфекции, которые можно лечить с помощью соединений по настоящему изобретению, включают, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый отит, инфекции внутричерепных полостей, глазные инфекции, инфекции ротовой полости, такие как инфекции зубов, десен и слизистых оболочек, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, мочеполовые инфекции, желудочно-кишечные инфекции, гинекологические инфекции, сепсис, инфекции костей и сустав, кожные инфекции и инфекции структуры кожи, бактериальный эндокардит, ожоги, антибактериальную профилактику в хирургии и антибактериальную профилактику иммуносупрессированных пациентов, таких как пациенты, которые получают противораковую химиотерапию, или пациенты с пересаженными органами. Вне зависимости от того, упоминалось ли это ранее или будет упоминаться далее в тексте настоящего описания, под способностью указанных соединений лечить бактериальную инфекцию понимают,что указанные соединения могут лечить инфекции, вызываемые одним или несколькими бактериальными штаммами. Вне зависимости от того, упоминалось ли это ранее или будет упоминаться далее в тексте настоящего описания, под бактериальной инфекцией, отличной от микобактериальной инфекции, понимают,что бактериальная инфекция отличается от инфекции, вызываемой одной или несколькими микобактериями. Настоящее изобретение касается также композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по настоящему изобретению. Из соединений по настоящему изобретению могут быть составлены различные фармацевтические формы для введения. В качестве подходящих композиций могут быть приведены все композиции, которые обычно применяют для системного введения лекарств. Для приготовления фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения необязательно в форме аддитивной соли, которое используют в качестве активного ингредиента, объединяют в виде однородной смеси с фармацевтически приемлемым носителем, при этом носитель может принимать весьма разнообразные формы в зависимости от формы предназначенного для введения препарата. Желательно, чтобы указанные фармацевтические композиции были приготовлены в виде стандартной дозированной формы, в частности, для введения перорально или в виде парентеральной инъекции. Например, при приготовлении композиции в виде пероральной дозированной формы могут применяться любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии или растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие средства, связующие, разрыхлители и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы являются наиболее удобными пероральными дозированными формами, и в этом случае, очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно представляет собой, по крайней мере, в значительной части, стерильную воду, хотя могут добавляться и другие ингредиенты, например, вещества, способствующие повышению растворимости. Могут быть приготовлены, например, растворы для инъекций, в которых носителем является физиологический солевой раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также приготовлены суспензии для инъекций, и в этом случае можно использовать подходящие жидкие носители, суспендирующие агенты и т.п. Включены также препараты в виде твердых форм, которые предназначены для превращения в препараты в виде жидких форм непосредственно перед применением. В зависимости от способа введения фармацевтические композиции, предпочтительно, содержат в диапазоне от 0,05 до 99 мас.%, более предпочтительно, в диапазоне от 0,1 до 70 мас.%, активного ингредиента и в диапазоне от 1 до 99,95 мас.%, более предпочтительно, в диапазоне от 30 до 99,9 мас.%, фармацевтически приемлемого носителя, при этом все проценты даны по отношению к общей массе композиции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные из области техники, например, смазывающее средство, стабилизатор, буферную добавку,эмульгатор, регулятор вязкости, поверхностно-активное вещество, консервант, отдушку или краситель. Наиболее удобно составлять вышеуказанные фармацевтические композиции в виде стандартной дозированной формы с целью облегчения введения и обеспечения однородности дозировки. Стандартная дозированная форма в контексте настоящего описания означает физически дискретные единицы, пригодные для однократного дозирования, при этом каждая единица содержит определенное количество-9 015617 активного ингредиента, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами подобных стандартных дозированных форм являются таблетки (в том числе таблетки с насечками или таблетки с нанесенным покрытием), капсулы,пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п. и их разделенные части. Дневная доза соединения по настоящему изобретению, конечно, варьирует в зависимости от применяемого соединения, способа введения, требуемого лечения и установленной микобактериальной инфекции. Однако в общем случае удовлетворительные результаты будут получены тогда, когда соединение по настоящему изобретению вводят с дневной дозой, не превышающей 1 г, в частности, в диапазоне от 10 до 50 мг/кг массы тела. Поскольку установлено, что соединения формулы (Ia) или формулы (Ib) активны против бактериальной инфекции, то соединения по настоящему изобретению могут быть объединены с другими антибактериальными средствами с целью эффективной борьбы с бактериальными инфекциями. Таким образом, настоящее изобретение касается также комбинации (a) соединения по настоящему изобретению и (b) одного или нескольких других антибактериальных средств. Настоящее изобретение касается также комбинации (a) соединения по настоящему изобретению и(b) одного или нескольких других антибактериальных средств для использования в качестве лекарственного препарата. Настоящее изобретение касается также применения комбинации или фармацевтической композиции, как указано выше, для лечения бактериальной инфекции. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество (a) соединения по настоящему изобретению и (b) одного или нескольких других антибактериальных средств, также включена в настоящее изобретение. Массовое отношение (a) соединения по настоящему изобретению и (b) другого(их) антибактериального(ых) средств(а), когда их дают в виде комбинации, может быть установлено специалистом. Указанное отношение и точная доза и частота введения зависят от используемого конкретного соединения по настоящему изобретению и другого(их) антибактериального(ых) средств(а), конкретного вылечиваемого состояния, тяжести вылечиваемого состояния, возраста, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также другого лекарственного средства, которое индивид может принимать, что хорошо известно специалистам в данной области. Кроме того, должно быть очевидным, что эффективное суточное количество может быть снижено или увеличено в зависимости от ответной реакции пациента, лечение которого проводят, и/или в зависимости от оценки врача, который назначает соединения по настоящему изобретению. Соединения по настоящему изобретению и одно или несколько других антибактериальных средств могут быть объединены в одном препарате, или же они могут быть приготовлены в виде отдельных препаратов, так что их можно вводить одновременно, раздельно или последовательно. Таким образом, настоящее изобретение касается также продукта, содержащего (a) соединение по настоящему изобретению и (b) одно или несколько других антибактериальных средств, как объединенного препарата для одновременного, раздельного или последовательного применения при лечении бактериальной инфекции. Другими антибактериальными средствами, которые могут быть объединены с соединениями формулы (Ia) или формулы (Ib), являются известные из области техники антибактериальные средства. Другими антибактериальными средствами являются антибиотики -лактамовой группы, такие как натуральные пенициллины, полусинтетические пенициллины, натуральные цефалоспорины, полусинтетические цефалоспорины, цефамицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды,такие как N-нуклеозиды, С-нуклеозиды, карбоциклические нуклеозиды, бластицидин S; макролиды, такие как 12-членные кольцевые макролиды, 14-членные кольцевые макролиды, 16-членные кольцевые макролиды; анзамицины; пептиды, такие как блеомицины, грамицидины, полимиксины, бацитрацины,пептидные антибиотики с большими циклами, содержащие лактоновые связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацидины, микамицин, неокарциностатин, стендомицин, биомицин,виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин A; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; монензины; пирролнитрин; фосфомицин; фузидиевая кислота; D-(p-гидроксифенил)глицин; D-фенилглицин; энедиины. Конкретными антибиотиками, которые могут быть объединены с соединениями формулы (Ia) или формулы (Ib) по настоящему изобретению, например, являются бензилпенициллин (калий, прокаин, бензатин), феноксиметилпенициллин (калий) фенетициллин калий, пропициллин, карбенициллин (динатрий,фенил натрий, инданил натрий), сульбенициллин, тикарциллин динатрий, метициллин натрий, оксациллин натрий, клоксациллин натрий, диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрий, амоксициллин, циклациллин, гектациллин, сулбактамнатрий, талампициллин гидрохлорид, бакампициллин гидрохлорид, пивмециллинам, цефалексин, цефаклор, цефалоглицин, цефадроксил, цефрадин, цефроксадин, цефапирин натрий, цефалотин натрий, цефацетрил натрий, цефсулодин натрий, цефалоридин, цефатризин, цефоперазон натрий, цефамандол, вефотиам гидрохлорид, цефазолинD, неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, салиномицин, амфотерицин B, нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицин пальмитат гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникол пальмитат, митомицин C, пирролнитрин, фосфомицин, фузидиевая кислота, бикозамицин, тиамулин,сикканин. Другими микобактериальными средствами, которые могут быть объединены с соединениями формулы (Ia) или формулы (Ib), являются, например, рифампицин (= рифампин); изониазид; пиразинамид; амикацин; этионамид; моксифлоксацин; этамбутол; стрептомицин; пара-аминосалициловая кислота; циклосерин; капреомицин; канамицин; тиоацетазон; PA-824; хинолоны/фторхинолоны, такие как, например, офлоксацин, ципрофлоксацин, спарфлоксацин; макролиды, такие как, например, кларитромицин, клофазимин, амоксициллин с клавулановой кислотой; рифамицины; рифабутин; рифапентин. Общие методы получения Соединения по настоящему изобретению могут быть в общем случае получены путем проведения последовательности стадий, каждая из которых известна специалистам. Соединения формулы (Ia), где Z обозначает радикал формулы (a), в котором X означает -CH2-,представленные ниже формулой (Ia1), могут быть получены взаимодействием соединения формулы (II) с соединением формулы (III) в соответствии со схемой реакций 1, приведенной ниже. Схема 1(где Y обозначает уходящую группу, такую как атом брома, атом хлора, гидроксил, птолуолсульфонилокси или метансульфонилокси). Если Y обозначает атом брома, то реакцию в общем случае проводят в присутствии основания, такого как карбонат калия, карбонат натрия, Et3N, в подходящем растворителе, таком как ацетонитрил, диметилформамид, N-метилпирролидон или диглим. Если Y обозначает гидрокси, то реакцию в общем случае проводят в присутствии P(Ph)3 и диизопропилазодикарбоксилата (DIAD) или диэтилазодикарбоксилата (DEAD) в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (Ia), где Z обозначает радикал формулы (b), представленные ниже формулой(Ia2), могут быть получены взаимодействием соединения формулы (II) с соединением формулы (IV) в соответствии со схемой реакций 2, приведенной ниже. Схема 2 Реакцию можно провести в условиях, которые аналогичны приведенным выше на схеме 1. Соединения формулы (Ia2) можно превратить в промежуточные соединения формулы (V), которые затем могут вступать во взаимодействие с соединением формулы (VI) с образованием соединений формулы (Ia), где Z обозначает радикал формулы (a), в котором X означает -CO-, представленных ниже формулой (Ia3), как показано далее на схеме реакций 3. На стадии (a) соединения формулы (Ia2) можно гидролизовать, например, обработкой водным раствором гидроксида лития в органическом растворителе, таком как тетрагидрофуран. На стадии (b) промежуточное соединение формулы (V) взаимодействует с аминовым соединением формулы (VI), например, в присутствии N-этил-N'-(3-диметиламино-пропил)карбодиимида (EDCI) и 1-гидроксибензотриазола (HOBT) в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан и/или тетрагидрофуран. Промежуточное соединение формулы (II), где R6 обозначает арил, а Y обозначает атом брома, представленное ниже формулой (IIa1), может быть получено бромированием соединения формулы (VII) в соответствии с приведенной ниже схемой реакций 4a. Схема 4a Бромирование соединения формулы (VII) можно осуществить, например, действием N-бромсукцинимида (NBS) и дибензоилпероксида в подходящем растворителе, таком как тетрахлорид углерода. Соответствующее соединение формулы (II), где Y обозначает атом хлора, может быть получено аналогичным образом. Промежуточное соединение формулы (II), где R6 обозначает арил, а Y обозначает гидрокси, представленное ниже формулой (IIa2), может быть получено реакцией соединения формулы (VIIa) с соединением формулы (VIIb) в соответствии с приведенной ниже схемой реакций 4b. Схема 4b Промежуточное соединение формулы (II), где R6 обозначает Het, а Y обозначает гидрокси или атом брома, представленное ниже формулами (IIb1) и (IIb2), может быть получено в соответствии с приведенной ниже схемой реакций 5a. Схема 5a На стадии (a) соединение формулы (VIII) взаимодействует с соединением HetH, например, при использовании н-бутиллития, в подходящем растворителе, таком как тетрагидрофуран или Et2O, в результате чего вводится радикал Het. На стадии (b) превращение гидроксильного радикала в радикал брома можно осуществить, например, воздействием на соединение формулы (IIb1) бромирующего агента, такого как трибромид фосфора или водный раствор бромистоводородной кислоты, в подходящем раствори- 12015617 теле, таком как дихлорметан. Соответствующее соединение формулы (II), где Y обозначает атом хлора,может быть получено аналогичным образом. Промежуточное соединение формулы (II), где R6 представляет Het, а Y представляет толуолсульфонилокси или метансульфонилокси, обозначенные ниже как RSO2O, при этом промежуточное соединение представлено ниже формулой (IIb3), может быть получено в соответствии с приведенной ниже схемой реакций 5b. Схема 5b Превращение гидроксильного радикала в радикал эфира мезилата или тозилата можно осуществить,например, обработкой соединения (IIb1) метансульфонилхлоридом или п-толуолсульфонилхлоридом,соответственно, в присутствии основания, такого как триэтиламин, и в подходящем растворителе, таком как дихлорметан. Промежуточное соединение формулы (IV), где R3 обозначает арилметил или Het-метил, представленное ниже формулой (IVa), где R3a обозначает арил или Het, может быть получено взаимодействием соединения формулы (X) с соединением формулы (XI) в соответствии с приведенной ниже схемой реакций 6. Схема 6 Реакцию соединения формулы (X) с соединением формулы (XI) обычно проводят с использованием цианоборгидрида натрия в присутствии кислоты, такой как уксусная кислота, и в подходящем растворителе, таком как метанол. В качестве альтернативы, промежуточное соединение формулы (IV) может быть получено реакцией соединения формулы (XII) с соединением формулы (XIII) в соответствии с приведенной ниже схемой реакций 7. Схема 7 В соединении формулы (XII) на приведенной выше схеме L обозначает подходящую уходящую группу, такую как атом хлора, а реакцию в общем случае проводят в присутствии основания, такого как карбонат калия или карбонат натрия, и в присутствии подходящего растворителя, такого как ацетонитрил, диметилформамид, N-метилпирролидон или диглим. Соединение формулы (Ia), где R2 обозначает пирролидино, представленное ниже формулой (Ia4),можно получить взаимодействием соединения формулы (XIV), где R2a обозначает атом галогена, например, хлора, с пирролидином в соответствии с приведенной ниже схемой реакций 8. Схема 8 Исходное соединение формулы (XIV) можно получить аналогично тому, как описано для получения соединений формулы (I) и показано на схеме 1. Соединения формулы (I), где R1 обозначает атом галогена, например, брома, могут быть превращены в соответствующие соединения формулы (I), где R1 обозначает алкил, например, метил, действием подходящего алкилирующего агента, такого как CH3B(OH)2 или (CH3)4Sn, в присутствии Pd(PPh3)4 в подходящем растворителе, таком как толуол или 1,2-диметоксиэтан (DME). Аналогичные соединения формулы (I), где R1 обозначает атом галогена, например, брома, могут быть превращены в соответствующие соединения формулы (I), где R1 обозначает пиридил, воздействием 3-(1,3,2-диоксаборинан-2- 13015617 ил)пиридин в присутствии Pd(PPh3)4 и основания, такого как карбонат натрия, в подходящем растворителе, таком как DME. Соединения формулы (Ib) могут быть получены аналогично тому, как описано выше для соответствующих соединений формулы (Ia). Соединения формулы (Ia) или формулы (Ib) могут быть превращены в соответствующие N-оксиды обычным образом, например, воздействием 3-хлорнадбензойной кислоты в подходящем растворителе,таком как дихлорметан. Очевидно, что в приведенных выше и в приведенных далее реакциях продукты реакции могут быть выделены из реакционной среды и, если необходимо, могут быть дополнительно очищены в соответствии с методами, которые в общем случае известны из области техники, такими как экстракция, кристаллизация и хроматография. Очевидно также, что продукты реакции, которые существуют в более чем одной энантиомерной форме, могут быть выделены из их смеси известными способами, например, препаративной хроматографией, такой как ВЭЖХ. Как правило, соединения формулы (Ia) или формулы (Ib) могут быть разделены на их изомерные формы. Следующие примеры поясняют настоящее изобретение, однако они не ограничивают настоящее изобретение. Экспериментальная часть Далее в контексте настоящего описания "DME" означает 1,2-диметоксиэтан, "NBS" означает Nбромсукцинимид, ДМФА означает N,N-диметилформамид, ТГФ означает тетрагидрофуран, "DIPE" означает диизопропиловый эфир, "BTEAC" означает хлорид бензилтриэтиламмония, "EDCI" означает 1-(3 диметиламинопропил)-3-этилкарбодиимид.HCl, "HOBT" означает 1-гидроксибензотриазол, "DIAD" означает диизопропилазодикарбоксилат, а "polymerlab NCO" означает метилизоцианат полистирола.A. Получение промежуточных соединений. Пример A1. a) Получение промежуточного соединения 1. Смесь 5-бром-1H-индол-2,3-диона (0,066 моль) в 3N растворе NaOH (150 мл) перемешивают при 80C в течение 30 мин, а затем охлаждают до комнатной температуры. Добавляют 1,3-дифенил-1 пропанон (0,066 моль) и смесь нагревают в течение ночи до температуры 80C, затем охлаждают и подкисляют до значения pH 5 уксусной кислотой. Осадок отфильтровывают, промывают водой и диизопропиловым эфиром и сушат. Выход: 15 г промежуточного соединения 1 (55%).b) Получение промежуточного соединения 2. Смесь промежуточного соединения 1 (15 г) в дифениловом эфире (150 мл) перемешивают в течение ночи при температуре 300C. Полученную смесь очищают колоночной хроматографией на силикагеле(элюент: циклогексан: 100). Чистые фракции собирают и растворитель упаривают. Выход: 3,0 г промежуточного соединения 2 (22%).c) Получение промежуточного соединения 3 Смесь промежуточного соединения 2 (0,0027 моль), 1-бром-2,5-пирролидиндиона (0,0027 мол) и дибензоилпероксида (0,00005 моль) в CCl4 (10 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч, а затем выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (надa) Получение промежуточного соединения 4 Бензолпропаноилхлорид (0,488 моль) добавляют по каплям при комнатной температуре к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) и смесь перемешивают в течение ночи- 14015617 при комнатной температуре. Смесь выливают в воду и концентрированный раствор NH4OH и экстрагируют CH2Cl2. Органический слой сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток кристаллизуют из диэтилового эфира. Остаток (119,67 г) растворяют в CH2Cl2 и промывают 1N раствором HCl. Органический слой сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 107,67 г промежуточного соединения 4 (87%).b) Получение промежуточного соединения 5. Реакцию проводят дважды. POCl3 (1,225 моль) добавляют по каплям при температуре 10C в ДМФА (0,525 моль). Затем при комнатной температуре добавляют промежуточное соединение 4 (0,175 моль). Смесь перемешивают в течение ночи при температуре 80C, выливают на лед и экстрагируютCH2Cl2. Органический слой сушат (над MgSO4), отфильтровывают и растворитель упаривают. Продукт используют без дальнейшей очистки. Выход: 77,62 г промежуточного соединения 5 (67%).c) Получение промежуточного соединения 6. Смесь промежуточного соединения 5 (0,233 моль) в 30%-ном растворе CH3ONa в CH3OH (222,32 мл) и CH3OH (776 мл) перемешивают при кипячении с обратным холодильником в течение ночи, выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/циклогексан 20/80, а затем 100/0; 20-45 мкм). Чистые фракции объединяют и растворитель упаривают. Выход: 25 г промежуточного соединения 6 (33%).d) Получение промежуточного соединения 7. Смесь промежуточного соединения 6 (0,03 моль), 1-бром-2,5-пирролидиндиона (0,03 моль) и дибензоилпероксида (0,1 г) в CCl4 (100 мл) перемешивают при кипячении с обратным холодильником в течение 1 ч. Добавляют 10%-ный K2CO3 и смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 12,2 г промежуточного соединения 7 (98%). Пример A3. Получение промежуточного соединения 8. Смесь промежуточного соединения 6-бром-3-(бромфенилметил)-2-хлорхинолина(получают аналогично A2.d) (0,0036 моль), N,N-диметил-N'-(фенилметил)-1,2-этандиамина (0,0036 моль) и K2CO3 (0,0036 моль) в CH3CN (20 мл) перемешивают при температуре 80C в течение 12 ч. Растворитель упаривают. Смесь экстрагируют CH2Cl2/H2O. Органический слой отделяют, сушат (над MgSO4),отфильтровывают и растворитель упаривают. Остаток (2,3 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 98/2; 70-200 мкм). Собирают требуемые фракции и растворитель упаривают. Выход: 0,4 г промежуточного соединения 8. Пример A4. a) Получение промежуточного соединения 9.(140 мл) перемешивают при кипячении с обратным холодильником в течение ночи, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (12,6 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/циклогексан 40/60; 15-35 мкм). Собирают требуемые фракции и растворитель упаривают. Выход: 7,5 г промежуточного соединения 9.b) Получение промежуточного соединения 34. 1,6 М раствор nBuLi (0,03 моль) в токе азота добавляют по каплям при температуре в интервале от-20C до -10C к раствору 2,2, 6,6-тетраметилпиперидина (0,03 моль) в ТГФ (90 мл). Смесь перемешивают при -20C в течение 20 мин, затем охлаждают до -70C. По каплям добавляют раствор промежуточного соединения 9 (0,025 моль) в ТГФ (39,6 мл). Смесь перемешивают при -70C в течение 1 ч. По каплям добавляют раствор 2-фторбензальдегида (0,03 моль) в ТГФ (11,1 мл). Смесь перемешивают при -70C в течение 3 ч и 30 мин, а затем дают нагреться до комнатной температуры, перемешивают в течение ночи при комнатной температуре, выливают в H2O и экстрагируют EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 9,96 г. Эту фракцию очищают колоночной хроматографией на силикагеле (элюирование в градиенте концентрации: циклогексан/CH2Cl2 от 50/50 до 100/0; 15-4 0 мкм). Собирают две фракции и растворитель упаривают. Выход: 2,52 г фракции A и 0,75 г фракции 2. Третью фракцию получают, промывая колонкуCH3OH. Растворитель упаривают. Выход: 4,10 г промежуточного соединения 34 (45%). Пример A5. a) Получение промежуточного соединения 10. При температуре 5C медленно добавляют POCl3 (327 мл) к ДМФА (120 мл). По окончании добавляют N-(4-метилфенил)бензолпропанамид (0,501 моль). Смесь перемешивают при температуре 80C в течение ночи, затем охлаждают до комнатной температуры и выливают на лед. Добавляют EtOAc. Смесь перемешивают в течение 1 ч, добавляя лед, а затем экстрагируют EtOAc. Органический слой отделяют,промывают водой, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 182,2 г промежуточного соединения 10.b) Получение промежуточного соединения 11. Смесь промежуточного соединения 10 (0,0112 моль), фенилбороновой кислоты (0,034 моль),Pd(PPh3)4 (0,0011 моль) и 2 М раствора Na2CO3 (0,056 моль) в DME (50 мл) перемешивают при температуре 90C, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4),отфильтровывают и растворитель упаривают. Остаток (5 г) кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 1 г (29%). Эту фракцию очищают колоночной хроматографией на силикагеле(элюент: циклогексан/EtOAc 90/10, 15-0 мкм). Собирают чистые фракции и упаривают. Выход: 2 г промежуточного соединения 11 (58%).c) Получение промежуточного соединения 12. Смесь промежуточного соединения 11 (0,0088 моль) и NBS (0,0098 моль) в 1,2-дихлорэтане (50 мл) перемешивают при кипячении с обратным холодильником в течение 3 ч, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 3,6 г промежуточного соединения 12. Пример A6. a) Получение промежуточного соединения 13.LiOH, H2O (0,0035 моль) добавляют к смеси конечного соединения 146 (получают в соответствии сB1.a) (0,0018 моль) в ТГФ (10 мл) и H2O (10 мл). Смесь перемешивают в течение ночи при температуре 60C. ТГФ упаривают. Добавляют 3N раствор HCl. Осадок отфильтровывают и сушат. Выход: 1 г промежуточного соединения 13 (100%).b) Получение промежуточного соединения 14. Промежуточное соединение 14 получают аналогично способу получения промежуточного соединения 13, однако в качестве исходного соединения используют конечное соединение 131 (получают в соответствии с B2.a). Выход: промежуточное соединение 14 (86%).c) Получение промежуточного соединения 15. Смесь конечного соединения 145 (получают в соответствии с B2.c) (0,0008 моль) и LiOH, H2O(0,0026 моль) в ТГФ (8 мл) и H2O (2 мл) перемешивают при комнатной температуре в течение 12 ч, а затем перемешивают при температуре 60C в течение 12 ч и выливают в воду. Добавляют 5N раствор HCl до тех пор, пока pH не достигнет значения 5. Смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 0,45 г промежуточного соединения 15 (97%).d) Получение промежуточного соединения 16. Смесь конечного соединения 137 (получают в соответствии с B2.b) (0,0069 моль) и LiOH, H2O(0,0143 моль) в ТГФ (20 мл) и H2O (20 мл) перемешивают при комнатной температуре в течение 12 ч, а затем перемешивают при температуре 60C в течение 24 ч и выливают в воду. ТГФ упаривают. Остаток растворяют в смеси H2O /3N HCl. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (надe) Получение промежуточного соединения 17. Смесь конечного соединения 150 (получают в соответствии с B1.b) (0,0007 моль) и LiOH, H2O(0,0023 моль) в ТГФ (10 мл) и H2O (10 мл) перемешивают при комнатной температуре в течение 12 ч и выливают в H2O. Добавляют 3N раствор HCl. Смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 0,3 г промежуточного соединения 17.f) Получение промежуточного соединения 18. Смесь конечного соединения 151 (получают в соответствии с B2.d) (0,0038 моль) и LiOH, H2O(0,0077 моль) в H2O (20 мл) и ТГФ (20 мл) перемешивают при комнатной температуре в течение 4 дней. Добавляют H2O и EtOAc. Добавляют 3N раствор NaOH. Органический слой промывают насыщенным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 1,6 г проме- 17015617 жуточного соединения 18 (90%).g) Получение промежуточного соединения 37. Смесь конечного соединения 130 (получают в соответствии с B2.h) (0,0015 моль) и LiOH, H2O(0,0045 моль) в ТГФ (8 мл) и H2O (8 мл) перемешивают при температуре 65C в течение 24 ч, а затем охлаждают до комнатной температуры. Добавляют 3N раствор HCl. Смесь упаривают досуха. Выход: 0,85 г промежуточного соединения 37 (100%). Пример A7. a) Получение промежуточного соединения 19. Смесь промежуточного соединения 6 (получают в соответствии с A2.c) (0,0076 моль) и CuCN (0,028 моль) в ДМФА (25 мл) перемешивают при кипячении с обратным холодильником в течение 16 ч, затем охлаждают до комнатной температуры и выливают в воду со льдом. Осадок отфильтровывают, растворяют в смеси H2O/этилендиамин и экстрагируют CH2Cl2. Органический слой промывают насыщенным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Смесь фильтруют через силикагель (элюент: CH2Cl2). Фильтрат упаривают досуха. Выход: 1,1 г промежуточного соединения 19 (53%).b) Получение промежуточного соединения 20. Смесь промежуточного соединения 19 (0,0066 моль), NBS (0,0066 моль) и дибензоилпероксида(0,0003 моль) в 1,2-дихлорметане (30 мл) перемешивают при температуре 80C в течение 3 ч, а затем охлаждают до комнатной температуры. Добавляют H2O и CH2Cl2. Органический слой промывают H2O, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (3,5 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 92/8; 15-40 мкм). Собирают чистые фракции и растворитель упаривают. Выход: 1,9 г промежуточного соединения 20 (81%). Пример A8. a) Получение промежуточного соединения 21. Смесь 2-хинолинкарбоксальдегида (0,0019 моль), гидрохлорида этилового эфира глицина (0,002 моль) и NaBH3CN (0,0028 моль) в CH3OH (1 мл) и CH3COOH (20 мл) перемешивают при комнатной температуре в течение 3 ч, выливают в H2O и 10%-ный K2CO3 и экстрагируют смесью CH2Cl2/CH3OH. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 15-40 мкм). Собирают две фракции и растворитель упаривают. Выход: 1,7 г промежуточного соединения 21b) Получение промежуточного соединения 27.(0,0223 моль), гидрохлорида этилового эфира глицина (0,0245 моль) в уксусной кислоте (0,5 мл) и метаноле (80 мл) при 0C. Смесь перемешивают при комнатной температуре в течение 4 ч, а затем выливают в 10%-ный раствор K2CO3 и экстрагируют CH2Cl2. Органический слой сушат над сульфатом магния, отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикаге- 18015617 ле (элюент: CH2Cl2/MeOH/NH4OH 97,5/2,5/0,1). Собирают чистые фракции и растворитель упаривают. Выход: 2,3 г промежуточного соединения 27 (43%). Пример A9. a) Получение промежуточного соединения 22. 1,6 М раствор nBuLi в гексане (0,0103 моль) в токе азота добавляют при температуре -70C к раствору 3-бромпиридина (0,0103 моль) в диэтиловом эфире (20 мл). Смеси дают нагреться до -45C, а затем вновь охлаждают до -70C. Добавляют раствор 2-фенил-3-хинолинкарбоксальдегида (0,0008 моль) в ТГФ(20 мл). Смесь при перемешивании в течение 2 ч нагревают от -70C до комнатной температуры. Добавляют H2O. Смесь экстрагируют EtOAc. Органический слой промывают насыщенным раствором NaCl,сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток растворяют в диэтиловом эфире. Смесь отфильтровывают, промывают диэтиловым эфиром и сушат при 50C в вакууме. Выход: 2,1 г промежуточного соединения 22 (79%).b) Получение промежуточного соединения 23. Смесь промежуточного соединения 22 (0,0046 моль) в PBr3 (3 мл) и толуоле (45 мл) перемешивают при кипячении с обратным холодильником в течение 1 ч и 30 мин, а затем охлаждают до комнатной температуры. Осадок отфильтровывают, промывают диэтиловым эфиром и сушат при 60C в вакууме. Выход: 2,4 г промежуточного соединения 23 (100%) (температура плавления: 161C). Пример A10. a) Получение промежуточного соединения 24. Смесь промежуточного соединения 5 (получают в соответствии с A2.b) (0,009 моль) в HCl (6N) (50 мл) перемешивают при кипячении в течение ночи. Осадок отфильтровывают, промывают H2O, затемb) Получение промежуточного соединения 25. Смесь промежуточного соединения 24 (0,0089 мл) ICH3 (0,026 моль) и BTEAC (0,0044 моль) вNaOH (40 мл) и ТГФ (30 мл) перемешивают в течение ночи при комнатной температуре. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 1,5 г промежуточного соединения 25 (79%).c) Получение промежуточного соединения 26. Смесь промежуточного соединения 25 (0,0043 моль) и NBS (0,0048 моль) в 1,2-дихлорэтане (25 мл) перемешивают при кипячении с обратным холодильником в течение 3 ч и выливают в H2O. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 2 г промежуточного соединения 26. Пример A11. a) Получение промежуточного соединения 28. Фенол (0,066 моль) добавляют порциями к смеси 60%-ного NaH (0,069 моль) в 1,4-диоксане (200 мл) и ДМФА (80 мл), а затем добавляют промежуточное соединение 5 (получают в соответствии с A2.b)(0,033 моль), и суспензию нагревают при кипячении с обратным холодильником в течение 20 ч. Смесь охлаждают, выливают в 10%-ный раствор K2CO3 и экстрагируют CH2Cl2. Органический слой сушат над сульфатом магния, отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/CH2Cl2 70/30). Собирают чистые фракции и растворитель упаривают. Выход: 7,3 г промежуточного соединения 28 (57%) (температура плавления: 111C).b) Получение промежуточного соединения 29. Смесь промежуточного соединения 28 (0,0026 мл), NBS (0,0028 моль) и дибензоилпероксида(0,00005 моль) перемешивают при температуре 80C в течение 3 ч, выливают в H2O и экстрагируютCH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 1,3 г промежуточного соединения 29 (100%) (температура плавления: 110C). Пример A12. Получение промежуточного соединения 30. Смесь 3,5-дифторбензиламина (4,2 ммоль), этилхлорацетата (4,2 ммоль) и карбоната калия (4,2 ммоль) в ацетонитриле (7 мл) перемешивают при температуре 80C в течение 18 ч. Смесь охлаждают,выливают в H2O и экстрагируют CH2Cl2. Органический слой сушат над сульфатом магния, отфильтровывают и растворитель упаривают. Выход: 0,58 г промежуточного соединения 30 (60%). Пример A13. a) Получение промежуточного соединения 31.(10 мл) нагревают при температуре 80C в течение 5 ч, а затем упаривают досуха. Остаток растворяют в смеси воды и CH2Cl2, подщелачивают, экстрагируют CH2Cl2, сушат над сульфатом магния, отфильтровывают и растворитель упаривают. Выход: 2,48 г промежуточного соединения 31 (62%).b) Получение промежуточного соединения 32. Смесь промежуточного соединения 31 (0,011 моль) и 30%-ного раствора метоксида натрия (0,011 моль) в MeOH кипятят с обратным холодильником в течение 3 ч, а затем охлаждают до комнатной температуры и выливают в воду со льдом. Осадок отфильтровывают, сушат и очищают колоночной хроматографией на силикагеле (элюент: циклогексан/CH2Cl2 70/30). Чистые фракции собирают и растворитель упаривают. Выход: 1,6 г промежуточного соединения 32 (40%).c) Получение промежуточного соединения 33.- 20015617 Смесь промежуточного соединения 32 (0,0053 моль), NBS (0,0053 моль) и дибензоилпероксида(0,00002 моль) в трифтортолуоле (31 мл) перемешивают при температуре 80C в течение 5 ч и охлаждают до комнатной температуры. Добавляют H2O и CH2Cl2. Органический слой промывают водой, сушат(над MgSO4), отфильтровывают и растворитель упаривают. Остаток (2,68 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и высушивают. Выход: 2,4 г промежуточного соединения 33 (85%)(температура плавления: 117C). Пример A14. a) Получение промежуточного соединения 35. 1,6 М раствор nBuLi в гексане (0,0257 моль) в токе азота добавляют при температуре -70C к раствору бензофурана (0,0257 моль) в ТГФ (30 мл). Смесь перемешивают при температуре -70C в течение 3 ч. Добавляют раствор 2-фенилхинолин-3-карбальдегида (получают в соответствии с методикой, приведенной в заявке на патент США (опубликована 2004) 2004009976, содержание которой включено в настоящее изобретение в виде ссылки) (0,0129 моль) в ТГФ (30 мл). Смесь перемешивают при -70C в течение 3 ч, а затем выливают на лед при -20C и экстрагируют EtOAc. Органический слой промывают насыщенным водным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают. Выход: 3,75 г промежуточного соединения 35 (83%) (температура плавления: 184C).b) Получение промежуточного соединения 36.PBr3 (0,0006 моль) добавляют по каплям при комнатной температуре к раствору промежуточного соединения 35 (0,0005 моль) в CH2Cl2 (5 мл). Смесь перемешивают при комнатной температуре в течение 30 мин, а затем упаривают досуха. Выход: промежуточное соединение 36. Смесь промежуточного соединения 3 (получают в соответствии с A1.c) (0,0004 моль), этилового эфира N-(фенилметил)глицина (0,0008 моль) и K2CO3 (0,0013 моль) в CH3CN (6 мл) перемешивают при температуре 80C в течение ночи. Добавляют H2O. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,3 г) очищают колоночной хроматографией на кромасиле (элюент: циклогексан/EtOAc 90/10; 10 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,165 г конечного соединения 146 (66%). Смесь конечного соединения 146 (получают в соответствии с B1.a) (0,0007 моль), тетракис(трифенилфосфин)палладия (0,00007 моль) и (CH3)4Sn (0,0014 моль) в толуоле (8 мл) перемешивают при кипячении с обратным холодильником в течение 2 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 90/10; 15-40 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,109 г конечного соединения 150 (31%). Смесь конечного соединения 146 (получают в соответствии с B1.a) (0,53 ммоль), Pd(PPh3)4 (0,053 ммоль), циклического эфира, образованного пиридинбороновой кислотой и 1,3-пропандиолом (0,0016 моль), и водного раствора карбоната натрия (2 М, 0,0027 моль) в диметилгликоле (7 мл) перемешивают при температуре 90C в течение 2 ч, а затем выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH: 95/5). Чистые фракции собирают и растворитель упаривают. Выход: 62 мг конечного соединения 152 (21%). Пример B2. a) Получение соединения 131. Смесь промежуточного соединения 7 (получают в соответствии с A2.d) (0,24 ммоль), гидрохлорида этилового эфира саркозина (0,24 ммоль) и K2CO3 (0,24 ммоль) в CH3CN (5 мл) перемешивают при температуре 80C в течение 18 ч. Смесь охлаждают и выливают в воду и экстрагируют CH2Cl2. Органический слой сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток кристаллизуют из диизопропилового эфира. Осадок отфильтровывают и сушат. Выход: конечное соединение 131 (100%). Смесь промежуточного соединения 7 (получают в соответствии с A2.d) (0,004 моль), этилового эфира N-(фенилметил) глицина (0,0009 моль) и K2CO3 (0,0014 моль) в CH3CN (8 мл) перемешивают при температуре 80C в течение ночи, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют,сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,3 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 90/10; 15-40 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,054 г конечного соединения 137 (21%). Смесь промежуточного соединения 7 (получают в соответствии с A2.d) (0,0098 моль), промежуточного соединения 27 (получают в соответствии с A8.b) (0,0098 моль) и K2CO3 (0,0108 моль) в CH3CN (80 мл) перемешивают при температуре 80C в течение 12 ч. Растворитель упаривают. Смесь экстрагируютCH2Cl2/H2O. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (5,4 г) очищают колоночной хроматографией на силикагеле (градиентное элюирование:CH2Cl2/CH3OH от 98/2 до 99/1; 15-40 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,66 г конечного соединения 145 (12%) (температура плавления: 96C). Смесь промежуточного соединения 20 (получают в соответствии с A7.b) (0,0053 моль), этилового эфира N-(фенилметил)глицина (0,008 моль) и K2CO3 (0,008 моль) в CH3CN (20 мл) перемешивают при кипячении с обратным холодильником в течение 18 ч, охлаждают до комнатной температуры и вылива- 22015617 ют в смесь H2O и EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат (надMgSO4), отфильтровывают и растворитель упаривают. Остаток (3 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 1,85 г конечного соединения 151 (74%) (температура плавления: 148C). Раствор промежуточного соединения 23 (получают в соответствии с А 9.b) (0,0037 моль) в этиловом эфире N-(фенилметил)глицина (7 мл) перемешивают при 125C в течение 6 ч, затем охлаждают до комнатной температуры, выливают в H2O и экстрагируют EtOAc. Органический слой промывают водой, затем насыщенным водным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Выход: 0,4 г. Указанную фракцию очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 60/40; 15-40 мкм). Собирают две фракции и растворитель упаривают. Выход: 2,65 г фракции 1 и 0,35 г фракции 2 (19%). Фракцию 1 растворяют в смеси CH2Cl2/метилизоцианат полистирола. Смесь перемешивают при комнатной температуре в течение 2 ч и фильтруют. Фильтрат упаривают. Выход: 0,32 г конечного соединения 129 (18%). Смесь промежуточного соединения 26 (получают в соответствии с A10.c) (0,0012 моль), гидрохлорида этилового эфира N-метилглицина (0,0019 моль) и K2CO3 (0,0024 моль) в CH3CN (15 мл) перемешивают при температуре 80C в течение 6 ч. Растворитель упаривают досуха. Остаток растворяют в смеси Смесь промежуточного соединения 33 (получают в соответствии с A13.c) (0,0027 моль), гидрохлорида этилового эфира N-метилглицина (0,0027 моль) и K2CO3 (0,004 моль) в CH3CN (12 мл) перемешивают при кипячении с обратным холодильником в течение 23 ч. Добавляют гидрохлорид этилового эфира N-метилглицина (1 эквивалент), а затем K2CO3 (1 эквивалент). Смесь перемешивают при кипячении с обратным холодильником в течение 24 ч, затем охлаждают до комнатной температуры и выливают в смесь H2O и EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат (над MgSO4),отфильтровывают и растворитель упаривают. Остаток (1,15 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 95/5; 15-40 мкм). Собирают требуемые фракции и растворитель упаривают. Выход: 0,68 г конечного соединения 132 (52%). Смесь промежуточного соединения 36 (получают в соответствии с A14.b) (0,0056 моль), этилового эфира N-(фенилметил)глицина (0,0171 моль) и K2CO3 (0,0171 моль) в CH3CN (50 мл) перемешивают при кипячении с обратным холодильником в течение 18 ч, затем выливают в H2O и экстрагируют CH2Cl2. Органический слой промывают насыщенным раствором NaCl, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (5 г) очищают колоночной хроматографией на силикагеле (элюент:- 23015617 циклогексан/EtOAc 90/10). Чистые фракции собирают и растворитель упаривают. Выход: 0,79 г конечного соединения 130 (27%). Конечное соединения 143 получают аналогично методике, приведенной в B2.с, из промежуточного соединения 21. Конечное соединения 148 получают аналогично методике, приведенной в B2.c, из промежуточного соединения 29. Конечное соединения 141 получают аналогично методике, приведенной в B2.c, из промежуточного соединения 30. Пример B3. Смесь промежуточного соединения 13 (получают в соответствии с A6.a) (0,0003 моль), диметиламина (0,0005 моль), EDCI (0,0005 моль), HOBT (0,0005 моль) и Et3N (0,0005 моль) в CH2Cl2/ТГФ (8 мл) перемешивают при комнатной температуре в течение 3 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,2 г) кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 0,053 г конечного соединения 53(бензил-[(6-бром-2-феноксихинолин-3-ил)фенилметил]аминоуксусной кислоты) (получают ана- 24015617 логично методике, приведенной в A6.c) (0,0002 моль), гидрохлорида N-метил-2-пропанамина (0,0003 моль), EDCI (0,0004 моль) и HOBT (0,0004 моль) в CH2Cl2 (3 мл) и ТГФ (3 мл) перемешивают при комнатной температуре в течение 12 ч, а затем выливают в H2O и CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,25 г) очищают колоночной хроматографией на кромасиле (15 мкм). Чистые фракции собирают и растворитель упаривают. Выход: конечное соединение 30 (37%). Смесь промежуточного соединения 14 (получают в соответствии с A6.b) (0,0002 моль), гидрохлорида метиламина (0,0002 моль), EDCI (0,0003 моль) и HOBT (0,0003 моль) в CH2Cl2 (2 мл), ТГФ (2 мл) и триэтиламина (0,1 мл) перемешивают при комнатной температуре в течение 12 ч, затем выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,15 г) очищают колоночной хроматографией на кромасиле (элюент: от CH2Cl2 100 до CH2Cl2/CH3OH 90/10; 5 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,063 г конечного соединения 3 (62%) (температура плавления: 190C). Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0008 моль), N-метил-2 пропанамина (0,001 моль), EDCI (0,0012 моль) и HOBT (0,0012 моль) в CH2Cl2 (5 мл) и ТГФ (5 мл) перемешивают при комнатной температуре в течение 12 ч, а затем выливают в H2O и CH2Cl2 и перемешивают в течение 5 мин. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,42 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 99/1; 5 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,14 г фракции 1 и 0,064 г фракции 2. Фракцию 1 кристаллизуют из смеси DIPE/диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,138 г конечного соединения 41 (31%) (температура плавления: 126C). Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0002 моль), диметиламина (0,0003 моль), Et3N (0,0004 моль), EDCI (0,0003 моль) и НОВТ (0,0003 моль) в CH2Cl2 (2 мл) и ТГФ(2 мл) перемешивают при комнатной температуре в течение 12 ч, а затем выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,1 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 99/1; 10 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,056 г фракции A и 0,1 г фракции B. Фракцию A растворяют в диэтиловом эфире. Смесь упаривают. Выход: 0,055 г конечного соединения 45 Смесь промежуточного соединения 37 (получают в соответствии с A6.g) (0,0004 моль), N-метил-2 пропанамина (0,0004 моль), EDCI (0,0006 моль) и НОВТ (0,0006 моль) в CH2Cl2 (5 мл) и ТГФ (5 мл) перемешивают при комнатной температуре в течение 3 ч. Добавляют H2O. Смесь экстрагируют CH2Cl2, а затем фильтруют. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель- 25015617 упаривают. Остаток (0,12 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH от 100/0 до 98/2; 5 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,073 г конечного соединения 36 (33%). Пример B4. Смесь промежуточного соединения 16 (получают в соответствии с A6.d) (0,0006 моль), 1 метилпиперазина (0,0009 моль), EDCI (0,0009 моль) и НОВТ (0,0009 моль) в CH2Cl2 (8 мл) и ТГФ (8 мл) перемешивают при комнатной температуре в течение 1 ч, а затем выливают в H2O и экстрагируютCH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,4 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 95/5; 5 мкм). Чистые фракции собирают и растворитель упаривают. Остаток кристаллизуют из смеси Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0002 моль), 4 метилпиперазинамина (0,0002 моль), EDCI (0,0003 моль) и НОВТ (0,0003 моль) в CH2Cl2 (3 мл) и ТГФ (3 мл) перемешивают при комнатной температуре в течение 12 ч, а затем упаривают досуха. Остаток растворяют в EtOH. Осадок отфильтровывают и сушат. Выход: 0,3 г. Указанную фракцию очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 10 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,082 г фракции A (34%) и 0,03 г фракции B. Фракцию A очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,2; 3,5 мкм). Чистые фракции собирают и растворитель упаривают Выход: 0,05 г конечного соединения 69 (21%). Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0021 моль), Nметилпиперазина (0,0003 моль), EDCI (0,0033 моль) и HOBT (0,0033 моль) в CH2Cl2 (2 мл) и ТГФ (2 мл) перемешивают при комнатной температуре в течение 12 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток(0,1 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1; 10 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,06 г фракции A и 0,007 г фракции B. Фракцию A растворяют в диэтиловом эфире. Смесь упаривают. Выход: 0,056 г конечного соединения 72 Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0008 моль), пиперидина(0,001 моль), EDCI (0,0012 моль) и НОВТ (0,0012 моль) в CH2Cl2 (5 мл) и ТГФ (5 мл) перемешивают при комнатной температуре в течение 12 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,46 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 99/1; 5 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,094 г фракции A и 0,04 8 г фракции B. Фракцию A кристаллизуют из смеси DIPE/диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,094 г конечного соединения Смесь промежуточного соединения 15 (получают в соответствии с A6.c) (0,0001 моль), Nметилпиперазина (0,0002 моль), EDCI (0,0002 моль) и НОВТ (0,0002 моль) в CH2Cl2 (3 мл) и ТГФ (3 мл) перемешивают при комнатной температуре в течение 12 ч, затем выливают в H2O/CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,11 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 95/5; 5 мкм). Чистые фракции собирают и растворитель упаривают. Остаток сушат с диэтиловым эфиром. Выход: 0,062 г конечного соединения 114 (55%). Смесь промежуточного соединения 18 (получают в соответствии с A6.f) (0,0004 моль), пирролидина (0,0006 моль), EDCI (0,0006 моль) и НОВТ (0,0006 моль) в CH2Cl2 (4 мл) и ТГФ (4 мл) перемешивают при комнатной температуре в течение 18 ч. Добавляют H2O и CH2Cl2. Смесь фильтруют. Фильтрат упаривают. Остаток очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 95/5; 10 мкм). Чистые фракции собирают и растворитель упаривают. Остаток (0,14 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат при 50C в вакууме. Выход: 0,068 г конечного соединения 122 (32%) (температура плавления: 161C). Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,0008 моль), тиоморфолина (0,001 моль), EDCI (0,0012 моль) и НОВТ (0,0012 моль) в CH2Cl2 (5 мл) и ТГФ (5 мл) перемешивают при комнатной температуре в течение 12 ч и выливают в H2O и CH2Cl2, затем перемешивают 5 мин. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток(0,48 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH 99/1; 5 мкм). Чистые фракции собирают и растворитель упаривают. Остаток (0,117 г) кристаллизуют из смеси Смесь конечного соединения 105 (получают аналогично методике, приведенной в B4.a) (0,0002 моль), метилбороновой кислоты (0,0005 моль), Pd(PPh3)4 (0,00002 моль) и 2 М раствора Na2CO3 (0,0011 моль) в DME (2,9 мл) перемешивают при температуре 90C в течение 6 ч, а затем охлаждают до комнатной температуры. Добавляют H2O. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат(над MgSO4), отфильтровывают и растворитель упаривают, получая 0,238 г. Указанную фракцию очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 99/1; 10 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,08 г фракции A и 0,06 г фракции B. Фракцию В кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 0,047 г конечного соединения 59 (33%) (температура плавления: 126C). Пример B6. Получение соединения 154. 3-Хлорбензолнадкарбоновую кислоту (0,0005 моль) добавляют при 5C к раствору конечного соединения 105 (получают аналогично методике, приведенной в B4.a) (0,0005 моль) в CH2Cl2 (7 мл). Смесь перемешивают при комнатной температуре в течение 24 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,3 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH от 100/0 до 98/2; 5 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,07 г фракции A и 0,013 г конечного соединения 154 (4%). Пример B7. Получение соединения 29. Смесь промежуточного соединения 8 (получают в соответствии с A3.a) (0,0002 моль) в пирролидине (0,5 мл) перемешивают при температуре 140C в течение 12 ч. Остаток очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 10 мкм). Собирают чистые фракции и растворитель упаривают. Остаток растворяют в диэтиловом эфире и сушат. Выход: 0,08 г конечного соединения 29 (58%). Пример B8. a) Получение соединения 51. Смесь промежуточного соединения 3 (получают в соответствии с A1.c) (0,0006 моль), N,N-диметилN'-(фенилметил)-1,2-этандиамина (0,0009 моль) и K2CO3 (0,0009 моль) в CH3CN (6 мл) перемешивают в течение ночи при температуре 80C, затем выливают в H2O и экстрагируют EtOAc. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,44 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,5; 20 мкм). Собирают чистые фракции и растворитель упаривают. Выход: 0,17 г конечного соединения 51 (47%). Смесь промежуточного соединения 7 (получают в соответствии с A2.d) (0,0012 моль), N,Nдиметил-N'-фенил-1,2-этандиамина (0,0018 моль) и K2CO3 (0,0018 моль) в CH3CN (10 мл) перемешивают в течение ночи при температуре 80C, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,86 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Собирают две фракции и растворитель упаривают. Выход: 0,64 г фракции A и 0,01 г фракции B. Фракцию A кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 0,03 г конечного соединения 18 (температура плавления: 120C). Пример B9. Получение соединения 22.DIAD (0,0027 моль) при температуре 0C в токе азота добавляют по каплям к смеси промежуточного соединения 34 (получают в соответствии с A4.b) (0,0014 моль), N,N-диметил-N'-(фенилметил)-1,2 этандиамина (0,0027 моль) и PPh3 (0,0027 моль) в ТГФ (15 мл). Смесь перемешивают при комнатной- 28015617 температуре в течение ночи, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (2,6 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Чистые фракции собирают и растворитель упаривают. Остаток (0,086 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 10 мкм). Чистые фракции собирают и растворитель упаривают. Выход: 0,05 г конечного соединения 22 (7%). Пример B10. a) Получение соединения 20. Смесь промежуточного соединения 7 (получают в соответствии с A2.d) (0,0013 моль) и N,Nдиметил-N'-(2-метоксифенил)-1,2-этандиамина (0,0026 моль) перемешивают при температуре 90C в течение 2 ч, а затем растворяют в H2O и H2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,5 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 10 мкм). Чистые фракции собирают и растворитель упаривают. Остаток (0,084 г) растворяют в CH3COCH3 и превращают в соль щавелевой кислоты. Осадок отфильтровывают и сушат. Выход: 0,099 г конечного соединения 20 (18%) (температура плавления: 142C). Смесь промежуточного соединения 12 (получают в соответствии с A5.c) (0,0013 моль) и N,N,N'триметил-1,2-этандиамина (0,0026 моль) перемешивают при температуре 90C в течение 2 ч, а затем растворяют в H2O и H2Cl2. Органический слой отделяют, сушат (над MgSO4), отфильтровывают и растворитель упаривают. Остаток (0,5 г) очищают колоночной хроматографией на кромасиле (элюент:CH2Cl2/CH3OH/NH4OH 95/5/0,1; 10 мкм). Чистые фракции собирают и растворитель упаривают. Остаток Смесь промежуточного соединения 14 (получают в соответствии с A6.b) (0,17 ммоль), 4-метилпиперидина (0,255 ммоль), 1-гидроксибензотриазола (0,255 ммоль) и гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (0,03 г, 0,255 ммоль) в смеси ТГФ/CH2Cl2 (1:1, 4 мл) перемешивают при комнатной температуре в течение 12 ч. Смесь выливают в воду и органический слой отделяют. Продукт очищают колоночной хроматографией на силикагеле (колонка Kromasil 5 мкм 25020 мм, от CH2Cl2 : 100 до CH2Cl2/MeOH; 90/10). Чистые фракции собирают и растворитель упаривают. Выход: конечное соединение 83 (58%). Смесь промежуточного соединения 17 (получают в соответствии с A6.e) (0,15 ммоль), диэтиламина(0,225 ммоль), 1-гидроксибензотриазола (0,225 ммоль) и гидрохлорида 1-(3-диметиламинопропил)-3 этилкарбодиимида (0,255 ммоль) в смеси ТГФ/CH2Cl2 (1:1, 4 мл) перемешивают при комнатной температуре в течение 12 ч. Смесь выливают в воду и органический слой отделяют. Продукт очищают колоночной хроматографией на силикагеле (колонка Kromasil 5 мкм, 25020 мм, от CH2Cl2 : 100 доCH2Cl2/MeOH; 95/5). Чистые фракции собирают и растворитель упаривают. Выход: конечное соединение 47 (44%).
МПК / Метки
МПК: A61P 31/00, C07D 401/04, C07D 215/12, C07D 417/06, C07D 401/14, C07D 215/227, C07D 413/06, C07D 401/12, C07D 405/12, C07D 215/48, C07D 401/06, C07D 405/06, A61K 31/47
Метки: хинолина, производные, антибактериальные
Код ссылки
<a href="https://eas.patents.su/30-15617-antibakterialnye-proizvodnye-hinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные производные хинолина</a>
Предыдущий патент: Рабочая жидкость для энергетической установки с органическим циклом ранкина
Следующий патент: Способы получения алкилированных углеводородов из текучей среды, полученной способом термической переработки in situ
Случайный патент: Способ и система для ввода ингибитора гидратообразования при добыче и подготовке углеводородного сырья к транспортировке и хранению












