Антибактериальные производные хинолина
Номер патента: 16733
Опубликовано: 30.07.2012
Авторы: Доранж Исмет, Гийемон Жером Эмиль Жорж, Лансуа Давид Франсис Ален, Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил
Формула / Реферат
1. Соединение формулы (Ia)
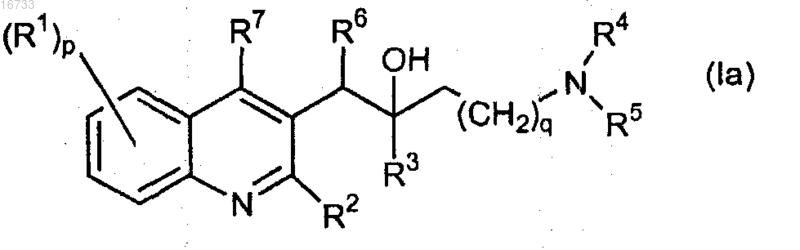
включая его любую стереохимически изомерную форму,
где q представляет собой целое число, равное 2 или 4;
р представляет собой целое число, равное 1;
R1 представляет собой C2-6алкенил, С2-6алкинил, -C=N-OR11, аминогруппу, ди(С1-6алкил)аминогруппу, амино-С1-6алкил, С1-6алкилкарбониламино-С1-6алкил, ди(С1-6алкил)аминокарбонил, арилкарбонил, R5aR4aN-алкил, R5aR4aN-;
R2 представляет собой C1-6алкилоксигруппу;
R3 представляет собой арил-С1-6алкил, арил;
каждый R4 и R5 представляет собой C1-6алкил или
R4 и R5 совместно и включая N, к которому они присоединены, образуют пиперидинил;
R4a и R5a вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, включающей в себя пиперазиногруппу и морфолиногруппу, необязательно замещенные C1-6алкилом;
R6 представляет собой арил1;
R7 представляет собой водород;
R11 представляет собой водород или C1-6алкил;
арил представляет собой гомоцикл, выбранный из фенила, нафтила, причем каждый из них необязательно замещен галогеном;
арил1 представляет собой гомоцикл, выбранный из фенила, необязательно замещенного галогеном,
и его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R1 представляет собой С2-6алкенил, C2-6алкинил, -C=N-OR11, аминогруппу, ди(C1-6алкил)аминогруппу, амино-C1-6алкил, С1-6алкилкарбониламино-C1-6алкил, ди(С1-6алкил)аминокарбонил, арилкарбонил, R5aR4aN-алкил, R5aR4aN-;
R2 представляет собой С1-6алкилоксигруппу;
R3 представляет собой арил-С1-6алкил, арил;
каждый R4 и R5 представляет собой С1-6алкил или
R4 и R5 совместно и включая N, к которому они присоединены, образуют пиперидинил;
R4a и R5a вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, включающей в себя пиперазиногруппу и морфолиногруппу, необязательно замещенные алкилом;
R6 представляет собой арил1;
R7 представляет собой водород;
R11 представляет собой водород или С1-6алкил;
арил представляет собой гомоцикл, выбранный из фенила, нафтила, причем каждый из них необязательно замещен галогеном;
арил1 представляет собой гомоцикл, выбранный из фенила, необязательно замещенного галогеном.
3. Соединение по п.1 или 2, в котором R1 представляет собой С2-6алкенил, С2-6алкинил, -C=N-OR11, аминогруппу, ди(С1-6алкил)аминогруппу, амино-С1-6алкил, C1-6алкилкарбониламино-С1-6алкил, ди(С1-6алкил)аминокарбонил, R5aR4aN-алкил, R5aR4aN-.
4. Соединение по п.3, в котором R1 представляет собой R5aR4aN-алкил или R5aR4aN-.
5. Соединение по любому из предыдущих пунктов, в котором R2 представляет собой С1-6алкилоксигруппу.
6. Соединение по п.5, в котором R2 представляет собой метилоксигруппу.
7. Соединение по любому из предыдущих пунктов, в котором R3 представляет собой арил-С1-6алкил или арил.
8. Соединение по любому из предыдущих пунктов, в котором R4 и R5 представляют собой C1-6алкил.
9. Соединение по любому из пп.1-8, в котором R4 и R5 совместно с атомом азота, к которому они присоединены, образуют пиперидиногруппу.
10. Соединение по любому из предыдущих пунктов, в котором R6 представляет собой фенил, необязательно замещенный галогеном.
11. Соединение по п.1, в котором
R1 представляет собой С2-6алкенил, C2-6алкинил, -C=N-OR11, аминогруппу, амино-С1-6алкил, С1-6алкилкарбониламино-С1-6алкил, ди(C1-6алкил)аминокарбонил, арилкарбонил, R5aR4aN-алкил, R5aR4aN-;
R2 представляет собой C1-6алкилоксигруппу;
R3 представляет собой арил-С1-6алкил или арил;
каждый R4 и R5 представляет собой С1-6алкил или
R4 и R5 совместно с атомом азота, к которому они присоединены, образуют пиперидиногруппу;
R6 представляет собой фенил, необязательно замещенный галогеном;
R7 представляет собой водород;
R11 представляет собой водород или C1-4алкил.
12. Применение соединения по любому из пп.1-11 в качестве лекарственного средства для лечения бактериальной инфекции, включая микобактериальную инфекцию.
13. Фармацевтическая композиция для лечения бактериальной инфекции, включающая в себя терапевтически эффективное количество соединения, как определено в любом из пп.1-11 в качестве активного ингредиента, и фармацевтически приемлемый носитель.
14. Применение соединения по любому из пп.1-11 для производства лекарственного средства для лечения бактериальной инфекции.
15. Применение по п.14, в котором бактериальной инфекцией является инфекция грамположительной бактерией.
16. Применение по п.15, в котором бактериальной инфекцией является инфекция Mycobacterium tuberculosis.
17. Применение по п.15, в котором грамположительной бактерией является Streptococcus pneumoniae.
18. Применение по п.17, в котором грамположительной бактерией является Staphylococcus aureus.
19. Применение по п.18, в котором Staphylococcus aureus представляет собой метициллин-резистентный Staphylococcus aureus.
20. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (II-а), где W1 представляет собой приемлемую уходящую группу с трибутил(C2-6алкенил)оловом в присутствии подходящего катализатора и подходящего растворителя
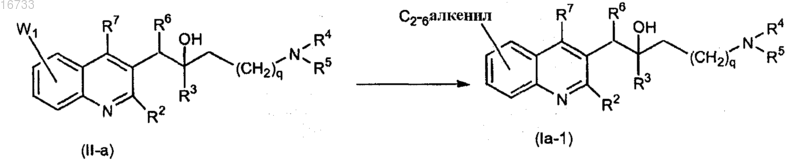
где все переменные определены, как в п.1.
21. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (III-а) с гидрохлоридом гидроксиламина или гидрохлоридом С1-6алкоксиламина в присутствии подходящего растворителя
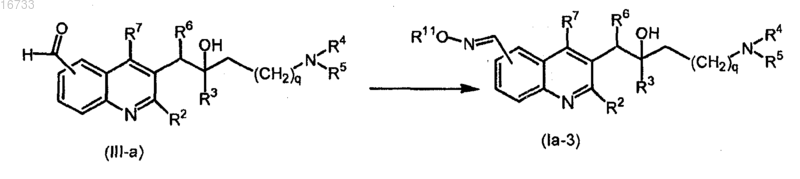
где все переменные определены, как в п.1.
22. Способ получения соединения по п.1, включающий восстановление промежуточного соединения формулы (III-а) в присутствии Н2, подходящего катализатора и подходящего растворителя
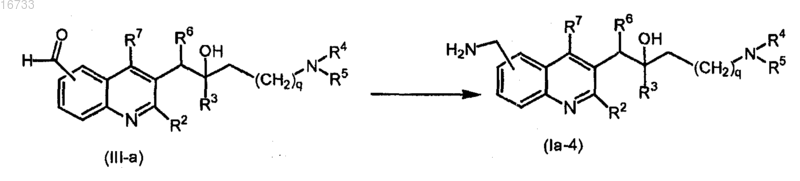
где все переменные определены, как в п.1.
23. Комбинация для лечения бактериальной инфекции, содержащая (а) соединения по любому из пп.1-11 и (b) любой один или более других антибактериальных средств.
24. Применение продукта, содержащего (а) соединение по любому из пп.1-11 и (b) один или более других антибактериальных средств, в качестве комбинированного препарата для одновременного, раздельного или последовательного лечения бактериальной инфекции.
Текст
Настоящее изобретение относится к новым замещенным производным хинолина согласно общей формуле (Ia) или формуле (Ib): Гийемон Жером Эмиль Жорж, Лансуа Давид Франсис Ален (FR), Доранж Исмет (SE), Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил (BE) включая их любую стереохимически изомерную форму, их N-оксид, их фармацевтически приемлемую соль или их сольват. Заявленные соединения применимы для лечения бактериальной инфекции. Также заявлены композиция, включающая в себя фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество заявленного соединения, применение заявленных соединений или композиций для производства лекарственного средства для лечения бактериальной инфекции и способ получения заявленных соединений. 016733 Настоящее изобретение относится к новым замещенным производным хинолина, применимым для лечения бактериальных заболеваний, включая, но не ограничиваясь ими, заболевания, обусловленные патогенными микобактериями, такими как Mycobacterium tuberculosis, M.bovis, M.leprae, M.avium иM.marinum, или патогенными стафилококками или стрептококками. Предпосылки создания изобретенияMycobacterium tuberculosis является возбудителем туберкулеза (ТВ), тяжелой и потенциально фатальной инфекции, распространенной по всему свету. Оценки Всемирной организации здравоохранения указывают, что каждый год туберкулезом заражаются более 8 миллионов человек и 2 миллиона человек ежегодно умирают от туберкулеза. За последнее десятилетие число случаев туберкулеза в мире увеличилось на 20%, причем наиболее тяжелым является положение в наиболее бедных странах. Если эта тенденция продолжится, заболеваемость туберкулезом в течение следующих двадцати лет возрастет на 41%. Спустя 50 лет после внедрения эффективной химиотерапии, туберкулез остается после СПИДа главной причиной смертности взрослых людей во всем мире. Эпидемию туберкулеза осложняет увеличивающееся количество штаммов с множественной лекарственной резистентностью и смертельно опасный симбиоз с ВИЧ. Вероятность развития активного туберкулеза у лиц, инфицированных ВИЧ и туберкулезом, в 30 раз больше, чем у ВИЧ-негативных пациентов; туберкулез является причиной смерти каждого третьего пациента с ВИЧ/СПИД во всем мире. Все существующие подходы к лечению туберкулеза основаны на привлечении комбинации множественных лекарственных средств. Например, в схеме лечения, рекомендованной Министерством здравоохранения США, в течение двух месяцев применяют комбинацию изониазида, рифампицина и пиразинамида, после чего следует четырехмесячный курс одних лишь изониазида и рифампицина. Пациенты,инфицированные ВИЧ, продолжают принимать эти лекарственные средства в течение последующих семи месяцев. Пациентам, инфицированным штаммами M.tuberculosis с множественной лекарственной резистентностью, в комбинированную терапию добавляют такие лекарственные средства, как этамбутол,стрептомицин, канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Не существует такого единственного лекарственного средства, которое было бы эффективным при клиническом лечении туберкулеза, и нет такой комбинации препаратов, которые предоставили бы возможность лечения продолжительностью менее шести месяцев. Имеется настоятельная медицинская потребность в новых лекарственных средствах, которые усовершенствовали бы современную терапию, облегчив режимы лечения для пациентов и медицинского персонала. Лучшим способом достижения этого является применение менее продолжительных схем лечения, требующих меньшего контроля за пациентами. Наиболее полезны первые два месяца лечения, т.е. в течение интенсивной, или бактерицидной, фазы, когда применяют сразу четыре лекарственных средства; при этом уменьшается большая часть бактериальной нагрузки и пациент становится незаразным. Следующие 4-6 месяцев, или стерилизующая фаза, необходимы для уничтожения остающихся бацилл и минимизации риска рецидива. Исключительно полезным было бы мощное стерилизующее лекарственное средство, которое сократило бы лечение до 2 месяцев или менее. Необходимы и лекарственные средства, которые могли бы облегчить пациенту соблюдение режима лечения благодаря уменьшению необходимого контроля. Очевидно, что наиболее выгодным было бы соединение, которое одновременно сокращало бы продолжительность лечения и снижало бы частоту введения препарата. Эпидемию туберкулеза осложняет увеличивающаяся заболеваемость штаммами с множественной лекарственной резистентностью, или MDR-TB. Считают, что до 4% всех случаев туберкулеза в мире приходится на MDR-TB - на его формы, резистентные к наиболее эффективным лекарственным средствам из четырех стандартных препаратов (изониазиду и рифампицину). В отсутствие лечения MDR-TB является летальным; его невозможно адекватно лечить способами стандартной терапии, поэтому его лечение требует применения лекарственных средств "второго уровня" длительностью до 2 лет. Эти лекарственные средства часто токсичны, дороги и малоэффективны. В отсутствие эффективной терапии заразные больные с MDR-TB продолжают распространять это заболевание, создавая новые очаги инфекции со штаммами MDR-TB. Имеется настоятельная медицинская потребность в новом лекарственном средстве с новым механизмом действия, которое демонстрировало бы активность против лекарственнорезистентных, в частности множественно лекарственно-резистентных, штаммов MDR. Используемый выше или ниже в настоящем описании термин "лекарственно-резистентный" является термином, хорошо понятным специалисту в микробиологии. Лекарственно-резистентная микобактерия является микобактерией, которая больше не является восприимчивой по меньшей мере к одному из ранее эффективных лекарственных средств; у которой развилась способность сопротивляться антибиотической атаке по меньшей мере одного из прежде эффективных лекарственных средств. Лекарственнорезистентный штамм может передавать эту способность к сопротивлению своему потомству. Указанная резистентность может быть следствием произвольных генетических мутаций в бактериальной клетке,которая изменяет ее чувствительность к единственному лекарственному средству или к другим лекарственным средствам.MDR-туберкулез является специфической формой лекарственно-резистентного туберкулеза, обусловленного бактерией, резистентной, по меньшей мере, к изониазиду и рифампицину (с резистентностью к другим лекарственным средствам или без нее), которые в настоящее время являются двумя наиболее мощными противотуберкулезными лекарственными средствами. Таким образом, везде, где выше или ниже в настоящем описании используется термин "лекарственно-резистентный", он включает в себя и понятие "множественно лекарственно-резистентный". Другим фактором в контроле эпидемии туберкулеза является проблема латентного туберкулеза. Несмотря на десятилетия осуществления программ контроля за туберкулезом (ТВ), около 2 миллиардов человек заражены туберкулезными микобактериями (хотя бы бессимптомно). Примерно 10% из этих лиц имеют риск развития активного туберкулеза в течение своей жизни. Глобальную эпидемию туберкулеза поддерживает и инфицирование туберкулезом ВИЧ-пациентов и увеличение числа множественно лекарственно-резистентных штаммов. Реактивация латентного (скрытого) ТВ представляет собой высокий фактор риска для развития болезни и около 32% умерших от ВИЧ были заражены. Для контроля за эпидемией туберкулеза необходимо найти новые лекарственные средства, которые могли бы убивать "дремлющие" или латентные бациллы. Латентный ТВ может быть реактивирован и вызвать заболевание под действием нескольких факторов, таких как подавление иммунитета у хозяина при применении иммуносупрессантов, таких как антитела к фактору некроза опухолейили интерферону-. В случае ВИЧпозитивных пациентов единственным профилактическим средством, доступным для лечения латентного ТВ, являются двух-трехмесячные режимы рифампицина, пиразинамида. Эффективность этого режима лечения остается неясной, и, кроме того, длительность такого лечения является важным фактором, ограничивающим его применения в странах с ограниченными ресурсами. Поэтому настоятельно необходимо найти новые лекарственные средства, которые могли бы действовать в качестве химиопрофилактических средств для лиц с латентными ТВ-бациллами. Бациллы туберкулеза попадают в организм здорового человека при вдохе; они подвергаются фагоцитозу альвеолярными макрофагами легких. Это ведет к сильной иммунной реакции и образованию гранулем, которые состоят из макрофагов, инфицированных M.tuberculosis и окруженных Т-клетками. После 6-8-недельного периода иммунная реакция хозяина приводит к некротической гибели инфицированных клеток и накоплению казеозного материала с определенными внеклеточными бациллами, окруженными макрофагами, эпителиоидными клетками и слоями лимфоидной ткани на периферии. У здоровых людей в этом окружении погибает большинство микобактерий, но небольшая часть бацилл все же выживает и, как полагают, существует в нереплицирующемся гипометаболическом состоянии и является толерантной к уничтожению, вызываемому противотуберкулезными лекарственными средствами, такими как изониазид. Эти бациллы могут оставаться в таком измененном физиологическом окружении даже в течение всей жизни человека, не показывая никаких клинических симптомов заболевания. Однако в 10% случаев эти латентные бациллы могут реактивироваться и вызвать заболевание. Одна из гипотез объясняет развитие этих устойчивых бактерий патофизиологическим окружением в пораженной ткани человека, а именно пониженным содержанием кислорода, ограниченным поступлением питательных веществ и кислым рН. Предполагают, что данные факторы делают эти бактерии фенотипически толерантными к главным антимикобактериальным лекарственным средствам. В дополнение к контролю за эпидемией ТВ появляется проблема резистентности к антибиотикам первого уровня. Некоторые важные примеры этого явления включают в себя Streptococcus pneumoniae,резистентный к пенициллину, энтерококки, резистентные к ванкомицину, Staphylococcus aureus, резистентный к метициллину, сальмонеллы с множественной резистентностью. Последствия резистентности к антибиотикам весьма серьезны. Инфекции, обусловленные резистентными микробами, не поддаются лечению, что в результате приводит к более длительному заболеванию и большему риску смерти. Неэффективность лечения также ведет к более длительным периодам инфективности, что увеличивает число инфицированных людей, перемещающихся в населенном пространстве, тем самым подвергая всю популяцию риску заражения резистентным штаммом. Во всем мире больницы являются критическими компонентами проблемы антимикробной резистентности. Сочетание присутствия весьма восприимчивых пациентов, интенсивного и длительного применения противомикробных средств и наличия перекрестных инфекций приводит к появлению инфекций с высокорезистентными бактериальными патогенами. Самолечение противомикробными средствами является другим важным фактором, вносящим свой вклад в развитие резистентности. Противомикробные средства, применяемые при самолечении, могут не быть необходимыми, их дозы часто неадекватны или могут не содержать адекватных количеств активного лекарственного средства. Соблюдение пациентом рекомендованного режима лечения является другой важной проблемой. Пациенты забывают принимать лекарственное средство, прерывают курс лечения, когда начинают чувствовать себя лучше, или оказываются неспособными оплатить полный курс, что создает идеальную среду для адаптации микробов, а не для их уничтожения.-2 016733 Вследствие появления резистентности к множеству антибиотиков медики сталкиваются с инфекциями, для которых нет эффективной терапии. Заболеваемость, смертность и финансовые затраты, обусловленные такими инфекциями, становятся тяжелым бременем для систем здравоохранения во всем мире. Поэтому имеется настоятельная потребность в новых соединениях для лечения бактериальных инфекций, особенно микобактериальных инфекций, включая лекарственно-резистентные и латентные микобактериальные инфекции, а также других бактериальных инфекций, особенно тех, которые вызваны резистентными бактериальными штаммами.WO 2004/011436, WO 2005/070924, WO 2005/070430 и WO 2005/075428 раскрывают определенные замещенные производные хинолина, обладающие активностью против микобактерий, в частности против Mycobacterium tuberculosis. WO 2005/117875 описывает замещенные производные хинолина, обладающие активностью против резистентных микобактериальных штаммов. WO 2006/067048 описывает замещенные производные хинолина, обладающие активностью против латентного туберкулеза. Одно конкретное соединение из этих замещенных производных хинолина описано в Science (2005), 307, 223227, а его способ действия описан в WO 2006/035051. Другие замещенные хинолины раскрыты в US-5965572 (Соединенные Штаты Америки) для лечения инфекций, резистентных к антибиотикам; в WO 00/34265 описаны соединения, ингибирующие рост бактериальных микроорганизмов. Целью настоящего изобретения является предоставление новых соединений, в частности замещенных производных хинолина, обладающих свойством ингибирования бактериального роста, особенно роста микобактерий, но также и других бактерий, таких как стрептококки и стафилококки, и поэтому данные соединения полезны для лечения бактериальных заболеваний, в частности заболеваний,вызванных патогенными бактериями, такими как Streptococcus pneumonia, Staphylococcus aureus илиMycobacterium tuberculosis (включая латентное заболевание и включая резистентные штаммы M.tuberculosis), M.bovis, M.leprae, M.avium и M.marinum. Сущность изобретения Настоящее изобретение относится к новым замещенным производным хинолина согласно формуле включая любые их стереохимически изомерные формы,где q представляет собой целое число, равное 0, 1, 2, 3 или 4; р представляет собой целое число, равное 1, 2, 3 или 4;R2 представляет собой водород, алкилоксигруппу, арил, арилоксигруппу, гидроксигруппу, меркаптогруппу, алкилоксиалкилоксигруппу, алкилтиогруппу, моно- или ди(алкил)аминогруппу, пирролидино, где Y представляет собой СН 2, О, S, NH или N-алкил; группу или радикал формулы; каждый R4 и R5 независимо представляет собой водород, алкил или бензил илиR4 и R5 совместно и включая N, к которому они присоединены, могут образовывать радикал, выбранный из группы, включающей в себя пирролидинил, 2-пирролинил, 3-пирролинил, пирролил, имидазолидинил, пиразолидинил, 2-имидазолинил, 2-пиразолинил, имидазолил, пиразолил, триазолил, пиперидинил, пиридинил, пиперазинил, имидазолидинил, пиридазинил, пиримидинил, пиразинил, триазинил,морфолинил и тиоморфолинил, причем каждый радикал необязательно замещен алкилом, галогеном,галогеналкилом, гидроксигруппой, алкилоксигруппой, аминогруппой, моно- или диалкиламиногруппой,алкилтиогруппой, алкилоксиалкилом, алкилтиоалкилом и пиримидинилом;R4a и R5a вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, включающей в себя пирролидиногруппу, пиперидиногруппу, пиперазиногруппу, морфолиногруппу, 4-тиоморфолиногруппу, 2,3-дигидроизоиндол-1-ил, тиазолидин-3-ил, 1,2,3,6-тетрагидропиридил,-3 016733 гексагидро-1 Н-азепинил,гексагидро-1 Н-1,4-диазепинил,гексагидро-1,4-оксазепинил,1,2,3,4 тетрагидроизохинолин-2-ил, пирролинил, пирролил, имидазолидинил, пиразолидинил, 2-имидазолинил,2-пиразолинил, имидазолил, пиразолил, триазолил, пиридинил, пиридазинил, пиримидинил, пиразинил и триазинил, причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями и каждый из заместителей независимо выбран из группы, включающей в себя алкил, галогеналкил, галоген, арилалкил,гидроксигруппу, алкилоксигруппу, аминогруппу, моно- или диалкиламиногруппу, алкилтиогруппу, алкилтиоалкил, арил, пиридил или пиримидинил;R6 представляет собой арил 1 или Het;R8 представляет собой водород или алкил;R9 представляет собой оксогруппу илиR8 и R9 совместно образуют радикал -CH=CH-N=;R11 представляет собой водород или алкил; арил представляет собой гомоцикл, выбранный из фенила, нафтила, аценафтила или тетрагидронафтила, причем каждый из них необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или диалкиламиногруппы, алкила, галогеналкила, алкилоксигруппы, галогеналкилоксигруппы, карбоксила,алкилоксикарбонила, аминокарбонила, морфолинила или моно- или диалкиламинокарбонила; арил 1 представляет собой гомоцикл, выбранный из фенила, нафтила, аценафтила или тетрагидронафтила, причем каждый из них необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из гидроксигруппы, галогена, цианогруппы, нитрогруппы, аминогруппы, моноили диалкиламиногруппы, алкила, галогеналкила, алкилоксигруппы, алкилтиогруппы, галогеналкилоксигруппы, карбоксила, алкилоксикарбонила, аминокарбонила, морфолинила, Het или моно- или диалкиламинокарбонила;Het представляет собой моноциклический гетероцикл, выбранный из группы, включающей в себяN-феноксипиперидинил, пиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил,изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил или пиридазинил; или бициклический гетероцикл, выбранный из группы, включающей в себя хинолинил, хиноксалинил, индолил,бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; каждый моноциклический и бициклический гетероцикл необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из галогена, гидроксигруппы, алкила или алкилоксигруппы; их N-оксиды, фармацевтически приемлемые соли или сольваты. Везде, где его используют в настоящем документе, термин "соединения формулы (Ia) или (Ib)" или"соединения согласно настоящему изобретению" понимают как включающий также их фармацевтически приемлемые соли или их N-оксидные формы или их сольваты. Соединения формул (Ia) и (Ib) взаимосвязаны в том, что, например, соединение, соответствующее формуле (Ib), в котором R9 представляет собой оксогруппу, является таутомерным эквивалентом соединения, соответствующего формуле (Ia), в котором R2 представляет собой гидроксигруппу (кетоенольная таутомерия). В определении для группы Het ее считают включающей в себя все возможные изомерные формы гетероциклов, например пирролил включает в себя 1 Н-пирролил и 2 Н-пирролил. Арил, арил 1 или Het, перечисленные в определениях заместителей соединений формулы (Ia) или(Ib) (см., например, R3), как указано выше или ниже в настоящем документе, могут быть присоединенными к остальной части молекулы формулы (Ia) или (Ib) через любой подходящий кольцевой углерод или гетероатом, если не указано иначе. Так, например, когда группа Het является имидазолилом, она может быть 1-имидазолилом, 2-имидазолилом, 4-имидазолилом и т.п. Линии, проведенные от заместителей внутрь кольцевой системы, указывают, что связь может быть присоединенной к любому из подходящих кольцевых атомов. Фармацевтически приемлемые соли, как указано выше или ниже в настоящем документе, означают,что они включают в себя терапевтически активные нетоксичные кислотно-аддитивные солевые формы,которые способны образовывать соединения согласно формуле (Ia) или формуле (Ib). Указанные кислотно-аддитивные соли можно получать, обрабатывая основную форму соединений согласно формуле (Ia) или формуле (Ib) соответствующими кислотами, например неорганическими кислотами, например галоидоводородной кислотой, в частности хлористо-водородной, бромисто-водородной, серной, азотной и фосфорной кислотами; органическими кислотами, например уксусной, гидроксиуксусной, пропановой,молочной, пировиноградной, щавелевой, малоновой, янтарной, малеиновой, фумаровой, яблочной, винной, лимонной, метансульфоновой, этансульфоновой, бензолсульфоновой, п-толуолсульфоновой, цикламовой, салициловой, п-аминосалициловой и памовой кислотами.-4 016733 Соединения согласно формуле (Ia) или формуле (Ib), содержащие кислотные протоны, можно преобразовывать в формы их терапевтически активных нетоксичных аддитивных солей с металлами или аминами, обрабатывая соответствующими органическими и неорганическими основаниями. Фармацевтически приемлемые соли, как указано выше или ниже в настоящем документе, означают, что они также включают в себя терапевтически активные формы нетоксичных аддитивных солей с металлами или аминами (основно-аддитивные солевые формы), которые способны образовывать соединения согласно формуле (Ia) или формуле (Ib). Соответствующие основно-аддитивные солевые формы включают в себя,например, аммонийные соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин,пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин,дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин,триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-Dглюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабаминовые соли и соли с аминокислотами,такими как, например, аргинин, лизин и т.п. Наоборот, указанные кислотно- или основно-аддитивные солевые формы можно преобразовать в свободные формы, обрабатывая их соответствующим основанием или кислотой. Термин "фармацевтически приемлемая соль" также включает в себя четвертичные аммонийные соли (четвертичные амины), которые соединения формулы (Ia) или (Ib) способны образовывать по реакции между основным азотом соединения формулы (Ia) или (Ib) и соответствующим кватернизующим агентом, таким как, например, необязательно замещенный C1-6 алкилгалогенид, арил-C1-6 алкилгалогенид,С 1-6 алкилкарбонилгалогенид,арилкарбонилгалогенид,Het-C1-6 алкилгалогенид илиHetкарбонилгалогенид, например, метилйодид или бензилйодид. Предпочтительно Het представляет собой моноциклический гетероцикл, выбранный из фуранила или тиенила; или бициклический гетероцикл,выбранный из бензофуранила или бензотиенила; каждый моноциклический и бициклический гетероцикл может необязательно быть замещенным 1, 2 или 3 заместителями и каждый заместитель независимо выбран из группы галогена, алкила и арила. Предпочтительно кватернизующим агентом являетсяC1-6 алкилгалогенид. Можно также применять другие реагенты с хорошими уходящими группами, такие как C1-6 алкилтрифторметансульфонаты, C1-6 алкилметансульфонаты и C1-6 алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают в себя хлор, бром, йод, трифторацетат, ацетат, трифлат, сульфат, сульфонат. Предпочтительно противоионом является йод. Выбранный противоион можно ввести, применяя ионообменные смолы. Термин "сольват" включает в себя гидраты и формы присоединения растворителя, которые соединения формулы (Ia) или (Ib) способны образовывать, а также их соли. Примерами таких форм являются,например, гидраты, алкоголяты и т.п. В рамках настоящего изобретения подразумевается, что соединение согласно настоящему изобретению по своей природе включает в себя все свои стереохимически изомерные формы. Термин "стереохимически изомерные формы", используемый выше или ниже в настоящем описании, определяет все возможные стереоизомерные формы, которыми могут обладать соединения формулы (Ia) и (Ib) и ихN-оксиды, фармацевтически приемлемые соли или физиологически функциональные производные. Если не указано или упомянуто иначе, химическое обозначение соединений означает смесь всех стереохимически возможных изомерных форм. В частности, стереогенные центры могут иметь R- илиS-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь цис- или трансконфигурацию. Соединения, охватывающие двойные связи, могут иметь при указанной двойной связи стереохимию типа Е или Z. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области. Стереохимически изомерные формы соединений формулы (Ia) и (Ib), очевидно, предназначены для включения в объем настоящего изобретения. Особенно интересны те соединения формулы (Ia) или (Ib), которые являются стереохимически чистыми. Согласно положениям номенклатуры CAS, когда в молекуле присутствуют два стереогенных центра с известной абсолютной конфигурацией, хиральному центру с низшим уровнем нумерации, как референсному центру, приписывают дескриптор R или S (на основе правила последовательности КанаИнгольда-Прелога). Конфигурацию второго стереогенного центра указывают, применяя относительные дескрипторы [R,R] или [R,S], где R всегда указывают в качестве референсного центра и [R,R] указывает центры с одной и той же хиральностью, a [R,S] указывает центры с неодинаковой хиральностью. Например, если хиральный центр с низшей нумерацией в молекуле имеет S-конфигурацию, а второй центр является R-центром, стереодескриптор будет определен как S-[R,S]. Если применяют и: положение заместителя с высшим приоритетом на асимметрическом атоме углерода в кольцевой системе, имеющей низшее кольцевое число, всегда произвольно определяют в -положении средней плоскости, определенной кольцевой системой. Положение заместителя с высшим приоритетом на дру-5 016733 гом асимметрическом атоме углерода в кольцевой системе относительно положения заместителя с высшим приоритетом на референсном атоме обозначают как , если он находится на той же стороне средней плоскости, определенной кольцевой системой, или как , если он находится на другой стороне средней плоскости, определенной кольцевой системой. Когда указана конкретная стереоизомерная форма, это означает, что указанная форма является существенно свободной, т.е. содержит менее 50%, предпочтительно менее 20%, более предпочтительно менее 10%, даже более предпочтительно менее 5%, еще предпочтительнее менее 2% и наиболее предпочтительно менее 1% другого изомера (одного или более). Таким образом, когда соединение формулы(Ia) или (Ib), например, определено как (R,S), это означает, что данное соединение существенно свободно от (S,R)-изомера. Соединения обеих формул (Ia) и (Ib) и некоторые из промежуточных соединений обязательно имеют по меньшей мере два стереогенных центра в своей структуре, что может привести по меньшей мере к 4 стереохимически различным структурам. Соединения обеих формул (Ia) и (Ib) можно синтезировать в форме смесей, в частности рацемических смесей, энантиомеров, которые можно отделять друг от друга, следуя процедурам разделения, известным в данной области. Рацемические соединения обеих формул (Ia) и (Ib) можно преобразовать в соответствующие диастереомерные солевые формы по реакции с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяют, например, селективной или фракционной(дробной) кристаллизацией и из них щелочью освобождают энантиомеры. Альтернативный способ разделения энантиомерных форм соединений обеих формул (Ia) и (Ib) привлекает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также произвести из соответствующих стереохимически чистых изомерных форм подходящих исходных материалов при условии, что реакция стереоспецифична. Предпочтительно, если требуется конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими препаративными способами. В этих способах преимущественно применяют энантиомерно чистые исходные материалы. Таутомерные формы соединений формулы (Ia) или (Ib) означают, что они включают в себя такие соединения формулы (Ia) или (Ib), в которых, например, енольная группа преобразуется в кетогруппу(кетоенольная таутомерия). Таутомерные формы соединений формулы (Ia) и (Ib) или промежуточных соединений согласно настоящему изобретению считают входящими в объем настоящего изобретения.N-оксидные формы настоящих соединений считают включающими в себя соединения формулы (Ia) или (Ib), в которых один или несколько третичных атомов азота окислены до так называемого N-оксида. Соединения формул (Ia) и (Ib) можно преобразовывать в соответствующие N-оксидные формы,следуя процедурам, известным в данной области для преобразования трехвалентного азота в егоN-оксидную форму. Указанную реакцию N-окисления можно проводить по реакции исходного материала формулы (Ia) или (Ib) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают в себя, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать в себя пероксикислоты, такие как, например, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты, например пероксоуксусная кислота,алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются,например, вода, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. В рамках настоящего изобретения соединение согласно настоящему изобретению считают изначально включающим в себя все изотопные комбинации его химических элементов. В рамках настоящего изобретения химический элемент, в частности, когда его называют в связи с соединением согласно формуле (Ia) или (Ib), содержит все изотопы и смеси изотопов этого элемента, как природных, так и произведенных синтетически, как в естественной концентрации, так и в изотопно-обогащенной форме. В частности, когда называют водород, имеют в виду 1H, 2 Н, 3 Н и их смеси; когда называют углерод, имеют в виду 11C, 12 С, 13 С, 14 С и их смеси; когда называют азот, имеют в виду 13N, 14N, 15N и их смеси; когда называют кислород, имеют в виду 14O, 15O, 16O, 17O, 18O и их смеси; когда называют фтор, имеют в виду 18F,19F и их смеси. Поэтому соединение согласно настоящему изобретению по своей природе включает в себя соединение с одним или более изотопов одного или более элементов и их смеси, включая радиоактивное соединение, также называемое радиоактивно меченым соединением, в котором один или более нерадиоактивных атомов заменены одним или более радиоактивными изотопами. Под термином "радиоактивно меченое соединение" понимают любое соединение согласно формуле (Ia) или (Ib), его фармацевтически приемлемую соль или его N-оксидную форму или его сольват, который содержит по меньшей мере один радиоактивный атом. Например, соединение может быть меченным радиоактивными изотопами, испус-6 016733 кающими позитроны или гамма-радиацию. Для процедур радиолигандного связывания (мембраннорецепторный анализ) атомом выбора для замены являются 3 Н-атом или 125I-атом. Для визуализации наиболее часто применяемыми радиоактивными изотопами, испускающими позитроны (PET), являются 11C,18F, 15O и 13N; их производят в ускорителе, и они имеют периоды полураспада, равные 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада у этих радиоактивных изотопов являются такими короткими, применять их можно только в учреждениях, в составе которых имеется ускоритель для их производства, что ограничивает их применение. Из них наиболее широко применяют 18F, 99mTc, 201Tl и 123I. Порядок обращения с этими радиоактивными изотопами, их производство, выделение и включение в молекулу известны специалисту в данной области. В частности, радиоактивный атом выбирают из группы водорода, углерода, азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбирают из группы водорода, углерода и галогена. В частности, радиоактивный изотоп выбирают из группы 3 Н, 11C, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br,77Br и 82Br. Предпочтительно радиоактивный изотоп выбирают из группы 3 Н, 11 С и 18F. В рамках настоящего изобретения алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; в котором каждый атом углерода может быть необязательно замещенным цианогруппой,гидроксигруппой, С 1-6 алкилоксигруппой или оксогруппой. Предпочтительно алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; в котором каждый атом углерода может быть необязательно замещен гидроксилом илиC1-6 алкилоксигруппой. Предпочтительно алкил представляет собой метил, этил или циклогексилметил, более предпочтительно метил или этил. Интересным вариантом алкила во всех определениях, использованных выше или ниже в настоящем документе, является C1-6 алкил, который представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, такой как, например,метил, этил, пропил, 2-метилэтил, пентил, гексил и т.п. Предпочтительной подгруппой C1-6 алкила является С 1-4 алкил, который представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил и т.п. В рамках настоящего изобретения С 2-6 алкенил представляет собой прямой или разветвленный углеводородный радикал, имеющий от 2 до 6 атомов углерода, содержащий двойную связь, такой как этенил,пропенил, бутенил, пентенил, гексенил и т.п.; С 2-6 алкинил представляет собой прямой или разветвленный углеводородный радикал, имеющий от 2 до 6 атомов углерода, содержащий тройную связь, такой как этинил, пропинил, бутинил, пентинил, гексинил и т.п.; С 2-6 циклоалкил представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, и является общим типом радикала для циклопропила, циклобутила, циклопентила, циклогексила. В рамках настоящего изобретения галоген представляет собой заместитель, выбранный из группы фтора, хлора, брома и йода, и галогеналкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; в котором один или более атомов углерода замещены одним или более атомами галогена. Предпочтительно галоген является бромом, фтором или хлором, в частности хлором или бромом. Предпочтительно галогеналкил является полигалоген-С 1-6 алкилом, который определен как моно- или полигалогензамещенный C1-6 алкил, например метил с одним или более атомов фтора, например дифторметил или трифторметил, 1,1-дифторэтил и т.п. В том случае, когда к алкилу или C1-6 алкильной группе в рамках определения галогеналкила или полигалоген-C1-6 алкила присоединено более одного атома галогена, они могут быть одинаковыми или различными. Первый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в которомR2 представляет собой водород, C1-6 алкилоксигруппу, арил, арилоксигруппу, гидроксигруппу, меркаптогруппу, C1-6 алкилокси-C1-6 алкилоксигруппу, C1-6 алкилтиогруппу, моно- или ди(C1-6 алкил)аминогруппу, пирролидиногруппу или радикал формулы, в котором Y представляет собой СН 2, О, 016733R3 представляет собой C1-6 алкил, С 3-6 циклоалкил, арил-C1-6 алкил, арил-O-C1-6 алкил, арил-C1-6 алкилO-C1-6 алкил, арил, Het, Het-C1-6 алкил, Het-O-C1-6 алкил или Het-C1-6 алкил-О-C1-6 алкил или каждый R4 и R5 независимо представляет собой водород, C1-6 алкил или бензил илиR4 и R5 совместно и включая N, к которому они присоединены, могут образовывать радикал, выбранный из группы, включающей в себя пирролидинил, 2-пирролинил, 3-пирролинил, пирролил,имидазолидинил, пиразолидинил, 2-имидазолинил, 2-пиразолинил, имидазолил, пиразолил, триазолил,пиперидинил, пиридинил, пиперазинил, имидазолидинил, пиридазинил, пиримидинил, пиразинил, триазинил, морфолинил и тиоморфолинил, причем каждый радикал необязательно замещен C1-6 алкилом, галогеном, галоген-C1-6 алкилом, гидроксигруппой, C1-6 алкилоксигруппой, аминогруппой, моно- или ди(C1-6 алкил)аминогруппой, C1-6 алкилтиогруппой, C1-6 алкилокси-C1-6 алкилом, C1-6 алкилтио-C1-6 алкилом и пиримидинилом;R4a и R5a вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, включающей пирролидиногруппу, пиперидиногруппу, пиперазиногруппу, морфолиногруппу,4-тиоморфолиногруппу, 2,3-дигидроизоиндол-1-ил, тиазолидин-3-ил, 1,2,3,6-тетрагидропиридил, гексагидро-1 Н-азепинил, гексагидро-1 Н-1,4-диазепинил, гексагидро-1,4-оксазепинил, 1,2,3,4-тетрагидроизохинолин-2-ил,пирролинил,пирролил,имидазолидинил,пиразолидинил,2-имидазолинил,2-пиразолинил, имидазолил, пиразолил, триазолил, пиридинил, пиридазинил, пиримидинил, пиразинил и триазинил, причем каждый радикал необязательно замещен 1, 2, 3 или 4 заместителями и каждый заместитель независимо выбран из группы, включающей в себя C1-6 алкил, полигалоген-C1-6 алкил, галоген,арил-C1-6 алкил, гидроксигруппу, C1-6 алкилоксигруппу, C1-6 алкилокси-C1-6 алкил, аминогруппу, моно- или ди(C1-6 алкил)аминогруппу, C1-6 алкилтиогруппу, C1-6 алкилокси-C1-6 алкил, C1-6 алкилтио-C1-6 алкил, арил,пиридил или пиримидинил;R6 представляет собой арил 1 или Het;R8 представляет собой водород или C1-6 алкил;R9 представляет собой оксогруппу илиR8 и R9 совместно образуют радикал -CH=CH-N=;R11 представляют собой водород или C1-6 алкил; арил представляет собой гомоцикл, выбранный из группы, включающей в себя фенил, нафтил,аценафтил или тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из группы, включающей в себя гидроксигруппу, галоген,цианогруппу, нитрогруппу, аминогруппу, моно- или ди(C1-6 алкил)аминогруппу, C1-6 алкил, полигалогенC1-6 алкил, C1-6 алкилоксигруппу, галоген-C1-6 алкилоксигруппу, карбоксил, C1-6 алкилоксикарбонил, аминокарбонил, морфолинил или моно- или ди(C1-6-алкил)аминокарбонил; арил 1 представляет собой гомоцикл, выбранный из группы, включающей в себя фенил,нафтил, аценафтил или тетрагидронафтил, каждый из который необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из группы, включающей в себя гидроксигруппу, галоген, цианогруппу, нитрогруппу, аминогруппу, моно- или ди(C1-6 алкил)аминогруппу, C1-6 алкил, полигалоген-C1-6 алкил, C1-6 алкилоксигруппу, C1-6 алкилтиогруппу, галоген-C1-6 алкилоксигруппу, карбоксил,C1-6 алкилоксикарбонил, аминокарбонил, морфолинил, Het или моно- или ди(C1-6 алкил)аминокарбонил;Het представляет собой моноциклический гетероцикл, выбранный из группы, включающей в себяN-феноксипиперидинил, пиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил,изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил или пиридазинил; или бициклический гетероцикл, выбранный из группы, включающей в себя хинолинил, хиноксалинил, индолил,бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил; причем каждый моноциклический и бициклический гетероцикл необязательно замещен 1, 2 или 3 заместителями и каждый заместитель независимо выбран из группы, включающей в себя галоген, гидроксигруппу, C1-6 алкил илиC1-6 алкилоксигруппу. Второй интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R1 представляет собой C2-6 алкенил, С 2-6 алкинил, -C=N-OR11, аминогруппу,моно- или ди(C1-6 алкил)аминогруппу, амино-C1-6 алкил, моно- или ди(C1-6-алкил)амино-C1-6 алкил,C1-6 алкилкарбониламино-C1-6 алкил, аминокарбонил, моно- или ди(C1-6 алкил)аминокарбонил, R5aR4aNалкил, R5aR4aN-, R5aR4aN-C(=O)-; конкретно, в котором R1 представляет собой С 2-6 алкенил, С 2-6 алкинил,-C=N-OR11, R5aR4aN-алкил, R5aR4aN-, R5aR4aN-C(=O)-; даже более конкретно, в котором R1 представляет собой С 2-6 алкенил или -C=N-OR11. Третий интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором р равно 1.-8 016733 Четвертый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R2 представляет собой водород, алкилоксигруппу или алкилтиогруппу, конкретно водород, C1-6 алкилоксигруппу или С 1-6 алкилтиогруппу. Более конкретно, R2 представляет собой С 1-6 алкилоксигруппу, предпочтительно метилоксигруппу. Пятый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R3 представляет собой алкил, арилалкил, арил, или Het; конкретно C1-6 алкил,арил-C1-6 алкил, арил или Het; более конкретно, C1-6 алкил, необязательно замещенный фенил, необязательно замещенный нафтил, арил-С 1-6 алкил, в котором арил представляет собой необязательно замещенный фенил или необязательно замещенный нафтил или Het; даже более конкретно, необязательно замещенный фенил, необязательно замещенный нафтил, арил-С 1-6 алкил, в котором арил представляет собой необязательно замещенный фенил или необязательно замещенный нафтил; в котором необязательным заместителем является предпочтительно галоген, например хлор. Предпочтительно R3 представляет собой фенил; нафтил; фенил-C1-6 алкил или нафтил-C1-6 алкил. Шестой интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором q равно 1, 2 или 3. Более предпочтительно q равно 1 или 3. Седьмой интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором каждый R4 и R5 независимо представляет собой водород или C1-6 алкил, конкретно,C1-6 алкил, более конкретно, метил или этил. Предпочтительно R4 и R5 представляют собой метил. Восьмой интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R4 и R5 вместе с атомом азота, к которому они присоединены, образуют радикал, выбранный из группы, включающей в себя пиперидиногруппу, пиперазиногруппу, морфолиногруппу, имидазолил, триазолил, и каждое из указанных колец необязательно замещено C1-6 алкилом; более конкретно,пиперидиногруппа. Девятый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R6 представляет собой фенил, необязательно замещенный галогеном, цианогруппой илиC1-6 алкилоксигруппой; конкретно, фенил, необязательно замещенный, галогеном. Десятый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R7 представляет собой водород. Одиннадцатый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором соединение является соединением формулы (Ia). Двенадцатый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором соединение является соединением формулы (Ib) и в котором R8 представляет собой водород и R9 представляет собой оксогруппу. Тринадцатый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором соединение является соединением формулы (Ib), конкретно, в котором R8 представляет собой алкил, более конкретно, C1-6 алкил, например метил. Четырнадцатый интересный вариант осуществления относится к соединению формулы (Ia) или (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором R1 помещен в положение 6 хинолинового кольца. В рамках настоящего изобретения хинолиновое кольцо соединений формулы (Ia) или (Ib) пронумеровано следующим образом: Четырнадцатым интересным вариантом осуществления является соединение формулы (Ia) или (Ib) или их любая подгруппа, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором арил представляет собой нафтил или фенил, более предпочтительно фенил,каждый из которых необязательно замещен одним или более заместителями, выбранными из галогена,например хлора; цианогруппы; алкила, например метила; или алкилоксигруппы, например метилоксигруппы.-9 016733 Пятнадцатым интересным вариантом осуществления является применение соединения формулы(Ia) или (Ib) или их любой подгруппы, как указано выше в настоящем документе в качестве интересного варианта осуществления, для производства лекарственного средства для лечения бактериальной инфекции грамположительной и/или грамотрицательной бактерией, предпочтительно бактериальной инфекции грамположительной бактерией. Шестнадцатым интересным вариантом осуществления является применение соединения формулы(Ia) или (Ib) или их любой подгруппы, как указано выше в настоящем документе в качестве интересного варианта осуществления, для производства лекарственного средства для лечения бактериальной инфекции, в котором соединение формулы (Ia) или (Ib) имеет IC9015 мкл/мл против по меньшей мере одной бактерии, в частности грамположительной бактерии; предпочтительно IC9010 мкл/мл; более предпочтительно IC905 мкл/мл; значение IC90 определяют, как описано ниже в настоящем документе. Семнадцатый интересный вариант осуществления относится к соединению формулы (Ia) или его любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, в котором применяют одно или более, предпочтительно все, из следующий определений:R3 представляет собой арилалкил или арил; в частности фенил, нафтил или фенил-С 1-6 алкил, необязательно. замещенный галогеном;R11 представляет собой водород или C1-4 алкил, в частности водород или метил;q равно 1 или 3; р равно 1. Предпочтительно в соединениях формулы (Ia) и (Ib) или их любой подгруппе, как указано выше в настоящем документе в качестве интересного варианта осуществления, термин "алкил" представляет собой C1-6 алкил, более предпочтительно С 1-4 алкил и термин "галогеналкил" представляет собой полигалоген-C1-6 алкил. Наиболее предпочтительными соединениями формулы (Ia) являются соединения, выбранные из включая их любую стереохимически изомерную форму, их фармацевтически приемлемую соль, ихN-оксидную форму или их сольват.- 10016733 В частности, предпочтительными соединениями формулы (Ia) являются соединения 7, 33, 9 или 34(см. таблицы ниже в настоящем документе); их фармацевтически приемлемая соль, их N-оксидная форма или их сольват. Предпочтительно соединение формулы (Ia) или (Ib) является конкретной смесью энантиомеров(ниже в настоящем документе обозначенных как конкретные диастереоизомеры А и В) и, следовательно,оно существенно свободно от другого диастереоизомера (одного или более). Если соединение формулы(Ia) или (Ib) имеет два хиральных центра, это означает, что данное соединение является смесью, в частности рацемической смесью, энантиомеров (R,S) и (S,R) или смесью, в частности рацемической смесью,энантиомеров (R,R) и (S,S). Ниже в настоящем документе смеси, в частности рацемические смеси, двух энантиомеров указаны как диастереомер А или В. Обозначение рацемической смеси как А или В зависит от того, выделяют ли ее первой в протоколе синтеза (т.е. А) или второй (т.е. В). Более предпочтительно,чтобы соединение формулы (Ia) или (Ib) было конкретным энантиомером (существенно свободным от других энантиомеров). Если соединение формулы (Ia) или (Ib) имеет два хиральных центра, это означает,что данное соединение является (R,S)-, (S,R)-, (R,R)- или (S,S)-энантиомером. Ниже в настоящем документе указанные конкретные энантиомеры обозначены как А 1, А 2, В 1 или В 2. Обозначение энантиомера как А 1, А 2, В 1 или В 2 зависит от того, выделяют ли его первым или вторым (1 или 2) в протоколе синтеза, и от того, отделяют ли его от диастереомера A (A1, A2) или В (B1, B2). Фармакология. Неожиданно было показано, что соединения согласно настоящему изобретению применимы для лечения бактериальной инфекции, включая микобактериальную инфекцию, в частности заболеваний, обусловленных патогенными микобактериями, такими как Mycobacterium tuberculosis (включая его латентную и лекарственно-резистентную форму), M.bovis, M.leprae, M.avium, M.leprae и M.marinum. Настоящее изобретение также относится к соединениям формулы (Ia) или (Ib), как определено выше в настоящем документе, их фармацевтически приемлемым солям или их N-оксидным формам или их сольватам для применения в качестве лекарственного средства, в частности для применения в качестве лекарственного средства для лечения бактериальной инфекции, включая микобактериальную инфекцию. Кроме того, настоящее изобретение также относится к применению соединения формулы (Ia) или(Ib), его фармацевтически приемлемых солей или его N-оксидных форм или его сольватов, а также его любых фармацевтических композиций, как описано ниже в настоящем документе, для производства лекарственного средства для лечения бактериальной инфекции, включая микобактериальную инфекцию. Соответственно, в другом аспекте настоящее изобретение предоставляет способ лечения пациента,страдающего от (или с риском) бактериальной инфекции, включая микобактериальную инфекцию, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. В дополнение к их активности против микобактерий, соединения согласно настоящему изобретению активны и против других бактерий. В общем случае, бактериальные патогены можно классифицировать либо как грамположительные, либо как грамотрицательные патогены. Антибиотические соединения с активностью как против грамположительных, так и против грамотрицательных патогенов обычно считают обладающими широким спектром активности. Соединения согласно настоящему изобретению считают активными против грамположительных и/или грамотрицательных бактериальных патогенов, в частности против грамположительных бактериальных патогенов. В частности, настоящие соединения активны по меньшей мере против одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, более предпочтительно против одной или более грамположительных бактерий и/или одной или более грамотрицательных бактерий. Настоящие соединения имеют бактерицидную или бактериостатическую активность. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включают в себя Staphylococci (стафилококки), например S.aureus; Enterococci (энтерококки), например E.faecalis;Bacillus subtilis; Listeria (листерии), например Listeria моно-cytogenes; Haemophilus (гемофилюсы), например Н.influenza; Moraxella (моракселлы), например M.catarrhalis; Pseudomonas (псевдомонады), например Pseudomonas aeruginosa; и Escherichia (эшерихии), например Е.coli. Особенно важны грамположительные патогены, например Staphylococci (стафилококки), Enterococci (энтерококки) и Streptococci(стрептококки), вследствие развития резистентных штаммов, которые сложно лечить и которые трудно полностью уничтожить в заселенной ими больничной среде. Примерами таких штаммов являются метициллин-резистентный золотистый стафилококк (methicillin resistant Staphylococcus aureus, MRSA), метициллин-резистентные коагулазоотрицательные стафилококки (methicillin resistant coagulase negativestaphylococci, MRCNS), пенициллин-резистентный Streptococcus pneumoniae (легочный стрептококк) и множественно-резистентный Enterococcus faecium. Соединения согласно настоящему изобретению показывают активность и против резистентных бактериальных штаммов.- 11016733 Соединения согласно настоящему изобретению особенно активны против Streptococcus pneumoniaeStaphylococcus aureus, такой как, например, метициллин-резистентный Staphylococcus aureus (MRSA). В частности, соединения согласно настоящему изобретению активны против Streptococcus pneumoniae. Поэтому настоящее изобретение также относится к применению соединения формулы (Ia) или (Ib),его фармацевтически приемлемых солей или его N-оксидных форм, а также его любых фармацевтических композиций, как описано ниже в настоящем документе, для производства лекарственного средства для лечения бактериальной инфекции, включая инфекцию, обусловленную стафилококками и/или стрептококками. Соответственно, в другом аспекте настоящее изобретение предоставляет способ лечения пациента,страдающего от (или с риском) бактериальной инфекции, включая инфекцию, обусловленную стафилококками и/или стрептококками, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. Без связи с какой бы то ни было теорией полагают, что активность настоящих соединений состоит в ингибировании F1F0-ATP-синтазы, в частности в ингибировании F0-комплекса F1F0-ATP-синтазы, более конкретно, в ингибировании с-субъединицы F0-комплекса F1F0-ATP-синтазы, приводящему к гибели бактерий вследствие исчерпания клеточных уровней АТР в бактериях. Поэтому, в частности, соединения согласно настоящему изобретению активны в отношении бактерий, выживаемость которых зависит от правильного функционирования F1F0-ATP-синтазы. Бактериальные инфекции, которые можно лечить настоящими соединениями, включают в себя, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый отит среднего уха, инфекции черепных синусов, глазные инфекции, инфекции полости рта, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, мочеполовые инфекции, желудочно-кишечные инфекции, гинекологические инфекции, септицемию, инфекции костей и суставов, инфекции кожи и кожных структур, бактериальный эндокардит, ожоги, антибактериальную профилактику в хирургии, антибактериальную профилактику у иммуносупрессивных пациентов, таких как пациенты, получающие противораковую химиотерапию, или пациенты с трансплантацией органов. Везде, где в настоящем документе указано, что соединения могут лечить бактериальную инфекцию,подразумевается, что данные соединения могут лечить инфекцию, обусловленную одним или более бактериальными штаммами. Изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно настоящему изобретению. Соединения согласно настоящему изобретению могут быть оформлены в виде различных фармацевтических форм для целей введения. В качестве подходящих композиций можно указать все композиции, обычно применяемые для системно вводимых лекарственных средств. Для получения фармацевтических композиций согласно настоящему изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента соединяют в тонкой смеси с фармацевтически приемлемым носителем, который может быть весьма разнообразным по форме в зависимости от формы препарата, желательного для введения. Эти фармацевтические композиции желательны в единичной дозированной форме, подходящей, в частности, для введения перорально или посредством парентеральной инъекции. Например, при получении композиций в пероральной дозированной форме можно применять любую обычную фармацевтическую среду, такую как,например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара,каолин, разбавители, смазывающие средства, связующие, дезинтегранты и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения таблетки и капсулы представляют собой наиболее выгодные пероральные единичные дозированные формы, в случае которых, очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель будет, как правило, содержать стерильную воду, по крайней мере, в большей части, хотя можно включать и другие ингредиенты, например, для улучшения растворимости. Можно приготовить, например, инъекционные растворы, в которых носитель содержит физиологический раствор соли, раствор глюкозы или смесь физиологического раствора соли и раствора глюкозы. Можно также приготовить инъекционные суспензии, в которых можно применять соответствующие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердой форме, которые предназначены для преобразования, незадолго перед применением,в препараты в жидкой форме. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, даже более предпочтительно от 0,1 до 50 мас.% активного ингредиента (одного или более) и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, даже более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, причем все процентные доли приведены в расчете на общую массу композиции.- 12016733 Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области, например смазочное средство, стабилизатор, буферное средство, эмульгатор, регулятор вязкости, поверхностно-активное вещество, консервант, отдушку или краситель. Особенно выгодно оформлять вышеуказанные фармацевтические композиции в единичной дозированной форме для простоты введения и единообразия дозирования. Использованный в настоящем описании термин "единичная дозированная форма" относится к физически дискретным единицам, подходящим в качестве единообразных доз, причем каждая единица содержит предопределенное количество активного ингредиента, рассчитанное на производство желаемого терапевтического эффекта, вместе с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечками или покрытые оболочкой), капсулы, пилюли, порошки в пакетах, облатки, суппозитории, инъекционные растворы или суспензии и т.п. и их отдельные композиции. Ежедневная доза соединения согласно настоящему изобретению будет, конечно, меняться в зависимости от применяемого соединения, способа введения, желаемого лечения и указанного микобактериального заболевания. Однако обычно удовлетворительные результаты будут получены, когда соединение согласно настоящему изобретению вводят в ежедневной дозе, не превышающей 1 г, например в диапазоне от 10 до 50 мг/кг массы тела. Учитывая тот факт, что соединения формулы (Ia) или формулы (Ib) активны против бактериальных инфекций, настоящие соединения можно комбинировать с другими антибактериальными средствами для эффективной борьбы с бактериальными инфекциями. Поэтому настоящее изобретение также относится к комбинации (а) соединения согласно настоящему изобретению и (b) одного или более других антибактериальных агентов. Настоящее изобретение также относится к комбинации (а) соединения согласно настоящему изобретению и (b) одного или более других антибактериальных агентов для применения в качестве лекарственного средства. Настоящее изобретение также относится к применению комбинации или фармацевтической композиции, как определено непосредственно выше для лечения бактериальной инфекции. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения согласно настоящему изобретению и (b) один или более других антибактериальных агентов, также включена в настоящее изобретение. Соотношение масс (а) соединения согласно настоящему изобретению и (b) другого антибактериального средства (одного или более), когда их дают в комбинации, может определить специалист в данной области. Как хорошо известно специалистам в данной области, указанное соотношение и точная доза и частота введения зависят от применяемых конкретного соединения согласно настоящему изобретению и другого антибактериального средства (одного или более), конкретного заболевания, подлежащего лечению, тяжести заболевания, подлежащего лечению, возраста, массы тела, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также других лекарственных средств, которые может принимать индивид. Кроме того, очевидно, что эффективное ежедневное количество можно уменьшать или увеличивать в зависимости от реакции субъекта, подвергаемого лечению, и/или в зависимости от оценки врача, назначающего соединения согласно настоящему изобретению. Конкретное соотношение масс для настоящего соединения формулы (Ia) или (Ib) и другого антибактериального средства может находиться в диапазоне от 1/10 до 10/1, более конкретно от 1/5 до 5/1,даже более конкретно от 1/3 до 3/1. Соединения согласно настоящему изобретению и одно или более других антибактериальных средств можно комбинировать в одном препарате или их можно изготавливать в раздельных препаратах,так что их можно вводить одновременно, раздельно или последовательно. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение согласно настоящему изобретению и (b) одно или более других антибактериальных средств в качестве комбинированного препарата для одновременного, раздельного или последовательного применения для лечения бактериальной инфекции. Другими антибактериальными средствами, которые можно комбинировать с соединениями формулы (Ia) или (Ib), являются, например, антибактериальные средства, известные в данной области. Другие антибактериальные средства включают в себя антибиотики -лактамной группы, такие как природные пенициллины, полусинтетические пенициллины, природные цефалоспорины, полусинтетические цефалоспорины, цефаломицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины,монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как N-нуклеозиды, С-нуклеозиды, карбоциклические нуклозиды, бластицидин S; макролиды, такие как 12-членные кольцевые макролиды, 14-членные кольцевые макролиды, 16-членные кольцевые макролиды; ансамицины; пептиды, такие как блеомицины, грамицидины, полимиксины, бацитрацины, макроциклические пептидные антибиотики, содержащие лактонные связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацидины, микамицин, неокарциностатин, стендомицин, биомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин А; новобиоцин; гризеофульвин; хлорам- 13016733 феникол; митомицины; фумагиллин; монензины; пирролнитрин; фосфомицин; фузидовая кислота;D-(п-гидроксифенил)глицин; D-фенилглицин; ендиины. Специфическими антибиотиками, которые можно комбинировать с настоящими соединениями формулы (Ia) или (Ib), являются, например, бензилпенициллин (калия, прокаина, бензатина), феноксиметилпенициллин (калия), фенетициллин калия, пропициллин, карбенициллин (динатрия, фенил натрия,инданил натрия), сулбенициллин, тикарциллин динатрия, метициллин натрия, оксациллин натрия, клоксациллин натрия, диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрия,амоксициллин, циклациллин, гектациллин, сульбактам натрия, гидрохлорид талампициллина, гидрохлорид бакампициллина, пивмециллинам, цефалексин, цефаклор, цефалоглицин, цефадроксил, цефрадин,цефроксадин, цефапирин натрия, цефалотин натрия, цефацетрил натрия, цефсулодин натрия, цефалоридин, цефатризин, цефоперазон натрия, цефамандол, гидрохлорид цефотиама, цефазолин натрия, цефтизоксим натрия, цефотаксим натрия, гидрохлорид цефменоксима, цефуроксим, цефтриаксон натрия, цефтазидим, цефокситин, цефметазол, цефотетан, латамоксеф, клавулановая кислота, имипенем, азтреонам,тетрациклин, гидрохлорид хлортетрациклина, деметилхлортетрациклин, окситетрациклин, метациклин,доксициклин, ролитетрациклин, миноциклин, гидрохлорид даунорубицина, доксорубицин, акларубицин,сульфат канамицина, беканамицин, тобрамицин, сульфат гентамицина, дибекацин, амикацин, микрономицин, рибостамицин, сульфат неомицина, сульфат паромомицина, сульфат стрептомицина, дигидрострептомицин, дестомицин А, гигромицин В, апрамицин, сизомицин, сульфат нетилмицина, гидрохлорид спектиномицина, сульфат астромицина, валидамицин, касугамицин, полиоксин, бластицидин S, эритромицин, эстолат эритромицина, фосфат олеандомицина, триацетилолеандомицин, китасамицин, джозамицин, спирамицин, тилозин, ивермектин, мидекамицин, сульфат блеомицина, сульфат пепломицина, грамицидин S, полимиксин В, бацитрацин, сульфат колистина, колистинметансульфонат натрия, энрамицин, микамицин, виргиниамицин, сульфат капреомицина, виомицин, энвиомицин, ванкомицин, актиномицин D, неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, салиномицин, амфотерицин В,нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, гидрохлорид пальмитата клиндамицина, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, пальмитат хлорамфеникола, митомицин С, пирролнитрин, фосфомицин, фузидовая кислота, бикозамицин, тиамулин, сикканин. Другими агентами, которые можно комбинировать с соединениями формулы (Ia) или (Ib), являются, например, рифампицин (=рифампин); изониазид; пиразинамид; амикацин; этионамид; этамбутол; стрептомицин; парааминосалициловая кислота; циклосерин; капреомицин; канамицин; тиоацетазон; РА-824; хинолоны/фторхинолоны, такие как, например, моксифлоксацин, гатифлоксацин, офлоксацин,ципрофлоксацин, спарфлоксацин; макролиды, такие как, например, кларитромицин, клофазимин, амоксициллин с клавулановой кислотой; рифамицины; рифабутин; рифапентин; соединения, раскрытые вWO 2004/011436. Общие препаративные способы. Соединения согласно настоящему изобретению обычно можно получать, применяя последовательность стадий, каждая из которых известна специалисту. Соединения формулы (Ia) или (Ib), где R1 представляет собой С 2-6 алкенил, причем указанные соединения представлены формулой (Ia-1) или (Ib-1), можно получать по реакции промежуточного соединения (II-а) или (II-b), где W1 представляет собой приемлемую уходящую группу, такую как, например,галоген, например бром и т.п., с трибутил(С 2-6 алкенил)оловом, таким как, например, трибутил(винил)олово, в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, в присутствии подходящего растворителя, такого как, например, N,N-диметилформамид. Эту реакцию предпочтительно проводят при повышенной температуре.- 14016733 Соединения формулы (Ia) или (Ib), где R1 представляет собой R5aR4aN-, причем указанные соединения представлены формулой (Ia-2) или (Ib-2), можно получать из промежуточного соединения формулы Соединения формулы (Ia) или (Ib), где R1 представляет собой -C=N-OR11, причем указанные соединения представлены формулой (Ia-3) или (Ib-3), можно получать из промежуточного соединения формулы (III-а) или (III-b) по реакции с гидрохлоридом гидроксиламина или гидрохлоридом C1-6 алкоксиламина в присутствии подходящего растворителя, такого как, например, пиридин. Соединения формулы (Ia) или (Ib), где R1 представляет собой -CH2-NH2, причем указанные соединения представлены формулой (Ia-4) или (Ib-4), можно получать из промежуточного соединения формулы (III-а) или (III-b) восстановлением в присутствии Н 2, подходящего катализатора, такого как, например, палладий на активированном угле, и подходящего растворителя, такого как, например, NH3/спирт,например NH3/метанол. Соединения формулы (Ia) или (Ib), где R1 представляет собой R5aR4aN-CH2-, причем указанные соединения представлены формулой (Ia-5) или (Ib-5), можно получать по реакции промежуточного соединения формулы (III-а) или (III-b) с подходящим реагентом формулы R5aR4aN-H в присутствии подходящего восстановителя, такого как, например, BH3CN, подходящего растворителя, такого как, например,ацетонитрил и тетрагидрофуран, и подходящей кислоты, такой как, например, уксусная кислота. Соединения формулы (Ia) или (Ib), где R1 представляет собой аминогруппу, причем указанные соединения представлены формулой (Ia-6) или (Ib-6), можно получать по реакции промежуточного соединения формулы (IV-a) или (IV-b) с подходящим азидом, таким как, например, дифенилфосфорилазид(DPPA), и подходящим основанием, таким как, например, триэтиламин, в подходящем растворителе,таком как, например, толуол. Полученный продукт подвергают модифицированной реакции Курциуса и при добавлении триметилсилилэтанола получают карбаматное промежуточное соединение. На следующей стадии проводят реакцию этого промежуточного соединения с тетрабутиламмонийбромидом Соединения формулы (Ia) или (Ib), где R1 представляет собой аминокарбонил, моно или ди(алкил)аминокарбонил или R5aR4aN-C(=O)-, причем указанный R1 представлен группой R1a и указанные соединения представлены формулой (Ia-7) или (Ib-7), можно получать по реакции промежуточного соединения формулы (IV-a) или (IV-b) с подходящим амином, подходящим связующим реагентом, таким как, например, гидроксибензотриазол, подходящим активирующим реагентом, таким как подходящий карбодиимид, такой как, например, 1,1'-карбонилдиимидазол, или N,N'-дициклогексилкарбодиимид,или 1-(3-диметиламинопропил)-3-этилкарбодиимид, подходящим основанием, таким как, например, триэтиламин, и подходящим растворителем, таким как, например, тетрагидрофуран и метиленхлорид. Соединения формулы (Ia) или (Ib), где R1 представляет собой арилкарбонил, причем указанные соединения представлены формулой (Ia-8) или (Ib-8), можно получать по реакции на первой стадии(а) промежуточного соединения формулы (II-а) или (II-b) с подходящим арилальдегидом в присутствии н-BuLi и подходящего растворителя, такого как, например, тетрагидрофуран. Эту реакцию предпочтительно проводят при низкой температуре, такой как, например, -70 С. На следующей стадии (b) продукт,- 16016733 полученный на стадии (а), окисляют подходящими окислителями, такими как, например, оксид марганца, в присутствии подходящего растворителя, такого как, например, метиленхлорид. Соединения формулы (I-а) или (Ib) можно также получать по реакции промежуточного соединения формулы (V-a) или (V-b) с промежуточным соединением формулы (VI) согласно следующей реакционной схеме: применяя н-BuLi в смеси с подходящим основанием, таким как, например, диизопропиламин, и подходящим растворителем, таким как, например, тетрагидрофуран, где все переменные определены как в формуле (Ia) или (Ib). Перемешивание может повысить скорость реакции. Реакцию можно удобно проводить при температуре в диапазоне между -20 и -70 С. Соединения формулы (Ia) или (Ib), где q равно 2, 3 или 4, причем указанные соединения представлены формулой (Ia-9) или (Ib-9), можно также получать по реакции промежуточного соединения формулы (VII-а) или (VII-b), где q' равно 0, 1 или 2, с первичным или вторичным амином HNR4R5 в присутствии подходящего катализатора, такого как, например, Rh(cod)2BF4, необязательно в присутствии второго катализатора (для восстановления), такого как, например, Ir(cod)2BF4, в присутствии подходящего лиганда, такого как, например, Xantphos, в подходящем растворителе, таком как, например, тетрагидрофуран и спирт, например метанол, в присутствии СО и Н 2 (под давлением) при повышенной температуре. Эту- 17016733 реакцию предпочтительно проводят для промежуточных соединений формулы (VII), где q' равняется 1. Соединения формулы (Ia) или (Ib) можно также получать по реакции промежуточного соединения формулы (VIII-а) или (VIII-b), где W2 представляет собой приемлемую уходящую группу, такую как,например, галоген, например хлор или бром, с подходящим первичным или вторичным амином HNR4R5 необязательно в присутствии подходящего растворителя, такого как, например, ацетонитрил. Отыскание подходящих температур, разбавлений и продолжительности реакций для оптимизации вышеуказанных реакций для получения желаемого соединения подразумевается входящим в компетенцию специалиста в данной области. Соединения формулы (Ia) или (Ib) можно, кроме того, получать, взаимно превращая соединения формулы (Ia) или (Ib) согласно группе реакций трансформации, известных в данной области. Соединения формулы (Ia) или (Ib) можно преобразовывать в соответствующие N-оксидные формы,следуя процедурам, известным в данной области для преобразования трехвалентного азота в егоN-оксидную форму. Указанную реакцию N-окисления обычно можно проводить по реакции исходного материала формулы (Ia) или (Ib) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают в себя, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать в себя пероксикислоты, такие как, например, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты, например пероксоуксусная кислота,алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются,например, вода, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Соединения формулы (Ia) или (Ib) можно также преобразовывать в четвертичный амин по реакции с подходящим кватернизующим агентом, таким как, например, необязательно замещенныйC1-6 алкилгалогенид, арил-C1-6 алкилгалогенид, C1-6 алкилкарбонилгалогенид, арилкарбонилгалогенид,Het1-С 1-6 алкилгалогенид или Het1-карбонилгалогенид, например метилйодид или бензилйодид, в присутствии подходящего растворителя, такого как, например, ацетон, где Het1 представляет собой фуранил или тиенил; или бициклический гетероцикл, выбранный из бензофуранила или бензотиенила; каждый моноциклический и бициклический гетероцикл может необязательно быть замещенным 1, 2 или 3 заместителями и каждый заместитель независимо выбран из группы галогена, C1-6 алкила и арила. Указанные четвертичные амины представлены нижеуказанной формулой, в которой R10 представляет собойC1-6 алкил, C1-6 алкилкарбонил, арил-С 1-6 алкил, арилкарбонил, Het1-C1-6 алкил или Het1-карбонил и в кото- 18016733 рой А- представляет собой фармацевтически приемлемый противоион, такой как, например, йодид. Соединения формулы (Ia) или (Ib), где R6 представляет собой фенил, замещенный галогеном, можно преобразовывать в соединение формулы (Ia) или (Ib), где R6 представляет собой фенил, замещенный группой Het, по реакции с Het-В(ОН)2 в присутствии подходящего катализатора, такого как, например,Pd(PPh3)4, в присутствии подходящего основания, такого как, например, Na2CO3, и подходящего растворителя, такого как, например, толуол или 1,2-диметоксиэтан (DME) и спирт, например метанол. Соединения формулы (Ia-4) или (Ib-4) можно преобразовывать в соединение формулы (Ia) или (Ib),где R1 представляет собой алкилкарбониламино-СН 2-, по реакции с подходящим алкилкарбонилхлоридом в присутствии подходящего основания, такого как, например, N,N-диэтилэтанамин, и подходящего растворителя, такого как, например, метиленхлорид. Соединения формулы (Ia-4) или (Ib-4) можно преобразовывать в соединение формулы (Ia) или (Ib),где R1 представляет собой -СН 2-N-(C1-6 алкил)2, по реакции с подходящим альдегидным или кетонным реагентом, таким как, например, параформальдегид или формальдегид, в присутствии цианоборогидрида натрия, уксусной кислоты и подходящего растворителя, такого как, например, ацетонитрил. Соединение формулы (Ia), где R2 представляет собой метоксигруппу, можно преобразовывать в соответствующее соединение формулы (Ib), где R8 представляет собой водород и R9 представляет собой оксогруппу, посредством гидролиза в присутствии подходящей кислоты, такой как, например, хлористоводородная кислота, и подходящего растворителя, такого как, например, диоксан. Очевидно, что в предшествующих и в последующих реакциях продукты реакций можно выделять из реакционной среды и, если необходимо, дополнительно очищать согласно методикам, общеизвестным в данной области, таким как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакций, которые существуют более чем в одной энантиомерной форме, можно выделять из их смеси известными способами, в частности препаративной хроматографией, такой как препаративная ВЭЖХ, хиральная хроматография. Индивидуальные диастереоизомеры или индивидуальные энантиомеры можно также получать посредством сверхкритической жидкостной хроматографии (SCF). Исходные материалы и промежуточные соединения представляют собой соединения, которые являются либо коммерчески доступными, либо могут быть получены согласно традиционным реакционным процедурам, общеизвестным в данной области. Например, промежуточные соединения формулы(IIa)-(IId) могут быть получены согласно способам, описанным в WO 2004/011436, WO 2005/070924,WO 2005/070430 или WO 2005/075428, содержание которых включено в настоящий документ посредством ссылки. В частности, промежуточные соединения формулы (II-а) или (II-b) могут быть получены из промежуточного соединения формулы (IX-а) или (IX-b) и промежуточного соединения формулы (VI) согласно следующей реакционной схеме 1. Схема 1- 19016733 применяя н-BuLi в смеси с подходящим основанием, таким как, например, диизопропиламин, и подходящим растворителем, таким как, например, тетрагидрофуран, где все переменные определены, как в формуле (Ia) или (Ib). Перемешивание может увеличить скорость реакции. Реакцию удобно проводить при температуре в диапазоне между -20 и -70 С. Промежуточные соединения формулы (III-а) или (III-b) можно получать из промежуточного соединения формулы (II-а) или (II-b) по реакции с N,N-диметилформамидом в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Реакцию предпочтительно проводят при низкой температуре, например -70 С. Промежуточные соединения формулы (IV-a) или (IV-b) можно получать из промежуточного соединения формулы (II-а) или (II-b) по реакции с СО 2 в присутствии н-BuLi и подходящего растворителя,такого как, например, тетрагидрофуран. Реакцию предпочтительно проводят при низкой температуре,например -70 С. Промежуточные соединения формулы (V-a) можно получать согласно следующей реакционной схеме 2. Схема 2 в которой все переменные определены, как в формуле (Ia). Реакционная схема 2 включает в себя стадию (а), на которой соответственно замещенный анилин реагирует с соответствующим ацилхлоридом, таким как, например, 3-фенилпропионилхлорид,3-фторбензолпропионилхлорид или п-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этилендихлорид. Реакцию можно удобно проводить при температуре в диапазоне от комнатной температуры до температуры рефлюкса (кипячения с обратным холодильником). На следующей стадии (b) аддукт, полученный на стадии (а), реагирует с фосфорилхлоридом (POCl3) в присутствииN,N-диметилформамида (формилирование Вильсмейера-Хаака с последующей циклизацией). Реакцию можно удобно проводить при температуре в диапазоне от комнатной температуры до температуры рефлюкса. На следующей стадии (с-1) вводят специфическую R2-группу, где R2 представляет собой, например, C1-6 алкилоксирадикал, по реакции промежуточного соединения, полученного на стадии (b), сO-C1-6 алкилом в присутствии подходящего растворителя, такого как, например, HO-C1-6 алкил. Промежуточное соединение, полученное на стадии (b), можно также преобразовать в промежуточное соединение,в котором R2 представляет собой, например, радикал C1-6 алкилтио-, по реакции с S=C(NH2)2 в присутствии подходящего растворителя, такого как, например, спирт, например этанол, или смесь спирта с водой,необязательно в присутствии подходящего основания, такого как, например, KOH (см. стадию (с-2, с последующей реакцией с C1-6 алкил-I в присутствии подходящего основания, такого как, например,- 20016733K2CO3, и подходящего растворителя, такого как, например, 2-пропанон (см. стадию (d. Промежуточное соединение, полученное на стадии (b), можно также преобразовать в промежуточное соединение, в котором R2 представляет собой -N(R2a)(алкил), где R2a представляет собой водород или алкил, по реакции с подходящей солью NH(R2a)(алкила) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя, такого как, например, ацетонитрил (стадия (с-3. Промежуточное соединение, полученное на стадии (b), можно также преобразовать в промежуточное соединение, в котором R2 представляет собой C1-6 алкилокси-C1-6 алкилоксигруппу, необязательно замещеннуюC1-6 алкилоксигруппой, причем указанный R2 представлен группой R2b, по реакции с C1-6 алкилокси-C16 алкил-ОН, необязательно замещенным C1-6 алкилоксигруппой, в присутствии NaH и подходящего растворителя, такого как, например, тетрагидрофуран (стадия (с-4. Промежуточные соединения формулы (V-a), где R2 и R7 представляют собой водород, причем указанные промежуточные соединения представлены формулой (V-a-5), можно получать согласно следующей реакционной схеме (3), в которой на первой стадии (а) замещенный индол-2,3-дион реагирует с необязательно замещенным 3-фенилпропионовым альдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Пфитцингера), после чего соединение карбоновой кислоты декарбоксилируют на следующей стадии (b) при высокой температуре в присутствии подходящего реакционно-инертного растворителя, такого как дифениловый эфир. Схема 3 Промежуточные соединения формулы (V-a), где R6 представляет собой группу Het, причем указанные промежуточные соединения представлены формулой (V-a-6), можно получать согласно следующей реакционной схеме 3 а. Схема 3 а Реакционная схема 3 а включает в себя стадию (а), на которой соответствующий хинолиновый фрагмент реагирует с Het-С(=O)-Н, с использованием н-BuLi в смеси подходящего основания, такого как, например, 2,2,6,6-тетраметилпиперидин, и подходящего растворителя, такого как, например, тетрагидрофуран. Перемешивание может повысить скорость реакции. Реакцию можно удобно проводить при температуре в диапазоне между -20 и -70 С. На следующей стадии (b) продукт, полученный на стадии(а), преобразуют в промежуточное соединение формулы (V-a-6) по реакции с подходящей кислотой, такой как, например, трифторуксусная кислота, и триизопропилсиланом в присутствии подходящего растворителя, такого как, например, метиленхлорид. Промежуточные соединения формулы (V-b), в частности (V-b-1) или (V-b-2), можно получать согласно следующей реакционной схеме 4. Схема 4 Реакционная схема 4 включает в себя стадию (а), на которой хинолиновый фрагмент преобразуют в хинолиноновый фрагмент по реакции с подходящей кислотой, такой как, например, хлористоводородная кислота. На следующей стадии (b) вводят заместитель R8 по реакции промежуточного соединения, полученного на стадии (а), с подходящим алкилирующим агентом, таким как, например, алкилйодид, например метилйодид, в присутствии подходящего основания, такого как, например, NaOH или бензилтриэтиламмонийхлорид, подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (V-b), где R8 и R9 взяты вместе для образования радикала-CH=CH-N=, причем указанные промежуточные соединения представлены формулой (V-b-3), можно получать согласно следующей реакционной схеме 5. Реакционная схема 5 включает в себя стадию (а), на которой это промежуточное соединение реагирует с NH2-CH2-СН(ОСН 3)2. На следующей стадии (b) образуют конденсированный имидазолильный фрагмент по реакции с уксусной кислотой в присутствии подходящего растворителя, такого как, например, ксилол. Промежуточные соединения формулы (VI) представляют собой соединения, которые либо являются коммерчески доступными, либо могут быть получены согласно традиционным реакционным процедурам, общеизвестным в данной области. Например, промежуточные соединения формулы (VI) можно получать согласно следующей реакционной схеме 6. Схема 6 Реакционная схема 6 включает в себя стадию (а), на которой R3, который, конкретно, представляет собой соответственно замещенный арил, более конкретно, соответственно замещенный фенил, реагирует по реакции Фриделя-Крафта с соответствующим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как, например, AlCl3, FeCl3,SnCl4, TiCl4 или ZnCl2, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этилендихлорид. Реакцию можно удобно проводить при температуре в диапазоне между комнатной температурой и температурой рефлюкса. На следующей стадии (b) вводят аминогруппу (-NR4R5) по реакции промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином(HNR4R5). Промежуточные соединения формулы (VI) можно также получать согласно следующей реакционной схеме 7. Схема 7 Реакционная схема 7 включает с себя стадию (а), на которой R3-C(=O)-H, который является, например, соответственно замещенным арилкарбоксальдегидом, более конкретно, соответственно замещенным фенил- или нафтилкарбоксальдегидом, реагирует с соответствующим промежуточным соединением, таким как, например, 1-бром-4-хлорбутан, в присутствии реактива Гриньяра и подходящего растворителя, такого как, например, диэтиловый эфир, тетрагидрофуран. Реакцию можно удобно проводить при низкой температуре, например 5 С. На следующей стадии (b) проводят окисление в присутствии реактива Джонса в подходящем растворителе, таком как, например, ацетон. На следующей стадии (с) вводят аминогруппу (-NR4R5) по реакции промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3. В качестве альтернативы, промежуточные соединения формулы (VI) можно получать согласно следующей реакционной схеме 8. Реакционная схема 8 включает в себя стадию (а), на которой, например, подходящая кислота реагирует с NH(CH3)(OCH3) в присутствии 1,1'-карбонилдиимидазола и подходящего растворителя, такого как, например, CH2Cl2. На следующей стадии (b) продукт, полученный на стадии (а), реагирует с подходящим реактивом Гриньяра, например 4-хлорбутилмагнийбромидом, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. На следующей стадии (с) вводят аминогруппу(-NR4R5) по реакции промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3. Альтернативно, промежуточные соединения формулы (VI), где q равно 1, причем указанные промежуточные соединения представлены формулой (VI-а), можно получать согласно следующей реакционной схеме 9. Схема 9 Реакционная схема 9 включает в себя стадию, на которой подходящее ацетильное производное R3,такое как, например, ацетилциклогексан, реагирует с параформальдегидом и подходящим первичным или вторичным амином HNR4R5, предпочтительно в его солевой форме, в присутствии подходящей кислоты, такой как, например, хлористо-водородная кислота, и т.п., и подходящего растворителя, такого как, например, спирт, например этанол. Промежуточные соединения формулы (VI), где R3 представляет собой R3a'-CH2-CH2-, что возможно для тех промежуточных соединений формулы (VI), в которых R3 представляет собой алкил, арилалкил,арил-O-алкил, арилалкил-O-алкил, Het-алкил, Het-O-алкил или Het-алкил-O-алкил и R3a' является тем же,что и R3, но имеет меньше на 2 атома углерода в цепи алкила, присоединенного к остальной части молекулы, и где q представляет собой 1, причем указанные промежуточные соединения представлены формулой (VI-b), можно получать согласно следующей реакционной схеме 10. Схема 10 Реакционная схема 1) включает в себя стадию (а), на которой подходящий альдегид реагирует с ацетоном в присутствии подходящего основания, такого как, например, гидроксид натрия. На следующей стадии (b) продукт, полученный на стадии (а), реагирует с первичным или вторичным аминомHNR4R5 в присутствии СН 2(=O), подходящей кислоты, такой как, например, хлористо-водородная кислота и т.п., и подходящего растворителя, такого как, например, спирт, например этанол. На следующей стадии (с) продукт, полученный на стадии (b), гидрируют (Н 2) в присутствии подходящего катализатора,например палладия на активированном угле, и подходящего растворителя, такого как, например, вода и спирт, например этанол.- 23016733 Промежуточные соединения формулы (VII-а) можно получать согласно следующей реакционной схеме 11. Схема 11 Реакционная схема 11 включает в себя стадию реакции соответственно замещенного хинолина, в котором W2 представляет собой пригодную уходящую группу, такую как, например, галоген, например бром, с соответственно замещенным дезоксибензоином в присутствии подходящего катализатора, такого как, например, диацетат палладия, подходящего лиганда, такого как, например, X-PHOS, подходящего основания, такого как, например, карбонат цезия, подходящего растворителя, такого как, например, ксилол, в потоке N2. На следующей стадии (b) продукт, полученный на стадии (а), реагирует с подходящим реактивом Гриньяра (например, СН 2=СН-(СН 2)q-Mg-Br), таким как, например, аллилмагнийбромид, в подходящем растворителе, таком как, например тетрагидрофуран. Промежуточные соединения формулы (VII-b) можно получать соответственно. Промежуточные соединения формулы (VIII-а) можно получать согласно следующей реакционной схеме 12. Схема 12 В реакционной схеме 12 промежуточное соединение формулы (V-a) реагирует с промежуточным соединением формулы (X), для синтеза которого делаются ссылки на схемы 6, 7 и 8, в присутствии н-BuLi в подходящем растворителе, таком как, например, тетрагидрофуран, и подходящего основания,такого как, например, диизопропиламин. Перемешивание может повысить скорость реакции. Реакцию можно удобно проводить при температуре в диапазоне между -20 и -70 С. Промежуточные соединения формулы (VIII-b) можно получать соответственно. Промежуточные соединения формулы (IX-а) или (IX-b) можно получать согласно реакционным процедурам, описанным выше для промежуточных соединений (V-a) или (V-b). Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Экспериментальная часть. У некоторых соединений или промежуточных соединений не была экспериментально определена абсолютная стереохимическая конфигурация стереогенного атома углерода (одного или более) или конфигурация при двойной связи. В этих случаях стереохимически изомерную форму, которую выделяли первой, обозначали как "А", а вторую как "В", без дополнительной ссылки на действительную стереохимическую конфигурацию. Однако специалист в данной области, используя способы, известные в данной области, такие как, например, ЯМР, может однозначно охарактеризовать указанные изомерные формы"А" и "В". Подразумевается, что выбор наиболее адекватного способа определения действительной стереохимической конфигурации находится в компетенции такого специалиста. Если "А" и "В" представляют собой смеси стереохимически изомерных форм, в частности смеси энантиомеров, они могут быть разделены далее; при этом соответствующие фракции, выделенные первыми, обозначают как "А 1" или соответственно "В 1", а вторые как "А 2" или соответственно "В 2", без дополнительной ссылки на действительную стереохимическую конфигурацию. Однако специалист в данной области, используя способы, известные в данной области, такие как, например, дифракция рентгеновских лучей, может однозначно охарактеризовать указанные изомерные формы "А 1", "А 2" и "B1",- 24016733"B2", в частности указанные энантиомерные формы "A1", "A2" и "B1", "B2". В некоторых случаях, когда конечное соединение или промежуточное соединение, указанные как конкретный диастереомер или энантиомер, преобразуют в другое конечное соединение или промежуточное соединение, последние могут унаследовать от первых признак диастереомера (А или В) или энантиомера (A1, A2, B1, B2). Ниже в настоящем документе "ДМФ" означает N,N-диметилформамид, "иПА" означает изопропиламин, "ТГФ" означает тетрагидрофуран и "ДИПЭ" означает диизопропиловый эфир. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 18 а(0,116 моль) в концентрированной HCl (1,4 мл) и этаноле (48 мл) перемешивали и кипятили с обратным холодильником в течение 24 ч, затем охлаждали до комнатной температуры. Добавляли 1 н. HCl. Смесь промывали диэтиловым эфиром, подщелачивали 2 М K2CO3 и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 15-40 мкм). Собирали две фракции и выпаривали растворитель. Выход: 1,6 г промежуточного соединения 18 а (49%).b. Получение промежуточного соединения 1 н-BuLi 1,6 М в гексане (0,0056 моль) добавляли по каплям при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0564 моль) в ТГФ (10 мл) под током N2. Смесь перемешивали при -20 С в течение 20 мин, затем охлаждали до -70 С. Добавляли раствор 6-бром-2-метокси-3-(фенилметил)хинолина[654655-69-3] (промежуточное соединение 3 в WO 2004/011436) (0,0051 моль) в ТГФ (20 мл). Смесь перемешивали при -70 С в течение 90 мин. Добавляли раствор промежуточного соединения 18 а (полученного согласно A1.a) (0,0072 моль) в ТГФ (18 мл). Смесь перемешивали при -70 С в течение 3 ч. Добавляли H2O при -30 С. Смесь экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98,5/1,5/0,1; 15-40 мкм), затем на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1; 10 мкм). Собирали две фракции и выпаривали растворитель. Выход: 0,2 г фракции 1 и 0,13 г фракции 2. Обе фракции кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили. Выход: 0,146 г промежуточного соединения 1 (5%) (т.пл.=148 С) и 0,076 г промежуточного соединения 2 (3%) (т.пл.=157 С). с. Получение промежуточного соединения 14 и 15 н-BuLi 1,6 М в гексане (0,0018 моль) добавляли по каплям при -20 С к раствору диизопропиламина(0,0018 моль) в ТГФ (4 мл) под током N2. Смесь перемешивали при -20 С в течение 20 мин, затем охлаждали до -70 С. Добавляли раствор 6-бром-2-метокси-3-(фенилметил)хинолина [654655-69-3], описанного в WO 2004/011436 в качестве промежуточного соединения 3 (содержание которого включено в настоящий документ посредством ссылки), (0,0015 моль) в ТГФ (5 мл). Смесь перемешивали при -70 С в течение 90 мин. Добавляли раствор 1-фенил-5-(1-пиперидинил)-1-пентанона (0,0018 моль) в ТГФ (5 мл). Смесь перемешивали при -70 С в течение 90 мин. Добавляли H2O. Смесь экстрагировали EtOAc. Орга- 25016733 нический слой промывали насыщенным водным NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (0,9 г) очищали колоночной хроматографией на кромасиле (элюент:CH2Cl2/CH3OH/NH4OH 97/3/0,1; 10 мкм). Собирали две фракции и выпаривали растворитель. Выход: 0,085 г промежуточного соединения 14 (10%; т.пл.=129 С) и 0,133 г второй фракции (15%). Эту фракцию кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили при 60 С в вакууме. Выход: 0,05 г промежуточного соединения 15 (6%; т.пл.=166 С). Пример А 2. а-1. Получение промежуточного соединения 4 н-BuLi 1,6 M в гексане (0,0071 моль) добавляли по каплям при -70 С к раствору 25903852 соединения 190 в WO 2004/011436 (0,0028 моль) в ТГФ (17 мл) под током N2. Смесь перемешивали при -70 С в течение 1 ч. Добавляли раствор N,N-диметилформамида (0,014 моль) в ТГФ (11 мл) при -70 С. Смесь перемешивали при -70 С в течение 2 ч. Добавляли Н 2 О. Смесь экстрагировали EtOAc. Органический слой промывали насыщенным водным NaCl, сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 1,45 г промежуточного соединения 4 (диа А). Промежуточное соединение 5 получали согласно той же процедуре, что и промежуточное соединение 4, но исходя из соединения 191 в WO 2004/011436. Выход: 0,92 г промежуточного соединения 5 (диа В). а-2. Получение промежуточного соединения 3 Промежуточное соединение 3 получали согласно той же процедуре, что и промежуточное соединение 4, но исходя из соединения 66 в WO 2004/011436. Остаток кристаллизовали из ДИПЭ. Выход: 0,60 г промежуточного соединения 3 (69%; диа В). а-3. Получение промежуточного соединения 10, 11, 12 и 13 н-BuLi (1,6 М в гексанах, 14,1 мл, 0,0225 моль) добавляли по каплям при -70 С под током азота к раствору соединения 14 в WO 2004/011436 (5,0, г, 9,0 ммоль) в ТГФ (50 мл). Смесь перемешивали в течение 90 мин при -70 С, затем добавляли N,N-диметилформамид (5,5 мл, 0,072 моль). Полученную смесь перемешивали в течение 2 ч при -70 С, затем добавляли воду. Смесь экстрагировали EtOAc. Органический слой промывали водой, затем раствором соли, сушили над MgSO4, фильтровали и выпаривали досуха. Остаток кристаллизовали из диизопропилового эфира и метанола. Выход: 1,7 г промежуточного соединения 10 (38%). Промежуточное соединение 11 (диа В) получали соответственно промежуточному соединению 10,но исходя из соединения 15 (В) в WO 2004/011436. Выход: 1,0 г промежуточного соединения 11 (22%). Промежуточное соединение 12 (A1; 1R,2S) получали соответственно промежуточному соединению 10, но исходя из соединения 12 (A1; 1R,2S) в WO 2004/011436. Выход: 3,8 г промежуточного соединения 12. Промежуточное соединение 13 (А 2; 1S,2R) получали соответственно промежуточному соединению 10, но исходя из соединения 13 (А 2; 1S,2R) в WO 2004/011436.- 26016733 Выход: 2 г промежуточного соединения 13. Пример A3. Получение промежуточного соединения 6 Раствор 6-бром-2-метокси-3-(фенилметил)хинолина [654655-69-3], описанного в качестве промежуточного соединения 3 в WO 2004/011436 (2,0 г, 6,1 ммоль), морфолина (0,644 мл, 7,3 ммоль), трис(дибензилиденацетон)палладия (0,28 г, 0,31 ммоль), 2-(ди-трет-бутилфосфино)бифенила (0,18 г,0,61 ммоль) и трет-бутоксида натрия (0,82 г, 8,54 ммоль) в толуоле (20 мл) перемешивали при 80 С в течение 24 ч, затем охлаждали до комнатной температуры и выливали в воду. Органический слой экстрагировали EtOAc, промывали водой и раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (15-40 мкм, 200 г,циклогексан/EtOAc 80:20). Собирали фракции и выпаривали растворитель. Выход: 2,4 г промежуточного соединения 6 (выход: 78%). Пример А 4. а. Получение промежуточного соединения 7 н-BuLi (1,6 М в гексанах, 14,1 мл, 0,0225 моль) добавляли по каплям при -70 С под током азота к раствору соединения 14 в WO 2004/011436 (5,0 г, 9,0 ммоль) в ТГФ (50 мл). Смесь перемешивали в течение 2 ч при -70 С, затем добавляли сухой лед. Полученную смесь перемешивали в течение 1 ч при -70 С,затем добавляли воду. Осадок отфильтровывали, промывали водой, СН 3 ОН, затем СН 3 СН 2 ОН и сушили в вакууме. Выход: 0,8 г промежуточного соединения 7 (17%). Вторую фракцию получали из фильтрата. Выход: 1,3 г промежуточного соединения 7 (28%).b. Получение промежуточных соединений 8 и 9 Дифенилфосфорилазид (DPPA, 0,454 мл, 2,11 ммоль) добавляли к раствору промежуточного соединения 7 (полученного согласно А 4.а) (1,1 г, 2,11 ммоль) и триэтиламин (0,297 мл, 2,11 ммоль) в толуоле(20 мл) под током азота. Смесь перемешивали при 80 С в течение 2 ч, затем добавляли 2-(триметилсилил)этанол (0,61 мл, 4,2 ммоль). Раствор перемешивали в течение 5 ч при 80 С, затем при комнатной температуре в течение ночи. Смесь выливали в воду и экстрагировали EtOAc. Органический слой промывали водой, затем раствором соли, сушили над MgSO4, фильтровали и выпаривали досуха. Остаток (1,3 г) очищали колоночной хроматографией на силикагеле (SiO2 15-40 мкм, элюент:CH2Cl2/CH3OH/NH4OH: 98/2/0,1). Собирали чистые фракции и выпаривали растворитель. Выход: 0,46 г промежуточного соединения 8 (34%). Промежуточное соединение 9 (диа В) получали согласно той же процедуре, что и промежуточное соединение 8 (диа А), но исходя из соединения 15 в WO 2004/011436. Выход: 0,70 г промежуточного соединения 9 (52%).- 27016733 Пример А 5. а. Получение промежуточного соединения 16 и 17 н-BuLi 1,6 М в гексане (0,563 мл, 0,90 ммоль) добавляли по каплям к раствору соединения 12 вWO 2004/011436 (0,25 г, 0,45 ммоль) в ТГФ (3 мл), охлаждали при -70 С в атмосфере N2. Смесь перемешивали в течение 1 ч при -70 С и затем медленно добавляли раствор 3-бромбензальдегида (0,105 мл,0,90 ммоль) в ТГФ (0,5 мл). Реакционную смесь перемешивали в течение 1 ч при -70 С и затем разбавляли водой при -40 С. Органический слой экстрагировали этилацетатом и промывали раствором соли. После этого органический слой сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт(0,34 г) очищали хроматографией на силикагеле (15-40 мкм, 30 г, CH2Cl2/CH3OH/NH4OH 97:3:0,1). Выход: 0,11 г промежуточного соединения 16 (37%; 1R,2S). Промежуточное соединение 17 (диа А) получали согласно той же процедуре, что и промежуточное соединение 16, но исходя из соединения 14 в WO 2004/011436).Выход: 0,11 г промежуточного соединения 17 (34%).b. Получение промежуточного соединения 18 Соответственно, промежуточное соединение 18 (диа В) получали согласно той же процедуре, что и промежуточное соединение 16, но исходя из соединения 36 в WO 2004/011436. Выход: 0,13 г промежуточного соединения 18 (36%). В. Получение конечных соединений. Пример В 1. а. Получение соединений 8, 9 и 10(3 мл) нагревали в микроволновой печи (80 С, 10 мин, 100 Вт). Смесь охлаждали, выливали в водный раствор KF (10 мас.%), экстрагировали EtOAc и фильтровали через короткий слой целита. Органический слой промывали водой, затем раствором соли и сушили над MgSO4, фильтровали и выпаривали досуха. Остаток (0,26 г) очищали колоночной хроматографией на силикагеле (элюент: от 100% CH2Cl2 до смесиCH2Cl2/CH3OH/NH4OH, 98/2/0,2). Собирали чистые фракции и выпаривали растворитель. Выход: 0,018 г соединения 8 (диа А; выход: 45%, т.пл.=164 С). Соединение 9 получали согласно той же процедуре, но исходя из соединения 12 в WO 2004/011436(S,R; [843663-66-1]). Выход: 0,060 г соединения 9 (A1; 1R,2S; выход: 45%). Соединение 10 получали согласно той же процедуре, но исходя из соединения 15 в WO 2004/011436 Соединение 13 получали согласно процедуре для соединения 8, но применяя соответствующие алкиновые реагенты. Выход: 45% (диа А; т.пл.=100 С). Соединение 14 получали согласно процедуре для соединения 10, но применяя соответствующие алкиновые реагенты. Выход: 51% (диа В; т.пл.=202 С). с. Получение соединений 1 и 2 Соединение 1 получали согласно процедуре для соединения 8, но исходя из соединения 37 вWO 2004/011436 (диа А). Выход: 25% (диа А; т.пл.=184 С). Соединение 2 получали согласно процедуре для соединения 10, но исходя из соединения 36 в Соединение 11 получали согласно процедуре для соединения 8. Выход: 65% (диа А, (Е); т.пл.=190 С). Соединение 12 получали согласно процедуре для соединения 10. Выход: 47% (диа В, (Е); т.пл.=189 С). е. Получение соединений 6 и 7 Раствор промежуточного соединения 1 (0,2 г, 0,00036 моль), трибутил(винил)олова (0,21 мл,0,000725 моль) и дихлор-бис-(трифенилфосфин)палладия (0,025 г, 0,000036 моль) в ДМФ (4 мл) перемешивали в течение 10 мин при 80 С в микроволновой печи (100 Вт). Затем добавляли дополнительную порцию трибутил(винил)олова (1 экв.) и дихлор-бис-(трифенилфосфин)палладия (0,05 экв.) и смесь опять перемешивали в течение 10 мин при 80 С в микроволновой печи (100 Вт). Затем смесь охлаждали до комнатной температуры, выливали в 10% раствор KF и разбавляли в EtOAc. Смесь перемешивали в
МПК / Метки
МПК: A61K 31/496, C07D 401/04, C07D 215/14, A61P 31/04, C07D 417/04, C07D 413/04
Метки: антибактериальные, производные, хинолина
Код ссылки
<a href="https://eas.patents.su/30-16733-antibakterialnye-proizvodnye-hinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные производные хинолина</a>
Предыдущий патент: Система и способ определения средней скорости транспортных средств в целях управления дорожным движением
Следующий патент: Средства для стимуляции продуцирования iga на основе бактерий lactobacillus amylovorus и штамм бактерий lactobacillus amylovorus cp1750 ferm bp-10532
Случайный патент: Способ получения строительного отделочного материала или строительного изделия из кремнистых пород












