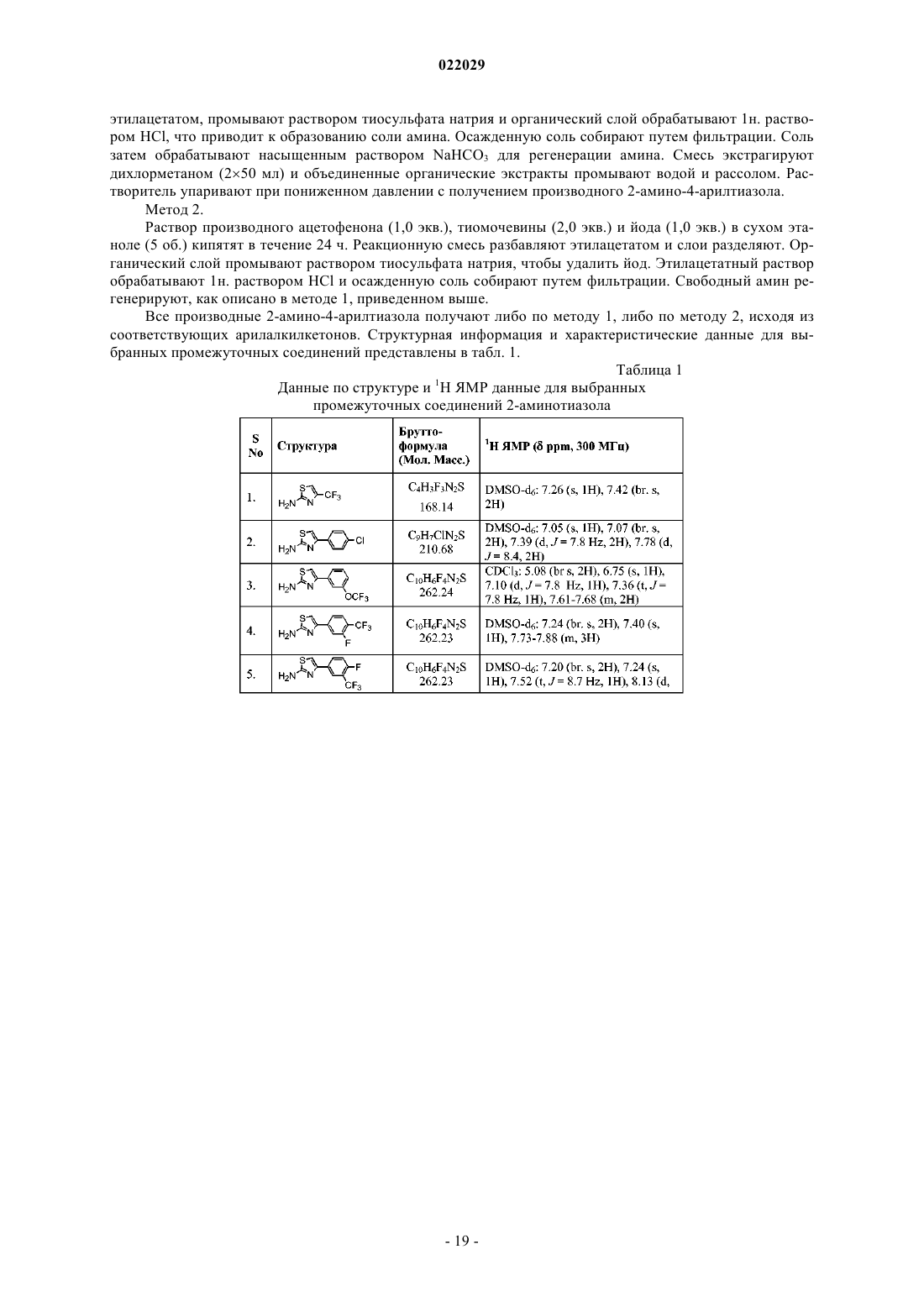
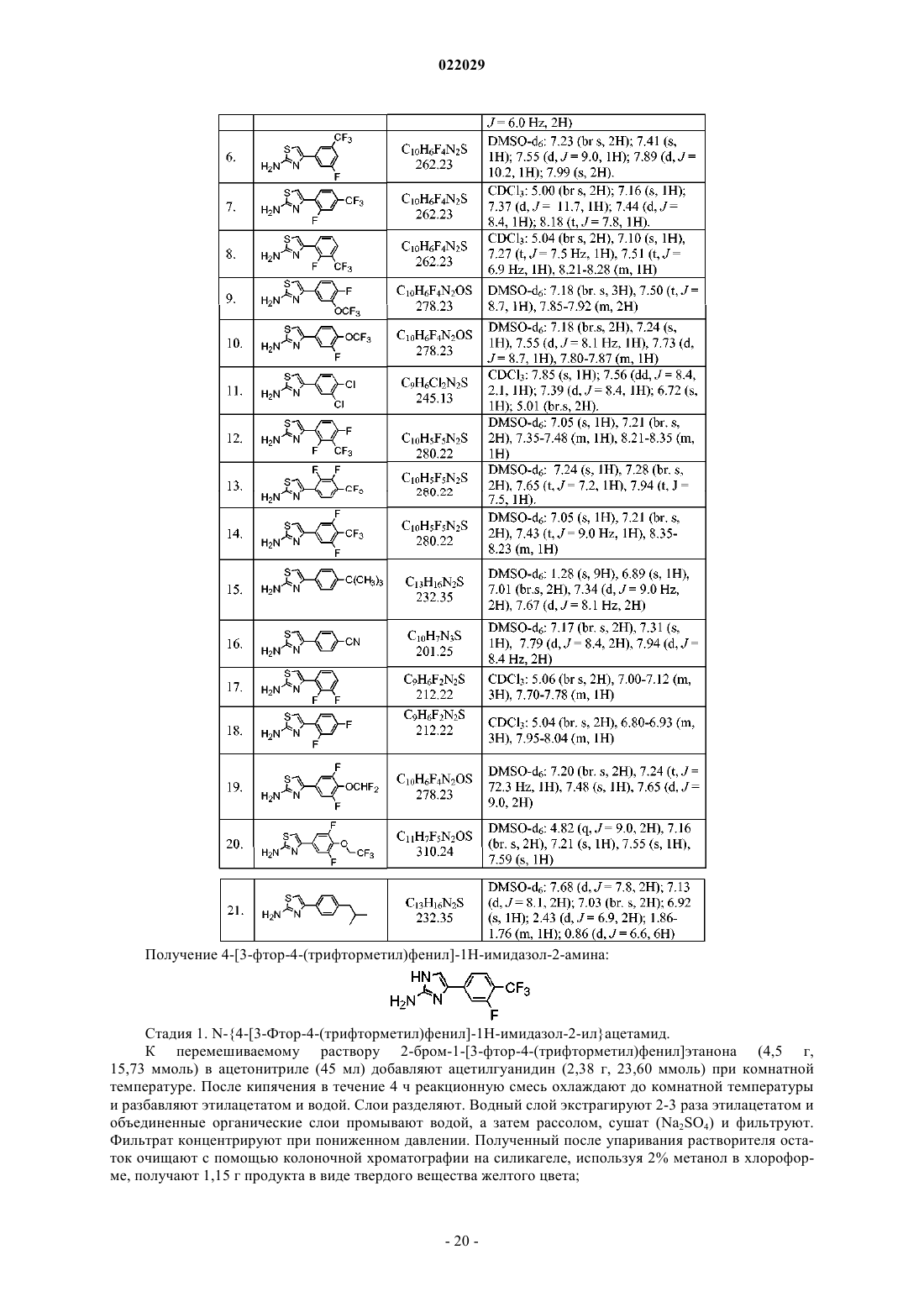
Производные тиенопиримидиндиона в качестве модуляторов trpa1
Номер патента: 22029
Опубликовано: 30.10.2015
Авторы: Мухопадхяй Индранил, Кумар Сукеерти, Вагхмар Найан Татерао, Кхайраткар-Джоши Неелима, Маргал Санджей, Томас Абрахам
Формула / Реферат
1. Соединение, имеющее структуру
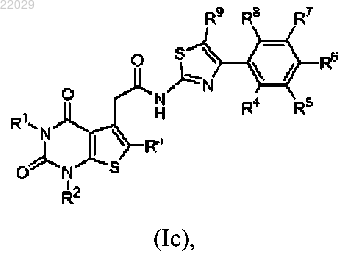
или его фармацевтически приемлемая соль,
где R1, R2 и Ra, которые могут быть одинаковыми или разными, каждый независимо, представляют собой водород или (С1-С4)алкил;
R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или разными, каждый независимо, выбраны из группы, состоящей из водорода, галогена, циано, (C1-C8)алкила, (C1-C8)алкокси, галоген(С1-С8)алкила и галоген(С1-С8)алкокси.
2. Соединение по п.1, где R1 и R2 представляют собой (С1-С4)алкил.
3. Соединение по п.2, где (С1-С4)алкил представляет собой метил.
4. Соединение по любому из пп.1-3, где R4 и R5 независимо выбраны из группы, состоящей из водорода, фтора, трифторметила и трифторметокси.
5. Соединение по любому из пп.1-4, где R6 и R7 независимо выбраны из группы, состоящей из водорода, фтора, трифторметила и трифторметокси.
6. Соединение по любому из пп.1-5, где R8 и R9 представляют собой водород.
7. Соединение, выбранное из:
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-[4-(трифторметил)-1,3-тиазол-2-ил]ацетамида;
N-[4-(4-хлорфенил)-1,3-тиазол-2-ил]-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[3-(трифторметокси)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-[4-(4-изобутилфенил)-1,3-тиазол-2-ил]ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[4-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[3-4-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[2-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[3-фтор-5-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[2-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[4-фтор-3-(трифторметокси)фенил]-1,3-тиазол-2-ил}ацетамида;
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-{4-[3-фтор-4-(трифторметокси)фенил]-1,3-тиазол-2-ил}ацетамида;
N-[4-(3,4-дихлорфенил)-1,3-тиазол-2-ил]-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
[N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамид]натрия;
N-{4-[2,3-дифтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3,5-дифтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(4-трет-бутилфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(4-хлорфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(3,4-дихлорфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(2,3-дифторфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(2,4-дифторфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[4-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[4-фтор-3-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-фтор-4-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-[4-(4-цианофенил)-1,3-тиазол-2-ил]-2-(6-этил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(6-этил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[2,4-(дифтор-3-трифторметил)фенил]-1,3-тиазол-2-ил}-2-(6-этил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[4-(дифторметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(6-этил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3,5-дифтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(6-этил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-6-пропил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[4-дифторметокси-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-6-пропил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида;
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(6-изопропил-1,3-диметил-2,4-диоксо-l,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетамида,
или их фармацевтически приемлемых солей.
8. Соединение формулы
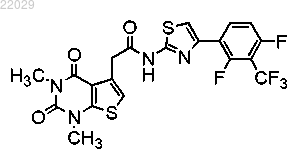
или его фармацевтически приемлемая соль.
9. Соединение формулы
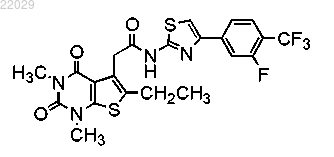
10. Соединение формулы
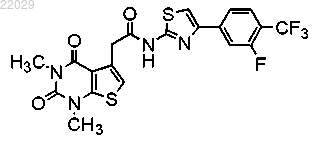
11. Соединение формулы
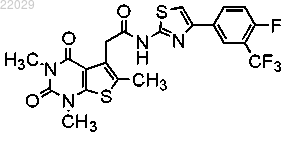
12. Соединение формулы
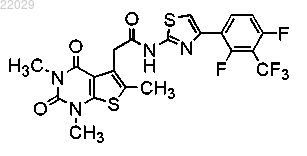
13. Фармацевтическая композиция, содержащая одно или более соединений, выбранных из любого пп.1-12, и одно или более фармацевтически приемлемых связующих, носителей, разбавителей или их смеси.
14. Способ лечения заболеваний или состояний, связанных с TRPA1 функцией у субъекта, нуждающегося в нем, включающий введение субъекту эффективного количества соединения по любому из пп.1-12.
15. Способ по п.14, отличающийся тем, что симптомы заболевания или состояния, связанного с TRPA1 функцией, выбраны из таких, как боль, хроническая боль, комплексный регионарный болевой синдром, нейропатическая боль, послеоперационная боль, боль при ревматоидном артрите, боль при остеоартрозе, боль в спине, висцеральная боль, раковая боль, алгезия, невралгия, мигрень, диабетическая нейропатия, ишиас, ВИЧ-ассоциированная нейропатия, постгерпетическая невралгия, фибромиалгия, повреждение нерва, ишемия, нейродегенеративное состояние, инсульт, постинсультная боль, рассеянный склероз, респираторные заболевания, астма, кашель, COPD (ХОБЛ), воспалительные расстройства, эзофагит, гастроэзофагеальная рефлюксная болезнь (GERD), синдром раздраженной кишки, воспалительное заболевание кишечника, тазовая гиперчувствительность, недержание мочи, цистит, ожоги, псориаз, экзема, рвота, язва желудка и двенадцатиперстной кишки и зуд.
16. Способ по п.15, отличающийся тем, что симптомы заболевания или состояния являются связанными с хронической болью.
17. Способ по п.15, отличающийся тем, что симптомы заболевания или состояния являются связанными с нейропатической болью.
18. Способ по п.15, отличающийся тем, что симптомы заболевания или состояния являются связанными с болью при ревматоидном артрите или с болью при остеоартрозе.
Текст
Изобретение относится к новым производным тиенопиримидиндиона в качестве TRPA(транзиторный рецепторный потенциал в подсемействе А) модуляторов. В частности, описанные здесь соединения являются полезными для лечения или профилактики заболеваний, условий и/или расстройств, моделируемых TRPA1 (транзиторный рецепторный потенциал подсемейства А,член 1). Также предусмотрены способы получения описанных здесь соединений, промежуточных соединений, используемых в их синтезе, их фармацевтические композиции и способы лечения или профилактики заболеваний, состояний и/или расстройств, модулируемых TRPA1. Родственные заявки Заявка на данное изобретение имеет приоритет согласно предварительной заявке 665/MUM/2009, поданной на выдачу патента Индии 23 марта 2009 г.; 2213/MUM/2009, поданной 23 сентября 2009 г.; 2906/MUM/2009, поданной 16 декабря 2009 г.; и предварительной заявке на патентUS 61/171,355, поданной 21 апреля 2009 г.; 61/251,994, поданной 15 октября 2009 г., и 61/294,470, поданной 12 января 2010 г., все положения вышеуказанных заявок включены в данное описание посредством ссылки. Область изобретения Настоящее изобретение относится к тиенопиримидиндионовому производному в качестве TRPA1 модулятора с активностью транзиторного рецепторного потенциала анкирина 1 (TRPA1). Уровень техники Каналы или рецепторы с транзиторным рецепторным потенциалом (TRP) являются болевыми рецепторами. Они классифицируются в семь подсемейств: TRPC (каноническое), TRPV (ваниллоидное),TRPM (меластатиновое), TRPP (поликистиновое), TRPML (муколипиновое), TRPA (анкириновое,ANKTM1) и TRPN (NOMPC) семейства. TRPC семейство может быть разделено на 4 подсемейства:(i) TRPC1; (ii) TRPC2; (iii) TRPC3, TRPC6, TRPC7 и (iv) TRPC4, TRPC5 на основании последовательности функциональных сходств. В настоящее время TRPV семейство имеет 6 членов. TRPV5 и TRPV6 более близки друг другу по сравнению с TRPV1, TRPV2, TRPV3 или TRPV4. TRPA1 наиболее близко кTRPV3 и более близко к TRPV1 и TRPV2, по сравнению с TRPV5 и TRPV6. TRPM семейство состоит из 8 членов. Составляющие включают основной член TRPM1 (меластатин или LTRPC1), TRPM3TRPML семейство состоит из муколипинов, которые включают TRPML1 (муколипин 1), TRPML2 (муколипин 2) и TRPML3 (муколипин 3). TRPP семейство состоит из двух групп каналов: те, что предполагают шесть трансмембранных доменов, и те, которые имеют одиннадцать. TRPP2 (PKD2), TRPP3(PKD2L1), TRPP5 (PKD2L2) - все предполагают шесть трансмембранных доменов. TRPP1 (PKD1, PC1),PKD-REJ и PKD-1L1 - все, как предполагается, имеют одиннадцать трансмембранных доменов. Единственный член TRPA семейства у млекопитающих является ANKTM1. Предполагается, что TRPA1 экспрессируется в ноцицептивных нейронах. Ноцицептивные нейроны нервной системы чувствуют периферическое повреждение и передают болевые сигналы. TRPA1 является связанным с мембраной и наиболее вероятно функционирует как гетеродимерный потенциалзависимый канал. Предполагается, что он имеет конкретную вторичную структуру, его N-конец выстроен из большого числа анкириновых повторов, которые, как полагают, образуют подобную пружине систему.TRPA1 активируется посредством множества вредоносных стимулов, включая холодные температуры(активируются при 17 С), острые природные соединения (например, горчица, корица и чеснок) и раздражители окружающей среды (MacPherson L.J. et al., Nature, 2007, 445; 541-545). Вредоносные соединения активируют TRPA1 ионные каналы посредством ковалентной модификации цистеинов до образования ковалентно связанных аддуктов. Множество эндогенных молекул, образующихся во время тканевого воспаления/повреждения, были идентифицированы как патологические активаторы TRPA1 рецептора. Они включают пероксид водорода, который продуцируется за счет оксидативного стресса, развивающегося в ходе воспаления, алкенил альдегид 4-HNE - внутриклеточный продукт пероксидации липидов и циклопентенон простагландин 15dPGJ2, который продуцируется из PGD2 в ходе воспаления/аллергического ответа. TRPA1 также активируется рецептор-зависимым образом брадикинином(BK), который высвобождается при повреждении ткани на периферических терминалях. Разница между TRPA1 и другими TRP рецепторами заключается в том, что TRPA1 лигандное связывание существует в течение нескольких часов, за счет чего физиологический ответ (например, боль) значительно продлевается. Таким образом, для диссоциации электрофильной молекулы требуется эффективный антагонист.WO 2005/089206 описывают TRP каналы в качестве мишеней для лечения боли и сходных состояний. С целью разработать лучшие анальгетики для лечения как острой, так и хронической боли и разработать способы лечения различных нейропатических и ноцицептивных состояний боли существует необходимость в более эффективном и безопасном терапевтическом лечении заболеваний, состояний и/или расстройств, модулируемых посредством TRPA1. Сущность изобретения Настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемой соли,где R1 и R2, которые могут быть одинаковыми или разными, являются независимо выбранными из водорода, замещенного или незамещенного алкила, галогеналкила, алкенила, алкинила, циклоалкила,циклоалкилалкила, арилалкила, (CRxRy)nORx, CORx, COORx, CONRxRy, (CH2)nNRxRy, (CH2)nCHRxRy иR3 является выбранным из водорода, замещенного или незамещенного алкила, алкенила, алкинила,циклоалкила, циклоалкилалкила, циклоалкенила;Z1 и Z2 независимо представляют собой серу или CRa с условием, что один из Z1 или Z2 всегда представляет собой серу и другой представляет собой CRa;Ra является выбранным из водорода, циано, галогена, замещенного или незамещенного алкила, галогеналкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, ORx, (CRxRy)nORx, CORx, COORx,CONRxRy, S(O)mNRxRy, NRxRy, NRx(CRxRy)nORx, (CH2)nNRxRy, (CH2)nCHRxRy, NRx(CRxRy)nCONRxRy,(CH2)nNHCORx, (CH2)nNH(CH2)nSO2Rx, (CH2)nNHSO2Rx, SRx и ORx;U является выбранным из замещенного или незамещенного арила, замещенных или незамещенных 5-членных гетероциклов, выбранных из группы, состоящей из тиазола, изотиазола, оксазола, изоксазола,тиадиазола, оксадиазола, пиразола, имидазола, фурана, тиофена, пирролов, 1,2,3-триазолов и 1,2,4 триазола, или замещенного или незамещенного 6-членного гетероцикла, выбранного из группы, состоящей из пиримидина, пиридина и пиридазина;V является выбранным из водорода, циано, нитро, -NRxRy, галогена, гидроксила, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила,галогеналкила, галогеналкоксила, циклоалкилалкоксила, арила, арилалкила, биарила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклилалкила, -C(O)ORx, -ORx, -C(O)NRxRy, -C(O)Rx иU и V вместе могут образовывать необязательно замещенное 3-7-членное, насыщенное или ненасыщенное циклическое кольцо, которое может необязательно содержать один или более гетероатомов,выбранных из О, S и N; в каждом случае Rx и Ry являются независимо выбранными из водорода, гидроксила, галогена, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклилалкила; в каждом случае m и n являются независимо выбранными из интервала от 0 до 2, оба включительно. В соответствии с одним воплощением обеспечивается соединение формулы (Ia) или его фармацевтически приемлемая соль,где R1 и R2, которые могут быть одинаковыми или разными, являются независимо выбранными из водорода, замещенного или незамещенного алкила, галогеналкила, алкенила, алкинила, циклоалкила,циклоалкилалкила, арилалкила, (CRxRy)nORx, CORx, COORx, CONRxRy, (CH2)nNRxRy, (CH2)nCHRxRy иRa является выбранным из водорода, циано, галогена, замещенного или незамещенного алкила, галогеналкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, ORx, (CRxRy)nORx, CORx, COORx,CONRxRy, S(O)mNRxRy, NRxRy, NRx(CRxRy)nORx, (CH2)nNRxRy, (CH2)nCHRxRy, NRx(CRxRy)nCONRxRy,(CH2)nNHCORx, (CH2)nNH(CH2)nSO2Rx, (CH2)nNHSO2Rx, SRx и ORx;U является выбранным из замещенного или незамещенного арила, замещенных или незамещенных 5-членных гетероциклов, выбранных из группы, состоящей из тиазола, изотиазола, оксазола, изоксазола,тиадиазола, оксадиазола, пиразола, имидазола, фурана, тиофена, пирролов, 1,2,3-триазолов и-2 022029 1,2,4-триазола, или замещенного или незамещенного 6-членного гетероцикла, выбранного из группы,состоящей из пиримидина, пиридина и пиридазина;V является выбранным из водорода, циано, нитро, -NRxRy, галогена, гидроксила, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила,галогеналкила, галогеналкоксила, циклоалкилалкоксила, арила, арилалкила, биарила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклилалкила, -C(O)ORx, -ORx, -C(O)NRxRy, -C(O)Rx иU и V вместе могут образовывать необязательно замещенное 3-7-членное, насыщенное или ненасыщенное циклическое кольцо, которое может необязательно содержать один или более гетероатомов,выбранных из О, S и N; в каждом случае Rx и Ry являются независимо выбранными из водорода, гидроксила, галогена, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклилалкила; в каждом случае m и n являются независимо выбранными из интервала от 0 до 2, оба включительно. Раскрытые ниже воплощения иллюстрируют настоящее изобретение и не предназначены для ограничения формулы изобретения конкретными примерами воплощений. В соответствии с одним воплощением специально предусмотренными являются соединения формулы (Ia), в которых Ra представляет собой галоген или (С 1-С 4)алкил. Согласно другому воплощению специально предусмотренными являются соединения формулы (Ia),в которых R1 и R2 представляют собой (С 1-С 4)алкил, предпочтительно метил. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ia), в которых U представляет собой замещенный или незамещенный 5-членный гетероцикл, предпочтительно тиазол, имидазол, изоксазол, пиразол или тиадиазол. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ia), в которых U представляет собой замещенный или незамещенный 6-членный гетероцикл, предпочтительно пиримидин. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ia), в которых V представляет собой замещенный или незамещенный арил, предпочтительно фенил. В данном воплощении заместителей в фениле может быть один или несколько, и они являются независимо выбранными из водорода (например, F, Cl или Br), циано, алкила (например, трет-бутил), галогеналкила(например, CF3) и галогеналкоксила (например, OCHF2, OCF3, OCH2CF3 или OCH2CH2CF3). В соответствии с одним воплощением предусмотренным является соединение формулы (Ib) или его фармацевтически приемлемая соль,где U, V, R1, R2 и Ra определены выше. Приведенные ниже воплощения иллюстрируют настоящее изобретение и не предназначены для ограничения формулы изобретения конкретными примерами воплощений. В соответствии с одним воплощением специально предусмотренными являются соединения формулы (Ib), в которых Ra представляет собой водород. Согласно другому воплощению специально предусмотренными являются соединения формулы (Ib),в которых R1 и R2 представляют собой метил. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ib), в которых U представляет собой замещенный или незамещенный 5-членный гетероцикл, предпочтительно тиазол. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ib), в которых V представляет собой замещенный или незамещенный арил, предпочтительно фенил. В данном воплощении заместителей в фениле может быть один или несколько, и они являются независимо выбранными из водорода (например, F, Cl или Br), алкила (СН 2 СН(СН 3)2), галогеналкила (например,CF3) и галогеналкоксила (например, OCHF2, OCF3 или OCH2CF3).-3 022029 В соответствии с одним воплощением предусмотренным является соединение формулы (Ic) или его фармацевтически приемлемая соль,где R1, R2 и Ra, которые могут быть одинаковыми или разными, каждый независимо, представляют собой водород или (С 1-С 4)алкил;R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или разными, являются, каждый независимо, выбранными из группы, состоящей из водорода, галогена, циано, гидроксила, нитро, амино, замещенного или незамещенного алкила, алкокси, галогеналкила, галогеналкоксила, циклоалкила, циклоалкилалкила, циклоалкенила, циклоалкилалкокси, арила, арилалкила, биарила, гетероарила,гетероарилалкила, гетероциклического кольца и гетероциклилалкила. Приведенные ниже воплощения иллюстрируют настоящее изобретение и не предназначены для ограничения формулы изобретения конкретными примерами воплощений. В соответствии с одним воплощением специально предусмотренными являются соединения формулы (Ic), в которых R1 и R2 представляют собой метил. Согласно другому воплощению специально предусмотренными являются соединения формулы (Ic),в которых R4, R5, R6 и R7 являются независимо выбранными из водорода, фтора, трифторметила или трифторметокси. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ic), в которых R8 представляет собой водород. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Ic), в которых R9 представляет собой водород. В соответствии с одним воплощением предусмотренным является соединение формулы (Id) или его фармацевтически приемлемая соль,где R1, R2, и Ra, которые могут быть одинаковыми или разными, каждый независимо, представляют собой водород или (С 1-С 4)алкил;R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или разными, являются, каждый независимо, выбранными из группы, состоящей из водорода, галогена, циано, гидроксила, нитро, амино, замещенного или незамещенного алкила, алкокси, галогеналкила, галогеналкоксила, циклоалкила, циклоалкилалкила, циклоалкенила, циклоалкилалкокси, арила, арилалкила, биарила, гетероарила,гетероарилалкила, гетероциклического кольца и гетероциклилалкила. Приведенные ниже воплощения иллюстрируют настоящее изобретение и не предназначены для ограничения формулы изобретения конкретными примерами воплощений. В соответствии с одним воплощением специально предусмотренными являются соединения формулы (Id), в которых R1 и R2 представляют собой метил. Согласно другому воплощению специально предусмотренными являются соединения формулы (Id),в которых R4, R5, R6 и R7 являются независимо выбранными из водорода, фтора, трифторметила или трифторметокси. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Id), в которых R8 представляет собой водород. Согласно еще одному воплощению специально предусмотренными являются соединения формулы(Id), в которых R9 представляет собой водород. Следует понимать, что формулы (I), (Ia)-(Id) структурно включают в себя все стереоизомеры, энантиомеры и диастереомеры и фармацевтически приемлемые соли, которые могут быть ожидаемыми, исходя из их общей химической структуры. Особым образом рассматриваются соединения по формулам (I), (Ia)-(Id), которые имеют у людей значения IC50 менее 250 нМ, предпочтительно менее 100 нМ, более предпочтительно менее 50 нМ по-4 022029 отношению к TRPA1 активности при измерении по способу, описанному в данном документе. Соединение по настоящему изобретению в качестве TRPA1 модулятора применяется здесь, поскольку оно является более селективным для одной изоформы TRP по сравнению с другими, например 2-, 5-, 10-кратно и более предпочтительно по меньшей мере 20-, 40-, 50-, 60-, 70-, 80- или по меньшей мере 100- или даже 1000-кратно более селективным для TRPA1 по сравнению с одним или более изTRPC6, TRPV5, TRPV6, TRPM8, TRPV1, TRPV2, TRPV4 и/или TRPV3. В соответствии с другим аспектом настоящее изобретение предусматривает фармацевтическую композицию, которая включает по меньшей мере одно соединение, описанное здесь, и по меньшей мере один фармацевтически приемлемый наполнитель (такой как фармацевтически приемлемый носитель или разбавитель). Предпочтительно фармацевтическая композиция включает терапевтически эффективное количество по меньшей мере одного соединения, описанного здесь. Соединения, описанные в настоящем документе, могут быть связаны с фармацевтически приемлемым наполнителем (таким как носитель или разбавитель), или разбавлены носителем, или заключены в носитель, который может быть в виде капсулы, пакетика, бумаги или другого контейнера. Соединения по настоящему изобретению могут быть введены в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Окончательная доза будет зависеть от состояния, подверженного лечению, пути введения и возраста, массы тела и состояния пациента и будет определяться решением доктора. Соединения по настоящему изобретению могут применяться в производстве лекарственных препаратов для лечения любых заболеваний, раскрытых здесь. Соединения и фармацевтические композиции,здесь описанные, пригодны для модулирования TRPA1 рецепторов, при этом модулирование, как предполагается, связано с множеством болезненных состояний. Соединение по настоящему изобретению может быть введено одно или в комбинации с другими терапевтическими агентами. Например, TRPA1 модулятор вводится совместно с одним или более противовоспалительным агентом, противоугревым агентом, агентом против морщин, агентом против рубцевания, антипсориатическим агентом, антипролиферативным агентом, противогрибковым агентом, противовирусным агентом, антисептическим агентом, противомигренозным агентом, кератолитическим агентом или ингибитором роста волос. В соответствии с другим аспектом настоящее изобретение также предусматривает способ ингибирования TRPA1 рецепторов у субъекта, который в этом нуждается, путем введения этому субъекту одного или более соединений, описанных здесь, в количестве, эффективном, чтобы вызвать ингибирование такого рецептора. Подробное описание изобретения Определения. Термины "галоген" или "гало" включают фтор, хлор, бром или йод. Термин "алкил" относится к углеводородному радикалу с прямой или разветвленной цепью, состоящей исключительно из атомов углерода и водорода, не содержащей ненасыщенности, имеющей от 1 до 9 атомов углерода, и которая присоединена к остальной части молекулы одинарной связью, например метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил и 1,1-диметилэтил (трет-бутил). Термин "C1-6 алкил" относится к алкильной цепи, имеющей от 1 до 6 атомов углерода. Если иное не будет определено в дальнейшем, все алкильные группы, описанные здесь, могут быть прямой или разветвленной цепью, замещенной или незамещенной. Термин "алкенил" относится к алифатической углеводородной группе, содержащей двойную связь углерод-углерод, которая может быть прямой или разветвленной цепью, имеющей от 2 до 10 атомов углерода, например этенил, 1-пропенил, 2-пропенил (аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил и 2-бутенил. Если иное не будет определено в дальнейшем, все алкенильные группы, описанные здесь,могут быть прямой или разветвленной цепью, замещенной или незамещенной. Термин "алкинил" относится к углеводородному радикалу с прямой или разветвленной цепью,имеющему по крайней мере одну тройную углерод-углерод связь и содержащему от 2 до приблизительно 12 атомов углерода (с радикалами, предпочтительно содержащими от 2 до приблизительно 10 атомов углерода), например этинил, пропинил и бутинил. Если иное не будет определено в дальнейшем, все алкинильные группы, описанные здесь, могут быть с прямой или разветвленной цепью, замещенными или незамещенными. Термин "алкокси" относится к прямому или разветвленному, насыщенному алифатическому углеводороднуму радикалу, связанному с атомом кислорода, который присоединен к основной структуре. Примеры алкоксигрупп включают, но не ограничиваются, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентокси, 3-метилбутокси и т.п. Если иное не будет определено в дальнейшем, все алкоксигруппы, описанные здесь, могут быть прямыми или разветвленными, замещенными или незамещенными. Термин "галогеналкил" и "галогеналкоксил" означает алкил или алкокси, в зависимости от обстоятельств может быть замещенным одним или более атомом галогена, где алкильная и алкоксигруппы оп-5 022029 ределены выше. Термин "гало" используется здесь взаимозаменяемо с термином "галоген", означающимF, Cl, Br или I. Примеры "галогеналкила" включают, но не ограничиваются, трифторметил, дифторметил,2,2,2-трифторэтил, пентафторэтил, пентахлорэтил-4,4,4-трифторбутил, 4,4-дифторциклогексил, хлорметил, дихлорметил, трихлорметил, 1-бромэтил и подобными. Примеры "галогеналкоксила" включают, но не ограничиваются, фторметокси, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, пентафторэтокси, пентахлорэтокси, хлорметокси, дихлорметокси, трихлорметокси, 1-бромэтокси и подобными. Если иное не будет определено в дальнейшем, все "галогеналкильные" и "галогеналкоксильные" группы,описанные здесь, могут быть прямыми или разветвленными, замещенными или незамещенными. Термин "циклоалкил" обозначает неароматическую моно- или полициклическую систему колец,содержащую от 3 до приблизительно 12 атомов углерода, такие как циклопропил, циклобутил, циклопентил и циклогексил. Примеры полициклических циклоалкильных групп включают, но не ограничиваются, пергидронафтильную, адамантильную и норборнильную группы мостиковые циклические группы или спиробициклические группы, например спиро(4,4)нон-2-ил. Если иное не будет определено в дальнейшем, все циклоалкильные группы, описанные здесь, могут быть замещенными или незамещенными. Термин "циклоалкилалкил" относится к циклическому содержащему кольцо радикалу, включающему от 3 до приблизительно 8 атомов углерода, непосредственно связанному с алкильной группой. Циклоалкилалкильная группа может быть присоединена к основной структуре любым атомом углерода в алкильной группе, что приводит к созданию устойчивой структуры. Неограничивающие примеры таких групп включают циклопропилметил, циклобутилэтил и циклопентилэтил. Если иное не будет определено в дальнейшем, все циклоалкилалкильные группы, описанные здесь, могут быть замещенными или незамещенными. Термин "циклоалкилалкокси" используется для обозначения алкоксигруппы, замещенной циклоалкилом, где алкокси и циклоалкил определены выше (либо в самом широком аспекте, либо в предпочтительном аспекте). Примеры циклоалкилалкоксигрупп включают циклопропилметокси, 1- или 2-циклопропилэтокси, 1-, 2- или 3-циклопропилпропокси, 1-, 2-, 3- или 4-циклопропилбутокси,циклобутилметокси, 1- или 2-циклобутилэтокси, 1-, 2- или 3-циклобутилпропокси, 1-, 2-, 3- или 4-циклобутилбутокси,циклопентилметокси,1 или 2-циклопентилэтокси,1-,2 или 3-циклопентилпропокси, 1-, 2-, 3- или 4-циклопентилбутокси, циклогексилметокси, 1- или 2-циклогексилэтокси и 1-, 2- или 3-циклогексилпропокси. Предпочтительно циклоалкилалкокси представляет собой (С 3-6)циклоалкил(С 1-6)алкокси. Если иное не будет определено в дальнейшем, все циклоалкилалкоксигруппы, описанные здесь, могут быть замещенными или незамещенными. Термин "циклоалкенил" относится к циклическому содержащему кольцо радикалу, включающему от 3 до приблизительно 8 атомов углерода, по крайней мере с одной двойной связью углерод-углерод,такому как циклопропенил, циклобутенил и циклопентинил. Если иное не будет определено в дальнейшем, все циклоалкенильные группы, описанные здесь, могут быть замещенными или незамещенными. Термин "арил" означает карбоциклическую ароматическую систему, состоящую из одного, двух,или трех колец, где такие кольца могут быть конденсированными. Если кольца являются конденсированными, одно из колец должно быть полностью ненасыщенным, и конденсированные кольца могут быть полностью насыщенными, частично ненасыщенными или полностью ненасыщенными. Термин"конденсированные" означает, что второе кольцо присутствует (например, присоединенное или образованное) и при этом имеет два смежных атома, как обычно (т.е. объединенный) с первым кольцом. Термин "конденсированный" является эквивалентным термину "соединенный". Термин "арил" охватывает ароматические радикалы, такие как фенил, нафтил, тетрагидронафтил, индан и бифенил. Если иное не будет определено в дальнейшем, все арильные группы, описанные здесь, могут быть замещенными или незамещенными. Термин "арилалкил" относится к арильной группе, как определено выше, связанной непосредственно с алкильной группой, как определено выше, например -CH2C6H5 или -C2H4C6H5. Если иное не будет определено в дальнейшем, все арилалкильные группы, описанные здесь, могут быть замещенными или незамещенными. Термин "гетероциклическое кольцо" относится к устойчивому 3-15-членному кольцевому радикалу,который состоит из атомов углерода и от 1 до 5 гетероатомов, выбранных из азота, фосфора, кислорода и серы. Для целей настоящего изобретения гетероциклический кольцевой радикал может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные, мостиковые или спирокольцевые системы и азотные, фосфорные, углеродные, кислородные атомы и атомы серы в гетероциклическом кольцевом радикале могут быть окислены до различной степени окисленности. В дополнение, атом азота может быть необязательно кватернизирован и кольцевой радикал может быть частично или полностью насыщенным (т.е. гетероцикл или гетероарил). Примеры таких гетероциклических кольцевых радикалов включают, но без ограничения, азетидинил, акридинил,бензодиоксолил, бензодиоксанил, бензофуранил, карбазолил, циннолинил, диоксоланил, индилизинил,нафтиридинил, пергидроазепинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиридил,птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетразолил, имидазолил,тетрагидроизохинолил,пиперидинил,пиперазинил,2-оксопиперазинил,2-оксопиперидинил,-6 022029 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4-пиперидонил, пирролидинил, пиразинил,пиримидинил, пиридазинил, оксазолил, оксазолинил, оксазолидинил, триазолил, инданил, изоксазолил,изоксазолидинил, морфолинил, тиазолил, тиазолинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил, октагидроиндолил, октагидроизоиндолил, хинолил, изохинолил, декагидроизохинолил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензооказолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, диоксафосфоланил, оксадиазолил, хроманил и изохроманил. Гетероциклический кольцевой радикал может быть присоединен к основной структуре по любому гетероатому или атому углерода, что приводит к формированию устойчивой структуры. Если иное не будет определено в дальнейшем, все гетероциклические кольца, описанные здесь, могут быть замещенными или незамещенными. Термин "гетероциклил" относится к гетероциклическому кольцевому радикалу, как описано выше. Гетероциклический кольцевой радикал может быть присоединен к основной структуре по любому гетероатому или атому углерода, что приводит к образованию устойчивой структуры. Если иное не будет определено в дальнейшем, все гетероциклические группы, описанные здесь, могут быть замещенными или незамещенными. Термин "гетероциклилалкил" относится к гетероциклическому кольцевому радикалу, непосредственно присоединенному к алкильной группе. Гетероциклический кольцевой радикал может быть присоединен к основной структуре по любому гетероатому или атому углерода, что приводит к образованию устойчивой структуры. Если иное не будет определено в дальнейшем, все гетероциклические группы,описанные здесь, могут быть замещенными или незамещенными. Термин "гетероарил" относится к ароматическому гетероциклическому циклическому радикалу. Гетероарильный кольцевой радикал может быть присоединен к основной структуре через любой гетероатом или атом углерода, что приводит к созданию устойчивой структуры. Если иное не будет определено в дальнейшем, все гетероарильные групп, описанные здесь, могут быть замещенными или незамещенными. Термин " гетероарилалкил " относится к гетероарильному циклическому радикалу, непосредственно связанному с алкильной группой. Гетероарилалкильный радикал может быть присоединен к основной структуре через любой атом углерода в алкильной группе, что приводит к созданию устойчивой структуры. Если иное не будет определено в дальнейшем, все гетероарилалкильные группы, описанные здесь,могут быть замещенными или незамещенными. Если не указано иное, термин "замещенный", используемый здесь, относится к замещенным одним или несколькими или любой комбинации из следующих заместителей: гидрокси, галоген, карбоксил,циано, нитро-, оксо (=О), тио (=S), замещенный или незамещенный алкил, замещенный или незамещенный галогеналкил, замещенный или незамещенный алкокси, замещенный или незамещенный галогеналкокси, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный амино, замещенный или незамещенный арил,замещенный или незамещенный гетероарил, замещенное или незамещенное гетероциклилалкильное кольцо, замещенный или незамещенный гетероарилалкил, замещенное или незамещенное гетероциклическое кольцо, замещенный или незамещенный гуанидин, -COORx', -C(O)Rx', -C(S)Rx', -C(O)NRx'Ry',-C(O)ONRx'Ry', -NRx'CONRy'Rz', -N(Rx')SORy', -N(Rx')SO2Ry', -(=N-N(Rx')Ry'), -NRxC(O)ORy', -NRx'Ry',-NRx'C(O)Ry', -NRx'C(S)Ry', -NRx'C(S)NRy'Rz', -SONRx'Ry', -SO2NRx'Ry', -ORx', -ORx'C(O)NRy'Rz',-ORx'C(O)ORy', -OC(O)Rx', -OC(O)NRx'Ry', -Rx'NRy'C(O)Rz', -Rx'ORy', -Rx'C(O)ORy', -Rx'C(O)NRy'Rz',-Rx'C(O)Ry', -Rx'OC(O)Ry', -SRx', -SORx', -SO2Rx' и -ONO2, где Rx' Ry' и Rz' независимо выбраны из водорода,замещенного или незамещенного алкила, замещенного или незамещенного алкокси, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного амино, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного гетероциклилалкильного кольца, замещенного или незамещенного гетероарилалкила или замещенного или незамещенного гетероциклического кольца. Термин "лечить" или "лечение" болезни, расстройства или состояния включает в себя (а) предупреждение или задержку появления клинических симптомов болезни, расстройства или состояния, развивающиеся у субъекта, который может страдать или быть предрасположен к болезни, расстройству или состоянию, но еще не испытывающий или проявляющй клинических или субклинических признаков болезни, расстройства или состояния; (б) ингибирование болезни, расстройства или состояния, т.е. остановка или сокращения развития болезни или по крайней мере одного из клинических или субклинических симптомов; или (с) облегчение болезни, т.е. вызывая регрессию болезни, расстройства или состояния или по крайней мере одно из ее клинических или субклинических симптомов.-7 022029 Термин "субъект" включает в себя млекопитающих (главным образом людей) и других животных,таких как одомашненные животные (например, домашние питомцы, включая кошек и собак) и неодомашненные животные (например, дикие животные)."Терапевтически эффективное количество" обозначает количество соединения, которое при введении субъекту для лечения состояния, расстройства или условия является достаточным, чтобы произвести такое лечение. "Терапевтически эффективное количество" будет варьироваться в зависимости от соединения, заболевания и его тяжести и возраста, веса, физического состояния и реагирования субъекта, подлежащего лечению. Соединения, описанные в настоящем документе, могут образовывать соли. Неограничивающие примеры фармацевтически приемлемых солей, образующие часть данного патента, включают соли, полученные из неорганических основных солей органических оснований, солей хиральных оснований, солей природных аминокислот и солей неприродных аминокислот. Некоторые соединения настоящего изобретения, в том числе соединения формулы (I), (Ia)-(Id) способны существовать в стереоизомерных формах (например, диастереомеры и энантиомеры). Настоящее изобретение включает в себя эти стереоизомерные формы (в том числе диастереомеры и энантиомеры) и их смеси. Различные стереоизомерные формы соединений настоящего изобретения могут быть отделены друг от друга способами, известными в данной области, или данный изомер может быть получен стереоспецифическим или асимметрическим синтезом. Таутомерные формы, а также смеси соединений, описанных здесь также рассматриваются. Фармацевтические композиции. Фармацевтическая композиция в настоящем документе включает по меньшей мере одно соединение, описанное здесь, и по меньшей мере один фармацевтически приемлемый наполнитель (такой как фармацевтически приемлемый носитель или разбавитель). Предпочтительно фармацевтическая композиция включает соединение(я), описанное здесь, в количестве, достаточном для ингибирования TRPA1 у субъекта (например, человека). Ингибиторная активность соединений, соответствующих формулам (I),(Ia)-(Id), может быть измерена с помощью исследования, приведенного ниже. Соединение по настоящему изобретению может быть связано с фармацевтически приемлемым наполнителем (таким как носитель или разбавитель), или быть растворенным в носителе, или заключенным в носитель, который может быть в виде капсулы, пакетика, бумаги или другого контейнера. Фармацевтические композиции могут быть приготовлены с помощью методик, известных специалистам в данной области. Например, активное соединение может быть смешано с носителем, или растворено в носителе, или заключено в носитель, который может быть в виде ампулы, капсулы, пакетика, бумаги или другого контейнера. Когда носитель служит разбавителем, он может быть твердым, полутвердым или жидким веществом, которое действует как носитель, наполнитель или среда для активного соединения. Активное соединение может быть адсорбировано на гранулированном твердом контейнере,например в пакетике. Фармацевтические композиции могут быть в традиционной форме, например капсулы, таблетки,аэрозоли, растворы, суспензии или препараты для местного применения. Способы лечения. Соединения и фармацевтические композиции по настоящему изобретению могут быть введены для лечения любого расстройства, состояния или заболевания, поддающегося лечению путем ингибированияTRPA1. Например, соединения и фармацевтические композиции настоящего изобретения являются подходящими для лечения или профилактики следующих заболеваний, состояний и расстройств, опосредованных или связанных с активностью TRPA1 рецепторов: боль, хроническая боль, комплексный регионарный болевой синдром, нейропатическая боль, послеоперационная боль, боль при ревматоидном артрите, боль при остеоартрозе, боль в спине, висцеральная боль, раковая боль, алгезия, невралгия, мигрень,нейропатии, вызванные химиотерапией нейропатии, раздражение глаза, раздражение бронхов, кожное раздражение (атопический дерматит), обморожение, спастичность, кататония, каталепсия, паркинсонизм,диабетическая нейропатия, ишиас, ВИЧ-ассоциированная нейропатия, постгерпетическая невралгия,фибромиалгия, повреждение нерва, ишемия, нейродегенеративное состояние, инсульт, постинсультная боль, рассеянный склероз, респираторные заболевания, астма, кашель, ХОБЛ, воспалительные расстройства, эзофагит, гастроэзофагеальная рефлюксная болезнь (GERD), синдром раздраженной кишки, воспалительное заболевание кишечника, тазовая гиперчувствительность, недержание мочи, цистит, ожоги,псориаз, экзема, рвота, язва желудка и двенадцатиперстной кишки и зуд. Связь между терапевтическим эффектом и ингибированием TRPA1 продемонстрирована, например, в Story, G.M. et al. Cell, 2003, 112,819-829; McMahon, S.B. и Wood, J.N., Cell, 2006, 124, 1123-1125; Voorhoeve, P.M. et al. Cell, 2006, 124,1169-1181; Wissenbach, U., Niemeyer, В.А. и Flockerzi, V. Biology of the Cell, 2004, 96, 47-54 и в источниках, на которые они ссылаются. Боль может быть острой или хронической. В то время как острая боль обычно является самоограничивающейся, хроническая боль существует в течение 3 месяцев или более и может приводить к существенным изменениям в личности пациента; образ жизни, функциональные способности и общее качество жизни (K.M. Foley, Pain, in Cecil Textbook of Medicine; J.C. BennettF. Plum (eds.), 20th ed., 1996, 100-8 022029 107). Ощущение боли может быть запущено посредством некоторого количества физических или химических раздражителей, и чувствительные нейроны, которые опосредуют ответ на этот вредоносный раздражитель, обозначаются термином "ноцицепторы". Ноцицепторы являются первичными чувствительными афферентными нейронами (с С и А волокнами), которые активируются под действием широкого спектра вредоносных раздражителей, включая химические, механические, термические и кислотные(рН 6) воздействия. Ноцицепторы являются нервами, которые воспринимают и реагируют на части тела,которые подверглись повреждению. Они сигнализируют о раздражении ткани, предстоящем повреждении или настоящем повреждении. При активации они передают болевые сигналы (через периферические нервы и через спинной мозг) в головной мозг. Хроническая боль может быть классифицирована либо как ноцицептивная, либо как нейропатическая. Ноцицептивная боль включает боль, вызванную повреждением ткани, и воспалительную боль, такую как боль, связанную с артритом. Нейропатическая боль вызывается повреждением чувствительных нервов периферической или центральной нервной системы и поддерживается искаженным соматосенсорным восприятием. Боль обычно хорошо локализована, постоянная и часто имеет ноющий или пульсирующий характер. Висцеральная боль является подтипом ноцицептивной боли, которая затрагивает внутренние органы. Она имеет тенденцию быть эпизодической и слаболокализованной. Ноцицептивная боль обычно ограничена по времени, так что, когда повреждение ткани заживает, боль обычно проходит(артрит является явным исключением, при котором боль не ограничена по времени). Общие методы получения. Описанные здесь соединения, включающие соединения общей формулы (I), (Ia)-(Id) и конкретные примеры, получают с использованием методов, известных специалистам в данной области, посредством последовательности реакций, изображенной на схемах 1-10, а также другими методами. Кроме того, в следующих синтетических схемах, в которых приведены конкретные кислоты, основания, реагенты,конденсирующие агенты, растворители и др., следует понимать, что другие подходящие кислоты, основания, реагенты, конденсирующие агенты и др., могут быть использованы и включены в объем настоящего изобретения. Соединения, полученные с помощью общих последовательностей реакций, могут быть недостаточно чистыми. Эти соединения могут быть очищены с помощью одного из методов для очистки органических соединений, известных специалистам в данной области, например кристаллизацией или колоночной хроматографией на силикагеле или оксиде алюминия с использованием различных растворителей в подходящих соотношениях. Все возможные стереоизомеры предусмотрены в рамках данного изобретения Общий подход к синтезу тиенопиримидинилацетамидов общей формулы (I), где Z1, Z2, R1, R2, R3,U, V и L определены выше в описании, раскрыт, как описано на схеме 1. Реакция связывания соединений формулы (1) с аминами формулы (2) в присутствии подходящего конденсирующего агента, такого как гидрохлорида 1-этил-3-(3'-диметиламинопропил)карбодиимида (EDCI), и основания в подходящем растворителе дает соединения формулы (3). Селективное N-алкилирование соединений формулы (3) подходящим алкилирующим агентом формулы (4) в присутствии основания и растворителя дает соединения общей формулы (I). Схема 1base - основание; solvent - растворитель. Общий подход к синтезу тиено[2,3-d]пиримидинил ацетамидов общей формулы (Ia), где R1, R2, U иV имеют значения, указанные выше, раскрыт, как описано на схеме 2. Синтез начинается из имеющейся в продаже 1,3-диалкилбарбитуровой кислоты формулы (5). Известный 6-хлор-5-формил-1,3 диметилурацил (6) получают в соответствии с описанной методикой (Singh, J.S. et al., Synthesis, 1988,342-344) путем формилирования промежуточного соединения (5) с помощью POCl3 и ДМФА. Обработка 6-хлор-5-формил-1,3-диалкилурацила (6) гидроксиламином в метаноле с последующей дегидратацией с помощью оксихлорида фосфора дает 6-хлор-5-циано-1,3-диметиурацил формулы (7). Обработка соединений формулы (7) с помощью алкилмеркаптоацетата формулы (8) (где R представляет собой алкил) в присутствии подходящего основания дает по реакции сочетания аминоэфир формулы (9) с последующейin situ циклизацией. Это превращение является аналогичным описанному Motoi, Y. et al., J. HeterocyclicChem., 1990, 717-721. Аминоэфир (9) при диазотировании с последующим замещением на галоген с помощью галогенида меди (например, бромида меди или йодида меди) дает промежуточное соединение формулы (10), где X представляет собой галоген. Арилгалогенид формулы (10) в реакции с пинаколовым эфиром аллилбороновой кислоты формулы (11) в присутствии палладиевых катализаторов, таких как бис-(трифенилфосфин)дихлорид палладия или тетракис-(трифенилфосфин)палладия(0), дает аллиловую-9 022029 производную формулы (12) [например, аналогично методике сочетания по Судзуки-Мияуры, описаннойKotha, et al., Synlett, 2005, 12, 1877-1890]. Гидролиз и декарбоксилирование аллильных производных тиофена формулы (12) с использованием меди в присутствии хинолина при повышенной температуре дает аллиловый тиенопиримидиндион формулы (14) [аналогичная методика описана Ludo., E.J. Kennis. etal. in Biorg.Med. Chem. Lett., 2000, 10, 71-74 и Mashraqui, S.H. et al., Tetrahedron, 2005, 61, 3507-3513]. Озонолиз соединений формулы (14) в метаноле в щелочной среде с последующим гидролизом эфира (15) с помощью водного раствора кислоты дает соединения формулы (16). (Это преобразование аналогично описывается Mohler, D.L. et al., Synthesis, 2002, 745-748). Связывание соединений формулы (16) с соответствующими аминами формулы (2), используя стандартный метод связывания амидов, дает соединения общей формулы (Ia'). Схема 2t-butyl nitrite - трет-бутилнитрит; hydrolysis - гидролиз; decarboxylation - декарбоксилирование; amidation - амидирование. Подход к синтезу тиено[2,3-d]пиримидинил ацетамидов формулы (Ia), где Ra представляет собой алкильную группу (например, метил, этил, пропил, изопропил) и R1, R2, U и V имеют значения, указанные выше, представлен на схеме 3. Функцианализированный тиофен формулы (18) получают "in one pot" 3-компонентной реакцией связывания (синтез Гевальда), используя малононитрил, соответствующий альдегид и порошкообразную серу (Byrn, S.R. et al., J. Pharm, Sci., 2001, 90, 371). Соединение формулы(18) превращают в соединения формулы (19) путем последовательных превращений хорошо известных в области органического синтеза. Циклизация соединений формулы (19) с тиофосгеном дает соединения формулы (20), которые в результате селективного N-алкилирования дает соединения формулы (21). Галогенирование соединений формулы (21) (например, N-бромсукцинимидом или N-йодсукцинимидом в присутствии BF3-эфирата или трифторметансульфокислоты) дает соединения формулы (22). Данное превращение соответствует методике, описанной George, О.L. et al., J. Am. Chem. Soc., 2004, 126, 1577015776. Сочетание Сузуки-Мияура арилгалогенидов формулы (22) с аллилбороновыми кислотами формулы (11) в присутствии Pd(0) приводит к аллилтиофенам формулы (23), как описано на схеме 1. Превращение соединений формулы (23) в соединения формулы (24) может быть выполнено методами, хорошо известными специалистам в данной области [например, Postema, M.H.D. et al. in J. Org. Chem., 2003, 68,4748-4754]. Соединения формулы (24) могут быть преобразованы в соединения формулы (25) окислительными методами, хорошо известными в литературе. Связывание соединений формулы (25) с соответствующими аминами формулы (2), используя стандартный метод связывания амидов, дает соединения общей формулы (Ia).triphosgene - трифосген, solvent - растворитель; etherate - эфират; oxidation - окисление; amidation амидирование Общий подход к синтезу тиено[3,4-d]пиримидинил ацетамидов формулы (Ib'), где R1, R2, U и V определены выше, раскрыт, как показано на схеме 4. Известные производные 6-метилурацила (26) могут быть получены двумя различными методами. В одном подходе N,N-диметилмочевина конденсируется с уксусным ангидридом в присутствии пиридина, как сообщает Egg, H. et al., Synthesis, 1982, 1071-1073. Альтернативно, промежуточное соединение (26) может быть получено путем алкилирования 6-метилурацила в соответствии с методикой, сообщенной Siverman, R.В. et al., J. Am. Chem. Soc, 1982,104, 6434-6439. Ацилирование по Фриделю-Крафтсу промежуточного соединения (26) в присутствии каталитического количества кислоты Льюиса, например ZnCl2, дает соединения формулы (27). Аналогичная методика сообщается Tsupak, Е.В. et al., J. Chemistry heterocyclic compounds, 2003, 39, 953-959. Циклизация соединения формулы (27) синтезом по Гевальду дает ожидаемый 5-метилтиено[3,4d]пиримидиндион формулы (28), как описано у Tormyshey, V.М. et al., Synlett, 2006, 2559-2164. Реакция соединений формулы (28) с диалкилкарбонатом в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе дает диэфир формулы (29). Деалкоксикарбонилирование соединений формулы (29), используя подходящее основание, такое как гидрид натрия или, используя смесьDMSO/NaCl/вода, приводит к требуемому эфиру тиено[3,4-d]пиримидиндиона формулы (30). Реакция связывания эфира формулы (30) с соответствующими аминами формулы (2), используя подходящее основание, такое как гидрид натрия, в присутствии подходящего растворителя, такого как сухой толуол или ксилол, дает соединения общей формулы (Ib'). Схема 4sulphur - сера, base - основание, solvent - растворитель. Еще один подход к синтезу тиено[3,4-d]пиримидинил ацетамидов формулы (Ib), где Ra представляет собой алкильные группы, такие как метил, этил, пропил и др., и R1, R2, U и V имеют значения, указанные выше, раскрыт, как показано на схеме 5. Производное урацила (26), полученное, как описано на схеме 4, обрабатывают алкилгалогенидом формулы RaX в присутствии подходящего основания, такого как диизопропиламид лития, что дает соединения формулы (31). Подобный подход описан у Hiriyakkanavar,J. et al., Tetrahedron Lett. 1992, 33(41), 6173-6176. Ацилирование по Фриделю-Крафтсу промежуточных соединений формулы (31) дает кетон (32). Циклизация соединений формулы (32) методом синтеза по Гевальду дает требуемый тиено[3,4-d]пиримидиндион формулы (33). Соединения формулы (33) могут быть превращены в эфиры формулы (34) по реакции (33) с диалкилкарбонатом в присутствии сильного основания, такого как гидрид натрия, с последующим деалкоксикарбонилированием, как описано на схеме 4. Реакция сочетания эфиров формулы (34) с соответствующими аминами формулы (2), используя подходящее основание, такое как гидрид натрия, в присутствии подходящего растворителя, такого как сухой толуол или ксилол, дает соединения общей формулы (Ib).sulphur - сера, base - основание, solventрастворитель. Альтернативный подход к синтезу тиено[3,4-d]пиримидинил ацетамидов формулы (Ib'), где R1, R2,U и V определены выше, представлен на схеме 6. Формилирование производного урацила (26) с помощью оксихлорида фосфора и сухого ДМФА дает 5-формильное производное формулы (35), как описано у Shirahashi, M. et al., Yakugaku Zasshi, 1971, 91, 1372. Обработка 5-формильного производного (35) с помощью гидрохлорида гидроксиламина с последующей дегидратацией с помощью оксихлорида фосфора дает 5-цианопроизводное формулы (36). Аналогичный подход сообщает Hirota, K. et al., Heterocycle,1998, 47, 871-882). Аминотиофен формулы (37) получают по реакции промежуточного соединения формулы (36) с порошкообразной серой и морфолином в условиях реакции Гевальда. Аминотиофен (37) в результате диазотирования с последующим замещением галогена с помощью галогенида металла, такого как бромид меди или йодид меди, приводит к галогенпроизводному формулы (38). Арилгалогенид формулы (38) может быть превращен в аллилтиофен формулы (39) по реакции сочетания Судзуки-Мияуры с пинаколовым эфиром аллилбороновой кислоты формулы (11) в присутствии катализатора Pd(0). Аллилтиофен формулы (39) может быть превращен в тиено[3,4-d]пиримидинил уксусную кислоту формулы(40) путем окислительного расщепления терминальной двойной связи, как показано на схеме 1. Связывание соединений формулы (40) с аминами общей формулы (2), используя стандартный метод связывания амидов, дает соединения общей формулы (Ib'). Схема 6reflux - нагревание при кипении; morpholine - морфолин; ethanol - этанол; diazotization - диазотирование; oxidation - окисление, amidation - амидирование. Общий подход к синтезу соединений формулы (Ic) или (Id), где Ra представляет собой галоген или алкил, R1, R2, R4, R5, R6, R7 R8 и R9 имеют значения, указанные выше, получают, как показано на схеме 7. Связывание соединений формулы (25) с соответствующими аминами формулы (46), используя стандартный метод сочетания амидов, будет давать соединения общей формулы (Ic). Аналогичное сочетание соединений формулы (40) с соответствующими аминами формулы (46), используя стандартный метод сочетания амидов, будет давать соединения общей формулы (Id).amidation - амидирование. Схема 8 изображает синтез 2-амино-4-арилтриазолов формулы (46) (где R4, R5, R6, R7 R8 и R9 имеют значения, указанные выше), которые получают из ацетофенонов формулы (45), используя известные подходы. Некоторые ди- и тризамещенные ацетофеноны не являются коммерчески доступными и их получают из соответствующих производных бензойной кислоты формулы (41) в три стадии. Таким образом, кислоту формулы (41) превращают в соответствующий хлорангидрид формулы (42), используя оксалилхлорид в присутствии каталитических количеств ДМФА в сухом дихлорметане. Хлорангидрид формулы (42) превращают в соответствующий амид Вайнбера формулы (44) путем обработки егоN,О-диметилгидрохлоридом гидроксиламина формулы (43) в присутствии подходящего основания, такого как триэтиламин. Добавление алкилмагний йодида к амиду Вайнбера формулы (44) приводит к производному ацетофенона формулы (45). Превращение производного ацетофенона формулы (45) в 2-амино-4-замещенный аритиазол формулы (46) может быть осуществлено двумя подходящими способами, описанными на схеме 8. В первом случае ацетофенон превращают в соответствующий фенацилбромид, который, в свою очередь, реагирует с тиомочевиной в подходящем растворителе, таком как тетрагидрофуран, при кипячении. Альтернативно, производное ацетофенона формулы (45) может быть превращено в 2-амино-4-арилтиазол (46) в одну стадию, путем его реакции с тиомочевиной и йодом в кипящем этаноле (Carroll, K. et al., J. Am. Chem.base - основание, solvent - растворитель; ether - эфир; thiourea - тиомочевина. Синтез 2-амино-4-арилимидазоламина формулы (48) (где R4, R5, R6, R7 R8 и R9 имеют значения, указанные выше) описан на схеме 9. Таким образом, реакция производного ацетофенона формулы (45) с бромом в уксусной кислоте дает фенацилбромид, который реагирует с ацетилгуанидином в ацетонитриле при температуре кипения, что дает N-ацетилимидазол формулы (47). N-Деацетилирование (47) в кислой среде дает 2-амино-4-арилимидазолы формулы (48). Аналогично методике, описанной у Thomas, L. et al.,J. Org. Chem., 1994, 59, 7299-7305. Схема 9guanidine acetate - ацетат гуанидина; solvent - растворитель; deaxetylation - деацетилирование. Некоторые из 5-амино-3-фенилпиразолов, используемые для синтеза соединений настоящего изобретения, являются коммерчески доступными. Коммерчески недоступные 3-амино-1-арилпиразолы получают, как показано на схеме 10. Реакция производного фенилгидразина формулы (49) с акрилонитри- 13022029 лом в присутствии подходящего основания, такого как этоксид натрия или метоксид натрия, в кипящем этаноле дает дигидропроизводное соединения формулы (50). Промежуточное соединение (50) в результате окисления с помощью N-бромсукцинимида, как описано у Duffin, G.F. et al., J. Chem. Soc., 1954, 408415, дает производные 3-амино-1-арилпиразолов формулы (51) (где R4, R5, R6, R7 и R8 имеют значения,указанные выше). Схема 10reflux - кипячение; toluene - толуол. Экспериментальные данные Если не указано иное, обработка включает в себя распределение реакционной смеси между органической и водной фазой, указанной в скобках, разделение слоев и сушку органического слоя над сульфатом натрия, фильтрацию и упаривание растворителя. Очистка, если иное не указано, включает в себя очистку хроматографическими методами с помощью силикагеля, обычно используя смесь этилацетат/петролейный эфир подходящей полярности в качестве подвижной фазы. Использование отличных элюирующих систем указывается в круглых скобках. В тексте используются следующие сокращения: ДМСО-d6: гексадейтеродиметилсульфоксид;AcOEt: этилацетат; экв. или eq.: эквиваленты. Промежуточные соединения Промежуточное соединение 1. Стадия 1. 6-Хлор-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксальдегид. Оксихлорид фосфора (690 мл) медленно добавляют к сухому N,N-диметилформамиду (180 мл) при 0 С. Смеси затем дают нагреться до комнатной температуры. 1,3-Диметилбарбитуровую кислоту (60 г,384,27 ммоль) добавляют порциями и кипятят в течение 45 мин. Избыток оксихлорида фосфора и ДМФА отгоняют при пониженном давлении и вязкий остаток выливают в ледяную воду (2000 мл). Реакционной смеси дают нагреться до комнатной температуры и экстрагируют с помощью хлороформа (3500 мл). Объединенные органические субстраты сушат над Na2SO4 и концентрируют. Полученное сырое вещество затем перемешивают в 10% этилацетате в гексане (150 мл) и получают 58 г продукта в виде твердого вещества бледно-желтого цвета; 1 Н ЯМР (300 МГц, CDCl3)3,41 (s, 3 Н), 3,69 (s, 3H), 10,18 (br s, 1H). Стадия 2. 6-Хлор-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбоксальдегид оксим. К смеси промежуточного соединения по стадии 1 (56 г, 262,37 ммоль) и гидрохлорида гидроксиламина (22,8 г, 327,97 ммоль) в метаноле (525 мл) по каплям добавляют раствор KOH (18,3 г,327,97 ммоль) в воде (32 мл) в течение 1 ч, в течение этого времени температуру реакционной смеси поддерживают ниже 10 С. Смесь перемешивают при комнатной температуре 1 ч и результирующий осадок оксима собирают путем фильтрации, промывают водой (2250 мл), метанолом (2150 мл) и сушат,что дает 46,3 г продукта в виде твердого вещества бледно-желтого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,51 (s, 3 Н), 7,94 (s, 1H), 11,40 (br s, 1H). Стадия 3. 6-Хлор-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбонитрил. Промежуточное соединение по стадии 2 (46 г, 263,48 ммоль) порциями добавляют к оксихлориду фосфора (410 мл) при комнатной температуре и реакцию перемешивают далее в течение 2 ч. Избыток оксихлорида фосфора упаривают при пониженном давлении. Полученный сырой остаток промывают диэтиловым эфиром несколько раз и затирают с водой. Полученное твердое вещество фильтруют, промывают метанолом и сушат, что дает 33,4 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,38 (s, 3 Н), 3,69 (s, 3 Н).- 14022029 Стадия 4. Этил 5-амино-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6 карбоксилат. Смесь промежуточного соединения по стадии 3 (32 г, 160,00 ммоль), этилмеркаптоацетата (19,4 мл,176,88 ммоль) и безводного карбоната натрия (17,0 г, 105,99 ммоль) в этаноле (800 мл) кипятят при перемешивании 3 ч. Реакционную смесь охлаждают до комнатной температуры. Полученное твердое вещество собирают путем фильтрации, промывают водой, этанолом и сушат, что дает 41,6 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)1,35 (t, J=6,6 Гц, 3 Н), 3,39 (s, 3 Н), 3,49 (s, 3 Н), 4,29 (q, J=6,9 Гц, 2H),6,83 (br s, 2H). Стадия 5. Этил 5-бром-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6 карбоксилат. К перемешиваемому раствору трет-бутилнитрита (26,3 мл, 220,21 ммоль) в ацетонитриле (590 мл) медленно в течение 10-15 мин добавляют бромид меди (31,5 г, 220,21 ммоль). Промежуточное соединение по стадии 4 (41,4 г, 146,191 ммоль) добавляют порциями при комнатной температуре. Реакцию нагревают при 65 С в течение 3 ч. Смесь охлаждают до комнатной температуры, гасят насыщенным раствором тиосульфата натрия, 1 н. раствором HCl (200 мл), добавляют и экстрагируют с помощью этилацетата. Объединенные органические слои промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт затем очищают с помощью колоночной хроматографии на силикагеле,используя 3% этилацетат в хлороформе, что дает 24,6 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)1,41 (t, J=6,9 Гц, 3 Н), 3,42 (s, 3 Н), 3,57 (s, 3 Н), 4,39 (q, J=6,9 Гц, 2H). Стадия 6. Этил 5-аллил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6 карбоксилат. К перемешиваемому раствору промежуточного соединения по стадии 5 (24,5 г, 70,60 ммоль) в сухом ТГФ (350 мл) добавляют карбонат цезия (46,0 г, 141,20 ммоль) и пинаколовый эфир аллилбороновой кислоты (23,8 мл, 127,08 ммоль) в атмосфере азота и смесь дегазируют в течение 10 мин. Добавляют тетракис-(трифенилфосфин)палладий(0) (8,1 г, 7,06 ммоль) и реакцию кипятят в течение 24 ч в атмосфере азота. Реакционную смесь разбавляют водой (250 мл) и экстрагируют с помощью этилацетата (3100 мл). Объединенные органические экстракты концентрируют и полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5% этилацетат в петролейном эфире, что дает 4,62 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)1,39 (t, J=7,2 Гц, 3 Н), 3,41 (s, 3 Н), 3,56 (s, 3 Н), 4,18-4,24 (m, 2H), 4,314,40 (m, 2H), 4,99-5,15 (m, 2H), 5,95-6,03 (m, 1H). Стадия 7. 5-Аллил-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-карбоновая кислота. К перемешиваемому раствору промежуточного соединения по стадии 6 (4,6 г, 14,93 ммоль) в этаноле (50 мл) добавляют 1,25 М водный раствор KOH (15,5 мл) и смесь кипятят в течение 2 ч. Растворитель концентрируют при пониженном давлении и подкисляют 1 н. раствором HCl. Твердое вещество выделяют фильтрованием и сушат, что дает 3,50 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)3,42 (s, 3 Н), 3,56 (s, 3 Н), 4,24 (d, J=6,0 Гц, 2H), 5,01-5,18 (m, 2H), 5,956,05 (m, 1H). Стадия 8. 5-Аллил-1,3-диметилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион. Порошкообразную медь (231 мг, 3,642 г-атом) добавляют к суспензии промежуточного соединения по стадии 7 (3,4 г, 12,142 ммоль) в хинолине (60 мл) и результирующую смесь перемешивают и нагревают при 235 С в течение 3 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом, промывают 1 н. раствором HCl и водой. Объединенные органические слои сушат и концентрируют. Очистка сырого продукта с помощью колоночной хроматографии на силикагеле, используя 5% этилацетат в петролейном эфире, дает 2,17 г продукта в виде твердого вещества грязнобелого цвета; 1 Н ЯМР (300 МГц, CDCl3)3,41 (s, 3 Н), 3,55 (s, 3 Н), 3,71 (s, 2H), 5,09-5,15 (m, 2H), 5,97-6,10 (m,1H), 6,50 (s, 1H). Стадия 9. Метил (1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетат. К раствору промежуточного соединения по стадии 8 (2,14 г, 9,033 ммоль) в дихлорметане (106 мл) добавляют 2,5 М метанольный раствор NaOH (60 мл). Раствор охлаждают (-78 С) и газообразный озон барботируют через него в течение 90 мин. Реакционную смесь нагревают до комнатной температуры,разбавляют водой и экстрагируют с помощью этилацетата. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5% этилацетат в петролейном эфире, что дает 1,35 г продукта в виде твердого вещества бледно-желтого цвета; 1 Н ЯМР (300 МГц, CDCl3)3,39 (s, 3 Н), 3,47 (s, 3 Н), 3,74 (s, 3 Н), 3,95 (s, 2 Н), 6,70 (s, 1H).- 15022029 Стадия 10 (1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)уксусная кислота. Смесь промежуточного соединения по стадии 9 (1,3 г, 4,850 ммоль) и 6 н. раствор H2SO4 (12 мл) в 1,4-диоксане (12 мл) перемешивают при температуре кипения в течение 1 ч, что дает гомогенный раствор бледно-желтого цвета. Этот раствор охлаждают, разбавляют водой и экстрагируют с помощью этилацетата (250 мл). Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют. Полученный остаток растирают в диэтиловом эфире, полученное твердое вещество собирают путем фильтрации, что дает 450 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (DMSO-d6, 300 МГц)3,21 (s, 3H), 3,45 (s, 3H), 3,79 (s, 2H), 7,01 (s, 1H), 12,22 (br s, 1H). Промежуточное соединение 2. Стадия 1. 2-Амино-5-метилтиофен-3-карбонитрил. К перемешиваемому раствору пропиональдегида (87,99 г, 1514 ммоль) и порошкообразной серы(48,4 г, 1514 ммоль) в сухом ДМФА (320 мл) по каплям добавляют триэтиламин (127,7 мл, 909 ммоль) при 0 С. Результирующий темный раствор затем нагревают до комнатной температуры в течение 1 ч. Раствор малононитрила (100 г, 1514 ммоль) в сухом ДМФА (180 мл) переносят в делительную воронку и добавляют путем прикапывания. Результирующую коричневатую смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют водой и экстрагируют с помощью этилацетата (3500 мл). Объединенные органические субстраты промывают водой (2300 мл), сушат над Na2SO4 и концентрируют. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле,используя 10% этилацетат в петролейном эфире, получают 25,8 г продукта в виде твердого вещества бледно-коричневого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,28 (s, 3 Н), 4,60 (br. s, 2 Н), 6,33 (s, 1H). Стадия 2. 2-Амино-5-метилтиофен-3-карбоксамид. Промежуточное соединение со стадии 1 (25,5 г, 163,46 ммоль) добавляют порциями к концентрированной серной кислоте (163 мл) при перемешивании и смесь затем нагревают при 55 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и выливают на колотый лед. Смесь подщелачивают путем добавления жидкого аммиака. Твердое вещество отделяют, собирают путем фильтрации,что дает 16,8 г продукта в виде твердого вещества бледно-коричневого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,27 (s, 3 Н), 5,34 (br. s, 2 Н), 6,01 (br. s, 2 Н), 6,33 (s, 1H). Стадия 3. 6-Метилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион. К перемешиваемому раствору промежуточного соединения по стадии 2 (16,5 г, 94,82 ммоль) в сухом ТГФ (316 мл) добавляют тиофосген (14,07 г, 47,41 ммоль) и смесь кипятят в атмосфере азота. Смесь охлаждают до комнатной температуры и разбавляют водой (200 мл) при перемешивании. Осажденное твердое вещество собирают путем фильтрации и сушат, что дает 13,8 г желаемого продукта; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 6,82 (s, 1H), 11,07 (br. s, 1H), 11,79 (br. s, 1H). Стадия 4. 1,3,6-Триметилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион. К раствору промежуточного соединения со стадии 3 (13,5 г, 74,17 ммоль) в сухом ДМФА (148 мл) добавляют безводный K2CO3 (51,25 г, 370,85 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч. Метилйодид (34,74 г, 244,78 ммоль) медленно добавляют при перемешивании и затем перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь разбавляют водой и осажденное твердое вещество фильтруют, промывают водой и сушат, что дает 12,6 г продукта в виде твердого вещества коричневого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,42 (s, 3 Н), 3,22 (s, 3 Н), 3,42 (s, 3 Н), 6,90 (s, 1H). Стадия 5. 5-Йод-1,3,6-триметилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион. К перемешиваемому раствору промежуточного соединения по стадии 4 (12,5 г, 59,52 ммоль) в эфирате трифторида бора (300 мл) добавляют N-йодсукцинимид (19,9 г, 89,28 ммоль) и смесь перемешивают 3 ч при комнатной температуре в атмосфере азота. Реакционную смесь разбавляют водой (100 мл), экстрагируют с помощью этилацетата (3200 мл) и объединенные органические слои промывают водой(2150 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, используя 2% этилацетат в хлороформе, получают 9,7 г продукта в виде твердого вещества бледно-коричневого цвета; 1- 16022029 Стадия 6. 5-Аллил-1,3,6-триметилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион. Данное соединение получают, как описано на стадии 6 для промежуточного соединения 1. Взаимодействие промежуточного соединения по стадии 5 (9,0 г, 26,78 ммоль) с пинаконовым эфиром аллилбороновой кислоты (9,0 мл, 48,21 ммоль) в присутствии тетракис-(трифенилфосфин)палладия(0) (3,09 г,2,678 ммоль) и фторида цезия (8,13 г, 53,56 ммоль) в сухом ТГФ дает 4,5 г соединения, указанного в названии, в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,22 (s, 3 Н), 3,40 (s, 3 Н), 3,51 (s, 3 Н), 3,66 (d, J=5,4 Гц, 2 Н), 5,00-4,92 (m,2 Н), 6,03-5,90 (m, 1H). Стадия 7. (1,3,6-Триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)ацетальдегид. Тетраоксид осмия (2,5 мас.% в трет-бутаноле, 10 мг, 0,008 ммоль) добавляют к суспензии промежуточного соединения по стадии 6 (1,0 г, 4,0 ммоль), перйодата натрия (1,78 г, 8,48 ммоль) в смеси ТГФ:Н 2 О (1:4, 80 мл) и результирующую смесь перемешивают при комнатной температуре в течение 6 ч. Реакцию гасят путем добавления насыщенного раствора тиосульфата натрия и экстрагируют с помощью этилацетата (3150 мл). Объединенные органические субстраты промывают рассолом, сушат над Na2SO4 и упаривание растворителя дает 0,92 г соединения, указанного в названии, в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,32 (s, 3 Н), 3,38 (s, 3 Н), 3,52 (s, 3 Н), 4,01 (s, 2H), 9,79 (br. s, 1H). Стадия 8. (1,3,6-Триметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)уксусная кислота. К раствору промежуточного соединения по стадии 7 (900 мг, 3,57 ммоль) и сульфаминовой кислоты(693 мг, 7,142 ммоль) в ацетоне (17,8 мл) добавляют хлорит натрия (484 мг, 5,357 ммоль) в воде (5,35 мл) и реакционную смесь перемешивают в течение 2 ч. Растворитель упаривают, разбавляют водой и подкисляют 1 н. раствором HCl. Полученное твердое вещество фильтруют и сушат, что дает 375 мг соединения, указанного в названии, в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,30 (s, 3 Н), 3,20 (s, 3 Н), 3,42 (s, 3 Н), 3,80 (s, 2H), 12,19 (br s, 1H); Данное соединение получают в 8 стадий по методике, описанной для получения промежуточного соединения 2, за исключением использования на первой стадии бутиральдегида вместо пропиональдегида. Соединение выделяют в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)1,12-1,27 (m, 3 Н), 2,50-2,78 (m, 2 Н), 3,23 (s, 3 Н), 3,43 (s, 3 Н), 3,80 (s,2 Н), 12,19 (br s, 1H). Промежуточное соединение 4. Данное соединение получают в 8 стадий по методике, описанной для получения промежуточного соединения 2, за исключением использования на первой стадии валерианового альдегида вместо пропиональдегида. Соединение выделяют в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)0,91 (t, J=7,5 Гц, 3 Н), 1,51-1,60 (m, 2H), 2,69 (t, J=6,9 Гц, 2H), 3,20 (s,3H), 3,35 (s, 3H), 3,79 (s, 2H), 12,19 (br s, 1H). Промежуточное соединение 5. Данное соединение получают в 8 стадий по методике, описанной для получения промежуточного соединения 2, за исключением на первой стадии использования изовалерианового альдегида вместо пропиональдегида. Соединение выделяют в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)1,22 (d, J=6,3 Гц, 6H), 3,20 (s, 3 Н), 3,32-3,38 (m, 1H, overlapped с Стадия 1. 1,3,6-Триметилпиримидин-2,4(1H,3H)-дион. К раствору N,N'-диметилмочевины (10,0 г, 113,588 ммоль) и 4-диметиламинопиридина (13,873 г,113,588 ммоль) в сухом пиридине (30 мл) по каплям добавляют уксусный ангидрид (32,20 мл,340,67 ммоль) при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят в 2 н. растворе HCl (250 мл) и экстрагируют с помощью хлороформа(2250 мл). Органический слой промывают 1 н. раствором HCl (100 мл), раствором бикарбоната натрия(75 мл), рассолом (75 мл) и сушат (Na2SO4). Растворитель упаривают при пониженном давлении, получают 10,25 г продукта в виде твердого вещества желтого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,24 (s, 3 Н), 3,33 (s, 3 Н), 3,40 (s, 3 Н), 5,62 (s, 1H). Стадия 2. 5-Ацетил-1,3,6-триметилпиримидин-2,4(1H,3H)-дион. Смесь промежуточного соединения по стадии 1 (10,0 г, 62,893 ммоль), ацетилхлорида (4,47 мл,62,893 ммоль) и безводного хлорида цинка (8,57 г, 62,893 ммоль) в сухом бензоле (150 мл) кипятят в течение 48 ч. Растворитель полностью упаривают при пониженном давлении, разбавляют водой (500 мл) и экстрагируют с помощью хлороформа (3150 мл). Объединенные органические слои промывают водой(150 мл), сушат (Na2SO4) и концентрируют. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 30% этилацетат в петролейном эфире, с получением 4,7 г продукта в виде твердого вещества бледно-желтого цвета; 1H ЯМР (300 МГц, CDCl3)2,38 (s, 3 Н), 2,55 (s, 3 Н), 3,37 (s, 3 Н), 3,48 (s, 3 Н). Стадия 3. 1,3,5-Триметилтиено[3,4-d]пиримидин-2,4(1H,3H)-дион. К перемешиваемому раствору промежуточного соединения по стадии 2 (3,0 г, 14,150 ммоль) в сухом этаноле (56 мл) добавляют морфолин (1,854 мл, 21,226 ммоль), серу (679,2 мг, 21,226 ммоль) и уксусную кислоту (424 мкл, 7,075 ммоль) при комнатной температуре. После кипячения в течение 72 ч реакционную смесь охлаждают до комнатной температуры, разбавляют водой (150 мл) и экстрагируют с помощью этилацетата (150 мл). Объединенные органические слои промывают раствором бикарбоната натрия (75 мл), рассолом (50 мл), сушат (Na2SO4) и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный после упаривания растворителя остаток очищают с помощью колоночной хроматографии на силикагеле, используя 15% этилацетат в петролейном эфире, получают 1,5 г продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,87 (s, 3H), 3,39 (s, 3H), 3,46 (s, 3H), 6,25 (s, 1H). Стадия 4. Диэтил (1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[3,4-d]пиримидин-5-ил)ацетат. К перемешиваемому раствору промежуточного соединения по стадии 3 (2,3 г, 10,952 ммоль) в диэтилкарбонате (43 мл) добавляют гидрид натрия (60% дисперсия в минеральном масле, 1,05 г,26,29 ммоль) и кипятят в течение 48 ч. Реакционную смесь охлаждают до комнатной температуры, гасят в воде и экстрагируют с помощью этилацетата (375 мл). Объединенные органические слои промывают рассолом (50 мл), сушат над Na2SO4 и концентрируют. Очисткой сырого продукта с помощью колоночной хроматографии на силикагеле, используя 12% этилацетат в петролейном эфире, получают 1,56 г продукта в виде твердого вещества желтого цвета; 1 Н ЯМР (300 МГц, CDCl3)1,30 (t, J=6,9 Гц, 6H), 3,39 (s, 3 Н), 3,48 (s, 3 Н), 4,20-4,31 (m, 4H), 6,40 (s,1H), 6,58 (s, 1H). Стадия 5. Этил (1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[3,4-d]пиримидин-5-ил)ацетат. К перемешиваемому раствору промежуточного соединения по стадии 4 (1,5 г, 4,237 ммоль) в сухом этаноле (17 мл) добавляют каталитическое количество гидрида натрия (60% дисперсия в минеральном масле, 16,94 мг, 0,423 ммоль) при комнатной температуре и кипятят в течение 2 ч. Растворитель полностью упаривают при пониженном давлении и разбавляют водой. Полученное твердое вещество фильтруют и сушат, получают 615 мг продукта в виде твердого вещества грязно-белого цвета; 1H ЯМР (300 МГц, CDCl3)1,29 (t, J=7,2 Гц, 3 Н), 3,38 (s, 3 Н), 3,47 (s, 3 Н), 4,22 (q, J=7,2 Гц, 2H),4,37 (s, 2H), 6,44 (s, 1H). Общая методика получения 2-амино-4-арилтиазолов. Метод 1. В раствор производного ацетофенона (1,0 экв.) в ледяной уксусной кислоте (5 об.) добавляют жидкий бром (1,0 экв.) при 0 С и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют водой и экстрагируют с помощью этилацетата, промывают рассолом и сушат над Na2SO4. Полученный после концентрирования сырой продукт растворяют в сухом ТГФ- 18022029 этилацетатом, промывают раствором тиосульфата натрия и органический слой обрабатывают 1 н. раствором HCl, что приводит к образованию соли амина. Осажденную соль собирают путем фильтрации. Соль затем обрабатывают насыщенным раствором NaHCO3 для регенерации амина. Смесь экстрагируют дихлорметаном (250 мл) и объединенные органические экстракты промывают водой и рассолом. Растворитель упаривают при пониженном давлении с получением производного 2-амино-4-арилтиазола. Метод 2. Раствор производного ацетофенона (1,0 экв.), тиомочевины (2,0 экв.) и йода (1,0 экв.) в сухом этаноле (5 об.) кипятят в течение 24 ч. Реакционную смесь разбавляют этилацетатом и слои разделяют. Органический слой промывают раствором тиосульфата натрия, чтобы удалить йод. Этилацетатный раствор обрабатывают 1 н. раствором HCl и осажденную соль собирают путем фильтрации. Свободный амин регенерируют, как описано в методе 1, приведенном выше. Все производные 2-амино-4-арилтиазола получают либо по методу 1, либо по методу 2, исходя из соответствующих арилалкилкетонов. Структурная информация и характеристические данные для выбранных промежуточных соединений представлены в табл. 1. Таблица 1 Данные по структуре и 1 Н ЯМР данные для выбранных промежуточных соединений 2-аминотиазола Стадия 1. N-4-[3-Фтор-4-(трифторметил)фенил]-1H-имидазол-2-илацетамид. К перемешиваемому раствору 2-бром-1-[3-фтор-4-(трифторметил)фенил]этанона (4,5 г,15,73 ммоль) в ацетонитриле (45 мл) добавляют ацетилгуанидин (2,38 г, 23,60 ммоль) при комнатной температуре. После кипячения в течение 4 ч реакционную смесь охлаждают до комнатной температуры и разбавляют этилацетатом и водой. Слои разделяют. Водный слой экстрагируют 2-3 раза этилацетатом и объединенные органические слои промывают водой, а затем рассолом, сушат (Na2SO4) и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный после упаривания растворителя остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2% метанол в хлороформе, получают 1,15 г продукта в виде твердого вещества желтого цвета;s, 1H). Стадия 2. 4-[3-Фтор-4-(трифторметил)фенил]-1H-имидазол-2-амин. К перемешиваемому раствору промежуточного соединения со стадии 1 (1,1 г, 3,829 ммоль) в смеси метанола (20 мл) и воды (20 мл) добавляют концентрированную H2SO4 (2 мл) и полученную смесь кипятят в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, подщелачивают раствором карбоната калия (рН 10) и экстрагируют с помощью этилацетата (250 мл). Органический слой сушат (Na2SO4) и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный после упаривания растворителя остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5% метанол в хлороформе, получают 290 мг продукта в виде твердого вещества желтого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)5,55 (br s, 2 Н), 7,32 (s, 1H), 7,59-7,67 (m, 3 Н), 11,30 (br s, 1H). Получение 4-[3-(трифторметокси)фенил]-1H-имидазол-2-амина: Стадия 1. N-4-[3-(Трифторметокси)фенил]-1H-имидазол-2-илацетамид. Соединение, указанное в названии, образуется в соответствии с описанной методикой, используя 2-бром-1-[3-(трифторметокси)фенил]этанон (1,7 г, 6,00 ммоль) и ацетилгуанидин (0,91 г, 9,01 ммоль) в ацетонитриле (17 мл), получают 460 г продукта в виде твердого вещества желтого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,07 (s, 3 Н), 5,50 (s, 1H), 7,10-7,15 (m, 1H), 7,39 (t, J=7,8 Гц, 1H), 7,477,64 (m, 3H), 7,92 (s, 1H). Стадия 2. 4-[3-(Трифторметокси)фенил]-1H-имидазол-2-амин. Соединение, указанное в названии, получают в соответствии с описанной методикой, используя промежуточное соединение по стадии 1 (450 мг, 1,578 ммоль) в смеси метанол-вода (22 мл) и концентрированной H2SO4 (1 мл), что дает 130 мг продукта в виде твердого вещества желтого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)5,75 (br s, 2H), 7,08 (d, J=8,1 Гц, 1H), 7,21 (s, 1H), 7,41 (t, J=7,8 Гц,1H), 7,55-7,64 (m, 2H), 11,30 (br s, 1H). Получение 1-(4-бромфенил)-1H-пиразол-3-амина Соединение, указанное в названии, получают по реакции 4-бромфенилгидразина с акрилонитрилом в присутствии подходящего основания, такого как этоксид натрия, в кипящем этаноле с последующим окислением с помощью N-бромсукцинимида; 1 Н ЯМР (300 МГц, DMSO-d6)3,81 (br s, 2 Н), 5,84 (s, 1H), 7,41 (d, J=8,7 Гц, 2H), 7,47 (d, J=8,7 Гц,2H), 7,63 (s, 1H). 4-(4-Бромфенил)пиримидин-2-амин получают по реакции 4-бромацетофенона сN,N-диметилформамид диметилацеталем с последующей циклизацией с гидрохлоридом гуанидина, в присутствии подходящего основания, такого как карбонат калия в кипящем диметиленгликоль моноэтиловом эфире; 1 Н ЯМР (300 МГц, DMSO-d6)6,69 (br s, 2 Н), 7,11 (d, J=5,1 Гц, 1H), 7,67 (d, J=8,4 Гц, 2H), 7,99 (d,J=8,1 Гц, 2H), 8,29 (d, J=4,8 Гц, 1H). 3-(4-Хлорфенил)изоксазол-5-амин, 5-(4-бромфенил)изоксазол-3-амин, 3-(4-хлорфенил)-1H-пиразол 5-амин, 5-(4-бромфенил)-1,3,4-тиадиазол-2-амин, используемые в синтезе, являются коммерчески доступными и были приобретены у фирмы Aldrich. Раскрытые в описании соединения по иллюстративным примерам синтезируют путем взаимодействия производных тиенопиримидинуксусной кислоты с соответствующими ариламинами. Примеры Общая методика получения соединений по примерам. Метод А. К перемешиваемому раствору производного карбоновой кислоты (1,0 экв.) в 1,2-дихлорэтане добавляют EDCI (1,2 экв.), HOBt (0,3 экв.) и 4-диметиламинопиридин (0,1 экв.) и смесь перемешивают при комнатной температуре в течение 10-15 мин. Затем добавляют соответствующий амин (1,0 экв.) и смесь перемешивают при той же температуре в течение 48 ч. Растворитель упаривают при пониженном давлении и полученный остаток разбавляют метанолом и перемешивают при комнатной температуре в течение 30 мин. Выделенное твердое вещество собирают путем фильтрации. Твердый продукт затем очищают путем перекристаллизации из изопропанола или метанола, что дает требуемые продукты. Метод В. К перемешиваемому раствору производного карбоновой кислоты (1,0 экв.) в смеси тетрагидрофуран и N,N-диметилформамид (3:1) добавляют EDCI (2,0 экв.) и смесь перемешивают в течение 30 мин. Соответствующий амин (1,0 экв.) и DMAP (0,2 экв.) добавляют и смесь выдерживают при 80 С при перемешивании в течение еще 24 ч. Большую часть тетрагидрофурана упаривают при пониженном давле- 21022029 нии, и смесь подкисляют до рН 6,0 путем добавления 2 н. раствора соляной кислоты. Осажденное твердое вещество собирают путем фильтрации. Продукт затем очищают путем кристаллизации или с помощью колоночной хроматографии на силикагеле, используя смесь метанол-хлороформ. Метод С. К перемешиваемому раствору соответствующего тиазоламина (1,2 экв.) в сухом толуоле добавляют гидрид натрия и смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют эфир тиенопиримидинуксусной кислоты (1,0 экв.) и смесь нагревают при кипячении в течение ночи. Смесь охлаждают и подкисляют рН 6,0 путем добавления 2 н. раствора соляной кислоты. Осажденное твердое вещество собирают путем фильтрации. Продукт затем очищают путем кристаллизации или с помощью колоночной хроматографии на силикагеле, используя смесь метанола и хлороформа. Пример 1. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)-N-[4-(трифторметил)1,3-тиазол-2-ил]ацетамид Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-(трифторметил)-1,3-тиазол-2 амином (66 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,471 ммоль), HOBt (16 мг,0,118 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл), что дает 27 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,18 (s, 3 Н), 3,46 (s, 3H), 4,05 (s, 2 Н), 7,07 (s, 1H), 7,91 (s, 1H), 12,70 Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (200 мг, 0,709 ммоль) с 4-(4-хлорфенил)-1,3-тиазол-2-амином(149 мг, 0,709 ммоль) в присутствии гидрохлорида EDCI (163 мг, 0,851 ммоль), HOBt (28 мг,0,212 ммоль) и DMAP (8,60 мг, 0,079 ммоль) в 1,2-дихлорэтане (4 мл), что дает 95 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,06 (s, 2 Н), 7,07 (s, 1H), 7,50 (d, J=8,4 Гц,2H), 7,66 (s, 1H), 7,92 (d, J=8,4 Гц, 2H), 12,41 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (150 мг, 0,590 ммоль) с 4-[3-(трифторметокси)фенил]-1,3 тиазол-2-амином (155 мг, 0,590 ммоль) в присутствии гидрохлорида EDCI (135 мг, 0,708 ммоль), HOBt(24 мг, 0,177 ммоль) и DMAP (7,21 мг, 0,059 ммоль) в 1,2-дихлорэтане (6 мл), что дает 40 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,07 (s, 2 Н), 7,07 (s, 1H), 7,32 (d, J=7,8 Гц,1H), 7,58 (t, J=7,8 Гц, 1H), 7,78 (s, 1H), 7,87 (s, 1H), 7,94 (d, J=8,1 Гц, 1H), 12,44 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-(4-изобутилфенил)-1,3-тиазол-2 амином (91 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,472 ммоль), HOBt (16 мг,0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл), что дает 42 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, CDCl3)0,88 (d, J=6,3 Гц, 6H), 1,83-1,90 (m, 1H), 2,48 (d, J=6,9 Гц, 2H), 3,51 (s,3H), 3,57 (s, 3H), 4,06 (s, 2H), 6,88 (s, 1H), 7,04 (s, 1H), 7,16 (d, J=7,8 Гц, 2H), 7,72 (d, J=7,8 Гц, 2H), 10,73 Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (102 мг, 0,401 ммоль) с 4-[3-фтор-4-(трифторметил)фенил]1,3-тиазол-2-амином (105 мг, 0,401 ммоль) в присутствии гидрохлорида EDCI (92 мг, 0,481 ммоль), HOBt(16 мг, 0,120 ммоль) и DMAP (5 мг, 0,040 ммоль) в 1,2-дихлорэтане (4 мл), что дает 16 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,07 (s, 2 Н), 7,07 (s, 1H), 7,83-8,01 (m, 4H),12,51 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (102 мг, 0,401 ммоль) с 4-[4-фтор-3-(трифторметил)фенил]1,3-тиазол-2-амином (105 мг, 0,401 ммоль) в присутствии гидрохлорида EDCI (92 мг, 0,481 ммоль), HOBt(16 мг, 0,120 ммоль) и DMAP (5 мг, 0,040 ммоль) в 1,2-дихлорэтане (4 мл), что дает 23 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,06 (s, 2 Н), 7,07 (s, 1H), 7,64 (t, J=9,0 Гц,1H), 7,83 (s, 1H), 8,08-8,36 (m, 2H), 12,48 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (150 мг, 0,590 ммоль) с 4-[2-фтор-4-(трифторметил)фенил]1,3-тиазол-2-амином (155 мг, 0,590 ммоль) в присутствии гидрохлорида EDCI (135 мг, 0,708 ммоль),HOBt (24 мг, 0,177 ммоль) и DMAP (7,21 мг, 0,059 ммоль) в 1,2-дихлорэтане (6 мл), что дает 35 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,08 (s, 2 Н), 7,08 (s, 1H), 7,70-7,84 (m, 3 Н),8,23-8,28 (m, 1H), 12,52 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[3-фтор-5-(трифторметил)фенил]1,3-тиазол-2-амином (103 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,471 ммоль), HOBt(16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (6 мл), что дает 21 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,07 (s, 2 Н), 7,07 (s, 1H), 7,64 (d, J=8,1 Гц,1H), 7,97 (s, 1H), 8,06 (d, J=9,0 Гц, 1H), 8,13 (s, 1H), 12,49 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[2-фтор-3-(трифторметил)фенил]1,3-тиазол-2-амином (103 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,472 ммоль), HOBt(16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (6 мл), что дает 40 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,08 (s, 2 Н), 7,07 (s, 1H), 7,53 (t, J=7,5 Гц,1H), 7,66 (s, 1H), 7,77 (t, J=6,9 Гц, 1H), 8,30-8,37 (m, 1H), 12,49 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[4-фтор-3-(трифторметокси)фенил]1,3-тиазол-2-амином (109 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,472 ммоль), HOBt(16 мг, 0,118 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл), что дает 35 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,06 (s, 2 Н), 7,07 (s, 1H), 7,59 (t, J=8,7 Гц,1H), 7,76 (s, 1H), 8,00-8,06 (m, 2H), 12,44 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[3-фтор-4-(трифторметокси)фенил]1,3-тиазол-2-амином (109 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,471 ммоль), HOBt(16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл), что дает 35 мг продукта в виде твердого вещества белого цвета; Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-(3,4-дихлорфенил)-1,3-тиазол-2 амином (96,5 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI (90 мг, 0,471 ммоль), HOBt (16 мг,0,118 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл), что дает 40 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,06 (s, 2 Н), 7,07 (s, 1H), 7,70 (d, J=8,4 Гц,1H), 7,80 (s, 1H), 7,89 (d, J=6,9 Гц, 1H), 8,14 (s, 1H), 12,43 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[2,4-дифтор-3(трифторметил)фенил]-1,3-тиазол-2-амином (110 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI(90 мг, 0,471 ммоль), HOBt (16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл),что дает 20 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,07 (s, 2 Н), 7,08 (s, 1H), 7,55 (t, J=9,0 Гц,1H), 7,62 (s, 1H), 8,34 (q, J=6,9 Гц, 1H), 12,50 (br s, 1H); К раствору соединения по примеру 13 (50 мг, 0,096 ммоль) в сухом ТГФ (1 мл) добавляют гидрид натрия (60% дисперсия в минеральном масле, 5 мг, 0,106 ммоль) при комнатной температуре и перемешивают в течение 2 ч. Избыток растворителя удаляют при пониженном давлении, и полученное твердое вещество промывают гексаном (25 мл), сухим диэтиловым эфиром (5 мл) и хорошо сушат, что дает 50 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,23 (s, 3 Н), 3,46 (s, 3 Н), 3,81 (s, 2 Н), 6,89 (s, 1H), 7,04 (s, 1H), 7,40 (t,J=9,6 Гц, 1H), 8,41 (q, J=6,9 Гц, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[2,3-дифтор-4(трифторметил)фенил]-1,3-тиазол-2-амином (ПО мг, 0,393 ммоль) в присутствии гидрохлорида EDCI(90 мг, 0,472 ммоль), HOBt (16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл),что дает 27 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,08 (s, 2 Н), 7,08 (s, 1H), 7,70-7,80 (m, 2H),7,98-8,04 (m, 1H), 12,56 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 1 (100 мг, 0,393 ммоль) с 4-[3,5-дифтор-4(трифторметил)фенил]-1,3-тиазол-2-амином (110 мг, 0,393 ммоль) в присутствии гидрохлорида EDCI(90 мг, 0,472 ммоль), HOBt (16 мг, 0,117 ммоль) и DMAP (5 мг, 0,039 ммоль) в 1,2-дихлорэтане (4 мл),что дает 30 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)3,19 (s, 3 Н), 3,47 (s, 3 Н), 4,07 (s, 2 Н), 7,07 (s, 1H), 7,83 (s, 1H), 7,87 (s,1H), 8,06 (s, 1H), 12,51 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-(4-трет-бутилфенил)-1,3-тиазол-2 амином (86 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,447 ммоль), HOBt (15 мг,0,111 ммоль) и DMAP (5 мг, 0,037 ммоль) в 1,2-дихлорэтане (4 мл), что дает 38 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)1,30 (s, 9H), 2,35 (s, 3H), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,05 (s, 2 Н), 7,45 Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-(3-трифторметоксифенил)-1,3 тиазол-2-амином (97 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,447 ммоль), HOBt(15 мг, 0,111 ммоль) и DMAP (5 мг, 0,037 ммоль) в 1,2-дихлорэтане (4 мл), что дает 21 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,33 (d, J=7,2 Гц,1H), 7,58 (t, J=7,8 Гц, 1H), 7,78 (s, 1H), 7,97-7,85 (m, 2H), 12,45 (s, 1H);- 26022029 Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (200 мг, 0,746 ммоль) с 4-(4-хлорфенил)-1,3-тиазол-2-амином(157 мг, 0,746 ммоль) в присутствии гидрохлорида EDCI (171 мг, 0,895 ммоль), HOBt (30 мг,0,223 ммоль) и DMAP (9,11 мг, 0,074 ммоль) в 1,2-дихлорэтане (4 мл), что дает 13 мг продукта в виде твердого вещества желтого цвета; 1 Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-(3,4-дихлорфенил)-1,3-тиазол-2 амином (91 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,445 ммоль), HOBt (15 мг,0,111 ммоль) и DMAP (5 мг, 0,037 ммоль) в 1,2-дихлорэтане (3,7 мл), что дает 13 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,71 (d, J=8,1 Гц,1H), 7,81 (s, 1H), 7,89 (d, J=8,1 Гц, 1H), 8,15 (s, 1H), 12,45 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-(2,3-дифторфенил)-1,3-тиазол-2 амином (80 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,447 ммоль), HOBt (15 мг,0,111 ммоль) и DMAP (5 мг, 0,037 ммоль) в 1,2-дихлорэтане (4 мл), что дает 15 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,28-7,46 (m, 2 Н),7,59 (s, 1H), 7,78-7,87 (m, 1H), 12,48 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-(2,4-дифторфенил)-1,3-тиазол-2 амином (97 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,447 ммоль), HOBt (15 мг,0,111 ммоль) и DMAP (4,5 мг, 0,037 ммоль) в 1,2-дихлорэтане (3 мл), что дает 25 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,22 (t, J=6,6 Гц,1H), 7,33-7,41 (m, 1H), 7,46 (s, 1H), 8,06 (d, J=7,2 Гц, 1H), 12,43 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-[4-фтор-3-(трифторметил)фенил]1,3-тиазол-2-амином (97 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,445 ммоль), HOBt(15 мг, 0,111 ммоль) и DMAP (4,5 мг, 0,037 ммоль) в 1,2-дихлорэтане (3,7 мл), что дает 28 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2H), 7,61 (d, J=9,0 Гц,1H), 7,82 (s, 1H), 8,24-8,30 (m, 2H), 12,47 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (100 мг, 0,373 ммоль) с 4-[3-фтор-4-(трифторметил)фенил]1,3-тиазол-2-амином (97 мг, 0,373 ммоль) в присутствии гидрохлорида EDCI (85 мг, 0,447 ммоль), HOBt(15 мг, 0,111 ммоль) и DMAP (5 мг, 0,037 ммоль) в 1,2-дихлорэтане (4 мл), что дает 24 мг продукта в виде твердого вещества белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 8,01-7,85 (m, 4 Н),12,49 (s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (180 мг, 0,671 ммоль) с 4-[4-фтор-3-(трифторметокси)фенил]1,3-тиазол-2-амином (187 мг, 0,671 ммоль) в присутствии гидрохлорида EDCI (154 мг, 0,805 ммоль),HOBt (27,2 мг, 0,201 ммоль) и DMAP (8,19 мг, 0,0071 ммоль) в 1,2-дихлорэтане (7 мл), что дает 17,5 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,35 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,58 (t, J=9,0 Гц,1H), 7,74 (s, 1H), 8,00-8,06 (m, 2H), 12,40 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (180 мг, 0,671 ммоль) с 4-[3-фтор-4-(трифторметокси)фенил]1,3-тиазол-2-амином (187 мг, 0,671 ммоль) в присутствии гидрохлорида EDCI (154 мг, 0,805 ммоль),HOBt (27,2 мг, 0,201 ммоль) и DMAP (8,19 мг, 0,0071 ммоль) в 1,2-дихлорэтане (7 мл), что дает 54 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,18 (s, 3 Н), 3,44 (s, 3 Н), 4,06 (s, 2 Н), 7,65 (t, J=9,3 Гц,1H), 7,80 (s, 1H), 7,85 (d, J=8,7 Гц, 1H), 7,98 (d, J=9,0, 1H), 12,47 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод В) путем связывания промежуточного соединения 2 (150 мг, 0,559 ммоль) с 4-(2,4-дифтор-3(трифторметил)фенил)-1,3-тиазол-2-амином (156 мг, 0,559 ммоль) в присутствии гидрохлорида EDCI(214 мг, 1,119 ммоль), DMAP (13,5 мг, 0,119 ммоль) в смеси ТГФ:ДМФА (3:1, 2,8 мл), что дает 27 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, CDCl3)2,55 (s, 3 Н), 3,53 (2s, 6 Н), 4,04 (s, 2 Н), 7,07 (t, J=9,0 Гц, 1H), 7,38 (s, 1H),8,33 (q, J=8,7 Гц, 1H), 10,96 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (140 мг, 0,522 ммоль) с 4-[3-(трифторметокси)фенил]-1Hимидазол-2-амином (126 мг, 0,522 ммоль) в присутствии гидрохлорида EDCI (120 мг, 0,626 ммоль),HOBt (21 мг, 0,156 ммоль) и DMAP (6,38 мг, 0,052 ммоль) в 1,2-дихлорэтане (4 мл), что дает 30 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,20 (s, 3 Н), 3,44 (s, 3 Н), 4,10 (s, 2 Н), 7,10-7,16 (m, 1H),7,39-7,50 (m, 2H), 7,68 (s, 1H), 7,72-7,80 (m, 1H), 11,38 (br s, 1H), 11,68 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 2 (150 мг, 0,559 ммоль) с 4-[3-фтор-4-(трифторметил)фенил]1H-имидазол-2-амином (137 мг, 0,559 ммоль) в присутствии гидрохлорида EDCI (128 мг, 0,671 ммоль),HOBt (22 мг, 0,167 ммоль) и DMAP (6,83 мг, 0,055 ммоль) в 1,2-дихлорэтане (6 мл), что дает 16,5 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)2,36 (s, 3 Н), 3,20 (s, 3 Н), 3,44 (s, 3 Н), 3,98 (s, 2H), 7,57 (s, 1H), 7,707,80 (m, 3 Н), 11,40 (br s, 1H), 11,83 (br s, 1H); Соединение, указанное в названии, получают в соответствии с общей методикой (метод А) путем связывания промежуточного соединения 3 (150 мг, 0,531 ммоль) с 4-(4-цианофенил)-1,3-тиазол-2 амином (107 мг, 0,531 ммоль) в присутствии гидрохлорида EDCI (122 мг, 0,638 ммоль), HOBt (21 мг,0,159 ммоль) и DMAP (6,4 мг, 0,053 ммоль) в 1,2-дихлорэтане (5,3 мл), что дает 10 мг продукта в виде твердого вещества грязно-белого цвета; 1 Н ЯМР (300 МГц, DMSO-d6)1,19 (t, J=7,5 Гц, 3 Н), 2,79 (q, J=7,8 Гц, 2H), 3,18 (s, 3H), 3,47 (s, 3H),4,07 (s, 2H), 7,87-7,93 (m, 3H), 8,09 (d, J=8,4 Гц, 2H), 12,48 (br s, 1H);
МПК / Метки
МПК: A61K 31/381, C07D 495/04, A61P 29/00
Метки: производные, модуляторов, качестве, тиенопиримидиндиона, trpa1
Код ссылки
<a href="https://eas.patents.su/30-22029-proizvodnye-tienopirimidindiona-v-kachestve-modulyatorov-trpa1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиенопиримидиндиона в качестве модуляторов trpa1</a>
Предыдущий патент: Композиции, содержащие масляную смесь жирных кислот и поверхностно-активное вещество, способы и применения композиций
Следующий патент: Способ получения 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты
Случайный патент: Полимер этилена, пленка и способ полимеризации