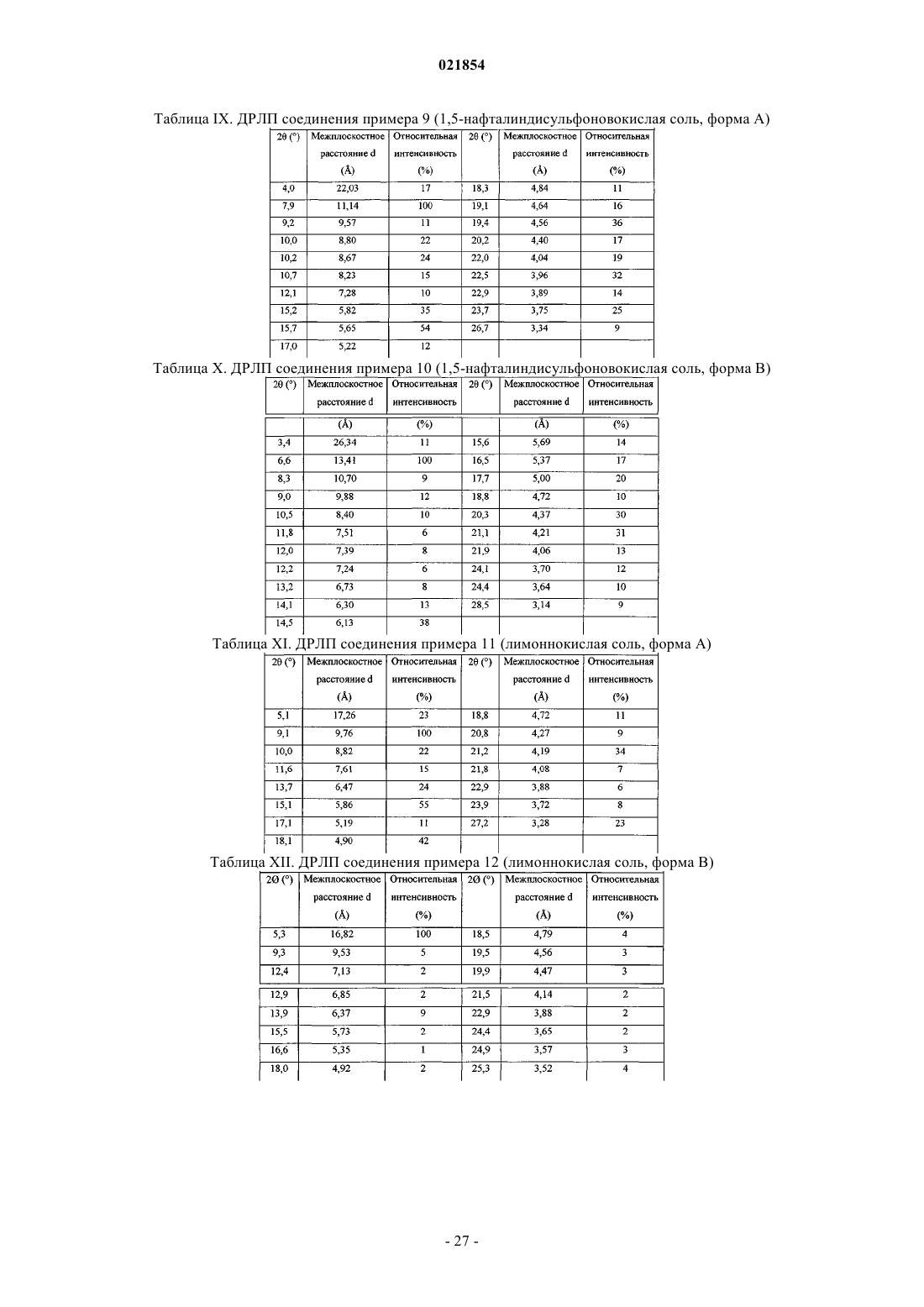
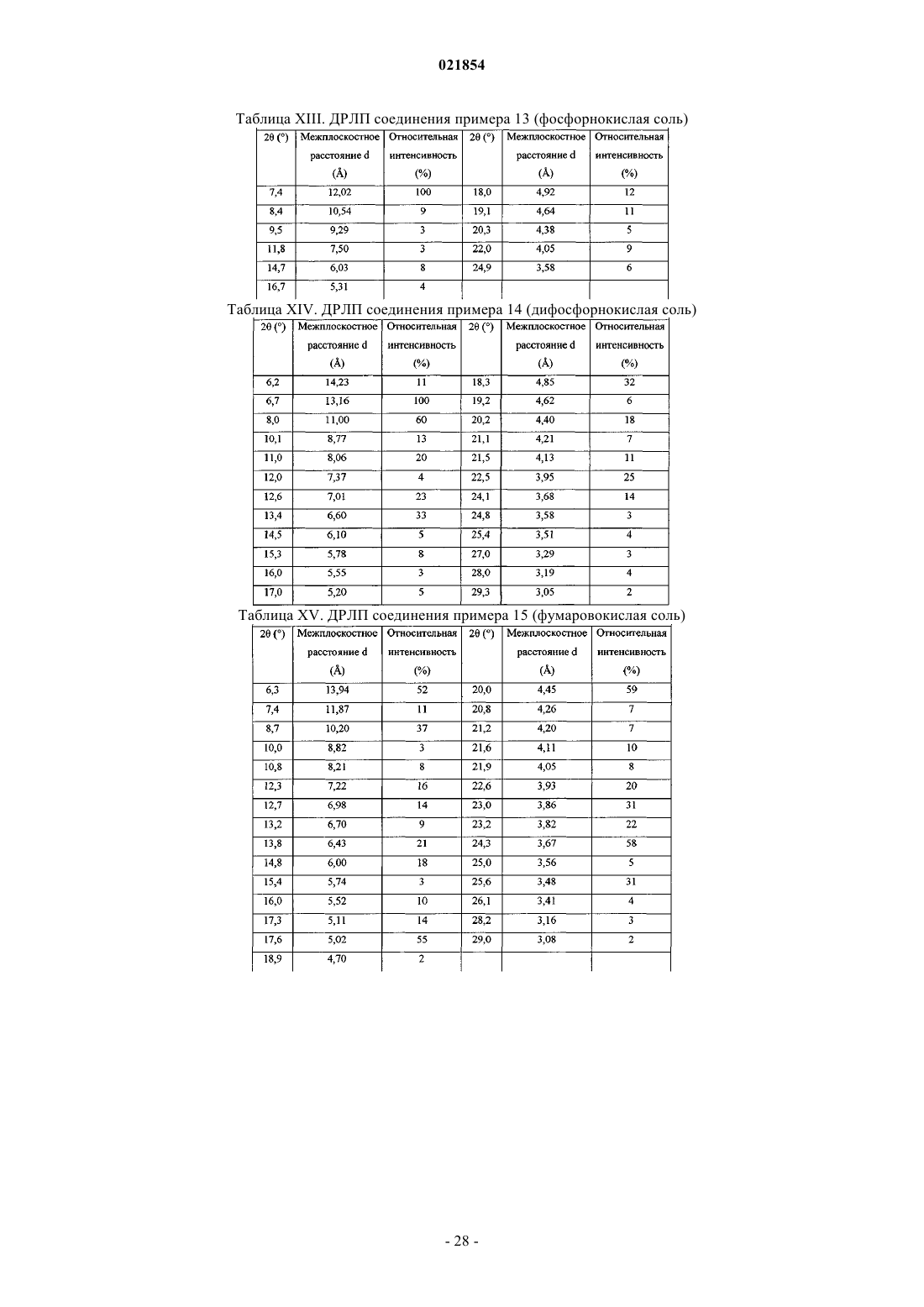
Дисахариновая, дифумаровокислая, ди-1-гидрокси-2-нафтойнокислая и монобензойнокислая соли 4-(диметиламино)бутил-2-(4-((2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата
Номер патента: 21854
Опубликовано: 30.09.2015
Авторы: Том Стивен, Макайнэли Томас, Айзоб Йошиаки, Беннет Николас Джеймс, Пимм Остин
Формула / Реферат
1. Дисахариновая, дифумаровокислая, ди-1-гидрокси-2-нафтойнокислая или монобензойнокислая соль 4-(диметиламино)бутил-2-(4-((2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата.
2. Соль по п.1, представляющая собой дисахариновую соль.
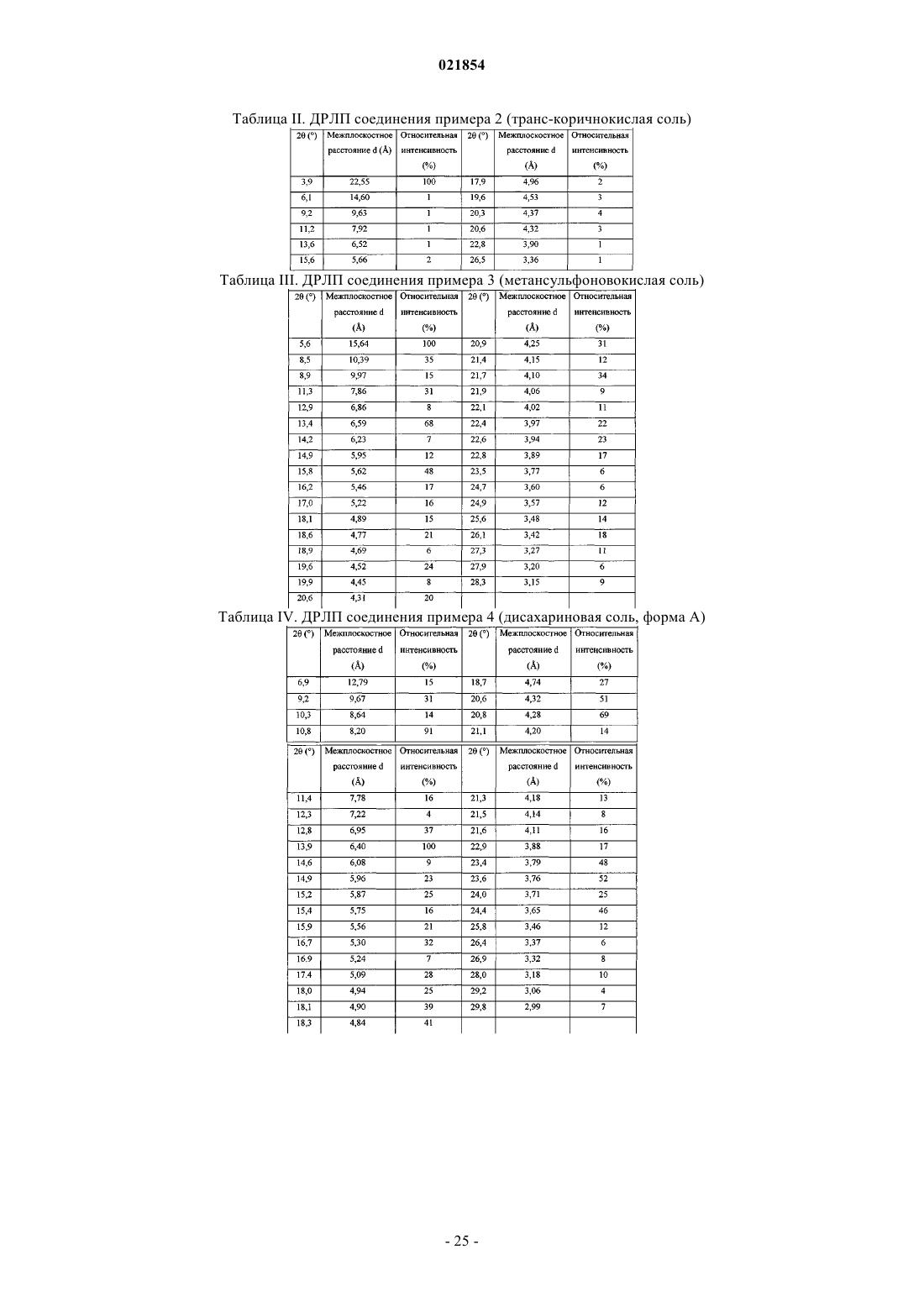
3. Соль по п.1, представляющая собой форму А дисахариновой соли, характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2θ примерно 9,2°, 14,9° или 15,2° при измерении с использованием CuKα-излучения.
4. Соль по п.1, представляющая собой форму В дисахариновой соли, характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2θ примерно 12,0°, 12,5°, 16,4° или 19,8° при измерении с использованием CuKα-излучения.
5. Соль по п.1, представляющая собой дифумаровокислую соль.
6. Соль по п.1, представляющая собой дифумаровокислую соль, характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2θ примерно 9,1°, 14,2°, 15,8° или 20,4° при измерении с использованием CuKα-излучения.
7. Соль по п.1, представляющая собой ди-1-гидрокси-2-нафтойнокислую соль.
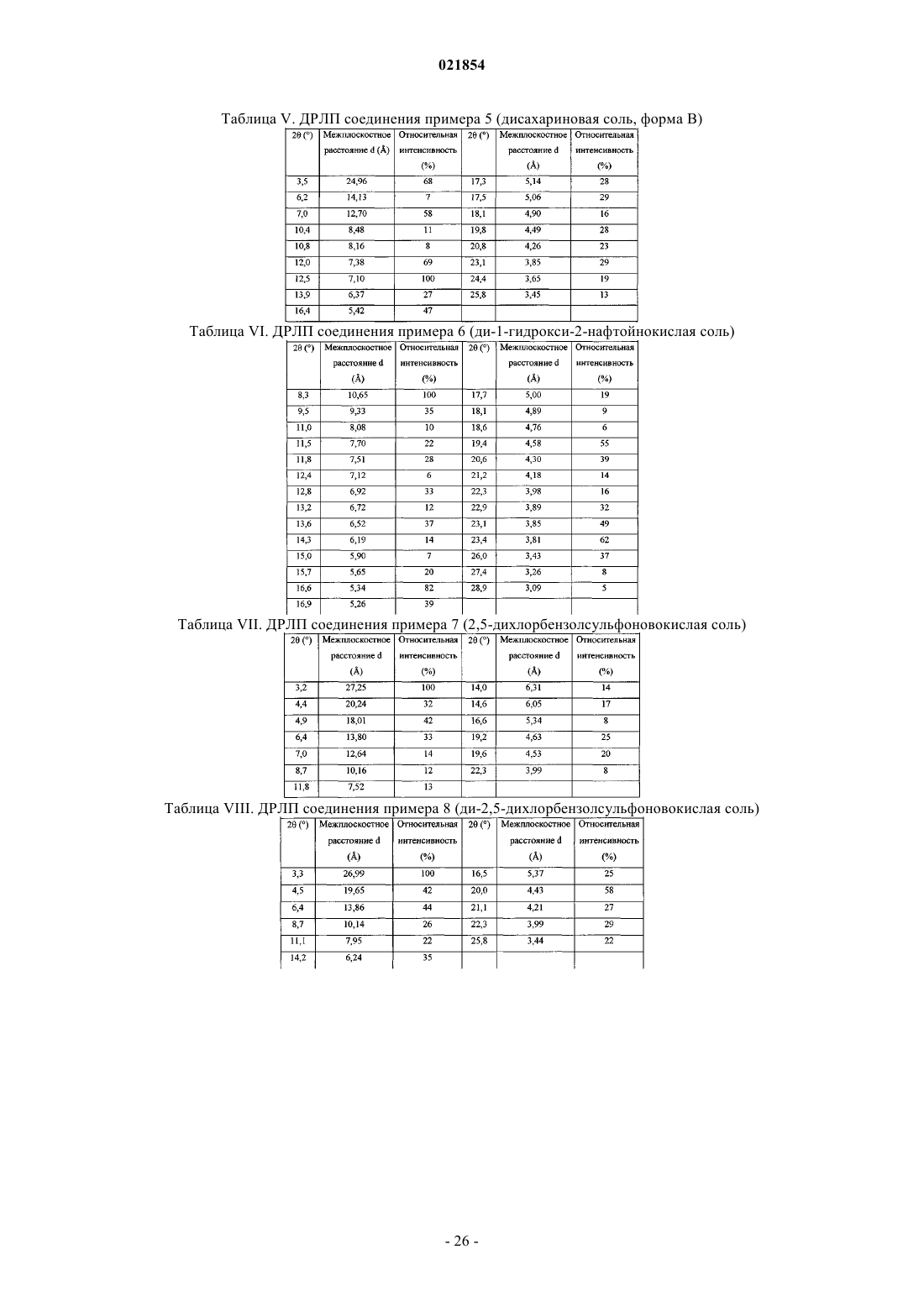
8. Соль по п.1, представляющая собой ди-1-гидрокси-2-нафтойнокислую соль, характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2θ примерно 8,3°, 16,6°, 19,4° или 23,4° при измерении с использованием CuKα-излучения.
9. Соль по п.1, представляющая собой монобензойнокислую соль.
10. Соль по п.1, представляющая собой монобензойнокислую соль, характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2θ примерно 6,3°, 9,3°, 17,8° или 23,8° при измерении с использованием CuKα-излучения.
11. Фармацевтическая композиция для использования в лечении заболевания, модулируемого Toll-подобным рецептором 7 (TLR7), содержащая соль по любому из пп.1-10 вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.
12. Фармацевтическая композиция для использования в лечении TLR7-модулируемого заболевания по п.11 в форме сухого порошкового препарата для применения в ингаляционной терапии.
13. Сухой порошковый ингалятор, содержащий фармацевтическую композицию для использования в лечении TLR7-модулируемого заболевания по п.12.
14. Применение соли по любому из пп.1-10 для лечения астмы, COPD (хроническое обструктивное заболевание легких), аллергического ринита, аллергического конъюнктивита, атопического дерматита, рака, гепатита В, гепатита С, HIV (вирус иммунодефицита человека), HPV (вирус папилломы человека), бактериальных инфекций или дерматоза.
Текст
Согласно изобретению предложены соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (соединение (I, фармацевтические композиции, содержащие их, и их применение в терапии.(71)(73) Заявитель и патентовладелец: АСТРАЗЕНЕКА АБ (SE); ДАЙНИППОН СУМИТОМО ФАРМА КО., ЛТД. (JP) Настоящее изобретение относится к солям производных пиримидина, к фармацевтическим композициям, содержащим их, и к их применению в терапии. Иммунная система включает врожденный и приобретенный иммунитет, которые оба работают вместе, защищая хозяина от микробных инфекций. Было показано, что врожденный иммунитет может распознавать ассоциированные с патогенами консервативные молекулярные структуры через Toll-подобные рецепторы (TLR), экспрессированные на клеточной поверхности иммунных клеток. Распознавание проникающих патогенов затем запускает продуцирование цитокинов (включая интерферон альфа (IFN и повышающую регуляцию ко-стимулирующих молекул на фагоцитах, приводя к модуляции Т-клеточной функции. Таким образом, врожденный иммунитет тесно связан с приобретенным иммунитетом и может влиять на развитие и регуляцию приобретенной ответной реакции.TLR представляют собой семейство трансмембранных рецепторов типа I, характеризующихся NH2 концевым внеклеточным доменом с богатыми лейцином повторами (LRR) и СООН-концевым внутриклеточным хвостом, содержащим консервативную область, называемую доменом, гомологичным рецептору Toll/IL-1 (TIR). Внеклеточный домен содержит варьирующее количество LRR, которые, как известно, вовлечены в связывание с лигандом. До настоящего времени описаны одиннадцать TLR у людей и мышей. Они отличаются друг от друга специфичностью к лигандам, паттернами экспрессии и генамимишенями, которые они могут индуцировать. Были разработаны лиганды, которые действуют через TLR (также известные как модификаторы иммунного ответа (ERMS, например производные имидазохинолина, описанные в патенте США 4689338, которые включают продукт имиквимод (Imiquimod) для лечения остроконечных кондилом, и производные аденина, описанные в WO 98/01448 и WO 99/28321. В WO 2009/067081 описан класс производных пиримидина, обладающих иммуномодулирующими свойствами, которые действуют через TLR7 и которые полезны в лечении вирусных или аллергических заболеваний и рака. 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат и некоторые его соли описаны в примере 57, приведенном в международной патентной заявкеPCT/SE2008/051334, поданной 21 ноября 2008 г., опубликованной как WO 2009/067081. В технологии приготовления лекарственных форм важно, чтобы лекарственное вещество (активное соединение) было в форме, в которой им удобно манипулировать и в которой его удобно обрабатывать. Это имеет большое значение не только с точки зрения получения коммерчески жизнеспособного процесса производства самого лекарственного вещества, но и с точки зрения последующего изготовления фармацевтических композиций, содержащих активное соединение и подходящие эксципиенты. В этой связи, химическая стабильность и физическая стабильность активного соединения являются важными факторами. Необходимо,чтобы активное соединение и композиции, содержащие его, действительно были способны храниться в течение целесообразных периодов времени без каких-либо значительных изменений физико-химических характеристик (например, химического состава, плотности, гигроскопичности и растворимости) активного соединения. Кроме того, если активное соединение предназначено для включения в состав композиции для введения в легкие, например с помощью сухого порошкового ингалятора, такого как устройство Turbuhaler, то желательно, чтобы активное соединение можно было без труда микронизировать с получением порошка с хорошими текучими свойствами и содержащего чрезвычайно тонкую фракцию частиц (т.е. фракцию, в которой частицы активного соединения имеют масс-медианный диаметр (MMD), меньший или равный 10 мкм (микрон. Такая фракция способна доставляться глубоко в легкие, что способствует более быстрому и лучшему всасыванию активного соединения. Специалисту понятно, что обычно если лекарственное вещество может быть без труда получено в стабильной форме, например в стабильной кристаллической форме, то это может дать преимущества, такие как легкость обращения, легкость приготовления и увеличенный срок хранения подходящих фармацевтических композиций, а также более надежный профиль растворимости. Неожиданно было обнаружено, что существует возможность получения некоторых солей 4(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата, имеющих улучшенные физико-химические свойства по сравнению с соединением в форме свободного основания,которые могут быть приготовлены в виде сухой порошковой композиции для назального/легочного введения. Структура 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (далее "соединение (1)") изображена ниже Таким образом, в соответствии с настоящим изобретением предложена бензойнокислая, дисахариновая, 1-гидрокси-2-нафтойнокислая или фумаровокислая соль соединения (1) (активный фармацевтический ингредиент, АФИ). Кроме того, в настоящем изобретении раскрыты транс-коричнокислая, метансульфоновокислая, 2,5-дихлорбензолсульфоновокислая, 1,5-нафталиндисульфоновокислая, лимоннокислая, фосфорнокислая, L-виннокислая и янтарнокислая соли соединения (1). В контексте настоящего изобретения термин "соль" относится к кристаллическому веществу, в котором АФИ и кислота ионизированы или, альтернативно, в котором оба компонента образуют отчетливую межмолекулярную взаимосвязь, такую как водородная связь, для объединения и получения в результате однородного кристаллического вещества (со-кристалла). Очевидным является то, что соль согласно изобретению может быть частично ионизированной и частично сокристаллической. В другом аспекте настоящего изобретения предложена бензойнокислая, дисахариновая, 1-гидрокси 2-нафтойнокислая или фумаровокислая соль соединения (1), которая демонстрирует характеристические пики дифракции рентгеновских лучей на порошке (выраженные в градусах 2), которые представлены в табл. I-XIX в примере 20, приведенном ниже. Кроме того, в настоящем изобретении раскрыты транскоричнокислая, метансульфоновокислая, 2,5-дихлорбензолсульфоновокислая, 1,5-нафталиндисульфоновокислая, лимоннокислая, фосфорнокислая, L-виннокислая и янтарнокислая соли, которые демонстрируют характеристические пики дифракции рентгеновских лучей на порошке (выраженные в градусах 2),которые представлены в табл. I-XIX в примере 20, приведенном ниже. Если не указано иное, данные дифракции рентгеновских лучей на порошке, описанные здесь, были получены с использованием CuK-излучения, как описано в примерах. В данном изобретении также раскрыты сольваты (включая гидраты) солей по изобретению. Однако соли по изобретению предпочтительно являются безводными и предпочтительно находятся в несольватированной форме. В одном из воплощений данного изобретения соль по изобретению или ее сольват имеет кристаллические свойства и предпочтительно является по меньшей мере на 50% кристаллической(им), более предпочтительно по меньшей мере на 60% кристаллической(им), еще более предпочтительно по меньшей мере на 70% кристаллической(им) и наиболее предпочтительно по меньшей мере на 80% кристаллической(им). Кристалличность может быть оценена стандартными рентгеновскими дифрактометрическими методами. В другом воплощении данного изобретения соль или ее сольват является от 50, 60, 70, 80 или 90% до 95, 96, 97, 98, 99 или 100% кристаллической(им). Если не указано иное, стехиометрическое соотношение соединения (1) к кислоте в соли по изобретению может варьировать, например, от 2:1 до 1:2 или представлять собой любое соотношение в этих пределах, такое как 1:1. Примеры предпочтительных солей по изобретению включают соли соединения(1) в соотношении соединение (1):кислота, равном 1:1, с бензойной кислотой, или соли соединения (1) в соотношении соединение (1):кислота, равном 1:2, с сахарином (т.е. дисахариновая соль), 1-гидрокси-2 нафтойной кислотой (т.е. ди-1-гидрокси-2-нафтойнокислая соль). Другая подходящая соль представляет собой соль 1:2 с фумаровой кислотой (т.е. дифумаровокислая соль). Примеры других солей соединения(1) включают соли соединения (1) в соотношении соединение (1):кислота, равном 1:1, с транс-коричной кислотой, метансульфоновой кислотой, 2,5-дихлорбензолсульфоновой кислотой, 1,5-нафталиндисульфоновой кислотой, лимонной кислотой, фосфорной кислотой, фумаровой кислотой, L-винной кислотой и янтарной кислотой или соли соединения (1) в соотношении соединение (1):кислота, равном 1:2, с 2,5 дихлорбензолсульфоновой кислотой (т.е. ди-2,5-дихлорбензолсульфоновокислая соль), фосфорной кислотой (т.е. дифосфорнокислая соль) или янтарной кислотой (т.е. диянтарнокислая соль). Авторы данного изобретения неожиданно обнаружили, что дисахариновая, дифумаровокислая, ди 1-гидрокси-2-нафтойнокислая и бензойнокислая соли соединения (1) демонстрируют хорошую химическую стабильность в твердом состоянии при хранении в условиях высокой температуры и высокой влажности (например, при 40C и относительной влажности 75%). Кроме того, исследования стабильности смесей дисахариновой соли с моногидратом лактозы и смесей дифумаровокислой соли с моногидратом лактозы показывают, что эти соли в высокой степени стабильны также в присутствии моногидрата лактозы, традиционного носителя, используемого в композициях лекарственных средств для ингаляции. Стабильность этих солей иллюстрируется в приведенных в данном описании примерах. Следовательно,можно считать, что эти соли имеют преимущество, поскольку они демонстрируют, например, улучшенную стабильность при хранении. Соответственно, в одном из воплощений данного изобретения предложена дисахариновая, дифумаровокислая, ди-1-гидрокси-2-нафтойнокислая или бензойнокислая соль соединения (1). В другом воплощении данного изобретения предложена дисахариновая, ди-1-гидрокси-2-нафтойнокислая или бензойнокислая соль соединения (1). В еще одном воплощении данного изобретения предложена дисахариновая, дифумаровокислая или бензойнокислая соль соединения (1). В еще одном воплощении данного изобретения предложена дисахариновая или дифумаровокислая соль соединения (1). Дисахариновые соли соединения (1) В еще одном воплощении данного изобретения предложена дисахариновая соль соединения (1). Авторы настоящего изобретения обнаружили, что дисахариновая соль соединения (1) существует в нескольких кристаллических формах. Одна кристаллическая форма дисахариновой соли, далее "форма А дисахариновой соли соединения (1)", имеет картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 4. Наиболее значимые пики формы А представлены в табл. IV в примерах. Форма А дисахариновой соли соединения (1) представляется наиболее термодинамически стабильной кристаллической формой этой соли. Соответственно, в следующем аспекте данного изобретения предложена форма А дисахариновой соли соединения (1). Согласно еще одному аспекту данного изобретения предложена форма А дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 9,2, 14,9 или 15,2. Согласно еще одному аспекту данного изобретения предложена форма А дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 9,2, 10,3,11,4, 12,8, 14,9, 15,2, 22,9 или 23,4. Согласно еще одному аспекту данного изобретения предложена форма А дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 9,2, 14,9 и 15,2. Согласно еще одному аспекту данного изобретения предложена форма А дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 9,2, 10,3, 11,4, 12,8, 14,9, 15,2,22,9 и 23,4. Согласно еще одному аспекту данного изобретения предложена форма А дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма А имеет картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 4. При нагревании в дифференциальном сканирующем калориметре (ДСК) (условия такие, как описано в разделе "примеры") форма А дисахариновой соли соединения (1) демонстрирует эндотерму плавления с температурой начала примерно 124C и максимальной температурой примерно 127C, что иллюстрируется на фиг. 20. В данном изобретении также раскрыт способ получения формы А дисахариновой соли соединения(1), включающий (1) взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами сахарина в этилацетате и (2) кристаллизацию указанной формы А. Взаимодействие на стадии (1) соответственно проводят при температуре окружающей среды. Кристаллизация формы А на стадии (2) может происходить спонтанно после образования соли. В этом случае может быть необходимым перемешивание полученной суспензии соли для обеспечения полной кристаллизации. Перемешивание суспензии соли для удобства проводят при температуре окружающей среды. Как правило, перемешивание суспензии соли в течение нескольких суток в этилацетате,в течение, например, от 1 до 10 суток, например в течение примерно 6 суток, обеспечивает получение кристаллической формы А. В данном изобретении также раскрыт еще один способ получения формы А дисахариновой соли соединения (1), включающий (1) взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами сахарина в ацетонитриле; (2) концентрирование реакционной смеси и (3) кристаллизацию указанной формы А из этилацетата. Взаимодействие на стадии (1) соответственно проводят при температуре окружающей среды. Концентрирование смеси на стадии (2) может быть осуществлено, например, путем выпаривания некоторого или всего количества ацетонитрила. Кристаллизация формы А на стадии (3) может быть осуществлена, например, путем перемешивания суспензии или раствора соли в этилацетате. Перемешивание суспензии/раствора соли для удобства проводят при температуре окружающей среды. Обычно перемешивание в течение нескольких суток в этилацетате, предпочтительно от 1 до 10 суток, например от 2 до 7 суток, обеспечивает получение кристаллической формы А. Конкретные реакционные условия, которые приводят к образованию формы А дисахариновой соли соединения (1), иллюстрируются в примерах. Кристаллизацию формы А в способе, описанном выше, можно стимулировать введением затравочных кристаллов формы А. Затравочные кристаллы могут быть получены способами, описанными в примерах. Использование введения затравки является особенно предпочтительным в крупномасштабном производстве соли. Введение затравки также дает возможность использовать альтернативные раствори-3 021854 тели и условия процесса для получения формы А дисахариновой соли соединения (1). Соответственно, в одном из воплощений форму А дисахариновой соли соединения (1) получают способом, включающим(2) добавление этилацетата, поддерживая температуру смеси примерно 40C;(3) введение в смесь затравочных кристаллов формы А дисахариновой соли соединения (1);(5) выделение формы А дисахариновой соли соединения (1). На стадии (2) после введения затравочных кристаллов смесь соответствующим образом перемешивают в течение некоторого периода времени для обеспечения кристаллизации, например в течение примерно 5 ч. На стадии (4) смесь охлаждают, чтобы стимулировать дальнейшую кристаллизацию. В одном из воплощений смесь охлаждают до температуры примерно от 10 до 20C. В одном из воплощений смесь охлаждают до температуры примерно 20C. В одном из воплощений смесь охлаждают до температуры примерно 20C. В еще одном воплощении смесь охлаждают поэтапно сначала примерно до 35C и затем примерно до 15C. На первом этапе после охлаждения примерно до 35C смесь перемешивают в течение примерно 4 ч, после чего охлаждают примерно до 15C. Смесь затем соответствующим образом перемешивают в течение приблизительно более 2 ч, после чего выделяют форму А. Соль может быть подвергнута перекристаллизации путем растворения соли в ацетонитриле и перекристаллизации путем повторения стадий (2)-(5), указанных выше. Другая кристаллическая форма дисахариновой соли, далее "форма В дисахариновой соли соединения (1)", дает картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 5. Самые значимые пики формы В приведены в табл. V в примерах. Соответственно, в еще одном аспекте данного изобретения предложена форма В дисахариновой соли соединения (1). Согласно еще одному аспекту данного изобретения предложена форма В дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 12,0, 12,5,16,4 или 19,8. Согласно еще одному аспекту данного изобретения предложена форма В дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 7,0, 10,8,12,0, 12,5, 13,9, 16,4, 17,3 или 19,8. Согласно еще одному аспекту данного изобретения предложена форма В дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 12,0, 12,5, 16,4 и 19,8. Согласно еще одному аспекту данного изобретения предложена форма В дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 7,0, 10,8, 12,0, 12,5, 13,9, 16,4,17,3 и 19,8. Согласно еще одному аспекту данного изобретения предложена форма В дисахариновой соли соединения (1), характеризующаяся тем, что указанная форма В имеет картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 5. При нагревании в дифференциальном сканирующем калориметре (ДСК) (условия такие, как описано в разделе "примеры") форма В дисахариновой соли соединения (1) демонстрирует эндотерму плавления с температурой начала примерно 106C и максимальной температурой примерно 110C, что иллюстрируется на фиг. 21. Форма В дисахариновой соли соединения (1) может быть получена способом, включающим взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами сахарина в этилацетате или ацетонитриле. Форма В затем может быть подвергнута кристаллизации из этилацетата с использованием конкретных условий, описанных в примерах. Кристаллизацию формы В можно стимулировать введением в суспензию соли затравочных кристаллов формы В. Затравочные кристаллы могут быть получены одним из способов, описанных в примерах. Дифумаровокислая соль соединения (1) В еще одном воплощении данного изобретения предложена дифумаровокислая соль соединения (1). Дифумаровокислая соль соединения (1) является кристаллической и дает картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 19. Самые значимые пики дифумаровокислой соли представлены в табл. XIX в примерах. Согласно еще одному аспекту данного изобретения предложена дифумаровокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 9,1, 14,2, 15,8 или 20,4. Согласно еще одному аспекту данного изобретения предложена дифумаровокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 7,8, 9,1, 14,2, 15,8,18,7, 19,0, 20,4 или 24,7. Согласно еще одному аспекту данного изобретения предложена дифумаровокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 9,1, 14,2, 15,8 и 20,4. Согласно еще одному аспекту данного изобретения предложена дифумаровокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 7,8, 9,1, 14,2, 15,8, 18,7, 19,0, 20,4 и 24,7. В еще одном воплощении предложена дифумаровокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке, по существу, такую,как показано на фиг. 19. Измерения влагопоглощения методом гравиметрической сорбции пара (ДСП (динамическая сорбция пара), как описано в разделе "примеры") показали, что дифумаровокислая соль соединения (1) является незначительно гигроскопичной (влагопоглощение 0,2-2% мас./мас. при относительной влажности 80%, см. фиг. 22). В данном изобретении также раскрыт способ получения дифумаровокислой соли соединения (1),включающий (1) взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами фумаровой кислоты в ацетонитриле или смеси ацетонитрила и тетрагидрофурана (THF) с образованием дифумаровокислой соли и (2) кристаллизацию дифумаровокислой соли из диэтилового эфира. Взаимодействие на стадии (1) соответствующим образом проводят при температуре окружающей среды. Для удобства фумаровая кислота может быть растворена в THF. Этот раствор затем добавляют к раствору соединения (1) в ацетонитриле. Альтернативно, фумаровая кислота может быть добавлена к раствору соединения (1) в виде твердого вещества. После взаимодействия дифумаровокислая соль может быть выделена, например, путем выпаривания растворителя(ей). Кристаллизацию на стадии (2) удобно проводить путем суспендирования соли в диэтиловом эфире. Кристаллизация дифумаровокислой соли наблюдается после перемешивания суспензии при температуре окружающей среды в течение нескольких суток, например в течение от примерно 5 до 7 суток. В данном изобретении также раскрыт способ получения дифумаровокислой соли соединения (1),включающий (1) взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами фумаровой кислоты в этаноле и (2) кристаллизацию дифумаровокислой соли, например путем добавления подходящего антирастворителя, такого как изопропилацетат. Кристаллизацию дифумаровокислой соли можно стимулировать введением в смесь затравочных кристаллов дифумаровокислой соли. Затравочные кристаллы могут быть получены одним из способов,описанных в примерах. При использовании введения затравки для инициирования кристаллизации дифумаровокислой соли возможно применение широкого разнообразия растворителей и антирастворителей для кристаллизации. Например, дифумаровокислая соль может быть кристаллизована из спирта, такого как метанол или этанол. При использовании введения затравки удобно кристаллизовать дифумаровокислую соль из метанола или этанола с использованием подходящего антирастворителя для осуществления кристаллизации. Подходящие антирастворители включают, например, сложный эфир, такой как изопропилацетат. Можно считать, что использование системы растворителя/антирастворителя, такой как метанол/изопропилацетат, вместе с затравочными кристаллами обеспечивает удобный способ получения дифумаровокислой соли в больших масштабах. Соответственно, в одном из воплощений дифумаровокислую соль получают способом, включающим(1) растворение соединения (1) в этаноле и взаимодействие с приблизительно 2 молярными эквивалентами фумаровой кислоты;(2) добавление изопропилацетата, одновременно поддерживая температуру смеси примерно 30C;(3) введение в смесь затравочных кристаллов дифумаровокислой соли соединения (1);(4) добавление дополнительного количества изопропилацетата и охлаждение смеси до примерно 20C и(5) выделение дифумаровокислой соли соединения (1). Предпочтительно на стадии (1) соединение (1) растворяют в примерно 6 объемах этанола. На стадии (2) к смеси добавляют предпочтительно примерно 2,8 объемов изопропилацетата. На стадии (3) смесь подходящим образом перемешивают в течение примерно 2,5 ч, после чего вводят затравочные кристаллы для обеспечения кристаллизации. На стадии (4) к смеси добавляют предпочтительно примерно 3,2 объемов изопропилацетата. Смесь затем подходящим образом перемешивают в течение примерно 1 ч. Ди-1-гидрокси-2-нафтойнокислая соль соединения (1) В еще одном воплощении данного изобретения предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1). Ди-1-гидрокси-2-нафтойнокислая соль соединения (1) является кристаллической и дает картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 6. Самые значимые пики ди-1-гидрокси-2-нафтойнокислой соли представлены в табл. VI в примерах. В еще одном воплощении предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 8,3, 16,6, 19,4 или 23,4. В еще одном воплощении предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 8,3, 9,5, 11,5, 11,8, 12,8, 13,6,16,6, 16,9, 19,4 или 23,4. В еще одном воплощении предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 8,3, 16,6, 19,4 и 23,4. В еще одном воплощении предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 8,3, 9,5, 11,5, 11,8, 12,8, 13,6, 16,6, 16,9, 19,4 и 23,4. В еще одном воплощении предложена ди-1-гидрокси-2-нафтойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 6. В данном изобретения также раскрыт способ получения ди-1-гидрокси-2-нафтойнокислой соли соединения (1), включающий (1) взаимодействие соединения (1) с приблизительно 2 молярными эквивалентами 1-гидрокси-2-нафтойной кислоты в ацетонитриле, (2) концентрирование смеси из стадии (1) и(3) кристаллизацию 1-гидрокси-2-нафтойнокислой соли соединения (1). Концентрирование смеси на стадии (2) может быть достигнуто путем удаления некоторого или всего количества растворителя, например, путем выпаривания или дистилляции. Соответственно, на стадии(3) соль кристаллизуют, например, путем суспендирования соли в небольшом количестве этилацетата в течение нескольких суток (например, от 1 до 7 суток), как иллюстрируется в примерах. Кристаллизацию соли можно стимулировать введением в смесь затравочных кристаллов соли. Затравочные кристаллы могут быть получены одним из способов, описанных в примерах. Бензойнокислая соль соединения (1) В еще одном воплощении данного изобретения предложена бензойнокислая соль соединения (1). Бензойнокислая соль в этом воплощении представляет собой соль соединения (1) в соотношении 1:1, т.е. монобензойнокислую соль соединения (1). Монобензойнокислая соль соединения (1) является кристаллической и дает картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 1. Самые значимые пики монобензойнокислой соли показаны в табл. I в примерах. В еще одном воплощении предложена монобензойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 6,3, 9,3, 17,8 или 23,8. В еще одном воплощении предложена монобензойнокислая соль соединения (1), характеризующаяся тем, что указанная бензойнокислая соль имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно 6,3, 7,2, 9,3, 12,6, 15,6, 17,8,19,8, 22,2, 23,8 или 24,5. В еще одном воплощении предложена монобензойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 6,3, 9,3, 17,8 и 23,8 В еще одном воплощении предложена монобензойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при 2 примерно 6,3, 7,2, 9,3, 12,6, 15,6, 17,8, 19,8, 22,2, 23,8 и 24,5. В еще одном воплощении предложена монобензойнокислая соль соединения (1), характеризующаяся тем, что указанная соль имеет картину дифракции рентгеновских лучей на порошке, по существу, такую, как показано на фиг. 1. В данном изобретении также раскрыт способ получения монобензойнокислой соли соединения (1),включающий (1) взаимодействие соединения (1) с приблизительно 1 молярным эквивалентом бензойной кислоты в ацетонитриле; (2) концентрирование смеси со стадии (2) и (3) кристаллизацию монобензойнокислой соли соединения (1). Концентрирование смеси на стадии (2) может быть достигнуто, например, в результате удаления некоторого или всего количества растворителя путем выпаривания или дистилляции. Соответственно, на стадии (3) соль может быть кристаллизована, например, путем суспендирования соли в небольшом коли-6 021854 честве ацетонитрила, как описано в примерах. Кристаллизацию соли можно стимулировать введением в смесь затравочных кристаллов соли. Затравочные кристаллы могут быть получены одним из способов,описанных в примерах. В конкретных воплощениях данного изобретения индивидуальные кристаллические формы соли соединения (1), по существу, не содержат другие кристаллические формы этой соли соединения (1). Например, описанная кристаллическая форма А дисахариновой соли соединения (1) содержит менее 30%,20%, 15%, 10%, 5%, 3% или, что особенно предпочтительно, менее 1 мас.% других кристаллических форм дисахариновой соли соединения (1), таких как форма В. Соответственно, в одном из воплощений форма А дисахариновой соли соединения (1), по существу, не содержит форму В дисахариновой соли соединения (1). В конкретных воплощениях данного изобретения, когда стехиометрия соли указана конкретно, например соль с соотношением 1:1 соединения (1) к кислоте (т.е. монокислотная соль) или соль с соотношением 1:2 соединения (1) к кислоте (т.е. дикислотная соль), тогда соль предпочтительно, по существу,не содержит соли с другой стехиометрией. Например, дифумаровокислая соль соединения (1), по существу, не содержит монофумаровокислую соль. Соответственно, конкретная соль соединения (1) содержит менее 30%, 20%, 15%, 10%, 5%, 3% или, что особенно предпочтительно, менее 1 мас.% соли другой стехиометрии. Если в данном описании соли описаны как имеющие "картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при 2 примерно ", то картина ДРЛП(картина дифракции рентгеновских лучей на порошке) соли может содержать одно или более из перечисленных значений 2. Например, одно или более из перечисленных значений 2, 2 или более из перечисленных значений 2 или 3 или более из перечисленных значений 2. В предыдущих абзацах, где дано определение пиков дифракции рентгеновских лучей на порошке для кристаллических форм солей соединения (1), термин "примерно" использован в выражении "при 2 примерно ", чтобы показать, что точные положения пиков (т.е. перечисленные значения углов 2-тета) не должны рассматриваться как абсолютные значения, поскольку, как известно специалистам в данной области техники, точные положения пиков могут в небольшой степени варьировать от одного измерительного прибора к другому, от одного образца к другому или в результате использования незначительных изменений условий измерения. Выше в данном описании также указано, что кристаллические соли соединения (1) дают картины дифракции рентгеновских лучей на порошке, "по существу," такие же, как картины дифракции рентгеновских лучей на порошке, показанные на фиг. 1, 4, 5, 6 и 19, и имеют самые значимые пики (значения углов 2-тета), по существу, такие, как представлено в табл. I, IV, V, VI и XIX. Следует иметь в виду, что использование термина "по существу" в этом контексте также предназначено для того, чтобы показать, что значения углов 2-тета на картинах дифракции рентгеновских лучей на порошке могут в небольшой степени варьировать от одного прибора к другому, от одного образца к другому или в результате незначительных изменений используемых условий измерения, поэтому положения пиков, показанные на фигурах или указанные в таблицах, опять же не должны рассматриваться как абсолютные значения. Специалисту в области дифракции рентгеновских лучей на порошке известно, что на относительную интенсивность пиков могут влиять, например, размеры частиц выше приблизительно 30 мкм и неунитарные аспекты соотношений, которые могут влиять на анализ образцов. Кроме того, очевидно, что интенсивности могут колебаться в зависимости от экспериментальных условий и приготовления образцов, например от предпочтительной ориентации частиц в образце. Применение щелей с автоматической или фиксированной расходимостью также будет влиять на вычисление относительной интенсивности. Специалист в данной области техники может оперировать такими эффектами при сравнении дифракционных картин. Специалисту в области дифракции рентгеновских лучей на порошке также известно, что из-за разницы в высотах образцов и ошибок в калибровке позиции детектора может произойти небольшой сдвиг в положениях 2. Как правило, отклонение 0,1 от данного значения считается корректным. Специалисту в данной области техники также известно, что незначительные изменения в точках плавления, измеренных методом ДСК, могут иметь место в результате изменения чистоты образцов,подготовки образцов и условий измерения (например, скорости нагревания). Ясно, что альтернативные данные по точкам плавления могут быть следствием использования других типов оборудования или использования условий, отличающихся от условий, описанных в данном описании. Следовательно, числовые значения точек плавления и эндотерм, указанные в данном документе, не должны восприниматься в качестве абсолютных значений, и такие ошибки измерения не следует принимать во внимание при интерпретации данных ДСК. Типично, точки плавления могут варьировать в пределах 5C или менее. Соли соединения (1), описанные в данном документе, можно также характеризовать и/или отличать от других физических форм другими подходящими аналитическими методами, например методами БИКспектроскопии (спектроскопии в ближней инфракрасной области) или твердотельной ядерной магнитнорезонансной спектроскопии. Химическая структура солей соединения (1), описанных в данном документе, может быть подтверждена обычными методами, например методом протонного ядерного магнитно-резонансного (ЯМР) анализа. Получение соединения (1) Свободное основание (т.е. соединение (1, использованное в получении солей, описанных в данном документе, может быть получено, как описано в примере 57, приведенном в WO 2009/067081. Соединение (1) может быть также получено, как проиллюстрировано в приведенных в данном описании примерах. Один конкретный способ получения соединения (1) иллюстрируется на реакционной схеме 1, на которой также показано конечное получение формы А дисахариновой соли соединения (1). реакционная схема Конкретные реакционные условия, указанные на реакционной схеме, описаны более подробно в примерах. Следует также иметь в виду, что конкретные реакционные условия и растворители и т.п. не ограничиваются теми, которые указаны на реакционной схеме, и не накладывают ограничений на способ синтеза, проиллюстрированный на реакционной схеме. Соответственно, другие реакционные условия могут быть подходящими для получения соединения (1) способом, который иллюстрируется на реакционной схеме. Например, в одном независимом аспекте реакционной схемы на стадии (1) реакцию взаимодействия метил-3-гидрокси-2-метиленбутаноата с 2-(4-бромфенил)ацетонитрилом проводят в присутствии подходящего палладиевого катализатора и основания. Подходящим палладиевым катализатором является, например, PdCl2[Р(о-tol)3]2 (как указано на реакционной схеме 1), Pd[Р(трет-Bu)3]2, Pd(ОАс)2 с трифенилфосфином или Pd(OAc)2 с тетра-н-бутиламмонийбромидом (ТВАВ). Основание может представлять собой, например, органическое аминное основание или неорганическое основание. Примеры органических аминных оснований включают триэтиламин и N,N-дициклогексилметиламин. Примеры неорганических оснований включают подходящее карбонатное основание, такое как бикарбонат натрия. Это взаимодействие удобно проводить в присутствии подходящего растворителя, например полярного апротонного растворителя, такого как тетрагидрофуран (THF), ацетонитрил, пропионитрил или N,N-диметилформамид (DMF). Реакционная температура может быть равна 70-80C или температуре дефлегмации растворителя в случае THF. Например, в еще одном независимом аспекте реакционной схемы 1 на стадии (3) взаимодействие продукта стадии (2) (2-(4-2-амино-4-гидрокси-6-метилпиримидин-5-ил)метил)фенил)ацетонитрила) с арилсульфонилгалогенидом может быть осуществлено в присутствии основания. Подходящим арилсульфонилгалогенидом является, например, замещенный бензолсульфонилгалогенид, такой как 2,4,6 триизопропилбензолсульфонилхлорид (IPBsCl, как указано на реакционной схеме 1), 2,4-диметоксибензолсульфонилхлорид, 4-метоксибензолсульфонилхлорид или 2-мезитиленсульфонилхлорид (2,4,6 триметилбензолсульфонилхлорид). Основание может представлять собой, например, органическое аминное основание или неорганическое основание. Примеры органических аминных оснований включают 1,4-диазабицикло[2.2.2]октан (DABCO), N-метилпирролидин, N-метилморфолин, N,N,N',N'-тетраметил-1,3-пропандиамин (TMPDA), TMPDA с каталитическим количеством N-метилимидазола (NMI),1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) с каталитическим количеством NMI или гидрохлорид триме-8 021854 тиламина с двойным-тройным соотношением триэтиламина. Примеры неорганических оснований включают подходящее карбонатное основание, такое как карбонат калия. Растворитель может представлять собой полярный апротонный растворитель или ароматический углеводород. Взаимодействие осуществляют в присутствии подходящего растворителя, например полярного апротонного растворителя, такого как ацетонитрил, тетрагидрофуран (THF) или 2-метилтетрагидрофуран, или ароматического углеводорода, такого как толуол. Заболевания и медицинские состояния Соли (включая сольватированные формы) по изобретению полезны в качестве модуляторов активности TLR7, и, следовательно, их можно вводить млекопитающему, включая человека, для лечения следующих состояний или заболеваний: 1) дыхательные пути: обструктивные заболевания дыхательных путей, включая астму, в том числе бронхиальную, аллергическую, эндогенную, экзогенную астму, астму, вызываемую физической нагрузкой, астму, вызываемую лекарственными средствами (включая астму, вызываемую аспирином и нестероидными противовоспалительными лекарственными средствами (NSAID, и астму, вызываемую пылью, как перемежающуюся, так и персистентную, и всех типов тяжести, а также другие причины гиперреактивности дыхательных путей; хроническое обструктивное заболевание легких (COPD); бронхит,включая инфекционный и эозинофильный бронхит; эмфизема; бронхоэктазия; муковисцидоз; саркоидоз; легкое фермера и родственные заболевания; пневмонит с гиперчувствительностью; фиброз легкого,включая криптогенный фиброальвеолит, идиопатическую интерстициальную пневмонию, фиброзное осложнение антинеопластической терапии и хронической инфекции, включая туберкулез и аспергиллез,а также другие грибковые инфекции; осложнения после трансплантации легкого; васкулитные и тромботические нарушения сосудистой сети легких и легочная гипертензия; противокашлевая активность,включающая лечение хронического кашля, связанного с воспалением и секреторными состояниями дыхательных путей, и ятрогенного кашля; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, включая нервный ринит (сенную лихорадку); назальный полипоз; острая вирусная инфекция, включая насморк и инфекцию, обусловленную респираторным синцитиальным вирусом, вирусом гриппа, коронавирусом (в том числе SARS(тяжелый острый респираторный синдром и аденовирусом; 2) кожа: псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы и реакции гиперчувствительности отсроченного типа; фито- и фотодерматиты; себорейный дерматит,герпетиформный дерматит, красный плоский лишай, склерозный и атрофический лишай, гангренозная пиодермия, кожный саркоид, дискоидная красная волчанка, пемфигус, пемфигоид, врожденный буллезный эпидермолиз, крапивница, ангионевротический отек, васкулиты, токсические эритемы, кожные эозинофилии, гнездная алопеция, плешивость по мужскому типу, синдром Свита, синдром ВебераКрисчена, мультиформная эритема; целлюлит как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические поражения; вызываемые лекарственными средствами расстройства, включая лекарственную сыпь; 3) глаза: блефарит; конъюнктивит, включая круглогодичный и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хороидит; аутоиммунное заболевание; дегенеративные или воспалительные расстройства, поражающие сетчатку; офтальмит, включая симпатический офтальмит; саркоидоз; инфекции, включая вирусные, грибковые и бактериальные; 4) мочеполовые: нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и хроническую язву мочевого пузыря; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульво-вагинит; болезнь Пейрони; эректильная дисфункция (как мужская, так и женская); 5) отторжение трансплантата: острое и хроническое, например после трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы или после переливания крови; или хроническая болезнь "трансплантат против хозяина"; 6) другие аутоиммунные и аллергические расстройства, включая ревматоидный артрит, синдром раздраженного кишечника, системная красная волчанка, рассеянный склероз, тиреоидит Хашимото, базедовая болезнь, болезнь Аддисона, сахарный диабет, идиопатическая тромбоцитопеническая пурпура,эозинофильный фасцит, гипер-IgE синдром, антифосфолипидный синдром и синдром Сезари; 7) онкология: лечение распространенных видов рака, включая рак предстательной железы, рак молочной железы, рак легкого, рак яичника, рак поджелудочной железы, рак толстой и ободочной кишки,рак желудка, рак кожи и опухоли мозга и злокачественности, поражающие костный мозг (включая лейкозы) и лимфопролиферативные системы, такие как ходжкинская и неходжкинская лимфома; включая предупреждение и лечение метастатического заболевания и рецидивов опухолей и паранеопластические синдромы; и 8) инфекционные заболевания: вирусные заболевания, такие как остроконечные кондиломы, обыкновенные бородавки, роговые бородавки, гепатит В, гепатит С, вирус простого герпеса, контагиозный моллюск, оспа, вирус иммунодефицита человека (HIV), вирус папилломы человека (HPV), цитомегаловирус (CMV), вирус ветряной оспы (VZV), риновирус, аденовирус, коронавирус, грипп, парагрипп; бак-9 021854 териальные заболевания, такие как туберкулез и Mycobacterium avium, лепра; другие инфекционные заболевания, такие как грибковые заболевания, хламидиоз, кандидоз, аспергиллез, криптококковый менингит, пневмоцистная пневмония, вызываемая Pneumocystis carnii, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомозная инфекция и лейшманиоз. Таким образом, в настоящем изобретении раскрыты соль соединения (1), определенная в данном документе, или сольват этой соли для применения в терапии. В настоящем изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении лекарственного средства для применения в терапии. В контексте настоящего изобретения термин "терапия" также охватывает "профилактику", если нет иных конкретных указаний. Термины "терапевтический" и "терапевтически" следует толковать соответственно. Профилактика, в частности, относится к лечению лиц, у которых ранее уже был эпизод данного заболевания или состояния или у которых имеется повышенный риск развития данного заболевания или состояния. Лицами, имеющими риск развития конкретного заболевания или состояния, обычно считаются те лица, которые имеют семейную историю данного заболевания или состояния, или лица, которые по результатам генетического тестирования или скрининга идентифицированы как особенно восприимчивые к развитию данного заболевания или состояния. В частности, соли (включая сольватированные формы) по изобретению могут быть использованы в лечении астмы, COPD, аллергического ринита, аллергического конъюнктивита, атопического дерматита,рака, гепатита В, гепатита С, HIV, HPV, бактериальных инфекций и дерматоза. Кроме того, эти соли могут быть также полезны в качестве вакцинных адъювантов. Соответственно, в еще одном аспекте данного изобретения предложено применение соли соединения (1), определенной в данном документе, для лечения астмы, COPD или аллергического ринита. Кроме того, в настоящем изобретении раскрыто применение сольвата этой соли для лечения астмы, COPD или аллергического ринита. В еще одном аспекте данного изобретения предложено применение соли соединения (1), определенной в данном документе, для лечения астмы. Кроме того, в настоящем изобретении раскрыто применение сольвата этой соли для лечения астмы. В еще одном аспекте данного изобретения предложено применение соли соединения (1), определенной в данном документе, для лечения COPD. Кроме того, в настоящем изобретении раскрыто применение сольвата этой соли для лечения COPD. В еще одном аспекте данного изобретения предложено применение соли соединения (1), определенной в данном документе, для лечения аллергического ринита. Кроме того, в настоящем изобретении раскрыто применение сольвата этой соли для лечения аллергического ринита. В данном изобретении также раскрыты соль соединения (1), определенная в данном документе, или сольват этой соли для применения в качестве вакцинного адъюванта. В данном изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении лекарственного средства для лечения астмы, COPD или аллергического ринита. В данном изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении лекарственного средства для лечения астмы. В данном изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении лекарственного средства для лечения COPD. В данном изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении лекарственного средства для лечения аллергического ринита. В данном изобретении также раскрыто применение соли соединения (1), определенной в данном документе, или сольвата этой соли в изготовлении вакцины для лечения заболевания или состояния. В данном изобретении раскрыт способ лечения воспалительного заболевания у пациента, страдающего указанным заболеванием или имеющего риск развития указанного заболевания, включающий введение пациенту терапевтически эффективного количества соли соединения (1), определенной в данном документе, или сольвата этой соли. В данном изобретении также раскрыт способ лечения заболеваний дыхательных путей, например обратимого обструктивного заболевания дыхательных путей, такого как астма, у пациента, страдающего указанным заболеванием или имеющего риск развития указанного заболевания, включающий введение пациенту терапевтически эффективного количества соли соединения (1), определенной в данном документе, или сольвата этой соли. В данном изобретении также раскрыт способ лечения или снижения риска развития заболевания или состояния, при котором имеет место или причиной которого является аномальный рост клеток (например, рака), включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соли соединения (1), определенной в данном документе, или сольвата этой соли. В данном изобретении также раскрыт способ лечения или снижения риска развития заболевания или состояния, при котором имеет место или причиной которого является аномальный рост клеток (например, рака), включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества вакцины и соли соединения (1), определенной в данном документе, или сольвата этой соли. В данном изобретении также раскрыт способ усиления ответной реакции на вакцину у пациента,включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества вакцины и соли соединения (1), определенной в данном документе, или сольвата этой соли. Для вышеупомянутых терапевтических применений вводимая дозировка будет, разумеется, варьировать в зависимости от используемой соли, способа введения, желаемого лечения и показанного расстройства. Например, суточная дозировка (сольватированной) соли, если ее вводят ингаляцией, может находиться в диапазоне от 0,05 микрограммов на килограмм массы тела (мкг/кг) до 100 микрограммов на килограмм массы тела (мкг/кг). Например, доза может составлять от примерно 0,1 до 100 мкг/кг, например примерно 0,1, 0,5, 1, 2, 5, 10, 20, 50 или 100 мкг/кг. Альтернативно, если (сольватированную) соль вводят перорально, то суточная дозировка может находиться в диапазоне от 0,01 микрограммов на килограмм массы тела (мкг/кг) до 100 миллиграммов на килограмм массы тела (мг/кг). Дозировки, упомянутые в данном описании, относятся к дозе соединения (1) в виде свободного основания. Соответственно, эквивалентная доза конкретной соли будет выше вследствие более высокой молекулярной массы по сравнению со свободным основанием. Соли по изобретению можно применять сами по себе, но, как правило, их будут вводить в форме фармацевтической композиции, в которой соль или ее сольват (активный ингредиент) содержится вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. Общепринятые методики выбора и приготовления фармацевтических композиций описаны (см., например, в "Pharmaceuticals - TheScience of Dosage Form Designs", M.E. Aulton, Churchill Livingstone, 1988). В зависимости от способа введения фармацевтическая композиция может содержать от 0,05 до 99 мас.% (массовый процент), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента (все массовые проценты рассчитаны от общей массы композиции). Согласно настоящему изобретению предложена также фармацевтическая композиция для использования в лечении заболевания, модулируемого Toll-подобным рецептором 7 (TLR7), содержащая соль соединения (1), определенную в данном документе, или сольват этой соли вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. Согласно настоящему изобретению предложена также фармацевтическая композиция для использования в лечении заболевания, модулируемого Toll-подобным рецептором 7 (TLR7), содержащая смесь соли соединения (1), определенной в данном документе, или сольвата этой соли с фармацевтически приемлемым адъювантом, разбавителем или носителем. Фармацевтические композиции можно вводить местно (например, на кожу или в легкое и/или дыхательные пути (введением путем пероральной или назальной ингаляции в форме, например, кремов,растворов, суспензий, гептафторалкановых (HFA) аэрозолей и сухих порошковых лекарственных форм,например лекарственных форм в ингаляторе, известном как Turbuhaler; или системно, например путем перорального введения в форме таблеток, капсул, сиропов, порошков или гранул; или путем парентерального введения в форме растворов или суспензий; или путем подкожного введения; или путем ректального введения в форме суппозиториев; или трансдермально. Фармацевтические композиции для введения ингаляцией В одном из воплощений данного изобретения фармацевтическую композицию вводят ингаляцией(пероральной или назальной). Соль соединения (1) можно вводить с помощью устройства для доставки, например сухого порошкового ингалятора, дозирующего ингалятора, небулайзера или устройства для назальной доставки. Такие устройства известны. В еще одном воплощении фармацевтическую композицию вводят с помощью сухого порошкового ингалятора (DPI).DPI может быть "пассивным", то есть активируемый вдохом, или "активным", когда порошок дозируется каким-либо механизмом, иным чем вдох пациента, например за счет подвода находящегося внутри сжатого воздуха. В настоящее время доступны три типа пассивных сухих порошковых ингаляторов: однодозовые ингаляторы, ингаляторы с многократными стандартными дозами или многодозовые (резервуарные) ингаляторы. В однодозовых устройствах индивидуальные дозы находятся обычно в желатиновых капсулах, и их нужно загружать в ингалятор перед применением. Примеры таких ингаляторов включают устройства Spinhaler (Aventis), Rotahaler (GlaxoSmithKline), Aeroliser (Novartis), Inhalator(Boehringer) и Eclipse (Aventis). Ингаляторы с многократными стандартными дозами содержат множество индивидуально упакованных доз либо в виде множества желатиновых капсул, либо в блистерах. Примеры таких ингаляторов включают устройства Diskhaler (GlaxoSmithKline), Diskus (GlaxoSmithKline) и Aerohaler (Boehringer). В многодозовых устройствах лекарственное средство содержится в виде неразделенного на дозы порошка в резервуаре, из которого отмериваются индивидуальные дозы. Примеры таких ингаляторов включают устройства Turbuhaler (AstraZeneca), Easyhaler (Orion), Novolizer(ASTA Medica), Clickhaler (Innovata Biomed) и Pulvinal (Chiesi). Ингалируемая фармацевтическая композиция или сухая порошковая форма для использования вDPI могут быть приготовлены путем смешивания тонкоизмельченного активного ингредиента (имеющего, как правило, масс-медианный диаметр, равный и менее 10 мкм, предпочтительно равный или менее 5 мкм) с веществом-носителем, например моно-, ди- или полисахаридом, сахарным спиртом или другим полиолом. Подходящими носителями являются сахара или сахарные спирты, например лактоза, глюкоза,раффиноза, мелезитоза, лактитол, малтитол, трегалоза, сахароза, маннит и крахмал. Частицы носителя могут иметь масс-медианный диаметр от 20 до 1000 мкм, обычно от 50 до 500 мкм. Порошковая смесь затем может быть, если требуется, расфасована в твердые желатиновые капсулы, обеспечивая содержание в каждой из них желаемой дозы активного ингредиента. Альтернативно, ингалируемая фармацевтическая композиция может быть приготовлена путем переработки тонкоизмельченного порошка (например, состоящего из частиц тонкоизмельченного активного ингредиента и тонкоизмельченного носителя) в сферы, которые распадаются в процессе осуществления ингаляции. Этим сфероидизированным порошком заполняют предназначенный для лекарственного средства резервуар многодозового ингалятора, например ингалятора, известного как Turbuhaler, в котором дозатор отмеривает желаемую дозу, которую затем вдыхает пациент. Соответственно, согласно настоящему изобретению предложен также сухой порошковый ингалятор, в частности сухой порошковый ингалятор с многократными стандартными дозами, содержащий ингалируемую фармацевтическую композицию по изобретению. В другом воплощении соль соединения (1) вводят с помощью ингалятора, дозирующего отмеренные дозы (MDI), в частности ингалятора, дозирующего отмеренные дозы под давлением (pMDI). pMDI содержит активное вещество в виде подходящего раствора или суспензии в контейнере под давлением. Активное вещество доставляется в результате приведения в действие клапана на pMDI устройстве. Приведение в действие может быть осуществлено вручную или посредством вдоха. В pMDI, которые приводятся в действие вручную, устройство приводят в действие пользователи, когда они делают ингаляцию,например путем нажатия на подходящий механизм высвобождения на pMDI устройстве. pMDI, приводимые в действие посредством вдоха, приводятся в действие, когда пациент делает вдох через мундштук ингалятора pMDI. Это может быть предпочтительным, так как приведение в действие устройств синхронизируется с вдохом пациента и может обеспечивать более согласованное дозирование активного вещества. Примером pMDI устройств является Rapihaler (AstraZeneca). Ингалируемая фармацевтическая композиция для применения в pMDI может быть приготовлена путем растворения или диспергирования соли соединения (1) в подходящем пропелленте с использованием или без использования дополнительных эксципиентов, таких как растворители (например, этанол),поверхностно-активных веществ, смазывающих веществ, консервантов или стабилизирующих агентов. Подходящие пропелленты включают углеводородные, хлорфторуглеродные и гидрофторалкановые (например, гептафторалкановые) пропелленты или смеси любых таких пропеллентов. Предпочтительными пропеллентами являются P134a и P227, каждый из которых может быть использован один или в комбинации с другими пропеллентами и/или поверхностно-активным веществом и/или другими эксципиентами. При использовании соли соединения (1) в виде суспензии соль предпочтительно присутствует в тонкоизмельченной форме (имеющей масс-медианный диаметр, обычно равный или менее 10 мкм, предпочтительно равный или менее 5 мкм). В еще одном воплощении соль соединения (1) вводят с помощью ингалятора, дозирующего отмеренные дозы, в комбинации со спейсером. Подходящие спейсеры известны и включают Nebuchamber(AstraZeneca) или Volumatic (GSK). В еще одном воплощении соль соединения (1) вводят с помощью небулайзера. Подходящие небулайзеры известны. Ингалируемая фармацевтическая композиция для использования в небулайзере может быть приготовлена путем диспергирования или предпочтительно растворения соли соединения (1) в подходящей водной среде. Композиция может также содержать, например, подходящие регуляторы pH и/или тоничности, поверхностно-активные вещества и консерванты. Примером подходящей композиции является композиция, содержащая соль соединения (1), цитратный буфер и физиологический раствор. В еще одном воплощении соль соединения (1) вводят назально в виде спрея из подходящего устройства для назальной доставки, например насоса-распылителя или MDI, адаптированного для назальной доставки. Альтернативно, соль можно вводить назально в виде порошка с использованием подходящегоDPI устройства, например Rhinocort Turbuhaler (AstraZeneca). Назально ингалируемая фармацевтическая композиция для использования в насосе-распылителе или назальном MDI устройстве может быть приготовлена путем диспергирования или предпочтительно растворения соли соединения (1) в подходящей водной среде, подобной среде, описанной выше для ингаляции посредством MDI устройства. Подходящими сухими порошковыми композициями для назальной доставки являются композиции, которые описаны выше для доставки с помощью DPI. Однако если необходимо ограничивать проникание соединения в легкое и удерживание соединения в носовой полости, то может потребоваться использование соединения в виде частиц большего размера, например частиц со средним диаметром примерно более 10 мкм, например от 10 до 50 мкм. Соответственно, согласно настоящему изобретению предложено также ингаляторное устройство,подходящее для назального введения (например, сухой порошковый ингалятор, в частности сухой порошковый ингалятор с множеством стандартных доз или pMDI ингалятор), содержащий ингалируемую фармацевтическую композицию по изобретению. Соли по изобретению можно также вводить совместно с другими соединениями, применяемыми для лечения вышеуказанных состояний. Примеры таких дополнительных соединений включают соединения, описанные в WO 2009/067081. Следует иметь в виду, что термин "соль соединения (1)", упоминаемый в отношении применений,способов лечения, фармацевтических композиций и введения, охватывает любую из солей, описанных в данном документе, например бензойнокислую, транс-коричнокислую, метансульфоновокислую, дисахариновую, 1-гидрокси-2-нафтойнокислую, ди-1-гидрокси-2-нафтойнокислую, 2,5-дихлорбензолсульфоновокислую, ди-2,5-дихлорбензолсульфоновокислую, 1,5-нафталиндисульфоновокислую, лимоннокислую,фосфорнокислую, дифосфорнокислую, фумаровокислую, дифумаровокислую, L-виннокислую, янтарнокислую, диянтарнокислую соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата. В данном изобретении, следовательно, также раскрыты комбинированные терапии, при которых соль по изобретению или фармацевтическую композицию, содержащую соль по изобретению, вводят одновременно или последовательно, или в виде объединенного препарата с другим терапевтическим агентом или агентами, для лечения одного или более перечисленных состояний. Краткое описание графических материалов На фиг. 1 представлена картина дифракции рентгеновских лучей на порошке монобензойнокислой соли соединения (1). На фиг. 2 представлена картина дифракции рентгеновских лучей на порошке моно-транс-коричнокислой соли соединения (1). На фиг. 3 представлена картина дифракции рентгеновских лучей на порошке монометансульфоновокислой соли соединения (1). На фиг. 4 представлена картина дифракции рентгеновских лучей на порошке дисахариновой соли соединения (1) (форма А). На фиг. 5 представлена картина дифракции рентгеновских лучей на порошке дисахариновой соли соединения (1) (форма В). На фиг. 6 представлена картина дифракции рентгеновских лучей на порошке ди-1-гидрокси-2 нафтойнокислой соли соединения (1). На фиг. 7 представлена картина дифракции рентгеновских лучей на порошке моно-2,5-дихлорбензолсульфоновокислой соли соединения (1). На фиг. 8 представлена картина дифракции рентгеновских лучей на порошке ди-2,5-дихлорбензолсульфоновокислой соли соединения (1). На фиг. 9 представлена картина дифракции рентгеновских лучей на порошке моно-1,5-нафталиндисульфоновокислой соли соединения (1) (форма А). На фиг. 10 представлена картина дифракции рентгеновских лучей на порошке моно-1,5-нафталиндисульфоновокислой соли соединения (1) (форма В). На фиг. 11 представлена картина дифракции рентгеновских лучей на порошке монолимоннокислой соли соединения (1) (форма А). На фиг. 12 представлена картина дифракции рентгеновских лучей на порошке монолимоннокислой соли соединения (1) (форма В). На фиг. 13 представлена картина дифракции рентгеновских лучей на порошке монофосфорнокислой соли соединения (1). На фиг. 14 представлена картина дифракции рентгеновских лучей на порошке дифосфорнокислой соли соединения (1). На фиг. 15 представлена картина дифракции рентгеновских лучей на порошке монофумаровокислой соли соединения (1). На фиг. 16 представлена картина дифракции рентгеновских лучей на порошке моно-L-виннокислой соли соединения (1). На фиг. 17 представлена картина дифракции рентгеновских лучей на порошке моноянтарнокислой соли соединения (1). На фиг. 18 представлена картина дифракции рентгеновских лучей на порошке диянтарнокислой соли соединения (1). На фиг. 19 представлена картина дифракции рентгеновских лучей на порошке дифумаратной соли соединения (1). На фиг. 20 представлена кривая дифференциальной сканирующей калориметрии (ДСК) для формы А дисахариновой соли соединения (1). Ось x показывает температуру (C), и ось у показывает тепловой поток (ватты/г). На фиг. 21 представлена кривая дифференциальной сканирующей калориметрии (ДСК) для формы В дисахариновой соли соединения (1). Ось x показывает температуру (C), и ось у показывает тепловой поток (ватты/г). На фиг. 22 представлен изотермический график динамической сорбции пара (ДСП) для дифумаровокислой соли соединения (1). Ось х показывает относительную влажность (ОВ %), и ось у показывает изменение массы образца. На фиг. 23 представлен изотермический график динамической сорбции пара (ДСП) для монофумаровокислой соли соединения (1). Ось x показывает относительную влажность (ОВ %), и ось у показывает изменение массы образца. На фиг. 24 представлены данные по стабильности при хранении моносахариновой (2 разные партии, закрашенные треугольники), моно-транс-коричнокислой (закрашенные кружочки), моноянтарнокислой (закрашенные ромбики), монобензойнокислой (незакрашенные ромбики), дифумаровокислой(незакрашенные кружочки), дигидроксинафтойнокислой (незакрашенные треугольники) и дисахариновой (крестики) солей соединения (1) при хранении при 40C и относительной влажности 75%. Ось x показывает время (недели), и ось у показывает % (мас./мас.) продукта разложения, представляющего собой кислоту формулы (А) (приведенной в примере 22). На фиг. 25 представлены данные по стабильности при хранении смесей моногидрата лактозы с моносахариновой (закрашенные треугольники), монобензойнокислой (незакрашенные ромбики), дифумаровокислой (незакрашенные кружочки) и дисахариновой (крестики) солями соединения (1) при хранении при 40C и относительной влажности 75%. Ось x показывает время (недели), и ось у показывает %(мас./мас.) продукта разложения, представляющего собой кислоту формулы (А) (приведенной в примере 22). Примеры Настоящее изобретение далее дополнительно разъясняется со ссылкой на приведенные ниже иллюстративные примеры, в которых, если не указано иное(1) температуры приведены в градусах Цельсия (C); операции проводили при комнатной температуре или при температуре окружающей среды, то есть при температуре в пределах 18-25C;(2) как правило, ход реакций отслеживали методом ВЭЖХ (высокоэффективная жидкостная хроматография), и времена реакций приведены только для иллюстрации;(3) выходы приведены только для иллюстрации и необязательно являются теми, которые могут быть достигнуты тщательной разработкой процесса; получения повторяли, если требовалось больше вещества;(4) химические символы имеют их обычные значения; использованы единицы и символы системы СИ;(5) соотношения растворителей приведены в единицах объем:объем (об./об.);(6) если не указано иное, исходные вещества были приобретены коммерческим путем. Общие методы ЯМР 1H ЯМР спектры снимали при 298K на приборе Varian Unity Inova 400 МГц (программное обеспечение: VNMR 6.1 С и VNMRJ 1.1D; датчик: Nalorac 5 мм DG400-5AT) или Varian Mercury-VX 300 МГц(программное обеспечение: VNMR 6.1 С; датчик: Varian 5 мм AutoSW PFG). Основные пики ацетона-d6 или диметилсульфоксида (DMSO)-d6 использовали в качестве внутренних стандартов. Дифференциальная сканирующая калориметрия (ДСК) Используя стандартные методы (например, методы, описанные в Hhne, G.W.Н. et al. (1996), Differential Scanning Calorimetry, Springer, Berlin), калориметрический ответ тестируемого образца на увеличение температуры исследовали на дифференциальном сканирующем калориметре (ДСК) ТА InstrumentsQ2000. Измерения выполняли при температуре от 0 до 250C с шагом увеличения температуры 10C в минуту. Приблизительно 0,5-5 мг тестируемого образца помещали в алюминиевые кюветы с крышками (не обжимающими) в потоке газообразного азота (50 мл/мин). Как упоминалось выше, общеизвестно, что при ДСК начальная и максимальная температуры могут варьировать в зависимости от чистоты образца и параметров прибора, в частности частоты сканирования температуры. Специалист в данной области может использовать рутинную оптимизацию/калибровку установок параметров прибора для дифференциального сканирующего калориметра, чтобы можно было собирать данные, сравнимые с данными, представленными здесь. Сокращения Использованы следующие сокращения: водн.: водныйPrOAc: изопропилацетат ОФ-ВЭЖХ: высокоэффективная жидкостная хроматография с обращенными фазамиTHF: тетрагидрофуран Получение аддукта (соли) Образование аддукта (соли) 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата Если не указано иное, аддукты (соли), описанные в примерах, приведенных ниже, получали следующим образом. К аликвотам раствора 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин 5-ил)метил)фенил)ацетата (20 мг) в ацетонитриле (2 мл) добавляли 1 молярный эквивалент или 2 молярных эквивалента соответствующей кислоты, либо твердой, либо растворенной в ацетонитриле (2 мл)(бензойной кислоты (твердой), транс-коричной кислоты (твердой), метансульфоновой кислоты, 2,5 дихлорбензолсульфоновой кислоты, лимонной кислоты, 1,5-нафталиндисульфоновой кислоты, 85%-ной водн. фосфорной кислоты, янтарной кислоты (твердой), фумаровой кислоты (твердой), L-винной кислоты, сахарина (твердого) или 2-гидрокси-1-нафтойной кислоты (твердой. Растворитель удаляли из полученных смесей путем выпаривания на открытом воздухе. Растворитель (любой из ацетонитрила, тетрагидрофурана, этилацетата, диметоксиэтилового эфира, метил-трет-бутилового эфира, 1,4-диоксана или диэтилового эфира, каждый 2 мл) затем добавляли к остаткам после выпаривания, и смеси суспендировали в течение 7 суток до образования соответствующих аддуктов. Твердые вещества отфильтровывали с использованием центрифуги и сушили под вакуумом. Пример 1 Бензойнокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин 5-ил)метил)фенил)ацетата Получение включало суспендирование с ацетонитрилом. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с диэтиловым эфиром. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с диэтиловым эфиром. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1HATU (0,333 г) добавляли к перемешиваемому раствору 2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)уксусной кислоты (0,3 г), 4-(диметиламино)бутан-1-ола (0,308 г) и основания Хюнига (0,45 мл) в DMF (6 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч и затем очищали методом ОФ-ВЭЖХ на колонкеXBridge C8 (30100 мм), элюируя смесью 0,2% водн. NH3 и ацетонитрила. Полученную смолу (225 мг) растворяли в MeCN (5 мл), затем добавляли сахарин (186 мг) и растворитель выпаривали при пониженном давлении до остатка в виде пены (411 мг). После суспендирования (16 мг) в этилацетате (0,5 мл) при перемешивании в течение 7 суток получили указанное в заголовке соединение (форма А дисахариновой соли соединения (1, которое выделяли фильтрованием. Стехиометрия (соединение (1) к кислоте) 1:2 подтверждена ЯМР-анализом. 1H ЯМР DMSO-d6:7.92 (t, 1H), 7.69-7.52 (m, 8H), 7.40 (s, 2H), 7.18 (d, 2H), 7.10 (d, 2H), 4.03 (t, 2H),3.82 (s, 2H), 3.63 (s, 2H), 3.41-3.29 (m, 2H), 3.10-3.02 (m, 2H), 2.76 (s, 6H), 2.20 (s, 3H), 1.71-1.54 (m, 4H),1.47 (квинтет, 2H), 1.28-1.05 (m, 4H), 0.81 (t, 3H). Пример 4 а Альтернативное получение дисахариновой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) Суспензию 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (1,0 г) в EtOAc (10 мл) нагревали до тех пор, пока она не превращалась в раствор, и затем охлаждали до 20C. К этому раствору добавляли сахарин (0,9 г) и смесь перемешивали при указанной температуре в течение 3 ч. После перемешивания в течение 6 суток полученный осадок собирали фильтрованием и сушили с получением формы А дисахариновой соли соединения (1), 1,78 г. Пример 4 б Альтернативное получение дисахариновой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат (0,50 г, 1,13 ммоль) и сахарин (0,41 г, 2,26 ммоль) объединяли и добавляли MeCN (25 мл). Суспензию обрабатывали ультразвуком до получения прозрачного раствора. Растворитель выпаривали с получением дисахариновой соли в виде масла. К этому маслу добавляли EtOAc (17 мл). Маслянистый остаток не растворился полностью при комнатной температуре. Смесь обрабатывали ультразвуком, при этом образовалась белая суспензия с некоторым количеством смолоподобного вещества на стенках колбы. Смесь перемешивали в течение 2 суток и полученные кристаллы собирали фильтрованием и сушили при пониженном давлении с получением формы А дисахариновой соли соединения (1) (757 мг, выход 83%). Пример 4 в Альтернативное получение дисахариновой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) Перемешиваемую смесь метил-3-гидрокси-2-метиленбутаноата (70,0 г), 2-(4-бромфенил)ацетонитрила (126,5 г), PdCl2[P(o-tol)3]2 (4,2 г) и триэтиламина (108,9 г) в ацетонитриле (280 мл) нагревали в атмосфере азота при 70C в течение 6 ч. Смесь охлаждали до комнатной температуры, разбавляли толуолом (840 мл) и водой (840 мл) и перемешивали в течение 10 мин. Органический слой отделяли, промывали водой (840 мл) и концентрировали при пониженном давлении с получением указанного в подзаголовке соединения в виде красного масла, 158,7 г. Этот продукт использовали на следующей стадии без дополнительной очистки. ЖХ-МС (жидкостная хроматография/масс-спектрометрия) m/z 244 ХИАД- (химическая ионизация при атмосферном давлении с регистрацией отрицательных ионов).(2) 2-(4-2-Амино-4-гидрокси-6-метилпиримидин-5-ил)метил)фенил)ацетонитрил Перемешиваемую смесь неочищенного продукта со стадии (1) и карбоната гуанидина (128,1 г) в метаноле (915 мл) кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (923 мл) и нейтрализовали уксусной кислотой. Смесь затем охлаждали до 10C и полученный осадок собирали фильтрованием, промывали метанолом (501 мл) и сушили при пониженном давлении с получением указанного в подзаголовке соединения в виде твердого вещества,82,4 г. 1H ЯМР DMSO-d6:10.91 (brs, 1H), 7.20-7.17 (m, 4H), 6.38 (s, 2H), 3.95 (s, 2H), 3.63 (s, 2H), 2.00 (s,3H). ЖХ-МС m/z 255 ХИАД+ (химическая ионизация при атмосферном давлении с регистрацией положительных ионов).(3) 2-(4-2-Амино-4-2,4,6-триметилбензолсульфонил)окси)-6-метилпиримидин-5-ил)метил)фенил)ацетонитрил N,N,N',N'-тетраметил-1,3-пропандиамин (56,7 г) добавляли по каплям в суспензию продукта со стадии (2) (85,0 г) и 2,4,6-триметилбензолсульфонилхлорида (87,8 г) в THF (452,9 г), и эту смесь нагревали при 45 в течение 7 ч. К смеси добавляли 2,5% HCl в воде (1291 г), и эту смесь перемешивали при 5C в течение 30 мин. Полученный осадок собирали фильтрованием, промывали ацетонитрилом(268,0 г) и сушили с получением неочищенного указанного в подзаголовке соединения в виде твердого вещества. Перемешиваемую суспензию этого твердого вещества в ацетонитриле (654,5 г) нагревали при 70C в течение 30 мин, охлаждали до 5C и перемешивали при 5C в течение 30 мин. Полученный осадок собирали фильтрованием, промывали ацетонитрилом (268,0 г) и сушили с получением указанного в подзаголовке соединения в виде твердого вещества, 113,1 г. 1(4) 2-(4-2-Амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетонитрил Трифторуксусную кислоту (27,4 г) медленно добавляли к суспензии продукта со стадии (3) (105,0 г) и н-пентиламина (62,9 г) в бутилацетате (877,8 г), и эту смесь нагревали при 120C в течение 2 ч. Смесь охлаждали до 20C, и к смеси добавляли 4%-ный водн. NaOH (997,5 г). Органический слой отделяли,промывали водой (997,5 г) и 10%-ным водн. NH4Cl (997,5 г) соответственно, и растворитель выпаривали при пониженном давлении с получением твердого вещества. Это твердое вещество растворяли в ацетонитриле (221,1 г) при 50C и раствор охлаждали до 42C, вносили затравку и перемешивали при этой температуре в течение 1 ч. После этого смесь охлаждали до 5C и перемешивали при 5C в течение 1 ч. Полученный осадок собирали фильтрованием, промывали ацетонитрилом (231,5 г) и сушили при пониженном давлении с получением указанного в подзаголовке соединения в виде твердого вещества, 52,0 г. 1(5) 2-(4-2-Амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)уксусная кислота Смесь продукта со стадии (4) (51,7 г) и 5 М KOH (517 г) в этаноле (204 г) нагревали при 80C в течение 4 ч. После этого растворитель выпаривали при пониженном давлении, остаток разбавляли водой(259 мл) и промывали трет-бутилметиловым эфиром (390 г) при 25C. Раствор охлаждали до 5C, и pH раствора доводили до pH 5 концентрированной HCl. Полученный осадок собирали фильтрованием, промывали раствором воды (200 мл) и MeCN (200 г) и сушили с получением указанного в подзаголовке соединения в виде твердого вещества, 57,0 г, содержащего 4,5 мас.% воды. 1(6) 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат 4,4'-Диметиламинобутанол (66,7 г), HOBt (30,8 г) и EDCI.HCl (43,8 г) добавляли к суспензии продукта со стадии (7) (65,0 г) в DMF (619 г) в атмосфере азота при 25C. Смесь перемешивали при 45C в течение 4 ч и подкисляли 2 М HCl (650 г). Смесь промывали CHCl3 (966 г), затем 28%-ным водн. NH3(176 г). Смесь экстрагировали EtOAc (2586 г), и органический слой промывали водой (3975 г). Раствор концентрировали при пониженном давлении с получением указанного в подзаголовке соединения в виде коричневого масла, 68,2 г. 1(7) Дисахариновая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) Сахарин (41,5 г) добавляли к перемешиваемому раствору продукта со стадии (6) (50,0 г) в ацетонитриле (150 мл). Смесь нагревали до 40C и перемешивали при этой температуре в течение 10 мин. Смесь разбавляли EtOAc (500 мл), вносили затравочные кристаллы формы А и перемешивали при 40C в течение 5 ч. Смесь затем охлаждали до 20C и перемешивали при этой температуре в течение 2 ч. Полученное твердое вещество собирали фильтрованием, промывали EtOAc (200 мл) и сушили при пониженном давлении с получением неочищенного образца указанного в подзаголовке соединения в виде белого твердого вещества, 81,5 г. Неочищенный продукт, полученный выше (1,0 г), растворяли в ацетонитриле (2 мл), нагревали до 40C и перемешивали при этой температуре в течение 20 мин. Нагретый раствор фильтровали через бумажный фильтр (0,1 мкм меш). Фильтрат разбавляли EtOAc (7 мл), вносили затравочные кристаллы формы А и перемешивали при 40C в течение 30 мин. Смесь затем охлаждали до 35C и перемешивали при этой температуре в течение 4 ч. После этого смесь охлаждали до 15C и перемешивали при этой температуре в течение 2 ч. Полученный осадок собирали фильтрованием, промывали EtOAc (2 мл) и сушили с получением указанного в заголовке соединения в виде белого твердого вещества, 0,9 г. 1(t, 2H), 3.82 (s, 2H), 3.63 (s, 2H), 3.38-3.33 (m, 2H), 3.07-3.02 (m, 2H), 2.76 (s, 6H), 2.20 (s, 3H), 1.69-1.55 (m,4H), 1.51-1.43 (m, 2H), 1.27-1.17 (m, 2H), 1.16-1.07 (m, 2H), 0.80 (t, 3H). ЖХ-МС m/z 442 многовариантная+ Пример 4 г Альтернативное получение формы А дисахариновой соли 4-(диметиламино)бутил-2-(4-2-амино-4 метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата(1) Метил-2-(4-(цианометил)бензил)-3-оксобутаноат Перемешиваемую смесь метил-3-гидрокси-2-метиленбутаноата (30,0 г, 0,23 моль), 2-(4 бромфенил)ацетонитрила (54,2 г, 0,28 моль), PdCl2[P(o-tol)3]2 (1,8 г, 2 ммоль) и триэтиламина (46,7 г, 0,46 моль) в ацетонитриле (90 г) нагревали при 70C в течение 6 ч в атмосфере азота. Смесь охлаждали до 25C, разбавляли толуолом (300 г) и 10%-ным водным раствором уксусной кислоты (360 г) и перемешивали в течение 10 мин. Органический слой отделяли, промывали водой (360 г) и концентрировали при пониженном давлении с получением указанного в подзаголовке соединения в виде красного масла, 67,3 г. Этот продукт использовали на следующей стадии без дополнительной очистки. ЖХ-МС m/z 244 ХИАД(2) 2-(4-2-Амино-4-гидрокси-6-метилпиримидин-5-ил)метил)фенил)ацетонитрил Перемешиваемую смесь неочищенного продукта со стадии (1) и карбоната гуанидина (36,7 г, 0,20 моль) в метаноле (389 г) кипятили с обратным холодильником в течение 7 ч. Смесь охлаждали до 30C,разбавляли водой (222 г) и pH раствора доводили до pH 6,5 уксусной кислотой. После этого смесь охлаждали до 5C, полученный осадок собирали фильтрованием, промывали метанолом дважды (167 г, 333 г) и сушили при пониженном давлении с получением указанного в подзаголовке соединения в виде твердого вещества, 32,6 г. 1(3) 2-(4-2-Амино-4-2,4,6-триизопропилбензолсульфонил)окси)-6-метилпиримидин-5-ил)метил)фенил)ацетонитрил Суспензию продукта со стадии (2) (6,0 г, 23,6 ммоль), 2,4,6-триизопропилбензолсульфонилхлорида(9,28 г, 30,6 ммоль) и DABCO (4,76 г, 42,5 ммоль) в THF (48,0 г) перемешивали при 30C в течение 7 ч. К этой смеси добавляли воду (9,6 г) и органический слой отделяли и концентрировали при пониженном давлении с получением твердого вещества. Это твердое вещество растворяли в ацетонитриле (57,0 г) и нагревали до 60C. К раствору добавляли воду (36,0 г) и смесь перемешивали при 60C в течение 1 ч. К смеси добавляли воду (36,0 г) и смесь охлаждали до 5C и перемешивали при 5C в течение 1 ч. Полученный осадок собирали фильтрованием, промывали дважды объединенным раствором воды (9,0 г) и ацетонитрила (3,6 г) и сушили с получением указанного в подзаголовке соединения в виде твердого вещества, 11,6 г. 1(4) 2-(4-2-Амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетонитрил Трифторуксусную кислоту (2,19 г, 19,2 ммоль) добавляли к суспензии продукта со стадии (3) (10,0 г, 19,2 ммоль) и н-пентиламина (5,0 г, 57,6 ммоль) в бутилацетате (65,0 г) и смесь нагревали при 120C в течение 6 ч. Смесь охлаждали и концентрировали при пониженном давлении с получением твердого вещества. Суспензию твердого вещества в толуоле (30,0 г) снова концентрировали при пониженном давлении с получением твердого вещества. К раствору твердого вещества в толуоле (55,0 г) и THF (14,0 г) добавляли 5%-ный водн. LiOH (60,0 г) и смесь перемешивали при 40C. Отделенный органический слой промывали водой (60,0 г) при 40C и концентрировали при пониженном давлении с получением твердого вещества. Суспензию полученного твердого вещества в толуоле (42,0 г) перемешивали при 54C в течение 1 ч и охлаждали до 5C и перемешивали при 5C в течение 10 ч. Полученный осадок собирали фильтрованием и промывали ацетонитрилом (5,0 г) и водой (12,0 г) соответственно с получением указанного в подзаголовке соединения в виде влажных кристаллов, 5,90 г. Этот продукт использовали на следующей стадии без высушивания. ЖХ-МС m/z 324 многовариантная+(5) 2-(4-2-Амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)уксусная кислота Суспензию влажного продукта со стадии (4) (5,90 г) в 10%-ном водн. NaOH (34,2 г) и этаноле (24,9 г) нагревали при 85C в течение 5 ч. Смесь охлаждали до 25C и pH раствора доводили до pH 6,5 18%ным водным раствором уксусной кислоты (31,1 г). Полученный осадок собирали фильтрованием, промывали водой (18,6 г) и ацетонитрилом (15,5 г) соответственно и сушили с получением указанного в подзаголовке соединения в виде белого твердого вещества, 4,43 г. 1(6) Гидрохлорид 2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)уксусной кислоты Суспензию продукта со стадии (5) (8,00 г, 23,4 ммоль) в ацетонитриле (48,0 г) нагревали до 40C и к этой суспензии медленно добавляли 35%-ную водн. HCl (2,68 г, 25,7 ммоль). После этого смесь перемешивали при 40C в течение 1 ч и к смеси медленно добавляли изопропилацетат (160 г). Смесь охлаждали до 15C и перемешивали в течение 1 ч. Полученный осадок собирали фильтрованием, промывали объединенным раствором ацетонитрила (5,14 г) и изопропилацетата (13,9 г) и сушили с получением указанного в подзаголовке соединения в виде белого твердого вещества, 8,27 г. 1(7) 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат (соединение (1 Раствор продукта со стадии (6) (2,00 г, 5,28 ммоль) и метансульфоновой кислоты (1,52 г, 15,8 ммоль) в ацетонитриле (16,0 г) охлаждали до 20C и к этому раствору медленно добавляли тионилхлорид(0,94 г, 7,92 ммоль). После этого смесь перемешивали при 20C в течение 30 мин и к смеси медленно добавляли 4-диметиламино-1-бутанол (1,11 г, 9,50 ммоль). Смесь нагревали до 40C и перемешивали при этой температуре в течение 5 ч. После этого реакционную смесь охлаждали до 20C и к смеси медленно добавляли этилацетат (18,0 г) и 25%-ный водн. триметиламин (18,0 г). Органический слой отделяли и промывали соответственно 5%-ным водн. NH4Cl (20,0 г), 1%-ным водн. NaCl (20,0 г) и водой (20,0 г). Раствор указанного в подзаголовке соединения использовали на следующей стадии без концентрирования. ЖХ-МС m/z 442 многовариантная+(8) Дисахариновая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) (дисахариновая соль соединения (1) (форма А Раствор продукта со стадии (7) разбавляли ацетонитрилом (9,3 г) и добавляли активированный уголь (0,2 г). Смесь перемешивали при 25C в течение 30 мин, фильтровали через бумажный фильтр (1 мкм меш) и промывали ацетонитрилом (7,0 г). К фильтрату добавляли сахарин (1,32 г, 7,21 ммоль), и затем количество продукта со стадии (7) в растворе определяли ВЭЖХ-анализом. Эквивалент сахарина для продукта со стадии (7) доводили до 2,00 молярного соотношения дополнительной загрузкой сахарина (0,34 г, 1,86 ммоль), и раствор концентрировали при пониженном давлении. Соответствующий остаток разбавляли ацетонитрилом (4,1 г) и этилацетатом (9,6 г), нагревали до 40C и вносили затравочные кристаллы формы А указанного в заголовке соединения. После этого смесь перемешивали при 40C в течение 1 ч и добавляли этилацетат (10,6 г). Смесь перемешивали при 40C в течение 1 ч, охлаждали до 10C и перемешивали в течение 2 ч. Полученное твердое вещество собирали фильтрованием, промывали объединенным раствором ацетонитрила (0,8 г) и этилацетата (3,0 г) и сушили при пониженном давлении с получением неочищенного образца указанного в подзаголовке соединения в виде белого твердого вещества, 3,11 г. Полученный выше неочищенный продукт (3,00 г) суспендировали в ацетонитриле (4,5 г), и суспензию нагревали до 40C. Полученный раствор фильтровали через бумажный фильтр (1 мкм меш) и фильтрат разбавляли этилацетатом (12,0 г). В смесь вносили затравочные кристаллы формы А дисахариновой соли и перемешивали ее в течение 1,5 ч. Суспензию разбавляли этилацетатом (18,0 г), перемешивали в течение 1 ч и затем охлаждали до 10C и перемешивали в течение 3 ч. Полученное твердое вещество собирали фильтрованием, промывали объединенным раствором ацетонитрила (0,8 г) и этилацетата (3,9 г) и сушили при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества, 2,54 г. 1(s, 6H), 2.20 (s, 3H), 1.69-1.55 (m, 4H), 1.51-1.43 (m, 2H), 1.27-1.17 (m, 2H), 1.16-1.07 (m, 2H), 0.80 (t, 3H,J=7 Гц). ЖХ-МС m/z 442 многовариантная + Пример 5 Дисахариновая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5 ил)метил)фенил)ацетата (форма В) 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат (300 мг, 0,68 ммоль) и сахарин (249 мг, 1,36 ммоль) объединяли и добавляли ацетонитрил (15 мл). Суспензию обрабатывали ультразвуком до получения прозрачного раствора. Растворитель выпаривали,остаток растворяли в этилацетате (10 мл) и перемешивали в течение 3 суток при комнатной температуре с получением формы В дисахариновой соли соединения (1). 1H ЯМР DMSO-d6:7.91 (1H, s), 7.69-7.54 (8 Н, m), 7.39 (2H, s), 7.18 (2H, d), 7.10 (2H, d), 4.04 (2H, t),3.82 (2H, s), 3.63 (2H, s), 3.39-3.33 (2H, m), 3.04 (2H, t), 2.75 (6H, s), 2.20 (3H, s), 1.71-1.54 (4 Н, m), 1.531.42 (2H, m), 1.28-1.17 (2H, m), 1.16-1.06 (2H, m), 0.81 (3H, t). Пример 5 а Альтернативное получение дисахариновой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма В) Объединяли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат (400 мг, 0,91 ммоль), растворенный в этилацетате (10 мл), и сахарин (332 мг, 1,81 ммоль), растворенный и обработанный ультразвуком в этилацетате (40 мл). Растворитель выпаривали,остаток суспендировали в этилацетате (10 мл) и перемешивали в течение 3 суток при комнатной температуре с получением формы В дисахариновой соли соединения (1). Пример 5 б Альтернативное получение 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата дисахариновой соли (формы В) 4-(Диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетат (523 мг, 1,18 ммоль) растворяли в 8 мл ацетонитрила. В отдельной колбе сахарин (434 мг, 2,37 ммоль) объединяли с 10 мл ацетонитрила с получением суспензии, которую добавляли к смеси соединения (1) с ацетонитрилом. Смесь перемешивали до получения прозрачного раствора при комнатной температуре(10 мин). Растворитель выпаривали. К смолистому остатку добавляли EtOAc (25 мл), и в эту смесь вносили затравку 0,1 мг формы В дисахариновой соли соединения (1). Смесь перемешивали в течение 3 суток при комнатной температуре, фильтровали и сушили (643 мг) с получением формы В дисахариновой соли соединения (1). Стехиометрия (соединение (1) к кислоте) 1:2 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с этилацетатом. Стехиометрия (соединение (1) к кислоте) 1:2 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с метил-трет-бутиловым эфиром. Стехиометрия (соединение(2H, m), 1.27-1.18 (2H, m), 1.15-1.07 (2H, m), 0.81 (3H, t). Пример 8 Ди-2,5-дихлорбензолсульфоновокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата Получение включало суспендирование с этилацетатом. Пример 9 1,5-Нафталиндисульфоновокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма А) Получение включало суспендирование с диметоксиэтаном. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1H ЯМР DMSO-d6:8.86 (2H, d), 7.92 (2H, dd), 7.40 (2H, dd), 7.18 (2H, d), 7.09 (2H, d), 4.03 (2H, t),3.81 (2H, s), 3.63 (2H, s), 3.40-3.33 (2H, m), 3.07-3.01 (2H, m), 2.75 (6H, s), 2.18 (3H, s), 1.69-1.53 (4H, m),1.52-1.41 (2H, m), 1.28-1.17 (2H, m), 1.15-1.05 (2H, m), 0.81 (3H, t). Пример 10 1,5-Нафталиндисульфоновокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (форма В) Получение включало суспендирование с тетрагидрофураном. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с ацетонитрилом. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1(2H, m), 1.11-0.99 (2H, m), 0.76 (3H, t). Пример 12 Лимоннокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5 ил)метил)фенил)ацетата (форма В) Получение включало суспендирование с тетрагидрофураном. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с дихлорметаном. Пример 14 Дифосфорнокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата Получение включало суспендирование с ацетонитрилом. (Ди)стехиометрию фосфатного противоиона подтверждали добавлением триметилфосфата. Протонный и фосфорный спектры снимали в условиях анализа, и целые числа соединения и триметилфосфата сопоставляли для определения стехиометрии. 1 Получение включало суспендирование с ацетонитрилом. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с ацетонитрилом. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1 Получение включало суспендирование с диэтиловым эфиром. Стехиометрия (соединение (1) к кислоте) 1:1 подтверждена ЯМР-анализом. 1H ЯМР DMSO-d6:7.14 (2H, d), 7.05 (2H, d), 6.55-6.46 (1H, m), 6.12 (2H, s), 4.01 (2H, t), 3.73 (2H, s),3.59 (2H, s), 3.31-3.23 (2H, m), 2.35 (4H, s), 2.29 (2H, t), 2.18 (6H, s), 2.03 (3H, s), 1.63-1.50 (2H, m), 1.501.37 (4H, m), 1.31-1.07 (4H, m), 0.82 (3H, t). Пример 18 Диянтарнокислая соль 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин 5-ил)метил)фенил)ацетата Получение включало суспендирование с метил-трет-бутиловым эфиром. Стехиометрия (соединение К 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетату (200 мг, 0,45 ммоль), растворенному в ацетонитриле (4 мл), добавляли фумаровую кислоту (105 мг, 2 молярных эквивалента), предварительно растворенную в THF. Полученную смесь концентрировали в вакууме до твердого остатка, добавляли диэтиловый эфир (2 мл) и перемешивали в течение 7 суток с получением дифумаровокислой соли соединения (1). Пример 19 а Альтернативное получение дифумаровокислой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата К 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетату (100 мг, 0,23 ммоль), растворенному в ацетонитриле (4 мл), добавляли твердую фумаровую кислоту (105 мг, 2 молярных эквивалента). Полученную смесь концентрировали в вакууме до твердого остатка, добавляли диэтиловый эфир (2 мл) и перемешивали в течение 7 суток с получением дифумаровокислой соли соединения(s, 2H), 3.61 (s, 2H), 3.38-3.26 (m, 2H), 2.39-2.22 (m, 8H), 2.13 (s, 3H), 1.61-1.37 (m, 6H), 1.30-1.07 (m, 4H), 0.82 (t,3H). Пример 19 б Альтернативное получение дифумаровокислой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата Фумаровую кислоту (52,6 мг) добавляли к перемешиваемому раствору 4-(диметиламино)бутил-2-(4-2 амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата (100,0 мг) в этаноле (0,6 мл). Раствор разбавляли iPrOAc (0,6 мл) и перемешивали при 25C в течение 5 ч. Полученный осадок собирали фильтрованием, промывали объединенным раствором iPrOAc (0,6 мл) и этанола (0,6 мл) и сушили при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества, 125,6 мг.H ЯМР DMSO-d6:7.17 (d, 2H, J=8 Гц), 7.07 (d, 2H, J=8 Гц), 6.52 (s, 4H), 4.01 (t, 2H, J=6 Гц), 3.77 (s, 2H),3.60 (s, 2H), 3.34-3.29 (m, 2H), 2.56-2.45 (m), 2.34 (s, 6H), 2.13 (s, 3H), 1.59-1.52 (m, 2H), 1.49-1.42 (m, 4H), 1.281.18 (m, 2H), 1.16-1.09 (m, 2H), 0.81 (t, 3H, J=7 Гц). ЖХ-МС m/z 442 многовариантная+ Пример 19 в Альтернативное получение дифумаровокислой соли 4-(диметиламино)бутил-2-(4-2-амино-4-метил-6(пентиламино)пиримидин-5-ил)метил)фенил)ацетата Фумаровую кислоту (31,6 г) добавляли к перемешиваемому раствору продукта со стадии (6), описанной в примере 4 в, (60,0 г) в этаноле (360 мл). Смесь нагревали до 30C и перемешивали при этой температуре в течение 30 мин. Раствор разбавляли iPrOAc (180 мл), вносили затравочные кристаллы дифумаровокислой соли и перемешивали при 30C в течение 2,5 ч. Смесь разбавляли дополнительным количеством iPrOAc (180 мл), охлаждали до 20C и перемешивали при этой температуре в течение 1 ч. Полученный осадок собирали фильтрованием, промывали раствором iPrOAc (120 мл) и этанола (90 мл), промывали iPrOAc (120 мл) и сушили при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества, 81,9 г. 1(m, 2H), 0.81 (t, 3H). ЖХ-МС m/z 442 многовариантная + Пример 20 Анализы методом дифракции рентгеновских лучей на порошке Общие методики Анализы методом дифракции рентгеновских лучей на порошке (ДРЛП) могут быть осуществлены на образцах, приготовленных стандартными методами (см., например, Giacovazzo et al., eds., Fundamentals ofKlugAlexander eds., X-ray Diffraction Procedures, John WileySons, New York (1974. Картины дифракции рентгеновских лучей на порошке солей, описанных в приведенных выше примерах 1-19, (в безводной форме) получали, как описано ниже. Для анализов использовали рентгеновский порошковый дифрактометр (парафокусирующаяся система Брэгга-Бретано) с использованием монохроматического CuK-излучения (45 кВ и 40 мА). Первичная оптика включала щели Соллера и щель с автоматической расходимостью. Плоские образцы готовили на пластинах с нулевым фоном, которые вращались во время измерений. Вторичная оптика включала щели Соллера, автоматическую антирассеивающую щель, приемную щель и монохроматор. Дифрагированный сигнал детектировали пропорциональным ксенон-заполненным детектором. Дифракционные картины снимали в пределах 22 (тета)40 в режиме непрерывного сканирования со 100-секундной экспозицией с шагом 0,02. Необработанные данные сохраняли в памяти компьютера. Оценку осуществляли по необработанным или сглаженным дифракционным картинам. Для вышеуказанных измерений использовали дифрактометр Panalytical X'pert MPD - в отражательном режиме. Специалист в данной области техники может установить эффективные параметры для порошкового рентгеновского дифрактометра таким образом, чтобы можно было собирать дифракционные данные, соизмеримые с представленными данными. Полученные результаты показаны на фиг. 1-19. В приведенных ниже табл. I-XIX перечислены значения 2 (тета) (погрешность: +/-0,1 2), межплоскостные расстояния d и относительные интенсивности пиков, показанных на картинах дифракции рентгеновских лучей, представленных соответственно на фиг. 1-19. Таблица I. ДРЛП соединения примера 1 (бензойнокислая соль) Таблица II. ДРЛП соединения примера 2 (транс-коричнокислая соль) Таблица III. ДРЛП соединения примера 3 (метансульфоновокислая соль) Таблица IV. ДРЛП соединения примера 4 (дисахариновая соль, форма А) Таблица V. ДРЛП соединения примера 5 (дисахариновая соль, форма В) Таблица VI. ДРЛП соединения примера 6 (ди-1-гидрокси-2-нафтойнокислая соль) Таблица VII. ДРЛП соединения примера 7 (2,5-дихлорбензолсульфоновокислая соль) Таблица VIII. ДРЛП соединения примера 8 (ди-2,5-дихлорбензолсульфоновокислая соль) Таблица IX. ДРЛП соединения примера 9 (1,5-нафталиндисульфоновокислая соль, форма А) Таблица X. ДРЛП соединения примера 10 (1,5-нафталиндисульфоновокислая соль, форма В) Таблица XI. ДРЛП соединения примера 11 (лимоннокислая соль, форма А) Таблица XII. ДРЛП соединения примера 12 (лимоннокислая соль, форма В) Таблица XIII. ДРЛП соединения примера 13 (фосфорнокислая соль) Таблица XIV. ДРЛП соединения примера 14 (дифосфорнокислая соль) Таблица XV. ДРЛП соединения примера 15 (фумаровокислая соль) Таблица XVI. ДРЛП соединения примера 16 (L-виннокислая соль) Таблица XVI. ДРЛП соединения примера 16 (L-виннокислая соль) Таблица XVII. ДРЛП соединения примера 17 (янтарнокислая соль)
МПК / Метки
МПК: A61P 27/14, A61P 17/00, A61P 31/00, C07D 239/49, A61P 11/00, A61P 35/00, A61K 31/505
Метки: ди-1-гидрокси-2-нафтойнокислая, соли, 4-(диметиламино)бутил-2-(4-((2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата, монобензойнокислая, дисахариновая, дифумаровокислая
Код ссылки
<a href="https://eas.patents.su/30-21854-disaharinovaya-difumarovokislaya-di-1-gidroksi-2-naftojjnokislaya-i-monobenzojjnokislaya-soli-4-dimetilaminobutil-2-4-2-amino-4-metil-6-pentilaminopirimidin-5-ilmetilfenilacetata.html" rel="bookmark" title="База патентов Евразийского Союза">Дисахариновая, дифумаровокислая, ди-1-гидрокси-2-нафтойнокислая и монобензойнокислая соли 4-(диметиламино)бутил-2-(4-((2-амино-4-метил-6-(пентиламино)пиримидин-5-ил)метил)фенил)ацетата</a>
Предыдущий патент: Устройство для нанесения прокладочной ленты
Следующий патент: Штаммы talaromyces и ферментные композиции
Случайный патент: Автоинъектор