3-({[3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидpо-1,4-бензотиазепин-8-ил]метил}амино)пентандиовая кислота
Номер патента: 21753
Опубликовано: 31.08.2015
Авторы: Аквино Кристофер Джозеф, Коуэн Дэвид Джон, Ву Юлинь, Коллинз Джон Лорен
Формула / Реферат
1. Соединение
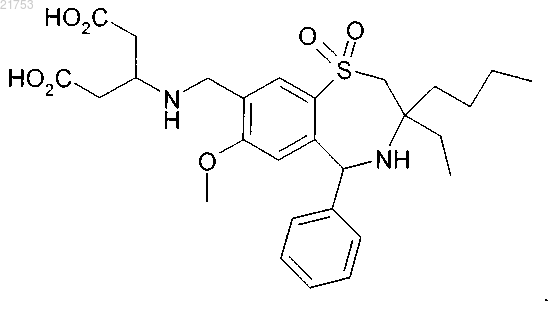
2. Соединение
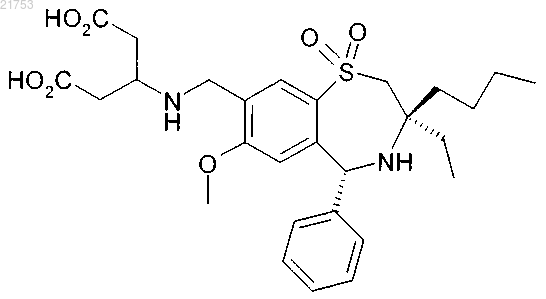
3. Соединение по п.2, где указанное соединение является кристаллическим.
4. Фармацевтически приемлемая соль соединения по любому из пп.1-3.
5. Фармацевтическая композиция, которая ингибирует iBAT (котранспортер желчных кислот в подвздошной кишке), содержащая соединение или соль по любому из пп.1-4.
6. Фармацевтическая композиция для применения в лечении нарушения обмена веществ у человека, содержащая соединение или соль по любому из пп.1-4.
7. Фармацевтическая композиция по п.6, где указанное нарушение обмена веществ представляет собой сахарный диабет (типа I и типа II) или ожирение.
8. Применение соединения или соли по любому из пп.1-4 в лечении нарушения обмена веществ у человека.
Текст
и способы лечения метаболических расстройств. Область изобретения Настоящее изобретение относится к соединениям, которые полезны в лечении и предупреждении нарушений обмена веществ, в том числе сахарного диабета (типа I и типа II), ожирения и родственных расстройств, а также включает способы получения соединений, фармацевтические композиции, содержащие эти соединения, и терапевтические применения таких соединений. Предшествующий уровень техники Более 200 миллионов людей в мире больны диабетом. По оценкам Всемирной организации здравоохранения 1,1 млн людей умерли от диабета в 2005 г., и предполагается, что количество смертей от диабета во всем мире увеличится в два раза в период с 2005 по 2030 г. Новые химические соединения, которые эффективно лечат диабет, могут сохранить миллионы человеческих жизней. Диабет относится к нарушениям обмена веществ, приводящим к неспособности организма эффективно регулировать уровни глюкозы. Примерно 90% из всех диабетических случаев являются результатом диабета II типа, тогда как остальные 10% являются результатом диабета I типа, гестационного диабета и латентного аутоиммунного диабета у взрослых (LADA). Все формы диабета приводят к повышенным уровням глюкозы крови, и если его постоянно оставлять без лечения, то он может привести к увеличению риска макрососудистых (болезни сердца, удара, других форм сердечно-сосудистого заболевания) и микрососудистых [почечной недостаточности (нефропатии), слепоты от диабетической ретинопатии,повреждения нервов (диабетической невропатии)] осложнений. Диабет I типа, также известный как ювенильный или инсулинзависимый сахарный диабет (IDDM),может иметь место в любом возрасте, но наиболее часто его диагностируют у детей, подростков или молодых совершеннолетних людей. Диабет I типа обусловлен аутоиммунной деструкцией -клеток, вырабатывающих инсулин, которая приводит к неспособности продуцировать достаточное количество инсулина. Инсулин контролирует уровни глюкозы крови путем стимуляции транспорта глюкозы крови в клетки для энергетического использования. Недостаточная выработка инсулина будет приводить к уменьшенному поглощению глюкозы в клетках и, в результате, к накоплению глюкозы в кровотоке. Отсутствие в клетках доступной глюкозы будет в итоге приводить к появлению симптомов диабета I типа: полиурии (частому мочеиспусканию), полидипсии (жажде), постоянному голоду, потере массы, изменениям зрения и усталости. В пределах 5-10 лет после диагностирования диабета I типа -клетки поджелудочной железы пациента, вырабатывающие инсулин, полностью разрушаются, и организм больше не может продуцировать инсулин. В результате пациентам с диабетом I типа в последующие периоды их жизни требуется ежедневное введение инсулина. Диабет II типа, также известный как инсулиннезависимый сахарный диабет (NIDDM) или диабет взрослых, имеет место, когда поджелудочная железа вырабатывает недостаточное количество инсулина и/или ткани становятся устойчивыми к нормальным или высоким уровням инсулина (инсулинорезистентность), что приводит к чрезмерно высоким уровням глюкозы крови. К инсулинорезистентности могут привести многие факторы, включая постоянно повышенные уровни глюкозы крови, генетические факторы, ожирение, отсутствие физической нагрузки и увеличение возраста. В отличие от диабета I типа симптомы диабета II типа выражены более явно, и заболевание в результате может быть не диагностировано в течение нескольких лет после появления с максимумом преобладания у взрослых в возрасте около 45 лет. К сожалению, у детей увеличивается коэффициент заболеваемости диабетом II типа. Первичной целью лечения диабета II типа является достижение и удержание контроля над уровнем глюкозы для снижения риска микрососудистых (диабетической невропатии, ретинопатии или нефропатии) и макрососудистых (болезни сердца, удара, других форм сердечно-сосудистого заболевания) осложнений. Рекомендации, касающиеся лечения диабета II типа, которые в настоящее время имеются от Американской ассоциации диабетологов (ADA) и Европейской ассоциации по исследованию диабета(EASD) [Diabetes Care, 2008, 31 (12), 1], в общих чертах описывают изменение образа жизни, включая уменьшение массы и увеличенную физическую нагрузку в качестве первичного терапевтического подхода при ведении пациента с диабетом II типа. Однако для большинства пациентов этот подход сам по себе в течение первого года становится недостаточным, заставляя врачей со временем предписывать медикаменты. ADA и EASD рекомендуют метформин, агент, который снижает выработку глюкозы печенью, в качестве медикамента класса 1 а; однако значительное количество пациентов, принимающих метформин, может испытывать желудочно-кишечные побочные эффекты и, в редких случаях, потенциально фатальный лактоцидоз. Рекомендации в отношении медикаментов класса 1b включают сульфонилмочевины, которые стимулируют секрецию инсулина поджелудочной железой путем модулирования активности калиевых каналов, и экзогенный инсулин. Несмотря на то, что оба медикамента быстро и эффективно снижают уровни глюкозы крови, инсулин требует 1-4 инъекции в сутки, и оба агента могут привести к нежелательному увеличению массы и потенциально фатальной гипогликемии. Рекомендации класса 2 а включают новейшие агенты, такие как тиазолидиндионы (TZD) (пиоглитазон и розиглитазон),которые увеличивают инсулинорезистентность мышц, печени и жира, а также аналоги GLP-1 (глюкагоноподобного пептида-1), которые увеличивают опосредованную глюкозой секрецию инсулина после приема пищи из -клеток поджелудочной железы. Несмотря на то, что TZD демонстрируют надежный,-1 021753 длительный контроль над уровнями глюкозы крови, неблагоприятные эффекты включают увеличение массы, отек, переломы костей у женщин, обострение застойной сердечной недостаточности и потенциально увеличенный риск ишемических сердечно-сосудистых явлений. Аналоги GLP-1 также эффективно контролируют уровни глюкозы крови; однако для этого класса медикаментов требуется инъекция, и многие пациенты жалуются на тошноту. Медикаменты, добавленные в список класса 2 совсем недавно,представляют собой ингибиторы DPP-4 (дипептидилпептидазы-4), которые, подобно аналогам GLP-1,увеличивают опосредованную глюкозой секрецию инсулина из -клеток. К сожалению, ингибиторыDPP-4 только лишь умеренно контролируют уровни глюкозы крови, и остается надежно установить долгосрочную безопасность ингибиторов DPP-4. Другие медикаменты, менее предписанные для диабета II типа, включают ингибиторы -гликозидазы, глиниды и аналоги амилина. Очевидно, что для пациентов с диабетом II типа необходимы новые медикаменты с улучшенными эффективностью, длительностью и профилями побочных эффектов.GLP-1 и GIP (желудочный ингибиторный полипептид) представляют собой пептиды, известные как инкретины, которые секретируются L- и K-клетками соответственно из желудочно-кишечного тракта в кровоток после приема питательных веществ. Этот важный физиологический ответ служит первичным механизмом сигнализации между концентрацией питательного вещества (глюкоза/жир) в желудочнокишечном тракте и другими периферическими органами. После секреции оба циркулирующих пептида инициируют сигналы в -клетках поджелудочной железы для увеличения стимулированной глюкозой секреции инсулина, которая, в свою очередь, контролирует концентрации глюкозы в кровотоке (см. обзоры в Diabetic Medicine 2007, 24 (3), 223; Molecular and Cellular Endocrinology 2009, 297 (1-2), 127; Experimental and Clinical EndocrinologyDiabetes 2001, 109(Suppl. 2), S288). Связь между инкретиновыми гормонами GLP-1 и GIP и диабетом II типа хорошо изучена. В большинстве исследований показано, что диабет II типа ассоциируется с приобретенным нарушением секреции GLP-1, а также действия GIP (см. Diabetes 2007, 56 (8), 1951 и Current Diabetes Reports 2006, 6 (3),194). Применение экзогенного GLP-1 для лечения пациентов с диабетом II типа очень ограничено вследствие быстрого разрушения его протеазой DPP-4. В качестве миметиков GLP-1 разработано множество модифицированных пептидов, которые являются устойчивыми к DPP-4 и демонстрируют большую длительность действия, чем эндогенный GLP-1. Агенты с таким профилем, которые, как было показано, являются очень эффективными для лечения диабета II типа, включают экзенатид и лираглутид, однако для этих агентов требуется инъекция. Пероральные агенты, которые ингибируют DPP-4, такие как ситаглиптин, вилдаглиптин и саксаглиптин, повышают интактный GLP-1 и умеренно контролируют уровни циркулирующей глюкозы (см. PharmacologyTherapeutics 2010, 125 (2), 328; Diabetes Care 2007, 30(6),1335; Expert Opinion on Emerging Drugs 2008, 13 (4), 593). Для лечения диабета II типа были бы желательны новые пероральные медикаменты, увеличивающие секрецию GLP-1. Желчные кислоты, как было показано, увеличивают секрецию пептидов из желудочно-кишечного тракта. Желчные кислоты высвобождаются из желчного пузыря в тонкую кишку после каждого приема пищи для облегчения переваривания питательных веществ, в частности жира, липидов и липидорастворимых витаминов. Желчные кислоты также функционируют в качестве гормонов, регулирующих холестериновый гомеостаз, энергию и гомеостаз глюкозы посредством ядерных рецепторов (FXR, PXR, CAR,VDR) и связанного с G-белком рецептора TGR5 (см. обзоры в Nature Drug Discovery 2008, 7, 672; Diabetes, Obesity and Metabolism 2008, 10, 1004). TGR5 является членом родопсинподобного подсемейства связанных с G-белком рецепторов (GPCR) (класс А), который экспрессируется в кишечнике, желчном пузыре, жировой ткани, печени и избранных областях центральной нервной системы. TGR5 активируется многочисленными желчными кислотами, при этом литохолевая и деоксихолевая кислоты являются наиболее мощными активаторами (Journal of Medicinal Chemistry 2008, 51 (6), 1831). Деоксихолевая и литохолевая кислоты увеличивают секрецию GLP-1 из линии энтероэндокринных клеток STC-1, частично через TGR5 (Biochemical and Biophysical Research Communications 2005, 329, 386). Синтетический TGR5 агонист INT-777, как было показано, увеличивает in vivo интестинальную секрецию GLP-1 у мышей (CellMetabolism 2009, 10, 167). Соли желчных кислот, как было показано, стимулируют секрецию GLP-1 из Lклеток ободочной кишки на васкулярно-перфузируемой модели ободочной кишки крысы (Journal of Endocrinology 1995, 145(3), 521), также как и GLP-1, пептид YY (PYY) и нейротензин на васкулярноперфузируемой модели подвздошной кишки крысы (Endocrinology 1998, 139(9), 3780). У людей инфузия деоксихолата в сигмовидную ободочную кишку приводит к быстрому и заметному, чувствительному к дозе увеличению концентраций в плазме PYY и энтероглюкагона (Gut 1993, 34(9), 1219). Агенты, которые увеличивают концентрации желчной кислоты в подвздошной и ободочной кишке или концентрации соли желчной кислоты, будут увеличивать секрецию кишечного пептида (gut peptide), включая GLP-1 иPYY, но не ограничиваясь ими. Желчные кислоты синтезируются в печени из холестерина, затем подвергаются реакции конъюгации карбоновой кислоты с аминной функциональной группой таурина и глицина. Конъюгированные желчные кислоты секретируются в желчном пузыре, где происходит накопление до тех пор, пока потребляется пища. После еды желчный пузырь сокращается и выпускает свое содержимое в двенадцати-2 021753 перстную кишку, где конъюгированные желчные кислоты облегчают абсорбцию холестерина, жира и жирорастворимых витаминов в проксимальный отдел тонкой кишки (см. обзоры в Frontiers in Bioscience 2009, 14, 2584; Clinical Pharmacokinetics 2002, 41 (10), 751; Journal of Pediatric Gastroenterology and Nutrition 2001, 32, 407). Конъюгированные желчные кислоты продолжают движение через тонкую кишку до дистального отдела подвздошной кишки, где 90% реабсорбируются в энтероциты посредством апикального натрийзависимого транспортера желчной кислоты (ASBT, также известного как iBAT). Оставшиеся 10% деконъюгируются до желчных кислот с помощью кишечных бактерий в терминальном отделе подвздошной кишки и толстой кишки, из которых 5% затем пассивно реабсорбируются в толстую кишку, а оставшиеся 5% экскретируются в экскременты. Желчные кислоты, которые реабсорбируются в подвздошной кишке с помощью ASBT, затем транспортируются в воротную вену для рециркуляции к печени. Этот весьма регулируемый процесс, называемый печеночно-кишечной рециркуляцией, важен для общего поддержания суммарной совокупности желчных кислот организма, так как количество желчной кислоты, которое синтезируется в печени, эквивалентно количеству желчных кислот, которые экскретируются в экскременты. Фармакологическое нарушение реабсорбции желчных кислот с помощью ингибитора ASBT приводит к увеличенным концентрациям желчных кислот в ободочной кишке и экскрементах, при этом физиологическим результатом является увеличенная конверсия печеночного холестерина до желчных кислот для компенсирования фекальной потери желчных кислот. Многие фармацевтические компании рассматривали этот механизм в качестве стратегии снижения сывороточного холестерина у пациентов с дислипидемией/гиперхолестеринемией (см. обзоры в Current Medicinal Chemistry 2006, 13,997). Важно, что увеличение концентрации желчной кислоты/соли в ободочной кишке, опосредованноеASBT-ингибитором, также будет увеличивать гормональную секрецию кишечных GLP-1, PYY, GLP-2 и других кишечных пептидов. Таким образом, ингибиторы ASBT могут быть полезны для лечения диабетаII типа, диабета I типа, дислипидемии, ожирения, синдрома укороченной кишки, хронического идиопатического запора, синдрома раздраженной кишки (IBS), болезни Крона и артрита. Некоторые 1,4-тиазепины раскрыты, например, в WO 94/18183 и WO 96/05188. Сообщается, что эти соединения полезны в качестве ингибиторов обратного захвата желчных кислот в подвздошной кишке(ASBT). Краткое изложение сущности изобретения Кратко в одном из аспектов настоящего изобретения раскрыто соединение В другом аспекте настоящего изобретения раскрыто соединение В предпочтительном воплощении вышеуказанное соединение является кристаллическим. В еще одном аспекте настоящего изобретения раскрыта фармацевтически приемлемая соль любого из вышеуказанных соединений. В еще одном аспекте настоящего изобретения раскрыта фармацевтическая композиция, которая ингибирует iBAT (котранспортер желчных кислот в подвздошной кишке), содержащая любое из вышеуказанных соединений или солей. В еще одном аспекте настоящего изобретения раскрыта фармацевтическая композиция для применения в лечении нарушения обмена веществ у человека, содержащая любое из вышеуказанных соединений или солей. В предпочтительном воплощении вышеуказанная фармацевтическая композиция применяется для лечения сахарного диабета (типа I и типа II) или ожирения. В еще одном аспекте настоящего изобретения раскрыто применение любого из вышеуказанных соединений или солей в лечении нарушения обмена веществ у человека. Подробное описание изобретения Атом углерода, с которым связано незамещенное фенильное кольцо, является хиральным. Предпоч-3 021753 тительной стереохимией при таком атоме углерода является R-стереохимия.R4 представляет собой NR5R5. Один R5 представляет собой Н, а другой представляет собой СН(R7)С 1 алкилСО 2 Н.R7 представляет собой С 1 алкилСО 2 Н. Если ясно, что не указано иное, то "алкил", используемый в данном описании изобретения, может представлять собой алкил с прямой цепью или алкил с разветвленной цепью. Обзор подходящих фармацевтически приемлемых солей присутствует, например, в Berge et al., J.Pharm. Sci., 66, 1-19, 1977. В одном из воплощений соли присоединения кислоты выбраны из гидрохлорида, гидробромида, гидройодида, сульфата, бисульфата, нитрата, фосфата, гидрофосфата, ацетата, бензоата, сукцината, сахарата, фумарата, малеата, лактата, цитрата, тартрата, глюконата, камсилата, метансульфоната, этансульфоната, бензолсульфоната, п-толуолсульфоната и памоата. В другом воплощении соли присоединения основания включают соли металлов (такие как соли натрия, калия, алюминия, кальция, магния и цинка) и аммониевые соли (такие как соли изопропиламина, диэтиламина, диэтаноламина). Другие соли (такие как трифторацетаты и оксалаты) можно использовать в процессе получения соединений формулы (I) и их фармацевтически приемлемых солей, и они включены в объем этого изобретения. Специалист-химик может получить соли присоединения кислоты и основания путем обработки соединения формулы (I) подходящей кислотой или основанием в подходящем растворителе с последующей кристаллизацией и фильтрованием. Способ лечения или предупреждения нарушений обмена веществ может в качестве монотерапии включать введение как такового(ой) соединения или соли по этому изобретению. Соединения и соли по этому изобретению также можно применять в комбинации с другими терапевтическими агентами. Подходящие агенты для применения в комбинации с соединениями и солями по этому изобретению включают, например, усилители чувствительности к инсулину, ингибиторы абсорбции глюкозы, бигуаниды,усилители секреции инсулина или метформин. Примеры Соединения по этому изобретению могут быть получены множеством способов, включая хорошо известные стандартные способы синтеза. Общие иллюстративные способы синтеза изложены ниже; конкретные соединения по изобретению получают в рабочих примерах. Согласно общим принципам синтетической химии, если необходимо, то для чувствительных или реакционноспособных групп на всех описанных ниже схемах используют защитные группы. Манипуляции с защитными группами осуществляют в соответствии со стандартными способами органического синтеза (T.W. Green and P.G.M. Wuts (1991), Protected Groups in Organic Synthesis, John WileySons, документ включен путем ссылки на защитные группы). Эти группы удаляют на подходящей стадии синтеза соединения, используя способы, которые очевидны специалистам в данной области. Выбор способов, а также условий реакций и порядка их осуществления должен быть согласован с получением соединений по настоящему изобретению. Специалисты в данной области могут легко получить соединения по изобретению в соответствии со схемами 1-9. Как показано на схеме 1, некоторые ключевые промежуточные соединения могут быть получены из(Brieaddy L.E., WO 9605188, 1996). После деметилирования, опосредованного кислотой Льюиса, и последующего взаимодействия с трифторметансульфоновым ангидридом (Tf2O) получали промежуточный трифлат (А). После взаимодействия А с оксидом углерода и палладиевым катализатором в МеОН получали промежуточный сложный эфир (В). После взаимодействия А в присутствии цианида и палладиевого катализатора получали промежуточный нитрил (С), который восстанавливали диизобутилалюминийгидридом (DiBAL-H) с получением промежуточного альдегида (D). Схема 1 Получение ключевых промежуточных соединений Соединения по изобретению могут быть получены, как показано на схеме 2. В результате обработки промежуточного альдегида (D) замещенным амином в условиях восстановительного аминирования и последующего, если необходимо, снятия защиты с помощью кислоты, основания или функционализации(окисления) получали 8-аминометиловые примеры (F). Схема 2 Получение аминометиловых замещенных соединений Способ 1. Раствор (3R,5R)-3-бутил-3-этил-7,8-бис-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-1,1-диоксида (200 г, 479 ммоль) (полученного, как описано Brieaddy L.E. в WO 9605188,1996) в DCE (1 л) насыщали HCl, затем обрабатывали одной порцией хлорида алюминия (200 г, 1,5 моль). Реакционную смесь перемешивали с медленным охлаждением до температуры окружающей среды, затем перемешивали в течение 2,5 ч. При интенсивном перемешивании реакционную смесь добавляли к смеси лед-Н 2 О. Двухфазную смесь обрабатывали 1 н. HCl (примерно 200 мл), затем после перемешивания в течение 30 мин разделяли фазы. Органическую фазу отделяли, промывали (2 раза) разбавленной HCl (1,5 л Н 2 О/примерно 200 мл 1 н. HCl), сушили над MgSO4, фильтровали и концентрировали досуха с получением региоизомерной смеси 7-ОН и 8-ОН продуктов (185 г, 458 ммоль, выход 96%) в виде белой пены. Анализ методом 1 Н ЯМР указал на смесь 7/8-фенолов в соотношении 47:53 соответственно. Региоизомеры разделяли хиральной хроматографией [CSP (хиральная неподвижная фаза): полимер целлюлоза-трис-(3,5-дихлорфенилкарбамат), иммобилизованный на диоксиде кремния (CHIRALPAK IC,20 мкм, 2025 см), DCM и изопропанол (98/2 об./об.) в качестве подвижной фазы] с получением промежуточных соединений 1 а и 1b. Промежуточное соединение 1b (пик, элюирующийся быстрее): (3R,5R)-3-бутил-3-этил-8(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-7-ол-1,1-диоксид (86,3 г, белое твердое вещество, чистота 98,2%): 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 0.74 (t, J=7,0 Гц, 3 Н), 0.79 (t, J=7,4 Гц, 3H), 0.94-1.28 (m, 4H),1.30-1.53 (m, 2 Н), 1.64-1.81 (m, 1 Н), 1.91-2.10 (m, 1 Н), 2.45 (d, J=9,8 Гц, 1 Н), 3.04 (d, J=14,8 Гц, 1 Н), 3.49(d, J=14,8 Гц, 1 Н), 3.80 (s, 3H), 5.85 (d, J=10,0 Гц, 1 Н), 6.06 (s, 1 Н), 7.19-7.52 (m, 6 Н), 9.93 (s, 1H). Промежуточное соединение 1 а (пик, элюирующийся медленнее): (3R,5R)-3-бутил-3-этил-7(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксид (72,5 г) в виде белого твердого вещества: 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 0.75 (t, J=7,1 Гц, 3H), 0.79 (t, J=7,5 Гц, 3H), 0.95-1.28 (m, 4H),1.31-1.53 (m, 2 Н), 1.64-1.76 (m, 1 Н), 1.98-2.10 (m, 1 Н), 2.43 (d, J=9,8 Гц, 1 Н), 3.06 (d, J=14,8 Гц, 1 Н), 3.42(газ.) при температуре окружающей среды (во время осуществления этой стадии внутренняя температура увеличилась до 39 С). После достижения 39 С барботирование HCl (газ.) через раствор продолжали в течение 5 мин. Порциями в течение 40 мин добавляли хлорид алюминия (1250 г, 9,37 моль) с небольшим наружным охлаждением, поддерживая температуру реакционной смеси 38-42 С. Реакционную смесь перемешивали в течение 2 ч и затем медленно вливали в 10 кг смеси лед/вода. Аналогичным образом хлоридом алюминия и HCl обрабатывали две дополнительные порции из 1250 г и 500 г (3R,5R)-3-бутил 3-этил-7,8-бис(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-1,1-диоксида. Три реакционные смеси (теоретически суммарно 7,19 моль), погашенные смесью лед/вода, объединяли и разделяли фазы. Водную фазу экстрагировали CH2Cl2 (3 л) и объединенные органические слои промывали водой (34 л) и концентрировали до тех пор, пока не начинал кристаллизоваться продукт. Смесь разбавляли гептаном и выдерживали при перемешивании. Осадок собирали фильтрованием, сушили на воздухе в течение 2 суток, а затем в вакуумной печи при 55 С в течение 48 ч с получением смеси (3R,5R)-3-бутил-3-этил-7(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксида и (3R,5R)-3-бутил-3-этил 8-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-7-ол-1,1-диоксида (примерно 9:8, 2,8 кг). После очистки смеси в соответствии с методикой способа 1 получали 1235 г (3R,5R)-3-бутил-3-этил-7(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксида в виде белого твердого вещества. Способ 3. Раствор (3R,5R)-3-бутил-3-этил-7,8-бис-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-1,1-диоксида (11,1 кг, 26,58 моль) в DCE (69,7 кг) обрабатывали водой (0,48 кг, 26,67 моль), затем устанавливали температуру 35-40 С. В раствор загружали оксалилхлорид (3,4 кг, 26,78 моль) и перемешивали в течение 30 мин. Затем в раствор загружали трихлорид алюминия в последовательности 3,6 кг, 26,9 моль; 3,6 кг, 26,9 моль; 1,8 кг, 13,4 моль; 1,8 кг, 13,4 моль, 0,9 кг, 6,8 моль с предоставлением между загрузками промежутка времени 30 мин. Реакционную смесь перемешивали при 3540 С до завершения реакции. Реакционную смесь гасили путем медленного добавления реакционного раствора к воде (119 кг). Органическую фазу отделяли, затем экстрагировали два раза водой (60 кг) и один раз насыщенным раствором хлорида натрия (30 кг). Дихлорэтанный раствор смеси продуктов кон-6 021753 центрировали до конечной массы 39 кг. Этот раствор использовали в качестве питательного раствора для препаративной хроматографии, как описано в способе 1. Фракции с целевым продуктом частично концентрировали до объема примерно 12 л. Затем растворы концентрировали путем дистилляции при атмосферном давлении до внутренней температуры котла 80 С. После охлаждения произошла кристаллизация. Исходную суспензию разбавляли водой (6-12 л) и перемешивали в течение 2 ч. Продукт собирали фильтрованием, промывали водой (4 л), затем сушили при 60 С под вакуумом до постоянной массы. Из этого продукта получали 4,1 кг (10,22 моль) (3R,5R)-3 бутил-3-этил-8-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-7-ол-1,1-диоксида (промежуточное соединение 1b) и 3,9 кг (9,72 моль) (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксида (промежуточное соединение 1 а). Переработка промежуточного соединения 1b в (3R,5R)-3-бутил-3-этил-7,8-бис-(метилокси)-5 фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-1,1-диоксид. Раствор (3R,5R)-3-бутил-3-этил-8-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-7-ол 1,1-диоксида (4,1 кг, 10,22 моль) в ацетоне (19,7 кг) обрабатывали карбонатом калия (3,84 кг) и доводили до 25-30 С. Загружали метилйодид (5,84 кг, 41,14 моль) и реакционную смесь выдерживали при 25-30 С до завершения реакции. Реакционную смесь концентрировали путем дистилляции до объема, составляющего в итоге примерно 8 л, затем загружали дихлорэтан (31 кг). Реакционную смесь экстрагировали(2 раза) водой (20,8 кг) и осуществляли дополнительную загрузку дихлорэтана (26 кг). Раствор продукта концентрировали до примерно 23 л с образованием раствора, подходящего для повторного снятия защиты с получением промежуточных соединений 1 а и 1b, как описано выше в способе 3. Промежуточное соединение 2. (3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил-трифторметансульфонат Способ 1. К раствору (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-8-ол-1,1-диоксида (105 г, 26 ммоль) и пиридина (27,3 мл, 34 ммоль) в DCM, охлажденному до 0 С, под азотом медленно в течение 30 мин добавляли трифторметансульфоновый ангидрид (57,1 мл, 34 ммоль), поддерживая внутреннюю температуру 5-10 С. После завершения добавления реакционную смесь перемешивали до тех пор, пока анализ методом тонкослойной хроматографии (ТСХ) и жидкостной хроматографии - масс-спектрометрии (ЖХ-МС) не показал полное превращение в продукт. К смеси медленно добавляли Н 2 О (250 мл) и смесь перемешивали в течение 10 мин, после чего разделяли слои. Водный слой экстрагировали DCM и объединенные органические вещества промывали 10%-ной HCl,рассолом, затем сушили (Na2SO4), фильтровали и концентрировали до половины объема. До тех пор пока раствор не стал мутным, добавляли гексаны, и начинала происходить кристаллизация. Затем твердую фазу фильтровали из раствора с получением указанного в заголовке соединения (134,6 г, 95%) в виде белого твердого вещества, которое использовали без дополнительной очистки: 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.76-0.96 (m, 6H), 1.03-1.40 (m, 4 Н), 1.40-1.67 (m, 4 Н), 1.77-1.97 (m,1 Н), 2.10-2.28 (m, 1 Н), 3.07 (d, J=14,8 Гц, 1 Н), 3.48 (d, J=14,9 Гц, 1 Н), 3.62 (s, 3H), 6.09 (s, 1H), 6.34 (s, 1H),7.32-7.50 (m, 5 Н), 7.96 (s, 1H); ЭР (электрораспыление) - ЖХ-МС m/z 536 (М+Н)+. Способ 2. К перемешиваемой суспензии (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксида (1099 г, 2,72 моль) в трет-бутилметиловом эфире (16 л) добавляли пиридин (441 мл, 5,45 моль) при охлаждении до 15 С. По каплям в течение 45 мин добавляли чистый трифторметансульфоновый ангидрид (1076 г, 3,81 моль), поддерживая температуру реакционной смеси 14-16 С. После добавления реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Медленно добавляли воду (6 л) и смесь быстро перемешивали в течение 15 мин. Слои разделяли и органическую фазу промывали смесью вода/рассол (1:1, 5 л), сушили над MgSO4 и фильтровали. Фильтрат концентрировали для удаления большей части трет-бутилметилового эфира (удаляли примерно 13-14 л). Полученную суспензию фильтровали и осадок на фильтре промывали гептаном. После сушки осадка на фильтре в вакууме в течение ночи при 40 С получали (3R,5R)-3-бутил-3-этил-7(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил-трифторметансульфонат в виде не совсем белого твердого вещества (1342 г). Вторую партию продукта получали из маточного раствора (63 г). Суммарный выход составил 1405 г. Способ 3. В реактор загружали 2,75 кг (6,8 моль) (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил 2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ол-1,1-диоксида, 19,9 кг 1,4-диоксана, 1,08 кг (13,6 моль) пиридина при 25 С и перемешивали при этой температуре до растворения. Затем раствор охлаждали до примерно 10 С, после чего добавляли трифторметансульфоновый ангидрид (2,8 кг, 9,9 моль) с такой скоро-7 021753 стью, чтобы внутренняя температура составляла примерно 5-15 С. Реакционную смесь перемешивали при этой температуре в течение примерно 45 мин. Затем температуру рубашки увеличивали до примерно 25 С и реакционную смесь перемешивали при этой температуре до завершения реакции. Затем в реактор добавляли толуол (16,3 кг) и 10%-ный рассол (8,3 л) и смесь перемешивали в течение по меньшей мере 5 мин, затем давали отстояться в течение дополнительных 5 мин. Водный слой удаляли. Добавляли воду(8,3 кг) и смесь перемешивали в течение примерно 5 мин, затем давали отстояться в течение по меньшей мере 10 мин. Водный слой удаляли и повторяли промывку водой. После удаления водного слоя объем органического слоя уменьшали путем вакуумной перегонки до примерно 11 л. Добавляли гептан (18,8 кг) и общий объем снова уменьшали путем вакуумной перегонки до примерно 14 л. Добавляли еще 4 кг гептанов и смесь медленно охлаждали до примерно 5 С в течение ночи. Продукт собирали фильтрованием и 2 раза промывали гептанами (3,6 кг и 4,0 кг). Осадок извлекали сухим в атмосфере N2, затем сушили в вакууме (примерно 60 С) с получением 3,47 кг (95%) (3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1 диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил-трифторметансульфоната. Промежуточное соединение 6. (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбонитрил-1,1-диоксид(10 мл) перемешивали при температуре окружающей среды в течение 15 мин в потоке азота. Реакционную смесь нагревали до 80 С и перемешивали в течение 8 ч. Затем смесь охлаждали до температуры окружающей среды, удаляли в вакууме DMF, добавляли Et2O и органические вещества промывали 2 н.NH4OH (водн.), а потом рассолом. Органические вещества сушили (Na2SO4), фильтровали и концентрировали. Остаток растирали со смесью гексаны/EtOAc, и белое твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (0,386 г, 92%): 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.73-0.97 (m, 6 Н), 0.98-1.62 (m, 8 Н), 1.77-1.92 (m, 1 Н), 2.08-2.24 (m,1 Н), 3.01 (d, J=14,9 Гц, 1 Н), 3.45 (d, J=14,9 Гц, 1 Н), 3.62 (s, 3H), 6.08 (br. s., 1 Н), 6.26 (s, 1 Н), 7.32-7.49 (m,5 Н), 8.28 (s, 1H); ЭР-ЖХ-МС m/z 413 (М+Н)+. Способ 2. В раствор (3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил-трифторметансульфоната (1,346 кг, 2,51 моль) в DMF (2,5 л) загружали Zn(CN)2 (440 г, 3,75 моль) и перемешиваемую смесь дегазировали путем пропускания N2 через смесь в течение 60 мин. Добавляли воду (25 мл) и дегазирование продолжали в течение 30 мин. Добавляли DPPF (14,5 г, 26,16 ммоль) и Pd2(dba)3 (10,5 г, 11,47 ммоль) и реакционную смесь нагревали до 8085 С, продолжая дегазирование. Полагали, что при этой температуре реакция завершилась через 2 ч. После охлаждения реакционной смеси до 60 С добавляли толуол (500 мл) и смесь перемешивали в течение ночи при охлаждении до температуры окружающей среды. Добавляли толуол (8 л) и смесь промывали водой (42 л). Органическую фазу сушили над MgSO4 и фильтровали и фильтрат перемешивали над смолой PL-BnSH (460 г, для извлечения примесей тяжелых металлов) в течение 3 суток. Смолу удаляли фильтрованием и фильтрат концентрировали до кристаллизации продукта. Добавляли гептан (12 л) и полученную твердую фазу собирали фильтрованием и промывали гептаном. Затем белую твердую фазу сушили под вакуумом с получением (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбонитрил-1,1-диоксида (1,010 кг). Способ 3. В реактор помещали (3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил-трифторметансульфонат (2160 г, 4,05 моль) и цианид цинка (266 г,2,23 моль), а затем воду (1084 мл) и N-метилпирролидинон (10830 мл). Содержимое помещали под азот,затем подвергали вакуумированию (3 раза). Реакционную смесь нагревали до 100 С и обрабатывали суспензией ацетата палладия (4,8 г, 0,02 моль) и 1,1'-бис-(дифенилфосфино)ферроцена (15,7 г, 0,03 моль) вNMP (50 мл). Реакционную смесь сразу обрабатывали полиметилгидросилоксаном (PMHS, 22 г) в NMP(50 мл) и выдерживали при 100 С в течение примерно 1 ч, после чего анализ методом высокоэффективной жидкостной хроматографии (ВЭЖХ) показал завершение реакции. Реакционную смесь охлаждали до примерно 35 С и обрабатывали приготовленным раствором воды (8685 г), гидроксида аммония (1958 г) и этанола (17130 г) в течение примерно 10 мин. Полученную суспензию нагревали до примерно 80 С для растворения. Раствор охлаждали до 20 С в течение примерно 60 мин и выдерживали при 20 С в течение примерно 90 мин. Твердую фазу фильтровали, промывали приготовленным раствором 50% этанол/вода(4330 мл), затем гептаном (4300 мл) и извлекали сухим. Твердую фазу сушили в вакуумной печи при Способ 1. (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8 карбонитрил-1,1-диоксид (7,42 г, 17,99 ммоль), растворенный в DCM (150 мл), обрабатывали 1 М DIBALH в толуоле (36,0 мл, 36,0 ммоль) при 0 С и перемешивании в течение 1 ч, после чего анализ методом ЖХ-МС показал полное превращение. Реакционную смесь вливали в смесь лед/1 н. HCl и интенсивно перемешивали в течение 1 ч. Органическую фазу отделяли, сушили над MgSO4, фильтровали и концентрировали с получением желтого твердого вещества. Неочищенный продукт растворяли в 80 мл горячегоEtOAc, к которому добавляли 250 мл гексанов до появления мутности. Смесь оставляли медленно охлаждаться до температуры окружающей среды, а затем охлаждали в ледяной бане. Полученный осадок отфильтровывали, промывали холодной смесью 20% EtOAc/гексаны и сушили на воздухе с получением(3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-карбальдегид-1,1 диоксида (4,00 г, выход 53,5%) в виде белого кристаллического твердого вещества. Маточный раствор концентрировали досуха и остаток очищали на 120 г силикагеля, элюируя смесью 20-40%EtOAc/гексаны, с получением дополнительного продукта в виде белого твердого вещества: 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 0.74 (t, J=7,0 Гц, 3H), 0.81 (t, J=7,4 Гц, 3H), 0.96-1.29 (m, 4 Н),1.33-1.54 (m, 2 Н), 1.68-1.81 (m, 1 Н), 2.01-2.13 (m, 1 Н), 2.80 (d, J=9,8 Гц, 1 Н), 3.13 (d, J=15,0 Гц, 1 Н), 3.58(s, 1H), 10.27 (s, 1H); ЖХ-МС (ЭР+) m/z 416.3 [М+Н]. Способ 2. К перемешиваемому раствору (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-карбонитрил-1,1-диоксид (673,3 г, 1,63 моль) в CH2Cl2 (3,3 л) в течение 50 мин добавляли 1,5 М раствор Dibal-H в толуоле (1,467 л, 2,20 моль), поддерживая температуру реакционной смеси ниже 0 С. Реакционную смесь перемешивали в течение 30 мин при охлаждении до -10 С. Реакционную смесь гасили путем очень медленного добавления 1 М HCl (8 л) в течение 1,25 ч, поддерживая температуру реакционной смеси ниже +15 С (внимание: добавление первых 500 мл HCl является очень экзотермичным). Добавляли толуол (7 л) и смесь перемешивали в течение 3 ч. Водную фазу удаляли, а органический слой промывали 1 М HCl (5 л). Объединенные водные слои экстрагировали CH2Cl2MgSO4, фильтровали и частично концентрировали до тех пор, пока не образовалась густая суспензия. Суспензию разбавляли гептаном (2-3 объема) и выдерживали при перемешивании в течение 15 мин. Твердую фазу собирали фильтрованием и промывали гептаном. Осадок на фильтре сушили на воздухе в течение 3 ч, а затем в вакуумной печи в течение ночи при 50 С с получением (3R,5R)-3-бутил-3-этил-7(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-карбальдегид-1,1-диоксида в виде белого твердого вещества (533 г). Способ 3. В реактор добавляли (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбальдегид-1,1-диоксид (2402 г, 5,82 моль) и толуол (20714 г) и перемешивали при 40 С с образованием раствора. Затем раствор охлаждали до примерно -35 С и обрабатывали раствором DIBAL-H (1,5 М в толуоле, 4472 г, 7,85 моль), поддерживая внутреннюю температуру меньше -30 С. Реакционную смесь перемешивали при примерно -30 С в течение 1 ч до завершения реакции и затем гасили путем медленного добавления 1 н. раствора HCl (примерно 40 кг) до рН 1,0. Реакционную смесь нагревали до примерно 30 С и перемешивали в течение 1 ч. Перемешивание останавливали, нижний водный слой отделяли, а органический слой еще два раза промывали 1 н. раствором HCl (каждый раз 7200 мл), поддерживая температуру примерно 40 С. Водные слои объединяли и обратно промывали толуолом (4126 г). Объединенные органические слои промывали насыщенным водным хлоридом натрия(9000 мл), а затем упаривали при пониженном давлении до примерно 12 л. Потом при атмосферном давлении выпаривали растворитель до конечного объема примерно 7 л и обрабатывали гептанами (16420 г). Содержимое охлаждали до примерно 15 С и перемешивали в течение примерно 2 ч. Твердую фазу вручную делили на мелкие части и ополаскивали гептанами из реактора (23260 г) и собирали фильтрованием. Собранный твердый материал промывали дополнительным количеством гептанов (3180 г), затем сушили при 50 С с получением (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-8-карбальдегид-1,1-диоксида (2128 г, 88%). Промежуточное соединение 18. Диэтил-3-аминопентандиоат К раствору -глутаминовой кислоты (500 мг, 3,40 ммоль) в EtOH (10 мл) по каплям добавляли тионилхлорид (0,992 мл, 13,59 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и концентрировали при пониженном давлении. Остаток распределяли между DCM и насыщенным раствором карбоната калия. Органический слой промывали насыщенным рассолом, сушили(NaSO4) фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (702 мг, 97%) в виде бесцветного масла: 1 Н ЯМР (CDCl3)м.д. 4.04-4.27 (m, 4 Н), 3.46-3.74 (m, 1 Н), 2.24-2.60 (m, 4 Н), 1.09-1.29 (m, 6 Н). Промежуточное соединение 26. [(3R,5S)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил 2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метанол Стадия 1. К ледяному раствору (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбонитрил-1,1-диоксида (2,37 г, 5,74 ммоль) в DCM (50 мл) добавляли DDQ (2,3 дихлор-5,6-дициано-п-бензохинон) (1,956 г, 8,62 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 72 ч. Реакционную смесь распределяли между Н 2 О и DCM. Органический слой промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. После очистки с использованием силикагеля (EtOAc/гексаны = от 1:4 до 3:1) и дополнительной очистки с использованием силикагеля (MeOH:DCM = от 0:100 до 5:95) получали (3R)3-бутил-3-этил-7-(метилокси)-5-фенил-2,3-дигидро-1,4-бензотиазепин-8-карбонитрил-1,1-диоксид (1,42 г, 59%) в виде белого твердого вещества: 1 Н ЯМР (CDCl3)м.д. 8.27 (s, 1H), 7.60 (d, J=7,2 Гц, 2 Н), 7.44-7.54 (m, 1H), 7.35-7.45 (m, 2 Н), 6.77 (s,1H), 3.90 (s, 3H), 3.63-3.86 (m, 3H), 1.02-1.76 (m, 8H), 0.89 (t, J=7,2 Гц, 3H), 0.83 (t, J=6,8 Гц, 3H); ЭР-ЖХМС m/z 411 (М+Н)+. Стадия 2. К ледяному раствору (3R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3-дигидро-1,4 бензотиазепин-8-карбонитрил-1,1-диоксида (1,32 г, 3,22 ммоль) в DCM (30 мл) по каплям добавляли DIBAL-H (6,43 мл, 643 ммоль) в виде 1 М раствора в толуоле. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, обрабатывали 1 н. раствором соляной кислоты и перемешивали в течение 1 ч, после чего разделяли слои. Водный слой экстрагировали DCM, а объединенные органические слои промывали Н 2 О, насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением (3R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3-дигидро-1,4 бензотиазепин-8-карбальдегид-1,1-диоксида (1,0 г, 75%) в виде белого твердого вещества: 1 Н ЯМР (CDCl3)м.д. 10.48 (s, 1H), 8.50 (s, 1 Н), 7.59-7.68 (m, 2 Н), 7.43-7.52 (m, 1 Н), 7.34-7.43 (m,2 Н), 6.80 (s, 1H), 3.89 (s, 3H), 3.63-3.83 (m, 2 Н), 0.99-1.36 (m, 5 Н), 0.88 (t, J=7,0 Гц, 3H), 0.82 (t, J=7,0 Гц,3H); ЭР-ЖХ-МС m/z 414 (М+Н)+. Стадия 3. К раствору (3R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3-дигидро-1,4-бензотиазепин-8 карбальдегид-1,1-диоксида (720 мг, 1,741 ммоль) в THF (20 мл) по каплям добавляли комплекс боранTHF (3,48 мл, 1 М раствор в THF, 3,48 ммоль). Реакционную смесь перемешивали в течение ночи, затем при 40 С в течение еще 24 ч. Реакционную смесь охлаждали до комнатной температуры, гасили МеОН,перемешивали в течение 30 мин и концентрировали при пониженном давлении. Несколько раз добавляли МеОН и выпаривали при пониженном давлении. После очистки с использованием силикагеля(EtOAc:гексаны = от 20:80 до 50:50) получали указанное в заголовке соединение (306 мг, 42%) в виде белого твердого вещества: 1 Н ЯМР (CDCl3)м.д. 8.05 (s, 1 Н), 7.30-7.53 (m, 5 Н), 6.18 (s, 1 Н), 6.08 (br. s., 1 Н), 4.53-4.82 (m, 2 Н),3.56 (s, 3H), 3.43 (d, J=14,9 Гц, 1 Н), 3.08 (d, J=14,9 Гц, 1 Н), 2.38 (dd, J=14,7, 7,4 Гц, 1 Н), 2.14 (t, J=5,9 Гц,1 Н), 1.71-1.87 (m, 1 Н), 1.44-1.57 (m, 2 Н), 1.09-1.42 (m, 5 Н), 0.91 (t, J=6,8 Гц, 3H), 0.79 (t, J=1,2 Гц, 3H); ЭРЖХ-МС m/z 418 (М+Н)+. Промежуточное соединение 27. (3R,5S)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбальдегид-1,1-диоксид(491 мг, 1,157 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и фильтровали через набивку из силикагеля. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (391 мг, выход 85%) в виде белого твердого вещества: 1 Н ЯМР (CDCl3)м.д. 10.35 (s, 1H), 8.55 (s, 1H), 7.33-7.52 (m, 5H), 6.30 (s, 1H), 6.13 (s, 1H), 3.63 (s,3H), 3.47 (d, J=14,9 Гц, 1 Н), 3.08 (d, J=14,9 Гц, 1 Н), 2.40 (dd, J=14,9, 7,4 Гц, 1 Н), 1.83 (dd, J=14,9, 7,4 Гц,1 Н), 1.11-1.47 (m, 5 Н), 0.91 (t, J=6,8 Гц, 3H), 0.78 (t, J=7,4 Гц, 3H); ЭР-ЖХ-МС m/z 416 (М+Н)+. Промежуточное соединение 48. Диметил-3-аминопентандиоат Диметил-(2Z)-3-амино-2-пентендиоат (613 г, 3,54 моль) порциями при перемешивании добавляли кTFA (3,15 л), поддерживая температуру реакционной смеси ниже 30 С с помощью наружного охлаждения. После растворения большей части твердой фазы по каплям в течение 1 ч добавляли 1 М ВН 3-THF(1,53 л, 1,53 моль), поддерживая температуру реакционной смеси 18-21 С. Реакционную смесь охлаждали до 10 С и гасили путем добавления воды (500 мл) по каплям в течение 5 мин, поддерживая температуру реакционной смеси 10-15 С. Реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин, а затем фильтровали. Фильтрат концентрировали для удаления большей части TFA и полученный материал растворяли в CH2Cl2 (4 л). К перемешиваемому раствору K3PO4 (3 кг) в воде (3 л) медленно добавляли CH2Cl2 раствор при температуре окружающей среды и смесь быстро перемешивали в течение 10 мин. Слои разделяли и водную фазу экстрагировали CH2Cl2 (2 л). Объединенные CH2Cl2 слои сушили над MgSO4, фильтровали и концентрировали с получением диметил-3-аминопентандиоата(568 г) в виде жидкости золотистого цвета: 1 Н ЯМР (DMSO-d6)м.д. 3.56 (s, 6 Н), 3.35 (m, 1 Н), 2.42 (dd, J=16 Гц, J=5,3 Гц, 2 Н), 2.29 (dd, J=16 Гц, J=8 Гц, 2 Н), 1.93 (br s, 2H). Промежуточное соединение 49. Диметил-3-аминопентандиоат (соль уксусной кислоты) Раствор диметил-3-аминопентандиоата (568 г, 3,24 моль) в трет-бутилметиловом эфире (2,3 л) охлаждали в ледяной бане и по каплям добавляли ледяную уксусную кислоту (195, 3,24 моль), поддерживая температуру реакционной смеси примерно 15 С. В полученную смесь вносили затравку небольшого количества целевого кристаллического продукта и перемешивали в течение 90 мин при охлаждении до 5 С. Полученный осадок собирали фильтрованием и промывали смесью трет-бутилметиловый эфир/гептан (1:1). Осадок на фильтре сушили под вакуумом с получением уксуснокислой соли диметил 3-аминопентандиоата в виде не совсем белого твердого вещества (640 г): 1 Н ЯМР (DMSO-d6)м.д. 5.30 (br s, 3H), 3.56 (s, 6H), 3.36 (m, 1 Н), 2.44 (dd, J=16 Гц, J=5 Гц, 2 Н),2.31 (dd, J=16 Гц, J=8 Гц, 2H), 1.86 (s, 3H). Промежуточное соединение 50. Диметил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо 5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоат К перемешиваемой смеси (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-8-карбальдегид-1,1-диоксида (857 г, 2,06 моль) в изоPrOAc (8 л) добавляли ледяную уксусную кислоту (420 г, 6,99 моль), а затем уксуснокислую соль диметил-3-аминопентандиоата (645 г,2,74 моль). Порциями в течение 45 мин добавляли триацетоксиборогидрид натрия (656 г, 3,09 моль),- 11021753 поддерживая температуру реакционной смеси ниже 22 С. Через 1 ч реакционную смесь промывали водой (8 л) и 10%-ным Na2CO3 (8 л). Органическую фазу сушили над MgSO4, фильтровали и концентрировали с получением диметил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоата в виде масла (1,2 кг): 1 Н ЯМР (DMSO-d6)м.д. 7.90 (s, 1H), 7.42-7.34 (m, 4H), 7.34-7.26 (m, 1 Н), 6.04 (s, 1 Н), 5.91 (d,J=9,87 Гц, 1 Н), 3.67-3.53 (m, 3H), 3.55 (s, 3H), 3.54 (s, 3H), 3.50 (d, J=15 Гц, 1 Н), 3.40 (s, 3H), 3.23 (m, 1 Н),3.01 (d, J=15 Гц, 1 Н), 2.58-2.39 (m, 4 Н), 2.03 (m, 1 Н), 2.16 (br s, 1 Н), 1.76-1.66 (m, 1 Н), 1.50-1.30 (m, 2 Н),1.27-0.96 (m, 4 Н), 0.77 (t, J=7,5 Гц, 3H), 0.73 (t, J=7,0 Гц, 3H).II. Получение соединений по изобретению. Пример 26. 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-ил]метиламино)пентандиовая кислота Способ 1, стадия 1. К раствору (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-карбальдегид-1,1-диоксида (683 мг, 1,644 ммоль) в 1,2-дихлорэтане (20 мл) добавляли диэтил-3-аминопентандиоат (501 мг, 2,465 ммоль) и уксусную кислоту (0,188 мл, 3,29 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем обрабатывалиNaHB(OAc)3 (697 мг, 3,29 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи и гасили водным раствором карбоната калия. Смесь экстрагировали DCM. Объединенные органические слои промывали Н 2 О, насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением диэтил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1 диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоата (880 мг, 88%) в виде светло-желтого масла: МС-ЖХ-МС m/z 603 (М+Н)+. Способ 1, стадия 2. К раствору диэтил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5 фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоата (880 мг, 1,460 ммоль) в смеси THF-/МеОН/Н 2 О (1:1:1, 30 мл) добавляли гидроксид лития (175 мг, 7,30 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали при пониженном давлении. Для растворения остатка добавляли Н 2 О и MeCN. Раствор подкисляли уксусной кислотой до рН 4-5, частично концентрировали при пониженном давлении для удаления MeCN и оставляли стоять в течение 30 мин. Белый осадок собирали фильтрованием и сушили при пониженном давлении при 50 С в течение ночи с получением указанного в заголовке соединения (803 мг, 100%) в виде белого твердого вещества: 1 Н ЯМР (MeOH-d4)м.д. 8.05 (s, 1H), 7.27-7.49 (m, 5H), 6.29 (s, 1H), 6.06 (s, 1 Н), 4.25 (s, 2 Н), 3.603.68 (m, 1 Н), 3.58 (s, 3H), 3.47 (d, J=14,8 Гц, 1 Н), 3.09 (d, J=14,8 Гц, 1 Н), 2.52-2.73 (m, 4 Н), 2.12-2.27 (m,1 Н), 1.69-1.84 (m, 1 Н), 1.48-1.63 (m, 1 Н), 1.05-1.48 (m, 5 Н), 0.87 (t, J=7,4 Гц, 3H), 0.78 (t, J=7,0 Гц, 3H); ЭРЖХ-МС m/z 547 (М+Н)+. Способ 2. Раствор диметил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил 2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоата (примерно 600 г) в THF (2,5 л) и МеОН (1,25 л) охлаждали в ледяной бане и по каплям в течение 20 мин добавляли раствор NaOH (206 г,5,15 моль) в воде (2,5 л) (температура реакции 10-22 С). После перемешивания в течение 20 мин раствор концентрировали (для удаления THF/MeOH) и подкисляли концентрированной HCl до рН примерно 4. Выпавший в осадок продукт выдерживали при перемешивании, собирали фильтрованием и сушили на воздухе в течение ночи. Вторую 600 г партию диметил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1 диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоата подвергали омылению аналогичным образом. Объединенные неочищенные продукты (теоретически примерно 2 моль) суспендировали в CH3CN (8 л) и воде (4 л) и перемешиваемую смесь нагревали до 65 С. Образовывался раствор, который охлаждали до 10 С в течение 2 ч, несколько раз используя в этот период времени затравку аутентичного образца целевого кристаллического продукта. Полученную суспензию перемешивали при 10 С в течение 2 ч и фильтрованием собирали твердое вещество. Осадок на фильтре промывали водой и сушили на воздухе в течение ночи. После дополнительной сушки до постоянной массы в вакуумной печи при 55 С получали кристаллическую 3([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8 ил]метиламино)пентандиовую кислоту в виде белого твердого вещества (790 г). Способ 3. (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8 карбальдегид-1,1-диоксид (1802 г, 4,336 моль) и диметил-3-аминопентандиоат (1334 г, 5,671 моль) суспендировали в изоPrOAc (13,83 кг). К реактору прикладывали азотную атмосферу. К суспензии при 20 С добавляли ледяную уксусную кислоту (847 мл, 14,810 моль) и смесь перемешивали до тех пор, пока не наблюдалось полное растворение. Потом к реакционной смеси в течение периода времени 7 мин добавляли твердый триацетоксиборогидрид натрия (1424 г, 6,719 моль). Реакционную смесь выдерживали при 20 С в течение 3 ч, после чего анализ образца методом жидкостной хроматографии (ЖХ) показал полное израсходование (3R,5R)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8 карбальдегид-1,1-диоксида. Затем в реактор добавляли воду (20,36 кг) и рассол (4,8 кг). Содержимое реактора перемешивали в течение 10 мин и потом давали отстояться в течение 10 мин. Нижний водный слой затем удаляли и направляли в отходы. В реактор добавляли заранее приготовленный 10%-ный(мас./мас.) водный раствор бикарбоната натрия (22,5 л). Содержимое перемешивали в течение 10 мин и потом давали отстояться в течение 10 мин. Нижний водный слой затем удаляли и направляли в отходы. В реактор добавляли вторую промывку 10%-ного (мас./мас.) водного бикарбоната натрия (22,5 л). Содержимое реактора перемешивали в течение 10 мин и давали отстояться в течение 10 мин. Нижний водный слой затем удаляли и направляли в отходы. Затем путем вакуумной перегонки уменьшали содержимое реактора до масла. К маслу добавляли THF (7,15 кг) и МеОН (3,68 кг). Содержимое реактора нагревали до 55 С и интенсивно перемешивали до тех пор, пока не наблюдось полное растворение. Затем содержимое реактора охлаждали до 25 С, потом добавляли заранее приготовленный водный раствор NaOH(6,75 кг воды и 2,09 кг NaOH (50%-ный мас./мас. раствор при охлаждении с использованием рубашки. Содержимое реактора выдерживали при температуре ниже 42 С, добавляя при этом раствор NaOH. После добавления NaOH снова устанавливали температуру 25 С и реакционную смесь перемешивали в течение 75 мин, после чего анализ методом ВЭЖХ показал, что реакция завершилась. В реактор добавляли гептан (7,66 кг) и содержимое перемешивали в течение 10 мин и затем оставляли отстаиваться в течение 10 мин. Водный слой собирали в чистую бутыль Nalgene. Гептановый слой удаляли из реактора и направляли в отходы. Затем водный раствор возвращали в реактор и реактор подготавливали для вакуумной перегонки. В процессе вакуумной перегонки собирали примерно 8,5 л дистиллята, сбрасывали вакуум и снова устанавливали температуру содержимого реактора 25 С. В реактор в течение периода времени 40 мин добавляли 1 н. раствор HCl (30,76 кг). Полученную суспензию перемешивали при 25 С в течение 10 ч, затем охлаждали до 5 С в течение периода времени 2 ч. Суспензию выдерживали при 5 С в течение 4 ч, после чего вакуумным фильтрованием собирали продукт в фильтровальном сосуде (filtercrock). Затем осадок на фильтре промывали холодной (5 С) водой (6 кг). Осадок продукта сушили на воздухе в фильтровальном сосуде под вакуумом в течение примерно 72 ч. Затем продукт переносили в три сушильных лотка и сушили в вакуумной печи при 50 С в течение 79 ч. Потом температуру вакуумной печи увеличивали до 65 С в течение еще 85 ч. Продукт выгружали, получая единичную партию из 2568 г (выход 93,4%) 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиовой кислоты промежуточного качества в виде не совсем белого твердого вещества. 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиовую кислоту промежуточного качества растворяли (4690 г) в смеси ледяной уксусной кислоты (8850 г) и очищенной воды (4200 г) при 70 С. Полученный раствор пропускали через 5 мкм фильтр тонкой очистки, поддерживая температуру выше 30 С. Реактор и фильтр ополаскивали смесью ледяной уксусной кислоты (980 г) и очищенной воды (470 г). Устанавливали температуру раствора 50 С. К раствору добавляли фильтрованную очищенную воду (4230 г). Затем в мутный раствор вносили затравку кристаллической 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо 5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиовой кислоты (10 г). Поддерживая температуру 50 С в суспензию загружали фильтрованную очищенную воду с контролируемой скоростью (11030 г в течение 130 мин). Затем к суспензии добавляли дополнительное количество фильтрованной очищенной воды с более быстрой контролируемой скоростью (20740 г в течение 100 мин). Окончательная загрузка фильтрованной очищенной воды (3780 г) приводила к получению суспензии. Затем суспензию охлаждали до 10 С с линейной скоростью в течение 135 мин. Твердую фазу фильтровали через фильтр из гладкой блестящей ткани (sharkskin filter paper) для удаления маточного раствора. Осадок на фильтре ополаскивали отфильтрованным этилацетатом (17280 г), затем промывочные жидкости удаляли фильтрованием. Полученный влажный осадок отделяли в лотки и сушили под вакуумом при 50 С в течение 23 ч. Затем температуру увеличивали до 60 С и сушку продолжали в течение еще 24 ч с получением кристаллической 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиовой кислоты (3740 г, выход 79,7%) в виде белого твердого вещества. К суспензии этой кристаллической 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5 фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиовой кислоты (3660 г) и фильтрованной очищенной воде (3,6 л) добавляли фильтрованную ледяную уксусную кислоту (7530 г). Температура увеличилась до 60 С и наблюдалось полное растворение. Температуру понижали до 55 С, смесь фильтровали и обрабатывали очищенной водой (3,2 л). Затем в раствор вносили затравку кристаллической 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4 бензотиазепин-8-ил]метиламино)пентандиовой кислоты (18 г), получая суспензию. В суспензию загру- 13021753 жали фильтрованную очищенную воду с контролируемой скоростью (9 л в течение 140 мин). Затем к суспензии добавляли дополнительное количество фильтрованной очищенной воды с более быстрой контролируемой скоростью (18 л в течение 190 мин). Потом суспензию охлаждали до 10 С с линейной скоростью в течение 225 мин. Твердую фазу фильтровали через фильтр из гладкой блестящей ткани для удаления маточного раствора. Затем осадок на фильтре ополаскивали фильтрованной очищенной водой(18 л) и промывочные жидкости удаляли фильтрованием. Полученный влажный осадок отделяли в лотки и сушили под вакуумом при 60 С в течение 18,5 ч с получением кристаллической 3-([(3R,5R)-3-бутил 3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-ил]метиламино) пентандиовой кислоты (3330 г, выход 90,8%) в виде белого твердого вещества, которое анализировали на кристалличность, как в итоге показано ниже. Пример 43. 3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро 1,4-бензотиазепин-8-ил]метиламино)пентандиовая кислота Стадия 1. Раствор (3R,5S)-3-бутил-3-этил-7-(метилокси)-5-фенил-2,3,4,5-тетрагидро-1,4-бензотиазепин-8-карбальдегид-1,1-диоксида (100 мг, 0,241 ммоль) и диметил-3-аминопентандиоата (63,2 мг,0,361 ммоль) в 1,2-дихлорэтане (4 мл) перемешивали в течение 30 мин, затем обрабатывали уксусной кислотой (0,069 мл, 1,203 ммоль). Реакционную смесь перемешивали в течение 1 ч, обрабатывалиNaHB(OAc)3 (102 мг, 0,481 ммоль), перемешивали при комнатной температуре в течение ночи и гасили 2 н. водн. раствором карбоната натрия. После перемешивания в течение 30 мин смесь экстрагировалиDCM. Органический слой промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. После очистки с использованием силикагеля (EtOAc/гексаны = от 1:4 до 1:1) получали диметил-3-([(3R,5R)-3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5 тетрагидро-1,4-бензотиазепин-8-ил]метиламино)пентандиоат (92,7 мг, 67%) в виде бесцветного масла: 1 Н ЯМР (CDCl3)м.д. 7.99 (s, 1H), 7.21-7.52 (m, 5 Н), 6.12 (s, 1 Н), 6.06 (s, 1 Н), 3.74 (d, J=5,3 Гц, 2 Н),3.66 (s, 6H), 3.50 (s, 3H), 3.23-3.44 (m, 2 Н), 3.05 (d, J=14,6 Гц, 1 Н), 2.56 (d, J=6,2 Гц, 4 Н), 2.26-2.44 (m, 1 Н),1.67-1.87 (m, 2 Н), 1.03-1.56 (m, 7 Н), 0.89 (t, J=6,6 Гц, 3H), 0.76 (t, J=7,2 Гц, 3H); ЭР-ЖХ-МС m/z 575THF/MeOH/H2O (1:1:1, 6 мл) добавляли моногидрат гидроксида лития (67,2 мг, 1,601 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем частично концентрировали при пониженном давлении для удаления органических растворителей. 1 н. соляной кислотой устанавливали рН водной фазы 5. Белый осадок собирали фильтрованием и сушили на воздухе с получением указанного в заголовке соединения (42 мг, 45%) в виде белого твердого вещества: 1 Н ЯМР (DMSO-d6)м.д. 7.94 (s, 1 Н), 7.41 (d, J=4,3 Гц, 4 Н), 7.26-7.38 (m, 1H), 6.10 (s, 1H), 5.93 (br.s, 1H), 3.80 (s, 2H), 3.55 (d, J=14,9 Гц, 1 Н), 3.08 (d, J=14,9 Гц, 1 Н), 2.57-2.76 (m, 1 Н), 2.31-2.47 (m, 3H),2.04-2.21 (m, 1 Н), 1.55-1.82 (m, 1 Н), 1.07-1.51 (m, 7 Н), 0.86 (t, J=6,6 Гц, 3H), 0.66 (t, J=7,2 Гц, 3H); ЭР-ЖХМС m/z 547 (М+Н)+. Способ определения кристалличности. Анализ методом дифференциальной сканирующей калориметрии (ДСК) осуществляли с использованием прибора ТА Instruments Q1000 DSC. Образец загружали в негерметично закрытый алюминиевый тигль и сканировали при продувке азотом при 10 С/мин. Термогравиметрический анализ (ТГА) осуществляли с использованием прибора ТА Instruments Q5000 TGA. Образец загружали в платиновый тигль и сканировали от комнатной температуры до выше начала разложения при 10 С/мин. Образец конечного кристаллического примера 26 после способа 3 продемонстрировал начало разложения при примерно 207 С. ТГА анализ подтвердил, что эндотерма ДСК была обусловлена скорее разложением, чем настоящим плавлением. Незначительная потеря массы (меньше чем 0,5% мас./мас.) до разложения наблюдалась при ТГА анализе. Образец конечного кристаллического примера 26 после способа 3 имел существенные дифракционные пики на картине дифракции рентгеновских лучей на порошке (картине PXRD) при значениях 2 иd-расстоянии вв скобках 4,9 (18), 5,3 (17), 9,8 (9,0), 12,0 (7,4), 13,2 (6,7), 18,5 (4,8), 19,8 (4,5), 21,1 (4,2). Изображение дифракции рентгеновских лучей на порошке получали, заполняя образцом 1-мм стеклянный капилляр. Изображение PXRD получали с использованием дифрактометра PANalytical X'Pert ProMPD, снабженного медной рентгеновской трубкой, эллиптическим зеркалом для падающих лучей и детектором PANalytical X'celerator. В качестве внутреннего стандарта для корректировки, если необходимо,- 14021753 экспериментальных ошибок 2 использовали кремниевый порошок (NIST 640b). Кроме того, негативное изображение для узкого диапазона низких значений углов сравнивали с позитивным изображением для узкого диапазона низких значений углов для оценки ошибки в отношении 2 для наименьших наблюдаемых дифракционных пиков (около 5 2), а также для подтверждения того, что капилляр находился,по существу, на одной линии с пучком рентгеновских лучей. Данные по дифракции собирали для углов 2 от 3,5 до 90. Отдельно получали картину капилляра, заполненного чистым образцом (без внутреннего стандарта), при углах 2 от 3,5 до 50. Способ определения ингибирования iBAT человека. Для измерения поглощения желчных кислот клетками, экспрессирующими котранспортер желчных кислот в подвзвошной кишке (iBAT), клетки HEK293 культивировали в DMEM (модифицированная по способу Дульбекко среда Игла)/F12 с добавлением 10% FBS (фетальной бычьей сыворотки). Клетки при достижении конфлюентности 80-90% собирали за 24 ч до начала эксперимента. Клетками засевали покрытые поли-d-лизином планшеты в концентрации 50000 клеток на планшет, добавляли вирус iBATBacmam человека таким образом, чтобы каждый планшет содержал 3,6710 е 6 pfu (бляшкообразующих единиц) (73,4 pfu/лунка). Каждый планшет для анализа покрывали свободнодышащей изоляцией BreatheEasy Seal и помещали в инкубатор на 24 ч для предоставления экспрессии транспортера. В день проведения эксперимента по поглощению к сбалансированному солевому раствору Хенкса добавляли 10 мкМ HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту) и устанавливали рН 7,4 с помощью TRIS (трис-(гидроксиметил)аминометана) (HBSSH). Буфер для анализа приготавливали путем добавления 100 пМ [3 Н]-таурохолата и 10 мкМ холодного таурохолата к HBSSH (сбалансированному солевому раствору Хенкса с HEPES) при комнатной температуре. Отдельный промывочный буфер приготавливали путем добавления 10 мкМ холодного таурохолата к HBSSH (примерно 30 мл на планшет для анализа) и помещали на лед. Используя 100%-ный DMSO для каждого тестируемого соединения получали 8-точечные, 3-кратные кривые разведения, начиная с 200 мкМ. Аналогичным образом получали 8-точечную кривую доза-ответ для контрольного соединения, представляющего собой(Brieaddy L.E., WO 9605188, 1996)], начиная с 1,8 мМ. Планшеты с лекарственными средствами изготавливали, добавляя 3 мкл каждой концентрации в v-донный 96-луночный планшет, затем 60-кратно разводили 177 мкл буфера для анализа. Планшеты удаляли из инкубатора и оставляли охлаждаться до температуры окружающей среды. Среду отсасывали и лунки один раз промывали 300 мкл HBSSH. 50 мкл каждой концентрации на кривой доза-ответ добавляли в трех повторах с помощью колонки для планшетов для анализа, резервируя колонку 10 для контроля (буфер для анализа + 1,67% DMSO), а колонки 11 и 12 для контрольного соединения. Планшеты инкубировали при температуре окружающей среды в течение 90 мин, затем планшеты подвергали отсасыванию, потом промывали 1300 мкл промывочного буфера. В каждую лунку добавляли 220 мкл Microscint 20 и планшеты герметично закрывали. Количество [3 Н]таурохолата в клеточном лизате подсчитывали на следующие сутки с использованием сцинтилляционного счетчика для микропланшетов. Процент ингибирования поглощения определяли для каждой концентрации лекарственного средства с использованием следующей формулы: 100(1-Т 1-С 2)/(С 1-С 2; где Т 1 представляет собой среднее число импульсов в минуту (cpm) для тестируемого соединения, С 1 представляет собой среднее cpm, наблюдаемое в отсутствие какого-либо добавленного ингибитора, а С 2 представляет собой среднее cpm,наблюдаемое в присутствии вещества, известного в качестве вызывающего 100%-ное ингибирование поглощения (30 мкМ контрольное соединение). Величины IC50 можно определить, используя формулу,y=(Vmax хn)/(Kn+хn). Соединения по изобретению были протестированы в описанном выше анализе; результаты суммированы ниже, где каждое число является средним по меньшей мере для 2 полученных результатов. 3. Соединение по п.2, где указанное соединение является кристаллическим. 4. Фармацевтически приемлемая соль соединения по любому из пп.1-3. 5. Фармацевтическая композиция, которая ингибирует iBAT (котранспортер желчных кислот в подвздошной кишке), содержащая соединение или соль по любому из пп.1-4. 6. Фармацевтическая композиция для применения в лечении нарушения обмена веществ у человека,содержащая соединение или соль по любому из пп.1-4. 7. Фармацевтическая композиция по п.6, где указанное нарушение обмена веществ представляет собой сахарный диабет (типа I и типа II) или ожирение. 8. Применение соединения или соли по любому из пп.1-4 в лечении нарушения обмена веществ у человека.
МПК / Метки
МПК: A01N 43/22, A61K 31/38, A01N 43/02
Метки: 3-({[3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидpо-1,4-бензотиазепин-8-ил]метил}амино)пентандиовая, кислота
Код ссылки
<a href="https://eas.patents.su/17-21753-3-3-butil-3-etil-7-metiloksi-11-dioksido-5-fenil-2345-tetragidpo-14-benzotiazepin-8-ilmetilaminopentandiovaya-kislota.html" rel="bookmark" title="База патентов Евразийского Союза">3-({[3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидpо-1,4-бензотиазепин-8-ил]метил}амино)пентандиовая кислота</a>
Предыдущий патент: Способ идентификации источника дефекта стекла, ассоциированного с коррозией огнеупора
Следующий патент: Теплоизолированная гибкая многослойная полимерная труба и трубопровод
Случайный патент: Способ энантиоселективного синтеза отдельных энантиомеров модафинила ассиметричным окислением












