Соединения для уменьшения продукции бета-амилоида
Номер патента: 21527
Опубликовано: 30.07.2015
Авторы: Бой Кеннет М., Чзан Юньхуй, Макор Джон Е., Томпсон III Лорин А., Гернон Джейсон М., У Юн-Цзинь
Формула / Реферат
1. Соединение формулы (I)
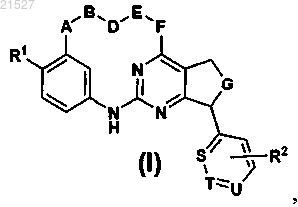
включая его фармацевтически приемлемые соли, где
R1 представляет собой нитрильную группу или представляет собой гетероароматическое кольцо, выбранное из имидазола и триазола, где указанное гетероароматическое кольцо необязательно имеет в качестве заместителей одну или две группы, выбранные из атома галогена, галоген-С1-6алкила, гидроксила, амино, C1-6алкокси и С1-6алкила;
А выбран из О и СН2 или представляет собой связь;
B-D-E представляет собой -СН2-СН=СН-СН2- (цис), -СН2-СН=СН-СН2- (транс), -(СН2)3-, -(СН2)4-, -СН2-СН(ОН)-СН2-СН2-, -СН2-СН2-СН(ОН)-СН2-, -СН2-СН2-N(R3)-СН2-СН2- или -СН2-СН2-О-СН2-СН2-;
F выбран из О и NR3 или представляет собой связь;
G выбран из -СН2-, -СН2-СН2-, NR3 и -N(R3)-СН2-;
S, Т и U независимо выбраны из атома углерода и атома азота, при условии, что не более чем один из S, Т и U представляет собой атом азота;
R2 необязательно представляет собой одну, две или три группы, выбранные из атома галогена, С1-4алкокси, OCF3, С1-4алкила, CN;
R3 независимо представляет собой C1-4алкил или атом водорода.
2. Соединение по п.1, где R1 представляет собой имидазол, который имеет в качестве заместителя группу галогена.
3. Соединение по п.1, где R1 представляет собой триазол, содержащее три атома азота, который имеет в качестве заместителя метильную группу.
4. Соединение по п.1, где R1 представляет собой -CN.
5. Соединение по п.1, где А представляет собой атом кислорода.
6. Соединение по п.1, где F представляет собой NH, NMe или NEt.
7. Соединение по п.1, где B-D-E представляет собой -СН2-СН=СН-СН2- (цис), -СН2-СН=СН-СН2- (транс), -(СН2)3- или -(СН2)4-.
8. Соединение по п.1, где B-D-E представляет собой -СН2-СН(ОН)-СН2-СН2-, -СН2-СН2-СН(ОН)-СН2-, -СН2-СН2-N(R3)-СН2-СН2- или -СН2-СН2-О-СН2-СН2.
9. Соединение по п.1, где G представляет собой -СН2-, -СН2-СН2- или -N(R3)-СН2-.
10. Соединение, которое выбрано из группы, состоящей из







11. Фармацевтическая композиция для лечения расстройств, чувствительных к уменьшению продукции β-амилоидного пептида, содержащая терапевтически эффективное количество соединения по п.1 в сочетании с фармацевтически приемлемым носителем или разбавителем.
12. Фармацевтическая композиция для лечения расстройств, чувствительных к уменьшению продукции β-амилоидного пептида, содержащая терапевтически эффективное количество соединения по п.10 в сочетании с фармацевтически приемлемым носителем или разбавителем.
Текст
СОЕДИНЕНИЯ ДЛЯ УМЕНЬШЕНИЯ ПРОДУКЦИИ БЕТА-АМИЛОИДА В изобретении представлены соединения формулы (I), включая их фармацевтически приемлемые соли модулирующие продукцию -амилоидного пептида (-АР), которые можно применять в лечении болезни Альцгеймера и других патологических состояний, вызываемых продукцией амилоидного пептида (-АР). Область техники Настоящее изобретение относится к соединениям, которые являются ингибиторами продукции амилоидного пептида (А), а также к способам лечения болезни Альцгеймера (БА) и других патологических состояний, связанных с продукцией -амилоида, с применением данных соединений. Кроме того,изобретение относится к фармацевтическим композициям, содержащим данные соединения. Уровень техники Болезнь Альцгеймера (БА) представляет собой прогрессирующее нейродегенеративное заболевание, начало которого характеризуется потерей памяти и дальнейшее развитие которого приводит к таким последствиям, как тяжелое нарушение познавательных способностей, изменение поведения и нарушение моторной функции (Grundman, M. et al., Arch Neurol. (2004), 61: 59-66; Walsh, D.M. et al., Neuron (2004),44: 181-193). БА представляет собой самую распространенную форму деменции и является третьей основной причиной смерти после сердечно-сосудистых расстройств и рака. Негативные последствия БА значительны, к ним относятся страдание пациентов и членов их семей, а также выключение пациентов и лиц, осуществляющих за ними уход, из производственной деятельности. В настоящее время отсутствуют методики лечения, которые эффективно предупреждают БА или устраняют клинические симптомы и лежащую в их основе патофизиологию. Для подтверждения диагноза БА у пациента, страдавшего деменцией, необходимо провести гистологическое исследование на вскрытии, чтобы оценить количество и локализацию нейритических бляшек и нейрофибриллярных клубков (Consensus recommendations for the postmortem diagnosis of Alzheimer'sdisease. Neurobiol. Aging (1997), 18: S1-2). Аналогичные изменения наблюдаются у пациентов, страдающих трисомией 21 (болезнью Дауна). Бляшки преимущественно состоят из -амилоидных (А) пептидов,которые образуются в результате последовательного протеолитического расщепления предшественника бета-амилоида (АРР) -секретазой (ВАСЕ, от англ. -site APP-cleaving enzyme) с образованием Nконцевого фрагмента АРР и -секретазой с образованием С-концевого фрагмента АРР (Selkoe, D.J., Physiol. Rev. (2001), 81: 741-766). -Секретаза представляет собой трансмембранный белковый комплекс, который включает никастрин, Aph-1, PEN-2 и либо пресенилин-1 (PS-1), либо пресенилин-2 (PS-2) (Wolfe,M.S. et al., Science (2004), 305: 1119-1123). Считается, что PS-1 и PS-2 содержат каталитические сайты секретазы. А 40 представляет собой наиболее распространенную форму синтезируемых А (80-90%), тогда как А 42 наиболее тесно связан с патогенезом БА. В частности, мутации в генах АРР, PS-1 и PS-2, приводящие к редким наследственным формам БА, вызывают образование А 42-агрегатов, являющихся первичными токсическими продуктами (Selkoe, D.J., Physiol Rev. (2001), 81: 741-766). Имеющиеся данные дают возможность предположить, что олигомерные протофибриллярные и внутриклеточные А 42 играют значительную роль в патологическом процессе (Geary, J.P. et al., Nat. Neurosci. (2005), 8: 79-84). Ингибиторы ферментов, участвующих в образовании А 42, таких как -секретаза, представляют собой потенциальные базисные лекарства для лечения БД. Есть основания считать, что уменьшение уровня А в головном мозге путем ингибирования секретазы может препятствовать появлению и прогрессированию БА (Selkoe, D., Physiol. Rev. (2001), 81: 741-766; Wolfe, M., J. Med. Chem. (2001), 44: 2039-2060). Появляются данные о роли А в других заболеваниях, включающих легкое когнитивное нарушение (ЛКН), болезнь Дауна, церебральную амилоидную ангиопатию (САА), деменцию с тельцами Леви (DLB), боковой амиотрофический склероз (ALS-D), миозит с включенными тельцами (IBM) и возрастную дегенерацию желтого пятна. Соответственно, соединения, которые ингибируют -секретазу и уменьшают продукцию А, можно было бы с успехом использовать в лечении этих или других А-обусловленных заболеваний. Избыточная продукция и/или замедленный клиренс А приводят к развитию САА (Thal, D. et al., J.Neuropath. Exp. Neuro. (2002), 61: 282-293). У пациентов, страдающих данным заболеванием, сосудистые амилоидные депозиты вызывают дегенерацию стенок сосудов и аневризмы, что может являться причиной 10-15% геморрагических инсультов у пожилых пациентов. Как и в случае БА, мутации в гене, кодирующем А, приводят к развитию ранней формы САА, называемой церебральная геморрагия с амилоидозом голландского типа, а у мышей, экспрессирующих данный мутантный белок, развивается САА,похожая на соответствующее заболевание у человека. Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие САА. Проявлениями DLB являются зрительные галлюцинации, бред и паркинсонизм. Интересно, что мутации, обнаруженные у пациентов, страдающих наследственными формами БА, и вызывающие накопление А в виде депозитов, также могут вызывать образование телец Леви и симптомы DLB (Yokota, О. etal., Acta Neuropathol. (Berl.) (2002), 104: 637-648). Кроме того, у некоторых пациентов, страдающих DLB,имеются депозиты А, схожие с депозитами А, характерными для БА (Deramecourt, V. et al., J. Neuropathol. Exp. Neurol (2006), 65: 278-288) Ha основе этих данных можно предположить, что А, по-видимому,является причиной патологии, обусловленной тельцами Леви, которая характерна для DLB, и поэтому соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие DLB. Приблизительно у 25% пациентов, страдающих ALS, имеет место значительная по своей выраженности деменция или афазия (Hamilton, R.L. et al., Acta Neuropathol. (Berl.) (2004), 107: 515-522). У большей части (60%) этих пациентов (называемых ALS-D-пациентами) обнаружены убиквитин-позитивные включения, содержащие в основном белок TDP-43 (Neumann, M. et al., Science (2006), 314: 130-133). Приблизительно 30% ALS-D-пациентов имеют амилоидные бляшки, похожие на А-бляшки, вызывающие деменцию (Hamilton, R.L. et al., Acta Neuropathol. (Berl.) (2004), 107: 515-522). Для выявления данных пациентов следует использовать визуализирующие агенты для определения амилоидных бляшек,потенциально для лечения данных пациентов можно было бы использовать соединения, которые снижают уровень А.IBM представляет собой редкое возрастное дегенеративное заболевание скелетных мышц. Появление депозитов А в мышцах пациентов, страдающих IBM, и рекапитуляция некоторых аспектов данного заболевания путем моделирования повышенной экспрессии АРР в мышцах трансгенных мышей подтверждают другие данные о роли А в развитии IBM (см. обзор Murphy, М.Р. et al., Neurology (2006), 66:S65-68). Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитиеIBM. Установлено, что при возрастной дегенерации желтого пятна А является одним из компонентов старческих бляшек, внеклеточных депозитов, расположенных под пигментным эпителием сетчатки(RPE) (Anderson, D.H. et al., Exp. Eye Res. (2004), 78: 243-256). Недавние исследования на мышах показали возможную связь А и дегенерации желтого пятна (Yoshida, Т. et al., J. Clin. Invest. (2005), 115: 27932800). Обнаружено, что у пациентов, страдающих БА, увеличено депонирование А и имеют место супрануклеарные катаракты (supranuclear cataracts) (Goldstein, L.E. et al., Lancet (2003), 361: 1258-1265). Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие возрастной дегенерации желтого пятна. Соединения, которые ингибируют гамма-секретазу, также могут быть использованы в лечении патологических состояний, ассоциированных с потерей миелинизации, например рассеянного склероза(Watkins, Т.A. et al., Neuron (2008), 60: 555-569). Недавние исследования, выполненные учеными Медицинского Центра при Джорджтаунском университете, дают возможность предположить, что ингибиторы гамма-секретазы могут предотвращать продолжительные нарушения, вызванные травматическим повреждением головного мозга (Loane, D.J. etal., Nature Medicine (2009): 1-3). Логично предположить, что блокирование активности указанных секретаз приводит к снижению уровня А. Дополнительный подход состоит в избирательном уменьшении продукции А 1-42 путем воздействия определенными соединениями, которые направляют расщепление АРР -секретазой в сторону формирования альтернативных более коротких форм А. Данные короткие формы, по-видимому,обладают меньшей способностью агрегировать, и растворы данных коротких форм А являются менее нейротоксичными, чем растворы А 1-42 (см. Barten, Donna M.; Meredith, Jere Е., Jr.; Zaczek, Robert; Houston, John G.; Albright, Charles F. Drugs in RD (2006), 7(2), 87-97). Соответственно, соединения, которые избирательно уменьшают продукцию А 1-42, и фармацевтические композиции, содержащие данные соединения, являются лечебными агентами, которые предотвращают повреждение, вызываемое сверхпродукцией А, и могут быть использованы в лечении болезни Альцгеймера, болезни Дауна, САА и миозита с включенными тельцами, DLB и других расстройств, связанных со сверхпродукцией А. Поэтому в данной области техники существует необходимость в новых соединениях, которые ингибируют продукцию -амилоидного пептида (А), а также в композициях, содержащих данные соединения, и способах лечения с применением данных соединений. Сущность изобретения Согласно первому аспекту настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли где R1 представляет собой нитрильную группу или представляет собой пяти- или шестичленное гетероароматическое кольцо, содержащее от одного до трех гетероатомов, независимо выбранных из атома азота, кислорода и серы, где указанное гетероароматическое кольцо необязательно имеет в качестве заместителей одну или две группы, выбранные из атома галогена, галоген-С 1-6 алкила, гидроксила, амино,С 1-6 алкокси и С 1-6 алкила; А выбран из О и СН 2 или представляет собой связь;D выбран из О, NR3, -СН(ОН)-, -CH(OR3)- и -CH(N[R3]2)- или представляет собой связь; Е выбран из-(СН 2)n-, -СН=СН- (цис), -СН=СН- (транс) и -(CH2)nCH(R3)-;F выбран из О и NR3 или представляет собой связь;S, Т и U независимо выбраны из атома углерода и атома азота, при условии, что не более чем один из S, Т и U представляет собой атом азота;R2 необязательно представляет собой одну, две или три группы, выбранные из атома галогена,С 1-4 алкокси, OCF3, С 1-4 алкила и CN;R3 независимо представляет собой С 1-4 алкил или атом водорода;n имеет значение 0-3. Согласно первому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где R1 представляет собой пятичленное гетероароматическое кольцо, содержащее два атома азота, которое имеет в качестве заместителя группу галогена. Согласно второму варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где R1 представляет собой пятичленное гетероароматическое кольцо, содержащее три атома азота, которое имеет в качестве заместителя алкильную группу. Согласно третьему варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где R1 представляет собой CN. Согласно четвертому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где А представляет собой атом кислорода. Согласно пятому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где B-D-E представляет собой-СН 2-СН=СН-(СН 2)n-, где указанный олефин имеет цис- или транс-конфигурацию. Согласно шестому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где B-D-E представляет собой-(СН 2)n-. Согласно седьмому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), включая его фармацевтически приемлемые соли, где F представляет собой NH,NMe или NEt. Согласно второму аспекту настоящего изобретения предложена фармацевтическая композиция для лечения расстройств, чувствительных к уменьшению продукции -амилоидного пептида, содержащая терапевтически эффективное количество соединения формулы (I), включая его фармацевтически приемлемые соли, в сочетании с фармацевтически приемлемым носителем или разбавителем. Согласно третьему аспекту настоящего изобретения предложен способ лечения расстройств, чувствительных к уменьшению продукции -амилоидного пептида, у млекопитающего, нуждающегося в таком лечении, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы (I), включая его фармацевтически приемлемые соли. Согласно первому варианту осуществления третьего аспекта изобретения указанное расстройство выбрано из болезни Альцгеймера (БА), болезни Дауна, легкого когнитивного нарушения (ЛКН), церебральной амилоидной ангиопатии (ЦАА), деменции с тельцами Леви (ДТЛ), бокового амиотрофического склероза (ALS-D), миозита с включенными тельцами (IBM), возрастной дегенерации желтого пятна и рака. Согласно второму варианту осуществления третьего аспекта изобретения указанное расстройство выбрано из болезни Альцгеймера и болезни Дауна. Согласно третьему варианту осуществления третьего аспекта изобретения указанное расстройство представляет собой болезнь Альцгеймера. Другие аспекты настоящего изобретения могут включать подходящие комбинации вариантов осуществления изобретения, раскрытых в данном описании. Другие аспекты и варианты осуществления изобретения можно найти в данном описании. Подробное описание изобретения Описание настоящего изобретения должно быть истолковано в соответствии с законами и принципами образования химических связей. В некоторых случаях для того, чтобы поместить заместитель в определенное положение, необходимо удалить атом водорода. Необходимо понимать, что соединения, включенные в объем настоящего изобретения, соответствуют требованиям, предъявляемым к стабильности соединений, которые используются в качестве фармацевтических агентов. Подразумевается, что определение любого заместителя или переменной в конкретном положении молекулы не зависит от определений данного заместителя или переменной, когда они расположены в других местах этой же молекулы. Все патенты, заявки на патенты и ссылка на литературу, упомянутые в описании изобретения,включены в данное описание посредством ссылки во всей своей полноте. В случае расхождения с указанными источниками настоящее описание, включая определения, будет иметь преимущественную силу. В некоторых случаях количество атомов углерода в конкретной группе указано перед названием группы. Например, термин "галоген-С 1-6 алкокси" означает галогеналкоксигруппу, содержащую от одного до шести атомов углерода, а термин "С 1-4 алкокси-С 1-2 алкил" означает алкоксигруппу, содержащую от одной до четырех алкоксигрупп, соединенных с основной молекулярной группировкой через алкильную группу, содержащую один или два атома углерода. Во всех случаях, когда использованы такие названия,они заменяют собой все другие определения, содержащиеся в данном описании. В контексте данного описания формы единственного числа существительных включают формы множественного числа, если из контекста ясно не следует иное. Если где-либо в тексте ясно не указано иное, описанные ниже термины имеют следующие значения. Термин "алкокси" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "алкоксиалкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей одну, две или три алкоксигруппы. Термин "алкоксикарбонил" в контексте данного описания относится к алкоксигруппе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкил" в контексте данного описания относится к группе, происходящей от насыщенного углеводорода с нормальной или разветвленной цепью, содержащего от одного до десяти атомов углерода. Термин "алкиламино" в контексте данного описания относится к -NHRx, где Rx представляет собой алкильную группу. Термин "алкиламиноалкокси" в контексте данного описания относится к алкиламиногруппе, соединенной с основной молекулярной группировкой через алкоксигруппу. Термин "алкилкарбонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкилсульфонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "алкилсульфониламидо" в контексте данного описания относится к -C(O)NHS(O)2Rx, где Rx представляет собой алкильную группу. Термин "амино" в контексте данного описания относится к -NH2. Термин "циано" в контексте данного описания относится к -CN. Термин "циклоалкил" в контексте данного описания относится к насыщенной моноциклической углеводородной кольцевой системе, содержащей от трех до четырнадцати атомов углерода и не содержащей гетероатомов. Термин "циклоалкиламино" в контексте данного описания относится к -NHRx, где Rx представляет собой циклоалкильную группу. Термин "диалкиламино" в контексте данного описания относится к -NRxRy, где каждый из Rx и Ry представляет собой алкильную группу. Термин "диалкиламиноалкокси" в контексте данного описания относится к диалкиламиногруппе,соединенной с основной молекулярной группировкой через алкоксигруппу. Термин "диметиламино" в контексте данного описания относится к -N(CH3)2. Термины "галоген" и "атом галогена" в контексте данного описания относятся к F, Cl, Br и I. Термин "галогеналкокси" в контексте данного описания относится к алкоксигруппе, имеющей в качестве заместителей один, два, три или четыре атома галогена. Термин "галогеналкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей один, два, три или четыре атома галогена. Термин "водород" или "Н" в контексте данного описания относится к атому водорода, включая его изотопы. Термин "гидрокси" в контексте данного описания относится к -ОН. Термин "метиламино" в контексте данного описания относится к -NHCH3. Термин "сульфонил" в контексте данного описания относится к -SO2-. Следует понимать, что изобретение включает все стереохимические формы, или их смеси, которые способны уменьшать продукцию -амилоидного пептида. Некоторые соединения согласно настоящему изобретению также могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия, обусловленная ограниченным вращением вокруг асимметричной простой связи, например, вследствие стерического препятствия или напряжения кольца, может быть использована для разделения разных конформеров. Настоящее изобретение включает каждый конформационный изомер указанных соединений и их смеси. Некоторые соединения согласно настоящему изобретению могут существовать в цвиттер-ионной форме, и настоящее изобретение включает каждую цвиттер-ионную форму данных соединений и смеси указанных форм. Фармацевтически приемлемые соли и пролекарства соединений, раскрытых в данном описании,включены в объем настоящего изобретения. Подразумевается, что термин "фармацевтически приемлемая соль" в контексте данного описания и формулы изобретения включает нетоксичные соли присоединения оснований. Подходящие соли включают соли, образованные органическими и неорганическими кислотами, такими как, без ограничения,соляная кислота, бромисто-водородная кислота, фосфорная кислота, серная кислота, метансульфоновая кислота, уксусная кислота, винная кислота, молочная кислота, сульфиновая кислота, лимонная кислота,малеиновая кислота, фумаровая кислота, сорбиновая кислота, аконитовая кислота, салициловая кислота,фталевая кислота и т.п. Подразумевается, что термин "фармацевтически приемлемая соль" в контексте данного описания также включает соли кислотных групп, такие как карбоксилат, с такими противоионами, как ион аммония, соли щелочных металлов, в особенности соли натрия или калия, соли щелочноземельных металлов, в особенности соли кальция или магния, и соли с подходящими органическими основаниями, такими как низшие алкиламины (метиламин, этиламин, циклогексиламин и тому подобное),или с замещенными низшими алкиламинами (например с гидроксил-замещенными алкиламинами, такими как диэтаноламин, триэтаноламин или трис(гидроксиметил)-аминометан), или с такими основаниями,как пиперидин или морфолин. Как указано выше, соединения согласно изобретению также включают "пролекарства". Термин"пролекарство" в контексте данного описания включает термин "сложные эфиры в качестве пролекарств" и термин "простые эфиры в качестве пролекарств". Термин "сложные эфиры в качестве пролекарств" в контексте данного описания включает сложные эфиры и карбонаты, полученные в результате взаимодействия одного или более чем одного гидроксила соединений формулы I либо с алкил-, алкокси- или арил-замещенными ацилирующими агентами, либо с фосфорилирующим агентом (в соответствии с методиками, известными специалистам в данной области техники), приводящего к образованию ацетатов,пивалатов, метилкарбонатов, бензоатов, сложных эфиров аминокислот, фосфатов, сложных полуэфиров кислот, таких как малонаты, сукцинаты или глутараты, и т.п. Согласно некоторым вариантам осуществления изобретения сложные эфиры аминокислот могут являться особенно предпочтительными. Примеры таких сложных эфиров, используемых в качестве пролекарств, включают Термин "простые эфиры в качестве пролекарств" включает как фосфатацетали, так и О-глюкозиды. Типичные примеры таких простых эфиров, используемых в качестве пролекарств, включают Как указано выше, в настоящем изобретении предложено соединение формулы (I), включая его фармацевтически приемлемые соли: где R1 представляет собой нитрильную группу или представляет собой пяти- или шестичленное гетероароматическое кольцо, содержащее от одного до трех гетероатомов, независимо выбранных из атома азота, кислорода и серы, где указанное гетероароматическое кольцо необязательно имеет в качестве заместителей одну или две группы, выбранные из атома галогена, галоген-С 1-6 алкила, гидроксила, амино,С 1-6 алкокси и C1-6 алкила; А выбран из О и СН 2 или представляет собой связь; В выбран из-(СН 2)n-, -СН=СН- (цис), -СН=СН- (транс) и -(CH2)nCH(R3)-;D выбран из О, NR3, -СН(ОН)-, -CH(OR3)- и -CH(N[R3]2)- или представляет собой связь; Е выбран из-(СН 2)n-, -СН=СН- (цис), -СН=СН- (транс) и -(CH2)nCH(R3)-;F выбран из О и NR3 или представляет собой связь;S, Т и U независимо выбраны из атома углерода и атома азота, при условии, что не более чем один из S, Т и U представляет собой атом азота;R2 необязательно представляет собой одну, две или три группы, выбранные из атома галогена,С 1-4 алкокси, OCF3, С 1-4 алкила, CN;R3 независимо представляет собой С 1-4 алкил или атом водорода;n имеет значение 0-3. В предпочтительном варианте осуществления изобретения R1 представляет собой пятичленное гетероароматическое кольцо, содержащее два атома азота, которое имеет в качестве заместителя группу галогена. Согласно другому варианту осуществления изобретения R1 представляет собой пятичленное гетероароматическое кольцо, содержащее три атома азота, которое имеет в качестве заместителя алкильную группу, более предпочтительно метильную группу. В другом предпочтительном варианте осуществления изобретения R1 представляет собой -CN. Согласно еще одному варианту осуществления изобретения в соединениях формулы (I) А представляет собой атом кислорода. Согласно другому варианту осуществления изобретения B-D-E представляет собой -СН 2-СН=СН(СН 2)n-, где указанный олефин имеет цис- или транс-конфигурацию. Согласно еще одному варианту осуществления изобретения B-D-E представляет собой-(СН 2)n-, где n имеет значение 3 или 4. В предпочтительном варианте осуществления изобретения B-D-E представляет собой -СН 2-СН(ОН)-СН 2-СН 2-,-СН 2-СН 2-СН(ОН)-СН 2-, -СН 2-СН 2-N(R3)-СН 2-СН 2- или -СН 2-СН 2-О-СН 2-СН 2-. Согласно другому варианту осуществления изобретения B-D-E-F представляет собой-(CH2)nCH(R3)-NR3- или-(CH2)n-NR3-(CH2)n-. В предпочтительном варианте осуществления изобретения F представляет собой NH, NMe или NEt,где "Me" означает метил и "Et" означает этил. Кроме того, в предпочтительном варианте осуществления изобретения G представляет собой -СН 2-,-СН 2-СН 2- или -N(R3)-СН 2-. Некоторые предпочтительные соединения согласно настоящему изобретению включают следующие соединения: Кроме того, предпочтительные соединения также включают следующие соединения: или их фармацевтически приемлемые соли. Если в терапевтических целях терапевтически эффективное количество соединения формулы (I),включая его фармацевтически приемлемые соли, может быть введено в виде необработанного химического соединения, активный ингредиент может быть представлен в виде фармацевтической композиции. Соответственно, в изобретении дополнительно предложены фармацевтические композиции, которые включают терапевтически эффективное количество соединений формулы (I), включая их фармацевтически приемлемые соли, и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. Соединения формулы (I), включая их фармацевтически приемлемые соли, являются такими, как описано выше. Носитель(и), разбавитель(и) или эксципиент(ы) должен (должны) быть приемлемым(и) в смысле его (их) совместимости с другими ингредиентами препарата и не наносить вред реципиенту. В соответствии с другим аспектом изобретения также предложен способ получения фармацевтического препарата, включающий смешивание соединения формулы (I), включая его фармацевтически приемлемые соли, с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом. Доза соединений формулы I, необходимая для достижения терапевтического эффекта, зависит не только от таких факторов, как возраст, масса тела и пол пациента, способа введения, но также от желаемой степени уменьшения продукции -АР и эффективности конкретного используемого соединения в отношении конкретного нарушения, вызываемого данным заболеванием. Следует также принимать во внимание, что лечебная доза конкретного соединения может быть введена в виде стандартной лекарственной формы и что данная стандартная лекарственная форма, подобранная специалистом, отражает относительный уровень активности соединения. Решение о назначении конкретной дозы и частоты введения (сколько раз в сутки следует проводить введение) принимается по усмотрению врача. С целью получения желаемого терапевтического эффекта дозы могут быть подобраны в соответствии с конкретными обстоятельствами, указанными в настоящем изобретении. Для млекопитающего, включая человека, имеющего или возможно имеющего любое заболевание,связанное с продукцией -А, подходящая суточная доза соединения формулы I или фармацевтической композиции, содержащей указанное соединение, находится в диапазоне от приблизительно 0,05 до приблизительно 10 мг/кг, предпочтительно от приблизительно 0,1 до 2 мг/кг, при парентеральном введении. При пероральном введении данная доза может находиться в диапазоне от приблизительно 0,1 до приблизительно 75 мг/кг, предпочтительно от 0,1 до 10 мг/кг массы тела. Предпочтительно, когда активный ингредиент вводят равными дозами от одного до четырех раз в сутки. Однако обычно сначала вводят маленькую дозу, и затем дозу постепенно увеличивают до тех пор, пока не будет определена доза, оптимальная для конкретного реципиента, находящегося на лечении. В соответствии с правилами клинической практики указанное соединение предпочтительно вводить до получения в организме концентрационного уровня, который обеспечивает эффективное противоамилоидное действие и не вызывает никаких вредных или нежелательных побочных эффектов. Однако следует понимать, что количество соединения,которое вводят в действительности, определяет врач с учетом всех существенных обстоятельств, включающих патологическое состояние, которое лечат, выбранное соединение, которое планируют вводить,выбранный путь введения, возраст, массу тела, реакцию конкретного пациента и тяжесть симптомов пациента. Фармацевтические препараты могут быть адаптированы для введения любым подходящим путем,например пероральным (включая трансбуккальный или сублингвальный), ректальным, назальным, местным (включая трансбуккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожные, внутрикожные, внутримышечные, внутрисуставные, интрасиновиальные, интрастернальные, интратекальные, внутривенные или интрадермальные инъекции или инфузии, а также инъекции или инфузии внутрь пораженных тканей) путем. Такие препараты могут быть получены с помощью методик, известных в области фармации, например путем объединения активного ингредиента с носителем (носителями) или эксципиентом (эксципиентами). Фармацевтические препараты, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, например капсул или таблеток, порошков или гранул, растворов или суспензий в водных или неводных жидкостях, пен или кремов для приема внутрь или жидких эмульсий типа масло в воде или эмульсий типа вода в масле. Например, в препарате, адаптированном для перорального введения, в форме таблетки или капсулы активный лекарственный компонент может быть комбинирован с подходящим для перорального введения нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Порошки изготавливают путем измельчения соединения до получения вещества подходящего тонкого помола и смешивания с измельченным подобным образом фармацевтическим носителем, таким как пригодный для приема внутрь углевод, например крахмал или маннит. Препарат также может содержать ароматизаторы, консерванты, диспергирующие и окрашивающие агенты. Капсулы изготавливают из описанной выше порошковой смеси, которой заполняют желатиновую оболочку. Перед заполнением капсульной оболочки в порошковую смесь могут быть добавлены скользящие и смазывающие вещества, такие как коллоидный кремнезем, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль. Когда капсулы предназначены для приема внутрь, для улучшения доступности лекарства также могут быть добавлены разрыхлители или солюбилизирующие агенты, такие как агар-агар, карбонат кальция или карбонат натрия. Кроме того, если это желательно или необходимо, в смесь также могут быть включены подходящие связующие вещества, смазывающие вещества, разрыхлители и окрашивающие агенты. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза,кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль и т.п. Смазывающие вещества, используемые в данных лекарственных формах, включают олеат натрия, хлорид натрия и т.п. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бетонит, ксантановую камедь и т.п. Таблетки изготавливают в виде препарата, например, путем получения порошковой смеси, гранулирования или комкования, добавления смазывающего вещества и разрыхлителя и прессования в форме таблетки. Порошковую смесь получают путем смешивания соединения, измельченного подходящим образом, с описанным выше разбавителем или основой и, необязательно, со связующим веществом, таким как карбоксиметилцеллюлоза, алигинат, желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем ресорбции, таким как четвертичная соль, и/или поглощающим агентом, таким как бетонит, каолин или гидрофосфат кальция. Порошковая смесь может быть гранулирована путем увлажнения связующим веществом, таким как сироп, крахмальная паста, раствор гуммиарабика или растворы целлюлозных или полимерных веществ, и последующего продавливания через сито. Как альтернатива гранулированию, порошковая смесь может быть пропущена через таблеточную машину, которая формирует разнородные заготовки, измельченные до гранул. Для предотвращения прилипания гранул к формообразующему штампу таблеточной машины гранулы могут быть покрыты смазывающим веществом путем добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. После добавления смазывающего вещества из смеси прессуют таблетки. Соединения согласно настоящему изобретению также могут быть комбинированы с подвижным инертным носителем, затем из полученной смеси сразу прессуют таблетки, минуя стадии гранулирования или комкования. На таблетки могут быть нанесены прозрачные или матовые защитные покрытия, состоящие из изолирующего покрытия шеллаком, покрытия сахаром или полимерным веществом и полирующего покрытие воском. Чтобы от- 14021527 личать разные стандартные дозы, в эти покрытия могут быть добавлены красящие вещества. Жидкие препараты, подходящие для перорального введения, такие как растворы, сиропы и эликсиры, могут быть изготовлены в стандартной лекарственной форме, чтобы принимаемое количество жидкости содержало заданное количество соединения. Сиропы могут быть получены путем растворения соединения в подходящих ароматизированных водных растворах, а эликсиры получают с использованием нетоксичного носителя. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, вкусовые добавки, такие как мятное масло или натуральные подсластители, или сахарин или другие искусственные подсластители, и т.п. При необходимости препараты в стандартных лекарственных формах, предназначенные для перорального введения, могут быть получены путем микрокапсулирования. Данные препараты также могут быть изготовлены в форме препаратов пролонгированного или замедленного высвобождения, например,путем покрытия или внедрения частиц вещества в полимеры, воск и тому подобное. Соединения формулы (I), включая их фармацевтически приемлемые соли, также могут быть введены в форме липосомальных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и многослойные везикулы. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолин. Соединения формулы (I), включая их фармацевтически приемлемые соли, также могут быть доставлены с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть присоединены к растворимым полимерам в качестве носителей для направленной доставки лекарства. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, содержащий в качестве заместителей пальмитоильные остатки. Кроме того, соединения могут быть присоединены к биодеградируемым полимерам, которые можно использовать для достижения контролируемого высвобождения лекарства, например к полимолочной кислоте, поли-эпсилон-капролактону, полигидроксимасляной кислоте, полиортоэфирам, полиацеталям,полидигидропиранам, полицианоакрилатам и поперечно сшитым или амфипатичным блок-сополимерам гидрогелей. Фармацевтические препараты, адаптированные для трансдермального введения, могут быть изготовлены в форме отдельных пластин пластыря, которые остаются в непосредственном контакте с эпидермисом реципиента в течение продолжительного периода времени. В этом случае активный ингредиент может быть доставлен из пластыря, например, путем ионтофореза, общее описание которого можно найти в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические препараты, адаптированные для местного введения, могут быть изготовлены в форме мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других внешних тканей, например тканей ротовой полости и кожи, предпочтительно использовать препараты в форме мази или крема для местного введения. При изготовлении препарата в форме мази активный ингредиент может быть смешан либо с парафиновой мазевой основой,либо мазевой основой, смешивающейся с водой. Альтернативно, активный ингредиент может быть представлен в виде препарата в форме крема, где в качестве кремовой основы используется эмульсия масло в воде или вода в масле. Фармацевтические препараты, адаптированные для местного введения в глаза, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, главным образом в водном растворителе. Фармацевтические препараты, адаптированные для местного введения в ротовую полость, включают лепешки, пастилки и жидкости для промывания рта. Фармацевтические препараты, адаптированные для ректального введения, могут быть изготовлены в форме суппозиториев или клизм. Фармацевтические препараты, адаптированные для назального введения, где в качестве носителя используется твердое вещество, включают крупный порошок, который можно втягивать носом, как нюхательный табак, то есть путем быстрой ингаляция через носовой ход из контейнера с порошком, который держат близко к носу. Подходящие препараты в форме назального спрея или назальных капель, где в качестве носителя используется жидкость, включают водные или масленые растворы активного ингредиента. Фармацевтические препараты, адаптированные для введения путем ингаляции, включают мелкие частицы пыли или тумана, которые могут быть сформированы с помощью различных типов аэрозольных дозирующих устройств, небулайзеров или инсуффляторов. Фармацевтические препараты, адаптированные для вагинального введения, могут быть изготовлены в форме пессариев, тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические препараты, адаптированные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферные аген- 15021527 ты, бактериостатические вещества и растворенные вещества, которые делают препарат изотоничным крови реципиента, для которого он предназначен, а также водные и неводные стерильные суспензии,которые могут содержать суспендирующие агенты и загустители. Данные препараты могут находиться в упаковках для одноразового приема или в упаковках для многократного приема, например в запаянных ампулах и пробирках, и могут храниться в лиофилизированном состоянии (после сублимационной сушки); в лиофилизированные препараты непосредственно перед использованием требуется только добавить стерильный жидкий носитель, например воду для инъекций. Экстемпоральные инъекционные растворы и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток. Следует понимать, что кроме конкретных ингредиентов, описанных выше, препараты могут содержать другие агенты, используемые в данной области техники, имеющие отношение к данному типу препарата, например, препараты, подходящие для перорального введения, могут содержать корригенты. Далее настоящее изобретения будет описано со ссылкой на некоторые варианты осуществления изобретения, не ограничивающие его объем. Напротив, настоящее изобретение включает все альтернативы, модификации и эквиваленты, как если бы они были включены в объем прилагаемой формулы изобретения. Соответственно, каждый из приведенных примеров, которые включают конкретные варианты осуществления изобретения, иллюстрирует только одно практическое использование изобретения, при этом следует понимать, что данные примеры иллюстрируют только некоторые варианты осуществления изобретения и приведены для того, чтобы показать, что именно является наиболее полезным, и облегчить понимание описанных методик и концептуальных аспектов изобретения. Соединения согласно настоящему изобретению могут быть синтезированы с использованием методик, описанных ниже, в сочетании с методиками синтеза, известными в химии органического синтеза,или вариаций указанных методик, понятных специалистам в данной области техники. Предпочтительные методики включают методики, описанные ниже, но не ограничены ими. Все ссылки, упомянутые в описании изобретения, включены в данное описание посредством ссылки во всей своей полноте. Соединения согласно настоящему изобретению могут быть получены с использованием реакций и методик, описанных в данном разделе. Указанные реакции проводят в растворителях, подходящих для используемых реагентов и веществ, а также подходящих для осуществления желаемых превращений. Также необходимо понимать, что в описаниях методик синтеза, приведенных ниже, все выбранные условия реакций, включая выбор растворителя, реакционной атмосферы, температуры реакционной смеси,продолжительности реакции, и методики очистки соответствуют стандартным условиям проведения данной реакции, которые может легко определить специалист в данной области техники. Специалисту в области органического синтеза понятно, что функциональные группы, находящиеся в различных положениях молекулы, должны быть совместимы с предполагаемыми реагентами и реакциями. Ограничения,которые накладываются на заместители, которые совместимы с условиями реакции, совершенно очевидны специалисту в данной области техники, при наличии таких ограничений должны быть использованы альтернативные методики. Исходные вещества, которые могут быть использованы для синтеза соединений согласно настоящему изобретению, известны специалистам в данной области техники. Данные вещества либо имеются в продаже, либо могут быть легко синтезированы. Описанные ниже методики являются исключительно иллюстративными и не ограничивают объем формулы изобретения каким-либо образом. Следует понимать, что в некоторых случаях необходимо получить соединение, в котором функциональная группа защищена с использованием стандартной защитной группы. Такие защитные группы затем удаляют с получением соединения согласно настоящему изобретению. Детали, касающиеся использования защитных групп применительно к настоящему изобретению, известны специалистам в данной области техники. Аббревиатуры, использованные в настоящем изобретении, включая, в частности, аббревиатуры, использованные в иллюстративных схемах и примерах, приведенных ниже, хорошо известны специалистам в данной области техники. Некоторые из использованных аббревиатур перечислены ниже. Химические аббревиатуры, использованные в описании изобретения и Примерах, определены следующим образом: "dba" означает дибензилиденацетон; "трет-Bu" означает трет-бутил; "ДХМ" означает дихлорметан; "LDA" означает диизопропиламид лития; "Ph" означает фенил; "ТФУ" означает трифторуксусную кислоту; "Et" означает этил; "ДМФА" означает N,N-диметилформамид; "ОАс" означает ацетат; "ч" означает часы, "мин" означает минуты и "ТГФ" означает тетрагидрофуран. Общие схемы Примеры методик, которые могут быть использованы для получения соединений согласно настоящему изобретению, приведены на схемах 1-15. На схемах 1-3 приведены различные пути синтеза замещенных анилиновых фрагментов, использованных при получении указанных соединений. Как показано на схеме 1, различные алкенолы с концевой двойной связью могут быть присоединены к хлор- или фторнитрофенолам 1 с получением хлор- или фтор-алкеноксинитробензолов 2. Различные гетероциклы 3,включая, без ограничения, 1 Н-имидазол, 4-метил-1H-имидазол, 4-хлор-1H-имидазол и 4-(дифторметил)1H-имидазол, могут быть присоединены к указанному промежуточному соединению 2 в присутствии основания с получением гетероарил-замещенных нитроаренов 4. Восстановление соединений 4 с исполь- 16021527 зованием реагентов, которые не затрагивают олефиновую ненасыщенную связь, включая железо в кислой среде или SnCl2, или с использованием других условий, известных специалисту в данной области техники, приводит к получению замещенных анилинов 5. Несмотря на то что схема 1 иллюстрирует получение 4-(1 Н-имидазол-1-ил)анилинов 4, специалисту в данной области техники понятно, что данная методика может быть широко использована для синтеза других 4-гетероариланилинов, включая, без ограничения, разнозамещенные 4-(1H-1,2,4-триазол-1-ил)анилины и 4-(1 Н-1,2,3-триазол-1-ил)анилины. Кроме того, вместо нитрофенолов формулы 1 могут быть использованы замещенные нитропиридинолы,что в итоге приводит к получению амино-замещенных пиридинов. Схема 1 Как показано на схеме 2, различные гетероциклы 3, включая, без ограничения, 1 Н-имидазол, 4 метил-1H-имидазол, 4-хлор-1H-имидазол, 4-(дифторметил)-1H-имидазол, могут быть присоединены к дифтор- или хлор-фтор-нитроаренам 6 с получением фтор-гетероарил нитробензолов 7. В результате взаимодействия алкенолов с концевой двойной связью с промежуточными соединениями 7 в присутствии основания получают гетероарил-замещенные нитроарены 4. Восстановление соединений 4 с использованием реагентов, которые не затрагивают олефиновую ненасыщенную связь, включая железо в кислой среде или SnCl2, или с использованием других условий, известных специалисту в данной области техники, приводит к получению замещенных анилинов 5. Несмотря на то что схема 1 иллюстрирует получение 4-(1 Н-имидазол-1-ил)анилинов 4, специалисту в данной области техники понятно, что данная методика может быть широко использована для синтеза других 4-гетероариланилинов, включая, без ограничения, разнозамещенные 4-(1H-1,2,4-триазол-1-ил)анилины и 4-(1H-1,2,3-триазол-1-ил)анилины. Схема 2 Дополнительная методика получения аналогов соединений согласно п.1 формулы изобретения приведена на схеме 3. Известный 2-фтор-5-нитротолуол 8 может быть бромирован действием NBS в условиях фотохимической реакции с получением соединений 9. Полученный бромид может быть подвергнут замещению с использованием различных спиртов в соответствии с методикой, описанной в WO 200815569. Расширительное применение данной методики, предполагающее использование в качестве спиртов подходящих алкенолов с концевой двойной связью, описанных выше, позволяет получить фторнитроарены 10. Последующая замена фтор-заместителя гетероциклом в присутствии основания приводит к получению соединений 11. В результате восстановления нитрогруппы с использованием описанных выше условий, не затрагивающих олефин, получают анилины 12. На следующих схемах приведены различные пути синтеза 2,4-дихлор-7-арил-6,7-дигидро-5Hциклопента[d]пиримидинов, использованных при получении соединений согласно настоящему изобретению. Как показано на схеме 4, циклопентанон 13 может быть подвергнут взаимодействию с различными галогенидами арилмагния с получением третичных спиртов 14. В присутствии дегидратирующих агентов, таких как неорганические кислоты или тионилхлорид, данные третичные спирты могут быть подвергнуты элиминированию воды с получением олефинов 15. При обработке агентами, окисляющими до перекисного соединения, такими как пермуравьиная кислота, олефины 15 могут быть превращены в 2 арилциклопентаноны 16. Abu Thaher, В.; Koch, P.; Del Amo, V.; Knochel, P.; Laufer, S. Synthesis 2008, 2,225-228. Схема 4 Альтернативно, (см. схему 5), 2-арилциклопентаноны 16 могут быть получены путем обработки циклопентеноксида 17 различными галогенидами арилмагния в присутствии солей меди, таких как иодид меди, и последующего окисления полученных спиртов 18. Указанное окисление может быть выполнено с использованием ряда окисляющих агентов, известных специалистам в данной области техники, при этом лучшие результаты получаются при использовании периодинана Десса-Мартина. Dess, D.В.; Martin,J.C. J. Org. Chem. 1983, 48, 4155-4156. Схема 5 Дополнительные кетоны, которые могут использоваться для получения соединений согласно п.1 формулы изобретения, могут быть получены с использованием методики, описанной в О. Dirat et al., Tetrahedron Letters, 2006, 47, 1295. Данная методика (приведена на схеме 6) основана на альфаарилировании (Fox et al., Journal of the American Chemical Society, 2000, 122, 1360) подходящих кетонов 19. Как показано на схеме 7, 2-арилциклопентаноны 23 могут быть депротонированы сильным основанием, таким как LDA, и обработаны алкилцианоформиатом с получением кетоэфиров 21, которые подвергают взаимодействию с 2-метил-2-тиопсевдомочевиной с получением 2-амино-7-арил-6,7 дигидроциклопента[е][1,3]оксазин-4(5H)-онов 22. Соединения 22 подвергают гидролизу в присутствии кислотного катализатора с получением 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионов 23. Larsen, J. S.; Christensen, L.; Ludvig, G.; Jrgensen, P.Т.; Pedersen, E.В.; Nielsen, С.J. Chem. Soc., Perkin Альтернативно, 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионы 23 получают в результате взаимодействия 2-арилциклопентанонов 16 с N-(хлоркарбонил)изоцианатом (схема 8). Последующая обработка 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионов 23 раствором аммиака в воде и хлорирование оксихлоридом фосфора приводят к получению 2,4-дихлор-7-арил-6,7 дигидро-5H-циклопента[d]пиримидинов 25. Схема 8 По аналогии с синтезом, представленным на схеме 8, дополнительные кетоны могут быть подвергнуты взаимодействию с N-(хлоркарбонил)изоцианатом с получением дополнительных оксазиндионов 26,которые могут быть подвергнуты взаимодействию с аммиаком с получением пиримидиндионов 27 (схема 9). Последующее хлорирование приводит к получению промежуточных дихлоридов 28. Схема 9 2,4-Дихлор-7-арил-6,7-дигидро-5H-циклопента[d]пиримидины 25 также могут быть синтезированы в соответствии с методикой, описанной на схеме 10. 4-Хлор-2,6-диметоксипиримидин 29 может быть депротонирован сильным основанием, таким как н-бутиллитий или 2,2,6,6-тетраметилпиперидин, депротонирование останавливают путем добавления аллилбромида с получением 5-аллил-4-хлор-2,6-диметоксипиримидина 30. Nencka, R.; Votruba, I.; Hrebabecky, H.; Jansa, P.; Tloustova, E.; Horska, K.; Masojidkova, M.; Holy, A. J. Med. Chem. 2007, 50, 6016-6023. Данное соединение может быть подвергнуто взаимодействию с -стирилбороновыми кислотами в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий, с получением со- 19021527 единений формулы 31, которые могут быть подвергнуты метатезису олефинов с замыканием цикла в присутствии катализатора Граббса с получением 2,4-диметокси-7-арил-5H-циклопента[d]пиримидинов 32. Grubbs, R. H. Handbook of Metathesis, 2003, First Edition, Wiley-VCH. Двойная связь в соединениях 32 может быть восстановлена с получением 2,4-диметокси-7-арил-6,7-дигидро-5Hциклопента[d]пиримидинов 33, данные соединения подвергают гидролизу в присутствии кислотного катализатора и последующему хлорированию оксихлоридом фосфора с получением промежуточных соединений 25. Схема 10 2,4-Дихлор-7-арил-6,7-дигидро-5H-циклопента[d]пиримидины 25 подвергают избирательному взаимодействию с первичными и вторичными аминами, содержащими концевую олефиновую ненасыщенную связь, с получением 4-амино-производных 34, которые при нагревании могут быть подвергнуты взаимодействию с анилинами 5 с получением субстратов 35 для последующего метатезиса с замыканием цикла (схема 11). Указанное взаимодействие может быть выполнено либо в присутствии кислоты (например с использованием уксусной кислоты), либо в присутствии основания (например с использованием гидрида натрия). Альтернативно, данное взаимодействие может быть осуществлено путем катализа на металле в условиях, описанных в литературе, например с использованием в качестве катализаторовPd(dba)2 и ксантфоса (9,9-диметил-4,5-бис-(дифенилфосфино)ксантена), в присутствии сильного основания (NaOt-Bu) или Na2CO3 в смеси воды и сорастворителя (обычно в смеси ТГФ/вода или диоксан/вода). Схема 11 Как показано на схеме 12, бис-олефины 35 могут быть подвергнуты превращению в разбавленном состоянии путем метатезиса с замыканием цикла (Grubbs, R.H. Handbook of Metathesis, 2003, First Edition,Wiley-VCH) с получением цис- и транс-олефинов 36. Данные соединения могут быть подвергнуты дополнительному превращению с целью восстановления олефина с использованием Pd/C и Н 2 или аналогичных условий с получением макроциклов 37. Подходящие замещенные анилины могут иметь структуру ключевых соединений, таких как 39-цис,39-транс и 40, и могут быть получены с использованием аналогичных реагентов. Принципиальная методика получения данных анилинов приведена на схеме 13. Дополнительные вариации этой общей схемы очевидны специалисту в данной области техники. Схема 13 На схеме 14 приведена дополнительная методика получения аналогов соединений согласно п.1 формулы изобретения. Известный 3,4-дифтор-нитробензол 41 подвергают замещению с использованием подходящего гетероцикла 3. Другую группу фтора замещают в присутствии основания с использованием соответствующим образом функционализированного и необязательно защищенного аминоспирта 43. Удаление любой присутствующей защитной группы с использованием условий, известных специалистам в данной области техники (Green, T.W., Wuts, P.G.M. Protective Groups in Organic Synthesis, 1999, ThirdEdition, John WileySons), и последующее замещение подходящего пиримидин дихлорида 45 в 4-й позиции приводит к получению соединений, соответствующих структурной формуле 46. В результате восстановления нитрогруппы с использованием условий, не затрагивающих группу хлора, получают анилин, последующее замещение 2-хлор-заместителя с использованием условий, описанных на схеме 11,приводит к получению макроциклов 47. Схема 14 Рацемические соединения согласно настоящему изобретению могут быть разделены с использованием методик хирального разделения, известных среднему специалисту в данной области техники, с получением индивидуальных энантиомеров (схема 15). Это продемонстрировано ниже на примере серии циклопента[d]пиримидинов, но одинаково применимо к другим рацемическим соединениям, описанным в данном патенте. Дополнительные представители класса соединений, описанного в п.1 формулы изобретения, могут быть получены в соответствии со схемой 16. Карбоксилирование бензонитрилов и последующее простое восстановление с использованием катализа на металле (палладий на углероде или аналогичные методики) приводят к получению замещенного сложного бета-аминоэфира 53. Конденсация с эфиром акриловой кислоты приводит к получению промежуточного соединения 54, которое может быть сразу алкилировано по атому азота, чтобы обеспечить присутствие заместителей R3. Затем промежуточное соединение 55 подвергают циклизации в присутствии основания (обычно KOt-Bu) с получением сложного бетакетоэфира 56. Конденсация сложного бета-кетоэфира 56 с мочевиной в присутствии основания приводит к получению пиримидиндионового промежуточного соединения 57, которое затем может быть хлорировано в стандартных условиях с получением дихлорида 58. Данный дихлорид может быть превращен в соединения, описанные в п.1 формулы изобретения, с использованием стандартных методик (см. ниже). Схема 16 Дополнительные представители класса соединений, описанного в п.1 формулы изобретения, могут быть получены в соответствии со схемой 17. Этерификация аминокислоты и последующее алкилирование с использованием 4-бромбутановой кислоты этилового эфира приводят к получению промежуточного соединения 61, которое может быть сразу алкилировано по атому азота, чтобы обеспечить присутствие заместителей R3. Затем промежуточное соединение 62 подвергают циклизации в присутствии основания (обычно KOt-Bu) с получением сложного бета-кетоэфира 63. Конденсация сложного бетакетоэфира 63 с мочевиной в присутствии основания приводит к получению пиримидиндионового промежуточного соединения 64, которое затем может быть хлорировано в стандартных условиях с получением дихлорида 65. Данный дихлорид может быть превращен в соединения, описанные в п.1 формулы изобретения, с использованием стандартных методик (см. ниже). Дополнительные представители класса соединений, описанного в п.1 формулы изобретения, могут быть получены в соответствии со схемой 18. Когда F представляет собой связь, С(4) пиримидина прямо соединен с атомом углерода. Данная структура может быть получена в результате кросс-сочетания с использованием реактива Гриньяра в присутствии катализатора, обычно Fe(acac)2. 2,4-Дихлор-7-арил-6,7 дигидро-5H-циклопента[d]пиримидины 25 подвергают избирательному взаимодействию с металлоорганическими соединениями с получением замещенных пиримидинов 66, которые при нагревании могут быть подвергнуты взаимодействию с анилинами 5 с получением субстратов 67 для последующего метатезиса с замыканием цикла. Указанное взаимодействие может быть выполнено либо в присутствии кислоты (например с использованием уксусной кислоты), либо в присутствии основания (например с использованием гидрид натрия). Альтернативно, данное взаимодействие может быть осуществлено путем катализа на металле в условиях, описанных в литературе, например с использованием в качестве катализаторов Pd(dba)2 и ксантфоса, в присутствии сильного основания (NaOt-Bu) или Na2CO3 в смеси воды и сорастворителя (обычно в смеси ТГФ/вода или диоксан/вода). Бис-олефины 67 могут быть подвергнуты превращению в разбавленном состоянии путем метатезиса с замыканием цикла (Grubbs, R.H. Handbookof Metathesis, 2003, First Edition, Wiley-VCH.) с получением цис- и транс-олефинов 68. Данные соединения могут быть подвергнуты дополнительному превращению с целью восстановления олефина с использованием Pd/C и Н 2 или аналогичных условий с получением макроциклов 69. Вместо дихлорида 25 могут быть использованы альтернативные пиримидин дихлориды, что должно быть ясно специалисту в данной области техники. Схема 18"ЖХВД" представляет собой использованную в данном описании аббревиатуру жидкостной хрома- 23021527 тографии высокого давления. "ЖХ-МС" относится к жидкостной хроматографии высокого давления,которую выполняют в соответствии с определением ЖХВД и с использованием массспектрометрического детектора. Растворители для ЖХВД: когда указано, что хроматографию выполняли с использованием "стандартных условий", это означает, что образец растворяли в метаноле (1 мг/мл) и элюировали с использованием градиента, задаваемого программой, со скоростью потока растворителя 1,0 мл/мин. Препаративная обратнофазовая ЖХВД: когда указано, что хроматографию выполняли с использованием "стандартных условий", это означает, что образец (приблизительно 20 мг) растворяли в метаноле (10 мг/мл) и очищали на колонке Waters-Atlantis S5 30 мм 100 мм с использованием для элюирования градиента концентрации (0-100%) буфера В в буфере А (буфер А = 10% СН 3 ОН/90% вода/0,1% ТФУ и буфер В = 90% МеОН/10% вода/0,1% ТФУ) в течение 10 мин при 40 мл/мин. Спектры протонного ЯМР получали на спектрометре Bruker 400 или 500. Данные относятся к фиксированному растворителю. Подразумевается, что приведенные примеры помогают дополнительно понять настоящее изобретение. Подразумевается, что конкретные использованные вещества, а также продукты и условия дополнительно иллюстрируют конкретные варианты осуществления изобретения и не ограничивают обоснованный объем изобретения. Синтез соединений Препарат А. 4-(4-Хлор-1H-имидазол-1-ил)-3-аллилоксианилин(500 мл) при -78 С в потоке газообразного азота добавляли по каплям раствор BBr3 (747 ммоль) в дихлорметане. Данную реакционную смесь перемешивали в течение ночи при -20 С и затем в течение 1 ч при 4 С. К реакционной смеси добавляли по каплям 10 мл МеОН и 100 мл воды. Полученную смесь подщелачивали путем добавления 10% раствора NaOH. Затем водный слой подкисляли и экстрагировали хлороформом. Объединенные органические слои сушили с использованием Na2SO4, фильтровали и концентрировали под вакуумом с получением желаемого 2-хлор-5-нитрофенола в виде желтого твердого вещества (12,5 г, 68%). Промежуточное соединение А(2). 2-(Аллилокси)-1-хлор-4-нитробензол К перемешиваемому раствору 2-хлор-5-нитрофенола (13,0 г, 75,1 ммоль) в ДМФА (150 мл) добавляли K2CO3 (15,5 г, 113 ммоль). Данную смесь охлаждали до 0 С и добавляли по каплям бромистый аллил (9,60 мл, 113 ммоль). Затем реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре в атмосфере азота. Реакционную смесь концентрировали с целью удаления ДМФА,затем к остатку добавляли EtOAc. Данную смесь промывали водой и солевым раствором. Органический слой сушили (Na2SO4) и концентрировали под вакуумом с получением желаемого 2-(аллилокси)-1-хлор 4-нитробензола в виде ярко-желтого твердого вещества (11,5 г, выход: 72%). ЖХ-МС: (М+Н)+ = 212,2. 1 Н ЯМР (400 МГц, CDCl3)м.д.: 7.81-7.77 (2 Н, m), 7.52 (1H, d, J=8.8 Гц), 6.12-6.02 (1H, m), 5.545.37 (2 Н, m), 4.72-4.70 (2 Н, m). Промежуточное соединение А(3). 1-(2-(Аллилокси)-4-нитрофенил)-4-хлор-1H-имидазол ммоль) и хлопьев гидроксида калия (1,90 г, 33,9 ммоль) в безводном ДМСО (50 мл) нагревали в течение 20 ч при 90 С в атмосфере азота. Затем реакционную смесь оставляли охлаждаться до комнатной температуры, и добавляли охлажденную до 0 С воду. Образовавшийся осадок собирали путем вакуумной фильтрации. Данный продукт сушили и очищали путем колоночной хроматографии (5% EtOAc/гексан) с получением желаемого 1-(2-(аллилокси)-4-нитрофенил)-4-хлор-1H-имидазола в виде желтого твердого вещества (3,48 г, выход: 40%). ЖХ-МС: (М+Н)+ = 280,2. 1 Н ЯМР (400 МГц, CDCl3)м.д.: 7.97-7.93 (2 Н, m), 7.77 (1H, s), 7.44 (1H, d, J=8.8 Гц), 6.05-5.98 (1 Н,m), 5.45-5.37 (2 Н, m), 4.70-4.65 (2 Н, m). Препарат А. 4-(4-Хлор-1H-имидазол-1-ил)-3-аллилоксианилин(500 мг, 1,8 ммоль), абсолютного метанола (10 мл) и хлорида аммония (768 мг, 14 ммоль), добавляли железный порошок - 325 меш (737 мг, 12,5 ммоль). К колбе присоединяли обратный холодильник, охлаждаемый водой, и данную гетерогенную смесь нагревали до 65 С при интенсивном перемешивании в течение 30 мин. Затем реакционную смесь фильтровали и промывали метанолом. Растворитель удаляли под вакуумом. К остатку добавляли EtOAc и промывали водой и солевым раствором. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением 4-(4-хлор-1H-имидазол-1-ил)-3 аллилоксианилина (380 мг, выход: 83%). ЖХ-МС: (М+Н)+ = 250,0. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.48 (d, J=1.22 Гц, 1 Н), 6.97-7.02 (m, 2 Н), 6.26-6.32 (m, 2 Н), 5.875.98 (m, 1 Н), 5.20-5.34 (m, 2 Н), 4.48 (d, J=5.19 Гц, 2 Н), 3.86 (br s, 2H). Препараты В и С. В: 3-(аллилокси)-4-(3-метил-1 Н-1,2,4-триазол-1-ил)анилин С: 3-(аллилокси)-4-(5-метил-1 Н-1,2,4-триазол-1-ил)анилин Смесь 3-метил-1H-1,2,4-триазола (15,0 г, 181 ммоль), 1,2-дифтор-4-нитробензола (28,7 г, 181 ммоль) и бикарбоната натрия (15,2 г, 181 ммоль) в ДМСО (100 мл) нагревали в течение 48 ч при 80 С. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в воду (800 мл). Полученную водную смесь экстрагировали EtOAc (этилацетатом) (3200 мл). Объединенные органические экстракты промывали последовательно водой (500 мл) и солевым раствором (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенную реакционную смесь очищали путем хроматографии на силикагеле (30-80% EtOAc/гексан, линейный градиент) с получением двух региоизомерных продуктов. Фракции, содержащие чистый менее полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-3-метил-1H-1,2,4 триазола (7,2 г, 30,8 ммоль, выход: 17%) в виде желтоватого твердого вещества. Спектры 1-(2-фтор-4 нитрофенил)-3-метил-1H-1,2,4-триазола [В 1]: ЖХ-МС: (М+Н)+ = 223,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.73 (d, J=2.7 Гц, 1 Н), 8.15-8.26 (m, 3 Н), 2.53 (s, 3 Н). Фракции, содержащие чистый более полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-5-метил-1H-1,2,4-триазола (6.23 г, выход: 15%) в виде желтоватого твердого вещества. Спектры 1-(2-фтор-4-нитрофенил)-5-метил-1H-1,2,4-триазола [с 1]: ЖХ-МС: (М+Н)+ = 223,1. 1 Суспензию NaH (2,295 г, 57,4 ммоль, 60% дисперсия в минеральном масле) в ДМФА (85 мл) охлаждали при 0 С и добавляли по каплям раствор 1-(2-фтор-4-нитрофенил)-3-метил-1H-1,2,4-триазола (8,50 г, 38,3 ммоль). В течение 10 мин добавляли через шприц аллиловый спирт (2,67 г, 49,9 ммоль). Данную реакционную смесь оставляли нагреваться до комнатной температуры. Через 30 мин согласно ТСХанализу реакция была завершена. Реакционную смесь медленно гасили водой (20 мл), обрабатывали солевым раствором (200 мл) и экстрагировали EtOAc (этилацетатом) (3200 мл). Объединенные органические экстракты промывали водой (3200 мл) и солевым раствором (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Данную неочищенную реакционную смесь очищали путем хроматографии на силикагеле (20-80% EtOAc/гексан, линейный градиент). Фракции, содержащие чистый продукт, концентрировали при пониженном давлении с получением 1-(2(аллилокси)-4-нитрофенил)-3-метил-1 Н-1,2,4-триазола (5 г, 19,21 ммоль, выход: 50%) в виде желтого твердого вещества. ЖХ-МС: (М+Н)+ = 261,0. 1 Суспензию NaH (0,675 г, 16,88 ммоль, 60% дисперсия в минеральном масле) в ДМФА (25 мл) охлаждали до 0 С. Добавляли по каплям раствор 1-(2-фтор-4-нитрофенил)-5-метил-1H-1,2,4-триазола (2,50 г, 11,25 ммоль). В течение 5 мин добавляли через шприц аллиловый спирт (0,784 г, 13,5 ммоль). Данную реакционную смесь оставляли нагреваться до комнатной температуры. Через 30 мин согласно ТСХанализу реакция была завершена. Реакционную смесь медленно гасили водой (10 мл), разбавляли солевым раствором (100 мл) и экстрагировали EtOAc (этилацетатом) (350 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Данную неочищенную реакционную смесь очищали путем хроматографии на силикагеле (20-80% EtOAc/гексан, линейный градиент). Фракции, содержащие чистый продукт, концентрировали при пониженном давлении с получением 1-(2(аллилокси)-4-нитрофенил)-5-метил-1H-1,2,4-триазола (1,5 г, выход: 51%) в виде желто-коричневого твердого вещества. ЖХ-МС: (М+Н)+ = 261,0. 1 В круглодонную колбу, содержащую смесь 1-(2-(аллилокси)-4-нитрофенил)-3-метил-1H-1,2,4 триазола (500 мг, 1,921 ммоль), абсолютного метанола (5 мл), воды (1 мл) и хлорида аммония (517 мг,9,61 ммоль), добавляли железный порошок - 325 меш (565 мг, 9,6 ммоль). К колбе присоединяли обратный холодильник, охлаждаемый водой, и данную гетерогенную смесь нагревали до 65 С при интенсивном перемешивании в течение 50 мин. Затем реакционную смесь фильтровали и промывали метанолом. Растворитель удаляли под вакуумом. К остатку добавляли EtOAc и промывали водой и солевым раствором. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением 3(аллилокси)-4-(3-метил-1H-1,2,4-триазол-1-ил)анилина (270 мг, выход: 61%). ЖХ-МС: (М+Н)+ = 231,2. 1 В круглодонную колбу, содержащую смесь 1-(2-(аллилокси)-4-нитрофенил)-5-метил-1H-1,2,4 триазола (4 г, 15,37 ммоль), абсолютного метанола (40 мл), воды (8 мл) и хлорида аммония (4,11 г, 76,86 ммоль), добавляли железный порошок - 325 меш (4,52 г, 76,86 ммоль). К колбе присоединяли обратный холодильник, охлаждаемый водой, и данную гетерогенную смесь нагревали до 65 С при интенсивном перемешивании в течение 50 мин. Затем реакционную смесь фильтровали и промывали метанолом. Растворитель удаляли под вакуумом. К остатку добавляли EtOAc и промывали водой и солевым раствором. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением 3-(аллилокси)-4(5-метил-1H-1,2,4-триазол-1-ил)анилина (1,5 г, выход: 42%) в виде темно-коричневого твердого вещества. ЖХ-МС: (М+Н)+ = 231,2. 1 К перемешиваемому раствору 2-гидрокси-4-нитробензонитрила (5,0 г, 30,48 ммоль) в ДМФА (50 мл) добавляли Cs2CO3 (19,9 г, 60,97 ммоль). Данную смесь охлаждали до 0 С и добавляли по каплям бромистый аллил (4,39 г, 36,58 ммоль). Реакционную смесь перемешивали в течение 12 ч при 90 С в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и концентрировали с целью удаления ДМФА, затем к остатку добавляли EtOAc (50 мл). Данную смесь промывали водой (230 мл) и солевым раствором (30 мл). Органический слой сушили с использованием Na2SO4 и концентрировали под вакуумом с получением 2-(аллилокси)-4-нитробензонитрила в виде желтого твердого вещества (4 г,выход: 65%). ЖХ-МС: (М+Н)+ = 205,2. 1 В круглодонную колбу, содержащую смесь 2-(аллилокси)-4-нитробензонитрила (4,0 г, 19,6 ммоль),абсолютного метанола (40 мл), воды (8 мл) и хлорида аммония (5,2 г, 98 ммоль), добавляли железный порошок - 325 меш (5,7 г, 98,0 ммоль). К колбе присоединяли обратный холодильник, охлаждаемый водой, и данную гетерогенную смесь нагревали до 65 С при интенсивном перемешивании в течение 50 мин. Затем реакционную смесь фильтровали и промывали метанолом. Растворитель удаляли под вакуумом. К остатку добавляли EtOAc, и данный раствор промывали водой и солевым раствором. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением 2-(аллилокси)-4 аминобензонитрила (3,2 г, выход: 94%) в виде светло-коричневого твердого вещества. ЖХ-МС: (М+Н)+ = 175,2. 1 К охлажденному до 0 С раствору 2-(2-аминоэтоксиэтанол) (10 г, 95,23 ммоль) в дихлорметане (500 мл) добавляли триэтиламин (19,23 г, 190,47 ммоль) и затем по каплям в течение 15 мин Вос-ангидрид(22,62 г, 104,76 ммоль) при 0 С. Данную реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч, наблюдая за ходом реакции с использованием ТСХ (тонкослойной хроматографии). Растворитель удаляли при пониженном давлении и остаток переносили в этилацетат (400 мл) и промывали насыщенным раствором хлорида аммония (2250 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали с получением трет-бутил (2-(2 гидрокси)этокси)этилкарбамата (10,9 г, 55,8%) в виде бесцветной жидкости. 1 К охлажденному до 0 С раствору трет-бутил (2-(2-гидрокси)этокси)этилкарбамата (5 г, 24,5 ммоль) в дихлорметане (200 мл) добавляли трифенилфосфин (9,63 г, 36,7 ммоль) и затем четырехбромистый углерод (12,18 г, 36,7 ммоль) при 0 С. Данную реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Растворитель удаляли при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле (силикагель 60-120 меш), используя 5-10% этилацетат в петролейном эфире, с получением трет-бутил 3-бромпропилкарбамата (4,9 г, 70,73%) в виде светлокоричневой жидкости. 1(20 мл) добавляли Промежуточное соединение Е(2) (4,95 г, 17,44 ммоль) и затем иодид тетрабутиламмония (0,214 г, 0,581 ммоль) при комнатной температуре. Данную реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Растворитель удаляли при пониженном давлении, остаток переносили в этилацетат (200 мл) и промывали солевым раствором (2100 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали с получением трет-бутил 2-(2-(2-хлор-5 нитрофенокси)этокси)этилкарбамата (2,1 г, 50%) в виде светло-коричневого твердого вещества. ЖХ-МС: К перемешиваемой смеси промежуточного соединения Е(3) (4,0 г, 11,1 ммоль), KOH (0,93 г, 16,6 ммоль) в ДМСО (30 мл) добавляли хлоримидазол (1,69 г, 16,6 ммоль) при комнатной температуре. Данную реакционную смесь перемешивали в течение 18 ч при 90 С, наблюдая за ходом реакции с использованием ЖХ-МС и ТСХ. Затем реакционную смесь выливали на дробленый лед (50 г) и экстрагировали этилацетатом (3200 мл). Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученное неочищенное соединение очищали путем колоночной хроматографии (силикагель 60-120 меш), используя 60-70% этилацетат в петролейном эфире,с выходом трет-бутил 2-(2-(2-(4-хлор-1H-имидазол-1-ил)-5 нитрофенокси)этокси)этилкарбамата (3,0 г, 63,29%) в виде желтого твердого вещества. ЖХ-МС: (М 100)+ = 326,2. 1 К охлажденному до 0 С раствору промежуточного соединения Е(4) (1 г, 2,34 ммоль) в ТГФ (20 мл) добавляли HCl в диоксане (20 мл). Данную реакционную смесь перемешивали в течение 3 ч при комнатной температуре, наблюдая за ходом реакции с использованием ТСХ и ЖХ-МС. Затем реакционную смесь концентрировали при пониженном давлении и вливали в охлажденную до 0 С воду (100 мл). рН подводили насыщенным раствором бикарбоната натрия (100 мл) и экстрагировали дихлорметаном(2100 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением препарата Е в виде светло-желтой жидкости (0,72 г, 94,11%). ЖХ-МС: К раствору 3-аминопропан-1-ола (10 г, 133,3 ммоль) в дихлорметане (500 мл) добавляли триэтиламин (26,9 г, 266,6 ммоль) и затем по каплям в течение 15 мин Вос-ангидрид (31,82 г, 146,6 ммоль) при 0 С. Данную реакционную смесь перемешивали в течение 18 ч при комнатной температуре, наблюдая за ходом реакции с использованием ТСХ. Растворитель удаляли при пониженном давлении, остаток растворяли в этилацетате (400 мл) и промывали насыщенным раствором хлорида аммония (2250 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом с получением трет-бутил-3-гидроксипропилкарбамата (9,8 г, 42,06%) в виде бесцветной жидкости. 1
МПК / Метки
МПК: A61P 25/28, C07D 487/16, C07D 498/06, A61K 31/33, C07D 487/06, C07D 498/16
Метки: продукции, уменьшения, соединения, бета-амилоида
Код ссылки
<a href="https://eas.patents.su/30-21527-soedineniya-dlya-umensheniya-produkcii-beta-amiloida.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для уменьшения продукции бета-амилоида</a>












