Фосфаплатины и их применение для лечения рака
Формула / Реферат
1. Комплекс фосфаплатины, выбранный из группы, состоящей из:
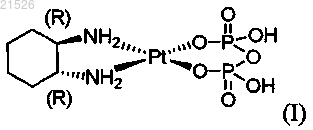
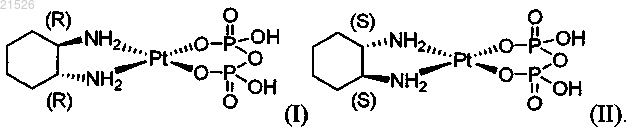
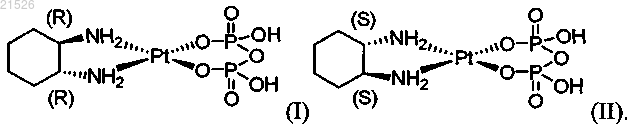
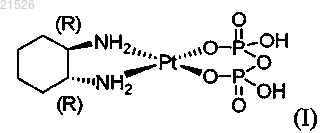
(i) энантиомерно чистого (1R,2R)-пиро-DACH-2, имеющего формулу (I)
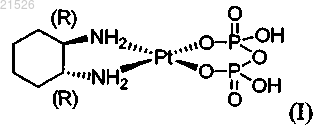
,
или его фармацевтически приемлемой соли или сольвата;
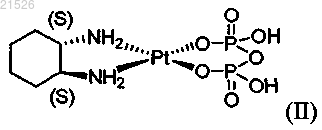
(ii) энантиомерно чистого (1S,2S)-пиро-DACH-2, имеющего формулу (II)
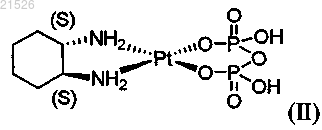
,
или его фармацевтически приемлемой соли или сольвата;
(iii) цис-пиро-DACH-2, имеющего формулу (III)
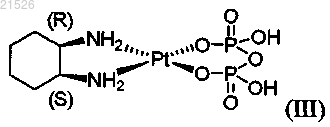
,
или его фармацевтически приемлемой соли или сольвата;
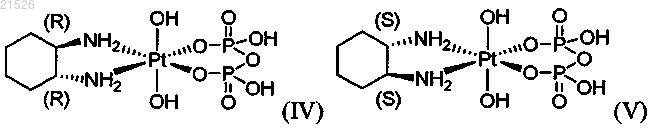
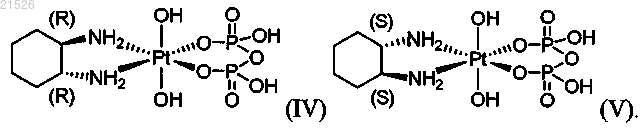
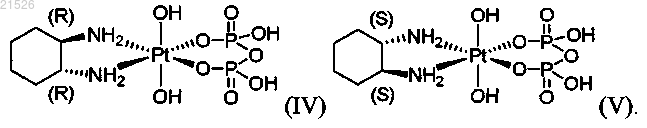
(iv) энантиомерно чистого (1R,2R)-пиро-DACH-4, имеющего формулу (IV)
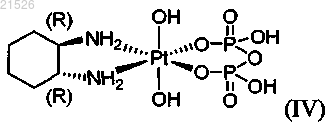
,
или его фармацевтически приемлемой соли или сольвата;
(v) энантиомерно чистого (1S,2S)-пиро-DACH-4, имеющего формулу (V)

или его фармацевтически приемлемой соли или сольвата; и
(vi) цис-пиро-DACH-4, имеющего формулу (VI)
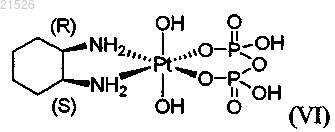
,
или его фармацевтически приемлемой соли или сольвата.
2. Комплекс фосфаплатины, выбранный из группы, состоящей из:
(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-2, имеющего формулу (I), или (1S,2S)-пиро-DACH-2, имеющего формулу (II)

,
или его фармацевтически приемлемой соли или сольвата; и
(ii) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-4, имеющего формулу (IV) или (1S,2S)-пиро-DACH-4, имеющего формулу (V)
,
или его фармацевтически приемлемой соли или сольвата.
3. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-2 от 0,1 до 99%.
4. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1S,2S)-пиро-DACH-2 от 0,1 до 99%.
5. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-4 от 0,1 до 99%.
6. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1S,2S)-пиро-DACH-4 от 0,1 до 99%.
7. Фармацевтическая композиция для лечения пролиферативного заболевания, содержащая:
(а) один или более комплексов фосфоплатины, выбранных из:
(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-2, по формуле (I)
,
или его фармацевтически приемлемых солей или сольватов;
(ii) энантиомерно обогащенный пиро-DACH-2, содержащий энантиомерный избыток (1S,2S)-пиро-DACH-2 формулы (II)
,
или его фармацевтически приемлемых солей или сольватов;
(iii) цис-пиро-DACH-2 формулы (III)
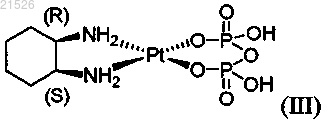
,
или его фармацевтически приемлемых солей или сольватов;
(iv) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-4 формулы (IV)
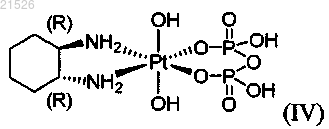
,
или его фармацевтически приемлемых солей или сольватов;
(v) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1S,2S)-пиро-DACH-4 формулы (V)

,
или его фармацевтически приемлемых солей или сольватов;
(vi) цис-пиро-DACH-4 формулы (VI)
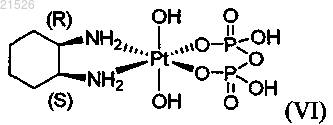
,
или его фармацевтически приемлемых солей или сольватов; и
(vii) мультикомплексной смеси, содержащей по меньшей мере два из указанных комплексов фосфаплатины (i)-(vi); и
(b) по меньшей мере один фармацевтически приемлемый ингредиент, выбранный из группы, состоящей из носителей, разбавителей, адъювантов и растворителей.
8. Фармацевтическая композиция по п.7, где указанные комплексы фосфаплатины представляют собой изолированные мономерные комплексы фосфаплатины.
9. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-2, содержащий энантиомерный избыток от 10 до 100% (1R,2R)-пиро-DACH-2.
10. Фармацевтическая композиция по п.9, в которой указанный энантиомерно обогащенный пиро-DACH-2 состоит из (1R,2R)-пиро-DACH-2 формулы (I) и (1S,2S)-пиро-DACH-2 формулы (II)
11. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-2, содержащий энантиомерный избыток от 10 до 100% (1S,2S)-пиро-DACH-2.
12. Фармацевтическая композиция по п.11, при этом указанный энантиомерно обогащенный пиро-DACH-2 состоит из (1R,2R)-пиро-DACH-2 формулы (I) и (1S,2S)-пиро-DACH-2 формулы (II)
13. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-4, содержащий энантиомерный избыток от 10 до 100% (1R,2R)-пиро-DACH-4.
14. Фармацевтическая композиция по п.13, в которой указанный энантиомерно обогащенный пиро-DACH-4 состоит из (1R,2R)-пиро-DACH-4 формулы (IV) и (1S,2S)-пиро-DACH-4 формулы (V)
15. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-4, содержащий энантиомерный избыток от 10 до 100% (1S,2S)-пиро-DACH-4.
16. Фармацевтическая композиция по п.15, в которой указанный энантиомерно обогащенный пиро-DACH-4 состоит из (1R,2R)-пиро-DACH-4 формулы (IV) и (1S,2S)-пиро-DACH-4 формулы (V)
17. Фармацевтическая композиция по п.7, содержащая цис-пиро-DACH-2
18. Фармацевтическая композиция по п.7, содержащая цис-пиро-DACH-4.
19. Фармацевтическая композиция по п.7, где указанным пролиферативным заболеванием является рак.
20. Фармацевтическая композиция по любому из пп.7-19, где указанное пролиферативное заболевание выбрано из рака яичников, рака яичка, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака головы и шеи, рака кожи, рака поджелудочной железы, рака молочной железы, глиобластомы и колоректального рака.
21. Фармацевтическая композиция по любому из пп.7-19, где указанным пролиферативным заболеванием является рак, резистентный к терапии по меньшей мере одним из цисплатина, карбоплатина и оксалиплатина.
22. Способ лечения пролиферативного заболевания, который предусматривает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества композиции, содержащей:
(а) по меньшей мере один комплекс фосфоплатины, выбранный из:
(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-2 формулы (I)
,
или его фармацевтически приемлемых солей или сольватов;
(ii) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1S,2S)-пиро-DACH-2 формулы (II)
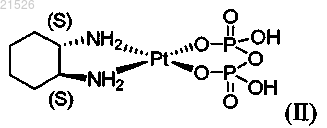
,
или его фармацевтически приемлемых солей или сольватов;
(iii) цис-пиро-DACH-2 формулы (III)
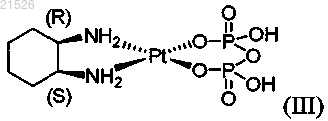
,
или его фармацевтически приемлемых солей или сольватов;
(iv) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)-пиро-DACH-4 формулы (IV)
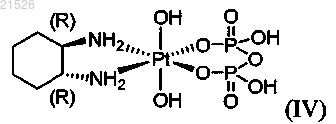
или его фармацевтически приемлемых солей или сольватов;
(v) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1S,2S)-пиро-DACH-4 формулы (V)

или его фармацевтически приемлемых солей или сольватов;
(vi) цис-пиро-DACH-4 формулы (VI)
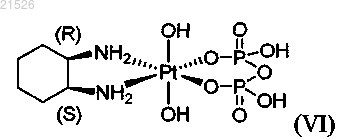
,
или его фармацевтически приемлемых солей или сольватов; и
(vii) мультикомплексной смеси, содержащей по меньшей мере два из указанных комплексов фосфоплатины (i)-(vi).
23. Способ по п.22, где указанная композиция дополнительно содержит:
(b) по меньшей мере один фармацевтически приемлемый ингредиент, выбранный из группы, состоящей из носителей, разбавителей, адъювантов и растворителей.
24. Способ по п.22 или 23, где указанная композиция содержит по меньшей мере один комплекс фосфаплатины, выбранный из группы, состоящей из:
(i) энантиомерно чистого (1R,2R)-пиро-DACH-2;
(ii) энантиомерно чистого (1S,2S)-пиро-DACH-2;
(iii) энантиомерно чистого (1R,2R)-пиро-DACH-4;
(iv) энантиомерно чистого (1S,2S)-пиро-DACH-4;
(v) цис-пиро-DACH-2 и
(vi) цис-пиро-DACH-4, при этом
указанная композиция не содержит оба (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2 и
указанная композиция не содержит оба (1R,2R)-пиро-DACH-4 и (1S,2S)-пиро-DACH-4.
25. Способ по любому из пп.22-24, где по меньшей мере один комплекс фосфаплатины указанной композиции состоит из энантиомерно обогащенного пиро-DACH-2, энантиомерно обогащенного пиро-DACH-4 или обоих.
26. Способ по любому из пп.22-25, где по меньшей мере один комплекс фосфаплатины указанной композиции состоит из энантиомерно чистого (1R,2R)-пиро-DACH-2, энантиомерно чистого (1R,2R)-пиро-DACH-4 или обоих.
27. Способ по любому из пп.22-26, где указанная композиция дополнительно содержит цисплатин, карбоплатин, оксалиплатин или их комбинацию.
28. Способ по любому из пп.22-27, где указанным пролиферативным заболеванием является рак.
29. Способ по п.28, где указанное пролиферативное заболевание выбрано из рака яичников, рака яичка, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака головы и шеи, рака кожи, рака поджелудочной железы, рака молочной железы, глиобластомы и колоректального рака.
30. Способ по п.28, где указанным пролиферативным заболеванием является рак, резистентный к терапии по меньшей мере одним из цисплатина, карбоплатина и оксалиплатина.
31. Способ по любому из пп. 22-30, где указанным субъектом является млекопитающее.
32. Способ по любому из пп.22-30, где указанным субъектом является человек.
Текст
ФОСФАПЛАТИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА Предложены стабильные мономерные фосфаплатины, а именно пирофосфатные комплексы платины(II) или платины(IV), содержащие цис-циклогександиаминовый лиганд или энантиомерно обогащенные или энантиомерно чистые транс-циклогександиаминовые лиганды, и способ их получения. Эффективности и токсичности фосфаплатиновых соединений определены в отношении различных видов рака, включая восприимчивые и резистентные рак яичников, головы, шеи и колоректальный рак. Данная заявка истребует приоритет согласно 35 U.S.С. 119(е) американской предварительной заявке 61/351514, зарегистрированной 4 июня 2010 года, которая включена здесь во всей своей полноте посредством отсылки. Область техники, к которой относится изобретение Изобретение в целом относится к пирофосфатным комплексам платтны; способам синтеза предложенных комплексов; композициям, содержащим предложенные комплексы; и к способам лечения пролиферативных заболеваний с использованием предложенных комплексов, композиций, содержащих предложенные комплексы или их комбинации. Сведения о предшествующем уровне техники В 2008 году было диагностировано более 12 миллионов случаев рака по всему миру и более 7 миллионов человек умерли от опухолевых образований. Известно, что рак является основной причиной смерти в развитых странах и второй основной причиной смерти в развивающихся странах (уступает только HIV/AIDS). После диагностирования рака прогноз для пациента во многом зависит от того, был ли рак диагностирован на ранней стадии или распространился по всему организму, и является или стал резистентным к известным схемам химиотерапии. Противораковые препараты на основе платины, такие как цисплатин, карбоплатин и оксалиплатин,широко применялись для лечения разных видов рака, таких как рак яичников, рак яичка, мелкоклеточный рак легкого и колоректальный рак. Эти соединения могут применяться в комбинации с другими методами лечения, включая лучевую терапию, для лечения более широкого спектра видов рака. На сегодняшний день более 600 клинических испытаний адъювантных терапевтических режимов, использующих соединения платины, подтвердили способность соединений платины эффективно лечить широкий спектр других видов рака. Например, по данным недавних исследований можно предположить, что противодиабетический препарат росиглитазон можно эффективно применять в комбинации с карбоплатином для лечения множественных форм рака. Это вносит новое направление в неуклонно растущие применения противораковых препаратов на основе платины, поскольку основная часть адъювантных терапий ограничена главным образом комбинациями противораковых или противорадиационных препаратов с другими противораковыми препаратами. Таким образом, постоянная потребность в новых противораковых препаратах на основе платины сохраняется, также как в новых применениях противораковых препаратов на основе платины. Традиционные химиотерапевтические препараты на основе платины, такие как цисплатин, инициируют апоптоз в G2-фазе клеточного цикла преимущественно посредством ингибирования процессов транскрипции и репликации, в особенности при высоких дозах. Ковалентное связывание с ДНК черезN7-позиции гуанинового и аденинового оснований, обоих путем внутри- и межнитиевых сшивок, считается ключевым явлением на молекулярном уровне в запуске каскада клеточных реакций, ведущих к апоптозу (программированная клеточная гибель). Многочисленные проблемы были обнаружены в понимании комплексности клеточной и молекулярной металло-биохимии цисплатина и молекулярных механизмов цитотоксичности. Вкратце, было замечено, что платинированная ДНК лежит в основе инициирования цитотоксичности. Связанная платиной ДНК секвестрирована ядерными белками с высокой подвижностью (HMG) от прохождения репараций с помощью эксцизионных ферментов репарации нуклеотидов (NER). Кроме того, полагают, что эти аддукты платина-ДНК активируют р 53 фактор транскрипции, индуцируют фосфорилирование гистона и запускают конденсацию хроматина. Несмотря на то, что химиотерапии на основе платины широко используются для лечения рака, их применение у большого количества пациентов ограничено из-за серьезных побочных эффектов, таких как нефротоксичность, нейротоксичность, ототоксичность, миелосупрессии и приобретенной резистентности к препаратам на основе металла платины. Например, значительный процент пациентов становится устойчивым к терапии цисплатином. Несмотря на то, что карбоплатин немного уменьшает токсичность по сравнению с цисплатином, это не ослабляет резистентности. В настоящее время оксалиплатин является утвержденным препаратом для лечения колоректального рака, но его резистентность большей частью является неисследованной. В данной области недостаточно понимания на молекулярном уровне развития резистентности к традиционным химиотерапевтическим препаратам на основе платины и способов преодоления такой резистентности. Несмотря на недостаточно полное понимание, полагают, что способность к репарации повреждения ДНК путем вырезания связанной платины из ДНК чаще всего способствует механизмам резистентности. Другими механизмами, которые способствуют резистентности, являются уменьшенные внутриклеточные накопления цисплатина из-за пониженного поглощения, связанного с понижающим регулированием экспрессии медь-транспортного белка CTR1; повышенный эффлюкс, связанный со сверхэкспрессией сМОАТ, АТР 7 А и АТР 7 В; нарушенное понижающее регулирование проапоптотических генов и повышающее регулирование антиапоптотических генов. С другой стороны, повышающее регулирование белка CTR1 связано с повышенной ототоксичностью. Изменение МАРК и дезактивация платины глутатионом и другими маленькими молекулами и белками, в особенности металлотионином,также были предложены в качестве факторов, способствующих резистентности к платиновым препаратам. В свете указанного выше, имеется потребность в путях преодоления резистентности к платиновым препаратам, включая разработку препаратов, которые не являются восприимчивыми к механизмам репарации ДНК. В различных вариантах патент США 7700649 (Bose) и патент США 12/722189 (Bose) отвечают некоторым потребностям в данной области путем раскрытия путей синтеза и способов лечения рака с использованием нового класса комплексов платины, а именно пирофосфатных комплексов, имеющих металлические центры платины(II) или платины(IV). Раскрытые соединения и способы являются частью стратегии разработки препарата, основанной на создании класса платиновых противоопухолевых средств, которые ковалентно не связывают ДНК, сводя на нет основанную на репарации ДНК резистентность. Эта стратегия является уходом от традиционных подходов к разработке препаратов на основе платины, в которых ДНК связывание является центральной темой в разработке более эффективных противораковых средств на основе платины. Среди пирофосфато-платиновых комплексов, раскрытых в патенте США 7700649 (Bose) и патенте США 12/722189 (Bose), представлена рацемическая транс 1,2-циклогександиамин(пирофосфато)платина(II) и рацемическая транс 1,2-циклогександиамин-транс-дигидроксо(пирофосфато)платина(IV). Несмотря на то, что было обнаружено, что эти рацемические комплексы являются эффективными для лечения некоторых видов рака, все еще существует потребность в улучшенных подходах к разработке препаратов, включая, но без ограничения, улучшение эффективности пирофосфатоплатиновых терапий, уменьшение токсичности таких терапий и ингибирование роста раковых клеток путем улучшенного направленного воздействия на гены, отвечающие за уничтожение раковых клеток. Сущность изобретения В различных вариантах настоящее описание реализует вышеизложенные потребности путем раскрытия стратегии разработки препарата, основанной на энантиомерно чистых и энантиомерно обогащенных мономерных пирофосфато-платиновых комплексах. Таким образом, настоящее описание изобретения обеспечивает самые эффективные формы пирофосфато-платиновых комплексов, а также идентификацию целевых генов, отвечающих за уничтожение раковых клеток и ингибирование роста раковых клеток. Предложенные комплексы являются стабильными, показывают повышенную цитотоксичность и более высокую эффективность по сравнению с традиционными противораковыми средствами. Эта стратегия разработки препарата является также уходом от традиционных подходов к разработке препаратов на основе платины, в которых ДНК связывание остается центральной темой. Среди различных вариантов настоящее описание обеспечивает изолированные, мономерные комплексы цис или транс)-1,2-циклогександиамин) (дигидропирофосфато)платины(II) и цис или транс)1,2-циклогександиамин)-транс-дигидроксо(дигидропирофосфато)платины(IV), при этом комплексы являются энантиомерно чистыми или содержат энантиомерный избыток комплекса на основе цис-1,2 циклогександиамина или один из двух различимых комплексов на основе транс-1,2-циклогександиамина. Таким образом, настоящее изобретение обеспечивает комплексы платины(II) и платины(IV), выбранные из (i) 1R,2R)-1,2-циклогександиамин)(дигидропирофосфато)платины(II) (называемый здесь как"(1R,2R)-(пиро-DACH)-2"; (ii) 1S,2S)-1,2-циклогександиамин)(дигидропирофосфато)платины(II) (называемый здесь как "(1S,2S)-пиро-DACH-2"; (iii) 1S,2S)-1,2-циклогександиамин)(дигидропирофосфато) платины(II) или 1S,2R)-1,2-циклогександиамин)(дигидропирофосфато)платины(II) (которые являются соединениями с налагающимися зеркальными изображениями и совместно именуются как "цис-пироDACH-2"; (iv) 1R,2R)-1,2-циклогександиамин)-транс-дигидроксо (дигидропирофосфато)платины(IV)(дигидропирофосфато)платины(IV) (называемый здесь как "(1S,2S)-пиро-DACH-4") и (vi) 1R,2S)-1,2 циклогександиамин)-транс-дигидроксо(дигидропирофосфато)платины(IV) или 1S,2R)-1,2-циклогександиамин)-транс-дигидроксо(дигидропирофосфато)платины(IV) (которые являются соединениями с налагающимися зеркальными изображениями и совместно именуются как "цис-пиро-DACH-4"; а также фармацевтически приемлемые соли или сольваты любого из (i)-(vi). В отношении аминогрупп на 1,2 циклогександиаминовом лиганде, в соединениях (i), (ii), (iv) и (v) стереохимии (1R,2R) и (1S,2S) представляют аминогруппы в транс конфигурациях, тогда как в соединениях (iii) и (vi) стереохимии (1R,2S) и(1S,2R) представляют аминогруппы в цис конфигурациях. Кроме того, настоящее описание изобретения обеспечивает в некоторых вариантах композиции, содержащие терапевтически эффективное количество одного или нескольких предложенных комплексов и по меньшей мере один фармацевтически приемлемый ингредиент, такой как носитель, разбавитель, адъювант или растворитель. В еще других вариантах настоящее описание изобретения предлагает способы лечения одного или нескольких пролиферативных заболеваний путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества композиции, содержащей один или несколько предложенных комплексов. Краткое описание чертежей Несмотря на то, что описание завершается формулой изобретения, ясно определяющей объект, который заявители рассматривают в качестве своего изобретения, настоящее изобретение может быть лучше понято при рассмотрении вместе с сопровождающими чертежами, на которых фиг. 1 показывает спектр кругового дихроизма стереоизомеров (I) (1R,2R)-пиро-DACH-2, (II)(1S,2S)-пиро-DACH-2, (III) цис-пиро-DACH-2, (IV) (1R,2R)-пиро-DACH-4, (V) (1S,2S)-пиро-DACH-4,(VI) цис-пиро-DACH-4 и транспиро-DACH-2; фиг. 2 отражает активности (1R,2R)-пиро-DACH-2, (1S,2S)-пиро-DACH-2 и транспиро-DACH2, определенные с помощью анализов клоногенности путем воздействия на клетки рака яичников человека (А 2780) различных концентраций соединений в течение 24 ч; фиг. 3 отражает активности (1R,2R)-пиро-DACH-2, (1S,2S)-пиро-DACH-2 и транспиро-DACH2, определенные с помощью анализов клоногенности путем воздействия на резистентные к цисплатину клетки рака яичников человека (OVCAR-10) различных концентраций соединений в течение 24 ч; фиг. 4 представляет собой график изменения среднего размера опухоли за период шесть недель во время введения фосфаплатинов согласно вариантам, описанным здесь, в клетки рака яичников человека у мышей; фиг. 5 показывает эффективности (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4, описанные подробно ниже, в отношении резистентных к цисплатину клеток рака яичников человека (OVCAR-10); фиг. 6 показывает графики изменения размера опухоли во времени при сравнении контроля(PBS/Bic), вводимого один раз через день в течение трех дней ("qodx3"), карбоплатина, вводимого в дозе 60 мг/кг (вводимого qodx3), и (1R,2R)-пиро-DACH-4, вводимого в дозе 40 мг/кг [вводимого один раз в день в течение трех последовательных дней ("qdx3")]; и фиг. 7 показывает эффективности (1R,2R)-пиро-DACH-2 [вводимого qodx3 и один раз в день в течение четырех последовательных дней ("qdx4")] и (1R,2R)-пиро-DACH-4 (вводимого qdx4), описанные подробно ниже, в отношении рака головы и шеи человека (UMSCC10b). Сведения, подтверждающие возможность осуществления изобретения Представлено описание конкретных вариантов настоящего изобретения. Изобретение, однако, может быть воплощено в различных формах и не должно рассматриваться как ограниченное изложенными далее вариантами. Эти варианты скорее представлены для того, чтобы описание было более полным и всесторонним, и полностью передавало масштаб изобретения опытным специалистам в данной области. Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, которое понимается средним специалистом в области, к которой относится данное изобретение. Терминология, используемая в описании настоящего изобретения, употребляется только с целью описания конкретных вариантов осуществления и не предполагает быть ограничивающей. Используемые в описании и прилагаемой формуле формы единственного числа подразумевают также множественное число, если в контексте ясно не указано иное. Следует отметить, что термины, подобные "предпочтительно", "обычно" и "как правило", используются здесь не с целью ограничить масштаб формулы изобретения или указать на то, что некоторые признаки являются критическими, существенными или даже важными для структуры или функции изобретения. Эти термины скорее предназначены лишь для освещения альтернативных или дополнительных признаков, которые могут или не могут быть использованы в конкретном варианте настоящего изобретения. Термин "по существу" используется здесь для представления присущей степени неопределенности,которая может относиться к любому количественному сравнению, величине, измерению или другому представлению. Кроме того, термин "по существу" используется здесь для представления степени, до которой количественное обозначение может изменяться от исходного значения без вызывания изменения базовой функции объекта изобретения, находящегося на рассмотрении. Таким образом, термин используется для представления присущей степени неопределенности, которую можно отнести к любому количественному сравнению, величине, измерению или другому обозначению, относящемуся к группировке элементов или признаков, которые теоретически могут проявлять точное соответствие или поведение,могут на практике осуществлять что-либо немного меньше, чем точно. Если не указано иное, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и прочие, используемые в описании и в формуле изобретения, следует понимать как измененные во всех примерах термином "примерно", который означает до 10% указанной величины. К тому же, раскрытие любых диапазонов в описании и формуле следует понимать как включение самого диапазона и также значений, содержащихся в этом диапазоне, а также предельные значения. Если не указано иное, числовые параметры, приведенные в описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут изменяться в зависимости от желательных свойств, которые хотят получить по настоящему изобретению. Несмотря на то, что числовые диапазоны и параметры, отражающие объем изобретения, являются приближенными значениями, численные значения, указанные в конкретных примерах, представлены настолько точно, насколько это возможно. Любое числовое значение, однако, по существу, содержит определенные ошибки, неизбежно вытекающие из стандартного отклонения, обнаруживаемого в их соответствующих контрольных измерениях. Используемый здесь термин "фосфаплатин" относится в целом к платиновым комплексам, коорди-3 021526 нированным с одним бидентатным пирофосфато-лигандом. Фосфаплатины согласно описанным здесь вариантам могут иметь следующие общие структуры (А) и (В): в которых L1 и L2 представляют собой нейтральные лиганды (независимо выбранные из NH3; замещенных или незамещенных алифатических аминов и замещенных или незамещенных ароматических аминов) или один бидентатный нейтральный лиганд (выбранный из замещенных или незамещенных алифатических или ароматических диаминов) с концевыми группами L1и L2, координированными с металлическим платиновым центром; L3 и L4 представляют собой лиганды (выбранные из гидроксида, уксусной кислоты, масляной кислоты и альфа-гидроксикислот, аминов или их заряженных частиц), координированные с металлическим платиновым центром. Пирофосфато-лиганд может быть нейтральным(не показан) или заряженным (показан). В случае заряженного, пирофосфато-лиганд присутствует с противоионами, представленными Z+. Примерами Z+ являются, без ограничения, водород; щелочные металлы, такие как натрий и калий; и моновалентные органические группы. Предпочтительно, чтобы Z+ представлял собой противоион, что приводит к образованию фармацевтически приемлемой соли. Независимо от того, является лиганд заряженным или нейтральным, общая структура комплексов платины(II), представленная (А), является плоско-квадратной и общая структура комплексов платины(IV), представленная(В), является октаэдрической. В целом фосфаплатины с трудом подвергаются гидролизу, являются растворимыми в водном растворе при нейтральном рН и стабильными в водном растворе при нейтральном рН. Более того, фосфаплатины показали общую цитотоксичность в отношении клеток опухолевых линий и являются эффективными в клеточных линиях, резистентных к одному из цисплатина или карбоплатина или обоим из них. Таким образом, фосфаплатины являются эффективными и в некоторых случаях более эффективными в отношении индуцирования гибели раковых клеток по сравнению с известными платиновыми противораковыми препаратами, и проявляют желаемую стабильность и растворимость в растворах, подходящих для введения пациентам. Используемый здесь в отношении фосфаплатинов изобретения термин "стабильный" относится к устойчивости комплексов к гидролизу при хранении в водном растворе при рН в диапазоне 6-8 в течение периода времени от 2 до 6 дней. В отличие от цисплатина, карбоплатина и родственных противораковых препаратов на основе платины, фосфаплатины ковалентно не связываются с ДНК. Полагают, что резистентность к цисплатину,карбоплатину и родственным противораковым препаратам связана с эффективной репарацией повреждения ДНК разнообразными ферментами, включая ядерные ферменты эксцизионной репарации. Однако,поскольку фосфаплатины не связываются ковалентно с ДНК, резистентность в отношении фосфаплатинов за счет механизма репарации ДНК является маловероятной. Данные указывают на то, что фосфаплатины запускают сверхэкспрессию транскрипционного фактора fas и родственных fas транскрипционных факторов, некоторых проапоптотических генов, таких как Bak и Вах, и генов подавления роста опухоли,таких как PUMA и PTEN. Более того, фосфаплатины понижающе регулируют BCL2, антиапоптотический ген. Эксперименты методом Вестерн-блоттинга, которые основаны на определении экспрессии белков, транскрибируемых этими генами, показали схожую тенденцию. К тому же, клеточное связывание фосфаплатинов меньше, чем цисплатина, при этом фосфаплатины проявляют высокую цитотоксичность. Таким образом, настоящее изобретение обеспечивает эффективные платиновые противораковые препараты, которые имеют молекулярную мишень, отличную от молекулярных мишеней, существующих в данной области. Термин "энантиомерный избыток" используется здесь в соответствии с его общепринятым определением. А именно для двух энантиомеров А и В, которые могут присутствовать в смеси в молярных количествах MA и MB, соответственно энантиомерный избыток энантиомера Е, присутствующего в высоком молярном количестве в смеси, может быть выражен уравнением %Е = (МА-МВ)/(МА + МВ)100, где Е 0%. "Рацемическая смесь" энантиомеров А и В, которая может быть обозначена аббревиатурой, такой как "рац" и/или (или просто отсутствовать любая ссылка на энантиомеры), имеет Е=0%, так как МА = МВ. В качестве дополнительной иллюстрации смесь, состоящая из А и В, в которой МА = 60% и МВ= 40%, имеет энантиомерный избыток А, равный 20%. Такая же смесь может альтернативно рассматриваться как смесь, состоящая из 80% рацемической смеси А и В в комбинации с 20% энантиомерно чистого А, так как каждая молекула В (40% смеси) может быть составлена в паре с молекулой А в смеси (40% смеси) для оставления без пары избытка молекул А (20% смеси). Используемый здесь термин "энантиомерно чистый" в отношении молекулы, имеющей два энантиомера, А и В, относится к соединению или композиции, содержащей преимущественно только один из энантиомеров, А или В, но не оба А и В энантиомера. Для "энантиомерно чистого" комплекса 97%Е 100%. Используемый здесь термин "энантиомерно обогащенный" относится в широком понимании к со-4 021526 единению или композиции, которая содержит молекулу, имеющую два энантиомера А и В, при этом соединение или композиция имеет энантиомерный избыток одного из энантиомеров А или В. Таким образом "энантиомерно обогащенная смесь А и В" может относиться к смеси с энантиомерным избытком А или к смеси с энантиомерным избытком В, где 0%Е 100% для А или В. В качестве иллюстративных примеров энантиомерный избыток каждого из А или В может быть больше 0,01%, больше 1%, больше 10%, больше 25%, больше 50%, больше 75%, больше 90%, больше 98%, больше 99%, больше 99,9% или даже равен 100%. В разных вариантах предложены стабильные мономерные фосфаплатиновые комплексы (и композиции, содержащие терапевтически эффективное количество одного или нескольких указанных комплексов). В некоторых вариантах указанные комплексы и композиции могут применяться в способах лечения рака, включая, но без ограничения, рака, резистентного к лечению одним или несколькими препаратами,выбранными из цисплатина, карбоплатина и оксалиплатина. Комплексы В разных вариантах предложены комплексы фосфаплатины, выбранные из группы, состоящей из:(iii) энантиомерно обогащенного пиро-DACH-2, имеющего энантиомерный избыток (1R,2R)-пироDACH-2, имеющего формулу (I), или (1S,2S)-пиро-DACH-2, имеющего формулу (II)(vii) энантиомерно обогащенного пиро-DACH-4, имеющего энантиомерный избыток (1R,2R)-пироDACH-4, имеющего формулу (IV), или (1S,2S)-пиро-DACH-4, имеющего формулу (V) В комплексах согласно формулам (I)-(VI) сокращенное обозначение "пиро-DACH" относится к 1,2 циклогександиамин(пирофосфато)платиновому комплексу (где "пиро" относится к бидентатному пирофосфато-лиганду и "DACH" относится к бидентатному 1,2-циклогександиаминовому лиганду (названному согласно номенклатуре IUPAC), известному также как 1,2-диаминоциклогексан. Обозначение(1R,2R), (1S,2S) или цис перед термином "пиро-DACH" относится к стереохимической конфигурации хиральных центров в положении 1 и положении 2 1,2-циклогександиаминового лиганда. Число (т.е. 2 или 4) после обозначения "пиро-DACH" относится к степени окисления платинового центра. То есть"пиро-DACH-2" относится к комплексу платины(II), и "пиро-DACH-4" относится к комплексу платины(IV). Фосфаплатины по формулам (I)-(VI) с платиной, координированной с пирофосфатным и 1,2 циклогександиаминовым лигандами, могут существовать в виде четырех стереоизомеров благодаря воз-5 021526 можной цис- и транс-геометрии двух аминогрупп (-NH2) в хиральных углеродных центрах 1 и 2 диаминового лиганда. Эти стереоизомеры проявляют (1R,2R)-, (1S,2S)-, (1R,2S)- и (1S,2R)-конфигурации. Транс-лиганд, транс-1,2-циклогександиамин, обеспечивает два энантиомера, имеющие (1R,2R)- и(1S,2S)-конфигурации соответственно. Цис-изомер теоретически охватывает (1R,2S)- и (1S,2R)энантиомеры, но эти два цис-изомера являются эквивалентными, накладывающимися зеркальными изображеними, неотличимыми друг от друга по своей структуре и химическим свойствам. Таким образом,два энантиомера цис-изомера называются в дальнейшем в данном описании просто как "цис-изомер" и обозначаются одной формулой. Обе смеси энантиомерно обогащенного пиро-DACH-2 (iii) и энантиомерно обогащенного пироDACH-4 (vii) характеризуются энантиомерным избытком больше нулевого (1R,2R)-энантиомера или(1S,2S)-энантиомера. Энантиомерный избыток может изменяться и в иллюстративных вариантах может быть больше 0,01%, больше 1%, больше 10%, больше 25%, больше 50%, больше 75%, больше 90%,больше 98%, больше 99%, больше 99,9% или даже равен 100%. В иллюстративных вариантах (1R,2R)энантиомер находится в энантиомерном избытке, например, энантиомерный избыток (1R,2R)энантиомера составляет больше 90%. В других иллюстративных вариантах (1S,2S)-энантиомер находится в энантиомерном избытке, например, энантиомерный избыток (1R,2R)-энантиомера составляет больше 90%. В еще других иллюстративных вариантах энантиомерно обогащенная смесь пиро-DACH-2 (i) и/или энантиомерно обогащенная смесь пиро-DACH-4 (ii) являются энантиомерно чистыми в (1R,2R)энантиомере или (1S,2S)-энантиомере. В представленных здесь сравнительных данных энантиомерно чистых комплексов по формулам (I),(II), (IV) и (V) и соответствующих рацемических смесей, описанных в патенте США 7700648, далее в этом документе рацемические смеси (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2 будут сокращенно обозначены как "транспиро-DACH-2". Аналогично рацемическая смесь (1R,2R)-пиро-DACH-4 и(1S,2S)-пиро-DACH-4 будет называться как "транспиро-DACH-4". В качестве неограничивающего примера соединения формул (I)-(VI) могут быть синтезированы из исходного материала, такого как цис-(1,2-циклогександиамин) дихлорплатина(II), который может быть получен путем превращения K2PtCl в K2PtI4 добавлением иодида калия. K2PtI4 затем может вступать в реакцию с 1,2-циклогександиамином, имеющим требуемую стехиометрию, такую как цис-1,2-циклогександиамин, транс-(1R,2R)-1,2-циклогександиамин, транс-(1S,2S)-1,2-циклогександиамин или их смеси. Полученные комплексы (1,2-циклогександиамин)дииодоплатины(II) затем могут быть трансформированы в соответствующие комплексы (1,2-циклогександиамин)диакваплатины(II) in situ путем добавления двух эквивалентов нитрата серебра. Диаква-комплекс [Pt(1,2-циклогександиамин)(Н 2 О)2] затем может быть превращен в цис-дихлор-комплексы [Pt(1,2-циклогександиамин)Cl2] путем добавления хлорида калия. Будет понятно, что могут использоваться другие подходящие условия реакции. В неограничивающих примерах исходные комплексы 1,2-циклогександиамин-платины(II) вступают в реакцию с избыточным пирофосфатом и температура может изменяться примерно от 35 до 45C или в любом более узком интервале от 35 до 45C. Хорошие результаты были получены при температуре 40C. В некоторых примерах реакция протекает в течение примерно от 13 до 16 ч или в любом предпочтительном более узком интервале от 13 ч до 16 ч. Хорошие результаты были получены при времени реакции 15 ч. В некоторых примерах рН может составлять примерно от 6 до 7, примерно от 7 до 8 и примерно от 8 до 9. Хорошие результаты были получены при рН 8. Водная реакционная смесь может быть концентрирована таким образом, чтобы не происходило образование осадка пирофосфата. Будет понятно, что водная реакционная смесь может быть концентрирована любым подходящим способом. Например, водная реакционная смесь может быть концентрирована путем ротационного выпаривания. Затем рН реакционной смеси можно быстро понизить до рН меньше 2 путем добавления подходящей кислоты. В некоторых вариантах для понижения рН может использоваться азотная кислота. В некоторых вариантах рН находится в диапазоне примерно от 1 до 2. Хорошие результаты были получены при рН 1. В некоторых вариантах реакционная смесь может быть охлаждена до температуры в интервале от 5C до комнатной температурой (25C2C) после концентрирования реакционной смеси. В других примерах способ, кроме того, предусматривает охлаждение реакционной смеси до температуры в интервале от 5C до комнатной температуры после понижения рН реакционной смеси. Для приготовления комплексов платины(IV) согласно формулам (II) и (V) требуются дополнительные стадии для присоединения гидроксолигандов. Таким образом, дополнительно к описанным выше стадиям, в реакционную смесь может быть добавлен пероксид водорода и необязательно реагент, выбранный из группы, состоящей из солей уксусной кислоты, солей масляной кислоты и солей альфагидроксикислот, после выдерживания реакционной смеси при температуре примерно от 30 до 60C в течение примерно от 12 ч до 18 ч при рН примерно от 7 до 9. Необязательный реагент, который может быть добавлен вместе с пероксидом водорода перед концентрированием реакционной смеси, может быть выбран из ацетата натрия, бутирата натрия, аминов и солей натрия альфа-гидроксикислот. В других примерах необязательный реагент, добавленный вместе с пероксидом водорода перед концентрированием реакционной смеси, может быть выбран из ацетата калия, бутирата калия, любых монодентатных аминов, таких как аммиак, изопропиламин и другие, и солей калия альфа-гидроксикислот. Композиции В некоторых различных вариантах дополнительно представлены композиции, содержащие один или несколько из (а) предложенных комплексов фосфаплатины; (b) фармацевтически приемлемых солей(а); и (с) фармацевтически приемлемого сольвата (а). Указанные композиции могут дополнительно содержать по меньшей мере один фармацевтически приемлемый ингредиент, выбранный из разбавителей,адъювантов и растворителей, которые в целом относятся к инертным, нетоксичным, твердым или жидким наполнителям, разбавителям или инкапсулирующим материалам, не вступающим в реакцию с фосфаплатинами. Эти виды добавок хорошо известны в данной области и описаны далее в отношении способов лечения. Согласно различным вариантам предложенная композиция содержит один или несколько из следующих компонентов:(i) энантиомерно чистый (1R,2R)-пиро-DACH-2, имеющий формулу (I), или его фармацевтически приемлемая соль или сольват;(ii) энантиомерно чистый (1S,2S)-пиро-DACH-2, имеющий формулу (II), или его фармацевтически приемлемая соль или сольват;(iii) энантиомерно обогащенный пиро-DACH-2, имеющий энантиомерный избыток (1R,2R)-пироDACH-2, имеющий формулу (I), или (1S,2S)-пиро-DACH-2, имеющий формулу (II), или их фармацевтически приемлемые соли или сольваты;(iv) цис-пиро-DACH-2, имеющий формулу (III), или его фармацевтически приемлемая соль или сольват;(v) энантиомерно чистый (1R,2R)-пиро-DACH-4, имеющий формулу (IV), или его фармацевтически приемлемая соль или сольват; или его фармацевтически приемлемая соль или сольват;(vii) энантиомерно обогащенный пиро-DACH-4, имеющий энантиомерный избыток (1R,2R)-пироDACH-4, имеющий формулу (IV), или (1S,2S)-пиро-DACH-4, имеющий формулу (V), или их фармацевтически приемлемые соли или сольваты; и(viii) цис-пиро-DACH-4, имеющий формулу (VI), или его фармацевтически приемлемая соль или сольват. В некоторых вариантах предложенная композиция содержит один комплекс (или его фармацевтически приемлемую соль или сольват), имеющий формулу согласно любым формулам (I)-(VI). В некото-7 021526 рых вариантах предложенная композиция представляет собой мультикомплексную смесь, состоящую из не менее двух комплексов (или их фармацевтически приемлемых солей или сольватов), имеющих формулы согласно любым формулам (I)-(VI). Мультикомплексная смесь может содержать один, два, три,четыре, пять или шесть соединений согласно формулам (I)-(VI), при условии, что мультикомплексная смесь не представляет собой чистую рацемическую смесь (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2 или чистую рацемическую смесь (1R,2R)-пиро-DACH-4 и (1S,2S)-пиро-DACH-4. Рассматриваемые способы В еще других вариантах комплексы, композиции или и те и другие, описанные выше, могут применяться по отдельности или с другими фармацевтически приемлемыми ингредиентами в способах лечения пролиферативных заболеваний или нарушений (совместно именуемых "заболевания"). Предложенные способы предусматривают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества комплекса или композиции, описанной выше. Субъектом может быть животное, такое как, например, млекопитающее, включая человека. Пролиферативные заболевания, которые рассматриваются как поддающиеся лечению у человека, включают рак яичников, рак яичка, мелкоклеточный рак легкого,немелкоклеточный рак легкого и рак головы и шеи, рак кожи, рак поджелудочной железы, рак молочной железы, колоректальный рак, глиобластому. Предполагается, что в некоторых вариантах комплексы и/или композиции могут использоваться в комбинированных терапиях, включающих параллельное или последовательное лечение известными препаратами на основе платины, такими как цисплатин, карбоплатин и/или оксалиплатин. В дальнейшем предполагается, что комплексы и/или композиции могут применяться для лечения рака, резистентного к лечению одним или несколькими препаратами, выбранными из цисплатина, карбоплатина, оксалиплатина, и/или применяться в комбинации с другими классами лекарственных средств, включающих антимитотики, такие как таксаны, аналоги нуклеозидов, такие как гемцитабин, антибиотики антрациклинового ряда, такие как доксорубицин, или целевые терапии, такие как моноклональные антитела. Как описано здесь, комплексы формул (I)-(VI) проявили такую же эффективность или более высокую эффективность, чем цисплатин и карбоплатин, обеспечивая, таким образом, способ лечения рака для пациентов, которые ранее не имели эффективных альтернатив терапии цисплатином и карбоплатином. Однако, пациенты, которые ранее не проходили терапию цисплатином или карбоплатином, могут получать терапию предложенными комплексами, композициями и способами, описанными здесь. Проведение терапии может быть осуществлено в госпитале или другом медицинском учреждении медицинским персоналом. Комплексы формул (I)-(VI) можно вводить и дозировать в соответствии с надлежащей медицинской практикой, принимая во внимание клиническое состояние отдельно взятого пациента, место и способ введения, режим введения, возраст пациента, пол, вес тела и другие факторы, известные врачу-терапевту. Фармацевтически "терапевтически эффективное количество" в целях, указанных здесь, определяется аспектами, известными в данной области. Количество должно быть эффективным для достижения улучшения, включая, но без ограничения, улучшенный коэффициент выживаемости или более быстрое восстановление, или улучшение или устранение симптомов и других признаков, которые выбраны в качестве соответствующих показателей опытными специалистами в данной области. Предполагается, что комплексы настоящего изобретения могут вводиться животным, включая млекопитающих и человека, по отдельности или в виде композиций. Более того, предполагается, что комплексы формул (I)-(VI) можно вводить в течение расширенного терапевтического окна. В качестве одного иллюстративного примера предполагается, что один или несколько предложенных комплексов можно вводить в виде одной или нескольких доз от 5 до 50 мг/кг; или же от 10 до 50 мг/кг; или же от 20 до 50 мг/кг; или же от 30 до 50 мг/кг; или же от 40 до 50 мг/кг; или же от 45 до 50 мг/кг. Конечно, опытный специалист должен учесть,что терапевтические дозы могут изменяться в зависимости от вводимого комплекса, композиции и субъекта, получающего вводимый комплекс или композицию. Таким образом, рассматриваются терапевтические дозы больше чем 50 мг/кг, также как терапевтические дозы меньше чем 5 мг/кг. Дозы могут быть однократными дозами или множественными дозами, вводимыми в течение периода в несколько дней. В качестве иллюстративного примера предполагается, что комплексы формул (I)-(VI) можно вводить в виде одной, двух, трех, четырех, пяти, шести или более доз в течение нескольких дней. Кроме того, предполагается, что комплексы можно вводить непрерывно в течение одного или более дней, например, с помощью помпы или капельницы. В другом иллюстративном примере предполагается, что комплексы можно вводить в течение одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более дней. В способе лечения комплексы формул (I)-(VI) можно вводить различными способами. Следует отметить, что их можно вводить в виде комплекса и можно вводить отдельно в водном растворе, используя преимущество превосходной растворимости этих комплексов, или в качестве действующего ингредиента в комбинации с фармацевтически приемлемыми носителями, разбавителями, адъювантами и растворителями. Предполагается, что комплексы можно вводить перорально, подкожно или парентерально, включая внутривенное, внутриартериальное, внутримышечное, интраперитонеальное, интратонзилярное и интраназальное введение, а также интратекальные и инфузионные методы введения. Импланты комплек-8 021526 сов также могут быть полезными. В случае парентерального введения комплексы формул (I)-(VI) могут быть составлены в виде стандартной лекарственной инъецируемой формы (напр., раствора, суспензии, эмульсии). Фармацевтические составы, подходящие для инъецирования, включают стерильные водные растворы или дисперсии и стерильные порошки для восстановления в стерильных инъекционных растворах или дисперсиях. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол(например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и подобные), их подходящие смеси и растительные масла. Подходящую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддерживания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Неводные носители, такие как хлопковое масло, кунжутное масло,оливковое масло, соевое масло, кукурузное масло, подсолнечное масло или арахисовое масло и сложные эфиры, такие как изопропилмиристат, могут также использоваться в качестве систем растворителей для композиций. Дополнительно могут использоваться различные добавки, которые повышают стабильность, стерильность и изотоничность композиций, включая антибактериальные консерванты, антиоксиданты, хелатирующие агенты и буферы. Предотвращение действия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми агентами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и подобными. Во многих случаях желательно включение изотонических агентов, например сахаров, хлорида натрия и подобных. Продолжительная абсорбция инъецируемых фармацевтических форм может быть обусловлена использованием агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина. Тем не менее, любой используемый носитель, разбавитель или добавка должны быть совместимыми с комплексами фосфаплатины. Стерильные инъецируемые растворы могут быть приготовлены путем введения комплексов фосфаплатины в требуемое количество соответствующего растворителя с одним или несколькими другими ингредиентами, при необходимости. Фармакологический состав, содержащий фосфаплатины, можно вводить пациенту в виде инъеционного состава, содержащего любой совместимый носитель, такой как различные растворители, адъюванты, добавки и разбавители; или же комплексы фосфаплатины можно вводить пациенту парентерально в форме подкожных имплантов с медленным высвобождением или систем целевой доставки, таких как моноклональные антитела, векторная доставка, ионтофоретические, полимерные матрицы, липосомы и микросферы. Много других таких имплантов, систем доставки и модулей хорошо известны опытным в данной области специалистам. Примеры Лучшее понимание описанных вариантов будет достигнуто при обращении к следующим иллюстративным примерам, и опытному специалисту в данной области будет понятно, что изложенные примеры не являются ограничением настоящего изобретения. Пример 1. Синтез (1R,2R)-пиро-DACH-2 [формула (I)]. В качестве исходного материала для формирования комплекса платины(II), цис-дииодо- или цисдихлор-(транс-(1R,2R)-(-)-1,2-циклогександиамин)платину(II) получали путем взаимодействия K2PtI4 или более предпочтительно K2PtCl4, соответственно, с (1R,2R)-(-)-1,2-циклогександиамином. Затем цисдииодо-(1R,2R)-(-)-1,2-циклогександиамин)платину(II) или предпочтительно цис-дихлор-(1R,2R)-(-)-1,2 циклогександиамин)платину(II) растворяли с натрия пирофосфат декагидратом в дистиллированной воде, рН 8, и полученную смесь инкубировали при 40C в течение 15 ч. После инкубационного периода раствор концентрировали путем выпаривания на ротарном испарителе и фильтровали для удаления любого непрореагировавшего исходного материала. Быстрое понижение рН приблизительно до 1,0 путем добавления 1N азотной кислоты вызывало осаждение продукта. Осаждение завершали путем охлаждения примерно до 0C, продукт выделяли путем вакуумной фильтрации и промывали холодной водой и ацетоном. Синтез позволил получить энантиомерно чистый (1R,2R)-пиро-DACH-2. Пример 2. Синтез (1S,2S)-пиро-DACH-2 [формула (II)]. Энантиомерно чистую (1S,2S)-1,2-циклогександиамин(пирофосфато)платину(II) получали способом, аналогичным описанному в примере 1, за исключением того, что цис-дииод- или цис-дихлор-(транс(1S,2S)-(+)-1,2-циклогександиамин)платину(II) использовали в качестве исходного материала вместо цис-дииод- или цис-дихлор-(транс-(1R,2R)-(-)-1,2-циклогександиамин)платины(II) соответственно. Синтез позволил получить энантиомерно чистый (1S,2S)-пиро-DACH-2. Пример 3. Синтез (1R,2R)-пиро-DACH-4 [формула (IV)]. Исходный материал из примера синтеза 1, т.е. цис-дииодо- или цис-дихлор-(транс-(1R,2R)-(-)-1,2 циклогександиамин)платину(II) и натрия пирофосфат декагидрат растворяли в дистиллированной воде,рН 8, и полученную смесь инкубировали при 40C в течение 15 ч. После инкубационного периода в реакционную смесь добавляли аликвоту 30% Н 2 О 2 и реакционную смесь оставляли для протекания реакции еще в течение 3 ч. Раствор затем концентрировали путем выпаривания на ротарном испарителе и фильтровали для удаления любого непрореагировавшего исходного материала. Быстрое понижение рН приблизительно до 1,0 путем добавления 1N азотной кислоты вызывало осаждение продукта. Осаждение завершали охлаждением примерно до 0C, продукт выделяли путем вакуумной фильтрации, и промывали холодной водой и ацетоном. Синтез позволил получить энантиомерно чистый (1R,2R)-пиро-DACH-4. Пример 4. Синтез (1S,2S)-пиро-DACH-4 [формула (V)]. Энантиомерно чистую (1S,2S)-1,2-циклогександиамин-транс-дигидроксо(пирофосфато)платину(IV) готовили способом, аналогичным описанному в примере синтеза 3, за исключением того, что исходный материал из примера синтеза 2, т.е. цис-дииод- или цис-дихлор-(транс-(1S,2S)-(+)-1,2-циклогександиамин)платину(II) использовали в качестве исходного материала вместо цис-дииод- или цис-дихлор(транс-(1R,2R)-(-)-1,2-циклогександиамин)платины(II) соответственно. Синтез позволил получить энантиомерно чистый (1S,2S)-пиро-DACH-4. Пример 5. Синтез цис-пиро-DACH-2 [формула (III)]. В колбе с круглым дном емкостью 500 мл, оснащенную мешалкой, натрия пирофосфат декагидрат(0,400 г) растворяли в дистиллированной воде (250 мл). Затем рН раствора доводили до 8,0 с помощью 2 М азотной кислоты. Затем раствор помещали в водяную баню при 40C и перемешивали магнитной мешалкой. Затем в перемешиваемый раствор добавляли цис-дихлор-(цис-1,2-циклогександиамин) платину(II) (0,100 г, 0,26 ммоль). Смесь оставляли для взаимодействия в течение 15 ч, и затем растворитель выпаривали при 48C в вакууме до объема 5 мл. Затем смесь пропускали через фильтровальную бумагу,и раствор собирали в 10 мл колбу, снабженную мешалкой. Колбу помещали в ледяную баню, помещенную на платформу мешалки, и при осторожном перемешивании рН регулировали от начального значения 6,5 до 2,0 с помощью 2N азотной кислоты. После понижения рН происходило медленное образование осадка. Перемешивание продолжали еще в течение 5 мин, после чего суспензию фильтровали через стеклянный фильтр средней пористости, который держали на льду перед использованием. Затем твердое вещество промывали холодной водой (2 порции по 5 мл) и холодным ацетоном (2 порции по 5 мл) и фильтр оставляли в десикаторе на ночь. Это позволило получить светлый желтый порошок (0,077 г, 0,16 ммоль, 60% выход). Пример 6. Синтез цис-пиро-DACH-4 [формула (VI)]. В колбе с круглым дном емкостью 500 мл, оснащенную мешалкой, натрия пирофосфат декагидрат(0,400 г) растворяли в дистиллированной воде (250 мл). Затем рН раствора доводили до 8,0 с помощью 2 М азотной кислоты. Затем раствор помещали в водяную баню при 40C и перемешивали магнитной мешалкой. Затем в перемешивающийся раствор добавляли цис-дихлор-(цис-1,2-циклогександиамин) платину(II) (0,100 г, 0,26 ммоль). Смесь оставляли для взаимодействия в течение 15 ч, добавляли 3 мл 30% (мас./мас.) Н 2 О 2 и оставляли еще на три часа. Затем растворитель выпаривали при 48C в вакууме до объема 5 мл. Затем смесь пропускали через фильтровальную бумагу, и раствор собирали в 10 мл колбу,снабженную мешалкой. Колбу помещали в ледяную ванну над плитой мешалки и при осторожном перемешивании регулировали рН от начального значения 6,5 до 2,0 с помощью 2N азотной кислоты. После понижения рН происходило медленное образование осадка. Перемешивание продолжали еще в течение 5 мин, после чего суспензию фильтровали через стеклянный фильтр средней пористости, который держали на льду перед его использованием. Затем твердое вещество промывали холодной водой (2 порции по 5 мл) и холодным ацетоном (2 порции по 5 мл) и фильтр оставляли в десикаторе на ночь. Это позволило получить белый порошок (0,120 г, 0,23 ммоль, 88% выход). Пример 7. Свойства фосфаплатинов. Все фосфаплатины, синтезированные в соответствии с изложенными выше примерами синтеза, показали растворимость больше чем 40 мМ/л в водном растворе при нейтральном рН в PBS и бикарбонатном буфере. (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4, в частности, показали значительную стабильность при нейтральном рН в водном растворе. Как правило, разложения не наблюдали в течение семи дней после растворения фосфаплатиновых соединений в воде и контролировали с помощью 31 РЯМР спектроскопии. Соединения, приготовленные согласно примерам синтеза, представленным выше, характеризовали с помощью спектроскопии кругового дихроизма (CD) для определения конфигурации изомеров и с помощью 31 Р-ЯМР и масс-спектрометрии для определения состава. Снимали дополнительный спектр CD рацемической смеси транспиро-DACH-2, приготовленной согласно способам, описанным в патенте США 7700649. Спектр CD регистрировали в фосфатном буфере (50 мМ) при рН 6.8. (1R,2R)- и (1S,2S)-формы пиро-DACH-2 и пиро-DACH-4 показали связанные с хиральностью оптические активности, но рацемическая смесь (транспиро-DACH-2) и цис-изомеры обоих, пиро-DACH-2 и пиро-DACH-4, не показали каких-либо пиков CD.CD-спектры показаны на фиг. 1, где числа в скобках относятся к соединению формулы, соответствующей числу в скобках. Концентрации анализируемых соединений составили: (I), 2,7 мМ; (II), 2,5 мМ;(III), 1,3 мМ; (IV), 3,5 мМ; (V), 2,9 мМ; (VI), 2,7 мМ; и транспиро-DACH-2, 3,5 мМ. Пример 8. Эффективность in vitro и анализ выживаемости клеток (клоногенный анализ). Для определения относительных активностей фосфаплатинов формул (I)-(VI) каждый стереоизомер тестировали с применением клоногенного клеточного анализа in vitro с использованием клеток рака яич- 10021526 ников человека, клеток колоректального рака человека и клеток рака головы и шеи человека. Клетки рака яичников человека, А 2780 и А 2780/С 30 (кросс-резистентные к 30 мкМ цисплатина и 100 мкМ карбоплатина) получали от компании Dr. Thomas Hamilton (Fox Chase Cancer Center, Philadelphia, PA). Клетки культивировали в монослое в среде RPMI 1640, дополненной 10% фетальной бычьей сывороткой, 2 мМ глутамином, 0,25 ед/мл инсулина и пенициллином/стрептомицином (100 ед/мл) в инкубаторе при 37C при непрерывной продувке 5% СО 2. Клетки пересевали с использованием 0,0625% раствора трипсина вHBSS для поддержания клеток в экспоненциальной фазе клеточного роста. Величины половинной максимальной ингибирующей концентрации (IC50) определяли с применением клоногенного анализа или анализа клеточной пролиферации CyQUANT. В клоногенном анализе,например, 500-700 клеток А 2780 из суспензии одиночных клеток высевали на чашки Петри диаметром 60 мм за 24 ч до обработки платиновыми соединениями для клеточного связывания. В день обработки платиновыми соединениями, описанными выше в примерах синтеза, среду декантировали и заменяли соединениями фосфаплатины в соответствующих концентрациях (от 50 нМ до 75 мкМ) в три разных момента времени, и обработанные клетки помещали обратно в инкубатор при 37C на 24 ч. Планшеты в трех повторностях ставили для каждой концентрации платинового соединения. После 24 ч обработки среду, содержащую платиновые соединения, декантировали и заменяли свежей средой. Эти планшеты возвращали в инкубатор при 37C на 7 дней для колониеобразования. В анализе пролиферации клеток CyQUANT значения IC50 определяли путем измерения содержания ДНК с использованием набора CyQUANT Cell Proliferation Assay Kit (Invitrogen), который содержит зеленый флуоресцентный краситель, который проявляет высокую интенсивность флуоресценции при присоединении к клеточной ДНК. В этих экспериментах требуемое количество клеток подвергали воздействию фосфаплатинов в различных концентрациях в течение 72 ч перед измерением содержания ДНК. Так как содержание ДНК пропорционально числу выживающих клеток, анализ может обеспечить количественное измерение пролиферирующих клеток. Методика описана подробно в Jones et al., "Sensitive determination of cell number using the CyQUANT cell proliferation assay," J. Immunol. Methods, vol. 254,pp. 85-98 (2001). Данные по IC50 на основании клоногенных анализов и/или анализов пролиферации клеток CyQUANT приведены в табл. 1-5. В табл. 1-5, за исключением мест, где указаны величины фактической погрешности, для каждого представленного значения допускается погрешность не больше чем 15% от указанного значения; и если не указано иначе, данные получены на основании клоногенных анализов. Таблица 1. Значения IC50 для фосфаплатиновых соединений в отношении клеточных линий рака яичников человека: А 2780, эпителиальный рак яичников человека; и А 2780/С 30, эпителиальный рак яичников человека, резистентный к 30 мкМ цисплатине и 100 мкМ карбоплатине Таблица 2. Значения IC50 для фосфаплатиновых соединений в отношении клеточных линий рака яичников человека: OVCAR-10, рак яичников человека, резистентный к терапии цисплатином; и OVCAR-5,клетки прогрессирующего рака яичников человека Таблица 3. Значения IC50 для фосфаплатиновых соединений в отношении клеточных линий рака головы и шеи человека: USMCC10b, клеточная линия рака головы и шеи человека; и UMSCC-10b/15s, клеточная линия рака головы и шеи человека, резистентная к цисплатину Таблица 4. Значения IC50 для фосфаплатиновых соединений в отношении клеточных линий колоректального рака (НТ-29) Таблица 5. Значения IC50 для фосфаплатиновых соединений в отношении раковых клеточных линий человека: А 459, клеточные линии аденокарциномы легкого человека; U251, клетки глиобластомы человека; РС-3, клетки метастатического колоректального рака человека; SKMEL-2, раковые клетки меланомы кожи человека; MCF-7, клетки рака молочной железы человека; OVCAR-8, клетки рака яичников человека с дисфункцией р 53; и OVCAR-10, рак яичников человека, резистентный к терапии цисплатином, все определенные с помощью технологии CyQUANT, описанной выше, которая напрямую измеряет содержание ДНК путем измерения флуоресцентных сигналов при интеркаляции Дополнительно, данные изомерные соединения также тестировали путем их воздействия в течение 144 ч на следующие клеточные линии: UMSCC10b, Panc-1, UMSCC15s, A2780/C30 и НСС 1806. Изомер(1R,2R)-пиро-DACH-2 проявил удивительно превосходную активность по сравнению с рацемическим транспиро-DACH-2. Например, (1R,2R)-пиро-DACH-2 показал значение IC50 1,7 (мкМ) по сравнению со значением IC50 18,5 (мкМ) для рацемического транспиро-DACH-2 в клеточной линии рака поджелудочной железы Panc-1; (1R,2R)-пиро-DACH-2 показал значение IC50 0,3 (мкМ) по сравнению со значением IC50 8,9 (мкМ) для рацемического транспиро-DACH-2 в клеточной линии рака головы и шеиUMSCC10b; и (1R,2R)-пиро-DACH-2 показал значение IC50 9,7 (мкМ) по сравнению со значением IC50 30 (мкМ) для рацемического транспиро-DACH-2 в клеточной линии рака молочной железы НСС 1806. Среди транс-изомеров, клоногенные анализы показали гораздо лучшую активность изомеров(1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4 по сравнению с рацемическими смесями транспироDACH-2 и транспиро-DACH-4, соответственно. Например, было обнаружено, что значение IC50 составило 18015 мкМ при действии транспиро-DACH-4 на клетки рака яичников человека (А 2780) в течение часа; тогда как IC50 для этой же клеточной линии составило 4010 мкМ для (1R,2R)-пиро-DACH4 под действием иных идентичных экспериментальных условий (табл. 1). Расширенные действия(1R,2R)-изомеров на различные раковые клеточные линии человека позволили получить гораздо более низкие значения IC50, что указывает на возможность использования этих соединений в качестве эффективных противораковых средств. Например, (1R,2R)-пиро-DACH-2 имеет значение IC50 500 нМ (0,5 мкМ) по данным клоногенного анализа для клеток яичников человека и 2 мкМ для резистентного рака головы и шеи человека. Оба энантиомерно чистых соединения, (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2, показали одинаковую активность в пределах экспериментальной ошибки, когда клетки А 2780 подвергали воздействию в течение не менее 24 ч. Но когда клетки подвергали воздействию в течение более короткого пе- 13021526 риода времени, например, 1 часа, наблюдались различные активности (1R,2R)- и (1S,2S)-форм. (1R,2R)формы показали превосходную активность по сравнению с (1S,2S)-изомером при более коротком времени воздействия, что указывает на более быстрое поглощение (1R,2R)-изомера клетками. Более высокие значения IC50 для рацемических форм по сравнению с (1R,2R)- или (1S,2S)-формой может указывать на самоассоциацию двух форм, которые возможно поглощаются клетками с пониженной скоростью. В отношении de novo, резистентного к цисплатину рака яичников человека (OVCAR-10), (1R,2R)пиро-DACH-2 проявил лучшую in vitro эффективность, чем (1S,2S)-пиро-DACH-2. Примечательно, что(1R,2R)-пиро-DACH-2 проявил значительно лучшую активность по сравнению с цисплатином в клеточных линиях рака яичников человека OVCAR-10 (табл. 2 и 5) и OVCAR-8 (табл. 5). Цис-изомер проявил превосходную активность в отношении рака яичников человека (А 2780) по сравнению с другими соединениями. Например, цис-пиро-DACH-2 и цис-пиро-DACH-4 показали значения IC50 300 нМ и 4 мкМ соответственно после воздействия на клетки А 2780 в течение 24 ч по сравнению с 1,0 мкМ и 18 мкМ соответственно, соответствующих форм (1R,2R)-пиро-DACH-2 или (1R,2R)пиро-DACH-4. Следует отметить, что цисплатин и карбоплатин обеспечили гораздо более высокие значения IC50, т.е. 5.0 мкМ и 60 мкМ соответственно при аналогичных условиях. Без желания быть привязанными или ограниченными какой-либо теорией, предполагаемый химический принцип говорит о том, что значение IC50 рацемических форм должен быть равен среднему арифметическому соответствующих значений IC50 (1R,2R)-изомера и (1S,2S)-изомера. Однако, как показано в табл. выше, значение IC50 рацемической формы (например, пиро-DACH-2 в А 2780) гораздо выше,чем предполагаемое на основе смеси 50/50 (1R,2R)-энантиомера и (1S,2S)-энантиомера. Эти данные предполагают, что рацемические формы менее сильные, чем предполагалось, на основе энантиомерного распределения по неизвестным причинам. Одним правдоподобным объяснением может являться то, что рацемические формы самоассоциируются и, следовательно, не эффективно поглощаются клетками. В других тестах клетки обрабатывали платиновыми соединениями непрерывно в течение 7 дней. Колонии фиксировали и окрашивали 2% кристаллическим фиолетовым в 4% формальдегиде. Колонии,содержащие больше чем 50 клеток, подсчитывали. Количество подсчитанных колоний из планшетов в трех повторностях усредняли, и это число делили на количество высеянных клеток для получения значения доли клеток, формирующих колонии. Эти величины доли клеток, формирующих колонии, затем корректировали на эффективность засевания путем деления доли на количество клеток, формирующих колонии в планшетах, которые не были обработаны платиновыми соединениями. Данные по формированию колонии с А 2780 показаны на фиг. 2. Следует отметить, что оба энантиомера, (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2, показали почти одинаковые значения IC50 1,00,1 мкМ для (1R,2R) и 1,1 0,1 мкМ для (1S,2S), тогда как рацемическая смесь показала гораздо более высокое значение IC50 2,40,2 мкМ, что указывает на более низкую эффективность рацемической смеси. Аналогичные данные для(RD4), транспиро-DACH-2 (T-D2) и транспиро-DACH-4 (T-D4). Клинические исследования показали, что (1R,2R)-энантиомер оксалиплатина на примере такого же 1,2-диаминоциклогексанового носителя лиганда в оксалиплатине, который присутствует в фосфаплатинах, описанных здесь, проявляет превосходную эффективность по сравнению с другими стереоизомерами оксалиплатина. В противоположность оксалиплатину, все три пирофосфато-изомеры (т.е. (1R,2R)-,(1S,2S)- и цис) обоих, пиро-DACH-2 и пиро-DACH-4, являются очень активными в отношении различных типов рака. Однако оказалось, что универсальной тенденции не существует. Например, как подробно описано выше, (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2 показали почти равные значения IC50 в отношении раковых клеток человека А 2780 при воздействии этих соединений на клетки в течение 24 ч,тогда как для de nova, резистентного к цисплатину рака яичников человека (OVCAR 10), (1R,2R)-пироDACH-2 показал лучшую in vitro эффективность. С другой стороны, (1S,2S-пиро-DACH-4 показал превосходную активность по сравнению с (1R,2R)-пиро-DACH-4 в клетках рака яичников человека. Цисизомеры пиро-DACH-2 и пиро-DACH-4 проявили превосходную активность в отношении рака яичников человека (А 2780) по сравнению с транс-изомерами. Таким образом, данные в целом показывают, что некоторые конкретные виды рака можно лечить конкретными изомерами в более низких дозах по сравнению с рацемическими формами, избегая токсичности, вызванной другими изомерами, которые будут присутствовать в рацемических формах. Пример 9. Мониторинг сверхэкспрессии Fas методом иммунофлуоресценции. 6-Луночный планшет со свободными предварительно обработанными покровными стеклами засевали клетками рака яичников человека, А 2780 и А 2780/С 30 (перекрестно-устойчивые к 30 мкМ цисплатина и 100 мкМ карбоплатину), полученными от компании Dr. Thomas Hamilton (Fox Chase CancerRPMI 1640, дополненной 10% фетальной бычьей сывороткой, 2 мМ глутамином, 0,25 единиц/мл инулина и пенициллином/стрептомицином (100 единиц/мл) (Fisher Scientific, Pittsburg, PA) в инкубаторе при 37C при непрерывной продувке 5% СО 2. Клетки при 70% конфлюэнтности обрабатывали одним из фосфаплатиновых соединений из приме- 14021526 ров синтеза, представленных выше, в течение 1 ч. Планшеты затем осторожно отмывали дважды ледяным фосфатно-солевым буфером (PBS), заменяли стандартной средой и инкубировали дополнительно в течение 1 ч при 37C с продувкой 5% СО 2. Покровные стекла отмывали дважды PBS и клетки обрабатывали свежеприготовленным 1% формальдегидом и затем инкубировали при комнатной температуре в течение от 5 до 7 мин. Фиксированные клетки отмывали три раза PBS и блокировали 2% FBS/PBS при 4C в течение 30 мин с последующим отмыванием клеток три раза PBS по 5 мин. Отдельные покрывные стекла удаляли и переворачивали на 100 мкл первичного FAS-антитела в разбавлении 1:100 (Cell Signaling Technology Inc., Danvers, MA) в 5% БСА/1% молоко/PBS на поверхности Parafilm в течение 1 ч при комнатной температуре. Затем покровные стекла переносили обратно в чистый 6-луночный планшет для последовательного отмывания, а именно трех отмывок PBS, каждая в течение 5 мин. Покровные стекла переворачивали второй раз на другую чистую поверхность Parafilm и инкубировали с 100 мкл вторичного FITC-антитела в разбавлении 1:500 в 5% БСА/1% молоко/PBS в течение 1 ч при комнатной температуре. Затем покровные стекла отмывали три раза PBS по 5 мин. После этого влажные покрывные стекла монтировали на предметном стекле микроскопа с помощью среды Ultracruz с DAPI (4',6-диамидино-2-фенилиндол) (Santa Cruz Biotechnology, Santa Cruz, CA) для идентификации ядер клеток. Микроскоп представлял собой флуоресцентный микроскоп с увеличениями 10,40 и 100. Пример 10. Вестерн-блоттинг/иммунное окрашивание для определения уровня экспрессии белка. После электрофореза (12% SDS-PAGE) белки переносили на PVDF мембрану при напряжении 100 В в течение 1,5 ч при 4C. Мембраны отмывали в растворе, содержащем TBS и 0,05% Твин-20 (TBST), и блокировали 5%-ным раствором обезжиренного молока и 1% БСА. Мембраны инкубировали с первичным антителом, специфичным к интересующему белку, в разведении 1:25000 в течение ночи при 4C. Мембраны отмывали в 0.05% TBST с последующей инкубацией в соответствующем HRP конъюгате антитела с пероксидазой хрена (разведение 1:40000). Белки визуализировали с использованием системыECL-Advance chemiluminescent system (Amersham-GE Healthcare Biosciences, Pittsburg, PA). Фосфаплатины активируют ряд проапоптотических и опухоль-супрессирующих генов, таких какFAS, PTEN, PUMA, BAX и другие. Эксперименты методом вестерн-блоттинга подтверждают высокие уровни экспрессии белка, транскрибированные этими генами. Например, мыши, обработанные транс-пиро-DACH-4, проявляют повышающее регулирование FAS (вплоть до 25-кратного), ВАХ (вплоть до 4 кратного), PUMA (вплоть до 5-кратного), и понижающее регулирование VEGFR (до 50%) при воздействии транспиро-DACH-4 в течение от 1 до 12 ч. Аналогично, RR-пиро-DACH-2 и RR-пиро-DACH-4 показали понижающее регулирование BCL2 до 70%. К тому же, FAS, FADD и платиновое соединение были солокализованы в липидных рафтах. Кроме того, эти активации ассоциированы с увеличенной экспрессией сфингомиелиназы (Smase), как определено по повышенной экспрессии белка SMase. Сфингомиелин гидролизуется при действии фермента сфингомиелиназы (Smase) до церамида и фосфорилхолина. В стандартном эксперименте раковые клетки (1106) подвергаются действию (1R,2R)пиро-DACH-2 или (1R,2R)-пиро-DACH-4 (10 мкМ) в разные интервалы времени (от 5 мин до 2 ч). Клетки центрифугировали, и клеточный лизат собирали и отмывали холодным PBS. Набор реагентов Amplexred (Invitrogen) использовали для мониторинга активности Smase. Анализы выполняли согласно рекомендуемым протоколам, входящим в набор. Как правило, 11 мкл клеточного лизата суспендировали в 50 мМ натрий-цитратном буфере (рН 5,0) на 96-луночном планшете, и в каждую лунку добавляли сфингомиелин (5,0 мМ). Образцы инкубировали в течение 1 ч при 37C. После инкубации в каждую лунку добавляли 100 мкл реакционного раствора Amplex Red, содержащего 100 мМ Tris-HCl (100 мкМ), пероксидаз хрена Amplex Red (2 ед/мл, 0,2 ед/мл холиноксидазы и 8 ед/мл щелочной фосфатазы (рН 8,0). Образцы затем инкубировали в течение 30 мин при 37C. Интенсивность флуоресценции измеряли при 590 нм с использованием длины волны возбуждения от 530 нм до 560 нм. Значения флуоресценции для лунок,содержащих контрольные образцы (необработанные), вычитали из значения, полученного для каждого образца. Пример 11. Определение содержания платины в липидном рафте. Количественное содержание платины измеряли на спектрометре Graphite Furnace Atomic AbsorptionSpectrometer (Perkin Elmer AA-600) из калибровочных кривых, построенных с помощью платинового стандарта (Perkin Elmer, Waltham, MA) в 0,1% HNO3. Обработанные фосфаплатином клетки промывали 1 мл ледяного PBS и полным коктейлем ингибиторов протеазы PI (Pierce, Rockford, IL) 4 раза, и клеточный дебрис собирали путем центрифугирования при 4C при 1000 хг между каждым промыванием. Клеточную массу восстанавливали в 250 мкл PBS/PI, и содержание белка измеряли с использованием анализаMicro BCA (Pierce, Rockford, IL). Бычий сывороточный альбумин (БСА), приготовленный в разных концентрациях, использовали для построения стандартной кривой. Количественно определенные образцы белка расщепляли в концентрированной HNO3 в течение 4 ч с последующей обработкой 30% Н 2 О 2 в течение 1 ч перед анализом. Пример 12. Исследование токсичности у мышей линии SCID. 4-5-Недельных самок мышей линии SCID (c.b-17/LCR-Prkdc(SCID)/Crl, Strain Code 236', CharlesRiver Labs, Wilmington, MA) акклиматизировали в течение одной недели перед инициированием испытаний токсичности. Мышам инъецировали интраперитонеально (i/p) через шприцы со стерильными иглами 26 100 мкл одного из фосфаплатиновых соединений, описанных выше в примерах синтеза, в стерильном фильтрованном PBS. Дозы инъекций изменялись от 5 до 60 мг/кг и вводились один раз на день 1,один раз на день 3 и один раз на день 5. Для оценки токсичности фосфаплатиновых соединений каждый день записывали побочные реакции(т.е. 20% потеря веса и/или изменение в потреблении пищи, отклонение от нормального поведения,другие показатели здоровья или гибель). Частоту и тяжесть возникновения побочных реакций у мышей,инъецированных фосфаплатиновыми соединениями, сравнивали с контрольными группами мышей. Контрольным группам делали ложную инъекцию (в качестве контроля стрессовой реакции) или инъекцию,состоящую из PBS (носителя). Две группы мышей обрабатывали коммерчески доступными платиновыми соединениями для сравнения в дозах, основанных на ранее опубликованных данных (т.е. цисплатин при 12 мг/кг и карбоплатин при 60 мг/кг), для сравнения с фосфаплатиновыми соединениями. В конце исследования всех мышей анестезировали с помощью 358 мг/кг авертина, и отбирали кровь путем пункции сердца, используя туберкулиновый шприц с иглой 26. Таким образом, мышей подвергали эвтаназии путем обескровливания под анестезией. После эвтаназии органы, включая печень, селезенку, сердце, легкое, яичники и почки отбирали, фиксировали в 10% формалине и заливали в парафин для гистопатологического исследования. Изменения в характеристиках ткани исследовались опытным патологоанатомом. Мышей SCID с опухолью яичников обрабатывали транспиро-DACH-2 и транспиро-DACH4 в разных дозах до 40 мг/кг и рост опухоли контролировали до шести недель или до тех пор, пока размер опухоли не становился таким большим, что этих животных умерщвляли. Рост или регрессию опухоли у обработанных фосфаплатином мышей затем сравнивали с мышами, обработанными цисплатином (7 мг/кг), и мышами, обработанными карбоплатином (60 мг/кг). Три дозы платиновых соединений вводили через день, когда опухоль вырастала до размера не менее 100 мм 3. Индексы Gross log cell Kill и Net logGross Log cell Kill = T - C/(3.32 Td),Net Log cell Kill = (T - С - продолжительность лечения)/3.32 Td,где Т и С представляют собой мембранное значение времени роста опухоли до конкретного размера и Td представляет собой мембранное значение времени в днях, необходимое для увеличения вдвое опухоли у контрольных животных. Было обнаружено, что значения gross log cell kill, записанные для режимов, состоящих из трех доз,больше чем 3 и значения net log cell kill больше, чем 2 при дозе 40 мг/кг. Напротив, мыши, обработанные цисплатином (7 мг/кг), несмотря на то, что показали регрессию опухоли, погибали в течение 7 дней. Мыши, обработанные карбоплатином (60 мг/кг/доза) проявили гораздо меньшие значения log cell kill(меньше чем 2) по сравнению с транспиро-DACH-4. Дальнейшее наращивание дозы карбоплатина было невозможным, так как более 50% популяции погибало при дозе 60 мг/кг На основании in vitro данных полагают, что цис-пиро-DACH-2, цис-пиро-DACH-4, (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4 в особенности будут проявлять большую эффективность по сравнению с рацемическим транспироDACH-4. Пример 13. In vivo эффективность в отношении клеточной линии рака яичников А 2780. Стабильные клональные клеточные линии рака яичников А 2780 культивировали в клеточной культуре до достижения 80-90% конфлюэнтности. Трипсин (GIBCO/BRL, Grand Island, NY) использовали для открепления прилипших клеток. Обработанные трипсином клетки тщательно отмывали фосфатносолевым буфером (PBS) для удаления трипсина. Эффективность фосфаплатиновых соединений оценивали с использованием рака яичников человека А 2780 с помощью подкожного ксенотрансплантата у мышей SCID Hairless OutBred, SHO-PrkdcscidHrhr, (Charles River Labs, Wilmington, MA). 4-5-Недельных самок мышей SCID акклиматизировали в течение одной недели перед инициированием испытаний эффективности. Раковые клетки ресуспендировали в PBS и всех мышей, за исключением негативных контрольных мышей, инъецировали подкожно от 1106 клеток/0,10 мл до 5106 клеток/0,10 мл в PBS и оценивали на опухоли как функцию времени с использованием шприцев со стерильными иглами 26. Мышей исследовали ежедневно на рост опухоли. Опухоли измеряли с использованием цифровых калиптеров. Объем опухоли рассчитывали по формуле (W2L)/2, где W представляет собой длину перпендикулярной оси и L представляет собой длину самой длинной оси, при этом объем опухоли в мм 3 равен массе в мг. После приблизительно 2 недель подкожного инъецирования раковых клеток, после достижения опухолями измеряемых размеров (приблизительно 100-200 мм 3) инициировали введение фосфаплатинового соединения или контроля. Мышам вводили фосфаплатиновые соединения интраперитонеально один раз на день 1, снова один раз на день 3 и снова один раз на день 5. Каждую группу ксенотрансплантантных мышей обрабатывали фосфаплатиновыми соединениями, и подобранный комплект обрабатывали носителем/плацебо (раствор PBS) и ложными инъекциями (в качестве контроля реакции на стресс). К тому же, две группы мышей обрабатывали коммерчески доступными платиновыми соединениями для сравнения с фосфаплатиновыми соединениями в дозах на основе ранее опубликованных данных (т.е. цисплатин при 12 мг/кг и карбоплатин при 60 мг/кг). Ксенотрансплантат мышей SCID контролировали каждый день на любое побочное событие в их здоровье путем измерения потери веса/наращивания веса и потребления пищи. Измерения прекращали, и исследование завершали при достижении размера опухоли более 3000 мм 3. В конце исследования мышей анестезировали с помощью 358 мг/кг авертина и отбирали кровь путем пункции сердца с использованием туберкулинового шприца с иглой 26. Соответственно, мышей умерщвляли путем обескровливания под анестезией. После эвтаназии органы, включая печень, селезенку, сердце, легкое, яичники и почки,отбирали, фиксировали в 10% формалине и заливали в парафин для гистопатологического исследования. Изменения в характеристиках ткани исследовались опытным патологоанатомом. Данные по эффективности (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4 в отношении рака яичников человека А 2780 в модели мышиного ксенотрансплантата (иммунокомпроментированные мышиNIH III) приведены на фиг. 4. Во время испытания мышей обрабатывали через день в течение трех дней("qodx3") - однократно на день 1, однократно на день 3 и однократно на день 5. В частности, мышей обрабатывали 40 мг/кг (1R,2R)-пиро-DACH-2, 10 мг/кг (1R,2R)-пиро-DACH-4 или 5 мг/кг цисплатина. Числа N в надписи на фиг. 4 обозначают количество испытаний, в которых показанные точки на графике получены как средние значения. Данные на фиг. 4 для первых десяти дней обработок (1R,2R)-пироDACH-2 и (1R,2R)-пиро-DACH-4 ясно показали регрессию опухоли за период начальных стадий обработки. Пример 14. In vivo эффективность в отношении рака яичников человека и рака головы и шеи человека. Известно, что рак яичников человека (OVCAR-10) проявляет резистентность к обоим препаратам,цисплатину и карбоплатину. Стабильные клональные клеточные линии рака яичников человека OVCAR10 и рака головы и шеи человека UMSCC10b культивировали по отдельности в клеточной культуре до достижения 80-90% конфлюэнтности. Трипсин (GIBCO/BRL, Grand Island, NY) использовали для отделения прикрепленных прилипших клеток. Обработанные трипсином клетки тщательно отмывали в фосфатно-солевом буфере (PBS) для удаления трипсина. Эффективность фосфаплатиновых соединений оценивали путем подкожного имплантирования ксенотрансплантатов человека OVCAR-10 и UMSCC-10b мышам линии SCID Hairless OutBred, SHO-PrkdcscidHrhr (Charles River Labs, Wilmington, MA), самкам мышей в возрасте 4-х недель линии NIH (NIH III : NIHBNX-F; NIHS-Lystbg Foxnlnu Btkxid, Taconic(Rensselaer, NY. 4-5-Недельных самок мышей линии SCID/N1H акклиматизировали в течение одной недели перед инициированием испытаний эффективности. Раковые клетки ресуспендировали в PBS и всех мышей, за исключением негативных контрольных мышей, инъецировали подкожно от 1106 клеток/0.10 мл до 5106 клеток/0,10 мл в PBS. Размер опухоли оценивали как функцию времени. Мышей исследовали ежедневно на рост опухоли. Опухоли измеряли с использованием цифровых штангенциркулей. Объем опухоли рассчитывали по формуле (W2L)/2, где W представляет собой длину перпендикулярной оси и L представляет собой длину самой длинной оси, при этом объем опухоли в мм 3 равен массе в мг. После приблизительно 2 недель подкожного инъецирования раковых клеток, после достижения опухолями измеряемых размеров (приблизительно 100-200 мм 3) интраперитонеально вводили фосфаплатиновые соединения в требуемых дозах. Эти введения выполняли однократно на день 1, однократно на день 3 и однократно на день 5. Каждую группу ксенотрансплантантных мышей обрабатывали фосфаплатиновыми соединениями, и подобранный комплект обрабатывали носителем/плацебо (раствор PBS) и ложными инъекциями (в качестве контроля реакции на стресс). К тому же, две группы мышей обрабатывали коммерчески доступными платиновыми соединениями для сравнения с фосфаплатиновыми соединениями в дозах на основе ранее опубликованных данных (т.е. цисплатин при 12 мг/кг и карбоплатин при 60 мг/кг). Ксенотрансплантат мышей SCID/NIH контролировали каждый день на любое побочное явление в их здоровье путем измерения потери веса/наращивания веса и потребления пищи. Измерения прекращали, и исследование завершали при превышении размера опухоли 3000 мм 3. По завершении исследования мышей анестезировали с помощью 358 мг/кг авертина и отбирали кровь путем пункции сердца с использованием туберкуилинового шприца с иглой 26. Соответственно мышей умерщвляли путем обескровливания под анестезией. После эвтаназии органы, включая печень,селезенку, сердце, легкое, яичники и почки, отбирали, фиксировали в 10% формалине и заливали в парафин для гистопатологического исследования. Изменения в характеристиках ткани исследовались опытным патологоанатомом. Данные по эффективности (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4 в отношении клеток рака яичников человека OVCAR-10 приведены на фиг. 5 в сравнении с контролем PBS/Bicarb. Дозы вводили(40 мг/кг веса тела) при достижении размера опухоли 100-200 мм 3. Обработанные мыши показали регрессию опухоли за время обработки. Измерения размеров опухоли во времени приведены на фиг. 6 для контроля (PBS/Бикарбонат), вводимого qodx3, карбоплатина в дозе 60 мг/кг, вводимого qodx3, и (1R,2R)пиро-DACH-4 в дозе 40 мг/кг, вводимого qdx3. Интервалы отклонения отражают время (в днях, интерполированное при необходимости), за время которого средний размер опухоли достигал 1000 мм 3. По сравнению с контролем, в то время как карбоплатин проявлял процентное увеличение жизненного цикла(%ILS) только примерно 125%, (1R,2R)-пиро-DACH-4 показал %ILS примерно 209%. Данные по эффективности (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4 в отношении рака головы и шеи человека UMSCC10b приведены на фиг. 7. Дозы вводили qodx3 и/или qdx4, варьируя дозу от 10 мг/кг массы тела до 40 мг/кг массы тела. Данные по эффективности сравнивали с рацемической формой транспиро-DACH-4. Дозы вводили при достижении размера опухоли 100-200 мм 3. Пример 15. Максимально переносимые дозы (1R,2R)-пиро-DACH-2 и (1R,2R)-пиро-DACH-4. Для определения максимально переносимых доз проводили испытания по исследованию токсичности (1R,2R)-пиро-DACH-2, (1R,2R)-пиро-DACH-4, транспиро-DACH-2, транспиро-DACH-4,цисплатина и карбоплатина. Самкам мышей в возрасте 4-5-недель ICR CD-1), Taconic(Rensselaer, NY) вводили дозы с наращиванием от 10 мг/кг до 100 мг/кг. Вес тела мышей составлял от 15 г до 24 г. Мышам инъецировали один из фосфаплатинов через день в режиме трех доз. Общая потеря веса 20% или больше, болезненный вид, отсутствие набора веса, другие аспекты здоровья, отклонение от нормального поведения или гибель считались нежелательными явлениями. При дозах меньше 10 мг/кг потери веса не наблюдалось. При максимальной дозе 40 мг/кг отсутствовала гибель или потери веса больше чем 20% для всех соединений фосфаплатины. Данные результаты можно сравнить с цисплатином, для которого 100% мышей погибало при дозе 12 мг/кг, и с карбоплатином, для которого 33% смертельных исходов наблюдалось при дозе 60 мг/кг. При дозах выше 100 мг/кг все мыши либо теряли более 20% веса, либо погибали в течение пятнадцати дней введения. Пример 16. Количественное определение экспрессии генов методом полимеразной цепной реакции(ПИР) в режиме реального времени. Количественное определение экспрессии некоторых целевых генов осуществляли с использованием полимеразной цепной реакции (ПЦР) в реальном времени. Эндотелиальные клетки рака яичников человека (А 2780) и резистентные к цисплатину клетки (А 2780/С 30) культивировали в среде RPMI 1640 с цисплатином, (1R,2R)-пиро-DACH-4 и транспиро-DACH-4 или без них в течение 0, 3, 12 и 24 ч. Обработанные и необработанные раковые клетки содержали в среде RPMI 1640, дополненной 10% фетальной бычьей сывороткой, 2 мкмоль L-глутамина, 100 ед/мл пенициллина-стрептомицина и 0,25 ед/мл раствора инсулина, при 37C с продувкой 5% СО 2. РНК выделяли из обработанных и не обработанных клеток. Обработанные клетки представляют собой клетки, собранные после подвергания действию фосфаплатина при его значении концентрации IC50 в различные интервалы времени, от трех часов до 24 ч. Образцы РНК обрабатывали с помощью набора DNase-free RNase (QIAGEN Sciences) для удаления ДНК. Затем кДНК синтезировали с использованием набора High Capacity RNA-to-cDNA kit (Applied Biosystems) согласно инструкциям производителя. Концентрацию и чистоту РНК определяли с помощью УФ-спектроскопии (NanoDrop 2000 Thermo Scientific, Wilmington, DE). Минимальный коэффициент поглощения (отношение поглощения, измеренного при 260 нм, к поглощению, измеренному при 280 нм),равный 1.9, использовали в качестве приемлемой чистоты. Образцы выделенной РНК хранили при -80C и подвергали циклам минимального замораживанияоттаивания для поддержания целостности РНК. Дуплексные ПЦР в реальном времени выполняли с использованием наборов Taqman Gene Expression Assays для целевого гена и эндогенного контроля (актин) в этой же реакционной лунке. Эндогенный контроль является зондом, используемым для нормализации целевой мРНК. Данные полимеразные цепные реакции сначала выполняли с использованием различных концентраций кДНК для определения оптимальных концентраций кДНК, требуемых для обнаружения интересующего гена. Целевой ген метили синим красителем (FAM, поглощение: 494 нм,эмиссия: 518 нм), тогда как референсный ген метили зеленым красителем (VIC, поглощение: 538 нм,эмиссия: 554 нм). Концентрации кДНК выбирали таким образом, чтобы значения порогового цикла (Ct) для целевых генов находились между 17 и 32, самых чувствительных для детекции флуоресценции на приборе ABI StepOnePlus, используемом для измерений. Определяли значение порогового цикла (Ct), точки, при которой флуоресценция реакции количественной ПЦР едва превышает пороговую флуоресценцию системы детектирования. Эти значения Ct использовали для сравнения уровней целевых генов и эндогенных контролей. Количественные оценки экспрессии генов представлены в условиях кратного изменения (2-Ct), которые были рассчитаны из значений Ct и Ct согласно уравнениям: Ct = (Ct целевое - Ct референсное) и Ct = (Ct)время Х-(Ct)нулевое время(контроль). Кратная экспрессия для контрольных образцов (необработанных) оставалась равной 1, так как значение Ct = 0 и, следовательно, 2=1. Настоящее описание не должно рассматриваться как ограниченное конкретными примерами и вариантами, описанными здесь, но скорее должно пониматься как охватывающие все аспекты изобретения. Различные модификации, эквивалентные способы, а также многочисленные структуры и устройства, для которых настоящее изобретение может применяться, будут очевидны опытным специалистам в данной области. Опытным специалистам в данной области должно быть понятно, что могут быть сделаны различные изменения без отступления от объема изобретения, которые не должны считаться ограничением вариантов, описанных в изобретении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комплекс фосфаплатины, выбранный из группы, состоящей из:,или его фармацевтически приемлемой соли или сольвата;,или его фармацевтически приемлемой соли или сольвата;,или его фармацевтически приемлемой соли или сольвата;,или его фармацевтически приемлемой соли или сольвата; или его фармацевтически приемлемой соли или сольвата; и,или его фармацевтически приемлемой соли или сольвата. 2. Комплекс фосфаплатины, выбранный из группы, состоящей из:(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пироDACH-2, имеющего формулу (I), или (1S,2S)-пиро-DACH-2, имеющего формулу (II),или его фармацевтически приемлемой соли или сольвата; и(ii) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)пиро-DACH-4, имеющего формулу (IV) или (1S,2S)-пиро-DACH-4, имеющего формулу (V),или его фармацевтически приемлемой соли или сольвата. 3. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного держащего энантиомерный избыток (1R,2R)-пиро-DACH-2 от 0,1 до 99%. 4. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного держащего энантиомерный избыток (1S,2S)-пиро-DACH-2 от 0,1 до 99%. 5. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного держащего энантиомерный избыток (1R,2R)-пиро-DACH-4 от 0,1 до 99%. 6. Комплекс фосфаплатины по п.2, состоящий из энантиомерно обогащенного держащего энантиомерный избыток (1S,2S)-пиро-DACH-4 от 0,1 до 99%. 7. Фармацевтическая композиция для лечения пролиферативного заболевания, содержащая:(а) один или более комплексов фосфоплатины, выбранных из:(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пироDACH-2, по формуле (I),или его фармацевтически приемлемых солей или сольватов;(ii) энантиомерно обогащенный пиро-DACH-2, содержащий энантиомерный избыток (1S,2S)-пироDACH-2 формулы (II),или его фармацевтически приемлемых солей или сольватов;,или его фармацевтически приемлемых солей или сольватов;(iv) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)пиро-DACH-4 формулы (IV),или его фармацевтически приемлемых солей или сольватов;(v) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1S,2S)-пироDACH-4 формулы (V),или его фармацевтически приемлемых солей или сольватов;,или его фармацевтически приемлемых солей или сольватов; и(vii) мультикомплексной смеси, содержащей по меньшей мере два из указанных комплексов фосфаплатины (i)-(vi); и(b) по меньшей мере один фармацевтически приемлемый ингредиент, выбранный из группы, состоящей из носителей, разбавителей, адъювантов и растворителей. 8. Фармацевтическая композиция по п.7, где указанные комплексы фосфаплатины представляют собой изолированные мономерные комплексы фосфаплатины. 9. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-2,содержащий энантиомерный избыток от 10 до 100% (1R,2R)-пиро-DACH-2. 10. Фармацевтическая композиция по п.9, в которой указанный энантиомерно обогащенный пироDACH-2 состоит из (1R,2R)-пиро-DACH-2 формулы (I) и (1S,2S)-пиро-DACH-2 формулы (II) 11. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-2,содержащий энантиомерный избыток от 10 до 100% (1S,2S)-пиро-DACH-2. 12. Фармацевтическая композиция по п.11, при этом указанный энантиомерно обогащенный пироDACH-2 состоит из (1R,2R)-пиро-DACH-2 формулы (I) и (1S,2S)-пиро-DACH-2 формулы (II) 13. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-4,- 20021526 содержащий энантиомерный избыток от 10 до 100% (1R,2R)-пиро-DACH-4. 14. Фармацевтическая композиция по п.13, в которой указанный энантиомерно обогащенный пироDACH-4 состоит из (1R,2R)-пиро-DACH-4 формулы (IV) и (1S,2S)-пиро-DACH-4 формулы (V) 15. Фармацевтическая композиция по п.7, содержащая энантиомерно обогащенный пиро-DACH-4,содержащий энантиомерный избыток от 10 до 100% (1S,2S)-пиро-DACH-4. 16. Фармацевтическая композиция по п.15, в которой указанный энантиомерно обогащенный пироDACH-4 состоит из (1R,2R)-пиро-DACH-4 формулы (IV) и (1S,2S)-пиро-DACH-4 формулы (V) 17. Фармацевтическая композиция по п.7, содержащая цис-пиро-DACH-2 18. Фармацевтическая композиция по п.7, содержащая цис-пиро-DACH-4. 19. Фармацевтическая композиция по п.7, где указанным пролиферативным заболеванием является рак. 20. Фармацевтическая композиция по любому из пп.7-19, где указанное пролиферативное заболевание выбрано из рака яичников, рака яичка, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака головы и шеи, рака кожи, рака поджелудочной железы, рака молочной железы, глиобластомы и колоректального рака. 21. Фармацевтическая композиция по любому из пп.7-19, где указанным пролиферативным заболеванием является рак, резистентный к терапии по меньшей мере одним из цисплатина, карбоплатина и оксалиплатина. 22. Способ лечения пролиферативного заболевания, который предусматривает введение субъекту,нуждающемуся в этом, терапевтически эффективного количества композиции, содержащей:(а) по меньшей мере один комплекс фосфоплатины, выбранный из:(i) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1R,2R)-пироDACH-2 формулы (I),или его фармацевтически приемлемых солей или сольватов;(ii) энантиомерно обогащенного пиро-DACH-2, содержащего энантиомерный избыток (1S,2S)-пироDACH-2 формулы (II),или его фармацевтически приемлемых солей или сольватов;,или его фармацевтически приемлемых солей или сольватов;(iv) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1R,2R)пиро-DACH-4 формулы (IV) или его фармацевтически приемлемых солей или сольватов;(v) энантиомерно обогащенного пиро-DACH-4, содержащего энантиомерный избыток (1S,2S)-пироDACH-4 формулы (V) или его фармацевтически приемлемых солей или сольватов;,или его фармацевтически приемлемых солей или сольватов; и(vii) мультикомплексной смеси, содержащей по меньшей мере два из указанных комплексов фосфоплатины (i)-(vi). 23. Способ по п.22, где указанная композиция дополнительно содержит:(b) по меньшей мере один фармацевтически приемлемый ингредиент, выбранный из группы, состоящей из носителей, разбавителей, адъювантов и растворителей. 24. Способ по п.22 или 23, где указанная композиция содержит по меньшей мере один комплекс фосфаплатины, выбранный из группы, состоящей из:(vi) цис-пиро-DACH-4, при этом указанная композиция не содержит оба (1R,2R)-пиро-DACH-2 и (1S,2S)-пиро-DACH-2 и указанная композиция не содержит оба (1R,2R)-пиро-DACH-4 и (1S,2S)-пиро-DACH-4. 25. Способ по любому из пп.22-24, где по меньшей мере один комплекс фосфаплатины указанной композиции состоит из энантиомерно обогащенного пиро-DACH-2, энантиомерно обогащенного пироDACH-4 или обоих. 26. Способ по любому из пп.22-25, где по меньшей мере один комплекс фосфаплатины указанной композиции состоит из энантиомерно чистого (1R,2R)-пиро-DACH-2, энантиомерно чистого (1R,2R)пиро-DACH-4 или обоих. 27. Способ по любому из пп.22-26, где указанная композиция дополнительно содержит цисплатин,карбоплатин, оксалиплатин или их комбинацию. 28. Способ по любому из пп.22-27, где указанным пролиферативным заболеванием является рак. 29. Способ по п.28, где указанное пролиферативное заболевание выбрано из рака яичников, рака яичка, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака головы и шеи, рака кожи,рака поджелудочной железы, рака молочной железы, глиобластомы и колоректального рака. 30. Способ по п.28, где указанным пролиферативным заболеванием является рак, резистентный к терапии по меньшей мере одним из цисплатина, карбоплатина и оксалиплатина. 31. Способ по любому из пп. 22-30, где указанным субъектом является млекопитающее. 32. Способ по любому из пп.22-30, где указанным субъектом является человек.
МПК / Метки
МПК: A61P 35/00, A61K 33/24, A61K 31/282, C07F 15/00
Метки: лечения, фосфаплатины, рака, применение
Код ссылки
<a href="https://eas.patents.su/24-21526-fosfaplatiny-i-ih-primenenie-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Фосфаплатины и их применение для лечения рака</a>
Предыдущий патент: Эмульсионный концентрат гербицидной композиции
Следующий патент: Соединения для уменьшения продукции бета-амилоида
Случайный патент: Способ получения олмесартан медоксомила












