Противогрибковые производные 5,6-дигидро-4-[(дифторэтил)фенил]-4h-пирроло[1,2-а][1,4]бензодиазепина и 4-(дифторэтил)фенил-6h-пирроло[1,2-а] [1,4]бензодиазепина
Номер патента: 21220
Опубликовано: 30.04.2015
Авторы: Де Вит Келли, Мерпул Ливен, Мас Луи Жюль Роже Мари
Формула / Реферат
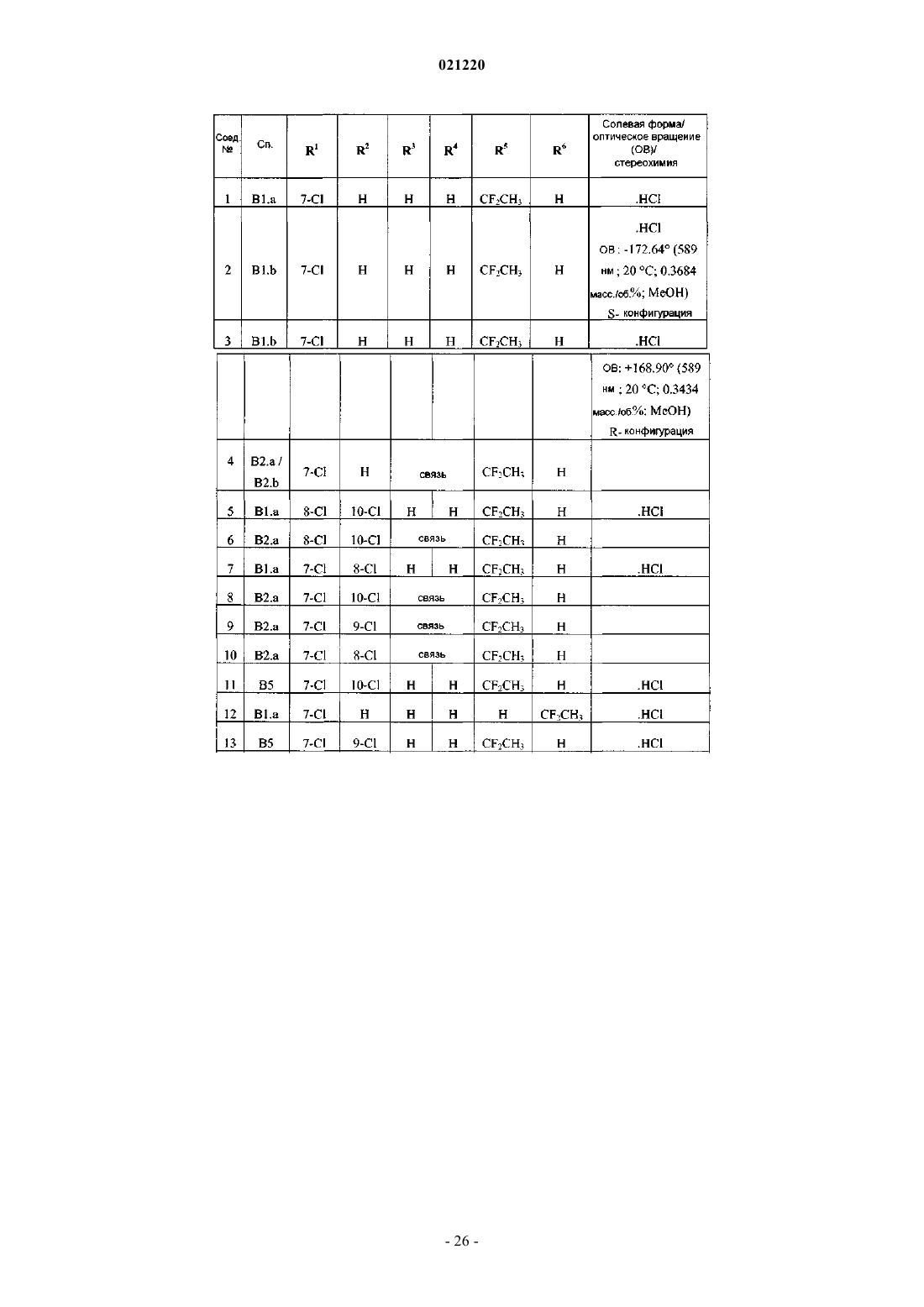
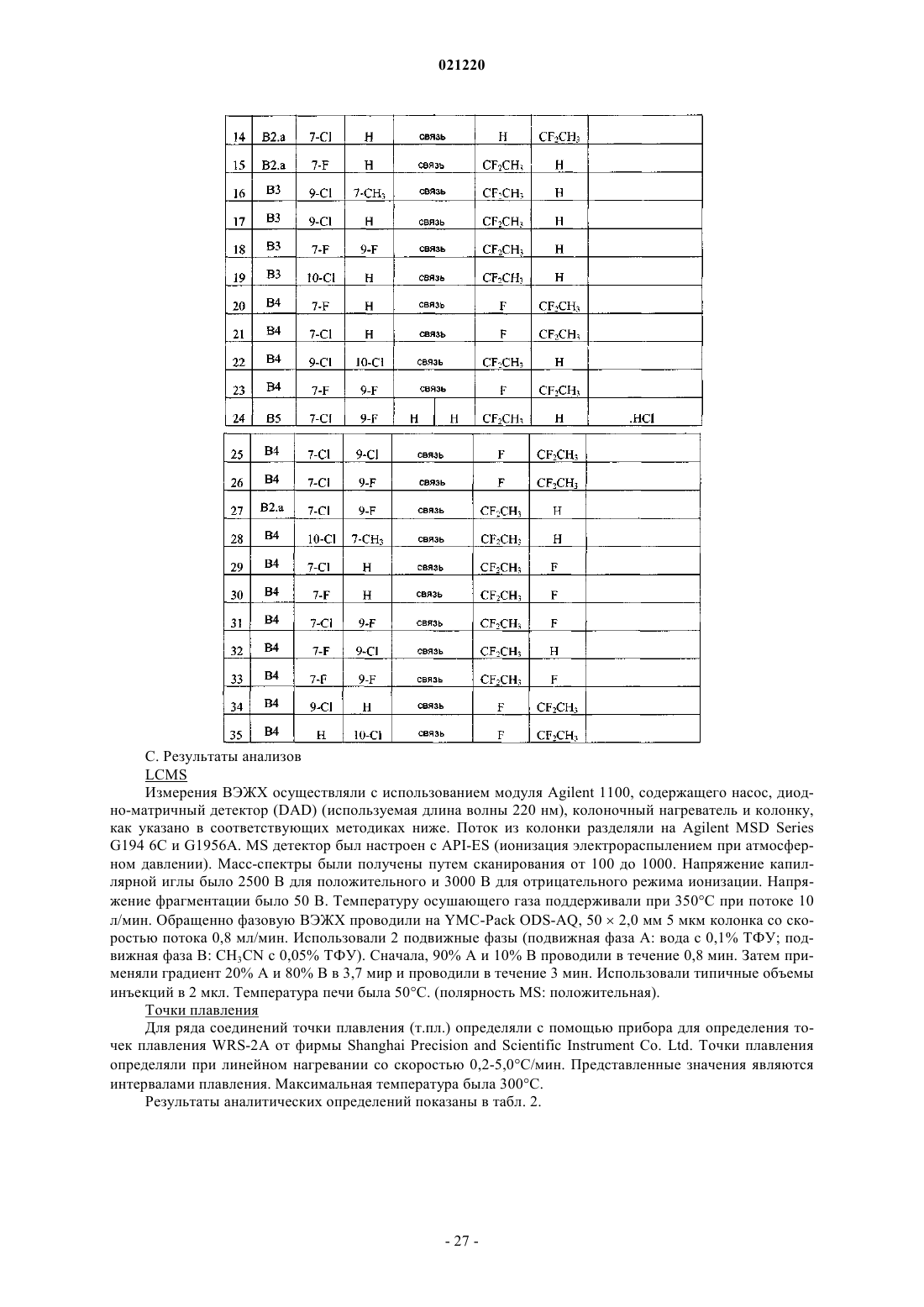
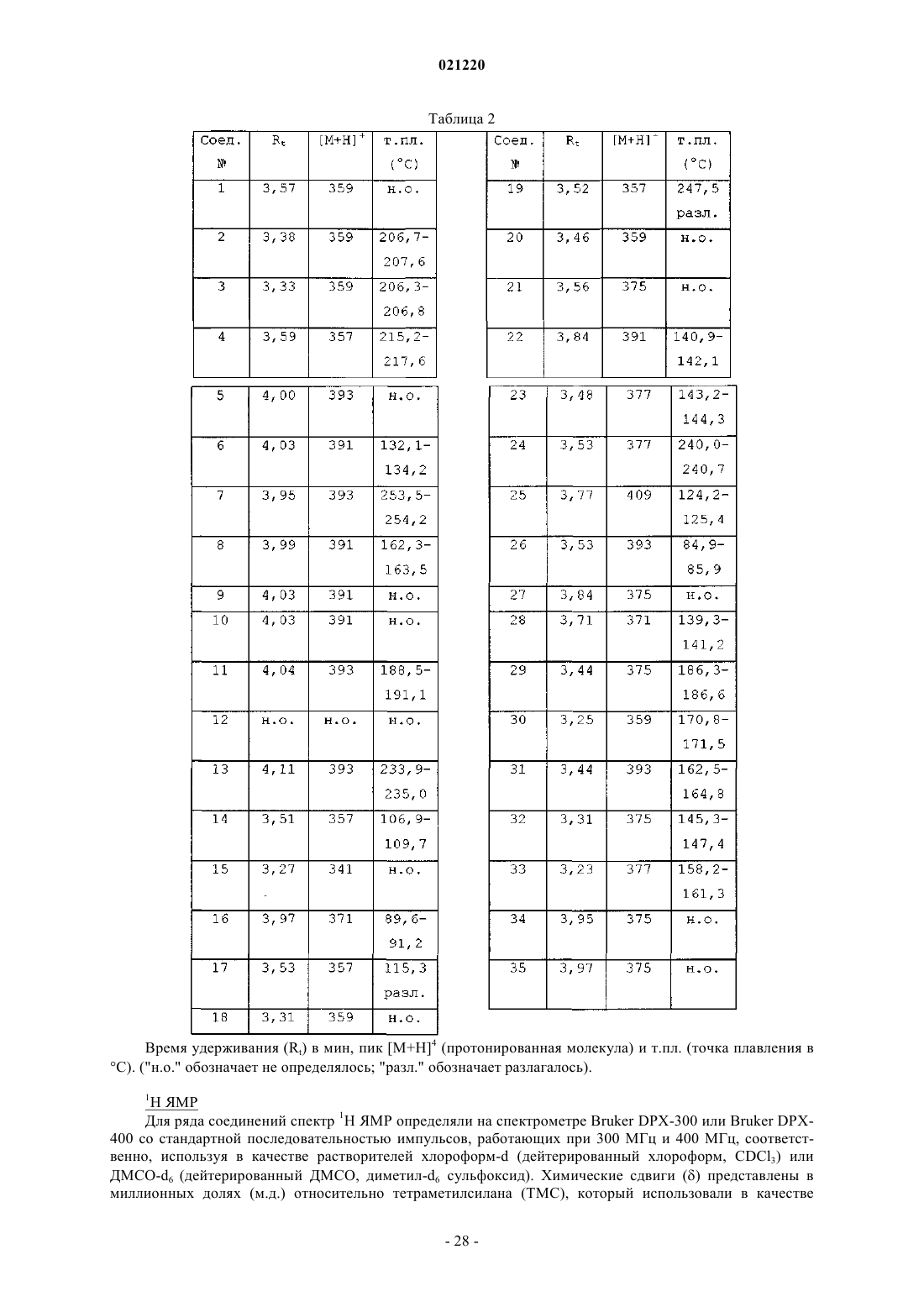
1. Соединение формулы (I)
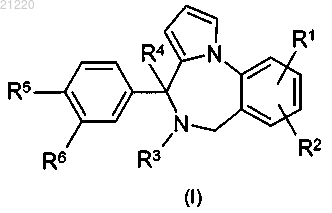
или его стереоизомерная форма, где
R1 представляет собой водород, хлор или фтор;
R2 представляет собой водород, хлор, фтор или метил;
R3 и R4 представляют собой водород;
или R3 и R4, взятые вместе, образуют связь;
R5 представляет собой 1,1-дифторэтил и
R6 представляет собой водород или фтор;
или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, где R1 представляет собой хлор или фтор.
3. Соединение по п.1, где R1 представляет собой хлор или фтор и где R2 представляет собой хлор, фтор или метил.
4. Соединение по п.1, где
R1 представляет собой хлор или фтор;
R2 представляет собой водород, хлор, фтор или метил;
R3 и R4, взятые вместе, образуют связь;
R5 представляет собой 1,1-дифторэтил и R6 представляет собой водород или фтор;
или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил.
5. Соединение по п.1, где
R1 представляет собой хлор или фтор;
R2 представляет собой водород;
R3 и R4, взятые вместе, образуют связь;
R5 представляет собой 1,1-дифторэтил;
R6 представляет собой водород.
6. Соединение по п.1, где
R1 находится в 7-м положении и представляет собой хлор или фтор и
R2 находится в любых других положениях и представляет собой водород, хлор, фтор или метил.
7. Соединение по п.1, представляющее собой 7-хлор-4-[4-(1,1-дифторэтил)фенил]-6Н-пирроло[1,2-а][1,4]бензодиазепин.
8. Соединение по п.1, представляющее собой 7-хлор-4-[4-(1,1-дифторэтил)фенил]-6Н-пирроло[1,2-а][1,4]бензодиазепин или его фармацевтически приемлемую соль присоединения или сольват.
9. Фармацевтическая композиция для лечения или профилактики грибковой инфекции, содержащая терапевтически эффективное количество соединения, указанного в любом из пп.1-8 и фармацевтически приемлемый носитель.
10. Применение соединения, указанного в любом из пп.1-8, в качестве лекарственного средства для лечения или профилактики грибковой инфекции.
11. Применение соединения, указанного в любом из пп.1-8, при лечении или профилактике грибковой инфекции.
12. Применение по п.11, где грибковая инфекция вызвана одним или несколькими грибами, выбранными из группы, состоящей из

13. Применение по п.11, где грибковая инфекция вызвана одним или несколькими грибами, выбранными из группы, состоящей из


14. Применение по п.11, где грибковая инфекция вызвана одним или несколькими грибами, выбранными из группы, состоящей из

Текст
Мерпул Ливен, Мас Луи Жюль Роже Мари, Де Вит Келли (BE) Медведев В.Н. (RU)LETTERS, PERGAMON, ELSEVIER SCIENCE, Настоящее изобретение относится к новым соединениям формулы (I) где R1, R2, R3, R4, R5 и R6 имеют значения, определенные в пунктах формулы изобретения. Соединения по настоящему изобретению активны, главным образом, в отношении дерматофитов и системных грибковых инфекций. Кроме того, изобретение относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также применению указанных соединений в качестве лекарственного средства.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область техники Настоящее изобретение относится к новым противогрибковым производным 5,6-дигидро-4[(дифторэтил)фенил]-4 Н-пирроло[1,2-а][1,4]бензодиазепина и 4-(дифторэтил)фенил-6 Н-пирроло[1,2 а][1,4]бензодиазепина, главным образом активным в отношении дерматофитов и системных грибковых инфекций. Кроме того, изобретение относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также к применению указанных соединений в качестве лекарственного средства. Уровень техники Дерматофит является общим названием для группы из 3 видов грибов, обычно вызывающих кожные заболевания у животных и человека. Это анаморфные грибы (бесполые или несовершенные грибы) родов: Microsporum, Epidermophyton и Trichophyton. Существует около 40 видов этих 3 родов. Дерматофиты вызывают кожные инфекции, инфекции волос и ногтей ввиду их способности получать питательные вещества из ороговевшего материала. Организмы колонизируют кератиновые ткани, и воспаление вызывается ответом хозяина на метаболические побочные продукты. Они, как правило, ограничены роговым слоем эпидермиса из-за их неспособности проникать в жизнеспособные ткани иммунокомпетентного хозяина. Однако, иногда организмы проникают в подкожные ткани, приводя к развитию кериона. Инвазия вызывает ответную реакцию хозяина, в диапазоне от легкой до сильной. По имеющимся данным кислотные протеиназы, эластаза, кератиназы и другие протеиназы, выступают в качестве факторов вирулентности. Системные грибковые инфекции (SFI) являются опасными для жизни заболеваниями, которые чаще всего поражают пациентов с ослабленным иммунитетом, обычно в результате терапевтического вмешательства при лечении злокачественных заболеваний. Количество SFI в современных больницах продолжает расти, а количество различных грибов, вовлеченных в SFI, является значительным и продолжает расти. Несмотря на множество случаев инвазивного кандидоза и аспергиллеза наблюдается повышенная частота инфекций, вызванных другими плесневыми грибами, такими как Scedosporium apiospermum,Fusarium spp. и Zygomycetes, Rhizopus и Mucor spp. Эффективность терапевтических средств для лечения всех этих инфекций очень высока, соответственно, необходимо иметь очень широкий спектр активности. В последние несколько десятилетий для лечения SFI использовали итраконазол, флуконазол, кетоконазол и внутривенный или липосомальный амфотерицин В, и все эти средства имеют свои ограничения в отношении спектра, безопасности и простоты введения. Совсем недавно было испытано и представлено на рынке третье поколение азолов, улучшающих лечение в отделениях интенсивной терапии. Вориконазол (Vfend) и позаконазол (Noxafil) показали значительное улучшение при лечении угрожающей жизни инвазивной SFI, такой как кандидоз, аспергиллез и инфекций, вызванных видами Fusarium, в клинических соответствующих дозах. Кроме того, позаконазол показал эффективность в отношении инфекций, вызванных развивающимся Zygomycetes spp. Эхинокандины, такие как анидулафунгин, каспофунгин и микафунгин, которые не являются конкурентными ингибиторами синтеза 1,3 глюкана в клеточных стенках грибов, проявляют высокую эффективность в отношении Candida spp. и Aspergillus spp., но не активны в отношении Cryptococcus, Fusarium или Zygomycetes spp. Из всех противогрибковых средств, азолы по-прежнему представляют собой уникальный класс соединений, демонстрирующих широкий противогрибковый спектр, путем ингибирования 14 деметилазы, фермента, имеющего существенное значение для биосинтеза эргостерина в грибах. Онихомикоз является наиболее распространенным заболеванием ногтей и составляет около половины всех заболеваний ногтей. Распространенность онихомикоза составляет около 6-8% у взрослого населения. Возбудители онихомикоза включают дерматофиты, Candida и плесневые грибы, не относящиеся к дерматофитам. Дерматофиты являются грибами, чаще всего вызывающими онихомикоз в западных странах с умеренным климатом, тогда как Candida и не относящиеся к дерматофитам плесневые грибы чаще вызывают заболевание в тропиках и субтропиках. Trichophyton rubrum является наиболее распространенным дерматофитом, вызывающим онихомикоз. Другими дерматофитами, которые могут вызвать заболевание, являются Trichophyton interdigitale, Epidermophyton floccosum, Trichophyton violaceum, Microsporum gypseum, Trichophyton tonsurans, Trichophyton soudanense и Trichophyton verrucosum. Другие возбудители включают Candida и не относящиеся к дерматофитам плесневые грибы, в частности, поколение плесневых грибов Scytalidium (также Neoscytalidium), Scopulariopsis и Aspergillus. 5,6-Дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепины были описаны в J. Chem. Soc.(C), 2732-2734(1971); J. Heterocyclic Chem., 13, 711-716 (1976) и J. Heterocyclic Chem., 16, 241-244 (1979). Соединения,описанные в этих ссылках, все имеют различные замещения в фенильной группе в 4-м положении и,кроме того, ни в одной из этих ссылок не сообщалось о биологических активностях. В WO 02/34752 описаны 4-замещенные 5,6-дигидро-4H-пирроло[1,2-а][1,4]бензодиазепины в качестве нового класса противогрибковых соединений. Тем не менее, в WO 02/34752 конкретно не описан настоящий пример замещения в фенильной группе в 4-м положении. Многие лекарственные соединения, обладая при этом желаемыми терапевтическими свойствами,используются неэффективно вследствие их плохой растворимости в воде. Так, например, в случае, когда такие соединения вводят перорально, лишь небольшая часть препарата попадает в кровь во время прохождения через желудочно-кишечный тракт. Как результат, для достижения требуемого поглощения лекарственного препарата может потребоваться введение высоких доз лекарственного соединения, чтобы продлить период приема препарата, или осуществление частых введений лекарственного соединения. Действительно, плохая растворимость и, соответственно, низкая биодоступность лекарственного препарата могут стать причиной использования альтернативного лекарственного препарата, возможно препарата с нежелательными побочными эффектами или препарата, требующего инвазивного введения (например, путем инъекции или инфузии), которые будут использоваться вместо плохо растворимого препарата. Поэтому целью настоящего изобретения является получение более биодоступных соединений с широким противогрибковым спектром или получение пригодных альтернативных соединений с достаточно высокой терапевтической эффективностью и достаточно низкими токсичностью или другими побочными эффектами. Неожиданно обнаружено, что противогрибковые соединения по настоящему изобретению или часть соединений по настоящему изобретению могут обладать улучшенными свойствами метаболической стабильности, улучшенными РК (фармакокинетическими) свойствами, повышенной растворимостью, уменьшенной потребностью в цитохроме Р 450 или повышенной биодоступностью по сравнению с соединениями, описанными в известном уровне техники. Соединения по настоящему изобретению могут быть использованы в качестве ингибиторов скваленэпоксидазы. Соответственно, объектом настоящего изобретения являются новые соединения с противогрибковым действием для преодоления или улучшения, по крайней мере, одного из недостатков предшествующего уровня техники, или их пригодная альтернатива. Сущность изобретения Было обнаружено, что соединения по настоящему изобретению могут быть использованы в качестве противогрибковых соединений. Настоящее изобретение относится к новым соединениям формулы (I)R5 представляет собой 1,1-дифторэтил и R6 представляет собой водород или фтор; или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил; и их фармацевтически приемлемым солям и сольватам. Настоящее изобретение также относится к способам получения соединений формулы (I) и фармацевтических композиций, содержащих эти соединения. Настоящие соединения являются эффективными средствами для борьбы с грибками in vivo. Новые соединения, описанные в настоящем изобретении, могут быть использованы при лечении и профилактике инфекций, вызванных дерматофитами, системными грибковыми инфекциями и онихомикозом. Новые соединения, описанные в настоящем изобретении, могут быть активны в отношении широкого спектра грибов, таких как Принимая во внимание вышеуказанную фармакологию соединений по настоящему изобретению,следует, что они пригодны для применения в качестве лекарственного средства. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и фармацевтически приемлемым аддитивным солям и сольватам, для использования при лечении и профилактике грибковых инфекций. Одним из преимуществ соединений или части соединений по настоящему изобретению может быть их повышенная биодоступность, улучшенные свойства метаболической стабильности, улучшенные фармакокинетические свойства, пониженное ингибирование канала HERG или сниженная потребность в цитохроме Р 450 по сравнению с соединениями, описанными в предшествующем уровне техники. Настоящее изобретение описано далее. В последующих разделах изобретения различные аспекты изобретения определены более подробно. Каждый определенный таким образом аспект может быть объединен с любым другим аспектом или аспектами, если конкретно не указано иное. В частности, любой признак, указанный как предпочтительный или выгодный, может быть объединен с любым другим признаком или признаками, обозначенными как предпочтительные или выгодные. Подробное описание Химические названия соединений по настоящему изобретению были даны в соответствии с правилами номенклатуры, согласованными с Chemical Abstracts Service (Химическая реферативная служба),используя номенклатурное программное обеспечение (ACD/Name product version 10,01; Build 15494, 1Dec 2 006) компании Advanced Chemical Development, Inc. В случае таутомерных форм должно быть понятно, что другие, не описанные таутомерные формы,также включены в объем настоящего изобретения. Атомы в трициклических системах пронумерованы, как показано на следующей формуле (XX): Следует иметь в виду, что некоторые из соединений формулы (I) и их фармацевтически приемлемые соли и сольваты могут иметь один или несколько центров хиральности и существуют в виде стереоизомерных форм. Выше и далее термин "соединения формулы (I)" подразумевает включение аддитивных солей,сольватов и стереоизомеров. Термин "стереоизомеры", "стереоизомерные формы" или "стереохимически изомерные формы",выше или далее в настоящем документе, используются взаимозаменяемо. Изобретение включает все стереоизомеры соединения формулы (I), либо в виде чистых стереоизомеров, либо в виде смеси двух или более стереоизомеров. Энантиомеры представляют собой стереоизомеры, которые являются неналагающимися зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой рацемат или рацемическую смесь. Диастереомеры (или диастереоизомеры) являются стереоизомерами, которые не являются энантиомерами, т.е. они не являются зеркальными отображениями друг друга. Если соединение содержит двойную связь, то заместители могут быть в Е или Z конфигурации. Если соединение содержит дизамещенную циклоалкильную группу, заместители могут находиться в цис- или транс-конфигурации. Таким образом, изобретение включает энантиомеры, диастереомеры, рацематы, Е-изомеры, Z-изомеры, цисизомеры, транс-изомеры и их смеси, когда это химически возможно. Абсолютная конфигурация определяется в соответствии с системой Кана-Ингольда-Прелога. Конфигурацию асимметричного атома обо-3 021220 значают как R или S. Индивидуальные соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены как (+) или (-), в зависимости от направления, в котором они вращают плоскость поляризованного света. Когда конкретный стереоизомер определен, это означает, что указанный стереоизомер, по существу, свободен, т.е. имеет отношение к менее чем 50%, предпочтительно менее 20%, более предпочтительно менее чем 10%, еще более предпочтительно менее чем 5%, в частности, менее чем 2%, и наиболее предпочтительно менее чем l% другим изомерам. Таким образом, когда соединение формулы (I), например, указано как (R), это означает, что соединение, в основном, не содержит (S)-изомер; когда соединение формулы (I), например, указано как Е, это означает, что соединение, в основном, не содержит Zизомер, когда соединение формулы (I), например, указано как цис, это означает, что соединение, в основном, не содержит транс-изомер. Соли соединений формулы (I) для терапевтического применения представляют собой соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Аддитивные соли фармацевтически приемлемых кислот и оснований, как указывалось выше или далее в настоящем документе, включают терапевтически активные формы аддитивных солей нетоксичной кислоты и основания, которые способны образовывать соединения формулы (I). Аддитивные соли фармацевтически приемлемой кислоты могут быть получены общепринятым способом обработки соединения в форме основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и подобные кислоты, или органические кислоты, такие как, например, уксусную, пропионовую, гидроксиуксусную, молочную, пировиноградную,щавелевую (т.е. этандиовую), малоновую, янтарную (т.е. бутандиовую кислоту), малеиновую, фумаровую, яблочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, птолуолсульфоновую, цикламовую, салициловую, п-аминосалициловую, памовую и тому подобные кислоты. С другой стороны, указанные солевые формы можно преобразовать в форму свободного основания обработкой подходящим основанием. Соединения формулы (I), содержащие кислотный протон, также можно преобразовать в их нетоксичные формы аддитивных солей металла или амина обработкой подходящими органическими и неорганическими основаниями. Подходящие солевые формы основания включают, например, соли аммония,соли щелочных или щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобные; соли с органическими основаниями, например, соли первичных, вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин, изопропиламин, четыре бутиламиновых изомера, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатина, N-метил-D-глюкамина, гидрабамина,и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. И, наоборот, солевая форма может быть преобразована путем обработки кислотой в форму свободной кислоты. Термин "сольват" включает гидраты и формы добавления растворителя, которые способны образовывать соединения формулы (I), а также их соли. Примерами таких форм являются, например, гидраты,алкоголяты и тому подобное. Соединения формулы (I), полученные способами, описанными ниже, могут быть синтезированы в виде смесей энантиомеров, в частности рацемических смесей энантиомеров, которые могут быть отделены друг от друга в соответствии с известными способами разделения. Способ разделения энантиомерных форм соединений формулы (I) включает в себя жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также могут быть получены из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ,при условии, что реакция протекает стереоспецифически. Предпочтительно, если требуется определенный стереоизомер, указанное соединение может быть синтезировано стереоспецифическими способами получения. В данных способах предпочтительно используют энантиомерно чистые исходные вещества. В рамках настоящей заявки соединение по настоящему изобретению, по существу, включает все изотопные сочетания его химических элементов. В рамках настоящей заявки, химический элемент, в частности, когда он указан в связи с соединением формулы (I), включает все изотопы и изотопные смеси этого элемента. Например, когда указан водород, должно быть понятно, что он относится к 1 Н, 2 Н, 3 Н и их смесям. Соответственно, соединение по настоящему изобретению, по существу, включает соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивное соединение, также называемое соединением, меченным радиоактивным изотопом, в котором один или несколько нерадиоактивных атомов были заменены одним из их радиоактивных изотопов. Под термином"соединение, меченное радиоактивным изотопом", понимается любое соединение формулы (I) или его фармацевтически приемлемая соль, которая содержит по меньшей мере один радиоактивный атом. Например, соединение может быть мечено позитроном или гаммаизлучающими радиоактивными изотопами. Для способов связывания с радиолигандом, 3 Н-атом или 125I-атом представляет собой атом, выбранный для замены. Для получения изображения наиболее широко используют позитронно-эмитирующие(PTE) радиоактивные изотопы, представляющие собой 11C, 18F, 15O и 13N, каждый из которых получен при помощи ускорителя и имеет период полураспада 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада этих радиоактивных изотопов очень короткие, то их использование практически возможно только в институтах, которые имеют ускоритель для их получения, и это обстоятельство, соответственно, ограничивает их применение. Наиболее широко используемыми из этих изотопов являются 18F, 99mTc, 201T1 и 123I. Обращение с такими радиоактивными изотопами, их получение, выделение и введение в молекулу хорошо известны специалистам в данной области техники. В частности, радиоактивный атом выбран из группы, включающей водород, углерод, азот, серу, кислород и галоген. В частности, радиоактивный изотоп выбран из группы, включающей 3 Н, 11C, 18F, 122I,123 125 131 75I, I, I, Br, 76Br, 77Br и 82Br. Как используется в описании и прилагаемой формуле изобретения, формы единственного числа существительных также включают множественное число, если в контексте явно не указано иное. К примеру, "соединение" означает одно соединение или несколько соединений. Термины, описанные выше, и другие, используемые в описании, хорошо известны специалистам в данной области. Предпочтительные свойства соединений по настоящему изобретению описаны в настоящей заявке. Настоящее изобретение относится к новым соединениям формулы (I)R5 представляет собой 1,1-дифторэтил и R6 представляет собой водород или фтор; или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил; и их фармацевтически приемлемым солям и сольватам. В одном из вариантов осуществления изобретение относится к соединениям формулы (I) и его стереоизомерным формам, гдеR1 представляет собой хлор или фтор;R5 представляет собой 1,1-дифторэтил, и R6 представляет собой водород или фтор; или R5 представляет собой водород или фтор, и R6 представляет собой 1,1-дифторэтил; и их фармацевтически приемлемым солям и сольватам. В одном из вариантов осуществления, изобретение относится к соединениям формулы (I) и его стереоизомерным формам, гдеR1 представляет собой хлор или фтор;R5 представляет собой 1,1-дифторэтил и R6 представляет собой водород или фтор; или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил; и их фармацевтически приемлемым солям и сольватам. В одном из вариантов осуществления изобретение относится к соединениям формулы (I) и его стереоизомерным формам, гдеR1 представляет собой хлор или фтор;R5 представляет собой 1,1-дифторэтил и R6 представляет собой водород или фтор; или R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил; и их фармацевтически приемлемым солям и сольватам. В другом варианте осуществления, изобретение относится к соединениям формулы (I) и его стерео-5 021220R1 представляет собой хлор или фтор;R6 представляет собой водород; и их фармацевтически приемлемым солям и сольватам. В следующем варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R5 представляет собой 1,1 дифторэтил и R6 представляет собой водород или фтор. В еще одном варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R5 представляет собой водород или фтор и R6 представляет собой 1,1-дифторэтил. В следующем варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где по меньшей мере один из R1 и R2 является иным, чем водород. В конкретном варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R2 представляет собой водород, хлор или фтор. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R3 и R4 представляют собой водород. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R1 или R2 находится в 7 положении и является иным, чем водород. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R1 находится в 7-положении и представляет собой хлор или фтор, в частности, R находится в 7-положении и представляет собой хлор. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, гдеR1 находится в 7-положении и представляет собой хлор или фтор, в частности, R1 находится в 7 положении и представляет собой хлор, иR2 находится в любом другом положении и представляет собой водород, хлор, фтор или метил, в частности хлор, фтор или метил; более конкретно хлор или фтор, и, даже более конкретно, хлор. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R2 находится в 7-положении и представляет собой хлор, фтор или метил. В другом варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, гдеR2 находится в 7-положении и представляет собой хлор, фтор или метил иR1 находится в любых других положениях и представляет собой водород, хлор или фтор, в частности хлор или фтор, более конкретно, хлор. В еще одном варианте осуществления изобретение относится к любому из других вариантов осуществления или любому сочетанию из других вариантов осуществления, где R3 и R4, взятые вместе, образуют связь. В следующем варианте осуществления изобретения соединение формулы (I) выбрано из группы,включающей включая любую стереохимически изомерную форму,и их фармацевтически приемлемые соли и сольваты. В еще другом варианте осуществления изобретения, соединение формулы (I) представляет собой 7 хлор-4-[4-(1,1-дифторэтил)фенил]-6 Н-пирроло[1,2-а][1,4]бензодиазепин. Все возможные сочетания выше указанных интересующих вариантов считаются включенными в объем данного изобретения. Настоящее изобретение охватывает также способы получения соединений формулы (I) и их подгрупп. Соединения формулы (I) и их подгруппы могут быть получены последовательностью стадий, как описано ниже. Соединения, как правило, получают из исходных продуктов, которые являются либо коммерчески доступными, либо полученными стандартными средствами, очевидными для специалистов в данной области. Соединения по настоящему изобретению также могут быть получены с использованием стандартных способов синтеза, обычно используемых специалистами в области органической химии. Соединения по настоящему изобретению могут быть получены согласно схеме 1. Схема 1 Соединения формулы (I), где R3 и R4, взятые вместе, образуют дополнительную связь, то есть соединения, представленные формулой (I-b), могут быть получены из соединений, представленных формулой (I-а), в соответствии с известными реакциями окисления амина до имина. Эти реакции окисления могут быть проведены путем осуществления взаимодействия соединения формулы (I-а) с окислителем,таким как, например, тетраацетат свинца или диоксид марганца, в реакционно инертном растворителе,таком как галогенированные углеводороды, например, дихлорметан (DCM) или трихлорметан. Скорость реакции может быть повышена путем перемешивания и, возможно, нагревания реакционной смеси. Альтернативно, соединения формулы (I-b) могут быть получены путем внутримолекулярной циклизации промежуточного соединения формулы (II). В присутствии кислоты, такой как, например, POCl3,амид промежуточного соединения формулы (II) может действовать как С-электрофил, приводя к замыканию кольца. Реакция может быть проведена в подходящем растворителе, таком как, например, DCM. Перемешивание и нагревание могут повысить скорость реакции. Соединение формулы (I-а) может быть получено исходя из промежуточного соединения формулы(IV) путем преобразования его в соль (III) путем взаимодействия с кислотой H+X- формулы (XI), и взаи-9 021220 модействием указанной соли формулы (III) с альдегидом формулы (XII) в подходящем растворителе,таком как спирт, например, метанол (МеОН), этанол (EtOH), изопропанол, при повышенной температуре, предпочтительно, при температуре кипения. Альтернативно, промежуточное соединение формулы (IV) сначала может быть подвергнуто взаимодействию с альдегидом формулы (XII), и полученный таким образом имин может быть циклизован в присутствии кислоты H+X- формулы (XI) до соединения формулы (I-а). Альтернативно, соединение формулы (I-а) может быть получено путем восстановления соединения формулы (I-b), используя способы, хорошо известные специалистам в данной области. Промежуточное соединение формулы (II) может быть получено с помощью реакции конденсации промежуточного соединения формулы (III) и (XIII). Указанная реакция может быть осуществлена в присутствии конденсирующих агентов, таких как общеизвестные 1-гидрокси-1 Н-бензотриазол (HOBt) и моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (EDCI). Реакция может быть проведена в присутствии основания, такого как триэтиламин (Et3N), и подходящего растворителя, такого как, например, DCM. Альтернативно, производное хлорангидрида кислоты(XIII) или его реакционноспособное сложноэфирное производное (XIII) также могут быть использованы в реакции этого типа для получения промежуточного соединения формулы (II). Промежуточное соединение формулы (XIII) или его хлорангидрид кислоты или сложноэфирное производное легко могут быть получены специалистами в данной области. Промежуточные соединения формулы (III) и (IV) получают путем восстановления 1-(2 цианофенил)пиррольного производного формулы (V). Для восстановления нитрильной функциональной группы могут быть использованы некоторые способы, хорошо известные специалистам в данной области, такие как, например: 1. LiAlH4/ТГФ [S. Raines, S.Y. Chai and F.P. Palopoli, J. Heterocyclic Chem., 13, 711-716 (1976)]. 2. i. бис(2-метоксиэтокси)алюминат натрия (Red-Al) 70% мас./мас. толуол, комнатная температура:ii. NaOH 10%, комнатная температура [G.W.H. Cheeseman and S.G. Greenberg; J. Heterocyclic Chem.,16, 241-244 (1979)] 3a. i. KBH4/CF3COOH, ТГФ, ii. H2O, iii. HCl [P. Trinka, P. Slegel and J. Reiter; J. Prakt. Chem., 338,675-678 (1996)] 3b. Боран-диметилсульфид (1:1), ТГФ 4a. RaNi (никель Ренея)/Н 2 4b. RaNi/раствор тиофена/(MeOH/NH3) Также могут быть использованы даже другие известные способы восстановления нитрильной функциональной группы. Промежуточное соединение формулы (V), в свою очередь, является коммерчески доступным или,альтернативно, может быть легко получено, например, обработкой 2-аминобензонитрильного производного формулы (VI) тетрагидро-2,5-диметоксифураном в инертном растворителе, таком как диоксан или тетрагидрофуран (ТГФ), в присутствии кислоты, такой как гидрохлорид 4-хлорпиридина, или в кислотном растворителе, таком как ледяная уксусная кислота, при повышенной температуре, предпочтительно при температуре кипения. Альтернативно, промежуточное соединение формулы (V) также может быть получено исходя из промежуточного соединения формулы (X). Как правило, промежуточное соединение формулы (X), где Halo определяется как Br, I, Cl или F, подвергают взаимодействию с пирролом в присутствии основания, такого как, например, Cs2CO3 или NaH, в подходящем растворителе, таком как обычно ДМФ. Альтернативно, промежуточное соединение формулы (IV) может быть получено путем обработки промежуточного соединения формулы (VII) боран-диметилсульфидом (1:1) в подходящем растворителе,таком как, например, ТГФ. Обычно реакция может быть осуществлена в присутствии кислоты, такой какHCl. После того, как реакция завершалась, реакционная смесь может быть подщелачена подходящим основанием, таким как NaOH. Реакция может быть осуществлена при повышенной температуре, предпочтительно, при температуре кипения. Промежуточное соединение формулы (VII) может быть получено исходя из промежуточного соединения формулы (VIII). Промежуточное соединение формулы (VIII) может быть подвергнуто взаимодействию с источником азота, таким как NH3H2O в присутствии HOBt и EDCI. Этот тип реакции обычно может быть осуществлен в подходящем растворителе, подобном ДМФ. Перемешивание реакционной смеси может повысить скорость реакции. Промежуточное соединение формулы (VIII) может быть легко получено путем обработки промежуточного соединения формулы (IX) тетрагидро-2,5-диметоксифураном в инертном растворителе, таком как диоксан, в присутствии кислоты, такой как гидрохлорид 4-хлорпиридина, при повышенной температуре, предпочтительно, при температуре кипения. Кроме того, в реакции этого типа для получения промежуточного соединения формулы (VIII) также может быть использовано реакционноспособное производное эфира (IX). Все исходные материалы являются коммерчески доступными или могут быть легко получены спе- 10021220 циалистами в данной области. Во всех этих получениях продукты реакции могут быть выделены из реакционной среды и, при необходимости, дополнительно очищены в соответствии с методиками, которые широко известны в данной области, такими как, например, экстракция, кристаллизация, растирание и хроматография. В частности,стереоизомеры могут быть выделены хроматографически с использованием стационарной хиральной фазы, такой как, например, Chiralpak AD (3,5-диметилфенилкарбамат амилозы) или Chiralpak AS, обе от фирмы Daicel Chemical Industries, Ltd, Япония. Чистые стереоизомерные формы соединений и промежуточных соединений по данному изобретению могут быть получены путем использования известных способов. Энантиомеры могут быть отделены друг от друга путем селективной кристаллизации их диастереомерных солей с помощью оптически активных кислот. Альтернативно, энантиомеры могут быть разделены хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереоизомерные формы могут быть также получены из соответствующих чистых форм стереоизомерных форм соответствующих исходных продуктов, при условии, что реакция протекает стереоселективно или стереоспецифически. Предпочтительно, если желателен конкретный стереоизомер, указанное соединение синтезировали путем стереоселективного или стереоспецифического способов получения. В этих способах целесообразно использовать хирально чистые исходные продукты. Стереоизомерные формы соединений формулы (I), что очевидно, предназначены для включения в объем изобретения. Хирально чистые формы соединений формулы (I) образуют предпочтительную группу соединений. В связи с этим хирально чистые формы промежуточных соединений и их солевые формы особенно могут быть использованы при получении хирально чистых соединений формулы (I). Также энантиомерные смеси промежуточных соединений могут быть использованы при получении соединений формулы (I) с соответствующей конфигурацией. Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые аддитивные соли и сольваты, могут быть активными в отношении диморфных патогенных микроорганизмов,дерматофитов, зигомицетов, гиалиновых гифомицетов, демациевых гифомицетов, дрожжей и дрожжеподобных организмов. Соединения формулы (I) и их стереоизомерные формы и фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении диморфных патогенных микроорганизмов, дрожжей и дрожжеподобных организмов. Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые аддитивные соли и сольваты, могут быть активны в отношении плесневых грибов. Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые соли и сольваты, могут быть активны в отношении широкого спектра грибов, таких как Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активны в отношении широкого спектра грибов, таких как Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые аддитивные соли и сольваты могут быть активны против широкого спектра грибков, таких как Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активны в отношении Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активны в отношении Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитив- 13021220 ные соли и сольваты могут быть активны в отношении Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны против широкого спектра грибков, таких как Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны против широкого спектра грибков, таких как Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении грибов, таких как Соединения формулы (I) и стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении грибов, таких как Candida parapsilosis; Aspergillusspp.; Cryptococcus neoformans; Microsporum spp.; Trichophyton spp.; Scedosporium spp. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые аддитивные соли и сольваты могут быть активны против различных грибков, которые поражают кожу, волосы и ногти, а также против подкожных и системных грибковых возбудителей. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении 3 родов дерматофитов: Trichophyton, Microsporum и Epidermophyton, в частности, в отношении Tnchophyton и Microsporum. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении дерматофитов и Aspergillus spp.; в частностиMicrosporum canis, Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigatus; более конкретно Microsporum cams, Trichophyton mentagrophytes и Trichophyton rubrum. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении Trichopnyton mentagrophytes, Trichophyton rubrum и Aspergillus spp.; в частности Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigatus. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активны в отношении Trichopnyton mentagrophytes; Trichophytonrubrum; Aspergillos spp., например Aspergillus fumigatus; Fusarium spp.; Mucor spp.; Zygomycetes spp.; Scedosporium spp.; Microsporum canis; Sporothrix schenckii; Cryptococcus neoformans и Candida parapsilosis. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении дерматофитов. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении Aspergillus fumigatus. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активны в отношении широкого спектра грибов, например одного или нескольких указанных выше грибов. Соединения формулы (I) и их стереоизомерные формы, и фармацевтически приемлемые аддитивные соли и сольваты являются эффективными противогрибковыми препаратами при пероральном или местном введении. Соединения по настоящему изобретению могут быть использованы в качестве ингибиторов синтеза эргостерола. Учитывая полезность соединения формулы (I), предложен способ лечения теплокровных животных,включая человека, страдающих от, или способ профилактики теплокровных животных, включая человека, страдающих от любых заболеваний, указанных выше. Таким образом, соединения формулы (I) предназначены для применения в качестве лекарственного средства. Также предложено применение соединения формулы (I) при получении лекарственного средства, используемого в лечении грибковых инфекций. Другие соединения формулы (I) предложены для применения при лечении грибковых инфекций. Используемый в настоящем документе термин "лечение" обозначает все процессы, в которых может быть замедление, нарушение, подавление или остановка развития инфекции, но не обязательно означает полное устранение всех симптомов. Изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для применения в качестве лекарственного средства. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для лечения или профилактики грибковых инфекций, в частности, грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его сте- 15021220 реоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для лечения грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для применения при лечении и профилактике грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для применения при лечении или профилактике, в частности, лечения грибковых инфекций; в частности грибковых инфекций, вызванных одним или несколькими из грибов, выбранных из группы,состоящей из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для применения при лечении грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания, и сольватам, для применения при лечении и профилактике грибковых инфекций, в частности, грибковых инфекций,- вызванных одним или несколькими из вышеуказанных грибов. Кроме того, изобретение относится к соединению, соответствующему общей формуле (I), его стереоизомерным формам и аддитивным солям фармацевтически приемлемой кислоты или основания и сольватам, для применения при лечении и профилактике грибковых инфекций, в которой грибковая инфекция вызвана одним или несколькими из грибов, выбранных из группы, состоящей из в частности, в котором грибковая инфекция вызвана одним или несколькими из грибов, выбранных из группы, состоящей из еще более конкретно, где грибковая инфекция вызвана одним или несколькими из грибов, выбранных из группы, состоящей из Новые соединения, описанные в настоящем изобретении, могут быть использованы при лечении или профилактике заболеваний или состояний, выбранных из группы, состоящей из инфекций, вызванных дерматофитами, системными грибковыми инфекциями и онихомикозом. Новые соединения, описанные в настоящем изобретении, могут быть использованы при лечении или профилактике заболеваний или состояний, таких как, например, инфекции, вызванные дерматофитами, системными грибковыми инфекциями или онихомикозом. Изобретение также относится к применению соединения в соответствии с общей формулой (I), его стереоизомерных форм и аддитивных солей фармацевтически приемлемой кислоты или основания, и сольватов при получении лекарственного средства. Изобретение также относится к применению соединения в соответствии с общей формулой (I), его стереоизомерных форм и аддитивных солей фармацевтически приемлемой кислоты или основания, и сольватов, при получении лекарственного средства для лечения или профилактики, в частности лечения,грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Соединения по настоящему изобретению могут быть введены млекопитающим, предпочтительно человеку, для лечения или профилактики, в частности лечения, грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Учитывая полезность соединения формулы (I), предложен способ лечения больных теплокровных животных, включая человека, или способ профилактики теплокровных животных, включая человека,страдающих от грибковых инфекций, в частности грибковых инфекций, вызванных одним или несколькими из вышеуказанных грибов. Указанные методы включают введение, то есть системное или местное введение, предпочтительно,пероральное введение, эффективного количества соединения формулы (I), его стереоизомерной формы и его фармацевтически приемлемой соли или сольвата, теплокровным животным, включая человека. Специалисты по лечению таких заболеваний могут определить эффективное терапевтическое суточное количество из результатов исследований, приведенных ниже. Эффективное терапевтическое суточное количество будет составлять примерно от 0,005 до 50 мг/кг, в частности от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,01 до 25 мг/кг массы тела, предпочтительно от около 0,01 до около 15 мг/кг, более предпочтительно от около 0,01 до около 10 мг/кг, еще более предпочтительно от около 0,01 до 1 мг/кг, наиболее предпочтительно от около 0,05 до 1 мг/кг массы тела. Количество соединения в соответствии с настоящим изобретением, также называемого в настоящем документе как активный ингредиент, которое необходимо для достижения терапевтического эффекта, будет, конечно, изменяться в каждом конкретном случае, например, в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента, и конкретного расстройства или заболевания, которое подвергают лечению. Способ лечения может также включать введение активного ингредиента по схеме от одного до четырех приемов в день. В этих методах лечения соединения в соответствии с изобретением предпочтительно получают перед введением. Как описано ниже, подходящие фармацевтические препараты получают известными способами с использованием хорошо известных и легко доступных ингредиентов. Хотя вполне возможно введение только активного ингредиента, предпочтительно получать его в виде фармацевтической композиции. Настоящее изобретение также относится к композициям для лечения или профилактики грибковых инфекций, включающим терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Носитель или разбавитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и не оказывать вредного воздействия на его получателей. Соединения по настоящему изобретению, которые являются подходящими для лечения или профилактики грибковых инфекций, можно вводить отдельно или в сочетании с одним или несколькими другими терапевтическими средствами. Комбинированная терапия включает в себя введение отдельной фармацевтической дозированной композиции, которая содержит соединение формулы (I) и одно или несколько дополнительных терапевтических средств, а также введение соединения формулы (I) и любых дополнительных терапевтических средств в виде отдельной фармацевтической дозированной композиции. Например, соединение формулы (I) и терапевтическое средство могут быть введены пациенту вместе в виде одной дозированной композиции для перорального введения, такой как таблетки или капсулы,или каждое средство может быть введено в виде отдельных дозированных композиций для перорального введения. С учетом полезных фармакологических свойств для обеспечения целей введения рассматриваемые соединения могут быть получены в виде различных фармацевтических форм. Соединения в соответствии с изобретением, в частности соединения формулы (I), его аддитивная соль фармацевтически приемлемой кислоты или основания, его стереохимически изомерная форма или любая подгруппа или их сочетание,могут быть получены в виде различных фармацевтических форм для обеспечения целей введения. В качестве подходящих композиций могут быть приведены всевозможные композиции, обычно используемые для системно вводимых лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента, объединяют в однородной смеси с фармацевтически приемлемым носителем, который может иметь самые разнообразные формы в зависимости от формы препарата, требуемой для введения. Такие фармацевтические композиции желательны в лекарственной форме для однократного введения, подходящей, в частности, для перорального, ректального, подкожного, парентерального введения или введения путем ингаляции. Например, при получении композиций в лекарственной форме для перорального введения,можно использовать любую обычную фармацевтическую среду, такую как, например, вода, гликоли,масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиро- 17021220 пы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие вещества, связующие вещества, разрыхляющие вещества и тому подобное, в случае порошков, пилюль, капсул и таблеток. Ввиду легкости введения таблетки и капсулы представляют собой наиболее предпочтительные стандартные лекарственные формы для перорального введения, при этом,что очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, в значительной степени, хотя могут быть включены и другие ингредиенты, например, вещества для повышения растворимости. Например, могут быть получены растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Например, могут быть получены растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Растворы для инъекций, содержащие соединения формулы (I), могут быть получены в масле, для пролонгированного действия. Соответствующими маслами для этой цели являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и длинноцепочечных жирных кислот и смеси этих и других масел. Также могут быть получены суспензии для инъекций, и в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и тому подобное. Также включены твердые формы препаратов, которые предназначены для преобразования в жидкие формы непосредственно перед применением. В композициях, подходящих для подкожного введения, носитель необязательно включает в себя средство для усиления проницаемости и/или подходящий увлажняющий агент, необязательно, в сочетании с подходящими добавками любой природы в незначительных количественных соотношениях, которые не оказывают существенного вредного воздействия на кожу. Такие добавки могут способствовать введению в кожу и/или могут быть использованы для получения желаемой композиции. Эти композиции могут быть введены различными способами, например, в виде трансдермального пластыря, в виде нанесения пятен, в виде мази. Соли присоединения кислоты или основания соединений формулы (I) в связи с их повышенной растворимостью в воде по сравнению с их соответствующей формой основания или кислоты, являются более подходящими для получения водных композиций. Композиции для введения через ноготь существуют в виде раствора, и носитель необязательно включает вещество, усиливающее проницаемость, который способствует проникновению противогрибкового средства в и через ороговевший слой ногтя. Среда растворителя включает воду, смешанную со вспомогательным растворителем, таким как спирт, имеющий от 2 до 6 атомов углерода, например этанол. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях могут быть предпочтительно использованы -, - и -циклодекстрины или их производные,в частности, гидроксиалкилзамещенные циклодекстрины, например, 2-гидроксипропилциклодекстрин или сульфобутилциклодекстрин. Также вспомогательные растворители, такие как спирты, могут улучшить растворимость и/или стабильность соединений по изобретению в фармацевтических композициях. Отношение активного ингредиента к циклодекстрину может изменяться в широких пределах. Например, может быть применено соотношение 1/100-100/1. Предпочтительное соотношение активного ингредиента к циклодекстрину находится в интервале от около 1/10 до 10/1. Более предпочтительное соотношение активного ингредиента к циклодекстрину находится в интервале от около 1/5 до 5/1. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, еще более предпочтительно от 0,1 до 50 мас.% соединения формулы (I) и от 1 до 99, 95 мас.%, более предпочтительно от 30 до 99,9 мас.%,еще более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, где все проценты приведены от общей массы композиции. В случае парентеральных композиций, могут быть включены также другие ингредиенты, способствующие растворению, например, циклодекстрины. Соответствующими циклодекстринами являются -, -, циклодекстрины или простые эфиры и смешанные простые эфиры, в которых одна или несколько гидроксильных групп ангидроглюкозных единиц циклодекстрина замещены C1-6 алкилом, в частности, метилом,этилом или изопропилом, например, случайным образом метилированным -CD; гидроксиС 1-6 алкилом, в частности гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиС 1-6 алкилом, в частности карбоксиметилом или карбоксиэтилом; C1-6 алкилкарбонилом, в частности ацетилом. В особенности следует отметить, что комплексообразователями и/или солюбилизаторами являются -CD, случайным образом метилированный -CD, 2,6-диметилCD, 2-гидроксиэтилCD, 2-гидроксиэтилСВ, 2 гидроксипропилCD и (2-карбоксиметокси)пропилCD, и, в частности, 2-гидроксипропилCD (2HPCD). Термин "смешанный эфир" обозначает производные циклодекстрина, где по крайней мере две циклодекстрин гидроксигруппы преобразованы в простой эфир с помощью различных групп, таких как, например, гидроксипропил и гидроксиэтил. Среднее молярное замещение (M.S.) используют как меру среднего числа молей алкоксильных групп на моль ангидроглюкозы. Средняя степень замещения (D.S.) относится к среднему числу замещенных гидроксильных групп на единицу ангидроглюкозы. Значение M.S. и D.S. может быть определено различными аналитическими методами, такими как ядерный магнитный резонанс (ЯМР), массспектрометрия (MS) и инфракрасная спектроскопия (ИК). В зависимости от используемого метода, могут быть получены слегка различные значения для одного данного производного циклодекстрина. Предпочтительно, как определено с помощью масс-спектрометрии, M.S. находится в диапазоне от 0,125 до 10 и D.S. находится в диапазоне от 0,125 до 3. Другие подходящие композиции для перорального или ректального введения включают частицы,состоящие из твердой дисперсии, содержащей соединение формулы (I) и одного или более соответствующих фармацевтически приемлемых водорастворимых полимеров. Используемый в дальнейшем термин "твердая дисперсия" обозначает систему в твердом состоянии(в отличие от жидкого или газообразного состояния), содержащую по крайней мере два компонента, в данном случае, соединение формулы (I) и водорастворимый полимер, в которой один компонент диспергирован практически равномерно в другом компоненте или компонентах (в случае дополнительных фармацевтически приемлемых веществ для получения лекарственного препарата, как правило, известных в данной области, включающих, например, пластификаторы, консерванты и тому подобное). Когда указанная дисперсия компонентов такова, что система является химически и физически полностью однородной или гомогенной, либо состоит из одной фазы, как это определяется в термодинамике, такая твердая дисперсия будет называться "твердый раствор". Твердые растворы являются предпочтительными физическими системами, так как компоненты в них, как правило, являются биологически легко доступными для организмов, которым они вводятся. Этот эффект, вероятно, можно объяснить легкостью, с которой указанные твердые растворы могут образовывать жидкие растворы при контакте с жидкой средой,такой как желудочно-кишечные соки. Легкость растворения может быть связана с тем, по крайней мере отчасти, что энергия, необходимая для растворения компонентов из твердого раствора, меньше, чем требуется для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Термин "твердая дисперсия" также включает дисперсии, которые являются менее гомогенными,чем твердые растворы. Такие дисперсии не являются химически и физически гомогенными или содержат более одной фазы. Например, термин "твердая дисперсия" также относится к системе, имеющей зоны или небольшие области, где аморфное микрокристаллическое или кристаллическое соединение формулы(I), или аморфный микрокристаллический или кристаллический водорастворимый полимер, или оба,диспергированы практически равномерно в другой фазе, содержащей водорастворимый полимер или соединение формулы (I), или твердый раствор, содержащий соединение формулы (I) и водорастворимый полимер. Вышеуказанные зоны являются областями в твердой дисперсии, отчетливо заметными по некоторому физическому признаку (свойству), небольшими по размеру и равномерно и в случайном порядке распределенными по твердой дисперсии. Кроме того, может быть пригодным получение противогрибковых соединений по настоящему изобретению в форме наночастиц, которые имеют модификатор поверхности, адсорбированный на их поверхности, в количестве, достаточном для поддержания эффективного среднего размера частиц менее 1000 нм. Используемые модификаторы поверхности, как полагают, включают такие модификаторы поверхности, которые физически адгезируются на поверхности противогрибкового средства, но химически не связываются с противогрибковым средством. Подходящие модификаторы поверхности, предпочтительно, могут быть выбраны из известных органических и неорганических фармацевтических наполнителей. Такие наполнители включают различные полимеры, низкомолекулярные олигомеры, природные вещества и поверхностно-активные вещества. Предпочтительные модификаторы поверхности включают неионные и анионные поверхностно-активные вещества. Еще один представляющий интерес способ получения соединений по настоящему изобретению включает в себя фармацевтическую композицию, в которой противогрибковые средства по настоящему изобретению включены в гидрофильные полимеры, и нанесение этой смеси в качестве пленочного покрытия на множество небольших гранул, с получением, таким образом, композиции, которая может быть легко обработана, и которая является подходящей для получения фармацевтических лекарственных форм для перорального введения. Указанные гранулы содержат расположенное в середине ядро круглой или сферической формы,пленочное покрытие из гидрофильного полимера, противогрибковое средство и слой защитного покрытия. Множество веществ является пригодным для применения в качестве ядра в гранулах, при условии,что указанные вещества являются фармацевтически приемлемыми и имеют соответствующие размеры и плотность. Примерами таких веществ являются полимеры, неорганические вещества, органические вещества и сахариды, и их производные. Для простоты введения и единообразия доз, в частности, особенно предпочтительно готовить вы- 19021220 шеуказанные фармацевтические композиции в виде стандартной лекарственной формы. Лекарственная форма, используемая в описании и формуле изобретения, относится к физически дискретным единицам,подходящим в качестве единичных доз, каждая единица содержит определенное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки, покрытые оболочкой), капсулы, пилюли, суппозитории, пакетированные порошки, облатки, инъецируемые растворы или суспензии, чайные ложки, столовые ложки и тому подобное, и их отдельное кратное количество. Поскольку соединения в соответствии с изобретением являются эффективными соединениями для перорального введения, фармацевтические композиции, содержащие указанные соединения для перорального введения, являются особенно предпочтительными. Следующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть Здесь и далее, термин "DCM" обозначает дихлорметан; "МеОН" обозначает метанол; "LCMS" обозначает жидкостную хроматографию/масс-спектрометрию; "ВЭЖХ" обозначает высокоэффективную жидкостную хроматографию; "к.т." обозначает комнатную температуру; "т.пл." обозначает точку плавления; "мин" обозначает минуту(ы); "час" обозначает час(ы); "вн.д." обозначает внутренний диаметр;"EtOAc" обозначает этилацетат; "Et3N" обозначает триэтиламин; "EtOH" обозначает этанол; "экв." обозначает эквивалент; "р.с." обозначает реакционную(ые) смесь(и); "q.s." сколько нужно; "СФХ" обозначает сверхкритическую флюидную хроматографию; "ТГФ" обозначает тетрагидрофуран; "НОАс" обозначает уксусную кислоту; "DEA" обозначает диэтиламин, "HOBt" обозначает 1-гидрокси-1 Н-бензотриазол;"EDCI" обозначает моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина. А. Получение промежуточных соединений Пример А 1. а-1)" Получение промежуточного соединения 1 2-Хлор-6-(1 Н-пиррол-1-ил)бензонитрил (50 г, 0,2467 моль) растворяли в ТГФ (500 мл). В этот раствор при комнатной температуре добавляли по каплям 10,0 М раствор ВН 3 в Me2S (27,1 мл, 0,2714 моль). Реакционную смесь далее перемешивали и кипятили с обратным холодильником в течение 12 ч. Затем смесь охлаждали до комнатной температуры и добавляли по каплям раствор 6 н HCl (47 мл). Реакционную смесь нагревали при температуре кипения в течение 30 мин. Прозрачный раствор охлаждали до температуры 0 С и добавляли NaOH (55,5 г). Смесь экстрагировали с помощью EtOAc и насыщенного солевого раствора. Органический слой сушили (MgSO4), фильтровали, и растворитель упаривали, получая 46,5 г продукта в виде свободного основания. Затем продукт подкисляли с помощью смесиHCl/диоксан (q.s.) с получением 55 г промежуточного соединения 1 (97%-ный выход; HCl). а-2) Альтернативный способ получения промежуточного соединения 1 Смесь 2-хлор-6-(1 Н-пиррол-1-ил)бензонитрила (0,08 моль) в MeOH/NH3 (250 мл) гидрировали при температуре 14 С с помощью никеля Ренея (2 г) в качестве катализатора, в присутствии 4%-ного раствора тиофена в МеОН (2 мл). После обработки Н 2 (2 экв.), катализатор отфильтровывали и фильтрат упаривали. Далее добавляли 6 н раствор 2-пропанол/HCl (14 мл). Затем растворитель упаривали, получая смесь 2-(1 Н-пиррол-1-ил)бензолметанамина и промежуточного соединения 1 в виде HCl-соли (HCl). Данную смесь использовали на следующей стадии реакции как таковую без дополнительной очистки. Пример А 2. Получение промежуточного соединения 2 4-(1,1-Дифторэтил)бензойную кислоту (5,05 г, 27,1 ммоль) растворяли в DCM (100 мл). В этот раствор добавляли Et3N (10 мл, 60,9 ммоль), HOBt (3,6 г, 27,1 ммоль), EDCI (5,18 г, 27,1 ммоль) и промежуточное соединение 1 (6,0 г, 2 4,7 ммоль) и реакционную смесь перемешивали в течение ночи. Затем добавляли воду (q.s.) и смесь экстрагировали с помощью DCM. Отделенный органический слой сушили(Na2SO4), фильтровали, и растворитель упаривали. Остаток очищали путем хроматографии на колонке(петролейный эфир/EtOAc, градиентное элюирование от 15/1 до 10/1). Фракции продукта собирали, и растворитель упаривали в вакууме, получая 8,2 г промежуточного соединения 2 (88,6%-ный выход). Пример A3. а) Получение промежуточного соединения 3(45,7 г, 346 ммоль) и гидрохлорида пиридина (1:1) (40 г, 346 ммоль) в диоксане (500 мл) нагревали при кипении с обратным холодильником в течение ночи. Затем растворитель упаривали, и остаток растворяли в EtOAc (100 мл). Данный раствор промывали насыщенным солевым раствором и водой. Органический слой отделяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Выход: 70 г сырого промежуточного соединения 3, которое использовали как таковое на следующей стадии реакции.b) Получение промежуточного соединения 4 К раствору промежуточного соединения 3, HOBt (47 г, 346 ммоль) и EDCI (70 г, 34 6 ммоль) в ДМФ(300 мл) добавляли NH3H2O (100 мл). Реакционную смесь перемешивали в течение ночи. Потом растворитель упаривали и остаток растворяли в EtOAc. Этот органический раствор сначала промывали насыщенным солевым раствором и водой, затем сушили (MgSO4) и фильтровали, и в конце растворитель упаривали. Выход: 55 г сырого промежуточного соединения 4, которое использовали как таковое на следующей стадии реакции. с) Получение промежуточного соединения 5 К смеси промежуточного соединения 4 (45 г, 202,5 ммоль) в ТГФ (500 мл) добавляли BH3Me2S (10 М раствор; 40,5 мл, 405 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи в атмосфере N2. Далее смесь охлаждали на бане лед-вода и добавляли 6 н раствор HCl (10 мл). Смесь опять кипятили с обратным холодильником в течение 30 мин. Смесь охлаждали на бане лед-вода и добавляли твердый NaOH до рН 9. Смесь экстрагировали с помощью DCM (2 раза по 30 0 мл) . Органические слои отделяли, объединяли, сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток коричневого цвета преобразовывали в HCl солевую форму (1:1) с помощью смеси HCl/2-пропанол, получая 35 г промежуточного соединения 5 (71%-ный выход).d) Получение промежуточного соединения 6 4-(1,1-Дифторэтил)бензойную кислоту (1,17 г, 6,13 ммоль) растворяли в DCM (50 мл). К раствору добавляли Et3N (7,3 мл), HOBt (0,828 г, 6,13 ммоль), EDCI (1,17 г, 6,13 ммоль) и промежуточное соединение 5 (1,5 г, 6,13 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем растворитель упаривали и к остатку добавляли воду. Водную смесь экстрагировали с помощью DCM. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворитель упаривали. Выход: 1,4 г промежуточного соединения 6 (60%-ный выход). Пример А 4. а) Получение промежуточного соединения 7 мл) в токе N2. Раствор нагревали при температуре 50 С в течение 16 ч и затем выливали в раствор NaHCO3 (q.s.). Полученную смесь экстрагировали с помощью EtOAc. Органический слой отделяли, сушили(Na2SO4), фильтровали и растворитель упаривали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: петролейный эфир/EtOAc от 30/1 до 20/1). Желаемые фракции собирали и растворитель упаривали в вакууме. Выход: 10,5 г промежуточного соединения 7b) Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (8,2 г, 5,7 ммоль) в 20%-ном растворе NaOH (50,0 мл) и EtOH(20,0 мл) кипятили с обратным холодильником и перемешивали в течение ночи. Затем смесь концентрировали в вакууме. HCl добавляли до рН 2, и образовывался осадок. Осадок отфильтровывали и сушили в вакууме. Твердый продукт использовали как таковой на следующей стадии реакции. Выход: 9,2 г промежуточного соединения 8. с) Получение промежуточного соединения 9 Смесь промежуточного соединения 1 (1,0 г, 4,2 ммоль), промежуточного соединения 8 (1,0 г, 5,0 ммоль), Et3N (5,0 мл, 36 ммоль), HOBt (0,62 г) и EDCI (0,96 г) в DCM (40 мл) перемешивали в течение ночи при комнатной температуре. Полученную смесь промывали водой (3 раза по 100 мл), сушили(MgSO4), фильтровали, и растворитель упаривали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: петролейный эфир/EtOAc от 20/1 до 10/1). Желаемые фракции собирали, и растворитель упаривали в вакууме. Выход: 0,9 г промежуточного соединения 9 В суспензию CuCN (21,5 г, 242 ммоль) в CH3CN (500 мл) добавляли трет-бутил нитрит (25 г, 242 ммоль). Смесь нагревали при температуре 70 С и перемешивали в течение 15 мин. Затем добавляли смесь 2-хлор-4-фтор-6-нитробензоламина (23 г, 121 ммоль) и CH3CN (q.s.), и полученный раствор коричневого цвета нагревали в течение ночи при температуре 70 С. Растворитель удаляли в вакууме. К остатку добавляли воду (q.s.) и водную смесь экстрагировали с помощью EtOAc. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: EtO Ас/петролейный эфир 1/4). Желаемые фракции собирали, и растворитель упаривали. Выход: 10 г промежуточного соединения 10 (41%-ный выход; твердый продукт желтого цвета).b) Получение промежуточного соединения 11 К раствору промежуточного соединения 10 (10 г, 50 ммоль) в НОАс (250 мл) по частям добавлялиFe (11,6 г, 200 ммоль). Реакционную смесь нагревали при температуре 70 С в течение 1 ч и затем охлаждали до комнатной температуры. Твердый продукт отфильтровывали, и растворитель упаривали. Остаток растворяли в EtOAc, промывали водным раствором NaHCO3 и водой. Органический слой сушили(MgSO4), фильтровали и растворитель упаривали. Выход: 6,2 г промежуточного соединения 11, которое использовали как таковое на следующей стадии реакции. с) Получение промежуточного соединения 12 Раствор промежуточного соединения 11 (6 г, 35 ммоль) и тетрагидро-2,5-диметоксифурана (4,66 г,35 ммоль) в НОАс (50 мл) нагревали при температуре кипения в течение 6 ч. Затем растворитель упаривали и остаток очищали путем хроматографии на колонке с силикагелем (элюент: DCM). Желаемые фракции собирали и растворитель упаривали. Выход: 4,6 г промежуточного соединения 12 (90%-ный выход).d) Получение промежуточного соединения 13 К смеси промежуточного соединения 12 (4,4 г, 20 ммоль) в ТГФ (50 мл) добавляли 10 М растворBH3Me2S (2 мл; 20 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи в атмосфере N2. Далее смесь охлаждали на бане лед-вода, и к смеси осторожно добавляли 6 н раствор HCl(10 мл). Раствор затем вновь кипятили с обратным холодильником в течение 30 мин и затем опять охлаждали на бане лед-вода. Добавляли твердый NaOH до рН 9. Смесь экстрагировали с помощью DCM (2 раза по 300 мл). Отделенный органический слой сушили (MgSO4), фильтровали, и растворитель упаривали. Остаток коричневого цвета преобразовывали в HCl соль (1:1) с помощью смеси HCl/2-пропанол. Выход: 5 г промежуточного соединения 13 (96%-ный выход). Пример А 6. а) Получение промежуточного соединения 14 Реакцию проводили в атмосфере N2: Смесь 4-бром-3-фторбензонитрила (6,0 г, 30,00 ммоль) и (1 этоксиэтенил)трибутилолова (11,2 мл, 33,00 ммоль) в толуоле (100 мл) перемешивали при комнатной температуре. К смеси добавляли Pd(PPh3)2Cl2 (0,72 г, 1,03 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником и перемешивали в течение ночи. Смесь охлаждали, и к смеси при перемешивании добавляли 2 н раствор KF (50 мл). Спустя 30 мин к смеси добавляли 6 н раствор HCl (100 мл) и смесь нагревали при температуре 70 С и перемешивали в течение 2 ч. Нерастворимые вещества отфильтровывали и фильтрат экстрагировали с помощью EtOAc (3 раза по 80 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Выход: 4,3 г промежуточного соединения 14 (88%-ный выход). Промежуточное соединение 14 может быть далее подвергнуто взаимодействию аналогично методике реакции, описанной в примере А 4, с получением соединения 29. Пример А 7. а) Получение промежуточного соединения 15 Смесь 4-хлор-2,6-дифторбензонитрила (1,66 г, 9,56 ммоль), пиррола (0,67 г, 10 ммоль) и Cs2CO3 (3,7 г, 12 ммоль) в ДМФ (20 мл) перемешивали в течение ночи. Далее твердый продукт отфильтровывали, и растворитель удаляли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: смесь EtOAc/петролейный эфир 10/1). Желаемые фракции собирали, и растворитель упаривали. Выход: 1,1 г промежуточного соединения 15 (15%-ный выход; твердый продукт белого цвета). Промежуточное соединение 15 может быть далее подвергнуто взаимодействию аналогично методике реакции, описанной в примере А 1, с получением соединение 32. В. Получение соединений Пример В 1. Смесь промежуточного соединения 1 (9,5 г, 39,2 ммоль) и 4-(1,1-дифторэтил)бензальдегида (8,0 г,47,0 ммоль) в EtOH (15 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч. Затем смесь охлаждали и кристаллизовали в течение ночи. Осадок отфильтровывали, промывали изопропиловым эфиром и сушили в вакууме. Выход: 8,0 г соединения 1 (52,2%-ный выход). Соединение 2: S энантиомер; Соединение 3: R энантиомер Соединение 1 выделяли в виде его энантиомеров с помощью хиральной СФХ (Колонка AD 300 мм 50 мм, 20 мкМ; Подвижная фаза: СО 2/МеОН(0,2% DEA) 60/40; Поток: 200 мл/мин). Две различные фракции собирали, и обе фракции преобразовывали в форму HCl соли с помощью смеси HCl/EtOH 1/1. Выход: 3,2 г соединения 2 (20,8%-ный выход; S конфигурация). Выход: 3,0 г соединения 3 (19,6%-ный выход; R конфигурация). Пример В 2. а) Получение соединения 4 Смесь соединения 1 (0,334 г, 0,0009 моль) и МnО 2 (2,6 г, 0,0299 моль) в DCM (15 мл) перемешивали в течение 96 ч при комнатной температуре. Далее осадок отфильтровывали через диатомовую землю и фильтрат упаривали. Остаток очищали с помощью препаративной ВЭЖХ, получая 0,19 г соединения 4b) Альтернативное получение соединения 4 Промежуточное соединение 2 (4,0 г, 10,67 ммоль) растворяли в POCl3 (12 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи. Далее смесь охлаждали и выливали в воду. Водную смесь нейтрализовали с помощью NaOH до рН 7 и затем экстрагировали с помощью DCM. Отделенный органический слой сушили (Na2SO4)/фильтровали и растворитель упаривали. Остаток кристаллизовали из EtOH, получая соединение 4 (56,3%-ный выход). Пример В 3. а) Получение соединения 18 Промежуточное соединение 6 (1,4 г, 3,71 ммоль) растворяли в POCl3 (10 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи. Затем смесь охлаждали и выливали в воду. Водную смесь нейтрализовали с помощью NaOH до рН 7, и затем экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали путем колоночной флэш хроматографии на силикагеле (элюент: смесь петролейный эфир/EtOAc 4/1). Фракции продукта собирали и растворитель упаривали с выходом 150 мг соединения 118 (21,6%-ный выход). Пример В 4. а) Получение соединения 21 Промежуточное соединение 9 (0,80 г, 2,0 ммоль) растворяли в POCl3 (3 мл). Смесь перемешивали в течение ночи при температуре 100 С. Затем реакционную смесь выливали в ледяную воду. ДобавлялиNaOH до рН 8-9. Смесь затем экстрагировали с помощью DCM. Органические слои отделяли, сушили(Na2SO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: смесь петролейный эфир/EtOAc от 10/1 до 5/1). Желаемые фракции собирали, и растворитель упаривали в вакууме. Выход: 0,510 г соединения 21 (выход 68 %). Пример В 5. а) Получение соединения 24 Раствор промежуточного соединения 13 (0,52 г, 2 ммоль) и 4-(1,1-дифторэтил)бензальдегида (0,374 г, 2 ммоль) в EtOH (5 мл) нагревали при кипении с обратным холодильником в течение 4 ч. Затем смесь охлаждали до комнатной температуры и твердый продукт собирали и сушили. Выход: 0,6 г соединения 24 (80%-ный выход; HCl). Используя аналогичные методики реакции, описанные в следующих примерах, были получены следующие соединения. "Соед. " обозначает номер соединения. "Сп." относится к номеру примера, в соответствии с которым осуществляли способ получения соединения. В случае, когда солевая форма не указана, соединение было получено в форме свободного основания. Соединения, где R3 и R4 представляют собой водород, и для которых в табл. 1 не указана конкретная стереохимия, были получены в виде смесей энантиомеров. В случае, когда целевое соединение, полученное с использованием аналогичных методик, как описано в В 1 или В 5, не преобразуются полностью в форму HCl соли, соединение преобразовывали в формуHCl соли, используя способы, известные специалисту в данной области. Согласно типичному способу,соединение растворяли в растворителе, таком как, например, 2-пропанол, и затем постепенно по каплям добавляли раствор HCl в растворителе, таком как, например, 2-пропанол. Перемешивание в течение определенного периода времени, обычно около 10 мин, может повысить скорость реакции. Таблица 1.LCMS Измерения ВЭЖХ осуществляли с использованием модуля Agilent 1100, содержащего насос, диодно-матричный детектор (DAD) (используемая длина волны 220 нм), колоночный нагреватель и колонку,как указано в соответствующих методиках ниже. Поток из колонки разделяли на Agilent MSD SeriesG194 6C и G1956A. MS детектор был настроен с API-ES (ионизация электрораспылением при атмосферном давлении). Масс-спектры были получены путем сканирования от 100 до 1000. Напряжение капиллярной иглы было 2500 В для положительного и 3000 В для отрицательного режима ионизации. Напряжение фрагментации было 50 В. Температуру осушающего газа поддерживали при 350 С при потоке 10 л/мин. Обращенно фазовую ВЭЖХ проводили на YMC-Pack ODS-AQ, 502,0 мм 5 мкм колонка со скоростью потока 0,8 мл/мин. Использовали 2 подвижные фазы (подвижная фаза А: вода с 0,1% ТФУ; подвижная фаза В: CH3CN с 0,05% ТФУ). Сначала, 90% А и 10% В проводили в течение 0,8 мин. Затем применяли градиент 20% А и 80% В в 3,7 мир и проводили в течение 3 мин. Использовали типичные объемы инъекций в 2 мкл. Температура печи была 50 С. (полярность MS: положительная). Точки плавления Для ряда соединений точки плавления (т.пл.) определяли с помощью прибора для определения точек плавления WRS-2A от фирмы Shanghai Precision and Scientific Instrument Co. Ltd. Точки плавления определяли при линейном нагревании со скоростью 0,2-5,0 С/мин. Представленные значения являются интервалами плавления. Максимальная температура была 300 С. Результаты аналитических определений показаны в табл. 2.H ЯМР Для ряда соединений спектр 1 Н ЯМР определяли на спектрометре Bruker DPX-300 или Bruker DPX400 со стандартной последовательностью импульсов, работающих при 300 МГц и 400 МГц, соответственно, используя в качестве растворителей хлороформ-d (дейтерированный хлороформ, CDCl3) или ДМСО-d6 (дейтерированный ДМСО, диметил-d6 сульфоксид). Химические сдвигипредставлены в миллионных долях (м.д.) относительно тетраметилсилана (ТМС), который использовали в качестве
МПК / Метки
МПК: C07D 487/04, A61K 31/5517, A61P 31/10
Метки: противогрибковые, производные, 1,4]бензодиазепина, 5,6-дигидро-4-[(дифторэтил)фенил]-4h-пирроло[1,2-а][1,4]бензодиазепина, 4-(дифторэтил)фенил-6h-пирроло[1,2-а
Код ссылки
<a href="https://eas.patents.su/30-21220-protivogribkovye-proizvodnye-56-digidro-4-diftoretilfenil-4h-pirrolo12-a14benzodiazepina-i-4-diftoretilfenil-6h-pirrolo12-a-14benzodiazepina.html" rel="bookmark" title="База патентов Евразийского Союза">Противогрибковые производные 5,6-дигидро-4-[(дифторэтил)фенил]-4h-пирроло[1,2-а][1,4]бензодиазепина и 4-(дифторэтил)фенил-6h-пирроло[1,2-а] [1,4]бензодиазепина</a>
Предыдущий патент: Игровая принадлежность, в частности игральная кость
Следующий патент: Способ устранения трещин в шпалах и заливочный раствор для этого способа
Случайный патент: Фунгицидная смесь на базе протиоконазола и пикоксистробина