Производные 2,3-бензодиазепина
Номер патента: 471
Опубликовано: 26.08.1999
Авторы: Шойом Шандор, Чузди Эмеше, Андраши Ференц, Моравчик Имре, Линг Иштван, Хорват Каталин, Хамори Тамаш, Тарнава Иштван, Абрахам Гизелла, Гал Мелинда, Сёллёши Марта, Берженьи Пал
Формула / Реферат
1. Соединения формулы I
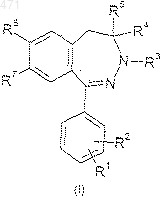
где R1 и R2 означают, независимо друг от друга, водород, галоген, C1-4 алкильную группу, C1-4 алкоксигруппу, нитрогруппу, трифторметильную группу или группу формулы -NR8R9, где R8 и R9 означают, независимо друг от друга, водород, С1-4 алкильную группу или группу формулы -COR10, где R10 означает водород, C1-6 алкильную группу, которая может быть замещена, С6-10 арильную группу, C1-4 алкоксигруппу, С3-5 циклоалкильную группу, С2-6 алкенильную группу, С3-5 циклоалкоксигруппу или группу формулы -NR11R12, где R11 и R12 означают, независимо друг от друга, водород, С1-4 алкильную группу, С3-5 циклоалкильную группу или С6-10 арильную группу; R3 означает C1-4 алкильную группу, С3-5 циклоалкильную группу или группу формулы -CO-R13, в которой R13 имеет те же значения, что и R10; R4 и R5 означают, независимо друг от друга, водород или C1-3 алкильную группу, R6 и R7 означают, независимо друг от друга, водород, хлор или бром, причем если один из R6 и R7 означает водород, то другой отличается от водорода, а также их изомеры и соли присоединения кислот этих соединений или изомеров.
2. Соединение формулы I по п.1: 3-ацетил-1-(4-аминофенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин.
3. Соединение формулы I по п.1: 1-(4-аминофенил)-8-хлор-4-метил-3-метилкарбамоил-4,5-дигидро-3H-2,3-бензодиазепин.
Текст
1 Изобретение относится к новым 2,3 бензодиазепинам, замещенным одним или двумя атомами галогена. Известен ряд биологически активных и терапевтически полезных 2,3-бензодиазепинов,в которых бензольное кольцо замещено двумя метоксигруппами или метилендиоксигруппой. 7,8-Диметоксипроизводные описаны в HU-P155 572, 179 018, 191 702 и 195 788. Эти соединения обладают, в первую очередь,транквилизаторной и/или антидепрессантной, а также позитивной инотропической активностью. Соединения,содержащие метилендиоксизаместитель в тех же позициях бензольного кольца, известны из HU-P191 698, 191 702 и 206 719, а также из US-P5,459, 137. По сравнению с диметокси-2,3 бензодизепинами метилендиоксисоединения отличаются, в основном, спазмоингибирующей,расслабляющей мускулы и нейрозащитной активностями. Из литературы известно, что последние соединения проявляют свою активность через неконкурентное ингибирование АМРА рецептора. (См. среди прочих: S.D.Donevan etI. Tarnawa et al., Bioorg. Med. Chem. Lett., 3, 99104 (1993). Далее, известно, что в центральной нервной системе млекопитающихLглутаминовая кислота является наиболее важным нейротрансмиттером акта возбуждения. При патологических обстоятельствах концентрация глутаминовой кислоты во внешнем пространстве клетки сильно повышается,приводя к острому или хроническому повреждению клеток центральной нервной системы. Возбуждающие аминокислоты, такие как глутаминовая кислота, проявляют свое действие путем активирования как ионотропических рецепторов (т.е. рецепторов ионных каналов),так и метаболотропических рецепторов,которые связываются с белками G. Типы ионотропических глутаматных рецепторов определяются в соответствии с агонистами,подходящими для их селективного возбуждения. Таким образом, различаютNMDA, АМРА и каинатный (ранее называемый квисквалатный) рецепторы, причем каждый тип рецептора включает подтипы (Ann. Rev.Neurosci., 17, 31 (1994. Было показано,что глутаматные рецепторы типа АМРА играют важную роль в ряде острых и хронических заболеваний,затрагивающих нервную систему, таких как эпилепсия, сопровождающихся мышечными судорогами,и в различных нейродегенеративных заболеваниях. Таким образом,путем ингибирования АМРА рецепторов можно добиться ингибированияExp. Ther., 260. 742 (1992. Активация АМРА рецепторов может быть ингибирована путем конкурентных и неконкурентных антагонистов. В большинстве случаев по сравнению с конкурентными антагонистами использование неконкурентных антагонистов может быть предпочтительно, так как достигается более сильная защита при экстремально высокой концентрации возбуждающей аминокислоты (Epilepsy Res., 15,179 (1993. Исходя из вышеизложенного, особое значение настоящего изобретения заключается в том, что 2,3-бензодиазепины, замещенные метилендиоксигруппой, обладают, вследствие их неконкурентной АМРА антагонистической активности,как спазмоингибирующим,расслабляющим мускулы, так и нейрозащитным эффектом, следовательно, эти соединения могут быть использованы в терапии как антиспазмолитики, антиэпилептики, а также при острых и хронических нейродегенеративных заболеваниях и потенциально при любых заболеваниях, где желательно ингибирование возбуждающей аминокислоты на уровне рецептора. К удивлению, было обнаружено, что терапевтически важная неконкурентная антагонистическая активность АМРА рецептора сохраняется, если бензольное кольцо содержит вместо метилендиоксигруппы один или два атома хлора или брома. Более того, было обнаружено, что новые галогеновые соединения имеют более предпочтительные свойства, чем известные соединения. Это наблюдение было удивительным, так как считается,что присутствие метилендиоксигруппы является необходимым условием для того, чтобы соединения проявляли вышеуказанную активность. Таким образом, изобретение относится к новым 2,3-бензодиазепинам формулы I где R1 и R2 означают, независимо друг от друга,водород, галоген, С 1-4 алкильную группу, С 1-4 алкоксигруппу, нитрогруппу, трифторметильную группу или группу формулы -NR8R9, где R8 и R9 означают, независимо друг от друга, 3 водород, C1-4 алкильную группу или группу формулы -COR10, где R10 означает водород, C1-6 алкильную группу, которая может быть замещена, С 6-10 арильную группу, С 1-4 алкоксигруппу, С 3-5 циклоалкильную группу,C2-6 алкенильную группу,С 3-5 циклоалкоксигруппу или группу формулы -NR11R12,где R11 и R12 означают, независимо друг от друга, водород, С 1-4 алкильную группу, С 3-5 циклоалкильную группу или С 6-10 арильную группу,R3 означает С 1-4 алкильную группу, С 3-5 циклоалкильную группу или группу формулы-CO-R13, в которой R13 имеет те же значения,что и R10,R4 и R5 означают, независимо друг от друга, водород или C1-3 алкильную группу,R6 и R7 означают, независимо друг от друга, водород, хлор или бром, причем если один из R6 и R7 означает водород, то другой отличается от водорода,а также к их изомерам и солям присоединения кислот. В значениях радикалов, представленных для формулы I, алкильная и алкиленовая группы имеют прямую или разветвленную цепочку. Если алкильная группа является замещенной, то заместителем служит алкоксигруппа или галоген. Циклоалкильной группой является циклопропильная,циклобутильная или циклопентильная группа. Арильной группой является фенил или нафтил. Так как соединения формулы I имеют хиральный центр, под изомерами соединений формулы I подразумеваются оба энантиомера и,в случае определенных замещений,стереоизомеры Е и Z, а также диастереомеры,таутомеры и их смеси, такие как рацематы. Соли присоединения кислот соединений формулы I - это соли, полученные при взаимодействии с физиологически подходящими неорганическими или органическими кислотами. Подходящими неорганическими кислотами являются,например, хлористо-водородная, бромистоводородная, фосфорная или серная кислоты. Подходящими органическими кислотами являются, например, муравьиная, уксусная,малеиновая, фумаровая, яблочная, молочная,винная, лимонная или метансульфокислота. Предпочтительная подгруппа соединений изобретения состоит из соединений формулы I,где R1 означает аминогруппу в позиции 4, R2, R4 и R6 означают водород, R5 означает метильную группу, R7 означает галоген и R3 означает алифатическую ацильную группу или алкилкарбамоильную группу. Из этой предпочтительной подгруппы,особенно предпочтительными соединениями являются те, в которых R3 означает ацетил,пропионил,циклопропилкарбонил или метилкарбамоил. 4 Соединения настоящего изобретения могут быть получены из соответствующих исходных соединений формулы II где R1, R2, R4, R5, R6 и R7 таковы, как определено выше способами, аналогичными описанным вHU-P206 719 или US-P5, 459, 137. Соединения формулы I также могут быть получены следующим образом: замещенное подходящим образом производное изохромана окисляют на воздухе с получением полукеталя,который реагирует с оксореагентом,подходящим для введения ацильной группы в позицию 3 (например гидразидом карбоновой кислоты, полукарбазидом и т.д.), затем получают бензодиазепиновое кольцо посредством метилсульфонилирования и замыкания цикла путем щелочной обработки. Детали получения соединений формулы I отражены в примерах. В предпочтительном получении соединений изобретения используются обычные методы синтеза 2,3-бензодиазепина. Таким образом,аминогруппы алкилируют алкилгалогенидом,или используется восстановительное аминирование с оксосоединением. Ацилирование проводят, как правило, хлоридом, ангидридом, смешанным ангидридом кислоты или алкилили фенилхлоркарбонатом - в случае катализа с агентом,связывающим кислоту,и/или производным пиридина при комнатной температуре или при повышенной температуре в растворителе. Карбамоильные группы получают путем реакции с соответствующим изоцианатом. Однако также возможно ацилирование активным сложным эфиром, таким как фенилхлоркарбонат, с последующей реакцией полученного соединения с первичным или вторичным аминосоединением. Нитрогруппы обычно восстанавливают каталитически в присутствии никелевого катализатора Ренея,палладиевого или платинового катализатора. Кроме газообразного водорода в качестве источника водорода может быть также использован гидрат гидразина или, например,формиат аммония. Исходные соединения формулы 5 относится к этим соединениям. Их получают способом, описанным в HU-P191 702, либо по аналогии с получением известных соединений. Детали способа получения соединений формулы II отражены в примерах. Как было указано выше, соединения настоящего изобретения обладают значительной неконкурентной АМРА антагонистической активностью, поэтому они могут быть использованы в терапии как антиспазмолитики для расслабления мускулов, а также для нейрозащиты,в лечении других неврологических и психических расстройств,которые могут быть отнесены к состоянию повышенного возбуждения АМРА рецептора. Соединения формулы I могут быть трансформированы в фармацевтические композиции,которые могут вводиться энтерально или парэнтерально. Для этой цели могут быть использованы традиционные органические или неорганические носители или наполнители фармацевтической индустрии,такие как вода, желатин, арабская смола,лактоза, крахмал, стеарат магния, тальк,растительные масла, полиэтиленгликоль и т.д. Фармацевтическая композиция может быть приготовлена в форме твердого препарата,такого как таблетка, драже, суппозиторий или капсула, или в форме жидкого препарата, такого как раствор, суспензия или эмульсия. В дополнение к носителям и средам, указанным выше,могут быть использованы добавки, обладающие сохраняющими, стабилизирующими, эмульгирующими, буферными и прочими свойствами. Препарат для парэнтерального введения состоит из стерильного раствора или суспензии активного ингредиента. В этом случае стерильный носитель может содержать одно или несколько вспомогательных средств, например местный анестетик, стабилизирующий агент или буфер. Дозировка, вводимая пациенту, зависит от метода введения, типа и тяжести заболевания, а также от веса и возраста пациента. Суточная дозаот 0,5 до 1000 мг, предпочтительно от 20 до 200 мг, и может быть введена однократно или в несколько примов. АМРА антагонистическая активность соединений формулы I продемонстрирована следующим тестом. Антагонистический эффект каинатаvitro определялась на препарате изолированной куриной сетчатки (M.J. Sheardown, Brain Res.,607,189(1993. Распространяющаяся депрессия была стимулирована 5 микроМ каината (химическое название каинатной кислоты 2-карбокси-4-изопропил-3 пиролидинуксусная кислота), и значения IС 50 определялись по Sheardown. Соединения тестировали, по крайней мере, в трех 6 концентрациях. Соединения,имеющие антагонистическую АМРА активность,ингибируют ответ на каинат, имеющий агонистическую активность АМРА рецептора,причем полученное ингибирование зависит от концентрации этих соединений. Значения IC50 показаны в табл.1. Таблица 1 Каинатная антагонистическая активностьin vitro. Соединение Ретинальнаяпримера распространяющаяся депрессия in vitro IC50 в микроМ 2 3,2 4 3,6 6 8,2 8 4,6 10 2,5 12 1,2 А 9,5 Эталонное соединение. А. 5-(4-аминофенил)-9 Н-1,3-диоксоло/4,5h/-/2,3/бензодиазепин (GYKI 52 466; HU-P No. 191 698, пример 8). Соединения настоящего изобретения и способ их получения далее поясняются следующими примерами без ограничения объема охраны изобретения. Пример 1. 3-Ацетил-7-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепин 0,72 г (2,2 ммоль) 7-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепина перемешивали в 4 мл уксусного ангидрида при 25 С в течение 3 ч, затем реакционную смесь вливали в 20 мл ледяной воды,кристаллический продукт отфильтровывали и промывали водой несколько раз. Полученный продукт очищали, суспендируя его в 4 мл горячего этанола. После фильтрации и сушки было получено 0,69 г (88%) названного соединения. Температура плавления: 174-175 С. Исходное соединение примера I получали следующим образом. Стадия А. 6-хлор-3-метил-1-(4 нитрофенил) изохроман. К раствору 17,06 г (100 ммоль) 1-(3-хлорофенил)-2-пропанола, приготовленного путем, аналогичным описанному вJ.Med.Chem., 21, 454 (1978), и 15,11 г (100 ммоль) 4-нитробензальдегида в 100 мл безводного бензола добавляли 13,65 г (100 ммоль) хлорида цинка (хлорид цинка был прокален перед добавлением) и чepeз этypeaкциoннyю смесь в течение 3 ч пpoпycкaли безводный газообразный хлористый водород. Смесь кипятили в течение 2,5 ч, затем после охлаждения смешивали с 100 мл воды. Органическую фазу отделяли, промывали водой, водным раствором бикарбоната натрия,затем насыщенным водным раствором хлорида 7 натрия, сушили и упаривали. Кубовый остаток 30,95 г маслянистого продукта кристаллизовали из 200 мл горячего этанола для получения 23,49 г (77%) названного соединения. Температура плавления: 118-120 С. Стадия Б. 6-хлор-3-метил 1-(4 нитрофенил)-2-бензопирилия перхлорат. 26,9 г (88,5 ммоль) производного изохромана, полученного на стадии А,растворяли в 270 мл ацетона и к полученному раствору добавляли по каплям 116 мл (310 ммоль) реагента Джонса (Jones'), охлаждая смесь на льду в течение 1 ч, затем реакционную смесь перемешивали при 25 С в течение 4 ч. Соль хромилия, выделенную в результате реакции,отфильтровывали,фильтрат упаривали. Полученные кристаллы суспендировали в 100 мл воды, затем снова отфильтровывали. Далее эти кристаллы растворяли в 304 мл горячей ледяной уксусной кислоты, добавляли 5,91 мл 70%-ной хлорной кислоты, затем после охлаждения выделенные кристаллы отфильтровывали и промывали 4 раза по 10 мл ледяной уксусной кислоты. Таким образом было получено 6,84 г (19%) названного соединения. Температура плавления: 236-237 С (разложение). Стадия В. 7-хлор-4-метил-1(16 ммоль) перхлората бензопирилия, приготовленного на стадии Б,растворяли в 32 мл диметилформамида, к полученному раствору по каплям добавляли 2,31 мл (48 ммоль) 98%-ного гидрата гидразина,реакционную смесь перемешивали при 25 С в течение 1 ч. Затем полученную смесь вливали в 320 мл воды,выделенный продукт отфильтровывали и промывали 5 раз по 10 мл воды. Полученный продукт очищали,суспендируя его в 50 мл горячего этанола. Таким образом было получено 4,41 г (87%) названного соединения. Температура плавления: 227-228 С. Стадия Г. 7-хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепин. 1,5 г (4,78 ммоль) производного бензодиазепина, полученного на стадии В,суспендировали в 60 мл метанола, к полученной суспензии добавляли 4,64 г (57,3 ммоль) концентрированной соляной кислоты, затем порциями добавляли при охлаждении холодной водой 2,07 г (54,8 ммоль) боргидрида натрия. Суспензию перемешивали при 25 С в течение 1 ч, добавляли твердый карбонат натрия для доведения рН смеси до значения около 8. Смесь разбавляли 60 мл воды, выделенный продукт отфильтровывали, промывали 4 раза по 5 мл 50%-ного водного метанола и сушили. В результате получили 1,47 г (97,4%) названного соединения. Температура плавления: 152-154 С. 8 Пример 2. 3-ацетил-1-(4-аминофенил)-7 хлор-4-метил-4,5-дигидро-3 Н-2,3-бензодиазепин. 0,66 г (1,8 ммоль) 3-ацетил-7-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3 бензодиазепина (полученного в примере 1) суспендировали в 35 мл метанола, затем добавляли примерно 0,5 г увлажненного никелевого катализатора Ренея и, при интенсивном перемешивании, 0,32 мл (6,5 ммоль) 98%-ного гидрата гидразина. Реакционную смесь перемешивали еще в течение 45 мин,затем катализатор отфильтровывали,промывали метанолом,объединенные фильтраты упаривали, кубовый остаток обрабатывали 10 мл воды для получения твердого продукта. 0,54 г сырого продукта перекристаллизовывают из 2 мл этанола с получением 0,44 г (75%) названного соединения. Температура плавления: 90-92 С. Пример 3. 7-хлор-4-метил-3-(метилкарбамоил)-1-(4-нитрофенил)-4,5-дигидро-3 Н 2,3-бензодиазепин. 0,72 г (2,2 ммоль) 7-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепина, полученного на стадии Г примера 1,растворяли в 15 мл безводного дихлорметана, к полученному раствору добавляли 1,3 мл (22,0 ммоль) метилизоцианата и оставляли реакционную смесь на 10 дней при 25 С. Затем смесь упаривали и остаток перекристаллизовывали из 3 мл горячего метанола. Кристаллы отфильтровывали,промывали 3 раза по 1 мл этанола и сушили. Таким образом было получено 0,78 г (95%) названного соединения. Температура плавления: 224-226 С. Пример 4. 1-(4-аминофенил)-7-хлор-4 метил-3-(метилкарбамоил)-4,5-дигидро-3 Н-2,3 бензодиазепин. 0,75 г (2,0 ммоль) 7-хлоро-4-метил-3(метилкарбамоил)-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепина, полученного как описано в примере 3, восстанавливали способом, описанным в примере 2, затем полученный продукт перекристаллизовывали из горячего этанола. Таким образом было получено 0,55 г(80%) названного соединения. Температура плавления: 134-136 С. Пример 5. 3-ацетил-8-хлор-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепин. 0,69 г (2,19 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепина ацетилировали способом, описанным в примере 1. Было получено 0,70 г (89%) названного соединения. Температура плавления: 227-229 С. Исходное соединение примера 5 получали следующим образом. Стадия А. 7-хлор-3-метил-1-(4-нитрофенил)изохроман. 9 Повторяли стадию А примера 1 с тем отличием, что в качестве исходного соединения брали 11,94 г (70 ммоль) 1-(4-хлорфенил)-2 пропанола (J. Med. Chem. 21, 454 (1978 и нагревали реакционную смесь в течение 1,5 ч. Таким образом было получено 6,8 г (32%) названного соединения. Температура плавления: 120-123 С. Стадия Б. 7-хлор-3-метил-1-(4-нитрофенил)-2-бензопирилия перхлорат. 6,8 г (22,4 ммоль) производного изохромана, полученного на стадии А, окисляли реагентом Джонса способом, описанным в стадии Б примера 1. Соль получали в ледяной уксусной кислоте, используя хлорную кислоту. Таким образом было получено 3,73 г (42%) названного соединения. Температура плавления: 247-255 С. Стадия В. 8-хлор-4-метил-1-(4 нитрофенил)-5 Н-2,3-бензодиазепин. 4,1 г(10,25 ммоль) перхлората бензопирилия, полученного в стадии Б, при охлаждении холодной водой добавляли к смеси 20,5 мл диметилформамида и 1,5 мл (70,7 ммоль) 98%-ного гидрата гидразина. Реакционную смесь перемешивали при 25 С в течение 1,5 ч, добавляли 25 мл воды,полученный продукт отфильтровывали,промывали 4 раза по 5 мл воды и перекристаллизовывали из 25 мл изопропанола. Таким образом было получено 2,82 г (87%) названного соединения. Температура плавления: 199-203 С. Стадия Г. 8-хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3-бензодиазепин. 1,62 г (5,16 ммоль) производного бензодиазепина, полученного в стадии В,восстанавливали методом, описанным в стадии Г примера 1. Таким образом было получено 1,59 г (98%) названного соединения. Температура плавления: 132-135 С. Пример 6. 3-ацетил-1-(4-аминофенил)-8 хлор-4-метил-4,5-дигидро-3 Н-2,3-бензодиазепин. 0,81 г (2,26 ммоль) 3-ацетил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3 Н-2,3 бензодиазепина, полученного в примере 5,восстанавливали способом, описанным в примере 2. Полученный продукт перекристаллизовывали из 50%-ного водного этанола. Таким образом было получено 0,64 г(86%) названного соединения. Температура плавления: 187-189 С. Пример 7. 8-хлор-4-метил-3-метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. Повторяли процедуру, описанную в примере 3, используя в качестве исходного соединения 0,79 г (2,5 ммоль) 8-хлор-4-метил-1(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина, полученного в стадии Г примера 5. Полученный продукт перекристаллизовывали из 10 изопропанола с получением 0,85 г (91%) названного соединения. Температура плавления: 190-192 С. Пример 8. 1-(4-аминофенил)-8-хлор-4 метил-3-метилкарбамоил-4,5-дигидро-3H-2,3 бензодиазепин. 0,65 г (1,74 моль) 8-хлор-4-метил-3 метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро 3H-2,3-бензодиазепина, полученного в примере 7, восстанавливали способом, описанным в примере 2. Таким образом было получено 0,59 г(99%) названного соединения. Температура плавления: 115-118 С. Пример 9. 3-ацетил-7,8-дихлор-4-метил-1(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. 0,35 г (0,99 ммоль) 7,8-дихлоро-4-метил-1(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина ацетилировали способом, описанным в примере 1. Таким образом было получено 0,36 г(93%) названного соединения. Температура плавления: 198-200 С. Исходное соединение примера 9 получали следующим образом. Стадия А. 6,7-дихлор-3-метил-1-(4-нитрофенил)-изохроман. Повторяли процедуру стадии А примера 1 с тем отличием, что в качестве исходного соединения брали 10,47 г (51,0 ммоль) 1-(3,4 дихлорфенил)-2-пропанола и кипятили реакционную смесь в течение 3 ч. Таким образом было получено 4,29 г (25%) названного соединения. Температура плавления: 189-191 С. Стадия Б. 7,8-дихлор-4-метил-1-(4-нитрофенил)-5 Н-2,3-бензодиазепин. 4,75 г (14,0 ммоль) производного изохромана, полученного в стадии А, используя реагент Джонса, окисляли способом стадии Б примера 1 с тем отличием, что вместо проведения реакции неочищенного продукта с хлорной кислотой производное 1-ацетонил-3,4 дихлор-4'-нитробензофенона(температура плавления: 121-122 С) выделяли с помощью хроматографии. Раствор вышеназванного производного в изопропаноле смешивали с 98%-ным гидратом гидразина при 25 С для получения производного моногидразона(температура плавления: 167-169 С). Проводили реакцию этого производного моногидразона с метанолом, содержащим 15% хлористого водорода, затем гидрохлорид названного соединения обрабатывали триэтиламином для получения свободного основания, которое очищали перекристаллизацией из горячего диметилформамида. Температура плавления: 231-233 С. Стадия В. 7,8-дихлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. 0,74 г (2,1 ммоль) производного бензодиазепина, полученного в стадии Б, восстанавливали способом, описанным в стадии Г примера 1. Таким образом было получено 0,70 г (95%) 11 названного соединения. Температура плавления: 182-184 С. Пример 10. 3-ацетил-1-(4-аминофенил)7,8-дихлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 0,34 г (0,86 ммоль) 3-ацетил-7,8-дихлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепина, полученного в примере 9, восстанавливали способом, описанным в примере 2. Полученный продукт очищали суспендированием в горячем этаноле. Таким образом было получено 0,25 г (80%) названного соединения. Температура плавления: 242-243 С. Пример 11. 7,8-дихлор-4-метил-3-метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепин. Проводили реакцию 0,33 г (0,94 ммоль) 7,8-дихлоро-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина, полученного в стадии В примера 9, с метилизоцианатом в соответствии с примером 3. Полученный продукт очищали, суспендируя его в горячем этаноле. Таким образом было получено 0,37 г (97%) названного соединения. Температура плавления: 221-223 С. Пример 12. 1-(4-аминофенил)-7,8-дихлор 4-метил-3-метилкарбамоил-4,5-дигидро-3H-2,3 бензодиазепин. 0,35 г (0,85 ммоль) 7,8-дихлор-4-метил-3 метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро 3H-2,3-бензодиазепина, полученного в примере 11,восстанавливали,используя способ,описанный в примере 2. Полученный продукт перекристаллизовывали из 50%-ного водного этанола. Таким образом было получено 0,27 г(данный способ отличается от способа,описанного в примере 5). 6,35 г (около 16,3 ммоль) неочищенного гидразида [1-/2-(2-гидроксипропил)-5-хлорфенил/-4-нитрофенилметилен]-уксусной кислоты растворяли в 70 мл безводного дихлорметана,раствор охлаждали до -15 С. К полученному раствору добавляли 4,10 мл (29,3 ммоль) триэтиламина при перемешивании, затем по каплям 1,65 мл(21,2 ммоль) метилсульфонилхлорида в течение примерно 5 мин. Через 20 мин реакционную смесь промывали 30 мл ледяной 1 N соляной кислоты,затем дважды по 30 мл ледяного водного раствора хлорида натрия. Органическую фазу сушили и упаривали. Твердый пеноподобный остаток суспендировали в 80 мл этанола и к этой суспензии при охлаждении льдом добавляли по каплям 0,90 мл (17,1 ммоль) 50%ного раствора хлорида натрия. Основная часть промежуточного продукта растворялась, и через несколько минут начинали выпадать желтые кристаллы. Смесь перемешивали в течение 12 последующих 4 ч, затем при охлаждении на льду по каплям добавляли 100 мл воды в течение 45 мин,полученный осадок фильтровали и промывали водой. Сухой неочищенный продукт растворяли примерно в 450 мл горячего этанола и концентрировали раствор примерно до одной трети его объема. После охлаждения осадок фильтровали для получения 3,92 г названного соединения в виде желтых кристаллов. Температура плавления: 226-228 С. (Выход 67% в расчете на производное изохромана,описанное в стадии А примера 5). Исходное соединение примера 13 получали следующим образом. Стадия А. 1-гидрокси-7-хлор-3-метил-1-(4 нитрофенил)-изохроман. 7,44 г (24,5 ммоль) производного 7-хлор-3 метил-1-(4-нитрофенил) изохромана (полученного, как описано в стадии А примера 5) растворяли в смеси 50 мл диметилформамида и 24 мл диметилсульфоксида и, охлаждая ледяной водой, пропускали воздух через капилляр,погружнный в жидкость. При интенсивном пробулькивании воздуха к реакционной смеси добавляли 2,60 мл (49,0 ммоль) 50%-ного водного раствора гидроксида натрия, при этом смесь становилась фиолетово-черной. Через 2 ч смесь вливали в 240 мл ледяной 0,5 N соляной кислоты,выпавший хлопьями осадок экстрагировали 3 раза по 100 мл этилацетата. Объединенные органические фракции промывали 100 мл насыщенного водного раствора гидрокарбоната натрия и водного раствора хлорида натрия до нейтральной реакции, сушили и упаривали. Было получено 8,70 г продукта в виде пены, состоящего только из одного соединения, что было показано тонкослойной хроматографией (Rf = примерно 0,2, при использовании смеси Н-гексана и этилацетата в соотношении 4:1). Анализ 1H ЯМР показал, что это соединение состоит из смеси двух возможных стереоизомеров и имеет чистоту примерно 90%. Полученное соединение использовали для следующей стадии реакции в виде, описанном выше. Стадия Б. Гидразид [1-/2-(2-гидроксипропил)-5-хлорфенил/-4-нитрофенилметилен] уксусной кислоты. Смесь 5,85 г (16,3 ммоль) полукеталя,полученного в стадии А (и имеющего чистоту примерно от 89 до 90%), 1,45 г (19,5 ммоль) гидразидацетата, 80 мл изопропанола, 20 мл воды и 2 мл 1 N соляной кислоты кипятили. В начале кипячения реагенты растворялись. После 3,5 ч кипячения к смеси добавляли следующие 0,33 г (4,45 ммоль) гидразидацетата и 1 мл 1 N соляной кислоты и продолжали реакцию в течение следующих 3,5 ч. Затем реакционную смесь упаривали и остаток растворяли в смеси 150 мл этилацетата и 100 мл водного раствора 13 гидрокарбоната натрия. После разделения водную фазу экстрагировали еще 50 мл этилацетата,объединенные органические фракции промывали водным раствором хлорида натрия, сушили и упаривали. Водный компонент пенообразного остатка удаляли путем добавления и выпаривания бензола. Полученные 6,35 г желтой смолы использовали в примере 13 для введения метилсульфонильной группы и реакции закрытия кольца. Пример 14. 3-карбамоил-8-хлор-4-метил-1(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. 6,13 г (около 16,27 ммоль) неочищенного 1-[/2-(2-гидроксипропил)-5-хлорфенил/-4-нитрофенилметилен]семикарбазида растворяли в 60 мл безводного пиридина и к полученному раствору добавляли по каплям 1,76 мл (22,77 ммоль) метилсульфонилхлорида при перемешивании при температуре-5 С. Реакционную смесь перемешивали при комнатной температуре в течение 23 ч, затем добавляли следующие 0,17 мл (2,8 ммоль) метилсульфонилхлорида. Через 3 ч смесь вливали в 500 мл раствора 1,5 N соляной кислоты и экстрагировали продукт три раза по 90 мл дихлорметана. Объединенные органические фракции промывали водным раствором хлорида натрия, сушили и упаривали. Полупродукт, полученный в виде твердой пены,помещали в 100 мл этанола и добавляли по каплям 1,03 мл (19,5 ммоль) 50%-ного водного раствора гидроксида натрия при перемешивании при комнатной температуре. После 4 ч перемешивания к реакционной смеси добавляли по каплям 150 мл воды при охлаждении льдом, выпавший в осадок кристаллический продукт фильтровали и промывали водой. Полученные 4,18 г (76%) продукта перекристаллизовывали путем растворения его в 270 мл этанола и упаривания раствора примерно до одной трети его первоначального объема. Таким образом было получено 3,16 г (54%) названного соединения. Температура плавления: 233-234 С (с разложением). Исходное соединение примера 14 получали следующим образом. 1-[/2-(2-гидроксипропил)-5-хлорфенил/-4 нитрофенилметилен]-полукарбазид. 6,19 г (примерно 18 ммоль) полукеталя,полученного как описано в стадии А примера 13, подвергали реакции с 3,01 г (27 ммоль) гидрохлорида полукарбазида в смеси 140 мл изопропанола и 60 мл воды. После 5 ч кипячения добавляли следующие 0,60 г (5,4 ммоль) гидрохлорида полукарбазида к реакционной смеси, которую кипятили еще 5 ч. Затем смесь упаривали, остаток суспендировали в воде, продукт фильтровали и промывали водой. 14 Было получено 6,62 г (98%) названного соединения,которое использовали в полученной форме для введения метилсульфонильной группы и реакции закрытия кольца. Для аналитических целей пробу очищали колоночной хроматографией(силикагель,элюент: смесь хлороформа с метанолом в соотношении 1:1). Как было доказано 1H ЯМР,данная проба состояла из стереоизомеров в соотношении примерно 1:1 и имела чистоту примерно 90%. По масс-спектрометрии: М=376/378. Пример 15. 1-(4-аминофенил)-3-карбамоил-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 3,16 г (8,81 ммоль) 3-карбамоил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепина (полученного как описано в примере 14) восстанавливали в метаноле в присутствии никелевого катализатора Ренея с 5 эквивалентами гидрата гидразина в соответствии со способом, описанным в примере 2. 2,71 г полученного продукта перекристаллизовывали из 50%-ного водного этанола. Таким образом было получено 2,29 г (79%) названного соединения. Температура плавления: 218-220 С. Пример 16. 3-этоксикарбонил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 2,36 г (5,81 ммоль) этил-3-[/2-(2 гидроксипропил)-5-хлорфенил/-4-нитрофенилметилен]карбазата растворяли в 25 мл безводного дихлорметана, к полученному раствору добавляли 1,46 мл (10,43 ммоль) триэтиламина и смесь подвергают реакции с 0,60 мл (7,70 ммоль) метилсульфонилхлорида при -15 С. Через 1 ч в реакционную смесь добавляли 20 мл дихлорметана, промывали ледяной 1 N соляной кислотой, затем водным раствором хлорида натрия, сушили и упаривали. Смолистый осадок растворяли в 34 мл этанола,к полученному раствору добавляли 0,32 мл (6,1 ммоль) 50%-ного водного раствора гидроксида натрия при перемешивании. Реакционную смесь перемешивали в течение 2 ч, затем по каплям добавляли 100 мл воды при охлаждении льдом, выпавший в осадок продукт фильтровали и промывали водой. Таким образом было получено 1,83 г (81%) названного соединения. Температура плавления: 124-126 С. Исходное соединение примера 16 получали следующим образом. Этил-3-[/2-(2-гидроксипропил)-5-хлорфенил/-4-нитро-фенилметилен]карбазат. 2,10 г (около 6 ммоль) полукеталя,полученного в стадии А примера 13, при кипячении подвергали реакции с 1,25 г (12,0 15 ммоль) этилкарбазата в смеси 80 мл этанола и 60 мл воды,содержащей 0,1 мл концентрированной соляной кислоты. После 2 ч кипячения к смеси добавляли следующие 0,12 г(1,2 ммоль) этилкарбазата, 1 каплю соляной кислоты и кипятили еще 2 ч. После упаривания остаток растворяли в водном растворе гидрокарбоната натрия,кристаллический продукт фильтровали и промывали водой. Было получено 2,36 г (97%) названного соединения. Продукт является смесью стереоизомеров в соотношении примерно 1:1. Температура плавления: 123-125 С. Пример 17. 1-(4-аминофенил)-3-этоксикарбонил-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 1,93 г (4,97 ммоль) 8-хлор-3-этоксикарбонил-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина восстанавливали гидразином в смеси метанола и дихлорметана в соотношении 4:1 в присутствии никелевого катализатора Ренея,используя способ,описанный в примере 2. Продукт очищали колоночной хроматографией(силикагель,элюент: смесь H-гексана и этилацетата в соотношении 1:1). Таким образом получили 1,46 г (82%) названного соединения в виде твердого пенообразного продукта. Температура плавления: 95-98 С. Пример 18. 3-п-бутилкарбамоил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 2,10 г (4,85 ммоль) 1-[/3-хлор-6-(2 гидроксипропил)/-4-нитрофенилметилен]-4-Hбутилполукарбазида ацилировали 0,53 мл (6,79 ммоль) метилсульфонилхлорида в дихлорэтане в присутствии 1,22 мл (8,73 ммоль) триэтиламина способом, описанным в примере 14. Неочищенный полупродукт замыкали в цикл, используя 0,28 мл (5,33 ммоль) 50%-ного водного раствора гидроксида натрия, как описано в примере 14. 1,40 г полученного продукта перекристаллизовывали из метанола. Таким образом было получено 1,14 г (56%) названного соединения. Температура плавления: 150 С. Исходное соединение примера 18, а именно 1-[/3-хлор-6-(2-гидроксипропил)/-4 нитрофенилметилен]-4-H-бутилполукарбазид получали из 1-гидрокси-7-хлор-3-метил-1-(4 нитрофенил)-изохромана (пример 13, стадия А) и 4-Н-бутилполукарбазида с помощью способа,описанного в отношении исходного вещества примера 14. Продукт, выделенный в виде смолы, очищали колоночной хроматографией 16 1,14 г (2,75 ммоль) 3-H-бутилкарбамоил-8 хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепина (полученного как описано в примере 18) восстанавливали 0,70 мл (13,74 ммоль) гидрата гидразина в 90 мл метанола в присутствии никелевого катализатора Ренея в соответствии со способом, описанном в примере 2. Продукт очищали колоночной хроматографией (силикагель, элюент: смесь дихлорметана и метанола в соотношении 98:2). После упаривания продукт выделяли в пенообразном виде, который может быть превращен в порошок. Было получено 0,93 г (88%) названного соединения. Температура плавления: 89-91 С. Пример 20. 3-ацетил-7,8-дихлор-4-метил 1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин (способ получения отличен от описанного в примере 9). 6,26 г (около 15,3 ммоль) неочищенного гидразида[1-/2-(2-гидроксипропил)-4,5-дихлорфенил/-4-нитрофенилметилен]-уксусной кислоты (см. стадию Б этого примера) метилсульфонилировали и замыкали в цикл путем щелочной обработки в соответствии с примером 13. Таким образом было получено 3,65 г (64% в расчете на изохроман, как описано в примере 9, стадия А) названного соединения в виде желтых кристаллов. Температура плавления: 190-195 С. Исходное соединение получали следующим образом. Стадия А. 1-гидрокси-6,7-дихлор-3-метил 1-(4-нитрофенил)изохроман. 6,0 г (17,7 ммоль) 6,7-дихлор-3-метил-1-(4 нитрофенил)изохромана окисляли, используя способ, описанный в примере 13, стадия А. 6,03 г (96%) названного соединения выделяли в виде желтых кристаллов. Полученный продукт, состоящий из смеси двух возможных стереоизомеров, использовали в следующей стадии реакции без очистки. Стадия В. Гидразид[/2-(2-гидроксипропил)-4,5-дихлорофенил/-4-нитрофенилметилен] уксусной кислоты. 5,18 г(14,6 ммоль) полукеталя,полученного на стадии А примера 20,подвергали реакции с уксусным гидразидом,используя способ стадии Б примера 13. 6,26 г названного соединения было получено в виде желтой смолы, которую использовали в реакциях метилсульфонилирования и закрытия кольца. Пример 21. 7,8-дихлор-4-метил-3-метилкарбамоил-1-(4-нитрофенил)-1-4,5-дигидро-3H2,3-бензодиазепин (способ получения отличен от описанного в примере 11). 8,66 г (около 20,4 ммоль) неочищенного 1[/3,4-дихлор-6-(2-гидроксипропил)/-4-нитрофенилметилен]-4-метилсемикарбазида метилсульфонилировали и замыкали в кольцо в соот 17 ветствии со способом, описанным в примере 13. Полученный продукт перекристаллизовывали из водного диметилформамида. Таким образом было получено 3,12 г (33%,в расчете на изохроман, как описано в стадии А примера 9) названного соединения в виде желтых кристаллов. Температура плавления: 218-220 С. Исходное соединение, а именно 1-[/3,4 дихлор-6-(2-гидроксипропил)/-4-нитрофенилметилен]-4-метилсемикарбазид получали из 1 гидрокси-6,7-дихлор-3-метил-1-(4-нитрофенил) изохромана (пример 20, стадия А) и 4 метилсемикарбазида способом, аналогичным описанному,в отношении исходного соединения примера 14. Неочищенный продукт,выделенный в виде желтой смолы,использовали в примере 21 без очистки. Пример 22. 3-ацетил-8-бром-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. 0,82 г (2,28 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина ацилировали в соответствии со способом примера 1. Таким образом было получено 0,84 г(91%) названного соединения. Температура плавления: 228-230 С. Исходное соединение примера 22 получали следующим образом. Стадия А. 7-бром-3-метил-1-(4-нитрофенил) изохроман. Повторяли процесс согласно стадии А примера 1 с тем отличием, что в качестве исходного соединения использовали 14,69 г(J. Med. Chem., 21, 454 (1978. Таким образом было получено 10,94 г (46%) названного соединения. Температура плавления: 130-133 С. Стадия Б. 8-бром-3-метил-1-(4-нитрофенил)-2-бензопирилия перхлорат. 10,8 г (32,5 ммоль) производного изохромана, полученного на стадии А примера 22, окисляли реагентом Джонса, как описано в стадии Б примера 1. Продукт получали взаимодействием с хлорной кислотой в ледяной уксусной кислоте. Таким образом было получено 4,91 г (34%) названного соединения. Температура плавления: 253-256 С. Стадия В. 8-бром-4-метил-1-(4-нитрофенил)-5 Н-2,3-бензодиазепин. 4,0 г (9,0 ммоль) перхлората бензопирилия,полученного в стадии Б примера 22,обрабатывали гидратом гидразина в соответствии со способом стадии В примера 1. Таким образом было получено 2,30 г (71%) названного соединения. Температура плавления: 200-205 С. 8-Бром-4-метил-1-(4-нитрофенил)-4,5 дигидро-3H-2,3-бензодиазепин. 3,0 г (8,38 ммоль) производного бензодиазепина, полученного в соответствии со 18 стадией В примера 22, восстанавливали, как описано в примере 1, стадия Г. Таким образом было получено 2,79 г (92%) названного соединения. Температура плавления: 131-135 С. Пример 23. 3-ацетил-1-(4-аминофенил)-8 бром-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 0,80 г (2,0 ммоль) 3-ацетил-8-бром-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 22) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из этанола. Таким образом было получено 0,62 г (83%) названного соединения. Температура плавления: 205-208 С. Пример 24. 8-бром-4-метил-1-(4-нитрофенил)-3-трифторацетил-4,5-дигидро-3H-2,3 бензодиазепин. 1,51 г (4,20 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в примере 22, стадия Г) перемешивали в смеси из 5 мл безводного дихлорметана и 5 мл трифторуксусного ангидрида при 25 С в течение 3 ч, затем реакционную смесь разбавляли дихлорметаном. Органическую фазу промывали водой и 2%-ным водным раствором гидрокарбоната натрия,сушили и упаривали. Полученный продукт очищали суспендированием в 5 мл горячего метанола. После фильтрации и сушки получали 1,66 г(86%) названного соединения. Температура плавления: 193-196 С. Пример 25. 1-(4-аминофенил)-8-бром-4 метил-3-фторацетил-4,5-дигидро-3H-2,3-бензодиазепин. 1,64 г (3,60 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-3-фторацетил-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 24) восстанавливали в соответствии со способом примера 2. Полученный продукт очищали хроматографией на силикагельной колонке, в качестве элюента использовали смесь хлороформа и метанола в соотношении 99:1. Таким образом было получено 1,33 г (87%) названного соединения. Температура плавления: 93-96 С. Пример 26. 8-бром-4-метил-1-(4-нитрофенил)-3-пропионил-4,5-дигидро-3H-2,3-бензодиазепин. 1,33 г (3,7 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-3-трифторацетил-4,5-дигидро-3H2,3-бензодиазепина (полученного в примере 22,стадия Г) ацилировали пропионовым ангидридом, используя способ примера 1. Полученный продукт очищали хроматографией на силикагельной колонке, причем в качестве элюента использовали смесь гексана и этилацетата в соотношении 9:1. Таким образом было получено 1,07 г (70%) названного соединения. Температура плавления: 178-180 С. 19 Пример 27. 1-(4-аминофенил)-8-бром-4 метил-3-пропионил-4,5-дигидро-3H-2,3-бензодиазепин. 1,05 г (2,52 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-3-пропионил-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 26) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из этанола. Таким образом было получено 0,85 г (87%) названного соединения. Температура плавления: 99-102 С. Пример 28. 8-бром-3-циклопропионил-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 0,90 г (2,5 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в примере 22, стадия Г) ацилировали 0,27 мл(3 ммоль) циклопропанкарбонилхлорида в 15 мл безводного дихлорметана в присутствии 0,22 мл(3 ммоль) триэтиламина при 25 С. Реакционную смесь вылили на 25 г измельченного льда и экстрагировали дихлорметаном. Органическую фазу промывали водой и водным раствором гидрокарбоната натрия, сушили и упаривали. Полученный продукт суспендировали в 3 мл горячего этанола. После фильтрации и сушки получали 0,88 г (82%) названного соединения. Температура плавления: 172-173 С. Пример 29. 1-(4-аминофенил)-8-бром-3 циклопропионил-4-метил-4,5-дигидро-3H-2,3 бензодиазепин. 0,79 г (1,77 ммоль) 8-бром-3-циклопропионил-4-метил-1-(4-нитрофенил)-4,5 дигидро-3H-2,3-бензодиазепина (полученного в примере 28) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из смеси этанола и гексана в соотношении 1:4. Таким образом было получено 0,55 г(78%) названного соединения. Температура плавления: 113-116 С. Пример 30. 8-бром-4-метил-3-метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепин. 0,84 г (2,33 ммоль) 8-бром-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в примере 22, стадия Г) подвергали реакции с метилизоцианатом в соответствии со способом примера 3. Полученный продукт суспендировали в 5 мл горячего этанола. После фильтрации и сушки получили 0,82 г (84%) названного соединения. Температура плавления: 197-200 С. Пример 31. 1-(4-аминофенил)-8-бром-4 метил-3-метилкарбамоил-4,5-дигидро-3H-2,3 бензодиазепин. 0,80 г (1,92 ммоль) 8-бром-4-метил-3 метилкарбамоил-1-(4-нитрофенил)-4,5-дигидро 3H-2,3-бензодиазепина (полученного в примере 30) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из 3 мл этилацетата. Таким 20 образом, было получено 0,50 г (68%) названного соединения. Температура плавления: 121-124 С. Пример 32. 8-бром-3-этоксикарбонил-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 8,11 г (18 ммоль) этил-3-[/5-бром-2-(2 гидроксипропил)фенил/-4-нитрофенилметилен]карбазата подвергали реакции с метилсульфонилхлоридом, затем с 50%-ным водным раствором гидроксида натрия в соответствии со способом, описанным в примере 16. Продукт экстрагировали дихлорметаном, органическую фазу промывали водой, сушили и упаривали. 6,78 г (87%) названного соединения было получено в виде твердой пены, которую использовали затем в примере 33. Исходное соединение получали следующим образом. Стадия А. 7-бром-1-гидрокси-3-метил-1-(4 нитрофенил) изохроман. 15,56 г (44,7 ммоль) 7-бром-1-гидрокси-3 метил-1-(4-нитрофенил) изохромана (полученного в примере 22, стадия А) окисляли,используя способ, описанный в примере 13,стадия А. Продукт экстрагировали бензолом,сушили и упаривали. Таким образом было получено 14,80 г (91%) названного соединения,являющегося смесью возможных изомеров. Этот продукт использовали без дальнейшей очистки. Стадия В. Этил-3-[/5-бром-2-(2-гидроксипропил)фенил/-4-нитрофенилметилен]карбазат. 6,82 г (18,72 ммоль) производного полукеталя, полученного на стадии А примера 32, подвергали реакции с этилкарбазатом,используя способ, описанный относительно получения исходного соединения примера 16. Продукт экстрагировали этилацетатом,органическую фазу промывали водой, сушили и упаривали. Таким образом было получено 8,11 г (96%) названного соединения. Продукт, состоящий из смеси возможных изомеров, использовали без дальнейшей очистки. Пример 33. 1-(4-аминофенил)-8-бром-3 этоксикарбонил-4-метил-4,5-дигидро-3H-2,3 бензодиазепин. 1,58 г(приготовленного в примере 32) восстанавливали в соответствии со способом,описанным в примере 2. Полученный продукт кристаллизовали из 4 мл этилацетата. Таким образом было получено 1,20 г (81%) названного соединения. Температура плавления: 114-117 С. Пример 34. 8-бром-3-карбамоил-4-метил 1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. Раствор 1,80 г (5 ммоль) 8-бром-4-метил-1(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазе 21 пина в 10 мл ледяной уксусной кислоты обрабатывали 0,53 г (6,5 ммоль) цианата калия. Через 1 ч раствор переливали в воду и выпавшие кристаллы фильтровали. Полученный продукт суспендировали в 15 мл горячего этанола. После фильтрации и сушки было получено 1,56 г(77%) названного соединения. Температура плавления: 193-203 С. Исходное соединение примера 34 получали следующим образом. 8-бром-4-метил-1-(4-нитрофенил)-4,5 дигидро-3H-2,3-бензодиазепин.(Это соединение идентично продукту стадии Г примера 22.) 5,20 г (12 ммоль) 8-бром-3-этоксикарбонил-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепина (полученного в примере 32) кипятили в 104 мл метанола с 6 мл 10 N раствора гидроксида натрия в течение 2 ч. После охлаждения реакционную смесь разбавляли 104 мл воды, выпавшие кристаллы фильтровали. Таким образом было получено 3,99 г (92%) названного соединения. Температура плавления: 125-130 С. Пример 35. 1-(4-аминофенил)-8-бром-3 карбамоил-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 1,55 г (3,84 ммоль) 8-бром-3-карбамоил-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 34) восстанавливали, используя способ примера 2. Полученный продукт кристаллизовали из 5 мл этанола. Таким образом было получено 1,19 г(83%) названного соединения. Температура плавления: 218-221 С. Пример 36. 8-хлор-4-метил-1-(4 нитрофенил)-3-трифторацетил-4,5-дигидро-3H2,3-бензодиазепин. 0,6 г (1,9 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в стадии Г примера 5) ацилировали трифторуксусным ангидридом в соответствии со способом примера 24. Получили 0,76 г (97%) названного соединения. Температура плавления: 150-152 С. Исходное соединение идентично продукту стадии Г примера 5, однако, оно может также быть получено следующим образом. 10,98 г (27 ммоль) 3-этоксикарбонил-8 хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепина (полученного в примере 16) гидролизовали, используя способ, описанный относительно получения исходного соединения примера 34. Таким образом, было получено 8,04 г 22 0,75 г (1,8 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-3-трифторацетил-4,5-дигидро-3H2,3-бензодиазепина (полученного в примере 36) восстанавливали в соответствии со способом примера 2. Полученный продукт очищали путем хроматографии на силикагельной колонке,причем в качестве элюента использовали смесь бензола и этилацетата в соотношении 3:1. Таким образом было получено 0,47 г (68%) названного соединения. Температура плавления: 165-167 С. Пример 38. 8-хлор-4-метил-1-(4 нитрофенил)-3-пропионил-4,5-дигидро-3H-2,3 бензодиазепин. 0,6 г (1,9 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного на стадии Г примера 5 или в примере 36, исходное соединение) ацилировали пропионовым ангидридом в соответствии со способом примера 26. Полученный продукт очищали путем хроматографии на силикагельной колонке, причем в качестве элюента использовали смесь бензола и этилацетата в соотношении 95:5. Таким образом было получено 0,56 г (79%) названного соединения. Температура плавления: 160-161 С. Пример 39. 1-(4-аминофенил)-8-хлор-4 метил-3-пропионил-4,5-дигидро-3H-2,3-бензодиазепин. 0,46 г (1,23 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-3-пропионил-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 38) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из 50%-ного водного этанола. Таким образом было получено 0,39 г (93%) названного соединения. Температура плавления: 118-120 С. Пример 40. 3-циклопропионил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 0,6 г (1,9 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного на стадии Г примера 5 или в примере 36,исходное соединение) ацилировали циклопропанкарбонилхлоридом в соответствии со способом примера 28. Получили 0,71 г (97%) названного соединения. Температура плавления: 158-160 С. Пример 41. 1-(4-аминофенил)-3-циклопропионил-8-хлор-4-метил-4,5-дигидро-3H-2,3 бензодиазепин. 0,72 г (1,87 ммоль) 3-циклопропионил-8 хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепина (полученного в примере 40) восстанавливали в соответствии со способом примера 2. Полученный продукт перекристаллизовывали из 50%-ного водного этанола. Таким образом было получено 0,57 г (86%) названного соединения. Температура плавления: 122-124 С. 23 Пример 42. (+)-3-ацетил-8-хлор-4-метил-1(4-нитрофенил)-4,5-дигидро-5 Н-2,3-бензодиазепин. 0,51 г (1,6 ммоль) (+)-8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-5 Н-2,3-бензодиазепина ацилировали уксусным ангидридом в соответствии со способом примера 1. 0,54 г полученного продукта кристаллизовали из 28 мл этилацетата при комнатной температуре. Таким образом было получено 0,28 г (48%) названного соединения. Температура плавления: 259-260 С. Анализ с помощью хиральной ВЭЖХ(Chiralcel OJ, элюент: смесь гексана и этанола в соотношении 1:1) показал, что продукт состоит из одного изомера. Исходное соединение примера 42 получали следующим образом.Trans. I. 2039 (1985 в 60 мл безводного дихлорэтана добавляли по каплям 2,43 мл (21,5 ммоль) борандиметилсульфидного комплекса(концентрация борана около 9,2 М) при -20 С. Через три часа раствор нагревали до 0 С и выдерживали при +4 С в течение 15 ч. К полученному раствору добавляли по каплям раствор 3,37 г (10,7 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-5 Н-2,3-бензодиазепина (полученного в стадии В примера 5) в 60 мл безводного дихлорметана при комнатной температуре в течение 30 мин. Реакционную смесь перемешивали при 60 С в течение 6 ч. Оранжевый раствор охлаждали до 25 С,обрабатывали 50 мл 10%-ного водного раствора карбоната натрия, промывали водой до нейтральной реакции, затем сушили и упаривали. Продукт выделяли на колонке с силикагелем, используя смесь бензола и этилацетата в соотношении 8:1. Полученное названное соединение состояло из смеси энантиомеров в соотношении 75:25 (показано ВЭЖХ: Chiralcel OJ, элюент: смесь гексана и этанола в соотношении 1:1). Пример 43. (-)-3-ацетил-1-(4-аминофенил)8-хлор-4-метил-4,5-дигидро-5 Н-2,3-бензодиазепин. 0,28 г (0,78 ммоль) (+)-3-ацетил-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-5 Н-2,3 бензодиазепина (полученного в примере 42) восстанавливали в соответствии со способом примера 2. Полученный продукт кристаллизовали из 2 мл этанола. Таким образом, было получено 0,15 г (58%) названного соединения. Температура плавления: 219-220 С.//D25=-712,1 (с=0,7; хлороформ). Продукт состоял из одного энантиомера 24 Пример 44. 3-(этилкарбамоил)-8-хлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 0,6 г (1,9 ммоль) 8-Хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в стадии Г примера 5 или в примере 36, исходное соединение) кипятили с 0,75 мл (9,5 ммоль) этилизоцианата в 25 мл безводного толуола в течение 24 ч. Смесь упаривали, остаток перекристаллизовывали из 5 мл этанола. Таким образом было получено 0,51 г(1,24 ммоль) 8-Хлор-3(этилкарбамоил)-4-метил-1-(4-нитрофенил)-4,5 дигидро-3H-2,3-бензодиазепина (полученного в примере 44) восстанавливали в соответствии со способом примера 2. Полученный продукт перекристаллизовывали из 4 мл 50%-ного водного этанола. Таким образом/ было получено 0,35 г(79%) названного соединения. Температура плавления: 165-167 С. Пример 46. 8-Хлор-4-метил-1-(4 нитрофенил)-3-(Н-пропилкарбамоил)-4,5-дигидро-3H-2,3-бензодиазепин. 0,6 г (1,9 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в стадии Г примера 5 или в примере 36, исходное соединение) подвергали реакции с H-пропилизоцианатом в соответствии со способом, описанным в примере 44. Полученный продукт перекристаллизовывали из этанола. Таким образом было получено 0,63 г(83%) названного соединения. Температура плавления: 186-187 С. Пример 47. 1-(4-аминофенил)-8-хлор-4 метил-3-(Н-пропилкарбамоил)-4,5-дигидро-3H2,3-бензодиазепин. 0,6 г (1,5 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-3-(Н-пропилкарбамоил)-4,5 дигидро-3H-2,3-бензодиазепина (полученного в примере 46) восстанавливали в соответствии со способом примера 2. Таким образом было получено 0,52 г (93%) названного соединения. Температура плавления: 88-90 С. Пример 48. 3-(изопропилкарбамоил)-8 хлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H2,3-бензодиазепин. 0,6 г (1,9 ммоль) 8-хлор-4-метил-1-(4 нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепина (полученного в стадии Г примера 5 или в примере 36, исходное соединение) подвергали реакции с изопропилизоцианатом в соответствии со способом примера 44. Полученный продукт перекристаллизовывали из этанола. Таким образом было получено 0,4 г 25 Пример 49. 1-(4-аминофенил)-3-(изопропилкарбамоил)-8-хлор-4-метил-4,5-дигидро 3H-2,3-бензодиазепин. 0,38 г (0,95 ммоль) 3-(изопропилкарбамоил)-8-хлор-4-метил-1-(4-нитрофенил)-4,5 дигидро-3H-2,3-бензодиазепина (полученного в примере 48) восстанавливали в соответствии со способом примера 2. Таким образом было получено 0,32 г (91%) названного соединения. Температура плавления: 100-102 С. Пример 50. 3-этоксикарбонил-7,8-дихлор 4-метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепин. 1,41 г (около 2,7 ммоль) неочищенного этил-3-[/2-(2-гидроксипропил)-4,5-дихлорфенил/-4-нитрофенилметилен]-карбазата метилсульфонилировали и замыкали кольцо как описано в примере 13. Таким образом было получено 0,94 г (75% в расчете на изохроман,как описано в стадии А примера 9) названного соединения. Температура плавления: 106-108 С. Исходное соединение примера 50 получали следующим образом. Этил-3-[/2-(2-гидроксипропил)-4,5-дихлорфенил/-4-нитрофенилметилен]-карбазат. 0,98 г (2,8 ммоль) 1-гидрокси-6,7-дихлор 3-метил-1-(4-нитрофенил) изохромана (полученного в стадии А примера 20) подвергали реакции с этилкарбазатом в соответствии со способом, описанным в отношении получения исходного соединения примера 16. Таким образом было получено 1,20 г (97%) названного соединения, состоящего из смеси возможных изомеров. Этот продукт использовали без дальнейшей очистки. Пример 51. 1-(4-аминофенил)-3-этоксикарбонил-7,8-дихлор-4-метил-4,5-дигидро-3H2,3-бензодиазепин. 0,94 г (2,2 ммоль) 3-этоксикарбонил-7,8 дихлор-4-метил-1-(4-нитрофенил)-4,5-дигидро 3H-2,3-бензодиазепина (полученного в примере 50) восстанавливали в соответствии со способом примера 2. Полученный продукт очищали хроматографией на колонке с силикагелем,причем в качестве элюента использовали смесь бензола и этилацетата в соотношении 4:1. Затем продукт перекристаллизовывали из этанола. Таким образом было получено 0,54 г (63%) названного соединения. Температура плавления: 190-192 С. Пример 52. 3-бутирил-7,8-дихлор-4-метил 1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин. 1,31 г (около 3 ммоль) неочищенного гидразида[1-/2-(2-гидроксипропил)-4,5-дихлорофенил/-4-нитрофенилметилен]масляной кислоты метилсульфонилировали и замыкали в кольцо в соответствии со способом примера 13. Таким образом было получено 1,08 г (86% в расчете на изохроман, как описано в стадии А примера 9) названного соединения. Температура плавления: 75-77 С. 26 Исходное соединение примера 52 получали следующим образом. Гидразид[1-/2-(2-гидроксипропил)-4,5 дихлорфенил/-4-нитрофенилметилен]масляной кислоты. 1,06 г (3 ммоль) полукеталя, полученного на стадии А примера 20, подвергали реакции с гидразидом масляной кислоты в соответствии со способом стадии В примера 13. 1,31 г названного соединения было получено в виде желтого аморфного вещества,которое использовали без дальнейшей очистки для метилсульфонилирования и реакции закрытия кольца. Пример 53. 1-(4-аминофенил)-3-бутирил 7,8-дихлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин. 1,08 г (2,6 ммоль) 3-бутирил-7,8-дихлор-4 метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3 бензодиазепина (полученного в примере 52) восстанавливали в соответствии со способом,описанным в примере 2. Полученный продукт очищали хроматографией на колонке с силикагелем, причем в качестве элюента использовали смесь бензола и этилацетата в соотношении 8:1. Затем продукт суспендировали в горячем этаноле. Таким образом было получено 0,57 г (57%) названного соединения. Температура плавления: 193-194 С. С использованием способов вышеприведенных примеров были получены следующие соединения: 7,8-дихлор-4-метил-1-(4-нитрофенил)-3 пропионил-4,5-дигидро-3H-2,3-бензодиазепин; 1-(4-аминофенил)-7,8-дихлор-4-метил-3 пропионил-4,5-дигидро-3H-2,3-бензодиазепин; 3-карбамоил-7,8-дихлор-4-метил-1-(4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин; 1-(4-аминофенил)-3-карбамоил-7,8-дихлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин; ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы I где R1 и R2 означают, независимо друг от друга,водород, галоген, C1-4 алкильную группу, C1-4 алкоксигруппу,нитрогруппу,трифторметильную группу или группу формулы -NR8R9,где R8 и R9 означают, независимо друг от друга,водород, С 1-4 алкильную группу или группу формулы -COR10, где R10 означает водород, C1-6 алкильную группу, которая может быть замещена, С 6-10 арильную группу, C1-4 алкоксигруппу, С 3-5 циклоалкильную группу,С 2-6 алкенильную группу,С 3-5 циклоалкоксигруппу или группу формулы -NR11R12,где R11 и R12 означают, независимо друг от друга, водород, С 1-4 алкильную группу, С 3-5 циклоалкильную группу или С 6-10 арильную группу; R3 означает C1-4 алкильную группу, С 3-5 циклоалкильную группу или группу формулы-CO-R13, в которой R13 имеет те же значения,что и R10; R4 и R5 означают, независимо друг от друга, водород или C1-3 алкильную группу, R6 иR7 означают, независимо друг от друга, водород,хлор или бром, причем если один из R6 и R7 означает водород, то другой отличается от водорода, а также их изомеры и соли присоединения кислот этих соединений или изомеров. 2. Соединение формулы I по п.1: 3-ацетил 1-(4-аминофенил)-8-хлор-4-метил-4,5-дигидро 3H-2,3-бензодиазепин. 3. Соединение формулы I по п.1: 1-(4 аминофенил)-8-хлор-4-метил-3-метилкарбамоил-4,5-дигидро-3H-2,3-бензодиазепин.
МПК / Метки
МПК: A61K 31/55, C07D 243/10
Метки: 2,3-бензодиазепина, производные
Код ссылки
<a href="https://eas.patents.su/15-471-proizvodnye-23-benzodiazepina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2,3-бензодиазепина</a>
Предыдущий патент: Гидроксиэтиламиносульфонамиды аминокислот в качестве ингибиторов протеаз ретровирусов.
Следующий патент: Фармацевтическая композиция для лечения сердечно-сосудистых заболеваний, содержащая 3-(2,2,2-триметилгидразиний)пропионат и гамма-бутиробетаин
Случайный патент: Замещенные карбоксамиды












