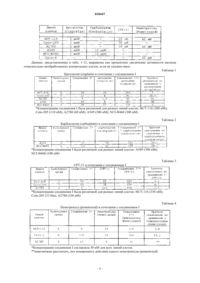
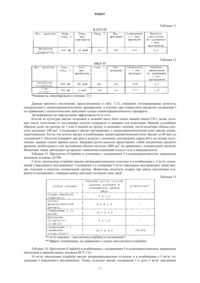
Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-а]пиридин-3-ил-2,5-диоксо-1н-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина с химиотерапевтическим агентом для лечения злокачественных опухолей
Номер патента: 18447
Опубликовано: 30.08.2013
Авторы: Энглер Томас Альберт, Чедид Марсио, Абуруб Актхам, Васудеван Венкатрагхаван
Формула / Реферат
1. Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с химиотерапевтическим агентом, выбранным из группы, состоящей из СРТ-11, пеметрекседа, гемцитабина, этопозида, доксорубицина, цисплатина и карбоплатина, для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки.
2. Применение по п.1, в котором химиотерапевтическим агентом является цисплатин или карбоплатин.
3. Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с пеметрекседом и химиотерапевтическим агентом, выбранным из группы, состоящей из цисплатина или карбоплатина, для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки.
4. Применение по п.3, в котором химиотерапевтическим агентом является карбоплатин.
Текст
ПРИМЕНЕНИЕ КОМБИНАЦИИ 7-(2,5-ДИГИДРО-4-ИМИДАЗО[1,2-А]ПИРИДИН-3 ИЛ-2,5-ДИОКСО-1 Н-ПИРРОЛ-3-ИЛ)-9-ФТОР-1,2,3,4-ТЕТРАГИДРО-2-(1 ПИПЕРИДИНИЛКАРБОНИЛ)ПИРРОЛО[3,2,1-JK][1,4]БЕНЗОДИАЗЕПИНА С ХИМИОТЕРАПЕВТИЧЕСКИМ АГЕНТОМ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ Описано применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1Hпиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина с химиотерапевтическим агентом для лечения рака яичников,немелкоклеточного рака легкого или рака ободочной и прямой кишки.in rabbits. J. Pharm. Pharmacol., 1996, 48(3), pp. 263-269 (реферат) [он-лайн] [Найдено 2011-12-07] Найдено из БД PubMed, PMID 8737051sulfobutylether beta-cyclodextrins (SBE) and danazolSBE inclusion complexes. Int. J. Pharm., 2001,212(2), pp. 177-86 (реферат) [он-лайн] [Найдено 2011-12-07] Найдено из БД PubMed, PMID 11165075(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Уровень техники Эффективность химиотерапии любого ракового заболевания ограничена чувствительностью конкретных раковых опухолей к определенному лечению. Даже в случае, когда опухоль реагирует на конкретную химиотерапию, острое и хроническое токсическое действие, связанное с химиотерапией, часто вынуждают снижать дозу или совсем прекращать лечение. Один из подходов к лечению раковых опухолей, не реагирующих на терапию, или к преодолению ограничивающей дозу токсичности заключается в комбинировании агентов, которые действуют по различным механизмам действия. Несмотря на то, что были открыты некоторые эффективные химиотерапевтические комбинации, идентификация комбинаций агентов, демонстрирующих повышенную эффективность при конкретном раковом заболевании или лучше переносимых пациентом, остается, по существу, эмпирической. Киназа-3 гликогенсинтетазы (GSK3) представляет собой серин/треонинкиназу, вовлеченную в различные сети передачи сигнала, которые регулируют ряд функций клеток. Роль GSK3 в лечении рака неясна. Существуют данные о том, что рапамицин (rapamycin), например, значительно потенцирует действие паклитаксела (paclitaxel), винорелбина (vinorelbine) и карбоплатина (carboplatin) в клетках раковой опухоли молочной железы путем активации GSK3, но не действие доксорубицина (doxorubicin) или гемцитабина (gemcitabine). Указанное потенцирование ингибировали с помощью хорошо известных ингибиторов GSK3 - хлорида лития, SB216763 и SB415286 (Dong, et al., Cancer Research, 65(5), 1961-1972(2005. В отличие от этого, было показано, что хлорид лития и SB216763, ингибиторы GSK3, значительно потенцируют противоопухолевое действие родственного фактору некроза опухоли лиганда, индуцирующего апоптоз (TRAIL), как в p53-положительных, так и в p53-отрицательных раковых клетках предстательной железы в субтоксических концентрациях (Liao, et al., Molecular Cancer Therapeutics, 2,1215-1222 (2003. Аналогично было показано, что хлорид лития сенсибилизирует клетки опухоли на фактор некроза опухоли (TNF) в клетках рабдомиосаркомы человека и в клетках фибросаркомы мышей,а ингибиторы GSK3 - Ro31-8220, вальпроевая кислота и индирубин-3'-моноксим не потенцировали такой эффект (Schoette, et al., The Journal of Biological Chemistry, 276(28), 25939-25945 (2001. Наконец,существуют данные о том, что ингибиторы GSK3 - хлорид лития и LY2119301, потенцируют действие адриамицина (adriamycin), этопозида (etoposide) и 5-фторурацила (5-fluorouracil) в p53-положительных клетках опухоли толстой кишки, но ни SB216763, ни SB415286 не потенцировали действие ни одного из исследованных агентов, и ни один из исследованных ингибиторов GSK3 не продемонстрировал желаемое потенцирование в линиях p53-отрицательных клеток опухоли толстой кишки (Tan, et al., Cancer Research, 65(19), 9012-9020 (2005. Существует необходимость в конкретных комбинациях агентов, проявляющих повышенную эффективность в лечении онкологического пациента с конкретным раковым заболеванием или обеспечивающих лучшую переносимость химиотерапии пациентом с раковым заболеванием. Ингибитор GSK3 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепин потенцирует действие некоторых агентов химиотерапии при конкретных раковых заболеваниях. Краткое описание сущности настоящего изобретения В настоящем изобретении предложено применение комбинации 7-(2,5-дигидро-4-имидазо[1,2a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с химиотерапевтическим агентом, выбранным из группы, состоящей из СРТ-11, пеметрекседа,гемцитабина, этопозида, доксорубицина, цисплатина и карбоплатина для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки. Кроме того, в настоящем изобретении предложено применение комбинации 7-(2,5-дигидро-4 имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с пеметрекседом и химиотерапевтическим агентом, выбранным из группы, состоящей из цисплатина или карбоплатина, для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки. Подробное описание настоящего изобретения Соединение СРТ-11 также известно как иринотекан (irinotecan) и продается под торговым названием КАМПТОСАР (CAMPTOSAR). СРТ-11 является средством химиотерапии, применяемым для лечения пациентов с распространенным раком толстого кишечника и толстой кишки. Его вводят периодически посредством болюсных инъекций или инфузии в дозировке 120-180 мг/м 2 в течение шестинедельных циклов лечения. Как правило, СРТ-11 вводят в сочетании с 5-фторурацилом (5-ФУ) и лейковорином(ЛВ) (leucovorin, LV). Соединение пеметрексед (pemetrexed) продается под торговым названием АЛИМТА (ALIMTA). Пеметрексед (pemetrexed) является химиотерапевтическим препаратом, применяемым для лечения пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого после предше-1 018447 ствующей химиотерапии. Пеметрексед (pemetrexed) в сочетании с цисплатином (cisplatin) показан для лечения пациентов со злокачественной мезотелиомой плевры в неоперабельном состоянии или тех пациентов, которые не могут подвергаться оперативному вмешательству по иным причинам. Как правило,пациенту вводят 500 мг/м 2 пеметрекседа (pemetrexed) посредством инфузии в течение 10 мин каждый 21 день после предварительного введения фолиевой кислоты, витамина B12 и дексаметазона (dexamethasone). Термин "платиносодержащий химиотерапевтический агент" обозначает противораковый химиотерапевтический агент, содержащий платину. Конкретные платиносодержащие химиотерапевтические агенты, предусмотренные способом согласно настоящему изобретению, включают цисплатин (cisplatin),карбоплатин (carboplatin) и оксалиплатин (oxaliplatin). Предпочтительным является применение цисплатина (cisplatin) или карбоплатина (carboplatin). Соединение цисплатин (cisplatin) продается под торговым названием ПЛАТИНОЛ-AQ (PLATINOL-AQ). Цисплатин (cisplatin) применяют для лечения пациентов с метастатическими опухолями яичников, которые уже прошли соответствующие хирургические и/или радиотерапевтические процедуры. Как отдельный агент, цисплатин (cisplatin), как правило, вводят в дозе 100 мг/м 2 внутривенно один раз за цикл, один раз каждые четыре недели. Цисплатин (cisplatin) также можно вводить в сочетании с ЦИТОКСАНОМ (CYTOXAN). Соединение карбоплатин (carboplatin) продается под торговым названием ПАРАПЛАТИН(PARAPLATIN). Карбоплатин (carboplatin) применяют для лечения пациентов с карциномой яичников. Как отдельный агент, карбоплатин (carboplatin) вводят, как правило, в дозе 360 мг/м 2 внутривенно один раз за цикл, один раз каждые четыре недели. Карбоплатин (carboplatin) также можно вводить в сочетании с циклофосфамидом (cyclophosphamide). Соединение оксалиплатин (oxaliplatin) продается под торговым названием ЭЛОКСАТИН(ELOXATIN). Оксалиплатин (oxaliplatin) применяют для лечения пациентов с раком ободочной и прямой кишки. Его вводят, как правило, в дозе 85 мг/м 2 внутривенно один раз за цикл, один раз каждые две недели в сочетании с 5-ФУ (5-FU) и ЛВ (LV). Соединение доксорубицин (doxorubicin) продается под торговыми названиями АДРИАМИЦИН(ADRIAMYCIN) и РУБЕКС (RUBEX). Доксорубицин (doxorubicin) успешно применяли для достижения регрессии при диссеминированных неопластических заболеваниях, таких как острый лимфобластный лейкоз, острый миелобластный лейкоз, опухоль Вильмса, нейробластома, саркомы мягких тканей и костей, карцинома молочной железы, карцинома яичников, переходно-клеточная карцинома мочевого пузыря, рак щитовидной железы, карцинома желудка, болезнь Ходжкина, злокачественная лимфома и бронхогенная карцинома. Его вводят, как правило, в дозе 60-75 мг/м 2 внутривенно с 21-дневными интервалами. Соединение этопозид (etoposide) продается под торговыми названиями ЭТОПОФОС (ETOPOPHOS), ТОПОСАР (TOPOSAR) и ВЕПЕЗИД (VEPESID). Этопозид (etoposide) применяют для лечения пациентов с раком яичка или легкого. Его, как правило, вводят посредством инъекции в дозе 5100 мг/м 2. Соединение 5-фторурацил (5-ФУ) продается под торговым названием АДРУЦИЛ (ADRUCIL). Его применяют для лечения пациентов с карциномой толстой кишки, прямой кишки, молочной железы,желудка и поджелудочной железы. 5-ФУ вводят, как правило, внутривенно в дозе 12 мг/кг один раз в день в течение четырех дней подряд. Гемцитабин (gemcitabine) продается под торговым названием ГЕМЗАР (GEMZAR). Его чаще всего применяют для лечения немелкоклеточного рака легкого, рака поджелудочной железы, рака мочевого пузыря и рака молочной железы. Его вводят, как правило, посредством внутривенной инфузии в дозировке 1000 мг/м 2 в течение 30 мин еженедельно из 4 недель в течение 3 недель подряд. Специалисту в данной области техники очевидно, что точную дозу и количество циклов лечения любым из вышеописанных агентов, необходимых для лечения пациента, определяет врач с учетом стадии и тяжести заболевания, а также конкретных потребностей и реакции конкретного пациента. В WO 03/076442 указано, что соединение 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо 1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепин, которое в данном источнике называют 3-(9-фтор-6-(пиперидин-1-ил)карбонил)-6,7-дигидро-6H[1,4]диазепино-[6,7,1-hi]индол-1-ил)-4-(имидазо[1,2-a]пиридин-3-ил)-2,5-диоксопиррол (пример 365, стр. 113), является ингибитором GSK-3. Принято, что два указанных названия являются синонимами, и каждое название обозначает следующую структуру: Соединение I Соединение I является основанием и, следовательно, может реагировать с любой из неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные с HCl, HBr,серной кислотой или метансульфокислотой. Соединение I образует сольваты, например, с водой, метанолом и этанолом. Предпочтительным сольватом является сольват, образованный с этанолом. Несмотря на то, что соединение I само по себе не обладает полезной противоопухолевой активностью, его введение в сочетании с СРТ-11, пеметрекседом (pemetrexed), гемцитабином (gemcitabine), этопозидом (etoposide), доксорубицином (doxorubicin) или платиносодержащими химиотерапевтическими агентами обеспечивает значительное терапевтическое преимущество в лечении рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки по сравнению с лечением только СРТ-11,пеметрекседом (pemetrexed), гемцитабином (gemcitabine), этопозидом (etoposide), доксорубицином(doxorubicin) или платиносодержащими химиотерапевтическими агентами. Одно из преимуществ данной комбинации заключается в том, что лечебное действие СРТ-11, пеметрекседа (pemetrexed), гемцитабина(gemcitabine), этопозида (etoposide), доксорубицина (doxorubicin) или платиносодержащих химиотерапевтических агентов потенцируют совместным введением с соединением I. То есть более низкая доза СРТ-11, пеметрекседа (pemetrexed), гемцитабина (gemcitabine), этопозида (etoposide), доксорубицина(doxorubicin) или платиносодержащих химиотерапевтических агентов по сравнению с той, которую вводят обычно, окажет аналогичное лечебное действие на пациента. Кроме того, пациент сможет ощутить более сильный лечебный эффект при введении обычной дозы СРТ-11, пеметрекседа (pemetrexed), гемцитабина (gemcitabine), этопозида (etoposide), доксорубицина (doxorubicin) или платиносодержащих химиотерапевтических агентов при типичной дозе, в случае, если указанные агенты введены совместно с соединением I. Этот способ лечения дает дополнительное преимущество удобства для пациента и врача,поскольку он позволяет водить соединение I по той же схеме лечения, что и СРТ-11, пеметрексед (pemetrexed), гемцитабин (gemcitabine), этопозид (etoposide), доксорубицин (doxorubicin) или платиносодержащие химиотерапевтические агенты. Комбинированная терапия согласно настоящему изобретению представляет собой улучшенный способ лечения пациента, страдающего от рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки. Пациент представляет собой млекопитающее, а предпочтительное млекопитающее представляет собой человека. Несмотря на то, что все описанные выше комбинации соединения I или фармацевтически приемлемой соли или сольвата указанного соединения и химиотерапевтических агентов являются полезными,некоторые комбинации являются предпочтительными. Одна предпочтительная комбинация представляет собой совместное введение 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения и платиносодержащего химиотерапевтического агента. Другим вариантом реализации является совместное введение 7-(2,5-дигидро-4 имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения и либо цисплатина (cisplatin), либо карбоплатина (carboplatin). Еще одним вариантом реализации настоящего изобретения является введение 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3 ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с пеметрекседом (pemetrexed) и платиносодержащим химиотерапевтическим агентом. Предпочтительным является введение 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор 1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с пеметрекседом (pemetrexed) и карбоплатином (carboplatin). Фраза "эффективное количество химиотерапевтического агента" обозначает дозу конкретного химиотерапевтического агента, необходимую для того, чтобы либо разрушить раковые клетки-мишени,-3 018447 либо замедлить или остановить прогрессирование ракового заболевания у пациента при введении химиотерапевтического агента в сочетании с соединением I или фармацевтически приемлемой солью или сольватом указанного соединения. Фраза "эффективное количество 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1Hпиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения обозначает дозу соединения I или фармацевтически приемлемой соли или сольвата указанного соединения, необходимую для потенцирования действия конкретной дозы конкретного химиотерапевтического агента, направленного либо на разрушение раковых клеток-мишеней, либо на замедление или остановку прогрессирования рака у пациента. Предполагаемые дозы соединения I или фармацевтически приемлемой соли или сольвата указанного соединения находятся в диапазоне от 5 до 600 мг/пациент/день. Предпочтительные дозы находятся в диапазоне от 50 до 400 мг/пациент/день. Еще более предпочтительные дозы находятся в диапазоне от 100 до 400 мг/пациент/день. Точную дозировку, необходимую для лечения пациента, определит врач с учетом стадии и тяжести заболевания, а также конкретных потребностей и реакции индивидуального пациента. Фраза "потенцировать действие конкретной дозы конкретного химиотерапевтического агента" обозначает, что доза химиотерапевтического агента более низкая, чем та, которую вводят обычно, будет эффективной дозой или что пациент при обычной дозе ощутит более сильное лечебное действие химиотерапевтического агента в случае его введения совместно с соединением I или фармацевтически приемлемой солью или сольватом указанного соединения. Термины "вводимый совместно" и "совместное введение", а также фразы "в комбинации с" и "введенный в комбинации с" в настоящем описании означают, что с соединение I или фармацевтически приемлемую соль или сольват указанного соединения вводят пациенту в течение того же цикла лечения, что и СРТ-11, пеметрексед (pemetrexed) или платиносодержащий химиотерапевтический агент. То есть соединение I или фармацевтически приемлемую соль или сольват указанного соединения можно вводить перед, во время или после введения СРТ-11, пеметрекседа (pemetrexed) или платиносодержащего химиотерапевтического агента по усмотрению врача с учетом типа опухоли, стадии заболевания, конкретного применяемого химиотерапевтического агента, а также состояния и чувствительности пациента. Следующие исследования in vitro и in vivo демонстрируют преимущества этих сочетаний. Примеры эффективности in vitro Апоптоз или запрограммированная гибель клеток характеризуется рядом биохимических реакций,одной из которых является индукция каспаз. Активированные каспазы представляют собой протеазы,которые участвуют в каскаде процессов распада, блокирующих ключевые ферменты, ответственные за гомеостаз и восстановление клеток. Каспазы 3 и 7 выполняют роль ключевых эффекторов в апоптозе, их можно детектировать и определять их количество с помощью флуоресцентного биохимического анализа. Увеличение активности каспазы 3/7 в клетках напрямую связано с апоптотической активностью (D.W.Nicholson, et al., Nature, 376, 37-43 (1995. Использовали набор реактивов Promega Аро-ONE Homogeneous Caspase-3/7 (каталог G7791). Буфер для анализа состоит из следующих составляющих: 30 мМMgCl2, 0,4 мМ EGTA (этиленгликоль тетрауксусная кислота), 0,5% Nonidet P40 (октилфенолполи(этиленгликолевый эфир, 0,1% CHAPS (3-[(3-холамидопропил)диметиламмонио]-1-пропансульфоната гидрат и 10% сахароза, которая лизирует/пермеабилизирует культивированные клетки и субстрат каспазы 3/7, Z-DEVD (Z-Асп(ОМе)-Глу(ОМе)-Вал-Асп(ОМе, связанный с профлуоресцентным родамином 110. Когда смесь буфер-субстрат добавляют к исследуемой пробе, распад и последующее удаление пептидов DEVD в результате активности каспазы 3/7 вызывает интенсивную флуоресценцию уходящей группы родамина 110, которую детектируют путем возбуждения при 499 нм. Количество флуоресцентного продукта пропорционально значению активности расщепления каспазы 3/7 в образце. Для измерения апоптотического влияния исследуемых соединений опухолевые клетки высевают по 1104 клеток на лунку в 96-луночные планшеты и инкубируют в течение ночи при 37C с 5% CO2. Опухолевые клетки обрабатывают исследуемым соединением в необходимых концентрациях в трипликате,включая лунки без обработки/лунки отрицательного контроля. Планшеты для анализа повторно инкубируют в течение 48 ч. В конце периода инкубации в каждую лунку с образцом добавляют смесь буфера для анализа и субстрата. Величину флуоресценции в каждой лунке измеряют при длине волны возбуждения 48520 нм и длине волны излучения 53025 нм. Рассчитывают процентное увеличение активности каспазы в обработанных клетках относительно необработанных контрольных клеток. НСТ-116 и colo-205 являются карциномами ободочной и прямой кишки, А 2780 и SKOV3 являются карциномами яичников, А 549, Calu-6 и NCI H-460 являются немелкоклеточными карциномами легкого, аAGS, KATO III и MKN 45 являются карциномами желудка. В следующих таблицах термин "соединениеI" или "соед. I" обозначает 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепин. Агенты химиотерапии тестировали при следующих концентрациях: Данные, представленные в табл. 1-12, выражены как процентное увеличение активности каспазы относительно необработанных контрольных клеток, если не указано иное. Таблица 1 Цисплатин (cisplatin) в сочетании с соединением I Концентрация соединения I была различной для разных линий клеток: НСТ-116 (300 нМ); Концентрация соединения I была различной для разных линий клеток: А 549 (300 нМ); Концентрация соединения I была различной для разных линий клеток: НСТ-116 (330 нМ); Концентрация соединения I составляла 30 нМ для всех линий клеток невозможно рассчитать, нет измеренного действия одного пеметрекседа (pemetrexed) Планшеты, инкубировали в течение 72 ч Данные кратного увеличения, представленные в табл. 1-12, отражают потенцирование апоптоза,опосредуемого химиотерапевтическими препаратами, в клетках при совместном введении соединения I по сравнению с апоптотическим действием только химиотерапевтического препарата. Эксперименты по определению эффективности in vivo. Клетки из культуры вводят подкожно в заднюю часть бока самок мышей линии CD-1 nu/nu, которых после получения от поставщика неделю содержали в виварии для адаптации. Мышей случайным образом делят на группы по 7 или 8 мышей на группу и начинают лечение, когда величина объема опухоли достигает 100 мм 3. Соединение I вводят внутривенно, а химиотерапевтический агент вводят интраперитонеально. Когда эти агенты вводят в комбинации, химиотерапевтический агент вводят за 60 мин до соединения I. Опухоли измеряют два раза в неделю с помощью электронных циркулей и на основе полученных данных строят кривые роста. Задержка роста опухоли представляет собой увеличение среднего времени, необходимого для достижения объема опухоли 1000 мм 3 по сравнению с контрольной группой. Животных также наблюдают на предмет появления изменений в массе тела и выживаемости. Таблица 13. Цисплатин (Cisplatin) в сочетании с соединением I в ксенотрансплантатах карциномы яичников человека А 2780. 5 мг/кг цисплатина (cisplatin) вводят интраперитонеально отдельно и в комбинации с 5 мг/кг соединения I (введенного внутривенно). Соединение I в дозировке 5 мг/кг (введенное внутривенно) также вводят отдельно в качестве контрольной группы. Животные получали подряд три цикла цисплатина (cisplatin) и соединения I, перерыв между циклами составлял семь дней. Таблица 13 5 мг/кг каждого - цисллатина (cisplatin) и соединения I Эффект комбинации, по сравнению с одним цисплатином (cisplatin) Таблица 14. Цисплатин (Cisplatin) в комбинации с соединением I в ксенотрансплантатах карциномы ободочной и прямой кишки человека НСТ-116. 10 мг/кг цисплатина (cisplatin) вводят интраперитонеально отдельно и в комбинации с 5 мг/кг соединения I (введенного внутривенно). Также отдельно вводят соединение I в дозе 5 мг/кг (введенное внутривенно) в качестве контрольной группы. Животные получали подряд три цикла цисплатина (cisplatin) и LY2090314, перерыв между циклами составлял семь дней. Таблица 14 5 мг/кг соединения I и 10 мг/кг цисплатина (cisplatm)Эффект комбинации по сравнению с одним цисплатином (cisplatin) Таблица 15. Цисплатин (Cisplatin) в комбинации с соединением I в ксенотрансплантатах карциномы ободочной и прямой кишки человека Colo-205. 5 мг/кг цисплатина (cisplatin) вводят интраперитонеально отдельно и в комбинации с 5 мг/кг соединения I (введенного внутривенно). Также отдельно вводят соединение I в дозе 5 мг/кг (введенное внутривенно) в качестве контрольной группы. Животные получали подряд три цикла цисплатина (cisplatin) и соединения I, перерыв между циклами составлял семь дней. Таблица 15 5 мг/кг каждого - цисплатина (cisplatin) и соединения IЭффект сочетания по сравнению с одним цисплатином (cisplatin) Таблица 16. Карбоплатин (Carboplatin) в комбинации с соединением I в ксенотрансплантатах немелкоклеточной раковой опухоли легкого человека NCI-H460. Соединение I вводят внутривенно в дозировке 5 мг/кг отдельно и с 50 мг/кг карбоплатина (Carboplatin) интраперитонеально. Введение производят каждые 14 дней 3 цикла. Для групп лечения, получающих и соединение I, и карбоплатин (Carboplatin), карбоплатин (Carboplatin) вводят за 60 мин до соединения I. 50 мг/кг карбоплатина (carboplatin) и 5 мг/кг соединения I Эффект сочетания по сравнению с одним карбоплатином (carboplatin) Таблица 17. Карбоплатин (Carboplatin) и пеметрексед (Pemetrexed) в комбинации с соединением I в ксенотрансплантатах немелкоклеточной раковой опухоли легкого человека NCI-H460. Соединение I вводят внутривенно в дозировке 5 мг/кг отдельно, с 10 мг/кг карбоплатина (carboplatin) интраперитонеально, с 300 мг/кг пеметрекседа (pemetrexed) интраперитонеально и с 10 мг/кг карбоплатина (carboplatin) интраперитонеально и 300 мг/кг пеметрекседа (pemetrexed) интраперитонеально. Введение осуществляют каждые 14 дней в течение трех циклов. Для групп лечения, получающих и соединение I, и карбоплатин (carboplatin), карбоплатин (carboplatin) вводят за 60 мин до соединения I. Для групп лечения, получающих и соединение I, и пеметрексед (pemetrexed), пеметрексед (pemetrexed) вводят за 24 ч до введения соединения I. Для групп лечения, получающих соединение I, карбоплатин(carboplatin) и пеметрексед (pemetrexed), пеметрексед (pemetrexed) вводят за 24 ч до соединения I, a карбоплатин (carboplatin) вводят за 60 мин до соединения I. Таблица 17 Эффект пеметрекседа (pemetrexed), карбоплатина (carboplatin) и соединения I по сравнению с карбоплатином (carboplatin) + пеметрекседом (pemetrexed) Данные, представленные в табл. 13-17, демонстрируют, что потенцирование соединением I задержки роста опухоли, вызванной химиотерапевтическим препаратом, является статистически значимым по сравнению с задержкой роста опухоли, вызванной только химиотерапевтическими препаратами. Получение 1. 2-Имидазо[1,2-]пиридин-3-ил-ацетамид. Этиловый эфир 4,4-диметокси-бут-2-еновой кислоты. Добавляли карбонат калия (16,5 г, 120 ммоль) к раствору диметоксиацетальдегида (мас.д. вещества в воде 60%) (15 мл, 100 ммоль) и триэтилфосфоноацетата (20 мл, 100 ммоль) в 210 мл тетрагидрофурана и 30 мл воды. Перемешивали смесь при комнатной температуре в течение 4 ч. Вливали реакционную смесь в диэтиловый эфир (200 мл) и промывали насыщенным водным хлоридом натрия. Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде желтого масла (15,8 г, 90%). 1 Н-ЯМР (300 МГц, CDCl3):6,77 (дд, J=15,9, 4,0 Гц, 1H), 6,13 (дд, J=15,9, 1,4 Гц, 1H), 4,95 (дд,J=4,0, 1,4 Гц, 1H), 4,22 (кв., J=7,1 Гц, 2H), 3,34 (с, 6H), 1,30 (т, J=7,1 Гц, 3H). Этиловый эфир имидазо[1,2-]пиридин-3-ил-уксусной кислоты. Нагревали смесь этилового эфира 4,4-диметокси-бут-2-еновой кислоты (43,5 г, 250 ммоль) и птолуолсульфоновой кислоты (4,75 г, 25 ммоль) в ацетонитриле (240 мл) и воде (15 мл) в колбе с обратным холодильником в течение 2 ч. Охлаждали реакционную смесь до комнатной температуры и добавляли 2-аминопиридин (18,8 г, 200 ммоль). Нагревали смесь в колбе с обратным холодильником в течение 16 ч, затем охлаждали до комнатной температуры. Разбавляли реакционную смесь этилацетатом (1200 мл) и последовательно промывали насыщенным водным бикарбонатом натрия (600 мл 3) и насыщенным водным хлоридом натрия (600 мл 2). Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде коричневого масла(30 г, 73%). 1 Н-ЯМР (300 МГц, CDCl3):8,06 (д, J=6,6 Гц, 1H), 7,63 (д, J=9,1 Гц, 1H), 7,56 (с, 1H), 7,20 (дд,J=8,9, 6,8 Гц, 1H), 6,84 (т, J=6,7 Гц, 1H), 4,17 (кв., J=7,3 Гц, 2H), 3,93 (с, 2H), 1,25 (т, J=7,3 Гц, 3H). Получение амида. Нагревали раствор этилового эфира имидазо[1,2-]пиридин-3-ил-уксусной кислоты (30 г, 147 ммоль) в NH3/MeOH (7 н. раствор, 250 мл) при 85C в герметичной пробирке в течение 15 ч. Охлаждали реакционную смесь до комнатной температуры и концентрировали при пониженном давлении. Обрабатывали остаток дихлорметаном, обрабатывали ультразвуком и фильтровали образующийся осадок с получением необходимого соединения в виде твердого вещества желтого цвета (8,9 г, 35%). 1H-ЯМР (300 МГц, DMSO):8,30 (д, J=6,9 Гц, 1H), 7,62 (ушир.с, 1H), 7,54 (д, J=9,0 Гц, 1H), 7,42 (с,1H), 7,21 (дд, J=7,7, 6,7 Гц, 1H), 7,18 (ушир.с, 1H), 6,91 (т, J=6,8 Гц, 1H), 3,81 (с, 2H). Получение 2. трет-Бутиловый эфир 9-фтор-7-метоксиоксалил-3,4-дигидро-1H[1,4]диазепино[6,7,1hi]индол-2-карбоновой кислоты. 2-Дибутоксиметил-4-фтор-1-нитробензол. Нагревали раствор 5-фтор-2-нитробензальдегида (10 г, 59,17 ммоль), бутанола (20 мл, 219 ммоль) и п-толуолсульфоновой кислоты (600 мг, 3,15 ммоль) в толуоле (200 мл) в колбе с обратным холодильником в течение 2 ч в колбе с насадкой Дина-Старка. Охлаждали реакционную смесь до комнатной температуры, разбавляли этилацетатом (400 мл) и последовательно промывали насыщенным водным бикарбонатом натрия (300 мл 3) и насыщенным водным хлоридом натрия (300 мл 2). Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде бледно-желтого масла (17 г, 96%). 1H-ЯМР (300 МГц, CDCl3):7,91 (дд, J=8,9, 4,9 Гц, 1H), 7,53 (дд, J=9,3, 2,9 Гц, 1H), 7,15-7,09 (м,1H), 6,04 (с, 1H), 3,67-3,50 (м, 4H), 1,63-1,54 (м, 4H), 1,44-1,32 (м, 4H), 0,92 (т, J=7,3 Гц, 6H). 5-Фтор-1H-индол-7-карбальдегид. Добавляли бромид винилмагния (1M в тетрагидрофуране, 85,2 мл, 85,2 ммоль) по каплям к раствору 2-дибутоксиметил-4-фтор-1-нитробензола (8,5 г, 28,4 ммоль) в тетрагидрофуране (250 мл) при -78C. Нагревали реакционную смесь до -(45-50)C в течение 30 мин, охлаждали до -78C и по каплям добавляли бромид винилмагния (1M в тетрагидрофуране, 85,2 мл, 85,2 ммоль). Нагревали реакционную смесь до-(45-50)C в течение 20 мин, затем добавляли насыщенный водный хлорид аммония (300 мл). Нагревали смесь до комнатной температуры и экстрагировали диэтиловым эфиром (200 мл 2). Промывали смешанные органические фазы насыщенным водным хлоридом натрия (400 мл 2), высушивали над сульфатом натрия и концентрировали при пониженном давлении. Растворяли остаток в тетрагидрофуране (100 мл),добавляли 0,5 Н HCl (10 мл) и перемешивали в течение 20 мин. Разбавляли смесь диэтиловым эфиром(200 мл), последовательно промывали насыщенным водным бикарбонатом натрия (200 мл 3) и насыщенным водным хлоридом натрия (200 мл 2). Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле, элюируя 5-10% этилацетатом в гексанах с получением необходимого соединения в виде бледно-желтого твердого вещества (2,6 г, 56%). 1H-HMP (300 МГц, CDCl3):10,07 (с, 1H), 10,05 (ушир.с, 1H), 7,62 (д, J=7,6 Гц, 1H), 7,42-7,39 (м,2H), 6,60 (д, J=5,4 Гц, 1H). 2-[(5-Фтор-1H-индол-7-илметил)амино]этанол. Добавляли 2-аминоэтанол (1,93 мл, 32,0 ммоль) с последующим добавлением уксусной кислоты(40 мл). Перемешивали при комнатной температуре в течение 15 мин. Порциями добавляли триацетоксиборгидрид натрия (4,07 г, 19,2 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение 3 ч. Медленно добавляли насыщенный водный бикарбонат натрия (100 мл) с последующим добавлением 1 н. NaOH до pH 9. Экстрагировали этилацетатом (100 мл 3). Промывали органическую фазу насыщенным водным хлоридом натрия (200 мл 2), высушивали над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде бледно-желтого твердого вещества (3,2 г, 96%). 1H-ЯМР (300 МГц, CDCl3):9,71 (ушир.с, 1H), 7,24 (д, J=2,7 Гц, 1H), 7,19 (дд, J=9,5, 2,3 Гц, 1H),6,79 (дд, J=9,8, 2,2 Гц, 1H), 6,49 (дд, J=3,1, 2,2 Гц, 1H), 4,15 (с, 2H), 3,77 (т, J=5,2 Гц, 2H), 2,84 (т, J=5,2 Гц,2H). трет-Бутиловый эфир (5-фтор-1H-индол-7-илметил)-(2-гидроксиэтил)карбаминовой кислоты. Добавляли по каплям раствор ди-трет-бутилдикарбоната (3,63 г, 16,65 ммоль) в тетрагидрофуране(40 мл) к раствору 2-[(5-фтор-1H-индол-7-илметил)амино]этанол (3,15 г, 15,14 ммоль) в тетрагидрофуране (60 мл) при 0C. Перемешивали реакционную смесь при комнатной температуре в течение 2 ч. Добавляли этилацетат (200 мл) и промывали насыщенным водным хлоридом натрия. Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде бледно-желтого масла (4,9 г, 100%). 1 Н-ЯМР (300 МГц, CDCl3):10,17 (ушир.с, 1H), 7,27-7,23 (м, 2H), 6,81 (дд, J=9,4, 2,4 Гц, 1H), 6,50(1,29 мл, 16,65 ммоль) к раствору трет-бутилового эфира (5-фтор-1H-индол-7-илметил)-(2 гидроксиэтил)карбаминовой кислоты (4,9 г, предположительно 15,14 ммоль) в дихлорметане (70 мл) при 0C. Перемешивали реакционную смесь в течение 30 мин при 0C. Разбавляли этилацетатом (200 мл),последовательно промывали насыщенным водным бикарбонатом натрия (200 мл 3) и насыщенным водным хлоридом натрия (200 мл 2). Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением необходимого соединения в виде желто-коричневого масла (5,9 г, 100%). 1 Н-ЯМР (300 МГц, CDCl3):10,07 (ушир.с, 1H), 7,28-7,2 (м, 2H), 6,83 (дд, J=9,3, 2,3 Гц, 1H), 6,50(дд, J=2,9, 2,2 Гц, 1H), 4,67 (с, 2H), 4,17 (т, J=5,5 Гц, 2H), 3,51 (т, J=5,6 Гц, 2H), 2,79 (с, 3H), 1,51 (с, 9H). трет-Бутиловый эфир 9-фтор-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты. Добавляли гидрид натрия (60%) (666 мг, 16,65 ммоль) одной порцией к раствору 2-[третбутоксикарбонил-(5-фтор-1H-индол-7-илметил)амино]этилового эфира метансульфокислоты (5,9 г,предположительно 15,14 ммоль) в диметилформамиде (40 мл) при 0C. Перемешивали реакционную смесь при 0C в течение 10 мин, а затем при комнатной температуре в течение 30 мин. Медленно добавляли воду (200 мл). Фильтровали и высушивали образующийся желтый осадок с получением необходимого соединения (4,14 г, 94%). 1H-ЯМР (300 МГц, CDCl3):7,15 (д, J=9,1 Гц, 1H), 7,07 (с, 1H), 6,78 (дд, J=14,7, 8,8 Гц, 1H), 6,49 (д,J=3,1 Гц, 1H), 4,81 (с, 1H), 4,76 (с, 1H), 4,25-4,23 (м, 2H), 3,94-3,83 (м, 2H), 1,49 (с, 9H). трет-Бутиловый эфир 9-фтор-7-метоксиоксалил-3,4-дигидро-1H[1,4]диазепино[6,7,1-hi]индол-2 карбоновой кислоты. Добавляли оксалилхлорид (1,62 мл, 18,56 ммоль) к раствору трет-бутилового эфира 9-фтор-3,4 дигидро-1H[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (4,14 г, 14,28 ммоль) в метил-третбутиловом эфире (100 мл) при -5C. Нагревали реакционную смесь до комнатной температуры в течение 1,5 ч, а затем охлаждали до -5C. Добавляли метанол (11,6 мл, 286 ммоль) и перемешивали при -5C в течение 30 мин. Добавляли насыщенный водный бикарбонат натрия (100 мл) и экстрагировали этилацетатом (100 мл 3). Последовательно промывали смешанную органическую фазу насыщенным водным бикарбонатом натрия (200 мл 3) и насыщенным водным хлоридом натрия (200 мл 2). Высушивали органическую фазу над сульфатом натрия, а затем концентрировали при пониженном давлении с получением соединения, указанного в названии, в виде твердого вещества желтого цвета (5,13 г, 93%). 1(5,13 г, 13,64 ммоль) и 2-имидазо[1,2-а]пиридин-3-ил-ацетамида (2,39 г, 13,64 ммоль) в диметилформамиде (80 мл). Перемешивали реакционную смесь при комнатной температуре в течение 3 ч. Добавляли насыщенный водный хлорид аммония (200 мл) и экстрагировали этилацетатом (200 мл 3). Промывали смешанные органические фазы насыщенным водным хлоридом натрия (200 мл 3), высушивали над сульфатом натрия и концентрировали при пониженном давлении. Растворяли остаток в дихлорметане (20 мл) и по каплям добавляли 4 н. HCl в диоксане (40 мл), затем перемешивали при комнатной температуре в течение 4 ч. Фильтровали образующийся осадок и промывали диэтиловым эфиром с получением соединения, указанного в названии, в виде твердого вещества красного цвета (4,4 г, 68%).MS (APCI): m/z = 402 [C22H16FN5O2 + H]+. Пример 1. 7-(2,5-Дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9-фтор 1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепин. Добавляли пиперидин-1-карбонилхлорид (0,5 мл, 4,0 ммоль) к раствору 3-(9-фтор-1,2,3,4 тетрагидро[1,4]диазепино[6,7,1-hi]индол-7-ил)-4-имидазо[1,2-a]пиридин-3-ил-пиррол-2,5-диона (1,42 г,3,0 ммоль) и триэтиламина (2,09 мл, 15,0 ммоль) в метаноле (80 мл). Перемешивали при комнатной температуре в течение ночи. Добавляли триэтиламин (1,04 мл, 7,5 ммоль) и пиперидин-1-карбонилхлорид(0,5 мл, 4,0 ммоль). Перемешивали при комнатной температуре в течение 5 ч. Добавляли этилацетат (500 мл) и последовательно промывали насыщенным водным бикарбонатом натрия (300 мл 3) и насыщенным водным хлоридом натрия (200 мл). Высушивали органическую фазу над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле, элюируя 0-3% метанолом в этилацетате с получением необходимого соединения, указанного в названии, в виде твердого вещества красного цвета (700 мг, 45%). Температура плавления = 188-190C.MS (APCI): m/z = 513 [C28H25FN6O3 + H]+. Пример 2. Метансульфонат 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3 ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина. Нагревали суспензию 7-(2,5-дигидро-4-имидазо[1,2-а]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина (500 мг, 0,976 ммоль) в метаноле (2,5 мл) до 64C. Добавляли раствор метансульфокислоты (64 мкл, 0,976 ммоль) в метаноле (1,0 мл) в течение 5 мин. Перемешивали смесь при 64C в течение 15 мин, а затем добавляли изопропанол (5,0 мл) в течение 30 мин. Образующуюся суспензию оставляли охлаждаться до комнатной температуры в течение 1 ч, а затем перемешивали при комнатной температуре в течение 4 ч. Фильтровали суспензию, промывали изопропанолом и высушивали при пониженном давлении при 42C с получением соединения, указанного в названии, в виде твердого вещества оранжевого цвета (478 мг, 88,5% (доведенное до 9,9% летучих компонентов в исходном веществе и 1,0% летучих компонентов в продукте. Температура плавления = 282,3C (DSC). Пример 3. Этанолат 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина. Нагревали суспензию 7-(2,5-дигидро-4-имидазо[1,2-а]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина (2,0 г, 3,9 ммоль) в этаноле (30 мл) до 70C. Добавляли 5 М HCl (0,73 мл) весь сразу. Перемешивали смесь при 70C в течение 10 мин, а затем добавляли 1 н. NaOH (3,63 мл) в течение 3 мин. Перемешивали смесь при 70C в течение 2 ч. Образующуюся суспензию оставляли охлаждаться до комнатной температуры в течение 1 ч, а затем перемешивали при комнатной температуре в течение 3,5 ч. Фильтровали суспензию, промывали этанолом и высушивали при пониженном давлении при 42C с получением соединения, указанного в названии, в виде твердого вещества оранжевого цвета (1,84 г, 92% (доведенное до 7,5% летучих компонентов в исходном веществе и 7,7% летучих компонентов в продукте. Температура плавления = 179,4C (DSC). Порошковые рентгеновские основные пики (углы 2 в градусах, интенсивность): 8,989, 100%; 9,787, 48,7%; 12,846, 20,0% и 7,444, 17,5%. Пример 4. Гидрат I 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина. Нагревали суспензию этанолата 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1Hпиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина (198,5 мг) в воде (10 мл) до 80C в течение 2,75 ч. Добавляли 3,11 мл 1 н. HCl. Когда температура дошла до 80C, быстро добавляли 3,11 мл 1 н. NaOH. Поддерживали температуру на уровне 80C в течение приблизительно 15 мин, затем оставляли суспензию охлаждаться до комнатной температуры. Собирали твердое вещество путем вакуумного фильтрования через ватманскую бумагу 1 и оставляли неплотно прикрытым сохнуть в течение ночи. Порошковые рентгеновские основные пики (углы 2 в градусах, интенсивность): 12,089, 100%; 10,485, 83,6%; 13,227, 56,0% и 7,660, 8,0%. Пример 5. Гидрат II 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина. Нагревали суспензию этанолата 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1Hпиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина (200,6 мг) в воде (25 мл) до 75C в течение 0,5 ч. Добавляли 0,72 мл 1 н. HCl и продолжали нагревать в течение 0,75 ч. Быстро добавляли 0,72 мл 1 н. NaOH. Оставляли суспензию охлаждаться до комнатной температуры. Собирали твердое вещество путем вакуумного фильтрования через ватманскую бумагу 1,промывали 20 мл деионизованной воды и оставляли неплотно прикрытым сохнуть в течение двух дней. Порошковые рентгеновские основные пики (углы 2 в градусах, интенсивность): 6,878, 100%; 5,732, 58,7%; 11,550, 82,8%; 18,426, 20,7% и 10,856, 44,2%. Пример 6. Дигидрат 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3-ил)-9 фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина. Нагревали суспензию этанолата 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1Hпиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина (200,8 мг) в воде (25 мл) до 75C в течение 0,67 ч. Добавляли 0,72 мл 1 н. HCl и продолжали нагревать в течение 1,75 ч. Добавляли 0,1 н. NaOH, увеличивая количество на 1 мл каждые 5 мин, пока не было добавлено 7,2 мл. После последнего добавления поддерживали температуру суспензии на уровне 75C в течение 0,67 ч, а затем оставляли суспензию охлаждаться до комнатной температуры. Собирали твердое вещество путем вакуумного фильтрования через ватманскую бумагу 1, промывали 20 мл деионизованной воды и оставляли неплотно прикрытым сохнуть в течение двух дней. Порошковые рентгеновские основные пики (углы 2 в градусах, интенсивность): 5,498, 100%; 22,149, 100%; 14,921, 32,9%; 11,399, 36,7% и 11,019, 20,5%. Предпочтительно соединение I готовят в виде фармацевтической композиции перед введением пациенту. Полезные составы содержат соединение I или фармацевтически приемлемую соль или сольват указанного соединения и SBE7CD. Соединение SBE7CD представляет собой сульфобутиловый эфир -циклодекстрина, описанный в патенте США 5134127. Он продается под торговым названием КАПТИСОЛ (CAPTISOL). Конкретные составы описаны в следующем разделе "Примеры составов". Полезная фармацевтическая композиция может быть получена путем растворения соединения I или фармацевтически приемлемой соли или сольвата указанного соединения (50 мг/мл) в 2-пирролидоне(СОЛУФОР-Р (SOLUPHOR-P. Это раствор затем разбавляют водным раствором SBE7CD (30 об.%) и полоксамером 188 (Лутрол-F 68 (Lutrol-F 68 (10 об.%). Пример состава 1. Готовили первый раствор добавлением 30,0 г SBE7CD к 71,25 мл воды и перемешивали или взбалтывали до полного растворения. Добавляли 10,0 г полоксамера 188 и продолжали перемешивать до полного растворения. Готовили второй раствор добавлением этанолата соединения I к 2-пирролидону согласно следующей формуле: мл 2-пирролидона = (фактическая масса этанолата соединения I (мг)/50 мг/мл)0,5. Добавляли первый раствор к второму раствору. Фильтровали полученный раствор через 0,2 мкм фильтр СУПОР (SUPOR) (гидрофильный полиэфирсульфон) (Pall Corporation) в очищенный от пыли контейнер. Следующий вариант фармацевтической композиции получают смешиванием соединения I или фармацевтически приемлемой соли или сольвата указанного соединения в эквимолярном количестве фармацевтически приемлемой кислоты в воде. Затем эту смесь смешивают по меньшей мере с одним молярным эквивалентом SBE7CD в виде водного раствора. Предпочтительные фармацевтически приемлемые соли включают HCl, HBr, серную кислоту и метансульфоновую кислоту. Особенно предпочтительным является применение HCl. Пример состава 2. Готовили первый раствор добавлением 20,0 г SBE7CD к 80 мл воды и перемешивали или взбалтывали до полного растворения. Добавляли этот раствор к этанолату соединения I, согласно следующей формуле: мл первого раствора = (фактическая масса этанолата соединения I (мг)/20 мг/мл) - (фактическая масса этанолата соединения I (мг)/1200 мг/мл) - (фактическая масса этанолата соединения I (мг) 0,00195107 мл 1 н. HCl/мг этанолата соединения I). Добавляли 1 н. HCl согласно следующему вычислению: добавление мл 1 н. HCl = (фактическая масса этанолата соединения I (мг)0,00195107 мл 1 н. HCl/мг этанолата соединения I). Перемешивали или обрабатывали ультразвуком до полного растворения соединения. Предпочтительный вариант фармацевтической композиции получают добавлением 1 мол. экв. соединения I или фармацевтически приемлемой соли или сольвата указанного соединения к водному раствору 1 мол. экв. SBE7CD при значении pH меньше 5,5 (pH исходного раствора), возможно в присутствии фармацевтически приемлемого буфера и перемешиванием до растворения соединения I или фармацевтически приемлемой соли или сольвата указанного соединения. Затем значение pH доводят до 2,53,5 с помощью фармацевтически приемлемого основания (pH конечного раствора). Полученный состав в форме раствора можно сразу вводить пациенту или в предпочтительном случае этот раствор возможно лиофилизируют и полученный в результате твердый состав можно впоследствии растворять в воде.SBE7CD может присутствовать в диапазоне от 1 мол. экв. до количества, необходимого для введения пациенту, не более 13,4 г SBE7CD в день. Предпочтительным является количество SBE7CD от 1,0 до 4,0 мол. экв., более предпочтительным является количество от 2,0 до 3,0 мол. экв., особенно предпочтительным является количество от 2,5 до 2,7 мол. экв. относительно соединения I. Несмотря на то, что приемлемым является любое значение pH исходного раствора меньше 5,5,предпочтительным является значение pH исходного раствора меньше 3,0, более предпочтительным является значение pH исходного раствора в диапазоне от 1,0 до 2,0, а еще более предпочтительным является значение pH исходного раствора от 1,2 до 1,4. Намеченного значения pH исходного раствора достигают добавлением любой фармацевтически приемлемой кислоты, которая может довести значение pH раствора до значения менее 5,5. Предпочтительным является применение соляной кислоты. Состав, возможно, может содержать фармацевтически приемлемый буфер. Фармацевтически приемлемыми буферами являются соединения, используемые специалистом в области приготовления фармацевтических составов для стабилизации pH конечного раствора в конкретном диапазоне pH. Фармацевтически приемлемые буферы включают фосфатные буферы, а также лимонную кислоту, глицин, винную кислоту или их фармацевтически приемлемые соли. Фармацевтически приемлемые соли этих кислот включают соли натрия и калия. Предпочтительным является присутствие фармацевтически приемлемого буфера в составе. Предпочтительным фармацевтически приемлемым буфером является винная кислота. Важно, что соединение I полностью растворяют до доведения значения pH до значения pH конечного раствора. Растворение можно осуществлять с помощью любых средств механического перемешивания или путем регулирования температуры раствора, если это необходимо или желательно. Предпочтительным является перемешивание раствора при комнатной температуре. Значения pH конечного раствора достигают добавлением любого фармацевтически приемлемого основания, которое может довести значение pH раствора до значения pH в диапазоне от 2,5 до 3,5. Предпочтительным является применение гидроксида натрия. Значение pH конечного раствора может находиться в диапазоне от 2,5 до 3,5, но предпочтительным является значение в диапазоне от 2,5 до 3,1. Еще более предпочтительным является значение pH конечного раствора в диапазоне от 2,7 до 3,1. После достижения значения pH конечного раствора раствор может быть лиофилизирован, если это необходимо или желательно, в стандартных условиях лиофилизации с получением твердой фармацевтической композиции, подходящей для восстановления водой. Пример состава 3. Готовили раствор 0,15 г винной кислоты и 12 г (5,55 ммоль) SBE7CD в 70 мл воды. Добавляли 5 мл 1,0 н. HCl и перемешивали при комнатной температуре. Добавляли 1,1 г (2,15 ммоль) этанолата соединения I и перемешивали при комнатной температуре до растворения. Добавляли 1 н. гидроксид натрия до значения pH около 2,9. Добавляли воду в количестве, достаточном для получения конечного объема 100 мл. Лиофилизировали этот раствор с получением аморфного твердого вещества оранжевокрасного цвета. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3 ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с химиотерапевтическим агентом, выбранным из группы, состоящей из СРТ-11, пеметрекседа, гемцитабина, этопозида, доксорубицина, цисплатина и карбоплатина, для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки. 2. Применение по п.1, в котором химиотерапевтическим агентом является цисплатин или карбоплатин. 3. Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-a]пиридин-3-ил-2,5-диоксо-1H-пиррол-3 ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина или фармацевтически приемлемой соли или сольвата указанного соединения с пеметрекседом и химиотерапевтическим агентом, выбранным из группы, состоящей из цисплатина или карбоплатина, для получения лекарственного средства для лечения рака яичников, немелкоклеточного рака легкого или рака ободочной и прямой кишки. 4. Применение по п.3, в котором химиотерапевтическим агентом является карбоплатин.
МПК / Метки
МПК: A61K 31/4745, A61K 31/7068, A61K 31/24, A61K 31/704, A61P 35/00, A61K 31/724, A61K 31/555, A61K 31/5517, A61K 31/4985, A61K 31/513
Метки: применение, химиотерапевтическим, лечения, комбинации, злокачественных, опухолей, агентом, 7-(2,5-дигидро-4-имидазо[1,2-а]пиридин-3-ил-2,5-диоксо-1н-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина
Код ссылки
<a href="https://eas.patents.su/15-18447-primenenie-kombinacii-7-25-digidro-4-imidazo12-apiridin-3-il-25-diokso-1n-pirrol-3-il-9-ftor-1234-tetragidro-2-1-piperidinilkarbonilpirrolo321-jk14benzodiazepina-s-himioterapevtich.html" rel="bookmark" title="База патентов Евразийского Союза">Применение комбинации 7-(2,5-дигидро-4-имидазо[1,2-а]пиридин-3-ил-2,5-диоксо-1н-пиррол-3-ил)-9-фтор-1,2,3,4-тетрагидро-2-(1-пиперидинилкарбонил)пирроло[3,2,1-jk][1,4]бензодиазепина с химиотерапевтическим агентом для лечения злокачественных опухолей</a>
Предыдущий патент: Способ многоствольного бурения из эксплуатационной колонны скважин
Следующий патент: Электрохимический аккумуляторный элемент
Случайный патент: Способ получения противомикробной мембраны