Гетероциклы с микробиоцидными свойствами
Номер патента: 21137
Опубликовано: 30.04.2015
Авторы: Каранта Лаура, Респондек Маттиас Штефан, Зульцер-Моссе Зара, Ламберт Клеменс
Формула / Реферат
1. Соединение формулы (I)
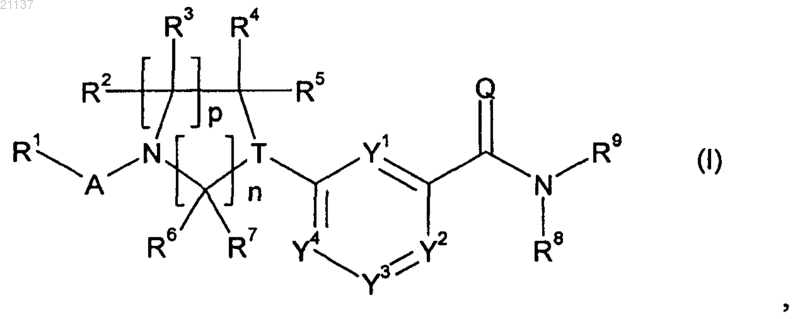
в которой А обозначает х-СН2-С(=O)-, х-O-С(=O)- или x-CH2-SO2-, причем х в каждом случае обозначает связь, присоединенную к R1;
Т обозначает СН или N;
Y1, Y2, Y3 и Y4 независимо обозначают СН или N;
Q обозначает О;
n равно 1 или 2;
р равно 1 или 2, при условии, что если n равно 2, то р равно 1;
R1 обозначает фенил или группу (b)
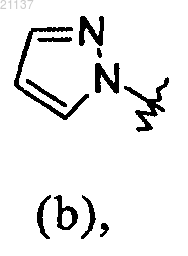
где каждый из фенила и группы (b) необязательно может быть замещен 1-3 заместителями, независимо выбранными из галогена, (С1-С4)алкила и (C1-С4)галоалкила;
R2, R3, R4, R5, R6 и R7, каждый, обозначают водород;
R8 обозначает водород или метил;
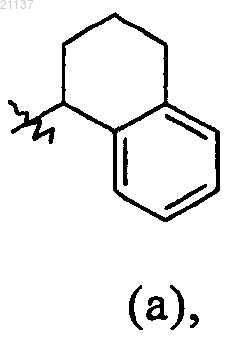
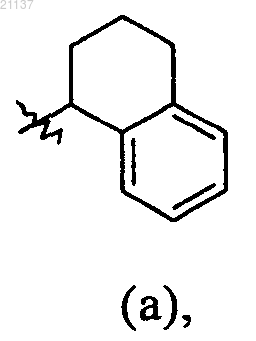
R9 обозначает фенил, бензил или группу (а)
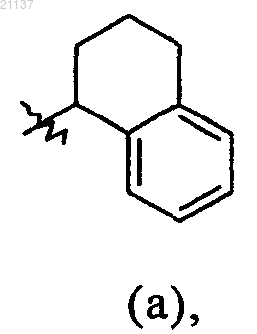
где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями, выбранными из метила;
или его агрохимически приемлемая соль или N-окись.
2. Соединение по п.1, в котором
А обозначает х-СН2-С(=O)-, х-O-С(=O)- или x-CH2-SO2-, причем x в каждом случае обозначает связь, присоединенную к R1;
Т обозначает СН;
Y1, Y2, Y3 и Y4 независимо обозначают СН или N, при условии, что как минимум 2 из Y1, Y2, Y3 и Y4 обозначают СН и в кольце, содержащем Y1, Y2, Y3 и Y4, нет связей N-N;
Q обозначает О;
n равно 1 или 2;
р равно 1;
R1 обозначает фенил или группу (b)
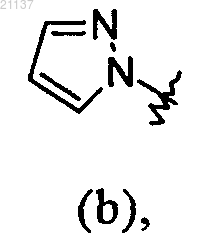
где каждый из фенила и группы (b) необязательно может быть замещен 1-3 заместителями, независимо выбранными из галогена, (С1-С4)алкила и (C1-С4)галоалкила;
R2, R3, R4, R5, R6 и R7, каждый, обозначают водород;
R8 обозначает водород или метил;
R9 обозначает фенил, бензил или группу (а)
где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями, выбранными из метила.
3. Соединение по п.1, в котором
А обозначает x-СН2-С(=O)-, где х обозначает связь, присоединенную к R1;
Т обозначает СН;
Y1, Y2, Y3 и Y4 независимо обозначают СН;
Q обозначает О;
n равно 2;
р равно 1;
R1 выбран из групп (с) или (d)
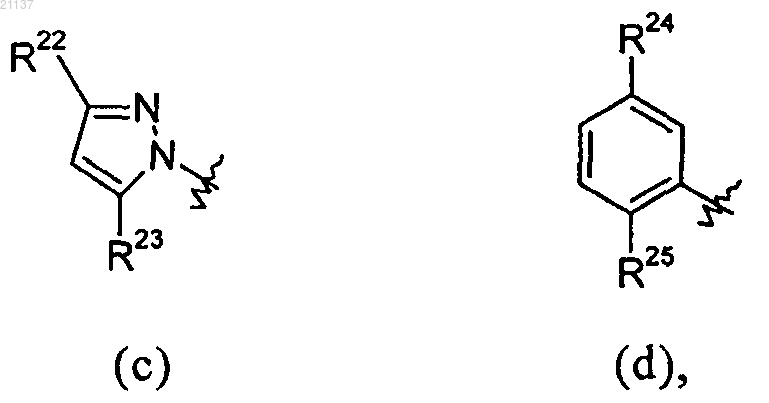
где R22, R23, R24 и R25 независимо выбраны из водорода, галогена, метила и галометила;
R2, R3, R4, R5, R6 и R7, каждый, обозначают водород;
R8 обозначает водород или метил;
R9 обозначает фенил, бензил или группу (а)
где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями, выбранными из метила.
4. Соединение по любому из пп.1-3, в котором по меньшей мере три из Y1, Y2, Y3 и Y4 обозначают СН, а оставшийся из Y1, Y2, Y3 и Y4 обозначает СН или N.
5. Соединение по любому из пп.1-4, в котором Y2 обозначает N.
6. Соединение по любому из пп.1-5, в котором р равно 1, а n равно 2.
7. Соединение формулы (I.a)
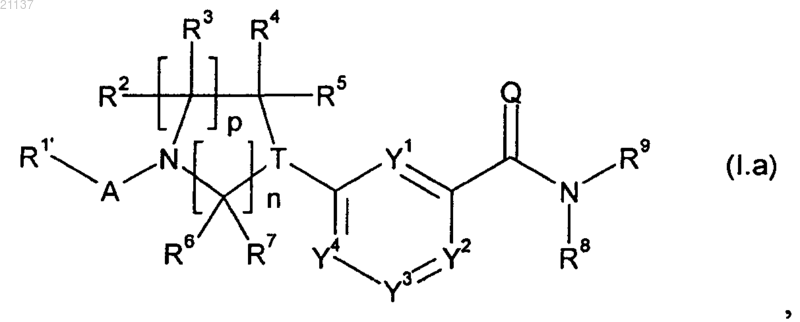
в которой R1' обозначает (С1-С8)алкил;
Y1, Y2, Y3, Y4, A, Q, T, n, р, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, определенные для формулы (I) в любом из пп.1-6.
8. Соединение формулы (IV)
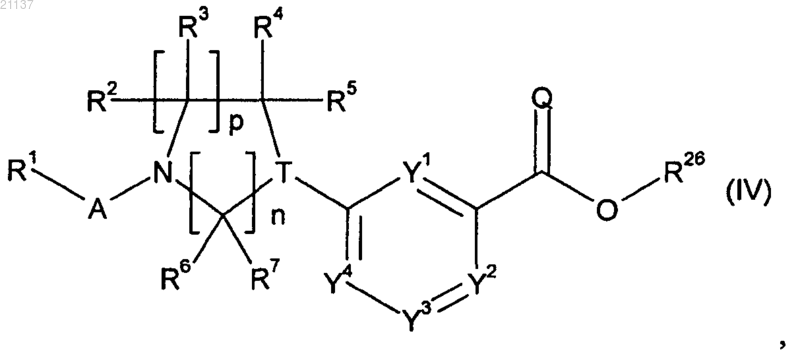
в которой Y1, Y2, Y3, Y4, A, Q, T, n, p, R1, R2, R3, R4, R5, R6 и R7 имеют значения, определенные для формулы (I) в любом из пп.1-6;
R26 обозначает (С1-С6)алкил или фенил, необязательно замещенный 1-3 заместителями, независимо выбранными из (С1-С4)алкила, (С1-С4)галоалкила, гидроксила, амино, циано и галогена.
9. Соединение формулы (XI)

в которой Y1, Y2, Y3, Y4, A, Q, n, p, R1, R2, R3, R4, R5, R6 и R7 имеют значения, определенные для формулы (I) в любом из пп.1-6;
Hal обозначает галоген.
10. Фунгицидная композиция, содержащая по меньшей мере одно соединение по любому из пп.1-6 и агрохимически приемлемый носитель.
11. Способ подавления или предупреждения заражения растений, их посадочного материала, собранного урожая или неживых материалов фитопатогенными микроорганизмами, или вызывающими порчу микроорганизмами, или потенциально опасными для человека организмами, включающий нанесение соединения по любому из пп.1-6 на растение, части растения или место его расположения, или на его посадочный материал, или на любую часть неживых материалов.
12. Способ по п.11, где фитопатогенные микроорганизмы представляют собой грибковые организмы.
Текст
Зульцер-Моссе Зара, Ламберт Клеменс, Каранта Лаура, Респондек Маттиас Штефан (CH) Представитель: Веселицкая И.А., Кузенкова Н.В.,Веселицкий М.Б., Каксис Р.А., Белоусов Ю.В., Куликов А.В., Кузнецова Е.В. (RU) Предметом настоящего изобретения являются гетероциклические соединения формулы (I), которые обладают микробиоцидной активностью, в частности фунгицидным действием, а также методы применения соединений формулы (I) для борьбы с микробами где А обозначает х-СН 2-С(=O)-, х-O-С(=O)- или X-CH2-SO2-, причем х в каждом случае обозначает связь,присоединенную к R1; Т обозначает СН или N; Y1, Y2, Y3 и Y4 независимо обозначают СН или N; Q обозначает О; n равно 1 или 2; р равно 1 или 2, при условии, что если n равно 2, то р равно 1; R1 обозначает фенил или группу (b) где каждый из фенила и группы (b) необязательно может быть замещен 1-3 заместителями, независимо выбранными из галогена, (С 1-С 4)алкила и (C1-С 4)галоалкила; R2, R3, R4, R5, R6 и R7, каждый, обозначают водород; R8 обозначает водород или метил; R9 обозначает фенил, бензил или группу (а) где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями,выбранными из метила; или их агрохимически приемлемая соль или N-окись.(71)(73) Заявитель и патентовладелец: ЗИНГЕНТА ПАРТИСИПЕЙШНС АГ (CH) Предметом настоящего изобретения являются гетероциклы, например, в качестве действующих веществ, которые обладают микробиоцидной активностью, в частности фунгицидным действием. Предметом изобретения также являются получение этих гетероциклов; гетероциклические производные, используемые в качестве промежуточных продуктов при получении таких гетероциклов; получение этих промежуточных продуктов; агрохимические композиции, которые содержат как минимум один такой гетероцикл; получение этих композиций и использование гетероциклов или композиций в сельскохозяйственном производстве, садоводстве или огородничестве для подавления или профилактики заражения растений, заготовленных продовольственных культур, семян или неживых материалов фитопатогенными микроорганизмами, преимущественно грибками. Некоторые гетероциклы, которые можно использовать в качестве фунгицидов, описаны в публикациях WO 2007/014290, WO 2008/013622, WO 2008/013925, WO 2008/091580, WO 2008/091594 иWO 2009/055514. Настоящее изобретение предлагает соединения формулы (I) где А обозначает х-СН 2-С(=O)-, х-O-С(=O)- или x-CH2-SO2-, причем х в каждом случае обозначает связь, присоединенную к R1; Т обозначает СН или N;Y1, Y2, Y3 и Y4 независимо обозначают СН или N;R1 обозначает фенил или группу (b) где каждый из фенила и группы (b) необязательно может быть замещен 1-3 заместителями, независимо выбранными из галогена, (С 1-С 4)алкила и (C1-С 4)галоалкила;R8 обозначает водород или метил;R9 обозначает фенил, бензил или группу (а): где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями,выбранными из метила; или их агрохимически приемлемую соль или N-окись. Если заместители указаны в качестве замещаемых "как вариант", это означает, что они могут нести или не нести один либо более одинаковых или различных заместителей. Обычно одновременно присутствуют не более трех таких факультативных заместителей. Термин "галоген" означает фтор, хлор, бром или йод. Термин "амино" означает -NH2. Алкильные, алкенильные или алкинильные заместители могут иметь прямую или разветвленную цепь. В зависимости от числа указанных атомов углерода алкил, самостоятельно или как часть другого заместителя, представляет собой, например, метил, этил, n-пропил, n-бутил, n-пентил, n-гексил, а также изомеры этих соединений, например изопропил, изобутил, сек-бутил, трет-бутил, изоамил или пивалоил. Галоалкильная группа может содержать один или несколько одинаковых или различных атомов галогена; ее примерами являются CH2Cl, CHCl2, CCl3, CH2F, CHF2, CF3, CF3CH2, CH3CF2, CF3CF2 илиCCl3CCl2. Наличие одного или нескольких возможных асимметричных атомов углерода в соединении формулы (I) означает, что соединения могут встречаться в формах оптических изомеров, т.е. в энантиомерных или диастереомерных формах. Как результат наличия возможной алифатической двойной связи С=С может возникать геометрическая изомерия, т.е. цис-транс или (E)-(Z) изомерия. Кроме того, в результате ограничения вращения вокруг одинарной связи могут возникать атропоизомеры. Формула (I) может включать все возможные упомянутые изомерные формы и их смеси. В объем настоящего изобретения включены все возможные упомянутые изомерные формы и их смеси для соединения формулы (I). Аналогичным образом, формула (I) может включать все возможные таутомеры. В объем настоящего изобретения включены все возможные таутомерные формы для соединения формулы (I). В каждом случае соединения формулы (I) согласно данному изобретению находятся в свободной форме, в окисленной форме в виде N-окиси или соли, например в форме соли, пригодной для использования в агрономических целях.N-окиси представляют собой окисленные формы третичных аминов или окисленные формы азота,содержащие гетероароматические соединения. Они описаны, например, в книге A. Albini and S. Pietra"Heterocyclic N-oxides", CRC Press, Boca Raton, 1991. К числу применимых солей соединений формулы (I) принадлежат соли, получаемые в результате добавления кислоты, например неорганической (минеральной) кислоты, такой как хлористо-водородная,бромисто-водородная, серная, азотная или фосфорная кислота, либо органической карбоновой кислоты,такой как щавелевая, винная, молочная, масляная, толуиловая, капроновая или фталевая кислота, либо сульфокислоты, такой как метан-, бензол- или толуолсульфокислота. Предпочтительно соединение формулы (I) является соединением, в котором А обозначает х-СН 2-С(=O)-, х-O-С(=O)- или x-CH2-SO2-, причем х в каждом случае обозначает связь, присоединенную к R1; Т обозначает СН;Y1, Y2, Y3 и Y4 независимо обозначают СН или N, при условии, что как минимум 2 из Y1, Y2, Y3 и 4R1 обозначает фенил или группу (b) где каждый из фенила и группы (b) необязательно может быть замещен 1-3 заместителями, независимо выбранными из галогена, (С 1-С 4)алкила и (C1-С 4)галоалкила;R8 обозначает водород или метил;R9 обозначает фенил, бензил или группу (а) где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями,выбранными из метила. Предпочтительно соединение формулы (I) является соединением, в котором А обозначает х-СН 2-С(=O)-, где х обозначает связь, присоединенную к R1; Т обозначает СН;R1 выбран из групп (с) или (d) где R22, R23, R24 и R25 независимо выбраны из водорода, галогена, метила и галометила;R8 обозначает водород или метил;R9 обозначает фенил, бензил или группу (а) где каждый из фенила, бензила и группы (а) необязательно может быть замещен 1-3 заместителями,выбранными из метила. Предметом настоящего изобретения являются также соединения формулы (I), где А обозначает х-СН 2-С(=O)-, х-ОС(=O)-, x-CH2-SO2-, причем х в каждом случае представляет собой связь, присоединенную к R1; Т обозначает СН или N;Y1, Y2, Y3 и Y4 независимо обозначают СН или N;R8 обозначает водород или метил; В предлагаемом ниже списке приведены определения, включая предпочтительные определения, для заместителей А, Т, Y1, Y2, Y3, Y4, Q, n, р, R1, R2, R3, R4, R5, R6, R7, R8, R9, R11, R12, R13, R14, R15, R16, R17,R18, R19, R22, R23, R24, R25 и R30 применительно к соединениям формулы (I). Для любого из этих заместителей любое из приведенных ниже определений можно использовать в сочетании с любым определением для любого другого заместителя, приведенным ниже. В объем настоящего изобретения включены соединения формулы со всеми возможными сочетаниями заместителей, определенных ниже или в любом другом месте настоящего документа. В целом, любое определение заместителя в данном документе применимо в сочетании с любым другим определением заместителя. А обозначает х-СН 2-С(=O)-, х-O-С(=O)- или x-CH2-SO2-, причем х в каждом случае обозначает связь, присоединенную к R1. Наиболее предпочтительно А обозначает х-СН 2-С(=O)-, где х обозначает связь, присоединенную к R1. Т обозначает СН или N. Наиболее предпочтительно Т обозначает СН.Y1, Y2, Y3 и Y4 независимо обозначают СН или N.R1 обозначает фенил или группу (b) где каждый фенил и каждая группа (b), как вариант, замещен(а) 1-3 заместителями, независимо выбранными из галогена, (С 1-С 4)алкила и (C1-С 4)галоалкила. Еще более предпочтительно R1 обозначает фенил или группу (b) где каждый фенил и каждая группа (b), как вариант, замещен(а) 1-3 заместителями, независимо выбранными из галогена, метила и галометила. В одной из групп соединений R1 выбран из группы (с) или (d) где R22, R23, R24 и R25 независимо выбраны из водорода, галогена, метила и галометила. В одной из групп соединений R1 обозначает группу (е), (f), (g) или (h)R8 обозначает водород или метил. Предпочтительно R8 обозначает водород.R9 обозначает фенил, бензил или группу (а) где каждый фенил, бензил и каждая группа (а), как вариант, замещен(а) 1-3 заместителями, независимо выбранными из метила. В одной из групп соединений R9 обозначает группу (i), (j) или (k)R22 предпочтительно обозначает водород или CF3. Предпочтительно R23, R24 и R25 независимо обозначают водород или метил. В одной из групп соединений как минимум два из Y1, Y2, Y3 и Y4 обозначают СН, а остальные из 1 2Y , Y , Y3 и Y4 обозначают СН или N. В одной из групп соединений как минимум три из Y1, Y2, Y3 и Y4 обозначают СН, а оставшийся из 1Y , Y2, Y3 и Y4 обозначает СН или N. В одной из групп соединений Y1 и Y4 обозначают СН, один из Y2 и Y3 обозначает СН, а другой из 2Y и Y3 обозначает СН или N. В одной из групп соединений Y1, Y2 и Y4 обозначают СН, a Y3 обозначает N. В одной из групп соединений Y1, Y3 и Y4 обозначают СН, a Y2 обозначает N. В одной из групп соединений Y1, Y2, Y3 и Y4 обозначают СН. В одной из групп соединений Y2 обозначает N. В одной из групп соединений Y3 обозначает N. В одной из групп соединений р равняется 1, а n равняется 2. В одной из групп соединений R2, R3, R4, R5, R6 и R7 обозначают Н. В одной из групп соединений Q обозначает О. В одной из групп соединений А обозначает х-СН 2-С(=O)-, где х представляет собой связь, присоединенную к R1. В одной из групп соединений R1 обозначает группу (f) В одной из групп соединений R8 обозначает водород. Во избежание недоразумений: если n равняется 1 и р равняется 1, соединения формулы (I) имеют формулу согласно формуле (IA) в которой А, Т, Y1, Y2, Y3, Y4, Q, R1, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям для формулы (I). Если n равняется 2, а р равняется 1, соединения формулы (I) имеют формулу согласно формуле (IB) в которой А, Т, G, Y1, Y2, Y3, Y4, Q, R1, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям для формулы (I). Если n равняется 1, а р равняется 2, соединения формулы (I) имеют формулу согласно формуле (IC) в которой А, Т, G, Y1, Y2, Y3, Y4, Q, R1, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям для формулы (I). Предметом настоящего изобретения также являются указанные выше соединения формулы (IA),формулы (IB) и формулы (IC). Предметом настоящего изобретения являются также соединения формулы (ID) в которой Y1, Y2, Y3, Y4, A, Q, R1, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям, приведенным выше для формулы (I). Предпочтительными для Y1, Y2, Y3, Y4, A, Q, R1, R2, R3, R4, R5, R6, R7, R8 иR9 являются определения, приведенные выше. Предметом настоящего изобретения являются также соединения формулы (IE) в которой Y1, Y2, Y3, Y4, A, Q, R1, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям, приведенным выше для формулы (I). Предпочтительными для Y1, Y2, Y3, Y4, A, Q, R1, R2, R3, R4, R5, R6, R7, R8 иR9 являются определения, приведенные выше. Предметом настоящего изобретения является также соединение формулы (IF) где Т обозначает N или СН; оба Y2 и Y3 обозначают СН или один из Y3 и Y2 обозначает N, а другой обозначает СН;R1 и R9 соответствуют приведенному выше определению для соединения формулы (I). Предпочтительными для R1 и R9 являются определения, приведенные выше. Предметом настоящего изобретения является также соединение формулы (IG) где Т обозначает N или СН; оба Y2 и Y3 обозначают СН или один из Y3 и Y2 обозначает N, а другой обозначает СН; аR9 соответствует приведенному выше определению для соединения формулы (I). Предпочтительными для R9 являются определения, приведенные выше. В объем настоящего изобретения включены также соединения формулы (I), в которой R1 обозначает защитную группу, такую как алкильная группа. Таким образом, в объем изобретения включены соединения формулы (I.a) в которой R1' обозначает (C1-C8)алкил, например (С 1-С 4)алкил, предпочтительно трет-бутил, a Y1,Y , Y3, Y4, A, Q, T, n, p, R2, R3, R4, R5, R6, R7, R8 и R9 соответствуют определениям, приведенным выше для формулы (I). Предпочтительными для Y1, Y2, Y3, Y4, A, Q, T, n, p, R2, R3, R4, R5, R6, R7, R8 и R9 являются определения, приведенные выше. Промежуточные продукты, соединения формулы (II), применимые для получения соединений формулы (I) 2 в которой Y1, Y2, Y3, Y4, A, Q, T, n, p, R1, R2, R3, R4, R5, R6 и R7 соответствуют определениям, приведенным выше для формулы (I). Предпочтительными для Y1, Y2, Y3, Y4, A, Q, T, n, p, R1, R2, R3, R4, R5, R6 и R7 являются определения, приведенные выше. Предметом настоящего изобретения является соединение формулы (IV) в которой Y1, Y2, Y3, Y4, A, Q, T, n, p, R1, R2, R3, R4, R5, R6 и R7 соответствуют определениям, приведенным выше для формулы (I); предпочтительными для Y1, Y2, Y3, Y4, A, Q, T, n, p, R1, R2, R3, R4, R5, R6 и R7 являются определения,приведенные выше; aR26 обозначает (С 1-С 6)алкил или фенил, как вариант, замещенный 1-3 заместителями, независимо выбранными из (С 1-С 4)алкила, (C1-С 4)галоалкила, гидроксила, амино, циано и галогена. Промежуточные продукты, соединения формулы (V), применимые для получения соединений формулы (I) в которой Y1, Y2, Y3, Y4, A, Q, n, p, R1, R2, R3, R4, R6 и R7 соответствуют определениям, приведенным выше для формулы (I); предпочтительными для Y1, Y2, Y3, Y4, A, Q, n, p, R1, R2, R3, R4, R6 и R7 являются определения, приведенные выше;R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил. Предпочтительно R26 обозначает (С 1-С 6)алкил или фенил, как вариант, замещенный 1-3 заместителями, независимо выбранными из (С 1-С 4)алкила, (C1-С 4)галоалкила, гидроксила, амино, циано и галогена. Промежуточные продукты, соединения формулы (X), применимые для получения соединений формулы (I) в которой Y1, Y2, Y3, Y4, Q, n, p, R2, R3, R4, R6 и R7 соответствуют определениям, приведенным выше для формулы (I); предпочтительными для Y1, Y2, Y3, Y4, Q, n, р, R2, R3, R4, R6 и R7 являются определения, приведенные выше;R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил. Предпочтительно R26 обозначает (С 1-С 6)алкил или фенил, как вариант, замещенный 1-3 заместителями, независимо выбранными из (С 1-С 4)алкила, (С 1-С 4)галоалкила, гидроксила, амино, циано и галогена. Предметом настоящего изобретения является соединение формулы (XI) в которой Y1, Y2, Y3, Y4, A, Q, n, р, R1, R2, R3, R4, R5, R6 и R7 соответствуют определениям, приведенным выше для формулы (I); предпочтительными для Y1, Y2, Y3, Y4, A, Q, n, p, R1, R2, R3, R4, R5, R6 и R7 являются определения,приведенные выше;Hal обозначает галоген. Предпочтительными отдельными соединениями являются 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-(R)-1,2,3,4 тетрагидронафталин-1-ил-бензамид (соединениеI.n.001); 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-R)-1 фенилэтил)бензамид (соединениеI.n.003); 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-(1,2,3,4 тетрагидронафталин-1-ил)бензамид (соединениеI.n.005); 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-(1-фенилэтил)бензамид(R)-(1,2,3,4-тетрагидронафталин-1-ил)амид 1'-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]1',2',3',4',5',6'-гексагидро-[4,4']бипиридинил-2-карбоновой кислоты (соединениеI.v.001); 3-4-[2-(3,5-диметилпиразол-1-ил)ацетил]пиперазин-1-ил-N-(R)-(1,2,3,4-тетрагидронафталин-1 ил)бензамид (соединение 1.z.001); 3-4-[2-(3,5-диметилпиразол-1-ил)ацетил]пиперазин-1-ил-N-(1,2,3,4-тетрагидронафталин-1 ил)бензамид (соединение 1.z.005). Соединения формулы (I) могут быть получены в соответствии с приведенными ниже схемами. Соединения формулы (I), в которой R1, R2, R3, R4, R5, R6, R7, R8, R9, A, T, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), могут быть получены путем трансформации соединения формулы (II), в которой R1, R2, R3, R4, R5, R6, R7, A, T, Y1, Y2, Y3, Y4, n, p и Q соответствуют определениям для формулы (I), при его взаимодействии с соединением формулы (III), в которой R8 и R9 соответствуют определениям для формулы (I), и пептидным связующим реагентом, таким как ВОР, РуВОР,HATU. Это показано на схеме 1. Соединения формулы (II), в которой R1, R2, R3, R4, R5, R6, R7, A, T, Y1, Y2, Y3, Y4, n, p и Q соответствуют определениям для формулы (I), могут быть получены путем омыления соединения формулы (IV), в которой R1, R2, R3, R4, R5, R6, R7, А, Т, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы(I), a R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил, при его взаимодействии с основанием, таким как гидроксид калия, гидроксид натрия, гидроксид лития, карбонат калия, карбонат натрия и т.д. Это показано на схеме 2. Схема 2 Соединения формулы (IV.1), в которой R1, R2, R3, R4, R5, R6, R7, A, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a R26 обозначает (C1-С 6)алкил или, как вариант, замещенный арил,могут быть получены путем восстановления соединения формулы (V), в которой R1, R2, R3, R4, R6, R7, A,Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a R26 обозначает (С 1-С 6)алкил или,как вариант, замещенный арил, при его взаимодействии с водородом и катализатором, таким как палладий на активированном угле, скелетный никелевый катализатор и т.д., или алюмогидридом лития. Это показано на схеме 3. Схема 3 Соединения формулы (V), в которой R1, R2, R3, R4, R6, R7, A, Y1, Y2, Y3, Y4, n р и Q соответствуют определениям для формулы (I), a R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил, могут быть получены путем трансформации соединения формулы (VI), в которой R2, R3, R5, R6, R7 n, p и А соответствуют определениям для формулы (I), a R27 и R28 независимо обозначают гидрокси или (С 1 С 6)алкил либо вместе с атомом бора, с которым они связываются, формируют пяти- или шестичленное насыщенное гетероциклическое кольцо, при его взаимодействии с соединением формулы (VII), в которой Y1, Y2, Y3, Y4 и Q соответствуют определениям для формулы (I), R26 обозначает (С 1-С 6)алкил или,как вариант, замещенный арил, a Hal обозначает галоген, предпочтительно йод, бром или хлор, и катализатором. Это показано на схеме 4. Соединения формулы (VI), в которой R1, R2, R3, R4, R6, R7 n, p и А соответствуют определениям для формулы (I), a R27 и R28 независимо обозначают гидрокси или (С 1-С 6)алкил либо вместе с атомом бора, с которым они связываются, формируют пяти- или шестичленное насыщенное гетероциклическое кольцо,могут быть получены путем трансформации соединения формулы (VIII), в которой R1, R2, R3, R4, R6, R7,n и р соответствуют определениям для формулы (I), a R27 и R28 независимо обозначают гидрокси или (С 1 С 6)алкил либо вместе с атомом бора, с которым они связываются, формируют пяти- или шестичленное насыщенное гетероциклическое кольцо, при его взаимодействии с соединением формулы (IX), в которойR1 и А соответствуют определениям для формулы (I), a R29 обозначает гидрокси или галоген, предпочтительно фтор, хлор или бром, и пептидным связующим реагентом или основанием, таким как пиридин,триэтиламин, этилдиизопропиламин и т.д. Это показано на схеме 5. Схема 5 Как вариант, соединения формулы (V), в которой R1, R2, R3, R4, R6, R7, A, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил, могут быть получены путем трансформации соединения формулы (X), в которой R2, R3, R4, R6, R7A, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a R26 обозначает (С 1-С 6)алкил или, как вариант, замещенный арил, при его взаимодействии с соединением формулы (IX), в которой R1 и А соответствуют определениям для формулы (I), a R29 обозначает гидрокси или галоген, предпочтительно фтор, хлор или бром, и пептидным связующим реагентом или основанием, таким как пиридин,триэтиламин, этилдиизопропиламин и т.д. Это показано на схеме 6. Как вариант, соединения формулы (I), в которой R1, R2, R3, R4, R5, R6, R7, R8, R9, A, T, Y1, Y2, Y3, Y4,n, p и Q соответствуют определениям для формулы, могут быть получены путем трансформации соединения формулы (XI), в которой R1, R2, R3, R4, R5, R6, R7, A, T, Y1, Y2, Y3, Y4, n, p и Q соответствуют определениям для формулы (I), a Hal обозначает галоген, предпочтительно фтор, хлор или бром, при его взаимодействии с соединением формулы (III), в которой R8 и R9 соответствуют определениям для формулы(I), и основанием, таким как пиридин, триэтиламин, этилдиизопропиламин и т.д. Это показано на схеме 7. Схема 7 Соединения формулы (XI), в которой R1, R2, R3, R4, R5, R6, R7, А, Т, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a Hal обозначает галоген, предпочтительно фтор, хлор или бром,могут быть получены путем трансформации соединения формулы (II), в которой R1, R2, R3, R4, R5, R6, R7,А, Т, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), при его взаимодействии с фосфорилгалогенидом, таким как фосфорилхлорид или фосфорилбромид, либо с тионилгалогенидом,таким как тионилхлорид или тионилбромид. Это показано на схеме 8. Схема 8 Соединения формулы (IV.2), в которой R1, R2, R3, R4, R5, R6, R7, A, Y1, Y2, Y3, Y4, n, р и Q соответствуют определениям для формулы (I), a R26 обозначает (C1-С 6)алкил или, как вариант, замещенный арил,могут быть получены путем трансформации соединения формулы (XII), в которой R1, R2, R3, R4, R6, R7, n,p и А соответствуют определениям для формулы (I), при его взаимодействии с соединением формулы(VII), в которой Y1, Y2, Y3, Y4 и Q соответствуют определениям для формулы (I), R26 обозначает (С 1 С 6)алкил или, как вариант, замещенный арил, a Hal обозначает галоген, предпочтительно йод, бром или хлор. Это показано на схеме 9. Схема 9 Авторами настоящей разработки было выявлено, что с точки зрения практического применения новые соединения формулы (I) обладают весьма высоким уровнем биологической активности для защиты растений от грибковых заболеваний. Соединения формулы (I) могут использоваться в агропромышленном производстве и в связанных с ним областях применения, например в качестве действующих веществ для борьбы с вредителями растений или на неживых материалах для борьбы с вызывающими порчу микроорганизмами, а также организмами, представляющими потенциальную опасность для человека. Новые соединения отличаются превосходной активностью при низких нормах расхода, хорошо переносятся растениями и безвредны для окружающей среды. Они обладают весьма полезными лечебными, профилактическими и системными свойствами и могут использоваться для защиты целого ряда культурных растений. Соединения формулы (I) могут использоваться для подавления жизнедеятельности или уничтожения вредителей, поражающих культурные растения целиком или их отдельные части (фрукты, цветки, листья, стебли, клубни,корни), в то же время обеспечивая и защиту вырастающих позже частей растений, например, от поражения фитопатогенными микроорганизмами. Соединения формулы (I) можно также применять в качестве протравливающих препаратов для обработки посадочного материала растений, например семян, таких как плоды, клубни или зерна, либо побегов растений (например, риса), с целью обеспечения защиты от грибковых инфекций, а также от фитопатогенных грибков, обитающих в почве. Перед высадкой посадочный материал можно обработать композицией, содержащей соединение формулы (I) семена, например, могут быть протравлены перед высеванием. Действующие вещества согласно настоящему изобретению можно использовать для обработки семенного зерна путем пропитки семян жидким составом либо их покрытия твердым составом. Композицией можно также обрабатывать место посадки во время высадки посадочного материала, например, в борозду для заделки семян во время высева. Предметом настоящего изобретения также являются упомянутые методы обработки посадочного материала растений и сам посадочный материал растений, обработанный таким образом. Кроме того, соединения согласно настоящему изобретению могут применяться для борьбы с грибками в родственных отраслях, например, для защиты технических материалов, включая древесину и получаемую из нее техническую продукцию, при хранении пищевых продуктов или для поддержания гигиены. Кроме того, данное изобретение может быть использовано для защиты неживых материалов, например пиломатериалов, стеновых плит и краски, от поражения грибками. Соединения формулы (I) эффективны, например, в борьбе с фитопатогенными грибками следующих классов: Fungi imperfecti (несовершенные грибы) (например, Alternaria spp.), базидиомицеты (например, Corticium spp., Ceratobasidium spp., Waitea spp., Thanatephorus spp., Rhizoctonia spp., Hemileiaspp., Cercospora spp., Pyrenophora spp., Rhynchosporium spp., Magnaporthe spp., Gaeumannomyces spp.,Oculimacula spp., Ramularia spp., Botryotinia spp.) и оомицеты (например, Phytophthora spp., Pythium spp.,Plasmopara spp., Peronospora spp., Pseudoperonospora spp., Bremia spp). Наблюдается превосходное действие соединений в борьбе с возбудителями ложной мучнистой росы (например, Plasmopara viticola) и кар- 12021137 тофельной гнили (например, Phytophthora infestans). Кроме того, новые компоненты формулы (I) эффективны в борьбе с фитопатогенными грамотрицательными и грамположительными бактериями (например, Xanthomonas spp., Pseudomonas spp., Erwinia amylovora, Ralstonia spp.) и вирусами (например, вирус мозаичной болезни табака). В рамках настоящего изобретения к числу подлежащих защите целевых сельскохозяйственных культур и/или полезных растений, в первую очередь, принадлежат следующие виды растений: зерновые(пшеница, ячмень, рожь, овес, рис, кукуруза, сорго и родственные виды); свекла (сахарная и кормовая); семечковые, косточковые и ягодные культуры (яблоня, груша, слива, персик, миндаль, вишня, земляника, малина и ежевика); бобовые растения (бобы, чечевица, горох, соя); масличные растения (сурепица,горчица, мак, маслины, подсолнух, кокос, клещевина, бобы какао и арахис); тыквенные культуры (тыква,огурцы, дыни); волокнистые растения (хлопок, лен, конопля, джут); цитрусовые (апельсин, лимон,грейпфрут, мандарин); овощи (шпинат, салат-латук, спаржа, капуста, морковь, лук, томаты, картофель,перец стручковый или красный); лавровые (авокадо, корица, камфора), а также такие растения, как табак,орехи, кофе, баклажаны, сахарный тростник, чай, перец, виноград, хмель, бананы и каучуконосные растения, а также газонные травы и декоративные растения. К полезным растениям и/или целевым сельскохозяйственным культурам в соответствии с настоящим изобретением наряду с традиционными относятся также генетически улучшенные или полученные с помощью генной инженерии сорта, например, отличающиеся стойкостью к насекомым (Bt- и VIPсорта), устойчивостью и к отрицательному воздействию гербицидов (стойкие к глифосату и глуфосинату сорта кукурузы, доступные в продаже под торговыми названиями RoundupReady и LibertyLink), или нематодоустойчивые сорта. В качестве примера генетически улучшенных или полученных с помощью генной инженерии сортов сельскохозяйственных культур можно назвать сорта хлопка Stoneville 5599BR и Stoneville 4892BR. Под термином "полезные растения" и/или "целевые сельскохозяйственные культуры" следует также понимать полезные растения с выработанной устойчивостью к токсичному воздействию гербицидов,например бромоксинилу, или классов гербицидов (таких как, например, ингибиторы HPPD, ингибиторы(протопорфириноген-оксидазы, полученные с помощью традиционных методов селекции или с помощью генной инженерии. Примером сельскохозяйственной культуры с устойчивостью к имидазолинонам,например имазамоксу, выработанной традиционными методами селекции (мутагенез), является сурепица(канола) Clearfield. В качестве примера сельскохозяйственных культур с устойчивостью к гербицидам или классам гербицидов, являющейся результатом применения генной инженерии, можно привести стойкие к глифосату и глуфосинату разновидности кукурузы, доступные на рынке под торговыми названиями RoundupReady, Herculex I и LibertyLink. Под термином "полезные растения" и/или "целевые сельскохозяйственные культуры" следует также понимать полезные растения, которые в результате трансформации с использованием технологий рекомбинантных ДНК получили способность синтезировать один или более токсинов с выборочным характером действия, таких как, например, токсины, вырабатываемые токсинообразующими бактериями, в особенности принадлежащими к роду бацилл. Под термином "полезные растения" и/или "целевые сельскохозяйственные культуры" следует также понимать полезные растения, которые в результате трансформации с использованием технологий рекомбинантных ДНК получили способность синтезировать антипатогенные вещества с выборочным характером действия, например так называемые "белки, связанные с патогенезом" (PR-белки, см., например, ЕРА-0392225). Примеры таких антипатогенных веществ и трансгенных растений, способных синтезировать такие антипатогенные вещества, известны, например, из публикаций ЕР-А-0392225, WO 95/33818 и ЕРА-0353191. Методы получения таких трансгенных растений хорошо известны специалистам в данной области и описаны, например, в вышеупомянутых публикациях. Под встречающимся в настоящем документе термином "место массового нахождения" растения следует понимать участок, где произрастают растения или высажен посадочный материал растений, либо участок, где посадочный материал растений будет высажен в почву. Примером такого места массового нахождения является поле, на котором произрастают культурные растения. Под термином "посадочный материал растения" следует понимать генеративные части растения,например семена, которые могут использоваться для размножения растения, и вегетативный растительный материал, такой как черенки или клубни (например, картофель). Можно упомянуть, например, семена (в строгом смысле слова), корни, плоды, клубни, луковицы, корневища и части растений. Можно также упомянуть проросшие растения и рассаду, которые подлежат пересаживанию после проращивания или после появления всходов. Эти молодые растения можно защитить до пересадки путем полной или частичной обработки погружением. Предпочтительно под "посадочным материалом растений" следует понимать семена. Соединения формулы (I) могут применяться в немодифицированной форме или предпочтительно вместе с присадками, традиционно используемыми в технологии приготовления химических соединений. С этой целью их удобно вводить известным способом в состав эмульгируемых концентратов, паст для покрытия семян, непосредственно разбрызгиваемых или разбавляемых растворов или суспензий, разбавленных эмульсий, смачивающихся порошков, растворимых порошков, дустов, гранул, а также заключить в оболочку, например, из полимерных веществ. Равно как и типы композиций, методики применения,такие как опрыскивание, распыление, опыление, разбрасывание, покрытие оболочкой или полив, выбирают в соответствии с намеченными целями и преобладающими условиями обработки. Композиции также могут содержать дополнительные присадки, такие как стабилизаторы, противопенные вещества, регуляторы вязкости, связующие вещества или усилители клейкости, а также удобрения, источники питательных микроэлементов либо другие составы специального действия. Носители и присадки, например для сельскохозяйственного использования, могут быть твердыми или жидкими и представляют собой вещества, применимые в технологии приготовления химических соединений, например натуральные или регенерированные минеральные вещества, растворители, диспергаторы, смачивающие агенты, усилители клейкости, загустители, связующие вещества или удобрения. Такие носители, например, описаны в публикации WO 97/33890. Соединения формулы (I) могут использоваться в форме композиций для обработки посевной площади или подлежащего защите растения одновременно или последовательно с дополнительными соединениями. Этими дополнительными соединениями могут быть, например, удобрения или источники питательных микроэлементов либо другие препараты, влияющие на рост растений. Ими также могут быть селективные или неселективные гербициды, а также инсектициды, фунгициды, бактерициды, нематоциды, моллюскоциды или смеси нескольких таких препаратов, при необходимости совместно с дополнительными носителями, поверхностно-активными веществами или улучшающими нанесение присадками,которые традиционно применяются в технологии приготовления химических соединений. Соединения формулы (I) обычно используются в форме фунгицидных композиций для уничтожения патогенных микроорганизмов или защиты от них; эти фунгицидные композиции содержат в качестве действующего вещества как минимум одно соединение формулы (I) или как минимум одно предпочтительное отдельное соединение, из определенных выше, в свободной форме или в форме соли, пригодной для использования в агрохимии, и как минимум одну из вышеупомянутых присадок. Настоящее изобретение предлагает фунгицидную композицию, содержащую как минимум одно соединение формулы (I), применяемый в агрохимии носитель и, как вариант, присадку. Применяемым в агрохимии носителем может быть, например, носитель, пригодный для сельскохозяйственного применения. Сельскохозяйственные носители хорошо известны в данной области. Предпочтительно кроме соединения формулы (I) упомянутые фунгицидные композиции могут содержать дополнительное фунгицидное действующее вещество. Соединение формулы (I) может быть единственным действующим веществом композиции или, где это необходимо, может примешиваться к одному или более дополнительных действующих веществ, таких как инсектицид, фунгицид, синергист, гербицид или регулятор роста растений. Дополнительное действующие вещество может в некоторых случаях приводить к неожиданному синергическому эффекту. Примерами пригодных для использования дополнительных действующих веществ являются следующие: Другой вариант настоящего изобретения касается применения соединения формулы (I) или предпочтительного отдельного соединения из определенных выше, композиции, содержащей как минимум одно соединение формулы (I) или как минимум одно предпочтительное отдельное соединение из определенных выше, или фунгицидной смеси, содержащей как минимум одно соединение формулы (I) или как минимум одно предпочтительное отдельное соединение из определенных выше, в смеси с другими описанными выше фунгицидами для подавления или профилактики заражения растений, например полезных растений, таких как культурные растения; их посадочного материала, например семян; собранного урожая, например собранных продовольственных культур; или неживых материалов фитопатогенными микроорганизмами, преимущественно грибковыми организмами. Еще один вариант изобретения касается метода подавления или профилактики заражения растений,например, полезных растений, таких как культурные растения; их посадочного материала, например семян; собранного урожая, например собранных продовольственных культур; или неживых материалов фитопатогенными микроорганизмами или микроорганизмами, вызывающими порчу, либо потенциально опасными для человека организмами, в особенности грибковыми организмами, который заключается в нанесении соединения формулы (I) или одного из определенных выше предпочтительных отдельных соединений в качестве действующего вещества на растения, части растений или места их массового нахождения, на их посадочный материал либо на любую часть неживого материала. Под "подавлением" или "профилактикой" следует понимать снижение зараженности фитопатогенными микроорганизмами, вызывающими порчу микроорганизмами либо потенциально опасными для человека организмами, в особенности грибковыми, до уровня проявления улучшения. Предпочтительным методом подавления или профилактики заражения культурных растений фитопатогенными микроорганизмами, в особенности грибковыми организмами, включающим применение соединения формулы (I) или агрохимической композиции, содержащей как минимум одно из упомянутых соединений, является обработка зеленой части растений. Частота обработки и норма расхода будут зависеть от опасности заражения соответствующим патогеном. Однако соединения формулы (I) могут также проникать в растение из почвы через корни (системное действие) при пропитке места массового нахождения растений жидким составом или внесении соединений в твердой форме, например в форме гранул, в почву (обработка почвы). При выращивании канадского риса такие гранулы можно применять на затопленных рисовых полях. Соединения формулы (I) можно также использовать для обработки семенного материала путем пропитки семян или клубней жидким составом фунгицида либо их покрытия твердым составом. Препаративная форма, например композиция, содержащая соединение формулы (I) и, при необходимости, твердая или жидкая присадка либо мономеры для заключения соединения формулы (I) в оболочку, может быть получена известным способом, обычно путем тщательного смешивания и/или измельчения соединения с наполнителями, например растворителями, твердыми носителями и, как вариант, поверхностно-активными веществами. Как правило, агрохимические препаративные формы и/или композиции содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.% соединения формулы (I), от 99,9 до 1 мас.%, предпочтительно от 99,8 до 5 мас.% твердой или жидкой присадки и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активного вещества. Обычно эффективная норма расхода составляет от 5 г до 2 кг действующего вещества (д.в.) на гектар (га), предпочтительно от 10 г до 1 кг д.в./га, наиболее предпочтительно от 20 г до 600 д.в./га. В случае использования в качестве протравителя для семян применимые дозы составляют от 10 мг до 1 г действующего вещества на 1 кг семян. Предпочтительным является создание коммерческих продуктов в виде концентратов, однако конечный пользователь, как правило, использует разведенные составы. Более подробно вышеописанное изобретение будет проиллюстрировано с помощью представленных ниже примеров, не претендующих на полноту. Пример 1. В данном примере описано получение 3-1-[2-(5-метил-3-трифторметилпиразол-1 ил)ацетил]пиперидин-4-ил-N-(R)-1,2,3,4-тетрагидронафталин-1-ил-бензамида (соединениеI.n.001). а) Получение трет-бутилового эфира 4-(3-этоксикарбонилфенил)-3,6-дигидро-2 Н-пиридин-1 карбоновой кислоты 1. К раствору этил-3-йодобензоата (10 г, 36,2 ммоль) в диоксане (400 мл) последовательно при комнатной температуре добавляли бис-(трифенилфосфин)палладий(II) хлорид (1,26 г, 1,8 ммоль), третбутиловый эфир 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (13,44 г, 43,46 ммоль) и водный раствор карбоната натрия (11,5 г в 100 мл воды, 108,6 ммоль). После перемешивания в течение 3 ч при температуре 110 С растворитель выпаривали, полученное масло желтого цвета растворяли в этилацетате (300 мл) и промывали рассолом (300 мл). Органический слой высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан от 0:1 до 3:7) для получения трет-бутилового эфира 4-(3-этоксикарбонилфенил)-3,6-дигидро-2 Н-пиридин-1 карбоновой кислоты (11,28 г, 94%). 1 Н-ЯМР (400 МГц, CDCl3):1,39-1,43 (t, 3 Н), 1,53 (s, 9H), 2,55-2,59 (m, 2H), 3,64 (t, 2H), 4,17-4,22(1 Этиловый эфир 3-пиперидин-4-ил-бензойной кислоты также может быть получен в соответствии со следующим источником: WO 2004092124 А 2 20041028 (MerckCo., Inc., USA. трет-Бутиловый эфир тетраметил[1,3,2]диоксаборолан-2-ил-3,6-дигидро-2 Н-пиридин-1(2 карбоновой кислоты можно получить в соответствии со следующим источником: Eastwood, P.R. Tetrahedron Letters 2000, 41, 3705 или приобрести у соответствующего поставщика (CAS 286961-14-6.b) Получение трет-бутилового эфира 4-(3-этоксикарбонилфенил)пиперидин-1-карбоновой кислоты 1. Раствор трет-бутилового эфира 4-(3-этоксикарбонилфенил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (11,28 г, 34,035 ммоль) в этаноле (680 мл) прокачивали через картридж с палладиевоуглеродным катализатором (Pd/C), используя проточный реактор для гидрирования H-Cube (20 С, 10 бар, 2 мл/мин). Растворитель затем выпаривали при пониженном давлении для получения третбутилового эфира 4-(3-этоксикарбонилфенил)пиперидин-1-карбоновой кислоты (10,55 г, 93%), который может быть использован в процессе выполнения следующего этапа без дальнейшей очистки. 1 Н-ЯМР (400 МГц, CDCl3):1,39-1,43 (t, 3 Н), 1,51 (s, 9H), 1,61-1,72 (dq, 1H), 1,78-1,90 (m, 1H), 2,662,74 (dt, 1H), 2,74-2,89 (m, 1H), 4,20-4,31 (m, 1H), 4,32-4,42 (q, 2H), 7,39-7,41 (m, 2H), 7,88-7,92 (m, 2H).c) Получение хлористо-водородной соли этилового эфира 3-пиперидин-4-ил бензойной кислоты 1. К раствору трет-бутилового эфира 4-(3-этоксикарбонилфенил)пиперидин-1-карбоновой кислоты(10,55 г, 31,64 ммоль) при комнатной температуре добавляли раствор 4 М HCl в диоксане (79 мл, 316,41 ммоль). После перемешивания всю ночь при комнатной температуре растворитель выпаривали при пониженном давлении. Полученное желтоватое вязкое масло растирали с диэтиловым эфиром и фильтровали для получения хлористо-водородной соли этилового эфира 3-пиперидин-4-ил бензойной кислотыd) Получение этилового эфира 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4 илбензойной кислоты. К раствору (5-метил-3-трифторметилпиразол-1-ил)уксусной кислоты (5,23 г, 20,75 ммоль) в DMF(50 мл) при комнатной температуре добавляли диизопропилэтиламин (43 мл, 207,58 ммоль), а затем 2(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат метанаминиум (10,52 г, 22,83 ммоль). После перемешивания в течение 15 мин при комнатной температуре к реакционной смеси добавляли хлористо-водородную соль этилового эфира 3-пиперидин-4-ил-бензойной кислоты (5,6 г, 20,75 ммоль). После перемешивания всю ночь при комнатной температуре растворитель выпаривали, а полученное масло коричневого цвета растворяли в этилацетате (200 мл), промывали насыщенным водным раствором бикарбоната натрия (100 мл) и водную фазу повторно экстрагировали этилацетатом (200 мл). Объединенные органические слои промывали раствором 1 М HCl (400 мл) и рассолом (400 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/циклогексан от 0:1 до 1:1) для получения этилового эфира 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4 илбензойной кислоты (4,35 г, 49,5%). 1 Н-ЯМР (400 МГц, d6-DMSO):1,28-1,39 (t, 3 Н), 1,45-1,55 (m, 1H), 1,65-1,79 (m, 1H), 1,80-1,91 (m,2H), 2,22 (s, 3H), 2,68-2,73 (m, 1H), 2,89-2,95 (m, 1H), 3,99-4,04 (m, 1H), 4,29-4,33 (q, 2H), 4,46-4,52 (m,1H), 5,21-5,38 (dd, 2H, диастереотопные), 6,50 (s, 1H), 7,47 (t, 1H), 7,55 (d, 1H), 7,80 (s, 1H), 7,81 (d, 1H).e) Получение 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-илбензойной кислоты. К раствору этилового эфира 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4 илбензойной кислоты (4,35 г, 10,27 ммоль) в метаноле (50 мл) при комнатной температуре добавляли водный раствор гидроксида натрия (2 М, 7,7 мл, 15,41 ммоль). После перемешивания в течение 4 ч при комнатной температуре растворитель удаляли, а остаток растворяли в THF (30 мл), и при комнатной температуре добавляли водный раствор гидроксида лития (121 мг в 5 мл воды). После перемешивания всю ночь при комнатной температуре растворитель удаляли, остаток растворяли в этилацетате (50 мл) и реакционную смесь окисляли до рН 1-2 с помощью 2 М водного раствора HCl. После разделения фаз водный слой повторно экстрагировали этилацетатом (20 мл), а объединенные органические слои промывали рассолом (50 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении для получения 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4 илбензойной кислоты (2,40 г, 59%), которая может быть использована в процессе выполнения следующего этапа без дальнейшей очистки. 1 Н-ЯМР (400 МГц, d6-DMSO):1,45-1,55 (m, 1H), 1,65-1,79 (m, 1H), 1,80-1,91 (m, 2H), 2,22 (s, 3H),2,67-2,78 (m, 1H), 2,89-2,95 (m, 1H), 3,17-3,24 (m, 1H), 3,95-4,04 (m, 1H), 4,46-4,52 (m, 1H), 5,21-5,38 (dd,2H, диастереотопные), 6,50 (s, 1H), 7,47 (t, 1H), 7,55 (d, 1H), 7,80 (s, 1H), 7,81 (d, 1H).f) Получение 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-(R)-1,2,3,4 тетрагидронафталин-1-ил-бензамида (соединениеI.n.001). К раствору 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-илбензойной кислоты (100 мг, 0,25 ммоль) в DMF (2 мл) при комнатной температуре добавляли диизопропилэтиламин(0,16 мл, 0,76 ммоль), а затем 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат метанаминиум (0,128 г, 0,27 ммоль). После перемешивания в течение 15 мин при комнатной температуре к реакционной смеси добавляли (R)-(1,2,3,4-тетрагидронафталин-1-ил)амин (0,045 г, 0,25 ммоль). После перемешивания в течение 2 ч при комнатной температуре растворитель выпаривали, а полученное масло коричневого цвета растворяли в этилацетате (10 мл), промывали насыщенным водным раствором бикарбоната натрия (20 мл) и водную фазу повторно экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали раствором 1 М HCl (20 мл) и рассолом (20 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/циклогексан от 1:1 до 8:2) для получения 3-1-[2(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-(R)-1,2,3,4-тетрагидронафталин-1-илбензамида (125 мг, 94%). 1 Н-ЯМР (400 МГц, d6-DMSO):1,52-1,61 (m, 1H), 1,68-1,89 (m, 5H), 1,91-2,02 (m, 1H), 2,22 (s, 3 Н),2,64-2,92 (m, 4 Н), 3,15-3,24 (m, 1 Н), 3,99-4,04 (m, 1 Н), 4,46-4,52 (m, 1 Н), 5,19-5,38 (m, 3 Н), 6,50 (s, 1 Н),7,12-7,19 (m, 4 Н), 7,38 (d, 1H), 7,75 (d, 1H), 7,82 (s, 1H), 8,71 (d, 1H). МС: m/z = 525 (М+1). Пример 2. В данном примере описано получение N-метил-3-1-[2-(5-метил-3-трифторметилпиразол-1 ил)ацетил]пиперидин-4-ил-N-(R)-1,2,3,4-тетрагидронафталин-1-ил-бензамида (соединениеI.o.001). а) Получение N-метил-3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N(R)-1,2,3,4-тетрагидронафталин-1-ил-бензамида (соединениеI.o.001). К раствору 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-илбензойной кислоты (320 мг, 0,80 ммоль) в DMF (8 мл) при комнатной температуре добавляли диизопропилэтиламин(1,01 мл, 4,85 ммоль), а затем 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат метанаминиум (0,41 г, 0,89 ммоль). После перемешивания в течение 15 мин при комнатной температуре к реакционной смеси добавляли метил-(R)-1,2,3,4-тетрагидронафталин-1-ил-амин (0,158 г, 0,80 ммоль). После перемешивания в течение 2 ч при комнатной температуре растворитель выпаривали, а полученное масло коричневого цвета растворяли в этилацетате (20 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл) и водную фазу повторно экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали раствором 1 М HCl (50 мл) и рассолом (50 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/циклогексан от 1:1 до 8:2) для полученияMC: m/z = 539 (M+1). Пример 3. В данном примере описано получение N-метил-3-1-[2-(5-метил-3-трифторметилпиразол-1 ил)ацетил]пиперидин-4-ил-N-R)-1-фенилэтил)бензамида (соединениеI.o.003). а) Получение N-метил-3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-NR)-1-фенилэтил)бензамида (соединениеI.o.003). К раствору 3-1-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-илбензойной кислоты (320 мг, 0,80 ммоль) в DMF (8 мл) при комнатной температуре добавляли диизопропилэтиламин(1,01 мл, 4,85 ммоль), а затем 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат метанаминиум (0,41 г, 0,89 ммоль). После перемешивания в течение 15 мин при комнатной температуре к реакционной смеси добавляли метилR)-1-фенилэтил)амин (0,132 г, 0,80 ммоль). После перемешивания в течение 2 ч при комнатной температуре растворитель выпаривали, а полученное масло коричневого цвета растворяли в этилацетате (20 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл) и водную фазу повторно экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали раствором 1 М HCl (50 мл) и рассолом (50 мл), высушивали над сульфатом натрия,фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/циклогексан от 1:1 до 8:2) для получения N-метил-31-[2-(5-метил-3-трифторметилпиразол-1-ил)ацетил]пиперидин-4-ил-N-R)-1-фенилэтил)бензамидаMC: m/z = 513 (M+1). Пример 4. В данном примере описано получение метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1'-[2-(5-метил 3-трифторметилпиразол-1-ил)ацетил]-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-6-карбоновой кислоты(соединениеI.q.005). а) Получение 6-этилового эфира 1'-трет-бутилового эфира 3',6'-дигидро-2'Н-[2,4']бипиридинил-6,1'дикарбоновой кислоты. К раствору этилового эфира 6-бромпиридин-2-карбоновой кислоты (1 г, 4,35 ммоль) в диоксане (40 мл) последовательно при комнатной температуре добавляли бис-(трифенилфосфин)палладий(II) хлорид(0,152 г, 0,217 ммоль), трет-бутиловый эфир 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6 дигидро-2 Н-пиридин-1-карбоновой кислоты (1,61 г, 5,21 ммоль) и водный раствор карбоната натрия(1,38 г в 10 мл воды, 13,04 ммоль). После перемешивания в течение 3 ч при температуре 110 С растворитель выпаривали, а полученное масло желтого цвета растворяли в этилацетате (30 мл) и промывали рассолом (30 мл). Органический слой высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан от 0:1 до 3:7) для получения 6-этилового эфира 1'-трет-бутилового эфира 3',6'дигидро-2'Н-[2,4']бипиридинил-6,1'-дикарбоновой кислоты (1,13 г, 78%). 1 Н-ЯМР (400 МГц, d6-DMSO):1,31-1,38 (t, 3H), 1,47 (s, 9H), 2,55-2,59 (m, 2H), 3,51-3,59 (m, 2H),4,08-4,12 (m, 2H), 4,31-4,37 (q, 2H), 6,74 (m, 1 Н), 7,75-7,79 (d, 1H), 7,88-7,91 (m, 1H), 7,92-7,99 (t, 1H).b) Получение 6-этилового эфира 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н[2,4']бипиридинил-6,1'-дикарбоновой кислоты. Раствор 6-этилового эфира 1'-трет-бутилового эфира 3',6'-дигидро-2'Н-[2,4']бипиридинил-6,1'дикарбоновой кислоты (1,12 г, 3,37 ммоль) в этаноле (67 мл) прокачивали через картридж с палладиевоуглеродным катализатором (Pd/C), используя проточный реактор для гидрирования H-Cube (20 С, 10 бар, 2 мл/мин). Растворитель затем выпаривали при пониженном давлении для получения 6-этилового эфира 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-6,1'-дикарбоновой кислоты(1,001 г, 89%), который может быть использован в процессе выполнения следующего этапа без дальнейшей очистки. 1 Н-ЯМР (400 МГц, d6-DMSO):1,31-1,38 (t, 3H), 1,47 (s, 9H), 1,55-1,65 (m, 2H), 1,79-1,88 (m, 2H),- 19021137MC: m/z = 333 (M+1). MS: m/z = 335 (M+1). с) Получение 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-6,1'дикарбоновой кислоты. К раствору 6-этилового эфира 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил 6,1'-дикарбоновой кислоты (100 мг, 0,3 ммоль) в метанол (5 мл) при комнатной температуре добавляли водный раствор гидроксида натрия (2 М, 0,23 мл, 0,5 ммоль). После перемешивания в течение 4 ч при комнатной температуре растворитель удаляли, а остаток растворяли в THF (5 мл), и при комнатной температуре добавляли водный раствор гидроксида лития (7 мг в 1 мл воды). После перемешивания всю ночь при комнатной температуре растворитель удаляли, остаток растворяли в этилацетате (10 мл), и реакционную смесь окисляли до рН 2-3 с помощью 2 М водного раствора HCl. После разделения фаз водный слой повторно экстрагировали этилацетатом (10 мл), а объединенные органические слои промывали рассолом (10 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении для получения 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-6,1'дикарбоновой кислоты (45 мг, 49%), который может быть использован в процессе выполнения следующего этапа без дальнейшей очистки. 1 Н-ЯМР (400 МГц, d6-DMSO):1,43 (s, 9H), 1,58-1,68 (m, 2H), 1,81-1,84 (m, 2H), 2,84-2,96 (m, 2H),3,27-3,39 (m, 1H), 4,07-4,10 (m, 2H), 7,52-7,54 (d, 1H), 7,86-7,92 (m, 2H).d) Получение трет-бутилового эфира 6-[метил(1,2,3,4-тетрагидронафталин-1-ил)карбамоил]3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты. К раствору 1'-трет-бутилового эфира 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-6,1'-дикарбоновой кислоты (150 мг, 0,49 ммоль), метил-(R)-1,2,3,4-тетрагидронафталин-1-ил-амина (0,079 г, 0,49 ммоль) и диизопропилэтиламина (0,50 мл, 0,49 ммоль) в DMF (10 мл) при комнатной температуре по капле добавляли ВОР (238 мг, 0,49 ммоль). После перемешивания всю ночь при комнатной температуре реакционную смесь выливали в воду (10 мл) и экстрагировали этилацетатом (20 мл). Водную фазу повторно экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (30 мл), раствором 1 M HCl (30 мл) и рассолом (30 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан 4:1) для получения третбутилового эфира 6-[метил(1,2,3,4-тетрагидронафталин-1-ил)карбамоил]-3',4',5',6'-тетрагидро-2'Н[2,4']бипиридинил-1'-карбоновой кислоты (215 мг, 97%). 1 Н-ЯМР (400 МГц, CDCl3):1,47 (s, 9 Н), 1,64-2,05 (m, 8 Н), 2,18-2,22 (m, 1H), 2,72-2,81 (m, 4H), 2,82e) Получение хлористо-водородной соли метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-6-карбоновой кислоты. К раствору трет-бутилового эфира 6-[метил(1,2,3,4-тетрагидронафталин-1-ил)карбамоил]-3',4',5',6'тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (202 мг, 0,45 ммоль) при комнатной температуре добавляли раствор 4 М HCl в диоксане (1,13 мл, 4,5 ммоль). После перемешивания всю ночь при комнатной температуре растворитель выпаривали при пониженном давлении для получения хлористоводородной соли метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-6-карбоновой кислоты (162 мг, 93%). 1 Н-ЯМР (400 МГц, d6-DMSO):1,83-2,02 (m, 6H), 2,51 (s, 3 Н), 2,52-2,59 (m, 2H), 2,71-3,03 (m, 2H),3,29-3,38 (m, 2H), 3,97-4,05 (m, 2H), 4,78-4,83 (m, 1 Н), 7,08-7,23 (m, 4H), 7,36-7,41 (m, 1H), 7,52-7,55 (m,1H), 7,90-7,95 (m, 1H), 8,81 (br, 1H), 9,04 (br, 1H).f) Получение метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1'-[2-(5-метил-3-трифторметилпиразол 1-ил)ацетил]-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-6-карбоновой кислоты (соединениеI.q.005). К раствору (5-метил-3-трифторметилпиразол-1-ил)уксусной кислоты (81 мг, 0,39 ммоль), хлористоводородной соли метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-6-карбоновой кислоты (150 мг, 0,39 ммоль) и диизопропилэтиламина (0,41 мл, 0,39 ммоль) в DMF (10 мл) при комнатной температуре по капле добавляли ВОР (191 мг, 0,39 ммоль). После перемешивания всю ночь при комнатной температуре реакционную смесь выливали в воду (10 мл) и экстрагировали этилацетатом (20 мл). Водную фазу повторно экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (30 мл),раствором 1 М HCl (30 мл) и рассолом (30 мл), высушивали над сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (этилацетат) для получения метил(1,2,3,4-тетрагидронафталин-1-ил)амида 1'-[2-(5 метил-3-трифторметилпиразол-1-ил)ацетил]-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-6-карбоновой кислоты (150 мг, 71%). М.р. 62-65 С. 1 Н-ЯМР (400 МГц, CDCl3):1,67-2,02 (m, 6H), 2,18-2,22 (m, 1H), 2,30 (s, 3 Н), 2,71 (s, 3 Н), 2,72-2,75(m, 2H), 3,17-3,27 (m, 2H), 3,97-4,05 (m, 2H), 4,58-4,78 (m, 2H), 4,96 (s, 2H), 5,05-5,15 (m, 1H), 6,33 (s, 1H),7,10-7,24 (m, 4H), 7,28-7,32 (m, 1H), 7,57-7,58 (m, 1H), 7,76-7,78 (m, 1H). В табл. 1 приведены примеры отдельных соединений формулы (I) согласно настоящему изобретению. Таблица 1 Отдельные соединения формулы (I) согласно изобретению
МПК / Метки
МПК: C07D 401/04, C07D 401/12, C07D 401/06, C07D 401/14, C07D 231/12
Метки: микробиоцидными, свойствами, гетероциклы
Код ссылки
<a href="https://eas.patents.su/30-21137-geterocikly-s-mikrobiocidnymi-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклы с микробиоцидными свойствами</a>
Предыдущий патент: Усовершенствованный метод количественного определения днк в биологическом образце
Следующий патент: Способ цифровой связи с фиксированным параметром связности
Случайный патент: Система для регулирования рабочих давлений в подземной буровой скважине












