3-аминоциклопентанкарбоксамиды в качестве модуляторов рецептора хемокина
Номер патента: 20470
Опубликовано: 28.11.2014
Авторы: Роджиер Дж.Дональд Джозеф, Труджилло Джон Исидро, Хуанг Вей, Тёрнер Стив Рональд, Хьюгес Роберт Оуэн, Деврадж Раджеш Венкатесваран
Формула / Реферат
1. Соединение формулы I(a) или I(b)
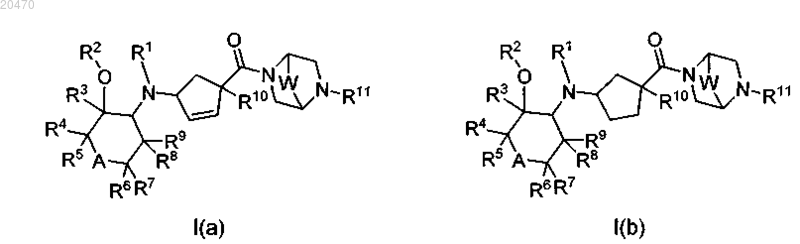
или его фармацевтически приемлемая соль, где
А означает О или CF2;
W означает CR13R14, C(O), CHOR15, CHF, CF2, О или S;
R1 означает Н или (C1-C6)алкил, необязательно замещенный 1-3 заместителями, выбранными из гало, ОН, СО2Н, СО2-(C1-C6)алкила или (C1-C3)алкокси;
R2 и R3, каждый независимо, означает Н, (C1-C6)алкил, (C1-C6)галоалкил, гало, (С3-С6)циклоалкил, CN, ОН, OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-C3)алкокси, ОН, CN или CO2R12;
R8 и R9, каждый независимо, означает Н, (C1-C6)алкил, (C1-C6)галоалкил, (С3-С6)циклоалкил, CN, ОН, OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-C3)алкокси, ОН, CN или CO2R12;
R2 и R9 вместе могут образовывать 5-8-членное кольцо;
R4 и R7 вместе могут образовывать 5-8-членное кольцо;
R4 и R5, каждый независимо, означает Н, CN, (C1-C6)алкил, гало, (C1-C3)алкокси, (C1-С3)галоалкокси, (С3-С6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С3)алкокси, ОН или CO2R12;
R6 и R7, каждый независимо, означает Н, CN, (C1-C6)алкил, гало, (С1-С3)алкокси, (C1-С3)галоалкокси, (С3-С6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С3)алкокси, ОН или CO2R12;
или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют 3-7-членный спироциклил;
или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют 3-7-членный спироциклил;
или R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют конденсированный 3-7-членный циклоалкил или 3-7-членный гетероциклоалкил;
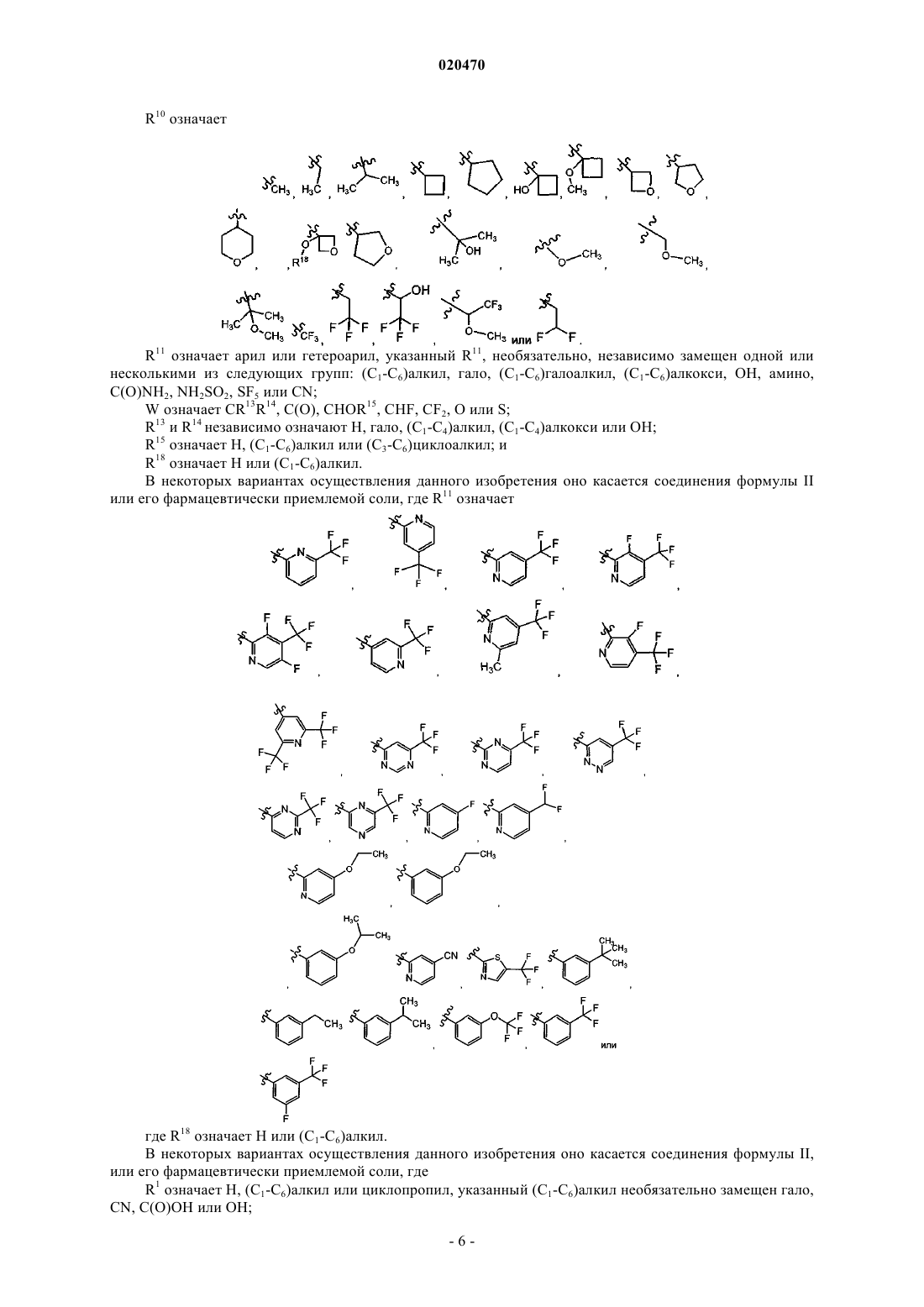
R10 означает (C1-C6)алкил, (C1-C6)галоалкил, (C1-C6)гидроксиалкил, (C1-C6)алкокси, (C3-С6)циклоалкил, гидрокси(C3-С6)циклоалкил, алкоксициклоалкил, ОН, (C1-С5)гетероциклил, амино, арил или CN,
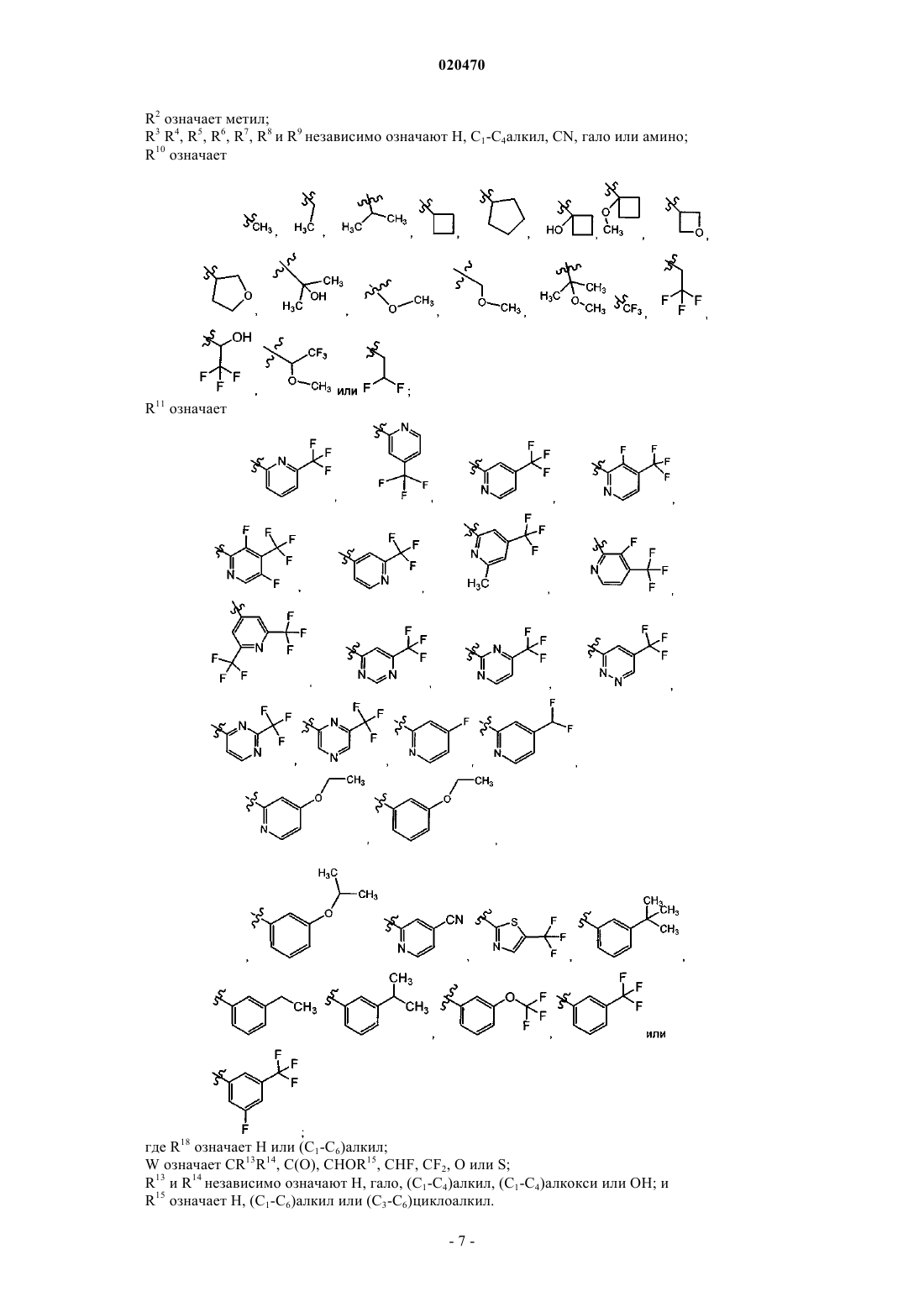
R11 означает арил или гетероарил, указанный R11 необязательно независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С6)галоалкил, (C1-C3)алкокси, ОН, амино, C(O)NH2, NH2SO2, SF5 или CN;
R12 означает Н, (C1-C4)алкил или (С3-С6)циклоалкил;
R13 означает Н, гало, (C1-C4)алкил, (C1-C4)алкокси или ОН;
R14 означает Н, гало, (C1-C4)алкил, (C1-C4)алкокси или ОН и
R15 означает Н, (C1-C6)алкил или (С3-С6)циклоалкил,
где арил выбирают из группы, включающей фенил, бифенилил, инденил, нафтил, бензотиенил, бензофуранил, индолил, хинолинил, бензотиазол, бензооксазол, бензимидазол, изохинолинил, изоиндолил, бензотриазол, индазол и акридинил;
гетероарил выбирают из группы, включающей фурил, тиенил, пироллил, имидазолил, триазолил, тиазолил, тетразолил, оксазолил, изоксазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, хиноксалинил, бензтиазолил, бензоксазолил, бензотиенил или бензофурил;
алкоксициклоалкил выбирают из группы, включающей алкоксициклопропил, алкоксициклобутил, алкоксициклопентил, алкоксициклогексил, алкоксициклогептил и алкоксициклопентенил;
гетероциклоалкил означает карбоциклическое кольцо (моно- или полициклическое), включающее 1, 2 или 3 гетероатома, которые независимо выбирают из группы, содержащей азот, кислород и серу; и гетероциклоалкил выбирают из группы, включающей тетрагидрофуранил, тетрагидротиофенил, морфолино, тиоморфолино, азетидинил, пирролидинил, пиперазинил, пиперидинил, пиран, диоксан и тиазолидинил.
2. Соединение формулы II
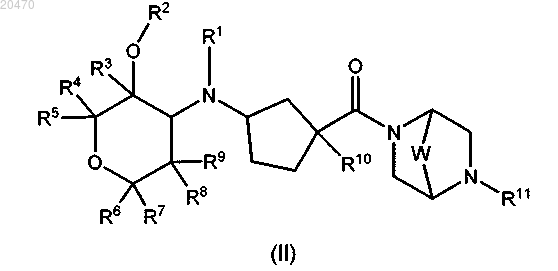
или его фармацевтически приемлемая соль, где
R1 означает Н, (C1-C6)алкил или (С3-С6)циклоалкил, указанный (C1-C6)алкил необязательно замещен гало, CN, С(О)ОН или ОН;
R2 означает (C1-C6)алкил, (C1-C6)галоалкил или (С3-С6)циклоалкил;
R3 R4, R5, R6, R7, R8 и R9 независимо означают Н, C1-C4 алкил, CN, гало или амино;
R10 означает (C1-C6)алкил, (C1-C6)галоалкил, (C1-C6)гидроксиалкил, (C1-C6)алкокси, (C3-C6)циклоалкил, гидрокси(С3-С6)циклоалкил, алкокси(С3-С6)циклоалкил, ОН, (C1-С5)гетероциклил, амино, арил, CN, метоксиметил, 1-гидроксиоксетан-3-ил, 1-(C1-С6)алкоксиоксетан-3-ил, 2-метоксипропан-2-ил, 1-гидрокси-2,2,2-трифторэтил и 1-метокси-2,2,2-трифторэтил;
R11 означает арил или гетероарил, указанный R11 необязательно независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С6)галоалкил, (C1-C6)алкокси, трифторметокси, ОН, амино, C(O)NH2, NH2SO2, SF5 или CN;
W означает CR13R14, C(O), CHOR15, CHF, CF2, О или S;
R13 и R14 независимо означают Н, гало, (C1-C4)алкил, (C1-C4)алкокси или ОН и
R15 означает Н, (C1-C6)алкил или (С3-С6)циклоалкил.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где
R1 означает Н или (C1-C6)алкил;
R2 означает (C1-C6)алкил или (C1-C6)галоалкил;
R3, R4, R5, R6, R7, R8 и R9 каждый означает Н;
R11 означает
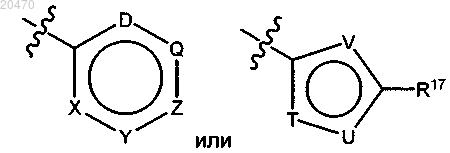
где X, Y, Z, Q и D независимо означают N или CR16 и где 0, 1, 2 или 3 из X, Y, Z, Q и D означают N; и
где Т, U и V независимо выбраны из СН, N, S или О, при условии, что Т и U оба одновременно не означают О или S;
каждый R16 независимо означает Н, гало, (C1-C6)алкил, (C1-C6)галоалкил, (C1-С6)алкокси, трифторметокси или CN;
R17 означает Н, (C1-C6)алкил, (C1-C6)галоалкил или (C1-C6)алкокси и
W означает CR13R14, C(O), CHOR15, CHF или CF2.
4. Соединение по п.3 или его фармацевтически приемлемая соль, где R2 означает метил.
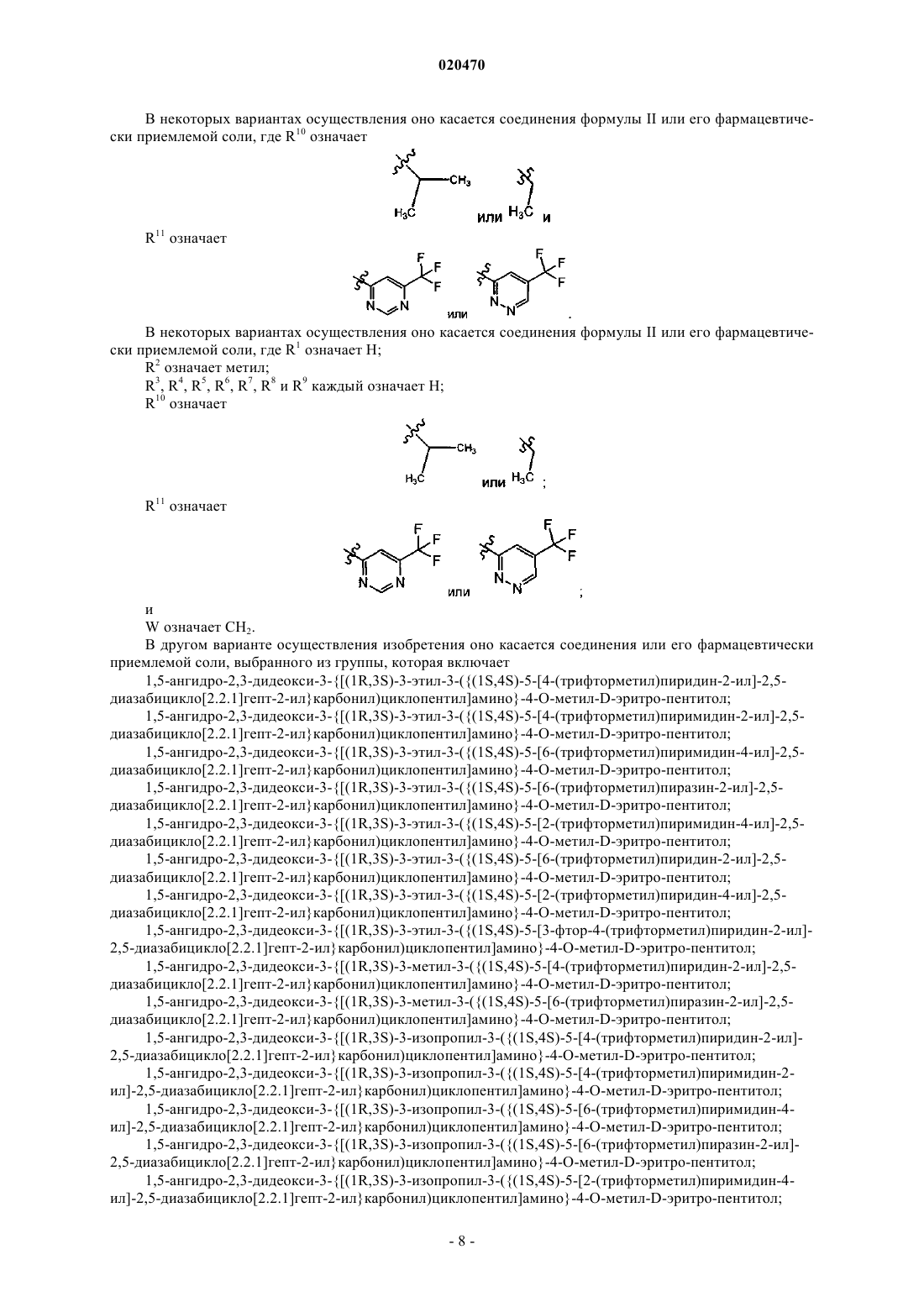
5. Соединение по п.4, где R10 означает

где R18 означает Н или (C1-C6)алкил.
6. Соединение по п.3 или его фармацевтически приемлемая соль, где R11 означает
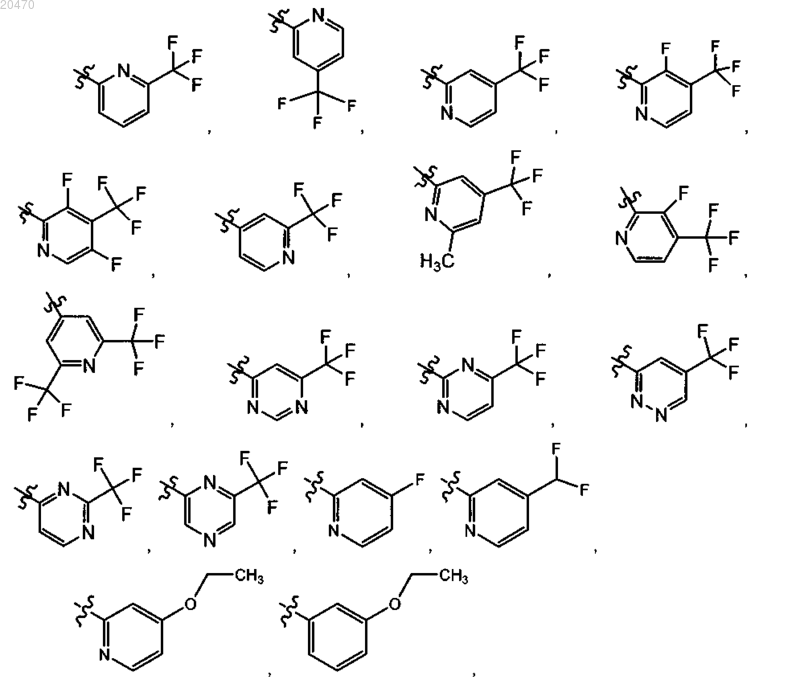
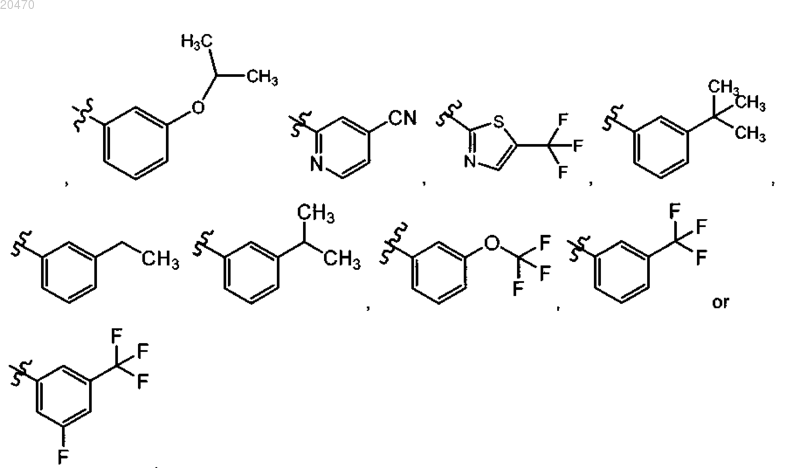
7. Соединение по п.5 или его фармацевтически приемлемая соль, где R11 означает
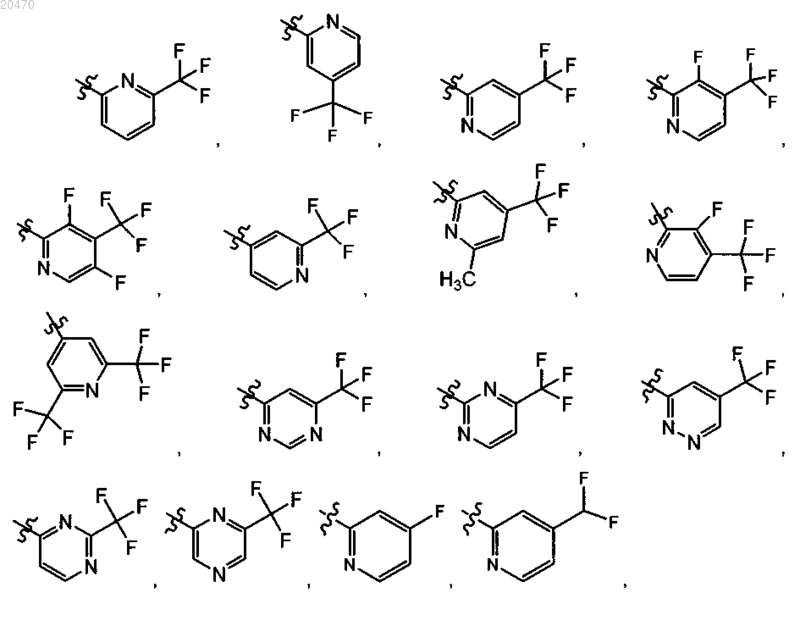
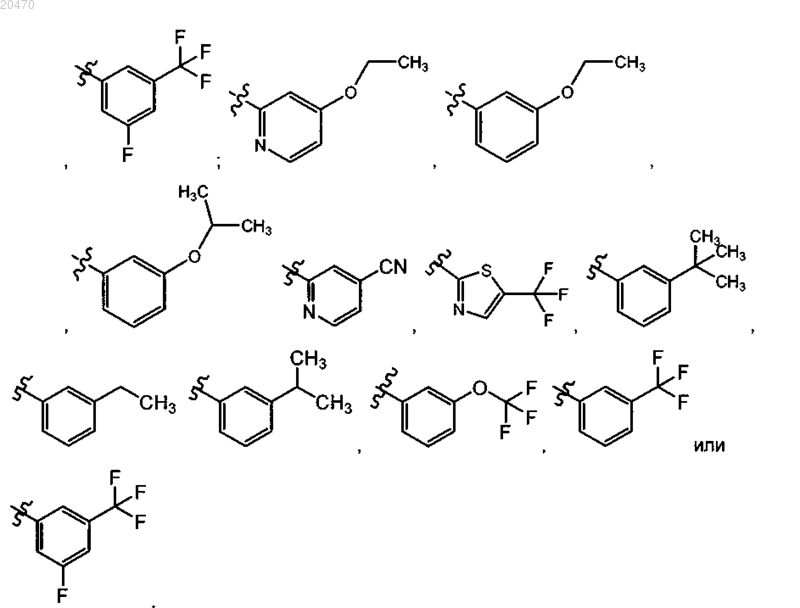
8. Соединение по п.7, где R10 означает
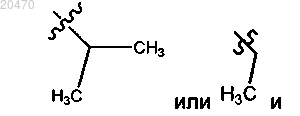
R11 означает
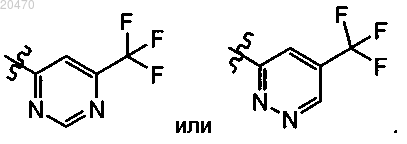
9. Соединение, выбранное из группы, которая включает следующие соединения:
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-этил-3-({(1S,4S)-5-[3-фтор-4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-метил-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-метил-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[5-(трифторметил)пиридазин-3-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[2,6-бис(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)-3-изопропилциклопентил]амино}-2,3-дидеокси-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-({(1S,4S)-5-[3-фтор-4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)-3-изопропилциклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[6-метил-4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-изопропил-3-({(1S,4S)-5-[3-(трифторметил)фенил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-({(1S,4S)-5-[3-фтор-5-(трифторметил)фенил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)-3-изопропилциклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(2,2-дифторэтил)-3-({(1S,4S)-5-[5-(трифторметил)пиридазин-3-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-O-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-4-О-метил-3-{[(1R,3S)-3-(2,2,2-трифторэтил)-3-({(1S,4S)-5-[5-(трифторметил)пиридазин-3-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1S,4S)-4-изопропил-4-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопент-2-ен-1-ил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1S,4S)-4-изопропил-4-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопент-2-ен-1-ил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1S,4S)-4-изопропил-4-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопент-2-ен-1-ил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1S,4S)-4-изопропил-4-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопент-2-ен-1-ил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-3-{[(1R,3S)-3-{[(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил}-3-этилциклопентил]амино}-2,3-дидеокси-4-О-метил-D-эритро-пентитол;
1,5-ангидро-3-{[(1R,3S)-3-{[(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил}-3-(2,2,2-трифторэтил)циклопентил]амино}-2,3-дидеокси-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-(1-гидроксициклобутил)-3-({(1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[(1R,3S)-3-гидроксициклобутил)-3-({(1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метил-D-эритро-пентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-O-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[5-(трифторметил)пиридазин-3-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол;
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол и
1,5-ангидро-2,3-дидеокси-3-{[3-(1-гидрокси-1-метилэтил)-3-({5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил}карбонил)циклопентил]амино}-4-О-метилпентитол,
или его фармацевтически приемлемая соль.
10. Соединение формулы
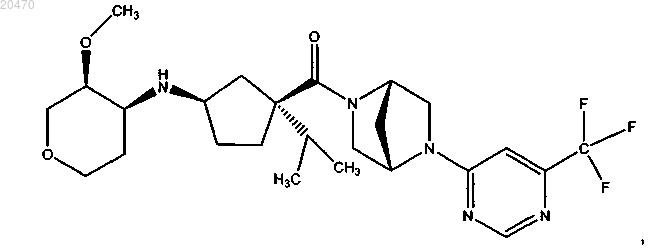
или его фармацевтически приемлемая соль.
11. Соединение формулы
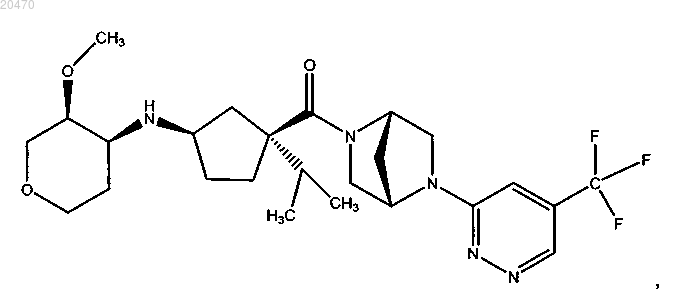
или его фармацевтически приемлемая соль.
12. Способ лечения заболевания, связанного с экспрессий или активностью рецептора хемокина, у пациента, который включает введение указанному пациенту соединения по п.2 или его фармацевтически приемлемой соли.
13. Способ по п.12, где указанным рецептором хемокина является CCR2 или CCR5.
14. Способ по п.12, где указанным заболеванием является диабет.
Текст
3-АМИНОЦИКЛОПЕНТАНКАРБОКСАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА ХЕМОКИНА Изобретение касается соединения формулы I(а) или I(b) Деврадж Раджеш Венкатесваран,Хуанг Вей, Хьюгес Роберт Оуэн,Роджиер Дж. Дональд Джозеф,Труджилло Джон Исидро, Трнер Стив Рональд (US) Панченко Л.С., Скобкарева Л.П. (BY) или его фармацевтически приемлемой соли, где значения заместителей являются такими, как указано в данном документе. Приоритет данной заявки заявлен в заявке США 61/118053, поданной 26 ноября 2008 г. Область изобретения Данное изобретение касается соединений, модулирующих активность рецепторов хемокинов, таких как CCR2 и CCR5. Соединения можно использовать, например, для лечения заболеваний, связанных с экспрессией или активностью рецептора хемокина. Предпосылки изобретения Миграция и транспорт лейкоцитов из кровеносной системы в пораженные ткани инициирует нормальный ответ организма на воспаление. Процесс, так же известный как пополнение лейкоцитов, тоже относится к возникновению и прогрессу воспалительных и аутоиммунных заболеваний. Патология этих заболеваний является результатом атаки иммунной системой тела нормальных тканей. Соответственно,предупреждение и блокировка попадания лейкоцитов в ткани мишени воспалительных, аутоиммунных заболеваний и рака будет эффективным терапевтическим вмешательством. Инфильтрация моноцитов/макрофагов в местах воспаления относится к белкам, таким как моноцитарный хемоатрактантный белок-1 (МСР-1, CCL2). Макрофаги продуцируют хемокины, такие как макрофагальный белок воспаления-1-бета (MIP-1, CCL4). Такие белки взаимодействуют с рецептором хемокинов, например, CCR2 и CCR5. Модулирование, такое как антагонизм или ингибирование, CCR2 илиCCR5 поможет в лечении широкого круга заболеваний. Идентификация соединения, которое модулирует активность рецепторов хемокинов, является желаемым достижением в разработке фармацевтических агентов для лечения заболеваний, связанных с активностью рецептора хемокина. Соединения данного изобретения помогают в достижении этих и других целей. Краткое описание изобретения В одном варианте осуществления данное изобретение относится к соединению формулы I(а) или или его фармацевтически приемлемой соли, где А означает О или CF2;R2 и R3 каждый независимо означает Н, (C1-C6)алкил, (C1-C6)галоалкил, гало, (C3-C6)циклоалкил,CN, ОН, OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-C3)алкокси, ОН, CN или CO2R12;R8 и R9 каждый независимо означает Н, (C1-C6)алкил, (C1-С 6)галоалкил, (С 3-С 6)циклоалкил, (С 3 С 6)циклоалкилокси, CN, ОН, OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С 3)алкокси, ОН, CN или CO2R12;R2 и R9 вместе могут образовывать 5-8-членное кольцо;R4 и R7 вместе могут образовывать 5-8-членное кольцо.R4 и R5 каждый независимо означает Н, CN, (C1-C6)алкил, гало, (С 1-С 3)алкокси, (C1-С 3)галоалкокси,(С 3-С 6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С 3)алкокси, ОН или CO2R12;R6 и R7 каждый независимо означает Н, CN, (C1-C6)алкил, гало, (С 1-С 3)алкокси, (C1-С 3)галоалкокси,(С 3-С 6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С 3)алкокси, ОН или CO2R12; или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют 3-7-членный спироциклил; или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют 4-7-членный спироциклил; или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют конденсированный 3-7-членный циклоалкил или 3-7-членный гетероциклоалкил;R10 означает (C1-C6)алкил, (C1-C6)галоалкил, (C1-C6)гидроксиалкил, (C1-C6)алкокси, (C3C6)циклоалкил, гидрокси(C3-C6)циклоалкил, (C1-C6)алкоксициклоалкил, ОН, (C1-С 5)гетероциклил, амино,арил или CN,R11 означает арил или гетероарил, указанный R11, необязательно, независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С 6)галоалкил, (C1-C6)алкокси, ОН, амино,C(O)NH2, NH2SO2, SF5 или CN;R15 означает Н, (C1-C6)алкил или (C3-C6)циклоалкил, где арил выбирают из группы, включающей фенил, бифенилил, инденил, нафтил, бензотиенил, бензофуранил, индолил, хинолинил, бензотиазол,бензооксазол, бензимидазол, изохинолинил, изоиндолил, бензотриазол, индазол и акридинил; гетероарил выбирают из группы, включающей фурил, тиенил, пироллил, имидазолил, триазолил,тиазолил, тетразолил, оксазолил, изоксазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, хиноксалинил, бензтиазолил, бензоксазолил, бензотиенил или бензофурил; алкоксициклоалкил выбирают из группы, включающей алкоксициклопропил, алкоксициклобутил,алкоксициклопентил, алкоксициклогексил, алкоксициклогептил и алкоксициклопентенил; гетероциклоалкил означает карбоцикличексое кольцо (моно- или полициклическое), включающее 1,2 или 3 гетероатома, которые независимо выбирают из группы, содержащей азот, кислород и серу; и гетероциклоалкил выбирают из группы, включающей тетрагидрофуранил, тетрагидротиофенил, морфолино, тиоморфолино, азетидинил, пирролидинил, пиперазинил, пиперидинил, пиран, диоксан и тиазолидинил. Детальное описание изобретения Данное изобретение не ограничивается вариантами осуществления, указанными в данном описании, и может быть модифицировано. А. Определение терминов К следующим терминам приводятся определения, которые надо использовать, если в формуле изобретения или где-либо еще в описании не указано иное. Термин "арил" включает ароматические карбоциклические группы, такие как фенил, бифенилил,инденил, нафтил, а так же ароматические углеродные кольца, конденсированные с гетероциклом, такие как бензотиенил, бензофуранил, индолил, хинолинил, бензотиазол, бензооксазол, бензимидазол, изохинолинил, изоиндолил, бензотриазол, индазол и акридинил. Термин "гетероарил" включает моно- и полициклические ароматические кольца, которые содержат от 3 до 20, или от 4 до 10 атомов кольца, как минимум один из которых является гетероатомом, таким как кислород, сера, фосфор или азот. Примеры таких групп включают фурил, тиенил, пироллил, имидазолил, триазолил, тиазолил, тетразолил, оксазолил, изоксазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, хиноксалинил, бензтиазолил, бензоксазолил, бензотиенил или бензофурил. Термин "циклоалкил" касается циклизованных углеводородов (моно- и полицикличных), таких как циклизованный алкил, алкенил или алкинил. В некоторых вариантах осуществления циклоалкил означает C3-14, C3-10, C3-8, C3-7, C3-6 или С 3-5. В некоторых вариантах осуществления каждый циклоалкильный остаток содержит от 3 до 14, от 3 до 10 или от 3 до 6 кольцообразующих атомов углерода. В некоторых вариантах осуществления циклоалкил содержит 0, 1 или 2 двойных или тройных связи. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил и т.д. В данной заявке циклоалкил так же включает содержащие мостик циклические углеводороды, такие как адамантил и т.д. Гетероциклические и карбоциклические кольца (моно- или полициклические), которые содержат в кольце один или несколько гетероатомов, таких как азот, кислород или сера. В некоторых вариантах осуществления гетероцикл содержит 3-8 членов кольца. В некоторых вариантах осуществления гетероцикл содержит 3-6 членов кольца. В некоторых вариантах осуществления гетероцикл содержит 1, 2 или 3 гетероатомов. Гетероциклы могут быть насыщенными или ненасыщенными. В некоторых вариантах осуществления гетероциклы содержат 0, 1 или 2 двойные или тройные связи. Кольцообразующие атомы углерода и гетероатомы могут так же нести оксо или сульфидные заместители (такие как СО, CS, SO,SO2, NO и т.д.). Примеры гетероциклов включают тетрагидрофуранил, тетрагидротиофенил, морфолино,тиоморфолино, азетидинил, пиролидинил, пиперазинил, пиперидинил, пиран, диоксан и тиазолидинил. Монозамещенный арил относится к арилу с одним заместителем. Полизамещенный арил относится к арилу с 2 или несколькими заместителями (такими как 2-4 заместители). Монозамещенный гетероарил относится к гетероарилу с одним заместителем. Полизамещенный гетероарил относится к гетероарилу с 2 или несколькими заместителями (такими как 2-4 заместители). Монозамещенный циклоалкил (или углеродное кольцо) относится к циклоалкилу с одним заместителем. Полизамещенный циклоалкил (или углеродное кольцо) относится к циклоалкилу с 2 или несколькими заместителями (такими как 2-4 заместителя). Монозамещенный гетероцикл относится к гетероциклу с одним заместителем. Полизамещенный гетероцикл относится к гетероциклу с 2 или несколькими заместителями (такими как 2-4 заместители). Термин "гало", сам по себе или как часть другого заместителя, означает фтор, хлор, бром или йод,пока не указано обратное. Аналогичным образом, термин, такой как галоалкил, включает моногалоалкил и полигалоалкил. Например, термин галоалкил, такой как гало(C1-C4)алкил, включает трифторметил,2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.д. Термин "алкил", при употреблении как самого по себе, так и как суффикс, включает как неразветвленную цепь, так и разветвленные структуры, такие как первичные алкилы, вторичные алкилы и третичные алкилы. Эти группы могут содержать до 15, или до 8, или до 4 атомов углерода. В некоторых вариантах осуществления алкил означает C1-10, C1-8, C1-6, C1-5, C1-4 или C1-3. Примеры алкилов включают группы, такие как метил, этил, н-пропил, изопропил, н-бутил, т-бутил, изобутил и втор.-бутил. Аналогичным образом термины "алкенил и алкинил" относятся к ненасыщенным неразветвленным или разветвленным структурам, которые содержат, например, от 2 до 12, или от 2 до 6 атомов углерода. В некоторых вариантах осуществления алкенил или алкинил означает C2-10, С 2-8, С 2-6, С 2-5, С 2-4 или С 2-3. Примеры алкенила и алкинила включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин "носитель" описывает ингредиент, отличающийся от соединения. Носителями могут быть фармацевтически приемлемый материал или среда. Примеры включают жидкий или твердый наполнитель, разбавитель, экципиент, растворитель или инкапсулирующий материал. Фраза "взаимодействие с рецептором хемокина" означает in vivo, ex vivo или in vitro контакт с рецептором хемокина и включает введение соединения или соли данного изобретения субъекту с рецептором хемокина, а так же, например, введение соединения или соли изобретения в образец, который содержит клеточный неочищенный или очищенный материал, содержащий рецептор хемокина. Например,контакт включает взаимодействие соединения с рецептором, такое как связывание. Термин "субъект" относится к любому животному, включая млекопитающих, таких как мыши,крысы, другие грызуны, кролики, собаки, кошки, свиньи, крупный рогатый скот, овцы, кони, приматы или люди. Термин "лечение" включает паллиативное, восстановительное или предупредительное ("профилактика") лечение субъекта. Термин "паллиативное лечение" относится к лечению, которое облегчает или уменьшает воздействие или состояние субъекта, без вылечивания состояния. Термин "восстановительное лечение" (и соответствующий термин "профилактика") относится к лечению, которое предупреждает появление состояния у субъекта. Термин "предупредительное лечение" ("целебное") относится к лечению, которое останавливает развитие, уменьшает патологические проявления или полностью вылечивает состояние субъекта. Лечение осуществляют терапевтически эффективным количеством соединения, солью или композицией, которая вызывает биологический или медицинский ответ ткани, системы или субъекта, установленным лицом, таким как исследователь, доктор, ветеринар или клиницист. В. Соединения В одном варианте осуществления данное изобретение относится к соединению формулы I(а) или или его фармацевтически приемлемой соли, где А означает О или CF2;R2 и R3 каждый независимо означает Н, (C1-C6)алкил, (C1-C6)галоалкил, гало, (С 3-С 6)циклоалкил,CN, ОН, OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-C3)алкокси, ОН, CN или CO2R12;R8 и R9 каждый независимо означает Н, (C1-C6)алкил, (C1-C6)галоалкил, (С 3-С 6)циклоалкил, CN, ОН,OCOR12; где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями,выбранными из F, (C1-C3)алкокси, ОН, CN или CO2R12;R2 и R9 вместе могут образовывать 5-8-членное кольцо;R4 и R7 вместе могут образовывать 5-8-членное кольцо.R4 и R5 каждый независимо означает Н, CN, (C1-C6)алкил, гало, (С 1-С 3)алкокси, (C1-С 3)галоалкокси,(С 3-С 6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, C1-3-алкокси, ОН или CO2R12;R6 и R7 каждый независимо означает Н, CN, (C1-C6)алкил, гало, (С 1-С 3)алкокси, (C1-С 3)галоалкокси,(С 3-С 6)циклоалкил, ОН, CO2R12, OCOR12, где указанный (C1-C6)алкил необязательно замещен одним или несколькими заместителями, выбранными из F, (C1-С 3)алкокси, ОН или CO2R12;R11 означает арил или гетероарил, указанный R11, необязательно, независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С 6)галоалкил, (C1-C6)алкокси, ОН, амино,C(O)NH2, NH2SO2, SF5 или CN;R15 означает Н, (C1-C6)алкил или (С 3-С 6)циклоалкил, где арил выбирают из группы, включающей фенил, бифенилил, инденил, нафтил, бензотиенил, бензофуранил, индолил, хинолинил, бензотиазол,бензооксазол, бензимидазол, изохинолинил, изоиндолил, бензотриазол, индазол и акридинил; гетероарил выбирают из группы, включающей фурил, тиенил, пироллил, имидазолил, триазолил,тиазолил, тетразолил, оксазолил, изоксазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, хиноксалинил, бензтиазолил, бензоксазолил, бензотиенил или бензофурил; алкоксициклоалкил выбирают из группы, включающей алкоксициклопропил, алкоксициклобутил,алкоксициклопентил, алкоксициклогексил, алкоксициклогептил и алкоксициклопентенил; гетероциклоалкил означает карбоцикличексое кольцо (моно- или полициклическое), включающее 1,2 или 3 гетероатома, которые независимо выбирают из группы, содержащей азот, кислород и серу; и гетероциклоалкил выбирают из группы, включающей тетрагидрофуранил, тетрагидротиофенил, морфолино, тиоморфолино, азетидинил, пирролидинил, пиперазинил, пиперидинил, пиран, диоксан и тиазолидинил. В другом варианте осуществления данного изобретения оно касается соединения формулы II или его фармацевтически приемлемой соли, гдеR11 означает арил или гетероарил, указанный R11 необязательно независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С 6)галоалкил, (C1-C6)алкокси, трифторметокси,ОН, амино, C(O)NH2, NH2SO2, SF5 или CN;R15 означает Н, (C1-C6)алкил или (С 3-С 6)циклоалкил. В другом варианте осуществления изобретение касается соединения формулы II или его фармацевтически приемлемой соли, где где X, Y, Z, Q и D независимо означают N или CR16 и где 0, 1, 2 или 3 из X, Y, Z, Q и D означают N; и где Т, U и V независимо выбраны из СН, N, S или О, при условии, что Т и U оба одновременно не означают О или S; каждый R16 независимо означают Н, гало, (C1-C6)алкил, (C1-C6)галоалкил, (C1-С 6)алкокси, трифторметокси или CN;W означает CR13R14, C(O), CHOR15, CHF или CF2. В некоторых вариантах осуществления соединения формулы II или его фармацевтически приемлемой соли R2 означает метил. В некоторых вариантах осуществления соединения формулы II или его фармацевтически приемлемой солиR11 означает арил или гетероарил, указанный R11, необязательно, независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С 6)галоалкил, (C1-C6)алкокси, ОН, амино,C(O)NH2, NH2SO2, SF5 или CN;R15 означает Н, (C1-C6)алкил или (С 3-С 6)циклоалкил. В некоторых вариантах осуществления соединения формулы II или его фармацевтически приемлемой соли R10 означает где R18 означает Н или (C1-C6)алкил. В некоторых вариантах осуществления соединения формулы II или его фармацевтически приемлемой солиR11 означает арил или гетероарил, указанный R11, необязательно, независимо замещен одной или несколькими из следующих групп: (C1-C6)алкил, гало, (C1-С 6)галоалкил, (C1-C6)алкокси, ОН, амино,C(O)NH2, NH2SO2, SF5 или CN;R18 означает Н или (C1-C6)алкил. В некоторых вариантах осуществления данного изобретения оно касается соединения формулы II или его фармацевтически приемлемой соли, где R11 означает где R18 означает Н или (C1-C6)алкил. В некоторых вариантах осуществления данного изобретения оно касается соединения формулы II,или его фармацевтически приемлемой соли, где В некоторых вариантах осуществления оно касается соединения формулы II или его фармацевтически приемлемой соли, где R10 означает В некоторых вариантах осуществления оно касается соединения формулы II или его фармацевтически приемлемой соли, где R1 означает Н;W означает СН 2. В другом варианте осуществления изобретения оно касается соединения или его фармацевтически приемлемой соли, выбранного из группы, которая включает 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[3-фтор-4-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-метил-3-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-метил-3-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-изопропил-3-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-изопропил-3-1S,4S)-5-[4-(трифторметил)пиримидин-2 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-изопропил-3-1S,4S)-5-[6-(трифторметил)пиримидин-4 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-изопропил-3-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-изопропил-3-1S,4S)-5-[2-(трифторметил)пиримидин-4 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1S,4S)-4-изопропил-4-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопент-2-ен-1-ил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1S,4S)-4-изопропил-4-1S,4S)-5-[4-(трифторметил)пиримидин-2 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопент-2-ен-1-ил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1S,4S)-4-изопропил-4-1S,4S)-5-[6-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопент-2-ен-1-ил]амино-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1S,4S)-4-изопропил-4-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопент-2-ен-1-ил]амино-4-О-метил-D-эритро-пентитол; 1,5-ангидро-3-[(1R,3S)-3-[(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил-3-этилциклопентил]амино-2,3-дидеокси-4-O-метил-D-эритро-пентитол; 1,5-ангидро-3-[(1R,3S)-3-[(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил-3-(2,2,2-трифторэтил)циклопентил]амино-2,3-дидеокси-4-O-метил-D-эритро-пентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[6-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[2-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-(1-гидроксициклобутил)-3-1S,4S)-5-[2-(трифторметил)пиридин-4-ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритропентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[4-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[6-(трифторметил)пиримидин-4 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[4-(трифторметил)пиримидин-2 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[5-(трифторметил)пиридазин-3-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[2-(трифторметил)пиримидин-4 ил]-2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[6-(трифторметил)пиридин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол; 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[2-(трифторметил)пиридин-4-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метилпентитол и 1,5-ангидро-2,3-дидеокси-3-[3-(1-гидрокси-1-метилэтил)-3-(5-[6-(трифторметил)пиразин-2-ил]2,5-диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-О-метилпентитол. В другом варианте осуществления изобретение касается соединения формулы или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение касается соединения формулы или его фармацевтически приемлемой соли. В другом варианте осуществления данного изобретения изобретение касается композиции, которая содержит соединение формулы I или II, или его фармацевтически приемлемую соль и носитель. В другом варианте осуществления изобретение касается способа лечения заболевания, связанного с экспрессией или активностью рецептора хемокина у пациента, который включает введение указанному пациенту соединения формулы I или II, или его фармацевтически приемлемой соли. В одном варианте осуществления способа указанный рецептор хемокина является CCR2 или CCR5 рецептором. В другом варианте осуществления способа заболеванием является диабет. Соли соединений изобретения могут включать их кислотно-аддитивные соли или основноаддитивные соли (включая двухосновные соли). Соли могут быть фармацевтически приемлемыми. Приемлемые кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли. Примеры солей включают следующие: ацетат, аспартат, бензоат, бесилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат,оротат, оксапат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат,тартрат, тозилат и трифторацетат. Приемлемые основно-аддитивные соли получают из оснований, которые образуют нетоксичные соли. Примеры солей включают следующие: алюминий, аргинин, бензатин, кальций, холин, диэтиламин,диоламин, глицин, лизин, магний, меглюмин, оламин, калий, натрий, трометамин и цинк. Так же могут образовываться гемисоли кислот и оснований, например, гемисульфат и гемикальций. Для ознакомления с приемлемыми солями см. ("Handbook of Pharmaceutical Salts: Properties, Selection and Use" by Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002. Соль можно быстро получить путем смешивания растворов соединений данного изобретения и нужной кислоты или основания, соответственно. Соль осаждает из раствора и может быть собрана путем выпаривания растворителя. Уровень ионизации соли может варьировать от полностью ионизированная до неионизированная. Соединения данного изобретения могут быть введены в виде пролекарств. Таким образом, определенные производные с небольшой или без фармакологической активности сами по себе, при введении в или на тело, могут преобразовываться в соединения данного изобретения с желаемой активностью, например, благодаря гидролитическому расщеплению. Такие производные называют "пролекарствами". Дополнительную информацию касательно применения пролекарств можно найти в ("Prodrugs as NovelDesign", Pergamon Press, 1987 (ed. E.В. Roche, American Pharmaceutical Association. Пролекарства можно получить, например, путем замены соответствующих функциональных групп соединений данного изобретения определенными остатками, известными средними специалисту как"про-остатки", описанные, например, в "Design of Prodrugs" by H. Bundgaard (Elsevier, 1985). Некоторые примеры таких пролекарств включают(i) когда соединение включает спиртовую группу (-ОН), его эфир, например, замещение водорода(ii) когда соединение включает вторичную аминогрупу, его амид, например, замещение водорода(C1-C10)алканоилом. Все изомеры, такие как стереоизомеры, пространственные (цис/транс или Z/E) изомеры и таутомерные формы соединений или солей входят в объем данного изобретения, включая соединения или соли с более чем одним типом изомерии и их смеси. Так же включенными являются кислотно-аддитивные или основные соли, где противоион является оптически активным, например, D-лактат или L-лизин, или рацемическим, например, DL-тартрат илиDL-аргинин. Изомеры могут быть разделены способами, известными специалисту в данной области. Данное изобретение включает изотопмеченные соединения изобретения, где один или несколько атомов замещены атомами с таким же атомным числом, но с атомной массой или массовым числом, которое отличает от атомной массы или атомного числа, обычного в природе. Изотопмеченные соединения изобретения в общем получают известными специалисту в данной области способами или способами, аналогичными описанным в сопроводительных примерах и приготовлениях, с использованием соответственного изотопно-меченного реагента вместо ранее использованного немеченого реагента. Для лечения нижеописанных состояний можно вводить соединения данного изобретения. Так же можно использовать соли соединений данного изобретения. С. Композиции Соединения или соли данного изобретения могут быть частью композиции. Композиции могут так же включать одно или несколько соединений или солей данного изобретения. Композиция так же может включать энантиомерный избыток одного ли нескольких соединений данного изобретения. В композицию могут быть включены другие фармакологически активные соединения и носители. Один вариант осуществления представляет собой композицию, которая содержит соединение формулы I или II или его соль. Другой вариант осуществления представляет собой композицию, которая содержит соединение формулы I или II или его соль и носитель. Например, носитель может быть экципиентом. Выбор экципиента в основном зависит от таких факторов, как определенный путь введения, влияния экципиента на растворимость и стабильность и природы лекарственной формы. Композиция может быть как твердой, так и жидкой и может быть создана как композиция с единичной дозой соединения, например таблетка, которая может содержать от 0,05 до 95 мас.% активных соединений. Соединения или соли данного изобретения могут быть связаны с приемлемыми полимерами в качестве направленных носителей лекарственных средств.D. Способы В некоторых вариантах осуществления соединения изобретения используются в способах модулирования активности одного или нескольких рецепторов хемокинов. Соответственно, изобретение касается способов, включающих взаимодействие рецептора хемокина с соединением формулы I или II или его солью. В некоторых вариантах осуществления рецептором хемокина является CCR2. В других вариантах осуществления рецептором хемокина является CCR5. В других вариантах осуществления изобретение касается способов модулирования рецептора хемокина путем взаимодействия рецептора с любым одним или несколькими соединениями или композициями, описанными в данном документе. В некоторых вариантах осуществления соединения данного изобретения могут действовать как ингибиторы рецепторов хемокинов. В других вариантах осуществления соединения изобретения могут быть использованы для модулирования активности рецептора хемокина у пациента,которому необходимо такое модулирование, путем введения модулирующего количества соединения формулы I или II или его соли. Рецепторы хемокина, к которым присоединяются и/или модулируются соединениями изобретения,включают любой рецептор хемокина. В некоторых вариантах осуществления рецептор хемокина относится к семейству рецепторов хемокинов СС, включая, например, CCR1, CCR2, CCR3, CCR4, CCR5,CCR6, CCR7, CCR8 и CCR10. В некоторых вариантах осуществления рецептором хемокина являетсяCCR2 или CCR5. В других вариантах осуществления рецептором хемокина является CCR2. В некоторых вариантах осуществления рецептором хемокина является CCR5. В некоторых вариантах осуществления рецептор хемокина присоединяется и/или модулируется как CCR2, так и CCR5. Соединения изобретения могут быть селективными, то есть соединение присоединяется или ингибирует с большим сродством или степенью определенный рецептор хемокина, по сравнению с как минимум одним другим рецептором хемокина. Соединения изобретения могут быть двойными ингибиторами или связывающими веществамиCCR2 и CCR5, что означает, что соединения изобретения могут присоединяться к или ингибировать какCCR2, так и CCR5 с большим сродством или степенью, соответственно, чем к другим рецепторам хемокинов, таких как CCR1, CCR3, CCR4, CCR6, CCR7, CCR8 и CCR10. В некоторых вариантах осуществления соединения изобретения обладают селективностью связывания или ингибирования CCR2 и CCR5 в большей степени, чем к другому рецептору хемокина. Сродство связывания и степень ингибирования определяют обычными способами, такими как приведенные в данном документе анализы. Данное изобретение так же касается способов лечения заболеваний или расстройств, связанных с рецептором хемокина, у индивидуума (например, пациента) путем введения индивидууму, который нуждается в таком лечении, терапевтически эффективного количества или дозы соединения данного изобретения или его фармацевтической композиции. В других вариантах осуществления изобретение касается способа лечения состояния, опосредованного активностью рецептора хемокина у субъекта, который включает введение субъекту соединения формулы I или II, или его фармацевтически приемлемой соли. Заболевание или состояние, связанное с рецептором хемокина, может включать любое заболевание,расстройство или состояние, непосредственно или опосредованно связанное с экспрессией или активностью рецептора хемокина. Заболевание или состояние, связанное с рецептором хемокина, так же может включать любое заболевание, расстройство или состояние, которое можно предупредить, облегчить или вылечить путем модулирования активности рецептора хемокина. Заболевание, связанное с рецептором хемокина, так же может включать любое заболевание, расстройство или состояние, характеризующееся связыванием инфекционного агента, такого как вирус или вирусный протеин, с рецептором хемокина. В некоторых вариантах осуществления заболеванием, связанным с рецептором хемокина, является заболевание, связанное с CCR5, такое как ВИЧ. Примеры состояния, опосредованного рецептором хемокина, включают воспаление, воспалительные заболевания, расстройства иммунной системы, боль, рак или вирусные инфекции. Примеры состояния, опосредованного рецептором хемокина, включают воспаление, воспалительные заболевания, расстройства иммунной системы, боль, раковые заболевания или вирусные инфекции. Примеры воспалительных заболеваний включают заболевания, которые имеют воспалительный компонент, такие как астма, сезонный и хронический аллергический ринит, синусит, конъюнктивит, возрастная макулярная дегенерация, пищевая аллергия, псориаз, отравление скумбрией, недифференцированная спондилоартропатия, юношеский спондилоартрит, подагра, крапивница, зуд, экзема, воспалительное заболевание кишечника, тромбоз, отит среднего уха, фиброз, фиброз печени, цирроз печени, болезнь сердца, болезнь Альцгеймера, сепсис, рестеноз, атеросклероз, рассеянный склероз, болезнь Крона,язвенный колит, синдром раздраженного кишечника, воспалительное заболевание кишечника, повышенная чувствительность легких, легочный фиброз, вызванный приемом лекарственного средства, хроническое обструктивное заболевание легких (COPD), артрит, нефрит, язвенный колит, атопический дерматит,инсульт, острое повреждение нерва, саркоидоз, гепатит, эндометриоз, невропатическая боль, гиперчувствительный пневмонит, эозинофильная пневмония, гиперчувствительность замедленного типа, интерстициальная болезнь легких (ILD) (например, идиопатический легочный фиброз или ILD связанная с ревматоидным артритом, системная красная волчанка, ревматоидный спондилит, системний склероз,синдром Ружеро-Шегрена, полимиозит или дерматомиозит, заболевания глаз (например, нейродегенерация сетчатки, хориоидальная реваскуляризация и т.д.) и т.д. Примеры расстройства иммунной системы включают ревматоидный артрит, псориатический артрит, системную красную волчанку, тяжелую миастению, юношеский диабет, гломерулонефрит, аутоиммунный тироидит, отторжение трансплантированного органа, включая отторжение аллотрансплантата, и реакция "трансплантат против хозяина". Примеры боли включают ноцицептивную и невропатическую боль. Боль может быть острой или хронической. Боль включает кожную боль, соматическую боль, висцеральную боль и ощущение боли в ампутированной конечности. Боль так же включает фибромиалгию, боль при ревматоидном артрите,боль при остеоартрите и боль, связанную с другими заболеваниями и состояниями, описанными в данном документе. Примеры рака включают рак молочных желез, рак яичников, множественную миелому и т.д., характеризующиеся инфильтрацией макрофагов (например, опухоль-ассоциированные макрофаги, ТАМ) в опухоли или больные ткани. Примеры вирусных инфекций включают грипп, птичий грипп, инфекционный герпес, ВИЧ или СПИД. Дополнительные воспалительные или иммунные заболевания, которые лечатся введением соединения данного изобретения, включают, например, аутоиммунный нефрит, волчаночный нефрит, синдром Гудпасчера, сопровождающийся нефритом, и гранулематоз Вегенера, сопровождающийся нефритом,красную волчанку, синдром Гудпасчера и гранулематоз Вегенера. Примеры диабетических состояний включают диабет, резистентность к инсулину, диабетическую невропатию, диабетическую нефропатию, диабетическую ретинопатию, катаракту, гипергликемию, гиперхолестеринемию, гипертензию, гиперинсулинемию, гиперлипидемию, атеросклероз, ишемию тканей,диабетическую кардиомиопатию, диабетическую микроангиопатию, диабетическую макроангиопатию и язвы стопы. Лечение диабета включает предупреждение или ослабление длительных состояний, таких как невропатия, нефропатия, ретинопатия или катаракта. В некоторых вариантах осуществления заболеванием является ревматоидный артрит, атеросклероз,волчанка, рассеянный склероз, невропатическая боль, отторжение трансплантата, диабет, диабетическая нефропатия, диабетические состояния или ожирение. В некоторых вариантах осуществления заболеванием является ревматоидный артрит. В некоторых вариантах осуществления заболеванием является диабет. В некоторых вариантах осуществления заболеванием является диабетическая нефропатия. В некоторых вариантах осуществления заболеванием является фиброз печени. В некоторых вариантах осуществления заболеванием является остеоартритная боль. В некоторых вариантах осуществления заболеванием является рак молочных желез, рак яичников или множественная миелома. В некоторых вариантах осуществления заболеванием является ВИЧ инфекция. Е. Дозировка и введение Фармацевтические композиции и лекарственные формы При применении в фармацевтике соединения формулы I или II вводят в виде фармацевтических композиций. Эти композиции получают известным в фармацевтике способом и вводят различными пу- 13020470 тями в зависимости от того, какое лечение нужно, локальное или системное, и области лечения. Введение может быть локальным (включая офтальмологическое и в слизистую, включая внутриносовое, вагинальное и ректальное), легочным (например, путем ингаляции или инсуффляцией порошков или аэрозолей, включая распыление; внутритрахеальное, внутриносовое, эпидермальное и трансдермальное),оральное или парентеральное. Парентеральное введение включает внутривенное, внутриартериальное,подкожное, внутрибрюшинное, внутримышечное или инъекции или вливания; или внутричерепное, например, интратекальное или внутрижелудочковое введение. Парентеральное введение могут осуществлять в виде простой болюсной дозы или, например, путем непрерывной перфузии. Фармацевтические композиции и композиции для локального введения включают трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны обычные фармацевтические носители, водные, порошковые или масляные основания, загустители и т.д. Так же используются презервативы, перчатки с покрытием и т.д. Данное изобретение так же включает фармацевтические композиции, которые содержат в качестве активного ингредиента одно или несколько вышеуказанных соединений формулы I или II в комбинации с одним или несколькими фармацевтически приемлемыми носителями. При получении композиций изобретения активный ингредиент обычно смешивают с экципиентом, разводят экципиентом или включают в такой носитель в виде, например, капсулы, саше, бумаги или другого контейнера. Когда экципиент используют как разбавитель, это может быть твердый, полутвердый или жидкий материал, который служит наполнителем, носителем или средой для активного ингредиента. Таким образом, композиции могут существовать в следующей форме: таблетки, пилюли, порошки, лозенги, саше, крахмальная капсула, эликсиры, суспензии, эмульсии, растворы, сиропы, аэрозоли (как твердая или жидкая среда), мази, содержащие, например, до 10 мас.% активного соединения, мягкие или твердые желатиновые капсулы, суппозитории, стерильные растворы для инъекций и стерильно упакованные порошки. При изготовлении композиции активное соединение измельчают до нужного размера частиц, перед тем как смешивать с другими ингредиентами. Если активное соединение плохо растворимо, его перемалывают до размера частиц меньше чем 200 меш. Если активное соединение хорошо растворимо, его перемалывают до такого размера частиц, чтобы обеспечить преимущественно однородное распределение в композиции, например, примерно 40 меш. Некоторые примеры приемлемых экципиентов включают следующие: лактоза, декстроза, сахароза,сорбит, манит, крахмал, гуммиарабик, фосфат кальция, альгинаты, трагакант, желатин, силицилат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, целлюлоза, вода, сироп и метилцеллюлоза. Композиции дополнительно могут включать лубриканты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгаторы и суспендирующие агенты; консерванты, такие как метил- и пропилгидрокси-бензоаты; подслащивающие агенты; и ароматизаторы. Композиции изобретения формуют таким образом, чтобы обеспечить быстрое, непрерывное или замедленное высвобождение активного ингредиента после введения пациенту, с применением известных способов. Композиции формуют как единичную дозированную форму, где каждая доза содержит от приблизительно 5 до приблизительно 1000 мг (1 г), как правило, приблизительно от 100 до приблизительно 500 мг, активного ингредиента. Термин "единичная дозированная форма" относится к физически обособленным единицам, приемлемым в качестве отдельных доз для людей и других млекопитающих, где каждая единица содержит предварительно рассчитанное количество активного соединения, таким образом, чтобы получить нужный терапевтический эффект, в комбинации с приемлемым фармацевтическим экципиентом. В некоторых вариантах осуществления соединения или композиции изобретения содержат от приблизительно 5 до приблизительно 50 мг активного ингредиента. Специалист в отрасли должен понимать,что соединения или композиции содержат от приблизительно 5 до приблизительно 10, от приблизительно 10 до приблизительно 15, от приблизительно 15 до приблизительно 20, от приблизительно 20 до приблизительно 25, от приблизительно 25 до приблизительно 30, от приблизительно 30 до приблизительно 35, от приблизительно 35 до приблизительно 40, от приблизительно 40 до приблизительно 45, или от приблизительно 45 до приблизительно 50 мг активного ингредиента. В другом варианте осуществления доза может равняться 35-45 мг. В некоторых вариантах осуществления соединения или композиции изобретения содержат от приблизительно 50 до приблизительно 500 мг активного ингредиента. Специалист в отрасли понимает, что соединения или композиции содержат от приблизительно 50 до приблизительно 75, от приблизительно 75 до приблизительно 100, от приблизительно 100 до приблизительно 125, от приблизительно 125 до приблизительно 150, от приблизительно 150 до приблизительно 175, от приблизительно 175 до приблизительно 200, от приблизительно 200 до приблизительно 225, от приблизительно 225 до приблизительно 250, от приблизительно 250 до приблизительно 275, от приблизительно 275 до приблизительно 300, от приблизительно 300 до приблизительно 325, от приблизительно 325 до приблизительно 350, от приблизительно 350 до приблизительно 375, от приблизительно 375 до приблизительно 400, от приблизительно 400 до приблизительно 425, от приблизительно 425 до приблизительно 450, от приблизительно 450 до приблизительно 475, или от приблизительно 475 до приблизительно 500 мг активного ингредиента. В некоторых вариантах осуществления соединения или композиции изобретения содержат от приблизительно 500 до приблизительно 1000 мг активного ингредиента. Специалист в отрасли должен понимать, что соединения или композиции содержат от приблизительно 500 до приблизительно 550, от приблизительно 550 до приблизительно 600, от приблизительно 600 до приблизительно 650, от приблизительно 650 до приблизительно 700, от приблизительно 700 до приблизительно 750, от приблизительно 750 до приблизительно 800, от приблизительно 800 до приблизительно 850, от приблизительно 850 до приблизительно 900, от приблизительно 900 до приблизительно 950, или от приблизительно 950 до приблизительно 1000 мг активного ингредиента. Активное соединение может быть эффективным в широком диапазоне дозировок и, как правило,вводится в фармацевтически эффективном количестве. Однако понятно, что фактически введенное количество активного соединения обычно определяется доктором, в зависимости от релевантных условий,включая состояние, которое лечат, выбранный путь введения, конкретное соединение для введения, возраст, массу и индивидуальное восприятие пациента, серьезность симптомов пациента и т.д. Для получения твердых композиций, таких как таблетки, активный ингредиент смешивают с фармацевтическим экципиентом, с образованием предварительной композиции, которая содержит гомогенную смесь соединения данного изобретения. При упоминании гомогенности таких композиций активный ингредиент, как правило, равномерно распределен в композиции таким образом, что композицию можно легко подразделить на одинаково эффективные лекарственные формы, такие как таблетки, пилюли и капсулы. После этого эту твердую композицию делят на лекарственные формы вышеописанного типа,которые содержат от, например, 0,1 до приблизительно 1000 мг активного ингредиента данного изобретения. Таблетки или пилюли данного изобретения могут иметь покрытие или быть компаундированы другим способом с целью обеспечения длительного воздействия. Например, таблетка или пилюля может содержать внутренний и внешний компонент, последний из которых представляет собой оболочку для первого. Два компонента можно разделить кишечным слоем, который противостоит разложению в желудке и позволяет внутреннему компоненту попасть в двенадцатиперстную кишку или замедляет его высвобождение. Для таких кишечных слоев или покрытий используют различные материалы, такие материалы включают большое количество полимерных кислот и смеси полимерных кислот с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которые могут быть включены соединения и композиции данного изобретения для орального введения или путем инъекции, включают водные растворы, приемлемо корригированные сиропы, водные или масляные суспензии и корригированные эмульсии со съедобными маслами, такими как масло хлопчатника, кунжутное масло, кокосовое масло или арахисовое масло, а так же эликсиры и похожие фармацевтические наполнители. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смесях, и порошки. Жидкие или твердые композиции могут содержать фармацевтически приемлемые формообразующие, как было описано выше. В некоторых вариантах осуществления композиции вводят орально или назально респираторным путем для локального или системного эффекта. Композиции могут быть распылены с применением инертных газов. Распыляющиеся растворы можно вдыхать непосредственно из распылителя или распылитель может быть присоединен к лицевой маске или респиратору с прерывистым избыточным давлением. Раствор, суспензию или порошок вводят орально или назально из устройства, нужным образом доставляющего композицию. Количество соединения или композиции, введенное пациенту, очень зависит от того, что вводили,цели введения, такой как профилактика или лечение, состояния пациента, пути введения и т.д. С целью терапевтического применения композиции вводят пациенту, уже страдающему заболеванием, в количестве, достаточном для излечения или хотя бы частичного прекращения симптомов болезни и ее последствий. Эффективную дозу выбирают в зависимости от состояния болезни, которую лечат, а так же от мнения доктора в зависимости от таких факторов, как серьезность заболевания, возраст, масса и общее состояние пациента и т.д. Композиции, введенные пациенту, могут существовать в вышеописанной форме фармацевтических композиций. Эти композиции стерилизуют обычным способом стерилизации или они могут быть стерильно профильтрованы. Водные растворы могут быть запакованы в таком виде или лиофилизированы,при этом лиофилизированную композицию комбинируют со стерильным водным носителем перед введением. рН композиции, как правило, составляет 3-11, или от 5 до 9, или от 7 до 8. Очевидно, что применение определенных вышеуказанных формообразующих, носителей или стабилизаторов приведет к образованию фармацевтических солей. Терапевтическая дозировка соединений данного изобретения изменяется в зависимости от, например, конкретной цели лечения, типа введения соединения, здоровья и состояния пациента и мнения доктора. Пропорция или концентрация соединения изобретения в фармацевтической композиции сильно зависит от ряда факторов, включая дозировку, химические характеристики (например, гидрофобность) и путь введения. Например, соединения изобретения могут вводиться в водном физиологическом буфер- 15020470 ном растворе, содержащем от приблизительно 0,1 до приблизительно 10% м/о соединения для парентерального введения. Некоторые стандартные дозировки включают от приблизительно 1 мкг/кг до приблизительно 1 г/кг массы тела в сутки. В некоторых вариантах осуществления диапазон дозировок составляет от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг массы тела в сутки. Дозировка вероятно зависит от таких переменных, как вид и степень прогресса заболевания или расстройства, общее состояние здоровья определенного пациента, относительная биологическая эффективность выбранного соединения, приготовление формообразующего и путь его введения. Эффективные дозы можно экстраполировать с помощью дозозависимых кривых, построенных с помощью анализов in vitro на животных. Соединения изобретения так же могут находиться в комбинации с одним или несколькими дополнительными активными ингредиентами, которые могут включать любой фармацевтический агент, такой как антитела, супрессанты иммунной системы, противовоспалительные агенты, химиотерапевтические агенты, агенты, снижающие уровень липидов, агенты, повышающие уровень ЛВП, стимуляторы секреции инсулина или сенсибилизаторы, лекарственные средства, используемые для лечения ревматоидного артрита и т.д. Режим лечения ревматоидного артрита (РА) Пациенты с ревматоидным артритом (РА), которых интенсивно лечили агентами, модифицирующими болезнь (метотрексат, агенты против малярии, золото, пеницилламин, сульфазалазин, дапсон, лефлунамид или биопрепараты), достигают различных результатов, включая полную ремиссию. Такие клинические ответы связаны с улучшением стандартных уровней активности болезни, а именно критерия АКР (Американская Коллегия Ревматологии), который включает боль, функцию, количество болезненных суставов, количество опухших суставов, общую оценку пациента, общую оценку врача, лабораторные измерения воспаления (CRP и ESR) и радиологическую оценку структурного повреждения сустава. Современные лекарственные вещества, модифицирующие болезнь (DMARD), требуют непрерывного введения для поддержания оптимального эффекта. Хроническая дозировка этих агентов связана со значительной токсичностью, и хозяин нуждается в соответствующей защите. Кроме того, часто пациенты становятся невосприимчивы к определенной терапии и нуждаются в альтернативном лечении. По этим причинам есть потребность в новом эффективном лечении, позволяющем отказаться от стандартныхDMARD. Пациенты со значительной восприимчивостью к анти-TNF терапии (инфликсимаб, етанерцепт, адалимумаб), анти-IL-1 терапии (кинарет) или другим болезнь-модифицирующим антиревматическим лекарствам (DMARD), которые включают, но не ограничиваются следующими: метотрексат, циклоспорин,соли золота, агенты против малярии, пеницилламин или лефлунамид, которым установили клиническую ремиссию болезни, могут лечиться соединениями, ингибирующими экспрессию и/или активность CCR2,включая, например, нуклеиновыми кислотами (например, молекулы антисмысловой или siPHK), белки(например, анти-CCR2 антитела), низкомолекулярные ингибиторы (например, соединения, описанные в данном документе, и другие ингибиторы рецептора хемокина, известные в отрасли). В некоторых вариантах осуществления соединение, ингибирующее экспрессию и/или активностьCCR2, является низкомолекулярным ингибитором CCR2 (или антагонистом). Антагонист CCR2 вводят орально один раз в сутки или дважды в сутки в дозировке, не превышающей 500 мг в день. Пациенты могут отказываться от дозы препарата, которым они лечатся, или уменьшать ее и поддерживать свое состояние приемом антагониста CCR2. Лечение пациентов комбинацией антагониста CCR2 их текущей терапии может длиться, например, от приблизительно одного до приблизительно двух дней, перед прекращением и уменьшением приема DMARD и продолжением приема антагониста CCR2. Существует значительное преимущество замены традиционных DMARD антагонистами CCR2. Традиционные DMARD имеют серьезные кумулятивные побочные эффекты, одним из наиболее распространенных является повреждение печени, а так же иммуносупрессорное действие. Считается, что антагонисты CCR2 имеют улучшенный безопасный на протяжении долгого времени профиль и не имеют подобного иммуносупрессорного действия, связанного с традиционными DMARD. Кроме того, период полураспада биопрепаратов обычно составляет дни или недели, что является обязательным требованием при наличии вредного воздействия. Период полураспада орально биодоступных антагонистов CCR2 составляет часы, поэтому риск продолжительного вредного воздействия препарата сводится к минимуму по сравнению с биологическими агентами. Так же, имеющиеся биологические агенты (инфликсимаб,етанерцепт, адалимумаб, кинарет), как правило, вводят внутривенно или подкожно, что требует введения препарата доктором или самим пациентом. Это приводит к возникновению реакций на месте вливания или инъекции. Этого можно избежать, используя орально вводимые антагонисты CCR2. Режим лечения диабета и инсулинорезистентности Диабет типа 2 является основной причиной болезненности и смертности западного общества. У большинства пациентов болезнь характеризуется дисфункцией панкреатических бета-клеток, сопровождаемой резистентностью к инсулину в печени и периферических тканях. На основе первичных механизмов развития болезни существует два главных класса оральной терапии диабета типа 2: стимуляторы секреции инсулина (сульфонилмочевины, такие как глибурид) и сенсибилизаторы инсулина (метформин и тиазолидиндионы, такие как розиглитазон). Комбинационная терапия, включающая оба механизма,- 16020470 убирает метаболические дефекты болезни и в большинстве случаев может улучшать потребность во введении экзогенного инсулина. Однако, со временем, зачастую развивается резистентность к инсулину, что приводит к потребности к дополнительному введению инсулина. Кроме того, предиабетическое состояние, так же называется метаболическим синдромом, характеризуется сниженной толерантностью к глюкозе, особенно в ассоциации с ожирением. Большинство пациентов, у которых развился диабет типа 2,начинали с развития резистентности к инсулину, с гипергликемией, возникающей, когда эти пациенты не могут больше удерживать уровень гиперинсулинемии, необходимый для поддержания гомеостаза глюкозы. Наступление резистентности к инсулину предсказывает начало болезни и ассоциируется с увеличением риска развития диабета типа 2, гипертензии и ишемической болезни сердца. Одним из наиболее важных факторов, который коррелирует с ухудшением толерантности к глюкозе и развитием от инсулинрезистентного состояния до диабета типа 2, является наличие центрального ожирения. Большинство пациентов с диабетом типа 2 страдают ожирением и ожирение само по себе связано с резистентностью к инсулину. Очевидно, что центральное ожирение является наиболее значимым фактором в развитии резистентности к инсулину, приводящей к диабету типа 2, предполагается, что сигналы от висцерального жира принимают участие в развитии резистентности к инсулину и развитии болезни. Кроме секретированных белковых факторов, ожирение вызывает клеточный воспалительный ответ, при котором макрофаги, происходящие из мозгового вещества костей, аккумулируются в жировых отложениях, превращаясь в макрофаги жировой ткани. Макрофаги жировой ткани накапливаются в жировой ткани в зависимости от размеров ожирения. Ткань-инфильтрирующие макрофаги являются источником многих воспалительных цитокинов, которые вызывают резистентность к инсулину в адипоцитах. Жировая ткань продуцирует МСР-1 в зависимости от ожирения, предполагается, что ее активность,которая проявляется в сигнализации посредством CCR2,так же может играть важную роль в аккумуляции макрофагов в жировой ткани. Неизвестно, или МСР-1/CCR2 взаимодействие напрямую отвечает за пополнение моноцитов в жировой ткани, или уменьшение пополнения моноцитов в жировой ткани у людей напрямую приведет к уменьшенному образованию провоспалительных молекул и когда образование провоспалительных молекул непосредственно связано с резистентностью к инсулину. Пациенты, демонстрирующие резистентность к инсулину, предиабетические (нормогликемические) или диабетические (гипергликемические), могут лечиться соединением, ингибирующим экспрессию и/или активность CCR2, включая, например, нуклеиновые кислоты (например, антисмысловые или siPHK), белки (например, анти-CCR2 антитела), низкомолекулярные ингибиторы (например, соединения,описанные в данном документе, и другие известные ингибиторы рецепторов хемокинов). В некоторых вариантах осуществления соединение, ингибирующее экспрессию и/или активность CCR2, является низкомолекулярным ингибитором CCR2 (или антагонистом). Антагонист CCR2 может вводится орально один раз в сутки или дважды в сутки. Пациенты могут отказываться от дозы препарата, которым они лечатся, или уменьшать ее и поддерживать свое состояние приемом антагониста CCR2. Альтернативно,лечение антагонистом CCR2 может использоваться как дополнительное к текущей терапии с целью повышения эффективности или предупреждения развития зависимости от инсулина. Существует значительное преимущество замены или дополнения традиционных агентов антагонистами CCR2. Такие агенты могут быть использованы, например, для прекращения развития предиабетического состояния, инсулинорезистентности в диабетическое. Такие агенты могут уменьшать или заменять потребность в использовании сенсибилизаторов инсулина, с их сопутствующей токсичностью. Такие агенты так же могут уменьшать потребность в или продлевать период до потребности в экзогенном инсулине. Режим лечения атеросклероза Атеросклероз - это состояние, характеризующееся отложением жирных соединений в стенках артерий. Бляшки включают такие скопления жирных соединений, холестерина, продуктов клеточных отходов, кальция и других соединений, которые накапливаются на внутренней стенке артерии. Бляшки могут расти до такой степени, что значительно снижают поток крови через артерию. Однако, более значительный ущерб происходит, когда бляшки становятся нестабильными и разрушаются. Разрушающиеся бляшки образуют кровяные сгустки, которые блокируют ток крови или отрываются и перемещаются в другие части тела. Если бляшка блокирует кровеносный сосуд, питающий сердце, это вызывает сердечный приступ. Если бляшка блокирует кровяной сосуд, питающий мозг, это вызывает инсульт. Атеросклероз - это медленнотекущее, комплексное заболевание, обычно начинающееся в детстве и зачастую прогрессирующее в более зрелом возрасте. Высокий уровень холестерина в крови является главным фактором риска для ишемической болезни сердца. Первичная структура бляшки основана на холестерине, добиться остановки увеличения бляшки можно путем снижения циркуляции холестерина или путем увеличения холестерин-несущих липопротеинов высокой плотности (ЛВП). Количество циркулирующего холестерина можно уменьшить, например, путем ингибирования его синтеза в печени или путем уменьшения его потребления с едой. Такие лекарственные средства, действующие по таким механизмам, включают лекарства для снижения высоких уровней холестерина: абсорбенты желчных кислот, ингибиторы синтеза липопротеинов, ингибиторы синтеза холестерина и производные фиброевой кислоты. Уровень циркулирующих ЛВП можно дополни- 17020470 тельно увеличить введением, например, пробухола или высоких доз ниацина. Терапия, включающая множественные механизмы действия, замедляла развитие болезни и разрушение бляшек. Атеросклероз обычно сопровождается клеточным воспалительным ответом, при котором макрофаги костного мозга аккумулируются в жирные полосы вдоль сосудистой стенки, превращаясь в пенистые клетки. Пенистые клетки являются источником многочисленных воспалительных цитокинов, которые вызывают развитие бляшек и ферментов, инициирующих дестабилизацию бляшек. Атеросклеротическая ткань также продуцирует МСР-1, предполагают, что его активность по средством передачи сигнала черезCCR2 также может играть важную роль в аккумуляции макрофагов в виде пенистых клеток в бляшке.CCR2-/- мыши продемонстрировали значительно уменьшенный уровень макрофагов в жирных полосах,образованных в результате диеты с высоким содержанием жира или генетического изменения в метаболизме липидов. Пациенты, продемонстрировавшие высокий уровень циркуляционного глицерина, низкий уровень ЛВП или увеличенный уровень циркуляционного CRP или наличие сосудистых бляшек, показанное на изображении, или любые другие доказательства наличия атеросклероза, могут получить лечение с помощью соединения, ингибирующего экспрессию и/или активность CCR2, включая, например, нуклеиновые кислоты (например, антисмысловые или siPHK), белки (например, анти-CCR2 антитела), низкомолекулярные ингибиторы (например, соединения, описанные в данном документе, и другие известные ингибиторы рецепторов хемокинов). В некоторых вариантах осуществления соединение, ингибирующее экспрессию и/или активность CCR2, является низкомолекулярным CCR2 ингибитором или (антагонистом),таким как соединение изобретения. Антагонист CCR2 вводят орально один раз в сутки или дважды в сутки в дозировке, не превышающей приблизительно 500 мг в сутки. Пациенты могут отказываться от дозы препарата, которым они лечатся, или уменьшать ее и поддерживать свое состояние приемом антагониста CCR2. Альтернативно, лечение антагонистом CCR2 может использоваться как вспомогательный в текущей терапии и увеличивать ее эффективность, например, предупреждать рост бляшек, стабилизировать уже образованную бляшку или вызывать регрессию бляшки. Существует значительное преимущество замены или дополнения традиционных агентов антагонистами. Такие агенты могут быть использованы, например, для остановки развития бляшек до стадии нестабильности, с чем ассоциируется риск разрушения бляшки. Такие агенты могут уменьшать или заменять потребность в использовании лекарств, модифицирующих холестерин, или лекарств, увеличивающих уровень ЛВП, вследствие их токсичности, которая не ограничивается смывкой, повреждением печени и повреждением мышц, таким как миопатия. Такие агенты так же могут снижать потребность или продлевать период до операции по открытию кровяного сосуда или до использования антикоагулянтов,которые необходимы, чтоб ограничить повреждения вследствие потенциального разрушения бляшки. Меченные соединения и способы исследования Другой аспект данного изобретения относится к соединению формулы I, меченому флуоресцентным красителем, магнитной меткой, тяжелым металлом или радиометкой, которое используют не только для построения изображения, но и для исследований, как in vitro так и in vivo, для определения локализации и количественного содержания рецептора хемокина в образцах ткани, включающих человеческие, и для идентификации лигандов рецептора хемокина путем ингибирования связывания меченного соединения. Соответственно, данное изобретение включает исследования рецептора хемокина, который содержит такие меченные соединения. Данное изобретение так же включает изотопно-меченные соединения формулы I. "Изотопно" или"радиомеченное" соединение является соединением изобретения, где один или несколько атомов заменены или замещены один атомом с атомной массой или атомным числом, отличающимися от атомной массы или атомного числа, привычного в природе (например, природного). Приемлемые радионуклиды, которые могут быть включены в соединения данного изобретения, включают, но не ограничиваются 2 Н, 3 НI, I и 131I. Выбор радионуклида для включения в радиомеченное соединение зависит от конкретного применения радиомеченного соединения. Например, для in vitro мечения рецептора хемокина и сравнительных анализов, соединения в которые включены 3 Н, 14 С, 82Br, 125I , 131I или 35S, являются наиболее приемлемыми. Для радиовидения наиболее приемлемыми являются 11 С, 18F, 125I, 123I, 124I, 131I, 75Br, 76Br или 77Br. Понятно, что "радиомеченное" или "меченное соединение" является соединением, в которое включен хотя бы один радионуклид. В некоторых вариантах осуществления радионуклид выбирают из группы, которая состоит из 3 Н, 14 С, 125I,35S и 82Br. Синтетические способы включения радиоизотопов в органические соединения являются приемлемыми для соединений изобретения и являются хорошо известными в данной области. Радиомеченное соединение изобретения может использоваться при скрининге для идентификации/оценки соединений. В общем, новое синтезированное или идентифицированное соединение (например, исследуемое соединение) можно оценить на его способность уменьшать связывание радиомеченного соединения с рецептором хемокина. Соответственно, способность исследуемого соединения конкурировать с радиомеченным соединением в связывании с рецептором хемокина напрямую коррелирует с его афинностью связывания. Наборы Данное изобретение так же включает фармацевтические наборы, используемые, например, для лечения или профилактики хемокин-связанных заболеваний, которые включают один или несколько контейнеров, содержащих фармацевтическую композицию, которая содержит терапевтически эффективное количество соединения формулы I. Такие наборы могут дополнительно включать, в случае необходимости, один или несколько стандартных компонентов фармацевтического набора, таких как, например,контейнеры с одним или несколькими фармацевтически приемлемыми носителями, дополнительные контейнеры и т. д., что является очевидным для специалиста. Инструкции, в виде вкладышей или этикеток, указывающие количества компонентов для введения, инструкции для введения, и/или инструкции для смешивания компонентов, так же могут быть включены в набор. Комбинация Соединения, или соли изобретения, или их смеси, могут вводиться в комбинации с одним или несколькими другими терапевтическими агентами, такими как лекарства. Соединение данного изобретения или его соль можно вводить одновременно или в разное время с одним или несколькими терапевтическими агентами. Например, "в комбинации" включает одновременное введение комбинации соединения или соли изобретения и терапевтического агента субъекту, когда такие компоненты расположены вместе в единой лекарственной форме, которая высвобождает указанные компоненты указанному субъекту, по сути, одновременно; по сути, одновременное введение комбинации соединения или соли изобретения и терапевтического агента субъекту, который нуждается в таком лечении, когда такие компоненты находятся раздельно, в отдельных лекарственных формах, которые принимаются, по сути, одновременно субъектом,после чего указанные компоненты высвобождаются в субъекте, по сути, одновременно; последовательное введение комбинации соединения или соли изобретения и терапевтического агента субъекту, когда такие компоненты находятся раздельно в отдельных лекарственных формах, которые принимаются субъектом последовательно со значительным интервалом времени между приемами, после чего указанные компоненты высвобождаются в субъекте в разное время; и последовательное введение такой комбинации соединения или соли изобретения и терапевтического агента субъекту, когда такие компоненты расположены вместе в единой лекарственной форме, которая высвобождает указанные компоненты контролированным образом, после чего их вводят указанному субъекту параллельно, последовательно,и/или перекрестно одновременно и/или в разное время, где каждая часть может вводиться одинаковым или разными путями. Один или несколько дополнительных фармацевтических агентов, таких как, например, антитела,противовоспалительные агенты, иммуносупрессанты, химиотерапевтические агенты, используются в комбинации с соединениями данного изобретения для лечения заболеваний, расстройств или состояний,связанных с рецептором хемокина. Один или несколько дополнительных фармацевтических агентов, таких как, например, противовирусные агенты, антитела, противовоспалительные агенты, стимуляторы секреции инсулина и сенсибилизаторы, агенты, модулирующие липиды и носители липидов сыворотки, и/или иммуносупрессанты, используются в комбинации с соединениями данного изобретения для лечения заболеваний, расстройств или состояний, связанных с рецептором хемокина. Агенты комбинируют с данными соединениями в единой или непрерывной лекарственной форме или агенты вводят одновременно или последовательно в виде отдельных лекарственных форм. Приемлемые противовирусные агенты для применения в комбинации с соединениями данного изобретения могут содержать нуклеозидный и нуклеотидный ингибитор обратной транскриптазы (NRTI),ненуклеозидный ингибитор обратной транскриптазы (NNRTI), ингибиторы протеазы и другие противовирусные лекарства. Приемлемые противовирусные агенты для применения в комбинации с соединениями данного изобретения могут содержать нуклеозидный и нуклеотидный ингибитор обратной транскриптазы (NRTI),ненуклеозидный ингибитор обратной транскриптазы (NNRTI), ингибиторы протеазы и другие противовирусные лекарства. Примеры приемлемых NRTI включают зидовудин (AZT); диданозин (ddI); залцитамиб (ddC); ставудин(d4T); ламивудин (3 ТС); абакавир (1592U89); адефовир дипивоксил [бис(РОМ)-РМЕА]; лобукавир (BMS180194); ВСН-10652; эмитрицитабин [(-)-FTC]; бета-L-FD4 (так же назвается бета-L-D4C и бета-L-2',3'диклеокси-5-фтор-цитиден); DAPD, -)-бета-D-2,6-диамино-пуриндиоксолан); и лоденозин (FddA). Обычные приемлемые NNRTI включают невирапин (BI-RG-587); делавирадин (ВНАР, U-90152); ефавиренз (DMP-266); PNU-142721; AG-1549; MKC-442 (1-(этокси-метил)-5-(1-метилэтил)-6-(фенилметил)(2,4(1H,3H)-пиримидиндион) и (+)-каланолид А (NSC-675451) и В. Обычные приемлемые ингибиторы протеазы включают саквинавир (Ro 31-8959); ритонавир (АВТ-538); индинавир (MK-639); нелфнавир (AG-1343); ампренавир (141W94); лазинавир (BMS-234475); DMP-450;BMS-2322623; АВТ-378 и AG-1 549. Другие противовирусные агенты включают гидроксимочевину, рибавирин, IL-2, IL-12, пентафузид,энфувиртид, С-34, циклотриазадисульфонамид CADA, РА-457 и Yissum Project No.11607. В некоторых вариантах осуществления противовоспалительные агенты или анальгетики для применения в комбинации с соединениями данного изобретения могут включать, например, опиатный агонист,ингибитор липоксигеназы, такой как ингибитор 5-липоксигеназы, ингибитор циклооксидазы, такой как ингибитор циклооксидазы-2, ингибитор интерлейкина, такой как ингибитор интерлейкина-1, ингибиторTNF, такой как инфликсимаб, етанерцепт или адалимумаб, NNMA антагонист, ингибитор оксида азота или ингибитор синтеза окиси азота, нестероидный противовоспалительный агент или противовоспалительный агент, сдерживающий выработку цитокина, например, такой как ацетаминофен, аспирин, кодеин, фентанил, ибупрофен, индометацин, кетодолак, морфин, напроксен, фенацетин, пироксикам, стероидный анальгетик, суфентанил, сунлиндак, тенидап и т.д. Аналогичным образом, эти соединения вводят с агентом, уменьшающим боль; потенцирующим средством, таким как кофеин, Н 2-антагонист, симетикон, гидроксид алюминия или магния; противоотечное, такое как фенилэфрин, фенилпропаноламин,псевдофедрин, оксиметазолин, эфинефрин, нафазолин, ксилометазолин, пропилгекседфин или леводезоксиэфедрин; противокашлевое средство, такое как кодеин, гидрокодон, карамифен, карбетапентан или декстраметорфан; диуретик; и седативный или неседативный антигистамин. В некоторых вариантах осуществления фармацевтические агенты для применения в комбинации с соединениями данного изобретения могут включать, но не ограничиваются следующими:(a) VLA-4 антагонисты, такие как описаны в US 5510332, WO 95/15973, WO 96/01644, WO 96/06108, WO 96/20216, WO 96/229661, WO 96/31206, WO 96/4078, WO 97/030941, WO 97/022897 WO 98/426567 WO 98/53814, WO 98/53817, WO 98/538185, WO 98/54207 и WO 98/58902;(с) иммуносупрессанты, такие как циклоспорин, такролимус, рапарницие и другие иммуносупрессанты типа FK506;(е) нестероидные анти-астматические, такие как тербуталин, метапротеренол, фенотерол, изоэтарин, албутерол, битолтерол, пирбутерол, теофиллин, кромолин натрия, атропин, ипратропиум бромид,антагонисты лейкотриенов (например, зафирлукаст, монтелукаст, пранлукаст, иралукаст, побилукаст,SKB-106,203), ингибиторы биосинтеза лейкотриенов (например, зилеутон, BAY-1005);(f) нестероидные противовоспалительные агенты (NSAID), такие как производные пропионовой кислоты (например, алминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флубипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (например, индометацин, ацернетацин, алклофенак, клиданак, диклофенак, фенклофенак,фенклозовая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикарны (изоксикарн, пироксикам, судоксикам и теноксикан), салицилаты (ацетилсалициловая кислота, сульфазалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон);(h) ингибиторы фосфодиэстеразы типа IV (PDE-IV);(i) другие антагонисты рецепторов хемокинов, особенно CXCR-4, CCR1, CCR2, CCR3 и CCR5;(j) агенты, снижающие уровень холестерина, такие как ингибиторы HMG-CoA редуктазы (ловастатин, сиривастатин и правастатин, флувастатин, аторвастатин и другие статины), комплексообразующие(холестирамин и колестипол), никотиновая кислота, фенопроизводные фиброевой кислоты (гемфиброзил, клофибрат, фенофибрат и бензафибрат) и пробукол;(n) другие соединения, такие как аминосалициловые кислоты, антиметаболиты, такие как азатиоприн и 6-меркаптопурин и цитотоксические хиимиотерапевтические агенты против рака. Массовое соотношение соединения данного изобретения и второго активного соединения может изменяться и зависит от эффективной дозы каждого ингредиента. Например, CCR2 и/или CCR5 антагонист используются в комбинации с противовоспалительным фармацевтическим агентом для лечения следующих заболеваний: воспаление, метаболическое заболевание, аутоиммунное заболевание, боль, рак или вирусная инфекция, для улучшения эффекта лечения, по сравнению с эффектом от лечения только терапевтическим агентом, без увеличения его токсического влияния. Усиливающее или синергическое влияние являются желаемыми результатами комбинированияCCR2 и/или CCR5 антагонистов данного изобретения с дополнительным агентом. Более того, устойчивость раковых клеток к агентам, таким как дексаметазон, может быть обратима благодаря лечению CCR2 и/или CCR5 антагонистами данного изобретения.F. Применение при получении композиции или лекарственного средства В одном варианте осуществления данное изобретение включает способы получения композиции или лекарственного средства, включая соединения или соли данного изобретения, для лечения состояний, опосредованных рецепторами хемокинов. В другом варианте осуществления изобретение включает применение одного или нескольких соединений или соли данного изобретения при получении композиции или лекарственного средства для лечения воспаления, воспалительного заболевания, иммунного расстройства, боли, рака или вирусной инфекции. Данное изобретение так же включает применение одного или нескольких соединений или соли данного изобретения в получении композиции или лекарственного средства для лечения одного или нескольких состояний, описанных в разделе способы.G. Схемы Соединения данного изобретения могут быть получены, используя способы, показанные на общей схеме синтеза, и экспериментальные методики, описанные ниже. Реакции способов синтеза, указанных в данном документе, осуществляют в приемлемых растворителях, которые выбираются специалистом в области органического синтеза, указанные приемлемые растворители, как правило, могут быть представлены любым растворителем, который, по сути, не реагирует с изначальными материалами (реактантами),промежуточными продуктам или продуктами при температурах, при которых проводятся реакции. Реакция может проводиться в одном растворителе или смеси нескольких растворителей. Для определенной реакции приемлемые растворители выбирают в зависимости от определенной стадии реакции. Получение соединения изобретения может включать защиту и снятие защиты многочисленных химических групп. Потребность в защите и снятии защиты и выбор определенных защитных групп осуществляется специалистом. Химия защитных групп описана (например, в T.W. Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd. Ed., WileySons, Inc., New York (1999, содержание которой включено в данный документ с помощью ссылки. Реакции контролируют с помощью любого приемлемого способа, известного в данной отрасли. Например, образование продукта можно контролировать с помощью спектроскопических средств, таких как ядерный магнитный резонанс (например, 1 Н или 13 С), инфракрасная спектроскопия, спектрофотометрия (например, УФ-видимая) или масс-спектрометрия, или хроматография, такая как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Исходные материалы, использованные в данном документе, являются доступными на рынке или могут быть получены с помощью стандартных способов синтеза. Общая схема синтеза приведена с целью иллюстрации и не является исчерпывающей. Схема 1 Получение примеров 1-23-40C раствор 2 М (в THF/этилбензол/гептан) LDA (68 мл, 138 ммоль) в тетрагидрофуране (120 мл) обрабатывали метил (1R,4S)-4-(2,5-диметил-1H-пиррол-1-ил)циклопент-2-ен-1-карбоксилатом (14,02 г,63,9 ммоль), поддерживая температуру на уровне не меньше чем -33C. Холодную реакционную смесь перемешивали на протяжении 40 мин и после этого медленно прибавляли раствор этилйодида (13,63 г,87,4 ммоль) в тетрагидрофуране (5 мл), поддерживая температуру на уровне не меньше чем -33C. Реакционную смесь перемешивали на охлаждающей бане в течение 4 ч и оставляли постепенно нагреваться. Реакционную смесь выливали в раствор NH4Cl (300 мл), после чего экстрагировали этилацетатом (2200 мл), промывали солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении. Полученное коричневое масло пропускали через колонку с силикагелем, используя растворитель 10% этилацетат/гексан, с получением метил (1R,4S)-4-(2,5-диметил-1H-пиррол-1-ил)-1-этилциклопент-2-ен-1 карбоксилата в виде коричневого масла (12,96 г, 82%). 1 Н ЯМР (400 МГц, CDCl3)млн ч. 5,98-5,96 (1H), 5,93-5,91 (1H), 5,73 (2H), 5,30-5,24 (1H), 3,71 Раствор метил (1R,4S)-4-(2,5-диметил-1 Н-пиррол-1-ил)-1-этилциклопент-2-ен-1-карбоксилата (12,94 г,52,3 ммоль) в метаноле (100 мл) обрабатывали 2,5N NaOH (30 мл, 75,0 ммоль) и перемешивали при комнатной температуре. Через 15 ч прибавляли 2,5N NaOH (10 мл, 25,0 ммоль) и реакционную смесь перемешивали на протяжении еще 4 ч. Метанол удаляли при пониженном давлении и остаток разделяли между диэтиловым эфиром и водой. Слои разделяли и водный слой подкисляли 4N HCl, дважды экстрагировали этилацетатом,промывали солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении с получением (1R,4S)-4-(2,5-диметил-1H-пиррол-1-ил)-1-этилциклопент-2-ен-1-карбоновой кислоты в виде коричневого масла (11,83 г, 97%). 1 Н ЯМР (400 МГц, CDCl3)млн ч. 5,98-5,96 (2H), 5,73 (2H), 5,30-5,26 (1H), 2,47-2,35 (2H), 2,20(14,51 г, 32,8 ммоль) и перемешивали в атмосфере азота при комнатной температуре на протяжении 20 мин. Прибавляли раствор (1S,4S)-2-ВОС-2,5-диазабицикло[2.2.1]гептана (5,66 г, 28,5 ммоль) в DMF (5 мл) и реакционную смесь перемешивали на протяжении 24 ч. Реакционную смесь разводили этилацетатом (100 мл) и промывали 60% насыщенным NaHCO3 (125 мл). Водный слой экстрагировали этилацета- 22020470 том. Органические слои объединяли, промывали солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении с получением коричневого масла (21,25 г). Масло пропускали через колонку с силикагелем с 50% этилацетат/гексан с получением трет-бутил (1S,4S)-5-[(1R,4S)-4-(2,5 диметил-1H-пиррол-1-ил)-1-этилциклопент-2-ен-1-ил]карбонил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата, в виде белой пены (8,14 г, 70%). 1 Н ЯМР (400 МГц, CDCl3)млн ч. 6,24-6,17 (1H), 5,90-5,86 (1H), 5,73-5,68 (2H), 5,34-5,22 (1H),5,02-4,41 (2H), 3,71-3,24 (4H), 2,61-2,39 (1H), 2,27-2,16 (7H), 1,89-1,59 (4H), 1,49-1,32 (9H), 0,95-0,85 (3H). Стадия 4. Получение трет-бутил (1S,4S)-5-[(1R,4S)-4-амино-1-этилциклопент-2-ен-1-ил]карбонил)2,5-диазабицикло[2.2.1]гептан-2-карбоксилата(10 мл) обрабатывали гидрохлоридом гидроксиламина (2,73 г, 39,1 ммоль) и 50 мас.% раствором гидроксиламина (2,4 мл, 39,2 ммоль). Реакционную смесь перемешивали в атмосфере азота и нагревали до 68C на протяжении 38,5 ч. Реакционную смесь охлаждали до комнатной температуры, разводили водой и подщелачивали (рН 11) путем добавления 2,5N NaOH. Реакционную смесь экстрагировали этилацетатом (3100 мл), промывали солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении с получением неочищенной смеси трет-бутил (1S,4S)-5-[(1R,4S)-4-амино-1-этилциклопент-2 ен-1-ил]карбонил-2,5-диазабицикло[2.2.1] гептан-2-карбоксилата в виде желтого масла (2,68 г, теоретический выход 2,12 г), которое использовали на следующей стадии без дополнительной очистки. Стадия 5. Получение трет-бутил (1S,4S)-5-[(1S,3R)-3-амино-1-этилциклопентил]карбонил)-2,5 диазабицикло[2.2.1]гептан-2-карбоксилата[2.2.1]гептан-2-карбоксилата (2,12 г, 6,32 ммоль) и 5% палладий на угле в метаноле (35 мл) перемешивали при комнатной температуре при 48 пси водорода на протяжении 21 ч. Реакционную смесь фильтровали через целит и осадок на фильтре промывали метанолом. Фильтрат и промывную жидкость концентрировали при пониженном давлении с получением трет-бутил (1S,4S)-5-[(1S,3R)-3-амино-1 этилциклопентил]карбонил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата в виде коричневого масла/пены (2,46 г, теоретический выход 2,13 г), которое использовали на следующей стадии без дополнительной очистки. Стадия 6. Получение (1S,4S)-трет-бутил 5-1S,3R)-1-этил-3-3S,4R)-3-метокси-тетрагидро-2 Нпиран-4-иламино)циклопентанкарбонил)-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата(1S,4S)-5-[(1S,3R)-3-амино-1-этилциклопентил]карбонил-2,5 диазабицикло[2.2.1]гептан-2-карбоксилата (1,58 г, 4,7 ммоль) в дихлорметане (25 мл) обрабатывали триацетоксиборгидридом натрия (2,36 г, 11,1 ммоль) и (3R)-3-метокситетрагидро-4 Н-пиран-4-он (0,76 г, 7,6 ммоль). Реакционную смесь перемешивали в атмосфере азота при 0C на протяжении 30 мин, после этого нагревали до комнатной температуры и перемешивали на протяжении 15 ч. Реакционную смесь обрабатывали 2,5NNaOH (10 мл) и перемешивали на протяжении 10 мин. Реакционную смесь разводили водой и слои разделяли. Водный слой дважды экстрагировали этилацетатом. Слой дихлорметана концентрировали при пониженном давлении и разделяли между этилацетатом и водой. Органические слои объединяли, промывали солевым раствором, сушили над MgSO4, концентрировали при пониженном давлении и очищали Biotage (0-100% метанол/этилацетат, 15 объемов колонки) с получением нужного продукта, 1,5-ангидро-3-[(1R,3S)-3[(1S,4S)-5-(трет-бутоксикарбонил)-2,5-диазабицикло[2.2.1]гепт-2-ил]карбонил-3 этилциклопентил]амино-2,3-дидеокси-4-О-метил-D-эритро-пентитол. ЖХ/МС (М+Н) = 452,3124 ожид.,452,3135 получ.; 1 Н ЯМР (400 МГц, CDCl3)млн ч. 4,94-4,41 (2H), 4,11-4,04 (1H), 3,97-3,91 (1H), 3,53-3,18 (11H),- 23020470 К раствору (1S,4S)-трет-бутил 5-1S,3R)-1-этил-3-3S,4R)-3-метокси-тетрагидро-2 Н-пиран-4 иламино)циклопентанкарбонил)-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (1,22 г, 2,89 ммоль) в 1,4 диоксане (15 мл) прибавляли 4N HCl/1,4-диоксан (15 мл). Реакционную смесь перемешивали при комнатной температуре на протяжении 18 ч. Жидкость сливали, получая клейкое твердое вещество, которое растворяли в метаноле и концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде и концентрировали с получением продукта соли HCl, в виде коричневой пены (1,23 г, теоретический выход 1,03 г), который использовали на следующей стадии без дополнительной очистки. Стадия 8. Получение 1,5-ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[4-(трифторметил) пиридин-2-ил]-2,5-диазабицикло[2.2.1]гепт-2-ил)карбонил)циклопентил]амино-4-О-метил-D-эритропентитола К раствору соли HCl (1S,4S)-2,5-диазабицикло[2.2.1]гептан-2-ил 1S,3R)-1-этил-3-3S,4R)-3 метокси-тетрагидро-2 Н-пиран-4-иламино)циклопентил)метанона (118 мг, 0,33 ммоль) в ДМСО (2 мл) прибавляли триэтиламин (0,15 мл, 1,08 ммоль) и 2-хлор-4-(трифторметил)пиридин (183 мг, 1,01 ммоль). Реакционную смесь нагревали при 120C на протяжении 15 ч. Реакционную смесь охлаждали до комнатной температуры и прибавляли к перемешиваемой ледяной воде. Смесь экстрагировали этилацетатом(3). Объединенные органические слои промывали солевым раствором, сушили над MgSO4, концентрировали при пониженном давлении и очищали Biotage (0-100% метанол/этилацетат, 15 объемов колонки) с получением продукта в виде коричневой пены (40 мг 26%). ЖХ/МС (М+Н) = 497,2739 ожид., 497,2884 получ.; 1 Н ЯМР (400 МГц, CDCl3)млн ч. 8,25-8,24 (1H), 6,75-6,74 (1H), 6,51-6,45 (1H), 5,13-4,76 (2H),4,10-4,03 (1H), 3,95-3,90 (1H), 3,72-3,16 (11H), 2,82-2,67 (1H), 2,58-2,36 (1H), 2,06-1,36 (12H), 0,86-0,67 1,5-Ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[4-(трифторметил)пиримидин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол Получали, как описано в примере 1, используя 2-хлор-4-(трифторметил)пиримидин вместо 2-хлор 4-(трифторметил)пиридина и модификацию стадии 8, как следует далее. Соль HCl амина (91 мг, 0,25 ммоль) помещали в колбу с 1,4-диоксаном (3 мл). Прибавляли триэтиламин (0,12 мл, 0,86 ммоль) и 2-хлор-4-(трифторметил)пиримидин (148 мг, 0,81 ммоль). ДМСО (0,3 мл) прибавляли до растворения и реакционную смесь нагревали при 100C на протяжении 20 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разделяли между этилацетатом и водой. Водный слой экстрагировали этилацетатом и объединенные органические слои промывали солевым раствором, сушили над MgSO4, концентрировали при пониженном давлении и очищали Biotage (0-100% метанол/этилацетат 15 объемов колонки) с получением продукта в виде коричневой пены (43 мг, 58%). ЖХ/МС (М+Н) = 498,2692 ожид., 498,2799 получ.; 1 Н ЯМР (400 МГц, CDCl3)млн ч. 8,48-8,47 (1H), 6,80-6,78 (1H), 5,16-4,71 (2H), 4,09-4,00 (1H),3,93-3,86 (1H), 3,70-3,51 (3H), 3,45-3,13 (8H), 2,85-2,66 (1H), 2,60-2,33 (1H), 2,06-1,35 (12H), 0,87-0,66 1,5-Ангидро-2,3-дидеокси-3-[(1R,3S)-3-этил-3-1S,4S)-5-[6-(трифторметил)пиримидин-4-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол Получали, как описано в примере 1, используя 4-хлор-6-(трифторметил)пиримидин вместо 2-хлор 4-(трифторметил)пиридин и модификацию стадии 8, как следует далее. HCl соль амина (227 мг, 0,63 ммоль) помещали в колбу с 1,4-диоксаном (3 мл). К перемешиваемому раствору прибавляли Xantphos (26 мг, 0,045 ммоль), Pd2(dba)3 (39 мг, 0,042 ммоль), Cs2CO3 (258 мг, 0,79 ммоль) и 4-хлор-6(трифторметил)пиримидин (261 мг, 1,43 ммоль), растворенный в 1,4-диоксане (1 мл). ДМСО (0,3 мл) прибавляли до растворимости и реакционную смесь нагревали при 100C на протяжении 15 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и очищали Biotage (0-100% метанол/этилацетат 15 объемов колонки) с получением продукта в виде коричневой пены (93 мг, 37%). ЖХ/МС (М+Н) = 498,2692 ожид., 498,2853 получ.; 1 Н ЯМР (400 МГц, CDCl3)млн ч. 8,63 (1H), 6,76-6,42 (1H), 5,31-4,54 (2H), 4,12-4,03 (1H), 3,96-3,85 1,5-Ангидро-2,3-дидеокси-3-[(1R,3S)-3-метил-3-1S,4S)-5-[4-(трифторметил)пиридин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол Получали, как описано в примере 1, используя метилйодид вместо этилйодида на стадии 1. ЖХ/МС 1,5-Ангидро-2,3-дидеокси-3-[(1R,3S)-3-метил-3-1S,4S)-5-[6-(трифторметил)пиразин-2-ил]-2,5 диазабицикло[2.2.1]гепт-2-илкарбонил)циклопентил]амино-4-O-метил-D-эритро-пентитол Получали, как описано в примере 3, используя метилйодид вместо этилйодида на стадии 1 и 2-йод 6-(трифторметил)пиразин вместо 4-хлор-6-(трифторметил)пиримидина на стадии 8. ЖХ/МС (М+Н) = 483,2583 ожид., 483,2543 получ.; 1 Н ЯМР (400 МГц, CDCl3)млн ч. 8,25-8,24 (1H), 6,75-6,74 (1H), 6,51-6,45 (1H), 5,09-4,76 (2H),4,09-4,03 (1H), 3,96-3,90 (1H), 3,70-3,23 (11H), 2,81-2,65 (1H), 2,53-2,27 (1H), 2,07-1,02 (13H).
МПК / Метки
МПК: A61P 35/00, A61K 31/407, A61P 29/02, C07D 487/08
Метки: хемокина, качестве, рецептора, 3-аминоциклопентанкарбоксамиды, модуляторов
Код ссылки
<a href="https://eas.patents.su/30-20470-3-aminociklopentankarboksamidy-v-kachestve-modulyatorov-receptora-hemokina.html" rel="bookmark" title="База патентов Евразийского Союза">3-аминоциклопентанкарбоксамиды в качестве модуляторов рецептора хемокина</a>
Предыдущий патент: Состав титанового сплава для производства высококачественных деталей, в частности, для авиационной промышленности
Следующий патент: Бытовой прибор с автоматическим отключением
Случайный патент: Способ повышения качества синтетической нефти, синтезированной по реакции синтеза фишера-тропша, и смешанной сырой нефти