Конденсированные тиазоло- и оксазолопиримидиноны
Номер патента: 20228
Опубликовано: 30.09.2014
Авторы: Гупта Рамеш Чхандра, Дешпанде Шайлеш, Джамадаркхана Прашант Г., Чххипа Лаксмикант, Чхаутхайвале Виджай, Дутт Чхайтанья, Сривастава Санджай, Чхаудхари Анита, Бадантхадка Мурали, Моханан Аноокх
Формула / Реферат
1. Соединение формулы (I)
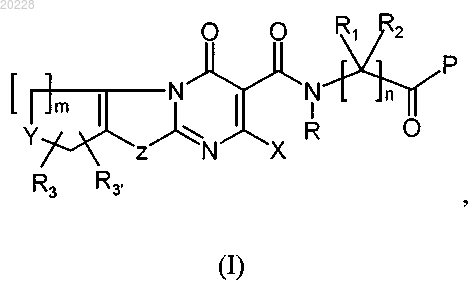
его фармацевтически приемлемые соли, изомеры и стереоизомеры, где
когда Y представляет собой NR4, О, S или SO2, m равняется 1-2, и когда Y представляет собой C(R5)(R6), m равняется 1-4;
n равняется 1-6;
Р представляет собой -ОН, -OR7, -NH2, -NHR7, -NR7R7' или -NHOH;
X представляет собой -ОН, -OR7 или -SR7;
Z представляет собой S или О;
R представляет собой водород, линейный или разветвленный (С1-С8)алкил, (С3-С7)циклоалкил или -(С1-С8)алкил(С6-С10)арил;
R1 и R2 независимо выбраны из водорода, линейного или разветвленного (С1-С8)алкила, (С6-С10)арила, -СН2-(С6-С10)арила и -СН2-гетероарила или
R1 и R2 могут соединяться вместе, формируя 3-6-членное моноциклическое кольцо;
R вместе с либо R1, либо R2 сопряженного углеродного атома может формировать 3-6-членное моноциклическое гетероциклическое кольцо;
R3 и R3' в каждом местоположении независимо выбраны из водорода, линейного или разветвленного (С1-С8)алкила, (С1-С5)алкокси и галогена;
R4 выбран из группы, включающей водород, линейный или разветвленный (C1-С8)алкил, (С3-С7)циклоалкил, гетероарил, -(С1-С8)алкил-(С6-С10)арил, -(С1-С8)алкил-гетероарил, -C(O)R8, -C(O)OR8, -C(O)NR8R9,
-C(S)NR8R9 и -SO2R8, где арильный и гетероарильный радикалы необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей -(С1-С8)алкил, -(С3-С7)циклоалкил, -ОН, -(С1-С5)алкокси, галоген, CN, -CF3 и -OCF3;
R5 и R6 независимо выбраны из группы, включающей водород, линейный или разветвленный (С1-С8)алкил, (С3-С7)циклоалкил, (С6-С10)арил, гетероарил, фтор, -СООН и -NHCO-(С6-С10)арил;
R5 и R6 могут соединяться вместе, формируя 3-6-членное карбоциклическое кольцо;
R7, R7' независимо выбраны из линейного или разветвленного (С1-С8)алкила, (С3-С7)циклоалкила и -(С1-С8)алкил-(С6-С10)арила;
R7 и R7' вместе с атомом азота, к которому они присоединены, могут формировать 5-6-членное моноциклическое насыщенное и частично насыщенное кольцо; причем кольцо может содержать 1-3 гетероатома, выбранных из N, S и О;
R8 выбран из группы, включающей линейный или разветвленный (С1-С8)алкил, (С3-С7)циклоалкил, -(С1-С8)алкил-(С3-С7)циклоалкил, гетероциклил, (С6-С10)арил, -(С1-С8)алкил-(С6-С10)арил, -(С1-С2)алкил-гетероциклил, гетероарил и -(С1-С8)алкил-гетероарил, где арильный и гетероарильный радикалы необязательно замещены одним или несколькими заместителями, выбранными из линейного или разветвленного (С1-С8)алкила, (С3-С7)циклоалкила, -(C1-С8)алкил-(С3-С7)циклоалкила, -ОН, (С1-С5)алкокси, галогена, -CN, -CF3, -OCF3 и -SO2-(C1-C8)алкила;
R9 представляет собой водород или линейный или разветвленный (С1-С8)алкил, где гетероарил относится к ароматической 5-14-членной моноциклической или бициклической кольцевой системе, имеющей по меньшей мере один гетероатом О, S, N, гетероцикл относится к полностью или частично насыщенной 3-14-членной моноциклической или бициклической кольцевой системе, имеющей по меньшей мере один гетероатом О, S, N.
2. Соединение по п.1, которое выбирают из группы, включающей









3. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении HIF гидроксилазы, содержащая терапевтически эффективное количество одного или нескольких соединений по п.1 в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
4. Способ лечения анемии у млекопитающих, включая человека, включающий введение терапевтически эффективного количества соединения по п.1.
5. Способ лечения анемии пожилых людей или анемии, связанной с состояниями, такими как хронические заболевания, почечная недостаточность, рак, инфекция, диализ, хирургическое вмешательство и химиотерапия у млекопитающих, включающий введение терапевтически эффективного количества соединения по п.1.
6. Способ предотвращения или лечения повреждения тканей, вызванного почечной ишемией, сердечно-сосудистой ишемией, цереброваскулярной ишемией, печеночной ишемией или ишемией периферических сосудов у млекопитающих, включая человека, включающий введение терапевтически эффективного количества соединения по п.1.
7. Способ предотвращения или лечения повреждения тканей, вызванного ишемическими расстройствами, включая острое повреждение почек, инфаркт миокарда, инсульт, ишемически-реперфузионное повреждение печени и заболевания периферических сосудов у млекопитающих, включая человека, включающий введение терапевтически эффективного количества соединения по п.1.
8. Применение соединения по п.1 для приготовления лекарственного препарата для лечения анемии.
9. Применение соединения по п.1 для приготовления лекарственного препарата для лечения анемии пожилых людей или анемии, связанной с состояниями, такими как хронические заболевания, почечная недостаточность, рак, инфекция, диализ, хирургическое вмешательство и химиотерапия.
10. Применение соединения по п.1 для приготовления лекарственного препарата для предотвращения или лечения повреждения тканей, вызванного почечной ишемией, сердечно-сосудистой ишемией, цереброваскулярной ишемией, печеночной ишемией или ишемией периферических сосудов.
11. Применение соединения по п.1 для приготовления лекарственного препарата для предотвращения или лечения повреждения тканей, вызванного ишемическими расстройствами, включая острое повреждение почек, инфаркт миокарда, инсульт, ишемически-реперфузионное повреждение печени и заболевания периферических сосудов.
Текст
Настоящее изобретение относится к новым соединениям формулы (I) их фармацевтически приемлемым солям и их изомерам, стереоизомерам. Настоящее изобретение также включает фармацевтические композиции, содержащие указанные соединения. Настоящее изобретение, кроме того, относится к способам лечения и применению вышеупомянутых соединений для приготовления лекарственного препарата для применения в качестве лекарственного средства.(71)(73) Заявитель и патентовладелец: ТОРРЕНТ ФАРМАСЬЮТИКАЛЗ ЛИМИТЕД (IN) Область изобретения Настоящее изобретение относится к новым тиазоло- и оксазолопиримидиноновым соединениям формулы (I), их фармацевтически приемлемым солям и их изомерам, стереоизомерам. Настоящее изобретение также включает фармацевтически приемлемые композиции указанных соединений и способ получения новых соединений. Настоящее изобретение, кроме того, относится к применению вышеупомянутых соединений для получения лекарственного препарата для использования в качестве лекарственного средства. Предпосылки изобретения Фактор транскрипции HIF (индуцируемый гипоксией фактор) играет центральную роль в гомеостазе кислорода. Ранний ответ на тканевую гипоксию представляет собой индукцию индуцируемого гипоксией фактора (HIF), транскрипционного активатора с основной структурой спираль-петля-спираль(bHLH) семейства PAS (Per/Arnt/Sim), который опосредует изменения в генной экспрессии в ответ на изменения концентрации кислорода в клетке. HIF представляет собой гетеродимер, состоящий из конститутивно экспрессируемой бета-субъединицы и одной из двух альфа-субъединиц, HIF1 и HIF2.1 В оксигенированных клетках (при нормоксии) субъединицы HIF быстро деградируют под действием механизма, который включает убиквитинирование комплексом супрессора опухоли фон ХиппельЛиндау (pVHL) с Е 3 лигазой. В условиях гипоксии HIF не деградирует, и активный комплекс HIF/ накапливается в ядре и активирует экспрессию некоторых генов, включая гены гликолитических ферментов, глюкозного транспортера (GLUT)-1, эритропоэтина (ЕРО), фактора роста эндотелия сосудов(VEGF) и адреномедуллина.1 Таким образом, активация HIF является одним из известных адаптивных механизмов, связанных с гипоксией/ишемией. Как указано, активация HIF приводит к усиленной экспрессии генов, которые выполняют многочисленные функции для борьбы с и для восстановления после гипоксических/ишемических состояний.2 В оксигенированных клетках (при нормоксии) два консервативных пролиновых остатка субъединицHIF подвергаются гидроксилированию. Эту реакцию катализируют HIF пролилгидроксилазы (PHD). Пролилгидроксилированная HIF взаимодействует с pVHL и быстро подвергается деградации под действием протеасомного механизма. К тому же, в клетках с нормальным содержанием кислорода один консервативный аспарагин HIF также подвергается гидроксилированию. Эту реакцию катализирует HIF аспарагилгидроксилаза (FIH). Аспарагилгидроксилированная HIF не взаимодействует с транскрипционным коактиватором СВР/р 300. При гипоксических/ишемических состояниях активности как HIF пролил-, так и HIF аспарагилгидроксилазы существенно уменьшаются из-за ограниченного количества молекулярного кислорода. В результате HIF не направляется на протеасомную деградацию и, следовательно, стабилизируется. Кроме того, HIF может взаимодействовать с транскрипционным коактиватором СВР/р 300. Такая стабилизированная и транскрипционно активная HIF потом формирует гетеродимер с HIF-бета субъединицей, перемещается в ядро и приводит к трансактивации HIF целевых генов.1 Ингибирование HIF пролилгидроксилазы и HIF аспарагилгидроксилазы, таким образом, может быть эффективным подходом для кислород-независимой активации HIF. Такая активация HIF фармакологическими средствами приводит к усиленной экспрессии генов, которые выполняют многочисленные функции для борьбы с и для восстановления после гипоксических/ишемических состояний. HIF-цели включают гены, ответственные за вазомоторную регуляцию (например, адреномедуллин, eNOS, гемоксигеназа), энергетический метаболизм (например, Glut-1, карбоангидраза-9), сигнальный каскад ангиогенеза (например, VEGF, VEGF рецептор-1) и эритропоэз (например, эритропоэтин, трансферрин, трансферриновый рецептор)1. Следовательно, активация HIF может принести значительную терапевтическую пользу при различных болезненных состояниях, таких как анемия различных типов и повреждения тканей, вызванные гипоксией/ишемией в условиях, например, острого повреждения почек, инфаркта миокарда, инсульта, ишемически-реперфузионного повреждения печени, заболеваний периферических сосудов и трансплантации печени или почки.3, 4, 5, 6, 7, 8 Анемия характеризуется уменьшением нормального числа красных кровяных клеток, которое обычно вызвано потерей крови (кровотечение), избыточным разрушением красных кровяных клеток (гемолиз) или недостаточным производством красных кровяных клеток (неэффективный гемопоэз). Так как гемоглобин обычно переносит кислород из легких к тканям, анемия ведет к гипоксии в органах. Поскольку выживание всех клеток человека зависит от кислорода, анемия может иметь широкий диапазон клинических проявлений. Анемия встречается чаще у пожилых людей, у раковых пациентов, особенно тех, кто получает химиотерапию и подвергается облучению, пациентов с почечными заболеваниями и целым рядом состояний, связанных с хроническими заболеваниями. Часто причиной анемии является сниженное производство эритропоэтина (ЕРО), приводящее к предотвращению эритропоэза. Эритропоэтин (ЕРО), встречающийся в природе гормон, который производится в ответ на HIF,стимулирует производство эритроцитов. ЕРО обычно выделяется почками, и эндогенный ЕРО повыша-1 020228 ется при условиях пониженного кислорода (гипоксия)9. Экзогенное введение ЕРО является одним из принятых способов лечения анемии, особенно у пациентов с хронической почечной недостаточностью, раковых пациентов, подвергающихся облучению и/или химиотерапии; однако его применение ограничено высокой стоимостью и повышенным риском тромбоза и гипертензии 10. Ишемию определяют как абсолютную или относительную нехватку кислорода в ткани или органе,происходящую в результате расстройств, таких как атеросклероз, диабет, тромбоэмболия, гипотензия и т.д. Сердце, мозг и почка особенно чувствительны к ишемическому стрессу, вызванному низким кровоснабжением. Ишемия может быть острой (внезапное проявление и короткая продолжительность) или хронической (медленное проявление с длительной продолжительностью или частые рецидивы). Острая ишемия часто связана с местным, необратимым некрозом ткани (инфаркт), тогда как хроническая ишемия обычно связана с временным гипоксическим поражением ткани. Если уменьшение перфузии является продолжительным или сильным, впрочем, хроническая ишемия также может быть связана с инфарктом. Инфаркт обычно встречается в селезенке, почке, легких, мозге и сердце, приводя к расстройствам, таким как инфаркт кишечника, инфаркт легкого, ишемический инсульт и инфаркт миокарда. Ишемические и гипоксические расстройства являются главной причиной заболеваемости и смертности. В настоящее время лечение ишемических и гипоксических расстройств сосредотачивается на ослаблении симптомов и лечении вызывающих их расстройств, но ни одна из этих терапий не обращена прямо на повреждение тканей, вызванное ишемией и гипоксией. Экзогенное введение некоторых HIF целевых генов, таких как эритропоэтин, VEGF, адреномедуллин, показало значительное функциональное восстановление при ишемическом и ишемическиреперфузионном поражении сердца, почки, мозга и печени.11, 12, 13, 14 В связи с недостатками современных способов лечения анемии и болезней, обусловленных гипоксией и ишемией, остается потребность в соединениях, которые эффективны в лечении анемий различных типов, таких как анемия у пожилых людей или анемия, связанная с хроническими заболеваниями или почечной недостаточностью, или раком, или инфекцией, или диализом, или хирургическим вмешательством, или химиотерапией, и при ишемических/гипоксических расстройствах, таких как острое повреждение почек, инфаркт миокарда, инсульт, ишемически-реперфузионное повреждение печени и заболевания периферических сосудов. Соединения настоящего изобретения обеспечивают средства ингибирования HIF гидроксилаз и, таким образом, активацию HIF, что приводит к усиленной экспрессии широкого спектра целевых генов,включая ген эритропоэтина (ЕРО), фактора роста эндотелия сосудов (VEGF), адреномедуллина и т.п., и,таким образом, применимы при лечении различных расстройств, включая анемию различных типов и состояния, связанные с ишемией/гипоксией. Документ ЕР 661269 раскрывает замещенные гетероциклические амиды карбоновой кислоты и их применение в качестве ингибиторов пролил-4-гидроксилазы и в качестве ингибиторов биосинтеза коллагена. Дополнительно, различные патентные публикации, такие как WO 2003049686, WO 2003053997, WO 2004108121, WO 2007146425, WO 2007146438, раскрывают соединения, которые стабилизируют HIF, и их применение для предотвращения и лечения состояний, связанных с ишемией и гипоксией, и состояний, связанных с ЕРО, таких как анемия и неврологические расстройства. Документ JP 5039293 раскрывает разнообразные конденсированные и замещенные тиазолопиримидиновые производные или их соли, применимые как иммуномодулирующее средство. Международные публикации WO 2009039321 и WO 2009039322 раскрывают бициклические гетероароматические N-замещенные глициновые производные, которые являются антагонистами HIFпролилгидроксилаз и применимы для лечения заболеваний, подобных анемии, оказывая влияние на ингибирование этих ферментов. Краткое описание настоящего изобретения В одном варианте осуществления настоящее изобретение обеспечивает новые соединения формулы их фармацевтически приемлемые соли и их изомеры, стереоизомеры, гдеR представляет собой водород, линейный или разветвленный (С 1-С 8)алкил(С 3-С 7)циклоалкил илиR1 и R2 независимо выбраны из водорода, линейного или разветвленного -(С 1-С 8)алкила, (С 6 С 10)арила, -СН 2-(С 6-С 10)арила и -СН 2-(С 5-С 14)гетероарила илиR вместе с либо R1, либо R2 сопряженного углеродного атома может формировать 3-6-членное моноциклическое (С 3-С 14)гетероциклическое кольцо;R3 и R3' в каждом местоположении независимо выбраны из водорода, линейного или разветвленного (С 1-С 8)алкила, (С 1-С 5)алкокси и галогена;R4 выбран из группы, включающей водород, линейный или разветвленный (С 1-С 8)алкил, (С 3 С 7)циклоалкил, (С 5-С 14)гетероарил, -(С 1-С 8)алкил-(С 6-С 10)арил, -(С 1-С 8)алкил-(С 5-С 14)гетероарил,-C(O)R8, -C(O)OR8, -C(O)NR8R9, -C(S)NR8R9 и -SO2R8, где арильный и гетероарильный радикалы необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей -(С 1 С 8)алкил, -(С 3-С 7)циклоалкил, -ОН, -(С 1-С 5)алкокси, галоген, CN, -CF3 и -OCF3;R5 и R6 независимо выбраны из группы, включающей водород, линейный или разветвленный (С 1 С 8)алкил, (С 3-С 7)циклоалкил, (С 6-С 10)арил, (С 5-С 14)гетероарил, фтор, -СООН и -NHCO-(С 6-С 10)арил;R7, R7' независимо выбраны из линейного или разветвленного (С 1-С 8)алкила, (С 3-С 7)циклоалкила иR7 и R7' вместе с атомом азота, к которому они присоединены, могут формировать 5-6-членное насыщенное и частично насыщенное кольцо; причем кольцо может содержать 1-3 гетероатома, выбранных из N, S и О;R8 выбран из группы, включающей линейный или разветвленный (С 1-С 8)алкил, (С 3-С 7)циклоалкил,-(С 1-С 8)алкил-(С 3-С 7)циклоалкил, (С 3-С 14)гетероциклил, (С 6-С 10)арил, -(С 1-С 8)алкил-(С 6-С 10)арил, -(С 1 С 2)алкил-(С 3-С 14)гетероциклил, гетероарил и -(С 1-С 8)алкил-(С 5-С 14)гетероарил, где арильный и гетероарильный радикалы являются необязательно замещенными одним или несколькими заместителями, выбранными из линейного или разветвленного (С 1-С 8)алкила, (С 3-С 7)циклоалкила, -(С 1-С 8)алкил-(С 3 С 7)циклоалкила, -(С 1-С 5)ОН, алкокси, галогена, -CN, -CF3, -OCF3 и -SO2-(С 1-С 8)алкила;R9 представляет собой водород или линейный или разветвленный (С 1-С 8)алкил. В другом варианте осуществления настоящее изобретение относится к соединению, как указано выше, однако только включая его фармацевтически приемлемые соли. В другом варианте осуществления настоящее изобретение включает синтетические промежуточные продукты, которые применяются при получении соединения формулы (I), и способ получения таких промежуточных продуктов. Другой вариант осуществления настоящего изобретения представляет собой способ получения соединения формулы (I), как описано в данном документе на схемах А-Е. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение формулы (I), необязательно в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Другой вариант осуществления настоящего изобретения представляет собой способ лечения анемии введением терапевтически эффективного количества соединения формулы (I) млекопитающим, нуждающимся в этом. Другой вариант осуществления настоящего изобретения представляет собой способ лечения анемии пожилых людей или анемии, связанной с состояниями, такими как хронические заболевания, почечная недостаточность, рак, инфекция, диализ, хирургическое вмешательство и химиотерапия, путем введения терапевтически эффективного количества соединения формулы (I) млекопитающим, нуждающимся в этом. Другой вариант осуществления настоящего изобретения представляет собой способ предотвращения или лечения повреждения тканей, вызванного почечной ишемией, сердечно-сосудистой ишемией,цереброваскулярной ишемией, печеночной ишемией или ишемией периферических сосудов, введением терапевтически эффективного количества соединения формулы (I) млекопитающим, нуждающимся в этом. Другой вариант осуществления настоящего изобретения представляет собой способ предотвращения или лечения повреждения тканей, вызванного ишемическими расстройствами, включая острое повреждение почек, инфаркт миокарда, инсульт, ишемически-реперфузионное повреждение печени и заболевания периферических сосудов, введением терапевтически эффективного количества соединения фор-3 020228 мулы (I) млекопитающим, нуждающимся в этом. Другой вариант осуществления настоящего изобретения представляет собой способ предотвращения или лечения повреждения тканей, вызванного ишемически-реперфузионным поражением при процедурах трансплантации органов, таких как печень или почка, введением терапевтически эффективного количества соединения формулы (I) млекопитающим, нуждающимся в этом. Другой вариант осуществления настоящего изобретения представляет собой применение соединения формулы (I) для приготовления лекарственного препарата для лечения анемии. Другой вариант осуществления настоящего изобретения представляет собой применение соединения формулы (I) для приготовления лекарственного препарата для лечения анемии пожилых людей или анемии, связанной с состояниями, такими как хронические заболевания, почечная недостаточность, рак,инфекция, диализ, хирургическое вмешательство и химиотерапия. Другой вариант осуществления настоящего изобретения представляет собой применение соединения формулы (I) для приготовления лекарственного препарата для предотвращения или лечения повреждения тканей, вызванного почечной ишемией, сердечно-сосудистой ишемией, цереброваскулярной ишемией, печеночной ишемией или ишемией периферических сосудов. Другой вариант осуществления настоящего изобретения представляет собой применение соединения формулы (I) для приготовления лекарственного препарата для предотвращения или лечения повреждения тканей, вызванного ишемическими расстройствами, включая острое повреждение почек, инфаркт миокарда, инсульт, ишемически-реперфузионное повреждение печени и заболевания периферических сосудов. Другой вариант осуществления настоящего изобретения представляет собой применение соединения формулы (I) для приготовления лекарственного препарата для предотвращения или лечения повреждения тканей, вызванного ишемически-реперфузионным поражением при процедурах трансплантации органов, таких как печень или почка. Детальное описание изобретения В одном варианте осуществления настоящее изобретение обеспечивает новые соединения формулы их фармацевтически приемлемые соли и их изомеры, стереоизомеры, гдеR, R1, R2, R3, R3', X, Y, Z, m, n и Р являются такими, как определено выше. Семейство специфических соединений исключительного интереса в пределах вышеприведенной формулы (I) содержит соединение и его фармацевтически приемлемые соли, такие как следующие. Определения Следующие определения применяются к выражениям, как используется всюду в этом описании, если иное не ограничивается специфическими случаями. Выражение "соединение", применяемое в настоящем документе, относится к любому соединению,охваченному общей формулой, раскрытой в настоящем документе. Соединения, описанные в настоящем документе, могут содержать одну или несколько двойных связей и, вследствие этого, существовать как изомеры, стереоизомеры, такие как геометрические изомеры, Е- и Z-изомеры, и могут иметь асимметричные атомы углерода (оптические центры) и поэтому существовать как энантиомеры, диастереоизомеры. Соответственно, химические структуры, описанные в настоящем документе, охватывают все возможные стереоизомеры показанных соединений, включая стереоизомерно чистую форму (например,геометрически чистую) и стереоизомерные смеси (рацематы). Соединение, описанное в настоящем документе, может существовать в виде конформационных изомеров, таких как форма "кресло" или "ванна". Соединения также могут существовать в нескольких таутомерных формах, включая енольную форму,кетоформу и их смеси. Соответственно, химические структуры, описанные в настоящем документе, охватывают все возможные таутомерные формы показанных соединений. Описанные соединения также включают изотопно-меченые соединения, где один или несколько атомов обладают атомной массой, отличной от атомной массы, традиционно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения настоящего изобретения, включают без ограничения 2 Н, 3 Н, 13 С, 14 С, 15N,18 О, 17 О. Соединения могут существовать в несольватированных формах, а также сольватированных формах, включая гидратированные формы. В основном, соединения могут быть гидратированными или сольватированными. Определенные соединения могут существовать во множественных кристаллических или аморфных формах. В основном, все физические формы являются эквивалентными для применений,предусмотренных в настоящем документе, и подразумеваются в рамках настоящего изобретения. Применение выражений в единственном числе в контексте описания настоящего изобретения (особенно в контексте следующих пунктов формулы) должно рассматриваться, как охватывающее и единственное число, и множественное, если в настоящем документе не указано иное, или нет явного противоречия контексту. К тому же должно быть понятно, что при изображении частичных структур соединения, тире ("-") указывает точку присоединения частичной структуры к остальной молекуле. Номенклатура соединений настоящего изобретения, как указано в настоящем документе, находится в соответствии с ISIS draw (версия 2.2) от MDLACD/Labs Pro-version 12.0."Фармацевтически приемлемая соль" относится к соли соединения, которое обладает желаемой фармакологической активностью исходного соединения. Такие соли включают: (1) соли присоединения кислоты, образованные с неорганическими кислотами, такими как соляная кислота, бромисто- 16020228 водородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.п.; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, изомасляная кислота, капроновая кислота, циклопентанпропионовая кислота, щавелевая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, пробковая кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота,бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, фталевая кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота,2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2 нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4 метилбицикло[2,2,2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глюкуроновая кислота, галактуроновая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образованные при замещении кислотного протона, присутствующего в исходном соединении, ионом металла, например щелочного металла, щелочно-земельного металла или алюминия; или координаты с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п. Также включены соли аминокислот, такие как аргинат и т.п. (см., например, Berge, S.M., et al., "Pharmaceutical Salts",Journal of Pharmaceutical Science, 1977, 66, 1-19). Настоящее изобретение также включает соединения в форме пролекарств. Пролекарства соединений, описанных в настоящем документе, представляют собой те соединения, которые легко подвергаются химическим изменениям при физиологических условиях (in vivo) для обеспечения соединения настоящего изобретения. Дополнительно, пролекарства могут быть превращены в соединения настоящего изобретения химическими или биохимическими способами в ex vivo среде, например, резервуаре трансдермального пластыря с подходящим ферментом или химическим веществом. Пролекарства в некоторых ситуациях легче ввести, чем исходное лекарственное средство. Они могут, например, переходить в биологически доступную форму при пероральном введении, тогда как исходное лекарственное средство не может. Пролекарство также может иметь улучшенную растворимость в фармакологической композиции по сравнению с исходным лекарственным средством. Сложные эфиры, пептидильные производные и т.п. соединений являются примерами пролекарств настоящего изобретения. In vivo гидролизуемый (или легко расщепляемый) сложный эфир соединения настоящего изобретения, содержащий карбоксигруппу,представляет собой, например, фармацевтически приемлемый сложный эфир, который гидролизуется в теле человека или животного, производя исходную кислоту. Выражение "замещенный", как используется в настоящем документе, включает моно- и полизамещение указанным заместителем в пределах, в которых такое единичное и множественное замещение(включая множественное замещение на одном и том же сайте) химически позволено и означает, что любой один или несколько водородов на обозначенном атоме замещаются с выбором из указанной группы,при условии, что нормальная валентность обозначенного атома не превышается, и что такое замещение приводит к стабильному соединению, например, когда заместитель является кетоном, то замещаются два водорода на атоме. Все заместители (R, R1, R2) и их дополнительные заместители, описанные в настоящем документе, могут присоединяться к основной структуре при любом гетероатоме или атоме углерода, что приводит к образованию стабильного соединения. Как используется в настоящем документе, "галоген" или "галогеновый" заместитель представляет собой моновалентный галогеновый радикал, выбранный из хлора, брома, йода и фтора. Выражение "алкил", используемое или отдельно, или в соединении с другой группой, относится к насыщенному алифатическому углеводородному радикалу, имеющему указанное число атомов углерода,и который является незамещенным или замещенным. При использовании нижнего индекса со ссылкой на алкил, нижний индекс относится к числу атомов углерода, которое эта группа может содержать. Например, "С 1-С 6" относится к любой алкильной группе, содержащей от одного до шести углеродов в структуре. Алкил может быть с прямой цепью, разветвленной цепью или циклическим. Указанный алкил может быть необязательно замещен заместителями в положениях, которые не препятствуют существенно получению соединений, попадающих в объем настоящего изобретения. Указанный алкил является необязательно замещенным одним-двумя заместителями, независимо выбранными из группы, включающей С 1-3 алкокси, амино, моно(С 1-3 алкил)амино, ди(С 1-3 алкил)амино, С 1-3 алкил и гидрокси. Выражение "алкокси" относится к любой алкильной группе, как определено в настоящем документе выше, присоединенной к исходному молекулярному фрагменту через кислородный мостик. Выражение "арил" относится к ароматической группе, например, которая представляет собой 6-10 членную моноциклическую или бициклическую углеродсодержащую кольцевую систему, которая может быть незамещенной или замещенной. Выражение "гетероарил" относится к ароматической группе, например, которая представляет собой 5-14-членную моноциклическую или бициклическую кольцевую систему, имеющую по меньшей мере один гетероатом, который может быть незамещенным или замещенным. Выражение "гетероатом", как используется в настоящем документе, включает кислород, серу и азот. Выражение "гетероциклил" относится к полностью или частично насыщенной циклической группе,например, которая представляет собой 3-14-членную моноциклическую или бициклическую кольцевую систему, имеющую по меньшей мере один гетероатом, который может быть незамещенным или замещенным. Выражение "гетероатом", как используется в настоящем документе, включает кислород, серу и азот. Как используется в настоящем документе, "комнатная температура" относится к температуре между 25 и 35 С. Как используется в настоящем документе, выражение "млекопитающие" означает человека или животное, такое как обезьяны, приматы, собаки, кошки, лошади, коровы и т.п. Выражения "курс лечения" или "лечение" любого заболевания или расстройства, как используется в настоящем документе, означает введение соединения млекопитающему, нуждающемуся в этом. Соединение может вводиться, тем самым обеспечивая профилактический эффект в смысле абсолютного или частичного предупреждения или отсрочивания проявления заболевания или расстройства, или их признака, или их симптома; и/или соединение может вводиться, тем самым обеспечивая частичное или полное лечение заболевания или расстройства и/или вредного эффекта, присущего расстройству. Фраза "терапевтически эффективное количество" означает количество соединения, которое при введении пациенту для лечения заболевания достаточно для воздействия такого лечения на заболевание."Терапевтически эффективное количество" будет меняться в зависимости от соединения, способа введения, заболевания и его тяжести, а также возраста, веса и т.д. пациента, подлежащего лечению. Во всем данном описании и прилагаемой формуле изобретения подразумевается, что слова "содержать" и "включать" и вариации, такие как "содержит", "содержащий", "включает", "включая" должны интерпретироваться в значении "включительно", если контекст не требует иного. Т.е. применение этих слов может означать включение элемента или элементов, специально не перечисленных. Неожиданным было обнаружить, что частично насыщенные трициклические соединения, содержащие один или несколько гетероатомов, проявляют лучший профиль активности in vitro. В другом варианте осуществления настоящее изобретение представляет собой способ получения соединения формулы (I). Следующие схемы реакций даются для того, чтобы раскрыть синтез соединения в соответствии с настоящим изобретением. Следовательно, соединения формулы (I) настоящего изобретения могут быть приготовлены, как описано в схемах ниже. Формула (I) включает, но без ограничения, соединения формул (Ia), (Ib), (Ic), (Id), (Ie) (If), (Ig), (Ih),(Ii), (Ij) и (Ik); соединение формулы (Ia) включает, но без ограничения, соединения формул (Ia-1) и (Ia-2); соединение формулы (Ic) включает, но без ограничения, соединения формул (Ic-1), (Ic-2) и (Ic-3); соединение формулы (Id) включает, но без ограничения, соединения формул (Id-1) и (Id-2). Соединение формул (Ia-Ik), относящееся к общей формуле (I), может быть получено следующими способами, описанными на схемах А, В, С, D и Е. Схема А Соединения, относящиеся к общей формуле (I), такие как соединение формул (Ia), (Ib), (Ic) и (Id),можно синтезировать из соединения формул (III) и (IV), как показано на схеме А, где R, R1, R2, R3, R3', Z,m и n являются такими, как определено выше, тогда как Y и R4 определены на схеме А. Как правило, соединение формулы (Ia) может быть получено при реакции соединения формулы (III) с различными сложными аминоэфирами, имеющими следующую общую формулу: где n, R, R1, R2 являются такими, как определено выше,с использованием подходящего связывающего реагента, такого как карбодиимиды, CDI (1,1'карбонилдиимидазол) или РуВор (бензотриазол-1-ил-окситрипирролидинофосфония гексафторфосфат),в присутствии основания, например третичного амина, такого как триэтиламин, и в апротонном растворителе, таком как тетрагидрофуран, дихлорметан и т.д. Соединение формулы (Ib) может быть получено окислением соединения формулы (Ia) подходящим окисляющим реагентом, таким как перкислота или перекись водорода, в растворителе, таком как диоксан, тетрагидрофуран или дихлорметан, при комнатной температуре в течение 2-6 ч. Соединение формулы (Ib) после щелочного гидролиза в присутствии основания, включая гидроксид щелочного металла,например гидроксид натрия, и в инертном растворителе, например тетрагидрофуране, воде или их смеси,обеспечивает соединение формулы (Ic). Соединение формулы (III) может быть получено нагреванием соответствующих аминов формулы(II) с 5-(бис-этилсульфанил-метилен)-2,2-диметил-[1,3]диоксан-4,6-дионом в подходящем растворителе,таком как спиртовой растворитель или диметилформамид, при 80-85 С в течение 2-24 ч. Соединение формулы (Id) может быть получено взаимодействием соединения формулы (IV) с различными сложными аминоэфирами, имеющими следующую общую формулу: где n, R, R1, R2 являются такими, как определено выше,в подходящем растворителе и основании, таком как пиридин, при 100-110 С в течение 2-6 ч. Соединение формулы (Ic) также может быть получено щелочным гидролизом соединения формулы(Id) в присутствии основания, включая гидроксид щелочного металла, например гидроксид натрия, и в инертном растворителе, например тетрагидрофуране, воде или их смеси. Соединение формулы (IV) может быть получено взаимодействием соответствующих аминов формулы (II) с триэтилметантрикарбоксилатом в подходящем растворителе, таком как ксилол, толуол или бромбензол, при повышенной температуре. Соединение формулы (II), такое как тиазол-2-амины (Z представляет собой S) или оксазол-2-амины(Z представляет собой О), является или синтезированным с использованием описанного в литературе способа (патентные документы US 2006/0252837, US 4423048 и J. Med. Chemistry, 2002, 45(23), 50905097), или коммерчески доступным. Схема В Несколько N-незамещенных и N-замещенных производных, относящихся к формуле (I), таких как соединения формул (Ie), (Ia-2) и (Ic-1), могут быть приготовлены из соединения формулы (Ia-1), как показано на схеме В, где R, R1, R2, R3, R3', R4, R8, R9, m и n являются такими, как определено выше. Соединение формулы (Ic-1) может быть получено окислением соединения формулы (Ia-2) перкислотой или перекисью водорода в растворителе, например тетрагидрофуране или дихлорметане, при комнатной температуре в течение 2-6 ч, с последующим основным гидролизом в присутствии основания,включая гидроксид щелочного металла, например гидроксид натрия, и в инертном растворителе, например тетрагидрофуране, воде или их смеси, при комнатной температуре в течение 2-6 ч. Соединение формулы (Ia-2) может быть получено введением различных R4-групп в соединение формулы (Ie) путем реагирования его с подходящими реагентами, такими как сульфонил хлориды, карбонил хлориды, хлороформиаты, изоцианаты, карбамоил хлориды, изотиоцианаты и карбамотиохлориды, в присутствии органического основания, например триэтиламина, пиридина или N-метилморфолина,и в растворителе, например тетрагидрофуране, дихлорметане или их смеси, при комнатной температуре в течение 2-8 ч. Соединение формулы (Ie) может быть получено снятием защиты Вос-группы в соединениях формулы (Ia-1) с использованием кислотных реагентов, таких как трихлоруксусная кислота, в инертном растворителе, таком как тетрагидрофуран или дихлорметан, при комнатной температуре в течение 2-6 ч. Соединение формулы (Ia-1) может быть получено из соединения формулы (III), как описано на схеме А. Схема С В альтернативном способе различные N-незамещенные и N-замещенные производные, относящиеся к формуле (I), такие как соединения формул (If), (Id-2) и (Ic-3), могут быть приготовлены из соединения формулы (Id-1) или (1 с-2), как показано на схеме С, где R, R1, R2, R3, R3', R4, m и n являются такими, как определено выше. Соединение формулы (Ic-3) может быть получено щелочным гидролизом соединения формулы (Id2) в присутствии основания, включая гидроксид щелочного металла, например гидроксида натрия, и в инертном растворителе, например тетрагидрофуране, воде или их смеси, при комнатной температуре в течение 2-6 ч. Соединение формулы (Id-2) может быть получено введением различных R4-групп при азоте соединения формулы (If) путем реагирования с R4-галогеном, где R4 представляет собой -СН 2-арил, в присутствии подходящего основания, например триэтиламина, пиридина или N-метилморфолина, и растворителя, такого как дихлорметан или тетрагидрофуран, при комнатной температуре в течение 5-12 ч. Соединения формулы (If) можно получить эстерификацией соединения формулы (Ic-2) с этанолом в присутствии карбодиимида с последующим удалением Вос-группы, используя кислотный реагент, например трифторуксусную кислоту, в инертном растворителе, например тетрагидрофуране или дихлорметане. В альтернативном способе соединение формулы (If) может быть получено снятием защиты Восгруппы с соединения формулы (Id-1), используя подобные условия, как описано на схеме В. Схема D Различные соединения формулы (I), такие как соединения формул (Ig), (Ih) (Ii) и (Ij), могут быть приготовлены из соединения формулы (Ia) или (Ib), как показано в схеме D, где R, R1, R2, R3, R3', R7,R7',Y, z, m и n являются такими, как определено выше. Соединение формулы (Ih) может быть получено реакцией соединения формулы (Ig) с соответствующим амином, используя связывающий реагент, такой как карбодиимиды, CDI или РуВор. Соединение формулы (Ij) может быть получено щелочным гидролизом соединения формулы (Ii) в присутствии основания, включая гидроксид щелочного металла, например гидроксид натрия, и в инертном растворителе, например тетрагидрофуране, воде или их смеси. Соединение формулы (Ii) может быть получено реакцией соединения формулы (Ib) с алкологолятом натрия, таким как этилат натрия, в подходящем растворителе, таком как тетрагидрофуран, при комнат- 20020228 ной температуре. Соединение формулы (Ig) может быть получено щелочным гидролизом соединения формулы (Ia). Схема Е Различные соединения формулы (I), такие как соединения формулы (Ik), могут быть получены, как показано на схеме Е, где R, R1, R2, R3, R3', Y, z, m и n являются такими, как определено выше. Соединения, относящиеся к формуле (Ik), где Р представляет собой -NH2, -NHR7, -NR7R7', NHOH и NHOR7, можно получить взаимодействием формулы (Ic) с соответствующим амином в подходящем состоянии, как,например, используя связывающий реагент, такой как карбодиимиды, в подходящем апротонном растворителе. Кроме того, соединения, относящиеся к формуле (I), где Р представляет собой NHSO2R7 и NHCOR7,можно получить взаимодействием формулы (IV), или (III), или (Ic) с подходящими реагентами и условиями. Общий способ синтеза предусматривается для каждой из раскрытых групп химических соединений. Специалист в данной области поймет, как заместить соответствующим образом модифицированный исходный материал, содержащий различные заместители. Специалист в данной области без труда синтезирует соединения, раскрытые в настоящем изобретении, используя общепринятые техники органического синтеза и микроволновые техники, из исходного материала, который или приобретают, или без труда можно получить, используя способы предшествующего уровня техники. Соединения настоящего изобретения могут иметь хиральные центры и встречаться в виде рацематов, рацемической смеси и в виде индивидуальных диастереомеров или энантиомеров со всеми изомерными формами, включенными в настоящее изобретение. Следовательно, если соединение хиральное,отдельные энантиомеры, в значительной степени не содержащие другие, включены в объем настоящего изобретения; кроме того, включены все смеси двух энантиомеров. Новые соединения настоящего изобретения, однако, не следует рассматривать, как формирующие единственный род объектов, рассматривающийся как настоящее изобретение, и любая комбинация соединений или их фрагментов может сама формировать род объектов. Новые соединения настоящего изобретения были получены согласно процедуре схем, как описано в настоящем документе выше, с использованием соответствующих материалов, и далее представлены с помощью следующих конкретных примеров. Примеры не рассматриваются и не считаются ограничивающими объем изложенного изобретения. Примеры Пример 1. Получение [(2-гидрокси-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а-диаза-флуорен-3 карбонил)-амино]-уксусной кислоты (соединение 1) Этап 1. Синтез 2-метилсульфанил-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а-диаза-флуорен-3 карбоновой кислоты. Суспензию 4,5,6,7-тетрагидро-бензотиазол-2-ил-амина (8 г, 0,0519 моль) и 5-(бис-этилсульфанилметилен)-2,2-диметил-[1,3]диоксан-4,6-диона (14,2 г, 0,0572 моль) в этаноле (60 мл) нагревали при 8590 С в течение 10 ч. Реакционную смесь охладили до комнатной температуры и профильтровали. Полученное таким образом твердое вещество промыли этанолом (20 мл) и затем диэтиловым эфиром (50 мл) и высушили с отсасыванием с получением 7,2 г названного соединения в виде твердого вещества. 1 Н-ЯМР (400 МГц, DMSO-d6):13,55 (1H, s), 3,30-3,34 (2 Н, m), 2,68-2,72 (2 Н, m), 2,48 (3 Н, s), 1,881,92 (4 Н, m).ESMS (масс-спектрометрия с электрораспылением): 296,9 (М 1). Этап 2. Синтез [(2-метилсульфанил-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а-диаза-флуорен-3 карбонил)-амино]-уксусной кислоты этилового сложного эфира. К раствору кислого соединения, которое получено на этапе 1, (7,0 г, 0,0236 моль) в дихлорметане(250 мл) добавили триэтиламин (9,85 мл, 0,070 моль) и этилового сложного эфира глицина гидрохлорид(4,93 г, 0,0354 моль) при комнатной температуре. К реакционной смеси добавили 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид (6,81 г, 0,0354 моль) при 10-15 С порциями и обеспечили перемешивание при комнатной температуре в течение 14 ч. Дихлорметан отогнали под ва- 21020228 куумом. К остатку добавили воду (200 мл) и перемешивали 15 мин. Появившееся при этом твердое вещество отфильтровали и промыли водой. Затем его суспендировали в смеси этилацетата (20 мл) и диэтилового эфира (30 мл) и отфильтровали. Полученное таким образом твердое вещество высушили с отсасыванием с получением 6,2 г названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):9,78 (1H, bs), 4,18-4,25 (4 Н, m), 3,31-3,36 (2 Н, m), 2,64-2,69 (2 Н, m),2,43 (3 Н, s), 1,85-1,90 (4 Н, m), 1,28 (3 Н, t).ESMS: 382 (M1). Этап 3. Синтез [(2-метансульфонил-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а-диаза-флуорен-3 карбонил)-амино]-уксусной кислоты этилового сложного эфира. К охлажденному раствору сложноэфирного соединения, которое получено на этапе 2, (6,0 г, 0,0157 моль) в дихлорметане (60 мл) добавили раствор м-хлорпербензойной кислоты (50-60%, 8,13 г) в дихлорметане (80 мл) при 5-10 С и перемешивали при той же температуре в течение 1 ч. Реакционную смесь разделили между дихлорметаном и водой. Собранный органический слой промыли бикарбонатом натрия, высушили над сульфатом натрия и отогнали под вакуумом с получением неочищенного остатка,который очистили колоночной хроматографией с использованием 1% метанола-дихлорметана. Собранные фракции выпарили с получением 2,5 г названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):7,42 (1 Н, bs), 4,18-4,27 (4H, m), 3,36-3,37 (2 Н, m), 3,33 (3 Н, s), 2,72-2,76ESMS: 413,9 (M1). Этап 4. Синтез [(2-гидрокси-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а-диаза-флуорен-3-карбонил)амино]-уксусной кислоты. К раствору сульфонового производного, которое получено на этапе 3, (2,5 г, 0,006 моль) в тетрагидрофуране добавили раствор гидроксида натрия (0,75 г, 0,0187 моль) в воде (15 мл) и перемешивали при комнатной температуре в течение 4 ч. Тетрагидрофуран отогнали под вакуумом и оставшийся раствор окислили 1 н. соляной кислотой и перемешивали в течение 30 мин. Появившееся при этом твердое вещество отфильтровали, промыли этилацетатом (25 мл) и сушили под вакуумом при 60 С в течение 8 ч с получением 1,45 г названного соединения в виде твердого вещества. 1 Этап 1. Синтез 2-метилсульфанил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбоновой кислоты. Названное соединение получали из 5,6,7,8-тетрагидро-4 Н-циклогептатиазол-2-ил-амина, используя аналогичный способ, как описано для этапа 1 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):3,56-3,59 (2 Н, m), 2,82-2,85 (2 Н, m), 2,42 (3 Н, s), 1,70-1,83 (6 Н, m).[(2-метилсульфанил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбонил)-амино]-уксусной кислоты этилового сложного эфира. Названное соединение получали, используя аналогичный способ, как описано для этапа 2 примера 1. 1 Н-ЯМР (400 МГц, CDCl3):9,78 (1H, bs), 4,19-4,25 (4 Н, m), 3,66-3,69 (2H, m), 2,72-2,75 (2 Н, m),2,42 (3 Н, s), 1,73-1,89 (6 Н, m), 1,27 (3 Н, t).[(2-метансульфонил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбонил)-амино]-уксусной кислоты этилового сложного эфира. К охлажденному раствору соединения, которое получено на этапе 2, (3,0 г, 0,0076 моль) в дихлорметане (60 мл) добавили раствор м-хлорнадбензойной кислоты (50-60%, 4,50 г) в дихлорметане (60 мл) при 5-10 С и перемешивали при той же температура в течение 3 ч. К реакционной смеси добавили дихлорметан (100 мл) и разделили между дихлорметаном и водой. Органический слой промыли бикарбонатом натрия, высушили над сульфатом натрия и отогнали под вакуумом с получением неочищенного остатка, который перемешали в диэтиловом эфире (100 мл). Полученное при этом твердое вещество собрали фильтрацией и сушили с отсасыванием с получением 2,5 г названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):7,36 (1 Н, bs), 4,19-4,27 (4 Н, m), 3,68-3,71 (2 Н, m), 3,33 (3 Н, s), 2,80-2,83ESMS: 428 (М 1). Этап 4. Синтез [(2-гидрокси-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диаза-бензо[а]азулен-3 карбонил)-амино]-уксусной кислоты. Названное соединение получали, используя аналогичный способ, как описано для этапа 4 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):16,2 (1H, bs), 9,74 (1H, t), 4,06 (2 Н, d), 3,55-3,60 (2 Н, m), 2,75-2,80ESMS: 335,9 (M+-1). ИК (KBr, СМ-1): 3268,2, 1739,6, 1674,6. Пример 3. Получение 3-(карбоксиметил-карбамоил)-2-гидрокси-4-оксо-5,8-дигидро-4 Н,6 Н-9-тиа 1,4 а,7-триаза-флуорен-7-карбоновой кислоты этилового сложного эфира (соединение 2) Этап 1. Синтез 2-метилсульфанил-4-оксо-5,8-дигидро-4 Н,6 Н-9-тиа-1,4 а,7-триаза-флуорен-3,7 дикарбоновой кислоты 7-этилового сложного эфира. Названное соединение получали из 2-амино-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-карбоновой кислоты этилового сложного эфира, используя аналогичный способ, как описано для этапа 1 примера 1 1 Н-ЯМР (400 МГц, DMSO-d6):13,52 (1H, s), 4,60 (2 Н, bs), 4,09 (2 Н, q), 3,69 (2 Н, bs), 3,27 (2 Н, bs),2,43 (3 Н, s), 1,22 (3 Н, t).ESMS: 370,1 (М 1). Этап 2. Синтез 3-(этоксикарбонилметил-карбамоил)-2-метилсульфанил-4-оксо-5,8-дигидро-4 Н,6 Н 9-тиа-1,4 а,7-триаза-флуорен-7-карбоновой кислоты этилового сложного эфира. Названное соединение получали, используя аналогичный способ, как описано для этапа 2 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):9,50 (1H, t), 4,58 (2 Н, bs), 4,03-4,15 (6 Н, m), 3,67 (2 Н, t), 3,24-3,34(2 Н, частично перекрыт сигналом воды), 2,34 (3 Н, s), 1,18-1,23 (6 Н, m).ESMS: 455,2 (М 1). Этап 3. Синтез 3-(этоксикарбонилметил-карбамоил)-2-метансульфонил-4-оксо-5,8-дигидро-4 Н,6 Н 9-тиа-1,4 а,7-триаза-флуорен-7-карбоновой кислоты этилового сложного эфира. Названное соединение получали, используя аналогичный способ, как описано для этапа 3 примера 2. 1 Н-ЯМР (400 МГц, DMSO-d6):8,59 (1H, t), 4,62-4,68 (2 Н, m), 4,02-4,15 (4 Н, m), 3,97 (2 Н, d), 3,653,70 (2 Н, m), 3,34 (2 Н, скрыт под сигналом воды), 3,23 (3 Н, s), 1,18-1,28 (6 Н, m).ESMS: 487,2 (М 1). Этап 4. Синтез 3-(карбоксиметил-карбамоил)-2-гидрокси-4-оксо-5,8-дигидро-4 Н,6 Н-9-тиа-1,4 а,7 триаза-флуорен-7-карбоновой кислоты этилового сложного эфира. Названное соединение получали, используя аналогичный способ, как описано для этапа 4 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):16,24 (1 Н, s), 12,9 (1H, bs), 9,66 (1H, t), 4,55 (2H, bs), 4,07-4,11 (4H,m), 3,67 (2H, t), 3,23-3,35 (2H, частично перекрыт сигналом воды), 1,21 (3 Н, t). Этап 1. Синтез (5-(5-трифторметил-пиридин-2-ил)-4,5,6,7-тетрагидро-тиазоло[5,4-с]пиридин-2 иламина). Смесь 1-(5-трифторметил-пиридин-2-ил)-пиперидин-4-она (9,9 г, 0,0405 моль), пирролидина (3,53 мл, 0,0445 моль) и п-толуолсульфоновой кислоты (100 мг) в циклогексане (50 мл) кипятили с обратным холодильником в течение 3 ч и удалили воду аппаратом Дина-Старка. Полученную смесь концентрировали под пониженным давлением и остаток растворили в метаноле (100 мл). К раствору добавили порошок серы (1,05 г, 0,0405 моль) и цинамид (1,37 г, 0,0405 моль) и перемешивали при комнатной температуре в течение ночи. Полученное твердое вещество собрали фильтрацией и промыли метанолом (10 мл) с получением 6,0 г названного соединения.ESMS: 301 (М 1). Этап 2. Синтез 2-гидрокси-4-оксо-7-(5-трифторметил-пиридин-2-ил)-5,6,7,8-тетрагидро-4 Н-9-тиа 1,4 а,7-триаза-флуорен-3-карбоновой кислоты этилового сложного эфира. Смесь 5-(5-трифторметил-пиридин-2-ил)-4,5,6,7-тетрагидро-тиазоло[5,4-с]пиридин-2-иламина (5,7 г, 0,019 моль) и триэтилметантрикарбоксилата (16,1 мл, 0,076 моль) в ксилоле (100 мл) нагревали при 140-150 С в течение 6 ч. Ксилол выпарили, затем добавили диэтиловый эфир и суспензию перемешивали в течение 15 мин. Ее отфильтровали и промыли эфиром. Неочищенное твердое вещество обработали дихлорметаном (200 мл) и отфильтровали для удаления нерастворимого остатка. Дихлорметановый слой отогнали под вакуумом с получением 1,3 г названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):13,96 (1H, s), 8,44 (1H, s), 7,72 (1H, dd), 6,79 (1H, d), 4,80 (2 Н, s), 4,47ESMS: 440,9 (M1). Этап 3. Синтез [2-гидрокси-4-оксо-7-(5-трифторметил-пиридин-2-ил)-5,6,7,8-тетрагидро-4 Н-9-тиа 1,4 а,7-триаза-флуорен-3-карбонил]-амино-уксусной кислоты этилового сложного эфира. Смесь соединения, которое получено на этапе 2, (1,2 г, 0,0272 моль) с этиловым сложным эфиром глицина гидрохлоридом (0,42 г, 0,0030 моль) нагревали в сухом пиридине (10 мл) при 100 С в течение 5 ч. Пиридин выпарили досуха и остаток перемешали в диэтиловом эфире (50 мл). Полученное при этом твердое вещество собрали фильтрацией и промыли этанолом (10 мл) и диэтиловым эфиром (10 мл). Его высушили с отсасыванием с получением 260 мг названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):15,99 (1H, s), 9,74 (1H, t), 8,45 (1H, s), 7,72 (1H, dd), 6,79 (1 Н, d), 4,80ESMS: 498 (M1). Этап 4. Синтез [2-гидрокси-4-оксо-7-(5-трифторметил-пиридин-2-ил)-5,6,7,8-тетрагидро-4 Н-9-тиа 1,4 а,7-триаза-флуорен-3-карбонил]-амино-уксусной кислоты. Названное соединение получали, используя аналогичный способ, как описано для этапа 4 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):9,67 (1H, t), 8,48 (1H, s), 7,91 (1H, dd), 7,14 (1H, d), 4,85 (2 Н, s), 4,07(2 Н, d), 4,01 (2H, t), 3,34 (2 Н, скрыт под сигналом воды). Этап 1. Синтез 2-метилсульфанил-4-оксо-5,8-дигидро-4 Н,6 Н-9-тиа-1,4 а,7-триаза-флуорен-3,7 дикарбоновой кислоты 7-трет-бутилового сложного эфира. Названное соединение получали из 2-амино-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-карбоновой кислоты трет-бутилового сложного эфира, используя аналогичный способ, как описано для этапа 1 примера 1. 1 Н-ЯМР (400 МГц, CDCl3):13,38 (1H, bs), 4,56 (2 Н, bs), 3,76 (2 Н, t), 3,42 (2 Н, bs), 2,49 (3 Н, s), 1,50ESMS: 398,2 (M1). Этап 2. Синтез 3-(этоксикарбонилметил-карбамоил)-2-метилсульфанил-4-оксо-5,8-дигидро-4 Н,6 Н 9-тиа-1,4 а,7-триаза-флуорен-7-карбоновой кислоты трет-бутилового сложного эфира. Названное соединение получали, используя аналогичный способ, как описано для этапа 2 примера 1. 1 Н-ЯМР (400 МГц, CDCl3):9,71 (1H, t), 4,52 (2 Н, bs), 4,18-4,25 (4 Н, m), 3,72 (2 Н, t) 3,37-3,44 (2 Н,m), 2,43 (3 Н, s), 1,50 (9 Н, s), 1,27 (3 Н, t).ESMS: 483,2 (M1). Этап 3. Синтез [(2-метилсульфанил-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа-1,4 а,7-триаза-флуорен-3 карбонил)-амино]-уксусной кислоты этилового сложного эфира. К раствору N-Boc производного, которое получено на этапе 2, (19,0 г, 0,0394 моль) в дихлорметане(60 мл) добавили трифторуксусную кислоту (60 мл) в течение получаса при 0-5 С и перемешивали при комнатной температуре в течение 4 ч. Растворитель отогнали под вакуумом и добавили воду (100 мл). Его подщелачивали раствором бикарбоната натрия и полученное твердое вещество собрали фильтрацией. Твердое вещество далее промыли диэтиловым эфиром (50 мл) и высушили под вакуумом при 60 С вESMS: 382,9 (М 1). Этап 4. Синтез [7-(5-хлор-тиофен-2-сульфонил)-2-метилсульфанил-4-оксо-5,6,7,8-тетрагидро-4 Н 9-тиа-1,4 а,7-триаза-флуорен-3-карбонил]-амино-уксусной кислоты этиловый сложный эфир. К смеси аминового производного, которое получено на этапе 3, (1,0 г, 0,0026 моль) и пиридина(0,31 мл, 0,0039 моль) в дихлорметане добавили раствор 5-хлор-тиофен-2-сульфонил хлорида (0,62 г,0,00287 моль) в дихлорметане (5 мл) при 0-5 С и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь влили в воду (50 мл) и экстрагировали дихлорметаном (50 мл 2). Комбинированный органический слой высушили над сульфатом натрия и отогнали под вакуумом для получения твердого вещества, которое суспендировали в этилацетате (10 мл). Его профильтровали и высушили с отсасыванием с получением 980 мг названного соединения. 1 Н-ЯМР (400 МГц, DMSO-d6):9,42-9,48 (1H, m), 7,68 (1H, d), 7,39 (1H, d), 4,32-4,36 (2 Н, m), 4,024,13 (4 Н, m), 3,38-3,51 (4 Н, скрыт под сигналом воды), 2,34-2,36 (3 Н, m), 1,15-1,22 (3 Н, m).ESMS: 564,8 (М 1). Этап 5. [7-(5-Хлор-тиофен-2-сульфонил)-2-метансульфонил-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа 1,4 а,7-триаза-флуорен-3-карбонил]-амино-уксусной кислоты этиловый сложный эфир. К охлажденному раствору соединения, которое получено на этапе 4, (950 мг, 0,0017 моль) в дихлорметане (20 мл) добавили раствор м-хлорпербензойной кислоты (50-60%, 0,72 г) в дихлорметане (30 мл) при 5-10 С и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь влили в воду (100 мл) и экстрагировали дихлорметаном (50 мл 2). Органический слой промыли бикарбонатом натрия, высушили над сульфатом натрия и отогнали под вакуумом с получением 800 мг неочищенного твердого вещества, которое использовали в следующем этапе без очистки. Этап 6. Синтез [7-(5-хлор-тиофен-2-сульфонил)-2-гидрокси-4-оксо-5,6,7,8-тетрагидро-4 Н-9-тиа 1,4 а,7-триаза-флуорен-3-карбонил]-амино-уксусной кислоты. К смеси соединений, которые получены на этапе 5, (0,8 г, 0,0013 моль) в тетрагидрофуране (20 мл) добавили раствор гидроксида натрия (160 мг, 0,004 моль) в воде (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель отогнали под вакуумом, оставшуюся массу окислили разбавленной соляной кислотой, появившийся осадок собрали фильтрацией и промыли диэтиловым эфиром (40 мл). Твердое вещество высушили под вакуумом с получением 220 мг названного соединения. 1 Н-ЯМР (400 МГц, DMSO-d6):16,28 (1H, s), 12,9 (1H, bs), 9,64 (1 Н, t), 7,65 (1H, d), 7,39 (1 Н, d),4,30-4,40 (2 Н, m), 4,08 (2 Н, d), 3,40-3,50 (2 Н, m), 3,34 (2 Н, спрятан под сигналом воды).[(2-метилсульфанил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбонил)-амино]-уксусной кислоты. Названное соединение получали, используя аналогичные условия гидролиза, как описано для этапа 4 примера 1, начиная с [(2-метилсульфанил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбонил)-амино]-уксусной кислоты этилового сложного эфира (этап 2 примера 2). 1 Н-ЯМР (400 МГц, DMSO-d6):9,50 (1H, t), 3,97 (2 Н, d), 3,58-3,61 (2 Н, m), 2,79-2,81 (2 Н, m), 2,32ESMS: 368,1 (M1). Этап 2. Синтез 2-метилсульфанил-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбоновой кислоты (2-оксо-2-пирролидин-1-ил-этил)-амида. К перемешанному раствору соединения, полученного на этапе 1, (1,0 г, 0,0027 моль) в дихлорметане (20 мл) добавили триэтиламин (1,13 мл, 0,0082 моль) и пирролидин (0,29 г, 0,0040 моль). К реакционной смеси добавили 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,78 г, 0,0040 моль) и перемешивали при комнатной температуре в течение 12 ч. Органический слой промыли 1 н. соляной кислотой (50 мл) и раствором бикарбоната натрия. Органический растворитель отогнали для получения твердого вещества, который перемешали в метаноле (20 мл), отфильтровали и высушили с отсасыванием с получением 0,35 г названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):10,07 (1H, bs), 4,18 (2 Н, d), 3,69-3,71 (2 Н, m), 3,53 (2H, t), 3,42 (2H, t),- 25020228 Этап 1. Синтез [(2-этокси-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диаза-бензо[а]азулен-3 карбонил)-амино]-уксусной кислоты этилового сложного эфира. Смесь соединения, полученного на этапе 3 примера 2, (1,00 г, 0,0023 моль) и этилат натрия (0,318 г,0,0046 моль) в этаноле (20 мл) перемешивали при 80 С в течение 15 мин и затем 10 ч при комнатной температуре. Реакционную смесь вылили в 1 н. HCl и экстрагировали этилацетатом (50 мл 2). Этилацетат отогнали и неочищенный остаток очистили с использованием 20% этилацетата в гексане. Фракции отогнали с получением 150 мг названного соединения. 1 Н-ЯМР (400 МГц, CDCl3):9,20 (1H, t), 4,49 (2 Н, q), 4,18-4,24 (4 Н, m), 3,65-3,68 (2 Н, m), 2,70-2,73ESMS: 394,1 (М 1). Этап 2. Синтез [(2-этокси-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диаза-бензо[а]азулен-3 карбонил)-амино]-уксусной кислоты. Названное соединение получали, используя аналогичные условия гидролиза, как описано для этапа 4 примера 1. 1 Н-ЯМР (400 МГц, DMSO-d6):12,50 (1H, bs), 8,61 (1H, t), 4,34 (2 Н, q), 3,88 (2 Н, d), 3,59-3,61 (2 Н,m), 2,76-2,79 (2 Н, m), 1,68-1,81 (6 Н, m), 1,27 (3 Н, t). К перемешанной суспензии [(2-гидрокси-4-оксо-6,7,8,9-тетрагидро-4 Н,5 Н-10-тиа-1,4 а-диазабензо[а]азулен-3-карбонил)-амино]-уксусной кислоты (0,70 г, 0,0020 моль) в дихлорметане (20 мл) добавили триэтиламин (0,85 мл, 0,0062 моль) и циклогексиламин (0,29 мл, 0,0025 моль). К реакционной смеси добавили гидроксибензотриазол (0,28 г, 0,0020 моль) и 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид (0,60 г, 0,0031 моль) и перемешивали при комнатной температуре в течение 12 ч. Дихлорметан отогнали и добавили к остатку 1 н. соляную кислоту (50 мл), отделенное твердое вещество собрали фильтрацией. Полученное при этом твердое вещество перемешивали в метанолеESMS: 417,2 (M+-1). ИК (KBr, СМ-1): 2929,3, 1671,4, 1653,4. Следующие типичные соединения настоящего изобретения получены аналогичным способом, используя схемы синтеза, как описано выше.
МПК / Метки
МПК: A61K 31/519, C07D 513/06, C07D 513/16, A61P 7/06
Метки: оксазолопиримидиноны, конденсированные, тиазоло
Код ссылки
<a href="https://eas.patents.su/30-20228-kondensirovannye-tiazolo-i-oksazolopirimidinony.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные тиазоло- и оксазолопиримидиноны</a>
Предыдущий патент: 1,2-дигидро-2-оксохинолиновые соединения в качестве лигандов рецептора 5-нт4
Следующий патент: Агонисты mglu2
Случайный патент: Прозрачная противоотражающая подложка, обладающая нейтральным отраженным цветом












