Соль п-толуолсульфокислоты 5-амино-3-(2′-о-ацетил-3′-дезокси-β-d-рибофуранозил)-3н-тиазоло[4,5-d]пиримидин-2-она и способы получения
Номер патента: 17005
Опубликовано: 28.09.2012
Авторы: Хейли Грегори Дж., Руден Эрик Дж., Ван Тинминь, Кучера Дэвид, Блаттер Фритц, Фиртельхаус Мартин
Формула / Реферат
1. Соединение формулы (1)
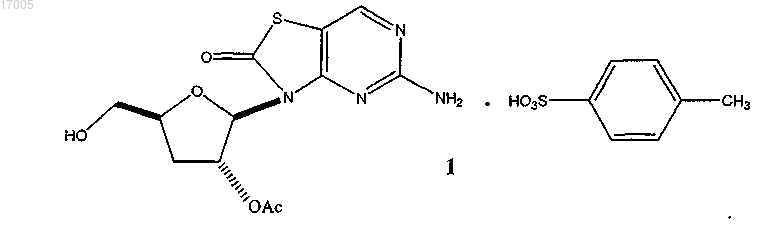
в кристаллической форме, где кристаллическая форма имеет дифракцию рентгеновских лучей (2-тета) с наиболее сильной полосой при угле 5,5°±0,3°.
2. Соединение по п.1, где кристаллическая форма имеет меньшие по интенсивности полосы при 11,8; 12,3; 17,9; 18,2; 19,7; 20,2; 21,3; 21,9; 23,8; 24,1 и 25,9°±0,3°.
3. Соединение по п.1, где кристаллическая форма имеет ИК-характеристические полосы поглощения при 1356, 1130, 804, 498 и 435 см-1 со средними полосами при 1637, 1602, 1054, 1037, 609 и 530 см-1.
4. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
5. Способ лечения или профилактики вирусного инфекционного гепатита В, вирусного инфекционного гепатита С, опухоли или злокачественного заболевания, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
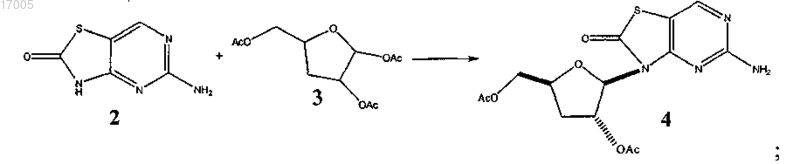
6. Способ получения соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1), включающий стадии:
(i) сочетания 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) с дезоксирибофуранозой (соединение 3) с образованием соединения формулы (4)
(ii) избирательного отщепления с использованием фермента 5'-ацетата в соединении формулы (4) с образованием 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 5)
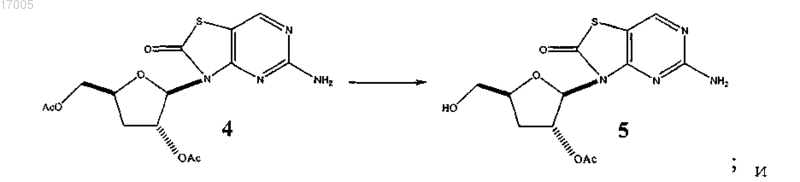
(iii) взаимодействия 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 5) с п-толуолсульфокислотой с образованием соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1)

7. Способ по п.6, в котором стадия (i) включает сочетание 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) с дезоксирибофуранозой (соединение 3B) с образованием соединения формулы (4)
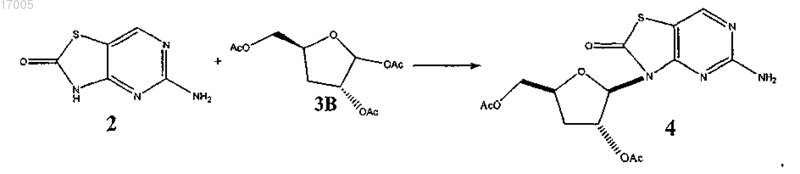
8. Способ по п.6, в котором реакцию сочетания на стадии (i) проводят без растворителя.
9. Способ по п.6, в котором реакцию сочетания на стадии (i) проводят в ацетонитриле.
10. Способ по п.6, в котором реакцию сочетания на стадии (i) проводят в присутствии кислоты.
11. Способ по п.10, в котором кислота является TMSOTf.
12. Способ по п.6, в котором реакцию сочетания на стадии (i) проводят в присутствии силилирующего реагента.
13. Способ по п.12, в котором силилирующий реагент представляет собой N,O-бис-(триметилсилил)ацетамид.
14. Способ по п.6, в котором реакцию сочетания на стадии (i) проводят в ацетонитриле в присутствии TMSOTf и N,O-бис-(триметилсилил)ацетамида.
15. Способ по п.14, в котором воду добавляют по окончании реакции сочетания для гашения избытка TMSOTf и BSA с образованием водного раствора трифликовой кислоты и гексаметилдисилоксана.
16. Способ по п.6, в котором в реакции сочетания на стадии (i) используют избыток 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) по отношению к дезоксирибофуранозе (соединение 3), основываясь на стехиометрии реакции.
17. Способ по п.6, в котором фермент представляет Candida antarctica.
18. Способ по п.6, в котором стадия (iii) включает взаимодействие 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 5) с п-толуолсульфокислотой с образованием соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1).
19. Способ по п.18, в котором растворитель выбирают из группы, состоящей из этанола, метанола, н-пропанола, изопропанола, н-бутанола, изобутанола, этилацетата, ацетонитрила, изопропилацетата, ТГФ и их смесей.
20. Способ по п.19, в котором растворитель содержит смесь изопропилацетата и ацетонитрила.
21. Способ по п.6, дополнительно включающий выделение соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1).
22. Способ по п.21, в котором выделенная соль п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-β-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1) имеет чистоту по меньшей мере 95%.
23. Способ получения соединения формулы (3)

включающий:
(i) сульфирование соединения формулы (6) сульфирующим реагентом в присутствии основания
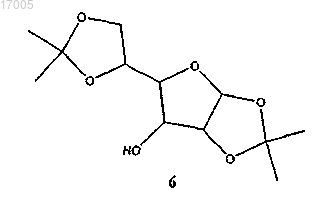
с образованием замещенного сульфонилом соединения формулы (7)
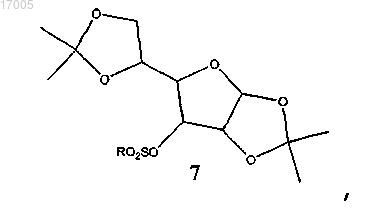
в которой R представляет необязательно замещенный алкил или арил;
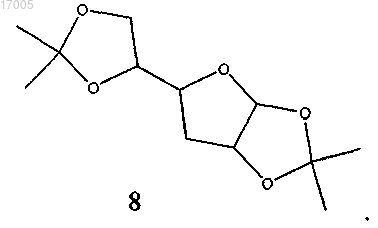
(ii) восстановление замещенного сульфонилом соединения формулы (7) восстановителем с образованием соединения формулы (8)

(iii) гидролиз соединения формулы (8) кислотой с образованием соединения формулы (9)
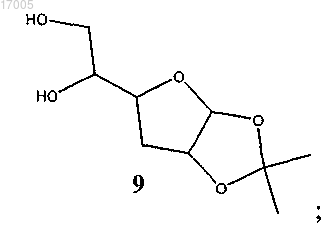
(iv) окисление соединения формулы (9) под действием окислителя с последующим восстановлением под действием восстановителя с образованием соединения формулы (10)
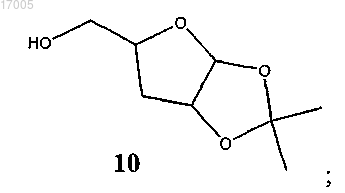
(v) ацетилирование соединения формулы (10) с использованием ацетилирующего реагента в присутствии кислотного катализатора с образованием соединения формулы (3)
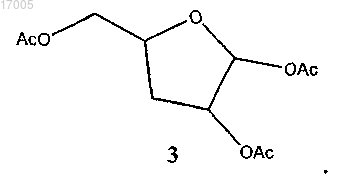
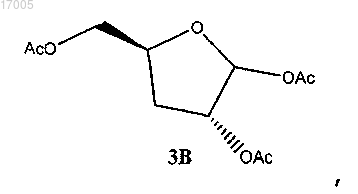
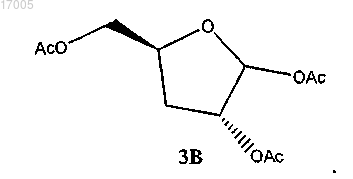
24. Способ по п.23, где соединение формулы (3) имеет ориентацию, показанную в формуле (3B)
включающий:
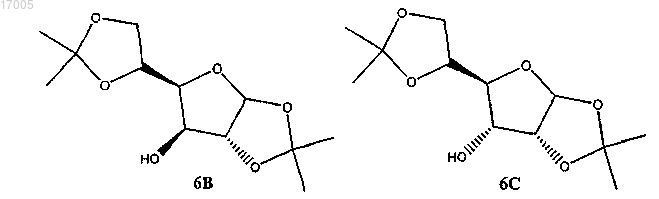
(i) сульфирование соединения формулы (6), имеющего ориентацию формулы (6B) или формулы (6C), или их смесей сульфирующим реагентом в присутствии основания
с образованием замещенного сульфонилом соединения формулы (7), имеющего ориентацию формулы (7B) или формулы (7C), или их смесей
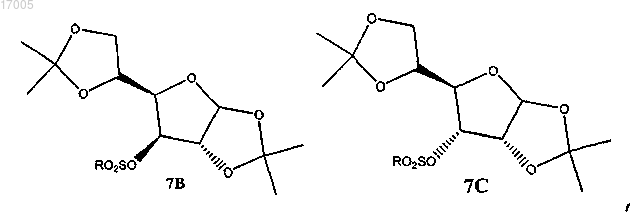
в которых R представляет необязательно замещенный алкил или арил;
(ii) восстановление замещенного сульфонилом соединения формулы (7), имеющего ориентацию формулы (7B) или формулы (1C), или их смесей под действием восстановителя с образованием соединения формулы (8B)
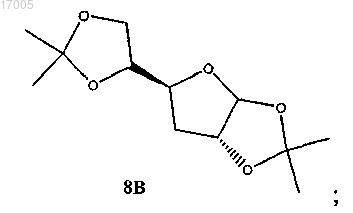
(iii) гидролиз соединения формулы (8), имеющего ориентацию формулы (8B), кислотой с образованием соединения формулы (9), имеющего ориентацию формулы (9B)

(iv) окисление соединения формулы (9), имеющего ориентацию формулы (9B), под действием окислителя с последующим восстановлением под действием восстановителя с образованием соединения формулы (10), имеющего ориентацию формулы (10B)
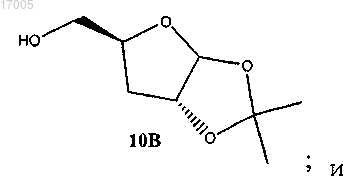
(v) ацетилирование соединения формулы (10), имеющего ориентацию формулы (10B), с использованием ацетилирующего реагента в присутствии кислотного катализатора с образованием соединения формулы (3), имеющего ориентацию формулы (3B)
25. Способ по п.23, в котором сульфирующий реагент выбирают из группы, состоящей из алкилсульфонового ангидрида, алкилсульфогалогенида, ароматического сульфонового ангидрида, ароматического сульфогалогенида и их смесей.
26. Способ по п.23, в котором сульфирующий реагент выбирают из группы, состоящей из трифликового ангидрида, тозилхлорида, метансульфонового ангидрида и метансульфогалогенида и их смесей.
27. Способ по п.23, в котором сульфирующий реагент является трифликовым ангидридом.
28. Способ по п.23, в котором восстановитель является борогидридом или алюмогидридом.
29. Способ по п.23, в котором восстановитель выбирают из борогидрида тетрабутиламмония, борогидрида тетраалкиламмония, борогидрида натрия, борогидрида лития, борогидрида калия, цианоборогидрида натрия, борогидрида магния, борогидрида кальция, триацетоксиборогидрида натрия и их смесей.
30. Способ по п.23, в котором кислота в последовательности реакций (iii) является органической или неорганической кислотой, необязательно разбавленной водой.
31. Способ по п.23, в которой окислитель выбирают из группы, состоящей из периодата натрия и ацетата свинца.
32. Способ по п.23, в котором кислотный катализатор выбирают из группы, состоящей из азотной кислоты, соляной кислоты, серной кислоты, сернистой кислоты, уксусной кислоты, трифторуксусной кислоты, алкилсульфокислоты, арилсульфокислоты и их смесей.
33. Способ по п.23, в котором R представляет собой CF3, CH3 или -С6Н4СН3.
34. Способ по п.23, в котором основание в последовательности реакций (i) представляет таковое, по меньшей мере, выбранное из группы, состоящей из пиридина, триэтиламина, имидазола и диизопропилэтиламина.
35. Способ по п.23, в котором дихлорметан используют в последовательности реакций (i).
36. Способ по п.23, в котором ароматический растворитель используют в последовательности реакций (ii).
37. Способ по п.23, в котором последовательность реакций (iv) проводят в растворителе метаноле, растворителе метиленхлориде, смеси растворителей метанол/метиленхлорид или смеси растворителей метанол/вода.
38. Способ по п.23, в котором последовательность реакций (v) проводят в растворителе уксусной кислоте, смеси уксусная кислота/органический растворитель или смеси уксусная кислота/водный растворитель.
39. Способ по п.23, где ацетилирующий реагент представляет собой уксусный ангидрид или уксусный хлорангидрид.
40. Способ восстановления замещенного сульфонилом соединения формулы (7)
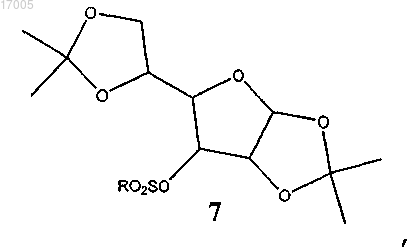
включающий восстановление замещенного сульфонилом соединения борогидридом тетрабутиламмония с образованием соединения формулы (8)
41. Способ по п.40, в котором соединение формулы (7) является производным глюкофуранозы формулы (7B)

производным аллофуранозы формулы (7C)
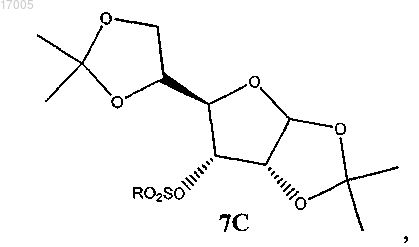
или смесью обоих.
42. Способ по п.40, в котором замещенное сульфонилом соединение является замещенным трифлатом соединением.
Текст
Изобретение относится к соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она и ее применению при лечении состояний, таких как вирусные инфекции, опухоли и злокачественные заболевания. Также раскрывается способ получения соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она и способы получения производных фуранозы, которые являются пригодными промежуточными соединениями при получении фармацевтических соединений, таких как соль п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она и т.п. 017005 Область техники, к которой относится изобретение Настоящее изобретение относится к соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она и ее применению при лечении состояний, таких как вирусные инфекции, опухоли и злокачественные заболевания. Также раскрывается способ получения соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3Hтиазоло[4,5-d]пиримидин-2-она и способы получения производных фуранозы, которые являются пригодными промежуточными соединениями при получении фармацевтических соединений, таких как соль птолуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она и т.п. Уровень техники Аналоги нуклеозидов являются важной группой соединений, которые пригодны для лечения заболевания. Например, аналоги нуклеозидов использовали для лечения злокачественных заболеваний и вирусных инфекций. После вхождения в клетку аналоги нуклеозидов обычно подвергаются фосфорилированию по путям спасения нуклеозидов, на которых аналоги фосфорилируются с образованием соответствующих моно-, ди- и трифосфатов. Среди прочих внутриклеточных функций трифосфорилированные аналоги нуклеозидов обычно служат в качестве субстратов для ДНК- или РНК-полимераз и включаются в ДНК и/или РНК. В том случае, когда трифосфорилированные аналоги нуклеозидов являются сильными ингибиторами полимераз, они могут индуцировать преждевременную остановку синтеза образующейся нуклеиново-кислотной молекулы. Когда трифосфорилированные аналоги нуклеозидов включаются в нуклеиново-кислотные репликаты или транскрипты, то может возникнуть нарушение экспрессии или функции генов. Некоторые нуклеозидные аналоги могут быть эффективными за счет их способности ингибировать аденозинкиназу. Аденозинкиназа катализирует фосфорилирование аденозина в аденозин-5'-монофосфат(АТФ). Ингибирование аденозинкиназы может эффективно повышать внеклеточное содержание аденозина у людей и тем самым служить в качестве способа лечения ишемических заболеваний, таких как кровоизлияние, воспаление, артрит, припадки и эпилепсии. В последние нескольких десятилетий предпринимались значительные усилия в исследовании терапевтических применений аналогов нуклеозидов. Например, некоторые пиримидо[4,5-d]пиримидиновые нуклеозиды были раскрыты в патенте США 5041542, Robins et al., в качестве эффективных средств для лечения L1210 у мышей BDF1. Кроме того, 3D-рибофуранозилтиазоло[4,5-d]пиримидины, проявившие высокую иммунологическую активность, включая воздействие на пролиферацию мышиных спленоцитов и в условиях in vivo действие против вируса леса Семлики, были раскрыты в патентах США 5041426 и 4880784, Robins et al. Также в ряде публикаций описаны негликозильные производные тиазоло[4,5-d]пиримидинового фрагмента. Например, см. патенты США 5994321 и 5446045; Revankar etal., J. Het. Chem., 30, 1341-1349 (1993); Lewis et al., J. Het. Chem., 32, 547-556 (1995). Было показано, что 3,5-дизамещенные-3H-тиазоло[4,5-d]пиримидин-2-оны обладают иммуномодулирующей активностью. Получение и применимость соединений данной группы описаны в публикации заявки на патент СШАUS 2006/0160830 (заявка на патент США 11/304691), которая в полном объеме включена в данный документ для сведения. В данной заявке описан синтез 5-амино-3-(2'-O-ацетил 3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она в виде свободного основания. Чистота данного соединения может варьировать в зависимости от способов очистки за счет аморфной природы свободного основания. Адекватная очистка свободного основания может ограничиваться применением некоторых растворителей, которые не являются приемлемыми для потребления человеком. Кроме того,аморфная форма (свободное основание) данного соединения имеет тенденцию быть гигроскопичной, что может сделать соединение расположенным к гидролизу. Следовательно, для фармацевтических применений желателен способ получения кристаллической формы данного соединения с высокой чистотой и стабильностью с низким содержанием нетоксичного растворителя. Сущность изобретения Изобретение относится к соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиDрибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она, формула (1) которой приведена ниже, и фармацевтическим композициям, содержащим соль. Соединение формулы (1) применяют в способах лечения или профилактики заболевания. Например, соединение формулы (1) применяют в способах лечения или профилактики начала развития и/или-1 017005 прогрессирования опухолей или злокачественных заболеваний. Также раскрываются способы лечения или профилактики инфекции, вызванной патогеном, например вирусами, включая вирус гепатита В или вирус гепатита С. Соединение формулы (1) также применяют в способах модуляции иммунной активности цитокинов. В другом варианте осуществления настоящее изобретение относится к способу получения соли птолуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1)(соединение 3) с образованием соединения формулы (4)(iii) взаимодействия 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 5) с п-толуолсульфокислотой с образованием соли птолуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 1) В еще одном варианте осуществления стадия (i) включает сочетание 5-амино-3H-тиазоло[4,5d]пиримидин-2-она (соединение 2) с дезоксирибофуранозой формулы (3B) с образованием соединения формулы (4) Еще один вариант осуществления относится к способам получения соединения формулы (3), кото-2 017005 рое является пригодным в качестве промежуточного соединения в получении соединения формулы (1)(i) сульфирование соединения формулы (6) сульфирующим реагентом в присутствии основания с образованием замещенного сульфонилом соединения формулы (7) в которой R представляет необязательно замещенный алкил или арил;(ii) восстановление замещенного сульфонилом соединения формулы (7) восстановителем с образованием соединения формулы (8)(iii) гидролиз соединения формулы (8) кислотой с образованием соединения формулы (9)(iv) окисление соединение формулы (9) под действием окислителя с последующим восстановлением под действием восстановителя с образованием соединения формулы (10)(v) ацетилирование соединения формулы (10) с использованием ацетилирующего реагента в присутствии кислотного катализатора с образованием соединения формулы (3) Другой вариант осуществления настоящего изобретения относится к способам получения соединения формулы (3B), которое является пригодным в качестве промежуточного соединения при получении соединения формулы (1)(i) сульфирование соединения формулы (6B), формулы (6C) или их смесей сульфирующим реагентом в присутствии основания с образованием замещенного сульфонилом соединения формулы (7B), формулы (7C) или их смесей в которых R представляет необязательно замещенный алкил или арил;(ii) восстановление замещенного сульфонилом соединения формулы (7B), формулы (7C) или их смесей под действием восстановителя с образованием соединения формулы (8B)(iii) гидролиз соединения формулы (8B) кислотой с образованием соединения формулы (9B)(iv) окисление соединения формулы (9B) под действием окислителя с последующим восстановлением под действием восстановителя с образованием соединения формулы (10B)(v) ацетилирование соединения формулы (10B) с использованием ацетилирующего реагента в присутствии кислотного катализатора с образованием соединения формулы (3B) В еще одном варианте осуществления изобретение относится к способу восстановления замещенного сульфонилом соединения формулы (7) восстановителем с образованием соединения формулы (8) в которой R представляет необязательно замещенный алкил или арил. В других вариантах осуществления R представляет необязательно замещенный C1-C6-алкил или фенил. В еще одном варианте осуществления R является CF3, CH3, -C6H4CH3. В еще одном варианте осуществления изобретение относится к способу восстановления замещенного сульфонилом соединения формулы (7B), формулы (7C) или их смесей восстановителем с образованием соединения формулы (8B) в которой R представляет необязательно замещенный алкил или арил. В еще одних вариантах осуществления R представляет необязательно замещенный C1-C6-алкил или-5 017005 фенил. В еще одном варианте осуществления R является CF3, CH3 или -С 6 Н 4 СН 3. Способы по настоящему изобретению подходят для масштабного промышленного получения соединений, описанных в данном документе. Способы являются операционно простыми, рациональными и эффективными. В частности, способы являются особенно подходящими для масштабного получения соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединения 1). Краткое описание фигур На фиг. 1 приведен FT-рамановский спектр соединения формулы (1). На фиг. 2 приведен PXRD спектр (спектр порошковой дифракции рентгеновских лучей) соединения формулы (1). Подробное описание изобретения В том смысле, в котором термин "содержащий" (и его грамматические варианты) используется в данном документе, он используется во включающем смысле "имеющий" или "включающий", а не в исключающем смысле "состоящий только из". В том смысле, в котором термин "галогенид" используется в данном документе, он относится к фториду, хлориду, бромиду и йодиду. Термин "галоген" относится к фтору, хлору, брому и йоду. В том смысле, в котором термин "алкил" используется в данном документе, если не указано иначе,он включает насыщенные моновалентные углеводородные радикалы, содержащие прямые, разветвленные или циклические группы (включая конденсированные или мостиковые бициклические и спироцилические группы) или комбинацию указанных выше групп. В отношении алкильной группы с циклическими группами группа должна содержать по меньшей мере три атома углерода. В том смысле, в котором термин "арил" используется в данном документе, если не указано иначе,он включает органическую группу, полученную из ароматического углеводорода удалением одного атома водорода, такую как фенил или нафтил. Группы "алкил" и "арил" необязательно замещены 1-5 заместителями, выбранными из -ОН, атома галогена, -CN, C1-C6-алкила, арилалкила, C1-C6-алкокси, C1-C6-алкенила, C1-C6-гидроксила, C1-C6 гидроксиалкила, амино, C1-C6-алкиламина, C1-C6-диалкиламина, в которых алкильные группы могут быть дополнительно замещены одним или более атомами галогена. Термин "Ac" означает ацетил. Соединения по изобретению могут находиться в виде индивидуальных стереоизомеров, рацематов и/или различных смесей энантиомеров и/или диастереоизомеров. Все такие индивидуальные стереоизомеры, рацематы и/или различные смеси энантиомеров и/или диастереоизомеров находятся в объеме настоящего изобретения. В том смысле, в котором термин "окислитель" используется в данном документе, он относится к соединению или молекулам, которые принимают электроны в химической реакции, и термин "восстановитель" относится к соединению, которое отдает электроны в химической реакции. Термин "иммуномодулятор" относится к природным или синтетическим продуктам, способным модифицировать нормальную или нарушенную иммунную систему посредством стимуляции или супрессии. Термин "профилактика" относится к способности соединения или композиции по изобретению осуществлять профилактику заболевания, указанного в данном документе, у пациентов с установленным диагнозом заболевания или с риском развития данного заболевания. Также термин включает профилактику дальнейшего прогрессирования заболевания у пациентов, которые уже страдают им или у которых имеются симптомы такого заболевания. Термин "пациент" или "субъект" означает животное (например, корову, лошадь, овцу, свинью, курицу, индейку, перепелку, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.) или млекопитающее, предпочтительно человека, включая химерных и трансгенных животных и млекопитающих. Термин "терапевтически эффективное количество" относится к количеству соединения по изобретению, достаточному для обеспечения целебного действия при лечении или профилактике заболевания с замедлением или сведением до минимума симптомов, связанных с заболеванием, или с излечения или ослаблением заболевания или инфекции, или их причин. В частности, терапевтически эффективное количество означает количество, достаточное для обеспечения лечебного действия в условиях in vivo. При использовании по отношению к количеству соединения по изобретению термин предпочтительно включает нетоксичное количество, которое повышает эффективность лечения в целом, приводит к снижению или устранению симптомов или причин заболевания или повышает терапевтическую эффективность, или оказывает синергическое действие с другим терапевтическим средством. Термин "профилактически эффективное количество" относится к количеству соединения по изобретению или другого активного ингредиента, достаточному для предупреждения заболевания, рецидивирования или развития заболевания. Профилактически эффективное количество может относиться к количеству, достаточному для профилактики первоначальной вирусной инфекции или рецидивирования или развития инфекции или заболевания, связанного с инфекцией. При использовании по отношению к количеству соединения по изобретению термин предпочтительно включает нетоксичное количество, ко-6 017005 торое повышает эффективность профилактики в целом или повышает профилактическую эффективность, или оказывает синергическое действие с другим профилактическим или терапевтическим средством. Термин "в комбинации" относится к применению более чем одного профилактического и/или терапевтического средства одновременно или последовательно и таким образом, что их соответствующие эффекты являются аддитивными или синергическими. Термин "лечение" относится к:(i) профилактике заболевания, нарушения или состояния у животного, которое может быть предрасположенным к заболеванию, нарушению или состоянию, но у которого диагноз еще не поставлен;(iii) ослаблению заболевания, нарушения или состояния или ослаблению симптомов заболевания,нарушения или состояния и/или обеспечению регрессии заболевания, нарушения или состояния. Термины "R" и "S" указывают на конкретную стереохимическую конфигурацию заместителя в асимметричном атоме углерода в химической структуре, как показано. Соединения по изобретению могут проявлять феномен таутомерии. Несмотря на то что приведенные в данном документе формулы не могут кратко отражать все возможные таутомерные формы, следует понимать, что все приведенные в данном документе формулы предназначены представлять любую таутомерную форму представленного соединения и не ограничиваются только конкретной формой соединения, отраженной формулой. Как это обычно понимают специалисты в данной области, оптически чистое соединение, содержащее один хиральный центр (т.е. один асимметричный атом углерода), представляет таковое, по существу, состоящее из одного из двух возможных энантиомеров (т.е. является энантиомерно чистым), и оптически чистое соединение, содержащее более чем один хиральный центр, представляет таковое, которое является одновременно диастереизомерно чистым и энантиомерно чистым. Предпочтительно соединения по настоящему изобретению применяют в форме, которая по меньшей мере на 90% не содержит других энантиомеров или диастереоизомеров соединений, т.е. в форме, которая содержит по меньшей мере на 90% один изомер (80% энантиомерный избыток ("э.и.") или диастереоизомерный избыток ("д.и.", более предпочтительно по меньшей мере 95% э.и. или д.и., еще более предпочтительно по меньшей мере 97,5%(95% э.и. или д.и.) и наиболее предпочтительно по меньшей мере 99% (98% э.и. или д.и.). Соль п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3Hтиазоло[4,5-d]пиримидин-2-она показана ниже в виде формулы (1) Свободное основание 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-он (соединение 5) является аморфным соединением. До настоящего изобретения 5 амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 5) никогда не был выделен в кристаллической форме. В настоящее время неожиданно было установлено по данному изобретению, что при определенных условиях можно получить кристаллическую форму с очень низким остаточным содержанием растворителя из соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил 3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1). Кристаллическая форма по настоящему изобретению обладает преимущественными свойствами по сравнению с аморфной формой 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 5). Например, меньшее остаточное количество растворителя будет присутствовать в конечном веществе препарата в любой форме, такой как растворенное состояние. Кроме того, при кристаллизации имеет место дополнительная очистка. Это приводит к более высокой стабильности вещества препарата и более простой обработке при производстве на заводе. Свободное основание 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-он (соединение 5) является гигроскопичным соединением. С учетом химической структуры можно предположить, что 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-он (соединение 5) может быть очень расположенным к гидролизу. В настоящее время неожиданно было установлено по данному изобретению, что кристаллическая форма соли птолуолсульфокислоты является только незначительно гигроскопичной и, таким образом, обладает лучшими свойствами для хранения и легче подвергается обработке. Было установлено,что свободное основание 5-амино-3-(2'-O-ацетил-3'-дезоксиDрибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 5) содержит некоторые близкие соеди-7 017005 нения (продукты побочных реакций во время синтеза) и содержит остаточные количества растворителей и воды. Термин "по существу, чистая" по настоящему изобретению означает, что суммарное содержание близких соединений составляет менее чем 1%, предпочтительно менее чем 0,75%, более предпочтительно менее чем 0,5%, и что остаточное содержание растворителей и воды находится на уровне менее 1%,предпочтительно менее чем 0,75%, более предпочтительно менее чем 0,5% и еще более предпочтительно менее чем 0,25% по массе. ИК-спектры - на фиг. 1 представлен FT-рамановский спектр соединения формулы (1). Соединение формулы (1) характеризуется следующими большими ИК-полосами при 1356, 1130, 804, 498 и 435 см-1 со средними полосами при 1637, 1602, 1054, 1037, 609 и 530 см-1. Данные по порошковой дифракции рентгеновских лучей - на фиг. 2 приведена диаграмма дифракции рентгеновских лучей соединения формулы (1). На диаграмме рентгеновских лучей угол дифракции 2-тета находится на графике на оси X и пик интенсивности находится на оси Y. Наиболее сильную полосу в диаграмме дифракции рентгеновских лучей наблюдают при угле 5,50,3, с меньшими по интенсивности полосами при 11,8, 12,3, 17,9, 18,2, 19,7, 20,2, 21,3, 21,9, 23,8, 24,1 и 25,90,3. Фармацевтические композиции. Кристаллическое соединение формулы (1) используют для получения фармацевтических композиций, содержащих по меньшей мере один фармацевтически приемлемый носитель и соединение формулы(1). Подробное описание получения фармацевтических композиций с использованием носителя приведено в публикации заявки на патент США 2006/0160830 (заявка на патент США 11/304691), которая в полном объеме включена в данный документ для сведения. Фармацевтические композиции и отдельные разовые лекарственные формы, содержащие соединение формулы (1), также входят в объем изобретения. Отдельные лекарственные формы по изобретению могут быть подходящими для перорального введения, введения через слизистые (включая сублингвальное, буккальное, ректальное, интраназальное или внутривагинальное введение), парентерального введения (включая подкожное, внутримышечное введение, инъекцию-болюс, внутриартериальное или внутривенное введение), трансдермального или местного применения. Фармацевтические композиции и лекарственные формы по изобретению, как правило, также содержат один или более фармацевтически приемлемых наполнителей. Также предусматриваются стерильные лекарственные формы. В альтернативном варианте осуществления фармацевтические композиции, входящие в данный вариант осуществления, включают соединение формулы (1) или его фармацевтически приемлемый гидрат или сольват и по меньшей мере одно дополнительное терапевтическое средство. Состав, форма и тип лекарственных форм по изобретению, как правило, будут варьировать в зависимости от их применения. Например, лекарственная форма, используемая при кратковременном лечении заболевания или связанного заболевания, может содержать большее количество одного или более активных ингредиентов по сравнению с лекарственной формой, используемой при продолжительном лечении того же заболевания. Аналогично лекарственная форма для парентерального введения может содержать меньшие количества одного или более активных ингредиентов по сравнению с лекарственной формой, предназначенной для перорального введения, используемой для лечения того же заболевания или нарушения. Данные и другие свойства, по которым конкретные лекарственные формы, входящие в объем изобретения, будут отличаться друг от друга, легко понятны специалистам в данной области. См.,например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Примеры лекарственных форм включают, но не ограничиваются этим, таблетки; таблетки в форме капсул; капсулы,такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; леденцы; дисперсии; суппозитории; мази; припарки; пасты; порошки; повязки; кремы; пластыри; растворы; наклейки; аэрозоли (например, спреи для носа или ингаляторы); гели; жидкие лекарственные формы, подходящие для перорального введения или нанесения на слизистые пациенту, в том числе суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или эмульсии вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые можно восстановить с получением жидких лекарственных форм, подходящих для парентерального введения пациенту. Типичные фармацевтические композиции и лекарственные формы содержат один или более носителей, наполнителей или разбавителей. Подходящие наполнители являются хорошо известными специалистам в области фармации, и неограничивающие примеры подходящих наполнителей приводятся в данном документе. Насколько конкретный наполнитель подходит для включения в фармацевтическую композицию или лекарственную форму, зависит от различных факторов, хорошо известных в данной области, включая, не ограничиваясь этим, путь, которым лекарственную форму будут вводить пациенту. Например, лекарственные формы для приема внутрь, такие как таблетки, могут содержать наполнители,не пригодные для применения в лекарственных формах для парентерального введения. Применимость конкретного наполнителя также может зависеть от конкретных активных ингредиентов в лекарственной форме.-8 017005 Изобретение включает безводные фармацевтические композиции и лекарственные формы, содержащие активные ингредиенты, поскольку вода может способствовать разрушению некоторых соединений. Например, добавление воды (например, в количестве 5%) является широко принятой практикой в области фармации в качестве средства обеспечения длительного хранения для определения таких характеристик, как период хранения или стабильность формуляции в течение времени. См., например, Carstensen, Drug Stability: PrinciplesPractice, 2d Ed., Marcel Dekker, NY, NY, 1995, p. 379-380. Фактически вода и тепло ускоряют разложение некоторых соединений. Таким образом, воздействие воды на формуляцию может иметь большое значение, поскольку влага и/или влажность обычно имеют место во время производства, обработки, упаковки, хранения, транспортировки и применения композиций. Безводные фармацевтические композиции и лекарственные формы по изобретению можно получить с использованием безводных ингредиентов или ингредиентов с низким содержанием влаги и условий с низким содержанием влаги или низкой влажностью. Безводную фармацевтическую композицию следует готовить и хранить таким образом, чтобы сохранялась ее безводная природа. Следовательно, безводные композиции предпочтительно упаковывают с использованием материалов, о которых известно, что они предупреждают воздействие воды таким образом, чтобы их можно было включить в подходящие фармацевтические наборы. Примеры подходящих упаковочных материалов включают, не ограничиваясь этим, герметично закрытую фольгу, пластики,контейнеры для разовых лекарственных форм (например, флаконы), блистерные упаковки и ленточные упаковки. Изобретение дополнительно включает фармацевтические композиции и лекарственные формы, которые содержат одно или более соединений, приводящих к снижению скорости разложения активного ингредиента. Такие соединения, которые относятся в данном документе к "стабилизаторам", включают,не ограничиваясь этим, антиоксиданты, такие как аскорбиновая кислота, буферы pH или буферные соли. Аналогично количествам и типам наполнителей, количества и конкретные типы активных ингредиентов в лекарственной форме могут различаться в зависимости от факторов, таких как, не ограничиваясь этим, путь, которым ее вводят пациентам. Однако типичные лекарственные формы по изобретению содержат соединение формулы (1) или его гидрат в количестве от 0,1 мг до 1500 мг на разовую лекарственную форму для обеспечения доз в пределах примерно от 0,01 до 200 мг/кг в сутки. Лекарственные формы для перорального введения. Фармацевтические композиции по изобретению, которые подходят для перорального введения, могут находиться в отдельных лекарственных формах, таких как, не ограничиваясь этим, таблетки (например, жевательные таблетки), таблетки в форме капсул, капсулы и жидкости (например, сиропы с вкусовым ароматизирующим веществом). Такие лекарственные формы содержат заранее определенные количества активных ингредиентов и их можно получить с использованием способов фармации, хорошо известных специалистам в данной области. В общем, см. Remington's Pharmaceutical Sciences, 18th ed., MackPublishing, Easton PA (1990). Типичные лекарственные формы для перорального введения по изобретению готовят объединением активного ингредиента(ов) в однородной смеси по меньшей мере с одним наполнителем с использованием обычных методов фармацевтической формуляции. Наполнители могут иметь самые разнообразные формы в зависимости от формы препарата, желаемой для введения. Например, наполнители, подходящие для применения в жидких лекарственных формах для перорального введения или аэрозольных лекарственных формах, включают, не ограничиваясь этим, воду, гликоли, масла, спирты, вкусовые вещества,консерванты и красители. Примеры наполнителей, подходящих для применения в твердых лекарственных формах для приема внутрь (например, порошках, таблетках, капсулах и таблетках в форме капсул),включают, не ограничиваясь этим, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители,средства для гранулирования, скользящие вещества, связывающие вещества и разрыхлители. За счет простоты их введения таблетки и капсулы представляют собой наиболее преимущественные лекарственные формы для приема внутрь и в этом случае применяют твердые наполнители. Если желательно, то таблетки можно покрыть оболочками с использованием стандартных методов с водными и неводными растворителями. Такие лекарственные формы можно получить любыми методами, известными в фармации. В целом фармацевтические композиции и лекарственные формы готовят равномерным и тщательным смешением активных ингредиентов с жидкими носителями, мелко измельченными твердыми носителями или обеими операциями, и затем приданием продукту желаемой формы, если это необходимо. Например, таблетку можно приготовить прессованием или формованием. Прессованные таблетки можно получить прессованием на подходящем устройстве активных ингредиентов, находящихся в свободно сыпучей форме, такой как порошок или гранулы, необязательно в смеси с наполнителем. Формованные таблетки можно получить формованием на подходящем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Примеры наполнителей, которые можно использовать в лекарственных формах для приема внутрь по изобретению, включают, не ограничиваясь этим, связывающие вещества, наполнители, разрыхлители и скользящие вещества. Связывающие вещества, подходящие для применения в фармацевтических ком-9 017005 позициях и лекарственных формах, включают, не ограничиваясь этим, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновая кислота, другие альгинаты, порошкообразный трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетилцеллюлозу, кальциевую соль карбоксиметилцеллюлозы, натриевую соль карбоксиметилцеллюлозы), поливинилпирролидон, метилцеллюлозу, прежелатизированный крахмал, гидроксипропилметилцеллюлозу (например,2208, 2906,2910), микрокристаллическую целлюлозу и их смеси. Примеры наполнителей, подходящих для применения в фармацевтических композициях и лекарственных формах, раскрытых в данном документе, включают, не ограничиваясь этим, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу,декстраны, каолин, манит, кремниевую кислоту, сорбит, крахмал, прежелатизированный крахмал и их смеси. Как правило, связывающее вещество или наполнитель в фармацевтических композициях по изобретению находятся в количестве примерно от 50 до примерно 99 вес.% от массы фармацевтической композиции или лекарственной формы. Подходящие формы микрокристаллической целлюлозы включают, не ограничиваясь этим, промышленно доступные материалы, такие как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581,AVICEL-PH-105 (производства FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook,PA) и их смеси. Конкретное связывающее вещество представляет смесь микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы, такую как AVICEL RC-581. Подходящие безводные или с низким содержанием влаги наполнители или добавки включают AVICEL-PH-103 и Starch 1500 LM. Разрыхлители применяют в композициях по изобретению для получения таблеток, которые распадаются при воздействии водной среды. Таблетки, которые содержат слишком много разрыхлителя, могут разрушаться при хранении, в то время как те, которые содержат его слишком мало, могут не распадаться с желаемой скоростью или при желаемых условиях. Таким образом, следует использовать достаточное количество разрыхлителя, которое не является не слишком большим, не слишком маленьким для того,чтобы отрицательно изменялось высвобождение активных ингредиентов, для получения твердых лекарственных форм для приема внутрь по изобретению. Используемое количество разрыхлителя варьирует в зависимости от типа композиции, и его легко могут определить специалисты в данной области. Типичные фармацевтические композиции содержат примерно от 0,5 до примерно 15 вес.% разрыхлителя, конкретно примерно от 1 до примерно 5 вес.% разрыхлителя. Разрыхлители, которые можно использовать в фармацевтических композициях и лекарственных формах по изобретению, включают, не ограничиваясь этим, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натриевую соль кроскармеллозы, кросповидон, калиевую соль полакрилина, натрий-крахмал гликолят, картофельный или тапиоковый крахмал, прежелатизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси. Скользящие вещества, которые можно использовать в фармацевтических композициях и лекарственных формах по изобретению, включают, не ограничиваясь этим, стеарат кальция, стеарат магния,минеральное масло, светлое минеральное масло, глицерин, сорбит, манит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрогенизированное растительное масло(например, кокосовое масло, масло семян подсолнечника, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллауреат, агар и их смеси. Дополнительные скользящие вещества включают, например, силоидный силикагель (AEROSIL 200 производства W.R. Grace Co. of Baltimore, MD), коагулированный аэрозоль синтетического силикагеля (производства Degussa Co. of Piano, TX), CAB-O-SIL (пирогенный диоксид кремния производства Cabot Co.of Boston, MA) и их смеси. Если их вообще используют, то, как правило, разрыхлители применяют в количестве менее чем примерно 1 вес.% к массе фармацевтических композиций или лекарственных форм, в которые их включают. Лекарственные формы с замедленным высвобождением. Активные ингредиенты по изобретению можно вводить с помощью средств с контролируемым высвобождением или с помощью устройств для доставки, которые являются хорошо известными специалистам в данной области. Примеры включают, не ограничиваясь этим, описанные в патентах США 3845770; 3916899; 3536809 и 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556 и 5733566, каждый из которых включен в данный документ для сведения. Такие лекарственные формы можно использовать для обеспечения медленного или контролируемого высвобождения одного или более активных ингредиентов с использованием, например, гидропропилметилцеллюлозы, других полимерных веществ, гелей, проницаемых мембран, осмотических систем, многослойных оболочек, микрочастиц, липосом, микросфер или их комбинаций, для обеспечения желаемого профиля высвобождения в различных соотношениях. Подходящие композиции с контролируемым высвобождением, известные специалистам в данной области, включая описанные в данном документе, можно легко выбрать для применения с активными ингредиентами по изобретению. Таким образом, изобретение включает отдельные разовые лекарственные формы, подходящие для перорального введения, например, такие как, не ограничиваясь этим, таблетки, капсулы, мягкие капсулы и таблетки в форме капсул, адаптированные для кон- 10017005 тролируемого высвобождения. Все фармацевтические продукты с контролируемым высвобождением имеют общую цель, заключающуюся в усовершенствовании терапии лекарственными препаратами по сравнению с их аналогами без контролируемого высвобождения. В идеале применение оптимально сконструированного препарата с контролируемым высвобождением при медикаментозном лечении характеризуется минимальным количеством лекарственной субстанции, используемой для лечения или профилактики состояния, в течение минимального периода времени. Преимущества композиций с контролируемым высвобождением включают длительный период проявления активности препарата, меньшую кратность введения и хорошее восприятие у пациента. Кроме того, композиции с контролируемым высвобождением можно использовать для оказания влияния на время начала действия или другие характеристики, такие как концентрация лекарственного препарата в крови, и, таким образом, они могут оказывать влияние на проявление побочных (например, нежелательных) эффектов. Большинство композиций с контролируемым высвобождением сконструировано для первоначального высвобождения определенного количества препарата (активного ингредиента), которое быстро обеспечивает желаемый терапевтический эффект, и затем постепенного и длительного высвобождения других порций препарата для поддержания данного уровня лечебного или профилактического эффекта в течение продолжительного периода времени. Для поддержания данного постоянного уровня препарата в организме лекарственное средство должно высвобождаться из лекарственной формы со скоростью, при которой будет замещаться то количество препарата, которое подверглось метаболизму и выделению из организма. Контролируемое высвобождение активного ингредиента можно обеспечить различными условиями, включая, не ограничиваясь этим, pH, температуру, ферменты, воду или другие физиологические условия или соединения. Лекарственные формы для парентерального введения. Лекарственные формы для парентерального введения можно вводить пациентам различными путями, в том числе, не ограничиваясь этим, подкожным, внутривенным (включая инъекцию-болюс), внутримышечным и внутриартериальным. За счет того, что при их введении, как правило, они обходят естественные барьеры для загрязнителей у пациента, то предпочтительно, чтобы лекарственные формы для парентерального введения были стерильными или были способными подвергнуться стерилизации перед введением пациенту. Примеры парентеральных лекарственных форм включают, не ограничиваясь этим,растворы, готовые для инъекций, сухие или лиофилизованные продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекций (восстанавливаемые порошки),суспензии, готовые для инъекций, и эмульсии. Подходящие носители, которые можно использовать для получения лекарственных форм для парентерального введения по изобретению, являются хорошо известными специалистам в данной области. Примеры включают, не ограничиваясь этим, воду для инъекций USP; водные растворители, такие как физиологический раствор для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и лактированный раствор Рингера; смешивающиеся с водой растворители, такие как, не ограничиваясь этим, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, не ограничиваясь этим, кукурузное масло, масло семян хлопчатника, кокосовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. В лекарственные формы для парентерального введения по изобретению можно включать соединения, повышающие растворимость одного или более активных ингредиентов, раскрытых в данном документе. Лекарственные формы для трансдермального введения. Лекарственные формы для трансдермального введения включают пластыри "типа резервуара" или"типа матрикса", которые можно прикреплять на кожу и носить в течение определенного периода времени для обеспечения проникновения желаемого количества активных ингредиентов. Подходящие наполнители (например, носители и разбавители) и другие вещества, которые можно использовать для обеспечения лекарственных форм для трансдермального и местного применения по данному изобретению, являются хорошо известными специалистам в области фармации, и они зависят от конкретной ткани, для которой применяется данная фармацевтическая композиция или лекарственная форма. С учетом этого факта типичные наполнители включают, не ограничиваясь этим, воду, ацетон,этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, которая подвергается обработке, можно использовать дополнительные компоненты до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, можно использовать вещества, усиливающие проникновение, для повышения доставки активных ингредиентов в ткани. Подходящие вещества, усиливающие проникновение, включают, не ограничиваясь этим, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; коллидон различных видов (повидон, поливидон); мочевину и различные водорастворимые или нерастворимые в воде эфиры сахаров, такие как твин 80 (полисорбат- 11017005 80) и спан 60 (сорбитан моностеарат). Значение pH фармацевтической композиции или лекарственной формы, или ткани, для которой применяют фармацевтическую композицию или лекарственную форму, можно также скорректировать для улучшения доставки одного или более активных ингредиентов. Аналогично для улучшения доставки можно скорректировать полярность растворителя-носителя, его ионную силу или осмотичность. Также к фармацевтическим композициям или лекарственным формам можно добавить соединения, такие как стеараты, в целях преимущественного изменения гидрофильности или липофильности одного или более активных ингредиентов и таким образом улучшить доставку. В этом отношении стеараты могут служить в качестве липидного носителя для композиции, в качестве эмульгатора или поверхностно-активного вещества, и в качестве вещества, усиливающего доставку или усиливающего проникновение действующего вещества в ткани. Для дополнительной коррекции свойств полученной композиции можно использовать различные соли, гидраты или сольваты активных ингредиентов. Лекарственные формы для местного применения. Лекарственные формы для местного применения по изобретению включают, не ограничиваясь этим, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing,Easton PA (1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Подходящие наполнители (например, носители и разбавители) и другие вещества, которые можно использовать для обеспечения лекарственных форм для трансдермального и местного применения по данному изобретению, являются хорошо известными специалистам в области фармации, и они зависят от конкретной ткани, для которой применяется данная фармацевтическая композиция или лекарственная форма. С учетом этого факта типичные наполнители включают, не ограничиваясь этим, воду, ацетон,этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, которая подвергается обработке, можно использовать дополнительные компоненты до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, можно использовать вещества, усиливающие проникновение, для повышения доставки активных ингредиентов в ткани. Подходящие вещества, усиливающие проникновение, включают, не ограничиваясь этим, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; коллидон различных видов (повидон, поливидон); мочевину и различные водорастворимые или нерастворимые в воде эфиры сахаров, такие как твин 80 (полисорбат 80) и спан 60 (сорбитан моностеарат). Лекарственные формы для введения через слизистые. Лекарственные формы для введения через слизистые по изобретению включают, не ограничиваясь этим, глазные растворы, спреи и аэрозоли, или другие формы, известные специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Лекарственные формы,подходящие для обработки слизистых в ротовой полости, можно формулировать в виде раствора для полоскания или гелей для ротовой полости. В одном варианте осуществления аэрозоль содержит носитель. В другом варианте осуществления аэрозоль не содержит носителя. Соединение формулы (1) также можно вводить непосредственно в легкие ингаляцией. Для введения посредством ингаляции соединение формулы (1) соответственно доставляют в легкие с помощью ряда устройств. Например, можно использовать дозированный ингалятор ("MDI"), в котором применяются резервуары, содержащие подходящий низкокипящий пропеллент, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, для доставки соединения формулы (1) непосредственно в легкие. Устройства MDI являются промышленно доступными от таких поставщиков, как 3M Corporation, Aventis, Boehringer Ingleheim, Forest Laboratories, GlaxoWellcome, Shering Plough и Vectura. Альтернативно можно использовать ингалятор для сухих порошков (DPI) для введения соединения формулы (1) в легкие (см., например, Raleigh et al., Proc. Amer. Assoc. Cancer Research Annual Meeting,1999, 40, 397, этот источник включен в данный документ для сведения). Как правило, функционированиеDPI основано на механизме, заключающемся в том, что выпуск газа создает облако сухого порошка внутри контейнера, которое затем может вдыхаться пациентом. Устройства DPI также хорошо известны в данной области и их можно получить от ряда производителей, включая, например, Fisons, GlaxoWellcome, Inhale Therapeutic Systems, ML Laboratories, Odose и Vectura. Популярным вариантом является мультидозовая система DPI ("MDDPI"), которая позволяет обеспечивать более чем одну терапевтическую дозу. Устройства MDDPI являются промышленно доступными от таких компаний, как AstraZeneca,Glaxo-Wellcome, IVAX, Schering Plough, SkyePharma и Vectura. Например, можно формулировать капсулы и картриджи из желатина для применения в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал, для данных систем. Другим типом устройства, которое можно использовать для доставки соединения формулы (1) в- 12017005 легкие, является устройство с жидким спреем, например, производства Aradigm Corporation. В системах с жидким спреем используется головка с очень небольшими отверстиями для распыления жидких лекарственных композиций, которые затем можно вдыхать непосредственно в легкие. В одном варианте осуществления распылительное устройство применяют для введения соединения формулы (1) в легкие. Распылители создают аэрозоли из жидких лекарственных композиций при использовании, например, ультразвуковой энергии с образованием мелких частиц, которые можно легко вдыхать (см., например, Verschoyle et al., British J. Cancer, 1999, 80, Suppl. 2, 96, этот источник включен в данный документ для сведения). Примеры распылителей включают устройства производства Sheffield/Systemic Pulmonary Delivery Ltd. (см. Armer et al., патент США 5954047; van der Linden et al., патент США 5950619; van der Linden et al., патент США 5970974, эти источники включены в данный документ для сведения), Aventis и Batelle Pulmonary Therapeutics. В одном варианте осуществления электрогидродинамическое ("EHD") аэрозольное устройство используют для введения соединения формулы (1) в легкие. В аэрозольных устройствах EHD используется электрическая энергия для распыления жидких лекарственных растворов или суспензий (см., например,Noakes et al., патент США 4765539; Coffee, патент США 4962885; Coffee, заявка PCT, WO 94/12285;Coffee, заявка PCT, WO 95/32807, эти источники включены в данный документ для сведения). Электрохимические свойства композиции соединения формулы (1) могут быть важными параметрами для оптимизации введения данного лекарственного препарата в легкие с использованием аэрозольного устройства EHD, и подобную оптимизацию обычно проводят специалисты в данной области. С помощью аэрозольных устройств EHD можно более эффективно доставлять лекарственные препараты в легкие по сравнению с существующими технологиями введения препаратов в дыхательные пути. Специалистам в данной области известны другие способы доставки соединения формулы (1) в легкие, и они находятся в объеме изобретения. Жидкие лекарственные композиции, подходящие для применения с распылителями, устройствами для жидких спреев и аэрозольными устройствами EHD, как правило, будут содержать соединение формулы (1) с фармацевтически приемлемым носителем. Предпочтительно фармацевтически приемлемый носитель представляет жидкость, такую как спирт, вода, полиэтиленгликоль или перфторуглерод. Необязательно можно добавить другое вещество для изменения аэрозольных свойств раствора или суспензии соединения формулы (1). Предпочтительно данное вещество является жидкостью, такой как спирт, гликоль, полигликоль или жирная кислота. Специалистам в данной области известны другие способы формуляции растворов или суспензий жидких лекарственных препаратов для применения в аэрозольных устройствах (см., например, Biesalski, патент США 5112598; Biesalski, патент США 5556611, эти источники включены в данный документ для сведения). Также соединение формулы (1) можно формулировать в виде композиций для ректального или интравагинального введения, таких как суппозитории или удерживаемые клизмы, например, содержащие обычные основы для суппозиториев, такие как какаомасло или другие глицериды. В дополнение к композициям, описанным выше, соединение формулы (1) также можно формулировать в виде препарата-депо. Такие длительно действующие композиции можно вводить посредством имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например,соединения можно формулировать с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионно-обменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Альтернативно можно использовать другие фармацевтические системы для доставки. Липосомы и эмульсии представляют хорошо известные примеры носителей для доставки, которые можно использовать для введения соединения формулы (1). Также можно использовать некоторые органические растворители, такие как диметилсульфоксид, хотя, как правило, одновременно за счет усиления токсичности. Соединение формулы (1) можно также доставлять с помощью системы с контролируемым высвобождением. В одном варианте осуществления можно использовать насос (Sefton, CRC Crit. Ref. Biomed. Eng.,1987, 14, 201; Buchwald et al., Surgery, 1980, 88, 507; Saudek et al., N. Engl. J. Med., 1989, 321, 574). В другом варианте осуществления можно использовать полимерные материалы (см. Medical Applications ofDuring et al., Ann. Neurol., 1989, 25, 351; Howard et al., J. Neurosurg., 71, 105(1989. В еще одном варианте осуществления систему с контролируемым высвобождением можно поместить вблизи с мишенью для соединений по изобретению, например легкими, для чего, таким образом, потребуется только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, p. 115(1984. Можно использовать другую систему с контролируемым высвобождением (см., например,Langer, Science, 1990, 249, 1527). Подходящие наполнители (например, носители и разбавители) и другие вещества, которые можно использовать для обеспечения лекарственных форм для введения через слизистые по данному изобрете- 13017005 нию, являются хорошо известными специалистам в области фармации, и они зависят от конкретного места применения и способа, которым вводят данную фармацевтическую композицию или лекарственную форму. С учетом этого факта типичные наполнители включают, не ограничиваясь этим, воду, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, которые являются нетоксичными и фармацевтически приемлемыми. В данной области хорошо известны примеры таких дополнительных ингредиентов. См., например, Remington'sPharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Значение pH фармацевтической композиции или лекарственной формы, или ткани, для которой применяют фармацевтическую композицию или лекарственную форму, также можно скорректировать для улучшения доставки одного или более активных ингредиентов. Аналогично для улучшения введения можно скорректировать полярность растворителя-носителя, его ионную силу или осмотичность. Также к фармацевтическим композициям или лекарственным формам можно добавить соединения, такие как стеараты, в целях преимущественного изменения гидрофильности или липофильности одного или более активных ингредиентов и, таким образом, улучшения введения. В этом отношении стеараты могут служить в качестве липидного носителя для композиции, в качестве эмульгатора или поверхностноактивного вещества и в качестве вещества, усиливающего доставку или усиливающего проникновение действующего вещества в ткани. Можно использовать различные соли, гидраты или сольваты активных ингредиентов для дополнительной корректировки свойств полученной композиции. Наборы. Изобретение относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих соединение формулы (1), пригодное для лечения или профилактики заболевания. В других предпочтительных вариантах осуществления изобретение относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих соединение формулы (1),пригодное для лечения или профилактики заболевания, или один или более контейнеров, содержащих дополнительное терапевтическое средство. Изобретение также относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих один или более ингредиентов фармацевтических композиций по изобретению. Необязательно вместе с таким контейнером(и) может находиться памятка в форме, установленной государственным управлением, регулирующим производство, применение или продажу фармацевтических или биологических продуктов, в которой представлено разрешение управления на производство, применение или продажу для лечения людей. Лечение заболевания. В одном варианте осуществления соединение формулы (1) используют в способах лечения и профилактики заболевания. Например, обеспечиваются способы профилактики или лечения инфекций у теплокровных животных, особенно у человека, вызванных патогенным микроорганизмом, включающие введение эффективного количества кристаллической формы соединения формулы (1). В предпочтительном варианте осуществления патогенный микроорганизм представляет бактериальную, грибковую или вирусную инфекцию, раскрытую в заявке WO 2005/121162, в предпочтительном варианте осуществления вирусную инфекцию, вызванную аденовирусом, цитомегаловирусом, вирусом гепатита A (HAV), вирусом гепатита B (HBV), флавивирусами, включая вирус желтой лихорадки и вирус гепатита C (HCV), вирусом герпеса простого типа 1 и 2, вирусом опоясывающего лишая, человеческим герпесвирусом 6, вирусом иммунодефицита человека (ВИЧ), вирусом папилломы человека (HPV), вирусом гриппа A, вирусом гриппа B, вирусом кори, вирусом парагриппа, вирусом полимиелита, поксвирусом (включая вирус натуральной оспы человека и обезьяний вирус), риновирусом, респираторным синцитиальным вирусом(RSV), многочисленными семействами вирусов, которые являются возбудителями геморрагической лихорадки различных типов, включая аренавирусы (LCM, вирус Хунин, вирус Мачупо, вирус Гуанарито и вирус лихорадки Ласса), буниавирусами (вирусами Ханта и вирусом лихорадки долины Рифт) и филовирусами (вирусом Эбола и вирусом Марбурга), рядом вирусов энцефалита, включая вирус Западного Нила, вирус Лакросс, вирус калифорнийского энцефалита, вирус венесуэльского лошадиного энцефалита,вирус восточного лошадиного энцефалита, вирус западного лошадиного энцефалита, вирус японского энцефалита, вирус болезни къянсанурского леса и вирусы клещевого энцефалита, такие как вирус конгокрымской геморрагической лихорадки. Особенно предпочтительными являются вирусы HBV и HCV. Другой вариант осуществления относится к способам модуляции иммунной активности цитокинов у теплокровных животных, особенно человека, включающим введение эффективного количества кристаллической формы соединения формулы (1). Также обеспечивается кристаллическая форма соединения формулы (1) для применения в медицине. Также обеспечивается применение кристаллической формы соединения формулы (1) для производства лекарственного препарата для лечения инфекции, вызванной патогеном, в частности вирусом, например HCV и HBV. Другой вариант осуществления относится к способам лечения опухолей или злокачественных заболеваний у млекопитающих введением млекопитающему (пациенту) терапевтически эффективного количества соединения формулы (1). Опухоли или злокачественные заболевания, предусмотренные для лечения, включают, не ограничиваясь этим, таковые, вызванные вирусом, и действие может включать подав- 14017005 ление трансформации зараженных вирусом клеток в злокачественные клетки, подавление распространения вирусов из трансформированных клеток в другие нормальные клетки и/или остановку роста трансформированных вирусом клеток. Полагают, что соединение по изобретению является пригодным для применения против широкого ряда опухолей, включая, не ограничиваясь этим, карциномы, саркомы и лейкемии. В данную группу входят карциномы молочной железы, ободочной кишки, мочевого пузыря,легких, предстательной железы, желудка и поджелудочной железы, и лимфобластные и миелоидные лейкемии. Количественное значение профилактической или терапевтической дозы соединения формулы (1) или его фармацевтически приемлемого сольвата или гидрата при кратковременном или длительном лечении или профилактике инфекции, однако, будет различаться в зависимости от природы и тяжести инфекции, и пути, которым вводят активный ингредиент. Доза и в некоторых случаях кратность введения также будут различаться в зависимости от заболевания, которое подвергается лечению, массы тела и ответной реакции у отдельного пациента. Подходящие схемы введения могут легко выбрать специалисты в данной области с учетом указанных факторов. Способы по настоящему изобретению особенно подходят для людей. В частности, способы и дозы по настоящему изобретению могут быть пригодными для пациентов с ослабленным иммунитетом, включая, не ограничиваясь этим, пациентов, зараженных ВИЧ, и пациентов с иммунодегенеративным заболеванием. Кроме того, способы можно использовать для пациентов с ослабленным иммунитетом, на время лечения находящихся в состоянии ремиссии. Способы и дозы по настоящему изобретению также являются, в частности, пригодными для пациентов, подвергающихся другой противовирусной терапии. Способы профилактики по настоящему изобретению являются особенно пригодными для пациентов с риском развития вирусной инфекции. Данные пациенты включают, не ограничиваясь этим, работников системы здравоохранения, например, врачей, медицинских сестер, сотрудников хосписов; военный персонал; учителей; работников по уходу за детьми; пациентов, путешествующих или проживающих в других странах, в частности, странах третьего мира, включая социальных работников, миссионеров и дипломатов. Наконец, способы и композиции включают лечение не поддающихся терапии пациентов или пациентов с резистентностью к лечению, такой как резистентность к ингибиторам обратной транскриптазы,ингибиторам протеазы и т.д. Дозы. Токсичность и эффективность соединения формулы (1) можно определить с использованием стандартных фармацевтических методов в клеточных культурах или на экспериментальных животных, например, с определением LD50 (дозы, вызывающей гибель 50% животных в группе) и ED50 (дозы, проявляющей 50% терапевтический эффект в группе). Соотношение токсической и терапевтической доз представляет терапевтический индекс и его можно выразить как соотношение LD50/ED50. Данные, полученные в тестах в клеточных культурах и в опытах на животных, можно использовать при определении пределов дозировок соединений для применения у людей. Предпочтительно дозы таких соединений находятся в пределах циркулирующих в крови концентраций, которые включают ED50, с незначительной токсичностью или без ее проявления. Дозировка может варьировать в данных пределах в зависимости от используемой лекарственной формы и применяемого пути введения. Для любого соединения, используемого в способе по изобретению, терапевтически эффективную дозу первоначально можно установить в тестах в клеточных культурах. Дозу можно определить на моделях животных с достижением циркулирующей в плазме крови концентрации, которая включает IC50 (т.е. концентрацию опытного соединения, при которой достигается половинное от максимального подавление симптомов) по данным тестов в клеточной культуре; альтернативно дозу соединения формулы (1) можно установить на моделях животных с достижением пределов циркулирующих в плазме крови концентраций соединения, которые соответствуют концентрации, необходимой для достижения фиксированной в количественном отношении ответной реакции. Такую информацию можно использовать для более точного установления пригодных доз у людей. Концентрации в плазме крови можно определить, например, высокоэффективной хроматографией высокого давления. Протоколы и композиции по изобретению предпочтительно тестируют в условиях in vitro и затем invivo в отношении желаемой терапевтической или профилактической активности перед применением у людей. Например, тесты in vitro, которые можно использовать для определения того, насколько показано применение конкретного терапевтического протокола, включают тесты на клеточных культурах в условиях in vitro, в которых клетки, реагирующие на воздействие соединения формулы (1), подвергают действию лиганда и количественно оценивают ответную реакцию с использованием соответствующего метода. Затем проводят оценку соединения формулы (1) в отношении его силы. Соединения для применения в способах по изобретению можно тестировать на подходящих модельных системах на животных перед испытанием у людей, включая, не ограничиваясь этим, крыс, мышей, кур, коров, обезьян, кроликов, хомяков и т.д. Затем соединения также можно использовать в соответствующих клинических испытаниях. Количественное значение профилактической или терапевтической дозы соединения формулы (1) по изобретению или его фармацевтически приемлемого сольвата или гидрата при кратковременном или- 15017005 длительном лечении или профилактике инфекции или состояния будет варьировать в зависимости от природы и тяжести инфекции, и пути, которым вводят активный ингредиент. Доза и, возможно, кратность введения также будут различаться в зависимости от заболевания, которое подвергается лечению,возраста, массы тела и ответной реакции отдельного пациента. Подходящие схемы введения могут легко выбрать специалисты в данной области с учетом указанных факторов. В одном варианте осуществления вводимая доза зависит от конкретного соединения, которое используется, и массы и состояния пациента. Подходящие дозы можно прогнозировать на основе данных, указанных выше исследований, в условияхin vitro и на основе результатов опытов на животных. В общем суточная доза находится в пределах примерно от 0,001 до 100 мг/кг, предпочтительно примерно от 1 до 25 мг/кг, более предпочтительно примерно от 5 до 15 мг/кг. Для лечения людей, зараженных вирусом гепатита C, соединение вводят в дозе примерно от 0,1 мг до примерно 15 г в сутки примерно от одного до четырех раз в сутки, предпочтительно от 100 мг до 12 г в сутки, более предпочтительно от 100 до 8000 мг в сутки. Кроме того, рекомендуемую суточную дозу можно вводить курсами в виде самостоятельных средств или в комбинации с другими терапевтическими препаратами. В одном варианте осуществления суточную дозу вводят в разовой дозе или в равно разделенных дозах. В близком варианте осуществления рекомендуемую суточную дозу можно вводить один раз в неделю, два раза в неделю, три раза в неделю,четыре раза в неделю или пять раз неделю. В одном варианте осуществления соединения по изобретению вводят для обеспечения системного распределения соединения в организме пациента. В близком варианте осуществления соединения по изобретению вводят для получения системного действия в организме. В другом варианте осуществления соединения по изобретению вводят перорально, через слизистую(включая сублингвальное, буккальное, ректальное, интраназальное или интравагинальное введение), парентерально (включая подкожное, внутримышечное введение, инъекцию-болюс, внутриартериальное или внутривенное введение), трансдермально или местно. В конкретном варианте осуществления соединения по изобретению вводят через слизистую (включая сублингвальное, буккальное, ректальное, интраназальное или интравагинальное введение), парентерально (включая подкожное, внутримышечное введение, инъекцию-болюс, внутриартериальное или внутривенное введение), трансдермально или местно. В дополнительном конкретном варианте осуществления соединения по изобретению вводят перорально. В дополнительном конкретном варианте осуществления соединения по изобретению не вводят перорально. Для различных инфекций можно применять различные терапевтически эффективные количества,как это хорошо известно специалистам в данной области. Аналогично количества, достаточные для лечения или профилактики таких инфекций, но не достаточные для того, чтобы вызвать, или достаточные для уменьшения побочных эффектов, связанных с обычными терапевтическими средствами, также входят в указанные выше пределы доз и схем кратности введения. Комбинированная терапия. Конкретные способы по изобретению дополнительно включают введение дополнительного терапевтического средства (т.е. иного терапевтического препарата, чем соединение по изобретению). В некоторых вариантах осуществления настоящего изобретения соединения по изобретению можно использовать в комбинации по меньшей мере с одним другим терапевтическим препаратом. Терапевтические препараты включают, не ограничиваясь этим, антибиотики, противорвотные препараты, антидепрессанты и противогрибковые средства, противовоспалительные препараты, противовирусные препараты, противоопухолевые препараты, иммуномодуляторы, -интерфероны, -интерфероны, рибавирин, алкилирующие агенты, гормоны, цитокины или модуляторы toll-подобных рецепторов. Соединение формулы (1) можно вводить или формулировать в комбинации с антибиотиками. Например, их можно формулировать с макролидным антибиотиком (например, тобрамицином (Tobi,цефалоспорином (например, цефалексином (Keflex, цефрадином (Velosef), цефуроксимом (Ceftin),цефпрозилом (Cefzil), цефаклором (Ceclor), цефиксимом (Suprax) или цефадроксилом (Duricef,кларитромицином (например, кларитромицином (Biaxin или эритромицином (например, эритромицином (EMycin, пенициллином (например, пенициллином V (V-Cillin K или Pen Vee K или хинолоном (например, офлоксацином (Floxin), ципрофлоксацином (Cipro) или норфлоксацином(Noroxin, аминогликозидными антибиотиками (например, апрамицином, арбекацином, бамбермицинами, бутирозином, дибекацином, неомицином, ундециленатом, нетилмицином, паромомицином, рибостамицином, сисомицином и спектиномицином), антибиотиками производными амфеникола (например,азидамфениколом, хлорамфениколом, флорфениколом и тиамфениколом), антибиотиками производными ансамицина (например, рифамидом и рифампином), карбацефемами (например, лоракарбефом), карбапенемами (например, биапенемом и имипенемом), цефалоспоринами (например, цефаклором, цефадроксилом, цефамандолом, цефатризином, цефазедоном, цефозопраном, цефпимизолом, цефпирамидом и цефпиромом), цефамицинами (например, цефбуперазоном, цефметазолом и цефминоксом), монобактамами (например, азтреонамом, карумонамом и тигемонамом), оксацефемами (например, фломоксефом и моксалактамом), пенициллинами (например, амдиноциллином, амдиноциллином пивоксилом, амокси- 16017005 циллином, бакампициллином, бензилпенициллиновой кислотой, натриевой солью бензилпенициллина,эпициллином, фенбенициллином, флоксациллином, пенамциллином, пенетаматом гидройодидом, пенициллином o-бенетамином, пенициллином O, пенициллином V, пенициллином V бензатином, пенициллином V гидрабамином, пенимепициклином и калиевой солью фенцихициллина), линкозамидами (например, клиндамицином и линкомицином), амфомицином, бацитрацином, капреомицином, колистином, эндурацидином, энвиомицином, тетрациклинами (например, апициклином, хлортетрациклином, хломоциклином и демеклоциклином), 2,4-диаминопиримидинами (например, бродимопримом), нитрофуранами(например, фуралтадоном и фуразолием хлоридом), хинолонами и его аналогами (например, циноксацином, клинафлоксацином, флумеквином и грепаглоксацином), сульфонамидами (например, ацетилсульфаметоксипиразином, бензилсульфамидом, ноприлсульфамидом, фталилсульфацетамидом, сульфакриозоидином и сульфацитином), сульфонами (например, диатимосульфоном, натриевой солью глюкосульфона и соласульфоном), циклосерином, мупироцином и туберином. Соединение формулы (1) также можно вводить или формулировать в комбинации с противорвотными средствами. Подходящие противорвотные средства включают, не ограничиваясь этим, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензквинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопримазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинолы, тиэтилперазин, тиопроперазин, трописетрон и их смеси. Соединение формулы (1) можно вводить или формулировать в комбинации с антидепрессантом. Подходящие антидепрессанты включают, не ограничиваясь этим, бинедалин, кароксазон, циталопрам,диметазан, фенкамин, индалпин, инделоксазин, гидрохолорид, нефопам, номифензин, окситриптан, оксипертин, пароксетин, сертралин, тиазесим, тразодон, бенмоксин, ипроклозид, ипрониазид, изокарбоксазид, ниаламид, октамоксин, фенелзин, котинин, ролициприн, ролипрам, макротилин, метралиндол, миансерин, миртазепин, адиназолам, амитриптилин, амитриптилиноксид, амоксапин, бутриптилин, кломипрамин, демексиптилин, дезипрамин, дибензепин, диметакрин, дотиепин, доксепин, флуацизин, имипрамин, имипрамин N-оксид, иприндол, лофепрамин, мелитрацен, метапрамин, нортриптилен, ноксиптилин,опипрамол, пизотилин, пропизепин, протриптилин, квинупрамин, тианептин, тримипрамин, адрафинил,бенактизин, бупропион, бутацетин, диоксадрол, дулоксетин, этоперидон, фебарбамат, фемоксетин, фенпентадиол, флуоксетин, флувоксамин, гематопорфирин, гиперицин, левофацетоперан, медифоксамин,милнаципрам, минаприн, моклобемид, нефазодон, оксафлозан, пибералин, пролинтан, пирисукцидеанол,ритансерин, роксиндол, хлорид рубидия, сулпирид, тандоспирон, тозалинон, тофенацин, толоксатон,транилципромин, L-триптофан, венлафаксин, вилоксазин и зимелдин. Соединение формулы (1) можно вводить или формулировать в комбинации с противогрибковым препаратом. Подходящие противогрибковые препараты включают, не ограничиваясь этим, амфотерицинB, итраконазол, кетоконазол, флуконазол, интратекал, флуцитозин, миконазол, бутоконазол, клотримазол, нистатин, терконазол, тиоконазол, циклопирокс, эконазол, галопрогрин, нафтифин, тербинафин, ундециленат и гризеофульвин. Соединение формулы (1) можно вводить или формулировать в комбинации с противовоспалительным препаратом. Подходящие противовоспалительные препараты включают, не ограничиваясь этим,нестероидные противовоспалительные препараты, такие как салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, сальсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, этодолак, мефенамовую кислоту, натриевую соль меклофенамат, толметин, кеторолак,диклофенак, ибупрофен, напроксен, натриевую соль напроксена, фенопрофен, кетопрофен, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, амприроксикам, дроксикам, пивоксикам, теноксикам, набуметом, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон и нимесулид; антагонисты лейкотриена, включая, не ограничиваясь этим, зилейтон, ауротиоглюкозу, золото-натрий тиомалат и ауранофин; стероиды, включая, не ограничиваясь этим, алклометазон дипроприонат, амцинонид, беклометазон дипроприонат, бетаметазон, бетаметазон бензоат, бетаметазон дипроприонат, бетаметазон натрий фосфат, бетаметазон валерат, клобетазол проприонат, клокортолон пивалат, гидрокортизон, производные гидрокортизона, дезонид, дезоксиматазон, дексаметазон, флунизолид, флукоксинолид, флурандренолид,гальциноцид, медризон, метилпреднизолон, метпреднизолон ацетат, метилпреднизолон натрий сукцинат,мометазон фуроат, параметазон ацетат, преднизолон, преднизолон ацетат, преднизолон натрий фосфат,преднизолон тебуатат, преднизон, триамцинолон, триамцинолон ацетонид, триамцинолон диацетат и триамцинолон гексацетонид; и другие противовоспалительные препараты, включая, не ограничиваясь этим, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон. Соединение формулы (1) можно вводить или формулировать в комбинации с другим противовирусным препаратом. Подходящие противовирусные препараты включают, не ограничиваясь этим, ингибиторы протеазы, нуклеозидные ингибиторы обратной транскриптазы, протеазы, ненуклеозидные ингибиторы обратной транскриптазы и аналоги нуклеозидов. Противовирусные препараты включают, не ограничиваясь этим, зидовудин, ацикловир, гангцикловир, видарабин, идоксуридин, трифлуридин, левовирин, вирамидин и рибавирин, а также фоскарнет, амантадин, римантадин, саквинавир, индинавир, ам- 17017005 пренавир, лопинавир, ритонавир, -интерфероны; -интерфероны; адефовир, клевадин, энтекавир, плеконарил. Соединение формулы (1) можно вводить или формулировать в комбинации с иммуномодулятором. Подходящие иммуномодуляторы включают, не ограничиваясь этим, метотрексат, лефлуномид, циклофосфамид, циклоспорин A, микофенолят мофетил, рапамицин (сиролимус), мизорибин, дезоксиспергуалин, бреквинар, малононитрилоамиды (например, лефлунамид), модуляторы рецепторов T-клеток и модуляторы рецепторов цитокинов, пептидомиметики и антитела (например, человеческие, гуманизированные, химерные, моноклональные, поликлональные антитела, фрагменты Fvs, ScFvs, Fab или F(ab)2 или связывающие фрагменты эпитопов), нуклеиново-кислотные молекулы (например, антисмысловые нулкеиновокислотные молекулы и тройные спирали), небольшие молекулы, органические соединения и неорганические соединения. Примеры модуляторов рецепторов T-клеток включают, не ограничиваясь этим, антитела против рецепторов T-клеток (например, анти-CD4-антитела (например, cM-Т 412 (Boehringer), IDEC-CE9.1 (IDEC и SKB), mAB 4162W94, Orthoclone и OKTcdr4a (Janssen-Cilag, анти-CD3 антитела (например, Nuvion (Product Design Labs), OKT3 (JohnsonJohnson) или Rituxan (IDEC), антиCD5-антитела (например, связанный с рицином иммуноконъюгат против CD5), анти-CD7-антитела (например, СНН-380 (Novartis, анти-С 08-антитела, моноклональные антитела против лиганда CD40 (например, IDEC-131 (IDEC, анти-CD52-антитела (например, CAMPATH 1H (Ilex, анти-CD2-антитела,анти-CD11a-антитела (например, Xanelim (Genentech, анти-B7-антитела (например, IDEC-114 (IDEC,CTLA4-иммуноглобулин и модуляторы toll-подобных рецепторов (TLR). Примеры модуляторов рецепторов цитокинов включают, не ограничиваясь этим, растворимые рецепторы цитокинов (например, внеклеточный домен рецептора TNF- или его фрагмент, внеклеточный домен рецептора IL-1 или его фрагмент и внеклеточный домен рецептора IL-6 или его фрагмент), цитокины или их фрагменты (например, интерлейкин IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-15, TNF-, интерферон IFN-, IFN-, IFN- и GM-CSF), антитела против рецепторов цитокинов (например, антитела против рецептора IFN, антитела против рецептора IL-2 (например, Zenapax (Protein Design Labs, антитела против рецептора IL-4, антитела против рецептора IL-6, антитела против рецептора IL-10 и антитела против рецептора IL-12), антитела против цитокинов (например, антитела против IFN, антитела против TNF-,антитела против IL-1, антитела против IL-6, антитела против IL-8 (например, ABX-IL-8 (Abgenix и антитела против IL-12). Соединение формулы (1) можно вводить или формулировать в комбинации со средством, которое ингибирует вирусные ферменты, включая, не ограничиваясь этим, ингибиторы протеазы HCV, такие какBILN 2061, SCH-503034, ITMN-191 или VX-950; и ингибиторы полимеразы NS5B, такие как NM107 (и его пролекарство NM283), R1626, R7078, BILN1941, GSK625433, GILD9128 или HCV-796. Соединение формулы (1) можно вводить или формулировать в комбинации со средством, которое ингибирует полимеразу HCV, например, описанным Wu, Curr. Drug Targets Infect. Disord., 3, 207-219(2003), или в комбинации с соединениями, которые ингибируют функцию геликазы вируса, например,описанными Bretner M. et al., Nucleosides Nucleotides Nucleic Acids, 22, 1531 (2003), или с ингибиторами других специфических мишеней HCV, например, описанными Zhang X., IDrugs, 5(2), 154-158 (2002). Соединение формулы (1) можно вводить или формулировать в комбинации со средством, которое ингибирует репликацию вирусов. Соединение формулы (1) можно вводить или формулировать в комбинации с цитокинами. Примеры цитокинов включают, не ограничиваясь этим, интерлейкин-2 (IL-2), интерлейкин-3 (IL-3), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-7 (IL7), интерлейкин-9 (IL-9), интерлейкин-10 (IL-10), интерлейкин-12 (IL-12), интерлейкин-15 (IL-15), интерлейкин-18 (IL-18), фактор роста тромбоцитов (PDGF), эритропоэтин (Epo), эпидермальный фактор роста(EGF), фактор роста фибробластов (FGF), колониестимулирующий фактор гранулоцитов-макрофагов(GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор макрофагов (M-CSF), пролактин и интерферон (IFN), например IFN- и IFN-. Соединение формулы (1) можно вводить или формулировать в комбинации с гормонами. Примеры гормонов включают, но не ограничиваются этим, лютеинизирующего гормона высвобождающий гормон(LHRH), гормон роста (GH), гормона роста высвобождающий гормон, АКТГ, соматостатин, соматотропин, соматомедин, гормон паращитовидной железы, высвобождающие факторы гипоталамуса, инсулин,глюкагон, энкефалины, вазопрессин, кальцитонин, гепарин, низкомолекулярные гепарины, гепариноиды,синтетические и природные опиоиды, инсулин-стимулирующие гормоны щитовидной железы и эндоприны. Соединение формулы (1) можно вводить или формулировать в комбинации с -интерферонами, которые включают, не ограничиваясь этим, интерферон -1a, интерферон -1b. Соединение формулы (1) можно вводить или формулировать в комбинации с -интерферонами, которые включают, не ограничиваясь этим, интерферон -1, интерферон -2a (роферон), интерферон -2b,интрон, Peg-интрон, Pegasys, консенсусный интерферон (инферген) и албуферон. Соединение формулы (1) можно вводить или формулировать в комбинации с веществом, усиливающим всасывание, в частности, которое направлено на лимфатическую систему, включая, не ограни- 18017005 чиваясь этим, гликохолат натрия; натрий капрат; N-лаурилD-мальтопиранозид; ЭДТА; смешанную мицеллу; и о которых сообщалось Muranishi, Crit. Rev. Ther. Drug Carrier Syst., 7-1-33, этот источник включен в полном объеме в данный документ для сведения. Можно использовать другие вещества, усиливающие всасывание. Соединение формулы (1) можно вводить или формулировать в комбинации с алкилирующим агентом. Примеры алкилирующих агентов включают, не ограничиваясь этим, азотистые иприты, этиленимины, метилмеламины, алкилсульфонаты, нитрозомочевины, триазены, меклоретамин,циклофосфамид, ифосфамид, мелфалан, хлорамбуцил, гексаметилмелаин, тиотепу, бузульфан, кармустин, стрептозоцин, дакарбазин и темозоломид. Соединение формулы (1) и другие лекарственные средства могут действовать аддитивно или более предпочтительно синергически. В одном варианте осуществления композицию, содержащую соединение по изобретению, вводят совместно с введением другого лекарственного средства, которое может быть частью одной композиции или находиться в другой композиции по сравнению с содержащей соединения по изобретению. В другом варианте осуществления соединение по изобретению вводят до или после введения другого лекарственного препарата. В отдельном варианте осуществления соединение по изобретению вводят пациенту, который ранее не подвергался лечению или на текущий момент не подвергается лечению другим лекарственным средством, в частности противовирусным препаратом. Способы получения. В еще одном варианте осуществления настоящее изобретение относится к способу получения соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она, формула (1) которой приведена ниже Способ является операционно простым, рациональным и эффективным и его можно использовать для масштабного промышленного получения данной соли. Кроме того, способ является экономичным и показывает высокую производительность и высокий выход в целом. В одном варианте осуществления способ синтеза соли п-толуолсульфокислоты 5-амино-3-(2'-Oацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она включает стадии:(соединение 3) с образованием соединения формулы (4)(iii) взаимодействия 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 5) с п-толуолсульфокислотой с образованием соли птолуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 1) В еще одном варианте осуществления стадия (i) включает сочетание 5-амино-3H-тиазоло[4,5d]пиримидин-2-она (соединение 2) с дезоксирибофуранозой формулы (3B) с образованием соединения формулы (4) Реакцию сочетания на стадии (i) можно проводить без растворителя в реакционном "расплаве" при высокой температуре (выше 130C), как правило, с использованием 1,3-бис-(4-нитрофенил)фосфата в качестве кислотного катализатора и в некоторых случаях в вакууме. Альтернативно реакцию проводят в растворителе, таком как ацетонитрил, толуол, дихлорэтан, ДМФА, метиленхлорид и их смеси. Как правило, реакцию сочетания проводят в присутствии кислоты, такой как триметилсилилтрифлат (TMSOTf),AlCl3, SnCl4 и TiCl4 вместе с силилирующим реагентом, таким как N,O-бис-(триметилсилил)ацетамид("BSA") или триметилсилилхлорид. Затем реакцию сочетания останавливают добавлением воды, которая гасит избыток кислоты и силилирующего реагента. В том случае, когда используют TMSOTf и BSA, то гашение реакции водой приводит к образованию водной трифликовой кислоты и гексаметилдисилоксана(CAS107-46-0). Водный раствор кислоты служит для гидролитического удаления остаточных силильных групп из гетероциклического фрагмента соединения формулы (4). В другом варианте осуществления в реакции сочетания на стадии (i) используют избыток 5-амино 3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) по отношению к дезоксирибофуранозе (соединение 3), основываясь на стехиометрии реакции. Например, 5-амино-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 2) может находиться в избытке примерно от 5 до примерно 50%, от примерно 5 до примерно 25% и от примерно 5 до примерно 15%. Кроме того, 5-амино-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 2) может находиться примерно в 10% избытке к дезоксирибофуранозе (соединение 3), основываясь на стехиометрии реакции. Избыток 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) удаляют повышением значения pH реакционной смеси после окончания реакции сочетания на стадии (i) в присутствии инертного твердого вещества, которое можно наносить и удалять фильтрованием. При последующей нейтрализации (с использованием основания, такого как бикарбонат натрия) добавляют хлорид натрия с получением трехслойной жидкой системы, способной к разделению фаз. Отделение избытка 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 2) может быть затруднительным. Однако было установлено, что повышение pH реакционной смеси после окончания реакции в присутствии инертного твердого вещества облегчает отделение. Значение pH повышают с помощью основания, такого как гидроксид натрия и/или карбонат натрия, в присутствии инертного твердого вещества, такого как фильтр с целитом, для осаждения избытка 5-амино-3H-тиазоло[4,5-d]пиримидин-2-она(соединение 2). Инертное твердое вещество наносится, и затем его удаляют фильтрованием. При дальнейшей нейтрализации основанием добавляют дополнительное количество хлорида натрия к оставшемуся фильтрату с получением трехслойной жидкой системы, способной к разделению фаз. Слой с наименьшей плотностью (верхний) представляет собой чистый гексаметилдисилоксан, который можно удалить разделением фаз, и при этом устраняется необходимость в перегонке (обычный путь удаления). Средняя фаза содержит желаемый нуклеозид (соединение 4) и ацетонитрил. Слой с наибольшей плотностью (нижний) представляет собой водное основание и его можно экстрагировать ацетонитрилом для дополнительного выделения соединения формулы (4) из реакционной смеси. После этого соединение формулы (4) является чистым и находится в смеси растворителей, которая является адекватной для проведения стадии (ii) без необходимости в дополнительной очистке. На стадии (ii) 5'-ацетат в соединении формулы (4) избирательно отщепляется. Это можно провести с использованием фермента, такого как Candida antarctica. Candida antarctica является промышленно доступным от Biocatalytics, Inc. Как правило, фермент ковалентно связан с твердой подложкой. Связанный с твердой подложкой фермент обеспечивает более эффективную рециркуляцию и обеспечивает более короткое время реакции. Раствор соединения формулы (4) в ацетонитриле, полученный на стадии (i), до- 20017005 бавляют к перемешиваемой суспензии находящегося на подложке фермента и буферу с pH примерно 7. Его также можно добавить к суспензии находящегося на подложке фермента в воде, содержащей основание, такое как бикарбонат натрия или ацетат натрия. Альтернативно раствор можно добавить к безводному этанолу и бикарбонату натрия и/или ацетату натрия с образованием, по существу, не содержащей воду суспензии находящегося на подложке фермента. После окончания реакции находящийся на подложке фермент отфильтровывают, промывают и хранят для дальнейшего применения. К фильтрату можно добавить хлорид натрия и экстрагировать изопропилацетатом. Такие соединения, как 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-он (соединение 5), являются трудными для очистки и часто практически не поддающимися очистке веществами. Выпаривание растворителя или осаждение на данной стадии представляет собой не адекватный способ сохранения состояния продукта, которое является субоптимальным. Однако при использовании способа по настоящему изобретению устраняется необходимость в очистке соединения формулы (5) и не требуется выпаривания растворителя или осаждения продукта. 5-Амино-3-(2'-Oацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 5) является уже чистым и находится в смеси растворителей, которая является адекватной для проведения стадии (iii). Стадия (iii) включает взаимодействие 5-амино-3-(2'-O-ацетил-3'-дезоксиO-рибофуранозил)-3Hтиазоло[4,5-d]пиримидин-2-она (соединение 5) с п-толуолсульфокислотой в растворителе с образованием соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 1). Как правило, реакцию проводят при температуре от примерно -20 до 40 С, от примерно 0 до примерно 30 С и от примерно 15 до примерно 30 С. Растворители, подходящие для реакции, включают, например, этанол, метанол, н-пропанол, изопропанол, н-бутанол, изобутанол,этилацетат, ацетонитрил, изопропилацетат, ТГФ и их смеси. Например, растворитель может содержать смесь изопропилацетата и ацетонитрила. В одном варианте осуществления смесь изопропилацетата и ацетонитрила получают на стадии (ii) и способ дополнительно включает добавление этанола. Как правило, количество сульфокислоты, использованной на стадии (iii), представляет таковое в пределах от эквимолярного количества до примерно 10% молярного избытка, основываясь на стехиометрии реакции. Взаимодействие на стадии (iii) проводят при любой концентрации реагентов. Например, концентрация реагентов может варьировать от примерно 1 до примерно 1000 ммоль. Кроме того, концентрация находится в пределах от примерно 50 до примерно 500 ммоль или от примерно 100 до примерно 250 ммоль. Раствор 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она(соединение 5) подвергают взаимодействию с раствором п-толуолсульфокислоты. Растворы смешивают в течение периода времени от примерно 5 мин до примерно 2 ч или от примерно 5 мин до примерно 1 ч. Кроме того, раствор п-толуолсульфокислоты можно добавлять к реакционной смеси, в которой синтезируют соединение формулы (1), как описано в публикации заявки на патент США 2006/0160830 (серия 11/304691), этот источник включен в полном объеме в данный документ для сведения. Реакцию на стадии (iii) проводят при температуре от примерно -20 до примерно 40 С, от примерно 0 до примерно 30 С и от примерно 15 до примерно 30 С. Растворители, подходящие для реакции, включают этанол, метанол, н-пропанол, изопропанол, н-бутанол, изобутанол, этилацетат, ацетонитрил, изопропилацетат, ТГФ и их смеси. В одном варианте осуществления смесь содержит изопропилацетат и ацетонитрил, которую получают на стадии (ii), и способ дополнительно включает добавление этанола к данной смеси. Как правило, количество сульфокислоты на стадии (iii) представляет таковое в пределах от эквимолярного количества до примерно 25% молярного избытка или примерно таковое в пределах от эквимолярного количества до примерно 10% молярного избытка, основываясь на стехиометрии реакции. При смешивании раствора 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 5) с раствором п-толуолсульфокислоты, соль п-толуолсульфокислоты 5 амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1) выпадает в осадок или кристаллизуется. Затем продукт реакции выделяют фильтрованием, промыванием и высушиванием. Также продукт реакции можно выделить выпариванием растворителя из реакционной смеси, осаждением или кристаллизацией продукта из альтернативной системы растворителей или можно выделить охлаждением реакционной смеси для осаждения или кристаллизации продукта. Обычно выделенный продукт соль п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил 3H-тиазоло[4,5-d]пиримидин-2-она (соединение 1) промывают и затем высушивают при температуре от примерно 40 до примерно 70 С или от примерно 50 до примерно 60 С. Высушивание можно проводить при атмосферном давлении или при пониженном давлении (в вакууме). Пониженное давление может находиться в пределах от примерно 0,1 до примерно 10 дюймов рт.ст. Способ, раскрытый в данном документе, может дополнительно включать стадию выделения соли птолуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5d]пиримидин-2-она (соединение 1), в котором чистота выделенной соли составляет по меньшей мере 95,96, 97, 98, 99, 99,5, 99,6, 99,7, 99,8 или 99,9%. Настоящее изобретение также относится к способу получения соединений формулы (3) и формулы(3B). На следующей схеме приведены два этих способа. В первой последовательности реакций (схема реакции 1) соединение формулы (6) подвергают сульфированию с помощью сульфирующего реагента в присутствии основания с получением замещенного сульфонилом соединения формулы (7). Последовательность реакций (схема 1) является следующей. Схема реакции 1 Сульфирующий реагент, основание и растворитель не ограничиваются при условии, что они могут обеспечить химическую реакцию, приведенную на схеме 1. Группа R на схеме реакций 1 может быть необязательно замещена алкилом или арилом. Неограничивающие примеры сульфирующих реагентов включают алкилсульфоновый ангидрид,алкилсульфогалогенид, ароматический сульфоновый ангидрид, ароматический сульфогалогенид и их смеси. Сульфирующие реагенты включают трифликовый ангидрид, тозилхлорид, метансульфоновый ангидрид, метансульфогалогенид, бензолсульфогалогенид, замещенный бензолсульфогалогенид, бензолсульфоновый ангидрид, замещенный бензолсульфоновый ангидрид и их смеси. Основание, использованное на схеме реакции 1, не ограничивается, и оно может быть органическим или неорганическим основанием, таким как триэтиламин, диизопропилэтиламин, имидазол или пиридин. Растворитель, использованный на схеме реакции 1, не ограничивается. Можно использовать галогенсодержащий растворитель, такой как дихлорметан, дихлорэтан и их смеси. В общем можно использовать непротонные растворители, такие как тетрагидрофуран или ацетонитрил. Последовательность реакций, приведенную на схеме 1, проводят при температуре от примерно -40 до примерно 25 С. Кроме того, реакцию можно проводить при температуре от примерно -20 до примерно 0 С. В последующей последовательности (схема реакции 2) замещенное сульфонилом соединение формулы (V), полученное в реакции на схеме 1, восстанавливают под действием восстановителя с образованием соединения формулы (8). Последовательность реакций (схема 2) является следующей. Схема реакции 2 Восстановитель, использованный на схеме реакции 2, не ограничивается при условии, что восстановитель может обеспечивать проведение необходимой реакции восстановления. Восстановитель может представлять борогидрид. Борогидрид может быть борогидридом тетраалкиламмония, борогидридом тетрабутиламмония, борогидридом натрия, цианоборогидридом натрия, борогидридом лития, борогидридом калия, борогидридом магния, борогидридом кальция, триацетоксиборогидридом натрия и их смесями. Растворитель, использованный на схеме реакции 2, не ограничивается. Можно использовать такие растворители, как толуол, бензол, ксилол, другие замещенные производные бензола и их смеси. Кроме того, можно использовать непротонные растворители, такие как диоксан, дихлорэтан, тетрагидрофуран и- 22017005 их смеси. Последовательность реакций, приведенную на схеме 2, проводят при температуре от примерно 25 до примерно 100 С. Кроме того, реакцию можно проводить при температуре от примерно 60 до примерно 80 С. В последующей последовательности (схема реакции 3) соединение формулы (8), полученное в реакции на схеме 2, гидролизуют водой в присутствии кислоты с получением соединения формулы (9). Последовательность реакций (схема 3) является следующей. Схема реакции 3 Кислота, использованная на схеме реакции 3, не ограничивается, и можно использовать неорганические или органические кислоты. Реакцию можно проводить в водном растворителе. Реакцию также можно проводить с 50% водным раствором уксусной кислоты или водным раствором HCl. Последовательность реакций, приведенную на схеме 3, проводят при температуре от примерно 0 до примерно 50 С. Кроме того, последовательность реакций, представленную на схеме 3, также можно проводить при температуре от примерно 20 до примерно 30 С. В последующей последовательности реакций (схема 4) соединение формулы (9), полученное в реакции на схеме 3, подвергают окислению под действием окислителя, затем восстанавливают под действием восстановителя с получением соединения формулы (10). Последовательность реакций (схема 4) является следующей. Схема реакции 4 Окислитель, использованный на схеме реакции 4, не ограничивается при условии, что окислитель может обеспечить проведение необходимой реакции окисления. Окислители включают периодат натрия,ацетат свинца и их смеси. Восстановитель, использованный на схеме реакции 4, не ограничивается, и он включает восстановители, перечисленные выше, которые использовались для схемы реакции 2. Растворитель, использованный на схеме реакций 4, не ограничивается. Растворители включают метанол, метиленхлорид, комбинацию метиленхлорида и метанола или комбинацию метанола и воды. Последовательность реакций, приведенную на схеме 4, проводят при температуре от примерно 0 до примерно 50 С. Кроме того, последовательность реакций, представленную на схеме 4, также можно проводить при температуре от примерно 20 до примерно 30 С. В конечной последовательности реакций (схема 5) соединение формулы (10), полученное в реакции на схеме 4, подвергают ацетилированию с использованием ацетилирующего реагента, такого как уксусный ангидрид или уксусный хлорангидрид, в присутствии кислотного катализатора, с получением соединения формулы (3). Последовательность реакций (схема 5) является следующей. Кислотный катализатор, использованный на схеме реакции 5, не ограничивается, и он включает неорганическую кислоту, органическую кислоту или обе неорганическую и органическую кислоту. Кислоты включают азотную кислоту, соляную кислоту, серную кислоту, сернистую кислоту, трифторуксусную кислоту, алкилсульфокислоту, арилсульфокислоту и их иммобилизованные формы и смеси. Как правило, последовательность реакций, приведенную на схеме 5, проводят в органическом растворителе, который содержит кислотные катализаторы, перечисленные выше. Также растворитель может представлять уксусную кислоту, смесь уксусная кислота/органический растворитель или смесь уксусная кислота/водный растворитель. Последовательность реакций, приведенную на схеме 5, проводят при температуре от примерно 0 до примерно 50 С. Кроме того, последовательность реакций, представленную на схеме 5, также можно проводить при температуре от примерно 20 до примерно 30 С. В дополнительном варианте осуществления изобретения общую схему реакций, приведенную выше(схемы 1-5), можно проводить, начиная с производного глюкофуранозы, реагента формулы (6B), с получением производного ацетилдезоксиксилофуранозы формулы (3B), как представлено на схеме реакций 6 следующим образом. Схема реакций 6 Реагенты и условия реакций, описанные для схем 1-5, можно использовать для схемы реакций 6. В дополнительном варианте осуществления изобретения общую схему реакций, приведенную выше(схемы 1-5), можно проводить, начиная с производного аллофуранозы, реагента формулы (6C), с получением производного ацетилдезоксиксилофуранозы формулы (3B), как представлено на схеме реакций 7 следующим образом. Реагенты и условия реакций, описанные для схем 1-5, можно использовать для схемы реакций 7. Также изобретение включает вариант осуществления, в котором смесь соединений формулы (6B) и(6C) используют в качестве исходных веществ, с получением конечного продукта формулы (3B) с использованием общей схемы реакций в целом, приведенной на схемах 1-5. Производное ацетилдезоксиксилофуранозы, 1,2,5-три-O-ацетил-3-дезокси-D-ксилофуранозу (соединение 3B), получают по схеме реакций 8 следующим образом. Схема реакций 8 Реагенты и условия реакций, описанные для схем 1-5, можно использовать для схемы реакций 8. Дополнительный вариант осуществления изобретения включает способ восстановления замещенного сульфонилом соединения формулы (7) восстановителем с получением соединения формулы (8) в которой R представляет необязательно замещенный алкил или арил. В одном конкретном варианте осуществления изобретения R представляет CF3, CH3 или -C6H4CH3. Соединение формулы (7) может представлять изомер глюкофуранозы формулы (7B) или изомер аллофуранозы формулы (7C), приведенные выше, или смесь соединений формулы (7B) и (7C) или смесь обоих. Восстановитель может представлять борогидрид. Борогидрид может быть борогидридом тетраалкиламмония, борогидридом тетрабутиламмония, борогидридом натрия, цианоборогидридом натрия, борогидридом лития, борогидридом калия, борогидридом магния, борогидридом кальция, триацетоксиборогидридом натрия и их смесями. Примеры Последующие примеры приведены только для иллюстрации и не предназначены для ограничения объема изобретения. На схемах синтеза, приведенных выше, если не указано иначе, значения температуры приведены в градусах Цельсия и все части и проценты приведены по массе. Реагенты были получены от коммерческих поставщиков, таких как Aldrich Chemical Company илиLancaster Synthesis Ltd., и их использовали без дополнительной очистки, если не указано иначе. Все растворители были получены от коммерческих поставщиков, таких как Aldrich, EMD Chemicals или Fisher, и их использовали в том виде, в котором они были получены. Реакции, приведенные ниже, как правило, проводили при положительном давлении азота или аргона при комнатной температуре (если не указано иначе) в безводных растворителя, и реакционные колбы снабжали тонкой резиновой прокладкой для внесения субстратов и реагентов через шприц. Стеклянную посуду высушивали в сушильном шкафу и/или высушивали жаром. Реакционные смеси анализировали TCX и/или анализировали ЖХ-МС и об их окончании судили по расходу исходного вещества. Проводили аналитическую тонкослойную хроматографию (ТСХ) на стеклянных пластинках, предварительно покрытых силикагелем 60 F254 толщиной 0,25 мм (EMD Chemicals),и проявляли под УФ-светом (254 нм) и/или йодом на силикагеле, и/или нагреванием с красителями для ТСХ, такими как фосфомолибденовая кислота в этаноле, раствор нингидрина, раствор перманганата калия или раствор сульфата церия. Препаративную тонкослойную хроматографию (препТСХ) проводили на стеклянных пластинках, предварительно покрытых силикагелем 60 F254 толщиной 0,5 мм (2020 см производства Thompson Instrument Company), и проявляли под УФ-светом (254 нм). 1H-ЯМР спектры и 13C-ЯМР спектры снимали на Varian Mercury-VX400 при 400 МГц. ЯМРспектры снимали в CDCl3 (выражали в ppm) с использованием хлороформа в качестве референсстандарта (7,27 ppm для протона и 77,00 ppm для углерода), CD3OD (3,4 ppm для протона и 49,3 ppm для углерода), ДМСО-d6 (2,49 ppm для протона) или в подходящих случаях тетраметилсилан в качестве внутреннего стандарта (0,00 ppm). Использовали при необходимости другие растворители, предназначенные для ЯМР. При регистрации множественных пиков использовали следующие сокращения: с(синглет), д (дублет), т (триплет), кв. (квартет), м (мультиплет), ушир. (широкий), ушир.с (широкий синглет), дд (дублет дублетов), дбт (дублет триплетов). Константы сочетания, когда они представлены, выражены в герцах (Гц). Инфракрасные спектры (ИК) записывали на спектрометре ATR FT-IR в виде чистых масел или твердых веществ и при предоставлении выражены в волновых числах (см-1). Масс-спектры представляют(+)-ES или APCI(+)LC/MS, полученные Analytical Chemistry Department of Anadys Pharmaceuticals, Inc. Элементный анализ проводили Atlantic Microlab., Inc. в Norcross, GA. Точки плавления (т.пл.) определяли на приборе с открытым капилляром и использовали без корректировки.- 26017005 В описанных способах синтеза и экспериментальных методах используются обычные химические сокращения, 2,2-DMP (2,2-диметоксипропан), Ac (ацетил), ACN (ацетонитрил), Bn (бензил), ВОС (третбутоксикарбонил),Bz(4-(N,Nдиметиламино)пиридин), ДМФА (N,N-диметилформамид), ДМСО (диметилсульфоксид), EDC (1-(3 диметиламинопропил)-3-этилкарбодиимид гидрохлорид), Et (этил), EtOAc (этилацетат), EtOH (этанол),HATU (О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат), HBTU (О-бензотриазол 1-ил-N,N,N',N'-тетраметилуроний гексафторфосфат), HF (фтористо-водородная кислота), НОВТ (1 гидроксибензотриазол гидрат), ВЭЖХ (высокоэффективная жидкостная хроматография), IPA (изопропиловый спирт), KOtBu (трет-бутилат калия), LDA (диизопропиламид лития), МСРВА (3 хлорпероксибензойная кислота), Me (метил), MeCN (ацетонитрил), MeOH (метанол), NaH (гидрид натрия), NaOAc (ацетат натрия), NaOEt (этилат натрия), Phe (фенилаланин), PPTS (пиридиний птолуолсульфонат), PS (полимер на подложке), Py (пиридин), pyBOP бензотриазол-1 илокси)трипирролидинофосфоний гексафторфосфат), TEA (триэтиламин), ТФК (трифторуксусная кислота), TFAA (трифторуксусный ангидрид), ТГФ (тетрагидрофуран), ТСХ (тонкослойная хроматография), Tol (толуоил), Val (валин) и т.п. Пример 1. Синтез соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3Hтиазоло[4,5-d]пиримидин-2-она. Стадия (i) - реакция сочетания. В трехгорлую колбу, снабженную датчиком температуры, холодильником и входным отверстием для азота, загружают 5-амино-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 2) [полученный согласно методу Wolfe et al. J. Org. Chem. 1997, 62, 1754-1759] (22 г, 130,9 ммоль) и ацетонитрил (198 мл). При перешивании в атмосфере азота вносят BSA (79,86 мл, 327,8 ммоль) через воронку и смесь подогревают до 40 С в течение 90 мин в атмосфере азота. Темный однородный раствор охлаждают до 5 С с использованием ледяной бани и добавляют 1,2,5-три-O-ацетилD-рибофуранозу (соединение 3) (35,42 г,111,32 ммоль) в 66 мл ацетонитрила. При перемешивании в атмосфере азота добавляют TMSOTf(23,54 мл, 130,9 ммоль) через пипетку, вызывая экзотермическую реакцию с повышением температуры до 15 С. Затем данную смесь нагревают до 75 С и выдерживают при данной температуре в течение 10 ч,а затем охлаждают вначале до комнатной температуры и затем до 15 С с использованием холодной водяной бани. К реакционной смеси добавляют воду порциями по 1 мл, обеспечивая максимальное протекание экзотермической реакции между каждым добавлением. После 6 добавлений внесение дополнительной порции объемом 1 мл не приводит к экзотермической реакции, затем вносят 38 мл воды через воронку и данную смесь перемешивают в течение 15 мин при комнатной температуре. К перемешиваемой реакционной смеси добавляют целит (44 г) с последующим добавлением гидроксида натрия(15,7 г 50% NaOH, 196,35 ммоль) в 22 мл воды в течение примерно 30 с. Перемешивают при комнатной температуре в течение 90 мин и реакционную смесь фильтруют. К перемешиваемому фильтрату добавляют бикарбонат натрия (16,5 г, 196,35 ммоль), растворенный в 200 мл воды. После окончания барботирования вносят 50 г хлорида натрия в виде твердого вещества и смесь перемешивают до полного растворения твердого вещества. Данную смесь переносят в делительную воронку и полученную трехфазную жидкую систему разделяют. Слой с наибольшей плотностью экстрагируют один раз 50 мл ацетонитрила и его объединяют со средней фазой первоначальной разделенной системы. К этому добавляют 11 г целита при перемешивании, через 5 мин смесь фильтруют. Фильтрат содержит желаемый продукт сочетания(соединение 4); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения. Стадия (ii) - ферментативный гидролиз. К раствору бикарбоната натрия (9,34 г, 111,32 ммоль, эквивалентно сахару (соединение 3) на стадии(i, растворенному в 278 мл воды, добавляют влажную, предварительно промытую, ковалентно связанную с подложкой липазу [методика промывания: образец массой 23,21 г сухой, ковалентно связанной с подложкой липазы Candida antarctica, тип В (Biocatalytics, номер по каталогу IMB-111) суспендируют в растворе ацетонитрил-вода 1:1, перемешивают в течение 4 ч, фильтруют и промывают 60 мл раствора ацетонитрил-вода (1:1)]. К данному перемешиваемому раствору добавляют раствор соединения (4) в ацетонитриле, полученного на стадии (i). Данную суспензию перемешивают в течение 36 ч, катализатор отфильтровывают, промывают раствором ацетонитрил-вода (1:1) и хранят при 0 С до последующего использования. Фильтрат экстрагируют 222 мл изопропилацетата, водную фазу перемешивают с 30 г хлорида натрия до растворения всего твердого вещества и затем экстрагируют два раза порциями изопропилацетата по 111 мл. Органические фракции объединяют, высушивают над MgSO4, перемешивают с 2,5 г Norit 211 в течение 90 мин и фильтруют через фильтр с целитом. Фильтрат содержит желаемый спирт (соединение 5); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения.- 27017005 Стадия (iii) - получение соли с использованием п-толуолсульфокислоты. Фильтрат со стадии (ii), который содержит соединение (5), растворенное в изопропилацетате и ацетонитриле, разбавляют 100 мл этанола крепостью 200 единиц. При перемешивании вносят по каплям птолуолсульфокислоту гидрат (15,89 г, 83,49 ммоль) в 50 мл этанола крепостью 200 единиц в течение 30 мин. Из реакционной смеси кристаллизуется не совсем белое твердое вещество. После перемешивания в течение 16 ч твердое вещество собирают фильтрованием, дважды промывают изопропилацетатом порциями по 100 мл и один раз 50 мл этанола крепостью 200 единиц. Твердое вещество высушивают в вакуумном сушильном шкафу с получением 30,55 г соли п-толуолсульфокислоты 5-амино-3-(2'-Оацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она с чистотой 98% по данным ВЭЖХ. Пример 2. Синтез соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3Hтиазоло[4,5-d]пиримидин-2-она без добавления воды при проведении ферментативного гидролиза на стадии (ii). Стадия (i) - реакция сочетания. В трехгорлую колбу, снабженную датчиком температуры, холодильником и входным отверстием для азота, загружают 5-амино-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 2) (22 г, 130,9 ммоль) и ацетонитрил (198 мл). При перешивании в атмосфере азота вносят BSA (79,86 мл, 327,8 ммоль) через воронку и смесь подогревают до 40 С в течение 90 мин в атмосфере азота. Темный однородный раствор охлаждают до 5 С с использованием ледяной бани и добавляют 1,2,5-три-O-ацетилD-рибофуранозу(соединение 3) (35,42 г, 111,32 ммоль) в 66 мл ацетонитрила. При перешивании в атмосфере азота добавляют TMSOTf (23,54 мл, 130,9 ммоль) через пипетку, вызывая экзотермическую реакцию с повышением температуры до 15 С. Затем данную смесь нагревают до 75 С и выдерживают при данной температуре в течение 10 ч, а затем охлаждают вначале до комнатной температуры и затем до 15 С с использованием холодной водяной бани. К реакционной смеси добавляют воду порциями по 1 мл, обеспечивая максимальное протекание экзотермической реакции между каждым добавлением. После 6 добавлений внесение дополнительной порции объемом 1 мл не приводит к экзотермической реакции, затем вносят 38 мл воды через воронку и данную смесь перемешивают в течение 15 мин при комнатной температуре. К перемешиваемой реакционной смеси добавляют целит (44 г) с последующим добавлением гидроксида натрия (15,7 г 50% NaOH, 196,35 ммоль) в 22 мл воды в течение примерно 30 с. Перемешивают при комнатной температуре в течение 90 мин и реакционную смесь фильтруют. К перемешиваемому фильтрату добавляют бикарбонат натрия (16,5 г, 196,35 ммоль), растворенный в 200 мл воды. После окончания барботирования вносят 50 г хлорида натрия в виде твердого вещества и смесь перемешивают до полного растворения твердого вещества. Данную смесь переносят в делительную воронку и полученную трехфазную жидкую систему разделяют. Слой с наибольшей плотностью экстрагируют один раз 50 мл ацетонитрила и его объединяют со средней фазой первоначальной разделенной системы. К этому добавляют 11 г целита при перемешивании, через 5 мин смесь фильтруют. Фильтрат содержит желаемый продукт сочетания (соединение 4); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения. Стадия (ii) - ферментативный гидролиз без добавления воды. В круглодонную колбу емкостью 500 мл добавляют 15,0 г иммобилизованной Candida antarctica(Novozyme 435, Biocatalytics, номер по каталогу IMB-102) с последующим внесением сухого этанола(60 мл). К данной смеси добавляют раствор соединения (4) в ацетонитриле, полученного на стадии (i), и колбу герметично закрывают от атмосферы и перемешивают при комнатной температуре. Через 72 ч добавляют 17,5 г целита 545 и перемешивают в течение 10 мин и затем твердые частицы отфильтровывают и промывают 80 мл этанола. Фильтрат содержит желаемый спирт (соединение 5); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения. Стадия (iii) - получение соли с использованием п-толуолсульфокислоты. Фильтрат со стадии (ii), который содержит соединение (5), растворенное в этаноле и ацетонитриле,разбавляют 100 мл этанола крепостью 200 единиц. При перемешивании вносят по каплям птолуолсульфокислоту гидрат (15,89 г, 83,49 ммоль) в 50 мл этанола крепостью 200 единиц в течение 30 мин. Из реакционной смеси кристаллизуется не совсем белое твердое вещество. После перемешивания в течение 16 ч твердое вещество собирают фильтрованием, дважды промывают изопропилацетатом порциями по 100 мл и один раз 50 мл этанола крепостью 200 единиц. Твердое вещество высушивают в вакуумном сушильном шкафу с получением 30,55 г соли п-толуолсульфокислоты 5-амино-3-(2'-Оацетил-3'-дезоксиD-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она с чистотой 98% по данным ВЭЖХ.- 28017005 Пример 3. Масштабный синтез соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиDрибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она. Стадия (i) - реакция сочетания. В реактор, снабженный датчиком температуры, холодильником и входным отверстием для азота,загружают 5-амино-3H-тиазоло[4,5-d]пиримидин-2-он (соединение 2) (1,45 кг, 8,6 моль) и ацетонитрил(1,29 л). При перемешивании в атмосфере азота добавляют BSA (5,23 л, 21,5 моль) через воронку и смесь нагревают до 40 С в течение 90 мин в атмосфере азота. Темный однородный раствор охлаждают до 5 С и добавляют 1,2,5-три-O-ацетилD-рибофуранозу (соединение 3) (2,33 кг, 7,32 моль) в 4,3 л ацетонитрила. При перешивании в атмосфере азота добавляют по каплям TMSOTf (1,54 л, 8,6 моль), вызывая экзотермическую реакцию с повышением температуры до 15 С. Затем данную смесь нагревают до 75 С и выдерживают при данной температуре в течение 10 ч, а затем охлаждают вначале до комнатной температуры и затем до 15 С. К реакционной смеси добавляют воду порциями по 100 мл, обеспечивая максимальное протекание экзотермической реакции между каждым добавлением. Когда добавление конечной порции объемом 100 мл больше не приводит к экзотермической реакции, то вносят 1,9 л воды через воронку и данную смесь перемешивают в течение 15 мин при комнатной температуре. К перемешиваемой реакционной смеси добавляют целит (2,47 кг) с последующим добавлением гидроксида натрия (516,8 г, 12,92 моль) в 14,5 л воды. Перемешивают при комнатной температуре в течение 90 мин и реакционную смесь фильтруют. К перемешиваемому фильтрату добавляют бикарбонат натрия (1,08 кг, 12,92 моль), растворенный в 14,5 л воды. После окончания барботирования вносят 3,3 кг хлорида натрия в виде твердого вещества и смесь перемешивают до полного растворения всего твердого вещества. Полученную трехфазную жидкую систему разделяют. Фазу с наибольшей плотностью экстрагируют один раз 3,3 л ацетонитрила и объединяют со средней фазой первоначальной разделенной системы. Данные объединенные фазы содержат желаемый продукт сочетания (соединение 4); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения. Стадия (ii) - ферментативный гидролиз. К раствору бикарбоната натрия (615 г, 7,32 моль, эквивалентно сахару (соединение 3) на стадии (i,растворенному в 21,5 л воды, добавляют сухую, ковалентно связанную с подложкой липазу Candida antarctica, тип В (1,59 кг; Biocatalytics, номер по каталогу IMB-111). К данному перемешиваемому раствору добавляют раствор соединения (4) в ацетонитриле, полученного на стадии (i). Данную суспензию перемешивают в течение 36 ч, катализатор отфильтровывают, промывают раствором ацетонитрил-вода (1:1) и хранят при 0 С до последующего использования. Фильтрат экстрагируют одной порцией изопропилацетата объемом 17,5 л, водную фазу перемешивают с 3,3 кг хлорида натрия до растворения всего твердого вещества и затем экстрагируют два раза порциями изопропилацетата объемом 9 л. Органические фракции объединяют, высушивают MgSO4, перемешивают с 117 г Norit 211 в течение 90 мин и фильтруют через фильтр с целитом. Фильтрат содержит желаемый спирт (соединение 5); его идентичность и чистоту определяют ВЭЖХ с использованием известного соединения. Стадия (iii) - получение соли с использованием п-толуолсульфокислоты. Фильтрат со стадии (ii), который содержит соединение (5), растворенное в изопропилацетате и ацетонитриле, разводят 5,5 л этанола крепостью 200 единиц. При перемешивании вносят по каплям птолуолсульфокислоту гидрат (1,04 кг, 5,49 моль) в 3,3 л этанола крепостью 200 единиц в течение 30 мин. Из реакционной смеси кристаллизуется не совсем белое твердое вещество. После перемешивания в течение 16 ч твердое вещество собирают фильтрованием, дважды промывают изопропилацетатом порциями по 7,5 л и один раз 3,5 л этанола крепостью 200 единиц. Твердое вещество высушивают в вакуумном сушильном шкафу с получением 2,38 кг соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезокси-D-рибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она с чистотой 98% по данным ВЭЖХ. Пример 4. Кристаллизация соли п-толуолсульфокислоты 5-амино-3-(2'-O-ацетил-3'-дезоксиDрибофуранозил)-3H-тиазоло[4,5-d]пиримидин-2-она. 5-Амино-3-(2'-O-ацетил-3'-дезоксиD-рибофуранозил)-3 Н-тиазоло[4,5-d]пиримидин-2-он [50,0 г(43,85 г, 134 ммоль) эффективный на основе CoA] вносят в 3-горлую колбу емкостью 2 л. Добавляют абсолютный этанол (840 мл) и смесь перемешивают при комнатной температуре в течение 10 мин с получением бледно-желтого раствора. Добавляют п-толуолсульфокислоту (pTsOH) (26,2 г, 138 ммоль) в отдельную колбу и растворяют в абсолютном этаноле (220 мл) при комнатной температуре. РастворpTsOH/этанол вносят в капельную воронку и затем добавляют по каплям к перемешиваемому раствору соединение формулы (5) в течение 40 мин при комнатной температуре. Колбу, которую используют для приготовления раствора pTsOH/этанол, и капельную воронку обмывают абсолютным этанолом(320 мл), каждую промывную фракцию сливают в реакционную суспензию. Реакционную смесь перемешивают в атмосфере N2 при комнатной температуре в течение ночи (18 ч) и затем фильтруют под вакуумом на воронке Бюхнера и через ватмановскую бумагу 1. Оставшиеся в колбе твердые частицы
МПК / Метки
МПК: A01N 43/78
Метки: 5-амино-3-(2'-о-ацетил-3'-дезокси-β-d-рибофуранозил)-3н-тиазоло[4,5-d]пиримидин-2-она, п-толуолсульфокислоты, получения, способы, соль
Код ссылки
<a href="https://eas.patents.su/30-17005-sol-p-toluolsulfokisloty-5-amino-3-2-o-acetil-3-dezoksi-beta-d-ribofuranozil-3n-tiazolo45-dpirimidin-2-ona-i-sposoby-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соль п-толуолсульфокислоты 5-амино-3-(2′-о-ацетил-3′-дезокси-β-d-рибофуранозил)-3н-тиазоло[4,5-d]пиримидин-2-она и способы получения</a>
Предыдущий патент: Пиридизиноновые производные
Следующий патент: Пестицидная композиция, содержащая фенамидон и инсектицидное соединение
Случайный патент: Композиции пароксетина