Конденсированные гетероциклические соединения
Номер патента: 9421
Опубликовано: 28.12.2007
Авторы: Чэнь Сяоци, Чэнь Си, Ли Лепин, Фань Пинчэнь, Цзаен Цзуань, Михалик Джеффри Т.
Формула / Реферат
1. Соединение, имеющее формулу (I)
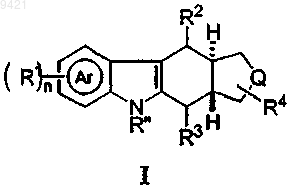
где 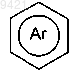 представляет собой бензольное кольцо;
представляет собой бензольное кольцо;
Q представляет собой -N(R)-(C1-С3)алкилен-;
R представляет собой 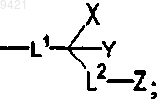
L1 представляет собой связь, (С1-С4)алкилен, (С1-С4)алкиленокси и (С1-С4)алкиленамино;
L2 представляет собой связь, (С1-С4)алкилен, (С2-С4)алкенилен, (С2-С4)алкинилен, (С1-С4)алкиленокси или (С1-С4)алкиленамино;
R", R3 и R4 каждый представляет собой водород;
каждый R1 представляет собой фтор(С1-С4)алкил;
R2 представляет собой (C1-C8)алкил;
X и Y независимо выбирают из группы, состоящей из (C1-C8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, -CO2R13 и -C(O)NR13R14;
необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего от 0 до 2 гетероатомов, независимо выбранных из группы, состоящей из N, O и S;
Z выбирают из группы, состоящей из -OR15, -NR15R16, -NR15R18, -C(O)R15, -CO2R15, -R18,
-C(O)NR15R16, -C(O)NR15R18, -SO2NR15R16, -SO2NR15R18, -NR16SO2R15, -N(R15)N(R16)SO2R17,
-C(O)N(R16)OR15, гидрокси(C1-С8)алкила, фтор(С1-С4)алкила, гетероарила, -C(=NOR15)NR16R17,
-C(R16)=NOR15, -NR16(OR15), -С(O)NR17C(O)NR15R16, -NR17C(O)NR16C(O)R15 и -NR17C(O)NR15R16;
R13, R14, R15, R16 и R17 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, цикло(С3-С6)алкила, фтор(С1-С4)алкила, гетеро(C1-С4)алкила, циклогетеро(С3-С6)алкила, арила и арил(С1-С4)алкила;
R18 представляет собой 5- или 6-членное кольцо, содержащее от 0 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S;
необязательно, когда две группы R, выбранные из группы, состоящей из R13, R14, R15, R16 и R17, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S; и
подстрочный индекс n равен 0 или 1.
2. Соединение, имеющее формулу (II)
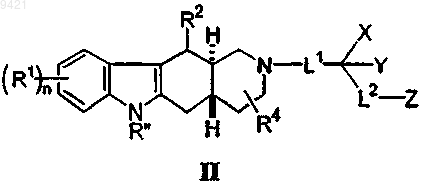
или его фармацевтически приемлемая соль, гидрат, сольват или пролекарство, где
L1 представляет собой связь, (С1-С4)алкилен, (С1-С4)алкиленокси или (С1-С4)алкиленамино;
L2 представляет собой связь, (С1-С4)алкилен, (С2-С4)алкенилен, (С2-С4)алкинилен, (С1-С4)алкиленокси или (С1-С4)алкиленамино;
R'' представляет собой водород;
каждый R1 представляет собой фтор(С1-С4)алкил;
R2 представляет собой (C1-C8)алкил;
R4 представляет собой водород;
X и Y независимо выбирают из группы, состоящей из (C1-C8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, -CO2R13 и -C(O)NR13R14;
необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего от 0 до 2 гетероатомов, независимо выбранных из группы, состоящей из N, O и S;
Z выбирают из группы, состоящей из -OR15, -NR15R16, -CO2R15, -R18, -C(O)NR15R16, -C(O)NR15R18,
-SO2NR15R16, -SO2NR15R18, -NR16SO2R15, -N(R15)N(R16)SO2R17, -C(O)N(R16)OR15, фтор(C1-C4)алкила, гетероарила, -С(=NOR15)NR16R17, -С(R16)=NOR15, -NR16(OR15), -C(O)NR17C(O)NR15R16, -NR17C(O)NR16C(O)R15 и -NR17C(O)NR15R16;
R13, R14, R15, R16 и R17 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, фтор(С1-С4)алкила, гетеро(С1-С4)алкила, арила и арил(С1-С4)алкила;
R18 представляет собой 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из N, O и S;
необязательно, когда две группы R, выбранные из группы, состоящей из R13, R14, R15, R16 и R17, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов, выбранных из группы, состоящей из N, O и S; и
подстрочный индекс n равен 0 или 1.
3. Соединение по п.2, где n равно 1.
4. Соединение по п.3, где L1 представляет собой (С1-С4)алкилен.
5. Соединение по п.4, имеющее формулу (III)
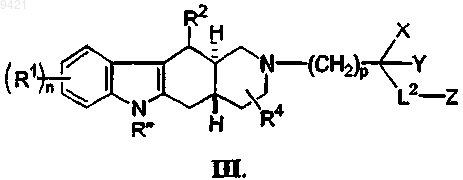
где подстрочный индекс p представляет собой целое число от 1 до 4.
6. Соединение по п.5, где p составляет 1, 2 или 3.
7. Соединение по п.6, где L2 представляет собой связь.
8. Соединение по п.7, где Z представляет собой -CO2R15 или -CO2NR15R16.
9. Соединение по п.6, где X и Y объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего от 0 до 2 гетероатомов, выбранных из группы, состоящей из O, N и S.
10. Соединение по п.9, где X и Y объединены с образованием 5- или 6-членного кольца, содержащего от 0 до 2 гетероатомов, выбранных из группы, состоящей из О, N и S.
11. Соединение по п.10, где X и Y объединены с образованием 5- или 6-членного кольца, содержащего 0 гетероатомов, 1 атом азота или 1 атом кислорода.
12. Соединение по п.2, имеющее формулу (IV)
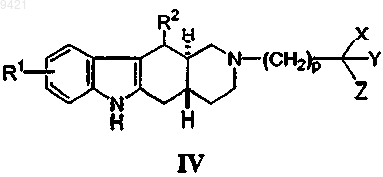
где подстрочный индекс p представляет собой целое число от 1 до 4.
13. Соединение по п.12, где p составляет 1, 2 или 3.
14. Соединение по п.13, где p равно 2.
15. Соединение по п.14, где Y представляет собой -CO2H.
16. Соединение по п.14, где X и Y объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего от 0 дю 2 гетероатомов, выбранных из группы, состоящей из O, N и S.
17. Соединение по п.14, где X и Y объединены с образованием 5- или 6-членного кольца, содержащего от 0 до 2 гетероатомов, выбранных из группы, состоящей из O, N и S.
18. Соединение по п.14, где X и Y объединены с образованием 5- или 6-членного кольца, содержащего 0 гетероатомов, 1 атом азота или 1 атом кислорода.
19. Соединение по п.14, где X и Y объединены с образованием 5- или 6-членного кольца, содержащего 0 гетероатомов, 1 атом азота или 1 атом кислорода, и Z представляет собой -CO2H.
20. Соединение по п.14, где R2 представляет собой метил.
21. Соединение по п.14, где R1 представляет собой CF3.
22. Соединение по п.21, где R1 представляет собой 9-трифторметил.
23. Соединение по п.14, где R1 представляет собой CF3 и R2 представляет собой метил.
24. Соединение по п.14, где R1 представляет собой CF3, R2 представляет собой метил и Z представляет собой -CO2H.
25. Соединение по п.24, где указанное соединение выбирают из группы, состоящей из
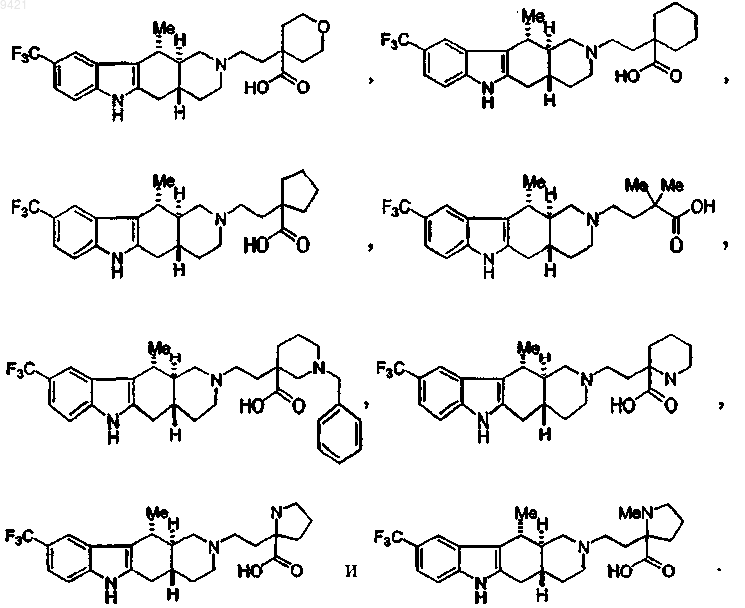
26. Фармацевтическая композиция для лечения состояния или нарушения, выбранных из группы, состоящей из ожирения, нарушения питания, состояния тревоги и нарушения настроения, включающая фармацевтически приемлемый носитель или эксципиент и соединение по любому одному из пп.1-25.
27. Применение соединения по п.1 или 2 для получения лекарственного средства для лечения состояния или нарушения, выбранных из группы, состоящей из ожирения, нарушения питания, состояния тревоги и нарушения настроения.
28. Применение по п.27, где указанное состояние или нарушение выбирают из группы, состоящей из ожирения, нервной анорексии, тревожного состояния, острого тревожного состояния с реакцией паники, обсессивно-компульсивного нарушения и депрессии.
29. Применение по п.27, где указанное лекарственное средство предназначено для введения в сочетании с агентом против ожирения, антидепрессантом или анксиолитическим агентом.
30. Применение по п.27, где указанное лекарственное средство предназначено для перорального введения.
31. Применение по п.27, где указанное лекарственное средство предназначено для парентерального введения.
32. Применение по п.27, где указанное соединение модулирует MCHR.
33. Применение соединения по п.1 или 2 для получения лекарственного средства для модификации поведения при питании.
34. Применение по п.33, где указанное лекарственное средство предназначено для снижения потребления пищи.
35. Применение по п.33, где указанное лекарственное средство предназначено для увеличения потребления пищи.
36. Применение соединения по п.1 или 2 для получения лекарственного средства для лечения состояния или нарушения, опосредованного MCHR.
37. Применение по п.36, где указанное состояние или нарушение выбирают из группы, состоящей из ожирения, нарушения питания, тревожного нарушения и нарушения настроения.
38. Применение по п.37, где указанное нарушение питания представляет собой нервную анорексию.
39. Применение по п.37, где указанное тревожное нарушение выбирают из группы, состоящей из тревожного состояния, острого тревожного состояния с реакцией паники, обсессивно-компульсивного нарушения.
40. Применение по п.37, где указанное нарушение настроения представляет собой депрессию.
Текст
009421 По данной заявке испрашивается приоритет на основании предварительной заявки на патент США 60/424456, содержание которой включено в настоящее описание во всей своей полноте посредством ссылки. Область изобретения Настоящее изобретение относится к соединениям, композициям и способам, полезным при лечении или профилактике состояний и нарушений, связанных с потреблением пищи, энергетическим гомеостазом и тревожными состояниями. Предпосылки создания изобретения Связанные с G-белком рецепторы играют важную роль в различных сигнальных процессах, включая те, которые вовлечены в сенсорную и гормональную сигнальную трансдукцию. Нарушения питания,которые представляют собой главное беспокойство для здоровья по всему миру, связаны с регуляциейGPCR. С одной стороны, нарушения, такие как ожирение, избыточное отложение жира в подкожных тканях, проявляют себя в увеличении веса тела. Люди, страдающие ожирением, имеют или подвержены медицинским аномалиям, включая трудности дыхания, сердечно-сосудистые заболевания, диабет и гипертензию. С другой стороны нарушения, такие как кахексия, общий недостаток питания и истощение,связанное с хроническим заболеванием и/или эмоциональным нарушением, связаны со снижением веса тела. Ранее было установлено, что нейропептидный меланинконцентрирующий гормон (MCH), циклический гипоталамусный пептид, включенный в регуляцию нескольких функций мозга, является основным регулятором потребления пищи и энергетического гомеостаза. Ранее было определено, что MCH представляет собой природный лиганд для 353-аминокислотного одиночного связанного с G-белком рецептора (GPCR), обозначаемого SLC-1 (также известен как GPR24). После его определения, SLC-1, который гомологичен по последовательности соматостатиновым рецепторам, часто упоминается как меланинконцентрирующий гормональный рецептор (MCH рецептор, MCHR или MCHR1) (см. Chambers et al., Nature 400: 261-65 (1999); Saito et al., Nature 400: 265-69 (1999); и Saito et al.,TEM 11 (8): 299-303 (2000. Существуют убедительные доказательства, что MCH вовлечен в регулирование потребления пищи. Во-первых, внутрицеребральное введение MCH крысам приводит к стимуляции потребления пищи. Далее, мРНК, соответствующая предшественнику MCH, повышает регуляцию в гипоталамусе у мышей с генетическим ожирением и голодающих животных. Наконец, мыши с дефицитом MCH являются худыми и характеризуются пониженным потреблением корма по сравнению с обычными мышами. Предполагается, что MCH проявляет свою активность за счет связывания с MCHR, приводя к мобилизации внутриклеточного кальция и сопутствующему снижению уровней цАМФ (см. Chambers et al., Nature 400: 261-65(1999); Shimada et al. Nature 396: 670-74 (1998. Также MCH активирует внутри спрямляющиеся калиевые каналы, и было установлено, что MCHR взаимодействует как с Gi белком, так и с Gq белком(Saito et al., ТЕМ 11 (8): 299-303 (2000. Кроме того, анализ локализации MCHR в тканях показывает,что он экспрессируется в тех областях мозга, которые вовлечены в обонятельное обучение и усиление. Совокупные данные позволяют предположить, что модуляторы MCHR должны оказывать влияние на нейронную регуляцию потребления пищи (см. Saito et al., Nature 400: 265-69 (1999. Показано, что MCH модулирует другие поведенческие реакции помимо питания, такие как тревожное состояние (Gonzales et al. (1996) Peptides 17: 171-177; Monzon et al. (1999) Physiol. Behav. 67: 813817). Идентификация модуляторов MCHR полезна для исследования физиологических процессов, опосредованных MCHR и разработки терапевтических агентов для лечения или профилактики состояний и нарушений, связанных с регулированием веса, обучением, тревожным состоянием и другими нейронально-родственными функциями. Краткое изложение сущности изобретения Настоящее изобретение относится к конденсированным гетероциклическим соединениям и композициям и к способам их применения для лечения или профилактики состояний и нарушений, опосредованных MCHR. В частности настоящее изобретение относится к соединениям, композициям и способам лечения или профилактики состояний и нарушений, связанных с потреблением пищи, энергетическим гомеостазом и тревожными состояниями. Разработанные в данном изобретении соединения имеют формулу (I) представляет собой моноциклическое или конденсированное арильное или гетероарильное кольQ представляет собой -N(R)- или -N(R)-(С 1-С 3)алкилен;R" представляет собой водород или (C1-C8)алкил; каждый R1 независимо выбирают из группы, состоящей из галогена, (C1-C8)алкила, (С 2-С 8)алкенила,(С 2-С 8)алкинила, фтор(С 1-С 4)алкила, -OR5, -SR5, фтор(С 1-С 4)алкокси, арила, арил(С 1-С 4)алкила, -NO2,-NR5R6, -C(O)R5, -CO2R5, -C(O)NR5R6, -N(R6)C(O)R5, -N(R6)CO2R5, -N(R7)С(O)NR5R6, -S(O)mNR5R6,S(O)mR5, -CN и -N(R6)S(O)mR5;R2 и R3 независимо выбирают из группы, состоящей из водорода, галогена, (C1-C8)алкила, (С 2 С 8)алкенила, (С 2-С 8)алкинила, фтор(С 1-С 4)алкила, -OR8, -SR8, фтор(С 1-С 4)алкокси, арила, арил(С 1-С 4)алкила, -NO2, -NR8R9, =O, -C(O)R8, CO2R8, -C(O)NR8R9, -N(R9)C(O)R8, -N(R9)CO2R8, -N(R10)C(O)NR8R9,-S(O)mNR8R9, -S(O)mR8, -CN и -N(R9)S(O)mR8;X и Y независимо выбирают из группы, состоящей из (C1-C8)алкила, (С 2-С 8)алкенила, (С 2 С 8)алкинила, -CO2R13 и -C(O)NR13R14; необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца,содержащего от 0 до 2 гетероатомов, независимо выбранных из группы, состоящей из N, О и S;R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)алкенила, (С 2-С 8)алкинила, цикло(С 3-С 6)алкила, фтор(С 1-С 4)алкила, гетеро(С 1-С 4)алкила, циклогетеро(С 3-С 6)алкила, арила и арил(C1-C4)алкила;R18 представляет собой 5- или 6-членное кольцо, содержащее от 0 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S (например, тетразол); необязательно, когда две группы R, выбранные из группы, состоящей из R5, R6, R8, R9, R11, R12, R13,14R , R15, R16 и R17, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S; подстрочный индекс m равен 1 или 2; и подстрочный индекс n равен 0, 1 или 2. представляет собой бензольное, нафталиновое, пирВ некоторых вариантах осуществления рольное, пиразольное, имидазольное, пиразиновое, оксазольное, изоксазольное, тиазольное, фурановое,тиофеновое, пиридиновое, пиримидиновое, бензотиазольное, пуриновое, бензимидазольное, индольное,изохинолиновое, хиноксалиновое и хинолиновое кольцо. представляет собой бензольное кольцо. В некоторых вариантах осуществления В некоторых вариантах осуществления Q представляет собой -N(R)-. В следующих вариантах осуществления R3 представляет собой водород или =O. представляет собой бензольное кольцо, R" представляВ конкретных вариантах осуществления ет собой водород, и R3 представляет собой водород. Следующие соединения, представленные в данном описании, имеют формулу (II)R представляет собой водород или (C1-C8)алкил; каждый R1 независимо выбирают из группы, состоящей из галогена, (C1-C8)алкила, (С 2-С 8)алкенила,(С 2-С 8)алкинила, фтор(С 1-С 4)алкила, -OR5, -SR5, фтор(С 1-С 4)алкокси, арила, арил(С 1-С 4)алкила, -NO2,-2 009421X и Y независимо выбирают из группы, состоящей из (C1-C8)алкила, (С 2-С 8)алкенила, (С 2 С 8)алкинила, -CO2R13 и -C(O)NR13R14; необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца,содержащего от 0 до 2 гетероатомов, независимо выбранных из группы, состоящей из N, О и S;R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, (С 2-С 8)алкенила, (С 2-С 8)алкинила, цикло(С 3-С 6)алкила, фтор(C1-C4)алкила, гетеро(С 1-С 4)алкила, циклогетеро(С 3-С 6)алкила, арила и арил(C1-C4)алкила;R18 представляет собой 5- или 6-членное кольцо, содержащее от 0 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S (например, тетразол); необязательно, когда две группы R, выбранные из группы, состоящей из R5, R6, R8, R9, R11, R12, R13,14R , R15, R16 и R17, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S; подстрочный индекс m равен 1 или 2; и подстрочный индекс n равен 0, 1 или 2. Подразумевается, что соединения, указанные выше в формулах, включают все их фармацевтически приемлемые соли, гидраты, сольваты и пролекарства. Разработанные в данном изобретении фармацевтические композиции включают фармацевтически приемлемый носитель в сочетании с соединением формулы I или II. В настоящем изобретении разработаны способы лечения или профилактики состояния или нарушения, выбранных из группы, состоящей из ожирения, нарушений питания, тревожных состояний и нарушений настроения. Способы включают введение нуждающемуся в этом субъекту терапевтически эффективного количества одного из вышеупомянутых соединений или фармацевтических композиций. Другие задачи, отличительные особенности и преимущества настоящего изобретения станут очевидны для специалистов в данной области из следующего описания и формулы изобретения. Краткое описание чертежа На фигуре приведены структуры иллюстративных соединений изобретения. Подробное описание изобретения Сокращения и определения. Использованные в данном описании сокращения являются обычными, если не указано другого. Термин MCHR относится к белку 1 рецептора меланинконцентрирующего гормона, если не указано другого. Термины лечить и лечение относятся к способу облегчения или прекращения заболевания и/или сопутствующих ему симптомов. Термины предотвращать и профилактика относятся к способу уменьшения возможности или исключения возможности появления заболевания. Использованный в данном описании термин MCHR-опосредованное состояние или нарушение и тому подобные относятся к состоянию или нарушению, отличающемуся несоответствующей, например меньше или больше нормальной, активностью MCHR. Однако MCHR-опосредованное состояние или нарушение представляет собой то, в котором моделирование МСНР некоторым образом влияет на базовое состояние или заболевание (например,MCHR антагонист приводит к некоторым улучшениям самочувствия пациента, по крайней мере, у некоторых пациентов). Иллюстративные MCHR-опосредованные состояния и нарушения включают ожирение, нарушения питания и другие поведенческие нарушения,такие как тревожные состояния и нарушения настроения. Термин терапевтически эффективное количество относится к такому количеству соединения, которое при введении является достаточным для предотвращения развития или облегчает в определенной степени один или несколько симптомов состояния или нарушения, подвергаемого лечению. Использованный в данном описании термин ожирение относится к избыточному накоплению жира тела. Ожирение может быть обусловлено генетическими причинами, факторами окружающей среды (например, меньшее расходование энергии по сравнению с ее потреблением) и регуляторными опре-3 009421 деляющими факторами. Обычно с ожирением связаны сердечно-сосудистые нарушения, липидные и метаболические нарушения, такие как гипертензия, гиперлипидемия, заболевание коронарной артерии и диабет. Как использовано в данном описании, термины нарушение питания, нарушение потребления пищи и тому подобные относятся к эмоциональному и/или поведенческому нарушению, связанному с избыточным снижением веса тела и немотивированными попытками избежать набора веса, например,голодание, самоиндуцированная рвота, злоупотребление слабительными или мочегонными средствами. С нарушениями питания обычно связана депрессия. Иллюстративные нарушения питания включают нервную анорексию и булимию. Как использовано в данном описании, термин тревожное состояние относится к эмоциональному и/или поведенческому нарушению, отличающемуся постоянными и распространяющимися тревогой или беспокойством, напряженным состоянием или раздражением, например, по поводу состояния здоровья,работы, денег или семьи, по неясным причинам. Тревожное состояние может сопровождаться тахикардией или одышкой. Иллюстративные тревожные состояния включают тревогу, обобщенное тревожное состояние, приступы паники и обсессивно-компульсивное нарушение (OCD). Как использовано в данном описании, термин нарушение настроения относится к эмоциональному и/или поведенческому нарушению, отличающемуся постоянными и распространяющимися приступами эйфории и/или депрессии. Иллюстративные нарушения настроения включают депрессию и биполярные нарушения. Тревожные состояния часто связаны с нарушениями настроения, такими как депрессия. Термин модулировать относится к способности соединения повышать или уменьшать функцию или активность MCHR. Модулирование, как описано в данном описании, включает антагонизм или агонизм MCHR или непосредственно, или косвенно. Антагонисты представляют собой соединения, которые, например, частично или полностью блокируют стимуляцию, уменьшают, предотвращают, замедляют активацию, деактивируют, ингибируют, уменьшают чувствительность или регулируют по типу отрицательной связи сигнальную трансдукцию. Агонисты представляют собой соединения, которые, например, стимулируют, повышают, активируют, открывают, облегчают, усиливают активацию, чувствительность или позитивно регулируют сигнальную трансдукцию. Термин алкил, сам по себе или в виде части другого заместителя, означает, если не указано другого, линейный или разветвленный или циклический углеводородный радикал или их сочетание, который является полностью насыщенным, имеет обозначенное число атомов углерода (например, C1-C8 означает от одного до восьми атомов углерода). Примеры алкильных групп включают метил, этил, нпропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропилметил, их гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и тому подобные. Как использовано в данном описании, определение (C1-C8)алкил относится к алкильной группе, содержащей от одного до восьми атомов углерода и включает, например, (С 3-С 4)алкил. Термин алкенил, сам по себе или в виде части другого заместителя, означает линейный или разветвленный или циклический углеводородный радикал или их сочетание, который может быть моно- и полиненасыщенным и содержит обозначенное число атомов углерода (например, С 2-С 8 означает от двух до восьми атомов углерода) и одну или несколько двойных связей. Примеры алкенильных групп включают винил, аллил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4 пентадиенил) и их высшие гомологи и изомеры. Термин алкинил, сам по себе или в виде части другого заместителя, означает линейный или разветвленный или циклический углеводородный радикал или их сочетание, который может быть моно- и полиненасыщенным и содержит обозначенное число атомов углерода (например, С 2-С 8 означает от двух до восьми атомов углерода) и одну или несколько тройных связей. Примеры алкинильных групп включают этинил, 1- и 3-пропинил, 3-бутинил и их высшие гомологи и изомеры. Термин алкилен, сам по себе или в виде части другого заместителя, означает двухвалентный радикал, полученный из алкила, что может быть проиллюстрировано на примере -СН 2 СН 2 СН 2 СН 2-. Обычно алкильная (или алкиленовая) группа будет содержать от 1 до 24 атомов углерода, при этом группы,содержащие 10 или меньше атомов углерода, являются предпочтительными в настоящем изобретении. Термин низший алкил или низший алкилен относится к алкильной или алкиленовой группе с короткой цепью, обычно содержащей семь или меньше атомов углерода. Термин алкокси, алкиламино и алкилтио (или тиоалкокси) используются в обычном их смысле и относятся к таким алкильным группам, которые присоединены к остатку молекулы через атом кислорода, аминогруппу или атом серы соответственно. Термин гетероалкил, сам по себе или в сочетании с другим термином, означает, если не указано другого, стабильный линейный, или разветвленный, или циклический углеводородный радикал или их сочетание, состоящий из установленного количества атомов углерода и от одного до трех гетероатомов,выбранных из группы, состоящей из О, N, Si и S, где атомы азота и серы необязательно могут быть окисленными, и гетероатом азота необязательно может быть кватернизованным. Гетероатом(ы) О, N и S могут размешаться в любом положении внутри данной гетероалкильной группы. Гетероатом Si может раз-4 009421 мещаться в любом положении данной гетероалкильной группы, включая положение, через которое алкильная группа присоединена к остатку молекулы. Примеры включают -СН 2-СН 2-О-СН 3, -CH2-CH2-NHCH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-СН 3, -СН=СН-ОСН 3, -Si(CH3)3, -CH2-CH=N-OCH3 и -CH=CH-N(CH3)-CH3. Вплоть до двух гетероатомов может располагаться последовательно, как, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Аналогично термин гетероалкилен, сам по себе или в виде части другого заместителя, означает двухвалентный радикал, полученный из гетероалкила, что может быть проиллюстрировано на примере-CH2-CH2-S-CH2CH2- и -CH2-S-CH2-CH2-NH-CH2-. Для гетероалкиленовых групп гетероатомы также могут занимать или один или оба концевых положения цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и тому подобные). Кроме того, для алкиленовой и гетероалкиленовой связывающих групп не подразумевается ориентация связывающей группы. Термины циклоалкил и гетероциклоалкил, сами по себе или в сочетании с другими терминами,представляют собой, если не указано другого, циклические варианты терминов алкил и гетероалкил соответственно. Таким образом, циклоалкильная группа имеет обозначенное число атомов углерода (т.е. обозначение C3-C8 означает от трех до восьми атомов углерода) и гетероциклоалкильная группа состоит из обозначенного числа атомов углерода (т.е. С 2-С 8 означает от двух до восьми атомов углерода) и от одного до трех гетероатомов, выбранных из группы, состоящей из О, N, Si и S, и где атомы азота и серы необязательно могут быть окисленными, и гетероатом азота необязательно может быть кватернизованным. Кроме того, для гетероциклоалкила, гетероатом может занимать положение, через которое гетероцикл присоединен к остатку молекулы. Примеры циклоалкилов включают циклопентил, циклотексил, 1 циклогексенил, 3-циклогексенил, циклогептил и тому подобные. Примеры гетероциклоалкилов включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3 морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил,1-пиперазинил, 2-пиперазинил и тому подобные. Термины гало и галоген, сами по себе или как часть другого заместителя, означают, если не указано другого, атом фтора, хлора, брома или иода. Кроме того, подразумевается, что термины, такие как галогеналкил, включают алкил, замещенный атомами галогена, которые могут быть одинаковыми или разными, в количестве, колеблющемся от одного до (2m'+1), где m' представляет собой общее число атомов углерода в алкильной группе. Например, подразумевается, что термин галоген (C1-C4)алкил включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и тому подобные. Таким образом, термин галогеналкил включает моногалогеналкил (алкил, замещенный одним атомом галогена) и полигалогеналкил (алкил, замещенный атомами галогена, количество которых колеблется в диапазоне от двух до (2m'+1) атомов галогена, где m' представляет собой общее число атомов углерода в алкильной группе). Соответственно, термин фтор(C1-C4)алкил включает фторметил, трифторметил, 2,2,2 трифторэтил, пентафторэтил, 1,1-дифторэтил и тому подобные. Термин пергалогеналкил означает,если не указано другого, алкил, замещенный (2m'+1) атомами галогена, где m' представляет собой общее число атомов углерода в алкильной группе. Например, подразумевается, что термин пергалоген(С 1 С 4)алкил включает трифторметил, пентахлорэтил, 1,1,1-трифтор-2-бром-2-хлорэтил и тому подобные. Термин арил означает, если не указано другого, полиненасыщенный, обычно ароматический углеводородный заместитель, который может представлять собой отдельное кольцо или множество колец(до трех колец), которые конденсированы и связаны ковалентно. Не ограничивающие примеры арильных групп включают фенил, 1-нафтил, 2-нафтил и 4-бифенил. Термин гетероарил относится к арильным группам (или кольцам), которые содержат от 0 до 4 гетероатомов, выбранных из N, О и S, и где атомы азота и серы необязательно являются окисленными и атом азота необязательно является кватернизованным. Гетероарильная группа может быть присоединена к остатку молекулы через гетероатом. Не ограничивающие примеры гетероарильных групп включают 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил,2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2 тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3 хинолил и 6-хинолил. Для краткости термин арил при использовании в сочетании с другими терминами (например,арилокси, арилтиокси, арилалкил) включает как арильное, так и гетероарильное кольца, как определено выше. Так, подразумевается, что термин арилалкил включает те радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенилэтил, пиридилметил и тому подобные),включая те алкильные группы, в которых атом углерода (например, метиленовая группа) был заменен,например, на атом кислорода (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и тому подобные). Подразумевается, что каждый из вышеуказанных терминов (например, алкил, гетероалкил,арил и гетероарил) включает как замещенные, так и незамещенные формы указанных радикалов. Предпочтительные заместители для каждого типа радикалов указаны ниже.-5 009421 Заместители для алкильных и гетероалкильных радикалов (а также тех групп, которые упоминаются как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил) могут представлять собой множество групп, выбранных из OR', =O,=NR', =N-OR', -NR'R", -SR', галогена, -SiR'R"R, -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R",-NR"C(O)R', -NR'-C(O)NRR, -NR'-SO2NRR, -NRCO2R', -NH-C(NH2)=NH, -NR'С(NH2)=NH, -NHC(NH2)=NR', -C(O)R', -SO2R', -SO2NR'R", -NR"SO2R', -CN и -NO2, числом от 0 до 3, где группы, имеющие 0, 1 или 2 заместителя являются особенно предпочтительными. Каждый из R', R" и R"' независимо относится к водороду, незамещенному (C1-C8)алкилу и гетероалкилу, фтор(C1-C4)алкилу, незамещенному арилу, арилу, замещенному одним-тремя галогенами, незамещенным алкилом, алкокси или тиоалкоксигруппами, или к арил(С 1-С 4)алкильным группам. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием 5-, 6- или 7-членного кольца. Например, подразумевается, что -NR'R" включает 1-пирролидинил и 4-морфолинил. Обычно, алкильная или гетероалкильная группа будет иметь от 0 до 3 заместителей, при этом группы, содержащие 2 или меньше заместителей, являются предпочтительными в настоящем изобретении. Более предпочтительно алкильный или гетероалкильный радикал будет незамещенным или монозамещенным. Наиболее предпочтительно, алкильный или гетероалкильный радикал будут незамещенными. Из вышеуказанного обсуждения заместителей специалисту в данной области будет понятно, что термин алкил, как подразумевается, включает такие группы, как тригалогеналкил (например, -CF3 и -CH2CF3). Предпочтительные заместители для алкильных и гетероалкильных радикалов выбирают из: -OR',=O, -NR'R", -SR', галогена, -SiR'R"R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R',-NR"CO2R', -NR'-SO2NR"R"', -C(O)R', -SO2R', -SO2NR'R", -NR"SO2R', -CN и -NO2, где R' и R" являются такими, как определено выше. В дальнейшем предпочтительные заместители выбирают из -OR', =O,-NR'R", галогена, -OC(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR"CO2R', -NR'-SO2NR"R,-SO2R', -SO2NR'R", -NR"SO2R', -CN и -NO2. Аналогично заместители для арильных и гетероарильных групп варьируют и выбирают из галогена,-OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -OC(O)NR'R", -NR"C(O)R',-NR"CO2R', -NR'-C(O)NR"R"', -NR'-SO2NRR, -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR',-C(O)R', -SO2R', -SO2NR'R", -NR"SO2R', -N3, -CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила, в количестве, колеблющемся от 0 до общего числа открытых валентностей ароматической кольцевой системы, и где R', R" и R независимо выбирают из водорода, (C1-C8)алкила и гетероалкила, незамещенного арила и гетероарила, (незамещенный арил)-(С 1-С 4)алкила и (незамещенный арил)окси-(С 1-С 4)алкила. Обычно, арильная или гетероарильная группа будет содержать от 0 до 3 заместителей, при этом группы,имеющие 2 или меньше заместителей являются предпочтительными в настоящем изобретении. Более предпочтительно арильная или гетероарильная группа будут незамещенными или монозамещенными. Наиболее предпочтительно арильная или гетероарильная группа будут незамещенными. Предпочтительные заместители для арильной и гетероарильной групп выбирают из галогена, -OR',-OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -ОС(O)NR'R", -NR"C(O)R', -C(O)R',-SO2R', -SO2NR'R", -NR"SO2R', -N3, -CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила, где R' и R" являются такими, как определено выше. Еще более предпочтительные заместители выбирают из галогена, -OR', -OC(O)R', -NR'R", -R', -CN, -NO2, -CO2R', -CONR'R", -NR"C(O)R', -SO2R', -SO2NR'R", -NR"SO2R',перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила. Как использовано в данном описании, заместитель -СО 2 Н включает его биоизостерные замены, такие какNew York, 1996; p. 203. Два заместителя у смежных атомов арильного кольца необязательно могут быть заменены заместителем формулы -Т-С(О)-(СН 2)q-U-, где Т и U независимо представляют собой -NH-, -О-, -СН 2- или простую связь, и q представляет собой целое число от 0 до 2. Альтернативно два заместителя у смежных атомов арильного кольца необязательно могут быть заменены заместителем формулы -А-(СН 2)r-В-, где А и В независимо представляют собой -СН 2-, -О-, -NH-, -S-, -S(O)-, -SO2-, -SO2NR'- или простую связь, и r представляет собой целое число от 1 до 3. Одна из простых связей образованного таким образом нового кольца необязательно может быть заменена на двойную связь. Альтернативно, два заместителя у смежных атомов арильного кольца необязательно могут быть заменены заместителем формулы -(СН 2)s-X(CH2)t-, где s и t независимо представляют собой целые числа от 0 до 3 и X представляет собой -O-, -NR'-,-S-, -S(O)-, -SO2- или -SO2NR'-. Заместитель R1 в -NR'- и -SO2NR'- выбирают из группы, состоящей из водорода или незамещенного (C1-С 6)алкила. Как использовано в данном описании, подразумевается, что термин гетероатом включает кислород (О), азот (N), серу (S) и кремний (Si). Подразумевается, что термин фармацевтически приемлемые соли включает соли активных соединений с относительно нетоксичными кислотами или основаниями в зависимости от конкретных заместителей, присутствующих в описанных здесь соединениях. Когда соединения по настоящему изобретению содержат относительно кислотные функциональные группы, взаимодействием нейтральной формы соединений с достаточным количеством желательного основания в отсутствие растворителя или в подходящем инертном растворителе могут быть получены основно-аддитивные соли. Примеры фармацевтически приемлемых основно-аддитивных солей включают соль натрия, калия, кальция, аммония,органического амина или магния или аналогичную соль. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, взаимодействием нейтральной формы соединений с достаточным количеством желательной кислоты или в отсутствие растворителя, или в подходящем инертном растворителе могут быть получены кислотно-аддитивные соли. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают соли, полученные из неорганических кислот,таких как хлористо-водородная, бромисто-водородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, иодисто-водородная или фосфористая кислоты и тому подобные, а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изобутановая, щавелевая, малеиновая, малоновая, бензойная, янтарная, суберановая, фумаровая, миндальная, фталевая, бензолсульфоновая, птолуолсульфоновая, лимонная, винная, метансульфоновая и тому подобные. Также включены соли аминокислот, такие как аргинат и тому подобные, и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и тому подобные (см., например, Berge, S.М., et al. (1977) J. Pharm. Sci. 66: 1-19). Некоторые конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, что позволяет превращать соединения или в основно-аддитивные, или в кислотно-аддитивные соли.-7 009421 Нейтральные формы соединений можно регенерировать взаимодействием соли с основанием или кислотой и выделением исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но в других отношениях соли эквивалентны исходной форме соединения в целях настоящего изобретения. В дополнение к солевым формам, настоящее изобретение относится к соединениям, которые находятся в форме пролекарства. Пролекарства описанных здесь соединений представляют собой соединения, которые легко претерпевают химические изменения в физиологических условиях, давая соединения по настоящему изобретению. Кроме того, пролекарства могут быть преобразованы в соединения по настоящему изобретению химическими и биохимическими методами ex vivo в окружающей среде. Например, пролекарства могут медленно преобразовываться в соединения по настоящему изобретению при помещении их в резервуар чрескожного пластыря вместе с подходящим ферментом или химическим реагентом. Пролекарства часто являются полезными, поскольку в некоторых ситуациях их можно вводить легче, чем исходное лекарственное средство. Они, например, могут быть биодоступными при пероральном введении, тогда как исходное лекарственное средство таким не является. Пролекарство также может обладать улучшенной растворимостью в фармакологических композициях по сравнению с исходным лекарственным средством. В данной области известно большое число пролекарственных производных,таких, для которых предполагается гидролитическое расщепление или окислительная активация пролекарства. В качестве примера, без ограничения, пролекарство будет представлять соединение по настоящему изобретению, которое вводят в виде сложного эфира (пролекарство), который затем метаболически гидролизуется до карбоновой кислоты, активного начала. Дополнительные примеры включают пептидильные производные соединений по настоящему изобретению. Некоторые соединения по настоящему изобретению могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. Обычно сольватированные формы эквивалентны несольватированным формам, и подразумевается, что они включены в объем настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в виде множества кристаллических или аморфных форм. Обычно все физические формы эквивалентны для применения, рассматриваемого в настоящем изобретении, и подразумевается, что они включены в объем настоящего изобретения. Некоторые соединения по настоящему изобретению содержат асимметрические атомы углерода(оптические центры) и двойные связи; подразумевается, что объем настоящего изобретения охватывает рацематы, энантиомеры диастреомеры, геометрические изомеры и индивидуальные изомеры. Соединения настоящего изобретения также могут иметь отличающиеся от природных соотношения атомных изотопов одного или нескольких атомов, которые составляют данные соединения. Например,соединения могут быть радиационно меченными радиоактивными изотопами, такими, например, как тритий (3 Н), иод-125 (125I) или углерод-14 (14 С). Подразумевается, что все изотопные вариации соединений по настоящему изобретению, радиоактивные или нерадиоактивные, включены в объем настоящего изобретения. Варианты осуществления изобретенияMCHR (GenBank Accession No. U71092) экспрессируется в мозге в умеренных количествах - в глазах и скелетных мышцах и в малых количествах - в языке и гипофизе. Факты позволяют предполагать,что MCHR вовлечен, помимо прочего, в обонятельное восприятие, регулирование потребления пищи и энергетический метаболизм, регулирование гипоталамо-гипофизарно-адренокортикальной оси после стресса, возбуждение и ощущение беспокойства (Saito et al., ТЕМ 11 (8): 299-303 (2000. Соединения по настоящему изобретению ингибируют активность MCHR и, таким образом, могут использоваться, например, для лечения или профилактики заболеваний, связанных с данными процессами. Соединения. В одном аспекте настоящее изобретение относится к соединениям, представленным формулой (I) или их фармацевтически приемлемым солям, гидратам, сольватам или пролекарствам. В формуле I представляет собой моноциклическое или конденсированное арильное или гетероарильное может представлять собой бензольное, нафталиновое, пиррольное, пиразольное,кольцо. Например,имидазольное, пиразиновое, оксазольное, изоксазольное, тиазольное, фурановое, тиофеновое, пиридиновое, бензотиазольное, пуриновое, бензимидазольное, индольное, изохинолиновое, хиноксалиновое или представляет собой бензол. хинолиновое кольцо. В предпочтительных вариантах осуществления Символ Q представляет собой -N(R)- или -N(R)-(C1-С 3)алкилен-. В некоторых вариантах осуществления Q представляет собой -N(R)-. Символ R представляет собой символ L1 представляет собой двухвалентную связывающую группу, выбранную из связи, (С 1 С 4)алкилена, (C1-C4)алкиленокси и (С 1-С 4)алкиленамино. Иллюстративные группы L1 представляют собой простую связь, метилен, этилен, н-пропилен и н-бутилен. Символ L2 представляет собой двухвалентную связывающую группу, выбранную из связи, (С 1-С 4)алкилена, (С 2-С 4)алкенилена, (С 2 С 4)алкинилена, (С 1-С 4)алкиленокси или (С 1-С 4)алкиленамино. Иллюстративные группы L2 представляют собой простую связь, метилен, этилен, н-пропилен и н-бутилен. Буквы X и Y независимо представляют собой (C1-C8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил, -CO2R13 или -С(O)NR13R14. Необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7 членного кольца, содержащего от 0 до 2 гетероатомов, независимо выбранных из группы, состоящей изR" представляет собой водород или (C1-C8)алкил. Каждый R1 независимо представляет собой галоген, (C1-C8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил,фтор(C1-C4)алкил, -OR5, -SR5, фтор(С 1-С 4)алкокси, арил, арил(С 1-С 4)алкил, -NO2, -NR5R6, -C(O)R5,-CO2R5, -C(O)NR5R6, -N(R6)С(О)R5, -N(R6)CO2R5, -N(R7)C(O)NR5R6, -S(O)mNR5R6, S(O)mR5, -CN иR2 и R3 независимо выбирают из водорода, галогена, (C1-C8)алкила, (С 2-С 8)алкенила, (С 2C8)алкинила, фтор(C1-C4)алкила, -OR8, -SR8, фтор(С 1-С 4)алкокси, арила, арил(C1-C4)алкила, -NO2, -NR8R9,=O, -C(O)R8, CO2R8, -C(O)NR8R9, -N(R9)C(O)R8, -N(R9)CO2R8, -N(R10)С(O)NR8R9, -S(O)mNR8R9, -S(O)mR8,-CN и -N(R9)S(O)mR8. Иллюстративные группы R2 представляют собой метил, изопропил, трифторметил,гидрокси, метокси, гидроксиметил, трифторметокси, фенил и =O. В некоторых вариантах осуществленияR3 представляет собой водород или =O.R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R16 и R17 независимо выбирают из водорода, (C1-C8)алкила,(С 2-С 8)алкенила, (С 2-С 8)алкинила, фтор(C1-C4)алкила, гетеро(С 1-С 4)алкила, арила и арил(C1-C4)алкила, иR18 представляет собой 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, О и S. Подстрочный индекс m равен 1 или 2, и подстрочный индекс n равен 0, 1 или 2. Необязательно, когда две группы R, выбранные из группы, состоящей из R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17 и R18, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов,выбранных из N, О и S. представляет собой бензольное кольцо, R" представВ конкретных вариантах осуществления ляет собой водород, и R3 представляет собой водород. В другом аспекте настоящее изобретение относится к соединениям формулы (II) или их фармацевтически приемлемым солям, гидратам, сольватам или пролекарствам. В формуле II символ L1 представляет собой двухвалентную связывающую группу, выбранную из связи, (С 1-С 4)алкилена,(C1-C4)алкиленокси и (С 1-С 4)алкиленамино. Иллюстративные группы L1 представляют собой простую связь, метилен, этилен, н-пропилен и н-бутилен. Символ L2 представляет собой двухвалентную связывающую группу, выбранную из связи, (C1-C4)алкилена, (С 2-С 4)алкенилена, (С 2-С 4)алкинилена, (С 1 С 4)алкиленокси и (С 1-С 4)алкиленамино. Иллюстративные группы L2 представляют собой простую связь,метилен, этилен, н-пропилен и н-бутилен. Буквы X и Y независимо представляют собой (C1-C8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил, -CO2R13 или -С(О)NR13R14. Необязательно, X и Y могут быть объединены с образованием 3-, 4-, 5-, 6- или 7 членного кольца, содержащего от 0 до 2 гетероатомов, выбранных из N, О и S. Буква Z представляет собой OR12, -NR12R13, -C(O)2R12, -R15, -C(O)NR12R13, -C(O)NR12R15,-SO2NR12R15, -NR13SO2R15, -N(R12)N(R13)SO2R14, -C(O)N(R13)OR12, фтор(С 1-С 4)алкил, гетероарил,-C(=NOR12)NR13R14, -C(R13)=NOR12, -NR13(OR12), -C(O)NR14C(O)NR12R13, -NR14C(O)NR13C(O)R12 иR" представляет собой водород или (C1-C8)алкил.- 10009421 Каждый R1 независимо представляет собой галоген, (C1-C8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил,фтор(С 1-С 4)алкил, -OR5, -SR5, фтор(С 1-С 4)алкокси, арил, арил(С 1-С 4)алкил, -NO2, -NR5R6, -C(O)R5,-CO2R5, -C(O)NR5R6, -N(R6)С(О)R5, -N(R6)CO2R5, -N(R7)C(O)NR5R6, -S(O)mNR5R6, S(O)mR5, -CN иR5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R16 и R17 независимо выбирают из водорода, (C1-C8)алкила,(С 2-С 8)алкенила, (С 2-С 8)алкинила, фтор (C1-C4)алкила, гетеро(C1-C4)алкила, арила и арил(C1-C4)алкила, иR18 представляет собой 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, O и S. Подстрочный индекс m равен 1 или 2, и подстрочный индекс n равен 0, 1 или 2. Необязательно, когда две группы R, выбранные из группы, состоящей из R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17 и R18, присоединены к одному и тому же атому азота, группы R могут быть объединены с образованием 3-, 4-, 5-, 6-или 7-членного кольца, содержащего атом азота и от 0 до 2 дополнительных гетероатомов,выбранных из N, О и S. Отличительной особенностью соединений изобретения является кольцо пиридо[4,3-b]карбазола,минимально замещенное в 2 и 11 положениях. Система нумерации кольца, использованная в данном изобретении, показана ниже. Специалисту в данной области будет понятно, что формула II охватывает два энантиомера. Энантиомеры имеют структурное расположение, показанное в следующих формулах. В вышеуказанных формулах I или II некоторые группы являются предпочтительными и описаны ниже. В одной из групп предпочтительных вариантов осуществления L1 представляет собой (C1C4)алкилен. В предпочтительном варианте осуществления L1 представляет собой незамещенный (С 1 С 4)алкилен или -(СН 2)p-, где подстрочный индекс р представляет собой целое число от 1 до 4. В следующем предпочтительном варианте осуществления р составляет 1, 2 или 3. В еще более предпочтительном варианте осуществления р составляет 2 или 3. В особенно предпочтительном варианте осуществления р равно 2. Одна группа предпочтительных вариантов осуществления представлена формулой (III) В предпочтительном варианте осуществления X и Y объединены с образованием а 3-, 4-, 5-, 6- или 7-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S. В следующем предпочтительном варианте осуществления X и Y объединены с образованием 5- или 6-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S. В особенно предпочтительном варианте осуществления X и Y объединены с образованием 5- или 6-членного кольца, содержащего 0 гетероатомов, 1 атом азота или 1 атом кислорода. В другом предпочтительном варианте осуществления L2 представляет собой связь, и Z представляет собой -CO2R15 или -CO2NR15R16. В другой группе предпочтительных вариантов осуществления R" представляет собой водород. В другой группе предпочтительных вариантов осуществления R" представляет собой замещенный(C1-C8)алкил. В предпочтительном варианте осуществления R" представляет собой (C1-C8)алкил, заме- 11009421 щенный гидрокси, алкиламино (например, -NHMe) или карбокси (-СО 2 Н). В особенно предпочтительном варианте осуществления R" представляет собой (С 3-C8)алкил, замещенный гидрокси, алкиламино или карбокси. В другой группе предпочтительных вариантов осуществления R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(С 1-С 4)алкокси, -CO2R5, -S(O)mNR5R6, -S(O)mR5 или-CN. В следующем предпочтительном варианте осуществления R1 независимо представляет собой галоген или фтор(C1-C4)алкил. В следующем предпочтительном варианте осуществления R1 представляет собой галоген или фтор(C1-C4)алкил, и подстрочный индекс n равен 0 или 1. В особенно предпочтительном варианте осуществления R1 представляет собой фтор(С 1-С 4)алкил, и подстрочный индекс n равен 0 или 1. В другой группе предпочтительных вариантов осуществления R2 представляет собой (С 1-С 4)алкил или арил. В другой группе предпочтительных вариантов осуществления R4 представляет собой водород. Также особенно предпочтительны те варианты осуществления, в которых объединены две или более из данных предпочтительных групп. Соответственно в одной группе особенно предпочтительных вариантов осуществления R" и R4 представляют собой водород. В другой группе особенно предпочтительных вариантов осуществления R" и R4 представляют собой водород, и R2 представляет собой (C1-C4)алкил или арил. В другой группе особенно предпочтительных вариантов осуществления R" и R4 представляют собой водород, R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(С 1 С 4)алкокси, -CO2R5, -S(O)mNR5R6, -S(O)mR5 или -CN, и R2 представляет собой (C1-C4)алкил или арил. В особенно предпочтительном варианте осуществления R" и R4 представляют собой водород, R1 представляет собой галоген или фтор(С 1-С 4)алкил, n равно 1, и R2 представляет собой (C1-C4)алкил или арил. В еще более предпочтительном варианте осуществления R" и R4 представляют собой водород, R1 представляет собой фтор (С 1-С 4)алкил, n равно 1 и R2 представляет собой (C1-C4)алкил или арил. Одна из групп особенно предпочтительных вариантов осуществления представлена формулой (IV) где р, R1, R2, L2, X, Y и Z имеют значения и предпочтительно сгруппированы как указано выше. В особенно предпочтительном варианте осуществления X и Y объединены с образованием 3-, 4-, 5-,6- или 7-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S, L2 представляет собой связь, и Z представляет собой -CO2R15 или -CO2NR15R16. В другом особенно предпочтительном варианте осуществления X и Y объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S, и R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(С 1-С 4)алкокси, -CO2R5,-S(O)10NR5R6, -S(O)mR5 или -CN. В другом особенно предпочтительном варианте осуществления X и Y объединены с образованием 3-, 4-, 5-, 6- или 7-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S, и R2 представляет собой (C1-C4)алкил или арил. В другом особенно предпочтительном варианте осуществления X и Y объединены с образованием 3-, 4-, 5-, 6-или 7-членного кольца, содержащего 0-2 гетероатома, выбранных из О, N и S, R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(C1-C4)алкокси, -CO2R5,-S(O)mNR5R6, -S(O)mR5 или -CN, и R2 представляет собой (С 1-С 4)алкил или арил. В другом особенно предпочтительном варианте осуществления R1 независимо представляет собой галоген, (C1-C4)алкил, фтор(С 1-С 4)алкил, -OR5, фтор(C1-C4)алкокси, -CO2R5, -S(O)mNR5R6, -S(O)mR5 или-CN, и R2 представляет собой (С 1-С 4)алкил или арил. В другом особенно предпочтительном варианте осуществления R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(C1-C4)алкокси, -CO2R5, -S(O)mNR5R6, -S(O)mR5 или-CN, L2 представляет собой связь, и Z представляет собой -CO2R15 или -CO2NR15R16. В другом особенно предпочтительном варианте осуществления R2 представляет собой (C1-C4)алкил или арил, L2 представляет собой связь, и Z представляет собой -CO2R15 или -CO2NR15R16. В другом особенно предпочтительном варианте осуществления R1 независимо представляет собой галоген, (С 1-С 4)алкил, фтор(C1-C4)алкил, -OR5, фтор(C1-C4)алкокси, -CO2R5, -S(O)mNR5R6, -S(O)mR5 или-CO2R15 или -CO2NR15R16. В особенно предпочтительном варианте осуществления настоящее изобретение относится к следующим соединениям. В следующих конкретных вариантах осуществления настоящее изобретение относится к фармацевтически приемлемым солям вышеуказанных соединений. Например, в определенном варианте осуществления настоящее изобретение относится к солям бензолсульфоновой кислоты и вышеуказанных соединений. Композиции. В другом аспекте настоящее изобретение относится к фармацевтическим композициям, включающим одно или несколько соединений по изобретению в сочетании с диагностически или фармацевтически приемлемым носителем или эксципиентом. Представленные композиции можно использовать для лечения или профилактики состояний или нарушений, опосредованных MCHR, такие как ожирение и нарушения питания, такие как нервная анорексия. Соединения по настоящему изобретению могут быть получены и введены в виде большого множества пероральных и парентеральных препаративных лекарственных форм. Так соединения по настоящему изобретению можно вводить путем инъекции, например,внутривенно, внутримышечно, внутрикожно, подкожно, внутридуоденально или внутрибрюшинно. Также описанные здесь соединения можно вводить путем ингаляции, например, интраназально. Кроме того,соединения по настоящему изобретению можно вводить чрескожно. Другие пути введения также предполагаются для использования в случае соединений по настоящему изобретению, включая введение депо-препарата и ректальное введение. Для получения фармацевтических композиций соединений по настоящему изобретению фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Твердые препаративные формы включают порошки, таблетки, пилюли, капсулы, саше, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут действовать как разбавители, вкусовые агенты, связующие вещества, консерванты, дезинтергирующие агенты для таблеток или инкапсулирующее вещество. В порошках носитель представляет собой тонкодисперсное твердое вещество, которое находится в смеси с тонкодисперсным активным компонентом. В таблетках активный компонент смешивают с носителем, обладающим необходимыми связующими свойствами, в подходящих пропорциях и придают желаемую форму и размер. Порошки и таблетки предпочтительно содержат примерно от 5 или 10 до 70% активного компонента. Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, сахар, лактозу,пектин, декстрин, крахмал, желатин, трагакантовую камедь, метилцеллюлозу, карбоксиметилцеллюлозу натрия, низкоплавкий воск, масло какао и тому подобное. Подразумевается, что термин препаративная форма включает композицию активного соединения с инкапсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент, вместе с другими носителями или без них,окружен носителем, который таким образом с ним связан. Аналогично, этот термин включает саше и пастилки. Таблетки, порошки, пилюли, саше и пастилки можно использовать в качестве твердых препаративных лекарственных форм, подходящих для перорального введения. Для получения суппозиториев низкоплавкий воск, такой как смесь глицеридов жирных кислот или- 13009421 масло какао, первоначально расплавляют и в нем гомогенно диспергируют активный компонент, например, путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы подходящего размера, оставляют охлаждаться и таким образом отверждаться. Жидкие препаративные формы включают растворы, суспензии и эмульсии, например, растворы в воде или смеси воды с пропиленгликолем. Для парентеральной инъекции жидкие препаративные формы могут быть изготовлены в виде раствора в водном полиэтиленгликоле. Водные растворы, подходящие для перорального применения, могут быть получены путем растворения активного компонента в воде и добавления, при желании, подходящих красителей, ароматизаторов, стабилизаторов и загустителей. Водные суспензии, подходящие для перорального применения, могут быть получены путем диспергирования тонкодисперсного активного компонента в воде вместе с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, карбоксиметилцеллюлоза натрия и другими хорошо известными суспендирующими агентами. Изобретение включает также твердые формы, которые предназначены для превращения незадолго до применения в жидкие препаративные формы для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Данные препаративные формы могут содержать, в дополнение к активному компоненту, красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизаторы и тому подобные. Фармацевтические препараты предпочтительно представляют собой единичную форму дозировки. В такой форме препарат подразделен на единичные дозы, содержащие подходящие количества активного компонента. Единичная форма дозировки может представлять собой упакованный препарат, где упаковка содержит определенные количества препарата, такой как упакованные таблетки, капсулы и порошки в пузырьках и ампулах. Также единичная форма дозировки может представлять собой саму по себе капсулу, таблетку, саше или пастилку или она может представлять собой любое их число в упакованной форме. Количество активного компонента в единичной форме дозировки препарата может изменяться и регулироваться от 0,1 до 1000 мг, предпочтительно от 1,0 мг до 100 мг в соответствии с конкретным применением и эффективностью активного компонента. Композиция, при желании, также может содержать другие совместимые терапевтические агенты. При терапевтическом применении для лечения или профилактики состояний и нарушений, связанных с MCHR, соединения, применяемые в фармацевтическом способе по изобретению, вводят в первоначальной дозировке примерно от 0,001 до примерно 100 мг/кг в сутки. Предпочтительной является диапазон дневной дозировки примерно от 0,1 до примерно 10 мг/кг. Дозировки, однако, могут изменяться в зависимости от требований пациента, серьезности состояния, подвергаемого лечению и используемого соединения. Определение правильной дозировки для конкретной ситуации является компетенцией лечащего врача. Обычно лечение начинают с меньших дозировок, которые меньше оптимальной дозы соединения. Затем дозировку увеличивают небольшими добавлениями до тех пор, пока не достигается оптимальный эффект в данных обстоятельствах. Для удобства, при желании, дневную дозировку можно разделять и вводить порциями в течение дня. Композиции благоприятным образом могут быть объединены и/или использованы в сочетании с агентами, используемыми для лечения и/или профилактики ожирения и нарушений питания и связанными с ними патологиями (например, сердечно-сосудистое заболевание и гипертензия). Во многих случаях введение субъекту соединений или композиций в сочетании с альтернативными агентами усиливает эффективность таких агентов. Соответственно, в некоторых случаях настоящие соединения при объединении или при введении в сочетании, например, с агентами против ожирения, можно использовать в дозировках, которые меньше ожидаемых количеств при использовании по отдельности, или в меньших дозировках, чем количества, рассчитанные для комбинированной терапии. Подходящие агенты для комбинированной терапии включают те, которые являются коммерчески доступными в настоящее время и те, которые находятся в стадии разработки или будут разработаны в будущем. Иллюстративные агенты, используемые при лечении ожирения включают агонисты 3 адренергического рецептора, лептин или его производные и антагонисты нейропептида Y. Иллюстративные агенты, используемые для лечения тревожных состояний и/или нарушений настроения, включают бензодиазепины, например, алпразолам, хлордиазепоксид, клоназепам, клоразепат, диазепам, доразепам, оксазепам и тому подобные; гетероциклические антидепрессанты, например амитриптилин, нортриптилин,имипрамин, дезипрамин, доксепин, тримипрасмин, кломипрамин, протриптилин, амоксапин и мапротилин; ингибиторы моноаминоксидазы (MAOI), например фенелзин и транилципромин, ингибиторы обратного захвата серотонина (SRI); селективные ингибиторы обратного захвата серотонина (SSRI), например флуоксетин, флувоксамин, пароксетин и сертралин; серотонергические-норадренергические антидепрессанты, например венлафаксин; антагонисты 5-НТ 2, например тразадон, нефазодон и миртазапин и катехоламинергические антидепрессанты, например бупроприон. Способы применения. Еще в одном аспекте настоящее изобретение относится к способам применения одного или нескольких соединений по изобретению для лечения или профилактики состояния или нарушения, связан- 14009421 ного с поведением при питании, энергетическим гомеостазом или тревожным состоянием. Иллюстративные состояния и нарушения, связанные с поведением при питании, энергетическим гомеостазом или тревожным состоянием включают нарушения питания, такие как нервная анорексия и булимия, ожирение,тревожные состояния, например общее тревожное состояние, приступы паники, расстройства панического типа и обсессивно-компульсивное нарушение (OCD), и расстройства настроения, например депрессия и биполярные нарушения. Способы применения соединения по изобретению для лечения или профилактики состояния или нарушения, связанного с потреблением пищи включают способы модифицирования потребления и приема пищи, например стимулирование и подавление приема пищи или увеличение или снижение потребления пищи. Способы включают введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения изобретения. В другом аспекте настоящее изобретение относится к способам использования соединения изобретения для лечения или профилактики состояния или нарушения, опосредованного MCHR. Способы включают введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения изобретения. Еще в одном аспекте настоящее изобретение относится к способам применения соединения изобретения для модулирования MCHR. Способы включают контактирование клетки с соединением изобретения. Соединения изобретения также могут модулировать G-протеинсвязанные рецепторы, относящиеся к MCHR, например MCHR2 (см. международную публикацию WO 00/49046 и WO 01/07606). Получение соединений. Настоящее изобретение относится к получению соединений формулы I. Схема 1 Общий путь синтеза указан на схеме 1, на которой показана конденсация замещенного арильного фрагмента A с бициклической структурой В с получением соединения формулы С, где переменные являются такими, как определено выше. В формуле А D1 представляет собой водород, галоген, -C(O)R7,-CO2R8 или -C(O)NR5R6, где R5, R6, R7 и R8 являются такими, как определено выше, и D представляет собой связь, -N(R")-, -N(защитная группа)-, -S- или -О-, где R" является таким, как определено выше, и защитная группа представляет собой защитную группу амина. Обычные защитные группы амина состоят из известных групп, которые используют для защитного блокирования аминогруппы во время описанных здесь синтетических методов. Такие обычные блокирующие группы легко удаляются, т.е. они могут быть удалены, при желании, с помощью способов, которые не вызывают расщепления или другого разрушения оставшейся части молекулы. Подходящие защитные группы для соединений настоящего изобретения будут очевидны из данной заявки, принимая во внимание уровень специалистов в данной области и со ссылкой на стандартные справочники, такие как Greene, Т.W. et al., Protective Groups in Organic Synthesis, Wiley, New York (1991). В формуле В Е 1 представляет собой водород, -C(O)R7, -CO2R8 или -C(O)NR5R6, где R5, R6, R7 и R8 являются такими, как определено выше, и Е 2 представляет собой =O или -NR5R6, где R5 и R6 являются такими, как определено выше. Когда соединение формулы А, где D1 представляет собой водород, и D2 представляет собой -N(R")- или -N(защитная группа)-, -S- или -O-, взаимодействует с соединением формулы В, где Е 1 представляет собой водород, и Е 2 представляет собой =O или его защитную группу (например, ацеталь), в типичных условиях индолизации по Фишеру, образуется соединение формулы С. Специалисту в данной области будет понятно, что представленный выше синтез может быть модифицирован для использования других исходных веществ и альтернативных реагентов для осуществления желаемых превращений. Например, соединение формулы А, где D1 представляет собой уходящую группу, такую как Cl, Br, I или толуолсульфонат, может взаимодействовать с соединением формулы В, где Е 2 представляет собой =O или его защищенный вариант, в катализируемой палладием реакции сочетания с получением соединения формулы С. Также соединение формулы А, где D1 представляет собой уходящую группу, и D2 представляет собой нитрогруппу, может взаимодействовать с соединением формулы В, где Е 1 представляет собой CO2R, и где Е 2 представляет собой =O или его защищенный вариант, с получением соединения формулы С. Соответственно описанные здесь синтез и реагенты представлены здесь в качестве не ограничивающих вариантов осуществления. Вещества, представленные формулой А, являются коммерчески доступными (Aldrich Chemical),или могут быть получены синтетически в соответствии с методиками, изложенными в литературе. Одним из способов получения соединений, представленных формулой В, является способ аннелирования по Робинсону между циклическим кетоном и замещенным еноном с последующим насыщением- 15009421 двойной связи. Специалисту в данной области будет очевидно, что доступны и другие методы. В этом процессе можно контролировать стереохимию и абсолютную стереохимию. Индивидуальные формы соединений формулы В, например, диастереомеры и энантиомеры, могут образовываться в стереоселективных реакциях или могут быть разделены, например, хроматографическими методами (диастереомеры) и оптическим разделением (энантиомеры). Анализ соединений. Активность MCHR полипептидов может быть оценена с использованием множества анализов in vitro и in vivo для определения функционального, химического и физического действий, например измерения лигандого связывания (например, радиоактивного лигандного связывания), уровней вторичного мессенджера (например, цАМФ, 4GMP, IP3, DAG, Са 2+), ионного потока, уровней фосфорилирования, уровней транскрипции, уровней нейротрансмиттеров и тому подобные. Кроме того, такие анализы можно использовать для тестирования антагонистов и агонистов MCHR. Скриннинговые анализы можно использовать для идентификации модуляторов, которые можно использовать в качестве терапевтических агентов, например, антагонистов активности MCHR. Модуляторы активности MCHR могут быть протестированы с использованием MCHR полипептидов, как описано выше, или рекомбинантных или природного происхождения (например, эндогенных). Белок может быть выделен, экспрессирован в клетку, экспрессирован в мембрану, полученную из клетки, экспрессирован в ткань или в животное рекомбинантного или природного происхождения. Например,можно использовать клетки почки, клетки печени, клетки ободочной кишки, трансформированные клетки или мембраны. Модулирование исследуют с использованием одного из описанных здесь анализов invitro или in vivo. Сигнальная трансдукция также может быть исследована in vitro с помощью реакций в растворе или твердофазных реакций с использованием химерной молекулы, такой как межклеточный домен рецептора, ковалентно связанного с гетерологичным доменом сигнальной трансдукции или гетерологичным межклеточным доменом, ковалентно связанным с трансмембраной и/или цитоплазматическим доменом рецептора. Также может быть изучена генная амплификация. Кроме того, лигандсвязывающие домены представляющего интерес белка могут использоваться в реакциях в растворе или твердофазных реакциях для анализирования лигандного связывания. Лигандное связывание с MCHR домена или химерного белка может быть протестировано в растворе, в двухслойной мембране, присоединенной к твердой фазе, в липидном монослое или в везикулах. Связывание модулятора может быть протестировано с использованием, например, изменений в спектроскопических характеристиках (например, флуоресценция, поглощение, показатель преломления), гидродинамических (например, форма), хроматографических свойствах или свойствах растворимости. Также можно исследовать взаимодействия с MCHR-G-белком, например, с помощью анализа связывания G-белка с MCHR или может быть исследовано его высвобождение из MCHR. Например, в отсутствие GTP активатор будет приводить к образованию тесно связанного комплекса G-белка (все три субъединицы) с MCHR. Этот комплекс можно обнаружить множеством способов, как отмечено выше. Такой анализ может быть модифицирован для поиска антагонистов. В одном варианте осуществления кMCHR и G-белку добавляют активатор в отсутствие GTP, давая возможность образования тесно связанного комплекса, и затем проводят скрининг антагонистов, наблюдая за диссоциацией комплекса MCHRG-белок. В присутствии GTP высвобождение альфа-субъединицы G-белка из других двух субъединиц Gбелка служит критерием активации. Активированный или ингибированный G-белок будет, в свою очередь, изменять свойства эффекторов в прямом 5'-3' направлении, таких как белки, ферменты и каналы. Классическими примерами являются активация цGMP фосфодиэстеразы с помощью трансдуцина в системе зрения, аденилатциклазы путем стимуляции G-белка, фосфолипазы С с помощью Gq и других родственных G-белков и модуляция разнообразных каналов Gi и другими G-белками. Расположенные в прямом направлении последовательности также могут быть исследованы, например, образование диацилглицерина и IP3 с помощью фосфолипазы С и, в свою очередь, мобилизация кальция посредством IP3. Активированный MCHR становится субстратом для киназ, которые фосфорилируют С-концевой хвост рецептора (а также возможно другие сайты). Таким образом, активаторы будут промотировать перенос 32 Р от гамма-меченного АТФ к рецептору, что может быть проанализировано с помощью сцинтилляционного счетчика. Фосфорилирование С-концевого хвоста будет промотировать связывание аррестиноподобных белков и будет мешать связыванию G-белков. Путь киназа/аррестин играет ключевую роль в снижении чувствительности многих рецепторов GPCR. Общий обзор по GPCR сигнальной трансдукции и способы анализа сигнальной трансдукции см., например, в публикациях Methods in Enzymology, vols. 237 и 238 (1994) и volume 96 (1983); Bourne et al., Nature 10: 349: 117-27 (1991); Bourne et al.,Nature 348: 125-32 (1990); Pitcher et al., Annu. Rev. Biochem. 67: 653-92 (1998). Образцы или анализируемые пробы, которые обработаны потенциальным антагонистом или агонистом MCHR, сравнивают с контрольными образцами, не содержащими исследуемого соединения, для изучения степени модуляции. Контрольным образцам (необработанным агонистами или антагонистами) приписывается относительная величина активности MCHR, равная 100. Ингибирование MCHR достигается, когда величина активности MCHR по сравнению с контролем составляет примерно 90%, необяза- 16009421 тельно 50%, необязательно 25-0%. Активация MCHR достигается когда величина активности MCHR по сравнению с контролем составляет 110%, необязательно 150, 200-500 или 1000-2000%. Изменения ионного потока могут быть оценены путем определения изменений в поляризации (т.е. электрическом потенциале) клетки и мембраны, экспрессирующей MCHR. Одним из способов определения изменений в клеточной поляризации является измерение изменений в токе (измеряя таким образом изменения в поляризации) с помощью метода фиксации напряжения и метода фиксации потенциала, например, клетка-присоединенный способ, способ внутрь-наружу и способ цельной клетки (см.,например, Ackerman et al., New Engl. J Med. 336: 1575-1595 (1997. Токи целой клетки обычно определяют с использованием стандартной методологии (см., например, Hamil et al., PFlugers. Archiv. 391: 85(1981). Другие известные анализы включают анализы потока радиоактивно меченых ионов с использованием чувствительных к электрическому напряжению красителей (см., например, Vestergarrd-Bogind et al.,J.Membrane Biol. 88: 67-75 (1988); GonzalesTsien, Chem. Biol. 4: 269-277 (1997); Daniel et al., J. Pharmacol. Meth. 25, 185-193 (1991); Holevinsky et al., J. Membrane Bioloqy 137: 59-70 (1994. Обычно исследуемые соединения присутствуют в диапазоне от 1 пМ до 100 мМ. Влияние исследуемых соединений на функцию полипептидов может быть измерено путем исследования любого из описанных выше параметров. Любое подходящее физиологическое изменение, которое воздействует на активность MCHR, может быть использовано для оценки влияния тестируемого соединения на полипептиды по настоящему изобретению. Когда функциональные последствия определяют с использованием неповрежденных клеток или животных, также можно измерять множество действий,таких как высвобождение трансмиттера, высвобождение гормона, транскрипционные изменения как известных, так и не охарактеризованных генетических маркеров (например, назерн-блоттинг), изменения клеточного метаболизма, например, роста клеток или изменения рН, и изменения во внутриклеточных вторичных мессенджерах, таких как Са 2+, IP3 или цАМФ. Предпочтительные анализы для MCHR включают клетки, которые нагружены иончувствительными или чувствительными к напряжению красителями для информации о рецепторной активности. В анализах для определения активности таких рецепторов также можно использовать известные агонисты и антагонисты для других связанных с G-белками рецепторов в качестве отрицательного или положительного контроля при оценке активности исследуемых соединений. В анализах для идентификации модулирующих соединений (например, агонистов, антагонистов) изменения в уровне ионов в цитоплазме или мембранное напряжение можно контролировать с использованием ион-чувствительных или флуоресцентных индикаторов мембранного напряжения соответственно. К ион-чувствительным индикаторам и зондам электрического напряжения, которые можно использовать, относятся описанные в каталоге Molecular Probes 1997. Для связанных с G-белками рецепторов смешанные G-белки, такие какGal5 и Gal6, могут быть использованы в выбранном способе анализа (Wilkie et al., Proc. Natl Acad. Sci.USA 88: 10049-10053 (1991. Такие смешанные G-белки дают возможность связывания с широким рядом рецепторов путем сигнальной трансдукции в гетерологичных клетках. Активация рецептора обычно инициирует последующие внутриклеточные события, например, увеличение вторичных мессенджеров, таких как IP3, которые высвобождают внутриклеточные запасы ионов кальция. Активация некоторых связанных с G-белками рецепторов стимулирует образование инозитолтрифосфата (IP3) посредством фосфолипаза. С опосредованного гидролиза фосфатидилинозитола (BerridgeIrvine, Nature 312: 315-21 (1984. IP3, в свою очередь, стимулирует высвобождение внутриклеточных запасов ионов кальция, и изменение уровней вторичных мессенджеров, таких как IP3, может быть использовано для оценки функции связанного с G-белком рецептора. Клетки, экспрессирующие такие связанные с G-белками рецепторы, могут проявлять повышенные уровни кальция в цитоплазме в результате вклада как за счет внутриклеточных запасов, так и посредством активации ионных каналов, и в таком случае может оказаться желательным, хотя и не необходимым, проводить такие анализы в не содержащем кальций буфере, необязательно дополненном хелатирующим агентом, таким как EGTA, для того, чтобы различить флуоресцентный ответ на высвобождение кальция из внутренних запасов. Другие анализы могут включать определение активности рецепторов, которые, будучи активированными, приводят к изменению уровня внутриклеточных циклических нуклеотидов, например, цАМФ или цGMP, путем активации или ингибирования расположенных ниже эффекторов, таких как аденилатциклаза. Существуют управляемые циклическими нуклеотидами ионные каналы, например, стержневые фоторецепторные клеточные каналы и обонятельные нейронные каналы, которые являются проницаемыми для катионов при активации путем связывания цАМФ или цGMP (см., например, Altenhofen et al., Proc.Natl. Acad. Sci. U.S.A. 88: 9868-9872 (1991) и Dhallan et al., Nature 347: 184-187 (1990. В случаях, где активация рецептора приводит к снижению уровней циклических нуклеотидов, может оказаться предпочтительным подвергать клетки воздействию агентов, которые увеличивают уровни внутриклеточных циклических нуклеотидов, например форсколина, перед добавлением рецепторактивирующего соединения к клеткам для анализа. Клетки для анализа данного типа могут быть получены котрансфекцией клетки-хозяина с ДНК, кодирующей управляемые циклическими нуклеотидами ионные каналы, GPCR фосфатазой и ДНК, кодирующей рецептор (например, определенные глутаматные рецепторы, мускаринаце- 17009421 тилхолиновые рецепторы, допаминовые рецепторы, серотониновые рецепторы и тому подобные), которые, будучи активированными, вызывают изменения уровней циклических нуклеотидов в цитоплазме. В одном варианте осуществления изменения внутриклеточного цАМФ или GMP могут быть измерены с использованием иммунологических анализов. Способ, описанный OffermannsSimon, J. Biol.Chem. 270: 15175-15180 (1995), может быть использован для определения уровня цАМФ. Также способ,описанный Felley-Bosco et al., 4177, J.Resp. Cell and Mol. Biol. 11: 159-164 (1994), может быть использован для определения уровня GMP. Кроме того, аналитический набор для измерения цАМФ и/или GMP описан в патенте США 4115538, включенном в данное описание путем ссылки. В другом варианте осуществления гидролиз фосфатидилинозитола (PI) можно проанализировать в соответствии с патентом США 5436128, включенным в данное описание путем ссылки. В другом варианте осуществления могут быть измерены уровни транскрипции для оценки влияния исследуемых соединений на сигнальную трансдукцию. Клетку-хозяин, содержащую представляющий интерес белок, приводят в контакт с исследуемым соединением в течение достаточного времени для воздействия на любые взаимодействия, а затем измеряют уровень экспрессии гена. Количество времени для воздействия на такие взаимодействия может быть определено эмпирически, например, проводя эксперимент во времени и измеряя уровни транскрипции как функцию времени. Количество транскрипции может быть измерено с использованием любого подходящего способа, известного специалисту в данной области. Например, экспрессия мРНК представляющего интерес белка может быть обнаружена с использованием метода назерн-блоттинга или их полипептидные продукты могут быть идентифицированы с использованием иммуноанализов. Альтернативно можно использовать анализы на основе транскрипции с использованием репортерных генов, как описано в патенте США 5436128, включенном в данное описание путем ссылки. Репортерные гены могут представлять собой, например, хлорамфениколацетилтрансферазу, люциферазу светлячка, бактериальную люциферазу, -галактозидазу и щелочную фосфатазу. Кроме того, представляющие интерес белки могут использоваться в качестве косвенного репортера при их присоединении ко второму репортеру, такому как зеленый флуоресцентный белок (см., например,Mistili Spector, Nature Biotechnology 15: 961-964 (1997. Количество транскрипции затем сравнивают с количеством транскрипции или в той же самой клетке в отсутствие исследуемого соединения, или его можно сравнивать с количеством транскрипции, по существу, в идентичной клетке, которая не содержит представляющий интерес белок. По существу,идентичная клетка может быть получена из тех же самых клеток, из которых была получена рекомбинантная (или не рекомбинантная) клеточная линия, но которая была модифицирована введением гетерологичной ДНК. Любое различие в количестве транскрипции указывает, что исследуемое соединение каким-то образом изменило активность белка, представляющего интерес. Следующие примеры приведены в качестве иллюстрации, а не для ограничения. Специалисты в данной области легко распознают множество некритических параметров, которые могут быть изменены или модифицированы с получением, по существу, аналогичных результатов. Примеры Использованные ниже реагенты и растворители доступны из коммерческих источников, таких какAldrich Chemical Co. (Milwaukee, Wisconsin, USA). Спектры 1 Н-ЯМР регистрировали на ЯМР спектрометре Varian Gemini 400 МГц. Значимые пики табулировали в следующем порядке: мультиплетность (с,синглет; д, дублет; т, триплет; кв, квартет; м, мультиплет; ушир. с, уширенный синглет), константа(ы) спин-спинового взаимодействия в герцах (Гц) и число протонов. Масс-спектры электронной ионизации(EI) записывали на масс-спектрометре Hewlett Packard 5989 А. Результаты масс-спектрометрии представлены как отношение массы к заряду с последующим относительным содержанием каждого иона (в скобках). Отдельная величина m/е представлена для иона М+Н (или, если указано, М-Н иона), содержащего наиболее распространенные изотопы атомов. Изотопное распределение во всех случаях соответствует ожидаемой формуле. Масс-спектральный анализ электроспрей-ионизации проводили на электроспрей масс-спектрометре HewlettPackard1100 MSD с использованием НР 1 100 ВЭЖХ для доставки образца. Обычно аналит растворяли в метаноле из расчета 0,1 мг/мл и 1 мкл раствора вводили в доставляющем растворителе в масс-спектрометр, который сканировал массу в диапазоне от 100 до 1500 Да. Все соединения могут быть проанализированы в режиме положительной ионизации ESI с использованием смеси ацетонитрил/вода в соотношении 1:1 с добавлением 1% уксусной кислоты в качестве доставляющего растворителя. Приведенные ниже соединения также могут быть проанализированы в отрицательном варианте ESI с использованием 2 мМ NH4OAc в смеси ацетонитрил/вода в качестве доставляющего растворителя. Аналитический ВЭЖХ анализ проводили на системе Hewlett-Packard Series 1050 с С 18 колонкой с обращенной фазой (4,6 мм 150 мм), производимой Shiseido Co., Japan. Градиентное элюирование проводили, используя различный процент ацетонитрила и воды (каждый с добавлением 0,1% трифторуксусной кислоты) в качестве подвижной фазы. Анализ оптической чистоты также проводили на системе Hewlett-Packard Series 1050, оборудованной хиральной ВЭЖХ колонкой (ChiralPak AD, 4,6 мм 150 мм), полученной от Chiral Technology. Изопропанол (3%) и гексан (97%), содержащий 0,1% диэтиламина использовали в качестве подвижной фазы. Соединение 4 получали в 4 стадии следующим образом. Стадия 1. Аннелирование по Робинсону. Смесь N-бензил-4-пиперидона (500 г, 2,65 моль) и пирролидин (330 мл, d 0,852, 3,96 моль) в толуоле (2 л) нагревали при кипении с обратным холодильником,удаляя выделяющуюся воду с помощью ловушки Дина-Старка. Через 8 ч было собрано 70 мл воды и объем собираемой воды в дальнейшем прекращал увеличиваться. По данным ГЖХ анализа выявлено присутствие исходного N-бензил-4-пиперидона и енаминового продукта. Растворитель и избыток пирролидина упаривали при пониженном давлении (вакуум, 60 Торр; нагревающая баня 50 С). Остаток растворяли в 500 мл толуола и опять упаривали, получая темное масло (630 г). Полученный енамин растворяли в безводном диоксане (2 л) и фильтровали в 5 л трехгорлую колбу,оборудованную механической мешалкой, обратным холодильником и капельной воронкой. В реакционную колбу в течение 20 мин добавляли 3-пентен-2-он (333 г, 2,78 моль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 25 ч. После охлаждения примерно до комнатной температуры добавляли NaOMe (6,7 г, 0,125 моль) и смесь нагревали при кипении с обратным холодильником в течение 6 ч. После охлаждения примерно до комнатной температуры добавляли к реакционной смеси предварительно перемешанный раствор AcONa (200 г) в 400 мл воды и ледяной АсОН (400 мл). Реакционную смесь нагревали при кипении с обратным холодильником дополнительно в течение 5 ч. Отгоняли приблизительно 1 л растворителя (и возможно пирролидина), остаток реакционной смеси охлаждали до комнатной температуры и доводили до слабощелочной среды (pH 8-9) с использованием 2 н. NaOH (2,5 л). После разделения слоев, водную фазу экстрагировали AcOEt (3 л). Органические экстракты объединяли, промывали насыщенным раствором соли и фильтровали через короткий слой силикагеля, получая темный прозрачный раствор. Фильтрат концентрировали при пониженном давлении,получая густое масло (670 г). Это вещество использовали непосредственно на стадии разделения на оптические изомеры. Стадия 2. Разделение на оптические изомеры. Схема 2 К перемешиваемому горячему раствору рацемического изохинолинона в виде свободного основания (626 г, 2,45 моль) в 95% этаноле (800 мл) добавляли раствор ди-О-п-толуоил-L-винная кислота (945 г, 2,45 моль) в горячем этаноле (1500 мл). Осаждение менее растворимой диастереомерной соли обычно происходило как только завершали смешивание. Смесь нагревали на горячей водяной бане (80 С) при осторожном перемешивании в течение 1 ч и оставляли медленно охлаждаться до комнатной температуры(обычно в течение ночи). Осадок отфильтровывали и промывали холодным 95% этанолом (800 мл). Твердое вещество (не совсем белое) растирали с горячим 95% этанолом (1500 мл) и отделяли после охлаждения (обычно после выдерживания при комнатной температуре в течение ночи) фильтрованием и промывали холодным этанолом. После двух растираний получали не совсем белое твердое вещество (340 г, примерно 98% ее). Соединение 2 а высвобождали из солевой формы нейтрализацией NaOH и экстракцией AcOEt. В колбу для встряхивающего аппарата Парра для гидрирования загружали соединение Nбензилизохинолинона с предыдущей стадии (120 г, 0,47 моль), 10% Pd/C (12 г, содержит 50% воды), дитрет-бутилдикарбонат (133 г, 0,61 моль) и этанол (1200 мл, 200). Реакционную смесь помещали в атмосферу водорода под давлением 60 фт/кв.дюйм. Давление водорода быстро падало в первые 2 ч, требовалась частая повторная загрузка. Реакционную смесь обычно оставляли реагировать без встряхивания на 8 ч и дольше. Дальнейшего расходования Н 2 не наблюдалось. Реакционную смесь фильтровали через слой целита, ополаскивали этанолом. Фильтрат концентрировали, получая продукт в виде густого масла, которое отверждалось при хранении, давая белое твердое вещество. Это вещество использовали на сле- 19009421 дующей стадии без дополнительной очистки. Стадия 4. Синтез индола по Фишеру. Раствор соединения N-Boc-изохинолинона с предшествующей стадии в пропаноле (200 мл) помещали в устойчивую к давлению колбу. Медленно добавляли концентрированную H2SO4 (13 мл). Сразу же происходило выделение газа, убывающее через 45 мин. Добавляли 4-трифторфенилгидразин (16,56 г,94,0 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре с последующим нагреванием при кипении с обратным холодильником в течение 3 ч до прекращения выделения газа. В этот момент по данным масс-спектрального анализа гидразон является основным компонентом реакционной смеси. Реакционный сосуд закрывали и нагревали при 90 С в течение 36 ч до завершения реакции в соответствии с контролем с помощью ТСХ (10:1:0,1, CH2Cl2/MeOH/NH4OH) и ES-масс-спектра в положительном режиме. По завершении реакции реакционную смесь выливали в перемешиваемый раствор 1 н. NaOH(образуется некоторое количество осадка). Смесь три раза экстрагировали дихлорметаном. Объединенные органические экстракты промывали водой, сушили над Na2SO4, фильтровали, и концентрировали,получая твердое вещество. Остаток растирали с CH2Cl2. Твердое вещество отфильтровывали. Продукт может быть очищен хроматографией на колонке с силикагелем с градиентным элюированием смесью-78 С добавляли метиловый эфир 4-тетрагидропиран-4-карбоновой кислоты (11,86 мл, 100 ммоль). После перемешивания в течение дополнительных 45 мин добавляли НМРА (10 мл) и йодистый аллил (11,9 мл, 130 ммоль). Реакционную смесь выдерживали в течение 20 мин при низкой температуре и оставляли нагреваться до комнатной температуры. Реакционную смесь выливали в воду и экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 20-30% EtOAc в гексане, получая прозрачное масло(16,6 г). Стадия 2. Вышеуказанный продукт алкилирования (15,26 г, 83 ммоль) перемешивали с NaIO4 (39,0 г, 182 ммоль) и OsO4 (70 мг) в iPrOH (400 мл) и Н 2 О (400 мл) в течение ночи. Реакционную смесь выливали в воду и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 40-70%EtOAc в гексане, получая продукт, метиловый эфир 4-(2-оксоэтил)тетрагидропиран-4-карбоновой кислоты, в виде масла (8,8 г). Стадия 3. Вышеуказанный альдегид (1,86 г, 10 ммоль) перемешивали с амином 4 (3,08 г, 10 ммоль) и NaBH(OAc)3 (8,48 г, 40 ммоль) в ClCH2CH2Cl (50 мл) в течение ночи. Реакционную смесь выливали в разбавленный водный раствор аммиака и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированиемEtOAc, смесью 10%MeOH/EtOAc, 10%MeOH/CH2Cl2, 20%MeOH/CH2Cl2 и 30%MeOH/CH2Cl2, получая 5 в виде твердого вещества (3,0 г). 1 Н ЯМР (ДМСО, 400 МГц)11,20 (с, 1 Н), 7,88 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,30 (д, J=8,5 Гц, 1 Н),3,73 (м, 3 Н), 3,68 (с, 3 Н), 3,33 (м, 2 Н), 3,22 (м, 1 Н), 2,88 (м, 1 Н), 2,75 (м, 1 Н), 2,60 (м, 1 Н), 2,42 (м, 1 Н),- 20009421 2,26 (м, 2 Н), 1,98 (м, 2 Н), 1,7-1,95 (м, 5 Н), 1,51 (м, 2 Н), 1,38 (д, J=6,5 Гц, 3 Н), 1,39 (м, 1 Н), 1,20 (м, 1 Н). Масс-спектр (ES): 479 [М+Н]. Пример 3. Образец соединения 5 (0,080 г, 0,17 ммоль) в ТГФ (2 мл) восстанавливали LiAlH4 (0,400 мл,1 М/ТГФ, 0,40 ммоль) в ТГФ (2 мл). По завершении восстановления реакционную смесь гасили 10% водным раствором Na2SO4. Осадок удаляли фильтрованием и органический фильтрат промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя. Очистка флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 5-30%MeOH/CH2Cl2, давала 6 в виде белого твердого вещества (0,065 г). 1 Н ЯМР (ДМСО, 400 МГц)11,22 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,29 (д, J=8,5 Гц, 1 Н),5,35 (с, 1 Н), 3,56 (м, 4 Н), 3,31 (м, 3 Н), 3,02 (м, 1 Н), 2,74 (м, 1 Н), 2,62 (м, 1 Н), 2,43 (м, 3 Н), 1,95 (м, 1 Н),1,86 (м, 1 Н), 1,75 (м, 1 Н), 1,60 (м, 2 Н), 1,25-1,5 (м, 10 Н). Масс-спектр (ES): 451 [М+Н]. Пример 4. Смесь сложных эфиров 5 (0,80 г, 1,7 ммоль) и LiOHH2O (0,80 г, 19 ммоль) в диоксане (10 мл) и воде (5 мл) нагревали при кипении с обратным холодильником в течение 7 ч. Реакционную смесь охлаждали. При подкислении НОАс (примерно до pH 5) образовывался белый осадок. Твердое вещество отфильтровывали, промывали водой, а затем простым эфиром, получая соединение 7 в виде белого твердого вещества (0,50 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,21 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,29 (д, J=8,5 Гц, 1 Н),3,71 (м, 2 Н), 3,31 (м, 2 Н), 2,97 (м, 1 Н), 2,75 (м, 1 Н), 2,62 (м, 1 Н), 2,44 (м, 4 Н), 1,6-2,05 (м, 8 Н), 1,2-1,5 (м,8 Н). Масс-спектр (ES): 465 [М+Н]. Пример 5. К смеси кислоты 7 (1,86 г, 4 ммоль) в CH2Cl2 (60 мл) с 4 каплями ДМФ добавляли оксалилхлорид(17 мл, 2 М в CH2Cl2, 34 ммоль). После перемешивания при комнатной температуре в течение 1 ч, смесь концентрировали и подвергали действию высокого вакуума, получая твердое вещество. К этому твердому веществу добавляли насыщенный раствор NH4OH в CH2Cl2 (60 мл). Смесь перемешивали в течение ночи и непосредственно загружали в хроматографическую колонку с последующим градиентным элюированием смесью, содержащей 10-20%MeOH/CH2Cl2 с повышающимся процентным содержанием (010%) добавленного NH4OH, получая соединение 8 в виде белого твердого вещества (1,674 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,28 (с, 1 Н), 7,80 (с, 1 Н), 7,45 (д, J=8,5 Гц, 1 Н), 7,29 (д, J=8,5 Гц, 1 Н),7,00 (с, ушир., 2 Н), 3,67 (м, 2 Н), 3,38 (м, 5 Н), 2,6-3,0 (м, 3 Н), 2,43 (м, 1 Н), 2,20 (м, 1H), 1,99 (м, 3 Н), 1,61,9 (м, 4 Н), 1,35-1,5 (м, 7 Н). Масс-спектр (ES): 464 [М+Н]. Пример 6. К смеси кислоты 7 (0,120 г, 0,256 ммоль), ДМФ (2 капли) в CH2Cl2 (2 мл) добавляли (COCl)2 (1,2 мл,2 М/CH2Cl2, 2,4 ммоль). После прекращения выделения газа смесь подвергали действию высокого вакуума, получая твердое вещество. Это твердое вещество повторно суспендировали в CH2Cl2 (2 мл), добавляли к нему (S) (+) 2-амино-1-пропанол (0,100 мл, 1,7 ммоль) и NEt3 (0,140 мл, 1 ммоль). После перемеши- 21009421 вания в течение 1 ч при комнатной температуре смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэшхроматографией на силикагеле с градиентным элюированием смесью 10-20% MeOH/CH2Cl2 с добавлением 0-10% NH4OH, получая соединение 9 в виде белого твердого вещества (0,098 г). 1 Н ЯМР (ДМСО, 400 МГц) : 11,22 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,29 (м, 2 Н), 4,70 (с,1 Н), 3,92 (м, 1 Н), 3,66 (м, 2 Н), 3,34 (м, 6 Н), 2,90 (м, 1 Н), 2,75 (м, 1 Н), 2,60 (м, 1 Н), 2,40 (м, 1 Н), 2,25 (м,2 Н), 2,20 (м, 3 Н), 1,84 (м, 1 Н), 1,72 (м, 3 Н), 1,41 (м, 7 Н), 1,07 (д, J=6,6 Гц, 3 Н). Масс-спектр (ES): 522 К смеси кислоты 7 (0,075 г, 0,16 ммоль), ДМФ (2 капли) в CH2Cl2 (2 мл) добавляли (COCl)2 (0,8 мл,2 М/CH2Cl2, 1,6 ммоль). После прекращения выделения газа смесь подвергали действию высокого вакуума, получая твердое вещество. К этому твердому веществу добавляли CH2Cl2 (2 мл), (S) (+) 2(аминометил)пирролидин (0,20 мл, 1,87 ммоль) и NEt3 (0,170 мл, 1,2 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре, выливали в насыщенный раствор NaHCO3 и экстрагировалиEtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводнымNa2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью 20-40% MeOH/CH2Cl2 в 0-10% NH4OH, получая соединение 10 в виде желтоватого твердого вещества (0,053 г). 1 Н ЯМР (ДМСО, 400 МГц) : 11,21 (с, 1 Н), 7,78 (с, 1 Н), 7,58 (м, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 3,67 (м, 2 Н), 3,1-3,5 (м, 8 Н), 2,75-2,9 (м, 4 Н), 2,6 (м, 1 Н), 2, 38 (м, 1 Н), 2,22 (м, 2 Н), 2,01 (м,2 Н), 1,6-1,9 (м, 8 Н), 1,4 (м, 7 Н), 1,47 (м, 1 Н). Масс-спектр (ES): 547 [М+Н]. Пример 8. Смесь амида 8 (0,695 г, 1,50 ммоль) и POCl3 (0,42 мл, 4,5 ммоль) в безводном пиридине (14 мл) нагревали при 120 С в герметично закрытом сосуде в течение 2 ч. Смесь охлаждали до комнатной температуры, выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью 5-30%MeOH/CH2Cl2, получая соответствующий нитрил в виде желтоватого твердого вещества (0,400 г). Вышеуказанный нитрил нагревали с Bu3SnN3 (0,74 мл, 2,7 ммоль) в толуоле (3 мл) при 120 С в герметично закрытом сосуде в течение 2 дней. По окончании реакции реакционную смесь охлаждали до комнатной температуры, подкисляли 1 М HCl в диэтиловом эфире и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью 20-40%MeOH/CH2Cl2 с 0-10% NH4OH, получая соединение 11 в виде желтоватого твердого вещества (0,196 г). 1 Н ЯМР (ДМСО, 400 МГц) : 11,26 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,30 (д, J=8, 5 Гц, 1 Н),3,37 (м, 3 Н), 3,14 (м, 4 Н), 3,14 (м, 1 Н), 2,77 (м, 1 Н), 2,64 (м, 3 Н), 2,43 (м, 2 Н), 2,25 (м, 3 Н), 2,01 (м, 2 Н),1,91 (м, 1 Н), 1,76 (м, 2 Н), 1,55 (м, 1 Н), 1,35-1,5 (м, 4 Н). Масс-спектр (ES): 489 [М+Н]. Пример 9. Соединение 12 получали в соответствии с методикой, подробно описанной в примере 4, заменяя метиловый эфир 4-(2-оксоэтил)тетрагидропиран-4-карбоновой кислоты на метиловый эфир циклогек- 22009421 санкарбоновой кислоты. 1 Н ЯМР (d6-ДМСО) : 12,47 (ушир.с, 1 Н), 11,31 (с, 1 Н), 10,46 (ушир.с, 1 Н), 7,78 (с, 1 Н), 7,44 (д,J=8,5 Гц, 1 Н), 7,28 (дд, J=8,5, 1,4 Гц, 1 Н), 3,78 (д, J=11,6 Гц, 1 Н), 3,56 (д, J=11,6 Гц, 1 Н), 3,10 (тд, J=12,2,5,0 Гц, 1 Н), 2,94 (м, 2 Н) , 2,81 (д, J=14,4 Гц, 2 Н), 2,65 (т, J=5,7 Гц, 1 Н), 2,40 (дд, J=15, 7,9, 8 Гц, 1 Н), 2,051,90 (м, 5 Н), 1,80-1,65 (м, 3 Н), 1,54-1,39 (м, 3 Н), 1,39 (д, J=6,6 Гц, 3 Н), 1,38-1,22 (м, 5 Н). Масс-спектр Соединение 13 синтезировали в 5 стадий в соответствии со следующей схемой. Стадия 1. Смесь метилового эфира 4-аллилтетрагидропиранкарбоновой кислоты (15,7 г, 92,4 ммоль) и LiOHH2O (29 г, 688 ммоль) в смеси ТГФ (110 мл), MeOH (110 мл) и воды (5 мл) нагревали при 85 С в запаянной ампуле в течение ночи. После охлаждения до комнатной температуры смесь экстрагировали EtOAc, промывали водой, сушили над безводным Na2SO4 и концентрировали с использованием роторного испарителя, получая соответствующую карбоновую кислоту в виде белого твердого вещества(12,82 г). Стадия 2. К смеси вышеуказанной кислоты (12,82 г, 75,4 ммоль), ДМФ (4 капли) в CH2Cl2 (300 мл) добавляли (COCl)2 (75,4 мл, 2M в CH2Cl2, 150,8 ммоль). После прекращения выделения газа смесь помещали на роторный испаритель. Полученный хлорангидрид кислоты (в 150 мл сухого ацетона) добавляли к NaN3 (48,75 г, 0,75 моль, в 300 мл воды) при 0 С в течение 30 мин. После перемешивания в течение 2 ч при комнатной температуре смесь выливали в ледяную воду и экстрагировали эфиром. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали с использованием роторного испарителя. Полученный азид растворяли в 100 мл бензола и медленно прибавляли к 100 мл кипящего бензола. Кипячение продолжали дополнительно в течение 40 мин, за это время выделение газа более не происходило. Бензол отгоняли и добавляли к смеси 120 мл MeOH. Смесь нагревали при кипении с обратным холодильником в течение 36 ч, охлаждали до комнатной температуры и непосредственно хроматографировали с использованием смеси 40% EtOAc/гексаны в качестве элюента. Карбаматный продукт получали в виде белого твердого вещества (14,15 г). Стадия 3. Полученный карбамат (0,498 г, 2,5 ммоль) перемешивали с NaIO4 (1,18 г, 5,5 ммоль) иOsO4 (30 мг) в МеОН (5 мл) и Н 2 О (5 мл) в течение 15 мин. Смесь непосредственно загружали на колонку для хроматографии, элюируя градиентно смесью 70-90% EtOAc/гексаны в качестве элюента и получая продукт альдегида в виде масла (0,48 г). Стадия 4. Вышеуказанный альдегид (0,38 г, 1,9 ммоль) перемешивали с амином 4 (0,587 г, 1,9 ммоль) и NaBH(OAc)3 (1,61 г, 7,6 ммоль) в ClCH2CH2Cl (15 мл) в течение ночи. Реакционную смесь выливали в разбавленный водный раствор аммиака и экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюирова- 23009421 нием смесью 20-40%MeOH/CH2Cl2 с добавлением 0-10%NH4OH, получая продукт конденсации в виде твердого вещества (0,618 г). Стадия 5. Смесь полученного продукта (0,618 г, 1,25 ммоль) и LiOHH2O (3,0 г, 71,5 ммоль) в смеси диоксана (20 мл) и воды (10 мл) нагревали при 120 С в запаянной ампуле в течение 8 ч. После охлаждения до комнатной температуры смесь выливали в насыщенный раствор NaHCO3 и экстрагировалиEtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводнымNa2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью 20-40% MeOH/CH2Cl2 с добавлением 0-10% NH4OH,получая соединение 13 в виде желтоватого твердого вещества (0,268 г). Масс-спектр(ES) : 436 [М+Н]. Пример 11. К смеси амина 13 (0,096 г, 0,22 ммоль) и NEt3 (0,084 мл, 0,6 ммоль) в CH2Cl2 (1,5 мл) добавляли ангидрид трифторметансульфоновой кислоты (0,067 мл, 0,40 ммоль) при 0 С. Через 20 мин смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью 5-20% MeOH/CH2Cl2, получая соединение 14 в виде желтоватого твердого вещества (0,077 г). 1 Н ЯМР (ДМСО, 400 МГц) : 11,27 (с, 1 Н), 7,81 (с, 1 Н), 7,46 (д, J=8,5 Гц, 1 Н), 7,30 (д, J=8,5 Гц, 1 Н),3,5-4,1 (м, 10 Н), 2,95 (м, 2 Н), 2,83 (м, 1 Н), 2,80 (м, 1 Н), 2,69 (м, 1 Н), 2,35 (м, 2 Н), 2,00 (м, 5 Н), 1,73 (м,3 Н), 1,40 (д, J=6,5 Гц, 3 Н). Масс-спектр (ES): 568 [М+Н]. Пример 12. К смеси кислоты 7 (0,070 г, 0,15 ммоль), ДМФ (2 капли) и ДХМ (2 мл) добавляли (COCl)2 (0,6 мл,2 М в ДХМ, 1,2 ммоль). После прекращения выделения газа растворители упаривали, получая твердое вещество. К данному твердому веществу добавляли ДХМ (2 мл), морфолин (0,2 мл, 2,3 ммоль) и TEA(0,15 мл, 1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле, элюируя смесью 20% МеОН/ДХМ и получая 15 в виде желтоватого твердого вещества (0,080 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,20 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,28 (д, J=8,5 Гц, 1 Н),3,69 (м, 2 Н), 3,58 (м, 8 Н), 3,44 (м, 2 Н), 3,32 (м, 2 Н), 3,24 (м, 1 Н), 2,90 (м, 1 Н), 2,74 (м, 1 Н), 2,42 (м, 1 Н),2,23 (м, 2 Н), 2,08 (м, 2 Н), 1,86 (м, 4 Н), 1,68 (м, 1 Н), 1,52 (м, 2 Н), 1,29 (м, 2 Н), 1,27 (д, J=8,5 Гц, 3 Н). Массспектр (ES): 534 [М+Н]. Пример 13.(0,381 г, 1,98 ммоль), HOBt (0,267 г, 1,98 ммоль), NMP (N-метилпирролидон) (0,44 мл, 4 ммоль), ДХМ (5 мл) и ДМФ (5 мл) перемешивали при комнатной температуре в течение 3 ч. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 10-20% МеОН/ДХМ с добавлением 1-3% NH4OH, получая 16 в виде белого твердого вещества (0,310 г). Масс-спектр (ES): 577 [М+Н].(0,127 г, 0,66 ммоль), HOBt (0,089 г, 0,66 ммоль), NMP (0,22 мл, 2 ммоль), ДХМ (1,5 мл) и ДМФ (1,5 мл) перемешивали при комнатной температуре в течение 8 ч. Смесь выливали в насыщенный растворNaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 10-25% МеОН/ДХМ с добавлением 1-3% NH4OH, получая 17 в виде белого твердого вещества (0,095 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,19 (с, 1 Н), 7,78 (с, 1 Н), 7,60 (т, J=5,5 Гц, 1 Н) , 7,43 (д, J=8,5 Гц, 1 Н),7,28 (д, J=8,5 Гц, 1 Н), 3,66 (м, 2 Н), 3,30 (м, 1 Н), 3,21 (м, 1 Н), 3,02 (м, 1 Н), 2,60-3,0 (м, 3 Н), 2,73 (м, 1 Н),2,60 (м, 1 Н), 2,47 (м, 1 Н), 2,40 (м, 1 Н), 2,20 (м, 3 Н), 2,10 (м, 1 Н), 2,00 (м, 2 Н), 1,79-1,95 (м, 4 Н), 1,5-1,7 (м,6 Н), 1,40 (м, 5 Н), 1,37 (д, J=6,5 Гц, 3 Н), 1,06 (м, 1 Н), 1,04 (т, J=7,5 Гц, 3 Н). Масс-спектр (ES): 575 [М+Н]. Пример 15. К смеси кислоты 7 (0,325 г, 0,7 ммоль), ДМФ (2 капли) и ДХМ (8 мл) добавляли (COCl)2 (3,6 мл, 2 М в ДХМ, 7,2 ммоль). После прекращения выделения газа смесь подвергали действию высокого вакуума,получая твердое вещество. К этому твердому веществу добавляли ДХМ (8 мл), MeONH2HCl (0,800 г, 9,6 ммоль) и TEA (0,60 мл, 4,3 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ, смешанного с 0-10% NH4OH, получая 18 в виде не совсем белого твердого вещества (0,24 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,20 (с, 1 Н), 11,15 (с, 1 Н), 7,79 (с, 1 Н), 7,43 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 3,68 (м, 2 Н), 3,63 (с, 3 Н), 3,35 (м, 2 Н), 3,23 (м, 1 Н), 2,89 (м, 1 Н), 2,75 (м, 1 Н), 2,60 (м, 1 Н),2,40 (м, 1 Н), 2,26 (м, 2 Н), 1,87-2,0 (м, 3 Н), 1,81 (м, 1 Н), 1,69 (м, 3 Н), 1,43 (м, 4 Н), 1,38 (д, J=6,5 Гц, 3 Н),1,19 (м, 1 Н). Масс-спектр (ES): 494 [М+H]. Пример 16. К смеси кислоты 7 (0,060 г, 0,13 ммоль), ДМФ (1 капля) и ДХМ (2 мл) добавляли (COCl)2 (0,6 мл,2 М в ДХМ, 1,2 ммоль). После прекращения выделения газа смесь подвергали действию высокого вакуума, получая твердое вещество. К этому твердому веществу добавляли ДХМ (2 мл), NH2CH2CN (0,200 г,3,6 ммоль) и TEA (0,15 мл, 1,07 ммоль). После перемешивания при комнатной температуре в течение 1 ч,смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ, смешанной с 0-8% NH4OH, получая 19 в виде белого твердого вещества (0,028 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,20 (с, 1 Н), 8,50 (с, 1 Н), 7,78 (c, 1 Н), 7,43 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 4,15 (д, J=5,5 Гц, 2 Н), 3,69 (м, 2 Н), 3,33 (с, 3 Н), 3,23 (м, 1 Н), 2,88 (м, 1 Н), 2,75 (м, 1 Н), 2,60 Смесь кислоты 7 (0,102 г, 0,22 ммоль), 2-аминометил-2-пропанола (0,095 г, 0,88 ммоль, получен в соответствии с Rai, В.; Dekhordi, L.С; Khodr, H.; Jin, Y.; Liu, Z.; R. С. Hider (1998) J. Med. Chem. 41: 33473359), EDC-HCl (0,127 г, 0,66 ммоль), HOBt (0,089 г, 0,66 ммоль), NMP (0,11 мл, 1 ммоль), ДХМ (2 мл) и ДМФ (2 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным злюированием смесью, содержащей 2040% МеОН/ДХМ, смешанной с 0-10% NH4OH, получая 20 в виде белого твердого вещества (0,085 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,20 (с, 1 Н), 7,79 (с, 1 Н), 7,54 (м, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 4,51 (с, 1 Н), 3,68 (м, 2 Н), 3,38 (м, 2 Н), 3,26 (м, 1 Н), 3,13 (д, J=6,0 Гц, 1 Н), 2,90 (м, 1 Н), 2,75 Синтезировали в две стадии. К смеси кислоты 7 (1,00 г, 2,2 ммоль), ДМФ (3 капли) и ДХМ (20 мл) добавляли (COCl)2 (10 мл, 2M в ДХМ, 20 ммоль). После прекращения выделения газа смесь помещали на роторный испаритель с последующим откачиванием с использованием высоковакуумного насоса, получая соответствующий ацилхлорид в виде твердого вещества. Ацилхлорид (растворенный в 10 мл ДХМ и 5 мл ДМФ) добавляли в колбу, содержащую NH2CH2CH2NH2 (4,42 мл, 66 ммоль) в ДХМ (15 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэшхроматографией на силикагеле с градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ,смешанной с 0-10% NH4OH, получая соответствующий аминоэтиламид в виде желтоватого твердого вещества. Вышеуказанный амид (0,035 г, 0,07 ммоль) перемешивали с AcCl (0,01 мл, 0,14 ммоль) и TEA(0,035 мл, 0,25 ммоль) в ДХМ (1 мл) в течение 10 мин. Смесь непосредственно загружали на колонку с силикагелем с последующим градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ,смешанной с 0-7% NH4OH, получая 21 в виде желтоватого твердого вещества (0,022 г). Масс-спектр Синтезировали в две стадии: смесь промежуточного аминоэтиламида из примера 18 (0,67 г, 1,65 ммоль), трифторуксусного ангидрида (0,292 мл, 2,1 ммоль), TEA (0,42 мл, 3 ммоль) и ДХМ (10 мл) перемешивали при комнатной температуре в течение 10 мин. Смесь выливали в насыщенный растворNaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 10-20% МеОН/ДХМ, смешанной с 1-2% NH4OH, получая соответствующий трифторметилацетамид в виде желтоватого твердого вещества (0,510 г). Вышеуказанный амид (0,300 г, 0,5 ммоль) нагревали при кипении с обратным холодильником сLAH (0,050 г, 1,3 ммоль) в ТГФ (5 мл) в течение 1 ч. По данным ВЭЖХ-масс-спектроскопии за это время реакция завершалась наполовину. Добавляли вторую порцию LAH (0,050 г, 1,3 ммоль). После нагревания при кипении с обратным холодильником в течение еще одного часа дальнейшего протекания реакции не наблюдалось. Смесь выливали в разбавленный раствор гидроксида аммония и экстрагировалиEtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводнымNa2SO4, концентрировали с использованием роторного испарителя. Флэш-хроматография на силикагеле с градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ, смешанной с 1-10% NH4OH, не приводила к разделению. Окончательное разделение было осуществлено препаративной ВЭЖХ, давая 22 в виде белого твердого вещества (0,037 г). Масс-спектр (ES): 589 [М+Н]. Пример 20. Смесь амина 13 (0,090 г, 0,2 ммоль), тетрагидро-3-фуранкарбоновой кислоты (0,047 г, 0,4 ммоль),EDCHCl (0,115 г, 0,6 ммоль), HOBt (0,081 г, 0,6 ммоль), TEA (0,140 мл, 1 ммоль), ДХМ (1 мл) и ДМФ (1 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в насыщенный растворNaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 20-40% МеОН/ДХМ, смешанной с 0-10% NH4OH, получая 23 в виде желтоватого твердого вещества (0,069 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,20 (с, 1 Н), 7,78 (с, 1 Н), 7,47 (с, ушир., 1 Н), 7,43 (д, J=8,5 Гц, 1 Н),7,28 (д, J=8,5 Гц, 1 Н), 3,89 (т, J=7,8 Гц, 1 Н), 3,58-3,85 (м, 6 Н), 3,48 (м, 2 Н), 3,30 (м, 1H), 3,05 (м, 1 Н), 2,74 Смесь амина 13 (0,065 г, 0,15 ммоль), метансульфонилуксусной кислоты (0,061 г, 0,45 ммоль),EDCHCl (0,086 г, 0,45 ммоль), HOBt (0,061 г, 0,45 ммоль], NMP (0,165 мл, 1,5 ммоль), ДХМ (1,5 мл) и ДМФ (1,5 мл) перемешивали при комнатной температуре в течение 24 ч. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 1520% МеОН/ДХМ, смешанной с 1-2% NH4OH, получая 24 в виде белого твердого вещества (0,052 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,19 (с, 1 Н), 7,90 (с, 1 Н), 7,79 (с, 1 Н), 7,44 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 4,13 (с, 2 Н), 3,63 (м, 2 Н), 3,54 (м, 2 Н), 3,32 (м, 2 Н), 3,11 (с, 3 Н), 2,92 (м, 1 Н), 2,74 (м, 1 Н),2,60 (м, 1 Н), 2,40 (м, 3 Н), 2,08 (м, 2 Н), 1,92 (м, 2 Н), 1,83 (м, 1 Н), 1,69 (м, 1 Н), 1,54 (м, 2 Н), 1,40 (м, 2 Н),1,38 (д, J=6,5 Гц, 3 Н), 1,19 (м, 1 Н). Масс-спектр (ES): 556 [М+Н]. Пример 22. Смесь амина 13 (0,097 г, 0,224 ммоль), 4,4-диоксотетрагидротиопиранилкарбоновой кислоты (0,040 г; 0,224 ммоль, полученной, как описано далее), EDCHCl (0,107 г, 0,56 ммоль), HOBt (0,076 г, 0,56 ммоль), NMP (0,275 мл, 2,5 ммоль), ДХМ (1,5 мл) и ДМФ (1,5 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 20% МеОН/ДХМ, смешанной с 1-3% NH4OH, получая 25 в виде белого твердого вещества (0,074 г).(140 мл) нагревали при кипении с обратным холодильником в течение ночи. Надосадочную жидкость декантировали и к оставшемуся твердому веществу добавляли 120 мл 20% водного раствора H2SO4. Полученную смесь нагревали при кипении с обратным холодильником дополнительно в течение 3 ч, экстрагировали смесью iPrOH/CHCl3, сушили над безводным Na2SO4 и концентрировали с использованием роторного испарителя, получая целевую 4,4-диоксотетрагидротиопиранилкарбоновую кислоту. Пример 23. Синтезировали в две стадии. Смесь амина 13 (0,100 г, 0,23 ммоль), ClSO2CH2CO2Me (0,039 г, 0,3 ммоль), пиридина (0,49 мл, 0,6 ммоль) и ДХМ (2 мл) перемешивали при комнатной температуре в течение 20 мин. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали препаративной ВЭЖХ, получая соответствующий сульфонамид. Вышеуказанный сульфонамид (0,020 г, 0,038 ммоль) подвергали взаимодействию с LAH (0,20 мл,1 М в ТГФ, 0,2 ммоль) в ТГФ (1 мл) при комнатной температуре в течение 15 мин. Реакционную смесь выливали в разбавленный раствор гидроксида аммония и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя. Флэш-хроматография на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ, смешанной с 1-3% NH4OH, давала соединение 26 в виде белого твердого вещества (0,004 г). Масс-спектр (ES): 544 [М+Н]. Пример 24.(1984) Tetrahedron Lett. 25:2301), EDCHCl (0,264 г, 1,37 ммоль), HOBt (0,186 г, 1,37 ммоль), NMP (0,44 мл, 4 ммоль), ДХМ (3 мл) и ДМФ (3 мл) перемешивали при комнатной температуре в течение 24 ч. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20%МеОН/ДХМ, смешанной с 0-2% NH4OH, получая 27 в виде белого твердого вещества (0,098 г). 1 Стадия 1. Смесь амина 13 (0,654 г, 1,5 ммоль), OHCCH2CH2CH2CO2Et (0,260 г, 2 ммоль),NaBH(OAc)3 (1,27 г, 6 ммоль) и ClCH2CH2Cl (10 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в разбавленный раствор NH4OH и экстрагировали EtOAc. Органический слой- 28009421 отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с помощью роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ, смешанной с 1-4% NH4OH, получая соответствующий моноалкилированный амин (0,35 г). Полученный выше продукт (0,35 г, 0,63 ммоль) гидролизовали, обрабатывая LiOHH2O (0,50 г, 12 ммоль) в диоксане (4 мл) и Н 2 О (2 мл) при комнатной температуре в течение 3 ч. Смесь подкислялиHOAc до слабо кислой среды и концентрировали досуха. Вышеуказанную кислоту (0,1 ммоль, содержит неорганическую соль) нагревали с NaOAc (0,200 г) в Ас 2 О (2 мл) при 105 С в течение 20 мин. Реакционную смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэшхроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ,смешанной с 0-3% NH4OH, получая 28 в виде белого твердого вещества (0,040 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,19 (с, 1 Н), 7,78 (с, 1 Н), 7,43 (д, J=8,5 Гц, 1 Н), 7,28 (д, J=8,5 Гц, 1 Н),3,64 (м, 2 Н), 3,45 (м, 4 Н), 3,36 (м, 1 Н), 2,92 (м, 1 Н), 2,75 (м, 1 Н), 2,61 (м, 1 Н), 2,38 (м, 5 Н), 2,26 (т, J=8,0 Гц, 2 Н), 1,89 (м, 6 Н), 1,68 (м, 1 Н), 1,41 (м, 2 Н), 1,38 (д, J=6,5 Гц, 3 Н), 1,26 (м, 1 Н). Масс-спектр (ES): 504 Синтезировали в две стадии. Смесь амина 13 (0,664 г, 1,52 ммоль), 2,5-диметокси-3-тетрагидрофуранкарбоксальдегида (0,487 г, 3,0 ммоль) и НОАс (8 мл) нагревали при 70 С в течение 2 ч. Смесь охлаждали до комнатной температуры, подщелачивали насыщенным раствором NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэшхроматографией на силикагеле с градиентным элюированием смесью, содержащей 10-20% МеОН/ДХМ,смешанной с 0-2% NH4OH, получая соответствующее производное формилпиррола (0,70 г). Вышеуказанный альдегид превращали в нитрил с использованием следующей реакции. В ампулу,содержащую NH2OHHCl (0,083 г, 1,2 ммоль) и CH3CN (3 мл) при 0 С добавляли TEA (0,168 мл, 1,2 ммоль) и альдегид (0,470 г, 0,91 ммоль). Смесь перемешивали при 0 С в течение 30 мин и при комнатной температуре в течение 4 ч. В этот момент добавляли фталевый ангидрид (0,178 г, 1,2 ммоль) и смесь нагревали при 90 С в течение 1 ч, выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4,концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 10-20% МеОН/ДХМ, смешанной с 0-1% NH4OH,получая 29 в виде желтоватого твердого вещества (0,167 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,18 (с, 1 Н), 7,84 (с, 1 Н), 7,77 (с, 1 Н), 7,43 (д, J=8,5 Гц, 1 Н), 7,28 (д,J=8,5 Гц, 1 Н), 7,17 (м, 1 Н), 6,54 (м, 1 Н), 3,71 (м, 2 Н), 3,41 (м, 2 Н), 3,08 (м, 1 Н), 2,73 (м, 2 Н), 2,55 (м, 2 Н),2,38 (м, 1 Н), 2,25 (м, 2 Н), 1,85-2,1 (м, 6 Н), 1,77 (м, 2 Н), 1,54 (м, 1 Н), 1,36 (д, J=6,5 Гц, 3 Н), 1,23 (м, 2 Н). Масс-спектр (ES): 511[М+Н]. Пример 27. Синтезировали в три стадии. Смесь амина 13 (0,600 г, 1,38 ммоль), BocNHCH2CHO (0,220 г, 0,38 ммоль), NaBH(OAc)3 (1,17 г, 5,5 ммоль) и ClCH2CH2Cl (14 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в разбавленный раствор NH4OH и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ, смешанной с 1-4% NH4OH, получая соответствующий продукт восстановительного аминирования (0,311 г). Полученный выше продукт (0,311 г, 0,537 ммоль) перемешивали с HCl (1,5 мл, 4 М в диоксане, 6 ммоль) в 1,5 мл ДХМ в течение 30 мин. Смесь выливали в разбавленный раствор NH4OH и экстрагирова- 29009421 ли EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали с использованием роторного испарителя, получая продукт снятия защитной группировки, который непосредственно использовали на следующей стадии. Полученный продукт со снятой защитной Boc-группой (0,129 г, 0,27 ммоль) кипятили с обратным холодильником с карбонилдиимидазолом (0,087 г, 0,54 ммоль) в ДХМ (8 мл) в течение 1 ч. Реакционную смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли,промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ, смешанной с 1-2% NH4OH, получая 30 в виде белого твердого вещества (0,123 г). Масс-спектр (ES): 505 [М+Н]. Пример 28. Образец спиртового соединения из примера 3 превращали в соответствующий альдегид окислением комплексом SO3-Py и ДМСО. К раствору данного альдегида (0,100 г, 0,2 ммоль) в МеОН (1 мл) при 0 С добавляли глиоксаль (0,055 г, 0,95 ммоль, 50% в воде) с последующим добавлением NH3 (0,50 мл, 1 ммоль, 2 М в МеОН). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 15-20% МеОН/ДХМ с добавлением 1-4% NH4OH, получая 31 в виде желтоватого твердого вещества (0,027 г). 1 Н ЯМР (ДМСО, 500 МГц) : 11,60 (с, ушир., 1 Н), 11,20 (с, 1 Н), 7,77 (с, 1H), 7,43 (д, J=8,5 Гц, 1H),7,28 (д, J=8,5 Гц, 1H), 6,96 (с, ушир., 2 Н), 3,70 (м, 2 Н), 3,32 (м, 4 Н), 3,19 (м, 1 Н), 2, 88 (с, 1 Н), 2,72 (м, 1 Н),2,57 (м, 1 Н), 2,51 (м, 1 Н), 2,38 (м, 1 Н), 2,23 (м, 2 Н), 2,09 (м, 1 Н), 1,82 (м, 3 Н), 1,66 (м, 2 Н), 1,39 (м, 2 Н),1,65 (д, J=6,5 Гц, 3 Н), 1,19 (м, 1 Н). Масс-спектр (ES): 487 [М+Н]. Пример 29.Marmor, R.С; Hilbert, P. (1971) J. Organic Chem. 36: 1379) в ТГФ (6 мл), охлажденному до -78 С в атмосфере азота добавляли по каплям KOtBu (1,8 мл, 1,8 ммоль, 1,0 М в ТГФ). Полученную смесь перемешивали в течение 10 мин при низкой температуре. Альдегид (0,268 г, 0,6 ммоль, растворен в ТГФ, тот же,который использован для получения соединения 31) добавляли по каплям к вышеуказанной смеси. Смесь перемешивали 30 мин при -78 С и еще 30 мин при комнатной температуре. Реакционную смесь гасили водой и смесь выливали в насыщенный раствор NaHCO3 и экстрагировали EtOAc. Органический слой отделяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4, концентрировали с использованием роторного испарителя и очищали флэш-хроматографией на силикагеле с градиентным элюированием смесью, содержащей 5-20% МеОН/ДХМ, получая соответствующий алкин в виде белого твердого вещества (0,200 г). Полученный алкин (0,100 г, 0,22 ммоль) нагревали с TMSN3 (1 мл) в запаянной ампуле при 140 С в течение двух дней. Смесь целиком непосредственно загружали на колонку, элюируя смесью, содержащей 15-20% МеОН/ДХМ, смешанной с 1-5% NH4OH, и получая 32 в виде белого твердого вещества Диизопропиламид лития (1,1 мл, 2,0 М, 2,2 ммоль) добавляли при -78 С к раствору ТГФ (0,25 М раствор), содержащему N-аллил-N-трет-бутоксикарбонилметансульфонамид (0,518 г, 2,2 ммоль). После перемешивания в течение 50 мин при -78 С добавляли раствор промежуточного соединения альдегида из примера 28 в безводном ТГФ (0,470 г, 1,05 ммоль) и смесь перемешивали в течение ночи при температу- 30
МПК / Метки
МПК: A61K 31/435, A61P 25/24, A61P 3/00, C07D 471/04
Метки: соединения, конденсированные, гетероциклические
Код ссылки
<a href="https://eas.patents.su/30-9421-kondensirovannye-geterociklicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные гетероциклические соединения</a>
Предыдущий патент: Способ очистки газового потока, загрязненного co2 и одним или более углеводородами и/или оксидами азота, путем адсорбции на агрегированных цеолитных адсорбентах
Следующий патент: Пленкообразующий раствор для получения металлооксидных покрытий и способ получения покрытий на его основе
Случайный патент: Способ регулирования поглощения бурового раствора












