Ингибиторы протеаз
Номер патента: 20122
Опубликовано: 29.08.2014
Авторы: Самуэльссон Бертиль, Канберг Пиа, Грабовска Урсула, Нильссон Магнус, Оден Лурдес Сальвадор
Формула / Реферат
1. Соединение, имеющее формулу II
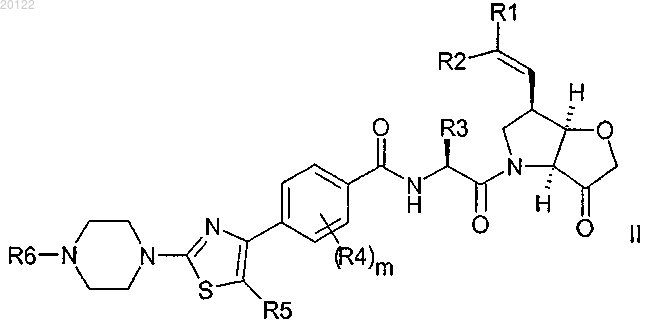
в которой
R1 образует этинильную связь и R2 представляет собой Н, с образованием ацетиленовой группы;
R3 представляет собой разветвленный С2-С6 алкил или С3-С6 циклоалкил;
R4 представляет собой метил или фтор; m равно 0, 1 или 2;
R5 представляет собой Н или фтор;
R6 представляет собой C1-C6 алкил;
или его фармацевтически приемлемая соль, N-оксид, содержащий атом кислорода при азоте пиперазинового фрагмента, или гидрат.
2. Соединение по п.1, в котором R3 представляет собой боковую цепь лейцина.
3. Соединение по любому из пп.1 или 2, в котором m равно 0 и R5 представляет собой F.
4. Соединение по любому из пп.1 или 2, в котором m равно 1, R4 представляет собой F и R5 представляет собой Н.
5. Соединение по п.4, в котором R4 расположен, как представлено в частичной структуре
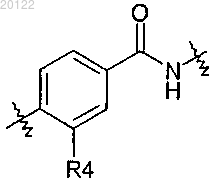
6. Соединение по любому из пп.1-5, в котором R6 представляет собой СН3.
7. Соединение по п.1, которое выбирают из
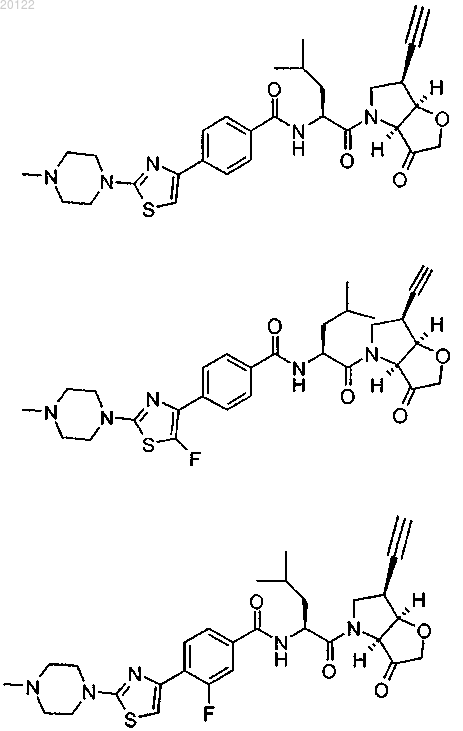
или его фармацевтически приемлемая соль, гидрат или N-оксид, содержащий атом кислорода при азоте пиперазинового фрагмента.
8. Соединение по п.7, имеющее формулу
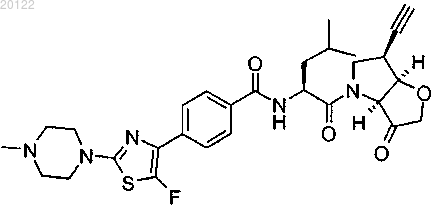
или его фармацевтически приемлемая соль, гидрат или N-оксид, содержащий атом кислорода при азоте пиперазинового фрагмента.
9. Применение соединения по любому из пп.1-8 для получения лекарственного средства для лечения или предотвращения заболевания, выбранного из остеопороза, заболевания десен (такого как гингивит и периодонтит), болезни Паджета, гиперкальцемии злокачественного образования, нарушения метаболизма костной ткани, заболеваний, характеризующихся избыточным разрушением хряща или скелета (таких как остеоартрит и ревматоидный артрит), рака костей, включая неоплазию, боли (особенно хронической боли).
10. Применение соединения по любому из пп.1-8 для лечения или предотвращении заболевания, выбранного из остеопороза, заболевания десен (такого как гингивит и периодонтит), болезни Паджета, гиперкальцемии злокачественного образования, нарушения метаболизма костной ткани, заболеваний, характеризующихся избыточным разрушением хряща или скелета (таких как остеоартрит и ревматоидный артрит), рака костей, включая неоплазию, боли (особенно хронической боли).
11. Способ лечения заболевания, опосредованного катепсином K, включающий введение безопасного и эффективного количества соединения по любому из пп.1-5 нуждающемуся в лечении субъекту.
12. Способ по п.11, в котором заболевание выбирают из остеопороза, заболевания десен (такого как гингивит и периодонтит), болезни Паджета, гиперкальцемии злокачественного образования, нарушения метаболизма костной ткани, заболеваний, характеризующихся избыточным разрушением хряща или скелета (таких как остеоартрит и ревматоидный артрит), рака костей, включая неоплазию, боли (особенно хронической боли).
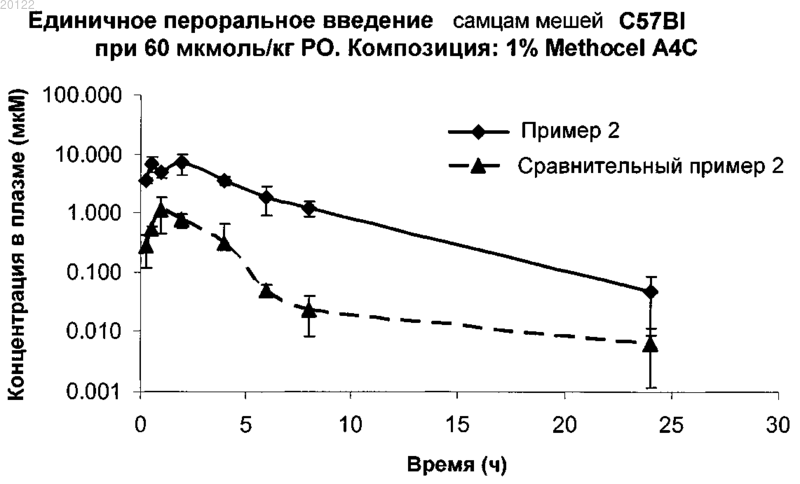
Текст
Соединения формулы II, в которых R1 образует этинильную связь и R2 представляет собой Н, с образованием ацетиленовой группы; R3 представляют собой разветвленный С 2-С 6 алкил или С 3-С 6 циклоалкил; R4 представляют собой метил или фтор; m равно 0, 1 или 2; R5 представляет собой Н или фтор; R6 представляют собой C1-С 6 алкил или их фармацевтически приемлемая соль, Nоксид, содержащий атом кислорода при азоте пиперазинового фрагмента, или гидрат, пригодные для лечения заболеваний, характеризующихся нарушением экспрессии или активности катепсинаK, таких как остеопороз, остеоартрит, ревматоидный артрит или метастазы в костях. Область техники Изобретение относится к ингибиторам цистеиновых протеаз, особенно цистеиновых протеаз папаинового суперсемейства. Настоящее изобретение относится к новым соединениям, пригодным для профилактики или лечения заболеваний, связанных с дисбалансом физиологических протеаз, таких как катепсин К. Уровень техники Папаиновое суперсемейство цистеиновых протеаз является широко распространенным у различных биологических видов, включая млекопитающих, беспозвоночных, простейших, растения и бактерии. Ряд катепсиновых ферментов млекопитающих, включая катепсины В, F, Н, K, L, О и S, относят к данному суперсемейству, и нарушенное регулирование их активности связано с рядом метаболических заболеваний, включая артрит, мышечную дистрофию, воспаление, гломерулонефрит и опухолевую инвазию. Патогенные ферменты, подобные катепсину, включают бактериальные гингипаины, малярийные фалципаины I, II, III и так далее, и цистеиновые протеазы из Pneumocystis carinii, Trypanosoma cruzei и brucei,Crithidia fusiculata, Schistosoma spp. Нарушенное регулирование катепсина K связано с рядом заболеваний, включая остеопороз, заболевания десен, такие как гингивит и периодонтит, болезнь Паджета, гиперкальцемию злокачественного образования и нарушение метаболизма костной ткани. Ввиду его повышенной концентрации в хлоропластах остеоартрических синовиальных мембран, катепсин K связан с заболеваниями, характеризующимися повышенным разрушением хрящей или скелета, такими как остеоартрит и ревматоидный артрит. Лечение заболеваний костей или скелета, таких как остеоартрит и остеопороз, наверняка будет требовать продолжительного введения ингибитора катепсина K, что часто имеет место у пациентов в преклонном возрасте или близких к преклонному возрасту. Это устанавливает необычайно высокие требования к простоте введения лекарственных средств, предназначенных для лечения данных заболеваний. Например, осуществляются попытки растянуть режимы дозировки современных лекарственных средств бисфосфонатного класса для лечения остеопороза до еженедельного или более длительного режимов введения для того, чтобы способствовать соблюдению режима терапии. Однако даже с улучшенным дозированием, сохраняются другие побочные эффекты бисфосфонатов. Бисфосфонаты блокируют ремоделирование кости, а не ослабляют его, как это делает ингибитор катепсина K. Для здоровых костей важно сохранять процесс ремоделирования, который бисфосфонаты блокируют полностью. Кроме того, бисфосфонаты обладают очень длительным временем полуразложения в кости, так что если возникают такие эффекты, как остеонекроз челюсти, невозможно удалить бисфосфонат из кости. В противоположность этому, ингибиторы катепсина К обладают обычно быстрым действием и независимым от скорости способом действия, что означает, что если проблема будет обнаружена, дозирование можно остановить и не будет накопления ингибитора в костном матриксе. Таким образом, существует потребность в альтернативных лекарственных средствах для лечения остеопороза и остеоартрита с превосходными фармакокинетическими и/или фармакодинамическими свойствами. Международная заявка на патентWO 2008/007107 описывает соединения формулы в которой Rd представляет собой замещенное моноциклическое кольцо, Rc представляет собой разветвленный алкил или циклоалкил, и Ra и Rb представляют собой ряд групп, включая Н, метил, этил,эфир, тиоэфир, амин, сульфонат и т.д. Только соединения, которые получают, содержат Н или метокси в данном положении. В данной области техники сохраняется необходимость в эффективных ингибиторах катепсина K. Особенно полезными являются ингибиторы катепсина K, которые обладают селективностью к катепсинуK по сравнению с другими катепсинами (например, селективностью к катепсину K по сравнению с катепсином S и/или катепсином L). Можно ожидать, что эффективные ингибиторы катепсина K, которые демонстрируют свойства, такие как высокая проходимость и/или улучшенные метаболические профили,будут иметь большую ценность в клинических ситуациях. Показания, относящиеся к катепсину K, такие как остеопороз или артрит, допускают длительные периоды введения и, следовательно, желательно, чтобы соединения обладали минимальной токсичностью или генотоксичностью. Сущность изобретения Согласно настоящему изобретению предлагаются соединения формулы IIR1 образует этинильную связь и R2 представляет собой Н, с образованием ацетиленовой группы;R3 представляют собой разветвленный С 2-С 6 алкил или С 3-С 6 циклоалкил;R4 представляют собой метил или фтор;R6 представляют собой C1-C6 алкил; или его фармацевтически приемлемая соль, N-оксид,содержащий атом кислорода при азоте пиперазинового фрагмента, или гидрат. Ясно, что соединения настоящего изобретение могут существовать в виде гидратов, таких как гидраты частичных формул: и настоящее изобретение включает все данные альтернативные формы. В других вариантах осуществления настоящего изобретения R1, вместе с олефином, показанным в формуле II, определяет этинильную связь, например, с образованием ацетиленовой группы, когда R2 представляет собой Н. Подходящий R3 представляет собой разветвленный С 2-С 6 алкил или С 3-С 6 циклоалкил. Характерные значения для циклоалкила для R3 включают циклопропил, циклобутил и особенно циклопентил или циклогексил. В одном варианте осуществления настоящего изобретения R3 представляет собой боковую цепь лейцина, показанную частичной структурой: В одном варианте осуществления настоящего изобретения m равно 2. Особенно интересными являются соединения, в которых m равно 1. Еще дополнительные варианты осуществления настоящего изобретения имеют m, равное 0.R4 соответственно представляет собой метил или фтор, особенно фтор. Если m равно 2, в настоящий момент предпочтительно, чтобы все R4 были одинаковыми. Когда m равно 1, R4 соответственно расположен, как представлено в частичной структуре: Примеры вариантов осуществления формулы II, в которой -C=CR1R2 группа представляет собой ацетилен, включаютN-[1-(6-этинил-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-2-метилбутил]-3-фтор-4-[2-(4 метилпиперазин-1-ил)тиазол-4-ил]бензамид и их фармацевтически приемлемые соли, N-оксиды и гидраты. Дополнительные примеры вариантов осуществления формулы II, в которых R1 и R2 представляют собой метил, включаютN-[1-(6-(диметилвинил)-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-2-метилбутил]-3-фтор-4[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамид и их фармацевтически приемлемые соли, N-оксиды и гидраты. Предполагается, что определение С 1-С 6 алкил R6 включает и разветвленные и неразветвленные алкильные группы, содержащие в сумме от одного до 6 атомов углерода. Примеры данных R6 групп представляют собой метил, этил, пропил (н-пропил и изопропил), бутил (н-бутил, изобутил, трет-бутил и втор-бутил). Одной особенно интересной R6 группой является метил. Второй особенно интересной R6 группой является пропил (особенно н-пропил). Дополнительные аспекты настоящего изобретения включают фармацевтическую композицию, содержащую соединение, как определено выше, и фармацевтически приемлемый носитель или разбавитель. Следующий аспект настоящего изобретения представляет собой применение соединения, как определено выше, для получения лекарственного средства для лечения заболеваний, опосредованных катепсином K, таких как остеопороз, заболевания десен (такие как гингивит и периодонтит), болезнь Паджета,гиперкальцемия злокачественного образования, нарушение метаболизма костной ткани, заболевания,характеризующиеся чрезмерным разрушением хряща или скелета (такие как остеоартрит и ревматоид-3 020122 ный артрит), рак костей, включая неоплазию, боль (особенно хроническую боль). Дополнительно настоящее изобретение относится к способу лечения или предотвращения заболевания, опосредованного катепсином K, включающему введение безопасного и эффективного количества соединения настоящего изобретения с целью лечения или предотвращения упомянутого заболевания,которое опосредовано катепсином K. Настоящее изобретение также относится к соединению настоящего изобретения для лечения или предотвращения заболевания, опосредованного катепсином K. Кроме того, в качестве одного аспекта настоящего изобретения предлагаются новые промежуточные соединения (как описано в настоящем изобретении), которые могут быть пригодны для получения соединений настоящего изобретения. В частности настоящее изобретение относится к соединению формулы: или его N-защищенному производному (например, Boc, CBz или Fmoc-защищенному). Настоящее изобретение также относится к соответствующему 1,3-диоксолан-защищенному аналогу и его Nзащищенным производным (например, Boc- CBz или Fmoc защищенным). В особенно предпочтительных вариантах осуществления данного структурного элемента C=C(R1)R2 группа представляет собой ацетилен. Следующее новое промежуточное соединение настоящего изобретения имеет формулу или соответствующий 1,3-диоксоланзащищенный аналог, в каждом случае, где N функцию необязательно защищают стандартной защитной группой, такой как Boc, CBz или Fmoc. Соединения настоящего изобретения могут образовывать соли, которые образуют дополнительный аспект настоящего изобретения. Подходящие фармацевтически приемлемые соли соединений формулыII включают соли органических кислот, особенно карбоновых кислот, включая, но не ограничиваясь ими,ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат,альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат,проприонат, тартрат, лактобионат, пиволат, камфорат, ундеканоат и сукцинат, органических сульфоновых кислот, таких как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2 нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и неорганических кислот, таких как хлороводородная, бромоводородная, йодоводородная кислоты, сульфаты, бисульфаты,гемисульфаты, тиоцианаты, персульфаты, соли фосфорной кислоты и сульфокислоты. Соединения настоящего изобретения можно в некоторых случаях выделить в виде гидрата. Гидраты обычно получают перекристаллизацией из смеси водный/органический растворитель, применяя органические растворители, такие как диоксан, тетрагидрофуран или метанол. Гидраты можно также получитьin situ введением соответствующего кетона пациенту.N-оксиды соединений настоящего изобретения можно получить способами, известными специалистам в данной области техники. Например, N-оксиды можно получить обработкой неокисленной формы соединения настоящего изобретения окисляющим агентом (например, трифторперуксусной кислотой,пермалеиновой кислотой, пербензойной кислотой, перуксусной кислотой, мета-хлорпероксибензойной кислотой или подобными) в подходящем инертном органическом растворителе (например, галогенированном углеводороде, таком как дихлорметан) при приблизительно 0 С. Альтернативно, N-оксиды соединений настоящего изобретения можно получить из N-оксида подходящего исходного соединения. Примеры N-оксидов настоящего изобретения включают N-оксиды частичных структур: Соединения настоящего изобретения в неокисленной форме можно получить из N-оксидов соответствующих соединений настоящего изобретения обработкой восстанавливающим агентом (например, серой, диоксидом серы, трифенилфосфином, боргидридом лития, боргидридом натрия, дихлоридом фосфора, трибромидом или подобным) в подходящем инертном органическом растворителе (например, ацетонитриле, этаноле, водном диоксане или подобном) при 0-80 С. Необходимо отметить, что положения радикалов в любой группе молекулы, применяемой в опре-4 020122 делениях, могут находиться где угодно в данной группе, при условии, что она является химически стабильной. Радикалы, применяемые в определениях переменных, включают все возможные изомеры, если не указано особо. Например, бутил включает трет-бутил, изобутил, н-бутил и т.д. Когда любая переменная встречается более одного раза в любой структурной составляющей, каждое определение является независимым. Если не упомянуто или показано, химическое название соединения включает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединение. Упомянутая смесь может содержать все диастереомеры и/или энантиомеры общей молекулярной структуры указанного соединения. Предполагается, что все стереохимически изомерные формы соединений настоящего изобретения или в чистой форме или смешанной друг с другом форме включены в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как упоминается в настоящем изобретении, определяют как изомеры, практически не содержащие других энантиомеров, или диастереомерные формы той же общей молекулярной структуры упомянутых соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, содержащим избыток стереоизомера, по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров), вплоть до избытка стереоизомера 100% (т.е. 100% одного изомера и отсутствие других), более предпочтительно к соединениям или промежуточным соединениям, содержащим избыток стереоизомера от 90% вплоть до 100%, даже более предпочтительно содержащим избыток стереоизомера от 94% вплоть до 100% и наиболее, содержащим избыток стереоизомера от 97% вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогично, но принимая во внимание избыток энантиомера и избыток диастереомера, соответственно, рассматриваемой смеси. Соединения настоящего изобретения можно получить в виде их отдельных стереоизомеров реакцией рацемической смеси соединения с оптически активным агентом для разделения, чтобы получить пару диастереомерных соединений, разделением диастереомеров и получением оптически чистого энантиомера. Когда разделение энантиомеров можно осуществлять, применяя ковалентные диастереомерные производные соединений формулы II, диссоциируемые комплексы являются предпочтительными (например, кристаллические структуры; диастереомерные соли). Диастереомеры обладают различными физическими свойствами (например, температурами плавления, температурами кипения, растворимостью,реакционной способностью и т.д.) и их можно легко разделить на основе этих различий. Диастереомеры можно разделить хроматографией, например ВЭЖХ, или, предпочтительно, методами отделения/разделения на основе различий в растворимости. Затем, оптически чистый энантиомер выделяют,вместе с агентом для разделения, любым практическим способом, который не приводил бы к рацемизации. Более подробное описание методик, применимых для разделения стереоизомеров соединений из их рацемической смеси, можно найти в Jean Jacques Andre Collet, Samuel H. Wilen, Enantiomers, Racematesand Resolutions, John WileySons, Inc. (1981). Соединения формулы II, как определено в настоящем изобретении, включают радиоизотопные или радиоактивномеченные соединения, в которых один или более атомов заменен изотопом данного атома,т.е. атомом, имеющим то же атомное число, но отличную атомную массу от атома (атомов), обычно встречающихся в природе. Примеры изотопов, которые можно вводить в соединения формулы I или любую подгруппу формулы I, включают, но не ограничиваются, изотопы водорода, такие как 2 Н и 3 Н (также обозначаемые D для дейтерия и Т для трития соответственно), углерода, такие как 11 С, 13 С и 14 С, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 31 Р и 32 Р, серы, такие как 35I, I, I и 131I. Выбор изотопа, включенного в изотопно-меченное соединение, будет зависеть от конкретного применения данного соединения. Например, для лекарственного средства или для анализов на распределение в тканях субстрата, соединение, в которое вводят радиоактивный изотоп, такой как 3 Н или 14 С, обычно будет наиболее приемлемым. Для применений с проявлением радиоактивности, например, позитронно-эмиссионной томографии (PET), будет пригодным позитронно-активный изотоп, такой как 11 С, 18F,13N или 15O. Введение более тяжелого изотопа, такого как дейтерий, т.е. 2 Н, может придавать большую метаболическую стабильность соединению формулы I или любой подгруппе формулы I, что приводит в результате к, например, повышенному времени полуразложения in vivo соединения или сниженным требуемым дозам. Для удобства синтеза обычно будет предпочтительно, чтобы соединения формулы II содержали изотопы, распространенные в природе. Изотопно-меченные соединения формулы I или любую подгруппу формулы II можно получить способами, аналогичными способам, описанным на схемах и/или в примерах в настоящем изобретении ниже, применяя подходящие изотопно-меченные реагенты или исходные соединения вместо соответствующих изотопно-немеченных реагентов или исходных соединений, или общепринятыми методиками,-5 020122 известными специалистам в данной области техники. Ясно, что настоящее изобретение распространяется на пролекарства, сольваты, комплексы и другие формы, приводящие к высвобождению соединения настоящего изобретения in vivo. Когда возможно вводить активный агент отдельно, предпочтительно, чтобы он присутствовал в качестве части в фармацевтической композиции. Данная композиция будет содержать определенный выше активный агент вместе с одним или более приемлемыми носителями/наполнителями и необязательно другими терапевтическими ингредиентами. Носитель (носители) должны быть приемлемыми с точки зрения совместимости с другими ингредиентами композиции и не должны быть вредными для пациента. Композиции включают композиции, пригодные для ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения, но предпочтительно композиция представляет собой композицию для перорального введения. Композиции можно удобно предоставить в виде стандартной лекарственной формы, например, таблеток и капсул с замедленным высвобождением, и их можно получить любым способом, хорошо известным в области фармацевтики. Данные способы включают стадию смешивания определенного выше активного ингредиента с носителем. Композиции обычно получают однородным и равномерным смешиванием активного ингредиента с жидкими носителями или мелко измельченными твердыми носителями или обоими, и затем, при необходимости формованием продукта. Настоящее изобретение включает способы получения фармацевтической композиции, включающие смешивание соединения формулы II или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем или средой. Если получение фармацевтической композиции включает тщательное смешивание фармацевтических наполнителей и активного ингредиента в солевой форме, затем, часто предпочтительно применять наполнители, которые является неосновными по свойствам, т.е. являются или кислыми или нейтральными. Композиции для перорального введения в настоящем изобретении можно предоставлять в виде дискретных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее определенное количество активного агента; в виде порошка или гранул; в виде раствора или суспензии активного агента в водной жидкости или неводной жидкости; или в виде жидкой эмульсии масло в воде или жидкой эмульсии вода в масле и в виде болюса и т.д. Относительно композиции для перорального введения (например, таблеток и капсул), термин подходящий носитель включает среды, такие как стандартные наполнители, например связующие агенты,например сироп, камедь, желатин, сорбит, трагакант, поливинилпирролидон (повидон), метилцеллюлоза,этилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например кукурузный крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, фосфат дикальция, хлорид натрия и альгиновую кислоту; и смазывающие вещества, такие как стеарат магния, стеарат натрия и стеараты других металлов, стеарат глицерина,стеариновая кислота, кремнийорганическая жидкость, тальк, воски, масла и коллоидная окись кремния. Можно также применять ароматизаторы, такие как мятное масло, масло винтергрена, вишневый ароматизатор или подобные. Может быть желательно добавлять красители для того, чтобы сделать лекарственную форму легко определяемой. Таблетки можно также покрывать способами, хорошо известными в данной области техники. Таблетку можно получить прессованием или формованием, необязательно с одним или более дополнительными ингредиентами. Прессованные таблетки можно получить прессованием в подходящем устройстве активного агента в свободно текучей форме, такой как порошок или гранулы, необязательно смешанной со связующим, смазывающим агентом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получить в подходящем устройстве смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки можно необязательно покрывать или на них можно наносить риски и их можно формулировать так, чтобы обеспечить медленное или контролируемое высвобождение активного агента. Другие композиции, пригодные для перорального введения, включают таблетки для рассасывания,содержащие активный агент в ароматизированной основе, обычно сахарозе и камеди или трагаканте; пастилки, содержащие активный агент в инертной основе, такой как желатин и глицерин, или сахарозе и камеди; и жидкости для полоскания рта, содержащие активный агент в подходящем жидком носителе. Подходящая доза для соединений или композиций настоящего изобретения будет зависеть от показания и состояния пациента и будет легко определяться опытами на лабораторных животных. Дозы,обеспечивающие внутриклеточные (для ингибирования физиологических протеаз папаинового суперсемейства) концентрации порядка 0,01-100 мкМ, более предпочтительно 0,01-10 мкМ, такие как 0,1-25 мкМ, являются обычно желательными и достижимыми. Соединения настоящего изобретения получают рядом химических реакций в растворе и на твердой фазе. Соединения обычно получают в виде структурных элементов, отражающих P1, P2 и Р 3 группи ингибитора, являющегося конечным продуктом. Не желая каким бы то ни было способом быть связанными теорией или не приписывая предполагаемые способы связывания для конкретных переменных, теорети-6 020122 ческие понятия Р 1, Р 2 и РЗ, как применяют в настоящем изобретении, предоставляют только для удобства, и они имеют в основном их общепринятые значения согласно SchlecterBerger и обозначают те части ингибитора, о которых предполагают, что они заполняют S1, S2, и S3 субсайты, соответственно, фермента, где S1 является соседним с сайтом расщепления и S3 является удаленным от сайта расщепления. Предполагается, что соединения, определенные формулой II, включены в объем настоящего изобретения, независимо от способа связывания. В общих чертах Р 1 структурный блок будет иметь формулу: в которой R1 и R2 представляют собой, как описано выше, две Rb группы определяют кеталь, такой как бисметилкеталь или вместе определяют циклический кеталь, такой как 1,3-диоксолан; и Rc представляет собой защитную группу гидроксила. Иногда Rc представляет собой Н или представляет собой кетофункцию ингибитора, являющегося конечным продуктом, в случаях, когда Р 1 структурный блок в виде кетона конденсируют с Р 2 и Р 3.WO 05/066180 описывает получение промежуточных соединений для вышеуказанных Р 1 структурных блоков, включая: Первая стадия в синтезе соединений настоящего изобретения обычно представляет собой получение в растворе функционализированного Р 1 структурного блока. Схема 1 иллюстрирует способ получения подходящего 6-альдегидного промежуточного соединения. Схема 1iv) Boc2O, 10% Na2CO3, v) Периодинан Десс-Мартина, DCM; vi) 1) CH3PPh3Br, KOtBu, THF; vii) 1) 9BBN-H, THF, 2) NaBO3, H2O, THF; viii) Периодинан Десс-Мартина, DCM. Исходный бициклический спирт (1 а) можно получить, как описано в WO 05/066180. Окисление гидроксифункции, например, периодинаном Десс-Мартина, с последующим превращением полученной кетофункции в диметилкеталь, осуществляемым обработкой триметилортоформиатом в присутствии кислоты, подобной п-толуолсульфокислоте, дает кеталь (1b). Удаление Cbz и бензильной защитных групп осуществляемое, например, гидрированием, применяя катализатор, подобный Pd(OH)2 или подобным, с последующей boc защитой полученной свободной аминогруппы, дает спирт (1 с). Окисление полученного свободного спирта, с использованием, например, периодинана Десс-Мартина, в растворителе,подобном дихлорметану, с последующей реакцией Виттига, применяя бромид метилтрифенилфосфония в присутствии KOtBu или подобного, дает олефин (Id). Гидроксилирование двойной связи, осуществляемое, например, обработкой 9-BBN-H, дает первичный спирт (1 е), который, затем, можно окислить до соответствующего альдегида (If), применяя подходящий способ окисления, такой как обработка периодинаном Десс-Мартина или подобным. Схема 2 иллюстрирует стандартный способ получения 6-ацетиленового Р 1 структурного блока, получающегося из 6-альдегидного промежуточного соединения схемы 1.i) CBr4, PPh3 CH2Cl2, 0C, ii) н-BuLi, THF, -78C С-6 ацетиленовый структурный блок lh получают,как показано на схеме 2. В сущности, ацетилен 1h легко получить из альдегидного предшественника 1f по двухстадийной методике Кори-Фукса через соответствующий 1,1-дибромолефин 1g. Альдегид 1f обрабатывают трифенилфосфинуглероддибромидом, например, полученным из Ph3PCH2Cl2 и CBr4, при 0 С для того, чтобы получить дибромалкен 1g. Последующая обработка дибромида в органическом растворителе, таком как THF, при пониженной температуре, обычно -78 С н-бутиллитием дает после выделения, ацетилен 1h, обычно с хорошим выходом. Ряд стандартных N-защитных групп можно применять вместо Boc группы, показанной в настоящем изобретении. Кроме того, диметилкеталь можно заменить рядом стандартных защитных групп кетона, включая циклические кетали или, в редких случаях, структурный блок можно получить с активной кетофункцией на месте, перед конденсацией. Соединения формулы II, в которых R1 и/или R2 определяют фторвинильный заместитель, получают добавлением фторметилгалогенида, такого как дибромдифторметан, к раствору трифенилфосфина в органическом растворителе, таком как DMF, например, при 0 С в инертной атмосфере. Раствор перемешивают в течение короткого промежутка времени (такого как 0,5 ч) и, затем, медленно добавляют альдегид 1f и цинковый порошок. Через 1 ч при комнатной температуре реакцию гасят добавлением водного NaHCO3 для того, чтобы получить защищенный Р 1 структурный блок 1h' (представленный выше N-Boc и диметилацеталем, но могут быть предусмотрены другие стандартные защитные группы). Соединения формулы II, в которых R1 и/или R2 определяют метилированный винильный заместитель, можно получить реакцией Виттига. Например, к суспензии активированного алкила, такого как йодид изопропилтрифенилфосфония в диэтиловом эфире, добавляют трет-бутоксид калия. Через приблизительно 2 ч добавляют к суспензии альдегида 1f, растворенный в растворителе, таком как диэтиловый эфир. После перемешивания (например, в течение 1 ч) реакцию можно гасить водным хлоридом аммония для того, чтобы получить винильный структурный блок 1h" (показан выше в виде диметилвинила). Хотя схема показана с N-Boc и диметилацетальными защитными группами, ясно, что могут быть предусмотрены другие стандартные защитные группы. Обычно для получения конечного соединения из подходящих Р 1 структурных блоков, таких как 1h,1h', 1h" или 1h"', удаляют N-защитную группу общепринятым способом, таким как обработка ацетилхлоридом в метаноле для удаления N-Boc защитной группы. С помощью полученного свободного амина вводят Р 2 остаток, например, с помощью ВосР 2-ОН, применяя стандартные реагенты для конденсации,такие как HATU, DIPEA, в DMF. Концевую Boc защиту снова удаляют ацетилхлоридом в метаноле, и Р 3 остаток вводят с помощью Р 3-ОН, применяя стандартные реагенты для конденсации, такие как HATU,DIPEA, в DMF. Наконец, диметилкетальную защиту удаляют TFA для того, чтобы получить конечное требуемое соединение. Наращивание цепи обычно проводят в присутствии подходящего конденсирующего реагента, например гексафторфосфата бензотриазол-1-илокситриспирролидинофосфония (РуВОР), гексафторфосфата O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU), гексафторфосфата О-(7-азабензотриазол-1 ил)-1,1,3,3-тетраметилурония (HATU), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида(DCC),необязательно в присутствии 1 гидроксибензотриазола (НОВТ), и основания, такого как N,N-диизопропилэтиламин, триэтиламин, Nметилморфолин и подобного. Реакцию обычно проводят при 20-30 С, предпочтительно при приблизительно 25 С, и она требует 2-24 ч для завершения. Подходящими растворителями для реакции являются инертные органические растворители, такие как галогенированные органические растворители (напри-8 020122 мер, хлористый метилен, хлороформ и подобные), ацетонитрил, N,N-диметилформамид, эфирные растворители, такие как тетрагидрофуран, диоксан и подобные. Альтернативно, вышеуказанную стадию конденсации для наращивания цепи можно осуществлять сначала превращением Р 3/Р 2 структурного блока в активное кислотное производное, такое как сукцинимидный эфир, и, затем, реакцией его с Р 1 амином. Реакция обычно требует 2-3 ч для завершения. Условия, применяемые в данной реакции, зависят от свойств активного кислотного производного. Например,если он представляет собой хлорангидридное производное, реакцию осуществляют в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, пиридина и подобного). Подходящие растворители для реакции представляют собой полярные органические растворители, такие как ацетонитрил, N,N-диметилформамид, дихлорметан или любые подходящие их смеси. Р 2 структурный блок обычно представляет собой N-защищенную аминокислоту, такую как Lлейцин, L-изолейцин, О-метил-L-треонин, L-3-гидроксивалин, 4-фторлейцин, L-циклопентилглицин илиL-циклогексилглицин, и Р 3 обычно содержит блокирующую группу, такую как производное бензойной кислоты, например, с N-алкилпиперазинил-Е группой, уже введенной или дающей синтон для этого в пара-положении. Подходящим образом защищенные отдельные структурные блоки можно вначале получить и впоследствии конденсировать вместе, предпочтительно в последовательности Р 2+Р 1 Р 2-Р 1, с последующим N-алкилпиперазинил-Е-бензойная кислота+Р 2-Р 1 N-алкилпиперазинил-Е-бензоат-Р 2-Р 1, гдеобозначает активированную форму, для того чтобы довести до минимума рацемизацию при Р 2. Конденсацию между двумя аминокислотами, аминокислотой и пептидом, или двумя пептидными фрагментами можно осуществлять, применяя стандартные способы конденсации, такие как азидный метод, метод смешанных ангидридов карбоновой и угольной кислоты (изобутилхлороформиат), карбодиимидный метод (дициклогексилкарбодиимид, диизопропилкарбодиимид или водорастворимый карбодиимид), метод активированных эфиров (п-нитрофениловый эфир, N-гидроксисукцинимидоэфир), метод с К-реагентом Вудворда, карбонилдиимидазольный метод, метод с применением фосфорных реагентов или метод окисления-восстановления. Некоторые из данных методов (особенно карбодиимидный метод) можно улучшить добавлением 1-гидроксибензотриазола или 4-DMAP. Данные реакции конденсации можно проводить в растворе (жидкая фаза) или на твердой фазе. Более подробно, стадия конденсации включает дегидратирующую конденсацию свободного карбоксила одного реагента со свободной аминогруппой другого реагента в присутствии конденсирующего реагента с образованием амидной связи. Описание данных реагентов для конденсации можно найти в общих руководствах по пептидной химии, например, М. Bodanszky, "Peptide Chemistry", 2nd rev ed.,Springer-Verlag, Berlin, Germany, (1993) далее называемой просто Bodanszky, содержание которой вводится в настоящее изобретение с помощью ссылки. Примерами подходящих реагентов для конденсации являются N,N'-дициклогексилкарбодиимид, 1-гидроксибензотриазол в присутствии N,N'-дициклогексилкарбодиимида или N-этил-N'-[(3-диметиламино)пропил]карбодиимида. Практичным и пригодным реагентом для конденсации является имеющийся в продаже гексафторфосфат (бензотриазол-1 илокси)трис-(диметиламино)фосфония, или отдельно или в присутствии 1-гидроксибензотриазола или 4DMAP. Другим практичным и пригодным реагентом для конденсации является имеющийся в продаже тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Еще одним практичным и пригодным реагентом для конденсации является имеющийся в продаже гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Реакцию конденсации проводят в инертном растворителе, например дихлорметане, ацетонитриле или диметилформамиде. Избыток третичного амина, например диизопропилэтиламина, N-метилморфолина, N-метилпирролидина или 4-DMAP добавляют для поддержания рН реакционной смеси приблизительно равной 8. Температура реакции обычно находится в диапазоне 0-50 С и продолжительность реакции обычно находится в диапазоне от 15 мин до 24 ч. Функциональные группы составляющих неприродных аминокислот обычно нужно защищать в процессе реакции конденсации для того, чтобы избежать образования нежелательных связей. Защитные группы, которые можно применять, перечислены в Greene, "Protective Groups in Organic Chemistry", JohnYork (1981), называемые далее просто Greene, описание которых вводится в настоящее изобретение с помощью ссылки. альфа-Карбоксильную группу С-концевого остатка обычно защищают в виде эфира, который можно расщепить для того, чтобы получить карбоновую кислоту. Защитные группы, которые можно применять, включают 1) алкиловые эфиры, такие как метиловый, триметилсилиловый и трет-бутиловый, 2) аралкиловые эфиры, такие как бензиловый и замещенный бензиловый, или 3) эфиры, которые расщепляются в мягких основных или мягких восстановительных условиях, такие как трихлорэтиловый и фенациловый эфиры. альфа-Аминогруппу каждой аминокислоты, которую нужно конденсировать, обычно N-защищают. Можно применять любую защитную группу, известную в данной области техники. Примеры данных групп включают: 1) ацильные группы, такие как формильная, трифторацетильная, фталильная и птолуолсульфонильная; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz илиZ) и замещенные бензилоксикарбонилы, и 9-флуоренилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как трет-бутилоксикарбонил (Boc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкильные карбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилильные, такие как триметилсилил; и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Предпочтительной защитной группой альфа-аминофункции является или Boc илиFmoc. Многие аминокислотные производные, защищенные подходящим образом для пептидного синтеза, имеются в продаже. Защитную группу альфа-аминофункции обычно отщепляют перед следующей стадией конденсации. Когда применяют Boc группу, предпочтительными способами являются трифторуксусная кислота,чистая или в дихлорметане, или HCl в диоксане или в этилацетате. Затем, полученную в результате аммониевую соль нейтрализуют или перед конденсацией или in situ основными растворами, такими как водные буферы, или третичными аминами в дихлорметане или в ацетонитриле или диметилформамиде. Когда применяют Fmoc группу, предпочтительными реагентами являются пиперидин или замещенный пиперидин в диметилформамиде, но можно применять любой вторичный амин. Деблокирование осуществляют при температуре от 0 С до комнатной температуры обычно 20-22 С. Когда получена последовательность ингибитора, любые оставшиеся защитные группы удаляют тем или иным способом, определяемым выбором защитных групп. Данные способы являются хорошо известными специалистам в данной области техники. Р 2 структурные блоки в виде N-защищенных L-аминокислот легко доступны и имеются в продаже,например L-лейцин, L-изолейцин, L-циклогексилглицин, О-метил-L-треонин, и другие являются имеющимися в продаже с рядом наборов защитных групп, таких как CBz, Boc или Fmoc. Другие варианты R3 легко получить из имеющихся в продаже исходных соединений. Например, соединения, в которых R3 представляет собой -С(СН 3)2 ОСН 3, можно получить реакцией CBz защищенной (S)-(+)-2-амино-3 гидрокси-3-метилбутановой кислоты с 3,3-диметоксигексагидрофуро (3, 2b) пирролом для того, чтобы получить требуемый Р 2-Р 1 блок. Теперь спиртовую группу боковой цепи Р 2 можно метилировать, применяя метилйодид в общепринятых условиях: гидрид натрия, имидазол, THF, для того, чтобы получить требуемый Р 2 без существенной рацемизации альфа центра. Теперь данную Р 2-Р 1 молекулу можно подвергать стадиям синтеза, как описано в настоящем изобретении, а именно удалению CBz и конденсации.WO 05/565299 описывает получение гамма-фторлейцинового Р 2 структурного блока. Альтернативный синтез Fmoc и N-Boc-гамма-фторлейцинового структурного блока показан в Truong et al Syn. Lett. 2005 no 8 1278-1280. Получение Р 3 структурных блоков описывают в WO 05/066180, WO 08/007114, или их легко получить аналогичными способами. Например, схема Е ниже показывает получение Р 3 структурного блока, в котором Е представляет собой фтор-замещенный тиазолил:i. HOAc, Br2, комнатная температура, 2 ч, 55% выход; ii. KF, 18-краун-6, CH3CN, 90C, 16 ч, 31% выход; iii. HOAc, Br2, 45C, 4 ч, 100% выход; iv. 4-метилпиперазин-1-карботиоамид, этанол, 70C, 2 ч,74% выход, v. LiOH, THF, H2O, комнатная температура, 16 ч, 79% выход. Схема Е. Синтез 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты. Исходное соединение, метил 4-ацетилбензоат, является имеющимся в продаже. Бромирование положения кетона проводят с помощью брома в уксусной кислоте для того, чтобы получить требуемый метиловый эфир 4-(2-бромацетил)бензойной кислоты. Последующая обработка метилового эфира 4-(2 бромацетил)бензойной кислоты фторидом калия в присутствии 18-краун-6 при 90 С дает метиловый эфир 4-(2-фторацетил)бензойной кислоты после колоночной хроматографии. Повторное бромирование в-положении кетона проводят с помощью брома в уксусной кислоте для того, чтобы получить требуемый метиловый эфир 4-(2-бром-2-фтор-ацетил)бензойной кислоты. Образование тиазола обычно осуществляют нагреванием метилового эфира 4-(2-бром-2-фторацетил)бензойной кислоты с 4-метилпиперазин-1-карботиоамидом при 70 С в течение 2 ч. После охлаждения требуемый метиловый эфир 4-[5 фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты осаждается. Деблокирование метилового эфира осуществляют, применяя раствор гидроксида лития и требуемую кислоту, 4-[5-фтор-2-(4 метилпиперазин-1-ил)тиазол-4-ил]бензойную кислоту обычно получают с хорошим выходом в виде ди- 10020122 гидрохлоридной соли после обработки хлороводородной кислотой. Термин "N-защитная группа" или "N-защищенная", как применяют в настоящем изобретении, относится к группам, предназначенным для того, чтобы защищать N-конец аминокислоты или пептида или для защиты аминогруппы от нежелательных реакций в процессе синтеза. Обычно применяемые Nзащитные группы описывают в Greene, "Protective Groups in Organic Synthesis" (John WileySons, NewYork, 1981), которая вводится в настоящее изобретение с помощью ссылки. N-защитные группы включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2 хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и подобные; сульфонильные группы,такие как бензолсульфонил, п-толуолсульфонил и подобные, группы, образующие карбаматы, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил,4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил,бензгидрилоксикарбонил, трет-бутоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и подобные; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и подобные; и силильные группы, такие как триметилсилил и подобные. Предпочтительные N-защитные группы включают формил, ацетил, бензоил, пивалоил, третбутилацетил, фенилсульфонил, бензил (bz), трет-бутоксикарбонил (ВОС) и бензилоксикарбонил (Cbz). Защитные группы гидрокси и/или карбоксифункций также широко рассмотрены там же в Greene и включают эфиры, такие как метиловый, замещенные метиловые эфиры, такие как метоксиметил, метилтиометил, бензилоксиметил, трет-бутоксиметил, 2-метоксиэтоксиметил и подобные, силильные эфиры,такие как триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), трибензилсилил, трифенилсилил,трет-бутилдифенилсилил триизопропилсилил и подобные, замещенные этиловые эфиры, такие как 1 этоксиметил, 1-метил-1-метоксиэтил, трет-бутил, аллил, бензил, п-метоксибензил, дифенилметил, трифенилметил и подобные, аралкильные группы, такие как тритил и пиксил (9-гидрокси-9-фенилксантеновые производные, особенно хлорид). Эфирные защитные группы гидроксифункции включают эфиры, такие как формиат, бензилформиат, хлорацетат, метоксиацетат, феноксиацетат, пивалоат, адамантоат, мезитоат, бензоат и подобные. Карбонатные защитные группы гидроксифункции включают метилвинил, аллил, циннамил, бензил и подобные. Подробное описание вариантов осуществления Различные варианты осуществления настоящего изобретения будут в настоящее время описаны посредством только иллюстрации со ссылкой на следующие примеры и фигуру 1, на которой показана концентрация в плазме относительно времени для самцов мышей C57BI, которым перорально вводили соединение настоящего изобретения или соединение предшествующего уровня техники. Справочный пример 1. Р 3 структурный блок. Стадия а) 4-Цианопропиофенон Как описано для получения 4-цианоацетофенона (Synth. Commun 1994, 887-890), смесь 4 бромпропиофенона (5,65 г, 26,4 ммоль), Zn(CN)2 (1,80 г, 15,3 ммоль) и Pd(PPh3)4 (2,95 г, 2,6 ммоль) кипятили с обратным холодильником при 80 С в DMF, не содержащем кислорода (35 мл, хранимый над 4 молекулярными ситами, барботированный Ar перед применением) в течение 18 ч. Смесь распределяли между толуолом (100 мл) и 2 н. NH4OH (100 мл). Органическую фазу экстрагировали 2 н. NH4OH (100 мл), промывали насыщенным водным NaCl (2100 мл), сушили и упаривали. Реакцию в 10 миллимолярном масштабе проводили аналогично и неочищенные продукты объединяли. Флеш-хроматография (330 г силикагеля, 6/1 петролейный эфир-EtOAc) давала белый твердый остаток (5,17 г, 89%). 1 Н ЯМР (CDCl3)м.д.: 1,22 (т, 3H, J=7,2 Гц), 3,00 (кв., 2 Н, J=7,3 Гц), 7,75 (д, 2 Н, J=8,8 Гц), 8,03 (д,2 Н, J=8,4 Гц) 13 С-ЯМР (CDCl3)м.д.: 7,8, 32,1, 116,1, 117,9, 128,3, 132,4, 139,7, 199,2. Стадия b) 4-Пропионилбензойная кислота 4-Цианопропиофенон (4,67 г, 29,3 ммоль) кипятили с обратным холодильником с 2 н. NaOH (90 мл,180 ммоль) и диоксаном (90 мл) при 95 С в течение ночи. Смесь разбавляли водой (150 мл), промывали эфиром (75 мл), подкисляли до рН 2 концентрированной HCl и экстрагировали эфиром (375 мл). Органическую фазу промывали насыщенным водным NaCl (375 мл), сушили, и упаривали для того, чтобы получить желтый твердый остаток (5,12 г, 98%). 1 Н ЯМР (CDCl3 + CD3OD)м.д.: 1,18 (т, 3H, J=7,2 Гц), 2,99, (кв., 2 Н, J=7,1 Гц), 7,95 (д, 2 Н, J=8,4 Гц), 8,08 (д, 2 Н, J=8,8 Гц). Полученную выше бензойную кислоту (890 мг, 5 ммоль), NaHCO3 (1,26 г, 15 ммоль) и йодметан(935 мкл, 15 ммоль) в DMF (10 мл) перемешивали при комнатной температуре в течение ночи. Смесь разбавляли насыщенным водным NaCl (50 мл) и экстрагировали эфиром (350 мл). Органическую фазу промывали водой (50 мл), сушили и упаривали. Флеш-хроматография (90 г силикагеля, 2/1 петролейный эфир-EtOAc) давала белый твердый остаток (744 мг, 77%). 1 Н ЯМР (CDCl3)м.д.: 1,24 (т, 3H, J=7 Гц), 3,03 (кв., 2 Н, J=7 Гц), 3,95 (с, 3H), 8,0 и 8,12 (АВкв.,4 Н). Стадия d) Метил 4-(2-бромпропионил)бензоат Метил 4-пропионилбензоат (744 мг, 3,87 ммоль), гидротрибромид пирролидона (1,98 г) и 2 пирролидинон (380 мг, 4,5 ммоль) в THF (38 мл) грели при 50 С в атмосфере азота в течение 3 ч. Смесь охлаждали, фильтровали, концентрировали и затем повторно растворяли в эфире (50 мл). Эфирный раствор промывали последовательно водой (20 мл), насыщенным водным Na2S2O5 (20 мл), насыщенным водным NaCl (20 мл) и водой (20 мл), сушили и упаривали для того, чтобы получить желтое масло (1,025 г), которое применяли непосредственно в конденсации Ганча. Данный материал содержал 91% требуемого бромкетона, 5% исходного кетона и 4% 4-бром-1-бутанола, как определено 1 Н ЯМР. 1 Н ЯМР (CDCl3)м.д.: 1,92 (д, 3H, J=7 Гц), 3,96 (с, 3H), 5,28 (кв., 1 Н, J=7 Гц), 8,07 и 8,14 (АВкв.,4 Н). Стадия е) метиловый эфир 4-[2-(4-трет-бутоксикарбонилпиперазин-1-ил)-5-метилтиазол-4-ил] бензойной кислоты Весь полученный выше -бромкетон и трет-бутиловый эфир 4-тионокарбонилпиперазин-1 карбоновой кислоты (J. Med. Chem., 1998, 5037-5054, 917 мг, 3,73 ммоль) кипятили с обратным холодильником в 36 мл THF при 70 С в течение 2 ч под N2. Осадок фильтровали и фильтрат упаривали для того, чтобы получить желтый твердый остаток. Колоночная флеш-хроматография (силикагель, 5/1 петролейный эфир-EtOAc) давала 624 мг светло-желтого твердого остатка. Хроматография осадка (силикагель, 2/1 петролейный эфир-EtOAc) давала еще 32 мг соединения. Суммарный выход был 44%. 1 Н ЯМР (CDCl3)м.д.: 1,46 (с, 9 Н), 2,43 (с, 3H), 3,42, (м, 4 Н), 3,54 (м, 4 Н), 3,90 (с, 3H), 7,68 и 8,04 Полученный выше метиловый эфир (564 мг, 1,35 ммоль) грели с 1,35 мл 2 н NaOH, 5 мл THF и 3,65 мл воды при 60 С в течение 4 ч. Реакционную смесь упаривали, выливали в 20 мл насыщенного водногоNaCl и 20 мл CH2Cl2 и, затем, подкисляли до рН 35% лимонной кислотой в ледяной бане. Слои разделяли и органическую фазу экстрагировали дополнительно 210 мл CH2Cl2. Органические фазы объединяли,промывали водой (10 мл), сушили и упаривали для того, чтобы получить светло-желтый твердый остаток(0,421 ммоль) растворяли в 4 М HCl в 1,4-диоксане и перемешивали при комнатной температуре в течение 1 ч. Затем, растворитель удаляли в вакууме и остаток 4-(5-метил-2-пиперазин-1-илтиазол-4 ил)бензойной кислоты суспендировали в метаноле (10 мл) и обрабатывали AcOH/AcONa буфером (рН 5,5,5 мл) и формальдегидом (0,547 ммоль). Реакционную смесь перемешивали при комнатной темпера- 12020122 туре в течение 1 ч, затем обрабатывали NaCNBH3 (0,547 ммоль) и перемешивали при комнатной температуре в течение ночи. Затем, растворитель удаляли в вакууме и остаток очищали колоночной хроматографией для того, чтобы получить заявленное в заголовке соединение (0,403 ммоль, 95%). Стадия а) Метил 4-бром-3-фторбензоат. 4-Бром-3-фторбензойную кислоту (2,46 г, 11,2 ммоль) растворяли в МеОН (9 мл) и толуоле (4 мл) и охлаждали в ледяной бане. (Триметилсилил) диазометан (11 мл, 2,0 М в гексане, 22 ммоль) добавляли по каплям до постоянного желтого цвета. Раствор перемешивали при комнатной температуре в течение 40 мин и, затем, концентрировали в вакууме. Вторую порцию карбоновой кислоты (2,43 г) обрабатывали аналогично. Неочищенный продукт из обеих порций объединяли и подвергали флеш-хроматографии(силикагель, 5/1 пентан-EtOAc) для того, чтобы получить метиловый эфир в виде белого твердого остатка (4,92 г, 95% выход). 1 Н ЯМР (400 МГц, CDCl3) дельта м.д. 7,77 (м, 1 Н), 7,71 (м, 1 Н), 7,64 (м, 1 Н), 3,93 (с, 3H). Стадия b) Метил 4-ацетокси-3-фторбензоат. Аллилхлорид (105 мкл, 1,28 ммоль) и TFA (20 мкл, 0,26 ммоль) добавляли к суспензии цинковой пыли (480 мг, 7,34 ммоль) и безводного бромида кобальда (II) (96,6 мг, 0,44 ммоль) в MeCN (4 мл) в атмосфере инертного газа. После перемешивания при комнатной температуре в течение 10 мин добавляли арилбромид (1,003 г, 4,30 ммоль растворяли в 5 мл MeCN) из (а), с последующим добавлением уксусного ангидрида (0,45 мл, 4,79 ммоль) и дополнительного MeCN (1 мл). Смесь перемешивали в течение ночи,гасили 1 М HCl (20 мл) и, затем, экстрагировали EtOAc (320 мл). Органическую фазу промывали последовательно насыщенным водным NaHCO3 (20 мл) и насыщенным NaCl (220 мл), сушили (Na2SO4) и концентрировали. Флеш-хроматография (силикагель, 6/1-4/1 петролейный эфир-EtOAc давала исходный бромид (161,1 мг, 16%) и требуемый кетон (белый твердый остаток, 305,5 мг, 36%). 1 Н ЯМР (CDCl3)м.д.: 1 Н (400 МГц) 7,94-7,86 (м, 2 Н), 7,80 (дд, 1 Н, J=11,2, 1,6 Гц), 3,95 (с, 3H),2,67 (д, 3H, J=4,4 Гц); 19F (376 МГц) -109,2 (м); 13 С (100 МГц) 195,4 (д, J=3,7 Гц), 165,1 (д, J=2,2 Гц), 161,6THF (10 мл) и 2-пирролидинон (91 мкл, 1,20 ммоль) добавляли к смеси кетона из b) (198 мг, 1,01 ммоль) и пирролидонгидротрибромида (532 мг, 1,07 ммоль). После нагревания при 60-65 С в течение 2 ч смесь концентрировали в вакууме и, затем, распределяли между EtOAc (20 мл) и насыщенным Na2S2O3(10 мл). Водную фазу экстрагировали EtOAc (10 мл). Органические фазы объединяли, промывали насыщенным NaCl (2 10 мл), сушили (Na2SO4) и концентрировали. Флеш-хроматография (силикагель, 7/1 петролейный эфир-EtOAc) давала белый твердый остаток (0,2634 г), содержащий 84% требуемого бромида (как определено интегрированием 19F ЯМР пиков). ЯМР (CDCl3)м.д.: 1H (400 МГц) 7,93 (м, 1 Н), 7,88 (м, 1 Н), 7,79 (дд, 1 Н, J=11,2, 1,6 Гц), 4,50 (д,2 Н, J=2,4 Гц), 3,94 (с, 3H) ; 19F (376 МГц) -108,4 (м). Стадия d) Метил 3-фтор-4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензоат.EtOH (5,0 мл) добавляли к полученному выше бромкетону (193 мг, 0,70 ммоль) и амиду 4 метилпиперазин-1-карботиокислоты (113 мг, 0,71 ммоль) и смесь грели при 70 С в течение 2 ч 15 мин. Осадок фильтровали, промывали холодным EtOH и сушили в вакууме и охарактеризовывали. Способ повторяли в большем масштабе для 1,75 г бромкетона (6,36 ммоль). 1 Н ЯМР (1/1 CDCl3-CD3OD)м.д.: 1 Н (400 МГц) 8,20 (м, 1 Н), 7,86 (дд, 1 Н, J=8,4, 1,6 Гц), 7,76 (дд,1 Н, J=11,4, 1,8 Гц), 7,38 (д, 1 Н, J=2,4 Гц), 4,23 (уш., 2 Н), 3,95, (с, 3H), 3,65 (уш., 4 Н), 3,32 (уш., 2 Н), 2,98 Осадок из обоих опытов объединяли и суспендировали в насыщенном NaHCO3 (50 мл). Смесь экстрагировали EtOAc. Органическую фазу промывали водой, сушили (Na2SO4) и упаривали для того, чтобы получить заявленное в заголовке соединение в виде твердого остатка кремового цвета (1,76 г). Стадия е) HCl соль 3-фтор-4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты. Метиловый эфир (1,76 г, 5,25 ммоль) из (d) грели при 80 С с 6 М HCl (40 мл) в течение 5,5 ч. Добавляли дополнительное количество 6 М HCl (10 мл) и смесь грели при 90 С в течение 1 ч 15 мин. Затем,после охлаждения, смесь упаривали в вакууме и лиофилизировали из воды для того, чтобы получить конечный продукт в виде твердого остатка кремового цвета с количественным выходом. ЯМР (DMSO-d6)м.д.: 1 Н (400 МГц) 11,60 (уш., 1 Н), 8,18 (т, 1 Н, J=8,0 Гц), 7,82 (дд, 1 Н, J=8,4, 1,6 Гц), 7,72 (дд, 1 Н, J=12,0, 1,6 Гц), 7,48 (д, 1 Н, J=2,8 Гц), 4,11 (м, 2 Н), 3,58 (м, 2 Н), 3,49 (м, 2 Н), 3,19 (м,2 Н), 2,80 (д, 3H, J=4,4 Гц); 19F (376 МГц)-113,5 (m); 13 С (100 МГц) 168,9, 166,0, 159,0 (д, J=250 Гц), 143,4,131,4 (д, J=8 Гц), 129,8, 125,8 (д, J=11 Гц), 125,6, 116,6 (д, J=24 Гц), 111,1 (J=15 Гц), 51,1, 45,0, 41,9.WO 05/066180) (7,4 г, 20 ммоль) в DCM (50 мл.) добавляли к перемешиваемому раствору окислителя при комнатной температуре в атмосфере азота в течение 45 мин. После дополнительных 90 мин перемешивания реакционной смеси считали, что реакция завершилась с помощью ТСХ. Добавляли водный 10%Na2S2O3 (200 мл) и смесь перемешивали при комнатной температуре в течение других 15 мин. Двухфазную систему переносили в делительную воронку и экстрагировали дважды EtOAc (200 мл и 100 мл сответственно). Объединенные органические фазы промывали один раз водным насыщенным NaHCO3 (100 мл) и соляным раствором (100 мл), сушили над Na2SO4, фильтровали и растворитель удаляли в вакууме,получая неочищенное заявленное в заголовке соединение в виде прозрачного масла (7,69 г, ); ESI+, m/z: 368 (М+1). Стадия b Бензиловый эфир (3aS,6aS)-6R-бензилокси-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4-карбоновой кислоты (1b). Кетопроизводное (1 а) (7,6 г) растворяли в сухом метаноле (100 мл). Триметилортоформиат (30 мл) и pTsOH (0,2 г) добавляли при комнатной температуре в атмосфере азота. Смесь грели при 60 С в течение 8 ч. Когда считали, что реакция завершилась согласно ТСХ, ее охлаждали до комнатной температуры и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат-гептан (1:4), которая давала заявленное в заголовке соединение в виде прозрачного масла (5,9 г, 71% на 2 стадии); ESI+, m/z: 382 (М+-ОМе). Стадия с(3aS,6aS)-3,3-диметоксигексагидрофуро[3,2-b]пиррол-6R-ол (1c). Раствор соединения (1b) (2,5 г, 6,4 ммоль) в метаноле (60 мл) и Pd(OH)2 (0,7 г) перемешивали при комнатной температуре в Н 2 атмосфере в течение 48 ч. Когда считали, что реакция завершилась согласно ТСХ, смесь фильтровали и концентрировали в вакууме для того, чтобы получить неочищенное заявленное в заголовке соединение в виде коричневатого масла (1,15 г); ESI+, m/z: 190 (М+ +1). Стадия d(3aS,6aS)-6R-гидрокси-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4 карбоновой кислоты (1d). 3,3-Диметоксигексагидрофуро[3,2-b]пиррол-6-ол (1 с) (2,80 г, 14,8 ммоль) растворяли в 75 мл смеси диоксан/вода (2:1). Добавляли по каплям до рН 9-9,5 раствор 10% Na2CO3 (25 мл). Смесь охлаждали до 0 С в ледяной бане и добавляли одной порцией Boc ангидрид. Реакция перемешивали при комнатной температуре в течение ночи и рН смеси поддерживали равной 9-9,5 добавлением дополнительного количества 10% раствора Na2CO3 в случае необходимости. Реакцию контролировали ТСХ (50:50 этилацетат:изогексан). После завершения смесь фильтровали для удаления образовавшихся солей и растворитель упаривали в вакууме. Водную смесь экстрагировали 3 100 мл EtOAc, объединенные органические фазы промывали 100 мл воды и 100 мл соляного раствора, сушили над Na2SO4, фильтровали и растворитель упаривали в вакууме для того, чтобы получить 3,79 г заявленного в заголовке карбамата в виде прозрачного масла (89%), 94% чистота (HPLC), ESI+, m/z: 312 (MNa). Стадия е(1 е). К спирту (1 е) (3,674 г, 12,70 ммоль), растворенному в DCM (80 мл), добавляли периодинан ДессМартина (7,00 г, 16,5 ммоль) и раствор перемешивали в течение 3 ч при комнатной температуре. Затем,реакцию гасили добавлением 10% Na2S2O3 (водн.) (150 мл), и полученную в результате суспензию перемешивали в течение 15 мин. Смесь переносили в делительную воронку, и фазы разделяли. Водную фазу экстрагировали трижды DCM и объединенные органические фазы последовательно промывали дважды насыщ. NaHCO3 раствором и сушили, фильтровали и концентрировали. Неочищенный материал очищали колоночной флеш-хроматографией (толуол/этилацетат 3:1), которая давала заявленное в заголовке соединение (2,882 г, 79%). Стадия f(1f). Кетосоединение (1 е) (1,10 г, 3,83 ммоль) растворяли в сухом THF (30 мл) и раствор охлаждали до 0 С. Раствор бромида метилтрифенилфосфония (4,0 г, 11,2 ммоль) и KOtBu (1,17 г, 10,5 ммоль) в сухомTHF (40 мл) добавляли 3 аликвотами с интервалом 2 ч. Через 6 ч раствор выливали в делительную воронку с диэтиловым эфиром (70 мл) и экстрагировали 10% лимонной кислотой (водн) (2 40 мл). Органическую фазу промывали насыщенным водным NaHCO3 (40 мл), сушили над Na2SO4, фильтровали и растворитель упаривали в вакууме. Неочищенный продукт очищали флеш-хроматографией (гептан:этилацетат 4:1), которая давала заявленное в заголовке соединение (524 мг, 48%). 1 Н ЯМР (CDCl3, 400 МГц)1,48 (с, 9 Н), 3,27 (с, 3H), 3,40 (д, 3H, J=16,6), 3,57-3,64 (м, 1 Н), 3,84 (д,1 Н, J=9,5), 3,92 (д, 1 Н, J=16,3), 4,07-4,25 (м, 1 Н), 4,35-4,49 (м, 1 Н), 4,98 (уш.с, 1 Н), 5,22 (д, 1 Н, J=16,4),5,34 (с, 1 Н). Стадия g(7,34 мл, 3,67 ммоль) и раствор перемешивали в течение ночи. Растворитель удаляли упариванием на роторе и повторно растворяли в THF (20 мл). Медленно добавляли к раствору МеОН (10 мл) и когда выделение газа прекращалось, добавляли к раствору Н 2 О (20 мл), с последующим добавлением NaBO3. Раствор фильтровали после перемешивания в течение 18 ч и фильтрат разбавляли EtOAc (70 мл) и промывали соляным раствором (2 50 мл). Органическую фазу сушили над Na2SO4, фильтровали и растворитель упаривали в вакууме. Неочищенный продукт очищали флеш-хроматографией (гептан:этилацетат 2:1),которая давала заявленное в заголовке соединение (477 мг, 86%). 1 Н ЯМР (CDCl3, 400 МГц)1,47 (с, 9 Н), 2,09-2,25 (м, 2 Н), 3,02-3,20 (м, 1 Н), 3,29 (с, 3H), 3,39 (с,3H), 3,65-3,93 (м, 4 Н), 4,44 (д, 1 Н, J=5,7), 4,70-4,84 (м, 1 Н). Стадия h(1 Н). К раствору спирта 1g (370 мг, 1,22 ммоль), растворенному в сухом DCM (10 мл), добавляли периодинан Десс-Мартина (673 мг, 1,59 ммоль). Реакцию перемешивали в течение 40 мин и, затем, гасили добавлением 10 мл 10% Na2S2O3:NaHCO3 (насыщ.) 1:1. Раствор разбавляли DCM (50 мл) и экстрагировали 1:1 смесью 10% Na2S2O3 :NaHCO3 (насыщ.) (50 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали. Неочищенный продукт очищали флеш-хроматографией (гептан:этилацетат (2:1, которая давала заявленное в заголовке соединение (290 мг, 79%). 1 Н ЯМР (CDCl3, 400 МГц)1,47 (с, 9 Н), 2,90-3,06 (м, 1 Н), 3,29 (с, 3H), 3,38 (с, 3H), 3,67-3,85 (м,2 Н), 3,88-4,55 (м, 3H), 4,93-5,19 (м, 1 Н), 9,64 и 9,80 (с, 1 Н). Два пика из-за наличия ротамеров. Справочный пример 4. 6-Ацетиленовый Р 1 структурный блок Альдегид справочного примера 3 (318,3 мг, 1,06 ммоль) в 6 мл дихлорметана (DCM) добавляли по каплям к раствору CBr4 (700 мг, 2,1 1 ммоль) и PPh3 (1,10 г, 4,19 ммоль) в 10 мл DCM, при охлаждении в ледяной бане. После перемешивания при 0 С в течение 2 ч смесь разбавляли 30 мл изогексана и, затем,фильтровали через короткую колонку с целитом. Колонку промывали 20 мл изогексана, с последующей промывкой 3/1 изогексан-DCM. Фильтрат упаривали для того, чтобы получить светло-желтый твердый остаток. Флеш-хроматография (силикагель, 3/1 изогексан-EtOAc) давала соединение 2 (339,5 мг, 70% выход). Раствор бутиллития (1,6 М в гексане, 1,50 мл) добавляли по каплям при -78 С к раствору дибромалкена стадии а (327,5 мг, 0,72 ммоль) в 13 мл THF. После перемешивания при -78 С в течение 1,75 ч, ре- 16020122 акцию гасили 3 мл насыщенным водным NH4Cl. Реакционную смесь концентрировали, затем распределяли между 30 мл насыщенного водного NaCl и 30 мл EtOAc. Водную фазу экстрагировали 2 30 млEtOAc. Органические фазы объединяли, сушили (Na2SO4) и упаривали для того, чтобы получить желтое масло. Флеш-хроматография (силикагель, 3/1 изогексан-EtOAc) давала заявленное в заголовке соединение в виде белого твердого остатка (161,7 мг, 67% выход). Ацетилхлорид (0,51 мл) добавляли по каплям к раствору концевого алкина справочного примера 4(153 мг, 0,514 ммоль) в МеОН (4,6 мл), охлажденному в ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение ночи и, затем, упаривали. Добавляли Boc-Leu-OH-H2O (145 мг,0,58 ммоль) и смесь упаривали с DMF, затем, повторно растворяли в 5 мл DMF и охлаждали в ледяной бане. Добавляли DIEA (0,36 мл, 2,1 ммоль), с последующим добавлением HATU (220 мг, 0,578 ммоль). После перемешивания при 0 С в течение 15 мин смесь перемешивали при комнатной температуре в течение 3 ч и, затем, концентрировали. Смесь растворяли в 20 мл EtOAc, промывали последовательно насыщенным водным NaHCO3 (10 мл) и насыщенным водным NaCl (210 мл), сушили (Na2SO4), и упаривали для того, чтобы получить желто-коричневое масло. Флеш-хроматография (силикагель, 1/1 изогексан-EtOAc) давала заявленное в заголовке соединение (213 мг, количественный).Boc деблокирование соединения стадии а) (0,514 ммоль) проводили как для справочного примера 4 выше для того, чтобы получить заявленную в заголовке HCl соль. Соль растворяли в CH2Cl2 и разделяли на три порции, упаривали отдельно для того, чтобы получить 0,17 ммоль на образец. Справочный пример 6. Альтернативный Р 3 структурный блокi. AcOH, бром, комнатная температура, 2 ч, 55% выход; ii. KF, ацетонитрил, 18-краун-6, 90 С, 16 ч; 31% выход; iii. AcOH, бром, 45 С, 4 ч, 100% выход; iv. Амид 4-метилпиперазин-1-карботиокислоты, , 2 ч, 74% выход; LiOH, комнатная температура, 16 ч, 100% выход. Наличие исходных соединений Метил 4-ацетилбензоат получали у Aldrich; амид 4-метилпиперазин-1-карботиокислоты-11 поставщиков, найденных в SciFinder (вероятно Chem Pur Products Ltd в Германии наиболее удобный). Стадия а) Метиловый эфир 4-(2-бромацетил)бензойной кислоты К раствору метилового эфира 4-ацетилбензойной кислоты (8,4 ммоль) в уксусной кислоте (20 мл) добавляли бром (8,4 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 ч, в течение данного времени красная окраска исчезала, и образовывался грязно-белый осадок. Продукт собирали фильтрацией и промывали холодной смесью метанол/вода (200 мл 1:1) для того, чтобы получить белый порошок (55%). 1 Н ЯМР (400 МГц, CDCl3) 3,98 (3H, с), 4,20 (2 Н, с), 8,02 (2 Н, д, J=8 Гц), 8,18 (2 Н, д,J=8 Гц). Стадия b) Метиловый эфир 4-(2-фторацетил)бензойной кислоты К суспензии фторида калия (3,11 ммоль) в ацетонитриле (1 мл) добавляли 18-краун-6 (0,1 ммоль) и реакцию грели при 90 С в течение 30 мин. Добавляли 4-(2-бром-ацетил)бензойную кислоту (1,56 ммоль),и реакцию грели при 90 С в течение 16 ч. Реакцию разбавляли водой (10 мл) и экстрагировали этилацетатом (320 мл). Продукт очищали на силикагеле, элюируя 5-15% этилацетата в изогексане для того,чтобы получить после концентрации в вакууме требуемых фракций, заявленный в заголовке продукт в виде белого твердого остатка (31%). 1 Н ЯМР (400 МГц, CDCl3) 3,98 (3H, с), 5,55 (2 Н, д, J=50 Гц), 7,95 К суспензии 4-(2-фторацетил)бензойной кислоты (1,19 ммоль) в уксусной кислоте (5 мл) добавляли бром (1,19 ммоль). Реакцию грели при 45 С в течение 4 ч, в течение данного времени образовывался зеленый раствор. Реакцию концентрировали в вакууме и упаривали азеотропно дважды с толуолом для того, чтобы получить заявленное в заголовке соединение в виде зеленого твердого остатка (100%). Продукт применяли неочищенным в следующей стадии. 1 Н ЯМР (400 МГц, CDCl3) 3,98 (3H, с), 7,04 (1 Н, с),8,05-8,10 (4 Н, м). Стадия d) Метиловый эфир 4-[5-Фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты Метиловый эфир 4-(2-Бром-2-фторацетил)бензойной кислоты (1,18 ммоль) и амид 4-метилпиперазин-1-карботиокислоты (1,18 ммоль) растворяли в этаноле (10 мл). Реакцию кипятили с обратным холодильником в течение 2 ч. Реакцию охлаждали до комнатной температуры, вызывая выпадение продукта. Продукт собирали фильтрацией и промывали холодным этанолом. Продукт обрабатывали водным бикарбонатом натрия для того, чтобы получить заявленное в заголовке соединение в виде бесцветного масла (74%). MS (ES+) 337 (М+Н, 100%). Стадия f) дигидрохлорид 4-[5-Фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты К раствору метилового эфира 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты(0,43 ммоль) в смеси тетрагидрофуран/вода (2,5 мл, 4:1) добавляли гидроксид лития (0,5 ммоль). Реакцию перемешивали при комнатной температуре в течение 16 ч. Реакцию концентрировали в вакууме и добавляли хлороводородную кислоту (2 н., 3 мл), вызывая выпадение продукта в виде белого твердого остатка. Продукт собирали фильтрацией для того, чтобы получить заявленное в заголовке соединение в виде белого твердого остатка (79%). MS (ES+) 322 (М+Н, 100%). Справочный пример 7 Альтернативный Р 1 структурный блок 0 С и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Когда полагали, что реакция достигла завершения, реакцию гасили 10% Na2S2O3 раствором. Реакционную смесь разбавлялиCH2Cl2 (30 мл) и, затем, промывали в свою очередь насыщенным Na2S2O3 раствором (250 мл) и насыщенным раствором бикарбоната натрия (250 мл). Затем, органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали в вакууме при комнатной температуре. Неочищенный продукт альдегид 7-2 (0,75 г, неочищенный) применяли в следующей стадии без дополнительной очистки. ТСХ: EtOAc:петролейный эфир 1:1 Rf=0,5. Стадия b) Реакция Виттига с соединением 7-2. К перемешиваемому раствору йодида изопропилтрифенилфосфония (6,48 г, 0,015 моль) (упаренный с сухим толуолом перед началом реакции) в сухом THF (20 мл) добавляли раствор н-BuLi (10,7 мл,0,0172 моль, 1,6 М в гексане) при -10 С в атмосфере азота и дополнительно перемешивали при 0 С в течение 1 ч. Цвет реакционной смеси медленно изменялся на темно-оранжевый цвет. Раствор соединения 2(0,75 г, 0,0025 моль) и безводного хлорида лития (1,5 мг) в сухом THF (20 мл) медленно добавляли к реакционной смеси при 0 С в атмосфере азота. Реакционную смесь дополнительно перемешивали в течение 30 мин, поддерживая ту же температуру и, затем, медленно нагревали до комнатной температуры и перемешивали в течение следующих 30 мин. Затем, реакционную смесь затем гасили насыщенным раствором хлорида аммония (20 мл). Неочищенный продукт экстрагировали EtOAc (230 мл), и органический слой промывали соляным раствором (50 мл) и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме и неочищенный продукт очищали колоночной хроматографией (нейтральный оксид алюминия, элюент 1% EtOAc в петролейном эфире) для того, чтобы получить чистое соединение 7.3 (0,19 г, выход 21% на две стадии). Справочный пример 8. Альтернативный Р 1-Р 2 структурный блок Первую реакцию осуществляли аналогичным способом, как сообщалось для справочного примера 5, но применяли 4 (0,2 г, 0,67 ммоль) в сухом МеОН (15 мл) и ацетилхлорид (0,66 мл) для получения Восдеблокированного аминосоединения, которое, затем, обрабатывали Вос-циклопентилглицином (0,17 г,0,7 ммоль), HATU (0,27 г, 0,7 ммоль) и DIEA (0,45 мл, 2,6 ммоль) в сухом DMF (7 мл) для получения чистого заявленного в заголовке соединения [0,195 г, выход 68%]. ТСХ система: EtOAc: петролейный эфир 1:1 об./об., Rf= 0,4. Справочный пример 9 Зондовое соединение для исследования пригодности дигалогенвинил Р 1. С помощью данного соединения проверяли синтетическую и биологическую пригодность дигалогенвинильного Р 1 конечного продукта. Ясно, что введение 6-дифторвинила соответствующей реакцией Виттига справочного примера 3 является тривиальным и что получение биологически активного конечного продукта дает уверенность, что заявленные дифторвинильные соединения являются также синтетически стабильными и активными. Альдегид 9-1 (318,3 мг, 1,06 ммоль) (см. справочный пример 3) в 6 мл дихлорметана (DCM) добавляли по каплям к раствору CBr4 (700 мг, 2,11 ммоль) и Ph3P (1,10 г, 4,19 ммоль) в 10 мл DCM при охлаждении в ледяной бане. После перемешивания при 0 С в течение 2 ч, смесь разбавляли 30 мл изогексана и,затем, фильтровали через короткую колонку с целитом. Колонку промывали 20 мл изогексана, с последующей промывкой 3/1 изогексан-DCM. Фильтрат концентрировали в вакууме для того, чтобы получить светло-желтый твердый остаток. Флеш-хроматография (силикагель, 3/1 изогексан-EtOAc) давала соединение 9-2 (339,5 мг, 70% выход). К раствору дибромалкена 9-2 (81,7 мг, 0,179 ммоль) в МеОН (1,62 мл), охлажденному в ледяной бане, добавляли по каплям ацетилхлорид (0,18 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и, затем, упаривали. Добавляли Boc-Leu-OH-H2O (50 мг, 0,20 ммоль), HATU (75 мг, 0,20 ммоль), 1,8 мл DMF, и в заключение, DIEA (125 мкл, 0,72 ммоль). После перемешивания при комнатной температуре в течение 5,5 ч смесь концентрировали в вакууме и, затем, распределяли междуEtOAc и насыщенным водным NaHCO3. Органическую фазу промывали дважды насыщенным воднымNaCl, сушили (Na2SO4) и концентрировали в вакууме. Флеш-хроматография (силикагель, 3/1 изогексанEtOAc) давала соединение 9-3 в виде белого твердого остатка (86,3 мг, 85% выход).Boc деблокирование соединения 9-3 (86,3 мг, 0,15 ммоль) осуществляли как для 9-2 выше для того,чтобы получить HCl соль амина. Добавляли к смеси аминовой соли DMF (1,5 мл), гидробромид 4-[2-(4- 20020122 метил-1-пиперазинил)-4-тиазолил]бензойной кислоты (65 мг, 0,17 ммоль) и HATU (65 мг, 0,17 ммоль) при охлаждении в ледяной бане. Добавляли DIEA (120 мкл, 0,69 ммоль). После перемешивания при комнатной температуре в течение 3 ч добавляли 20 мл EtOAc и затем смесь промывали 1 М NaHCO3 (10 мл),с последующей промывкой насыщенным водным NaCl. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме для того, чтобы получить неочищенный продукт. Флеш-хроматография (силикагель, CH2Cl2-MeOH 100/1-100/4 давала требуемый продукт в виде блежно-желтого твердого остатка (65,7 мг, 58% выход). Кеталь 9-4 (65,7 мг, 0,087 ммоль) перемешивали с 1,0 мл 97,5/2,5 (об./об.) TFA-H2O в течение 4 ч 20 мин и, затем, гасили водной суспензией NaHCO3. Смесь экстрагировали EtOAc. Органическую фазу промывали насыщенным водным NaCl, сушили (Na2SO4) и концентрировали в вакууме. Очистка прераративной ВЭЖХ давала кетон 9-5 в виде белого твердого остатка (12,6 мг).LC-UV/MS: моноизотопная молекулярная масса 709,1 Да, 94% чистота (колонка: АСЕ С 8 503,0 мм, 3 мкм частицы; подвижные фазы А: 10 мМ NH4Ac, В: 10 мМ NH4Ac в 90% MeCN; градиент: 30-70% В в течение 10 мин, затем промывка в течение 2 мин с 100% В; скорость потока: 0,8 мл/мин, обнаружение: UV210-400 нм и ESI-MS) Пример 1(73,9 мг, 0,19 ммоль), соединения справочного примера 5 (0,17 ммоль) и HATU (73,4 мг, 0,19 ммоль) при охлаждении в ледяной бане DMF (2 мл). Добавляли DIEA (0,12 мл, 0,69 ммоль). После перемешивания при комнатной температуре в течение 2,5 ч, смесь концентрировали, растворяли в 20 мл EtOAc и, затем,промывали 10 мл насыщенного водного NaHCO3. Водную фазу экстрагировали 10 мл EtOAc. Органические фазы объединяли, промывали насыщенным водным NaCl (215 мл), сушили (Na2SO4) и упаривали для того, чтобы получить неочищенный продукт. Первая флеш-хроматография (силикагель 40-63 мкм, 58% МеОН в EtOAc) давала очищенное соединение, которое подвергали второй хроматографии (YMC силикагель 6 нм S-50 мкс, 1-5% МеОН в CH2Cl2) для того, чтобы получить заявленное в заголовке соединение в виде светло-желтого твердого остатка (50,1 мг, 49% выход). Соединение стадии а) (50 мг, 0,0839 ммоль) растворяли в 10 мл TFA:H2O (97,5:2,5) и перемешивали в течение 4 ч. Растворитель выливали в делительную воронку, экстрагировали EtOAc и промывали насыщенным водным NaHCO3. Органическую фазу сушили над Na2SO4, фильтровали и упаривали. Неочищенный продукт очищали полупрепаративной ВЭЖХ на XBrideg Phenyl 5 мкм колонке с подвижными фазами А (90:10 Н 2 О: ацетонитрил, 10 мМ NH4Ac) и В (10:90 Н 2 О: ацетонитрил, 10 мМ NH4Ac), начиная с 25-60% В. Продукт получали в виде белого твердого остатка с выходом 62% (29 мг). LRMS (М+Н) 550. 1 Н ЯМР (CDCl3, 400 МГц): 0,95 (д, J=6,4, 3H), 1,03 (д, J=6,4, 3H), 1,57- 2,10 (м, 4 Н), 2,37 (с, 3H),2,60-2,54 (м, 4 Н), 3,17-3,26 (м, 1 Н), 3,55-3,64 (м, 5 Н), 4,07 (д, J=17,1, 1 Н), 4,27 (д, J=17,2, 1 Н), 4,50 (дд,J=7,8, 9,9, 1 Н), 4,77 (д, J=5,1, 1 Н), 4,91 (дд, J=4,6, 4,6, 1 Н), 4,97-5,06 (м, 1 Н), 6,85-6,91 (м, 2 Н), 7,79 (д,J=8,3, 2H), 7,89 (д, J=8,4, 3H). Пример 2 Добавляли к смеси гидрохлорида 4-[5-фтор-2-(4-метил-1-пиперазинил)-4-тиазолил]бензойной кислоты (68,0 мг, 0,19 ммоль), соединения справочного примера 5 (0,17 ммоль) и HATU (73,8 мг, 0,19 ммоль) при охлаждении в ледяной бане DMF (1,7 мл). Добавляли DIEA (0,12 мл, 0,69 ммоль). После перемешивания при комнатной температуре в течение 2,75 ч смесь обрабатывали как в примере 1 для того,чтобы получить неочищенный фтортиазольный аналог. Флеш-хроматография (YMC силикагель, 1-3% МеОН в CH2Cl2) давала заявленное в заголовке соединение в виде светло-желтого твердого остатка (62,8 мг, 60% выход).NaHCO3 (водн.). Органическую фазу сушили над Na2SO4, фильтровали и упаривали. Неочищенный продукт очищали полупрепаративной ВЭЖХ на XBrideg Phenyl 5 мкм колонке с мобильными фазами А(90:10 Н 2 О: ацетонитрил, 10 мМ NH4Ac) и В (10:90 Н 2 О: ацетонитрил, 10 мМ NH4Ac), начиная с 25-60% В. Продукт получали в виде белого твердого остатка с выходом 46% (26 мг). LRMS (М+Н) 568. 1 Н ЯМР (CDCl3, 400 МГц): 0,95 (д, J=6,4, 3H), 1,03 (д, J=6,4, 3H), 1,58-2,15 (м, 4 Н), 2,37 (с, 3H), 2,612,48 (м, 4 Н), 3,18-3,25 (м, 1 Н), 3,53-3,42 (м, 4 Н), 3,60 (т, J=10,5, 1H), 4,07 (д, J=17,1, 1 Н), 4,27 (д, J=17,2,1 Н), 4,56-4,46 (м, 1 Н), 4,91 (т, J=4,5, 1 Н), 4,96-5,06 (м, 1 Н), 6,87 (д, J=8,2, 1H), 7,81 (д, J=8,4, 2H), 7,90 (т,J=9,4, 2H). Пример 3 К смеси гидрохлорида 3-фтор-4-[2-(4-метил-1-пиперазинил)-4-тиазолил]бензойной кислоты (68,9 мг, 0,19 ммоль), соединения справочного примера 5 (0,17 ммоль) и HATU (80 мг, 0,21 ммоль) при охлаждении в ледяной бане добавляли DMF (1,7 мл). Добавляли DIEA (0,12 мл, 0,69 ммоль). После перемешивания при комнатной температуре в течение 3 ч, смесь концентрировали, растворяли в 30 мл EtOAc,промывали последовательно 15 мл насыщенного водного NaHCO3 и, затем, 30 мл насыщенного водногоNaCl. Органическую фазу сушили (Na2SO4) и, затем, упаривали. Флеш-хроматография (YMC силикагель,1-3% МеОН в CH2Cl2) давала заявленное в заголовке соединение в виде грязно-белого твердого остатка Кеталь стадии а) (67 мг, 0,11 ммоль) перемешивали с 1,10 мл 97,5/2,5 (об./об.) TFA-H2O в течение 2 ч и, затем, концентрировали. Смесь разбавляли EtOAc (10 мл), промывали насыщенным водным NaHCO3(5 мл), с последующей промывкой насыщенным водным NaCl (25 мл), сушили (Na2SO4) и упаривали. Неочищенный материал растворяли в 2 мл MeCN и 1 мл Н 2 О, и 0,9 мл данного раствора очищали препаративной ВЭЖХ для того, чтобы получить кетон заявленного в заголовке соединения в виде белого твердого остатка (8,2 мг).LC-UV/MS: моноизотопная молекулярная масса 567,2 Да, 97,6% чистота (колонка: АСЕ С 8 503,0 мм, 3 мкм частицы; подвижные фазы А: 10 мМ NH4Ac, В: 10 мМ NH4Ac в 90% MeCN; градиент: 20-100% В в течение 10 мин, затем промывка в течение 2 мин с 100%; скорость потока: 0,8 мл/мин, обнаружение: Ацетилхлорид (0,3 мл) добавляли по каплям к охлажденному на льду раствору соединения 7-3(103,4 мг, 0,316 ммоль) (см. справочный пример 7) в метаноле (2,9 мл). Раствор перемешивали при ком- 23020122 натной температуре в течение ночи и затем концентрировали в вакууме, упаривали дважды с СН 2 Сl2, и сушили в вакууме. Добавляли Вос-L-лейцин-H2O (96,2 мг, 0,386 ммоль) и HATU (143 мг, 0,376 ммоль), и смесь охлаждали в ледяной бане. Добавляли DMF (3,2 мл), с последующим добавлением DIEA (220 мкл,1,26 ммоль). Полученный в результате раствор перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь концентрировали в вакууме, растворяли в EtOAc (15 мл) и промывали последовательно насыщенным водным NaHCO3 (10 мл) и насыщенным водным NaCl (10 мл). Органическую фазу сушили (Na2SO4) и затем концентрировали в вакууме для того, чтобы получить неочищенное соединение. Колоночная флеш-хроматография (силикагель, 2/1 изогексан-EtOAc) давала соединение 4i в виде белого твердого остатка (127,8 мг, 92% выход). ТСХ Rf=0,56 (1/1 изогексан-EtOAc) LC-UV/MS Rt=1,98 мин (один пик), масс 441 [М+Н]+ (градиент 70-99% В в течение 3 мин, затем 100% В в течение 1,5 мин (способ - скорость потока 0,8 мл/мин,UV=210-400 нм, Phenomenex Gemini-NX 3 мкм С 18 110 А 503,0 мм, подвижные фазы А: 10 мМ NH4Ac в Н 2 О, В: 10 мМ NH4Ac в 90/10 MeCN-H2O). Соединение 4-i (127,8 мг, 0,290 ммоль) деблокировали, как описано выше, применяя МеОН (2,7 мл) и ацетилхлорид (0,30 мл). Конденсацию полученной в результате HCl соли амина (половина соединения,0,145 ммоль) с гидрохлоридом 4-[5-фтор-2-(4-метил-1-пиперазинил)-4-тиазолил]бензойной кислоты (67,4 мг, 0,19 ммоль) проводили аналогично, как Boc-Leu-OH стадию конденсации, в DMF (2,0 мл) с HATU(69 мг, 0,18 ммоль) и DIEA (115 мкл, 0,66 ммоль) в течение 3,5 ч. После колоночной флешхроматографии неочищенного продукта (силикагель, 2-5% МеОН в CH2Cl2), соединение 4-ii получали в виде бледно-желтого твердого остатка (48,3 мг, 52% выход). ТСХ Rf=0,5 (9/1 CH2Cl2-MeOH). LC-UV/MS Rt=2,41 мин, 95q% чистота, масс 644 [М+Н]+ (градиент 70-99% В в течение 3 мин, затем 100% В в течение 1,5 мин. К охлажденному на льду раствору кеталя 4-ii (41,3 мг, 0,064 ммоль) в CH2Cl2 (0,3 мл) добавляли по каплям 0,65 мл раствор TFA-вода (97,5/2,5 об/об). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, и затем помещали в ледяную баню и гасили насыщенным водным NaHCO3(10 мл). Смесь экстрагировали дважды EtOAc (20 мл, 10 мл). Органические фазы объединяли, промывали насыщенным водным NaCl (10 мл), сушили (Na2SO4) и концентрировали в вакууме. Очистка препаративной ВЭЖХ давало конечное заявленное в заголовке соединение.LC-UV/MS Rt=6,5 и 7,5 мин (гидрат и кетон), 98% чистота, моноизотопная молекулярная масса 597,3 Da (способ - скорость потока 0,8 мл/мин; UV=210-400 нм и ESI-MS; Phenomenex Gemini-NX С 18 503,0 мм, 3 мкм частицы; подвижные фазы А: 5 мМ NH4Ac в Н 2 О, В: 5 мМ NH4Ac в MeCN, градиент 20-99% В в течение 10 мин, затем промывка в течение 2 мин с 100% В). Пример 5. N-[1-(6-Этинил-3-оксогексагидрофуро[3,2-b]пиррол-4-ил)-1-циклопентил-2-оксоэтил]-4[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамид Реакцию осуществляли аналогичным способом, как сообщалось в случае примера 3, но применяя Р 1-Р 2 структурный блок справочного примера 8 (0,14 г, 0,33 ммоль) в сухом МеОН (15 мл), и ацетилхлорид (0,5 мл) применяли для того, чтобы получить Boc-деблокированный амин, который далее обрабатывали HCl солью (0,132 г, 0,33 ммоль), HOBt (0,04 г, 0,3 ммоль), EDCHCl (0,117 г, 0,61 ммоль) и NMM(0,11 мл, 1,0 ммоль) в сухом DMF (10 мл) для того, чтобы получить чистое соединение 5-а [0,05 г, выход 26%]. ТСХ система: CHCl3:МеОН 9,5:0,5 об./об., Rf= 0,25. Деблокирование кеталя 5-а (40,5 мг, 0,065 ммоль) до заявленного в заголовке кетона проводили как для соединения 3, применяя 0, 65 мл TFA-вода раствора, с реакцией при комнатной температуре в течение 2 ч 15 мин. Очистка препаративной ВЭЖХ давала 11 в виде бледно-желтого твердого остатка (14,75 мг).LC-UV/MS Rt=5,3 и 6,0 мин, (гидрат и кетон), 96,7% чистота, моноизотопная молекулярная масса 579,2 Да (способ - скорость потока 0,8 мл/мин; UV=210-400 нм и ESI-MS; Phenomenex Gemini-NX C18 503,0 мм, 3 мкм частицы; подвижные фазы А: 5 мМ NH4Ac, В: 5 мМ NH4Ac в MeCN, градиент 20-99% В в течение 10 мин, затем промывка в течение 2 мин с 100% В). Биологические примеры Определение протеолитической каталитической активности катепсина K Общепринятые анализы для катепсина K осуществляли, применяя человеческий рекомбинантный фермент, такой как фермент, описанный в PDB. Рекомбинантный катепсин К может экспрессироваться в различных имеющихся в продаже экспрессионных системах, включая системы Е coli, Pichia и Baculovirus. Очищенный фермент активируют удалением пропоследовательности общепринятыми способами. В стандартных условиях анализа для определения кинетических постоянных применяют флуорогенный пептидный субстрат, обычно H-D-Ala-Leu-Lys-AMC, и определяют или в 100 мМ Mes/Tris, рН 7,0, содержащем 1 мМ EDTA и 10 мМ 2-меркаптоэтанол, или в 100 мМ фосфат Na, 1 мМ EDTA, 0,1%PEG4000 рН 6,5 или 100 мМ ацетате Na, рН 5,5, содержащем 5 мМ EDTA и 20 мМ цистеин, в каждом случае необязательно с 1 М DTT в качестве стабилизатора. Применяемая концентрация фермента была 5 нМ. Стоковый раствор субстрата получали при 10 мМ в DMSO. Скрининг осуществляли при фиксированной концентрации субстрата 60 мкм и детальными кинетическими исследованиями с двойным разбавлением субстрата от 250 мкм. Суммарную DMSO концентрацию в анализе поддерживали ниже 3%. Все анализы проводили при комнатной температуре. Флуоресценцию продукта (возбуждение при 390 нм, испускание при 460 нм) наблюдали с помощью Labsystems Fluoroskan Ascent флуоресцентного планшет-ридер. Кривые образования продукта генерировали через 15 мин с последующим генерированием АМС продукта. Определение Ki катепсина S В анализе применяли экспрессируемый бакуловирусом человеческий катепсин S и boc-Val-Leu-LysAMC флуоресцентный субстрат, полученный у Bachem, в 384-луночном планшетном формате, в котором можно испытывать параллельно 7 испытуемых соединений с положительным контролем, включающим известный ингибитор катепсина S для сравнения. Разбавления субстрата 280 мкл/лунка 12,5% DMSO добавляли к рядам В-Н двух колонок полипропиленового планшета с 96 глубокими лунками. 70 мкл/лунка субстрата добавляли к ряду А. 2250 мкл/лунка буфера для анализа(100 мМ фосфат Na, 100 мМ NaCl, pH 6,5) добавляли к ряду А, смешивали и вдвое разбавляли вниз планшета до ряда Н. Разбавления ингибитора 100 мкл/лунка буфера для анализа добавляли в колонки 2-5 и 7-12 4 рядов 96-луночного полипропиленового планшета с V-образным дном. 200 мкл/лунка буфера для анализа добавляли к колонкам 1 и 6. Первое испытуемое соединение, полученное в DMSO, добавляли к колонке 1 верхнего ряда, обычно при таком объеме, чтобы обеспечить величину в 10-30 большую первоначально определенной приблизительной Ki. Приблизительную Ki рассчитывали из предварительного опыта, в котором 10 мкл/лунка 1 мМ boc-VLK-AMC (1/10 разбавление 10 мМ стокового раствора в DMSO, разбавленного в буфере для анализа) распределяли в рядах В-Н и 20 мкл/лунка в ряде А 96-луночного Microfluor планшета. 2 мкл каждого 10 мМ испытуемого соединения добавляли в отдельную лунку в ряду А, колонки 1-10. Добавляли 90 мкл буфера для анализа, содержащего 1 мМ DTT и 2 нМ катепсина S в каждую лунку рядов В-Н и 180 мкл в ряд А. Смешивали ряд А, применяя многоканальную пипетку, и дважды разбавляли в ряду G. Смешивали ряд Н и считывали в флуоресцентном спектрофотометре. Показания приводили с помощьюPrism data к уравнению конкурентного ингибирования, устанавливая S=100 мкМ и KM=100 мкМ для того, чтобы получить оценку Ki, вплоть до максимума 100 мкМ. Второе испытуемое соединение добавляли к колонке 6 верхнего ряда, третье к колонке 1 второго ряда и т.д. Добавляли 1 мкл соединения для сравнения к колонке 6 нижнего ряда. Смешивали колонку 1 и разбавляли вдвое в колонке 5. Смешивали колонку 6 и разбавляли вдвое в колонке 10. Применяя 8-канальную многоступенчатую пипетку, установленную на 510 мкл, распределяли 10 мкл/лунка субстрата в 384-луночном планшете для анализа. Распределяли первую колонку планшета для разбавления субстрата по всем колонкам планшета для анализа, начиная с ряда А. Концевой промежуток многоканальной пипетки правильно пропускал чередующиеся ряды. Распределяли вторую колонку во все колонки, начиная с ряда В. Применяя 12-канальную многоступенчатую пипетку, установленную на 410 мкл, распределяли 10 мкл/лунка ингибитора в 384-луночный планшет для анализа. Распределяли первый ряд планшета для разбавления ингибитора в чередующиеся ряды планшета для анализа, начиная с А 1. Концевой промежуток многоканальной пипетки правильно пропускал чередующиеся ряды. Аналогично, распределяли второй, третий и четвертый ряды в чередующиеся лунки и колонки, начиная с А 2, В 1 и В 2 сответственно. Смешивали 20 мл буфера для анализа и 20 мкл 1 М DTT. Добавляли достаточное количество катепсина S для того, чтобы получить 2 нМ конечную концентрацию. Применяя распределитель, такой как Multidrop 384, добавляли 30 мкл/лунка во все лунки планшета для анализа и считывали в флуоресцентном спектрофотометре, таком как Ascent. Показания, полученные на флуориметре (длины волн возбуждения и испускания 390 нм и 460 нм,соответственно, устанавливали, применяя полосно-пропускающие фильтры), отражающие степень расщепления ферментом флуоресцентного субстрата, невзирая на ингибитор, представляют собой линейную скорость, установленную для каждой лунки. Установленные скорости для всех лунок для каждого ингибитора приводили к уравнению для конкурентного ингибирования, применяя SigmaPlot 2000 для определения V, KM и Ki величин. Катепсин L Ki Применяли методику выше со следующими изменениями для определения Ki для катепсина L. Фермент является имеющимся в продаже человеческим катепсином L (например, Calbiochem). Субстратом был H-D-Val-Leu-Lys-AMC, полученный у Bahcem. Буфер для анализа представляет собой 100 мМ ацетат натрия, 1 мМ EDTA, рН 5,5. DMSO стоковый раствор (10 мМ в 100% DMSO) разбавляли до 10% в буфере для анализа. Фермент получали при 5 нМ концентрации в буфере для анализа плюс 1 мМ дитиотрийтол непосредственно перед применением. 2 мкл 10 мМ ингибитора, полученного в 100%DMSO, распределяли в ряду А. 10 мкл 50 мкМ субстрата (=1/200 разбавление 10 мМ стокового раствора в DMSO, разбавленного в буфере для анализа) Исследования ингибирования Потенциальные ингибиторы скринировали, применяя вышеуказанный анализ с различными концентрациями испытуемого соединения. Реакции инициировали добавлением фермента к буферизованным растворам субстрата и ингибитора. Значения Ki рассчитывали согласно уравнению 1. В котором 0 представляет собой скорость реакции, V представляет собой максимальную скорость,S представляет собой концентрацию субстрата с константой Михаэля KM, и I представляет собой концентрацию ингибитора. Результаты представлены в виде: А при 50 наномолярной; В 50-500 наномолярной; С 501-1000 наномолярной; Таким образом, соединения формулы II являются эффективными ингибиторами катепсина К и даже являются селективными к катепсину К по сравнению с близкородственными катепсинами S и L. Соединение справочного примера 9 придает уверенность, что соответствующие дифторвинильные соединения являются также активными и селективными. Метаболическая стабильность Соединения настоящего изобретения и показанные сравнительные примеры исследовали на метаболическую стабильность в анализе с применением цитозоля, в котором соединения выдерживали в имеющихся в продаже фракциях цитозоля печени человека, и исчезновение соединения отслеживали с помощью ВЭЖХ или LC/MS. Мало вероятно, что объединенные фракции цитозоля печени человека представляют отдельных лиц, чем кровь отдельного лица, и их можно хранить замороженными, в отличие от цельной крови. Таким образом, анализ с применением цитозоля обеспечивает подходящим опытным образцом анализа в качестве средства для определения стабильности соединений в in vivo окружении, таком как при обработке цельной кровью. Вкратце, испытуемые соединения (2 мкМ) выдерживают в смешанном цитозоле печени человека(Xenotech LLC Lenexa US, 1 мг/мл белка в 0,1 М фосфатном буфере, рН 7,4) при 37 С в течение одного часа. Ингибирование начинали добавлением 1 мМ NADPH кофактора. Рассчитанные по времени аналитические образцы отбирали через 0, 20, 40 и 60 мин и "ускоренно осаждали" добавлением 3 объемов охлажденного на льду ацетонитрила. Образцы центрифугировали при пониженной температуре и надосадочную жидкость отделяли и анализировали LC-MS-MS. Альтернативно, аналогичный анализ на стабильность осуществляли в цельной крови человека или обезьяны и/или в имеющихся в продаже микросомах печени, таких как XEN 025. Таблица 2 Сравнительный пример 1 представляет собой соединение, содержащее углерод-углеродную связь в положение 6 из WO 2008/007107, приводимого выше. Его получали легким способом из соединения 1 d(схема 1). Однако при наличии экзоциклического алкена 1d, стереоселективное гидрирование алкена с применением катализатора Адамса (диоксид платины) в этилацетате в атмосфере водорода, протекало сsyn присоединением водорода. Данное гидрирование давало по существу один продукт, а именно С-6 метильный изомер (LCMS [М+Н]=288 найденная) с R-стереохимией с хорошим выходом. Фациальная селективность, наблюдаемая в данном случае для стадии гидрирования, является аналогичной селективности, сообщенной ранее в литературе для близкородственной бициклической структуры (Srinivas et al,Synlett, 1999, 555-556). Полученный таким образом структурный блок деблокировали, конденсировали и окисляли до активной кетоформы, как для соединений настоящего изобретения, приведенных выше. Из сравнительного примера 1 ясно, что метильная группа в 6 положении дает соединение с CLint величиной в цельной крови 9 мкг/мин/мг, представляющей предполагаемое время полуразложения в цельной крови меньшее чем один час. В противоположность этому, ацетилен дает Clint величину 3, ко- 27020122 торое представляет собой рассчитанное время полуразложения в цельной крови, достигающее 4 ч. Примите во внимание также то, что HLM микросомальный клиренс (отражающий вклад печени в метаболизм соответствующих соединений) является значительно большим для 6-метильных молекул, чем для соединения настоящего изобретения, который в дальнейшем будет подчеркивать большую стабильность соединения настоящего изобретения. Повышенная стабильность in vivo допускает лучшее распределение соединения в теле в течение дня, несмотря на QD или BID дозы. Это особенно важно для показаний, таких как остеопороз, когда суточные изменения являются значительными. Проницаемость Данный эксперимент измеряет транспорт ингибиторов через клетки человеческого желудочнокишечного тракта. В анализе применяют хорошо известные Сасо-2 клетки с количеством пассажей 4060. Апикальный - базолатеральный транспорт В общем, каждое соединение испытывали в 2-4 лунках. Базолатеральная и апикальная лунки содержали 1,5 мл и 0,4 мл буфера переноса (ТВ), соответственно, и стандартная концентрация испытуемых веществ равна 10 мкМ. Кроме того, все испытуемые растворы и буферы содержали 1% DMSO. Перед экспериментом планшеты для транспорта предварительно покрывали культуральной средой, содержащей 10% сыворотку в течение 30 мин для того, чтобы избежать неспецифического связывания с пластиковым материалом. Через 21-28 дней в культуре на подложке, являющейся фильтром, клетки были готовыми для экспериментов на проницаемость. Планшет для транспорта 1 содержал 3 ряда 4 лунки каждый. Ряд 1 обозначали "промывка", ряд 2"30 мин" и ряд 3 "60 мин". Планшет для транспорта 2 содержал 3 ряда 4 лунки каждый, один обозначал ряд 4 "90 мин", ряд 5 "120 мин" и оставшийся ряд не обозначен. Культуральную среду из апикальных лунок удаляли и содержимое переносили в ряд для промывки(No. 1) в планшет для транспорта (планшет 1) вне 2 планшетов без содержимого, которые уже получили с 1,5 мл буфером для транспорта (HBSS, 25 мМ HEPES, рН 7,4) в рядах 1-5. В А В скрининге ТВ в базолатеральной лунке также содержал 1% бычий сывороточный альбумин. 0,5 мл буфера для транспорта (HBSS, 2 5 мМ MES, рН 6,5) добавляли к содержимому, и клеточный монослой уравновешивали в буферной системе для транспорта в течение 30 мин при 37 С в polymix встряхивателе. После достижения равновесия с буферной системой значение трансэпителиального электрического сопротивления (TEER) измеряли в каждой лунке EVOM "палочковым" прибором. ВеличиныTEER обычно составляли от 400 до 1000 на лунку (в зависимости от применяемого числа пассажей). Буфер для транспорта (ТВ, рН 6,5) удаляли с апикальной стороны и содержимое переносили в 30 минутный ряд (No.2) и свежие 425 мкл ТВ (рН 6,5), содержащего испытуемое вещество, добавляли к апикальной (донорной) лунке. Планшеты выдерживали в polymix встряхивателе при 37 С с медленной скоростью встряхивания приблизительно равной 150-300 об/мин. Через 30 мин инкубирования в ряду 2 содержимое переносили в новые предварительно нагретые базолатеральные (получатель) лунки каждые 30 мин; ряд 3 (60 мин), 4 (90 мин) и 5 (120 мин). 25 мкл образцы отбирали из апикального раствора через 2 мин и в конце эксперимента. Данные образцы представляли собой донорные образцы в момент начала и конца эксперимента. 300 мкл отбирали из базолатеральных (получатель) лунок в каждый запланированный момент времени и последнее значение TEER измеряли в конце эксперимента. Ко всем собранным образцам добавляли ацетонитрил до конечной концентрации 50% в образцах. Собранные образцы хранили при -20 С до анализа ВЭЖХ или LC-MS. Базолатеральный - апикальный транспорт В общем, каждое соединение испытывали в 2-4 лунках. Базолатеральная и апикальная лунки содержали 1,55 мл и 0,4 мл ТВ соответственно, и стандартная концентрация испытуемых веществ была равна 10 мкМ. Кроме того, все испытуемые растворы и буферы содержали 1% DMSO. Перед экспериментом планшеты для транспорта предварительно покрывали культуральной средой, содержащей 10% сыворотку в течение 30 мин для того, чтобы избежать неспецифического связывания с пластиковым материалом. Через 21-28 дней в культуре на подложке, являющейся фильтром, клетки были готовыми для экспериментов на проницаемость. Культуральную среду из апикальных лунок удаляли и содержимое переносили в ряд для промывки ( 1) в новый планшет без содержимого (планшет для транспорта). Планшет для транспорта содержал 3 ряда по 4 лунки. Ряд 1 обозначен промывка, ряд 3 представляет собой "экспериментальный ряд". Планшет для транспорта был ранее получен с 1,5 мл ТВ (рН 7,4) в ряду для промывки 1 и с 1,55 мл ТВ (рН 7,4), содержащем испытуемое вещество, в экспериментальном ряду 3 (донорная сторона). 0,5 мл буфера для транспорта (HBSS, 25 мМ MES, рН 6,5) добавляли к содержимому ряда 1 и клеточный монослой приводили в равновесие в буферной системе для транспорта в течение 30 мин при 37 С в polymix встряхивателе. После достижения равновесия с буферной системой значение трансэпителиального электрического сопротивления (TEER) измеряли в каждой лунке EVOM "палочковым" прибо- 28020122 ром. Буфер для транспорта (ТВ, рН 6,5) удаляли с апикальной стороны и содержимое переносили в ряд 3, и 400 мкл свежего ТВ, рН 6,5 добавляли к содержимому. Через 30 мин 250 мкл отбирали из апикальной (получатель) лунки и заменяли свежим буфером для транспорта. Впоследствии, отбирали 250 мкл образцы и заменяли свежим буфером для транспорта каждый 30 мин до конца эксперимента через 120 мин, и наконец, последнюю величину TEER измеряли в конце эксперимента. 25 мкл образцы отбирали из базолатерального (донор) участка через 2 мин и в конце эксперимента. Данные образцы представляют собой донорные образцы в момент начала и конца эксперимента. Ко всем собранным образцам добавляли ацетонитрил до конечной концентрации 50% в образцах. Собранные образцы хранили при -20 С до анализа ВЭЖХ или LC-MS. Вычисления Определение суммарной поглощенной фракции, FAcum, относительно времени. FAcum рассчитывали из: В котором CRi представляет собой концентрацию получателя в конце интервала i, и CDi представляет собой концентрацию донора в начале интервала i. Должно получаться линейное отношение. Определение коэффициентов проницаемости (Рарр см/с) рассчитывали из: В котором к представляет собой скорость транспорта (мин-1), определенную как угол наклона прямой, полученный линейной регрессией суммарной поглощенной фракции (FAcum) в виде функции времени (мин), VR представляет собой объем в камере приемника (мл), и А представляет собой площадь фильтра (см 2). Справочные соединения Большая проницаемость через желудочно-кишечную ткань является предпочтительной, т.к. она допускает применение меньших доз для достижения аналогичных степеней воздействия, как соединения,обладающие меньшей проницаемостью, вводимые в больших дозах. Низкая доза является предпочтительной, т.к. она снижает до минимума стоимость изделия для дневной дозы, что является крайне важным параметром для лекарственного средства, которое применяют в течение продолжительных периодов времени. Соединение примера 2 показывает рарр величину 9,110-6 см/с в Сасо-2 анализе, тогда как соединение примера 2 WO 2008 007107 предшествующего уровня техники показывает рарр величину 2,710-6 см/с при одновременном анализе. В данной системе анализа требующее доказательств соединение N-S)-13aS, 6R, 6aS)-6-метоксиоксодигидро-2 Н-фуро[3,2-b]пиррол-4(5 Н, 6 Н, 6 аН)ил)-4-метилоксопентан-2 ил)-4-(2-(4-метилпиперазин-1-ил)тиазол-4-ил)бензамид предшествующего уровня техники, которое описывается на странице 33 WO 2008/007107 (но чье получение не описано) показывает Рарр величину 0,9 10-6 см/с. В качестве опытного правила, рарр величина в районе 2 представляет собой in vivo поглощение только 10-30%, тогда как pарр величина, достигающая 10, будет, как правило, представлять полное поглощение. Значительные различия в рарр величинах между примером 2 и вышеуказанным примером 2 WO 2008 007107 предшествующего уровня техники хорошо согласуются с in vivo PK экспериментах на мышах,- 29
МПК / Метки
МПК: A61K 31/496, C07D 491/048, A61P 19/00
Метки: ингибиторы, протеаз
Код ссылки
<a href="https://eas.patents.su/30-20122-ingibitory-proteaz.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы протеаз</a>
Предыдущий патент: Ценный документ и способ определения степени загрязнения или изнашивания такого документа
Следующий патент: Способ получения стирола из толуола и метанола
Случайный патент: Состав, содержащий n-алкил триамид тиофосфорной кислоты и его использование


































