Дозированная лекарственная форма для перорального применения, содержащая ингибитор pde 4 в качестве действующего вещества и поливинилпирролидон в качестве вспомогательного вещества
Формула / Реферат
1. Дозированная лекарственная форма в виде таблетки или пеллета, предназначенная для перорального введения в организм ингибитора PDE 4 и содержащая ингибитор PDE 4 совместно с поливинилпирролидоном (ПВП) в качестве связующего и одно или несколько иных приемлемых фармацевтических вспомогательных веществ, в которой ингибитор PDE 4 представляет собой соединение формулы I
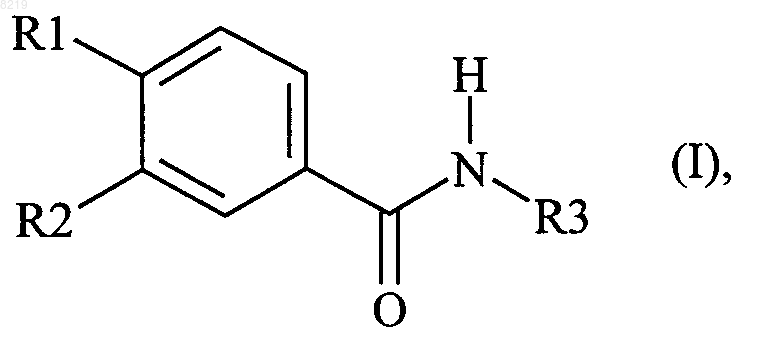
в которой R1 обозначает дифторметоксигруппу,
R2 обозначает циклопропилметоксигруппу и
R3 обозначает 3,5-дихлорпирид-4-ил,
или соли этого соединения либо N-оксид пиридина или его соли.
2. Дозированная лекарственная форма по п.1, в которой ингибитор PDE 4 представляет собой N-(3,5-дихлорпирид-4-ил)-3-циклопропилметокси-4-дифторметоксибензамид (рофлумиласт).
3. Дозированная лекарственная форма по п.1, в которой ингибитор PDE 4 представляет собой N-оксид пиридина соединения формулы I.
4. Дозированная лекарственная форма по п.2, содержащая в разовой дозе от 0,01 до 5 мг рофлумиласта, предпочтительно от 0,05 до 2,5 мг рофлумиласта и наиболее предпочтительно от 0,1 до 0,5 мг рофлумиласта.
5. Дозированная лекарственная форма по п.1, в которой содержание поливинилпирролидона (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 1 до 5%.
6. Дозированная лекарственная форма по п.1, в которой содержание поливинилпирролидона (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 2 до 3%.
7. Дозированная лекарственная форма по п.1, где поливинилпирролидон представляет собой Коллидон 25 (молекулярный вес 28000-34000), Коллидон 30 (молекулярный вес 44000-54000) или Коллидон 90F (молекулярный вес 1000000-1500000).
8. Дозированная лекарственная форма по п.1, в которой фармацевтические вспомогательные вещества представляют собой вспомогательные вещества из группы наполнителей, дополнительных связующих, разрыхлителей для таблеток, смазывающих веществ или антиадгезивов, корригентов, буферных веществ, консервантов, красителей и эмульгаторов.
9. Дозированная лекарственная форма по п.1, в которой содержание (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) связующего (поливинилпирролидона и при необходимости других связующих) составляет от 0,5 до 20%.
10. Дозированная лекарственная форма по п.8, представляющая собой таблетку, в которой содержание наполнителя (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 40 до 99%, предпочтительно от 60 до 97%.
11. Дозированная лекарственная форма по п.8, где наполнитель выбирают из группы, содержащей карбонат кальция, карбонат натрия, сахароспирты, например, такие как маннит, сорбит, ксилит или мальтит, крахмалы, например, такие как кукурузный крахмал, картофельный крахмал или крахмал пшеницы, микрокристаллическая целлюлоза, сахариды, такие как глюкоза, лактоза (например, моногидрат лактозы), левулоза, сахароза, декстроза и их смеси.
12. Дозированная лекарственная форма по п.11, где наполнитель выбирают из группы, содержащей кукурузный крахмал, микрокристаллическую целлюлозу, лактозу и их смеси.
13. Дозированная лекарственная форма по п.8, где смазывающее вещество или антиадгезив выбирают из группы, содержащей натрийстеарилфумарат, стеарат магния, стеарат кальция, стеариновую кислоту, тальк и коллоидный безводный диоксид кремния.
14. Дозированная лекарственная форма по п.1, представляющая собой твердую дозированную лекарственную форму для перорального введения с немедленным высвобождением действующего вещества (твердая оральная дозированная форма с немедленным высвобождением).
15. Дозированная лекарственная форма по п.1, которая представляет собой таблетку.
16. Дозированная лекарственная форма по п.15, в которой фармацевтические вспомогательные вещества представляют собой по меньшей мере один наполнитель и по меньшей мере одно смазывающее вещество или антиадгезив.
17. Дозированная лекарственная форма по п.15, содержащая
| Рофлумиласт | 0,125 мг |
| Моногидрат лактозы | 49,660 мг |
| Кукурузный крахмал | 13,390 мг |
| Поливидон К90 | 1,300 мг |
| Стеарат магтния (растительный) | 0,650 мг. |
18. Дозированная лекарственная форма по п.15, содержащая
| Рофлумиласт | 0,250 мг |
| Моногидрат лактозы | 49,660 мг |
| Кукурузный крахмал | 13,390 мг |
| Поливидон К90 | 1,300 мг |
| Стеарат магния (растительный) | 0,650 мг |
19. Дозированная лекарственная форма по п.15, содержащая
| Рофлумиласт | 0,500 мг |
| Моногидрат лактозы | 49,660 мг |
| Кукурузный крахмал | 13,390 мг |
| Поливидон К90 | 1,300 мг |
| Стеарат магния (растительный) | 0,650 мг |
20. Дозированная лекарственная форма по п.1, содержащая твердый раствор ингибитора PDE4 в связующем ПВП в качестве носителя.
21. Дозированная лекарственная форма по п.20, в которой твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 присутствует в виде молекулярной дисперсии в материале носителя.
22. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что (а) получают смесь ингибитора PDE 4 формулы I по п.1 и фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с водным раствором ПВП.
23. Способ по п.22, дополнительно включающий сушку полученных гранул и необязательно примешивание других фармацевтических вспомогательных веществ, смешение с антиадгезивом и прессование в таблетировочном прессе.
24. Способ по п.22, дополнительно включающий переработку полученного после гранулирования влажного продукта в пеллеты.
25. Способ по п.22, в котором гранулирование проводят в грануляторе с псевдоожиженным слоем в соответствующих условиях.
26. Способ по п.22, в котором на стадии (а) ингибитор PDE4 примешивают к другим фармацевтическим вспомогательным веществам в форме тритурации с фармацевтическим вспомогательным веществом.
27. Способ по п.26, в котором тритурацию получают измельчением ингибитора PDE4 с фармацевтическим вспомогательным веществом.
28. Способ по п.26 или 27, где фармацевтическое вспомогательное вещество представляет собой наполнитель.
29. Способ по п.22, включающий гранулирование смеси (а) ингибитора PDE4 формулы I по п.1 либо тритурации ингибитора PDE4 формулы I по п.1 с кукурузным крахмалом, (б) кукурузного крахмала и (в) моногидрата лактозы с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смесш т таблетировочном прессе.
30. Способ по п.22, включающий гранулирование смеси (а) ингибитора PDE4 формулы I по п.1 либо тритурации ингибитора PDE4 формулы I по п.1 с кукурузным крахмалом, (б) кукурузного крахмала, (в) микрокристаллической целлюлозы и (г) натрийкарбоксиметилкрахмала с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смеси в таблетировочном прессе.
31. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что (а) получают смесь фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с суспензией ингибитора PDE4 формулы I по п.1 в водном растворе ПВП.
32. Способ по п.31, включающий гранулировании смеси кукурузного крахмала и моногидрата лактозы совместно с суспензией ингибитора PDE4 формулы I по п.1 в водном растворе ПВП, сушку полученных гранул, смешение гранул с антиадгезивом и прессование полученной смеси в таблетировочном прессе.
33. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что получают твердый раствор ПВП и ингибитора PDE 4 формулы I по п.1.
34. Способ по п.33, в котором твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 формулы I по п.1 присутствует в виде молекулярной дисперсии в поливинилпирролидоне.
35. Способ по п.33, в котором твердый раствор получают с использованием основанного на использовании растворителя метода, заключающегося в растворении поливинилпирролидона, ингибитора PDE4 и при необходимости других фармацевтических вспомогательных веществ в приемлемом растворителе с последующим удалением растворителя путем распылительной сушки, обычной сушки, вакуумнойсушки или сушки вымораживанием.
36. Способ по п.33, в котором твердый раствор получают основанным на смешении методом, заключающемся в смешении ингибитора PDE4 и при необходимости других вспомогательных веществ с ПВП и их интенсивном перемешивании.
37. Способ получения дозированной лекарственной формы по п.1, включающий стадии: (а) получение содержащего действующее вещество материала в виде твердого раствора ингибитора PDE4 формулы I по п.1 в поливинилпирролидоне, (б) получение смеси содержащего действующее вещество материала и фармацевтических вспомогательных веществ и (в) гранулирование полученной на стадии (б) смеси с водным раствором поливинилпирролидона.
38. Способ по п.37, предназначенный для получения дозированной формы в виде таблетки, согласно которому влажные гранулы, полученные на стадии (в), сушат, смешивают со смазывающим веществом или антиадгезивом и прессуют в таблетировочном прессе.
39. Способ по п.37, предназначенный для получения дозированной формы в виде пеллет, согласно которому влажные гранулы, полученные на стадии (в), перерабатывают в соответствующие пеллеты путем экструдирования/сфероидизации.
40. Способ по п.37, предназначенный для получения дозированной формы в виде пеллет, согласно которому содержащий действующее вещество материал, представляющий собой твердый раствор ингибитора PDE4 в поливинилпирролидоне, наносят из дисперсии/суспензии в приемлемом растворителе на имеющие форму пеллетов носители.
41. Способ по п.40, где имеющие форму пеллетов носители представляют собой нонпарели или содержащие ГПМЦ пеллеты.
42. Применение соединения формулы I, представленной в п.1, для получения дозированной формы по п.1, предназначенной для лечения или профилактики заболеваний, для лечения и предотвращения которых показано применение ингибиторов PDE4.
43. Применение по п.42, согласно которому заболевания представляют собой астму или обструкцию дыхательных путей.
44. Применение по п.42, согласно которому заболевание представляет собой хроническое обструктивное заболевание легких (ХОЗЛ).
Текст
008219 Область техники, к которой относится изобретение Настоящее изобретение относится к области фармацевтической технологии и, в частности, к дозированной лекарственной форме в виде таблетки или пеллета, предназначенной для перорального введения в организм ингибитора PDE 4 в качестве действующего вещества при лечении таких заболеваний,как астма или обструкция дыхательных путей. Изобретение относится также к способу получения такой дозированной лекарственной формы. Уровень техники Ингибиторы циклонуклеотид-фосфодиэстеразы (PDE) (прежде всего типа 4) на сегодняшний день представляют особый интерес в качестве нового поколения действующих веществ, пригодных для лечения воспалительных заболеваний, прежде всего воспалений дыхательных путей, в частности астмы или обструкции дыхательных путей (например хронического обструктивного заболевания легких (ХОЗЛ. В настоящее время большое число ингибиторов PDE 4 успешно проходят клинические испытания. В заявках WO 00/50011 и WO 01/32165, которые относятся к дозированным лекарственным формам с контролируемым или замедленным высвобождением ингибитора PDE 4, отмечается, что некоторые ингибиторы PDE 4, такие как Ariflo (международное непатентованное название (МНН) циломиласт),при их поступлении в организм в высоких дозах неожиданно могут оказывать побочное действие на ЦНС. В указанных заявках WO 00/50011 и WO 01/32165 данный факт рассматривается как особый риск,связанный с применением дозированных лекарственных форм с немедленным высвобождением действующего вещества, и поэтому ингибитор PDE 4 Ariflo (МНН циломиласт) предлагается вводить в организм в дозированных лекарственных формах с контролируемым или замедленным его высвобождением. В патенте US 5286494 предложена дозированная лекарственная форма для слаборастворимого ингибитора PDE 4 ролипрама с контролируемым или замедленным его высвобождением. Однако процесс изготовления дозированных лекарственных форм с контролируемым или замедленным высвобождением слаборастворимых действующих веществ может быть сопряжен со сложностями технического и технологического характера, о чем говорится, например, в указанном патенте US 5286494. Действующие вещества из класса ингибиторов PDE 4 могут в зависимости от их химической структуры обладать низкой растворимостью в воде и водных системах. Так, в частности, установленная растворимость в воде ингибитора PDE 4 N-(3,5-дихлорпирид-4-ил)-3-циклопропилметокси-4 дифторметоксибензамида (МНН рофлумиласт), который описан в WO 95/01338, составляет лишь 0,53 мг/л при 21 С. Однако биодоступность лекарственного вещества в существенной степени зависит от скорости его высвобождения из фармацевтической лекарственной формы. Чем выше скорость высвобождения лекарственного вещества из препарата и его растворения, тем быстрее происходит его всасывание. Следовательно, биодоступность слаборастворимых в воде лекарственных веществ часто ограничена их растворимостью или скоростью растворения. Этим фактором объясняются значительные трудности,связанные с изготовлением соответствующих дозированных лекарственных форм. Сущность изобретения В настоящем изобретении предлагается дозированная лекарственная форма в виде таблетки или пеллета, предназначенная для перорального введения в организм ингибитора PDE 4 и содержащая ингибитор PDE 4 совместно с поливинилпирролидоном (ПВП) в качестве связующего и одно или несколько иных приемлемых фармацевтических вспомогательных веществ, в которой ингибитор PDE 4 представляет собой соединение формулы IR3 обозначает 3,5-дихлорпирид-4-ил,или соли этого соединения либо N-оксид пиридина или его соли. При этом ингибитор PDE 4 представляет собой N-(3,5-дихлорпирид-4-ил)-3-циклопропилметокси 4-дифторметоксибензамид (рофлумиласт) или N-оксид пиридина соединения формулы I. Предлагаемая дозированная лекарственная форма содержит в разовой дозе от 0,01 г до 5 мг рофлумиласта, предпочтительно от 0,05 до 2,5 мг рофлумиласта и наиболее предпочтительно от 0,1 до 0,5 мг рофлумиласта, а содержание поливинилпирролидона (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 1 до 5%, предпочтительно от 2 до 3%. Поливинилпирролидон представляет собой Коллидон 25 (молекулярный вес 28000-34000), Коллидон 30 (молекулярный вес 44000-54000) или Коллидон 90F (молекулярный вес 1000000-1500000).-1 008219 Фармацевтические вспомогательные вещества представляют собой вспомогательные вещества из группы наполнителей, дополнительных связующих, разрыхлителей для таблеток, смазывающих веществ или антиадгезивов, корригентов, буферных веществ, консервантов, красителей и эмульгаторов. В предлагаемой дозированной лекарственной форме содержание (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) связующего (поливинилпирролидона и при необходимости других связующих) составляет от 0,5 до 20%. В том случае, если дозированная лекарственная форма представляет собой таблетку, то содержание наполнителя (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 40 до 99%, предпочтительно от 60 до 97%, при этом наполнитель выбирают из группы, содержащей карбонат кальция, карбонат натрия, сахароспирты, например, такие как маннит,сорбит, ксилит или мальтит, крахмалы, например, такие как кукурузный крахмал, картофельный крахмал или крахмал пшеницы, микрокристаллическая целлюлоза, сахариды, такие как глюкоза, лактоза (например, моногидрат лактозы), левулоза, сахароза, декстроза и их смеси, предпочтительно наполнитель выбирают из группы, содержащей кукурузный крахмал, микрокристаллическую целлюлозу, лактозу и их смеси. Смазывающее вещество или антиадгезив выбирают из группы, содержащей натрийстеарилфумарат,стеарат магния, стеарат кальция, стеариновую кислоту, тальк и коллоидный безводный диоксид кремния. Предлагаемая дозированная лекарственная форма представляет собой твердую дозированную лекарственную форму для перорального введения с немедленным высвобождением действующего вещества (твердая оральная дозированная форма с немедленным высвобождением), например таблетку, в которой фармацевтические вспомогательные вещества представляют собой по меньшей мере один наполнитель и по меньшей мере одно смазывающее вещество или антиадгезив. Предпочтительно таблетка содержит 1. Рофлумиласт 0,125 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг. Еще более предпочтительно таблетка содержит 1. Рофлумиласт 0,500 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг. Дозированная лекарственная форма содержит твердый раствор ингибитора PDE4 в связующем ПВП в качестве носителя, где твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 присутствует в виде молекулярной дисперсии в материале носителя. Также предлагается способ получения описанной выше дозированной лекарственной формы, заключающийся в том, что (а) получают смесь ингибитора PDE 4 формулы I по п.1 и фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с водным раствором ПВП. Указанный способ дополнительно может включать сушку полученных гранул и необязательно примешивание других фармацевтических вспомогательных веществ, смешение с антиадгезивом и прессование в таблетировочном прессе. Кроме того, описанный способ может дополнительно включать переработку полученного после гранулирования влажного продукта в пеллеты. Гранулирование проводят в грануляторе с псевдоожиженным слоем в соответствующих условиях. На стадии (а) ингибитор PDE4 примешивают к другим фармацевтическим вспомогательным веществам в форме тритурации с фармацевтическим вспомогательным веществом, где тритурацию получают измельчением ингибитора PDE4 с фармацевтическим вспомогательным веществом. Фармацевтическое вспомогательное вещество представляет собой наполнитель. Предпочтительно способ включает гранулирование смеси (а) ингибитора PDE4 формулы I либо тритурации ингибитора PDE4 формулы I с кукурузным крахмалом, (б) кукурузного крахмала и (в) моногидрата лактозы с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смеси в таблетировочном прессе. Еще более предпочтительно способ включает гранулирование смеси (а) ингибитора PDE4 формулыI либо тритурации ингибитора PDE4 формулы I с кукурузным крахмалом, (б) кукурузного крахмала, (в) микрокристаллической целлюлозы и (г) натрийкарбоксиметилкрахмала с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смеси в таблетировочном прессе. В настоящем изобретении описывается также способ получения дозированной лекарственной формы, заключающийся в том, что (а) получают смесь фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с суспензией ингибитора PDE4 формулы I в водном растворе ПВП.-2 008219 Предпочтительно способ включает гранулирование смеси кукурузного крахмала и моногидрата лактозы совместно с суспензией ингибитора PDE4 формулы I в водном растворе ПВП, сушку полученных гранул, смешение гранул с антиадгезивом и прессование полученной смеси в таблетировочном прессе. Еще один способ получения дозированной лекарственной формы заключается в том, что получают твердый раствор ПВП и ингибитора PDE 4 формулы I. Твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 формулы I присутствует в виде молекулярной дисперсии в поливинилпирролидоне и его получают с использованием основанного на использовании растворителя метода, заключающегося в растворении поливинилпирролидона, ингибитора PDE4 и при необходимости других фармацевтических вспомогательных веществ в приемлемом растворителе с последующим удалением растворителя путем распылительной сушки, обычной сушки, вакуумной сушки или сушки вымораживанием. Альтернативно твердый раствор получают основанным на смешении методом, заключающимся в смешении ингибитора PDE4 и при необходимости других вспомогательных веществ с ПВП и их интенсивном перемешивании. В настоящем изобретении описывается еще один способ получения дозированной лекарственной формы, включающий стадии (а) получения содержащего действующее вещество материала в виде твердого раствора ингибитора PDE4 формулы I по п.1 в поливинилпирролидоне, (б) получения смеси содержащего действующее вещество материала и фармацевтических вспомогательных веществ и (в) гранулировании полученной на стадии (б) смеси с водным раствором поливинилпирролидона. Если указанный способ предназначен для получения дозированной формы в виде таблетки, то влажные гранулы, полученные на стадии (в), сушат, смешивают с со смазывающим веществом или антиадгезивом и прессуют в таблетировочном прессе. Если указанный способ предназначен для получения дозированной формы в виде пеллета, то влажные гранулы, полученные на стадии (в), перерабатывают в соответствующие пеллеты путем экструдирования/сфероидизации. При этом содержащий действующее вещество материал представляет собой твердый раствор ингибитора PDE4 в поливинилпирролидоне, который наносят из дисперсии/суспензии в приемлемом растворителе на имеющие форму пеллетов носители, а имеющие форму пеллетов носители представляют собой нонпарели или содержащие ГПМЦ пеллеты. В настоящем изобретении также описано применение соединения формулы I для получения дозированной формы, предназначенной для лечения или профилактики заболеваний, для лечения и предотвращения которых показано применение ингибиторов PDE4, таких как астма, обструкция дыхательных путей или хроническое обструктивное заболевание легких (ХОЗЛ). Подробное описание изобретения В основу настоящего изобретения была положена задача предложить дозированную лекарственную форму для перорального введения в организм слаборастворимых ингибиторов PDE 4, которая допускала бы возможность ее изготовления способом, не связанным со значительными сложностями технического и технологического характера, и которая позволяла бы учесть низкую растворимость слаборастворимого ингибитора PDE 4 и обеспечивала бы быструю, приемлемую биодоступность слаборастворимого ингибитора PDE 4 и тем самым повышение его концентрации в сыворотке до уровня, необходимого для быстрого достижения требуемого фармакологического эффекта без проявления побочных действий. Согласно изобретению неожиданно было установлено, что в отношении дозированной лекарственной формы для перорального введения в организм слаборастворимого ингибитора PDE 4 указанную задачу удается решить за счет использования в ней поливинилпирролидона (ПВП) в качестве связующего. По сравнению с дозированными лекарственными формами, в которых ПВП не используется в качестве связующего, предлагаемая в изобретении дозированная лекарственная форма обладает явно более высокими фармакокинетическими свойствами. Так, в частности, с точки зрения биодоступности слаборастворимого ингибитора PDE 4 при применении предлагаемых в изобретении дозированных лекарственных форм наблюдается более быстрое всасывание лекарственного вещества и тем самым более быстрое проявление фармакологического эффекта по сравнению с дозированными лекарственными формами без ПВП. Предлагаемая в изобретении дозированная лекарственная форма для перорального применения предпочтительно представляет собой твердую дозированную лекарственную форму в виде таблетки или пеллета. Предпочтительна при этом твердая дозированная лекарственная форма для перорального применения с немедленным высвобождением действующего вещества. В соответствии с этим описывается дозированная лекарственная форма в виде таблетки или пеллета, предназначенная для перорального введения в организм слаборастворимого ингибитора PDE 4 и содержащая слаборастворимый ингибитор PDE 4 совместно с поливинилпирролидоном в качестве связующего и одно или несколько иных приемлемых фармацевтических вспомогательных веществ (эксципиентов). Слаборастворимый ингибитор PDE 4 предпочтительно представляет собой соединение из группы соединений формулы IR2 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, либоR1 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, аR2 обозначает С 3-С 7 циклоалкилметоксигруппу или бензилоксигруппу иR31 обозначает гидроксил, галоген, цианогруппу, карбоксил, трифторметил, С 1-С 4 алкил, С 1 С 4 алкоксигруппу, С 1 -С 4 алкоксикарбонил, С 1-С 4 алкилкарбонил, С 1-С 4 алкилкарбонилоксигруппу, аминогруппу, моно- либо ди-С 1-С 4 алкиламиногруппу или С 1-С 4 алкилкарбониламиногруппу,R32 обозначает водород, гидроксил, галоген, аминогруппу, трифторметил, С 1-С 4 алкил или С 1 С 4 алкоксигруппу,R33 обозначает водород, галоген, С 1-С 4 алкил или С 1-С 4 алкоксигруппу,R34 обозначает гидроксил, галоген, цианогруппу, карбоксил, С 1-С 4 алкил, С 1-С 4 алкоксигруппу, С 1 С 4 алкоксикарбонил или аминогруппу,R35 обозначает водород, галоген, аминогруппу или С 1-С 4 алкил,R36 обозначает водород или галоген иR37 обозначает водород или галоген, соли этих соединений и N-оксиды пиридинов и их соли. С 3-С 7 циклоалкоксигруппа представляет собой, например, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу и циклогептилоксигруппу, среди которых предпочтительны циклопропилоксигруппа, циклобутилоксигруппа и циклопентилоксигруппа. С 3-С 7 циклоалкилметоксигруппа представляет собой, например, циклопропилметоксигруппу, циклобутилметоксигруппу, циклопентилметоксигруппу, циклогексилметоксигруппу и циклогептилметоксигруппу, среди которых предпочтительны циклопропилметоксигруппа, циклобутилметоксигруппа и циклопентилметоксигруппа. В качестве примеров С 1-С 4 алкоксигруппы, которая полностью или частично замещена фтором,можно назвать 1,2,2-трифторэтокси-, 2,2,3,3,3-пентафторпропокси-, перфторэтокси- и, в частности,1,1,2,2-тетрафторэтокси-, трифторметокси-, 2,2,2-трифторэтокси- и дифторметоксиостатки. Под галогеном подразумеваются бром, хлор и фтор. Под С 1-С 4 алкилом подразумеваются алкильные остатки с прямой или разветвленной цепью, содержащие от 1 до 4 атомов углерода. В качестве их примеров можно назвать бутильные, изобутильные,втор-бутильные, трет-бутильные, пропильные, изопропильные, этильные и метильные остатки. С 1-С 4 алкоксигруппа представляет собой остаток, который помимо атома кислорода содержит один из вышеуказанных С 1-С 4 алкильных остатков. В качестве примеров при этом можно назвать метокси- и этоксиостатки. С 1-С 4 алкоксикарбонил представляет собой карбонильную группу, к которой присоединен один из вышеуказанных С 1-С 4 алкоксиостатков. В качестве примеров при этом можно назвать метоксикарбонильный (СН 3 О-СО-) и этоксикарбонильный (СН 3 СН 2 О-СО-) остатки. С 1-С 4 алкилкарбонил представляет собой карбонильную группу, к которой присоединен один из вышеуказанных С 1-С 4 алкильных остатков. В качестве примера при этом можно назвать ацетильный остаток (СН 3 СО-). С 1-С 4 алкилкарбонилоксиостатки помимо атома кислорода содержат один из вышеуказанных С 1 С 4 алкилкарбонильных остатков. В качестве примера при этом можно назвать ацетоксиостаток (СН 3 СО-О-). В качестве примеров моно- либо ди-С 1-С 4 алкиламиноостатков можно назвать метиламино-, диметиламино- и диэтиламиноостатки. Примером С 1-С 4 алкилкарбониламиноостатка служит ацетиламиноостаток (-NH-CO-СН 3). В качестве примеров фенильных остатков, замещенных заместителями R31, R32 и R33, можно назвать такие остатки, как 2-ацетилфенил, 2-аминофенил, 2-бромфенил, 2-хлорфенил, 2,3-дихлорфенил,2,4-дихлорфенил, 4-диэтиламино-2-метилфенил, 4-бром-2-трифторметилфенил, 2-карбокси-5-хлорфенил,3,5-дихлор-2-гидроксифенил, 2-бром-4-карбокси-5-гидроксифенил, 2,6-дихлорфенил, 2,5-дихлорфенил,2,4,6-трихлорфенил, 2,4,6-трифторфенил, 2,6-дибромфенил, 2-цианофенил, 4-циано-2-фторфенил, 2 фторфенил, 2,4-дифторфенил, 2,6-дифторфенил, 2-хлор-6-фторфенил, 2-гидроксифенил, 2-гидрокси-4 метоксифенил, 2,4-дигидроксифенил, 2-метоксифенил, 2,3-диметоксифенил, 2,4-диметоксифенил, 2,6 диметоксифенил, 2-диметиламинофенил, 2-метилфенил, 2-хлор-6-метилфенил, 2,4-диметилфенил, 2,6 диметилфенил, 2,3-диметилфенил, 2-метоксикарбонилфенил, 2-трифторметилфенил, 2,6-дихлор-4-4 008219 метоксифенил,2,6-дихлор-4-цианофенил,2,6-дихлор-4-аминофенил,2,6-дихлор-4-метоксикарбонилфенил, 4-ацетиламино-2,6-дихлорфенил и 2,6-дихлор-4-этоксикарбонилфенил. В качестве примеров пиридильных остатков, замещенных заместителями R34, R35, R36 и R37,можно назвать такие остатки, как 3,5-дихлорпирид-4-ил, 2,6-диаминопирид-3-ил, 4-аминопирид-3-ил, 3 метилпирид-2-ил, 4-метилпирид-2-ил, 5-гидроксипирид-2-ил, 4-хлорпирид-3-ил, 3-хлорпирид-2-ил, 3 хлорпирид-4-ил, 2-хлорпирид-3-ил, 2,3,5,6-тетрафторпирид-4-ил, 3,5-дихлор-2,6-дифторпирид-4-ил, 3,5 дибромпирид-2-ил, 3,5-дибромпирид-4-ил, 3,5-дихлорпирид-4-ил, 2,6-дихлорпирид-3-ил, 3,5-диметилпирид-4-ил, 3-хлор-2,5,6-трифторпирид-4-ил и 2,3,5-трифторпирид-4-ил. К солям, которые могут образовывать соединения формулы I, относятся в зависимости от их замещения все возможные кислотно-аддитивные соли, но прежде всего все возможные соли с основаниями. Особо при этом можно назвать фармакологически приемлемые соли с неорганическими и органическими кислотами и основаниями, обычно используемыми в фармацевтической технологии. Фармакологически неприемлемые соли, которые могут образоваться, например, в качестве первоначальных продуктов при получении соединений по изобретению в промышленном масштабе, известными методами переводят или превращают в их фармакологически приемлемые соли. К соответствующим фармакологически приемлемым солям, во-первых, относятся водорастворимые и водонерастворимые кислотно-аддитивные соли, образованные, например, с такими кислотами, как соляная кислота, бромисто-водородная кислота,фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4-гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 1-гидрокси-2-нафтойная кислота, при этом кислоты используют для солеобразования в эквимолярных количествах либо в отличающихся от них количествах в зависимости от того, является ли кислота одно- или многоосновной, а также в зависимости от конкретного типа соли, которую требуется получить. К соответствующим фармакологически приемлемым солям, во-вторых, относятся также образованные с основаниями соли, которые являются наиболее предпочтительными. В качестве примера подобных основных солей можно назвать соли лития, натрия, калия, кальция, алюминия, магния, титана, аммония,меглумина или гуанидиния, при этом такие основания также используют для солеобразования в эквимолярных количествах либо в отличающихся от них количествах. К предпочтительным соединениям формулы I относятся соединения, в которыхR2 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, либоR1 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, аR2 обозначает С 3-С 5 циклоалкилметоксигруппу или бензилоксигруппу иR31 обозначает галоген, цианогруппу, карбоксил, С 1-С 4 алкил, С 1-С 4 алкоксигруппу или С 1 С 4 алкоксикарбонил,R32 обозначает водород, галоген, С 1-С 4 алкил или С 1-С 4 алкоксигруппу,R33 обозначает водород, галоген, С 1-С 4 алкил или С 1-С 4 алкоксигруппу,R34 обозначает галоген или С 1-С 4 алкил,R35 обозначает водород или галоген,R36 обозначает водород или галоген иR37 обозначает водород или галоген, соли этих соединений, а также N-оксиды пиридинов и их соли. К более предпочтительным соединениям формулы I относятся соединения, в которыхR2 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, либоR1 обозначает С 1-С 4 алкоксигруппу, которая полностью или частично замещена фтором, аR2 обозначает С 3-С 5 циклоалкилметоксигруппу или бензилоксигруппу иR3 обозначает 2-бромфенил, 2,6-дихлор-4-этоксикарбонилфенил, 2,6-диметоксифенил, 4-циано-2 фторфенил, 2,4,6-трифторфенил, 2-хлор-6-метилфенил, 2,6-диметилфенил, 2,6-дифторфенил, 2,6 дихлорфенил, 3,5-дихлорпирид-4-ил, 3-метилпирид-2-ил, 2-хлорпирид-3-ил, 3,5-дибромпирид-2-ил,2,3,5,6-тетрафторпирид-4-ил, 3-хлор-2,5,6-трифторпирид-4-ил, 3,5-дихлор-2,6-дифторпирид-4-ил или 2,6 дихлорпирид-3-ил,соли этих соединений, а также N-оксиды пиридинов и их соли. К наиболее предпочтительным соединениям формулы I относятся соединения, в которыхR3 обозначает 2-бромфенил, 2,6-дихлор-4-этоксикарбонилфенил, 2,6-диметоксифенил, 4-циано-2 фторфенил, 2,4,6-трифторфенил, 2-хлор-6-метилфенил, 2,6-диметилфенил, 2,6-дифторфенил, 2,6-5 008219 дихлорфенил, 3,5-дихлорпирид-4-ил, 3-метилпирид-2-ил, 2-хлорпирид-3-ил, 3,5-дибромпирид-2-ил,2,3,5,6-тетрафторпирид-4-ил, 3-хлор-2,5,6-трифторпирид-4-ил, 3,5-дихлор-2,6-дифторпирид-4-ил или 2,6 дихлорпирид-3-ил, соли этих соединений, а также N-оксиды пиридинов и их соли. Особо предпочтительным соединением формулы I является соединение, в которомR3 обозначает 3,5-дихлорпирид-4-ил,соли этого соединения, а также N-оксид пиридина и его соли. Химическое название этого соединения звучит какPDE 4 предпочтительно представляет собой ингибитор PDE 4, растворимость которого в воде при температуре от 15 до 25 С, в частности при 21 С, меньше или равна 100 мг/л, прежде всего меньше или равна 1 мг/л. Подобное соединение наиболее предпочтительно является одним из соединений формулы I. Указанные выше соединения формулы I и их применение в качестве ингибиторов фосфодиэстеразы(PDE) типа 4 описаны в заявке WO 95/01338. К числу других приемлемых фармацевтических вспомогательных веществ, которые могут использоваться в предлагаемой в изобретении дозированной лекарственной форме, относятся такие фармацевтические вспомогательные вещества, как наполнители, дополнительные связующие, разрыхлители для таблеток или же смазывающие вещества и антиадгезивы. В качестве примера других приемлемых вспомогательных веществ, которые можно включать в состав предлагаемой в изобретении дозированной лекарственной формы, можно назвать корригенты (такие как ароматизаторы и подслащивающие вещества),буферные вещества, консерванты, красители (такие как желтый или красный оксид железа) или же эмульгаторы. Ароматизаторы обычно добавляют в количестве от 0,05 до 1 мас.%. Другими примерами корригентов, которые добавляют для получения требуемого результата, являются кислоты, такие как лимонная кислота, подслащивающие вещества, такие как сахарин, аспартам, цикламат натрия или мальтол. Применяемый поливинилпирролидон (ПВП) представляет собой, в частности, водорастворимый ПВП со средней молекулярной массой более 2000, предпочтительно боле 20000. В качестве примеров при этом можно назвать коллидон 12 PF (молекулярная масса 2000-3000), коллидон 17 PF (молекулярная масса 7000-11000), коллидон 25 (молекулярная масса 28000-34000), коллидон 30 (молекулярная масса 44000-54000), коллидон 90 F (молекулярная масса 1000000-1500000). Предпочтительны ПВП с высокой молекулярной массой, такие, например, как коллидон 25, коллидон 30 и коллидон 90 F. В дополнение к ПВП при необходимости можно использовать и иные связующие, такие как поливинилацетат (например Kollidon VA 64), желатин, растительный клей на основе кукурузного крахмала,предварительно набухшие крахмалы (Starch 1500), гидроксипропилметилцеллюлозу (ГПМЦ) или гидроксипропилцеллюлозу (L-ГПЦ). К пригодным для применения наполнителям относятся такие наполнители, как карбонат кальция(например MagGran CC или Destab 95) и карбонат натрия, сахароспирты, в частности маннит (например Perlitol или Parteck M), сорбит (например Karion), ксилит или мальтит, крахмалы, в частности кукурузный крахмал, картофельный крахмал и крахмал пшеницы, микрокристаллическая целлюлоза,сахариды, в частности глюкоза, лактоза (например моногидрат лактозы), левулоза, сахароза и декстроза. Указанные наполнители при необходимости можно использовать и в различных смесях между собой. Кукурузный крахмал, микрокристаллическая целлюлоза и лактоза являются предпочтительными наполнителями. В качестве примера приемлемых смазывающих веществ и антиадгезивов можно назвать натрийстеарилфумарат, стеарат магния, стеарат кальция, стеариновую кислоту, тальк и коллоидный безводный диоксид кремния (аэросил). К пригодным для применения разрыхлителям относятся, в частности, нерастворимый поливинилпирролидон (нерастворимый ПВП, кросповидон), натрийкарбоксиметилкрахмал (натрийкрахмалгликолят), натрийкарбоксиметилцеллюлоза, альгиновая кислота, а также крахмалы, способные выполнять функцию разрыхлителя (например Starch 1500). Содержание ингибитора PDE 4 (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) в предлагаемой в изобретении дозированной лекарственной форме в зависимости от природы ингибитора PDE 4 обычно составляет от 0,01 до 50 мас.%. Предпочтительное содержание ингибитора PDE 4 в дозированной лекарственной форме составляет до 20 мас.%. Содержание связующего (ПВП и при необходимости других связующих) (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) согласно изобретению предпочтительно составляет от 0,5 до 20 мас.%. Предпочтительное содержание ПВП в дозированной лекарственной форме составляет от 1 до 5 мас.%, наиболее предпочтительно от 2 до 3 мас.%. Содержание наполнителя (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) в предлагаемой в изобретении таблетке преимущественно составляет от 40 до 99-6 008219 мас.%. Предпочтительное содержание наполнителя в дозированной лекарственной форме составляет от 60 до 97 мас.%. Содержание разрыхлителя (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) в быстро распадающейся таблетке обычно может достигать 35 мас.%. Предпочтительное содержание разрыхлителя в дозированной лекарственной форме составляет от 2 до 20 мас.%. Наиболее предпочтительное содержание разрыхлителя в дозированной лекарственной форме составляет от 5 до 10 мас.%. Содержание смазывающего вещества или антиадгезива (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) в быстро распадающейся таблетке обычно составляет от 0,1 до 5 мас.%. Предпочтительное содержание смазывающего вещества или антиадгезива в дозированной лекарственной форме составляет от 0,3 до 3 мас.%. Наиболее предпочтительное содержание смазывающего вещества или антиадгезива в дозированной лекарственной форме составляет от 0,5 до 2 мас.%. В одном из предпочтительных вариантов осуществления изобретения предлагаемая в нем дозированная лекарственная форма представляет собой таблетку. В этом случае в состав такой таблетки помимо слаборастворимого ингибитора PDE 4 и ПВП предпочтительно включать также в качестве других фармацевтических вспомогательных веществ по меньшей мере один наполнитель и по меньшей мере одно смазывающее вещество или антиадгезив. Предлагаемый в изобретении фармацевтический препарат можно получать методами, известными по их применению при производстве таблеток и пеллетов. В одном из вариантов осуществления изобретения предлагаемую в нем лекарственную форму изготавливают получением твердого раствора слаборастворимого ингибитора PDE 4 в связующем ПВП в качестве носителя. Для получения такого раствора можно использовать, например, основанный на применении растворителя метод, заключающийся в растворении ПВП, ингибитора PDE 4 и при необходимости других фармацевтических вспомогательных веществ в приемлемом растворителе с последующим удалением растворителя путем распылительной сушки, обычной сушки, вакуумной сушки или сушки вымораживанием. Согласно изобретению неожиданно было установлено, что указанный твердый раствор можно также получать основанным на смешении методом, заключающимся в смешении слаборастворимого ингибитора PDE 4 и при необходимости других фармацевтически вспомогательных веществ с ПВП и их интенсивном перемешивании. Настоящее изобретение относится также к твердому раствору слаборастворимого ингибитора PDE 4 в связующем ПВП в качестве носителя. Под твердым раствором ингибитора PDE 4 в связующем ПВП в качестве носителя в контексте настоящего изобретения подразумевается твердый раствор с аморфной структурой, в которой ингибитор PDE 4 присутствует в виде молекулярной дисперсии в материале носителя. Твердый раствор в случае его дальнейшей переработки в таблетки или пеллеты можно известными специалистам методами перерабатывать в качестве ингредиента, представляющего собой действующее вещество, совместно с другими ингредиентами, к которым относятся наполнители, связующие, разрыхлители и смазывающие вещества, в предлагаемые в изобретении дозированные лекарственные формы для перорального применения. В соответствии с этим изобретение относится также к способу получения дозированной лекарственной формы в виде таблетки или пеллета, предназначенной для перорального введения в организм ингибитора PDE 4, заключающемуся в том, что (а) получают содержащий действующее вещество материал в виде твердого раствора слаборастворимого ингибитора PDE 4 в ПВП, (б) получают смесь содержащего действующее вещество материала и фармацевтических вспомогательных веществ и (в) полученную на стадии (б) смесь гранулируют с водным раствором ПВП. Если предлагаемые в изобретении дозированные лекарственные формы представляют собой таблетки, то полученные на стадии (в) гранулы можно после их сушки и смешения со смазывающими веществами или антиадгезивами подвергать прессованию в таблетировочном прессе. Если предлагаемые в изобретении дозированные лекарственные формы представляют собой пеллеты, то полученные на стадии (в) влажные гранулы можно перерабатывать в соответствующие пеллеты путем экструдирования/сфероидизации. В другом варианте содержащий действующее вещество материал, представляющий собой твердый раствор слаборастворимого ингибитора PDE 4 в ПВП, можно наносить из дисперсий/суспензий в приемлемом растворителе на имеющие форму пеллетов носители (например нонпарели или содержащие ГПМЦ пеллеты). В следующем предпочтительном варианте осуществления изобретения предлагаемую в нем дозированную лекарственную форму получают гранулированием смеси, содержащей действующее вещество и фармацевтические вспомогательные вещества, с водным раствором ПВП, сушкой полученных гранул и при необходимости примешиванием других фармацевтических вспомогательных веществ. Полученный после гранулирования влажный продукт можно затем подвергать дальнейшей переработке в пеллеты и после этого расфасовывать в капсулы. Высушенные гранулы, при необходимости после примешивания к ним других фармацевтических вспомогательных веществ, можно после смешения с антиадгезивом прес-7 008219 совать в таблетировочном прессе. Процесс гранулирования предпочтительно проводить в грануляторе с псевдоожиженным слоем в соответствующих условиях. Помимо этого действующее вещество при необходимости можно примешивать к другим фармацевтическим вспомогательным веществам в виде порошка (тритурации), полученного растиранием с фармацевтическим вспомогательным веществом (прежде всего с наполнителем). Подобный подход наиболее предпочтительно использовать в тех случаях, когда содержание действующего вещества в дозированной лекарственной форме должно составлять менее 5 мас.%. Подобную тритурацию обычно можно получать измельчением действующего вещества совместно с фармацевтическим вспомогательным веществом (прежде всего с наполнителем). В соответствии с этим изобретение относится также к способу получения дозированной лекарственной формы в виде таблетки или пеллета, предназначенной для перорального введения в организм ингибитора PDE 4, заключающемуся в том, что а) приготавливают смесь действующего вещества и фармацевтических вспомогательных веществ и б) полученную на стадии а) смесь гранулируют с водным раствором ПВП. Предлагаемую в изобретении дозированную лекарственную форму наиболее предпочтительно получать гранулированием смеси из(а) слаборастворимого ингибитора PDE 4 либо тритурации слаборастворимого ингибитора PDE 4 с кукурузным крахмалом,(б) кукурузного крахмала и(в) моногидрата лактозы с водным раствором ПВП, сушкой полученных гранул, их смешением с антиадгезивом и прессованием полученной смеси в таблетировочном прессе. Слаборастворимым ингибитором PDE 4 в этом случае наиболее предпочтительно является рофлумиласт, одна из его солей, N-оксид пиридина или одна из его солей. В другом варианте предлагаемую в изобретении дозированную лекарственную форму наиболее предпочтительно получать гранулированием смеси из(а) слаборастворимого ингибитора PDE 4 либо тритурации слаборастворимого ингибитора PDE 4 с кукурузным крахмалом,(б) кукурузного крахмала,(в) микрокристаллической целлюлозы и(г) натрийкарбоксиметилкрахмала с водным раствором ПВП, сушкой полученных гранул, их смешением с антиадгезивом и прессованием полученной смеси в таблетировочном прессе. Слаборастворимым ингибитором PDE 4 в этом случае наиболее предпочтительно является рофлумиласт, одна из его солей, N-оксид пиридина или одна из его солей. В другом предпочтительном варианте осуществления изобретения предлагаемую в нем дозированную лекарственную форму получают гранулированием смеси фармацевтических вспомогательных веществ с суспензией действующего вещества в водном растворе ПВП, сушкой полученных гранул и при необходимости примешиванием других фармацевтических вспомогательных веществ. Полученный таким путем продукт можно, при необходимости после примешивания к нему антиадгезива, прессовать в таблетировочном прессе. Процесс гранулирования предпочтительно проводить в грануляторе с псевдоожиженным слоем в соответствующих условиях. В соответствии с этим изобретение относится также к способу получения дозированной лекарственной формы в виде таблетки или пеллета, предназначенной для перорального введения в организм ингибитора PDE 4, заключающемуся в том, что а) приготавливают смесь фармацевтических вспомогательных веществ и б) полученную на стадии (а) смесь гранулируют с суспензией действующего вещества в водном растворе ПВП. Предлагаемую в изобретении дозированную лекарственную форму наиболее предпочтительно получать гранулированием смеси кукурузного крахмала и моногидрата лактозы совместно с суспензией слаборастворимого ингибитора PDE 4 в водном растворе ПВП, сушкой полученных гранул, их смешением с антиадгезивом и прессованием полученной смеси в таблетировочном прессе. Согласно изобретению неожиданно было установлено, что предлагаемые в нем дозированные лекарственные формы, полученные с использованием физических смесей или тритураций слаборастворимого ингибитора PDE 4 с наполнителем (полученных, например, измельчением, интенсивным перемешиванием или экструзией) путем их гранулирования с водными растворами ПВП или полученные путем гранулирования с использованием суспензий ингибиторов PDE 4 в водных растворах ПВП, обладают такими же предпочтительными свойствами касательно обеспечения биодоступности слаборастворимого ингибитора PDE 4, что и дозированные лекарственные формы, при изготовлении которых сначала получают твердые растворы ПВП и ингибитора PDE 4. Сказанное означает, что взаимодействия, происходящие между ПВП и слаборастворимым ингибитором PDE 4 в процессе изготовления предлагаемых в изобретении дозированных лекарственных форм на основе физических смесей или тритураций слаборастворимого ингибитора PDE 4 с наполнителем, которые в последующем гранулируют с водными растворами-8 008219 ПВП, или в процессе их изготовления путем гранулирования с использованием суспензий ингибиторовPDE 4 в водных растворах ПВП, неожиданно сходны со взаимодействиями, происходящими в твердом растворе ПВП и ингибитора PDE 4. Поэтому при производстве предлагаемых в изобретении дозированных лекарственных форм можно также отказаться от технически более сложного в осуществлении варианта, предусматривающего получение твердого раствора основанным на применении растворителя методом. Краткое описание чертежа На прилагаемом к описанию чертеже показаны графики, отражающие изменение во времени средней концентрации рофлумиласта в сыворотке после его перорального введения в дозе 0,5 мг (2 таблетки по 0,25 мг в каждой) с использованием предлагаемых в изобретении дозированных лекарственных форм,а также для сравнения показан аналогичный график для дозированной лекарственной формы, не содержащей ПВП. Ниже на примерах рассмотрены методы изготовления предлагаемых в изобретении таблеток и препаратов. Приведенные ниже примеры служат исключительно для иллюстрации изобретения и более подробного пояснения лежащих в его основе принципов и не ограничивают его объем. Примеры Изготовление предлагаемых в изобретении таблеток Пример А. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,1 мг: 1. Рофлумиласт (микронизированный) 0,100 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг Всего 65,100 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,1 мг. Пример Б. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,125 мг: 1. Рофлумиласт 0,125 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг Всего 65,125 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,125 мг. Пример В. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,25 мг: 1. Рофлумиласт 0,250 мг 2. Микрокристаллическая целлюлоза 33,900 мг 3. Кукурузный крахмал 2,500 мг 4. Поливидон К 90 2,250 мг 5. Натрийкарбоксиметилкрахмал (тип А) 20,000 мг 6. Стеарат магния (растительный) 0,600 мг Всего 59,500 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентами (2) и (5) и остальным количеством ингредиента (3) загружают в рабо-9 008219 чий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (6) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 59,5 мг. Пример Г. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,25 мг: 1. Рофлумиласт 0,250 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг Всего 65,250 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,25 мг. Пример Д. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,5 мг: 1. Рофлумиласт 0,500 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Стеарат магния (растительный) 0,650 мг Всего 65,500 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,500 мг. Пример Е. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,5 мг: 1. Рофлумиласт 0,500 мг 2. Моногидрат лактозы 99,320 мг 3. Кукурузный крахмал 26,780 мг 4. Поливидон К 90 2,600 мг 5. Стеарат магния (растительный) 1,300 мг Всего 130,500 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 130,5 мг. Пример Ж. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 2,5 мг: 1. Рофлумиласт 2,500 мг 2. Микрокристаллическая целлюлоза 33,900 мг 3. Кукурузный крахмал 2,500 мг 4. Поливидон К 90 2,250 мг 5. Натрийкарбоксиметилкрахмал (тип А) 20,000 мг 6. Стеарат магния (растительный) 0,600 мг Всего 61,750 мг- 10008219 Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентами (2) и (5) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (6) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 61,75 мг. Пример З. Изготовление таблеток, содержащих в качестве действующего вещества рофлумиласт в количестве 0,1 мг (данные о массовом количестве ингредиентов указаны в пересчете на партию из 70000 таблеток): 1. Рофлумиласт (микронизированный) 7,000 г 2. Моногидрат лактозы 3476,200 г 3. Кукурузный крахмал 937,300 г 4. Поливидон К 90 91,000 г 5. Стеарат магния (растительный) 45,500 г Всего 4557,000 г Получение: Ингредиент (1) смешивают с 70 г ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем и на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде (давление распыления: 3 бара, температура продукта: 28-33 С, расход потока воздуха в течение первой трети от всей продолжительности процесса распыления: 100 м 3/ч, расход потока воздуха в течение остальной части процесса распыления: 150 м 3/ч, температура воздуха на входе: 40-70 С, производительность при распылении: 30-40 г/мин). По завершении процесса распыления полученный продукт сушат до тех пор, пока его температура не достигнет 34 С. После этого гранулы просеивают через сито из нержавеющей стали с размером ячеек 0,8 мм и после определения относительной поверхностной влажности гранул ее значение доводят до 20-50%. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,1 мг. Пример И. Изготовление таблеток, содержащих в качестве действующего вещества рофлумиласт в количестве 0,25 мг (данные о массовом количестве ингредиентов указаны в пересчете на партию из 70000 таблеток): 1. Рофлумиласт (микронизированный) 35,000 г 2. Моногидрат лактозы 3476,200 г 3. Кукурузный крахмал 937,300 г 4. Поливидон К 90 91,000 г 5. Стеарат магния (растительный) 45,500 г Всего 4585,000 г Получение: 19,25 г ингредиента (1) смешивают с 192,5 г ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем и на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиента (4) в очищенной воде (давление распыления: 3 бара, температура продукта: 2833 С, расход потока воздуха в течение первой трети от всей продолжительности процесса распыления: 100 м 3/ч, расход потока воздуха в течение остальной части процесса распыления: 150 м 3/ч, температура воздуха на входе: 40-70 С, производительность при распылении: 30-40 г/мин). По завершении процесса распыления полученный продукт сушат до тех пор, пока его температура не достигнет 34 С. После этого гранулы просеивают через сито из нержавеющей стали с размером ячеек 0,8 мм и после определения относительной поверхностной влажности гранул ее значение доводят до 20-50%. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,5 мг. Пример К. Изготовление таблеток, содержащих в качестве действующего вещества рофлумиласт в количестве 0,1 мг (данные о массовом количестве ингредиентов указаны в пересчете на партию из 70000 таблеток): 1. рофлумиласт (микронизированный) 7,000 г 2. моногидрат лактозы 3476,200 г 3. кукурузный крахмал 937,300 г 4. поливидон К 90 91,000 г 5. стеарат магния (растительный) 45,500 г Всего 4557,000 г Получение: Ингредиент (1) до гомогенности суспендируют в грануляционном растворе ингредиента (4) в очищенной воде. Ингредиенты (2) и (3) загружают в рабочий резервуар грануляционной системы- 11008219 с псевдоожиженным слоем и гранулируют с описанной выше грануляционной суспензией, а затем сушат. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,1 мг. Пример Л. Изготовление таблеток, содержащих в качестве действующего вещества рофлумиласт в количестве 0,25 мг (данные о массовом количестве ингредиентов указаны в пересчете на партию из 70000 таблеток): 1. Рофлумиласт (микронизированный) 35,000 г 2. Моногидрат лактозы 3476,200 г 3. Кукурузный крахмал 937,300 г 4. Поливидон К 90 91,000 г 5. Стеарат магния (растительный) 45,500 г Всего 4585,000 г Получение: Ингредиент (1) до гомогенности суспендируют в грануляционном растворе ингредиента (4) в очищенной воде. Ингредиенты (2) и (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем и гранулируют с описанной выше грануляционной суспензией, а затем сушат. Далее к гранулам добавляют ингредиент (5) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,25 мг. Пример М. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,25 мг: 1. Рофлумиласт 0,250 мг 2. Моногидрат лактозы 49,660 мг 3. Картофельный крахмал 10,000 мг 4. Кукурузный крахмал 3,590 мг 5. ПВП 25 1,500 мг 6. Стеарат магния (растительный) 0,650 мг Всего 65,650 мг Получение: Из ингредиента (4) и воды приготавливают дисперсию, в которой затем до гомогенности суспендируют ингредиент (1). Ингредиент (5) растворяют в воде и добавляют к этой дисперсии. С использованием этой дисперсии в грануляционной системе с псевдоожиженным слоем в приемлемых условиях гранулируют ингредиенты (2) и (3). Далее к гранулам добавляют ингредиент (6) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 65,650 мг. Пример Н. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,25 мг: 1. Рофлумиласт 0,250 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Желатин 1,300 мг 6. Стеарат магния (растительный) 0,650 мг Всего 66,550 мг Получение: Ингредиент (1) смешивают с частью от всего предусмотренного количества ингредиента (3) и из полученной смеси в планетарной мельнице приготавливают тритурацию. Полученную тритурацию совместно с ингредиентом (2) и остальным количеством ингредиента (3) загружают в рабочий резервуар грануляционной системы с псевдоожиженным слоем, на частицы тритурации распылением наносят 5%-ный грануляционный раствор ингредиентов (4) и (5) в очищенной воде и сушат в приемлемых условиях. Далее к гранулам добавляют ингредиент (6) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 66,55 мг. Пример H1 Препарат для педиатрического применения Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,125 мг: 1. Рофлумиласт 0,125 мг 2. Моногидрат лактозы 49,660 мг 3. Кукурузный крахмал 13,390 мг 4. Поливидон К 90 1,300 мг 5. Маннит 32,238 мг 6. Корригент- 12008219 8. Стеарат магния (растительный) 1,649 мг Всего 111,586 мг Препарат такого состава изготавливают описанным выше методом. Исследование физических свойств и сравнительные опыты с использованием дозированных лекарственных форм, при изготовлении которых в качестве связующего не использовался ПВП. Пример О. Время распада и показатели высвобождения действующего вещества определяли для дозированной лекарственной формы указанного в примере Г состава. Время распада: Время распада определяли с помощью соответствующего испытательного прибора по методике, описанной в Европейской фармакопее. Результат: 7,08 мин. Высвобождение действующего вещества: Показатели высвобождения действующего вещества определяли по методике, описанной в фармакопее США (USP XXV, аппарат 2). Результат: 78% от всего количества действующего вещества высвобождается по истечении 15 мин,а количественное высвобождение действующего вещества наблюдается через 60 мин. Пример П. Изготовление содержащей рофлумиласт дозированной лекарственной формы, в которой не используется ПВП. Данные о массовом количестве ингредиентов указаны в пересчете на одну таблетку с содержанием рофлумиласта 0,25 мг: 1. Рофлумиласт 0,250 мг 2. Моногидрат лактозы 70,300 мг 3. Картофельный крахмал 19,475 мг 4. Кукурузный крахмал 3,563 мг 5. Натрийкарбоксиметилкрахмал (тип А) 1,900 мг 6. Стеарат магния (растительный) 0,950 мг Всего 96,438 мг Получение: Из ингредиента (4) и воды приготавливают дисперсию, в которой затем до гомогенности суспендируют ингредиент (1). С использованием этой дисперсии в грануляционной системе с псевдоожиженным слоем в приемлемых условиях гранулируют ингредиенты (2) и (3). К высушенным гранулам добавляют ингредиент (5) и перемешивают до гомогенности. К полученной смеси добавляют ингредиент (6) и полученную после перемешивания смесь прессуют в таблетировочном прессе в таблетки со средней массой 96,438 мг. Сравнительное исследование План эксперимента: 24 человека, в 3 смены, рандомизированный метод; доза в каждом случае 0,5 мг (2 таблетки с содержанием рофлумиласта по 0,25 мг в каждой). Концентрацию рофлумиласта в сыворотке после его перорального введения в дозе 0,5 мг (2 таблетки по 0,25 мг в каждой) исследовали для следующих дозированных лекарственных форм: с ПВП в качестве связующего: таблетка, состав которой соответствует примеру Г и которая ниже обозначена как "таблетка А",таблетка, состав которой соответствует примеру Л и которая ниже обозначена как "таблетка Б"; без ПВП в качестве связующего: таблетка, состав которой соответствует примеру П и которая ниже обозначена как "таблетка В". Полученные в этом исследовании результаты в графическом виде представлены на прилагаемом к описанию чертеже. Эти результаты свидетельствуют о том, что после перорального введения дозированных лекарственных форм с ПВП в качестве связующего концентрация действующего вещества в плазме достигает максимального уровня гораздо быстрее нежели после перорального введения дозированных лекарственных форм без ПВП. В соответствии с этим при применении предлагаемых в изобретении дозированных лекарственных форм значительно повышается скорость всасывания. Промышленная применимость Предлагаемые в изобретении дозированные лекарственные формы могут использоваться для лечения и профилактики всех тех заболеваний, при которых показано применение ингибиторов PDE 4. Избирательные ингибиторы циклонуклеотид-фосфодиэстеразы (PDE) (прежде всего типа 4), во-первых, пригодны для применения в качестве бронхиальных терапевтических средств (для лечения обструкции дыхательных путей, поскольку они обладают расширяющим действием, а также обладают способностью повышать частоту дыхания и стимулировать дыхание) и для устранения эректильной дисфункции, поскольку они обладают сосудорасширяющим действием, а, во-вторых, пригодны прежде всего для лечения заболеваний, главным образом воспалительного характера, опосредуемых такими медиаторами, как гистамин, PAF-фактор (фактор активации тромбоцитов), производные арахидоновой кислоты, в частности лейкотриены и простагландины, цитокины, интерлейкины, хемокины, -, - и -интерферон, фактор некроза опухоли (TNF-фактор) или свободные радикалы кислорода, а также протеазы, например заболеваний дыхательных путей (для профилактики астмы), кожи, центральной нервной системы, кишечника,- 13008219 глаз и суставов. В соответствии с этим предлагаемые в изобретении фармацевтические препараты могут использоваться в медицине и ветеринарии, например, для лечения и профилактики следующих заболеваний: острых и хронических (прежде всего воспалительных и вызванных аллергенами) заболеваний дыхательных путей различной этиологии (бронхита, аллергического бронхита, бронхиальной астмы, ХОЗЛ),дерматозов (прежде всего пролиферативного, воспалительного и аллергического характера), таких, например, как псориаз (чешуйчатый лишай), токсическая и аллергическая контактная экзема, атопический дерматит, себорейная экзема, простой лишай, солнечная эритема, зуд в области половых органов и заднего прохода, гнездная алопеция, гипертрофические рубцы, дискоидная красная волчанка, фолликулярные и обширные пиодермии, эндогенные и экзогенные угри, розовые угри и иные пролиферативные,воспалительные и аллергические кожные заболевания, заболеваний, в основе которых лежит высвобождение TNF-фактора и лейкотриенов, например заболеваний артритного типа (ревматоидного артрита,ревматоидного спондилита, остеоартрита и иных артритных состояний), заболеваний иммунной системы(СПИДа, множественного склероза), шока различных типов [септического шока, эндотоксинового бактериально-токсического шока, грамотрицательного сепсиса, синдрома токсического шока и РДСВ (респираторного дистресс-синдрома взрослых)] и разлитых воспалений в области желудочно-кишечного тракта(болезни Крона и язвенного колита), заболеваний, в основе которых лежат аллергические и/или хронические аномальные иммунологические реакции в области верхних дыхательных путей (в фарингиальной области, области носа) и смежных областях (в области околоносовых пазух, области глаз) и в качестве примера которых можно назвать аллергический ринит/синусит, хронический ринит/синусит, аллергический конъюктивит и полипы носа, а также болезней сердца, для лечения которых могут использоваться ингибиторы PDE и в качестве примера которых можно назвать сердечную недостаточность, или болезней, для лечения которых ингибиторы PDE могут использоваться благодаря наличию у них расслабляющего действия на ткани и в качестве примера которых можно назвать эректильную дисфункцию или почечную и мочеточниковую колику, связанную с почечными конкрементами, или же заболеваний ЦНС,таких, например, как депрессии или артериосклеротическое слабоумие. Настоящее изобретение относится далее к способу лечения млекопитающих, включая человека,страдающих одним из вышеуказанных заболеваний. Этот способ отличается тем, что пациентумлекопитающему вводят в терапевтически эффективном и фармакологически приемлемом количестве ингибитор PDE 4, который присутствует в предлагаемой в изобретении дозированной лекарственной форме. Заболеванием, для лечения которой предпочтительно применять предлагаемый в изобретении способ, является астма или обструкция дыхательных путей, прежде всего ХОЗЛ (хроническое обструктивное заболевание легких). Предлагаемые в изобретении дозированные лекарственные формы содержат ингибитор PDE 4 в дозе, обычно применяемой для лечения того или иного конкретного заболевания. Дозировка действующего вещества соответствует порядку величин, традиционно принятому для ингибиторов PDE, при этом суточную дозу можно вводить в организм одной или несколькими разовыми дозами. Суточная доза действующего вещества при системной терапии (при пероральном применении) в норме составляет от 0,001 до 3 мг на килограмм веса тела. Предпочтительные предлагаемые в изобретении дозированные лекарственные формы содержат рофлумиласт в разовой дозе, составляющей от 0,01 до 5 мг, предпочтительно от 0,05 до 2,5 мг, наиболее предпочтительно от 0,1 до 0,5 мг. В качестве примера предлагаемых в изобретении фармацевтических препаратов можно назвать разовые дозированные лекарственные формы, каждая из которых содержит рофлумиласт в количестве 0,1 мг, 0,125 мг, 0,25 мг или 0,5 мг. Обычно одну или более одной предлагаемых в изобретении разовых дозированных лекарственных форм принимают однократно в день. При необходимости, однако, одну или несколько предлагаемых в изобретении разовых дозированных лекарственных форм можно принимать более одного раза в день. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Дозированная лекарственная форма в виде таблетки или пеллета, предназначенная для перорального введения в организм ингибитора PDE 4 и содержащая ингибитор PDE 4 совместно с поливинилпирролидоном (ПВП) в качестве связующего и одно или несколько иных приемлемых фармацевтических вспомогательных веществ, в которой ингибитор PDE 4 представляет собой соединение формулы IR3 обозначает 3,5-дихлорпирид-4-ил,или соли этого соединения либо N-оксид пиридина или его соли. 2. Дозированная лекарственная форма по п.1, в которой ингибитор PDE 4 представляет собой N(3,5-дихлорпирид-4-ил)-3-циклопропилметокси-4-дифторметоксибензамид (рофлумиласт).- 14008219 3. Дозированная лекарственная форма по п.1, в которой ингибитор PDE 4 представляет собой Nоксид пиридина соединения формулы I. 4. Дозированная лекарственная форма по п.2, содержащая в разовой дозе от 0,01 до 5 мг рофлумиласта, предпочтительно от 0,05 до 2,5 мг рофлумиласта и наиболее предпочтительно от 0,1 до 0,5 мг рофлумиласта. 5. Дозированная лекарственная форма по п.1, в которой содержание поливинилпирролидона (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 1 до 5%. 6. Дозированная лекарственная форма по п.1, в которой содержание поливинилпирролидона (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 2 до 3%. 7. Дозированная лекарственная форма по п.1, где поливинилпирролидон представляет собой Коллидон 25 (молекулярный вес 28000-34000), Коллидон 30 (молекулярный вес 44000-54000) или Коллидон 90F (молекулярный вес 1000000-1500000). 8. Дозированная лекарственная форма по п.1, в которой фармацевтические вспомогательные вещества представляют собой вспомогательные вещества из группы наполнителей, дополнительных связующих, разрыхлителей для таблеток, смазывающих веществ или антиадгезивов, корригентов, буферных веществ, консервантов, красителей и эмульгаторов. 9. Дозированная лекарственная форма по п.1, в которой содержание (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) связующего (поливинилпирролидона и при необходимости других связующих) составляет от 0,5 до 20%. 10. Дозированная лекарственная форма по п.8, представляющая собой таблетку, в которой содержание наполнителя (в массовых процентах в пересчете на массу окончательной дозированной лекарственной формы) составляет от 40 до 99%, предпочтительно от 60 до 97%. 11. Дозированная лекарственная форма по п.8, где наполнитель выбирают из группы, содержащей карбонат кальция, карбонат натрия, сахароспирты, например, такие как маннит, сорбит, ксилит или мальтит, крахмалы, например, такие как кукурузный крахмал, картофельный крахмал или крахмал пшеницы, микрокристаллическая целлюлоза, сахариды, такие как глюкоза, лактоза (например, моногидрат лактозы), левулоза, сахароза, декстроза и их смеси. 12. Дозированная лекарственная форма по п.11, где наполнитель выбирают из группы, содержащей кукурузный крахмал, микрокристаллическую целлюлозу, лактозу и их смеси. 13. Дозированная лекарственная форма по п.8, где смазывающее вещество или антиадгезив выбирают из группы, содержащей натрийстеарилфумарат, стеарат магния, стеарат кальция, стеариновую кислоту, тальк и коллоидный безводный диоксид кремния. 14. Дозированная лекарственная форма по п.1, представляющая собой твердую дозированную лекарственную форму для перорального введения с немедленным высвобождением действующего вещества (твердая оральная дозированная форма с немедленным высвобождением). 15. Дозированная лекарственная форма по п.1, которая представляет собой таблетку. 16. Дозированная лекарственная форма по п.15, в которой фармацевтические вспомогательные вещества представляют собой по меньшей мере один наполнитель и по меньшей мере одно смазывающее вещество или антиадгезив. 17. Дозированная лекарственная форма по п.15, содержащая Рофлумиласт 0,125 мг Моногидрат лактозы 49,660 мг Кукурузный крахмал 13,390 мг Поливидон К 90 1,300 мг Стеарат магтния (растительный) 0,650 мг. 18. Дозированная лекарственная форма по п.15, содержащая Рофлумиласт 0,250 мг Моногидрат лактозы 49,660 мг Кукурузный крахмал 13,390 мг Поливидон К 90 1,300 мг Стеарат магния (растительный) 0,650 мг 19. Дозированная лекарственная форма по п.15, содержащая Рофлумиласт 0,500 мг Моногидрат лактозы 49,660 мг Кукурузный крахмал 13,390 мг Поливидон К 90 1,300 мг Стеарат магния (растительный) 0,650 мг 20. Дозированная лекарственная форма по п.1, содержащая твердый раствор ингибитора PDE4 в связующем ПВП в качестве носителя.- 15008219 21. Дозированная лекарственная форма по п.20, в которой твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 присутствует в виде молекулярной дисперсии в материале носителя. 22. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что (а) получают смесь ингибитора PDE 4 формулы I по п.1 и фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с водным раствором ПВП. 23. Способ по п.22, дополнительно включающий сушку полученных гранул и необязательно примешивание других фармацевтических вспомогательных веществ, смешение с антиадгезивом и прессование в таблетировочном прессе. 24. Способ по п.22, дополнительно включающий переработку полученного после гранулирования влажного продукта в пеллеты. 25. Способ по п.22, в котором гранулирование проводят в грануляторе с псевдоожиженным слоем в соответствующих условиях. 26. Способ по п.22, в котором на стадии (а) ингибитор PDE4 примешивают к другим фармацевтическим вспомогательным веществам в форме тритурации с фармацевтическим вспомогательным веществом. 27. Способ по п.26, в котором тритурацию получают измельчением ингибитора PDE4 с фармацевтическим вспомогательным веществом. 28. Способ по п.26 или 27, где фармацевтическое вспомогательное вещество представляет собой наполнитель. 29. Способ по п.22, включающий гранулирование смеси (а) ингибитора PDE4 формулы I по п.1 либо тритурации ингибитора PDE4 формулы I по п.1 с кукурузным крахмалом, (б) кукурузного крахмала и(в) моногидрата лактозы с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смеси в таблетировочном прессе. 30. Способ по п.22, включающий гранулирование смеси (а) ингибитора PDE4 формулы I по п.1 либо тритурации ингибитора PDE4 формулы I по п.1 с кукурузным крахмалом, (б) кукурузного крахмала,(в) микрокристаллической целлюлозы и (г) натрийкарбоксиметилкрахмала с водным раствором поливинилпирролидона, сушку полученных гранул, смешение гранул с агентом высвобождения и прессование полученной смеси в таблетировочном прессе. 31. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что (а) получают смесь фармацевтических вспомогательных веществ и (б) полученную на стадии (а) смесь гранулируют с суспензией ингибитора PDE4 формулы I по п.1 в водном растворе ПВП. 32. Способ по п.31, включающий гранулировании смеси кукурузного крахмала и моногидрата лактозы совместно с суспензией ингибитора PDE4 формулы I по п.1 в водном растворе ПВП, сушку полученных гранул, смешение гранул с антиадгезивом и прессование полученной смеси в таблетировочном прессе. 33. Способ получения дозированной лекарственной формы по п.1, заключающийся в том, что получают твердый раствор ПВП и ингибитора PDE 4 формулы I по п.1. 34. Способ по п.33, в котором твердый раствор представляет собой твердый раствор с аморфной структурой, в которой ингибитор PDE4 формулы I по п.1 присутствует в виде молекулярной дисперсии в поливинилпирролидоне. 35. Способ по п.33, в котором твердый раствор получают с использованием основанного на использовании растворителя метода, заключающегося в растворении поливинилпирролидона, ингибитора PDE4 и при необходимости других фармацевтических вспомогательных веществ в приемлемом растворителе с последующим удалением растворителя путем распылительной сушки, обычной сушки, вакуумной сушки или сушки вымораживанием. 36. Способ по п.33, в котором твердый раствор получают основанным на смешении методом, заключающемся в смешении ингибитора PDE4 и при необходимости других вспомогательных веществ с ПВП и их интенсивном перемешивании. 37. Способ получения дозированной лекарственной формы по п.1, включающий стадии: (а) получение содержащего действующее вещество материала в виде твердого раствора ингибитора PDE4 формулыI по п.1 в поливинилпирролидоне, (б) получение смеси содержащего действующее вещество материала и фармацевтических вспомогательных веществ и (в) гранулирование полученной на стадии (б) смеси с водным раствором поливинилпирролидона. 38. Способ по п.37, предназначенный для получения дозированной формы в виде таблетки, согласно которому влажные гранулы, полученные на стадии (в), сушат, смешивают со смазывающим веществом или антиадгезивом и прессуют в таблетировочном прессе. 39. Способ по п.37, предназначенный для получения дозированной формы в виде пеллет, согласно которому влажные гранулы, полученные на стадии (в), перерабатывают в соответствующие пеллеты путем экструдирования/сфероидизации. 40. Способ по п.37, предназначенный для получения дозированной формы в виде пеллет, согласно которому содержащий действующее вещество материал, представляющий собой твердый раствор инги- 16008219 битора PDE4 в поливинилпирролидоне, наносят из дисперсии/суспензии в приемлемом растворителе на имеющие форму пеллетов носители. 41. Способ по п.40, где имеющие форму пеллетов носители представляют собой нонпарели или содержащие ГПМЦ пеллеты. 42. Применение соединения формулы I, представленной в п.1, для получения дозированной формы по п.1, предназначенной для лечения или профилактики заболеваний, для лечения и предотвращения которых показано применение ингибиторов PDE4. 43. Применение по п.42, согласно которому заболевания представляют собой астму или обструкцию дыхательных путей. 44. Применение по п.42, согласно которому заболевание представляет собой хроническое обструктивное заболевание легких (ХОЗЛ).
МПК / Метки
МПК: A61K 31/44, A61K 9/20, A61P 11/06, A61K 31/166, A61K 45/06
Метки: форма, ингибитор, лекарственная, вещества, содержащая, качестве, применения, перорального, поливинилпирролидон, вспомогательного, действующего, дозированная
Код ссылки
<a href="https://eas.patents.su/18-8219-dozirovannaya-lekarstvennaya-forma-dlya-peroralnogo-primeneniya-soderzhashhaya-ingibitor-pde-4-v-kachestve-dejjstvuyushhego-veshhestva-i-polivinilpirrolidon-v-kachestve-vspomogatel.html" rel="bookmark" title="База патентов Евразийского Союза">Дозированная лекарственная форма для перорального применения, содержащая ингибитор pde 4 в качестве действующего вещества и поливинилпирролидон в качестве вспомогательного вещества</a>












