Кристаллическая полиморфная форма с ингибитора белка, активирующего 5-липоксигеназу, фармацевтическая композиция на ее основе и применение в лечении
Номер патента: 19819
Опубликовано: 30.06.2014
Авторы: Сток Николас Саймон, Шааб Кевин Мюррэй, Кинг Кристофер Дэвид
Формула / Реферат
1. Кристаллическая полиморфная форма С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2)
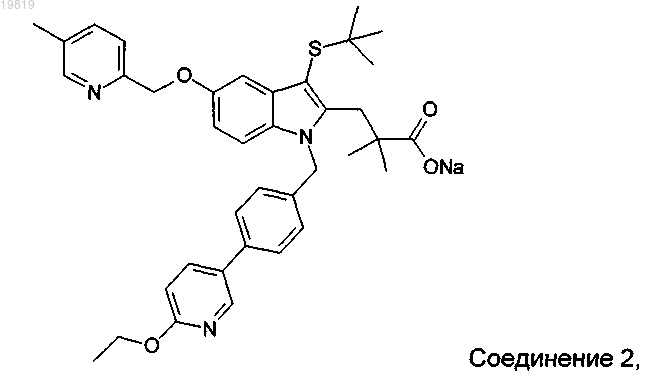
имеющая картину дифракции рентгеновских лучей на порошке (ДРЛП) с пиками при примерно 17,2°2-тета, при примерно 18,4°2-тета, при примерно 19,1°2-тета, при примерно 20,8°2-тета и при примерно 23,8°2-тета.
2. Кристаллическая полиморфная форма С по п.1, где соединение 2 образовано с использованием метил-трет-бутилового эфира.
3. Кристаллическая полиморфная форма С по п.1, где соединение 2 имеет по меньшей мере одно из следующих свойств:
(1в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине, представленной на фиг. 1;
(2в) единственная точка плавления при температуре от примерно 290 до примерно 295°C, измеренная методом дифференциальной сканирующей калориметрии (ДСК);
(3в) ДСК или термогравиметрический анализ (ТГА), по существу, аналогичные ДСК или ТГА, представленным на фиг. 15;
(4в) физическая и химическая стабильность (при 5, 25°C/60% относительная влажность (ОВ) и/или при 40°C/75% ОВ в течение по меньшей мере одного месяца в камере влажности);
(5в) негигроскопичность;
(6в) ИК (инфракрасный) спектр, по существу, аналогичный ИК-спектру, представленному на фиг. 19; и/или
(7в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине ДРЛП, полученной для кристаллов соединения 2, полученных из метил-трет-бутилового эфира (МТВЕ) или ацетонитрила.
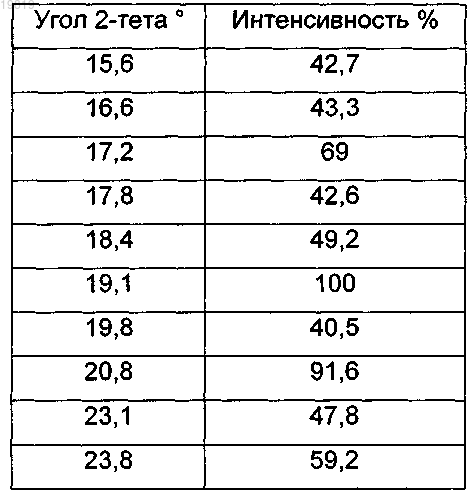
4. Кристаллическая полиморфная форма С по п.1, имеющая пики при значениях °2-тета, перечисленных ниже в следующей таблице, полученных с помощью дифрактометра с использованием источника Cu Kα излучения:
5. Кристаллическая полиморфная форма С по п.1 или 2, проявляющая следующие пики инфракрасного (ИК) спектра: 2968, 2935, 2893, 2866, 1604, 1563, 1369, 1414 (1473), 1285, 815 и 796 см-1.
6. Фармацевтическая композиция, содержащая:
а) кристаллическую полиморфную форму С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1 и
б) по меньшей мере один фармацевтически приемлемый неактивный ингредиент, выбранный из эксципиентов, разбавителей и носителей.
7. Фармацевтическая композиция по п.6, представляющая собой пероральную композицию, содержащую:
а) кристаллическую полиморфную форму С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1;
б) водный буферный раствор и, возможно,
в) этанол или Poloxamer 124.
8. Применение кристаллической полиморфной формы С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этокси-пиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1 в лечении астмы у человека.
9. Применение кристаллической полиморфной формы С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этокси-пиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1 в лечении или предупреждении аллергического ринита у человека.
10. Применение кристаллической полиморфной формы С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1 в лечении хронического обструктивного заболевания легких у человека.
11. Применение кристаллической полиморфной формы С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (соединение 2) по п.1 в лечении сердечно-сосудистого заболевания у человека.
Текст
КРИСТАЛЛИЧЕСКАЯ ПОЛИМОРФНАЯ ФОРМА С ИНГИБИТОРА БЕЛКА,АКТИВИРУЮЩЕГО 5-ЛИПОКСИГЕНАЗУ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ И ПРИМЕНЕНИЕ В ЛЕЧЕНИИ Раскрыта кристаллическая полиморфная форма С ингибитора FLAP 3-[3-трет-бутилсульфанил-1[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2 диметилпропионата натрия. Раскрыты также фармацевтические композиции, подходящие для введения млекопитающему, и применение указанной кристаллической полиморфной формы С для лечения астмы, аллергического ринита, хронического обструктивного заболевания легких и сердечно-сосудистого заболевания. Шааб Кевин Мюррэй, Кинг Кристофер Дэвид, Сток Николас Саймон (US) Поликарпов А.В., Борисова Е.Н. (RU) Родственные заявки Эта заявка имеет приоритет предварительной заявки США 61/055887, имеющей название "Пероральные композиции ингибитора FLAP", поданной 23 мая 2008 г., и предварительной заявки США 61/055,899, имеющей название "Способ изготовления и полиморфы ингибитора белка, активирующего 5 липоксигеназу", поданной 23 мая 2008 г., полное содержание каждой из которых включено в данное описание посредством ссылки. Область изобретения В данной заявке описана кристаллическая полиморфная форма С 3-[3-трет-бутилсульфанил-1-[4-(6 этокси-пиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия, фармацевтическая композиция на ее основе и применение в лечении или предупреждении заболеваний или состояний, ассоциированных с активностью белка, активирующего 5-липоксигеназу (FLAP). Предшествующий уровень техники Лейкотриены представляют собой биологические соединения, образующиеся из арахидоновой кислоты путем синтеза лейкотриенов. Лейкотриены синтезируются главным образом эозинофилами, нейтрофилами, тучными клетками, базофилами, дендритными клетками, макрофагами и моноцитами. Лейкотриены участвуют в биологических действиях, включая, исключительно в качестве примера, сокращение гладкой мускулатуры, активацию лейкоцитов, секрецию цитокинов, секрецию слизи и сосудистую функцию.FLAP является членом семейства белков MAPEG (мембраносвязанные белки, вовлеченные в метаболизм эйкозаноидов и глутатиона). FLAP ответственен за связывание арахидоновой кислоты и перенос ее на 5-липоксигеназу. 5-Липоксигеназа затем может катализировать двухстадийное окисление и дегидратацию арахидоновой кислоты, превращая ее в промежуточное соединение 5-НРЕТЕ (5 гидропероксиэйкозатетраеновая кислота), и в присутствии FLAP может превращать 5-НРЕТЕ в лейкотриен А 4 (LTA4). Под действием LTC4-синтазы LTA4 конъюгируется с восстановленным глутатионом(GSH) с образованием внутриклеточного продукта лейкотриена С 4 (LTC4). LTC4 превращается в лейкотриен D4 (LTD4) и лейкотриен Е 4 (LTE4) под действием гамма-глутамил-транспептидазы и дипептидаз.LTC4-синтаза играет центральную роль как единственный фермент, вовлеченный в образование цистеинил-лейкотриенов. Краткое изложение сущности изобретения Предложена кристаллическая полиморфная форма С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия имеющая картину дифракции рентгеновских лучей на порошке (ДРЛП) с пиками при примерно 17,22-тета, при примерно 18,42-тета, при примерно 19,12-тета, при примерно 20,82-тета и при примерно 23,82-тета. В частности, в одном воплощении кристаллической полиморфной формы С соединение 2 образовано с использованием метил-трет-бутилового эфира. В другом воплощении кристаллической полиморфной формы С соединение 2 имеет по меньшей мере одно из следующих свойств:(1 в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине, представленной на фиг. 1;(2 в) единственная точка плавления при температуре от примерно 290 до примерно 295C, измеренная методом дифференциальной сканирующей калориметрии (ДСК);(3 в) ДСК или термогравиметрический анализ (ТГА), по существу, аналогичные ДСК или ТГА,представленным на фиг. 15;(4 в) физическая и химическая стабильность (при 5C, 25C/60% относительная влажность (ОВ) и/или при 40C/75% ОВ в течение по меньшей мере одного месяца в камере влажности);(7 в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине ДРЛП, полученной для кристаллов соединения 2, полученных из метил-трет-бутилового эфира В еще одном воплощении кристаллическая полиморфная форма С имеет пики при значениях 2 тета, перечисленных ниже в следующей таблице, полученных с помощью дифрактометра с использованием источника Cu K излучения: В другом воплощении кристаллическая полиморфная форма С проявляет следующие пики инфракрасного (ИК) спектра: 2968 см-1, 2935 см-1, 2893 см-1, 2866 см-1, 1604 см-1, 1563 см-1, 1369 см-1, 1414(1473) см-1, 1285 см-1, 815 см-1 и 796 см-1. В изобретении также предложена фармацевтическая композиция, содержащая: а) кристаллическую полиморфную форму С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3 ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (Соединение 2); и б) по меньшей мере один фармацевтически приемлемый неактивный ингредиент, выбранный из эксципиентов, разбавителей и носителей. В частности, в одном воплощении фармацевтическая композиция является пероральной композицией, содержащей: а) кристаллическую полиморфную форму С 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3 ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (Соединение 2); б) водный буферный раствор; и возможно в) этанол или Poloxamer 124. Изобретение также относится к применению кристаллической полиморфной формы С 3-[3-(третбутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2 ил]-2,2-диметилпропионата натрия (Соединение 2) в лечении астмы у человека. Изобретение также относится к применению кристаллической полиморфной формы С 3-[3-(третбутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2 ил]-2,2-диметилпропионата натрия (Соединение 2) в лечении или предупреждении аллергического ринита у человека. Изобретение также относится к применению кристаллической полиморфной формы С 3-[3-(третбутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2 ил]-2,2-диметилпропионата натрия (Соединение 2) в лечении хронического обструктивного заболевания легких у человека. Изобретение также относится к применению кристаллической полиморфной формы С 3-[3-(третбутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2 ил]-2,2-диметилпропионата натрия (Соединение 2) в лечении сердечно-сосудистого заболевания у человека. Другие объекты, признаки и преимущества станут ясны из следующего далее подробного описания. Однако следует иметь в виду, что подробное описание и конкретные примеры, хотя и демонстрируют конкретные воплощения, приведены только в качестве иллюстрации, поскольку различные изменения и модификации в пределах замысла и объема изобретения станут ясны специалистам в данной области из этого подробного описания. Краткое описание графических материалов Фиг. 1 иллюстрирует картину ДРЛП полиморфной Формы С соединения 2. Фиг. 2 иллюстрирует картину ДРЛП полиморфной Формы В соединения 2. Фиг. 3 иллюстрирует картину ДРЛП аморфной фазы А соединения 2. Фиг. 4 иллюстрирует сравнение картин ДРЛП соединения 2, кристаллизация (в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм) или осаждение которого происходили в различных растворителях. Фиг. 5 иллюстрирует сравнение картин ДРЛП аморфной фазы А соединения 2 до и после одной недели при 40C и относительной влажности 75%. Фиг. 6 иллюстрирует сравнение картин ДРЛП полиморфной Формы В соединения 2 до и после экс-2 019819 периментов методом гравиметрической сорбции пара (ГСП). Фиг. 7 иллюстрирует сравнение картин ДРЛП полиморфной Формы С соединения 2 до и после одной недели при 40C и относительной влажности 75%. Фиг. 8 иллюстрирует картины ДРЛП аморфной фазы А соединения 2 при разных температурах. Фиг. 9 иллюстрирует сравнение картин ДРЛП аморфной фазы А соединения 2 при 230 и 280C с картиной ДРЛП полиморфной Формы С. Фиг. 10 иллюстрирует картины ДРЛП полиморфной Формы В соединения 2 при разных температурах. Фиг. 11 иллюстрирует сравнение картин ДРЛП полиморфной Формы В соединения 2 при 180, 220 и 260C с картиной ДРЛП полиморфной Формы С. Фиг. 12 иллюстрирует кривые ДСК (внизу) и ТГА (вверху) для аморфной фазы А соединения 2. Фиг. 13 иллюстрирует модифицированные кривые ДСК (внизу) и ТГА (вверху) для аморфной фазы А соединения 2. Фиг. 14 иллюстрирует кривые ДСК (внизу) и ТГА (вверху) для полиморфной Формы В соединения 2. Фиг. 15 иллюстрирует кривые ДСК (внизу) и ТГА (вверху) для полиморфной Формы С соединения 2. Фиг. 16 иллюстрирует диаграмму ГСП для аморфной фазы А соединения 2. Фиг. 17 иллюстрирует диаграмму ГСП для полиморфной Формы В соединения 2. Фиг. 18 иллюстрирует диаграмму ГСП для полиморфной Формы С соединения 2. Фиг. 19 иллюстрирует ИК спектр для полиморфной формы С соединения 2. Фиг. 20 иллюстрирует результаты экспериментов, проведенных для оценки индуцирования CYP соединением 2. Фиг. 21 иллюстрирует фармакокинетические характеристики однократной дозы и многократной дозы водного раствора соединения 2. Фиг. 22 иллюстрирует фармакодинамические характеристики (уровни LTB4 в крови) введений однократной дозы раствора соединения 2. Фиг. 23 иллюстрирует фармакодинамические характеристики (уровни LTE4 в моче) введения однократной дозы растворов соединения 2. Фиг. 24 иллюстрирует концентрации соединения 1 в плазме крови, наблюдаемые в когорте введения многократных доз 150 мг после введения соединения 2. Фиг. 25 иллюстрирует фармакодинамические характеристики (уровни LTB4 в крови) введения многократных доз водного раствора соединения 2. Подробное описание изобретения Лейкотриены (LT) представляют собой класс провоспалительных липидных медиаторов, образующихся из арахидоновой кислоты, которые играют важную роль в ряде биологических процессов. Арахидоновая кислота превращается в лейкотриен А 4 (LTA4) в результате духстадийного процесса, опосредованного ферментом 5-липоксигеназа (5-LO). Начальная стадия представляет собой окисление арахидоновой кислоты с образованием 5(S)-гидроксиперокси-6,8,11,14(E,Z,Z,Z)-эйкозатетраеновой кислоты (5 НРЕТЕ) с последующей дегидратацией с получением нестабильного эпоксида LTA4. LTA4 превращается в LTB4 под действием LTA4-гидролазы или в LTC4 через конъюгирование с глутатионом, опосредованное LTC4-синтазой. В результате расщепления амидной связи LTC4 превращается в LTD4 и затем впоследствии в LTE4. Начальная стадия окисления представляет собой процесс, который требует непосредственного участия как 5-LO, так и мембраносвязанного белка, активирующего 5-липоксигеназу (FLAP). Ингибирование либо FLAP, либо 5-LO приводит к ингибированию продуцирования всех лейкотриенов. LTB4 представляет собой лиганд для сопряженных с G-белком рецепторов (GPCR) BLT1 и BLT2, и оба эти рецептора вовлечены в хемотаксис и стимуляцию клеток в воспалительном ответе. Бронхоконстрикция, отек дыхательных путей и гиперсекреция слизи являются результатом действия цистеинил-лейкотриенов(cysLT) LTC4, LTD4 и LTE4. LTD4 и LTE4 оба являются лигандами для рецептора cysLT1. Лейкотриены являются липидными медиаторами воспаления, которые вовлечены в патогенез респираторных и сердечно-сосудистых заболеваний. Клеточная активация иммунными комплексами и другими воспалительными стимулами приводит к увеличению уровня внутриклеточного кальция и транслокации цитозольной фосфолипазы А 2 (CPLA2) и 5-липоксигеназы (5-LO) из цитозоля в ядерную мембрану. В присутствии белка, активирующего 5-липоксигеназу (FLAP), арахидоновая кислота (АА), высвобождаемая из ядерной мембраны под действием cPLA2, доставляется на 5-LO для превращения в 5-(S)гидроперокси-6,8,11,14-эйкозатетраеновую кислоту (5-НРЕТЕ) и затем в лейкотриен А 4 (LTA4). Мембранное взаимодействие 5-LO с FLAP является важным для биосинтеза лейкотриенов. FLAP представляет собой интегральный мембранный белок, который принадлежит суперсемейству MAPEG (мембраносвязанные белки, вовлеченные в метаболизм эйкозаноидов и глутатиона). В отличие от остальныхMAPEG, не было показано, что FLAP обладает ферментативной активностью или функционально модулируется глутатионом. Лейкотриены являются мощными медиаторами воспаления и бронхоспазма. Лейкотриены продуцируются главным образом тучными клетками, эозинофилами, моноцитами/макрофагами и нейтрофила-3 019819 ми в ответ на аллергические или воспалительные стимулы. Для клеточного синтеза лейкотриенов 5 липоксигеназа перемещается из немембранного компартмента (цитозоля или нуклеозоля) на мембраны(ядерный или эндоплазматический ретикулум) и взаимодействует с FLAP. FLAP переносит арахидоновую кислоту, высвобождемую из мембранных фосфолипидов фосфолипазами, на 5-LO. Затем происходит двухстадийная реакция превращения арахидоновой кислоты в LTA4. LTA4 может экспортироваться из клетки для трансцеллюлярного метаболизма или превращаться либо в LTB4, либо вLTC4. LTC4 экспортируется из клеток и превращается в LTD4 и затем в LTE4 в крови. LTB4 активирует рецепторы BLT1 и BLT2, а цистеинил-лейкотриены активируют рецепторы cysLT1 и cysLT2 (и возможно рецептор cysLT3). Хотя опосредованная цистеинил-лейкотриенами бронхоконстрикция у человека происходит посредством активации рецептора cysLT1, оба рецептора cysLT1 и cysLT2 присутствуют на клетках, вовлеченных в аллергическое воспаление, включая тучные клетки, эозинофилы и моноциты. Целый ряд перорально активных лекарственных средств воздействуют на лейкотриеновый путь. Монтелукаст является антагонистом рецепторов лейкотриенов. Пранлукаст и зафирлукаст являются антагонистами рецепторов лейкотриенов, применяемыми в лечении астмы и аллергического ринита. Эти лекарственные средства являются антагонистами рецепторов cysLT1, но не рецепторов cysLT2 или LTB4. Клинические исследования с этими антагонистами рецепторов cysLT1 демонстрируют, что цистеиниллейкотриены являются важными медиаторами аллерген-индуцированного уменьшения объема легких(ранняя и поздняя фазы), а также хронической астмы. Один ингибитор 5-липоксигеназы, зилейтон, демонстрирует клиническую эффективность при хронической астме, хотя он не эффективен в исследованиях с провокацией аллергенами. В клинических испытаниях показано, что три ингибитора FLAP (MK-0591, МК-866 и BAYX-1005) эффективны против аллерген-индуцированных ранней и поздней фаз уменьшения объема легких. МК 0591 также эффективен в исследованиях хронической астмы. Ингалируемые лекарственные средства, такие как бета-агонисты и кортикостероиды, могут быть эффективными и могут минимизировать системное воздействие, но они не оптимальны с точки зрения соблюдения пациентом режима и схемы лечения такими устройствами высвобождения лекарственного средства. Кроме того, использование ингалируемых стероидов, например, может приводить к задержке роста у детей или к катарактам у взрослых. Соединение 1, структура которого показана ниже, является мощным ингибитором FLAP, который блокирует раннюю стадию в лейкотриеновом пути, т.е. активацию 5-липоксигеназы. Соединение 1 является фармакологически активным in vitro и после перорального введения и хорошо переносимым в доклинических исследованиях. Кроме того, соединение 1 ингибирует образование LTB4 и цистеиниллейкотриенов, и это дает дополнительные клинические преимущества по сравнению с антагонистами рецепторов лейкотриенов, такими как монтелукаст. Роль FLAP в пути синтеза лейкотриенов значительна, поскольку FLAP совместно с 5 липоксигеназой осуществляет первую стадию в пути синтеза лейкотриенов. Следовательно, ингибирование FLAP представляет собой мишень для соединений, полезных в лечении лейкотриензависимых или лейкотриенопосредованных заболеваний или состояний, включая, к примеру, сосудистые и воспалительные расстройства, пролиферативные заболевания, респираторные и нераковые расстройства. Ингибиторы FLAP полезны в лечении лейкотриензависимых или лейкотриенопосредованных заболеваний или состояний. В данной заявке описаны композиции, фармацевтические композиции, способы лечения, способы приготовления лекарственных средств, способы получения, способы изготовления, стратегии лечения,фармакокинетические стратегии с использованием соединения 1 или его солей. включая его фармацевтически приемлемые сольваты (включая гидраты), аморфные фазы, частично кристаллические и кристаллические формы (включая все полиморфы), пролекарства, метаболиты и N-4 019819"Соединение 2", или "3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионат натрия", относится к натриевой соли 3-[3 трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2 ил]-2,2-диметилпропионовой кислоты, включая ее фармацевтически приемлемые сольваты (включая гидраты), аморфные фазы, частично кристаллические и кристаллические формы (включая все полиморфы), пролекарства, метаболиты и N-оксиды. 3-[3-трет-Бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)1H-индол-2-ил]-2,2-диметилпропионат натрия (также известный как соединение 2) имеет следующую структуру: Соединение 1 содержит два основных центра (пиридинильные группы) и один кислотный центр(карбоновокислотная группа). Образуются самые разнообразные соли. Соли соединения 1 включают: а) соли, образованные в результате замещения кислотного протона карбоновокислотной группы соединения 1 ионом металла, таким как, например, ион щелочного металла (например лития, натрия, калия), ион щелочно-земельного металла (например магния или кальция) или ион аммония, или в результате замещения аммониевым катионом (NH4+); б) соли, образованные в результате реакции соединения 1 с фармацевтически приемлемым органическим основанием, включая алкиламины, такие как холин, этаноламин, диэтаноламин, триэтаноламин,трометамин, N-метилглюкамин, дициклогексиламин, трис(гидроксиметил)метиламин, и соли с аминокислотами, такими как аргинин, лизин и т.п.; в) соли, образованные в результате реакции соединения 1 с фармацевтически приемлемой кислотой,которая обеспечивает образование солей присоединения кислоты. Фармацевтически приемлемые кислоты включают соляную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту, метафосфорную кислоту и т.п. или органические кислоты, такие как, например, уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота,малеиновая кислота, фумаровая кислота, трифторуксусная кислота, винная кислота, лимонная кислота,бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота,метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2 гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, 2 нафталинсульфоновая кислота, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис-(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсульфоновая кислота, глюконовая кислота,глутаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п. Термин "фармацевтически приемлемая соль соединения 1" охватывает все фармацевтически приемлемые сольваты (включая гидраты), аморфные фазы, частично кристаллические и кристаллические формы (включая все полиморфы), пролекарства, метаболиты и N-оксиды указанной фармацевтически приемлемой соли. В конкретных воплощениях фармацевтически приемлемая соль соединения 1 представляет собой 3[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1Hиндол-2-ил]-2,2-диметилпропионат натрия (соединение 2), и соединение 2 находится в аморфной фазе,частично кристаллической форме или кристаллической форме. В конкретном воплощении описанная здесь фармацевтическая композиция приготовлена в виде таблетки, и соединение 2 находится в кристаллической форме. Используемый здесь термин "фармацевтически приемлемый эксципиент" относится к веществу, такому как носитель, разбавитель, стабилизатор, диспергирующий агент, суспендирующий агент, загущающий агент и т.д., которое дает возможность предоставлять активный фармацевтический ингредиент(АФИ) в форме, подходящей для введения млекопитающему. В одном аспекте млекопитающим является человек. Фармацевтически приемлемые эксципиенты представляют собой вещества, которые, по сущест-5 019819 ву, не аннулируют желаемую биологическую активность или желаемые свойства соединения (т.е. АФИ) и являются относительно нетоксичными, т.е. при введении индивидууму это вещество не вызывает нежелательных биологических воздействий или не взаимодействует опасным для индивидуума образом с любым из компонентов композиции, в которой он содержится."Активный фармацевтический ингредиент", или АФИ, относится к соединению, которое обладает желаемой биологической активностью или желаемыми свойствами. В некоторых воплощениях АФИ представляет собой соединение 1. В некоторых воплощениях АФИ представляет собой соединение 2. Термин "фармацевтически приемлемая соль" применительно к соединению 1 относится к соли соединения 1, которая не вызывает значительного раздражения у млекопитающего, которому ее вводят, и,по существу, не аннулирует биологическую активность и свойства соединения. Следует иметь в виду, что ссылка на фармацевтически приемлемую соль охватывает формы присоединения растворителя (сольваты). Сольваты содержат либо стехиометрическое, либо нестехиометрическое количество растворителя и образуются в процессе кристаллизации (в результате кристаллизации,фазового превращения в твердом состоянии или взаимопревращения кристаллических форм) с использованием фармацевтически приемлемых растворителей, таких как вода, этанол, метил-трет-бутиловый эфир, изопропанол, ацетонитрил и т.п. В одном аспекте сольваты получают с использованием, без ограничений, растворителя(ей) класса 3. Категории растворителей определены, например, в материалах Международной конференции по гармонизации технических требований для регистрации фармацевтических средств для людей (The International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH), "Impurities: Guidelines for Residual Solvents, Q3C(R3),(November 2005. Гидраты образуются, когда растворителем является вода, или алкоголяты образуются,когда растворителем является спирт. В одном воплощении сольваты соединения 1 или его солей обычно получают или образуют в процессе осуществления описанных здесь способов. Кроме того, соединение 1 или его соли существуют в несольватированной форме. Используемый здесь термин "фармацевтическая комбинация" означает продукт, который образуется в результате смешивания или объединения более активных ингредиентов в количестве более одного, и включает как фиксированные, так и нефиксированные комбинации активных ингредиентов. Термин"фиксированная комбинация" означает, что активные ингредиенты, например соединение 1 и со-агент,вводят пациенту одновременно в форме единого вещества или единой дозировки. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение 1 и со-агент, вводят пациенту в виде отдельных веществ одновременно, параллельно или последовательно через неконкретные промежутки времени, и такое введение обеспечивает эффективные уровни двух соединений в организме пациента. Последнее также применимо к коктейльной терапии, например введению трех или более активных ингредиентов. Термин "фармацевтическая композиция" относится к смеси соединения 1 или его фармацевтически приемлемой соли и/или сольвата с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, загущающие агенты, эксципиенты и т.д. Фармацевтическая композиция облегчает введение соединения млекопитающему. Введение комбинации агентов включает введение описанных здесь агентов в единой композиции или в комбинации, где один или более агентов вводят отдельно от по меньшей мере одного другого агента. Формы и фазы Полиморфизм, т.е. способность вещества существовать в двух или более кристаллических фазах,делает возможным разное расположение и/или конформацию молекул в кристаллической решетке. Это расположение может в значительной степени влиять на физико-химические и технологические параметры, а также на срок годности или стабильность вещества и эксципиентов. Как правило, полиморфы также обеспечивают улучшенную растворимость и улучшенные скорости растворения. Термодинамические свойства, такие как теплоемкость, свободная энергия и химический потенциал, давление паров, растворимость и термодинамическая активность, а также кинетические свойства, такие как коэффициент диссоциации и стабильность, отличаются у полиморфов. Предложены композиции, содержащие полиморфы соединения 2. В конкретных воплощениях предложен активный фармацевтический ингредиент (АФИ),соединение 2, с чистотой более 80%, более 85%, более 90%, более 95%, более 96%, более 97%, более 98% или более 99%. Описаны различные формы соединения 1 и его фармацевтически приемлемых солей. В некоторых воплощениях любую из описанных здесь форм используют в приготовлении фармацевтической композиции. В некоторых воплощениях формы соединения 1, включая его фармацевтически приемлемые соли,и описанные здесь фармацевтически приемлемые сольваты включают без ограничений аморфную форму, частично кристаллические формы, кристаллические формы, измельченные формы и формы наночастиц. Различные кристаллические формы известны как полиморфы. Полиморфы включают разные конфигурации кристаллической упаковки соединения одного и того же элементного состава. В некоторых воплощениях полиморфы обычно имеют разные картины дифракции рентгеновских лучей, разные инфракрасные спектры, разные точки плавления, разную плотность, разную твердость, разную форму кри-6 019819 сталла, разные оптические и электрические свойства, разную стабильность и/или растворимость. Различные факторы, такие как растворитель для кристаллизации, скорость кристаллизации (в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм) и/или температура хранения, обуславливают получение конкретного полиморфа. В конкретном воплощении соединение 2 осаждено из метил-трет-бутилового эфира. В конкретном воплощении соединение 2 подвергнуто кристаллизации из метил-трет-бутилового эфира. В некоторых воплощениях соединение 2 подвергнуто кристаллизации из ацетонитрила. В некоторых воплощениях соединение 2 подвергнуто кристаллизации из изопропанола. В некоторых воплощениях соединение 2 подвергнуто кристаллизации из диметилсульфоксида. В некоторых воплощениях соединение 2 подвергнуто кристаллизации из смеси метил-третбутиловый эфир/вода. В некоторых воплощениях соединение 2 подвергнуто кристаллизации и является сольватированным. В конкретных воплощениях сольват содержит воду, МТВЕ или их комбинацию. В некоторых воплощениях соединение 2 десольватировано. В некоторых воплощениях соединение 2 является кристаллическим. Предложены полиморфы соединения 2. В одном аспекте описаны полиморфы соединения 2, где полиморф является аморфным или кристаллическим. В одном воплощении полиморф соединения 2 является аморфным. В другом воплощении полиморф соединения 2 представляет собой кристаллическую форму. В еще одном воплощении полиморф соединения 2 представляет собой кристаллическую форму и сольватирован. В еще одном воплощении полиморф соединения 2 представляет собой кристаллическую форму и десольватирован. Аморфная фаза А В изобретении также описана аморфная фаза А соединения 2. Фиг. 3 иллюстрирует картину ДРЛП аморфного соединения 2. В некоторых воплощениях аморфная фаза А соединения 2 имеет по меньшей мере одно свойство, выбранное из следующих:(2 а) по меньшей мере одно эндотермическое событие и по меньшей мере одно экзотермическое событие, наблюдаемые методом дифференциальной сканирующей калориметрии (ДСК);(3 а) температура стеклования примерно 127C;(4 а) точка плавления при температуре примерно 155C, затем событие рекристаллизации при температуре примерно 200C, затем вторая точка плавления при температуре от примерно 288 до примерно 295C;(5 а) фазовый переход в кристаллическую форму при нагревании выше примерно 200C, где кристаллическая форма, которая образуется при температуре выше примерно 200C, характеризуется картиной ДРЛП, по существу, аналогичной любой из картин ДРЛП, представленных на фиг. 9;(6 а) ДСК или ТГА, по существу, аналогичные ДСК или ТГА, представленным на фиг. 12;(8 а) химическая стабильность (при 5C, 25C/60% ОВ и/или 40C/75% ОВ в течение по меньшей мере одного месяца). В некоторых воплощениях аморфная фаза А cоединения 2 имеет по меньшей мере два свойства,выбранные из (1 а)-(6 а). В некоторых воплощениях аморфная фаза А cоединения 2 имеет по меньшей мере три свойства, выбранные из (1 а)-(6 а). В некоторых воплощениях аморфная фаза А cоединения 2 имеет по меньшей мере четыре свойства, выбранные из (1 а)-(6 а). В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (1 а) картину ДРЛП, показывающую отсутствие кристалличности. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (2 а) по меньшей мере одно эндотермическое событие и по меньшей мере одно экзотермическое событие, наблюдаемые методом дифференциальной сканирующей калориметрии (ДСК). В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (3 а) температуру стеклования примерно 127C. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (4 а) точку плавления при температуре примерно 155C, затем событие рекристаллизации при температуре примерно 200C, затем вторая точка плавления при температуре от примерно 288 до примерно 295C. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (5 а) фазовый переход в кристаллическую форму при нагревании выше примерно 200C, где кристаллическая форма,которая образуется при температуре выше примерно 200C, характеризуется картиной ДРЛП, по существу, аналогичной любой из картин ДРЛП, представленных на фиг. 9. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (6 а) ДСК или ТГА, по существу, аналогичные ДСК или ТГА, представленным на фиг. 12. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (7 а) гигроскопичность. В некоторых воплощениях аморфная фаза А cоединения 2 определена как имеющая (8 а) химическую стабильность. Полиморфная Форма В В изобретении также описана кристаллическая форма В соединения 2, имеющая по меньшей мере одно свойство, выбранное из следующих:(2 б) картина ДРЛП с пиками при примерно 6,62-тета, при примерно 8,12-тета, при примерно 19,72-тета, при примерно 21,02-тета, при примерно 21,92-тета и при примерно 22,12-тета;(3 б) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине ДРЛП для кристаллов cоединения 2, полученных из метил-трет-бутилового эфира (МТВЕ) или изопропанола;(4 б) по меньшей мере одно эндотермическое событие и по меньшей мере одно экзотермическое событие, наблюдаемые методом дифференциальной сканирующей калориметрии (ДСК);(5 б) фазовый переход во вторую кристаллическую форму при нагревании до температуры выше примерно 180C, где вторая кристаллическая форма, которая образуется выше примерно 180C, характеризуется картиной ДРЛП, по существу, аналогичной любой из картин ДРЛП, представленных на фиг. 11;(7 б) потеря кристалличности после полного цикла сорбция/десорбция в эксперименте методом ГСП. В некоторых воплощениях кристаллическая форма В соединения 2 имеет по меньшей мере два свойства, выбранные из (1 б)-(7 б). В некоторых воплощениях кристаллическая форма В соединения 2 имеет по меньшей мере три свойства, выбранные из (1 б)-(7 б). В некоторых воплощениях кристаллическая форма В соединения 2 имеет по меньшей мере четыре свойства, выбранные из (1 б)-(7 б). В некоторых воплощениях кристаллическая форма В соединения 2 имеет (1 б) картину ДРЛП, по существу, аналогичную картине, представленной на фиг. 2. В некоторых воплощениях кристаллическая форма В соединения 2 имеет (2 б) картину ДРЛП с пиками при примерно 6,62-тета, при примерно 8,12-тета, при примерно 19,72-тета, при примерно 21,02 тета, при примерно 21,92-тета и при примерно 22,12-тета. В некоторых воплощениях кристаллическая форма В соединения 2 имеет (3 б) картину дифракции рентгеновских лучей на порошке (ДРЛП), по существу аналогичную картине ДРЛП для кристаллов соединения 2, полученных из метил-трет-бутилового эфира (МТВЕ) или изопропанола. В некоторых воплощениях описана кристаллическая форма В соединения 2, имеющая (4 б) по меньшей мере одно эндотермическое событие и по меньшей мере одно экзотермическое событие, наблюдаемые методом дифференциальной сканирующей калориметрии (ДСК). В некоторых воплощениях описана кристаллическая форма В соединения 2, имеющая (5 б) фазовый переход во вторую кристаллическую форму при нагревании до температуры выше примерно 180C, где вторая кристаллическая форма, которая образуется при температуре выше примерно 180C, характеризуется картиной ДРЛП, по существу, аналогичной любой из картин ДРЛП, представленных на фиг. 11. В некоторых воплощениях кристаллическая форма В соединения 2 имеет свойство (6 б) гигроскопичности. В некоторых воплощениях кристаллическая форма В соединения 2 имеет свойство (7 б) потери кристалличности после полного цикла сорбция/десорбция в эксперименте методом ГСП. В некоторых воплощениях форма В кристаллизована из МТВЕ или изопропанола. В некоторых воплощениях форма В кристаллизована из изопропанола. В некоторых воплощениях форма В получена из растворов МТВЕ, где протонный сорастворитель (например вода или этанол) присутствует во время кристаллизациия (в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм). В некоторых воплощениях форма В получена кристаллизацией из протонного растворителя, такого как, без ограничений, изопропанол. В некоторых воплощениях форма В превращена в форму С путем удаления (дегидратации) протонных растворителей из кристаллов формы В. Полиморфная Форма С Кристаллическая полиморфная форма С соединения 2 по изобретению имеет по меньшей мере одно свойство, выбранное из следующих:(1 в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине, представленной на фиг. 1;(2 в) картина ДРЛП с пиками при примерно 17,22-тета, при примерно 18,42-тета, при примерно 19,12-тета, при примерно 20,82-тета и при примерно 23,82-тета;(3 в) единственная точка плавления при температуре от примерно 290C до примерно 295C;(4 в) ДСК или ТГА, по существу, аналогичные ДСК или ТГА, представленным на фиг. 15;(5 в) физическая и химическая стабильность (при 5C, 25C/60% ОВ и/или 40C/75% ОВ в течение по меньшей мере одного месяца);(8 в) картина дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичная картине ДРЛП для кристаллов соединения 2, полученных из метил-трет-бутилового эфира (МТВЕ) или ацетонитрила. В некоторых воплощениях полиморфная форма С соединения 2 имеет по меньшей мере два свойства, выбранные из (1 в)-(8 в). В некоторых воплощениях полиморфная форма С соединения 2 имеет по меньшей мере три свойства, выбранные из (1 в)-(8 в). В некоторых воплощениях полиморфная форма С соединения 2 имеет по меньшей мере четыре свойства, выбранные из (1 в)-(8 в). В некоторых воплощениях полиморфная форма С соединения 2 имеет по меньшей мере пять свойств, выбранных из (1 в)-(8 в). В некоторых воплощениях полиморфная форма С соединения 2 имеет (1 в) картину дифракции рентгеновских лучей на порошке (ДРЛП), по существу аналогичную картине, представленной на фиг. 1. В некоторых воплощениях полиморфная форма С соединения 2 имеет (2 в) картину ДРЛП с пиками при примерно 17,22-тета, при примерно 18,42-тета, при примерно 19,12-тета, при примерно 20,82 тета и при примерно 23,82-тета. В некоторых воплощениях полиморфная форма С соединения 2 имеет (3 в) единственную точку плавления при температуре от примерно 290C до примерно 295C. В некоторых воплощениях полиморфная форма С соединения 2 имеет (4 в) ДСК или ТГА, по существу, аналогичные ДСК или ТГА, представленным на фиг. 15. В некоторых воплощениях полиморфная форма С cоединения 2 имеет (5 в) физическую и химическую стабильность (при 5C; 25C/60% ОВ и/или 40C/75% ОВ в течение по меньшей мере одного месяца). В некоторых воплощениях полиморфная форма С cоединения 2 является (6 в) негигроскопичной. В некоторых воплощениях полиморфная форма С cоединения 2 имеет (7 в) ИК-спектр, по существу,аналогичный ИК-спектру, представленному на фиг. 19. В некоторых воплощениях полиморфная форма С соединения 2 имеет (8 в) картину дифракции рентгеновских лучей на порошке (ДРЛП), по существу, аналогичную картине ДРЛП для кристаллов Соединения 2, полученных из метил-трет-бутилового эфира (МТВЕ) или ацетонитрила. В некоторых воплощениях полиморфная форма С образована из метил-трет-бутилового эфира(МТВЕ). В другом аспекте полиморфная форма С образована из ацетонитрила. В некоторых воплощениях форма С получена путем удаления (дегидратации) протонных растворителей из кристаллов формы В. Как описано здесь, картины ДРЛП получены любым методом, включая, в качестве неограничивающего примера, (а) на дифрактометре Siemens D5000; или (б) на дифрактометре Bruker AXS C2GADDS. В конкретных воплощениях картина ДРЛП получена на дифрактометре Siemens D5000 с использованием источника Cu K излучения (40 кВ, 40 мА), - гониометра, расходимости V20 и принимающих щелей, графитового вторичного монохроматора и/или сцинтилляционного счетчика. В другом конкретном воплощении картина ДРЛП получена на дифрактометре Bruker AXS C2 GADDS с использованием источника Cu K излучения (40 кВ, 40 мА), автоматизированного XYZ столика, лазерного видеомикроскопа для автоматического позиционирования образца, 2-мерного детектора HiStar, многослойного зеркала Gbel, сопряженного с точечным коллиматором 0,3 мм, дивергенции пучка примерно 4 мм,- режима непрерывного сканирования, расстояния от детектора до образца 20 см, эффективного диапазона 2 3,2-29,7 и/или облучения образца пучком рентгеновских лучей в течение примерно 120 с. Как описано здесь, точки плавления могут быть определены любым методом, включая, в качестве неограничивающего примера, микроскопию с нагревательным столиком (НСМ) или дифференциальную сканирующую калориметрию (ДСК). В конкретных воплощениях микроскопия с нагревательным столиком представляет собой поляризационно-оптический микроскоп Leica LM/DM, объединенный с нагревательным столиком Mettler-Toledo MTFP82HT, нагревающим от температуры окружающей среды со скоростью от примерно 10C/мин до примерно 20C/мин. В некоторых воплощениях измерения методом ДСК выполняют любым способом с использованием, в качестве неограничивающего примера, (а) прибора для термического анализа ТА Instrument Q1000; или (б) Mettler ДСК 823 е. В конкретных воплощениях ТА Instrument Q1000 калибруют в отношении энергии и температуры с использованием сертифицированного индиевого образца от примерно 0,5 до примерно 3 мг, перфорированной алюминиевой кюветы,при скорости нагрева примерно 10C/мин от 25 до 350C, скорости продувки азотом примерно 50 мл/мин, с использованием Thermal Advantage V4.6.6 в качестве программного обеспечения для контроля прибора и/или с использованием Universal Analysis v4.3A в качестве программного обеспечения анализа данных. В других конкретных воплощениях Mettler ДСК 823 е калибруют в отношении энергии и температуры с использованием сертифицированного индиевого образца от примерно 0,5 до примерно 3 мг,перфорированной алюминиевой кюветы, при скорости нагрева примерно 10C/мин от 25 до 350C, скорости продувки азотом примерно 50 мл/мин и/или с использованием STARe v9.01 в качестве программного обеспечения для контроля прибора и анализа данных. Синтез ингибитора FLAP В данной заявке описаны способы получения соединения 1 и его фармацевтически приемлемых солей, в частности где фармацевтически приемлемая соль соединения 1 представляет собой соединение 2. Более конкретно, описан способ получения кристаллической формы 3-[3-трет-бутилсульфанил-1[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (Соединения 2), включающий следующие стадии: 1) добавление соединения 2 к метил-трет-бутиловому эфиру с образованием смеси; 2) нагревание смеси со стадии (1) и затем охлаждение раствора; и 3) выделение твердого вещества, образовавшегося на стадии (2), с получением кристаллической формы соединения 2. В некоторых вариантах выполнения способа кристаллическая форма соединения 2 имеет картину дифракции рентгеновских лучей с характеристическими значениями углов 2-тета примерно 6,62-тета,примерно 8,12-тета, примерно 19,72-тета, примерно 21,02-тета, примерно 21,92-тета и примерно 22,12-тета. В некоторых вариантах выполнения способа кристаллическая форма соединения 2 имеет картину дифракции рентгеновских лучей, которая коррелирует с картиной дифракции рентгеновских лучей, изображенной на фиг. 2. В некоторых вариантах выполнения способа кристаллическая форма соединения 2 имеет картину дифракции рентгеновских лучей с характеристическими значениями углов 2-тета примерно 17,22-тета,примерно 18,42-тета, примерно 19,12-тета, примерно 20,82-тета и примерно 23,82-тета. В некоторых вариантах выполнения кристаллическая форма соединения 2 имеет картину дифракции рентгеновских лучей, которая коррелирует с картиной дифракции рентгеновских лучей, изображенной на фиг. 1. В одном аспекте описан способ получения соединения 2, включающий следующие стадии: а) взаимодействие гидрохлорида 4-метоксифенилгидразина с бромидом 4-бромбензила в присутствии триэтиламина и толуола с получением гидрохлорида N-(4-бромбензил)-N-(4-метоксифенил)гидразина; б) обработку продукта стадии (a) HCl с получением гидрохлорида N-(4-бромбензил)-N-(4-метоксифенил)гидразина; в) взаимодействие гидрохлорида N-(4-бромбензил)-N-(4-метоксифенил)гидразина с уксуснойкислотой, этиловым эфиром 5-трет-бутилсульфанил-2,2-диметил-4-оксопентановой кислоты и ацетатом натрия в толуоле с получением этилового эфира 3-[1-(4-бромбензил)-3-трет-бутилсульфанил-5-метокси 1H-индол-2-ил]-2,2-диметилпропионовой кислоты; г) взаимодействие этилового эфира 3-[1-(4-бромбензил)-3-трет-бутилсульфанил-5-метокси-1Hиндол-2-ил]-2,2-диметилпропионовой кислоты с 2-метил-2-пропантиолом и хлоридом алюминия в дихлорметане с получением этилового эфира 3-[1-(4-бромбензил)-3-трет-бутилсульфанил-5-гидрокси-1Hиндол-2-ил]-2,2-диметилпропионовой кислоты; д) взаимодействие этилового эфира 3-[1-(4-бромбензил)-3-трет-бутилсульфанил-5-гидрокси-1Hиндол-2-ил]-2,2-диметилпропионовой кислоты с бис(пинаколато)дибором в условиях реакции, опосредованной палладием, с получением этилового эфира 3-3-трет-бутилсульфанил-5-гидрокси-1-[4-(4,4,5,5 тетраметил-[1,3,2]диоксоборолан-2-ил)бензил]-1H-индол-2-ил-2,2-диметилпропионовой кислоты; е) взаимодействие этилового эфира 3-3-трет-бутилсульфанил-5-гидрокси-1-[4-(4,4,5,5-тетраметил[1,3,2]диоксоборолан-2-ил)бензил]-1H-индол-2-ил-2,2-диметилпропионовой кислоты с 5-бром-2 этоксипиридином в условиях реакции, опосредованных палладием, с получением этилового эфира 3-3 трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-гидрокси-1H-индол-2-ил-2,2-диметилпропионовой кислоты; ж) взаимодействие этилового эфира 3-3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-гидрокси-1H-индол-2-ил-2,2-диметилпропионовой кислоты с гидрохлоридом 2-хлор-5 метилпиридина в присутствии основания и растворителя с получением этилового эфира 3-[3-третбутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]2,2-диметилпропионовой кислоты; з) снижение количества остаточного палладия в этиловом эфире 3-[3-трет-бутилсульфанил-1-[4-(6 этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты; и и) образование соединения 2 из этилового эфира 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин 3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты. В некоторых вариантах выполнения способа стадия (з) включает обработку этилового эфира 3-[3 трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2 ил]-2,2-диметилпропионовой кислоты тиол-модифицированным силикагелем. В некоторых вариантах выполнения способа стадия (з) включает обработку этилового эфира 3-[3 трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)-бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол 2-ил]-2,2-диметилпропионовой кислоты тиол-модифицированным силикагелем или активированным углем. В некоторых вариантах выполнения способа стадия (з) включает обработку этилового эфира 3-[3 трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2 ил]-2,2-диметилпропионовой кислоты тиолмодифицированным силикагелем и активированным углем. В некоторых вариантах выполнения способа стадия (з) включает обработку этилового эфира 3-[3-третбутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]2,2-диметилпропионовой кислоты тиолмодифицированным силикагелем. В некоторых вариантах выполнения способа стадия (з) включает обработку этилового эфира 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты активированным углем. В некоторых вариантах выполнения способа стадия (и) включает взаимодействие этилового эфира 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1Hиндол-2-ил]-2,2-диметилпропионовой кислоты с гидроксидом натрия в подходящем растворителе. В некоторых вариантах выполнения способа стадия (и) дополнительно включает кристаллизацию (в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм) или осаждение соединения 2 из метил-трет-бутилового эфира. В некоторых вариантах выполнения способа образец соединения 2 содержит обнаружимое количество палладия, которое составляет менее 20 млн-1. В одном аспекте образец соединения 2 содержит менее 20 млн-1 палладия. В одном аспекте описан способ получения 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионата натрия (Соединения 2), включающий следующие стадии: А) взаимодействие соединения формулы (III) где X' представляет собой уходящую группу; в присутствии основания и растворителя с образованием соединения формулы (I) и Б) образование соединения 2 из соединения формулы (I) со стадии (А). В некоторых вариантах выполнения способа стадия (А) дополнительно включает выделение соединения формулы (I) перед стадией (Б). В некоторых вариантах выполнения способа стадия (А) дополнительно включает снижение количества палладия до менее примерно 20 млн-1. В одном аспекте снижение количества палладия включает обработку соединения формулы (I) тиолмодифицированным силикагелем. В некоторых вариантах выполнения способа продукт со стадии (А) выделяют. В некоторых вариантах выполнения способа продукт со стадии (А) не выделяют. В некоторых вариантах выполнения способа соединение формулы (III) получают с использованием реакций сочетания в присутствии палладия, и оно содержит остаточный палладий. В некоторых вариантах выполнения способа выделение продукта со стадии (А) включает снижение остаточного палладия. В некоторых вариантах выполнения способа для снижения остаточного палладия используют активированный уголь. В конкретном воплощении активированный уголь представляет собой DARCO KB-G,DARCO KB-WJ. В некоторых вариантах выполнения способа снижение остаточного палладия включает использование модифицированного силикагеля. В некоторых вариантах выполнения способа снижение остаточного палладия включает использованием тиол-модифицированного силикагеля. В некоторых вариантах выполнения способа реакционную смесь на стадии (А) нагревают до температуры от примерно 50 до примерно 90C. В некоторых вариантах выполнения способа стадия (Б) включает гидролиз сложноэфирной группировки продукта со стадии (А). В некоторых вариантах выполнения способа стадия (Б) включает обработку соединения формулы(I) со стадии (А) следующим: а) LiOH, КОН или Са(ОН)2 с последующим доведением pH с образованием карбоновой кислоты, затем NaOH; или б) NaOH. В некоторых вариантах выполнения способа стадия (Б) включает обработку соединения формулы(I) со стадии (A) LiOH, затем NaOH. В некоторых вариантах выполнения способа стадия (Б) включает обработку соединения формулы (I) со стадии (A) NaOH. В некоторых вариантах выполнения способа стадию (Б) проводят в системе растворителей, содержащей тетрагидрофуран, воду и спирт, выбранный из метанола и этанола. В некоторых вариантах выполнения способа стадию (Б) проводят в системе растворителей, содержащей тетрагидрофуран, воду и этанол. В конкретном аспекте способ получения соединения 2 дополнительно включает кристаллизацию соединения 2 с использованием метил-трет-бутилового эфира. Кристаллизация может происходить в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм. В некоторых вариантах выполнения способа R1 представляет собой -СН 3 или -СН 2 СН 3. В конкретном воплощении R1 представляет собой -СН 2 СН 3. В некоторых вариантах выполнения способа основание на стадии (А) представляет собой цезиевое основание, калиевое основание или натриевое основание. В некоторых вариантах выполнения способа основание представляет собой цезиевое основание. В конкретном воплощении основание представляет собой карбонат цезия. В некоторых вариантах выполнения способа X1 выбран из Cl, Вг, I, -OSO2CF3, -OSO2(4 метилфенил), -OSO2(фенил) и -OSO2CH3. В конкретных воплощениях X1 представляет собой Cl. В одном аспекте соединение формулы (III) получают путем взаимодействия соединения формулы где R1 представляет собой С 1-С 6 алкил, и В представляет собой бороновую кислоту или боронатный сложный эфир; с соединением формулы (V) в присутствии первого катализатора сочетания; где X представляет собой уходящую группу с получением соединения формулы (III) В некоторых вариантах выполнения способа X представляет собой галогенид или трифлат. В неко- 12019819 торых вариантах выполнения способа X выбран из Cl, Br, I, -OSO2CF3, -OSO2(4-метилфенил),-OSO2(фенил) и -OSO2CH3. В некоторых вариантах выполнения способа X выбран из Cl, Br, I и-OSO2CF3. В некоторых вариантах выполнения способа X представляет собой Br. В некоторых вариантах выполнения способа В выбран из В некоторых вариантах выполнения способа В представляет собой В одном аспекте первый катализатор сочетания представляет собой палладиевый катализатор. В некоторых вариантах выполнения способа палладиевый катализатор представляет собой тетракис(трифенилфосфин)палладий (Pd(PPh3)4). В некоторых вариантах выполнения способа реакция синтеза соединений формулы (III) дополнительно включает нагревание до температуры от примерно 60 до примерно 95C. В одном аспекте соединение формулы (IV) получают путем взаимодействия соединения формулы где X" представляет собой уходящую группу, и R1 представляет собой C1-С 6 алкил, с борирующим реагентом в присутствии второго катализатора сочетания с получением соединения формулы (IV) В некоторых вариантах выполнения способа X" выбран из Cl, Br, I и -OSO2CF3. В некоторых вариантах выполнения способа борирующий реагент выбран из пинаколборана, катехолборана, бис(неопентилгликолато)дибора, бис(пинаколато)дибора, бис(гексиленгликолато)дибора и бис(катохолато)дибора. В конкретных воплощениях борирующий реагент представляет собой бис(пинаколато)дибор. В одном аспекте второй катализатор сочетания представляет собой второй палладиевый катализатор. В конкретном воплощении второй палладиевый катализатор представляет собой дихлор[1,1'бис(дифенилфосфино)ферроцен]палладий (Pd(dppf)Cl2). В некоторых вариантах выполнения способа взаимодействие дополнительно включает нагревание до температуры от примерно 60 до примерно 95C. В одном аспекте соединение формулы (VI) получают путем (В) взаимодействия соединения формулы (VII)(Г) деметилирования продукта со стадии (В) с получением соответствующего фенола формулы (VI) В некоторых вариантах выполнения способа стадию (В) проводят при температуре от примерно 10 до примерно 35C. В некоторых вариантах выполнения способа X" выбран из Br, Cl и I. В конкретном воплощении R1 представляет собой -CH2CH3. В некоторых вариантах выполнения способа стадия (Г) включает взаимодействие продукта со стадии (В) с 2-метил-2-пропантиолом и AlCl3 в растворителе. В некоторых вариантах выполнения способа стадия (Г) включает взаимодействие продукта со стадии (В) с реагентом, представляющим собой кислоту Льюиса, в растворителе. В некоторых вариантах выполнения способа реагент, представляющий собой кислоту Льюиса, выбран из трихлорида алюминия(AlCl3), хлорида Fe(III), трифторида бора, пентахлорида ниобия и трифлатов лантанидов (таких как, например, трифлат иттербия(III. В еще одном варианте выполнения растворитель на стадии (Г) представляет собой дихлорметан. В одном варианте выполнения стадия (Г) включает взаимодействие продукта стадии (В) с 2-метил-2-пропантиолом и AlCl3 в растворителе. Раскрытые способы обеспечивают синтез соединения 1 и его фармацевтически приемлемых солей. Описанные здесь способы пригодны, в частности, для крупномасштабного химического производства соединения 1 и его фармацевтически приемлемых солей. Описаны также способы получения соединения 2 с хорошим выходом, которое имеет хорошую растворимость и хорошую пероральную биодоступность. Более конкретные схемы синтеза проиллюстрированы ниже. Синтез соединения 1 начинается с получения гидрохлорида 2-хлорметил-5-метил-пиридина и алкилового эфира 5-трет-бутилсульфанил-2,2-диметил-4-оксопентановой кислоты (структура 2-4, Схема 2). Получение гидрохлорида 2-хлорметил-5-метилпиридина показано на схеме 1. Схема 1. Синтез гидрохлорида 2-хлорметил-5-метилпиридина Окисление 2,5-диметилпиридина дает N-оксид 2,5-диметилпиридина. Обработка N-оксида 2,5 диметилпиридина уксусным ангидридом, затем основанием, таким как гидроксид натрия, дает (5-метилпиридин-2-ил)метанол. (5-Метилпиридин-2-ил)метанол затем обрабатывают тионилхлоридом с получением гидрохлорида 2-хлорметил-5-метилпиридина. Алкиловый эфир 5-трет-бутилсульфанил-2,2-диметил-4-оксопентановой кислоты получают, как показано на схеме 2. Схема 2. Получение алкилового эфира 5-трет-бутилсульфанил-2,2-диметил-4-оксопентановой кислоты Алкилизобутираты, имеющие структуру 2-1 (где R1 представляет собой алкил), обрабатывают диизопропиламидом лития (LDA), затем 2,3-дихлор-1-пропеном, что приводит к получению алкиловых эфиров 4-хлор-2,2-диметил-пент-4-еновой кислоты, имеющих структуру 2-2. В одном аспекте R1 выбран из метила, этила, пропила, изопропила и бутила. В другом аспекте R1 представляет собой метил или этил. В другом аспекте R1 представляет собой этил. Алкиловые эфиры 4-хлор-2,2-диметил-пент-4-еновой кислоты, имеющие структуру 2-2, обрабатывают бромом с получением алкиловых эфиров 5-бром-2,2-диметил 4-оксопентановой кислоты, имеющих структуру 2-3. Алкиловые эфиры 5-бром-2,2-диметил-4- 14019819 оксопентановой кислоты, имеющие структуру 2-3, обрабатывают 2-метил-2-пропантиолом в присутствии основания с получением алкиловых эфиров 5-трет-бутилсульфанил-2,2-диметил-4-оксопентановой кислоты, имеющих структуру 2-4. Синтез алкиловых эфиров 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5 метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропановой кислоты (соединения, имеющие структуру 3-5) показан на схеме 3. Схема 3. Получение алкиловых эфиров соединения 1(где R1 представляет собой С 1-С 6 алкил), с получением алкиловых эфиров 3-[1-(4-бромбензил)-3-третбутилсульфанил-5-метокси-1H-индол-2-ил]-2,2-диметилпропионовой кислоты, имеющих структуру 3-1. В одном аспекте R1 выбран из метила, этила, пропила, изопропила и бутила. В другом аспекте R1 представляет собой метил или этил. В другом аспекте R1 представляет собой этил. Деметилирование алкиловых эфиров, имеющих структуру 3-1, проводят 2-метил-2-пропантиолом и хлоридом алюминия с получением алкиловых эфиров, имеющих структуру 3-2. Превращение бромида в боронатный эфир достигается с использованием бис(пинаколато)дибора,ацетата калия и палладиевого катализатора. В одном аспекте палладиевый катализатор представляет собой Pd(dppf)Cl2. Алкиловые эфиры, имеющие структуру 3-3, затем подвергают реакции сочетания с 5 бром-2-этоксипиридином в условиях сочетания Сузуки с получением алкиловых эфиров, имеющих структуру 3-4. В одном аспекте условия сочетания Сузуки включают неорганическое основание и палладиевый катализатор. В одном аспекте условия сочетания Сузуки включают карбонат калия и тетракис(трифенилфосфин)палладий. Основания, используемые в опосредованных палладием реакциях, включают, без ограничений, карбонат цезия, триэтиламин, диизопропилэтиламин, 1,2,2,6,6-пентаметилпиперидин, трибутиламин, карбонат натрия, карбонат калия, ацетат натрия, ацетат калия и фосфат калия. Алкиловые эфиры, имеющие структуру 3-4, затем обрабатывают основанием, затем гидрохлоридом 2-хлор-5-метилпиридина с получением соединений, имеющих структуру 3-5. В одном аспекте основание представляет собой карбонат цезия. В некоторых вариантах выполнения соединения, имеющие структуру 3-5, обрабатывают очищающим средством для снижения количества палладия до менее примерно 20 млн-1. В одном аспекте очищающее средство для снижения количества палладия содержит тиол-модифицированный силикагель. В одном аспекте соединения, имеющие структуру 3-5, выделяют перед гидролизом эфира. В другом аспекте соединения, имеющие структуру 3-5, не выделяют перед гидролизом эфира. В одном аспекте выделение соединений, имеющих структуру 3-5, включает использование средства для снижения остаточного палладия. В одном аспекте средство для снижения остаточного палладия содержит активированный уголь. В еще одном воплощении активированный уголь представляет собой DARCO KB-G,DARCO KB-WJ. В других воплощениях средство для снижения остаточного палладия содержит модифицированный силикагель. В другом воплощении средство для снижения остаточного палладия содержит тиол-модифицированный силикагель. В одном аспекте соединения, имеющие структуру 3-5, превращают двухстадийным способом в соединение 2, как показано на схеме 4. Схема 4. Гидролиз и образование соли Гидролиз алкиловых эфиров, имеющих структуру 3-5, с использованием LiOH в подходящем растворителе обеспечивает, после корректирования рН, образование карбоновой кислоты, т.е. соединения 1. Соединение 1 затем обрабатывают гидроксидом натрия в этаноле с получением соединения 2. В одном аспекте соединение 2 получают из соединений, имеющих структуру 3-5, с высоким выходом, высокой чистотой путем осуществления одностадийного гидролиза и реакции образования соли. В одном аспекте алкиловые эфиры, имеющие структуру 3-5, превращают в соединение 2 с высоким выходом одностадийным способом, как показано на схеме 5. Схема 5. Одностадийный гидролиз и образование соли Обработка алкиловых эфиров, имеющих структуру 3-5, в подходящем растворителе 50% водным раствором гидроксида натрия приводит к образованию соединения 2. В одном аспекте реакционную смесь нагревают. В одном аспекте соединение 2 образуют (кристаллизацией, фазовым превращением в твердом состоянии или взаимопревращением кристаллических форм) или осаждают из растворителя Класса 3. В одном аспекте соединение 2 образуют или осаждают из метил-трет-бутилового эфира (МТВЕ). В одном аспекте соединение 2 кристаллизуют из метил-трет-бутилового эфира (МТВЕ). В некоторых вариантах выполнения способа соединение 1 обрабатывают гидроксидом калия в растворителе с образованием 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата калия. В некоторых вариантах выполнения способа соединение 1 обрабатывают гидроксидом лития в растворителе с образованием 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионата лития. В некоторых вариантах выполнения способа соединение 1 обрабатывают гидроксидом кальция в растворителе с образованием кальциевой соли 3-[3-(трет-бутилсульфанил)-1-[4-(6-этоксипиридин-3 ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты. В некоторых вариантах выполнения способа соединение 1 обрабатывают дициклогексиламином в растворителе с образованием соответствующей соли. В некоторых вариантах выполнения способа соединение 1 обрабатывают N-метил-D-глюкамином в растворителе с образованием соответствующей соли. В некоторых вариантах выполнения способа соединение 1 обрабатывают трис(гидроксиметил)метиламином в растворителе с образованием соответствующей соли. В некоторых вариантах выполнения способа соединение 1 обрабатывают аргинином в растворителе с образованием соответствующей соли. В некоторых вариантах выполнения способа соединение 1 обрабатывают лизином в растворителе с образованием соответствующей соли. Терминология Если не указано иное, термины, использованные в этой заявке, включая описание и формулу изобретения, имеют определения, приведенные ниже. Необходимо отметить, что использованные в описании и прилагаемой формуле изобретения формы единственного числа охватывают объекты во множественном числе, если контекст ясно не диктует иное. Если не указано иное, использованы общепринятые методы масс-спектроскопии, ЯМР, ВЭЖХ, химии белков, органического синтеза, биохимии, технологии рекомбинантных ДНК и фармакологии, которые находятся в пределах компетенции специалиста в данной области. В этой заявке использование союза "или" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других форм, таких как "включают", "включает" и"включающий" не является ограничивающим. Группа "алкил" относится к алифатической углеводородной группе. Алкильная группировка является разветвленной, прямоцепочечной или циклической. Алкильная группа может быть обозначена как"С 1-С 6 алкил". В одном аспекте алкил выбран из метила, этила, пропила, изопропила, бутила, изобутила,трет-бутила, пентила, неопентила, гексила, этенила, пропенила, аллила, бутенила, циклопропила, циклобутила, циклопентила, циклогексила и т.п."Обнаружимое количество" относится к количеству, измеряемому с использованием стандартных аналитических методов (например ионной хроматографией, масс-спектрометрией, ЯМР, ВЭЖХ, газовой хроматографией, элементным анализом, ИК спектроскопией, атомно-эмиссионной спектрометрией с индуктивно связанной плазмой, методом II согласно USP231 и т.д.) (ICH guidances, Q2A Text on Validation of Analytical Procedures (March 1995) и Q2B Validation of Analytical Procedures: Methodology (November 1996. Термин "приемлемый", используемый здесь применительно к лекарственной форме, композиции или ингредиенту, означает отсутствие стойкого вредного воздействия на общее здоровье субъекта, которого лечат. Используемый здесь термин "респираторное заболевание" относится к заболеваниям, поражающим органы, которые вовлечены в дыхание, такие как нос, горло, гортань, трахея, бронхи и легкие. Респираторные заболевания включают, без ограничений, астму, респираторный дистресс-синдром взрослых и аллергическую (приобретенную) астму, неаллергическую (врожденную) астму, острую тяжелую астму,хроническую астму, клиническую астму, ночную астму, аллерген-индуцированную астму, аспиринчувствительную астму, астму, вызываемую физической нагрузкой, изокапническую гипервентиляцию,астму с началом в детском возрасте, астму с началом во взрослом возрасте, кашлевую форму астмы,профессиональную астму, стероид-устойчивую астму, сезонную астму, сезонный аллергический ринит,круглогодичный аллергический ринит, хроническое обструктивное заболевание легких, включая хронический бронхит или эмфизему, легочную гипертензию, интерстициальный фиброз легкого и/или воспаление дыхательных путей и мусковисцидоз и гипоксию. Используемый здесь термин "астма" относится к любому расстройству легких, которое характеризуется изменениями в движении газов в легких, связанными с констрикцией дыхательных путей по любой причине (врожденной, приобретенной или обеими; аллергической или неаллергической). Термин"астма" может быть использован с одним или более прилагательными, указывающими причину. Используемый здесь термин "сердечно-сосудистое заболевание" относится к заболеваниям, поражающим сердце или кровеносные сосуды или и то и другое, включая, без ограничений, аритмию, атеросклероз и его последствия, стенокардию, ишемию миокарда, инфаркт миокарда, сердечную или сосудистую аневризму, васкулит, инсульт, периферическую обструктивную артериопатию конечности, органа или ткани, реперфузионное повреждение после ишемии головного мозга, сердца или другого органа или ткани, эндотоксический, хирургический или травматический шок, гипертензию, клапанное сердечное заболевание, сердечную недостаточность, аномальное кровяное давление, шок, вазоконстрикцию (в том числе ассоциированную с мигренями), сосудистое нарушение, воспаление, недостаточность, ограниченные одним органом или тканью. Используемый здесь термин "глазное заболевание" относится к заболеваниям, которые поражают глаз или глаза и возможно также окружающие ткани. Глазные заболевания включают, без ограничений,глазное воспаление, конъюнктивит, ретинит, склерит, увеит, аллергический конъюнктивит, весенний конъюнктивит, паппилярный конъюнктивит и увеоретинит. Используемый здесь термин "боль" относится к острой и хронической боли, которая может быть центральной или периферической болью. Боль включает, без ограничений, ноцицептивную боль, невропатическую боль, воспалительную боль и невоспалительную боль, например периферическую невропатическую боль. Используемый здесь термин "кожное заболевание" включает, без ограничений, экзему, псориаз, заболевание кожи, нейродермит, зуд, эксфолиативный дерматит, аллергический дерматит, пемфигус и реакции гиперчувствительности. Используемый здесь термин "эффективное количество" или "терапевтически эффективное количество" относится к достаточному количеству агента, предназначенного для введения, которое облегчает до некоторой степени один или более симптомов заболевания или состояния, которое лечат. Результатом может быть снижение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Например, "эффективное количество" для терапевтических применений представляет собой количество композиции, содержащей соединение, как описано здесь, требуемое для получения клинически значимого уменьшения симптомов заболевания. Термин"терапевтически эффективное количество" включает, например, профилактически эффективное количество. Эффективное количество выбирают с учетом конкретного пациента и уровня заболевания. Понятно, что "эффективное количество" или "терапевтически эффективное количество" варьирует от субъекта к субъекту в зависимости от метаболизма лекарственного средства, возраста, массы тела, общего состояния здоровья субъекта, состояния, которое лечат, тяжести состояния, которое лечат, и суждения лечащего врача. В одном воплощении соответствующее "эффективное" количество в любом конкретном случае определяют с использованием таких методов, как исследование с увеличением дозы. Используемый здесь термин "совместное введение" или тому подобные термины охватывают введение выбранных терапевтических агентов одному субъекту и включают режимы лечения, при которых эти агенты вводят одинаковым путем или разными путями введения или в одно и то же время или в разное время. Используемые здесь термины "усиливают" или "усиление" означают увеличение или пролонгирование либо силы действия, либо продолжительности желаемого эффекта. Так, что касается усиления эффекта терапевтических агентов, термин "усиление" относится к возможности увеличения или пролонгирования либо силы действия, либо продолжительности воздействия других терапевтических агентов на систему. Используемый здесь термин "усиливающее эффективное количество" относится к количеству,адекватному для усиления эффекта другого терапевтического агента в желаемой системе. Используемые здесь термины "фиброз" или "фиброзное расстройство" относятся к состояниям, которые сопровождают острое или хроническое воспаление и ассоциированы с аномальным накоплением клеток и/или коллагена и включают, без ограничений, фиброз отдельных органов или тканей, таких как сердце, почка, суставы, легкое или кожа, и включают такие расстройства, как идиопатический легочный фиброз и криптогенный фиброзный альвеолит. Используемый здесь термин "лейкотриен-запускаемые медиаторы" относится к молекулам, способным продуцироваться в организме пациента в результате избыточного продуцирования клетками при их стимуляции лейкотриенами, таким как, исключительно в качестве примера, LTB4, LTC4, LTE4, цистеинил-лейкотриены, моноцитарный воспалительный белок (MIP-1 ), интерлейкин-8 (IL-8), интерлейкин-4(IL-4), интерлейкин-13 (IL-13), моноцитарный белок-хемоаттрактант (МСР-1), растворимая молекула межклеточной адгезии (sICAM; растворимая ICAM), миелопероксидаза (МРО), эозинофильная пероксидаза (ЕРО) и общие молекулы воспаления, такие как интерлейкин-6 (IL-6), С-реактивный белок (CRP) и сывороточный амилоидный А белок (SAA). Используемый здесь термин "лейкотриен-связанные медиаторы" относится к молекулам, способным продуцироваться в организме пациента в результате избыточного продуцирования клетками при их стимуляции лейкотриенами, таким как, таким как, исключительно в качестве примера, LTB4, LTC4, LTE4,цистеинил-лейкотриены, моноцитарный воспалительный белок (MIP-1 ), интерлейкин-8 (IL-8), интерлейкин-4 (IL-4), интерлейкин-13 (IL-13), моноцитарный белок-хемоаттрактант (МСР-1), растворимая молекула межклеточной адгезии (sICAM; растворимая ICAM), миелопероксидаза (МРО), эозинофильная пероксидаза (ЕРО) и общие молекулы воспаления, такие как интерлейкин-6 (IL-6), С-реактивный белок(CRP) и сывороточный амилоидный А белок (SAA). Используемый здесь термин "лейкотриен-зависимый" относится к состояниям или расстройствам,которые не могут развиваться или не могут развиваться до такой степени в отсутствие одного или более лейкотриенов. Используемый здесь термин "лейкотриен-опосредованный" относится к состояниям или расстройствам, которые развиваются в отсутствие лейкотриенов, но также развиваются в присутствии одного или более лейкотриенов. Используемый здесь термин "лейкотриен-чувствительный пациент" относится к пациенту, который был идентифицирован либо по генотипу гаплотипов FLAP, либо по генотипу одного или более других генов в лейкотриеновом пути и/или по фенотипу пациентов либо по предыдущему позитивному клиническому ответу на другой модулятор лейкотриенов, включая, исключительно в качестве примера, зилейтон, монтелукаст, пранлукаст, зафирлукаст, и/или по их профилю лейкотриен-запускаемых медиаторов,которые указывают на избыточную стимуляцию воспалительных клеток лейкотриенами, как вероятный положительный ответ на терапию модуляторами лейкотриенов. Термины "набор" и "изделие" используются как синонимы."Метаболит" соединения, описанного здесь, представляет собой производное этого соединения, которое образуется при метаболизме соединения. Термин "активный метаболит" относится к биологически активному производному соединения, которое образуется при метаболизме (биотрансформации) соединения. Используемый здесь термин "метаболизированный" относится к сумме процессов (включая, без ограничений, реакции гидролиза и реакции, катализируемые ферментами), посредством которых орга- 18019819 низм изменяет конкретное вещество. Так, ферменты могут производить конкретные структурные изменения соединения. Например, цитохром Р 450 катализирует множество разных окислительновосстановительных реакций, а уридиндифосфатглюкуронилтрансферазы (UGT) катализируют перенос активированной молекулы глюкуроновой кислоты на ароматические спирты, алифатические спирты,карбоновые кислоты, амины и свободные сульфгидрильные группы (например реакции конъюгирования). Дополнительная информация по метаболизму имеется в The Pharmacological Basis of Therapeutics,9th Edition, McGraw-Hill (1996). В одном воплощении метаболиты соединений, описанных здесь, идентифицируют либо путем введения соединений хозяину и анализа образцов ткани, взятых у хозяина, либо путем инкубирования соединений с печеночными клетками in vitro и анализа полученных соединений. Используемый здесь термин "модулировать" означает взаимодействовать с мишенью либо прямо,либо косвенно, изменяя активность мишени, включая, исключительно в качестве примера, повышать активность мишени, ингибировать активность мишени, ограничивать активность мишени или продлевать активность мишени. Используемый здесь термин "модулятор" относится к молекуле, которая взаимодействует с мишенью либо прямо, либо косвенно. Взаимодействия включают, без ограничений, взаимодействия агониста и антагониста. Используемый здесь термин "пролекарство" относится к агенту, который превращается в родительское лекарственное средство in vivo. Пролекарства часто бывают полезными, поскольку в некоторых ситуациях их легче вводить, чем родительское лекарственное средство. Они могут быть, например, биодоступными при пероральном введении, тогда как родительское лекарственное средство может не быть перорально биодоступным. Пролекарство также может иметь лучшую растворимость в фармацевтических композициях по сравнению с родительским лекарственным средством. Примером пролекарства, без ограничения, может быть соединение 1, которое вводят в виде сложного эфира ("пролекарство") для облегчения прохождения через клеточную мембрану, где растворимость в воде вредна для подвижности, но который затем метаболически гидролизуется до карбоновой кислоты, т.е. активного вещества, сразу после попадания внутрь клетки, где растворимость в воде полезна. Еще одним примером пролекарства может быть короткий пептид (полиаминокислота), связанный с кислотной группой, где пептид метаболизируется с образованием активной группировки. Используемые здесь термины "субъект" или "пациент" охватывают млекопитающих. В одном аспекте млекопитающим является человек. В другом аспекте млекопитающим является примат, не являющийся человеком, такой как шимпанзе и другие человекообразные обезьяны и обезьяньи виды. В одном аспекте млекопитающим является сельскохозяйственное животное, такое как крупный рогатый скот, лошадь, овца, коза или свинья. В одном аспекте млекопитающим является домашнее животное, такое как кролик, собака или кошка. В одном аспекте млекопитающим является лабораторное животное, включая грызунов, таких как крысы, мыши и морские свинки и т.п."Биодоступность" относится к проценту введенной массы соединения 1 или его фармацевтически приемлемой соли и/или сольвата, который доставляется в общий кровоток животного или человека, которого исследуют. Общую экспозицию (AUC(0-лекарственного средства при внутривенном введении обычно определяют как 100%-ную биодоступность (F%). "Пероральная биодоступность" относится к той степени, в которой соединение 1 или его фармацевтически приемлемая соль и/или сольват всасывается в общий кровоток при пероральном приеме фармацевтической композиции по сравнению с внутривенной инъекцией."Концентрация в плазме крови" относится к концентрации соединения 1 в плазменном компоненте крови млекопитающего. Понятно, что концентрация соединения 1 в плазме может значительно различаться у субъектов из-за различий метаболизма и/или взаимодействий с другими терапевтическими агентами. В одном аспекте концентрация соединения 1 в плазме крови варьирует от субъекта к субъекту. Соответственно, такие показатели, как максимальная концентрация в плазме (Cmax), или время до достижения максимальной концентрации в плазме (Tmax), или общая площадь под кривой зависимости концентрации в плазме от времени (AUC(0-варьируют от субъекта к субъекту. Из-за этой вариабельности в одном воплощении количество, необходимое для определения "терапевтически эффективного количества" соединения 1, варьирует от субъекта к субъекту."Всасывание лекарственного средства" или "всасывание" типично относится к процессу прохождения лекарственного средства от места введения лекарственного средства через барьер в кровеносный сосуд или место действия, например прохождения лекарственного средства из желудочно-кишечного тракта в воротную вену или лимфатическую систему. Выражения "измеряемая концентрация в сыворотке крови" или "измеряемая концентрация в плазме крови" описывают концентрацию в сыворотке крови или в плазме крови, обычно измеряемую в мг, мкг или нг терапевтического агента, всосавшегося в кровоток после введения, на мл, дл или л сыворотки крови. Здесь измеряемые концентрации в плазме крови обычно определены в нг/мл или мкг/мл."Фармакодинамика" относится к факторам, которые определяют биологический ответ, наблюдае- 19019819 мый в отношении концентрации лекарственного средства в месте действия."Фармакокинетика" относится к факторам, которые определяют достижение и сохранение соответствующей концентрации лекарственного средства в месте действия. Используемый здесь термин "устойчивое состояние" означает, что количество введенного лекарственного средства равно количеству выведенного из организма лекарственного средства за один интервал времени между приемами лекарственного средства, в результате чего создается плато или постоянная экспозиция лекарственного средства в плазме. Используемый здесь термин "лечить" или "лечение" относится к любому лечению расстройства или заболевания, такому как предупреждение возникновения расстройства или заболевания у субъекта,предрасположенного к этому расстройству или заболеванию, но еще не диагностированного как имеющего это расстройство или заболевание; ингибирование расстройства или заболевания, например остановка развития расстройства или заболевания, ослабление расстройства или заболевания, вызывание регрессии расстройства или заболевания, облегчение состояния, вызванного заболеванием или расстройством, или прекращение симптомов заболевания или расстройства профилактически и/или терапевтически. Таким образом, используемый здесь термин "лечить" используется как синоним термина "предупреждать"."Очищающее средство для снижения количества палладия" или "средство для снижения остаточного палладия" (или подобная фраза) относятся к средствам, используемым для снижения количества палладия в образцах, содержащих активные фармацевтические ингредиенты, с целью соблюдения нормативов технических условий ("Guideline on the Specification Limits for Residues of Metal Catalysts" EuropeanCPMP/SWP/QWP/4446/00 corr). В одном аспекте снижение количества палладия включает, без ограничений, обработку твердым тримеркаптотриазином (ТМТ), полистирол-связанным ТМТ, меркаптопористый полистирол-связанным ТМТ, полистирол-связанным этилендиамином, активированным углем,стеклянными шариковыми губками, Smopex, очистителями, связанными с диоксидом кремния, тиолмодифицированным силикагелем, N-ацетилцистеином, n-Bu3P, кристаллизацией, экстракцией, Iцистеином, n-Bu3P/молочной кислотой (Garrett et al., Adv. Synth. Catal. 2004, 346, 889-900). В одном аспекте активированный уголь включает, без ограничений, DARCO KB-G, DARCO KB-WJ. В одном аспекте очистители, связанные с диоксидом кремния, включают, без ограничений: означает силикагель. Подходящие растворители Терапевтические агенты, которые вводят млекопитающим, таким как люди, должны быть получены в соответствии с нормативными документами. Такие государственные нормативные документы соответствуют директивам надлежащей производственной практики (Good Manufacturing Practice (GMP. Директивы GMP указывают приемлемые уровни загрязнения активных терапевтических агентов, такие как,например, количество остаточного растворителя в конечном продукте. Предпочтительными растворителями являются растворители, подходящие для применения в аппаратуре GMP и согласующиеся с вопросами промышленной безопасности. Категории растворителей определены, например, в материалах Международной конференции по гармонизации технических требований к регистрации лекарственных средств для человека (International Conference on Harmonization of Technical Requirements for Registrationof Pharmaceuticals for Human Use (ICH), "Impurities: Guidelines for Residual Solvents, Q3C(R3), (November 2005. Растворители делятся на три класса. Растворители класса 1 токсичны, и их нужно избегать. Растворителями класса 2 являются растворители, использование которых ограничено в процессе производства терапевтического агента. Растворителями класса 3 являются растворители с низким потенциалом ток- 20019819 сичности и низшим риском для здоровья человека. Данные по растворителям класса 3 указывают на то,что они менее токсичны в экстренных или краткосрочных исследованиях и негативны в исследованиях генотоксичности. Растворители класса 1, которых нужно избегать, включают бензол, четыреххлористый углерод, 1,2 дихлорэтан, 1,1-дихлорэтен и 1,1,1-трихлорэтан. Примерами растворителей класса 2 являются ацетонитрил, хлорбензол, хлороформ, циклогексан,1,2-дихлорэтен, дихлорметан, 1,2-диметоксиэтан, N,N-диметилацетамид, N,N-диметилформамид, 1,4 диоксан, 2-этоксиэтанол, этиленгликоль, формамид, гексан, метанол, 2-метоксиэтанол, метилбутилкетон,метилциклогексан, N-метилпирролидин, нитрометан, пиридин, сульфолан, тетралин, толуол, 1,1,2 трихлорэтен и ксилол. Растворители класса 3, которые обладают низкой токсичностью, включают уксусную кислоту, ацетон, анизол, 1-бутанол, 2-бутанол, бутилацетат, трет-бутилметиловый эфир (МТВЕ), кумол, диметилсульфоксид, этанол, этилацетат, диэтиловый эфир, этилформиат, муравьиную кислоту, гептан, изобутилацетат, изопропилацетат, метилацетат, 3-метил-1-бутанол, метилэтилкетон, метилизобутилкетон, 2 метил-1-пропанол, пентан, 1-пентанол, 1-пропанол, 2-пропанол, пропилацетат и тетрагидрофуран. Остаточные растворители в активных фармацевтических ингредиентах (АФИ) связаны с процессом производства АФИ. В некоторых случаях растворители не полностью удаляются осуществляемыми на практике производственными методами. Выбор подходящего растворителя для синтеза АФИ может повышать выход или определять характеристики, такие как кристаллическая форма, чистота и растворимость. Следовательно, растворитель является ключевым параметром в процессе синтеза. В некоторых воплощениях композиции по изобретению содержат органический(ие) растворитель(и). В некоторых воплощениях композиции по изобретению содержат остаточное количество органического(их) растворителя(ей). В некоторых воплощениях композиции по изобретению содержат остаточное количество растворителя класса 3. В некоторых воплощениях органический растворитель представляет собой растворитель класса 3. В некоторых воплощениях растворитель Класса 3 выбран из группы, состоящей из уксусной кислоты, ацетона, анизола, 1-бутанола, 2-бутанола, бутилацетата, третбутилметилового эфира, кумола, диметилсульфоксида, этанола, этилацетата, диэтилового эфира, этилформиата, муравьиной кислоты, гептана, изобутилацетата, изопропилацетата, метилацетата, 3-метил-1 бутанола, метилэтилкетона, метилизобутилкетона, 2-метил-1-пропанола, пентана, 1-пентанола, 1 пропанола, 2-пропанола, пропилацетата и тетрагидрофурана. В некоторых воплощениях растворитель класса 3 выбран из этилацетата, изопропилацетата, трет-бутилметилового эфира, гептана, изопропанола и этанола. В одном аспекте композиции по изобретению включают обнаружимое количество органического растворителя. В некоторых воплощениях органический растворитель представляет собой растворитель класса 3. В некоторых воплощениях растворитель класса 3 выбран из группы, состоящей из уксусной кислоты, ацетона, анизола, 1-бутанола, 2-бутанола, бутилацетата, трет-бутилметилового эфира, кумола,диметилсульфоксида, этанола, этилацетата, диэтилового эфира, этилформиата, муравьиной кислоты,гептана, изобутилацетата, изопропилацетата, метилацетата, 3-метил-1-бутанола, метилэтилкетона, метилизобутилкетона, 2-метил-1-пропанола, пентана, 1-пентанола, 1-пропанола, 2-пропанола, пропилацетата и тетрагидрофурана. В еще одном дополнительном воплощении растворитель класса 3 выбран из этилацетата, изопропилацетата, трет-бутилметилового эфира, гептана, изопропанола и этанола. В других воплощениях органический растворитель выбран из изопропанола, ацетонитрила, этанола, пропиленгликоля и метилцеллюлозы в воде. В других воплощениях описаны композиции по изобретению, содержащие обнаружимое количество растворителя, которое составляет менее примерно 1%, где растворитель выбран из 1,2 диметоксиэтана, ацетонитрила, этилацетата, тетрагидрофурана, метанола, этанола, гептана и 2 пропанола. В еще одном воплощении композиции по изобретению содержат обнаружимое количество растворителя, которое составляет менеепримерно 5000 млн-1. В еще одном воплощении описаны композиции по изобретению, где обнаружимое количество растворителя составляет менее примерно 5000 млн-1,менее примерно 4000 млн-1, менее примерно 3000 млн-1, менее примерно 2000 млн-1, менее примерно 1000 млн-1, менее примерно 500 млн-1 или менее примерно 100 млн-1. В некоторых таких воплощениях композиция по изобретению содержит обнаружимое количество растворителя, выбранного из 1,2-диметоксиэтана, этилацетата, метанола, этанола, тетрагидрофурана и метил-трет-бутилового эфира, где растворители обнаруживаются на уровнях менее примерно 5000 млн-1. В некоторых воплощениях композиция содержит обнаружимое количество растворителя, выбранного из 1,2-диметоксиэтана, этилацетата, метанола, этанола, тетрагидрофурана и метил-трет-бутилового эфира,где растворители обнаруживаются на уровнях менее примерно 4000 млн-1. В некоторых воплощениях композиция содержит обнаружимое количество растворителя, выбранного из 1,2-диметоксиэтана, этилацетата, метанола, этанола, тетрагидрофурана и метил-трет-бутилового эфира, где растворители обнаруживаются на уровнях менее примерно 3000 млн-1. В некоторых воплощениях композиция содержит обнаружимое количество растворителя, выбранного из 1,2-диметоксиэтана, этилацетата, метанола, этанола,тетрагидрофурана и метил-трет-бутилового эфира, где растворители обнаруживаются на уровнях менее- 21019819 примерно 2000 млн-1. В некоторых воплощениях композиция содержит обнаружимое количество растворителя, выбранного из 1,2-диметоксиэтана, этилацетата, метанола, этанола, тетрагидрофурана и метилтрет-бутилового эфира, где растворители обнаруживаются на уровнях менее примерно 1000 млн-1. Фармацевтические композиции/лекарственные средства В некоторых воплощениях описана пероральная фармацевтическая композиция, содержащая: (а) примерно 1 г натриевой соли 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5 метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты (Соединение 2); и (б) примерно 100 мл раствора, содержащего 1% (мас./мас.) Poloxamer 124 и 99% (мас./мас.) водного буферного раствора карбоната натрия (0,01 ОМ, pH 9-10), подслащенного сукралозой. В некоторых воплощениях описана пероральная фармацевтическая композиция, содержащая (а) примерно 1 г или примерно 10 мг/мл натриевой соли Соединения 1 (Соединение 2); и (б) примерно 100 мл примерно 10 мМ водного буферного раствора карбоната натрия с pH примерно 9-10, содержащего примерно 10% мас./мас. абсолютного этанола и примерно 0,003% мас./мас. аспартама. В конкретном воплощении предложена пероральная фармацевтическая композиция, содержащая (а) примерно 10 мг/мл Соединения 2; (б) раствор, содержащий примерно 1% мас./мас. Poloxamer 124 и примерно 99% мас./мас. водного буферного раствора карбоната натрия (примерно 0,010 М, pH примерно 9-10) и (в) сукралозу(примерно 5 мг/100 мл). В некоторых воплощениях любая описанная здесь пероральная фармацевтическая композиция содержит или приготовлена в однократной дозе, содержащей от примерно 10 до примерно 1000 мг фармацевтически активной соли соединения 1. В конкретных воплощениях однократная доза содержит примерно от 10 до примерно 600 мг, от примерно 20 до примерно 600 мг, от примерно 40 до примерно 600 мг или от примерно 50 до примерно 600 мг фармацевтически приемлемой соли соединения 1. В конкретных воплощениях однократная доза при введении здоровым взрослым субъектам-людям натощак обеспечивает Cmax (максимальная концентрация в плазме крови) от примерно 0,1 до примерно 30 мкМ, от примерно 0,2 до примерно 30 мкМ или от примерно 0,1 до примерно 5 мкМ. В некоторых воплощениях однократная доза при введении здоровым взрослым субъектам-людям натощак обеспечивает AUC0-24 (площадь под кривой зависимости концентрации в плазме от времени за период времени от 0 до 24 ч) от примерно 4 до примерно 160 чмкМ, от примерно 5 до примерно 110 чмкМ, от примерно 5 до примерно 90 чмкМ, от примерно 5 до примерно 50 чмкМ, от примерно 5 до примерно 25 чмкМ. В некоторых воплощениях однократная доза фармацевтической композиции при введении здоровым взрослым субъектам-людям натощак обеспечивает Cmax, которая составляет менее примерно 5 мкМ, менее примерно 9 мкМ или менее примерно 12 мкМ. В некоторых воплощениях однократная доза пероральной фармацевтической композиции при введении здоровым взрослым субъектам-людям натощак обеспечивает примерно через 8 ч по меньшей мере 25%-ное, по меньшей мере 50%-ное, по меньшей мере 60%-ное, по меньшей мере 70%-ное, по меньшей мере 80%-ное или по меньшей мере 90%-ное снижение уровней LTB4 в крови. В некоторых воплощениях однократная доза обеспечивает примерно через 24 ч по меньшей мере 5%-ное, по меньшей мере 10%ное, по меньшей мере 20%-ное, по меньшей мере 30%-ное, по меньшей мере 40%-ное или по меньшей мере 50%-ное снижение уровней LTB4 в крови. В некоторых воплощениях однократная доза обеспечивает по меньшей мере 25%-ное, по меньшей мере 50%-ное, по меньшей мере 60%-ное, по меньшей мере 70%-ное, по меньшей мере 80%-ное или по меньшей мере 90%-ное снижение уровней LTB4 в моче. В конретных воплощениях фармацевтически активная соль Соединения 1 представляет собой соединение 2. В некоторых воплощениях однократная доза пероральной фармацевтической композиции содержит от примерно 10 мг до примерно 1 г, от примерно 10 до примерно 600 мг, примерно 10 мг, примерно 50 мг,примерно 150 мг, примерно 300 мг, примерно 600 мг или примерно 1000 мг соединения 2. В некоторых воплощениях фармацевтическая композиция в пероральной твердой лекарственной форме содержит: (а) от примерно 10 мг до примерно 1 г, или от примерно 50 мг до примерно 1 г, или от примерно 50 мг до примерно 600 мг соединения 2; и (б) по меньшей мере один неактивный фармацевтический ингредиент. В конкретных воплощениях пероральная твердая лекарственная форма содержит примерно 10 мг, примерно 50 мг, примерно 100 мг, примерно 150 мг, примерно 200 мг, примерно 250 мг,примерно 300 мг, примерно 450 мг или примерно 600 мг Соединения 2. В конкретных воплощениях пероральная твердая лекарственная форма содержит примерно 10 мг, примерно 50 мг, примерно 100 мг,примерно 150 мг, примерно 200 мг, примерно 250 мг или примерно 300 мг Соединения 2. В некоторых воплощениях фармацевтическая композиция в пероральной твердой лекарственной форме содержит менее примерно 10 млн-1 палладия. В некоторых воплощениях фармацевтическая композиция в пероральной твердой лекарственной форме содержит менее примерно 5000 млн-1 этилацетата. В некоторых воплощениях пероральная твердая лекарственная форма содержит менее примерно 5000 млн-1 этанола. В некоторых воплощениях фармацевтическая композиция в пероральной твердой лекарственной форме содержит кристаллическую форму соединения 2. В некоторых воплощениях соединение 2 находится в кристаллической форме, имеющей картину дифракции рентгеновских лучей с характеристическими значениями углов 2-тета примерно 17,22-тета, примерно 18,42-тета, примерно 19,12-тета, примерно 20,82-тета и примерно 23,82-тета. В некоторых воплощениях Соединение 2 находится кристаллической форме, имеющей спектр дифракции рентгеновских лучей, по существу аналогичный спектру, представленному на фиг. 1. В некоторых воплощениях Соединение 2 находится в кристаллической форме, имеющей картину дифракции рентгеновских лучей с характеристическими значениями градусов 2-тета примерно 6,62-тета, примерно 8,12-тета, примерно 19,72-тета, примерно 21,02-тета, примерно 21,92-тета и примерно 22,12-тета. В некоторых воплощениях Соединение 2 находится в кристаллической форме,имеющей спектр дифракции рентгеновских лучей, по существу аналогичный спектру, представленному на фиг. 2. В некоторых воплощениях пероральная твердая лекарственная форма содержит аморфную фазу (фазу А) соединения 2. В некоторых воплощениях описанные здесь фармацевтические композиции содержат кристаллическое соединение 2 и обнаружимое количество аморфного соединения 2. В некоторых воплощениях соединение 2 находится в форме/фазе, которая имеет растворимость в воде выше примерно 10 мг/мл при pH от примерно 9 до примерно 10 и при температуре примерно 25C. В некоторых воплощениях композиция содержит обнаружимое количество палладия, составляющее менее 20 млн-1. В некоторых других воплощениях композиция содержит обнаружимое количество палладия, составляющее менее 10 млн-1. В других воплощениях композиция содержит обнаружимое количество палладия, составляющее менее 5 млн-1. В некоторых воплощениях композиция содержит кристаллическое соединение 2. В некоторых воплощениях кристаллическое соединение 2 представляет собой полиморфную Форму В. В конкретном воплощении кристаллическое соединение 2 представляет собой полиморфную Форму С. В некоторых воплощениях композиция содержит аморфное соединение 2. В некоторых воплощениях композиция содержит обнаружимое количество воды. В некоторых воплощениях описанная здесь композиция содержит Соединение 2, которое кристаллизовано или осаждено из метил-трет-бутилового эфира. В некоторых воплощениях композиция содержит соединение 2, которое подвергнуто кристаллизации (в результате кристаллизации, фазового превращения в твердом состоянии или взаимопревращения кристаллических форм) из метил-трет-бутилового эфира. В некоторых воплощениях композиция соединения 2 содержит обнаружимое количество соединения, выбранного из: В некоторых воплощениях соединение 2 имеет чистоту более 97%. В других воплощениях соединение 2 имеет чистоту более 98%. В других воплощениях соединение 2 имеет чистоту более 99%. В одном аспекте любая описанная здесь фармацевтическая композиция в пероральной твердой лекарственной форме обеспечивает быстрое всасывание активного ингредиента в желудке и в верхних отделах желудочно-кишечного тракта. В конкретных воплощениях предложена пероральная твердая лекарственная форма в форме таблетки. В более конкретных воплощениях таблетка представляет собой таблетку немедленного высвобождения. В некоторых воплощениях пероральная твердая лекарственная форма, содержащая соединение 2,демонстрирует высвобождение in vitro соединения 2 в примерно 1% растворе лаурилсульфата натрия приpH примерно 7 и при температуре примерно 37C более чем примерно 90% примерно через 10 мин. В конкретных воплощениях высвобождение in vitro измеряют тестированием высвобождения лекарственного средства с использованием вращающейся корзинки Типа 1 согласно Фармакопее США (USP) при примерно 100 об./мин с примерно 500 мл примерно 1%-ного раствора лаурилсульфата натрия при pH примерно 7 и при температуре примерно 37C. В некоторых воплощениях предложена фармацевтическая композиция, содержащая Соединение 2,например фармацевтическая композиция в пероральной твердой лекарственной форме, где введение од- 23019819 нократной дозы фармацевтической композиции здоровому взрослому субъекту-человеку натощак обеспечивает Cmax менее примерно 5 мкМ и обеспечивает примерно через 8 ч по меньшей мере 80%-ное снижение уровней LTB4 в крови. В некоторых воплощениях предложена фармацевтическая композиция,например фармацевтическая композиция в пероральной твердой лекарственной форме, где введение однократной дозы фармацевтической композиции здоровому взрослому субъекту-человеку натощак обеспечивает примерно через 24 ч по меньшей мере 30%-ное снижение уровней LTB4 в крови. В некоторых воплощениях предложена фармацевтическая композиция, например фармацевтическая композиция в пероральной твердой лекарственной форме, где введение однократной дозы фармацевтической композиции здоровому взрослому субъекту-человеку натощак обеспечивает примерно через 24 ч по меньшей мере 50%-ное снижение уровней LTE4 в моче. В некоторых воплощениях любая описанная здесь пероральная твердая лекарственная форма содержит связывающий агент, разрыхлитель и глидант в качестве неактивных фармацевтических ингредиентов. В конкретных воплощениях неактивные фармацевтические ингредиенты включают силицированную микрокристаллическую целлюлозу (SMCC), маннит, кросповидон и стеарат магния. В некоторых воплощениях предложенные фармацевтические композиции в пероральной твердой лекарственной форме содержат от примерно 1 до примерно 99%, от примерно 1 до примерно 30%, от примерно 1 до примерно 20% или от примерно 10 до примерно 20 мас.% соединения 2. Описанные здесь фармацевтические композиции представляют собой фармацевтические композиции, которые после введения млекопитающему дают по меньшей мере один метаболит соединения 1. В конкретных воплощениях по меньшей мере один метаболит выбран из 3-[3-трет-бутилсульфинил-1-[4-(6 этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты, 3-[3-трет-бутилсульфанил-1-[4-(6-гидроксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты,3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метил-N-оксипиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты, ацилглюкуронида 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5 метилпиридин-2-илметокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты и их комбинаций. В конкретных воплощениях по меньшей мере один метаболит представляет собой ацилглюкуронид 3-[3-третбутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-илметокси)-1H-индол-2-ил]2,2-диметилпропионовой кислоты. В некоторых воплощениях фармацевтическая композиция содержит фармацевтически приемлемую (например натриевую) соль 3-[3-трет-бутилсульфанил-1-[4-(6-этоксипиридин-3-ил)бензил]-5-(5-метилпиридин-2-ил-метокси)-1H-индол-2-ил]-2,2-диметилпропионовой кислоты. В некоторых воплощениях предложена фармацевтическая композиция, содержащая активный ингредиент, который ингибирует белок, активирующий 5-липоксигеназу (FLAP), и, по существу, не ингибирует по меньшей мере один фермент цитохром Р 450, выбранный из CYP 3A4, CYP 1A2, CYP 2A6,CYP 2B6, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6 и CYP 2E1, в дозах вплоть до 40 мкМ или 50 мкМ. В некоторых воплощениях фармацевтическая композиция, содержащая активный ингибитор FLAP имеетIC50 (50%-ная ингибирующая концентрация) более примерно 40 или 50 мкМ в отношении по меньшей мере одного фермента цитохром Р 450, выбранного из CYP 3A4, CYP 1A2, CYP 2 А 6, CYP 2B6, CYP 2C8,CYP 2C9, CYP 2C19, CYP 2D6 и CYP 2E1. В некоторых воплощениях фармацевтическая композиция по существу не индуцирует цитохром Р 450 CYP 3A4, CYP 2C9, CYP 1A2, CYP 2C19 или CYP 2D6 в дозах вплоть до 40 мкМ или вплоть до 50 мкМ. В некоторых воплощениях фармацевтическая композиция, содержащая активный ингибитор FLAP, имеет IC50 более примерно 40 или 50 мкМ в отношении по меньшей мере одного фермента цитохром Р 450, выбранного из CYP 3A4, CYP 2C9, CYP 1A2, CYP 2 С 19 иCYP 2D6. В некоторых воплощениях ингибитор FLAP представляет собой соединение 1 или его фармацевтически приемлемую соль. В конкретном воплощении ингибитор FLAP представляет собой соединение 1. В другом конкретном воплощении ингибитор FLAP представляет собой соединение 2. В некоторых воплощениях предложена фармацевтическая композиция в пероральной твердой лекарственной форме, содержащая: (а) Соединение 2 и (б) возможно, по меньшей мере один неактивный фармацевтический ингредиент. В конкретных воплощениях фармацевтическая композиция в пероральной твердой лекарственной форме представляет собой композицию в форме капсулы. В более конкретных воплощениях капсула представляет собой твердую желатиновую капсулу. В различных воплощениях описанные здесь капсулы содержат по меньшей мере один эксципиент или не содержат эксципиентов. В некоторых воплощениях cоединение 2 в пероральной лекарственной форме является аморфным, частично кристаллическим или кристаллическим. В конкретных воплощениях cоединение 2 является кристаллическим. В одном аспекте описаны фармацевтические композиции для перорального введения млекопитающему, содержащие активный ингредиент, который ингибирует FLAP и по существу не вызывает увеличения массы печени млекопитающего. В некоторых воплощениях активный ингредиент представляет собой cоединение 1 или его фармацевтически приемлемую соль. В одном конкретном воплощении активный ингредиент представляет собой cоединение 1. В другом конкретном воплощении активный ингредиент представляет собой cоединение 2. В любом из описанных здесь аспектов лечение дополнительно включает введение по меньшей мере одного дополнительного фармацевтического агента, выбранного из ингалируемых кортикостероидов,бета-агонистов кратковременного действия, бета-агонистов длительного действия, антигистаминных средств, антихолинергических средств, нестероидных агонистов GR, противоинфекционных средств и противовирусных средств. В одном аспекте cоединение 1 или его фармацевтически приемлемую соль (например cоединение 2) применяют для лечения пациентов, страдающих лейкотриен-зависимыми состояниями или заболеваниями, включая, без ограничений, астму, хроническое обструктивное заболевание легких, легочную гипертензию, интерстициальный фиброз легкого, аллергический ринит, респираторный дистресс-синдром взрослых и воспалительные состояния. В одном аспекте описаны способы модулирования, включая снижение и/или ингибирование, активности белка, активирующего 5-липоксигеназу, прямо или косвенно, у млекопитающего, включающие, по меньшей мере, однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте описаны способы модулирования, включая снижение и/или ингибирование, активности лейкотриенов у млекопитающего, прямо или косвенно, включающие по меньшей мере однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте описаны способы лечения лейкотриен-зависимых или лейкотриен-опосредованных состояний или заболеваний, включающие по меньшей мере однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте описаны способы лечения млекопитающих с воспалительным и/или аллергическим состоянием, включающие по меньшей мере однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте описаны способы лечения воспаления у млекопитающего, включающие, по меньшей мере, однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). Респираторное заболевание включает, без ограничений, респираторный дистресс-синдром взрослых и аллергическую (приобретенную) астму, неаллергическую (врожденную) астму, острую тяжелую астму,хроническую астму, клиническую астму, ночную астму, астму, вызванную аллергеном, астму, вызванную физической нагрузкой, изокапническую гипервентиляцию, астму с началом в детском возрасте, астму с началом во взрослом возрасте, кашлевую форму астмы, профессиональную астму, астму, устойчивую к стероидам, сезонную астму, аллергический ринит, вазомоторный ринит, сосудистые реакции, эндотоксический шок, фиброгенез, легочный фиброз, аллергические заболевания, хроническое воспаление и респираторный дистресс-синдром взрослых. Хроническое обструктивное заболевание легких включает, без ограничений, хронический бронхит или эмфизему, легочную гипертензию, интерстициальный фиброз легкого и/или воспаление дыхательных путей и мусковисцидоз. В одном аспекте описаны способы предупреждения увеличения секреции слизи и/или отека у млекопитающего, включающие, по меньшей мере, однократное введение млекопитающему эффективного количества cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте описаны способы предупреждения рекрутинга эозинофилов, и/или базофилов,и/или дендритных клеток, и/или нейтрофилов, и/или моноцитов у млекопитающего, включающие, по меньшей мере, однократное введение млекопитающему эффективного количества соединения 1 или его фармацевтически приемлемой соли (например соединения 2). В другом аспекте описаны способы предупреждения или лечения острых или хронических расстройств, в которые вовлечен рекрутинг или активация эозинофилов, у млекопитающего, включающие по меньшей мере однократное введение млекопитающему эффективного количества соединения 1 или его фармацевтически приемлемой соли (например соединения 2). В любом из вышеупомянутых аспектов млекопитающим является человек. В любом из вышеупомянутых аспектов млекопитающим является человек, включая воплощения, где (а) человек имеет астматическое состояние или одно или более других состояний, выбранных из группы, состоящей из аллергической (приобретенной) астмы, неаллергической (врожденной) астмы, острой тяжелой астмы, хронической астмы, клинической астмы, ночной астмы, астмы, вызванной аллергеном, астмы, изокапнической гипервентиляции, астмы с началом в детском возрасте, астмы с началом во взрослом возрасте, кашлевой формы астмы, профессиональной астмы, астмы, устойчивой к стероидам, или сезонной астмы, или хронического обструктивного заболевания легких, или легочной гипертензии, или интерстициального фиброза легкого. В любом из вышеупомянутых аспектов предусмотрены дополнительные воплощения, в которых млекопитающее представляет собой животную модель воспаления легких, примеры которой приведены в данном описании. В любом из вышеупомянутых аспектов предусмотрены дополнительные воплощения, включающие однократные введения эффективного количества соединения 1 или его фармацевтически приемлемой соли (например соединения 2), в том числе дополнительные воплощения, в которых соединение 1 или его фармацевтически приемлемую соль (например соединение 2) (1) вводят один раз в сутки; (2) вводят два раза в сутки; или (3) вводят многократно на протяжении одних суток. В любом из вышеупомянутых аспектов предложены дополнительные воплощения, включающие многократные введения эффективного количества соединения, в том числе дополнительные воплощения,в которых (1) соединение вводят в однократной дозе; (2) время между многократными введениями составляет каждые 6 ч; (3) время между многократными введениями составляет каждые 8 ч; (4) время между многократными введениями составляет каждые 12 ч. В некоторых воплощениях описанные здесь способы лечения или предупреждения включают отдых от лекарственных средств, когда введение соединения 1 или его фармацевтически приемлемой соли (например Соединения 2) временно приостанавливают, или вводимую дозу временно снижают, и по окончании отдыха от лекарственных средств введение возобновляют. В некоторых воплощениях длительность отдыха от лекарственных средств варьирует от 2 суток до 1 года. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например соединение 2) применяют в изготовлении лекарственных средств для лечения лейкотриен-зависимых состояний, расстройств или заболеваний у человека с отсутствием клинического ответа на монтелукаст. В некоторых воплощениях лейкотриен-зависимое состояние, расстройство или заболевание представляет собой респираторное заболевание или состояние. В конкретном воплощении респираторное заболевание или состояние представляет собой астму. В одном аспекте описано лечение лейкотриен-зависимых состояний, заболеваний или расстройств у человека с отсутствием клинического ответа на монтелукаст. В некоторых воплощениях лейкотриензависимое состояние, расстройство или заболевание представляет собой респираторное заболевание или состояние. В конкретном воплощении респираторное заболевание или состояние представляет собой астму. В конкретном воплощении пациенту с отсутствием клинического ответа на монтелукаст вводят соединение 1 или его фармацевтически приемлемую соль (например соединение 2). В одном аспекте дозу соединения 1 или его фармацевтически приемлемой соли (например соединения 2), которую вводят здоровым пациентам-людям, снижают у пациентов-людей, которые не имеют или имеют недостаточные уровни фермента UDP (уридиндифосфат)-глюкуронозилтранфераза, обычно присутствующие у человека. В одном аспекте предложен способ увеличения биодоступности перорально вводимой дозы Соединения 1 или его фармацевтически приемлемой соли (например соединения 2) у здоровых пациентовлюдей, включающий пероральное введение млекопитающему: (1) дозы соединения 1 или его фармацевтически приемлемой соли (например соединения 2); и (2) ингибитора фермента UDPглюкуронозилтранфераза, обычно присутствующего у млекопитающего. В некоторых воплощениях фермент UDP-глюкуронозилтранфераза выбран из UGT1A1, UGT1A3, UGT1A6, UGT1A9 и UGT2B7. В любом из вышеупомянутых аспектов, относящихся к предупреждению или лечению воспаления,предложены дополнительные воплощения, включающие: (а) мониторинг воспаления у млекопитающего;(б) измерение бронхоконстрикции у млекопитающего; (в) измерение рекрутинга эозинофилов, и/или базофилов, и/или дендритных клеток, и/или нейтрофилов, и/или моноцитов, и/или лимфоцитов у млекопитающего; (г) мониторинг секреции слизи у млекопитающего; (д) измерение отека слизистой оболочки у млекопитающего; (ж) измерение уровней LTB4 в стимулированной кальциевым ионофором крови млекопитающего; (з) измерение уровней LTE4 в моче млекопитающего; или (и) идентификация пациента путем измерения лейкотриен-запускаемых воспалительных биомаркеров, таких как LTB4, LTC4, IL-6(интерлейкин 4), IL-13 (интерлейкин 13). В любом из вышеупомянутых аспектов, включающих предупреждение или лечение лейкотриензависимых или лейкотриен-опосредованных заболеваний или состояний, предложены дополнительные воплощения, включающие идентификацию пациентов путем скрининга по гаплотипу гена лейкотриенов. В некоторых воплощениях гаплотип гена лейкотриенов представляет собой ген лейкотриенового пути. В конкретном воплощении гаплотип гена лейкотриенового пути представляет собой гаплотип FLAP. В любом из вышеупомянутых аспектов, включающих предупреждение или лечение лейкотриензависимых или лейкотриен-опосредованных заболеваний или состояний, предложены дополнительные воплощения, включающие идентификацию пациентов путем мониторинга пациента в отношении: 1) по меньшей мере одного лейкотриен-связанного воспалительного биомаркера; или 2) по меньшей мере одного функционального маркерного ответа на лейкотриен-модифицирующий агент; или 3) по меньшей мере одного лейкотриен-связанного воспалительного биомаркера и по меньшей мере одного функционального маркерного ответа на лейкотриен-модифицирующий агент. В некоторых воплощениях лейкотриен-связанные воспалительные биомаркеры выбраны из группы,состоящей из LTB4, цистеинил-лейкотриенов, CRP, SAA, МРО, ЕРО, МСР-1, MIP- , sICAM, IL-6, IL-4 иIL-13. В некоторых воплощениях функциональный маркерный ответ представляет собой значимый объем легких (FEV1 (объем форсированного выдоха за первую секунду. В любом из вышеупомянутых аспектов, включающих предупреждение или лечение лейкотриензависимых или лейкотриен-опосредованных заболеваний или состояний, предложены дополнительные воплощения, включающие идентификацию пациентов путем: 1) скрининга пациента по меньшей мере по одному SNP (мононуклеотидный полиморфизм) и/или гаплотипу гена лейкотриенов, включая SNP в интронных или экзонных локализациях; или 2) мониторинга пациента в отношении по меньшей мере одного лейкотриен-связанного воспалительного биомаркера; или 3) мониторинга пациента в отношении по меньшей мере одного функционального маркерного ответа на лейкотриен-модифицирующий агент. В некоторых воплощениях SNP или гаплотип гена лейкотриена представляет собой ген лейкотриенового пути. В конкретных воплощениях SNP или гаплотип гена лейкотриенов представляет собой SNP или гаплотип FLAP. В некоторых воплощениях лейкотриен-связанные воспалительные биомаркеры выбраны из группы, состоящей из LTB4, цистеинил-лейкотриенов, CRP, SAA, МРО, ЕРО, МСР-1, MIP- ,sICAM, IL-6, IL-4 и IL-13. В некоторых воплощениях функциональный маркерный ответ представляет собой значимый объем легких (FEV1). В любом из вышеупомянутых аспектов, включающих предупреждение или лечение лейкотриензависимых или лейкотриен-опосредованных заболеваний или состояний, предложены дополнительные воплощения, включающие идентификацию пациентов по меньшей мере двумя из следующих путей: 1) скрининг пациента по меньшей мере по одному SNP или гаплотипу гена лейкотриенов; 2) мониторинг пациента в отношении по меньшей мере одного лейкотриен-связанного воспалительного биомаркера; 3) мониторинг пациента в отношении по меньшей мере одного функционального маркерного ответа на лейкотриен-модифицирующий агент. В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собой ген лейкотриенового пути. В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собойSNP или гаплотип FLAP. В некоторых воплощениях лейкотриен-связанные воспалительные биомаркеры выбраны из группы, состоящей из LTB4, цистеинил-лейкотриенов, CRP, SAA, МРО, ЕРО, МСР-1, MIP-,sICAM, IL-6, IL-4 и IL-13. В некоторых воплощениях функциональный маркерный ответ представляет собой значимый объем легких (FEV1). В любом из вышеупомянутых аспектов, включающих предупреждение или лечение лейкотриензависимых или лейкотриен-опосредованных заболеваний или состояний, предложены дополнительные воплощения, включающие идентификацию пациентов путем: 1) скрининга пациента по меньшей мере по одному SNP или гаплотипу гена лейкотриенов; 2) мониторинга пациента в отношении по меньшей мере одного лейкотриен-связанного воспалительного биомаркера; и 3) мониторинга пациента в отношении по меньшей мере одного функционального маркерного ответа на лейкотриен-модифицирующий агент. В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собой ген лейкотриенового пути. В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собойSNP или гаплотип FLAP. В некоторых воплощениях лейкотриен-связанные воспалительные биомаркеры выбраны из группы, состоящей из LTB4, цистеинил-лейкотриенов, CRP, SAA, МРО, ЕРО, МСР-1, MIP-,sICAM, IL-6, IL-4 и IL-13. В некоторых воплощениях функциональный маркерный ответ представляет собой значимый объем легких (FEV1). В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собой ген лейкотриенового пути. В некоторых воплощениях SNP или гаплотип гена лейкотриенов представляет собойSNP или гаплотип FLAP. В некоторых воплощениях лейкотриен-связанные воспалительные биомаркеры выбраны из группы, состоящей из LTB4, цистеинил-лейкотриенов, CRP, SAA, МРО, ЕРО, МСР-1, MIP, sICAM, IL-6, IL-4 и IL-13. В некоторых воплощениях функциональный маркерный ответ представляет собой значимый объем легких (FEV1). В некоторых воплощениях информацию, полученную тремя диагностическими методами, используют в алгоритме, в котором эту информацию анализируют для идентификации пациентов, нуждающихся в лечении соединением 1 или его фармацевтически приемлемой солью, и режима лечения. В любом из вышеупомянутых аспектов лейкотриен-зависимые или лейкотриен-опосредованные заболевания или состояния включают, без ограничений, астму, хроническое обструктивное заболевание легких, легочную гипертензию, интерстициальный фиброз легкого, ринит, аллергию, респираторный дистресс-синдром взрослых. Фармацевтические композиции готовят общепринятым способом с использованием одного или бо- 27019819 лее физиологически приемлемых носителей, содержащих эксципиенты и вспомогательные вещества,которые облегчают переработку активных соединений в лекарственные формы фармацевтического применения. Подходящие методы, носители и эксципиенты можно найти, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E,Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975); Liberman, H.A. andDosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott WilliamsWilkins 1999), полное содержание которых включено в данное описание посредством ссылки. Для перорального введения соединение 1 или его фармацевтически приемлемую соль (например соединение 2) готовят в виде композиции путем объединения активного соединения с фармацевтически приемлемыми носителями или эксципиентами. Такие носители обеспечивают приготовление соединения 1 или его фармацевтически приемлемой соли (например соединения 2) в виде таблеток, порошков, пилюль, драже, капсул, жидкостей, гелей, сиропов, эликсиров, взвесей, суспензий и т.п. для перорального проглатывания пациентом, которого лечат. Фармацевтические композиции содержат по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент и соединение 1 в качестве активного ингредиента в форме свободной кислоты или свободного основания или в форме фармацевтически приемлемой соли. Пероральные твердые лекарственные композиции, описанные здесь, содержат частицы соединения 1 или его фармацевтически приемлемой соли (например соединения 2) в кристаллической форме,аморфной форме, полукристаллической форме, полуаморфной форме или в форме их смесей. В одном аспекте пероральные твердые лекарственные композиции, описанные здесь, содержат частицы соединения 2. В одном аспекте пероральные твердые лекарственные композиции, описанные здесь, включают кристаллические частицы соединения 1 (свободная кислота). В одном аспекте пероральные твердые лекарственные композиции, описанные здесь, включают аморфные частицы соединения 1 (свободная кислота). Фармацевтические композиции, описанные здесь, содержат: (а) соединение 1 или его фармацевтически приемлемую соль (например, соединение 2), и одно или более из следующих веществ: (б) связывающие вещества, (в) разрыхлители, (г) наполнители (разбавители), (д) смазывающие вещества, (е) глиданты (вещества, улучшающие скользящие свойства), (ж) вспомогательные вещества для прессования,(з) красители, (и) подсластители, (к) консерванты; (л) суспендирующие/диспергирующие агенты, (м) пленкообразователи/покрытия, (н) корригенты, (о) печатные краски. В одном аспекте фармацевтические композиции, описанные здесь, в добавление к соединению 1 или его фармацевтически приемлемой соли (например, соединению 2) содержат одно или более из следующих веществ: (а) стеарат магния, (б) лактозу, (в) микрокристаллическую целлюлозу, (г) силицированную микрокристаллическую целлюлозу, (д) манит, (е) крахмал (кукурузный), (ж) диоксид кремния,(з) диоксид титана, (и) стеариновую кислоту, (к) крахмал-гликолят натрия, (л) желатин, (м) тальк, (н) сахарозу, (о) аспартам, (п) стеарат кальция, (р) повидон, (с) прежелатинированный крахмал, (т) гидроксипропилметилцеллюлозу, (у) ОРА продукты (покрытия и чернила), (ф) кроскармелозу, (х) гидроксипропилцеллюлозу, (ц) этилцеллюлозу, (ч) фосфат кальция (двухосновный), (ш) кросповидон, (щ) шеллак(и глазурь), (ы) карбонат натрия. В некоторых воплощениях пероральная фармацевтическая композиция дополнительно содержит фармацевтически приемлемый подсластитель. В конкретных воплощениях фармацевтически приемлемый подсластитель выбран из сахарозы, сукралозы, простого сиропа и Syrpalta. В более конкретных воплощениях фармацевтически приемлемый подсластитель представляет собой сукралозу. В других конкретных воплощениях фармацевтически приемлемый подсластитель представляет собой аспартам. В некоторых воплощениях любая из описанных здесь пероральных фармацевтических композиций содержит менее примерно 10 млн-1 палладия. В некоторых воплощениях пероральная фармацевтическая композиция имеет концентрацию Соединения 2 вплоть до примерно 60 мг/мл, от примерно 0,1 до примерно 60 мг/мл, от примерно 1 до примерно 50 мг/мл, от примерно 10 до примерно 50 мг/мл, от примерно 1 до примерно 20 мг/мл или примерно 10 мг/мл. В одном воплощении фармацевтические композиции для перорального применения получают смешиванием одного или более твердых эксципиентов с одним или более соединениями, описанными здесь,возможно гранулированием полученной смеси и переработкой смеси гранул после добавления подходящих вспомогательных веществ, если желательно, с получением таблеток. Подходящими эксципиентами являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; целлюлозные препараты, такие как, например, маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, микрокристаллическая целлюлоза, силицированная микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза; или другие, такие как поливинилпирролидон (PVP, или повидон) или фосфат кальция. Если желательно, добавляют разрыхляющие агенты, такие как поперечно-сшитая натрийкроскармелоза, поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. В одном воплощении фармацевтические композиции, описанные здесь, изготавливают в подходящей лекарственной форме, включая, без ограничений, водные пероральные дисперсии, твердые пероральные лекарственные формы, легкоплавкие лекарственные формы, шипучие лекарственные формы,лиофилизированные лекарственные формы, таблетки, капсулы, лекарственные формы длительного высвобождения, ингалируемый порошок, ингалируемая дисперсия, внутривенные лекарственные формы. В некоторых воплощениях лекарственные формы содержат терапевтически эффективное количество соединения 1 или его фармацевтически приемлемой соли (например соединения 2), дающее возможность вводить их, например, один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, один раз через день, один раз в сутки, два раза в сутки (b.i.d.) или три раза в сутки (t.i.d.), если желательно. В одном воплощении лекарственная форма содержит терапевтически эффективное количество соединения 1 или его фармацевтически приемлемой соли (например соединения 2), дающее возможность вводить ее один раз в сутки. В некоторых воплощениях эффективное количество соединения 1 или его фармацевтически приемлемой соли (например соединения 2) составляет от примерно 1 мг до примерно 5 г на дозу, от примерно 10 мг до примерно 2 г на дозу, от примерно 10 мг до примерно 1 г на дозу, от примерно 10 мг до примерно 1 г на дозу, от примерно 10 мг до примерно 0,5 г на дозу или от примерно 10 мг до примерно 0,4 г на дозу. В некоторых воплощениях эффективное количество соединения 1 или его фармацевтически приемлемой соли (например соединения 2) составляет от примерно 1 мг до примерно 5 г в сутки, от примерно 10 мг до примерно 2 г в сутки, от примерно 10 мг до примерно 1 г в сутки, от примерно 10 мг до примерно 0,6 г в сутки, от примерно 10 мг до примерно 0,5 г в сутки или от примерно 10 мг до примерно 0,4 г в сутки. В одном воплощении эффективное количество соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) составляет примерно 5 мг на дозу, примерно 10 мг на дозу, примерно 50 мг на дозу, примерно 150 мг на дозу, примерно 300 мг на дозу, примерно 450 мг на дозу, примерно 600 мг на дозу или примерно 1000 мг на дозу. В одном аспекте пероральные фармацевтические растворы содержат от примерно 10 до примерно 50 мг/мл соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В одном аспекте пероральные фармацевтические растворы содержат от примерно 10 до примерно 40 мг/мл, от примерно 10 до примерно 30 мг/мл или от примерно 10 до примерно 20 мг/мл соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В одном аспекте пероральные фармацевтические растворы содержат от примерно 10 мг/мл соединения 1 или его фармацевтически приемлемой соли(например, соединения 2). В одном воплощении педиатрические пероральные фармацевтические растворы содержат от примерно 1 мг/мл до примерно 20 мг/мл cоединения 1 или его фармацевтически приемлемой соли (например Соединения 2). В одном воплощении педиатрические пероральные фармацевтические растворы содержат от примерно 1 до примерно 15 мг/мл или от примерно 5 до примерно 15 мг/мл cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В некоторых воплощениях педиатрические пероральные фармацевтические растворы содержат примерно 10 мг/мл cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном аспекте таблетки немедленного высвобождения содержат от примерно 5% до примерно 50% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В некоторых воплощениях таблетки немедленного высвобождения содержат от примерно 5 до примерно 40% мас./мас. или от примерно 10 до примерно 40% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В некоторых воплощениях таблетки немедленного высвобождения содержат примерно 5% мас./мас., примерно 10% мас./мас., примерно 15% мас./мас., примерно 20% мас./мас., примерно 25% мас./мас., примерно 30% мас./мас., примерно 33% мас./мас., примерно 35% мас./мас., примерно 40% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (напримерcоединения 2). В одном аспекте капсулы немедленного высвобождения содержат от примерно 1,25 до примерно 50% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В некоторых воплощениях капсулы немедленного высвобождения содержат от примерно 5 до примерно 40% мас./мас., от примерно 10 до примерно 30% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В некоторых воплощениях капсулы немедленного высвобождения содержат примерно 5% мас./мас., примерно 10% мас./мас., примерно 15% мас./мас., примерно 20% мас./мас., примерно 25% мас./мас., или примерно 30% мас./мас. cоединения 1 или его фармацевтически приемлемой соли (например cоединения 2). В одном воплощении cоединение 1 или его фармацевтически приемлемую соль (например cоединение 2) изготавливают в лекарственной форме немедленного высвобождения для введения один раз в сутки. В общем, желательно введение cоединения 1 или его фармацевтически приемлемой соли (напримерcоединения 2) в количестве, которое является эффективным для достижения уровня в плазме крови, соответствующего концентрациям, которые, как установлено, эффективны in vivo в течение периода вре- 29
МПК / Метки
МПК: A61K 31/437, C07D 403/12, C07D 403/14, A61P 11/06
Метки: основе, ингибитора, активирующего, форма, белка, применение, кристаллическая, композиция, 5-липоксигеназу, полиморфная, фармацевтическая, лечении
Код ссылки
<a href="https://eas.patents.su/30-19819-kristallicheskaya-polimorfnaya-forma-s-ingibitora-belka-aktiviruyushhego-5-lipoksigenazu-farmacevticheskaya-kompoziciya-na-ee-osnove-i-primenenie-v-lechenii.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая полиморфная форма с ингибитора белка, активирующего 5-липоксигеназу, фармацевтическая композиция на ее основе и применение в лечении</a>
Предыдущий патент: Способ разделения медно-никелевого файнштейна
Следующий патент: Устройство для выпуска воздуха для колесного узла и способ выпуска воздуха из колесного узла
Случайный патент: Центробежный сепаратор молотковой мельницы












