Производные 2-пиридин-2-ил-пиразол-3(2h)-она, их получение и применение в терапии
Номер патента: 19774
Опубликовано: 30.06.2014
Авторы: Фоссе Валери, Иллиано Стефан, Альтенбюрже Жан-Мишель, Манетт Жеральдин
Формула / Реферат
1. Соединение формулы (I)
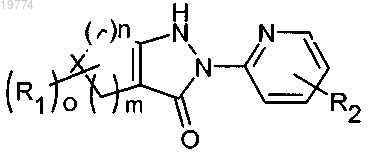
где n равно 0, 1, 2, 3 или 4;
m равно 0, 1 или 2;
о равно 0 или 1;
X представляет собой -СН2, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы, при условии, что R' представляет собой -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -СН2-фенил, -C(O)R5 или
-COOR5, где R5 имеет значения, определенные далее;
R1 представляет собой оксогруппу или группу -COOR5, где R5 имеет значения, определенные далее;
R2 представляет собой атом водорода или группу, выбранную из -(С1-С5)алкилов, -(С1-С5)алкоксигрупп, групп -COOR5, -NR5R6, -C(O)NR5R6, -SO2-NR3R4, гетероарилов, имеющих при необходимости в качестве заместителей -(С1-С5)алкил, -W-фенил, -W-гетероарил, -O-W-фенил и -O-W-гетероарил, где W, R3, R4, R5 и R6 имеют значения, определенные далее;
при условии, что
R3 и R4
(i) которые могут быть одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С1-С5)алкил, -(C3-С6)циклоалкил, фенил, гетероарил, -СН2-гетероарил или -W-OH; или
(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителей одну или две группы, выбранные из -(С1-С5)алкила и -СН2-фенила;
W означает -(С1-С5)алкилен, имеющий при необходимости в качестве заместителей одну или несколько гидроксигрупп;
R5 и R6, которые могут быть одинаковыми или разными, независимо друг от друга представляют собой атомы водорода или группы, выбранные из -(С1-С5)алкила и -(C3-С6)циклоалкила;
причем
гетероарил выбирают из фуранила, оксадиазолила и пиридинила;
гетероциклоалкил выбирают из 5-, 6- или 7-членного насыщенного цикла, содержащего один атом азота;
в форме основания или кислотно-аддитивной соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что
n равно 0, 1, 2, 3 или 4;
m равно 0, 1 или 2;
о равно 0 или 1;
X представляет собой -СН2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы;
R' представляет собой -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -СН2-фенил, -C(O)R5 или -COOR5;
R1 представляет собой оксогруппу или -COOR5;
R2 представляет собой атом водорода, -(С1-С5)алкил, (С1-С5)алкоксигруппу, -COOR5, -NR5R6, -C(O)NR5R6 или -SO2-NR3R4;
R3 и R4
(i) независимо друг от друга представляют собой такие группы, как атом водорода, -(С1-С5)алкил, -(C3-С6)циклоалкил, фенил, гетероарил или -СН2-гетероарил; или
(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителя -(С1-С5)алкил или СН2-фенил;
R5 и R6 независимо друг от друга представляют собой атомы водорода или (С1-С5)алкилы.
3. Соединение формулы (I) по п.1, отличающееся тем, что
n равно 0, 1, 2, 3 или 4;
m равно 0, 1 или 2;
о равно 0;
R1 представляет собой оксогруппу или -COOR5, причем группа R1 может быть связана с атомом углерода или гетероатомом;
R3 и R4
(i) независимо друг от друга представляют собой такие группы, как атом водорода, -(С1-С5)алкил, -(C3-С6)циклоалкил, фенил, гетероарил или -СН2-гетероарил; или
(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителей один или два -(С1-С5)алкила и/или СН2-фенила, причем гетероциклоалкил представляет собой пиперидил, пирролидинил или гексаметилениминогруппу;
R5 представляет собой -(С1-С5)алкил или -(С1-C5)циклоалкил и/или
R6 представляет собой атом водорода или (С1-С5)алкил.
4. Соединение формулы (I) по п.1, отличающееся тем, что
n равно 0, 1, 2, 3 или 4;
m равно 0, 1 или 2;
о равно 0 или 1;
X представляет собой -СН2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы;
R' представляет собой -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -СН2-фенил, -C(O)R5 или -COOR5;
R1 представляет собой оксогруппу или -COOR5;
R2 представляет собой -SO2-NR3R4;
R3 и R4
(i) независимо друг от друга представляют собой такие группы, как атом водорода, -(С1-С5)алкил, -(C3-С6)циклоалкил, фенил, гетероарил или -СН2-гетероарил; или
(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил;
R5 и R6 представляют собой -(С1-С5)алкилы.
5. Соединение формулы (I) по п.1, отличающееся тем, что
n равно 1, 2, 3 или 4;
m равно 0, 1 или 2;
о равно 0 или 1;
X представляет собой -СН2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы;
R' представляет собой -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -СН2-фенил, -C(O)R5 или -COOR5;
R1 представляет собой оксогруппу;
R2 представляет собой атом водорода, -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -COOR5, -NR5R6 или
-C(O)NR5R6;
R5 и R6 независимо друг от друга представляют собой атомы водорода, -(С1-С5)алкил или -(С3-С5)циклоалкил.
6. Соединение формулы (I) по п.1, отличающееся тем, что R2 представляет собой атом водорода, -(С1-С5)алкил, -(С1-С5)алкоксигруппу, -COOR5, -NR5R6, -C(O)NR5R6, гетероарил, имеющий в качестве заместителя -(С1-С5)алкил, -O-W-фенил или -О-W-гетероарил.
7. Соединение формулы (I) по п.1, отличающееся тем, что R2 представляет собой -SO2-NR3R4.
8. Соединение формулы (I) по любому из пп.1-7, отличающееся тем, что R2 представляет собой заместитель, связанный с атомом, находящимся в бета-положении пиридинового цикла.
9. Соединение формулы (I) по любому из пп.1-7, отличающееся тем, что R2 представляет собой заместитель, связанный с атомом, находящимся в гамма-положении пиридинового цикла.
10. Соединение формулы (I) по любому из пп.1-9, отличающееся тем, что оно представляет собой
2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2,4,5,6,7-гексагидро-3H-индазол-3-он;
6-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2,4,5,6,7-гексагидро-3H-индазол-3-он;
2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,4,5,6,7,8-гексагидроциклогепта[с]пиразол-3(2Н)-он;
N-этил-6-(3-оксо-1,3,4,5,6,7-гексагидро-2Н-индазол-2-ил)-N-фенилпиридин-3-сульфонамид;
6-(5-бензил-3-оксо-1,3,4,5,6,7-гексагидро-2Н-пиразоло[4,3-c]пиридин-2-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
(+/-)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-1,2,4,5,6,7-гексагидро-3H-индазол-3-он;
2-(4-метоксипиридин-2-ил)-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он;
2-(пиридин-2-ил)-1,4,5,6-тетрагидроциклопента[с]пиразол-3(2Н)-он;
(+/-)-5-бензил-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-1,2,4,5,6,7-гексагидро-3H-пиразоло[4,3-с]пиридин-3-он;
(+/-)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-6-метил-1,2,4,5,6,7-гексагидро-3H-индазол-3-он;
6-(5-бензил-3-оксо-1,3,4,5,6,7-гексагидро-2Н-пиразоло[4,3-c]пиридин-2-ил)-N,N-диэтилпиридин-3-сульфонамид;
N-этил-6-(3-оксо-1,3,4,5,6,7,8,9-октагидро-2Н-циклоокта[с]пиразол-2-ил)-N-фенилпиридин-3-сульфонамид;
N-этил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-c]пиразол-2(3H)-ил)-N-фенилпиридин-3-сульфонамид;
6-(5-бензил-3-оксо-1,3,4,5,6,7-гексагидро-2Н-пиразоло[4,3-c]пиридин-2-ил)-N,N-ди(проп-2-ил)пиридин-3-сульфонамид;
6-метокси-2-(пиридин-2-ил)-1,4,5,6-тетрагидроциклопента[с]пиразол-3(2Н)-он;
2-(пиридин-2-ил)-1,4,6,7-тетрагидротиопирано[4,3-с]пиразол-3(2Н)-он;
N-этил-6-(3-оксо-1,4,6,7-тетрагидротиопирано[4,3-с]пиразол-2(3H)-ил)-N-фенилпиридин-3-сульфонамид;
N-этил-6-(3-оксо-3,5,6,7-тетрагидротиопирано[3,2-с]пиразол-2(1Н)-ил)-N-фенилпиридин-3-сульфонамид;
N,N-диэтил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-c]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
N,N-диметил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
2-[5-(пирролидин-1-илсульфонил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-c]пиразол-3-он;
N-циклопропил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)-N-(проп-2-ил)пиридин-3-сульфонамид;
N-трет-бутил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
N-(фуран-2-илметил)-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
N-циклопентил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
N-метил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)-N-(пиридин-2-ил)пиридин-3-сульфонамид;
2-(пиридин-2-ил)-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он;
2-[4-(диметиламино)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он;
2-{5-[(4-бензилпиперидин-1-ил)сульфонил]пиридин-2-ил}-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он;
6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)-N-(пиридин-2-ил)пиридин-3-сульфонамид;
N-этил-6-(3-оксо-1,4,6,7-тетрагидропирано[4,3-c]пиразол-2(3H)-ил)-N-фенилпиридин-3-сульфонамид;
2-(4-этилпиридин-2-ил)-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-[5-(азепан-1-илсульфонил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-c]пиразол-3-он;
4-бензил-2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-5-оксо-4,5,6,7-тетрагидро-2Н-пиразоло[4,3-b]пиридин-3-олат натрия;
N-метил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-c]пиразол-2(3H)-ил)-N-(пиридин-2-илметил)пиридин-3-сульфонамид;
трет-бутил-2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-1,2,3,4,6,7-гексагидро-5Н-пиразоло[4,3-c]пиридин-5-карбоксилат;
6-(5-ацетил-3-оксо-1,3,4,5,6,7-гексагидро-2Н-пиразоло[4,3-c]пиридин-2-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
трет-бутил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилат;
2-(4-метилпиридин-2-ил)-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-{5-[трет-бутил(метил)сульфамоил]пиридин-2-ил}-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-{5-[трет-бутил(этил)сульфамоил]пиридин-2-ил}-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-(5-метилпиридин-2-ил)-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-[5-(трет-бутилкарбамоил)пиридин-2-ил]-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-(5-метоксипиридин-2-ил)-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
N-метил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)-N-(пиридин-4-ил)пиридин-3-сульфонамид;
2-{5-[циклопентил(этил)сульфамоил]пиридин-2-ил}-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-[4-(пиридин-3-илметокси)пиридин-2-ил]-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-1,2,3,4,6,7-гексагидро-5Н-пиразоло[4,3-c]пиридин-5-метилкарбоксилат;
циклопентил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилат;
2-метилпропил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилат;
2-[4-(проп-2-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-c]пиразол-3-он;
2-[5-(проп-2-ил)пиридин-2-ил]-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
метил-2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3,4,6-тетрагидро-1Н-тиено[3,4-c]пиразол-4-карбоксилат;
проп-2-ил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-c]пиразол-2(3H)-ил)пиридин-3-карбоксилат;
2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-6-метокси-2,4,5,6-тетрагидроциклопента[с]пиразол-3-олат натрия;
N-этил-6-(3-оксо-3,4,5,6-тетрагидроциклопента[с]пиразол-2(1Н)-ил)-N-фенилпиридин-3-сульфонамид;
2-[4-(пиридин-3-илметокси)пиридин-2-ил]-2,6-дигидро-4Н-тиено[3,4-с]пиразол-3-олат натрия;
2,2-диметилпропил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилат;
2-[5-(5-трет-бутил-1,2,4-оксадиазол-3-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он;
N-циклопентил-N-метил-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
N-циклопентил-N-этил-6-(3-оксо-3,4,5,6-тетрагидроциклопента[с]пиразол-2(1Н)-ил)пиридин-3-сульфонамид;
N-циклопентил-N-(2,3-дигидроксипропил)-6-(3-оксо-4,6-дигидро-1Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид;
2,2-диметилпропил-6-[5-(метилсульфонил)-3-оксо-1,3,4,5,6,7-гексагидро-2Н-пиразоло[4,3-c]пиридин-2-ил]пиридин-3-карбоксилат;
2-[5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-c]пиразол-3-он.
11. Способ получения соединения формулы (I) по любому из пп.1-10, отличающийся тем, что с органическим основанием вводят в реакцию соединение формулы (IV), которое находится в форме соединения формулы (IVa) или (IVb) или в обеих формах
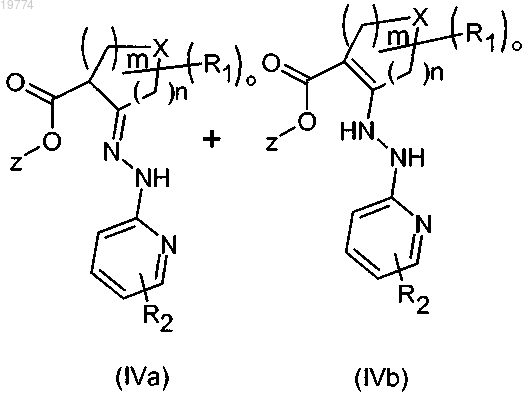
где X, R1, R2, n, m, о имеют значения, определенные в п.1;
z представляет собой алкил.
12. Соединения формул (IVa) и (IVb)

где X обозначает -CH(R') или -N(R');
R1, R2, n, m, о имеют значения, определенные в п.1;
z представляет собой алкил.
13. Лекарственное средство для лечения и/или профилактики заболеваний, в которых требуется активация транскрипционного фактора HIF, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-10 или аддитивную соль соединения формулы (I) с фармацевтически приемлемой кислотой.
14. Фармацевтическая композиция для лечения и/или профилактики заболеваний, в которых требуется активация транскрипционного фактора HIF, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-10 или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
15. Применение соединения формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения/профилактики сердечно-сосудистых заболеваний.
16. Применение соединения формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения/профилактики ишемии нижних конечностей, сердечной недостаточности, коронарных болезней сердца ишемического происхождения, таких как стенокардия или инфаркт миокарда, атеросклероза, сосудистых повреждений головного мозга ишемического происхождения, легочной гипертензии и любых патологий, вызываемых частичной или полной непроходимостью сосудов.
17. Применение соединения формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения/профилактики глаукомы, болезней почек или болезней головного мозга необязательно нейродегенеративного происхождения, анемии, или лекарственного средства, предназначенного для улучшения заживления ран или для сокращения периода послеоперационной реабилитации, или лекарственного средства, предназначенного для лечения состояний общей слабости, или также лекарственного средства, используемого с целью получения крови при осуществлении аутотрансфузий, необходимых в связи со сложными хирургическими вмешательствами, такими как операции на головном мозге или в области грудной клетки, или такими как операции на сердце или на уровне сонных артерий или аорты.
18. Применение соединения формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения/профилактики болезней сердца или периферических органов ишемического происхождения в порядке регенеративной терапии с использованием штаммов клеток.
19. Комбинация соединения формулы (I) по любому из пп.1-10 с одним или несколькими другими активными соединениями, приемлемыми для лечения гипертензии, сердечной недостаточности, диабета и анемии.
Текст
Изобретение относится к соединениям, соответствующим формуле (I), в виде основания или кислотно-аддитивной соли где n равно 0, 1, 2, 3 или 4; m равно 0, 1 или 2; о равно 0 или 1; X представляет собой -СН 2,-CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы, при условии, чтоR5 имеет значения, определенные далее; R1 представляет собой оксогруппу или группу -COOR5,где R5 имеет значения, определенные далее; R2 представляет собой атом водорода или группу,выбранную из -(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, групп -COOR5, -NR5R6, -C(O)NR5R6, -SO2NR3R4, гетероарилов, имеющих при необходимости в качестве заместителей -(С 1-С 5)алкил, -Wфенил, -W-гетероарил, -O-W-фенил и -O-W-гетероарил, где W, R3, R4, R5 и R6 имеют значения,определенные далее; при условии, что R3 и R4 (i) которые могут быть одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1 С 5)алкил, -(C3-С 6)циклоалкил, фенил, гетероарил, -СН 2-гетероарил или -W-OH; или (ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителей одну или две группы, выбранные из -(С 1-С 5)алкила и -СН 2-фенила;W означает -(С 1-С 5)алкилен, имеющий при необходимости в качестве заместителей одну или несколько гидроксигрупп; R5 и R6, которые могут быть одинаковыми или разными, независимо друг от друга представляют собой атомы водорода или группы, выбранные из -(С 1-С 5)алкила и-(C3-С 6)циклоалкила; причем гетероарил выбирают из фуранила, оксадиазолила и пиридинила; гетероциклоалкил выбирают из 5-, 6- или 7-членного насыщенного цикла, содержащего один атом азота; а также к способу их получения и к их применению в терапии. Объектами настоящего изобретения являются новые замещенные производные дигидропиразолона,их получение и применение в терапии в качестве активаторов транскрипционного фактора HIF. Гипоксия-индуцируемый фактор (HIF от "Hypoxia Inducible Factor" (гипоксия-индуцируемый фактор (HIF1-alpha) представляет собой транскрипционный фактор, конститутивно экспрессируемый во всех тканях. Данный белок обнаружен в 1994 году Gregg Semenza в ходе исследования регуляторных последовательностей гена ЕРО. Им идентифицирована последовательность, расположенная в некодирующем положении 3' в промоторе ЕРО, называемом "гипоксия-респонсивный элемент" (HRE) и представляющем собой сайт фиксации белка HIF1-alpha, обеспечивающего транскрипционную активацию ЕРО. Впоследствии последовательность HRE также была локализована более чем в 70 других генах, таких как VEGF (фактор роста сосудистого эндотелия) или Glutl (переносчик-1 глюкозы). Транскрипционный комплекс HIF-1 представляет собой, по меньшей мере, гетеродимер, образуемый белком HIF1-alpha или HIF2-alpha и другим транскрипционным фактором ARNT (ранее называемым HIF1-alpha). ARNT конститутивно и стабильно экспрессируется в клетках, при этом сущность регулирования транскрипционного комплекса связана с количеством HIF1-alpha, присутствующим в клетках и, таким образом, представляющим собой лимитирующий фактор. В нормальных условиях по кислороду белок HIF1-alpha быстро деградирует (время полужизни составляет 5 мин). Такая деградация является следствием гидроксилирования HIF1-alpha или HIF2-alpha соответственно на пролиновых остатках 402 и 563 и пролиновых остатках 405 и 531 в случае человеческих форм HIF-пролилгидроксилазами (HIFPHD или EGLN). Данное гидроксилирование обеспечивает связывание белка Хиппель-Линдау (pVHL), ассоциированного с убиквитинлигазой, вследствие чего вызывается деградация HIF1-alpha или HIF2-alpha убиквитин-протеасомной системой. В случае, когда клетка или ткань претерпевает гипоксию/ишемию, HIF1-alpha или HIF2-alpha больше не деградируются убиквитин-протеасомной системой и потому могут ассоциироваться с другими транскрипционными факторами комплекса HIF для перехода в ядро и активации своих целевых генов. Хотя гипоксия представляется главной причиной активации белков HIF1-alpha и HIF2-alpha, другие индукторы, такие как инсулин и факторы роста, также могут играть роль в их стабилизации, в частности,путем фосфорилирования на сериновых остатках 641 и 643. Таким образом, для идентификации соединений по настоящему изобретению был использован фенотипический скрининг, предусматривающий измерение стабилизации белка HIF1-alpha и/или HIF2alpha. Соединения по настоящему изобретению соответствуют приведенной далее формуле (I)X представляет собой -СН 2, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы, при условии, что R' представляет собой -(С 1-С 5)алкил, -(С 1-С 5)алкоксигруппу, -СН 2-арил,-C(O)R5 или -COOR5, где R5 имеет значения, определенные далее;R2 представляет собой атом водорода или группу, выбранную из (i) -(C1-C5)алкилов, (ii) -(C1C5)алкоксигрупп, групп (iii) -COOR5, (iv) -NR5R6, (v) -C(O)NR5R6, (vi) -SO2-NR3R4, (vii) гетероарилов,имеющих при необходимости в качестве заместителей -(С 1-С 5)алкилы, (viii) -W-арилов, (ix) -Wгетероарилов, (x) -O-W-арилов, (xi) -O-W-гетероарилов и (xii) групп -O-W-NR5R6, где W, R3, R4, R5 и R6 имеют значения, определенные далее; при условии, что R3 и R4(i) которые могут быть одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил, -(С 3-С 6)циклоалкил, арил, гетероарил, -СН 2-гетероарил,-(С 1-С 5)алкил-NR5R6, -W-OH или -W-NR5R6; или(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителей одну или несколько групп, выбранных из -(С 1-С 5)алкилов иW означает -(С 1-С 5)алкилен, имеющий при необходимости в качестве заместителей одну или несколько гидроксигрупп;R5 и R6, которые могут быть одинаковыми или разными, независимо друг от друга представляют собой атомы водорода или группы, выбранные из -(С 1-С 5)алкилов и -(С 3-С 6)циклоалкилов. Соединения формулы (I) могут находиться в форме оснований или солей, причем соединения формулы (I) в данном случае переводят в солевую форму кислотами или основаниями и предпочтительно фармацевтически приемлемыми кислотами или основаниями. При этом речь идет об аддитивных солях,в частности об аддитивных солях, образуемых кислотой или основанием и составляющих часть настоящего изобретения. Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами,однако соли других кислот, приемлемые, например, для очистки или выделения соединений формулы (I),также составляют часть настоящего изобретения. Можно упомянуть гидрохлоридные соли, соли трифторуксусной кислоты и соли натрия. Соединения формулы (I) могут находиться также в виде сольватов, а именно в виде ассоциаций или комбинаций с одной или несколькими молекулами растворителя. Такие сольваты также составляют часть настоящего изобретения. Когда индекс о равно 0, то цикл содержит только атомы водорода. Различные таутомерные формы соединений формулы (I) также составляют часть настоящего изобретения Кроме того, объектом настоящего изобретения является также однотипный тест на прямое измерение, основанное на бета-галактозидазной комплементации, количества белка HIF1-alpha в ядрах клеток,предпочтительно клеток HEK, после обработки данных клеток одним или несколькими испытуемыми соединениями, причем тест состоит в том, что:(a) предпочтительно в 384-луночные планшеты осуществляют посев упомянутых клеток в приемлемую культуральную среду, предпочтительно в 1%-ю эмбриональную телячью сыворотку (сокращенно(b) одно или несколько испытуемых соединений с соответствующей концентрацией в приемлемом растворителе прибавляют к клеткам, посеянным ранее в упомянутую культуральную среду, при этом испытуемые соединения предпочтительно растворяют в 0,1%-й SVF;(c) подготовленные таким образом клетки инкубируют в инкубаторе приблизительно при 37 С предпочтительно в течение приблизительно 6 ч;(d) лизируют клетки буферным лизирующим раствором, содержащим хемилюминесцентный субстрат для бета-галактозидазы;(e) инкубируют без доступа света перед считыванием и измерением люминесценции, представляющей собой функцию активности бета-галактозидазы. Скрининг соединений по настоящему изобретению осуществляют согласно испытанию, определенному ранее. В описании настоящего изобретения, если в тексте не упомянуто иное, принято, что атом галогена представляет собой атом фтора, хлора, брома или йода; алкил представляет собой алифатическую насыщенную линейную или разветвленную группу, которая может содержать 1, 2, 3, 4 или 5 атомов углерода (сокращенно -(С 1-С 5)алкил). В качестве примеров можно упомянуть (i) метил в качестве -С 1-алкила, (ii) этил в качестве -С 2-алкила, (iii) пропил и изопропил в качестве -С 3-алкила, (iv) бутил, изобутил и трет-бутил в качестве -С 4-алкила, (v) пентил и изопентил в качестве -С 5-алкила; алкилен представляет собой определенный ранее двухвалентный насыщенный линейный или разветвленный алкил, который может содержать 1, 2, 3, 4 или 5 атомов углерода (сокращенно -(С 1 С 5)алкилен-). В качестве примеров можно упомянуть метилен (или -СН 2-), этилен (или -СН 2-СН 2-), пропилен (-CH2-CH2-CH2-); циклоалкил представляет собой циклический алкил, могущий содержать 3, 4, 5 или 6 атомов углерода и обозначаемый сокращенно -(C3-С 6)циклоалкил. В качестве примеров можно упомянуть циклопропил, циклобутил, циклопентил, циклогексил; алкоксигруппа представляет собой -О-алкил, в котором алкил имеет определенные ранее значения. В качестве примеров можно упомянуть -О-(С 1-С 5)алкил или -(С 1-С 5)алкоксигруппу, в частности (i) -Ометил в качестве -O-С 1-алкила, (ii) -О-этил в качестве -O-С 2-алкила, (iii) -О-пропил и -О-изопропил в качестве -О-С 3-алкила, (iv) -О-бутил, -О-изобутил и -О-трет-бутил в качестве -O-С 4-алкила, (v) -О-пентил и-О-изопентил в качестве -O-С 5-алкила; алкоксиалкил представляет собой радикал формулы алкилен-О-алкил, в котором алкил и алкилен,-2 019774 необязательно содержащие одинаковое число атомов углерода, имеют определенные ранее значения. В качестве примеров можно упомянуть -(С 1-С 5)алкилен-О-(С 1-С 5)алкил, в котором -(С 1-С 5)алкилен- и -(С 1 С 5)алкил имеют определенные ранее значения; галогеналкил представляет собой определенный ранее алкил, имеющий в качестве заместителей 1,2, 3, 4 или 5 атомов галогена, определенных ранее. Можно упомянуть, например, галоген(С 1-С 5)алкил,содержащий определенный ранее (С 1-С 5)алкил, в частности трифторметил (сокращенно -CF3); арил представляет собой ароматический цикл, содержащий 6 атомов углерода. В качестве примера арила можно упомянуть фенил; гетероарил представляет собой ароматический цикл, содержащий 2, 3, 4 или 5 атомов углерода и от 1 до 3 гетероатомов, которые могут быть выбраны из атомов азота, кислорода и серы и независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 2, или независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 3. В качестве примеров можно упомянуть пиридил, пиррол, фурил; гетероциклоалкил представляет собой циклоалкил при необходимости мостикового типа, содержащий 5, 6 или 7 атомов углерода и 1, 2 или 3 гетероатома, которые могут быть выбраны из атомов азота,кислорода и серы и независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 2, или независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 3. Предпочтительно можно упомянуть пиперидил, пиперазинил, пирролидинил, гексаметилениминогруппу, морфолинил, 1,1-диоксотетрагидротиенил; литеры , ,ипри пиридиновом цикле соединений формулы (I) позволяют идентифицировать положения различных атомов углерода. Среди соединений, описанных в настоящем изобретении, можно упомянуть первую группу соединений, соответствующих формуле (I), в которойX представляет собой -СН 2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы; и/илиR2 представляет собой атом водорода, -(С 1-С 5)алкил, -(С 1-С 5)алкоксигруппу, -COOR5, -NR5R6,-C(O)NR5R6 или -SO2-NR3R4; и/или(i) независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил,-(C3-С 6)циклоалкил, арил, гетероарил, -СН 2-гетероарил или -(С 1-С 5)алкил-NR5R6; или(ii) совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителя -(С 1-С 5)алкил или арил; и/илиW представляет собой -(С 1-С 5)алкилен, имеющий при необходимости в качестве заместителей одну или несколько гидроксигрупп; и/илиR5 и R6 независимо друг от друга представляют собой атомы водорода или (С 1-С 5)алкилы. Первую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой n равно 0, 1, 2, 3 или 4. Вторую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой m равно 0, 1 или 2. Третью подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой о равно 0. Четвертую подгруппу соединений по настоящему изобретению составляют соединения формулы(I), в которой R1 представляет собой оксогруппу, -СН 2-арил, -C(O)R5- или -COOR5, причем группа R1 может быть связана с атомом углерода или гетероатомом. Арил предпочтительно представляет собой фенил. Пятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R2 представляет собой (i) атом водорода, (ii) -(C1-C5)алкил, (iii) -(С 1-С 5)алкоксигруппу,(iv) -COOR5, (v) -NR5R6, (vi) -C(O)NR5R6, (vii) гетероарил, имеющий в качестве заместителя -(С 1 С 5)алкил, (viii) -O-W-арил или (ix) -O-W-гетероарил. Шестую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R2 представляет собой -SO2-NR3R4. Седьмую подгруппу соединений по настоящему изобретению составляют соединения формулы (I),в которой R2 представляет собой заместитель, связанный с атомом, находящимся в бета-положении пиридинового цикла. Восьмую подгруппу соединений по настоящему изобретению составляют соединения формулы (I),в которой R2 представляет собой заместитель, связанный с атомом, находящимся в гамма-положении пиридинового цикла. Девятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R3 и R4 независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1 С 5)алкил, -(C3-С 6)циклоалкил, арил, гетероарил, -СН 2-гетероарил или -(С 1-С 5)алкил-NR5R6. Предпочтительно арил представляет собой фенил, а гетероарил представляет собой пиридил или фурил. Десятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости в качестве заместителей один или несколько -(С 1-С 5)алкилов и/или арилов. Предпочтительно гетероциклоалкил представляет собой пиперидил, пирролидинил или гексаметилениминогруппу, а арил представляет собой фенил. Одиннадцатую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R5 представляет собой -(С 1-С 5)алкил или -(С 1-С 5)циклоалкил. Двенадцатую подгруппу соединений по настоящему изобретению составляют соединения формулы(I), в которой R6 представляет собой атом водорода или (С 1-С 5)алкил. Подгруппы, определенные ранее и взятые раздельно или в комбинации, также составляют часть настоящего изобретения. Среди соединений, описанных в настоящем изобретении, можно также упомянуть подгруппу соединений, соответствующих формуле (I), в которойX представляет собой -СН 2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы;R3 и R4 независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1 С 5)алкил, -(С 3-С 6)циклоалкил, арил, гетероарил или -СН 2-гетероарил, или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил;R5 и R6 представляют собой -(С 1-С 5)алкилы. Среди соединений, описанных в настоящем изобретении, можно также упомянуть подгруппу соединений, соответствующих формуле (I), в которойX представляет собой -СН 2-, -CH(R')-, -N(R')- или гетероатом, выбранный из атома кислорода и атома серы;R2 представляет собой атом водорода, -(С 1-С 5)алкил, (С 1-С 5)алкоксигруппа, -COOR5, -NR5R6 илиR5 и R6 независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или -(С 1 С 5)циклоалкилы. Среди соединений формулы (I), являющихся объектами настоящего изобретения, можно упомянуть следующие соединения, такие как 2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2,4,5,6,7-гексагидро-3H-индазол-3-он; 6-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2,4,5,6,7-гексагидро-3H-индазол-3-он; 2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,4,5,6,7,8-гексагидроциклогепта[с]пиразол-3(2 Н)он;N-циклопентил-N-(2,3-дигидроксипропил)-6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)ил)пиридин-3-сульфонамид; 2,2-диметилпропил-6-[5-(метилсульфонил)-3-оксо-1,3,4,5,6,7-гексагидро-2 Н-пиразоло[4,3c]пиридин-2-ил]пиридин-3-карбоксилат; 2-[5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-c]пиразол 3-он. В дальнейшем описании под защитной группой (Pg) понимают группу, которая, с одной стороны,позволяет в ходе синтеза защищать реакционноспособную функциональную группу, такую, как гидрокси- или аминогруппа. Примеры защитных групп, а также способы их введения и удаления приведены в"Protective Groups in Organic Synthesis", Green et al., 3nd Edition (John WileySons, Inc., New York). Под уходящей группой (Lg) в дальнейшем описании понимают нуклеофильную группу, которая может быть легко отщеплена от молекулы вследствие разрыва гетеролитической связи с уходом электронной пары. Такая группа также может быть легко замещена другой нуклеофильной группой, например, в ходе реакции замещения. Такими уходящими группами являются, например, галогены или активная гидроксигруппа, такая как мезил, тозил, трифлат, ацетат и т.д. Примеры уходящих групп, а также информация по их получению приведены в "Advances in Organic Chemistry", J. March, 3rd Edition, WileyInterscience, p. 310-316. Соответственно настоящему изобретению соединения общей формулы (I) можно получить способом, описанным далее на схеме 1. Схема 1 Синтез соединений общей формулы (I) осуществляют исходя из соединений формулы (II), в которых R1, X, n, m и o имеют значения, описанные ранее, a z представляет собой алкил, предпочтительно метил или этил, и которые приводят во взаимодействие в протонном растворителе спиртового типа,предпочтительно в метаноле, при температуре в интервале от 20 до 60 С, с соединением формулы (III), в которой R2 имеет значения, описанные ранее, для получения промежуточного соединения формулы (IV),которое находится в виде соединения формулы (IVa) или (IVb) или в виде смеси обоих соединений и которое циклизуют в присутствии органического основания, предпочтительно метилата натрия, в протонном растворителе, таком как метанол, при температуре в интервале от 20 до 50 С. Полученные соединения формулы (I) при необходимости превращают с помощью соответствующей кислоты или основания в соли. Соединения формулы (II), способы получения которых не описаны, имеются в продаже или описаны в литературе либо же могут быть получены способами, известными специалистам в данной области техники. На схемах 2 а-2 с описано получение соединений формулы (III). Соединения формулы (III) получают исходя из соединения формулы (V), в которой Lg и R2 имеют определенные ранее значения, прибавлением гидразингидрата предпочтительно в протонном раствори-6 019774 Соединения формулы (III) могут быть получены также в две стадии, исходя из соединения формулы (V). При этом гидразиногруппу вводят сочетанием бензофенонгидразона формулы (VI) с соединением формулы (V) в присутствии каталитического количества палладия с получением промежуточного соединения формулы (VII), гидразиногруппу которого высвобождают обработкой кислотой, такой как соляная кислота, предпочтительно с концентрацией в интервале от 6 до 12 н., в бинарной смеси несмешивающихся растворителей, таких как толуол и вода, при температуре 100 С (схема 2b). Схема 2b Альтернативным образом, соединения формулы (III) могут быть синтезированы исходя из аминопиридина формулы (VIII), в которой R2 имеет определенные ранее значения, действием смеси азотной кислоты и концентрированной серной кислоты при 0 С с получением промежуточного N-нитроамина,который восстанавливают цинком в 10 н. растворе гидроксида натрия (схема 2 с). Схема 2 с Упомянутые на приведенных ранее схемах исходные вещества, промежуточные соединения и реагенты, способы получения которых не описаны, имеются в продаже или описаны в литературе, или же могут быть получены способами, известными специалистам в данной области техники. Настоящее изобретение в одном из других своих аспектов относится также к соединениям формул(IVa) и (IVb). Такие соединения являются полезными в качестве промежуточных соединений в синтезе соединений формулы (I). Примеры Приведенными далее примерами пояснено получение некоторых соединений по настоящему изобретению. Номера соединений в приведенных примерах соответствуют номерам в таблице, приведенной далее для пояснения химической структуры и физических свойств некоторых соединений по настоящему изобретению. Приняты следующие сокращения и сокращенные структурные формулы:t, C (ТС) - температура, С; мин (min) - минута; Тпл (PF) - температура плавления. Спектры протонного магнитного резонанса (1 Н ЯМР), приведенные далее, записаны при 400 МГц в ДМСО-d6 с использованием пика ДМСО-d5 в качестве эталона. Химические сдвигивыражены в миллионных долях (м.д.). Наблюдаемые сигналы обозначены как с=синглет; с ушир.=уширенный синглет; д=дублет; дд=дублет дублетов; дт=дублет триплетов; т=триплет; м=массив; Н=протон. Масс-спектры получены в следующих условиях комбинированной ЖХ/МС: методика 1: колонка: Jsphere (332 мм; 4 мкМ); элюенты: А=Н 2 О+0,05% ТФУ; B=CH3CN+0,05% ТФУ; Т=0:98% А; Т от 1,0 до 5,0 мин: 95% В; методика 2: колонка: Acquity ВЕН С 18 (502,1 мм; 1,7 мкМ); 220 нм; элюенты: А=Н 2 О+0,05% ТФУ; B=CH3CN+0,035% ТФУ; Т=0:98% А; Т от 1,6 до 2,1 мин: 100% В; Т от 2,5 до 3 мин: 9,3% А; подача: 1,0 мл/мин; t=40C; объем пробы: 2 мкл. Пример 1. 2-Пиридин-2-ил-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он (соединение 1 в табл. I) Смесь 7 г (64,1 ммоль) 2-гидразинопиридина и 10,3 г (64,1 ммоль) метил-4-оксотетрагидротиофен 3-карбоксилата в 130 мл МеОН нагревают в течение 12 ч при 80 С. Далее реакционную смесь сгущают при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем,элюируя смесью "ДХМ/МеОН" с градиентом от 0 до 10% МеОН. После сгущения при пониженном давлении выделяют 8,7 г (34,5 ммоль) промежуточного соединения гидразона в виде порошка желтого цвета и затем небольшими порциями при Ткомн прибавляют к раствору 0,8 г (34,5 ммоль) натрия в 46 мл безводного МеОН. Реакционную смесь перемешивают в течение 2 ч при Ткомн, затем образовавшийся осадок отделяют фильтрованием и последовательно промывают 10 мл МеОН и 20 мл пентана. Полученный остаток растворяют в 20 мл воды и прибавляют 10 мл уксусной кислоты. Полученный осадок отделяют фильтрованием, промывают 10 мл воды, сушат в вакууме и перекристаллизовывают из EtOH. Получают 4,2 г 2-пиридин-2-ил-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-она в виде беловатого порошка. Выход=56%. Тпл=152 С. 2.1. 2-Бром-N,N-диметилпиридин-4-амин. К раствору 12,6 мл (125 ммоль) N,N-диметилэтаноламина в 160 мл безводного гексана в атмосфере аргона при -5 С в течение 2 ч 30 мин прибавляют 100 мл (250 ммоль) 2,5 М раствора н-бутиллития в гексане, затем реакционную смесь перемешивают в течение 0,5 ч при 0 С и далее прибавляют 7,6 г (62,5 ммоль) 4-диметиламинопиридина. После перемешивания в течение 1 ч при 0 С реакционную смесь охлаждают до -78 С и в течение 2 ч 30 мин при -78 С прибавляют 51,8 г (156,2 ммоль) тетрабромметана в виде раствора в 250 мл безводного гексана. Затем температуре дают повышаться до 0 С и далее перемешивают в течение 1 ч 30 мин. Затем смесь гидролизуют водой (400 мл) и последовательно осуществляют экстракцию посредством Et2O (400 мл) и ДХМ (2400 мл). Объединенные органические фракции сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 6,4 г 2-бром-N,N-диметилпиридин-4-амина в виде твердого вещества коричневого цвета, используемого в таком виде на следующей стадии. Выход=51%. 1 Н ЯМР (CDCl3, 400 МГц)(м.д.): 7,9 (д, 1 Н); 6,6 (с, 1 Н); 6,4 (д, 1 Н); 2,9 (с, 6 Н). 2.2. 2-[2-(Дифенилметилиден)гидразино]-N,N-диметилпиридин-4-амин. К смеси 3,3 г (16,41 ммоль) 2-бром-N,N-диметилпиридин-4-амина в 40 мл безводного толуола, 3,5 г(18,05 ммоль) бензофенонгидразона, 2,2 г (23 ммоль) безводного трет-бутоксида натрия и 100 мг (0,82 ммоль) бензолбороновой кислоты в 40 мл толуола в атмосфере аргона при Ткомн после удаления из реакционной смеси газов продувкой аргоном прибавляют 74 мг (0,33 ммоль) ацетата палладия и 205 мг (0,33 ммоль) racBINAP. Затем реакционную смесь нагревают в течение 4 ч при 80 С. Далее реакционную смесь разбавляют 200 мл AcOEt, последовательно промывают водой (330 мл), насыщенным раствором NaHCO3 (30 мл) и насыщенным раствором хлорида натрия (30 мл), затем сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН" с градиентом МеОН от 0 до 10%. После сгущения при пониженном давлении получают 4,5 г 2-[2-(дифенилметилиден)гидразино]-N,N-диметилпиридин-4-амина в виде твердого вещества красного цвета. Выход=87%. 2.3. 2-Гидразино-N,N-диметилпиридин-4-амин. Смесь 4,5 г (14,22 ммоль) 2-[2-(дифенилметилиден)гидразино]-N,N-диметилпиридин-4-амина в 300 мл толуола и 80 мл 37%-го водного раствора соляной кислоты нагревают в течение 4 ч при 110 С. После доведения до Ткомн из реакционной смеси осуществляют экстракцию толуолом (3300 мл). Водную фазу разбавляют 200 мл воды, нейтрализуют при 0 С прибавлением 12 н. раствора гидроксида натрия и затем осуществляют экстракцию посредством ДХМ (3150 мл). Органические фракции объединяют и промывают насыщенным раствором хлорида натрия (300 мл), затем сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 1,87 г 2-гидразино-N,N-диметилпиридин-4-амина в виде твердого вещества коричневого цвета, используемого в таком виде на следующей стадии. Выход=87%. 1 Н ЯМР (м.д., ДМСО-d6, 400 МГц): 7,6 (д, 1 Н); 6,9 (с, 1 Н); 6,1 (дд, 1 Н); 5,9 (д, 1 Н); 4 (с ушир., 2 Н); 2,9 (с, 6 Н). 2.4. Гидрохлорид 2-[4-(диметиламино)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3 она. По методике, описанной в примере 1, исходя из 1,87 г 2-гидразино-N,N-диметилпиридин-4-амина и 1,97 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 35 мг 2-[4-(диметиламино)пиридин-2 ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-она. Затем получают гидрохлорид, лиофилизуя 35 мг ранее полученного соединения в 1 мл 0,1 н. раствора HCl. Таким образом, получают 36 мг гидрохлорида 2-[4-(диметиламино)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-она в виде лиофилизата белого цвета. Выход=1%. Тпл=182 С. 3.1. 2-[2-(Дифенилметилиден)гидразино]-4-метоксипиридин. По методике, описанной в примере 2.2, исходя из 0,5 г 2-хлор-4-метоксипиридина и 0,75 г бензофенонгидразона, получают 0,76 г 2-[2-(дифенилметилиден)гидразино]-4-метоксипиридина в виде твердого вещества желтого цвета, используемого в таком виде на следующей стадии. Выход=73%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,2 (с, 1 Н); 7,9 (д, 1 Н); 7,7-7,5 (м, 5 Н); 7,4-7,2 (м, 5 Н); 7,1 (с, 1 Н); 6,4 (д, 1 Н); 3,9 (с, 3H). 3.2. 2-Гидразино-4-метоксипиридин. По методике, описанной в примере 2.3, исходя из 0,76 г 2-[2-(дифенилметилиден)гидразино]-4 метоксипиридина, получают 0,24 г 2-гидразинометоксипиридина в виде лиофилизата желтого цвета, используемого в таком виде на следующей стадии. Выход=69%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 9,7 (с ушир., 1 Н); 7,7 (д, 1 Н); 6,5 (д, 1 Н); 6,4 (с, 1 Н); 4,8 (с ушир., 2 Н); 3,9 (с, 3H). 3.3. 2-(4-Метоксипиридин-2-ил)-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-он. По методике, описанной в примере 1, исходя из 243 мг 2-гидразино-4-метоксипиридина и 280 мг метил-4-оксотетрагидротиофен-3-карбоксилата, получают 82 мг 2-(4-метоксипиридин-2-ил)-1,2,4,6 тетрагидро-3H-тиено[3,4-с]пиразол-3-она в виде твердого вещества белого цвета. Выход=40%. Тпл=254C. 4.1. 6-Хлор-N-метил-N-пиридин-2-илпиридин-3-сульфонамид. К раствору 1,3 г (11,8 ммоль) N-метилпиридин-2-амина в 25 мл ДХМ при 0 С прибавляют 3,3 мл(23,6 ммоль) триэтиламина и затем небольшими порциями прибавляют 2,5 г (11,8 ммоль) 6 хлорпиридин-3-сульфонилхлорида (полученного согласно WO 9840332). После перемешивания в течение 12 ч при Ткомн реакционную смесь разбавляют 100 мл ДХМ, последовательно промывают 100 мл воды и 30 мл насыщенного раствора хлорида натрия, сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt", 4:1. После сгущения при пониженном давлении получают 2,8 г 6-хлор-Nметил-N-пиридин-2-илпиридин-3-сульфонамида в виде твердого вещества коричневого цвета. Выход=84%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,5 (с, 1 Н); 8,25 (д, 1 Н); 7,8 (дд, 1 Н); 7,7 (т, 1 Н); 7,5 (д, 1 Н); 7,3 (д,1 Н); 7,15 (т, 1 Н); 3,2 (с, 3H). 4.2. 6-Гидразино-N-метил-N-пиридин-2-илпиридин-3-сульфонамид. Раствор 1,4 г (4,9 ммоль) 6-хлор-N-метил-N-пиридин-2-илпиридин-3-сульфонамида и 0,96 мл (19,7 ммоль) гидразинмоногидрата в 8 мл EtOH нагревают в течение 12 ч при 80 С. Полученный осадок после доведения до Ткомн отделяют фильтрованием, промывают 10 мл EtOH и затем сушат в вакууме. Получают 0,85 г 6-гидразино-N-метил-N-пиридин-2-илпиридин-3-сульфонамида в виде кристаллов светло-желтого цвета. Выход=62%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,35 (с, 2 Н); 8,7 (м, 2 Н); 7,5 (д, 1 Н); 7,15 (дд, 1 Н); 6,7 (д, 1 Н); 6,4N-метил-6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)-N-пиридин-2-илпиридин-3 сульфонамида в виде твердого вещества белого цвета. Выход=45%. Тпл=226oC. 5.1. Этил-3-оксотетрагидро-2 Н-тиопиран-2-карбоксилат. К раствору 5 г (219 ммоль) натрия в 13 мл безводного EtOH и 88 мл эфира при 0 С в атмосфере аргона по каплям прибавляют 20,5 г (87,5 ммоль) этил-4-[(2-этокси-2-оксоэтил)сульфанил]бутаноата. После перемешивания в течение 18 ч при Ткомн реакционную смесь выливают в смесь "АсОН (12 мл)/лед (70 г)". Затем смесь сгущают при пониженном давлении, полученный остаток растворяют в 100 мл эфира,промывают насыщенным раствором хлорида натрия (250 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 10% AcOEt. Получают 5,64 г этил-3-оксотетрагидро-2 Нтиопиран-2-карбоксилата в виде маслоподобного вещества желтого цвета. Выход=34%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 12,3 (с, 1 Н); 4,3 (кв, 2 Н); 2,80 (м, 2 Н); 2,4 (т, 2 Н); 2,15 (м, 2 Н); 1,4N-Этил-6-(3-оксо-3,5,6,7-тетрагидротиопирано[3,2-с]пиразол-2(1 Н)-ил-N-фенилпиридин-3 сульфонамид. Смесь 1 г (5,31 ммоль) этил-3-оксотетрагидро-2 Н-тиопиран-2-карбоксилата и 1,55 г 6-гидразино-Nметил-N-пиридин-2-илпиридин-3-сульфонамида в 10 мл МеОН нагревают в течение 15 ч при 80 С. После доведения до Ткомн полученный осадок отделяют фильтрованием, промывают 5 мл МеОН и затем перекристаллизовывают из EtOH. Получают 395 мг N-этил-6-(3-оксо-3,5,6,7-тетрагидротиопирано[3,2c]пиразол-2(1 Н)-ил)-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход=16%. Тпл=198C. 6.1. 1-трет-Бутил-3-метил-4-оксопиперидин-1, 3-дикарбоксилат. К смеси 10 г (51,6 ммоль) метил-4-оксопиперидин-3-карбоксилата и 7,3 мл (51,6 ммоль) триэтиламина в 100 мл ДХМ прибавляют 11,3 г (51,6 ммоль) ди-трет-бутилдикарбоната. После выдерживания в течение 2 ч при Ткомн смесь разбавляют 300 мл ДХМ, промывают 200 мл воды, сушат над Na2SO4, затем фильтруют и сгущают при пониженном давлении. Получают 13 г 1-трет-бутил-3-метил-4 оксопиперидин-1,3-дикарбоксилата в виде твердого вещества белого цвета, используемого в таком виде на следующей стадии. 6.2. трет-Бутил-2-[5-[этил(фенил)сульфамоил]пиридин-2-ил]-3-оксо-1,2,3,4,6,7-гексагидро-5 Нпиразоло[4,3-c]пиридин-5-карбоксилат. По методике, описанной в примере 1, исходя из 1,7 г 6-гидразино-N-метил-N-пиридин-2 илпиридин-3-сульфонамида и 1,5 г 1-трет-бутил-3-метил-4-оксопиперидин-1,3-дикарбоксилата, получают 190 мг трет-бутил-2-[5-[этил(фенил)сульфамоил]пиридин-2-ил]-3-оксо-1,2,3,4,6,7-гексагидро-5 Н- 11019774 пиразоло[4,3-c]пиридин-5-карбоксилата в виде твердого вещества белого цвета. Выход=16%. Тпл=192C. 7.1. Пропил-4-оксотетрагидро-2 Н-пиран-3-карбоксилат. Соединение получают по методике, описанной в JACS, vol. 119, n 18, р. 4285-4291. 7.2.N-этил-6-(3-оксо-1,4,6,7-тетрагидропирано[4,3-c]пиразол-2(3H)-ил)-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход=57%. Тпл=164C. По методике, описанной в примере 1, исходя из 0,8 г 6-гидразино-N-метил-N-пиридин-2 илпиридин-3-сульфонамида и 0,76 г этил-1-бензил-3,6-диоксопиперидин-2-карбоксилата, полученного согласно Tetrahedron, Vol. 40, n 13, p. 2505, получают 220 мг требуемого соединения в виде твердого вещества белого цвета, которое растворяют в 6 мл смеси "вода/CH3CN" (5:1) и 1 экв 1 н. раствора NaOH и затем лиофилизуют. Таким образом, получают 225 мг 4-бензил-2-5-[этил(фенил)сульфамоил]пиридин 2-ил-5-оксо-4,5,6,7-тетрагидро-2 Н-пиразоло[4,3-b]пиридин-3-олата натрия в виде лиофилизата белого цвета. Выход=12%. Тпл 250C. М=C26H25N5O4S=503; М+Н=504; методика 2: Туд=1,16 мин. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,7 (д, 1 Н); 8,4 (с, 1 Н); 7,8 (д, 1 Н); 7,5-7,1 (м, 10 Н); 4,7 (с, 2 Н); 4,2 (с, 2 Н); 3,6 (кв, 2 Н); 3,1 (с, 2 Н); 1,0 (т, 3H). 9.1. 4-Этил-2-гидразинопиридин. К раствору 5 г (40,9 ммоль) 4-этилпиридин-2-амина в 10 мл концентрированной H2SO4 с температурой 0 С прибавляют 8 мл смеси "H2SO4/HNO3" (1:1) при температуре в интервале от 0 до 10 С и перемешивают в течение 1 ч при 0 С. Далее реакционную смесь выливают на 100 г льда, полученный осадок белого цвета отделяют фильтрованием и последовательно промывают 10 мл воды, 10 мл Et2O и 10 мл пентана. Полученное твердое вещество растворяют при 0 С в 100 мл 10 н. раствора NaOH, прибавляют 7,76 г (187 ммоль) порошка цинка и затем реакционную смесь перемешивают в течение 3 ч при 0 С. Далее реакционную смесь фильтруют через целит и из фильтрата осуществляют экстракцию посредствомAcOEt (3200 мл). Органические фракции объединяют, сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Получают 4,3 г 4-этил-2-гидразинопиридина в виде маслоподобного вещества красного цвета, используемого в таком виде на следующей стадии. Выход=77%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 7,9 (д, 1 Н); 7,2 (с ушир., 1 Н); 6,5 (с, 1 Н); 6,4 (д, 1 Н); 4,1 (с, 2 Н); 2,5 (кв, 2 Н); 1,1 (т, 3H). 9.2. 2-(4-Этилпиридин-2-ил)-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олат натрия. По методике, описанной в примере 8, исходя из 0,88 г 4-этил-2-гидразинопиридина и 1,0 г метил-4 оксотетрагидротиофен-3-карбоксилата, получают 225 мг 2-(4-этилпиридин-2-ил)-2,6-дигидро-4 Нтиено[3,4-с]пиразол-3-олата натрия в виде лиофилизата белого цвета. Выход=15%. Тпл 260C. 10.1. N-трет-Бутил-6-хлорпиридин-3-сульфонамид. По методике, описанной в примере 4.1, исходя из 2 г (9,43 ммоль) 6-хлорпиридин-3 сульфонилхлорида и 0,99 мл (9,43 ммоль) трет-бутиламина, получают 1,91 г N-трет-бутил-6 хлорпиридин-3-сульфонамида в виде твердого вещества белого цвета. Выход=82%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,8 (д, 1 Н); 8 (дд, 1 Н); 7,4 (д, 1 Н); 4,5 (с ушир., 1 Н); 1,2 (с, 9 Н). 10.2. N-трет-Бутил-6-хлор-N-метилпиридин-3-сульфонамид. Смесь 0,97 г (3,9 ммоль) N-трет-бутил-6-хлорпиридин-3-сульфонамида, 2,43 мл (39 ммоль) метилиодида и 5,4 г (39 ммоль) K2CO3 в 40 мл ацетона нагревают в течение 12 ч с обратным холодильником. Реакционную смесь фильтруют при Ткомн и фильтрат сгущают при пониженном давлении. Полученный остаток очищают на силикагеле, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 20% AcOEt,и получают 0,66 г N-трет-бутил-6-хлор-N-метилпиридин-3-сульфонамида в виде твердого вещества желтого цвета. Выход=65%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,8 (д, 1 Н); 8 (дд, 1 Н); 7,4 (д, 1 Н); 3 (с, 3H); 1,4 (с, 9 Н). 10.3. N-трет-Бутил-6-гидразино-N-метилпиридин-3-сульфонамид. По методике, описанной в примере 4.2, исходя из 0,66 г (2,53 ммоль) N-трет-бутил-6-хлор-Nметилпиридин-3-сульфонамида и 0,46 мл гидразинмоногидрата, получают 0,55 г N-трет-бутил-6 гидразино-N-метилпиридин-3-сульфонамида в виде твердого вещества белого цвета, используемого в таком виде на следующей стадии. Выход=84%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,8 (д, 1 Н); 8 (дд, 1 Н); 7 (д, 1 Н); 6,6 (с ушир., 1 Н); 4,1 (с ушир.,2 Н); 3,1 (с, 3H); 1,5 (с, 9 Н). 10.4. 2-5-[трет-Бутил(метил)сульфамоил]пиридин-2-ил-2, 6-дигидро-4 Н-тиено[3,4-с]пиразол-3 олат натрия. По методике, описанной в примере 8, исходя из 0,55 г N-трет-бутил-6-гидразино-N-метилпиридин 3-сульфонамида и 0,34 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 0,34 г 2-5-[третбутил(метил)сульфамоил]пиридин-2-ил-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олата натрия в виде лиофилизата белого цвета. Выход=67%. Тпл=130C. 11.1. 6-(3-Оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоновая кислота. По методике, описанной в примере 1, исходя из 1,75 г 6-гидразинопиридин-3-карбоновой кислоты и 1,8 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 2,5 г 6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4 с]пиразол-2(3H)-ил)пиридин-3-карбоновой кислоты в виде твердого вещества желтого цвета. Выход=94%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 12,5 (с ушир., 1 Н); 9,0 (с, 1 Н); 8,4 (д, 1 Н); 8,3 (с ушир., 1 Н); 4,1 (с, 2 Н); 3,8 (с, 2 Н). 11.2. 2-[5-(трет-Бутилкарбамоил)пиридин-2-ил]-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олат натрия. К смеси 200 мг (0,84 ммоль) 6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3 карбоновой кислоты, 90 мкл (0,84 ммоль) трет-бутиламина и 0,46 мл DIEA в 3 мл CH3CN, охлажденного до 0 С, прибавляют 365 мг TBTU. Затем реакционной смеси дают медленно нагреваться до Ткомн и перемешивают в течение 12 ч. Далее реакционную смесь сгущают при пониженном давлении, полученный остаток растворяют в 20 мл воды, осуществляют экстракцию посредством ДХМ (320 мл), сушат надNa2SO4, фильтруют, сгущают при пониженном давлении и очищают на силикагеле, элюируя смесью"ДХМ/МеОН" с градиентом от 0 до 10% МеОН. Получают 66 мг требуемого соединения, которое растворяют в 2 мл смеси "вода/CH3CN" (5:1) и 1 экв 1 н. раствора NaOH и затем лиофилизуют. Таким образом, получают 66 мг 2-[5-(трет-бутилкарбамоил)пиридин-2-ил]-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3 олата натрия в виде лиофилизата белого цвета. Выход=25%. Тпл 260C. 12.1. трет-Бутил-6-хлорпиридин-3-карбоксилат. К суспензии 1 г (6,35 ммоль) 6-хлорпиридин-3-карбоновой кислоты в 10 мл толуола при нагревании с обратным холодильником по каплям прибавляют 7,6 мл (31,75 ммоль) 1,1-ди-трет-бутокси-N,N- 14019774 диметилметанамина и далее реакционную смесь нагревают в течение 1/2 ч с обратным холодильником. После доведения до Ткомн реакционную смесь разбавляют 200 мл AcOEt, последовательно промывают водой (2100 мл), насыщенным раствором NaHCO3 (100 мл) и насыщенным раствором хлорида натрия(100 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 1,16 г третбутил-6-хлорпиридин-3-карбоксилата в виде маслоподобного вещества желтого цвета, используемого в таком виде на следующей стадии. Выход=86%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,2 (д, 1 Н); 7,3 (д, 1 Н); 1,5 (с, 9 Н). 12.2. трет-Бутил-6-гидразинопиридин-3-карбоксилат. По методике, описанной в примере 4.2, исходя из 1,16 г трет-бутил-6-хлорпиридин-3-карбоксилата и 1 мл гидразингидрата, получают 900 мг трет-бутил-6-гидразинопиридин-3-карбоксилата в виде твердого вещества, используемого в таком виде на следующей стадии. Выход=79%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,0 (д, 1 Н); 6,6 (д, 1 Н); 6,3 (с ушир., 1 Н); 3,2 (с ушир., 2 Н); 1,5 (с, 9 Н). 12.3. трет-Бутил-6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилат. По методике, описанной в примере 1, исходя из 0,75 г трет-бутил-6-гидразинопиридин-3 карбоксилата и 0,58 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 0,7 г трет-бутил-6-(3 оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-карбоксилата в виде твердого вещества белого цвета. Выход=61%. Тпл 250C. 13.1. 5-(Проп-1-ен-2-ил)пиридин-2-амин. Смесь 2 г (11,56 ммоль) 5-бромпиридин-2-амина, 2,39 мл (13,87 ммоль) 4,4,5,5-тетраметил-2-(проп 1-ен-2-ил)-1,3,2-диоксаборолана, 3,83 г (27,74 ммоль) K2CO3 в 30 мл ДМЭ и 10 мл воды перемешивают в течение 5 мин в атмосфере аргона и затем прибавляют 1 г (2,1 ммоль) бис-(трет-бутилфосфин)палладия. Далее реакционную смесь нагревают в течение 3 ч при 80 С. После доведения до Ткомн реакционную смесь разбавляют 40 мл воды и затем осуществляют экстракцию посредством AcOEt (330 мл). Органические фракции промывают 0,5 н. раствором HCl (330 мл). Водные фракции нейтрализуют 1 н. раствором гидроксида натрия и затем осуществляют экстракцию посредством AcOEt (250 мл). Объединенные органические фракции сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 1,10 г 5-(проп-1-ен-2-ил)пиридин-2-амина в виде твердого вещества желтого цвета, используемого в таком виде на следующей стадии. Выход=71%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,0 (с, 1 Н); 7,6 (д, 1 Н); 6,5 (д, 1 Н); 5,3 (с, 1 Н); 5,0 (с, 1 Н); 4,5 (с ушир., 2 Н); 2,1 (с, 3H). 13.2. 5-(Проп-2-ил)пиридин-2-амин. В колбе Парра смесь 1,1 г (8,2 ммоль) 5-(проп-1-ен-2-ил) пиридин-2-амина в 40 мл МеОН и 0,11 гPd/C, 10%, гидрируют при 7 бар в течение 24 ч. Далее реакционную смесь фильтруют через бумагуWhatman GF/F и сгущают при пониженном давлении. Таким образом, получают 1,07 г 5-(проп-2-ил)пиридин-2-амина в виде маслоподобного вещества желтого цвета, используемого в таком виде на следующей стадии. Выход=96%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,0 (с, 1 Н); 7,4 (1 Н, дд); 6,5 (д, 1 Н); 4,4 (сушир., 2 Н); 2,8 (м, 1 Н); 1,2 (с, 6 Н). 13.3. 2-Гидразинил-5-(проп-2-ил)пиридин. По методике, описанной в примере 9.1, исходя из 1,07 г 5-(проп-2-ил)пиридин-2-амина, получают 0,52 г 2-гидразинил-5-(проп-2-ил)пиридина в виде маслоподобного вещества коричневого цвета. Выход=44%. 13.4. 2-[5-(Проп-2-ил)пиридин-2-ил]-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олат натрия. По методике, описанной в примере 8, исходя из 520 мг 2-гидразинил-5-(проп-2-ил)пиридина и 251 мг метил-4-оксотетрагидротиофен-3-карбоксилата, получают 102 мг 2-[5-(проп-2-ил)пиридин-2-ил]-2,6- 15019774 14.1. 2-Хлор-4-(пиридин-3-илметокси)пиридин. Смесь 2 г (15,4 ммоль) 2-хлорпиридин-4-ола, 3,82 г (15,1 ммоль) гидробромида 3(бромметил)пиридина, 3 г (75,6 ммоль) гидроксида натрия и 1,39 г (4,3 ммоль) бромида тетрабутиламмония в 90 мл толуола нагревают в течение 12 ч с обратным холодильником. После доведения до Ткомн реакционную смесь разбавляют 300 мл AcOEt, последовательно промывают водой (2100 мл), насыщенным раствором NaHCO3 (100 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4,фильтруют, сгущают при пониженном давлении и затем очищают на хроматографией на силикагеле,элюируя смесью "ДХМ/МеОН", 98:2. Получают 2,5 г 2-хлор-4-(пиридин-3-илметокси)пиридина в виде маслоподобного вещества желтого цвета. Выход=73%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,6 (д, 1 Н); 8,25 (д, 1 Н); 7,8 (д, 1 Н); 7,4 (1 Н, дд); 7,0 (с,1 Н); 6,8 (д, 1 Н); 5,1 (с, 2 Н). 14.2. 2-Гидразинил-4-(пиридин-3-илметокси)пиридин. Смесь 0,5 г (2,27 ммоль) 2-хлор-4-(пиридин-3-илметокси)пиридина и 2 мл (40,5 ммоль) гидразингидрата нагревают при 80 С в течение 12 ч. Далее реакционную смесь разбавляют 30 мл воды и осуществляют экстракцию посредством AcOEt (330 мл). Органические фракции объединяют, промывают насыщенным раствором хлорида натрия (20 мл), затем сушат над Na2SO4, фильтруют, сгущают при пониженном давлении и очищают на силикагеле, элюируя смесью "ДХМ/МеОН", 95:5. Получают 197 мг 2 гидразинил-4-(пиридин-3-илметокси)пиридина в виде маслоподобного вещества желтого цвета. Выход=37%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,5 (д, 1 Н); 7,9 (д, 1 Н); 7,8 (д, 1 Н); 7,4 (дд, 1 Н); 7,3(с, 1 Н); 5,2 (с, 2 Н); 4,1 (с, 2 Н). 14.3. 2-[4-(Пиридин-3-илметокси)пиридин-2-ил]-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олат натрия. По методике, описанной в примере 8, исходя из 197 мг 2-гидразинил-4-(пиридин-3 илметокси)пиридина и 146 мг метил-4-оксотетрагидротиофен-3-карбоксилата, получают 225 мг 2-(4 этилпиридин-2-ил)-2,6-дигидро-4 Н-тиено[3,4-с]пиразол-3-олата натрия в виде лиофилизата белого цвета. Выход=48%. Тпл 260C. 15 А.1. 5-(3-трет-Бутил-1,2,4-оксадиазол-5-ил)-2-хлорпиридин. В приборе Дина-Старка к раствору 3,8 г (21,5 ммоль) 6-хлорпиридин-3-карбонилхлорида в 100 мл толуола небольшими порциями прибавляют 2,5 гN-гидрокси-2,2 диметилпропанимидамида, затем реакционную смесь перемешивают в течение 2 ч при Ткомн и далее нагревают в течение 2 ч. После доведения до Ткомн смесь сгущают при пониженном давлении и очищают хроматографией на силикагеле, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 10% AcOEt. Получают 4,1 г 5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2-хлорпиридина в виде твердого вещества белого цвета. Выход=81%. Н ЯМР, CDCl3, 400 МГц,(м.д.): 9,2 (с, 1 Н); 8,4 (дд, 1 Н); 7,5 (д, 1 Н); 7,8 (д, 1 Н); 1,4 (с, 9 Н). 15 А.2. 5-(3-трет-Бутил-1,2,4-оксадиазол-5-ил)-2-гидразинилпиридин. По методике, описанной в примере 4.2, исходя из 2 г 5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2 хлорпиридина и 3,9 мл гидразингидрата, получают 1,9 г 5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2 гидразинилпиридина в виде твердого вещества, используемого в таком виде на следующей стадии. Выход=97%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,1 (д, 1 Н); 6,9 (д, 1 Н); 6,5 (с ушир., 1 Н); 3,5 (с ушир., 2 Н); 1,3 (с, 9 Н). 15 А.3. 2-[5-(3-трет-Бутил-1,2,4-оксадиазол-5-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4 с]пиразол-3-он. По методике, описанной в примере 1, исходя из 0,6 г 5-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2 гидразинилпиридина и 0,41 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 0,32 г 2-[5-(3 трет-бутил-1,2,4-оксадиазол-5-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4-с]пиразол-3-она в виде твердого вещества белого цвета. Выход=38%. Тпл=240C. 15 В.1. 5-(5-трет-Бутил-1,2,4-оксадиазол-3-ил)-2-хлорпиридин. Смесь 1,5 г (8,74 ммоль) 6-хлор-N'-гидроксипиридин-3-карбоксимидамида и 1,13 мл (9,18 ммоль) триметилацетилхлорида в 15 мл толуола перемешивают в течение 1 ч при Ткомн и затем нагревают в течение 4 ч с обратным холодильником. Смесь разделяют фильтрованием. Образовавшееся твердое вещество растворяют в 15 мл АсОН и затем нагревают при 60 С в течение 5 ч. После доведения до Ткомн смесь сгущают при пониженном давлении и затем очищают хроматографией на силикагеле, элюируя смесью"циклогексан/AcOEt" (9:1). Получают 0,39 г 5-(5-трет-бутил-1,2,4-оксадиазол-3-ил)-2-хлорпиридина в виде твердого вещества белого цвета. Выход=21%. 15 В.2. 2-[5-(5-трет-Бутил-1,2,4-оксадиазол-3-ил)пиридин-2-ил]-1,2,4,6-тетрагидро-3H-тиено[3,4 с]пиразол-3-он (соединение 50 В в табл. I). По методикам примеров 15 А.2, 15 А.3, исходя из 5-(5-трет-бутил-1,2,4-оксадиазол-3-ил)-2 хлорпиридина и метил-4-оксотетрагидротиофен-3-карбоксилата, получают требуемое соединение в виде твердого вещества белого цвета. Тпл=240C. 16.1. 6-Хлор-N-циклопентилпиридин-3-сульфонамид. По методике примера 4.1, исходя из 5 г 6-хлорпиридин-3-сульфонилхлорида и 2 г циклопентиламина, получают 5,1 г 6-хлор-N-циклопентилпиридин-3-сульфонамида в виде твердого вещества желтого цвета. Выход=83%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,9 (с, 1 Н); 8,0 (д, 1 Н); 7,4 (д, 1 Н); 4,5 (д, 1 Н); 3,6 (кв, 1 Н); 1,8-1,2(м, 8 Н). 16.2. 6-Хлор-N-циклопентил-N-(проп-2-ен-1-ил)пиридин-3-сульфонамид. По методике примера 10.2, исходя из 1 г 6-хлор-N-циклопентилпиридин-3-сульфонамида и 0,42 мл аллилбромида, получают 1,2 г 6-хлор-N-фенил-N-(проп-2-ен-1-ил)пиридин-3-сульфонамида в виде мас- 17019774 лоподобного вещества оранжевого цвета. Выход=94%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,9 (с, 1 Н); 8,0 (д, 1 Н); 7,4 (д, 1 Н); 5,7 (дд, 1 Н); 5,2 (дд, 1 Н); 5,1 (д,1 Н); 4,2 (м, 1 Н); 3,7 (д, 2 Н); 1,8-1,2 (м, 8 Н). 16.3. 6-Хлор-N-циклопентил-N-(2,3-дигидроксипропил)пиридин-3-сульфонамид. К раствору 1,1 г (3,7 ммоль) 6-хлор-N-циклопентил-N-(проп-2-ен-1-ил)пиридин-3-сульфонамида в 15 мл смеси (1/1) tBuOH и воды при Ткомн прибавляют 1,2 г (10,3 ммоль) NMO и 0,52 мл (0,04 ммоль) 2,5%-го раствора OsO4 в tBuOH. Далее смесь перемешивают в течение 12 часов. Затем смесь разбавляют 200 мл воды, осуществляют экстракцию посредством Et2O (2100 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 0,92 г 6-хлор-N-циклопентил-N-(2,3 дигидроксипропил)пиридин-3-сульфонамида в виде твердого вещества коричневого цвета, используемого в таком виде на следующей стадии. Выход=75%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,1 (д, 1 Н); 7,5 (д, 1 Н); 4,3 (м, 1 Н); 4,0 (м, 1 Н); 3,6 (дд,2 Н); 3,2 (дд, 2 Н); 1,8-1,4 (м, 10 Н). 16.4. 6-Хлор-N-циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]пиридин-3-сульфонамид. Смесь 0,83 г (2,48 ммоль) 6-хлор-N-циклопентил-N-(2, 3-дигидроксипропил)пиридин-3 сульфонамида, 0,67 мл (5,45 ммоль) 2,2-диметоксипропана и 47 мг pTsOH в 5 мл ДМФА перемешивают в течение 3 ч при Ткомн. Затем смесь разбавляют 100 мл AcOEt, промывают 50 мл насыщенного раствораNaHCO3 и 50 мл воды, сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 0,92 г 6-хлор-N-циклопентил-N-[(2,2-диметил-1, 3-диоксолан-4-ил)метил]пиридин-3-сульфонамида в виде маслоподобного вещества коричневого цвета, используемого в таком виде на следующей стадии. Выход=98%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,0 (д, 1 Н); 7,3 (д, 1 Н); 4,3 (м, 1 Н); 4,0 (м, 2 Н); 3,7 (м,1 Н); 3,3 (дд, 1 Н); 3,1 (дд, 1H); 1,8-1,3 (м, 8H); 1,3 (м, 8 Н); 1,2 (с, 3H). 16.5.N-Циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]-6-гидразинилпиридин-3 сульфонамид. По методике примера 4.2, исходя из 0,92 г 6-хлор-N-циклопентил-N-[(2,2-диметил-1,3-диоксолан-4 ил)метил]пиридин-3-сульфонамида и 0,24 мл гидразингидрата, получают 0,85 г N-циклопентил-N-[(2,2 диметил-1,3-диоксолан-4-ил)метил]-6-гидразинилпиридин-3-сульфонамида в виде маслоподобного вещества желтого цвета. Выход=99%. 16.6.N-Циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]-6-(3-оксо-4,6-дигидро-1 Нтиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамид. По методике примера 1, исходя из 0,4 г N-циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]6-гидразинилпиридин-3-сульфонамида и 0,173 г метил-4-оксотетрагидротиофен-3-карбоксилата, получают 470 мг N-циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]-6-(3-оксо-4,6-дигидро-1 Нтиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамида в виде твердого вещества коричневого цвета. Выход=97%. 16.7.N-Циклопентил-N-(2,3-дигидроксипропил)-6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол 2(3H)-ил)пиридин-3-сульфонамид. Раствор 470 мг (0,54 ммоль) 6-N-циклопентил-N-[(2,2-диметил-1,3-диоксолан-4-ил)метил]-6-(3 оксо-4,6-дигидро-1 Н-тиено[3,4-с]пиразол-2(3H)-ил)пиридин-3-сульфонамида в 1 мл АсОН нагревают при 80 С в течение 4 ч. Смесь сгущают при пониженном давлении и затем очищают обращенно-фазной хроматографией на колонке С 18, элюируя смесью "HCl, 10-3 н./CH3CN" с градиентом от 0 до 100%CH3CN. Получают 48 мг N-циклопентил-N-(2,3-дигидроксипропил)-6-(3-оксо-4,6-дигидро-1 Н-тиено[3,4 с]пиразол-2(3H)-ил)пиридин-3-сульфонамида в виде твердого вещества белого цвета. Выход=30%. Тпл=190C. мл ДХМ при Ткомн по каплям прибавляют 0,5 мл мезилхлорида. Смесь перемешивают в течение 1 ч, далее разбавляют 50 мл AcOEt, промывают 20 мл воды и 20 мл насыщенного раствора хлорида натрия, затем сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 0,35 г метил-1(метилсульфонил)-4-оксопиперидин-3-карбоксилата. Выход=23%. 17.2. 2,2-Диметилпропил-6-хлорпиридин-3-карбоксилат. К раствору 10 г (56,8 ммоль) 6-хлорпиридин-3-карбонилхлорида в 100 мл безводного толуола в атмосфере аргона при Ткомн прибавляют 15 г (170,4 ммоль) 2,2-диметилпропанола. Затем реакционную смесь нагревают в течение 6 ч при 80 С. После доведения до Ткомн смесь сгущают и полученный остаток растворяют в 800 мл AcOEt, последовательно промывают водой (2200 мл), насыщенным растворомNaHCO3 (2200 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, затем сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью"циклогексан/AcOEt" с градиентом AcOEt от 0 до 5%. Получают 11,9 г 2,2-диметилпропил-6 хлорпиридин-3-карбоксилата в виде порошка белого цвета. Выход=92%. 1 Н ЯМР, CDCl3, 400 МГц,(м.д.): 7,5 (м, 5 Н); 4,2 (м, 5 Н); 3,0 (дд, 2 Н); 1,0 (т, 6 Н). 17.3. 2,2-Диметилпропил-6-гидразинилпиридин-3-карбоксилат. По методике, описанной в примере 4.2, исходя из 11,9 г (52,26 ммоль) 2,2-диметилпропил-6 хлорпиридин-3-карбоксилата, получают 4,3 г 2,2-диметилпропил-6-гидразинилпиридин-3-карбоксилата в виде порошка белого цвета. Выход=37%. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,15 (д, 1 Н); 6,9 (д, 1 Н); 4,0 (с, 2 Н); 3.5 (сушир.,1 Н); 1,0 (с, 9 Н). 17.4. 2,2-Диметилпропил-6-[5-(метилсульфонил)-3-оксо-1,3,4,5,6,7-гексагидро-2 Н-пиразоло[4,3c]пиридин-2-ил]пиридин-3-карбоксилат. По методике примера 1, исходя из 0,21 г метил-1-(метилсульфонил)-4-оксопиперидин-3 карбоксилата и 0,2 г 2,2-диметилпропил-6-гидразинилпиридин-3-карбоксилата, получают 10 мг 2,2 диметилпропил-6-[5-(метилсульфонил)-3-оксо-1,3,4,5,6,7-гексагидро-2 Н-пиразоло[4,3-c]пиридин-2 ил]пиридин-3-карбоксилата. Выход=3%. Тпл=230C.M=C18H24N4O5S=408; М+Н=409; методика 2: Туд=1,11 мин. 1 Н ЯМР, ДМСО-d6, 400 МГц,(м.д.): 12,2 (с ушир., 1 Н); 9,0 (с, 1 Н); 8,6 (с ушир., 1 Н); 8,5 (д, 1 Н); 4,1 (с, 2 Н); 4,0 (с, 2 Н); 3,5 (т, 2 Н); 3,0 (с, 3H); 2,8 (т, 2 Н); 1,0 (с, 9 Н). Следующие далее таблицы приведены для пояснения химической структуры и физических свойств некоторых соединений по настоящему изобретению. В табл. I пояснены соединения формулы (I) по настоящему изобретению, в которой R2 находится в бета-положении. Такие соединения обозначены далее как соединения формулы (I'). В табл. II пояснены соединения формулы (I) по настоящему изобретению, в которой R2 находится в гамма-положении. Такие соединения обозначены далее как соединения формулы (I"). Следующие далее табл. I и II приведены для пояснения химической структуры и физических свойств некоторых соединений по настоящему изобретению. В данных таблицах в столбце "Соль" символ "-" означает соединение в виде свободного основания, тогда как символы"CF3COOH", "HCl" и "Na" означают соединение в виде соли трифторуксусной кислоты, в виде гидрохлоридных солей и в виде натриевых солей соответственно; в других столбцах символ "-" означает, что соответствующий заместитель отсутствует в молекуле;Ph и Bn означают фенил и бензил соответственно; в столбце "Тпл" приведены температуры плавления соответствующих соединений в С; в столбце "ЖХ/МС" и в столбце "Методика" указаны соответственно масса пика МН+, идентифицированного масс-спектрометрией, и использованная и подробно описанная ранее аналитическая методика высокоэффективной жидкостной хроматографии. Соединения по настоящему изобретению были объектами фармакологических испытаний, имевших целью определение их свойств, в частности таких испытаний, как испытание in vitro по прямому измерению стабилизации белка HIF1-alpha, представляющего собой транскрипционный фактор, конститутивно экспрессируемый в клетках, но в нормальных условиях по кислороду деградируемый системой "убиквитин/протеасома"; функциональное испытание, позволяющее измерять в клетках Нер 3 В секрецию VEGF и ЕРО, представляющих собой два маркера активации HIF1-alpha в гепатоцитах. Оба эти испытания описаны далее. 1. Измерение стабилизации HIF1-alpha в клетках HEKEA. 1.1. Цель.HIF представляет собой транскрипционный фактор, участвующий в адаптации клеток к гипоксии. Этот транскрипционный фактор представляет собой, по меньшей мере, гетеродимер, образуемый 2 белками ARNT и HIF1-alpha. ARNT конститутивно экспрессируется клетками, причем основная часть регулирования комплекса осуществляется путем стабилизации белка HIF1-alpha. На практике данный белок в нормальных условиях по кислороду (приблизительно эквивалентно 20% от значения содержания кислорода в окружающей атмосфере) специфически гидроксилируется на 2 пролиновых остатках (пролиновые остатки 402 и 564 в случае белка человека) HIF-пролилгидроксилазой, вызывающей связывание белка Хиппель-Линдау (VHL). При этом такое связывание VHL с HIF1-alpha вызывает деградацию HIF1alpha системой "убиквитин/протеасома". В случае гипоксии (содержание О 25% в испытаниях на клетках) HIF-пролилгидроксилазы ингибируются, что обнаруживается по увеличению количества белкаHIF1-alpha в клетках. При этом указанный белок может ассоциироваться с ARNT для перехода в ядро и активации своих целевых генов. Поскольку гены, активированные HIF, вовлечены в адаптивный ответ клеток на гипоксию и тканей на ишемию, то цель состоит в идентификации и охарактеризовании соединений, стабилизирующих HIF1alpha в клетках, для того, чтобы амплифицировать или миметировать его положительную активность. Существует большое число испытаний, в которых описано косвенное измерение активности HIF посредством систем генов-репортеров (HRE-люцифераза) или посредством измерения содержания белков, индуцированных HIF (например, VEGF или ЕРО). Кроме того, единственными испытаниями, позволяющими непосредственно измерять количество белка HIF1-alpha в клетках, являются испытания, в которых используются антитела, например вестерн-блоттинг, включающий в себя стадии экстракции клеток (полные лизаты или нуклеарные экстракты), требующие большого количества клеток, в то же время,ограничивая также производительность скрининга соединений. Таким образом, цель состояла в разработке методики чувствительного скрининга, адаптируемого к 384-луночным планшетам и позволяющего непосредственно измерять количество белка HIF1-alpha в ядрах клеток. Это испытание было разработано для клеток HEK (клетки эпителия человека, происходящие из аденокарциномы почки). 1.2. Принцип испытания. Испытание представляет собой испытание на клетках, основанное на принципе комплементации фермента, при этом фермент, используемый в данном случае, представляет собой бета-галактозидазу. Клетки HEKEA представляют собой клетки HEK, стабильно и специфически экспрессирующие в своих ядрах мутантную бета-галактозидазу (омега-фрагмент, обозначаемый также ЕА) (линия клеток, реализуемая компанией DiscoverX). Такая конструкция обеспечивает проявление активности бетагалактозидазы только тогда, когда белок, содержащий комплементирующий фрагмент Prolabel, мигрировал в ядро. Этот белок, содержащий фрагмент Prolabel и представляющий собой в данном случае HIF1alpha или HIF1-alpha, измененный по 2 пролиновым остаткам 402 и 564, замещенным аланиновыми остатками, слит в С-концевом положении способом молекулярной биологии (вектор DiscoverX, реализуемый компанией Clontech) с комплементирующим пептидным фрагментом малой массы (Prolabel или ED массой приблизительно 4 кД). Затем вектором, кодирующим химерный белок HIF1-alphaProlabel,трансфицируют клетки HEKEA для получения стабильных клонов (HEKEAHIF1-alpha PLBL). Количество белка HIF1-alpha, "меченого" белком Prolabel в С-концевом положении и полученного после воздействия на клетки гипоксии или соединений, потенциально активирующих HIF, измеряют при добавке к клеткам буферного лизирующего раствора, содержащего хемилюминесцентный субстрат для бета-галактозидазы. Степень активности бета-галактозидазы пропорциональна количеству Prolabel и, следовательно,количеству HIF1-alpha, мигрировавшего в ядра клеток. Испытания осуществляли с обязательными параллельными определениями для подтверждения, что только фрагмент Prolabel не был стабилен в клетках и не обеспечивал, таким образом, степень активности. 1.3. Методика. 1.3.1. План эксперимента: 1) посев клеток в день J0; 2) культивирование в течение 24 ч в условиях нормоксемии; 3) приготовление и добавка соединений (Biomek 2000 и FX) в день J+1; 4) инкубация в условиях нормоксемии в течение 6 ч; 5) считывание результатов на планшетах (по люминесценции). 1.3.2. Посев клеток. Клетки высевают посредством устройства Multidrop в 384-луночные планшеты белого цвета с непрозрачным дном (Greiner, номер по каталогу 3704) в 30 мкл культуральной среды (1% SVF) в количестве 10000 клеток на лунку (планшет с клетками). 1.3.3. Обработка. Подготовка планшета для разбавления (планшет DL). Испытуемые соединения готовят с концентрацией 310-2 М в 100%-м ДМСО и затем разбавляют до концентрации 310-4 М в среде, содержащей 0,1% SVF (10 мкл в 990 мкл среды MEM). Затем соединения вручную вносят в 12-й столбец 96-луночного планшета со сферическим дном (по 200 мкл раствора каждого соединения), называемого планшет для разбавления (DL). Планшет DL с концентрациями от 310-4 до 10-9 М готовят с использованием устройства Biomek 2000 (программа: последовательная серия из 10 точек). Для сравнения и контроля вносят по 100 мкл среды DMEM с 0,1% SVF в лунки 1-го столбца, по 100 мкл дефероксамина с концентрацией 10-3 М в лунки рядов А, В, С, D 2-го столбца и по 100 мкл дефероксамина с концентрацией 510-3 М в лунки рядов Е, F, G, Н 2-го столбца. Распределение содержимого планшета DL по планшетам с клетками. Из планшета DL отбирают по 3,3 мкл пипетированием посредством устройства Biomek FX 96 для помещения с повторениями по горизонтальным рядам (с 1-го по 24-й столбец) в каждый 384-луночный планшет с клетками (планшет с клетками HEKEAHIF1-alpha PLBL). Затем клетки помещают на 6 ч в инкубатор при 37 С (содержание O2 окружающей атмосферы, 6%CO2). 1.3.4. Измерение активности бета-галактозидазы. Используемый набор представляет собой хемилюминесцентный набор PROLABEL (номер по каталогу 93-0001, DiscoverX). После инкубации в течение 6 ч при 37 С клетки лизируют прибавлением 15 мкл буферного лизирующего раствора, содержащего субстрат для бета-галактозидазы (19 объемов реактива Path hunter cell assay buffer + 5 объемов реактива Emarald II solution + 1 объем реактива Galacton star) и вносимого непосредственно в 30 мкл среды в планшете. Планшеты инкубируют в течение 60 минут без доступа света перед определением значения люминесценции с использованием устройства Top Count. Значения ЕС 50 соединений, рассчитанные с использованием программы подбора соответствующей кривой, представлены в табл. III, приведенной далее. Активирующая способность соединения в отношении HIF представлена молярной концентрацией,которая соответствует 50% от максимального ответа на это же соединение. Таблица IIIFlask T225 при 37 С в инкубаторе с атмосферой CO2. 1.4.2. Культуральная среда для клеток HEKEA HIF1-alpha PLBL: 2. Измерение секреции VEGF и ЕРО гепатоцитами Нер 3 В. 2.1. Цель.HIF представляет собой транскрипционный фактор, вовлеченный в адаптацию клеток к гипоксии. Поскольку гены, активированные HIF, вовлечены в адаптивный ответ клеток на гипоксию и тканей на ишемию, то цель состоит в идентификации и охарактеризовании соединений, стабилизирующих HIF1alpha в клетках, для того, чтобы амплифицировать или миметировать его положительную активность.HIF1-alpha был идентифицирован в связи с анализом промотора гена ЕРО, что делает этот белок одним из главных маркеров активации HIF1-alpha. С другой стороны, VEGF был также идентифицирован в ли- 28019774 тературных источниках в качестве одного из главных маркеров активации HIF. Это обстоятельство является причиной, по которой определение этих двух белков было принято для охарактеризования соединений, активирующих HIF в Нер 3 В. Таким образом, цель состояла в разработке методики чувствительного скрининга, адаптируемого к 96-луночным планшетам и позволяющего непосредственно измерять количество VEGF и ЕРО в супернатанте Нер 3 В (клетки, происходящие из гепатокарциномы человека) в ответ на действие потенциальных активаторов HIF. 2.2. Принцип испытания. Испытание представляет собой испытание ELISA, позволяющее определять содержание VEGF и ЕРО в супернатанте клеток Нер 3 В, подвергнутых действию гипоксии или обработанных дефероксамином в контрольных образцах или потенциальными активаторами HIF. Испытание адаптировано к 96 луночным планшетам, обеспечивающим наибольшую производительность скрининга соединений. 2.3. Методика. 2.3.1. План эксперимента: 1) посев клеток в день J0; 2) культивирование в течение 6 ч в условиях нормоксемии; 3) приготовление и добавка соединений (Biomek 2000 и FX); 4) инкубация в условиях нормоксемии в течение 18 ч; 5) количественное определение ЕРО и VEGF в супернатанте в день J+1. 2.3.2. Посев клеток. Клетки пересеивают в 100 мкл культуральной среды (10% SVF) в 96-луночных планшетах черного цвета с непрозрачным дном (номер по каталогу Costar 3916) в количестве 30000 клеток на лунку посредством устройства Multidrop. 2.3.3. Обработка клеток. Подготовка планшета для разбавления (планшет DL). Испытуемые соединения готовят с концентрацией 10-2 М в 100%-м ДМСО и затем разбавляют до концентрации 310-4 М в среде, содержащей 0,1% SVF (6 мкл в 194 мкл среды MEM). По 200 мкл раствора каждого соединения вносят в лунки 12-го столбца 96-луночного планшета разбавления. Разбавления в диапазоне от 310-4 до 310-8 М осуществляют с использованием устройства Biomek 2000 (программа: последовательная серия из 9 точек). В качестве контрольных образцов в лунки рядов А, В, С, D и рядов Е, F, G, Н 3-го столбца вносят соответственно по 100 мкл среды MEM с 0,1% SVF и дефероксамина с концентрацией 510-3 М. Распределение содержимого планшета DL по планшетам с клетками. Среду клеток, посеянных накануне в 96-луночные планшеты, меняют на 90 мкл среды, содержащей 0,1% SVF, и по 10 мкл из 96-луночных планшетов DL распределяют посредством устройства FX 96 по планшетам с клетками. Затем планшеты с обработанными таким образом клетками помещают на 18 ч в инкубатор при 37 С(содержание О 2 окружающей атмосферы, 6% СО 2). 2.3.4. Количественное определение ЕРО и VEGF. Супернатанты (80 мкл) Нер 3 В в 96-луночных планшетах, обработанных потенциальными активаторами HIF, отбирают многоканальной пипеткой для синхронного количественного определения VEGF и ЕРО способом ELISA согласно руководству поставщика (набор ЕРО Mesoscale (номер по каталогуK15122B-2. Значения ЕС 50 в отношении ЕРО и VEGF, рассчитанные с использованием программы подбора соответствующей кривой, представлены в приведенной далее табл. IV. 2.4. Прочее. 3. Результаты. Активирующая способность соединения в отношении HIF представлена концентрацией, которая соответствует 50% от максимального ответа на это же соединение, см. приведенную далее табл. IV.
МПК / Метки
МПК: C07D 409/12, C07D 401/12, C07D 491/04, A61P 27/06, C07D 213/72, C07D 495/04, C07D 405/12, C07D 213/77, A61K 31/4162, C07D 403/04, C07D 513/04, C07D 471/04
Метки: применение, 2-пиридин-2-ил-пиразол-3(2h)-она, получение, производные, терапии
Код ссылки
<a href="https://eas.patents.su/30-19774-proizvodnye-2-piridin-2-il-pirazol-32h-ona-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-пиридин-2-ил-пиразол-3(2h)-она, их получение и применение в терапии</a>
Предыдущий патент: Способ и устройство для формирования покрытия на стекле
Следующий патент: Заглушка для установки в трубе
Случайный патент: Способ получения бутадиена и/или бутенов из н-бутана












