3,4-диарилпиразолы в качестве ингибиторов протеинкиназ
Номер патента: 19722
Опубликовано: 30.05.2014
Авторы: Дзуккотто Фабио, Нуволони Стефано, Бьондаро Соня, Маркионни Кьяра, Модуньо Микеле, Тракванди Габриелла, Черви Джованни, Бадари Алессандра, Пуличи Маурицио, Трифиро' Паоло
Формула / Реферат
1. Соединение формулы (I)
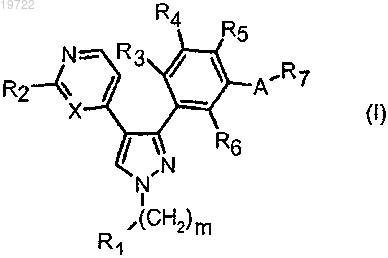
в которой m означает целое число от 0 до 6;
R1 означает водород, трихлорметил, трифторметил, галоген, цианогруппу, ОН, OR8, NR9R10, NR21COR22, СООН, COOR11, CONR12R13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C2-C8)алкенила или (С2-С8)алкинила, (С3-С8)циклоалкила, (С3-С8)циклоалкенила, гетероциклила, арила и гетероарила, где
R8 и R11, каждый независимо, означают необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C3-C8)циклоалкила, гетероциклила, арила и гетероарила;
R9, R10, R12 и R13, одинаковые или разные и каждый независимо, означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C3-C8)циклоалкила, гетероциклила, арила и гетероарила, или взятые вместе с атомом азота, с которым они связаны, любые R9 и R10, а также R12 и R13 образуют необязательно замещенный гетероциклил или гетероарил, необязательно содержащий один дополнительный гетероатом или группу гетероатомов, выбранную из S, О, N или NH;
R21 и R22, одинаковые или разные и каждый независимо, означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C3-C8)циклоалкила, гетероциклила, арила и гетероарила, или взятые вместе с атомами, с которыми они связаны, R21 и R22 образуют необязательно замещенный гетероциклил, необязательно содержащий один дополнительный гетероатом или группу гетероатомов, выбранную из S, О, N или NH;
X означает -СН или N;
R2 означает водород, галоген, NR14R15, где
R14 и R15 независимо означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила или гетероциклила; или R14 означает водород и R15 означает COR16, где
R16 означает неразветвленный или разветвленный (C1-C8)алкил, необязательно замещенный ОН группой, или гетероарил;
R3, R4, R5 и R6, каждый независимо, означают водород, галоген, трифторметил, трихлорметил, цианогруппу, OR20 или необязательно замещенный неразветвленный или разветвленный (C1-C8)алкил, где
R20 означает необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила;
А означает -CON(Y), -N(Y)CO-, -N(Y)SO2-, -N(Y)CON(Y)-, -C(R'R")N(Y)CO или -N(Y)C(R'R")-, где Y, R' и R" означают водород;
R7 означает водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C2-C8)алкенила или (C3-C8)циклоалкила, (C2-C8)алкинила, (C3-C8)циклоалкенила, гетероциклила, арила и гетероарила;
причем гетероциклил представляет собой 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, в котором один или несколько атомов углерода замещены гетероатомами, выбранными из N, О или S;
гетероарил относится к ароматическим 5-8-членным гетероциклам, содержащим от 1 до 3 гетероатомов, выбранных из N, О или S, необязательно далее конденсированным или связанным с ароматическими карбоциклическими и гетероциклическими кольцами;
арил относится к моно-, би- или поликарбоциклическим углеводородам, содержащим от 1 до 4 циклических систем, где по меньшей мере одно карбоциклическое кольцо является ароматическим;
причем в случае, если группа определена как необязательно замещенная, она может быть замещена 1-6 заместителями, выбранными из галогена, нитрогруппы, оксогруппы (=O), цианогруппы, (C1-C8)алкила, полифторированного (C1-C8)алкила, полифторированной (C1-C8)алкоксигруппы, (C2-C8)алкенила, (C2-C8)алкинила, гидрокси(C1-C8)алкила, фенила, фенил(C1-C8)алкила, (C3-C8)циклоалкила, гидроксигруппы, (C1-C8)алкоксигруппы, фенилоксигруппы, метилендиоксигруппы, (C1-C8)алкилкарбонилоксигруппы, фенилкарбонилоксигруппы, (C3-C8)циклоалкенилоксигруппы, (C1-C8)алкилиденаминооксигруппы, карбоксигруппы, (C1-C8)алкоксикарбонила, фенилоксикарбонила, (C3-C8)циклоалкилоксикарбонила, уреидогруппы, (C1-C8)алкиламиногруппы, ди(C1-C8)алкиламиногруппы, фениламиногруппы, дифениламиногруппы, формиламиногруппы, (C1-C8)алкилкарбониламиногруппы, фенилкарбониламиногруппы, аминокарбонила, (C1-C8)алкиламинокарбонила, ди(C1-C8)алкиламинокарбонила, фениламинокарбонила, (C1-C8)алкоксикарбониламиногруппы, гидроксиаминокарбонила, (C1-C8)алкоксииминогруппы, (C1-C8)алкилсульфониламиногруппы, фенилсульфониламиногруппы, формила, (C1-C8)алкилкарбонила, фенилкарбонила, (C3-C8)циклоалкилкарбонила, (C1-C8)алкилсульфонила, фенилсульфонила, аминосульфонила, (C1-C8)алкиламиносульфонила, ди(C1-C8)алкиламиносульфонила, фениламиносульфонила, фенилтиогруппы, (C1-C8)алкилтиогруппы, фосфоната и (C1-C8)алкилфосфоната;
где гетероарильное кольцо, необязательно дополнительно конденсированное или связанное с ароматическим карбоциклическим или гетероциклическим кольцом, является имидазолилом или тиенилом,
и его фармацевтически приемлемая соль.
2. Соединение формулы (I) по п.1, в котором m означает целое число от 0 до 2.
3. Соединение формулы (I) по п.1 или 2, в которой А означает -CON(Y), -N(Y)CO-, -N(Y)SO2-,
-N(Y)CON(Y)- или -C(R'R")N(Y)CO, где Y, R' и R" имеют значения, определенные в п.1.
4. Соединение формулы (I) по пп.1-3, в которой
R1 означает водород, трихлорметил, трифторметил, галоген, цианогруппу, ОН, OR8, NR9R10, CONR12R13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C2-C8)алкенила или (C2-C8)алкинила, (C3-C8)циклоалкила, (C3-C8)циклоалкенила, гетероциклила, арила и гетероарила, где
R8, R9, R10, R12 и R13 имеют значения, которые определены в п.1.
5. Соединение формулы (I) по пп.1-4, в которой R1 означает водород, трихлорметил, трифторметил, галоген или цианогруппу.
6. Соединение формулы (I) по пп.1-3, в которой R2 означает водород или NR14R15, где R14 и R15 независимо означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила или гетероциклила.
7. Соединение формулы (I) по пп.1-3, в которой R7 означает необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (С3-С8)циклоалкила, (C3-C8)циклоалкенила, гетероциклила, арила и гетероарила.
8. Соединение формулы (I) или его фармацевтически приемлемая соль по пп.1-7, которое выбрано из группы, состоящей из
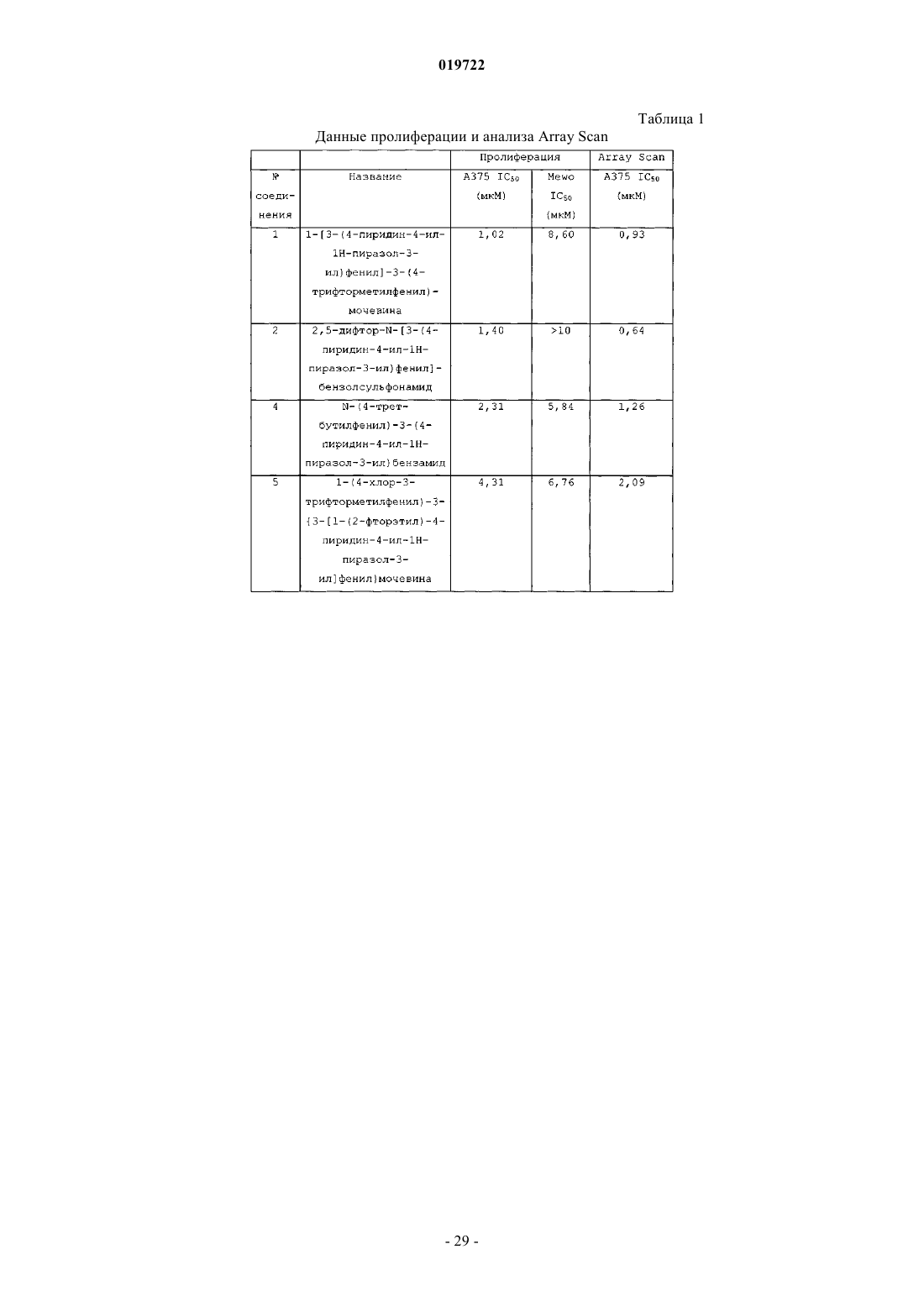
1-[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
2,5-дифтор-N-[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]бензолсульфонамида,
N-(4-хлорфенил)-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)бензамида,
N-(4-трет-бутилфенил)-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)бензамида,
1-(4-хлор-3-трифторметилфенил)-3-{3-[1-(2-фторэтил)-4-пиридин-4-ил-1Н-пиразол-3-ил]фенил}мочевины,
[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амид фуран-2-сульфоновой кислоты,
[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амид тиофен-3-сульфоновой кислоты,
1-[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-п-толилмочевины,
1-(4-хлорфенил)-3-[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]мочевины,
1-[3-(1-этил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
1-[3-(1-цианометил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
1-{3-[4-(2-аминопиридин-4-ил)-1Н-пиразол-3-ил]фенил}-3-(4-трифторметилфенил)мочевины,
1-{3-[1-(2-фторэтил)-4-пиридин-4-ил-1Н-пиразол-3-ил]фенил}-3-(4-трифторметилфенил)мочевины,
1-{3-[1-(2-гидроксиэтил)-4-пиридин-4-ил-1Н-пиразол-3-ил]фенил}-3-(4-трифторметилфенил)мочевины,
1-[3-(1-пиперидин-4-ил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
N-[3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-2-(4-трифторметилфенил)ацетамида,
N-[4-(3-{3-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиразол-4-ил)пиридин-2-ил]ацетамида,
N-[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-2,5-дифторбензолсульфонамида,
[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амида тиофен-3-сульфоновой кислоты,
[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амида фуран-2-сульфоновой кислоты,
[2,4-дифтор-3-(4-пиридин-4 -ил-1Н-пиразол-3-ил)фенил]амида пропан-1-сульфоновой кислоты,
[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амида циклопропансульфоновой кислоты,
[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амида 2,2,2-трифторэтансульфоновой кислоты,
[2,4-дифтор-3-(4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]амида циклогексансульфоновой кислоты,
1-{3-[4-(2-аминопиримидин-4-ил)-1Н-пиразол-3-ил]фенил}-3-(4-трифторметилфенил)мочевины,
N-[4-(3-{3-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиразол-4-ил)пиримидин-2-ил]ацетамида,
N-{3-[4-(2-аминопиримидин-4-ил)-1Н-пиразол-3-ил]фенил}-2,5-дифторбензолсульфонамида,
N-[4-(3-{3-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиразол-4-ил)пиридин-2-ил]пропионамида,
N-[4-(3-{3-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиразол-4-ил)пиридин-2-ил]изобутирамида,
4-гидрокси-N-[4-(3-{3-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиразол-4-ил)пиридин-2-ил]бутирамида,
3-(4-пиридин-4-ил-1Н-пиразол-3-ил)-N-(4-трифторметилфенил)бензамида,
этилового эфира 4-пиридин-4-ил-3-{3-[3-(4-трифторметилфенил)уреидо]фенил}пиразол-1-карбоновой кислоты,
1-[3-(1-метил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
1-[3-(1-бутил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
1-[3-(1-изобутил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,
N-[3-(1-этил-4-пиридин-4-ил-1Н-пиразол-3-ил)-2,4-дифторфенил]-2,5-дифторбензолсульфонамида,
N-[2,4-дифтор-3-(1-метил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-2,5-дифторбензолсульфонамида,
N-{2,4-дифтор-3-[4-(2-метиламинопиридин-4-ил)-1Н-пиразол-3-ил]фенил}-2,5-дифторбензолсульфонамида,
N-{3-[4-(2-этиламинопиридин-4-ил)-1Н-пиразол-3-ил]-2,4-дифторфенил}-2,5-дифторбензолсульфонамида,
N-{3-[4-(2-этиламинопиримидин-4-ил)-1Н-пиразол-3-ил]фенил}-2,5-дифторбензолсульфонамида,
N-[2,4-дифтор-3-(1-изобутил-4-пиридин-4-ил-1Н-пиразол-3-ил)фенил]-2,5-дифторбензолсульфонамида,
N-[3-(1-этил-4-пиридин-4-ил-1Н-пиразол-3-ил)-2,4-дифторфенил]-2-фторбензолсульфонамида,
N-[3-(1-этил-4-пиридин-4-ил-1Н-пиразол-3-ил)-2,4-дифторфенил]-3-фторбензолсульфонамида и
N-{3-[4-(2-аминопиридин-4-ил)-1-этил-1Н-пиразол-3-ил]-2,4-дифторфенил}-2,5-дифторбензолсульфонамида.
9. Способ in vitro ингибирования активности семейства RAF, который включает осуществление контакта указанного рецептора с эффективным количеством соединения по п.1.
10. Фармацевтическая композиция для лечения рака, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли по п.1 и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
11. Фармацевтическая композиция по п.10, дополнительно содержащая одно или несколько химиотерапевтических средств.
12. Набор, содержащий соединение формулы (I) или его фармацевтически приемлемую соль по п.1 и одно или несколько химиотерапевтических средств в виде комбинированного препарата для одновременного, раздельного или последовательного применения в противоопухолевой терапии.
13. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 в качестве лекарственного средства для лечения рака.
14. Применение соединения (I) или его фармацевтически приемлемой соли по п.1 в способе лечения злокачественной опухоли.
15. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 в производстве лекарственного средства, обладающего противоопухолевой активностью.
16. Набор, содержащий фармацевтическую композицию по п.10 и одно или несколько химиотерапевтических средств в виде комбинированного препарата для одновременного, раздельного или последовательного применения в противоопухолевой терапии.
Текст
Раскрыты производные 3,4-диарилпиразола формулы (I), которые определены в описании, и их фармацевтически приемлемые соли, способ их получения и содержащие их фармацевтические композиции; соединения согласно изобретению могут быть применимы в терапии, лечении заболеваний, ассоциированных с нарушенной регуляцией активности протеинкиназы, подобных злокачественной опухоли.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) Настоящее изобретение относится к некоторым замещенным соединениям 3,4-диарилпиразола, которые модулируют активность протеинкиназ. Следовательно, соединения согласно настоящему изобретению применимы для лечения заболеваний, вызванных нарушенной регуляцией активности протеинкиназ. Настоящее изобретение также относится к способам получения таких соединений, к фармацевтическим композициям, содержащим такие соединения, и к способам лечения заболеваний с применением фармацевтических композиций, содержащих такие соединения. Классический путь Ras, Raf, MEK (активируемая митогенами протеинкиназа/киназа регулируемой внеклеточными сигналами киназы), ERK (регулируемая внеклеточными сигналами киназа) играет центральную роль в регуляции различных клеточных функций в зависимости от клеточного контекста,включая клеточную пролиферацию, дифференцировку, жизнеспособность, иммортализацию и ангиогенез (обзор Peyssonnaux and Eychene, Biology of the Cell, 2001, 93, 3-62). В таком пути представители семейства Raf привлекаются к плазматической мембране после связывания с нагруженным гуанозинтрифосфатом (GTP) Ras, что приводит к фосфорилированию и активации белков Raf. Затем активированныеRaf фосфорилируют и активируют MEK, которые, в свою очередь, фосфорилируют и активируют ERK. После активации ERK транслоцируются из цитоплазмы в ядро, приводя к фосфорилированию и регуляции активности факторов транскрипции, таких как Elk-I и Myc. Сообщалось, что путь Ras/Raf/MEK/ERK вносит вклад в опухолевый фенотип благодаря индукции иммортализации, независимого от ростовых факторов роста, нечувствительности к ингибирующим рост сигналам, способности к инвазии и метастазированию, благодаря стимуляции ангиогенеза и ингибированию апоптоза (обзор в Kolch et al., Exp. Rev.Mol. Med., 2002, 25 April, http://www.expertreviews.org/02004386h.htm). Действительно, фосфорилирование ERK усиливается примерно на 30% во всех опухолях человека (Hoshino et al., Oncogene, 1999, 18,813-822). Это может быть результатом сверхэкспрессии и/или мутации ключевых представителей пути. Сообщалось о трех изоформах сериновых/треониновых протеинкиназ Raf: Raf-1/c-Raf, B-Raf иA-Raf (обзор в Mercer and Pritchard, Biochim. Biophys. Acta, 2003, 1653, 25-40), гены которых, как предполагается, возникли в результате дупликации генов. Все три гена Raf экспрессируются в большинстве тканей, но с некоторыми различиями: c-Raf экспрессируется повсеместно на высоком уровне, тогда как высокий уровень экспрессии B-Raf встречается в нервной ткани, a A-Raf в ткани мочеполовой системы. Высокогомологичные представители семейства Raf обладают перекрывающимися, но отличающимися биохимическими активностями и биологическими функциями (Hagemann and Rapp, Expt. Cell Res. 1999,253, 34-46). Экспрессия всех трех генов Raf требуется для нормального развития мышей, однако два из них, c-Raf и B-Raf, требуются для завершения беременности. Мыши B-Raf-/-погибали на стадии Е 12.5 вследствие кровотечения из сосудов, вызванного повышенным апоптозом эндотелиальных клеток (Wojnowski et al., Nature Genet., 1997, 16, 293-297). Согласно сообщениям B-Raf является основной изоформой, вовлеченной в пролиферацию клеток, и главной мишенью онкогенного Ras. Идентифицированы 5 соматических миссенс-мутаций только для B-Raf, встречающиеся с частотой 66% при злокачественных меланомах кожи (Davies et al., Nature, 2002, 417, 949-954), которые также присутствуют во многих злокачественных опухолях человека, включая без ограничения сосочковые опухоли щитовидной железы(Cohen et al., J. Natl. Cancer Inst., 2003, 95, 625-627), холангиокарциномы (Tannapfel et al., Gut, 2003, 52,706-712), злокачественные опухоли ободочной кишки и яичников (Davies et al., Nature, 10, 2002, 417, 949954). Наиболее частой мутацией в B-Raf (80%) является замена валина глутаминовой кислотой в положении 600. Такие мутации повышают базальную киназную активность B-Raf и, как предполагают, разобщают передачу сигнала Raf/MEK/ERK от расположенных выше стимулов пролиферации, включаяRas и активацию рецептора фактора роста, приводя к конститутивной активации ERK. Мутантные белкиB-Raf являются трансформирующими в клетках NIH3T3 (Davies et al., Nature, 2002, 15, 417, 949-954) и меланоцитах (Wellbrock et al., Cancer Res., 2004, 64, 2338-2342), а также было показано, что они необходимы для жизнеспособности клеток меланомы и трансформации (Hingorani et al., Cancer Res., 2003, 63,5198-5202). Как ключевой стимулятор каскада передачи сигналов Raf/MEK/ERK B-Raf представляет собой вероятную точку для вмешательства в опухоли, зависимые от такого пути. Замещенные производные пиразола для лечения опосредованных цитокинами заболеваний, таких как воспаление и артрит, описаны в WO 98/52940 и WO 00/31063, G.D. SearleСо. Производные гидроксиарилпиразола для лечения злокачественной опухоли описаны вWO 03/055860, Cancer Research Institute, и в WO 07/105058, Pfizer Inc. Производные пиримидинилпиразола для лечения гиперпролиферативных расстройств, таких как злокачественная опухоль, описаны в WO 07/24843, SmithKline Beecham Corporation. Несмотря на указанные разработки, все еще сохраняется необходимость в эффективных средствах для лечения указанных заболеваний. Авторы настоящего изобретения в настоящем описании раскрыли тот факт, что соединения формулы (I), описанные ниже, являются ингибиторами киназ и, следовательно, применимы в терапии в качестве противоопухолевых средств. Соответственно, первой целью настоящего изобретения является получение замещенного соединения 3,4-диарилпиразола, представленного формулой (I) где m означает целое число от 0 до 6;R1 означает водород, трихлорметил, трифторметил, галоген, цианогруппу, ОН, OR8, NR9R10,NR21COR22, СООН, COOR11, CONR12R13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленногоR8 и R11, каждый независимо, означают необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (C3-C8)циклоалкила, гетероциклила, арила и гетероарила;R9, R10, R12 и R13, одинаковые или разные и каждый независимо, означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила,(C3-C8)циклоалкила, гетероциклила, арила и гетероарила, или взятые вместе с атомом азота, с которым они связаны, любые R9 и R10, а также R12 и R13 образуют необязательно замещенный гетероциклил или гетероарил, необязательно содержащий один дополнительный гетероатом или группу гетероатомов, выбранную из S, О, N или NH;R21 и R22, одинаковые или разные и каждый независимо, означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила,(C3-C8)циклоалкила, гетероциклила, арила и гетероарила, или взятые вместе с атомами, с которыми они связаны, R21 и R22 образуют необязательно замещенный гетероциклил, необязательно содержащий один дополнительный гетероатом или группу гетероатомов, выбранную из S, О, N или NH;R14 и R15 независимо означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила или гетероциклила; или R14 означает водород и R15 означает COR16;R16 означает неразветвленный или разветвленный (C1-C8)алкил, необязательно замещенный ОН группой, или гетероарил;R3, R4, R5 и R6, каждый независимо, означают водород, галоген, трифторметил, трихлорметил, цианогруппу, OR20 или необязательно замещенный неразветвленный или разветвленный (C1-C8)алкил;R20 означает необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила; А означает -CON(Y), -N(Y)CO-, -N(Y)SO2-, -N(Y)CON(Y)-, -C(R'R")N(Y)CO или -N(Y)С(R'R")-, гдеR7 означает водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного(C3-C8)циклоалкила,(C2-C8)алкинила,(С 3-С 8)циклоалкенила, гетероциклила, арила и гетероарила; причем гетероциклил представляет собой 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, в котором один или несколько атомов углерода замещены гетероатомами,выбранными из N, О или S; гетероарил относится к ароматическим 5-8-членным гетероциклам, содержащим от 1 до 3 гетероатомов, выбранных из N, О или S, необязательно далее конденсированных или связанных с ароматическими карбоциклическими и гетероциклическими кольцами; арил относится к моно-, би- или поликарбоциклическим углеводородам, содержащим от 1 до 4 циклических систем, где по меньшей мере одно карбоциклическое кольцо является ароматическим; причем в случае, если группа определена как необязательно замещенная, она может быть замещена 1-6 заместителями, выбранными из галогена, нитрогруппы, оксогруппы (=O), цианогруппы,(C1-C8)алкила, полифторированного (C1-C8)алкила, полифторированной (C1-C8)алкоксигруппы,(C2-C8)алкенила,(C2-C8)алкинила,гидрокси(C1-C8)алкила,фенила,фенил(C1-C8)алкила,(C3-C8)циклоалкила, гидроксигруппы, (C1-C8)алкоксигруппы, фенилоксигруппы, метилендиоксигруппы,(C1-C8)алкилкарбонилоксигруппы,фенилкарбонилоксигруппы,(C3-C8)циклоалкенилоксигруппы,(C1-C8)алкилиденаминооксигруппы, карбоксигруппы, (C1-C8)алкоксикарбонила, фенилоксикарбонила,(C3-C8)циклоалкилоксикарбонила, уреидогруппы, (C1-C8)алкиламиногруппы, ди(C1-C8)алкиламиногруппы, фениламиногруппы, дифениламиногруппы, формиламиногруппы, (C1-C8)алкилкарбониламиногруппы,фенилкарбониламиногруппы,аминокарбонила,(C1-C8)алкиламинокарбонила,ди(C1-C8)алкиламинокарбонила, фениламинокарбонила, (C1-C8)алкоксикарбониламиногруппы, гидроксиаминокарбонила, (C1-C8)алкоксииминогруппы, (C1-C8)алкилсульфониламиногруппы, фенилсульфониламиногруппы, формила, (C1-C8)алкилкарбонила, фенилкарбонила, (C3-C8)циклоалкилкарбонила,-2 019722(C1-C8)алкилсульфонила,фенилсульфонила,аминосульфонила,(C1-C8)алкиламиносульфонила,ди(C1-C8)алкиламиносульфонила, фениламиносульфонила, фенилтиогруппы, (C1-C8)алкилтиогруппы,фосфоната и (C1-C8)алкилфосфоната; гетероарильное кольцо, необязательно дополнительно конденсированное или связанное с ароматическим карбоциклическим или гетероциклическим кольцом, является имидазолилом или тиенилом; и его фармацевтически приемлемых солей. Способ получения замещенных соединений 3,4-диарилпиразола, представленных формулой (I), состоит из стандартных синтетических превращений. Настоящее изобретение также относится к способу in vitro ингибирования активности семействаRAF, который включает осуществление контакта указанного рецептора с эффективным количеством соединения, представленного формулой (I), поэтому соединения настоящего изобретения пригодны для лечения заболеваний, вызванных и/или ассоциированных с нарушенной регуляцией активности протеинкиназ, в частности семейства RAF, путем введения млекопитающему, нуждающемуся в таком лечении,эффективного количества соединения замещенного 3,4-диарилпиразола, представленного формулой (I),которая определена выше, в частности для лечения рака. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент, носитель или разбавитель. Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение формулы (I) и одно или несколько химиотерапевтических средств. Кроме того, изобретение относится к набору, содержащему соединение формулы (I), которое определено выше, или его фармацевтически приемлемую соль, или его фармацевтические композиции и одно или несколько химиотерапевтических средств в виде комбинированного препарата для одновременного, раздельного или последовательного применения в противораковой терапии. В еще одном аспекте изобретение относится к соединению формулы (I), которое определено выше,или его фармацевтически приемлемой соли для применения в качестве лекарственного средства для лечения рака. Кроме того, изобретение относится к применению соединения формулы (I), которое определено выше, или его фармацевтически приемлемой соли в производстве лекарственного средства с противоопухолевой активностью. Наконец, изобретение относится к применению соединения формулы (I), которое определено выше,или его фармацевтически приемлемой соли в способе лечения злокачественной опухоли. Если не оговорено особо, то в случае указания соединений формулы (I) как таковых, а также любой их фармацевтической композиции или любого терапевтического средства, включающего такие соединения, настоящее изобретение охватывает все изомеры, таутомеры, гидраты, сольваты, комплексы, метаболиты, пролекарства, носители, N-оксиды и фармацевтически приемлемые соли соединений согласно настоящему изобретению. Метаболитом соединения формулы (I) является любое соединение, в которое то же самое соединение формулы (I) превращается in vivo, например, при введении млекопитающему, нуждающемуся в таком введении. Обычно, но не в качестве неограничивающего примера, при введении соединения формулы (I), такое производное может быть превращено в различные соединения, например включая более растворимые производные, подобные гидроксилированным производным, которые легко экскретируются. Следовательно, в зависимости от метаболического пути, в котором это происходит, любое из таких гидроксилированных производных можно считать метаболитом соединений формулы (I). Пролекарства представляют собой любые ковалентно связанные соединения, которые in vivo высвобождают активное исходное лекарственное средство формулы (I).N-оксиды представляют собой соединения формулы (I), где атомы азота и кислорода связаны семиполярной связью. Если в соединении согласно настоящему изобретению присутствует хиральный центр или другая форма изомерного центра, то подразумевается, что изобретение охватывает все формы такого изомера или изомеров, включая энантиомеры и диастереомеры. Соединения, содержащие хиральный центр, можно применять в виде рацемической смеси, обогащенной энантиомером смеси, или рацемическая смесь может быть разделена с использованием хорошо известных способов, и можно использовать один отдельный энантиомер. В тех случаях, когда соединения имеют ненасыщенные углерод-углеродные двойные связи, цис- (Z) и транс- (Е) изомеры входят в объем настоящего изобретения. В тех случаях, когда соединения могут существовать в таутомерных формах, каждую форму считают входящей в объем настоящего изобретения, независимо от того, существуют ли формы в равновесии или преимущественно в одной форме. По существу, если не оговорено особо, то в случаях, когда в соединениях формулы (I) m равно 0 иR1 означает водород, указана только одна из следующих таутомерных форм, представленных формулой(Ia) или (Ib), при этом другую форму следует считать входящей в объем изобретения: В случаях, когда соединения могут существовать в других таутомерных формах, таких как кетоенольные таутомеры, каждая таутомерная форма считается включенной в объем настоящего изобретения,независимо от того, существуют ли формы в равновесии или преимущественно в одной форме. Что касается термина "неразветвленный или разветвленный C1-C8-алкил", авторы подразумевают любую из таких групп, как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил,втор-бутил, н-пентил, н-гексил, н-гептил, н-октил и т.п. Что касается термина "неразветвленный или разветвленный C1-C6-алкил", авторы подразумевают любую из таких групп, как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил,втор-бутил, н-пентил, н-гексил и т.п. Что касается термина "неразветвленный или разветвленный C1-C3-алкил", авторы подразумевают любую из таких групп, как, например, метил, этил, н-пропил, изопропил. Что касается термина "C3-C8-циклоалкил", авторы подразумевают, если не оговорено особо, 3-8 членное полностью углеродное моноциклическое кольцо, которое может содержать одну или несколько двойных связей, но не имеет полностью сопряженной -электронной системы. Примерами циклоалкильных групп без ограничения являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан,циклогексен и циклогексадиен. Что касается термина "гетероциклил", авторы подразумевают 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, в котором один или несколько атомов углерода заменены гетероатомами, такими как атомы азота, кислорода и серы. Не ограничивающими примерами гетероциклильных групп являются, например, пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диоксолан, пиперидин,пиперазин, морфолин и т.п. авторы подразумевают алифатическую Что касается термина"C2-C8-алкенил",C2-C8-углеводородную цепь, которая содержит по меньшей мере одну углерод-углеродную двойную связь и которая может быть неразветвленной или разветвленной. Типичными примерами без ограничения являются этенил, 1-пропенил, 2-пропенил, 1- или 2-бутенил и т.п. Что касается терминаC2-C8-углеводородную цепь, которая содержит по меньшей мере одну углерод-углеродную тройную связь и которая может быть неразветвленной или разветвленной. Типичными примерами являются без ограничения этинил, 1-пропинил, 2-пропинил, 1- или 2-бутинил и т.п. Термин "гетероциклил" представляет собой 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, в котором один или несколько атомов углерода замещены гетероатомами,выбранными из N, О или S. Термин "гетероарил" относится к ароматическим 5-8-членным гетероциклам, содержащим от 1 до 3 гетероатомов, выбранных из N, О или S, необязательно далее конденсированных или связанных с ароматическими карбоциклическими и гетероциклическими кольцами. Термин "арил" относится к моно-, би- или поликарбоциклическим углеводородам, содержащим от 1 до 4 циклических систем, где по меньшей мере одно карбоциклическое кольцо является ароматическим; причем в случае, если группа определена как необязательно замещенная, она может быть замещена 1-6 заместителями, выбранными из галогена, нитрогруппы, оксогруппы (=O), цианогруппы,(C1-C8)алкила, полифторированного (C1-C8)алкила, полифторированной (C1-C8)алкоксигруппы,(C2-C8)алкенила,(C2-C8)алкинила,гидрокси(С 1-С 8)алкила,фенила,фенил(С 1-С 8)алкила,(C3-C8)циклоалкила, гидроксигруппы, (C1-C8)алкоксигруппы, фенилоксигруппы, метилендиоксигруппы,(C1-C8)алкилкарбонилоксигруппы,фенилкарбонилоксигруппы,(C3-C8)циклоалкенилоксигруппы,(C1-C8)алкилиденаминооксигруппы, карбоксигруппы, (C1-C8)алкоксикарбонила, фенилоксикарбонила,(C3-C8)циклоалкилоксикарбонила, уреидогруппы, (C1-C8)алкиламиногруппы, ди(C1-C8)алкиламиногруппы, фениламиногруппы, дифениламиногруппы, формиламиногруппы, (C1-C8)алкилкарбониламиногруппы, фенилкарбониламиногруппы, аминокарбонила, (C1-C8)алкиламинокарбонила, ди(C1C8)алкиламинокарбонила, фениламинокарбонила, (C1-C8)алкоксикарбониламиногруппы, гидроксиаминокарбонила, (C1-C8)алкоксииминогруппы, (C1-C8)алкилсульфониламиногруппы, фенилсульфониламиногруппы,формила,(C1-C8)алкилкарбонила,фенилкарбонила,(C3-C8)циклоалкилкарбонила,(C1-C8)алкил-сульфонила,фенилсульфонила,аминосульфонила,(C1-C8)алкиламиносульфонила,ди(C1-C8)алкиламиносульфонила, фениламиносульфонила, фенилтиогруппы, (C1-C8)алкилтиогруппы,фосфоната и (C1-C8)алкилфосфоната; где гетероарильное кольцо, необязательно дополнительно конденсированное или связанное с аро-4 019722 матическим карбоциклическим или гетероциклическим кольцом, является имидазолилом или тиенилом. Что касается термина "атом галогена", авторы подразумевают атом фтора, хлора, брома или йода. Что касается термина "цианогруппа", авторы подразумевают остаток -CN. Что касается термина "нитрогруппа", авторы подразумевают группу -NO2. Что касается термина "полифторированный алкил" или "полифторированная алкоксигруппа", авторы подразумевают любую из указанных выше неразветвленных или разветвленных C1-C8-алкильных или алкоксигрупп, которые замещены более чем одним атомом фтора, таким как, например, трифторметил,трифторэтил, 1,1,1,3,3,3-гексафторпропил, трифторметоксигруппа и т.п. Что касается термина "гидроксиалкил", авторы подразумевают любую из указанных вышеC1-C8-алкильных групп, несущую гидроксильную группу, такую как, например, гидроксиметил,2-гидроксиэтил, 3-гидроксипропил и т.п. На основании вышесказанного специалисту будет понятно, что любую группу, название которой является составным, такую как, например, ариламиногруппа, необходимо рассматривать, как это делают традиционно, исходя из частей, из которых она происходит, например, как аминогруппу, которая дополнительно замещена арилом, при этом арил имеет значение, которое определено выше. Подобным образом любой из терминов, такой как, например, "алкилтиогруппа", "алкиламиногруппа", "диалкиламиногруппа", "алкоксикарбонил", "алкоксикарбониламиногруппа", "гетероциклилкарбонил", "гетероциклилкарбониламиногруппа", "циклоалкилоксикарбонил" и т.п. включают группы, в которых остатки алкила, алкокси-, арила, C3-C8-циклоалкила и гетероциклила имеют значения, которые определены выше. Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли неорганических или органических кислот, например азотной, хлористо-водородной, бромистоводородной, серной, хлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой, молочной, щавелевой, фумаровой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетионовой и салициловой кислот. Фармацевтически приемлемые соли соединений формулы (I) также включают соли неорганических или органических оснований, например щелочных или щелочно-земельных металлов, особенно гидроксидов натрия, калия, кальция, аммония или магния, карбонатов или бикарбонатов, нециклических или циклических аминов, предпочтительно метиламин, этиламин, диэтиламин, триэтиламин, пиперидин и т.п. Предпочтительным классом соединений формулы (I) являются соединения, в которых m означает целое число от 0 до 2. Другим предпочтительным классом соединений формулы (I) являются соединения, в которых А означает -CON(Y), -N(Y)CO-, -N(Y)SO2-, -N(Y)CON(Y)- или -C(R'R")N(Y)CO, где Y и R' и R" имеют значения, которые определены выше. Дополнительным предпочтительным классом соединений формулы (I) являются соединения, в которых R1 означает водород, трихлорметил, трифторметил, галоген, цианогруппу, ОН, OR8, NR9R10,CONR12R13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного(C1-C8)алкила, (C2-C8)алкенила или (C2-C8)алкинила, (C3-C8)циклоалкила, (C3-C8)циклоалкенила, гетероциклила, арила и гетероарила, где R8, R9, R10, R12 и R13 имеют значения, которые определены выше. Особенно предпочтительным классом соединений формулы (I) являются соединения, в которых R1 означает водород, трихлорметил, трифторметил, галоген и цианогруппу. Другим дополнительным предпочтительным классом соединений формулы (I) являются соединения, в которых R2 означает водород или NR14R15, где R14 и R15 независимо означают водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила,(C3-C8)циклоалкила, гетероциклила, арила и гетероарила. Другим дополнительным предпочтительным классом соединений формулы (I) являются соединения, в которых R7 означает необязательно замещенную группу, выбранную из неразветвленного или разветвленного (C1-C8)алкила, (С 3-С 8)циклоалкила, (C3-C8)циклоалкенила, гетероциклила, арила и гетероарила. Предпочтительными конкретными соединениями формулы (I) являются соединения, выбранные из: 1-[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,2,5-дифтор-N-[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]бензолсульфонамида,N-(4-хлорфенил)-3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)бензамида,N-(4-трет-бутилфенил)-3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)бензамида,1-(4-хлор-3-трифторметилфенил)-3-3-[1-(2-фторэтил)-4-пиридин-4-ил-1 Н-пиразол-3 ил]фенилмочевины,[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]амид фуран-2-сульфоновой кислоты,[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]амид тиофен-3-сульфоновой кислоты,1-[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]-3-п-толилмочевины,1-(4-хлорфенил)-3-[3-(4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]мочевины,1-[3-(1-этил-4-пиридин-4-ил-1 Н-пиразол-3-ил)фенил]-3-(4-трифторметилфенил)мочевины,-5 019722N-3-[4-(2-аминопиридин-4-ил)-1-этил-1 Н-пиразол-3-ил]-2,4-дифторфенил-2,5 дифторбензолсульфонамида. Способ получения соединения формулы (I), которое определено выше, использует реакции и схемы синтеза, описанные ниже, с применением методик, доступных в данной области, и легкодоступных исходных веществ. Получение некоторых вариантов осуществления настоящего изобретения описано в примерах, которые приведены ниже, но специалистам в данной области будет понятно, что описанное получение может быть легко адаптировано для получения других вариантов настоящего изобретения. Например, синтез не приведенных в качестве примеров соединений согласно изобретению может быть осуществлен с использованием модификаций, очевидных для специалистов в данной области, например с использованием соответствующей защиты интерферирующих групп, благодаря замене на другие подходящие реагенты, известные в данной области, или путем осуществления обычных модификаций условий реакции. Альтернативно, будет понятно, что другие реакции, указанные в настоящем описании или известные в данной области, применимы для получения других соединений согласно изобретению. На приведенной схеме 1 показано получение соединения формулы (I). где G означает подходящий предшественник групп A-R7, определенных выше, такой как необязательно защищенная аминогруппа, нитрогруппа, галоген, цианогруппа или подходящий эфир карбоновой кислоты; и X, m, R1, R2, R3, R4, R5, R6 и R7 имеют значения, которые определены выше. Промежуточное соединение формулы (II) получают согласно способам А, В, С и D, описанным ниже. Соединение формулы (II) необязательно может быть превращено в другое соединение формулы (II) согласно любым способам Е и F, описанным ниже. Соединение формулы (I) получают, следуя одному из способов синтеза, описанных ниже при описании способов G, H, I, J и М. Соединение формулы (I) необязательно может быть превращено в другое соединение формулы (I) согласно любому из способов K и L, описанных ниже. Всем специалистам в данной области будет понятно, что при любом превращении, осуществляемом согласно указанным способам, могут требоваться стандартные модификации, такие как, например, защита мешающих групп, замена на другие подходящие реагенты, известные в данной области, или осуществление обычных модификаций условий реакции. Способ А. На указанной выше схемеJ означает кислород или группу -N(СН 3)О-;PG1 означает защитную группу, такую как силильные или ацильные производные или тетрагидропиранил;Alk означает C1-С 6-алкил; Е означает водород или алкоксикарбонил;L означает ОН или группу, которая может работать как удаляемая группа, такую как атом галогена,тозилат, мезилат или трифлат. В способе синтеза в случае получения соединения формулы (II), который описан как способ А, на стадии "а" соединение формулы 1 подвергают взаимодействию с диалкилфосфитом с получением гидроксиалкилфосфоната формулы 2. На стадиях "b" и "с" защита спиртовой функциональной группы с последующей реакцией Виттига с использованием подходящего 4-пиридилили 4-пиримидинилкарбоксальдегида формулы 4 дает соединение формулы 5, которое на стадии "d" легко гидролизуют, получая кетон, представленный формулой 6. На стадии "е" последний может быть получен альтернативно, исходя из соединения формулы 7, которое превращают в соответствующий металлоанион и подвергают взаимодействию с ароматическим алкилкарбоксилатом или амидом Вейнреба формулы 8. На стадии "f" превращение соединения формулы 6 в пиразолы осуществляют посредством образования производного енаминона формулы 9 с последующим осуществлением стадии "g" и "g1" путем конденсации с подходящим гидразином, получая соединение формулы (II). При использовании замещенного гидразина последняя реакция дает смесь региоизомеров, из которой требуемый изомер очищают известными способами, такими как хроматография на силикагеле или препаративная ВЭЖХ. В случае использования гидразина получают N-незамещенный пиразол формулы (II) способа А (m равно 0 и R1 означает водород). В последнем случае на стадии "h" введение группы -(CH2)mR1 для образования соединения формулы (II) осуществляют посредством N-алкилирования подходящим алкилирующим реагентом L-(CH2)mR1,где L означает группу, которая при активации необязательно может работать как удаляемая группа. Последняя реакция может давать смесь региоизомеров, из которой требуемый изомер очищают известными способами, такими как хроматография на силикагеле или препаративная ВЭЖХ. Согласно стадии "а" способа А конденсация между ароматическим альдегидом формулы 1 и диалкилфосфитом может быть осуществлена различными путями согласно обычным способам. Предпочтительно конденсацию осуществляют в присутствии основания, такого как триэтиламин (TEA) 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), диизопропиламид лития (LDA), метоксид натрия или т.п.,предпочтительно в растворителе, таком как, например, этилацетат, дихлорметан, толуол, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, ацетонитрил, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "b" способа А защита функциональной группы спирта может быть осуществлена различными путями согласно обычным способам, которые могут быть легко понятны всем специалистам в данной области. Например, такая спиртовая группа может быть защищена в виде силильных производных обработкой подходящим силилирующим реагентом, таким как любой алкилсилилгалогенид или азид в присутствии основания, такого как, например, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), или обработкой 1,1,1,3,3,3-гексаметилдисилазаном в присутствии субмолярных количеств йода или подходящей кислоты, такой как, например, серная кислота. Такие реакции могут быть осуществлены с использованием различных растворителей, таких как дихлорметан, толуол, тетрагидрофуран, 1,4-диоксан,1,2-диметоксиэтан, ацетонитрил, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. И также указанная защита может быть осуществлена ацилированием с использованием обработки подходящим ацилирующим реагентом, таким как хлорангидрид или ангидрид, в присутствии основания, с использованием различных растворителей, таких как дихлорметан, толуол, тетрагидрофуран, 1,4-диоксан,1,2-диметоксиэтан, N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Более предпочтительно такая защита может быть осуществлена с использованием 3,4-дигидро-2 Н-пирана в присутствии подходящего кислотного катализатора, такого как, например, п-толуолсульфоновая кислота (PTSA), с использованием таких растворителей, как толуол,тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "с" способа А взаимодействие соединения формулы 3 с соединением формулы 4 можно осуществить в присутствии подходящего основания, такого как, например, метоксид натрия,этоксид натрия, гидрид натрия, диизопропиламид лития или триэтиламин, в различных растворителях,таких как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, толуол, дихлорметан или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "d" способа А превращение соединения формулы 5 в соединение формулы 6 может быть осуществлено различными путями, известными в данной области, в зависимости от природы самой защитной группы. Например, когда защитной группой, введенной на стадии "b" способа А, является тетрагидропиранил, превращение осуществляют, используя любой гидролитический способ, известный в литературе, например, используя водный раствор хлористо-водородной кислоты в подходящем сорастворителе, например, метаноле, этаноле, тетрагидрофуране, ацетонитриле или тому подобном, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. В том случае, когда такой защитной группой является, например, силильная группа, удаление защиты может быть осуществлено с использованием сильных кислот, подобных трифторуксусной кислоте, хлорной кислоте, хлористо-водородной кислоте, фтористо-водородной кислоте, а также фторида тетрабутиламмония и его производных, в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, ацетонитрил,дихлорметан или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. В том случае, когда такой защитной группой является, например, ацильная группа, удаление защиты может быть осуществлено с использованием водного раствора щелочи, такой как NaOH, KOH, LiOH или т.п., необязательно в присутствии подходящего растворителя, такого как этанол, метанол, тетрагидрофуран или т.п. Согласно стадии "е" способа А соединение формулы 7 превращают в соединение формулы 6 в результате взаимодействия с сильным основанием, таким как гексаметилдисилазан натрия (NaHMDS), гексаметилдисилазан лития (LiHMDS), диизопропиламид лития (LDA), реактив Гриньяра и т.п., с последующей конденсацией с ароматическим алкилкарбоксилатом или амидом Вейнреба формулы 8. Указанную реакцию обычно осуществляют, используя различные растворители, такие как толуол,N,N-диметилформамид, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "f" способа А синтез производного енаминона формулы 9 осуществляют, используя диалкилацетальN,N-диметилформамида, ди-трет-бутилацеталь N,N-диметилформамида и т.п., в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, ацетонитрил, N,N-диметилформамид,N,N-диметилацетамид или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "g" способа А превращение соединения формулы 9 в соединение формулы (II) осуществляют, используя производное гидразина формулы NH2NH-(CH2)mR1 в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, ацетонитрил, уксусная кислота, N,N-диметилформамид или их смеси, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. В том случае, когда используют гидразин (m равно 0 и R1 означает водород), реакция протекает согласно стадии "g1" способа А, давая N-незамещенный пиразол формулы (II) способа А. Согласно стадии "h" способа А превращение указанного N-незамещенного пиразола формулы (II) способа А в другое соединение формулы (II) может быть осуществлено с использованием соединения формулы L-(CH2)mR1, где L означает ОН, и в таком случае можно использовать условия реакции Мицунобу, или L означает группу, которая необязательно при активации может работать как удаляемая группа, такую как атом галоген, тозилат, мезилат или трифлат. В первом случае, когда используют протокол Мицунобу, реакция может быть осуществлена с использованием диалкилазодикарбоксилата, такого как диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) или т.п., в присутствии триалкил- или триарилфосфина, предпочтительно трифенилфосфина, в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан,ацетонитрил. Когда L означает атом галогена или такую группу, как тозилат, мезилат или трифлат или т.п., превращение может быть осуществлено с использованием подходящего основания, такого как, например, NaH, K2CO3, Cs2CO3, NaOH, DBU, LiHMDS и т.п., в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, изопропанол, ацетонитрил, уксусная кислота, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.п. Указанные реакции могут быть осуществлены при температурах в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. При необходимости соединения формулы (II) могут быть отделены и очищены хроматографией на силикагеле или препаративной ВЭЖХ. Способ В. На приведенной выше схемеL' означает группу, которая может работать как удаляемая группа, такая как атом галогена, тозилат,мезилат или трифлат;PG2 означает защитную группу, такую как п-метоксибензил, тетрагидропиранил, тритильное или силильное производное, такое как триметилсилилэтоксиметил (SEM) и 2-триметилсилилэтансульфонил(SES); и М означает В(ОН)2, B(Oalk)2, Sn(Alk)3, Al(Alk)2, ZnHal, MgHal или ZrCp2Hal. В другом способе синтеза при получении соединения формулы (II), который описан как способ В,на стадии "а" производное 4-пиколина или 4-метилпиримидина формулы 11 подвергают взаимодействию с фосфорилтрихлоридом в условиях реакции Вильсмейера с образованием производного малонового альдегида, который подвергают конденсации с гидроксиламином с образованием соединения изоксазола формулы 12. На стадии "b" раскрытие цикла производного изоксазола дает соединение формулы 13, затем на стадии "с" конденсация с гидразином дает производное пиразола формулы 14. На стадии "d" используют реакцию Зандмейера, чтобы превратить соединение формулы 14 в производное йодпиразола формулы 15. На стадии "е" защита атома азота пиразола в соединении формулы 15 подходящей защитной группой, такой как, например, п-метоксибензил, тетрагидропиранил или тритил, дает промежуточный продукт формулы 16. На стадии "f" последний может быть превращен в соединение формулы 18 с использованием любой из реакций кросс-сочетания, подходящих для образования углерод-углеродных связей. Указанные реакции, которые хорошо известны в данной области, подразумевают сочетание с подходящим металлоорганическим реагентом, таким как, например, борорганическое, оловоорганическое, цинкорганическое, алюминийорганическое или цирконийорганическое соединение и т.п. Альтернативно, на стадии "g" соединение формулы 16 превращают в металлоорганическое производное, такое как борпиразолопроизводное, которое, в свою очередь, на стадии "h" подвергают кросс-сочетанию с подходящим электрофилом, таким как соединение арилгалогенида формулы 20, с образованием соединения формулы 18. Затем на стадии "i" удаляют защиту соединения формулы 18, получая соединение формулы(II) осуществляют посредством N-алкилирования подходящим алкилирующим реагентом L-(CH2)mR1. Последняя реакция может давать смесь региоизомеров, из которой требуемый изомер очищают известными способами, такими как хроматография на силикагеле или препаративная ВЭЖХ. Согласно стадии "а" способа В соединение формулы 11 подвергают взаимодействию с реагентом Вильсмейера, который может быть получен согласно способам, хорошо известным специалистам в данной области, в условиях, таких как условия, описанные Arnold (Arnold, Z. Coll. Czech. Chem. Commun.,1963, 28, 863). Конденсацию производного малонового альдегида с гидроксиламином осуществляют,используя такой растворитель, как этанол, тетрагидрофуран или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "b" способа В раскрытие цикла изоксазола формулы 12 осуществляют, используя водный раствор щелочи, такой как NaOH, KOH, LiOH или т.п., необязательно в присутствии подходящего растворителя, такого как этанол, метанол, тетрагидрофуран или т.п. Согласно стадии "с" способа В превращение соединения формулы 13 в соединение формулы 14 осуществляют, используя гидразин, в подходящем растворителе, таком как тетрагидрофуран,1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, ацетонитрил, уксусная кислота, N,N-диметилформамид или их смеси, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "d" способа В превращение соединения формулы 14 в соединение формулы 15 осуществляют, получая соль диазония, что можно сделать, используя нитрит натрия в воде или водных растворителях в присутствии неорганической кислоты, такой как хлористо-водородная кислота, серная кислота и т.п., после обработки йодидной солью, такой как KI, NaI, CsI, CuI, необязательно в присутствии йода. Альтернативно, соль диазония может быть получена с использованием изоамилнитрита в подходящем растворителе, таком как дихлорметан, диметоксиэтан, тетрагидрофуран и т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "е" способа В защита производного йодпиразола формулы 15 может быть осуществлена несколькими путями, которые хорошо известны специалистам в данной области, в зависимости от природы таких защитных групп. Например, защита может быть осуществлена с использованием пметоксибензилбромида в таких растворителях, как N,N-диметилформамид, в присутствии подходящего основания, такого как Cs2CO3, K2CO3 или т.п., при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. В качестве альтернативы защита может быть осуществлена с использованием дигидропирана в таких растворителях, как дихлорметан, тетрагидрофуран или т.п., в присутствии подходящего катализатора,- 10019722 такого как, например, п-толуолсульфоновая кислота (PTSA), при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Еще в следующем контексте указанная защита может быть осуществлена с использованием тритилхлорида в таких растворителях, как толуол, дихлорметан, тетрагидрофуран или т.п., в присутствии основания, такого как триэтиламин, DBU или т.п. И снова, когда такая защитная группа представлена группой SEM или SES, защита может быть осуществлена с использованием подходящего силилирующего реагента, такого как SEM-галогенид или SES-галогенид, в присутствии основания, такого как, например, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Такие реакции могут быть осуществлены с использованием различных растворителей, таких как дихлорметан, толуол, тетрагидрофуран,1,4-диоксан, 1,2-диметоксиэтан, ацетонитрил при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "f" способа В промежуточный продукт формулы 16 подвергают кросс-сочетанию с подходящим металлоорганическим соединением, таким как, например, борорганическое (реакция Сузуки), оловоорганическое (реакция Стилла), цинкорганическое, алюминийорганическое или цирконийорганическое соединение (реакция Негиши) и т.п. Указанные реакции хорошо известны специалистам в данной области. Предпочтительной реакцией является реакция Сузуки, в которой используют подходящий арил- или гетероарилборонат в присутствии основанного на палладии катализатора, такого как, например, тетракис-трифенилфосфин палладия, и подходящего основания, такого как Cs2CO3, K2CO3,Rb2CO3, NaOH, CsF и т.п. Согласно стадии "g" способа В соединение формулы 18 также может быть получено в результате превращения соединения формулы 16 в подходящее металлоорганическое производное, такое как борорганическое производное, оловоорганическое производное или т.п. Предпочтительными металлоорганическими соединениями являются борорганические соединения, которые могут быть получены, например,в результате взаимодействия соединения формулы 16 с подходящим соединением бора, таким как бис(пинаколато)дибор, пинаколборан или т.п., в присутствии подходящего палладиевого катализатора, такого как ацетат палладия, PdCl2(dppf), и подходящего основания, такого как KOAc, триэтиламин и т.п., в таких растворителях, как N,N-диметилформамид, диметилсульфоксид, диметоксиэтан, диоксан, тетрагидрофуран или т.п., при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "h" способа В металлоорганическое производное подвергают взаимодействию с подходящим электрофилом формулы 20, таким как арилгалогенид или трифторметансульфонат (трифлат), метансульфонат (мезилат) или п-толуолсульфонат (тозилат), в присутствии основанного на палладии или никеле катализатора, такого как, например, тетракис-трифенилфосфин палладия, и подходящего основания, такого как Cs2CO3, K2CO3, Rb2CO3, NaOH, CsF и т.п., получая соединение формулы 18. Согласно стадии "i" способов В удаление защитной группы PG2 может быть осуществлено несколькими путями, в зависимости от природы указанной защитной группы. Например, когда PG2 представляет собой группу тетрагидропиранила, превращение соединения формулы 18 в соединение формулы (II) способа А может быть осуществлено с использованием хлористо-водородной кислоты в метаноле или этаноле. Когда указанная защитная группа представляет собой, например, п-метоксибензил или тритил,превращение соединения формулы 18 в соединение формулы (II) А может быть осуществлено с использованием сильных кислот, таких как, например, трифторуксусная кислота, в подходящем сорастворителе,таком как дихлорметан, при температуре в диапазоне от 20C до температуры кипения с обратным холодильником или выше, при условии, что реакцию осуществляют в герметично закрытой пробирке, нагревая, например, в микроволновой печи, в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "j" способа В превращение соединений формулы (II) способа А в другое соединение формулы (II) осуществляют, как описано для стадии "h" способа А. На приведенной выше схемеPG3 означает защитную группу, направляющую в орто-положение, такую как тетрагидропиранил,триметилсилилэтоксиметил (SEM), метоксиэтоксиметил (MEM) или бензилоксиметил (ВОМ). В следующем способе синтеза при получении соединения формулы (II), который описан как способ С, на стадии "а" ароматический кетон формулы 10 подвергают конденсации с диалкилацеталемN,N-диметилформамида с образованием производного енаминона формулы 22, который на стадиях "b" и"е" подвергают конденсации с подходящим гидразином с образованием соединения пиразола. При использовании замещенного гидразина последняя реакция может давать смесь региоизомеров, из которой соединение формулы 24 может быть отделено и очищено хроматографией на силикагеле или препаративной ВЭЖХ. Когда используют гидразин (m равно 0 и R1 означает водород), получаютN-незамещенный пиразол формулы 23. В последнем случае на стадии "g" введение группы -(CH2)mR1 с образованием соединения формулы 24 осуществляют посредством N-алкилирования с использованием подходящего алкилирующего реагента формулы L-(CH2)mR1. Затем на стадиях "с" и "f" пиразолы формулы 23 и 24 соответственно превращают в галогенированные соединения формулы 25 и 26 соответственно в результате взаимодействия с N-галогенсукцинимидом, например N-йодсукцинимидом. Альтернативно, соединение общей формулы 25 может быть получено, исходя из металлоорганического реагента формулы 21, такого как борпиразолопроизводное, которое на стадии "q" подвергают кросс-сочетанию с подходящим электрофилом, таким как гетероарилгалогенид формулы 35, с образованием соединения формулы 36, которое на стадии "r" подвергают галогенированию с образованием соединения формулы 37. Последнее на стадии "s" подвергают обработке для удаления защиты, получая соединение общей формулы 25. На стадии "d" соединение формулы 25 превращают в соединение формулы 26 посредствомN-алкилирования подходящим алкилирующим реагентом формулы L-(CH2)mR1 аналогично стадии "g". Соединение формулы 26 представляет собой ключевой промежуточный продукт, который может быть превращен в соединение формулы (II) с использованием нескольких путей синтеза. Например, на стадии "h" соединение формулы 26 превращают непосредственно в соединение формулы (II), используя любую из реакций кросс-сочетания, подходящую для образования углеродуглеродных связей. В указанных реакциях, которые хорошо известны в данной области, предполагается сочетание с подходящим металлоорганическим реагентом, таким как, например, борорганическое соединение (реакция Сузуки). Альтернативно, на стадии "о" соединение формулы 26 превращают в металлоорганическое производное, такое как борпиразолопроизводное, которое на стадии "р" подвергают кросс-сочетанию с подходящим электрофилом, таким как гетероарилгалогенид формулы 29, с образованием соединения формулы Альтернативно, на стадии "k" соединение формулы 26 подвергают кросс-сочетанию с подходящим еноловым эфиром, получая соединение формулы 32, посредством двухступенчатой последовательности реакций, включающей кросс-сочетание с подходящим металлоорганическим производным енолового эфира с последующим гидролизом промежуточного енолового эфира. Альтернативно, на стадии "i" соединение формулы 26 подвергают реакции Соногашира с триметилсилилацетиленом с образованием промежуточного продукта формулы 30. На стадии "j" десилилирование последнего с последующей гидратацией промежуточного алкина, которую осуществляют на стадии "l",дает соединение формулы 32. На стадии "m" превращение соединения формулы 32 в соединение формулы (II) осуществляют посредством образования производного енаминона формулы 33, которое на стадии"n" подвергают конденсации с подходящим производным гуанидина или производнымS-алкилизотиомочевины, получая соединение формулы (II), где X означает атом азота. Согласно стадии "а" способа С синтез производного енаминона формулы 22 осуществляют, как описано для стадии "f" способа А. Согласно стадии "е" способа С превращение соединения формулы 22 в соединение формулы 24 осуществляют, как описано для стадии "g" способа А. Согласно стадии "b" способа С, на которой используют гидразин (m равно 0 и R1 означает водород),получают N-незамещенный пиразол формулы 23. Реакцию проводят, как описано для стадии "g1" способа А. Согласно стадиям "d" и "g" способа С превращение соединения формулы 23 или 25 в другое соединение формулы 24 или 26 соответственно осуществляют, как описано для стадии "h" способа А. Согласно стадиям "с" и "f" способа С превращение соединения формулы 23 или 24 в соединение формулы 25 или 26 соответственно может быть осуществлено с использованием ряда галогенирующих реагентов. Предпочтительным является йодирование, которое может быть осуществлено с использованием йода, монохлорида йода или N-йодсукцинимида. Взаимодействие с йодом осуществляют, например, используя такие растворители, как ацетонитрил, толуол, дихлорметан или вода и т.п., необязательно в присутствии KI или основания, такого как триэтиламин, K2CO3, NaOH и т.п., при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Взаимодействие с монохлоридом йода осуществляют, используя такие растворители, как уксусная кислота, дихлорметан или т.п., при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Предпочтительно указанную реакцию осуществляют, используя N-йодсукцинимид, в таких растворителях, как N,N-диметилформамид или N,N-диметилацетамид, при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "q" способа С металлоорганический реагент формулы 21 подвергают сочетанию с подходящим электрофилом, как описано для стадии "h" способа В. Согласно стадии "r" способа С защищенный арилпиразол формулы 36 превращают в галогенированное производное формулы 37, как описано для стадий "с" и "f" способа С. Согласно стадии "s" способа С удаление защитной группы PG3 может быть осуществлено несколькими путями, в зависимости от природы указанной защитной группы. Например, когда PG3 означает группу тетрагидропиранила, группу триметилсилилэтоксиметила (SEM) или метоксиэтоксиметил(MEM), превращение соединения формулы 37 в соединение формулы 25 может быть осуществлено с использованием хлористо-водородной кислоты в метаноле или этаноле. Когда PG3 означает группу бензилоксиметила, удаление защиты также может быть достигнуто при каталитическом гидрировании. Согласно стадии "h" способа С промежуточный продукт формулы 26 может быть подвергнут кросссочетанию с подходящим металлоорганическим соединением, таким как, например, борорганическое соединение (реакция Сузуки), оловоорганическое соединение (реакция Стилла), цинкорганическое, алюминийорганическое или цирконийорганическое соединение (реакция Негиши) и т.п. Указанные реакции,хорошо известные специалистам в данной области, осуществляют, как описано для стадии "f" способа В. Согласно стадии "о" способа С соединение формулы (II) альтернативно можно получить в результате превращения соединения формулы 26 в подходящее металлоорганическое производное, такое как борорганическое, оловоорганическое или т.п. производное, как описано для стадии "g" способа В. Согласно стадии "р" способа С указанное металлоорганическое производное подвергают взаимодействию с подходящим электрофилом, как описано для стадии "h" способа В. Согласно стадии "k" способа С соединение формулы 26 подвергают кросс-сочетанию с подходящим металлоорганическим производным енолового эфира, таким как 1-этоксивинилтри-н-бутилолово, с последующим гидролизом промежуточного енолового эфира. Согласно стадии "i" способа С соединение формулы 26 подвергают взаимодействию с триметилсилилацетиленом в присутствии подходящего палладиевого катализатора, такого как PdCl2(PPh3)2,Pd(PPh3)4 и т.п., и подходящего медного катализатора, такого как CuI. Указанную реакцию осуществляют в присутствии подходящего основания, такого как триэтиламин, диэтиламин, диизопропиламин и т.п.,- 13019722 необязательно в присутствии фосфинового лиганда, такого как трифенилфосфин. Реакцию обычно осуществляют при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "j" способа С группу триметилсилила удаляют, используя основание, такое какKOH, NaOH, K2CO3, в растворителе, таком как метанол, этанол или т.п., или используя подходящую фторидную соль, такую как KF, н-Bu4NF, в таких растворителях, как тетрагидрофуран, диметоксиэтан,N,N-диметилформамид или т.п. Согласно стадии "l" способа С гидратацию алкина формулы 31 с получением соединения формулы 32 осуществляют, используя, например, уксусную кислоту, трифторуксусную кислоту, трифторметансульфоновую кислоту, Hg(OTf)2, NaHSO3 и т.п., в подходящем водном растворителе, таком как ацетонитрил, диоксан, этанол или т.п. Согласно стадии "m" способа С синтез производного енаминона формулы 33 осуществляют, как описано для стадии "f" способа А. Согласно стадии "n" способа С конденсацию соединения формулы 33 с соединением формулы 34 с образованием соединения формулы (II) осуществляют, используя такие растворители, какN,N-диметилформамид, N,N-диметилацетамид, вода, тетрагидрофуран, диоксан, диметоксиэтан, ацетонитрил, этанол, изопропанол или их смесь, необязательно в присутствии подходящего основания, такого как этоксид натрия, метоксид натрия, K2CO3, NaOH, DBU или т.п., при температурах в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Способ D. На приведенной выше схеме m, R1, R2, R3, R4, R5, R6, G, L и Hal имеют значения, которые определены выше. В следующем способе синтеза при получении соединения формулы (II), который описан в способеD, на стадии "а" подходящий гетероарилгалогенид формулы 29 подвергают реакции Соногашира в присутствии подходящего арилалкина формулы 38 с образованием соединения формулы 39. На стадии "b" последнее соединение подвергают взаимодействию с производным диазоалкана, таким как триметилсилилдиазометан, с образованием соединения формулы (II) способа А. На стадии "с" введение группы (CH2)mR1 с образованием соединения формулы (II) осуществляют посредством N-алкилирования подходящим алкилирующим реагентом формулы L-(CH2)mR1. Последняя реакция может давать смесь региоизомеров, из которой требуемый изомер очищают известными способами, такими как хроматография на силикагеле или препаративная ВЭЖХ. Согласно стадии "а" способа D соединение формулы 29 подвергают сочетанию с алкином формулы 38 с помощью реакции Соногашира в присутствии подходящего палладиевого катализатора, такого какPdCl2(PPh3)2, Pd(PPh3)4 и т.п., и подходящего медного катализатора, такого как CuI. Указанную реакцию осуществляют в присутствии подходящего основания, такого как триэтиламин, диэтиламин, диизопропилэтиламин и т.п., необязательно в присутствии фосфинового лиганда, такого как трифенилфосфин. Реакцию обычно проводят при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "b" способа D взаимодействие соединения формулы 39 с триметилсилилдиазометаном осуществляют в таких растворителях, как дихлорметан, диэтиловый эфир, тетрагидрофуран, ацетонитрил, толуол или т.п., при температурах в диапазоне от -20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Водная обработка необязательно в присутствии кислоты, такой как, например, хлористо-водородная кислота, дает соединение формулы (II) способа А. Согласно стадии "с" способа D соединение формулы (II) А превращают в другое соединение формулы (II) в результате взаимодействия с соединением формулы L-(CH2)mR1, как описано для стадии "h" способа А. Соединения формулы (II), полученные согласно способам А-D, могут быть далее превращены в другое соединение формулы (II), способами, хорошо известными специалистам в данной области. Например, в случае соединения формулы (II)В (способа B), т.е. соединения формулы (II), в которомX означает группу СН и R2 означает водород, или соединения формулы (II)K, т.е. соединения формулы(II), в котором X означает группу СН и R2 означает галоген, указанное соединение может быть далее превращено в другое соединение формулы (II)С, (II)D, (II)Е и (II)F, где R2 соответственно означает На приведенной выше схеме m, R1, R3, R4, R5, R6, G, R14, R15, R16 и Hal имеют значения, которые определены выше. В способе синтеза для получения соединения формулы (II)С, (II)D, (II)Е и (II)F, который описан в способе Е, на стадии "а" атом азота пиридина в соединении формулы (II)В окисляют с образованиемN-оксидного производного формулы 40. На стадии "b" и "с" соответственно взаимодействие последнего с подходящим электрофильным агентом, таким как толуолсульфоновый ангидрид, в присутствии или с последующей обработкой подходящим нуклеофилом, таким как вторичный (NHR14R15) или первичный(NH2R14) амин, дает соединение формулы (II)С и (II)D соответственно. Альтернативно, на стадии "b1" и"c1" соответственно соединение формулы (II)K подвергают взаимодействию с подходящим нуклеофилом, таким как вторичный (NHR14R15) или первичный (NH2R14) амин, получая соединение формулы (II)С и (II)D соответственно. Необязательно на стадии "d", когда R14 представлен трет-бутильной группой,бензильной группой или т.п., указанные группы могут быть удалены, например, обработкой кислотой или в восстанавливающих условиях с получением соединения формулы (II)Е. На стадии "е" последнее необязательно может быть ацилировано с использованием подходящего электрофила, такого как ацилгалогенид, с образованием соединения формулы (II)F. Согласно стадии "а" способа Е окисление атома азота пиридина осуществляют с использованием окислителей, хорошо известных специалистам в данной области, таких как, например, пероксид водорода, в таком растворителе, как уксусная кислота или м-хлорпербензойная кислота, в таких растворителях,как дихлорметан, ацетон, тетрагидрофуран или т.п., при температурах в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "b" и "с" способа Е превращение соединения формулы 40 в соединение формулы(II)С и (II)D осуществляют путем активации пиридин-N-оксида и его взаимодействия со вторичным или первичным амином. Активацию обычно осуществляют, используя подходящий электрофильный реагент,такой как оксалилхлорид, трифторметансульфонилхлорид, тозилхлорид, фосфорилхлорид (POCl3), бензоилхлорид, уксусный ангидрид, толуолсульфоновый ангидрид и т.п., в таком растворителе, как дихлорметан, тетрагидрофуран, ацетонитрил, толуол, трифторметил, бензол и т.п. Предпочтительно применение толуолсульфонового ангидрида в трифторметилбензоле. Реакцию обычно осуществляют в присутствии вторичного или первичного амина, и такая реакция может быть осуществлена при температурах в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадиям "b1" и "c1" способа Е превращение соединения формулы (II)K в соединение формулы (II)С и (II)D осуществляют в результате его взаимодействия со вторичным или первичным амином в таких растворителях, как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, дихлорметан, тетрагидрофуран, диоксан, этанол и т.п., необязательно в присутствии подходящего основания, такого как, например, K2CO3, NaOH, триэтиламин, при температурах в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "d" способа Е, когда на стадии b был использован первичный амин, такой как третбутиламин или бензиламин, алкильный остаток такого амина может быть удален. Реакцию обычно осуществляют с использованием сильных кислот, таких как трифторуксусная кислота, необязательно в при- 15019722 сутствии подходящего сорастворителя, такого как дихлорметан, при температурах в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Альтернативно, указанную реакцию осуществляют, используя восстанавливающие условия, например Н 2, в присутствии подходящего катализатора гидрирования. Катализатором гидрирования обычно является металл, наиболее часто палладий, который можно использовать как таковой или на угольной подложке, в подходящем растворителе, таком как, например, тетрагидрофуран, 1,4-диоксан,N,N-диметилформамид, метанол, этилацетат или их смесь. Согласно стадии "е" способа Е соединения формулы (II)Е превращают в карбоксамид формулы(II)F. Специалисту понятно, что такая реакция может быть осуществлена различными путями и в разных рабочих условиях, которые широко известны в данной области для получения карбоксамидов. В качестве примера, соединение формулы (II)Е ацилируют с использованием соединения формулы R16COHal, гдеHal означает галоген, такой как хлорид; реакцию осуществляют в подходящем растворителе, таком как,например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид, в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, DBU и т.п., при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение подходящего периода времени, в частности от примерно 30 мин до примерно 96 ч. Соединение формулы (II), полученное согласно способам A-D, может быть далее превращено в другое соединение формулы (II) способами, хорошо известными специалистам в данной области. Например, в случае соединения формулы (II)G, т.е. соединения формулы (II), в котором X означает азот и R2 означает тиометил, или соединения формулы (II)L, т.е. соединения формулы (II), в котором X означает азот и R2 означает галоген, указанное соединение может быть далее превращено в другие соединения формулы (II)Н, (II)I и (II)J, в которых R2 соответственно означает NR14R15, NH2 или NHCOR16,согласно способу F, описанному ниже. Способ F. На приведенной выше схеме m, R1, R3, R4, R5, R6, G, R14, R15, R16 и Hal имеют значения, которые определены выше. В способе синтеза для получения соединения формулы (II)Н, (II)I и (II)J, который описан как способ F, на стадии "а" взаимодействие соединения формулы (II)G с окислителем дает сульфонилпроизводное формулы 41. На стадии "b" последнее обрабатывают подходящим нуклеофилом, таким как первичный или вторичный амин формулы NHR14R15, получая соединение формулы (II)Н. На стадии "с" сульфонилпроизводное формулы 41 обрабатывают хлоридом аммония с образованием соединения формулы(II)I. Альтернативно, на стадии "b1" и "c1" соединение формулы (II)L подвергают взаимодействию с подходящим нуклеофилом, таким как первичный или вторичный амин формулы (NHR14R15), или с хлоридом аммония, получая соединение формулы (II)Н и (II)I соответственно. Соединение формулы (II)I необязательно может быть ацилировано с использованием подходящего электрофила формулы R16COHal, гдеHal означает галогенид, такой как хлорид или т.п., с образованием соединения формулы (II)J. Согласно стадии "а" способа F окисление тиометильной группы осуществляют, используя окислители, хорошо известные специалистам в данной области, такие как, например, оксон, в подходящем растворителе, таком как тетрагидрофуран, диоксан, ацетон, необязательно в присутствии воды в качестве сорастворителя, или м-хлорпербензойной кислоты в таких растворителях, как дихлорметан, ацетон, тетрагидрофуран или т.п., при температурах в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "b" и "b1" способа F превращение соединения формулы 41 в соединение формулы(II)Н осуществляют, используя первичный или вторичный амин формулы R14R15NH в таких растворителях, как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, ди- 16019722 хлорметан, тетрагидрофуран, диоксан, этанол и т.п., необязательно в присутствии подходящего основания, такого как, например, K2CO3, NaOH, триэтиламин, при температурах в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "с" и "c1" способа F образование соединения (II)I из соединения формулы 41 осуществляют, используя раствор аммиака в подходящем растворителе, таком как дихлорметан, этанол и т.п., или соли аммония, такие как, например, ацетат аммония, в таких растворителях, какN,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид и т.п., при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Согласно стадии "d" способа F соединение формулы (II)I может быть превращено в карбоксамид формулы (II)J. Специалисту понятно, что такую реакцию можно осуществить различными путями и в разных рабочих условиях, которые широко известны в данной области для получения карбоксамидов. В качестве примера, соединение формулы (II)I ацилируют, используя соединение формулы R16COHal, гдеHal означает галоген, такой как хлорид; реакцию осуществляют, как описано для стадии "е" способа Е. Соединение формулы (I) может быть получено согласно любому из способов G, H, I, J и М, описанных ниже, при условии, что мешающие аминогруппы защищают введением подходящих защитных групп, как понятно специалистам в данной области. Согласно способу G, описанному ниже, исходя из соединения формулы (II)1, т.е. соединения формулы (II), в котором G означает нитрогруппу, или исходя из соединения формулы (II)2, т.е. соединения формулы (II), в котором G означает защищенную аминогруппу, получают соединение формулы (I)C,(I)D, (I)E (I)F, (I)G или (I)Н, где А соответственно означает NHSO2, NHCOO, NHCON(Y), NHCSNH,NHCO или SO2N(Y). Способ G. На приведенной выше схемеR7' означает R7, описанный выше, но не является водородом;W означает подходящую удаляемую группу, такую как гидроксигруппа или галоген;PG4 означает подходящую защитную группу аминоостатка, такую как бензил, бис-бензил,п-метоксибензил, тритил, фталоил, бензилоксикарбонил, п-нитробензилоксикарбонил и т.п. В способе синтеза для получения соединений формул (I)С-(I)Н, который описан в способе G, на стадии "а" соединение формулы (II)1 превращают в соединение формулы 42 восстановлением нитрогруппы до аминогруппы. На стадии "b" указанное соединение формулы 42 получают удалением подходящей защитной группы аминоостатка из соединения формулы (II)2. Затем на стадии "с", "d", "e", "g" и "h" указанное соединение формулы 42 подвергают взаимодействию с разными типами электрофила, получая соответственно соединение формулы (I)C, (I)D, (I)E, (I)F и(I)G. На стадии "f" соединение формулы (I)D превращают в соединение формулы (I)Е в результате взаимодействия с подходящим первичным или вторичным амином. На стадии "i" соединение формулы 42 подвергают реакции диазотирования в условиях Зандмейера с последующим взаимодействием с SO2 в присутствии хлористо-водородной кислоты и подходящего медного катализатора с образованием сульфонилхлорида формулы 44. На стадии "j" последнее соединение подвергают взаимодействию с подходящим первичным амином, получая соединение формулы (I)Н. Согласно стадии "а" способа G нитрогруппу соединения формулы (II)1 восстанавливают до аминогруппы, получая соединение формулы 42. Реакция может быть осуществлена различными путями и в разных рабочих условиях, которые широко известны в данной области для восстановления нитрогруппы до аминогруппы. Предпочтительно такую реакцию осуществляют в подходящем растворителе, таком как, например, вода, метанол, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, этилацетат или их смесь, в присутствии подходящего восстановителя, такого как, например, водород и катализатор гидрирования, или посредством обработки циклогексеном или циклогексадиеном и катализатором гидрирования, или посредством обработки хлоридом олова(II), или посредством обработки цинком или хлоридом цинка(II) и водным раствором хлористо-водородной кислоты или уксусной кислоты или хлорида аммония при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 1 до примерно 96 ч. Катализатором гидрирования обычно является металл, наиболее часто палладий, который можно использовать как таковой или на угольной подложке. Согласно стадии "b" способа G, когда PG4 означает защитную группу, такую как бензил(NHCH2Ph), бис-бензил (N(CH2Ph)2), п-метоксибензил, п-метоксифенил, тритил, бензилоксикарбонил или п-нитробензилоксикарбонильную группу, удаление защиты может быть осуществлено с использованием Н 2 в присутствии подходящего катализатора гидрирования. Катализатором гидрирования обычно является металл, наиболее часто палладий, или производное металла, такое как Pd(OH)2, который можно использовать как таковой или на угольной подложке, в подходящем растворителе, таком как, например,тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, метанол, этилацетат или их смесь. Альтернативно, указанное удаление защиты может быть осуществлено с использованием сильных кислот, таких как, например, серная кислота, хлористо-водородная кислота, трифторуксусная кислота,трифторметансульфоновая кислота или т.п., в присутствии подходящего растворителя, такого как толуол, ацетонитрил, дихлорметан или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 1 до примерно 96 ч. Кроме того, когда такой защитной группой является п-метоксифенильная группа, удаление защиты можно осуществлять также в окисляющих условиях, используя, например, нитрат церия-аммония (CAN), в подходящем растворителе, таком как ацетонитрил, диоксан, вода, метилэтилкетон или их смесь, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 1 до примерно 24 ч. Когда указанная защитная группа представлена группой фталоила, удаление защитной группы может быть осуществлено с использованием гидразина в подходящем растворителе, таком как этанол, вода, диоксан, тетрагидрофуран и т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 1 до примерно 96 ч. Согласно стадии "с" способа G соединение формулы 42 подвергают взаимодействию с сульфонилхлоридом в присутствии подходящего основания, такого как, например, пиридин, N-метилморфолин,диизопропилэтиламин, в подходящем растворителе, таком как пиридин, дихлорметан или тетрагидрофуран, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 1 ч до примерно 7 суток. Согласно стадии "d" способа G соединение формулы 42 предпочтительно подвергают взаимодействию с хлорформиатом в подходящем растворителе,таком как тетрагидрофуран,N,N-диметилформамид, дихлорметан, хлороформ, ацетонитрил, толуол или их смеси, при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 30 мин до примерно 96 ч. Реакцию обычно осуществляют в присутствии подходящей протонной ловушки, такой как триэтиламин, N,N-диизопропилэтиламин или пиридин. Согласно стадии "е" способа G соединение формулы 42 подвергают взаимодействию с подходящим изоцианатом в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, получая мочевину формулы (I)Е. Реакцию обычно осуществляют при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от при- 18019722 мерно 30 мин до примерно 96 ч. Согласно стадии "f" способа G соединение формулы (I)Е также получают из соединения формулы(I)D в результате взаимодействия с подходящим амином формулы R7N(Y)H. Указанную реакцию обычно осуществляют в подходящем растворителе, таком как диметилсульфоксид, тетрагидрофуран, N,Nдиметилформамид, N,N-диметилацетамид, ацетонитрил, толуол или их смеси, необязательно в присутствии дополнительного основания, такого как TEA, DIPEA, DBU или металлоорганический реагент, такой как реактив Гриньяра или триметилалюминий, при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 30 мин до примерно 96 ч. Согласно стадии "g" способа G соединение формулы 42 подвергают взаимодействию с подходящим тиоизоцианатом в подходящем растворителе, таком как дихлорметан или тетрагидрофуран, получая тиомочевину формулы (I)F. Реакцию обычно осуществляют при температуре в диапазоне от примерно-10C до температуры кипения с обратным холодильником и в течение периода времени, варьирующего от примерно 30 мин до примерно 96 ч. Согласно стадии "h" способа G соединение формулы 42 превращают в амид формулы (I)G в результате конденсации с любым производным формулы 43. Специалисту понятно, что такую реакцию можно осуществлять различными путями и в разных рабочих условиях, которые широко известны в данной области для получения карбоксамидов. В качестве примера, когда W означает галоген, такой как хлорид,реакцию осуществляет в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид или т.п.,при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Реакцию осуществляют в присутствии подходящей протонной ловушки, такой как триэтиламин,N,N-диизопропилэтиламин или пиридин. Когда W означает гидроксигруппу, реакцию осуществляют в присутствии связывающего реагента, такого как, например, тетрафторборат 2-(1 Н-бензотриазол-1-ил)1,1,3,3-тетраметилурония (TBTU), 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид,1-(3-диметиламинопропил)-3-этилкарбодиимид,N-циклогексилкарбодиимид-N'-пропилоксиметилполистирол или N-циклогексилкарбодиимид-N'-метилполистирол, в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил,толуол или N,N-диметилформамид, при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Указанную реакцию необязательно осуществляют в присутствии подходящего катализатора, например, 4-диметиламинопиридина, или в присутствии дополнительного связывающего реагента, такого как N-гидроксибензотриазол. Альтернативно, такую же реакцию также осуществляют, например, способом на основе смешанных ангидридов с использованием алкилхлорформиата,такого как этил-, изобутил- или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир,1,4-диоксан или N,N-диметилформамид, при температуре в диапазоне от примерно -30C до комнатной температуры. Согласно стадии "i" способа G аминогруппу соединения формулы 42 подвергают реакции диазотирования в условиях Зандмейера с последующим взаимодействием с SO2 в присутствии хлористоводородной кислоты и подходящего медного катализатора с образованием сульфонилхлорида формулы 44. Реакцию диазотирования осуществляют, используя нитрит натрия в воде или водных растворителях,в присутствии неорганической кислоты, такой как хлористо-водородная кислота, серная кислота и т.п.,или используя изоамилнитрит в подходящем растворителе, таком как дихлорметан, диметоксиэтан, тетрагидрофуран и т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Затем соль диазония обычно подвергают взаимодействию с SO2 в присутствии CuCl2 в подходящем растворителе, таком как вода,уксусная кислота или их смеси, при температуре в диапазоне от 0 до примерно 50C и в течение периода времени в диапазоне от 30 мин до примерно 6 ч. Согласно стадии "j" способа G соединение формулы 44 подвергают взаимодействию с подходящим амином, получая соединение формулы (I)Н. Указанную реакцию обычно осуществляют в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир,1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид или т.п., при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Реакция может быть осуществлена в присутствии подходящей протонной ловушки, такой как триэтиламин, N,N-диизопропилэтиламин или пиридин. Согласно способу Н, описанному ниже, исходя из соединения формулы (II)3, т.е. соединения формулы (II), в котором G означает бром, получают соединение формулы (I)I или (I)J, где А соответственно На приведенной выше схеме X, m, R1, R2, R3, R4, R5, R6, Е, R7, Alk и Y имеют значения, которые определены выше. В способе синтеза для получения соединения формулы (I)I и (I)J, который описан как способ Н, на стадии "а" соединение формулы (II)3 превращают в соединение формулы 45 в результате взаимодействия с подходящим метансульфонамидом или алкилсульфониламидоацетатом формулы 49 в присутствии подходящего основания, основанного на палладии катализатора и лиганда. Затем на стадии "b" последнее соединение подвергают взаимодействию с подходящим амином с образованием соединения формулы (I)I. На стадии "с" соединение формулы (II)3 подвергают взаимодействию с солью алкилмалонатом в присутствии подходящего медного катализатора с образованием соединения формулы 46, которое затем на стадии "d" гидролизуют до соответствующей карбоновой кислоты формулы 47 любыми способами,известными в данной области, например, с использованием гидроксида лития в присутствии подходящих растворителей, таких как смеси тетрагидрофурана, метанола и воды. Затем указанное соединение формулы 47 на стадии "е" конденсируют с подходящим амином с образованием соединения формулы (I)J. Альтернативно, соединение формулы (II)3 подвергают аминированию в условиях реакции Бухвальда-Хартвига с использованием бензофенонимина, подходящего основания и палладиевого катализатора с образованием соединения формулы 48. На стадии "g" последнее соединение гидролизуют в кислых условиях, например, используя хлористо-водородную кислоту, с образованием соединения формулы 42, которое подвергают любой из реакций, описанных в способ G выше. Согласно стадии "а" способа Н взаимодействие между соединением формулы (II)3 и подходящим метилсульфонамидом или алкилсульфониламидоацетатом, таким как 4-метансульфонилморфолин формулы 49, осуществляют, следуя условиям реакции, описанным в Gimm, J.В.; Katcher, M.H.; Witter, D.J.;Northrup, А.В., J. Org. Chem. 2007, 72 (21), 8135-8138, используя основание, такое как, например, третбутоксид натрия, подходящий палладиевый катализатор, такой как Pd(OAc)2, лиганд, такой как трифенилфосфин или тетрафторборат три-трет-бутилфосфония. Указанную реакцию обычно осуществляют в растворителях, таких как диоксан, диметоксиэтан и т.п., при температуре в диапазоне от примерно 0C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. В случае использования алкилсульфониламидоацетата(соединения 48, где Е означает алкилоксикарбонильную группу) после указанной реакции проводят обработку различными основаниями, такими как, например, K2CO3 или амид натрия, в подходящем растворителе, таком как 1,4-диоксан, диметилсульфоксид N,N-диметилформамид или т.п., при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Согласно стадии "b" способа Н взаимодействие между соединением формулы 45 и амином обычно осуществляют в подходящем растворителе, таком как 1,4-диоксан, ацетонитрил, толуол илиN,N-диметилформамид или т.п., при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Согласно стадии "с" способа Н взаимодействие между соединением формулы (II)3 и подходящим алкилацетатом или алкилмалонатом формулы 50 осуществляют, используя основание, такое как, например, гидрид натрия, подходящий катализатор, такой как CuBr, Pd(OAc)2 или PdCl2, лиганд, такой как,например, трифенилфосфин. Указанную реакцию обычно осуществляют в растворителях, таких как диоксан, диметоксиэтан и т.п., при температуре в диапазоне от примерно 0C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. В случае использования алкилмалоната (т.е. соединение формулы 50, где Е означает алкилоксикарбонильную группу) после указанной реакции проводят обработку основанием,таким как, например, K2CO3 или амид натрия, в подходящем растворителе, таком как 1,4-диоксан, диметилсульфоксид N,N-диметилформамид или т.п., при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Согласно стадии "d" способа Н гидролиз алкилового эфира формулы 46 осуществляют согласно хорошо известным способом, например, в присутствии водных растворов щелочей, таких как водный гидроксид натрия или гидроксид лития, в таких растворителях, как тетрагидрофуран, метанол, вода и их смеси. Для указанной реакции обычно требуется от 30 мин до 96 ч, и такую реакцию осуществляют при температуре в диапазоне от 0C до температуры кипения с обратным холодильником. Согласно стадии "е" способа Н соединение формулы 47 превращают в амид формулы (I)J в результате конденсации с подходящим амином. Специалисту понятно, что такую реакцию можно осуществлять различными путями и в разных рабочих условиях, которые широко известны в данной области для получения карбоксамидов. В качестве примера реакцию осуществляют в присутствии связывающего реагента, такого как, например, тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU),1,3-дициклогексилкарбодиимид,1,3-диизопропилкарбодиимид,1-(3-диметиламинопропил)-3 этилкарбодиимид, N-циклогексилкарбодиимид-N'-пропилоксиметилполистирол или N-циклогексилкарбодиимид-N'-метилполистирол, в подходящем растворителе, таком как, например, дихлорметан, хлороформ,тетрагидрофуран,диэтиловый эфир,1,4-диоксан,ацетонитрил,толуол илиN,N-диметилформамид, при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Указанную реакцию необязательно осуществляют в присутствии подходящего катализатора, например, 4-диметиламинопиридина, или в присутствии дополнительного связывающего реагента, такого как N-гидроксибензотриазол. Альтернативно, такую же реакцию также осуществляют, например, основанным на смешанных ангидридах способе, используя алкилхлорформиат, такой как этил-, изобутил- или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин,N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан илиN,N-диметилформамид, при температуре в диапазоне от примерно -30C до комнатной температуры. Согласно стадии "f" способа Н соединение формулы (II)3 превращают в соединение формулы 48 в результате взаимодействия с бензофенонимином в присутствии подходящего основания, такого как третбутоксид натрия, подходящего катализатора, такого как трис-дибензилиденацетон дипалладий, Pd2(dba)3,и необязательно дополнительного лиганда, такого как 2,2'-бис-(дифенилрфосфино)-1,1'-бинафтил(BINAP), в подходящем растворителе, таком как толуол, диметоксиэтан, диоксан и т.п., при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Согласно стадии "g" способа Н гидролиз соединения формулы 48 осуществляют, используя кислоту, такую как хлористо-водородная кислота в диоксане. Указанную реакцию обычно осуществляют при температуре в диапазоне от примерно 0 до 40C и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Дальнейшую обработку соединения формулы 42 осуществляют согласно способу G. Согласно способу I, описанному ниже, исходя из соединения формулы (II)4, т.е. соединения формулы (II), в котором G означает цианогруппу, получают соединение формулы (I)K, (I)L, (I)M, (I)N, (I)O или (I)Р, где А соответственно означает CON(Y), CH2NHSO2, CH2NHCOO, CH2NHCONH, CH2NHCSNH или CH2NHCO. На приведенной выше схеме X, m, R1, R2, R3, R4, R5, R6, R7, R7', Y и W имеют значения, которые определены выше. В способе синтеза для получения соединений формул (I)K-(I)Р, который описан в способе I, на стадии "а" цианогруппу соединения формулы (II)4 гидролизуют с образованием соединения формулы 51, и затем последнее соединение на стадии "b" конденсируют с подходящим амином с образованием соединения формулы (I)K. Альтернативно, на стадии "с" цианогруппу соединения формулы (II)4 восстанавливают с образованием соединения формулы 52. Затем на стадии "d", "e", "f", "g" и "h" указанное соединение формулы 52 подвергают взаимодействию с разными типами электрофила, получая соответственно соединение формулы (I)L, (I)M, (I)N, (I)O и (I)Р. Согласно стадии "а" способа I гидролиз цианогруппы осуществляют, используя любой способ, известный в данной области, предпочтительно с использованием водного раствора хлористо-водородной кислоты при нагревании в микроволновой печи при температуре в диапазоне от 80 до 200C в течение периода времени от 3 до 120 мин. Согласно стадии "b" способа I соединение формулы 51 превращают в амид формулы (I)K в результате конденсации с подходящим амином. Специалисту понятно, что такая реакция может быть осуществлена разными путями и в разных рабочих условиях, которые широко известны в данной области для получения карбоксамидов. В качестве примера, реакцию осуществляют в присутствии связывающего реагента, такого как, например, тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронияN,N-диметилформамид, при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Указанную реакцию необязательно осуществляют в присутствии подходящего катализатора, например 4-диметиламинопиридина, или в присутствии дополнительно связывающего реагента,такого как N-гидроксибензотриазол. Альтернативно, ту же самую реакцию также осуществляют, например, основанным на смешанных ангидридах способе, используя алкилхлорформиат, такой как этил-, изобутил- или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин,N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан илиN,N-диметилформамид, при температуре в диапазоне от примерно -30C до комнатной температуры. Согласно стадии "с" способа I соединение формулы (II)4 превращают в соединение формулы 52,используя подходящий восстановитель, например алюмогидрид лития, боргидрид лития, комплекс боран-диметилсульфоксид, боран или т.п., в подходящем растворителе, таком как тетрагидрофуран, диэтиловый эфир, толуол, дихлорметан, диглим и т.п., при температуре в диапазоне от -50C до температуры кипения с обратным холодильником, в течение соответствующего периода времени реакции, например от 30 мин до 48 ч. Стадии "d"-"h" способа I соответственно осуществляют, как описано для стадий "с", "d", "e", "g" и"h" способа G. Согласно способу J, описанному ниже, исходя из соединения формулы (II)5, т.е. соединения формулы (II), в котором G означает соответствующий сложный эфир карбоновой кислоты, получают соединение формулы (I)Q, где А означает CH2SO2N(Y). Способ J. На приведенной выше схеме X, m, R1, R2, R3, R4, R5, R6, R7, Y, Alk и L' имеют значения, которые определены выше. В способе синтеза, описанном как способ J, соединение формулы 51 получают на стадии "а" в результате гидролиза алкоксикарбонильной группы соединения формулы (II)5. Затем соединение формулы 51 подвергают реакции амидирования, как описано в способе I, стадия "b". На стадии "b" алкоксикарбонильную группу соединений (II)5 восстанавливают с образованием соединения формулы 53. Затем на стадии "с" гидроксигруппу последнего соединения заменяют более подходящей удаляемой группой, например бромом, тозилатом, мезилатом или трифлатом. На стадии "d" полученное таким образом соединение формулы 54 подвергают взаимодействию с подходящим нуклеофилом, таким как сульфит натрия, с образованием соединения формулы 55. Альтернативно, на стадии"g" соединение формулы 54 подвергают взаимодействию с азидом натрия и затем на стадии "h" промежуточный алкилазид восстанавливают с образованием соединения формулы 52, которое дополнительно функционализируют, затем обрабатывают подходящим электрофилом, как описано в способе I выше. Затем на стадии "е" соединение формулы 55 превращают в соответствующее хлоридное производное и затем на стадии "f" обрабатывают подходящим амином, получая соединение формулы (I)Q. Согласно стадии "а" способа J гидролиз сложного алкилового эфира осуществляют хорошо известными способами, например, в присутствии водных растворов щелочи, таких как водный раствор гидроксида натрия или гидроксида лития в таких растворителях, как тетрагидрофуран, метанол, вода и их смеси. Для указанной реакции обычно требуется от 30 мин до 96 ч, и такую реакцию осуществляют при температуре в диапазоне от 0C до температуры кипения с обратным холодильником. Согласно стадии "b" способа J восстановление соединения формулы (II)5 осуществляют, используя подходящий восстановитель, например алюмогидрид лития, боргидрид лития, боран или т.п., в подходящем растворителе, таком как тетрагидрофуран, диэтиловый эфир, толуол, дихлорметан и т.п., при температуре в диапазоне от -50C до температуры кипения с обратным холодильником, в течение подходящего периода времени реакции, например от 30 мин до 48 ч. Согласно стадии "с" способа J гидроксигруппу соединения формулы 53 превращают в более подходящую удаляемую группу, следуя способам, хорошо известным в данной области. Например, ее превращение в атом брома может быть осуществлено с использованием соответствующего бромирующего реагента, такого как Ph3PBr2, PBr3, SOBr2 или т.п., в подходящем растворителе, таком как дихлорметан, тет- 23019722 рагидрофуран, диэтиловый эфир, толуол и т.п., в течение периода времени в диапазоне от 30 мин до 24 ч,и реакцию осуществляют при температуре в диапазоне от 0C до температуры кипения с обратным холодильником. Превращение гидроксигруппы в группу тозилата, мезилата или трифлата обычно осуществляют, используя подходящие реагенты, такие как, например, тозилхлорид, мезилхлорид, трифторметансульфонилхлорид соответственно. Согласно стадии "d" способа J соединение формулы 54 подвергают взаимодействию с такими реагентами, как сульфит натрия, в растворителях, таких как вода, N,N-диметилформамид, ацетон или их смесь, необязательно в присутствии дополнительного соединения, такого как бромид тетрабутиламмония или т.п., при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Согласно стадии "е" способа J соединение формулы 54 подвергают взаимодействию с такими реагентами, как PCl5, POCl3, SOCl2, (COCl)2 или т.п., в подходящем растворителе, таком как тетрагидрофуран, дихлорметан или т.п., при температуре в диапазоне от 20C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч с образованием соединений формулы 56. Согласно стадии "f" способа J соединение формулы 56 подвергают взаимодействию с подходящим амином, получая соединение формулы (I)Q. Указанную реакцию обычно осуществляют в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир,1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид или т.п., при температуре в диапазоне от примерно -10C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Реакция может быть осуществлена в присутствии соответствующей протонной ловушки, такой как триэтиламин, N,N-диизопропилэтиламин или пиридин. Превращение соединения формулы 54 в соединение формулы 52 может быть осуществлено несколькими путями и в разных рабочих условиях, хорошо известных специалистам в данной области. В качестве примера в настоящем описании приведена двухстадийная последовательность реакций, включающая образование алкилазида формулы 57 и его восстановление в аминосоединение формулы 52. Соответственно, на стадии "g" способа J соединение формулы 54 подвергают взаимодействию с таким соединением, как азид натрия, в таком растворителе, как N,N-диметилформамид, ацетон, тетрагидрофуран, этанол, при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Согласно стадии "h" способа J соединение формулы 57 восстанавливают с образованием соединения формулы 52. Указанное восстановление осуществляют, используя любой подходящий восстановитель, таком как, например, PPh3, SnCl2, BH3 или т.п., в подходящем растворителе, таком как тетрагидрофуран, этанол, N,N-диметилформамид или т.п., при температуре в диапазоне от примерно 20C до температуры кипения с обратным холодильником и в течение соответствующего периода времени, в частности от примерно 30 мин до примерно 96 ч. Соединение формулы (I), полученное согласно способу G, способу Н, способу I или способу J, может быть далее превращено в другое соединение формулы (I), способами, хорошо известными специалистам в данной области. Например, в случае соединения формулы (I)R, т.е. соединения формулы (I), где X означает группу СН и R2 означает водород, или соединения формулы (I)АА, т.е. соединения формулы (I), где X означает группу СН и R2 означает галоген, указанное соединение может быть далее превращено в другое соединение формулы (I)S, (I)T, (I)U или (I)V, где R2 соответственно означает NR14R15, NHR14, NH2 или NHCOR16,согласно способу K, описанному ниже. На приведенной выше схеме m, R1, R3, R4, R5, R6, A, R7, R14, R15, R16 и Hal имеют значения, которые определены выше. В способе синтеза для получения соединения формулы (I)S, (I)T, (I)U и (I)V, который описан как способ K, на стадии "а" атом азота пиридина соединения формулы (I)R окисляют с образованиемN-оксидного производного формулы 58. На стадии "b" и "с", соответственно, взаимодействие последнего производного с подходящим электрофильным реагентом, таким как толуолсульфоновый ангидрид, в присутствии или с последующей обработкой подходящим нуклеофилом, таким как вторичный(NHR14R15) или первичный (NH2R14) амин, дает соединение формулы (I)S и (I)Т соответственно. Альтернативно, на стадии "b1" и "c1", соответственно, соединение формулы (I)АА подвергают взаимодействию с подходящим нуклеофилом, таким как вторичный (NHR14R15) или первичный (NH2R14) амин, получая соединение формулы (I)S и (I)Т соответственно. Необязательно на стадии "d", когда R14 представлен трет-бутильной группой, бензильной группой или т.п., указанные группы могут быть удалены, например,обработкой кислотой или в восстанавливающих условиях с получением соединения формулы (I)U. На стадии "е" последнее соединение необязательно может быть ацилировано с использованием подходящего электрофила, такого как ацилхлорид, с образованием соединения формулы (I)V. Реакции на стадиях "а", "b", "с", "d", "c1", "d1" и "е" способа K осуществляют аналогично реакциям на стадиях "а", "b", "с", "d", "c1", "d1" и "е" способа Е, описанного выше. Соединение формулы (I), полученное согласно способу G, способу Н, способу I или способу J, может быть далее превращено в другое соединение формулы (I) способами, хорошо известными специалистам в данной области. Например, в случае соединения формулы (I)W, т.е. соединения формулы (I), гдеX означает атом азота и R2 означает тиометил, или соединения формулы (I)АВ, т.е. соединения формулы(I), где X означает атом азота и R2 означает галоген, указанное соединение далее может быть превращено в другое соединение формулы (I)X, (I)Y или (I)Z, где R2 соответственно означает NR14R15, NH2 или На приведенной выше схеме m, R1, R3, R4, R5, R6, A, R7, R14, R15 и R16 и Hal имеют значения, которые определены. В способе синтеза для получения соединений формулы (I)Х, (1)Y и (I)Z, который описан как способL, на стадии "а" взаимодействие соединения формулы (I)W с окислителем дает сульфонильное производное формулы (I)W'. На стадии "b" последнее соединение обрабатывают подходящим нуклеофилом,таким как первичный или вторичный амин формулы NHR14R15, получая соединение формулы (I)Х. На стадии "с" сульфонильное производное формулы (I)W' обрабатывают хлоридом аммония с образованием соединения формулы (I)Y. Альтернативно, на стадии "b1" и "c1" соединение формулы (I)АВ подвергают взаимодействию с подходящим нуклеофилом, таким как первичный или вторичный амин формулы(NHR14R15), или с хлоридом аммония, получая соединение формулы (I)Х и (I)Y, соответственно. Соединение формулы (I)Y необязательно ацилируют, используя подходящий электрофил формулы R16COHal,где Hal означает галогенид, такой как хлорид или т.п., с образованием соединения формулы (I)Z. Реакции на стадиях "а", "b", "с", "b1", "c1" и "d" способа L осуществляют аналогично реакциям на стадиях "а", "b", "с", "b1", "c1" и "d" способа F, описанного выше. В следующем способе соединение формулы 60 превращают в соединение формулы (I)А согласно способу М, показанному ниже. Способ M. На приведенной выше схеме X, R2, R3, R4, R5, R6, A, R7 имеют значения, которые определены выше,m равно 0, R1 означает водород и PG5 означает защитную группу или смолу для твердофазного синтеза. Специалистам в данной области легко понятно, что когда PG5 представляет собой подходящую защитную группу или смолу для твердофазного синтеза, можно использовать различные способы, которые хорошо известны в данной области, чтобы удалить такую защитную группу или смолу, в зависимости от природы PG5. Согласно стадии "а" способа М, когда PG5 означает защитную группу, такую как силильная группа или ее производное, такое как 2-триметилсилилэтансульфонил (SEM), 2-триметилсилилэтансульфонил(SES) и т.п., удаление защиты может быть осуществлено с использованием фторида тетрабутиламмония,фторида цезия, а также трифторуксусной кислоты, хлорной кислоты, хлористо-водородной кислоты,фтористо-водородной кислоты и их производных в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, ацетонитрил, дихлорметан, N,N-диметилформамид или т.п., при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Когда такая защитная группа представлена группой тетрагидропиранила, превращение соединения формулы 60 в соединение формулы (I) осуществляют, используя хлористо-водородную кислоту в метаноле или этаноле. Когда указанной защитной группой является, например, бензил, п-метоксибензил или тритил, превращение соединения формулы 60 в соединение формулы (I) осуществляют, используя сильные кислоты, такие как, например,трифторуксусная кислота, в подходящем сорастворителе, таком как дихлорметан, при температуре в диапазоне от 20C до температуры кипения с обратным холодильником или выше, при условии, что реакцию осуществляют в герметично закрытом сосуде, нагревая, например, в микроволновой печи, в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Когда указанной защитной группой является, например, трет-бутоксикарбонил, превращение соединения формулы 60 в соединение формулы (I) осуществляют, используя сильные кислоты, такие как, например, трифторуксусная кислота, в подходящем сорастворителе, таком как дихлорметан или хлористо-водородная кислота в диоксане, при температуре в диапазоне от 20C до температуры кипения с обратным холодильником или выше, при условии,что реакцию осуществляют в герметично закрытом сосуде, нагревая, например, в микроволновой печи, в течение периода времени в диапазоне от 30 мин до примерно 24 ч. Когда указанной защитной группой является, например, этоксикарбонил, превращение соединения формулы 60 в соединение формулы (I)А осуществляют, используя, например, триэтиламин в присутствии метанола или т.п. реагенты, при температуре в диапазоне от 20C до температуры кипения с обратным холодильником в течение соответствующего периода времени, обычно от 30 мин до 48 ч. Когда группа PG5 представляет собой смолу для твердофазного синтеза, удаление такой смолы осуществляют согласно способам, хорошо известным специалистам в данной области, которые зависят от природы такой смолы. Обычно, когда используют смолу, содержащую тритилхлорид, смолу, содержащую 2-хлортритилхлорид, смолу, содержащую 4-(бромметил)феноксиметил, смолу, содержащую 4-(бромметил)феноксиэтил, бром-(4-метоксифенил)метилполистироловую смолу/бром-МАМР-смолу,- 26019722 п-нитрофенилкарбонатную смолу Ванга, п-нитрофенилкарбонатную смолу Меррифильда, смолу, содержащую 3,4-дигидро-2 Н-пиран-2-илметоксиметил, смолу, содержащую п-нитрофенилкарбонатбутилоксиметил и т.п., удаление осуществляют, используя трифторуксусную кислоту в подходящем растворителе, таком как дихлорметан, при комнатной температуре в течение соответствующего периода времени, обычно от 5 мин до 24 ч. В следующем способе соединение формулы (II) способа А, полученное способами А-D, превращают в соединение формулы 61 согласно способу N, показанному ниже. Способ N. На приведенной выше схеме X, R2, R3, R4, R5, R6, G и PG5 имеют значения, которые определены выше. Специалистам в данной области понятно, что введение PG5 может быть осуществлено различными путями и следуя различным способам, которые хорошо известны в данной области, в зависимости от природы PG5. Согласно стадии "а" способа N, когда PG5 означает силильное производное, тетрагидропиранил, пметоксибензил или тритил, превращение соединения формулы (II) способа А в соединение формулы 61 осуществляют, как описано для стадии "е" способа В. Когда PG5 означает алкоксикарбонильную группу,превращение соединения формулы (II) способа А в соединение формулы 61 осуществляют, используя соответствующий диалкилкарбонат, такой как, например, ди-трет-бутилдикарбонат, алкилхлорформиат,такой как, например, этилхлорформиат, необязательно в присутствии подходящего основания, такого как триэтиламин, N,N-диизопропилэтиламин или т.п., в подходящем растворителе, таком как, например, дихлорметан, тетрагидрофуран, при температуре в диапазоне от 0C до температуры кипения с обратным холодильником и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Когда PG5 означает смолу для твердофазного синтеза, нагрузка может быть осуществлена с использованием любой подходящей смолы, такой как полистироловая смола или смола из полистирола с привитым полиэтиленгликолем, при условии, что они несут подходящий линкер. Не ограничивающий список таких смол включает смолу, содержащую тритилхлорид, смолу, содержащую 2-хлортритилхлорид,смолу, содержащую 4-(бромметил)феноксиметил, смолу, содержащую 4-(бромметил)феноксиэтил, бромМАМР-смолу, п-нитрофенилкарбонатную смолу Ванга, п-нитрофенилкарбонатную смолу Меррифильда,смолу,содержащую 3,4-дигидро-2 Н-пиран-2-илметоксиметил,смолу,содержащую пнитрофенилкарбонат-бутилоксиметил и т.п. Указанные смолы обычно подвергают взаимодействию с соединениями общей формулы (II) способа А в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, толуол, 1,2-диметоксиэтан, N,N-диметилформамид, метанол или их смеси, необязательно в присутствии подходящей протонной ловушки,такой как триэтиламин,K2CO3,N,N-диизопропилэтиламин, пиридин или т.п., при температуре в диапазоне от 0 до 40C и в течение периода времени в диапазоне от 30 мин до примерно 48 ч. Специалистам в данной области понятно, что,когда в указанных соединениях формулы (II) m равно 0 и R1 означает защитную группу, которая описана выше, можно использовать любое или даже смесь региоизомерных соединений формулы (II) и 10 для предстоящего превращения, так как указанная защитная группа будет удалена в конце превращения с использованием любого способа, известного в данной области, получая соединения общей формулы (I),где m равно 0 и R1 означает водород. При получении соединений формулы (I) согласно любому из вариантов способа, которые, как подразумевается, все входят в объем изобретения, необязательные функциональные группы в исходных веществах, реагентах или их промежуточных продуктах, которые могут приводить к нежелательным побочным реакциям, необходимо должным образом защитить согласно обычным способам. Исходные вещества для способов, являющихся целью настоящего изобретения, включая любой возможный вариант, а также любой реагент, являются известными соединениями, и в том случае, если они не являются коммерчески доступными как таковые, могут быть получены согласно хорошо известным способам. Фармакология. Анализы. Анализ пролиферации клеток in vitro. Экспоненциально растущие клетки меланомы человека А 375 (с мутантным B-RAF) и клетки меланомы человека Mewo (с B-Raf дикого типа) высевали и инкубировали при 37C в увлажненной атмосфере с 5% СО 2. Через 24 ч в среду добавляли ступенчато возрастающие дозы соединения и клетки инкуби- 27019722 ровали в течение 72 ч. В конце обработки клетки промывали и подсчитывали. Количество клеток определяли с помощью системы мониторинга клеточного аденозинтрифосфата. Пролиферацию клеток сравнивали с контрольными клетками и вычисляли концентрацию, ингибирующую клеточный рост на 50%. Анализ p-MAPK (T202/Y204) с использованием ArrayScan. Клетки меланомы человека А 375, имеющие мутантный B-RAF, высевали в 384-луночные планшеты(Matrix), покрытые полилизином, при плотности 1000 клеток/лунка, в соответствующую среду с добавлением 10% FCS, и инкубировали в течение 16-24 ч. Клетки обрабатывали в течение 1,5 или 2 ч возрастающими дозами соединений (начальная доза 10 мкМ, коэффициент разбавления 2,5). В конце обработки клетки фиксировали 3,7% п-формальдегидом в течение 15-30 мин, затем дважды промывали D-PBS(Sigma-Aldrich) в течение 15 мин при комнатной температуре (раствор для окрашивания). В раствор для окрашивания добавляли моноклональное анти-фосфо-MAPK (T202/Y204) антитело Е 10 (Cell Signaling, в каталоге 9106) в разведении 1:100 и инкубировали в течение 1 ч при 37C. После удаления раствора первого антитела добавляли второе антитело против Ig мыши, конъюгированное с Су 2 (зеленый) (Amersham), разбавленное 1:500 в растворе для окрашивания, содержащем 2 мкг/мл DAPI. Планшет инкубировали в течение 1 ч при 37C, дважды промывали и затем регистрировали, используя Cellomics' ArrayScan VTI (4 поля/лунка, алгоритм CytoNucTrans). Параметр "MEAN RingAvglntenCh2", который измеряет среднюю интенсивность флуоресценции цитоплазмы, ассоциированную с окрашиванием p-MAPK, получали в качестве конечного результата. Мутации B-RAF, которые конститутивно активируют киназу, были идентифицированы в большинстве меланом и в большой части случаев карциномы прямой и ободочной кишки и сосочковой карциномы щитовидной железы. Рост клеток с активированным B-RAF строго зависит от активности B-RAF. С учетом описанных выше анализов ясно, что соединения формулы (I) обладают заметной активностью в ингибировании клеточной пролиферации, при этом значения IC50 ниже 10 мкМ для клеточной линии с мутантным B-Raf (A375) и выше для клеточной линии с B-Raf дикого типа (Mewo), как показано в табл. 1. В той же таблице также представлены данные, полученные с использованием соединений формулы(I) в анализе ArrayScan, и показана способность соединений формулы (I) ингибировать путь сигнальной трансдукции, контролируемый активацией B-RAF, в линии клеток А 375 с мутантным B-RAF. ЗначенияIC50 всегда ниже 10 мкМ, что соответствует значениям IC50, полученным в анализе пролиферации на той же самой линии клеток, это подтверждает, что антипролиферативная активность соединений является следствием ингибирования активности B-RAF.
МПК / Метки
МПК: C07D 407/14, C07D 409/14, C07D 401/04, A61K 31/4439, C07D 403/04, A61P 35/00
Метки: 3,4-диарилпиразолы, качестве, ингибиторов, протеинкиназ
Код ссылки
<a href="https://eas.patents.su/30-19722-34-diarilpirazoly-v-kachestve-ingibitorov-proteinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">3,4-диарилпиразолы в качестве ингибиторов протеинкиназ</a>
Предыдущий патент: Оздоровительная биологически активная добавка
Следующий патент: Ингибиторы cmet
Случайный патент: Композиции для доставки лекарственных средств с высокой водорастворимостью (варианты) и их применение в лечении злокачественной опухоли