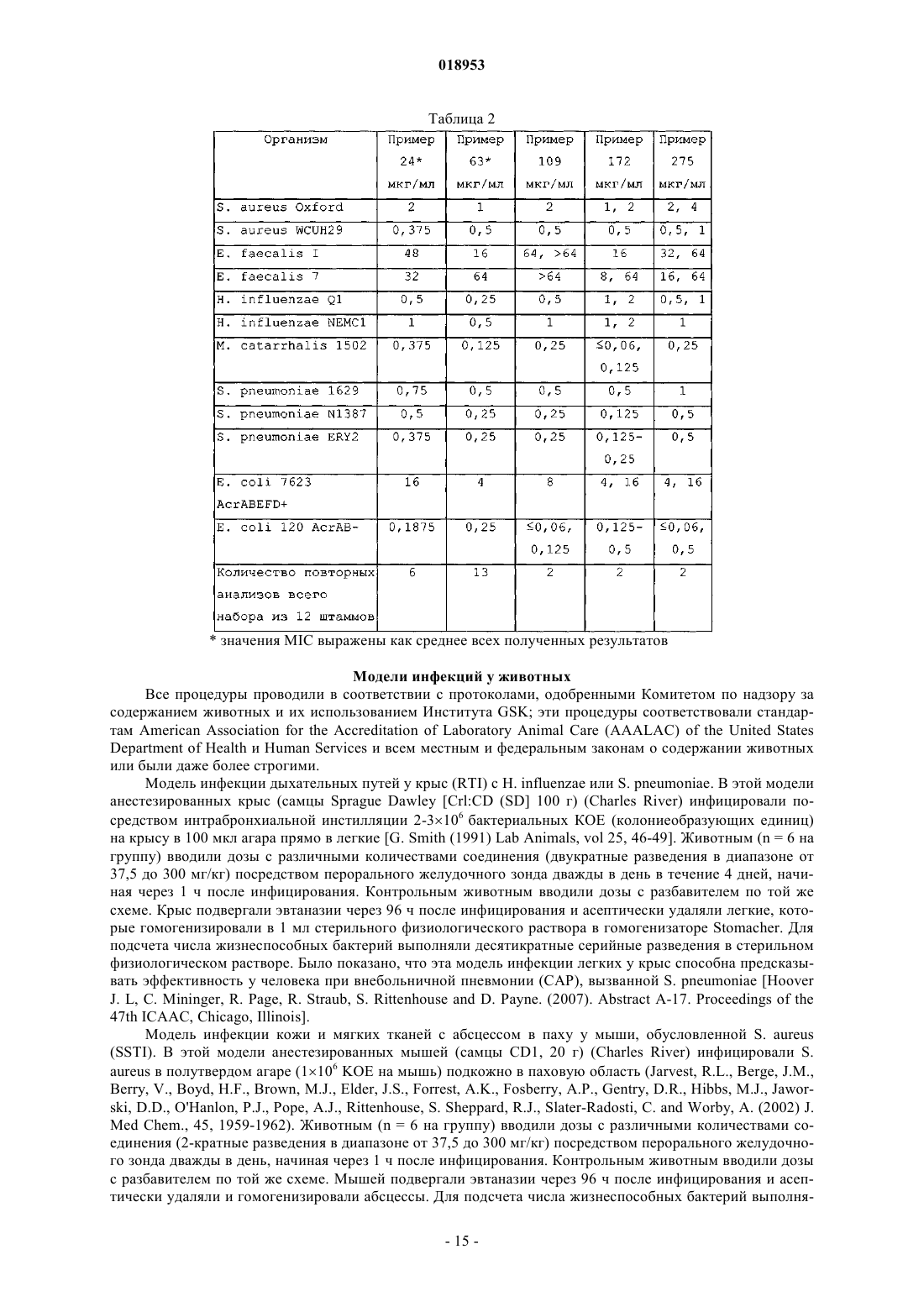
Ингибиторы пептиддеформилазы
Номер патента: 18953
Опубликовано: 30.12.2013
Авторы: Кристенсен Зигфрид Бенджамин IV, Цинь Дунхой, Ляо Сянминь, Фан Юйхун, Беновиц Эндрю В., Обарт Келли М., Нокс Эндрю Николсон, Дрибит Джейсон Кристофер, Ли Дзинхва, Нортон Бет
Формула / Реферат
1. Соединение, которое представляет собой
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
[(2R)-3-{2-[6-(1-азетидинил)-2-этил-5-фтор-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[6-(1-азетидинил)-5-фтор-2-(метилтио)-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[2-хлор-5-фтор-6-(4-метил-1-пиперазинил)-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-5-фтор-6-[(1-метилэтил)амино]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[6-(1-азетидинил)-5-фтор-2-метил-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-2-метил-6-(4-морфолинил)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-2-метил-6-[метил(метилокси)амино]-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[6-(2,5-дигидро-1Н-пиррол-1-ил)-5-фтор-2-метил-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-2-метил-6-(1,3-тиазолидин-3-ил)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-2-метил-6-[3-(метилокси)-1-азетидинил]-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-2-метил-6-[(3R)-3-(метилокси)-1-пирролидинил]-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-2-метил-6-[(3S)-3-(метилокси)-1-пирролидинил]-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-2-метил-6-[(1-метилэтил)амино]-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
{(2R)-2-(циклопентилметил)-3-[2-(5-фтор-2-метил-6-{метил[2-(метилокси)этил]амино}-4-пиримидинил)гидразино]-3-оксопропил}гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{6-[этил(метил)амино]-5-фтор-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(2S)-2-(гидроксиметил)-1-пирролидинил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[6-(циклобутиламино)-5-фтор-2-метил-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[6-(циклопентиламино)-5-фтор-2-метил-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(3R)-3-(гидроксиметил)-1-пирролидинил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(3S)-3-(гидроксиметил)-1-пирролидинил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
[(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1Н)-ил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[2-этил-5-фтор-6-(4-метил-1-пиперазинил)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-{2-[2-этил-5-фтор-6-(2-изоксазолидинил)-4-пиримидинил]гидразино}-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{6-[(3R)-3-(диметиламино)-1-пирролидинил]-2-этил-5-фтор-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{6-[(3S)-3-(диметиламино)-1-пирролидинил]-2-этил-5-фтор-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{2-этил-5-фтор-6-[(3S)-3-гидрокси-1-пирролидинил]-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{2-этил-5-фтор-6-[(3R)-3-гидрокси-1-пирролидинил]-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-{2-[6-(циклопропиламино)-2-этил-5-фтор-4-пиримидинил]гидразино}-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-{2-[2-этил-6-(4-этил-1-пиперазинил)-5-фтор-4-пиримидинил]гидразино}-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{2-этил-5-фтор-6-[4-(2-гидроксиэтил)-1-пиперазинил]-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-{2-[2-этил-5-фтор-6-(метиламино)-4-пиримидинил]гидразино}-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-{2-[2-этил-6-(этиламино)-5-фтор-4-пиримидинил]гидразино}-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{2-этил-5-фтор-6-[4-(1-метилэтил)-1-пиперазинил]-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
l-(6-{2-[(2R)-3-циклопентил-2-{[формил(гидрокси)амино]метил}пропаноил]гидразино}-2-этил-5-фтор-4-пиримидинил)-N,N-диметил-L-пролинамид;
N-{(2R)-2-(циклопентилметил)-3-[2-(6-{[2-(диметиламино)этил](метил)амино}-2-этил-5-фтор-4-пиримидинил)гидразино]-3-оксопропил}-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{6-[(3S)-3,4-диметил-1-пиперазинил]-2-этил-5-фтор-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
N-[(2R)-2-(циклопентилметил)-3-(2-{6-[(3R)-3,4-диметил-1-пиперазинил]-2-этил-5-фтор-4-пиримидинил}гидразино)-3-оксопропил]-N-гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-6-(4-метил-1-пиперазинил)-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[6-(этиламино)-5-фтор-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-6-(метиламино)-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-6-[(3S)-3-гидрокси-1-пирролидинил]-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[6-(диметиламино)-5-фтор-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-2-(метилтио)-6-(пропиламино)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-6-{[2-(метилокси)этил]амино}-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
1-[6-[2-((2R)-3-циклопентил-2-{[формил(гидрокси)амино]метил}пропаноил)гидразино]-5-фтор-2-(метилтио)-4-пиримидинил]-N,N-диметил-L-пролинамид;
((2R)-2-(циклопентилметил)-3-{2-[5-фтор-6-[(3R)-3-гидрокси-1-пирролидинил]-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[6-[(3R)-3-(диметиламино)-1-пирролидинил]-5-фтор-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
((2R)-2-(циклопентилметил)-3-{2-[6-(4-этил-1-пиперазинил)-5-фтор-2-(метилтио)-4-пиримидинил]гидразино}-3-оксопропил)гидроксиформамид;
[(2R)-3-{2-[2-хлор-5-фтор-6-(4-морфолинил)-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[6-(1-азетидинил)-2-хлор-5-фтор-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-{2-[2-хлор-6-(4-этил-1-пиперазинил)-5-фтор-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-5-фтор-6-[(2-гидроксиэтил)(метил)амино]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-5-фтор-6-[3-(метилокси)-1-азетидинил]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-[2-(2-хлор-5-фтор-6-{метил[2-(метилокси)этил]амино}-4-пиримидинил)гидразино]-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-5-фтор-6-[(8aS)-гексагидропирроло[1,2-а]пиразин-2(1Н)-ил]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-5-фтор-6-[(1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гепт-2-ил]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
1-{6-хлор-2-[2-((2R)-3-циклопентил-2-{[формил(гидрокси)амино]метил}пропаноил)гидразино]-5-фтор-4-пиримидинил}-N,N-диметил-L-пролинамид;
[(2R)-3-{2-[2-хлор-5-фтор-6-(пропиламино)-4-пиримидинил]гидразино}-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-6-[(3S)-3,4-диметил-1-пиперазинил]-5-фтор-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-6-[(3R)-3,4-диметил-1-пиперазинил]-5-фтор-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-6-[(2S)-2,4-диметил-1-пиперазинил]-5-фтор-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид;
[(2R)-3-(2-{2-хлор-6-[(2R)-2,4-диметил-1-пиперазинил]-5-фтор-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид и
[(2R)-3-(2-{2-хлор-5-фтор-6-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1Н)-ил]-4-пиримидинил}гидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид,
или его фармацевтически приемлемая соль.
2. Соединение, которое представляет собой [(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1Н)-ил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамид формулы
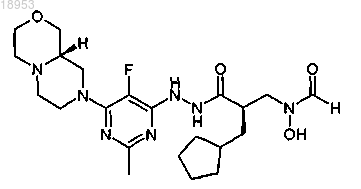
или его фармацевтически приемлемая соль.
3. Полиморфная форма 1 [(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4] оксазин-8(1Н)-ил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамида, характеризуемая данными ФТ-ИК-спектра фиг. 1, ФТ-рамановского спектра фиг. 3, порошковой рентгенограммой фиг. 6, термограммой дифференциальной сканирующей калориметрии фиг. 9 и записью термогравиметрического анализа фиг. 12.
4. Полиморфная форма 1 по п.3, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета, где:
a) указанная рентгенограмма включает пик при 4,1±0,1°; или
b) указанная рентгенограмма включает пик при 4,1±0,1° и 6,1±0,1°; или
c) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1° и 6,9±0,1°; или
d) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1° и 8,1±0,1°; или
e) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1° и 9,5±0,1°; или
f) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1° и 11,2±0,1°; или
g) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1°, 11,2±0,1° и 12,9±0,1°; или
h) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1°, 11,2±0,1°, 12,9±0,1° и 13,8±0,1°; или
i) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1°, 11,2±0,1°, 12,9±0,1°, 13,8±0,1° и 15,6±0,1°; или
j) указанная рентгенограмма включает пик при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1°, 11,2±0,1°, 12,9±0,1°, 13,8±0,1°, 15,6±0,1° и 18,3±0,1°.
5. Полиморфная форма 1 по п.4, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета и находящиеся в четырех или более позициях, выбранных из группы, состоящей из пиков при 4,1±0,1°, 6,1±0,1°, 6,9±0,1°, 8,1±0,1°, 9,5±0,1°, 11,2±0,1°, 12,9±0,1°, 13,8±0,1°, 15,6±0,1° и 18,3±0,1°.
6. Полиморфная форма 2 [(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1Н)-ил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамида, характеризуемая данными ФТ-ИК-спектра фиг. 2, ФТ-рамановского спектра фиг. 4, порошковой рентгенограммой фиг. 7, термограммой дифференциальной сканирующей калориметрии фиг. 10 и записью термогравиметрического анализа фиг. 13.
7. Полиморфная форма 2 по п.6, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета, где:
a) указанная рентгенограмма включает пик при 7,8±0,1°; или
b) указанная рентгенограмма включает пик при 7,8±0,1° и 9,5±0,1°; или
c) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1° и 12,3±0,1°; или
d) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1° и 13,2±0,1°; или
e) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1° и 15,6±0,1°; или
f) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1° и 18,3±0,1°; или
g) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1°, 18,3±0,1° и 19,0±0,1°; или
h) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1°, 18,3±0,1°, 19,0±0,1° и 20,6±0,1°; или
i) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1°, 18,3±0,1°, 19,0±0,1°, 20,6±0,1° и 21,4±0,1°; или
j) указанная рентгенограмма включает пик при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1°, 18,3±0,1°, 19,0±0,1°, 20,6±0,1°, 21,4±0,1° и 26,7±0,1°.
8. Полиморфная форма 2 по п.7, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета и находящиеся в четырех или более позициях, выбранных из группы, состоящей из пиков при 7,8±0,1°, 9,5±0,1°, 12,3±0,1°, 13,2±0,1°, 15,6±0,1°, 18,3±0,1°, 19,0±0,1°, 20,6±0,1°, 21,4±0,1° и 26,7±0,1°.
9. Полиморфная форма 3 [(2R)-2-(циклопентилметил)-3-(2-{5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1Н)-ил]-2-метил-4-пиримидинил}гидразино)-3-оксопропил]гидроксиформамида, характеризуемая данными ФТ-рамановского спектра фиг. 5, порошковой рентгенограммой фиг. 8, термограммой дифференциальной сканирующей калориметрии фиг. 11 и записью термогравиметрического анализа фиг. 14.
10. Полиморфная форма 3 по п.9, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета, где:
a) указанная рентгенограмма включает пик при 6,1±0,1°; или
b) указанная рентгенограмма включает пик при 6,1±0,1° и 7,5±0,1°; или
c) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1° и 8,2±0,1°; или
d) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1° и 9,1±0,1°; или
e) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1° и 12,0±0,1°; или
f) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1° и 12,8±0,1°; или
g) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1°, 12,8±0,1° и 13,4±0,1°; или
h) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1°, 12,8±0,1°, 13,4±0,1° и 16,0±0,1°; или
i) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1°, 12,8±0,1°, 13,4±0,1°, 16,0±0,1° и 23,3±0,1°; или
j) указанная рентгенограмма включает пик при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1°, 12,8±0,1°, 13,4±0,1°, 16,0±0,1°, 23,3±0,1° и 27,6±0,1°.
11. Полиморфная форма 3 по п.10, характеризуемая рентгенограммой, включающей пики, выраженные в единицах углов 2 тета и находящиеся в четырех или более позициях, выбранных из группы, состоящей из пиков при 6,1±0,1°, 7,5±0,1°, 8,2±0,1°, 9,1±0,1°, 12,0±0,1°, 12,8±0,1°, 13,4±0,1°, 16,0±0,1°, 23,3±0,1° и 27,6±0,1°.
12. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-9.
13. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в терапии.
14. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли при лечении бактериальной инфекции.
15. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для применения при лечении бактериальной инфекции.
16. Применение по п.14 или 15, где бактериальная инфекция вызвана Streptococcus, Staphylococcus, Moraxella, Haemophilus, Neisseria, Mycoplasma, Legionella, Chlamydia, Bacteroides, Clostridium, Fusobacterium, Propionibacterium или Peptostreptococcus.
17. Применение по п.14, где бактериальная инфекция представляет собой инфекцию уха, синусит, инфекцию верхних дыхательных путей, инфекцию нижних дыхательных путей, инфекцию половых органов, инфекцию кожи и мягких тканей или бактериальный эндокардит.
Текст
Изобретение направлено на определенные производные 2-(алкил)-3-[2-(5-фтор-4 пиримидинил)гидразино]-3-оксопропилгидроксиформамида, композиции, их содержащие,применение таких соединений для ингибирования активности бактериальной пептиддеформилазы(ПДФ) и при лечении бактериальных инфекций. Конкретно, настоящее изобретение направлено на соединения формулы (I), где R1, R2 и R3 определены в настоящем документе, и на их фармацевтически приемлемые соли. Соединения согласно этому изобретению являются ингибиторами бактериальной пептиддеформилазы и могут быть полезными при лечении бактериальных инфекций. Область техники, к которой относится изобретение Настоящее изобретение относится к определенным соединениям 2-(алкил)-3-[2-(5-фтор-4 пиримидинил)гидразино]-3-оксопропилгидроксиформамида, содержащим их композициям, применению таких соединений для ингибирования активности бактериальной пептиддеформилазы (ПДФ) и при лечении бактериальных инфекций. Предпосылки создания изобретения Синтез белка у бактерий начинается с N-формилметионил-тРНК (f-Met-tPHKi) и, как следствие, все вновь синтезированные полипептиды содержат N-формилметиониновый концевой участок (f-Met-pp)(схема I). Пептиддеформилаза (ПДФ) является металлоферментом, который удаляет N-формильную группу полипептидов по мере их появления из рибосомы в течение процесса элонгации [Adams, J. М.and Kaesberg, P. (1973) J. Mol. Biol. 79, 531-537]. В зависимости от природы их второй аминокислоты,полипептиды подвергаются дальнейшему процессингу метионинаминопептидазой (МАП) с образованием зрелого белка. Деформилирование играет незаменимую роль в созревании белка, поскольку МАП,фермент, существенный для роста бактерий, не может гидролизовать N-блокированные пептиды. Схема I. Роль ПДФ в синтезе белка ПДФ широко распространена в бактериях, причем в бактериальных геномах, секвенированных в настоящее время, присутствует по меньшей мере один pdf-ген. ПДФ не играет роли в эукариотическом цитоплазматическом синтезе белка, в котором Nформилирование не участвует, но белки ПДФ, кодируемые в ядре, содержащие сигнал локализации в хлоропластах/митохондриях, были идентифицированы в паразитах, растениях и млекопитающих, включая людей. ПДФ является существенной в органеллах растений и паразитов, поскольку их геномы кодируют ряд белков, для активности которых требуется деформилирование, но имеются данные, позволяющие предположить, что у животных этого нет. Фактически, исследования человеческой митохондриальной ПДФ показали, что она значительно менее активна, чем ее бактериальный аналог. Кроме того, ингибиторы ПДФ, активные против человеческого фермента ПДФ in vitro, не влияют на рост нормальных человеческих линий клеток [Nguyen, K. Т., Hu, X., Colton, С., Chakrabarti, R., Zhu, M. X. and Pei, D. (2003)Biochemistry 42, 9952-9958]. Таким образом, ингибиторы ПДФ представляют собой перспективный новый класс антибактериальных средств с новым механизмом действия, охватывающим широкий спектр патогенов. Ингибиторы ПДФ уже были описаны в данной области техники. Были поданы патентные заявки на производные гидразин-3-оксопропилгидроксиформамида следующей формулы, см. WO 03/101442 и WO 2006/055663. В частности, были предприняты попытки получать соединения, ингибирующие активность ПДФ, и в данной области техники был раскрыт целый ряд таких соединений. Тем не менее, продолжает оставаться потребность в таких ингибиторах ПДФ, которые можно применять для лечения бактериальных инфекций. Сущность изобретения Настоящее изобретение направлено на определенные производные 2-(алкил)-3-[2-(5-фтор-4 пиримидинил)гидразино]-3-оксопропилгидроксиформамида, содержащие их композиции, применение таких соединений для ингибирования активности бактериальной пептиддеформилазы (ПДФ) и для лечения бактериальных инфекций. Конкретно, настоящее изобретение направлено на конкретные представители соединений формулы (I) Один вариант настоящего изобретения представляет собой [(2R)-2-(циклопентилметил)-3-(2-5 фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3 оксопропил]гидроксиформамид формулы или его фармацевтически приемлемую соль. Другие варианты настоящего изобретения направлены на полиморфную форму 1, форму 2 и полиморфную форму 3 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Полиморфная форма 1 указанного соединения характеризуется данными ФТ-ИК-спектра фиг. 1,ФТ-рамановского спектра фиг. 3, порошковой рентгенограммой фиг. 6, термограммой дифференциальной сканирующей калориметрии фиг. 9 и записью термогравиметрического анализа фиг. 12. Полиморфная форма 2 указанного соединения характеризуется данными ФТ-ИК-спектра фиг. 2,ФТ-рамановского спектра фиг. 4, порошковой рентгенограммой фиг. 7, термограммой дифференциальной сканирующей калориметрии фиг. 10 и записью термогравиметрического анализа фиг. 13. Полиморфная форма 3 указанного соединения характеризуется данными ФТ-рамановского спектра фиг. 5, порошковой рентгенограммой фиг. 8, термограммой дифференциальной сканирующей калориметрии фиг. 11 и записью термогравиметрического анализа фиг. 14. Настоящее изобретние направлено также на фармацевтическую композицию, содержащую соединение согласно изобретению или его фармацевтически приемлемую соль. Настоящее изобретние касается применения соединения согласно изобретению или его фармацевтически приемлемой соли в терапии; применения соединения согласно изобретению или его фармацевтически приемлемой соли при лечении бактериальной инфекции; применения соединения согласно изобретению или его фармацевтически приемлемой соли в изготовлении лекарственного средства для применения при лечении бактериальной инфекции, причем бактериальная инфекция вызвана Streptococcus,Staphylococcus, Moraxella, Haemophilus, Neisseria, Mycoplasma, Legionella, Chlamydia, Bacteroides, Clostridium, Fusobacterium, Propionibacterium или Peptostreptococcus. Бактериальная инфекция представляет собой инфекцию уха, синусит, инфекцию верхних дыхательных путей, инфекцию нижних дыхательных путей, инфекцию половых органов, инфекцию кожи и мягких тканей или бактериальный эндокардит. Соединения согласно настоящему изобретению представляют собой ингибиторы бактериальной пептиддеформилазы и могут быть полезны для лечения указанных бактериальных инфекций. Краткое описание чертежей Фиг. 1 предоставляет ФТ-ИК-спектр полиморфной формы 1 [(2R)-2-(циклопентилметил)-3-(2-5 фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3 оксопропил]гидроксиформамида. Ось х дана в см-1, ось у представляет поглощение. Фиг. 2 предоставляет ФТ-ИК-спектр полиморфной формы 2 [(2R)-2-(циклопентилметил)-3-(2-5 фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3 оксопропил]гидроксиформамида. Ось х дана в см-1, ось у представляет поглощение. Фиг. 3 предоставляет ФТ-рамановский спектр полиморфной формы 1 [(2R)-2-(циклопентилметил)3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х дана в см-1, ось у представляет интенсивность. Фиг. 4 предоставляет ФТ-рамановский спектр полиморфной формы 2 [(2R)-2-(циклопентилметил)3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х дана в см-1, ось у представляет интенсивность. Фиг. 5 предоставляет ФТ-рамановский спектр полиморфной формы 3 [(2R)-2-(циклопентилметил)3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х дана в см-1, ось у представляет интенсивность. Фиг. 6 предоставляет порошковую рентгенограмму полиморфной формы 1 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х дана в градусах 2 тета, ось у представляет интенсивность. Фиг. 7 предоставляет порошковую рентгенограмму полиморфной формы 2 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинил гидразино)-3-оксопропил]гидроксиформамида. Ось х дана в градусах 2 тета, ось у представляет интенсивность. Фиг. 8 предоставляет порошковую рентгенограмму полиморфной формы 3 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинил гидразино)-3-оксопропил]гидроксиформамида. Ось х дана в градусах 2 тета, ось у представляет интенсивность. Фиг. 9 предоставляет термограмму дифференциальной сканирующей калориметрии (ДСК) полиморфной формы 1 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х представляет температуру (С), ось у представляет тепловой поток (Вт/г). Пик теплового потока при 132 С соответствует экзотермическому твердофазному преобразованию формы 1 в форму 3. Фиг. 10 предоставляет термограмму дифференциальной сканирующей калориметрии (ДСК) полиморфной формы 2 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х пред-2 018953 ставляет температуру (С), ось у представляет тепловой поток (Вт/г). Фиг. 11 предоставляет термограмму дифференциальной сканирующей калориметрии (ДСК) полиморфной формы 3 [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х представляет температуру (С), ось у представляет тепловой поток (Вт/г). Фиг. 12 предоставляет запись термогравиметрического анализа (ТГА) полиморфной формы 1 [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х представляет температуру (С), ось у представляет изменение массы (в %). Фиг. 13 предоставляет запись термогравиметрического анализа (ТГА) полиморфной формы 2 [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х представляет температуру (С), ось у представляет изменение массы (в %). Фиг. 14 предоставляет запись термогравиметрического анализа (ТГА) полиморфной формы 3 [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Ось х представляет температуру (С), ось у представляет изменение массы (в %). Подробное описание изобретения В описании настоящего изобретения химические элементы обозначены в соответствии с Периодической таблицей элементов. Аббревиатуры и символы, использованные в настоящем документе, согласуются с общей практикой применения таких аббревиатур и символов специалистами в химии и биологии. Конкретно, в примерах и везде в тексте настоящего описания могут быть использованы следующие аббревиатуры: г (граммы); кг (килограммы); л (литры); мкл (микролитры); М (молярный); мкМ (микромолярный); пМ (пикомолярный); мм (миллиметры); н (нормальный); в/в (внутривенный); МГц (мегагерц); ммоль (миллимоль); мин (минуты); т.кип. (точка кипения);DIPEA (диизопропилэтиламин); Все ссылки на эфир относятся к диэтиловому простому эфиру, а ссылки на раствор соли относятся к насыщенному водному раствору NaCl."Фармацевтически приемлемыми" называют те соединения, материалы, композиции и дозированные формы, которые, согласно здравому медицинскому смыслу, подходят для применения в контакте с тканями человека или животных без излишней токсичности, раздражения или других проблем или осложнений, соответственно разумному соотношению пользы и риска. Соединения Настоящее изобретение направлено на определенные производные соединений формулы I[(2R)-3-(2-2-хлор-5-фтор-6-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1 Н)-ил]-4-пиримидинилгидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид или их фармацевтически приемлемую соль. В определенных вариантах осуществления соединения согласно формуле I могут содержать кислотную функциональную группу. В определенных других вариантах осуществления соединения согласно формуле I могут содержать основную функциональную группу. Так, квалифицированному специалисту будет понятно, что можно получать соли соединения согласно формуле I. Действительно, в определенных вариантах осуществления настоящего изобретения соли соединения согласно формуле I могут быть более предпочтительными, чем соответствующие свободное основание или свободная кислота, поскольку, например, такие соли могут придавать молекуле большую стабильность или растворимость, тем самым облегчая изготовление дозированной формы. Согласно этому, настоящее изобретение также направлено на фармацевтически приемлемые соли соединений согласно формуле I. Обзор подходящих солей см. у Berge et al, J. Pharm. Sci., 1977, 66, 1-19. Соли кислот. Подходящие кислотно-аддитивные соли образуют из кислот, которые образуют нетоксичные соли и примерами которых являются гидрохлорид, гидробромид, гидройодид, сульфат, бисульфат, нитрат, фосфат, гидрофосфат, ацетат, малеат, малат, фумарат, малонат, лактат, тартрат, цитрат,формиат, глюконат, сукцинат, пируват, оксалат, оксалоацетат, трифторацетат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, метансульфоновая соль, этансульфоновая соль, п-толуолсульфоновая соль и изетионат. Соли оснований. Фармацевтически приемлемые соли оснований включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли органических оснований, включая соли первичных, вторичных и третичных аминов, таких как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и Nметил-D-глюкамин. Термин "фармацевтически приемлемые соли", используемый в настоящем документе, относится к солям, которые сохраняют желаемую биологическую активность соединения, являющегося предметом настоящего изобретения, и проявляют минимальные нежелательные токсикологические эффекты. Эти фармацевтически приемлемые соли могут быть получены in situ при конечном выделении и очистке данного соединения или посредством отдельной реакции очищенного соединения в виде его свободной кислоты или свободного основания с подходящим основанием или кислотой соответственно. Термин "соединения согласно настоящему изобретению", использованный в настоящем документе,означает как соединения согласно формуле I, так и их соли, включая фармацевтически приемлемые соли. Термин "соединение согласно настоящему изобретению", также появляющийся в настоящем документе,относится как к соединению согласно формуле I, так и к его солям, включая фармацевтически приемлемые соли. Соединения согласно настоящему изобретению могут существовать в твердой или жидкой форме. В твердом состоянии соединения согласно настоящему изобретению могут существовать в кристаллической или некристаллической форме или в виде их смеси. Квалифицированному специалисту будет понятно, что для соединений согласно настоящему изобретению, находящихся в кристаллической форме,могут быть образованы фармацевтически приемлемые сольваты, в которых молекулы растворителя являются включенными в кристаллическую решетку при кристаллизации. Сольваты могут содержать неводные растворители, такие как этанол, изопропанол, DMSO, уксусная кислота, этаноламин и этилацетат, или они могут содержать воду в качестве растворителя, который включен в кристаллическую решетку. Сольваты, в которых растворителем, включенным в кристаллическую решетку, является вода, обычно называют "гидратами". К гидратам относятся стехиометрические гидраты, а также композиции, содержащие переменные количества воды. Настоящее изобретение включает все такие сольваты. Кроме того, квалифицированному специалисту будет понятно, что определенные соединения согласно настоящему изобретению, существующие в кристаллической форме, включая их различные сольваты, могут демонстрировать полиморфизм (т.е. способность появляться в разных кристаллических структурах). Эти разные кристаллические формы обычно известны как "полиморфы". Настоящее изобретение включает все такие полиморфы. Полиморфы имеют один и тот же химический состав, но различаются упаковкой, геометрическим расположением и другими характерными свойствами кристаллического твердого состояния. Поэтому полиморфы могут иметь разные физические свойства, такие как внешняя форма, плотность, твердость, деформируемость, стабильность и растворимость. Полиморфы обычно демонстрируют разные точки плавления, ИК-спектры и порошковые рентгенограммы, что можно применять для идентификации. Квалифицированному специалисту будет понятно, что различные полиморфы можно производить, например, посредством изменения или регулирования условий реакции или реагентов, применяемых для получения соединения, или посредством разных процедур выделения и очистки. Например, изменения температуры, давления или растворителя могут в результате приводить к полиморфам. Кроме того, при определенных условиях один полиморф может спонтанно превращаться в другой полиморф. Один вариант осуществления настоящего изобретения представляет собой [(2R)-2-(циклопентил-7 018953 или его фармацевтически приемлемая соль. Получение соединений Соединения согласно формуле I получают, применяя традиционные методики органического синтеза. Подходящие пути синтеза описаны ниже в следующих общих реакционных схемах. Квалифицированному специалисту будет понятно, что если некоторый заместитель, описанный в настоящем документе, несовместим с методами синтеза, описанными в настоящем документе, то этот заместитель можно защищать подходящей защитной группой, устойчивой в реакционных условиях. Защитную группу можно удалять в подходящий момент реакционной последовательности, предоставляя желаемое промежуточное соединение или соединение, являющееся целью синтеза. Подходящие защитные группы и способы введения защиты и снятия защиты различных заместителей, выполняемые с использованием таких подходящих защитных групп, хорошо известны специалистам в данной области; соответствующие примеры можно найти в Т. Greene and P. Wuts, Protecting Groups in Chemical Synthesis(3rd ed.), John WileySons, NY (1999). В некоторых случаях заместитель можно подбирать специально,так чтобы он оказался реакционноспособным в применяемых условиях реакции. В этих обстоятельствах реакционные условия преобразуют выбранный заместитель в другой заместитель, который либо полезен в качестве промежуточного соединения, либо желателен как заместитель в конечном соединении синтеза. Схема 1 Как показано на схеме 1, соединение (11) можно получать по реакции соответствующего хлорангидрида кислоты (2) с хиральным агентом, таким как (S)-(-)-4-бензил-2-оксазолидинон (хиральный оксазолидинон Эванса), в присутствии основания, такого как н-бутиллитий, для получения хирального промежуточного соединения (3). Обработка соединения (3) основанием, таким как диизопропилэтиламин, в присутствии хелатирующего агента, такого как тетрахлорид титана, в растворителе, таком как тетрагидрофуран, с последующим добавлением электрофила, такого как бензилоксиметилхлорид, предоставляет соединение (4). Преобразование соединения (4) в соответствующую гидроксикислоту (7) может быть достигнуто посредством последовательности, включающей окислительное расщепление хирального оксазолидинона с использованием, например, Н 2 О 2 и гидроксида лития, до соответствующего промежуточного соединения (5) с последующим гидрогенолизом для получения промежуточного соединения (7). Соединение (3) можно также преобразовывать в промежуточное соединение (7) в альтернативной двустадийной процедуре. Для этого преобразования (3) можно обрабатывать основанием, таким как диизопропилэтиламин, в присутствии хелатирующего агента, такого как тетрахлорид титана, в растворителе,таком как тетрагидрофуран, с последующим добавлением триоксана или подходящего альтернативного эквивалента формальдегида для получения соединения (6), которое затем подвергают окислительному расщеплению хирального оксазолидинона с использованием, например, Н 2 О 2 и гидроксида лития до соответствующей кислоты (7). Конденсация кислоты (7) с бензилоксиамином в присутствии конденсирующих агентов, таких какEDC и DMAP, дает амид (8). Последний может быть циклизован до азетидин-2-она (9) в условиях реакции Мицунобу. Гидролиз азетидин-2-она (9) с использованием, например, гидроксида лития в подходящем растворителе дает соответствующую кислоту (10). Преобразование соединения (10) в продукт (11) может быть достигнуто с использованием соответствующего формилирующего агента, такого как муравьиная кислота/уксусный ангидрид или метилформиат, без растворителя или в соответствующем рас-8 018953 Как показано на схеме 2, защищенное ТНР промежуточное соединение (15) можно получать гидрированием азетидин-2-она (9), применяя катализатор, такой как 10% Pd/C, в соответствующем растворителе, таком как этанол, для получения соединения (12). Обработка соединения (12) дигидропираном в присутствии кислотного катализатора, такого как толуолсульфонат пиридиния, в соответствующем растворителе, таком как метиленхлорид, предоставляет ТНР-защищенный азетидин-2-он (13). Гидролиз азетидин-2-она (13) с применением, например, гидроксида лития в подходящем растворителе дает соответствующую кислоту (14). Преобразование соединения (14) в продукт (15) может быть достигнуто с применением подходящего формилирующего агента, такого как муравьиная кислота с уксусным ангидридом или метилформиат, без растворителей или в соответствующем растворителе, таком как дихлорметан. Преобразование соединения (14) в продукт (15) может быть также осуществлено с применением 5 метил-2-тиоксо-[1,3,4]тиадиазол-3-карбальдегида (Yazawa, Hisatoyo; Goto, Shunsuke; Tetrahedron Lett. 26; 31; 1985; 3703-3706) как формилирующего агента в соответствующем растворителе, таком как ацетон. Промежуточное соединение (15) можно также получать согласно литературным процедурам Как показано на схеме 3, конденсация хиральной кислоты (11 или 15) с пиримидинилгидразином(16, R2 = алкил, галоген, Н), с использованием условий, таких как EDC-HOAt-NMM, дает гидразид (17 или 18). Конечное снятие защиты (гидрогенолиз с применением катализатора, такого как 10% Pd/C, в соответствующем растворителе, таком как этанол, если Р представляет собой Bn; обработка 80%-ной уксусной кислотой в воде при комнатной температуре или 40 С, если Р представляет собой ТНР) дает желаемое конечное соединение (1), где R2 = алкил, галоген, Н. Специалисты в данной области могут получать гидразины общей структуры (16) согласно литературным методикам. Следующие ниже примеры конкретных структур гидразинов (16) и методик синтеза,применяемых для их получения, являются чисто иллюстративными и не предусматривают ограничения объема настоящего изобретения. Гидразины (24), где R2 представляет собой алкил и R3 представляет собой аминогруппу (R4R5N),можно получать из подходящих предшественников, как показано на схеме 4. Схема 4 Как показано на схеме 4, гидразин (24), когда R2 представляет собой водород или алкил, можно получать конденсацией коммерчески доступного фтормалоната (19) и подходящего амидина (20) в основных условиях, что дает пиримидинон (21). Амидины (20) являются коммерчески доступными или же специалисты в данной области могут их получать согласно литературным методикам. Обработка пиримидинона (21) POCl3 дает дихлорпиримидин (22). Обработка дихлорпиримидина (22) желаемым аминомR4R5NH при комнатной температуре в соответствующем растворителе, таком как метанол или DMSO, с последующей дальнейшей обработкой моногидратом гидразина в соответствующем растворителе, таком как DMSO, обычно с нагреванием, дает затем желаемый продукт (24), где R2 представляет собой водород или алкил. Гидразины формулы (30) [ (16), в которой R2 = хлор] можно получать как показано на схемах 5 или Конденсация коммерчески доступного фтормалоната (19) и мочевины в основных условиях предоставляет пиримидинон (25). Обработка пиримидинона (25) POCl3 предоставляет трихлорпиримидин (26). Обработка трихлорпиримидина (26) Вос-защищенным гидразином и диизопропилэтиламином при комнатной температуре в соответствующем растворителе, таком как THF, предоставляет промежуточное соединение (27). Дальнейшая обработка ди-трет-бутилдикарбонатом в присутствии диизопропилэтиламина и DMAP в соответствующем растворителе, таком как метиленхлорид, предоставляет затем желаемый три-Вос-защищенный продукт (28). Обработка (28) амином R4R5NH, в подходящем растворителе,таком как DMF, предоставляет пиримидин (29), и снятие защиты (29) в кислых условиях с последующей обработкой основанием предоставляет желаемые гидразины (30). Альтернативно, гидразины формулы (30) можно получать так, как показано на схеме 6. Схема 6 Обработка трихлорпиримидина (26) желаемым амином R4R5NH при комнатной температуре в соответствующем растворителе, таком как DMSO, с последующей дальнейшей обработкой моногидратом гидразина и нагреванием, предоставляет желаемый продукт (30), а также региоизомерный продукт (32). Два региоизомера обычно можно разделять хроматографически, например, посредством ВЭЖХ. Конечные соединения (1), где R2 представляет собой тиометил или метоксигруппу, можно получать так, как показано на схеме 7. Схема 7 Конденсация коммерчески доступного фтормалоната (19) и O-полусульфата метилизомочевины или полусульфата S-метилизотиомочевины в основных условиях предоставляет пиримидинон (33), в котором R2 представляет собой метоксигруппу или тиометил соответственно. Обработка пиримидинона для предоставления промежуточного соединения (36). Добавление R4R5NH к промежуточному соединению (36) предоставляет О-Bn-защищенный или О-ТНР-защищенный продукт (37). Конечное снятие защиты, проводимое либо посредством гидрогенолиза с применением катализатора, такого как 10% Pd/C, в соответствующем растворителе, таком как этанол, если Р представляет собой Вn; либо посредством обработки 80%-ной уксусной кислотой в воде при комнатной температуре или 40 С, если Р представляет собой ТНР, дает конечные желаемые соединения (1), когда R2 представляет собой метоксигруппу или тиометил, соответственно. Амины R4R5NH могут быть приобретенными из доступных коммерческих источников, полученными специалистом в данной области по литературным методикам или полученными так, как раскрыто в примерах, приведенных в настоящем документе. Способы применения Соединения согласно настоящему изобретению являются ингибиторами микробиальной пептиддеформилазы (ПДФ), и поэтому они способны предотвращать бактериальный рост. Эти соединения потенциально полезны при лечении инфекционных заболеваний, где основная патология является (по меньшей мере, частично) обусловленной (т.е. вызванной) разнообразными прокариотическими организмами. Примеры этого включают, но не ограничиваются ими, грамположительные и грамотрицательные аэробные и анаэробные бактерии из родов Streptococcus, например, S. pneumoniae и S. pyogenes, Staphylococcus, например, S. aureus, S. epidermidis и S. saprophyticus, Moraxella, например, M. catarrhalis, Haemophilus, например, Н. influenzae, Neisseria, Mycoplasma, например, M. pneumoniae, Legionella, например, L.pneumophila, Chlamydia, например, С. pneumoniae, Bacteroides, Clostridium, Fusobacterium, Propionibacterium и Peptostreptococcus. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Streptococcus, более подходящим образом, S. pneumoniae или S. pyogenes. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Staphylococcus, более подходящим образом, S. aureus, S.epidermidis или S. saprophyticus. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Moraxella, более подходящим образом, М. catarrhalis. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Haemophilus, более подходящим образом, Н. influenzae. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Neisseria. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Mycoplasma, более подходящим образом, М. pneumoniae. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Legionella, более подходящим образом, L. pneumophila. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Chlamydia, более подходящим образом, С. pneumoniae. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Bacteroides. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Clostridium. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Fusobacterium. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Propionibacterium. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными при лечении бактериальных инфекций, вызванных Peptostreptococcus. Соединения согласно настоящему изобретению могут также быть полезными при лечении бактериальных инфекций, вызванных бактериями, резистентными к антибиотикам из классов -лактамов, хинолонов, макролидов, кетолидов, гликопептидов и оксазолидинонов. Такие лекарственно-резистентные бактериальные инфекции включают, но не ограничиваются ими, S. pneumoniae, резистентный к пенициллину, макролидам или левофлоксацину; S. aureus, резистентный к метициллину или макролидам и промежуточно резистентный к ванкомицину; S. epidermidis, резистентный к метициллину; и S. aureus,резистентный к оксазолидинону. Соединения согласно настоящему изобретению могут быть полезными для лечения бактериальных инфекций у млекопитающих, конкретно у людей. Такие инфекции включают, но не ограничиваются ими,инфекции уха, синусит, инфекции верхних и нижних дыхательных путей, инфекции половых органов,инфекции кожи и мягких тканей и бактериальный эндокардит. Соединения согласно настоящему изобретению могут также быть полезными для предупреждения бактериальной инфекции, такой как бактери- 11018953 альная инфекция, обусловленная медицинскими или стоматологическими процедурами у млекопитающих, конкретно у людей. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения инфекций уха. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения синусита. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения инфекций верхних и нижних дыхательных путей. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения инфекций половых органов. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения инфекций кожи и мягких тканей. Подходящим образом, соединения согласно настоящему изобретению могут быть полезными для лечения бактериального эндокардита. Способы лечения согласно настоящему изобретению, конкретно, способы лечения инфекционных заболеваний, включая бактериальные инфекции, включают введение эффективного количества соединения согласно формуле I или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом. Один вариант осуществления настоящего изобретения предоставляет способ лечения бактериальной инфекции у людей, включающий введение [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил] гидроксиформамида или его фармацевтически приемлемой соли человеку, нуждающемуся в этом. Другой вариант осуществления настоящего изобретения предоставляет способ лечения бактериальной инфекции у людей, включающий введение [(2R)-3-(2-2-хлор-6-[(2R)-2,4-диметил-1-пиперазинил]-5 фтор-4-пиримидинилгидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамида или его фармацевтически приемлемой соли человеку, нуждающемуся в этом. Другой вариант осуществления настоящего изобретения предоставляет способ лечения бактериальной инфекции у людей, включающий введение [(2R)-2-(циклопентилметил)-3-(2-6-[(2R)-2,4-диметил-1 пиперазинил]-5-фтор-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида или его фармацевтически приемлемой соли человеку, нуждающемуся в этом. Другой вариант осуществления настоящего изобретения предоставляет способ лечения бактериальной инфекции у людей, включающий введение [(2R)-3-2-[2-хлор-5-фтор-6-(4-метил-4,7-диазаспиро[2.5] окт-7-ил)-4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил]гидроксиформамида или его фармацевтически приемлемой соли человеку, нуждающемуся в этом. Другой вариант осуществления настоящего изобретения предоставляет способ лечения бактериальной инфекции у людей, включающий введение 2R)-2-(циклопентилметил)-3-2-[5-фтор-2-метил-6-(4 метил-4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-3-оксопропил)гидроксиформамида или его фармацевтически приемлемой соли человеку, нуждающемуся в этом. Термин "инфекционное заболевание", используемый в настоящем документе, относится к любому заболеванию, характеризующемуся наличием микробной инфекции, такой как бактериальная инфекция. Термин "лечить", используемый в настоящем документе, в ссылке на некоторое патологическое состояние означает: (1) улучшать или предупреждать это состояние или одно или более из биологических проявлений этого состояния, (2) препятствовать (а) одной или более стадиям в биологическом каскаде,который ведет к патологическому состоянию или является ответственным за него, или (b) одному или более биологическим проявлениям патологического состояния, (3) облегчать один или более из симптомов или эффектов, связанных с патологическим состоянием, или (4) замедлять развитие патологического состояния или одного или более из биологических проявлений патологического состояния. Как указано выше, "лечение" некоторого патологического состояния включает предупреждение этого состояния. Квалифицированному специалисту будет понятно, что "предупреждение" не является абсолютным термином. В медицине "предупреждение" понимают как профилактическое введение лекарственного средства для существенного снижения вероятности или тяжести патологического состояния или его биологического проявления или для задержки появления такого состояния или его биологического проявления. Термин "эффективное количество", используемый в настоящем документе, в ссылке на некоторое соединение согласно настоящему изобретению означает количество этого соединения, достаточное для лечения патологического состояния у пациента, но достаточно малое для того, чтобы избегать серьезных побочных эффектов (при разумном соотношении пользы и риска), согласно медицинскому здравому смыслу. Эффективное количество соединения будет варьировать в зависимости от выбора конкретного соединения (например, с учетом силы действия, эффективности и периода полужизни этого соединения); выбранного пути введения; патологического состояния, подвергаемого лечению; тяжести патологического состояния, подвергаемого лечению; возраста, роста, массы тела и физического состояния пациента,подвергаемого лечению; медицинского анамнеза у пациента, подвергаемого лечению; продолжительности лечения; природы сочетанной терапии; желаемого терапевтического эффекта; и т.п., и обычно оно может быть определено квалифицированным специалистом. Термин "пациент", используемый в настоящем документе, относится к человеку или другому млекопитающему. Соединения согласно настоящему изобретению можно вводить подходящим путем введения, включая как системное введение, так и местное введение. Системное введение включает пероральное введение, парентеральное введение, трансдермальное введение, ректальное введение и введение посредством ингаляции. Парентеральное введение относится к пути введения, отличному от энтерального, трансдермального или ингаляционного, и осуществляемому посредством инъекции или вливания. Парентеральное введение включает внутривенную, внутримышечную и подкожную инъекцию или вливание. Ингаляцией называют введение в легкие пациента, осуществляемое как через рот, так и через носовые ходы. Местное введение включает нанесение на кожу, а также внутриглазное, интравагинальное или интраназальное введение. Соединения согласно настоящему изобретению можно вводить однократно или согласно режиму дозирования, при котором ряд доз вводят через различные интервалы времени в течение данного периода времени. Например, дозы можно вводить один, два, три или четыре раза в день. Дозы можно вводить до тех пор, пока не будет достигнут желаемый терапевтический эффект, или неопределенно долго для поддержания желаемого терапевтического эффекта. Подходящие режимы дозирования для соединения согласно настоящему изобретению зависят от фармакокинетических свойств соединения, таких как абсорбция, распределение и период полужизни, которые может определить квалифицированный специалист. Кроме того, подходящие режимы дозирования, включая продолжительность таких режимов для соединения согласно настоящему изобретению, зависят от состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста и физического состояния пациента, подвергаемого лечению, медицинского анамнеза пациента, подвергаемого лечению, природы сочетанной терапии, желаемого терапевтического эффекта и т.п. факторов, входящих в сферу компетенции и опыта квалифицированного специалиста. Кроме того, такому квалифицированному специалисту будет понятно, что для адаптации к данной индивидуальной реакции пациента на режим дозирования или в связи с тем, что индивидуальные потребности пациента меняются со временем, могут потребоваться соответствующие согласованные изменения подходящих режимов дозирования. Типичные дневные дозы могут варьировать в зависимости от выбора конкретного пути введения. Типичные дневные дозы для перорального введения человеку с массой тела, приблизительно равной 70 кг, могли бы находиться в диапазоне от 50 мг до 3 г, подходящим образом, от 100 мг до 2 г соединения согласно настоящему изобретению в день. Кроме того, соединения согласно настоящему изобретению можно вводить в виде пролекарств. Термин "пролекарство" соединения согласно настоящему изобретению, используемый в настоящем документе, относится к функциональному производному соединения, которое, после введения пациенту, со временем высвобождает соединение согласно настоящему изобретению in vivo. Введение соединения согласно настоящему изобретению в виде пролекарства может дать возможность квалифицированному специалисту совершать одно или более из следующих действий: (а) изменять момент появления данного соединения in vivo; (b) изменять продолжительность действия данного соединения in vivo; (с) изменять транспорт или распределение данного соединения in vivo; (d) изменять растворимость данного соединения in vivo; и (е) преодолевать побочный эффект или другие трудности, характерные для данного соединения. Типичные функциональные производные, применяемые для изготовления пролекарств, включают такие модификации соединения, которые in vivo отщепляются химическими или ферментативными способами. Такие модификации, которые включают получение фосфатов, амидов, сложных эфиров, сложных тиоэфиров, карбонатов и карбаматов, хорошо известны специалистам в данной области. Настоящее изобретение также предоставляет соединение согласно настоящему изобретению для применения в медицинской терапии, в частности, при бактериальных инфекциях. Таким образом, в следующем аспекте настоящее изобретение направлено на применение соединения согласно формуле I или его фармацевтически приемлемой соли при изготовлении лекарственного средства для лечения бактериальных инфекций. Как указано выше, соединения согласно формуле I являются ингибиторами ПДФ и могут быть полезными для лечения бактериальных инфекций. Биологическую активность соединения согласно формуле I можно определять, применяя подходящие методики анализа, такие как измерение ингибирования ферментативной активности ПДФ и оценка способности соединений ингибировать бактериальный ростin vitro или в моделях с инфекцией у животных. Определенные примеры согласно настоящему изобретению обладают большей антибактериальной активностью in vitro (MIC и/или MIC90) и/или лучшей эффективностью in vivo, чем примеры из WO 03/101442. Эти примеры включают, но не ограничиваются ими, следующие соединения:[(2R)-3-2-[2-хлор-5-фтор-6-(4-метил-4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-2(циклопентилметил)-3-оксопропил]гидроксиформамид и 2R)-2-(циклопентилметил)-3-2-[5-фтор-2-метил-6-(4-метил-4,7-диазаспиро[2.5]окт-7-ил)-4 пиримидинил]гидразино-3-оксопропил)гидроксиформамид. Определение IC50 для ПДФ Ферментативную активность ПДФ измеряли, применяя сопряженный тест с формиатдегидрогеназой (ФДГ) [Lazennec and Meinnel (1997) Anal. Biochem. 244, 180-182]. Как только ПДФ высвобождает формиат из метионина, его окисляет ФДГ, тем самым восстанавливая одну молекулу NAD до NADH, в результате чего увеличивается поглощение при 340 нм. Реакцию запускали добавлением ПДФ в микротитровальные планшеты, содержавшие все другие реакционные компоненты, и проводили непрерывный мониторинг в течение 20 мин при 25 С. Конечный реакционный состав для теста ПДФ Staphylococcusaureus (SaPDF) был следующим: 50 мМ фосфата калия, рН 7,6,5 единиц/мл ФДГ, 7 мМ NAD, 5% DMSO,1 нМ SaPDF и 2,9 мМ формил-Met-Ala-Ser в общем объеме 50 мкл. Серийные разбавления ингибиторов проводили в DMSO. Реагенты и формат теста были такими же и для ПДФ Haemophilias influenzae, за исключением того, что конечная концентрация формил-Met-Ala-Ser составляла 6 мМ. При определении ПДФ Streptococcus pneumoniae реакционные условия были похожими, но применяли 30 пМ фермента, 2 мМ NAD и 4 мМ формил-Met-Ala-Ser. Изменения концентраций формил-Met-Ala-Ser отражают различия в значениях Kм для субстрата, полученных с различными изоферментами ПДФ. Значения IC50 определяли аппроксимацией уравнением: % ингибирования = 100/1+(IC50/[I])S, где s представляет собой фактор наклона, I представляет собой концентрацию ингибитора и IC50 представляет собой такую концентрацию соединения, которая вызывает 50% ингибирования. Результаты Соединения примеров 1-281 ингибируют активность ПДФ S. aureus, H. influenzae и S. pneumoniae со значениями IC50100 нМ. Определение антимикробной активности Цельноклеточную антимикробную активность определяли микроразбавлением бульона, применяя методологию, рекомендованную Clinical and Laboratory Standards Institute (CLSI, прежде NCCLS)(NCCLS-Документ M7-A6 от "Methods for Dilution Susceptibility Tests for Bacteria that Grow Aerobically Approved Standard Sixth Edition", 2003). Соединения испытывали в серийных двукратных разведениях в диапазоне от 64 до 0,06 мкг/мл. В данном тесте оценивали набор из 12 штаммов. Этот набор состоял из следующих лабораторных штаммов: Staphylococcus aureus Oxford, Staphylococcus aureus WCUH29, Enterococcus faecalis I, Enterococcus faecalis 7, Haemophilus influenzae Q1, Haemophilus influenzae NEMC1,Moraxella catarrhalis 1502, Streptococcus pneumoniae 1629, Streptococcus pneumoniae N1387, Streptococcuspneumoniae Ery2, Escherichia coli 7623 (AcrABEFD+) и Escherichia coli 120 (AcrAB-). Минимальную ингибирующую концентрацию (MIC) определяли как наименьшую концентрацию соединения, ингибировавшую видимый рост. Определение конечной точки MIC проводили с помощью зеркального ридера. Результаты Каждое из соединений примеров 1-281 имеет минимальную ингибирующую концентрацию (MIC)4 мкг/мл против по меньшей мере одного из организмов, перечисленных выше. По меньшей мере для одного штамма каждого организма из перечисленных выше по меньшей мере одно соединение из примеров имело MIC4 мкг/мл, за исключением Enterococcus faecalis I и Enterococcus faecalis 7, для которых большинство соединений примеров имели значения MIC16 мкг/мл. Данные антимикробной активности (значения MIC в мкг/мл) для конкретных соединений примеров даны в табл.2. значения MIC выражены как среднее всех полученных результатов Модели инфекций у животных Все процедуры проводили в соответствии с протоколами, одобренными Комитетом по надзору за содержанием животных и их использованием Института GSK; эти процедуры соответствовали стандартам American Association for the Accreditation of Laboratory Animal Care (AAALAC) of the United StatesDepartment of Health и Human Services и всем местным и федеральным законам о содержании животных или были даже более строгими. Модель инфекции дыхательных путей у крыс (RTI) с Н. influenzae или S. pneumoniae. В этой модели анестезированных крыс (самцы Sprague Dawley [Crl:CD (SD] 100 г) (Charles River) инфицировали посредством интрабронхиальной инстилляции 2-3106 бактериальных КОЕ (колониеобразующих единиц) на крысу в 100 мкл агара прямо в легкие [G. Smith (1991) Lab Animals, vol 25, 46-49]. Животным (n = 6 на группу) вводили дозы с различными количествами соединения (двукратные разведения в диапазоне от 37,5 до 300 мг/кг) посредством перорального желудочного зонда дважды в день в течение 4 дней, начиная через 1 ч после инфицирования. Контрольным животным вводили дозы с разбавителем по той же схеме. Крыс подвергали эвтаназии через 96 ч после инфицирования и асептически удаляли легкие, которые гомогенизировали в 1 мл стерильного физиологического раствора в гомогенизаторе Stomacher. Для подсчета числа жизнеспособных бактерий выполняли десятикратные серийные разведения в стерильном физиологическом растворе. Было показано, что эта модель инфекции легких у крыс способна предсказывать эффективность у человека при внебольничной пневмонии (САР), вызванной S. pneumoniae [HooverJ. L, С. Mininger, R. Page, R. Straub, S. Rittenhouse and D. Payne. (2007). Abstract A-17. Proceedings of the 47th ICAAC, Chicago, Illinois]. Модель инфекции кожи и мягких тканей с абсцессом в паху у мыши, обусловленной S. aureus(SSTI). В этой модели анестезированных мышей (самцы CD1, 20 г) (Charles River) инфицировали S.Med Chem., 45, 1959-1962). Животным (n = 6 на группу) вводили дозы с различными количествами соединения (2-кратные разведения в диапазоне от 37,5 до 300 мг/кг) посредством перорального желудочного зонда дважды в день, начиная через 1 ч после инфицирования. Контрольным животным вводили дозы с разбавителем по той же схеме. Мышей подвергали эвтаназии через 96 ч после инфицирования и асептически удаляли и гомогенизировали абсцессы. Для подсчета числа жизнеспособных бактерий выполня- 15018953 ли десятикратные разбавления в стерильном физиологическом растворе. Результаты Некоторые из соединений примеров, описанных в настоящем документе, демонстрировали пероральную эффективность в одной или более из вышеуказанных моделей инфекции у животных, уменьшая число бактерий, выделяемых из легких и абсцессов, по сравнению с животными, не подвергавшимися лечению, более чем на три порядка величины ( 3 log10 KOE/мл). Композиции Соединения согласно настоящему изобретению обычно, но не обязательно, будут изготавливать в виде фармацевтических композиций до введения пациенту. Согласно этому, в другом аспекте настоящее изобретение направлено на фармацевтические композиции, содержащие соединение согласно настоящему изобретению и один или более из фармацевтически приемлемых эксципиентов. Фармацевтические композиции согласно настоящему изобретению можно получать и расфасовывать в недозированной форме, а эффективное количество соединения согласно настоящему изобретению можно отбирать и затем давать пациенту, как это делают с порошками и сиропами. Альтернативно, фармацевтические композиции согласно настоящему изобретению можно получать и расфасовывать в единичной дозированной форме, где каждая физически отдельная единица содержит безопасное и эффективное количество соединения согласно настоящему изобретению. Фармацевтические композиции согласно настоящему изобретению, полученные в единичной дозированной форме, обычно содержат от 25 мг до 1,5 г, подходящим образом, от 100 до 500 мг, соединения согласно настоящему изобретению. Фармацевтические композиции согласно настоящему изобретению обычно содержат одно соединение согласно настоящему изобретению. Однако в определенных вариантах осуществления, фармацевтические композиции согласно настоящему изобретению могут содержать более одного соединения согласно настоящему изобретению. Например, в определенных вариантах осуществления фармацевтические композиции согласно настоящему изобретению могут содержать два соединения согласно настоящему изобретению. Кроме того, фармацевтические композиции согласно настоящему изобретению могут, необязательно дополнительно содержать одно или более дополнительных фармацевтически активных соединений. Термин "фармацевтически приемлемый эксципиент", используемый в настоящем документе, означает фармацевтически приемлемые материал, композицию или среду, которые, например, участвуют в придании формы и консистенции фармацевтической композиции. Каждый эксципиент, когда его смешивают, должен быть совместимым с другими ингредиентами фармацевтической композиции, - во избежание таких взаимодействий, которые существенно снизили бы эффективность соединения согласно настоящему изобретению, когда его вводят пациенту, и таких взаимодействий, результатом которых были бы фармацевтические композиции, которые не являются фармацевтически приемлемыми. Кроме того,каждый эксципиент, чтобы быть фармацевтически приемлемым, конечно, должен быть достаточно высоко очищенным. Соединение согласно настоящему изобретению и фармацевтически приемлемый эксципиент или эксципиенты обычно будут изготавливать в виде дозированной формы, приспособленной для введения пациенту посредством желаемого пути введения. Например, дозированные формы включают формы,приспособленные(2) для парентерального введения, такие как стерильные растворы, суспензии и порошки для реконструкции; (3) для трансдермального введения, такие как трансдермальные пластыри;(4) для ректального введения, такие как суппозитории; (5) для ингаляции, такие как сухие порошки,аэрозоли, суспензии и растворы; и (6) для местного введения, такие как кремы, мази, лосьоны, растворы,пасты, спреи, пены и гели. Подходящие фармацевтически приемлемые эксципиенты будут различными в зависимости от выбора конкретной дозированной формы. Кроме того, для конкретной функции, выполняемой в композиции, могут быть выбраны подходящие фармацевтически приемлемые эксципиенты. Например, определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности облегчать производство однородных дозированных форм. Определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности облегчать перенос или транспорт соединения или соединений согласно настоящему изобретению, уже введенных пациенту, из одного органа или части тела в другой орган или другую часть тела. Определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие того, что они помогают пациенту соблюдать режим лечения. Подходящие фармацевтически приемлемые эксципиенты включают следующие типы эксципиентов: разбавители, наполнители, связующие, дезинтегранты, лубриканты, глиданты, гранулирующие средства, средства для покрытий, увлажнители, растворители, сорастворители, суспендирующие средства, эмульгаторы, подсластители, отдушки, средства, маскирующие запах и/или вкус, красители, средства,предотвращающие спекание, гигроскопические средства, хелатирующие агенты, пластификаторы, средства, повышающие вязкость, антиоксиданты, консерванты, стабилизаторы, поверхностно-активные ве- 16018953 щества и буферные вещества. Квалифицированному специалисту будет понятно, что определенные фармацевтически приемлемые эксципиенты могут выполнять более одной функции и могут выполнять альтернативные функции в зависимости от того, какое количество эксципиента присутствует в рецептуре и какие другие ингредиенты присутствуют в рецептуре. Квалифицированные специалисты обладают знаниями и квалификацией в данной области, которые дают им возможность выбирать подходящие фармацевтически приемлемые эксципиенты в подходящем количестве для применения в настоящем изобретении. Кроме того, имеется ряд источников, доступных квалифицированному специалисту, которые описывают фармацевтически приемлемые эксципиенты и могут быть полезными при выборе подходящих фармацевтически приемлемых эксципиентов. Примеры включают Remington's Pharmaceutical Sciences (Mack Publishing corporation The Handbook of Pharmaceutical Additives (Gower Publishing Limited) и The Handbook of Pharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press). Фармацевтические композиции согласно настоящему изобретению получают, применяя технику и способы, известные специалистам в данной области. Некоторые из способов, обычно применяемых в данной области, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Company). В одном аспекте настоящее изобретение направлено на твердую пероральную дозированную форму, такую как таблетка или капсула, содержащие безопасное и эффективное количество соединения согласно настоящему изобретению и разбавитель или наполнитель. Подходящие разбавители и наполнители включают лактозу, сахарозу, декстрозу, маннит, сорбит, крахмал (например, кукурузный крахмал,картофельный крахмал и пептизированный крахмал), целлюлозу и ее производные (например, микрокристаллическую целлюлозу), сульфат кальция и двухосновный фосфат кальция. Пероральная твердая дозированная форма может также содержать связующее. Подходящие связующие включают крахмал(например, кукурузный крахмал, картофельный крахмал и пептизированный крахмал), желатин, камедь акации, альгинат натрия, альгиновую кислоту, трагакант, гуаровую смолу, повидон и целлюлозу и ее производные (например, микрокристаллическую целлюлозу). Кроме того, пероральная твердая дозированная форма может содержать дезинтегрант. Подходящие дезинтегранты включают кросповидон, крахмальный гликолат натрия, кроскармелозу, альгиновую кислоту и натриевую соль карбоксиметилцеллюлозы. Кроме того, пероральная твердая дозированная форма может содержать лубрикант. Подходящие лубриканты включают стеариновую кислоту, стеарат магния, стеарат кальция и тальк. Там, где это уместно, препараты дозированных единиц для перорального введения могут быть микроинкапсулированными. Можно также изготавливать композицию для продления или поддержания постоянного высвобождения, например, посредством нанесения покрытия или включения частиц материала в полимеры, воск или т.п. Соединения согласно настоящему изобретению можно также связывать с растворимыми полимерами, применяемыми в качестве носителей направленного транспорта лекарственных средств. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламид-фенол, полигидроксиэтиласпартамид-фенол или полиэтиленоксид-полилизин, замещенный пальмитоиловыми остатками. Кроме того, соединения согласно настоящему изобретению могут быть связаны с полимерами из класса биодеградируемых полимеров, полезных для достижения контролируемого высвобождения лекарственного средства, например, с полимером молочной кислоты, полимером эпсилонкапролактона, полимером гидроксимасляной кислоты, полимерными сложными ортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-сшитыми или амфипатическими блок-сополимерами гидрогелей. В другом аспекте настоящее изобретение направлено на жидкую пероральную дозированную форму. Жидкости для перорального введения, такие как растворы, сиропы и эликсиры, можно получать в форме дозированных единиц, так что данное их число содержит предопределенное количество соединения согласно настоящему изобретению. Сиропы можно получать посредством растворения соединения согласно настоящему изобретению в водном растворе, содержащем подходящую отдушку, а эликсиры получают с применением нетоксичных спиртовых наполнителей. Суспензии можно получать посредством диспергирования соединения согласно настоящему изобретению в нетоксичных наполнителях. Можно также добавлять солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленовые простые эфиры сорбита, консерванты, отдушки, такие как масло мяты перечной, или естественные подсластители или сахарин или другие искусственные подсластители и т.п. В другом аспекте настоящее изобретение направлено на парентеральное введение. Фармацевтические композиции, приспособленные для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферные средства, бактериостатики и растворимые вещества, делающие препарат изотоничным с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Композиции могут быть представлены в контейнерах для одной дозы или множественных доз, например, в запаянных ампулах и герметично закрытых флаконах и могут храниться в виде препарата, высушенного из замороженного состояния (лиофилизованного), требующего только добавления сте- 17018953 рильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Растворы и суспензии для инъекций, приготовляемые ex tempore, можно получать из стерильных порошков,гранул и таблеток. В другом аспекте настоящее изобретение направлено на фармацевтическую композицию, содержащую[(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. Подходящим образом, [(2R)-2(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемая соль,могут быть приготовлены в виде препарата для перорального введения, подходящим образом, в жидкой или таблетированной форме или для парентерального введения. В другом аспекте настоящее изобретение направлено на фармацевтическую композицию, содержащую[(2R)-3-(2-2-хлор-6-[(2R)-2,4-диметил-1-пиперазинил]-5-фтор-4-пиримидинилгидразино)-2(циклопентилметил)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. Подходящим образом, [(2R)-3-(2-2-хлор-6-[(2R)-2,4 диметил-1-пиперазинил]-5-фтор-4-пиримидинилгидразино)-2-(циклопентилметил)-3-оксопропил]гидроксиформамид, или его фармацевтически приемлемая соль могут быть приготовлены в виде препарата для перорального введения, подходящим образом, в жидкой или таблетированной форме или для парентерального введения. В другом аспекте настоящее изобретение направлено на фармацевтическую композицию, содержащую[(2R)-2-(циклопентилметил)-3-(2-6-[(2R)-2,4-диметил-1-пиперазинил]-5-фтор-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. Подходящим образом, [(2R)-2-(циклопентилметил)-3-(2-6[(2R)-2,4-диметил-1-пиперазинил]-5-фтор-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемая соль, могут быть приготовлены в виде препарата для перорального введения, подходящим образом, в жидкой или таблетированной форме или для парентерального введения. В другом аспекте настоящее изобретение направлено на фармацевтическую композицию, содержащую [(2R)-3-2-[2-хлор-5-фтор-6-(4-метил-4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-2(циклопентилметил)-3-оксопропил]гидроксиформамид или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. Подходящим образом, [(2R)-3-2-[2-хлор-5-фтор-6-(4-метил 4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил]гидроксифорамид или его фармацевтически приемлемая соль могут быть приготовлены в виде препарата для перорального введения, подходящим образом, в жидкой или таблетированной форме или для парентерального введения. В другом аспекте настоящее изобретение направлено на фармацевтическую композицию, содержащую 2R)-2-(циклопентилметил)-3-2-[5-фтор-2-метил-6-(4-метил-4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-3-оксопропил)гидроксиформамид или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент подходящим образом, 2R)-2-(циклопентилметил)-3-2-[5 фтор-2-метил-6-(4-метил-4,7-диазаспиро[2.5]окт-7-ил)-4-пиримидинил]гидразино-3-оксопропил)гидроксиформамид или его фармацевтически приемлемая соль могут быть приготовлены в виде препарата для перорального введение, подходящим образом, в жидкой или таблетированной форме или для парентерального введения. Полиморфные формы Было найдено, что существуют 3 охарактеризованные и воспроизводимые полиморфные твердофазные формы [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин 8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида. Эти три формы представляют собой форму 1, форму 2 и форму 3. Форма 1 представляет собой кристаллическую форму, которую можно получать из суспензии [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида в простых эфирах, ацетатах, кетонах,длинноцепочечных спиртах и других системах растворителей (например, в нитрометане, ацетонитриле,2-бутаноне, метилацетате, этилацетате, диэтиловом эфире, гептане, диметилкарбонате, трет-бутилэтиловом эфире, 1-метокси-2-пропаноле, 2-метоксиэтиловом эфире, хлороформе, хлорбензоле, тетрагидрофуране, толуоле, циклогексане и циклогексаноне). Аналитически наблюдали сольватированную форму для [(2R)-2-(циклопентилметил)-3-(2-5-фтор 6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида в этилацетате. Десольватация этилацетатного сольвата, результатом которой является форма 1, может быть осуществлена посредством вакуумного фильтрования. Форма 2 представляет собой кристаллическую форму, которую можно получать из суспензии [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида в воде. Форма 3 представляет собой кристаллическую форму, которую можно получать из суспензии [(2R)2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4 пиримидинилгидразино)-3-оксопропил]гидроксиформамида в системе низших спиртовых растворителей, таких как метанол, 1-пропанол и 1-бутанол. Во избежание образования формы 2 эти спирты должны содержать очень мало воды или должны быть абсолютно дегидратированными, хотя точное пороговое содержание воды не было установлено. Нагревание формы 1 выше 132 С (но не выше 185 С, что привело бы к разложению соединения) вызывает экзотермическое твердофазное преобразование формы 1 в форму 3. Настоящее изобретение предоставляет форму 1, форму 2 или форму 3 [(2R)-2-(циклопентилметил)3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида, по существу, в чистой форме. Кроме того, настоящее изобретение предоставляет смеси [(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1c][1,4] оксазин-8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида, которые содержат две или более из формы 1, формы 2 и формы 3. В одном варианте осуществления смесь может включать как форму 1, так и форму 2. Композиция может содержать от 1, 2, 3, 4, 5, 10, 15, 20, 25,30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95, 97 или более чем примерно 99% формы 1 или формы 2. В другом варианте осуществления смесь может содержать как форму 2, так и форму 3. Композиция может содержать от 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95, 97 или более чем примерно 99% формы 2 или формы 3. В другом варианте осуществления смесь может содержать как форму 1, так и форму 3. В другом варианте осуществления смесь может содержать 1, 2, 3, 4, 5, 10, 15, 20,25, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95, 97 или более чем примерно 99% формы 1 или формы 3. В одном варианте осуществления настоящего изобретения композиция может содержать от 1, 2, 3,4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95, 97 или более чем примерно 99% индивидуальной полиморфной формы, будь то форма 1, форма 2 или форма 3. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму 1, форму 2 или форму 3 в по существу чистой кристаллической форме. Как известно, кристаллическое состояние соединения может быть описано несколькими кристаллографическими параметрами: размерами единичной ячейки, пространственными группами и положениями атомов в соединении относительно начала координат их единичной ячейки. Эти параметры экспериментально определяют рентгено-структурным анализом кристаллов. Соединение может образовывать более одного типа кристаллов. Эти различные кристаллические формы называют полиморфами. Форму 1, форму 2 и форму 3 можно различать посредством рентгеновской порошковой дифрактографии (XRPD) этих форм в твердом состоянии, как показано в настоящем документе на фиг. 6-8 для форм 1-3 соответственно. Для помощи в дифференциации твердофазных форм можно также применять данные ФТ-ИК-спектроскопии, ФТ-рамановской спектроскопии, дифференциальной сканирующей калориметрии (DSC) и термогравиметрического анализа (TGA), как показано и описано в настоящем документе. Характерные положения пиков на порошковой рентгенограмме сообщали для полиморфов в терминах угловых положений (два тета) с допустимой вариабельностью, обычно порядка 0,12-тета. Общая картина или положения большинства пиков могут также сдвигаться примерно на 0,1 вследствие различий в калибровке, установочных параметров и других вариаций от инструмента к инструменту и от оператора к оператору. Данные XRPD, описанные в настоящем документе, получали с помощью дифракционной системыBruker AXS PXRD General Area Detector, применяя методики, описанные в настоящем документе. Характеристические углы XRPD и межплоскостного расстояния d приведены ниже в табл. 1. Поэтому полиморфная форма 1 может быть охарактеризована любым одним, любыми двумя, любыми тремя, любыми четырьмя или любыми пятью или более из пиков угла 2-тета. Поэтому полиморфная форма 2 может быть охарактеризована любым одним, любыми двумя, любыми тремя, любыми четырьмя или любыми пятью или более из пиков угла 2-тета. Поэтому полиморфная форма 3 может быть охарактеризована любым одним, любыми двумя, любыми тремя, любыми четырьмя или любыми пятью или более из пиков угла 2-тета. Аналогичную характеризацию по любому одному, любым двум, любым трем, любым четырем или любым пяти или более значениям можно применять для межплоскостного расстояния d, выраженного в Ангстремах, как показано ниже в табл.1. ФТ-ИК-спектр твердых форм записывали с использованием системы Thermo Magna MidIR, применяя методики, описанные в настоящем документе. Основываясь на особенностях применяемых конкретных спектрометров и методик подготовки образцов, используемых оператором-аналитиком, можно ожидать небольших вариаций наблюдаемых пиков. Для положения каждого из пиков, указанных ниже, дан некоторый предел погрешности определения. Этот предел погрешности определения положения пика составляет приблизительно 1 см-1. ИК-пики формы 1 наблюдали при: 10351 см-1, 10591 см-1, 11141 см-1, 11551 см-1, 11731 см-1,13471 см-1, 14161 см-1, 14431 см-1, 16031 см-1 и 16561 см-1. Подходящим образом, форма 1 демонстрирует эти характеристические пики в группах, состоящих из любого одного, любых двух, любых трех,любых четырех или любых пяти пиков или их большего числа. ИК-пики формы 2 наблюдали при: 10361 см-1, 11141 см-1, 11521 см-1, 11721 см-1, 13101 см-1,14141 см-1, 14411 см-1, 15701 см-1, 16011 см-1 и 16621 см-1. Подходящим образом, форма 2 демонстрирует эти характеристические пики в группах, состоящих из любого одного, любых двух, любых трех,любых четырех или любых пяти пиков или их большего числа. ИК-данные для форм 1 и 2 проиллюстрированы на фиг. 1 и 2 соответственно. ФТ-рамановский спектр твердых форм записывали с использованием спектрометра Thermo FTRaman System 960, применяя методики, описанные в настоящем документе. Основываясь на особенностях применяемых конкретных спектрометров и методик подготовки образцов, используемых оператором-аналитиком, можно ожидать небольших вариаций наблюдаемых пиков. Для положения каждого из пиков, указанных ниже, дан некоторый предел погрешности определения. Этот предел погрешности определения положения пика составляет приблизительно 1 см-1. Рамановские пики формы 1 наблюдали при: 5061 см-1, 7601 см-1, 7961 см-1, 8841 см-1,11801 см-1, 13051 см-1, 14491 см-1 , 16061 см-1, 16741 см-1 и 29351 см-1. Подходящим образом форма 1 демонстрирует эти характеристические пики в группах, состоящих из любого одного, любых двух,любых трех, любых четырех или любых пяти пиков или их большего числа. Рамановские пики формы 2 наблюдали при: 2731 см-1, 4831 см-1, 5071 см-1, 7641 см-1,8471 см-1, 11791 см-1, 12281 см-1, 14461 см-1, 16731 см-1 и 29321 см-1. Подходящим образом форма 2 демонстрирует эти характеристические пики в группах, состоящих из любого одного, любых двух, любых трех, любых четырех или любых пяти пиков или их большего числа. Рамановские пики формы 3 наблюдали при: 2731 см-1, 5061 см-1, 7661 см-1, 7971 см-1, 11761-1 см , 12281 см-1, 13021 см-1, 14461 см -1, 16721 см-1 и 29341 см-1. Подходящим образом форма 3 демонстрирует эти характеристические пики в группах, состоящих из любого одного, любых двух, любых трех, любых четырех или любых пяти пиков или их большего числа. Рамановские данные для форм 1-3 проиллюстрированы на фиг. 3-5 соответственно.DSC-термограмму исследуемых форм получали с использованием ТА-инструментов Thermal Analysis System, Model DSC Q100, применяя методики, описанные в настоящем документе. Данные проиллюстрированы в настоящем документе в виде фиг. 9-11 для форм 1-3 соответственно. Формы 1, 2 и 3 имели начало плавления, измеренное посредством DSC, приблизительно при 187 С,185 С и 190 С, соответственно. Для формы 1 (фиг. 9) наблюдали плавление при 132 С, которое соответствует экзотермическому твердофазному формопреобразованию формы 1 в форму 3. Термогравиметрическое описание исследуемых форм получали с использованием ТА-инструментов Один вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 1, по существу, так как показано на порошковой рентгенограмме фиг. 6, ФТ-ИК-спектре фиг. 1,ФТ-рамановском спектре фиг. 3, DSC-термограмме фиг. 9 и данных TGA фиг. 12. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму 1, характеризуемую рентгенограммой, содержащей пики, выраженные в единицах углов два тета, где рентгенограмма включает пики при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1, 11,20,1, 12,90,1,13,80,1, 15,60,1 и 18,30,1. Подходящим образом, форму 1 характеризует рентгенограмма, включающая пики при 8,10,1, 9,5+0,1, 11,2+0,1, 12,90,1, 13,80,1 и 15,60,1. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 1,[(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин 8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида, где указанную полиморфную форму характеризует рентгенограмма, включающая пики, выраженные в единицах углов 2 тета, где:a) указанная рентгенограмма включает пик при 4,10,1; илиb) указанная рентгенограмма включает пик при 4,10,1 и 6,10,1; илиc) указанная рентгенограмма включает пик при 4,10,1, 6,10,1 и 6,90,1; илиd) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1 и 8,10,1; илиe) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1 и 9,5+0,1; илиf) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1 и 11,20,1; илиg) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1,11,20,1 и 12,90,1; илиh) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1,11,20,1, 12,90,1 и 13,80,1; илиi) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1,11,20,1, 12,90,1, 13,8 0,1 и 15,60,1; илиj) указанная рентгенограмма включает пик при 4,10,1, 6,10,1, 6,90,1, 8,10,1, 9,50,1,11,20,1, 12,90,1, 13,80,1, 15,60,1 и 18,30,1. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую форму 1 и фармацевтически приемлемый эксципиент. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 2, по существу, так как показано на рентгенограмме фиг. 7, ФТ-ИК-спектре фиг. 2, ФТрамановском спектре фиг. 4, DSC-термограмме фиг. 10 и данных TGA фиг. 13. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму 2, характеризуемую рентгенограммой, содержащей пики, выраженные в единицах углов два тета, где данная рентгенограмма включает пики при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1, 18,30,1,19,00,1, 20,60,1, 21,40,1 и 26,70,1. Подходящим образом, форму 2 характеризует рентгенограмма, включающая пики при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1, 18,30,1 и 19,00,1. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 2,[(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин 8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида, где указанную полиморфную форму характеризует рентгенограмма, включающая пики, выраженные в единицах углов 2 тета, где:a) указанная рентгенограмма включает пик при 7,80,1; илиb) указанная рентгенограмма включает пик при 7,80,1 и 9,50,1; илиc) указанная рентгенограмма включает пик при 7,80,1, 9,50,1 и 12,30,1; илиd) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1 и 13,20,1; илиe) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1 и 15,60,1; илиf) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1 и 18,30,1; илиg) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1,18,30,1 и 19,00,1; илиh) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1,18,30,1, 19,00,1, и 20,60,1; илиi) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1,18,30,1, 19,00,1, 20,60,1 и 21,40,1; илиj) указанная рентгенограмма включает пик при 7,80,1, 9,50,1, 12,30,1, 13,20,1, 15,60,1,18,30,1, 19,00,1, 20,60,1, 21,40,1 и 26,70,1. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую форму 2 и фармацевтически приемлемый эксципиент. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 3, существенно так, как показано на рентгенограмме фиг. 8, ФТ-рамановском спектре фиг. 5,DSC-термограмме фиг. 11 и данных TGA фиг. 14. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму 3, характеризуемую рентгенограммой, содержащей пики, выраженные в единицах углов два тета, где данная рентгенограмма включает пики при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1, 12,80,1,13,40,1, 16,00,1, 23,30,1 и 27,60,1. Подходящим образом, форму 3 характеризует рентгенограмма, включающая пики при 7,50,1, 8,20,1, 9,10,1, 12,80,1, 13,40,1 и 16,00,1. Другой вариант осуществления настоящего изобретения представляет собой полиморфную форму,форму 3,[(2R)-2-(циклопентилметил)-3-(2-5-фтор-6-[(9aS)-гексагидропиразино[2,1-c][1,4]оксазин 8(1 Н)-ил]-2-метил-4-пиримидинилгидразино)-3-оксопропил]гидроксиформамида, где указанную полиморфную форму характеризует рентгенограмма, включающая пики, выраженные в единицах углов 2 тета, где:a) указанная рентгенограмма включает пик при 6,10,1; илиb) указанная рентгенограмма включает пик при 6,10,1 и 7,50,1; илиc) указанная рентгенограмма включает пик при 6,10,1, 7,50,1 и 8,20,1; илиd) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1 и 9,10,1; илиe) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1 и 12,00,1; илиf) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1 и 12,8 0,1; илиg) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1,12,80,1 и 13,40,1; илиh) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1, 12,8 0,1, 13,40,1, и 16,00,1; илиi) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1, 12,8 0,1, 13,40,1, 16,00,1 и 23,30,1; илиj) указанная рентгенограмма включает пик при 6,10,1, 7,50,1, 8,20,1, 9,10,1, 12,00,1,12,80,1, 13,40,1, 16,00,1, 23,30,1 и 27,60,1. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую форму 3 и фармацевтически приемлемый эксципиент. Примеры Следующие примеры иллюстрируют настоящее изобретение. Эти примеры не предназначены для ограничения объема настоящего изобретения, они лишь предоставляют руководство квалифицированному специалисту по процедурам получения и применения соединений и композиций и по способам согласно настоящему изобретению. Хотя в настоящем документе описаны конкретные варианты осуществления настоящего изобретения, квалифицированному специалисту будет понятно, что в нем можно сделать разнообразные изменения и модификации, не выходя из сущности и объема настоящего изобретения. Символы и условные обозначения, использованные в настоящем документе для применения в этих процессах, схемах и примерах, соответствуют символам и условным обозначениям, применяемым в современной научной литературе, например, в Journal of the American Chemical Society или в Journal of Biological Chemistry. Стандартные однобуквенные или трехбуквенные аббревиатуры обычно применяли для обозначения аминокислотных остатков, для которых предполагали состояние в L-конфигурации, если не указано иначе. Если не указано иначе, все исходные материалы получали от коммерческих поставщиков и применяли без дальнейшей очистки. Все ссылки на "эфир" следует понимать как ссылки на диэтиловый эфир; термин "раствор соли" относится к насыщенному водному раствору NaCl. Если не указано иначе, все температуры выражены в С(градусах Цельсия). Все реакции проводили в инертной атмосфере при комнатной температуре, если не указано иначе, и все растворители были высшей доступной чистоты, если не указано иначе. Спектры 1 Н ЯМР (ниже в данном документе также обозначаемые как "ЯМР") записывали на инструменте VXR-300, Varian Unity-300, Varian Unity-400, Brucker AVANCE-400, General Electric QE-300 или спектрометре Bruker AM 400. Химические сдвиги выражены в миллионных долях (м.д.,единиц). Константы взаимодействия даны в герцах (Гц). Картины расщепления описывают эффективную мультиплетность, они обозначены как с (синглет), д (дуплет), т (триплет), кв. (квартет), квинт. (квинтет), м(мультиплет), шир. (широкий). Масс-спектры получали в системе ЖХ-МС открытого доступа с применением ионизации электрораспылением. Условия ЖХ: в течение 3 мин градиент от 10 до 80% CH3CN (0,018% TFA) с последующим выдерживанием в течение 1,25 мин и повторным уравновешиванием в течение 0,5 мин; детектиро- 22018953 вание по МС, УФ при 214 нм и детектором светорассеивания (ELS). Колонка: 2,150 мм Zorbax SB-C8. Для препаративной (преп) ВЭЖХ; приблизительно 100 мг конечных продуктов инъецировали в 1000 мкл МеОН, DMSO или DMF на колонку SunFire Prep C18 OBD, 5 мкм, 3075 мм при 35 мл/мин с 10-минутным градиентом от 5% CH3CN до 95% CH3CN в Н 2 О, затем 1,9 мин с 90% CH3CN в Н 2 О. Флэшхроматографию проводили на колонке Merck Silica gel 60 (230-400 меш), колонке с нормальной фазой Часть А. (4S)-Бензил-3-(3-циклопентилпропаноил)оксазолидин-2-он. К раствору (S)-(-)-4-бензил-2-оксазолидинона (25 г, 141 ммоль) в THF (350 мл) при -78 С добавляли по каплям н-BuLi (56,4 мл, 2,5 М раствор в гексане, 141 ммоль). После перемешивания в течение 60 мин при той же температуре реакционную смесь затем обрабатывали 3-циклопентилпропионилхлоридом(21,6 мл, 141 ммоль) в течение 0,25 ч. Реакционной смеси давали возможность нагреваться до комнатной температуры и перемешивали в течение ночи. Реакцию гасили насыщенным водным раствором NH4Cl(320 мл). Водный слой экстрагировали EtOAc (3200 мл). Объединенные органические слои сушили(MgSO4) и выпаривали, получая (4S)-бензил-3-(3-циклопентилпропаноил)оксазолидин-2-он в виде белого твердого вещества (42,4 г, 100%). ЖХ-МС: (М+Н)+: 302,3. Часть В. (4S)-3-2R)-3-Циклопентил-2-[(фенилметил)окси]метилпропаноил)-4-(фенилметил)-1,3 оксазолидин-2-он. К раствору (4S)-бензил-3-(3-циклопентилпропаноил)оксазолидин-2-она (42,4 г, 141 ммоль) в дихлорметане (500 мл) при 0 С в атмосфере азота добавляли хлорид титана (IV)(1Mв DCM, 155 мл, 155 ммоль) в медленном постоянном потоке. Спустя 5 мин добавляли по каплям диизопропилэтиламин (27 мл, 155 ммоль). После перемешивания при 0 С в течение 1 ч к полученному еноляту титана добавляли бензилоксиметилхлорид (TCl-America)(39 мл, 280 ммоль) в медленном постоянном потоке и смесь выдерживали при 0 С в течение 3,5 ч. Затем реакционную смесь гасили водой (400 мл). Водный слой экстрагировали дихлорметаном (150 мл 2). Органические экстракты промывали насыщенным NaHCO3, сушили (MgSO4) и выпаривали. Остаток промывали эфиром (2) и затем растирали со смесью гексанов с эфиром, получая 2 порции (4S)-3-2R)-3-циклопентил-2-[(фенилметил)окси]метилпропаноил)-4(фенилметил)-1,3-оксазолидин-2-она в виде бледно-желтого твердого вещества (42,7 г, 72%). ЖХ-МС:(М+Н)+: 422,2. Часть С. (4S)-3-[(2R)-3-Циклопентил-2-(гидроксиметил)пропаноил]-4-(фенилметил)-1,3-оксазолидин-2-он. Раствор (4S)-3-2R)-3-циклопентил-2-[(фенилметил)окси]метилпропаноил)-4-(фенилметил)-1,3 оксазолидин-2-она (42,7 г, 0,1 моль) в этаноле (800 мл) и DMF (180 мл) подвергали каталитическому гидрированию, применяя 10% Pd/C (4 г) в атмосфере водорода при повышенном давлении. По данным ЖХ-МС, спустя 24 ч реакция завершилась на 50%. Реакционную смесь продували азотом и подавали свежий водород. После дополнительных 60 ч реакционную смесь опять продували азотом, фильтровали и из фильтрата удаляли растворители, получая (4S)-3-[(2R)-3-циклопентил-2-(гидроксиметил)пропаноил]-4-(фенилметил)-1,3-оксазолидин-2-он (33,1 г, 100%). ЖХ-МС: (М+Н)+: 332,3. Часть D. (2R)-3-Циклопентил-2-(гидроксиметил)пропановая кислота.(33,1 г, 0,1 моль) перемешивали в смеси THF (330 мл) и воды (55 мл) и охлаждали до 0 С. Добавляли 30%-ный пероксид водорода (96 мл, 1 моль), затем моногидрат гидроксида лития (8,4 г, 0,2 моль). Реакционную смесь нагревали до комнатной температуры и затем перемешивали в течение ночи. THF удаляли посредством роторного выпаривания. Водный остаток промывали дихлорметаном (3100 мл), подкисляли 6 н. HCl и экстрагировали этилацетатом (4100 мл). Органические экстракты сушили (MgSO4) и выпаривали, получая (2R)-3-циклопентил-2-(гидроксиметил)пропановую кислоту в виде прозрачного бесцветного масла (18,5 г, 100%). ЖХ-МС: (М+Н)+: не детектировали. 1 Н ЯМР (400 МГц, CDCl3):7,3(шир.с, 1 Н), 3,79 (д, J = 5,83 Гц, 2 Н), 2,64-2,71 (м, 1 Н), 1,45-1,87 (м, 9 Н), 1,05-,14 (м, 2 Н). Часть Е. (2R)-3-Циклопентил-2-(гидроксиметил)-N-[(фенилметил)окси]пропанамид. К смеси (2R)-3-циклопентил-2-(гидроксиметил)пропановой кислоты (18,3 г, 106 ммоль), гидрохлорида О-бензилгидроксиламина (18,62 г, 117 ммоль) и 4-(диметиламино)пиридина (28,5 г, 233 ммоль) в дихлорметане (110 мл) при 0 С добавляли гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (22,3 г, 117 ммоль). Смесь выдерживали при 0 С в течение 3 ч. После этого времени добавляли 500 мл 1 н. холодной водной HCl и смесь перемешивали в течение следующих 30 мин. Образующийся в результате этого белый твердый осадок собирали фильтрованием. Осадок промывали 1 н. HCl, водой и холодным DCM. Сушка в течение ночи в вакуумном эксикаторе предоставляла (2R)-3-циклопентил-2- 23018953(гидроксиметил)-N-[(фенилметил)окси]пропанамид (19,1 г, 65%). ЖХ-МС: (М+Н)+: 278,1. Часть F. (3R)-3-(Циклопентилметил)-1-[(фенилметил)окси]-2-азетидинон. К смеси (2R)-3-циклопентил-2-(гидроксиметил)-N-[(фенилметил)окси]пропанамида (22,5 г, 81 ммоль) и трифенилфосфина (22,5 г, 97 ммоль) в THF (800 мл) при 0 С добавляли по каплям диизопропилазодикарбоксилат (18,9 мл, 97 ммоль). Реакционную смесь выдерживали при 0 С в течение 45 мин и затем выпаривали. Очистка посредством хроматографии на силикагеле с использованием смеси гексан/EtOAc в качестве элюирующей системы (95:5) предоставляла (3R)-3-(циклопентилметил)-1[(фенилметил)окси]-2-азетидинон (16,9 г, 81%). ЖХ-МС: (М+Н)+: 260,1. Часть G. (2R)-3-Циклопентил-2-([(фенилметил)окси]аминометил)пропановая кислота. Смесь (3R)-3-(циклопентилметил)-1-[(фенилметил)окси]-2-азетидинона (20 г, 77,1 ммоль) и LiOHН 2 О (32,4 г, 0,77 моль) в смеси THF с водой (500 мл/170 мл) перемешивали при комнатной температуре в течение 36 ч. К реакционной смеси добавляли 6 М HCl (130 мл) и затем добавляли 1 н. NaOH до достижения нейтрального рН. Слои разделяли и водный слой однократно экстрагировали EtOAc. Объединенные органические фазы сушили (MgSO4) и концентрировали, получая (2R)-3-циклопентил-2-([(фенилметил)окси]аминометил)пропановую кислоту (22,85 г, 100%) в виде прозрачного бесцветного масла. ЖХ-МС: (М+Н)+: 277,9. Часть Н. (2R)-3-Циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановая кислота. В атмосфере азота растворяли муравьиную кислоту (192 мл, 5 моль) в CH2Cl2 (450 мл) и охлаждали до 0 С. Затем добавляли уксусный ангидрид (73 мл, 0,77 моль) и реакционную смесь перемешивали в течение 45 мин. После этого времени добавляли раствор (2R)-3-циклопентил-2-([(фенилметил)окси] аминометил)пропановой кислоты (22,85 г неочищенный материал, предположительно, 77,1 ммоль) вCH2Cl2 (450 мл) и смесь, полученную в результате этого, перемешивали в течение 1,5 ч при 0 С. Затем удаляли летучие компоненты, неочищенный остаток растворяли в EtOAc (500 мл) и смесь промывали раствором соли (4100 мл). Органические фазы сушили (MgSO4) и концентрировали, получая (2R)-3 циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановую кислоту (23,5 г, 100%) в виде густого сиропа. ЖХ-МС: (М+Н)+: 306,1. Изопропаноловый сольват диизопропилэтиламиновой соли (2R)-3-циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановой кислоты можно получать следующим образом: к раствору(2R)-3-циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановой кислоты (25,9 г, 85 ммоль) в диэтиловом эфире (85 мл) добавляли диизопропилэтиламин (19,7 мл, 113 ммоль) и смесь перемешивали при комнатной температуре приблизительно в течение 3 ч. Затем реакционную смесь разбавляли дополнительным диэтиловым эфиром (85 мл) и водой (400 мл). Слои разделяли и органический слой экстрагировали еще два раза смесью воды и раствора соли (250 мл воды с добавленными 30 мл раствора соли и 200 мл воды с добавленными 30 мл раствора соли). Объединенные водные слои затем экстрагировали 40%-ным изопропанолом в хлороформе (3300 мл). Объединенные изопропанол-хлороформные слои сушили (Na2SO4), фильтровали и выпаривали, получая изопропаноловый сольват диизопропилэтиламиновой соли 2 (R)-3-циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановой кислоты,(30,29 г) в виде прозрачного масла бежевого цвета. ЖХ-МС: (М+Н)+: 306,2. Промежуточное соединение В.(3R)-3-(Циклопентилметил)-1-[(фенилметил)окси]-2-азетидинон (100 г, 386 ммоль) растворяли в этаноле (1,2 л) и раствор дегазировали. Добавляли Pd на С (10%, сухой, 8 г) и суспензию продували водородом и перемешивали в атмосфере водорода до завершения реакции по данным ЖХ-МС (приблизительно 6 ч). Затем суспензию продували азотом, фильтровали через Целит и выпаривали досуха. Твердое вещество, полученное в результате этого, повторно растворяли в CH2Cl2 (1 л) и добавляли дигидропиран(70 мл, 767 ммоль), затем п-толуолсульфонат пиридиния (PPTS, 5%, 4,85 г). Реакционную смесь перемешивали в течение 3 дней при комнатной температуре, затем концентрировали и хроматографировали на силикагеле, применяя 10-20% этилацетата в смеси гексанов и получая (3R)-3-(циклопентилметил)-1(тетрагидро-2 Н-пиран-2-илокси)-2-азетидинон в виде бесцветной жидкости (100%). Часть В. (2R)-3-Циклопентил-2-[(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановая кислота.(3R)-3-(Циклопентилметил)-1-(тетрагидро-2 Н-пиран-2-илокси)-2-азетидинон (68 г, 268 ммоль) растворяли в THF (1 л) и помещали в трехгорлую круглодонную колбу емкостью 3 л, оснащенную внутренней термопарой, обратным холодильником и механической мешалкой. Готовили раствор моногидрата гидроксида лития (56,3 г, 1,34 моль) в 400 мл Н 2 О и добавляли по каплям из капельной воронки при интенсивном перемешивании. Реакционную смесь перемешивали при комнатной температуре в течение 36 ч, затем разбавляли Н 2 О (350 мл) и промывали смесью гексанов (300 мл). Органический слой экстрагировали Н 2 О (100 мл) и объединенные водные слои охлаждали до 0 С и осторожно подкисляли 2 М лимонной кислотой (525 мл), добавляемой по каплям в течение 90 мин, поддерживая внутреннюю температуру ниже 10 С. Подкисленный материал экстрагировали этилацетатом (3250 мл) и объединенные органические слои промывали водой (2), сушили над MgSO4, фильтровали и выпаривали. Добавляли и отгоняли бензол (500 мл) и остаток сушили в вакууме, получая (2R)-3-циклопентил-2-[(тетрагидро-2 Нпиран-2-илокси)амино]метилпропановую кислоту (70,9 г, 98%) в виде бесцветной жидкости. Часть С. (2R)-3-Циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановая кислота. К раствору (2R)-3-циклопентил-2-[(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановой кислоты (97,05 г, 358 ммоль) в ацетоне (1,1 л) при комнатной температуре добавляли 5-метил-2-тиоксо[1,3,4]тиадиазол-3-карбальдегид (57,3 г, 358 ммоль) (Tetrahedron Lett. 1985, 26, 3703-3706). Когда полагали, что реакция завершилась, ацетон удаляли в вакууме. Остаток суспендировали в смеси гексанов (320 мл) и метил-трет-бутилового эфира (180 мл), затем обрабатывали ультразвуком. Спустя 10 мин белое твердое вещество (предположительно, 5-метил-3 Н-[1,3,4]тиадиазол-2-тион) отфильтровывали и фильтрат затем выпаривали в вакууме, получая (2R)-3-циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси) амино]метилпропановую кислоту в виде бледно-желтой смолы (124 г, 100%). ЯМР показывает, что продукт содержит небольшое количество МТВЕ и 5-метил-3 Н-[1,3,4]тиадиазол-2-тиона.(2R)-3-Циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановая кислота может быть также получена согласно литературным процедурам [Bracken, Bushell, Dean, Francavilla, Jain,Lee, Seepersaud, Shu, Sundram, Yuan; PCT Int. Appl. (2006), WO 2006127576 A2]. Диизопропилэтиламиновую соль (2R)-3-циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси) амино]метилпропановой кислоты можно получать следующим образом: раствор (2R)-3-циклопентил-2[(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановой кислоты (39,45 г, 145 ммоль) в метилформиате (300 мл) и диизопропилэтиламине (27,9 мл, 160 ммоль) помещали в запаянную трубку и нагревали до 50 С в течение 4 дней. После охлаждения до комнатной температуры метилформиат удаляли в вакууме и оставшийся остаток растворяли в диэтиловом эфире. Эфирный раствор экстрагировали водой и слои разделяли. Водный слой затем реэкстрагировали раствором 40% изопропанола в хлороформе (2). Объединенные изопропанольно-хлороформные слои затем концентрировали в вакууме, получая (2R)-3 циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановую кислоту в виде диизопропилэтиламиновой соли (28 г, содержащей остаточное количество хлороформа и изопропанола). Промежуточное соединение С. 4,6-Дихлор-5-фтор-2-метилпиримидин Часть А. 5-Фтор-4,6-дигидрокси-2-метилпиримидин. Раствор 200 мл 25% по массе метоксида натрия в метаноле (0,84 моль) разбавляли дополнительными 200 мл метанола. К раствору метоксида натрия добавляли ацетамидин-HCl (40 г, 0,42 моль) (образовывался белый осадок), после чего добавляли диметилфтормалонат (70 г, 0,4 6 моль). Содержимое перемешивали при комнатной температуре в течение ночи, затем концентрировали в вакууме досуха. Остаток, полученный в результате этого, повторно растворяли в горячей воде (300 мл). После охлаждения водного раствора до комнатной температуры медленно добавляли концентрированную HCl, пока при рН около 5 не происходило образование кристаллов (тонкие белые призмы). Концентрированную HCl добавляли по каплям до рН 3 и затем содержимое фильтровали. Выделенные кристаллы ополаскивали 1 М(М+Н)+: 145. Часть В. 4,6-Дихлор-5-фтор-2-метилпиримидин. 5-Фтор-4,6-дигидрокси-2-метилпиримидин (предположительно, 60 г, 0,42 моль) обрабатывали 300 мл POCl3 при 120 С в течение 3 ч. Реакционную смесь затем охлаждали до комнатной температуры и концентрировали в вакууме до тех пор, пока скорость удаления растворителя не снижалась до величины,меньшей 1 капли в секунду. Продукт является несколько летучим, и излишнее концентрирование в вакууме будет уменьшать выход. Неочищенный остаток выливали на дробленый лед и суспензию, полученную в результате этого, перемешивали в течение 1 ч, за время которого раствор нагревался до комнатной температуры. Образовывалось желтое твердое вещество, которое отфильтровывали, промывали водой и слегка подсушивали на воздухе до состояния свободной сыпучести. Это твердое вещество собирали и помещали в эксикатор над Р 2 О 5 до высушивания, что предоставляло чистый 4,6-дихлор-5-фтор-2 метилпиримидин (59 г, 79%). ЖХ-МС: (М+Н)+: 181/183. Промежуточное соединение D. 4,6-Дихлор-2-этил-5-фторпиримидин Часть А. 2-Этил-5-фтор-6-гидрокси-4(1 Н)-пиримидинон. Гидрохлоридную соль пропионамида (30,0 г, 276,3 ммоль) и диметилфтормалонат (41,4 г, 276,3 ммоль) в безводном метаноле (400 мл) обрабатывали порциями твердого NaOMe (45 г, 829 ммоль) при комнатной температуре. После этого добавления белую суспензию нагревали до 85 С и перемешивали в течение 2 ч. Затем растворитель выпаривали досуха. К остатку добавляли 70 мл 6 н. HCl при интенсивном перемешивании. Суспензию перемешивали в течение 10 мин до полной нейтрализации остатка. Белый осадок собирали фильтрованием и сушили в вакууме, получая 2-этил-5-фтор-6-гидрокси-4(1 Н)пиримидинон в виде белого твердого вещества. ЖХ-МС: (М+Н)+: 159,0; (M+Na)+:181,1. В некоторых случаях этот продукт может содержать соосажденный NaCl, в результате чего выход может превысить теоретическое значение. В таких случаях этот продукт направляют на следующую стадию вместе с присутствующим NaCl. Часть В. 4,6-Дихлор-2-этил-5-фторпиримидин. 2-Этил-5-фтор-6-гидрокси-4(1 Н)-пиримидинон (20 г, 126,6 ммоль) в POCl3 (58 мл, 633 ммоль) нагревали при 125 С (масляная баня) в течение 2 ч. К горячему раствору добавляли дополнительные 68 мл свежего POCl3. Раствор, полученный в результате этого, нагревали в течение дополнительных 2 ч, пока не был потреблен весь исходный материал. Избыток POCl3 отгоняли (62-68 С) в вакууме, получая светло-коричневый остаток. После охлаждения до комнатной температуры остаток разбавляли 50 мл CH2Cl2,затем выливали в ледяную воду (200 мл). К этой смеси добавляли 200 мл CH2Cl2 и полученную смесь перемешивали в течение 10 мин. После разделения двух слоев водный слой дополнительно экстрагировали 100 мл CH2Cl2. Объединенные органические слои сушили над Na2SO4, затем фильтровали через небольшой слой силикагеля, который затем промывали 150 мл 1% МеОН в CH2Cl2. Выпаривание растворителя предоставляло 4,6-дихлор-2-этил-5-фторпиримидин (21 г, 85%) в виде светло-желтой жидкости. ЖХ-МС: (М+Н)+: не детектировали. Промежуточное соединение Е. Часть А. 5-Фтор-6-гидрокси-2-метилтио-4(1 Н)-пиримидинон. К перемешиваемому раствору сульфата 2-метил-2-тиопсевдомочевины (41,7 г, 0,15 моль) и диметилфтормалоната (45 г, 0,30 моль) в МеОН (600 мл) при 0 С (ледяная баня) порционно добавлялиNaOMe (48,6 г, 0,90 моль). После завершения этого добавления ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение ночи. ЖХ-МС показала образование желаемого пиримидинонового продукта. Реакционную смесь концентрировали почти досуха в вакууме, разбавляли водой (50 мл) и подкисляли 6 н. HCl (150 мл) до рН 2, чтобы осадить продукт. После фильтрования твердое вещество промывали 1 н. HCl (210 мл) и сушили в вакууме, получая 5-фтор-6-гидрокси-2 метилтио-4(1 Н)-пиримидинон (35,7 г, 68%) в виде белого твердого вещества. ЖХ-МС: (М+Н)+: 177,3. Часть В. 4,6-Дихлор-5-фтор-2-(метилтио)пиримидин. Смесь 5-фтор-6-гидрокси-2-(метилтио)-4(1 Н)-пиримидинона (35,7 г, 0,20 моль) в POCl3 (150 мл) нагревали при 115 С в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь медленно выливали в смесь льда с водой (1500 мл) и перемешивали в течение 20 мин. Продукт экстрагировали в этилацетат (3800 мл) и объединенные органические экстракты промывали водой (21000 мл),раствором соли (1000 мл) и сушили (Na2SO4). Выпаривание растворителя предоставляло 4,6-дихлор-5 фтор-2-(метилтио)пиримидин в виде бледно-желтого твердого вещества (37,8 г, 89%). ЖХ-МС: (М+Н)+: не детектировали. Часть С. 4-Хлор-5-фтор-6-гидразино-2-(метилтио)пиримидин. 4,6-Дихлор-5-фтор-2-(метилтио)пиримидин (16,8 г, 78,85 ммоль) и триэтиламин (16,49 мл, 118,3 ммоль) растворяли в DMSO (200 мл) и перемешивали. Смесь охлаждали до 5 С на бане с ледяной водой. К этому раствору медленно добавляли моногидрат гидразина (4,59 мл, 94,62 ммоль). После завершения этого добавления реакционную смесь нагревали до КТ и перемешивание продолжали в течение 1 ч. Реакционную смесь разбавляли водой (500 мл) и водный раствор экстрагировали CH2Cl2 (3300 мл). Объединенный органический раствор промывали водой (3250 мл) и раствором соли (250 мл), затем сушили (Na2SO4) и концентрировали в вакууме, получая 4-хлор-5-фтор-6-гидразино-2-(метилтио)пиримидин в виде пенообразного твердого вещества красного цвета (9,70 г, 59%). ЖХ-МС: (М+Н)+: 208,9. Часть D. [(2R)-3-2-[6-Хлор-5-фтор-2-(метилтио)-4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил](тетрагидро-2 Н-пиран-2-илокси)формамид. Смесь 4-хлор-5-фтор-6-гидразино-2-(метилтио)пиримидина (9,70 г, 46,5 ммоль), (2R)-3 циклопентил-2-[формил(тетрагидро-2 Н-пиран-2-илокси)амино]метилпропановой кислоты (19,9 г, 46,5 ммоль), HOAt (6,96 г, 51,2 ммоль), EDCl (9,82 г, 51,2 ммоль) и N-метилморфолина (25,6 мл, 232,5 ммоль) в DMF (300 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли смесью гексанов с этилацетатом (2:3, 1 л) и промывали водой (3500 мл), органические фазы сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали посредством ОФ-ВЭЖХ на аппаратуре Gilson (35-95% ацетонитрил/вода, время градиента 8 мин), получая [(2R)-3-2-[6-хлор-5-фтор-2-(метилтио)4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил](тетрагидро-2 Н-пиран-2-илокси)формамид в виде красного стеклообразного вещества (12,89 г, 56,0%). ЖХ-МС: (М+Н)+: 490,4. Промежуточное соединение F. 2,4,6-Трихлор-5-фторпиримидин Часть А. 5-Фтор-6-гидрокси-2,4(1 Н,3 Н)-пиримидиндион. Механически перемешиваемый раствор мочевины (60,06 г, 1 моль) и диметилфтормалоната (150,11 г, 1 моль) в метаноле (1 л) обрабатывали 25%-ным по массе NaOMe в метаноле (4,6 М, 435 мл, 2 моль). Смесь кипятили с обратным холодильником в течение 3 ч и затем ей давали возможность охлаждаться до комнатной температуры. Смесь фильтровали, влажную массу растворяли в теплой воде (1,2 л) и водный раствор, полученный в результате этого, подкисляли концентрированной водной HCl (160 мл) до рН 2 при перемешивании в течение 1 ч. Смеси давали возможность охлаждаться до комнатной температуры,продукт отфильтровывали и тщательно промывали водой, затем сушили в вакууме, получая 5-фтор-6 гидрокси-2,4(1 Н,3 Н)-пиримидиндион (80 г, 55%) в виде белого твердого вещества. ЖХ-МС: (М+Н)+: 147,0. Часть В. 2,4,6-Трихлор-5-фторпиримидин. Тонко измельченный 5-фтор-6-гидрокси-2,4(1 Н,3 Н)-пиримидиндион (74 г, 0,507 моль) порционно в течение 30 мин добавляли к POCl3 (232 мл, 2,5 моль) при перемешивании (экзотермический процесс). После завершения этого добавления смесь выдерживали при 60 С, одновременно по каплям из шприца приливая N,N,-диметиланилин (65 мл). После этого добавления смесь нагревали до 100-110 С (внутренняя температура) до времени предполагаемого завершения реакции, обычно в течение 4-8 ч. Смесь охлаждали и массу оставшегося POCl3 удаляли осторожной вакуумной отгонкой при 80-90 С (некоторое количество продукта можно было детектировать в дистилляте POCl3). Оставшийся остаток выливали на лед (1 л) и перемешивали в течение 30 мин, затем экстрагировали эфиром (1400 мл, 2150 мл). Объединенные экстракты промывали водой и раствором соли, затем сушили (MgSO4). Фильтрование и отгонка эфира при атмосферном давлении предоставляли неочищенный продукт, который перегоняли при пониженном давлении, получая продукт (28,8 г, 28%) в виде легкоплавкого белого кристаллического твердого вещества (т. кип. 80-85 С, 12 мм). ЖХ-МС: (М+Н)+: не детектировали. Промежуточное соединение G. Трис(1,1-диметилэтил)2-(2,6-дихлор-5-фтор-4-пиримидинил)-1,1,2-гидразинтрикарбоксилат Часть А. 1,1-Диметилэтил-2-(2,6-дихлор-5-фтор-4-пиримидинил)гидразинкарбоксилат. 2,4,6-Трихлор-5-фторпиримидин (20,92 г, 104,1 ммоль) растворяли в THF (300 мл) при комнатной температуре и при перемешивании. К этому перемешиваемому раствору добавляли трет-бутилкарбазат(13,74 г, 104,1 ммоль), затем диизопропилэтиламин (19,0 мл, 109,3 ммоль). Реакционная смесь становилась светло-желтой, и через несколько минут образовывался осадок. По данным ТСХ-мониторирования(10% EtOAc/Hex), реакция видимо завершалась через 1,5 ч. Реакционную смесь концентрировали в вакууме для удаления большей части THF и остаток растворяли в CH2Cl2 (400 мл). Раствор промывали 400 мл насыщенного водного NH4Cl. Органические фазы сушили и концентрировали, получая бледножелтое твердое вещество (31,37 г). ЖХ-МС: (M+H+2Na-Boc)+: 241. Часть В. Трис(1,1-диметилэтил)2-(2,6-дихлор-5-фтор-4-пиримидинил)-1,1,2-гидразинтрикарбоксилат. 1,1-Диметилэтил-2-(2,6-дихлор-5-фтор-4-пиримидинил)гидразинкарбоксилат (31,37 г, 104,1 ммоль,предположительно) суспендировали в CH2Cl2 (400 мл). К раствору добавляли ди-трет-бутилдикарбонат(44,75 г, 205,0 ммоль), затем диизопропилэтиламин (36,3 мл, 208,2 ммоль). После почти полного раство- 27018953 рения этих веществ медленно добавляли DMAP (1,27 г, 10,4 ммоль). Реакционная смесь становилась красноватой, и через 5 мин наблюдали слабое закипание. Спустя 45 мин, по данным ЖХ-МС, реакция представлялась завершенной и смесь становилась светло-оранжевой. Реакционную смесь промывали 300 мл насыщенного NH4Cl и отделяли органические фазы. Приготовляли суспензию 1800 мл флорсила в CH2Cl2, которую переливали в большую воронку с пористым фильтром. Затем весь органический раствор пропускали через слой флорсила на фильтре, промывая 2 л CH2Cl2. На флорсиле оставалась красная полоса, а ТСХ показывала, что элюция продукта со слоя на фильтре была завершена. Фильтрат концентрировали до получения пенообразного бесцветного масла, которое в холодильнике кристаллизовалось в течение ночи (37,87 г, 73% от 2,4,6-трихлор-5-фторпиримидина). ЖХ-МС: (M+3H+2Na-3 Вос)+: 241. Промежуточное соединение Н. 4,6-Дихлор-5-фтор-2-(фторметил)пиримидин Часть А. 5-Фтор-2-(фторметил)-6-гидрокси-4(1 Н)-пиримидинон. Гидрохлоридную соль 2-фторацетамидина (11,2 г, 100 ммоль) и диметилфтормалонат (15 г, 100 ммоль) в безводном метаноле (300 мл) обрабатывали твердым NaOMe (16,2 г, 300 ммоль) и при перемешивании нагревали до 50 С. Когда ЖХ-МС показывал образование желаемого продукта, растворитель выпаривали досуха и остаток нейтрализовывали концентрированной HCl (20 мл). Фильтрованием собирали белый осадок, получая 5-фтор-2-(фторметил)-6-гидрокси-4(1 Н)-пиримидинон (выход 100%). ЖХМС: (М+Н)+: 163,1. Часть В. 4,6-Дихлор-5-фтор-2-(фторметил)пиримидин. 5-Фтор-2-(фторметил)-6-гидрокси-4(1 Н)-пиримидинон (6 г, 37 ммоль) суспендировали в POCl3 (20 мл, 222 ммоль) и перемешивали при 120 С в течение 2 ч. После испарения избытка POCl3 остаток выливали на лед и смесь, полученную в результате этого, экстрагировали CH2Cl2. Раствор в CH2Cl2 пропускали через слой силикагеля и фильтрат, полученный в результате этого, концентрировали, получая чистый 4,6-дихлор-5-фтор-2-(фторметил)пиримидин (6 г, 81%) в виде бесцветной жидкости. ЖХ-МС: (М+Н)+: не детектировали. Промежуточное соединение I. 4,6-Дихлор-2-(дифторметил)-5-фторпиримидин Часть А. 2,2-Дифторэтанимидамид HCl. К перемешиваемой суспензии хлорида аммония (5,1 г, 95 ммоль) в толуоле (150 мл) при 0 С добавляли триметилалюминий (46 мл, 2 М, 92 ммоль), продолжая перемешивание до прекращения бурления. Добавляли метилдифторацетат (2,38 мл, 27 ммоль) и смесь, полученную в результате этого, перемешивали в течение ночи при 80 С. После охлаждения до 0 С медленно добавляли метанол и раствор, полученный в результате этого, перемешивали в течение 90 мин при пониженной температуре, вызывая образование твердого вещества. Это вещество удаляли фильтрованием через Целит, после чего фильтрат выпаривали и получали 2,2-дифторэтанимидамид HCl (1,7 г, 485%) в виде желтоватого твердого вещества. Часть В. 2-(Дифторметил)-5-фтор-6-гидрокси-4(1 Н)-пиримидинон. Металлический натрий (0,91 г, 40 ммоль) растворяли в МеОН (100 мл) для образования метоксида натрия. Добавляли 2,2-дифторэтанимидамид HCl (1,73 г, 13 ммоль), затем диметилфторпропандиоат (2,0 г, 13 ммоль). Раствор, полученный в результате этого, перемешивали при 80 С в течение 3 ч, затем охлаждали до комнатной температуры. Добавляли водную HCl (6 мл, 6 М, 36 ммоль) и смесь, полученную в результате этого, концентрировали в вакууме. Оставшееся твердое вещество промывали холодной водой и отфильтровывали, получая 2-(дифторметил)-5-фтор-6-гидрокси-4(1 Н)-пиримидинон (1,43 г, 61%). Часть С. 4,6-Дихлор-2-(дифторметил)-5-фторпиримидин. Смесь 2-(дифторметил)-5-фтор-6-гидрокси-4(1 Н)-пиримидинона (1,43 г, 8,0 ммоль) и POCl3 (6 мл) нагревали при 110 С в течение 2,5 ч. После охлаждения до комнатной температуры реакционную смесь выливали на лед и перемешивали в течение 30 мин. Продукт экстрагировали в DCM и объединенные органические фазы промывали один раз водным насыщенным бикарбонатом натрия. Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. Это давало 4,6-дихлор-2(дифторметил)-5-фторпиримидин (460 мг, 27%) в виде желтого масла. Общая процедура А. Пример 1. 2R)-2-(Циклопентилметил)-3-2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил] гидразино-3-оксопропил)гидроксиформамид Часть А. 5-Фтор-4-гидразино-2-метил-6-(1-пирролидинил)пиримидин. 4,6-Дихлор-5-фтор-2-метилпиримидин (100 мг, 0,55 ммоль) растворяли в 2 мл DMSO и перемешивали при комнатной температуре. Добавляли пирролидин (50 мкл, 0,61 ммоль), затем DIPEA (210 мкл,1,21 ммоль). Реакционную смесь, полученную в результате этого, перемешивали в течение 2 ч, затем добавляли гидразин (1,0 мл) и содержимое нагревали до 80 С в течение 1 ч. После этого реакционную смесь охлаждали до комнатной температуры и очищали посредством ОФ-ВЭЖХ, получая 5-фтор-4 гидразино-2-метил-6-(1-пирролидинил)пиримидин (69 мг, 59%). Часть В. 2R)-2-(Циклопентилметил)-3-2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил] гидразино-3-оксопропил)[(фенилметил)окси]формамид. 5-Фтор-4-гидразино-2-метил-6-(1-пирролидинил)пиримидин (69 мг, 0,33 ммоль), (2R)-3-циклопентил-2-(формил[(фенилметил)окси]аминометил)пропановую кислоту (110 мг, 0,36 ммоль) и HOAt (49 мг, 0,36 ммоль) растворяли в 2 мл DMF. Добавляли NMM (0,18 мл, 1,65 ммоль), затем EDC (69 мг, 0,36 ммоль). После перемешивания в течение ночи при комнатной температуре реакционную смесь очищали посредством ОФ-ВЭЖХ, получая 2R)-2-(циклопентилметил)-3-2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил]гидразино-3-оксопропил)[(фенилметил)окси]формамид (90 мг, 55%). Часть С. 2R)-2-(Циклопентилметил)-3-2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил] гидразино-3-оксопропил)гидроксиформамид. 2R)-2-(Циклопентилметил)-3-2-[5-фтор-2-метил-6-(1-пирролидинил)-4-пиримидинил]гидразино-3-оксопропил)[(фенилметил)окси]формамид (90 мг, 0,18 ммоль) растворяли в 3 мл МеОН, дегазировали и помещали в атмосферу аргона. Добавляли 10% Pd/C (18 мг), содержимое тщательно дегазировали и помещали в атмосферу водорода приблизительно на 3 ч. Затем содержимое дегазировали и фильтровали через Целит и слой Целита промывали DCM и МеОН. Фильтрат, полученный в результате этого, концентрировали в вакууме, получая чистый 2R)-2-(циклопентилметил)-3-2-[5-фтор-2-метил-6-(1 пирролидинил)-4-пиримидинил]гидразино-3-оксопропил)гидроксиформамид (42 мг, 57%). ЖХ-МС: Часть А. 6-Азетидинил-2-этил-5-фтор-4-гидразинопиримидин. 4,6-Дихлор-2-этил-5-фторпиримидин (195 мг, 1,0 ммоль) растворяли в 3 мл МеОН и перемешивали при комнатной температуре. Добавляли азетидин (74 мкл, 1,1 ммоль), затем DIPEA (383 мкл, 2,2 ммоль). Реакционную смесь, полученную в результате этого, перемешивали при комнатной температуре до завершения замещения азетидином одного хлора, по данным ЖХ-МС-мониторирования. Затем в вакууме удаляли МеОН и остаток растворяли в смеси 2 мл DMSO и 1 мл гидразина. Раствор, полученный в результате этого, нагревали при 40 С в течение 1 ч до тех пор, пока по данным ЖХ-МС реакцию не признавали завершенной. Неочищенную реакционную смесь очищали посредством ОФ-ВЭЖХ, получая 4(1-азетидинил)-2-этил-5-фтор-6-гидразинопиримидин (136 мг, 64%). ЖХ-МС: (М+Н)+: 212,1. Часть В. [(2R)-3-2-[6-(1-Азетидинил)-2-этил-5-фтор-4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил][(фенилметил)окси]формамид. 4-(1-Азетидинил)-2-этил-5-фтор-6-гидразинопиримидин (88 мг, 0,42 ммоль), (2R)-3-циклопентил-2(формил[(фенилметил)окси]аминометил)пропановую кислоту (140 мг, 0,4 6 ммоль) и HOAt (56 мг, 0,42 ммоль) растворяли в 3 мл DMF. Добавляли NMM (71 мкл, 0,65 ммоль), затем EDC (75 мг, 0,40 ммоль). После перемешивания в течение ночи при комнатной температуре реакционную смесь очищали посредством ОФ-ВЭЖХ, получая [(2R)-3-2-[6-(1-азетидинил)-2-этил-5-фтор-4-пиримидинил]гидразино-2(циклопентилметил)-3-оксопропил][(фенилметил)окси]формамид (160 мг, 76%). ЖХ-МС:(М+Н)+: 499,4. Часть С. [(2R)-3-2-[6-(1-Азетидинил)-2-этил-5-фоюр-4-пиримидинил]гидразино-2-(циклопентилметил)-3-оксопропил]гидроксиформамид.[(2R)-3-2-[6-(1-Азетидинил)-2-этил-5-фтор-4-пиримидинил]гидразино-2-(циклопентилметил)-3 оксопропил][(фенилметил)окси]формамид (160 мг, 0,32 ммоль) растворяли в 10 мл МеОН, дегазировали и помещали в атмосферу аргона. Добавляли 5% Pd/C (40 мг) и содержимое тщательно дегазировали и перемешивали в атмосфере водорода до тех пор, пока по данным ЖХ-МС реакцию не признавали завершенной. Затем содержимое дегазировали, фильтровали через Целит и слой Целита промывали DCM и МеОН. Фильтрат, полученный в результате этого, концентрировали в вакууме, получая [(2R)-3-2-[6-(1- 29
МПК / Метки
МПК: C07D 239/42, A61K 31/195, A61P 31/00, A61K 31/16
Метки: ингибиторы, пептиддеформилазы
Код ссылки
<a href="https://eas.patents.su/30-18953-ingibitory-peptiddeformilazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы пептиддеформилазы</a>
Предыдущий патент: Сепаратор для флюида, содержащий центральное тело
Следующий патент: Способ хирургической коррекции килевидной деформации грудной клетки
Случайный патент: Вращающаяся створка искусственного сердечного клапана(варианты) и искусственный сердечный клапан( варианты)