Ингибиторы вируса гепатита с
Номер патента: 18782
Опубликовано: 30.10.2013
Авторы: Мартел Алан, Нгуен Ван Н., Снайдер Лоуренс Б., Минвелл Николас А., Ромин Джеффри Ли, Хаманн Лоуренс Г., Гуд Эндрю К., Ванг Гэн, Джеймс Клинт А., Бачанд Кэрол, Гудрих Джейсон, Лопез Омар Д., Ст.Лоран Денис Р., Янг Фуканг, Лавуа Рико, Рюдигер Эдвард Х., Лэнгли Дэвид Р., Дэон Даниэль Х., Белема Маконен
Формула / Реферат
1. Соединение, выбранное из
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1S)-2-метил-1,1-пропандиил)имино((2S)-1-оксо-1,2-пропандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1S)-2-метил-1,1-пропандиил)имино((2S,3R)-3-метокси-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1S)-2-метил-1,1-пропандиил)имино((2S)-3-метил-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1Н-имидазол-4,2-диил((1S)-2-метил-1,1-пропандиил)имино((2S)-4-метокси-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1R)-2-метил-1,1-пропандиил)имино((2S)-3-метил-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1R)-2-метил-1,1-пропандиил)имино((2S)-1-оксо-1,2-пропандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1Н-имидазол-4,2-диил((1R)-2-метил-1,1-пропандиил)имино((2S)-4-метокси-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1Н-имидазол-4,2-диил((1R)-2-метил-1,1-пропандиил)имино((2S,3R)-3-метокси-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1R)-2-метил-1,1-пропандиил)имино((2R)-3-метил-1-оксо-1,2-бутандиил)))бискарбамата;
диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил((1S)-2-метил-1,1-пропандиил)имино((2R)-3-метил-1-оксо-1,2-бутандиил)))бискарбамата;
N2-(метоксикарбонил)-N-((1S)-1-(4-(4'-(2-((2S)-1-(N-(метоксикарбонил)-L-валил)-2-пирролидинил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-2-метилпропил)-L-валинамида;
метил ((1S,2R)-2-метокси-1-(((2S)-2-(4-(4'-(2-((1S)-1-((N-(метоксикарбонил)-О-метил-L-треонил)амино)-2-метилпропил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата;
метил ((1S)-3-метокси-1-(((2S)-2-(4-(4'-(2-((1S)-1-((N-(метоксикарбонил)-О-метил-L-гомосерил)амино)-2-метилпропил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата;
метил ((1S)-2-((2S)-2-(4-(4'-(2-((1S)-1-((N-(метоксикарбонил)-L-аланил)амино)-2-метилпропил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)-1-метил-2-оксоэтил)карбамата;
N2-(метоксикарбонил)-N-((1R)-1-(4-(4'-(2-((2S)-1-(N-(метоксикарбонил)-L-валил)-2-пирролидинил)-1H-имидазол-4-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метилпропил)-L-валинамида;
метил ((1S,2R)-2-метокси-1-(((2S)-2-(4-(4'-(2-((1R)-1-((N-(метоксикарбонил)-О-метил-L-треонил)амино)-2-метилпропил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата;
метил ((1S)-3-метокси-1-(((2S)-2-(4-(4'-(2-((1R)-1-((N-(метоксикарбонил)-О-метил-L-гомосерил)амино)-2-метилпропил)-1H-имидазол-4-ил)-4-бифенилил)-1H-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата;
метил ((1S)-2-((2S)-2-(4-(4'-(2-((1R)-1-((N-(метоксикарбонил)-L-аланил)амино)-2-метилпропил)-1Н-имидазол-4-ил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)-1-метил-2-оксоэтил)карбамата
или фармацевтически приемлемой соли этих соединений.
2. Соединение, выбранное из
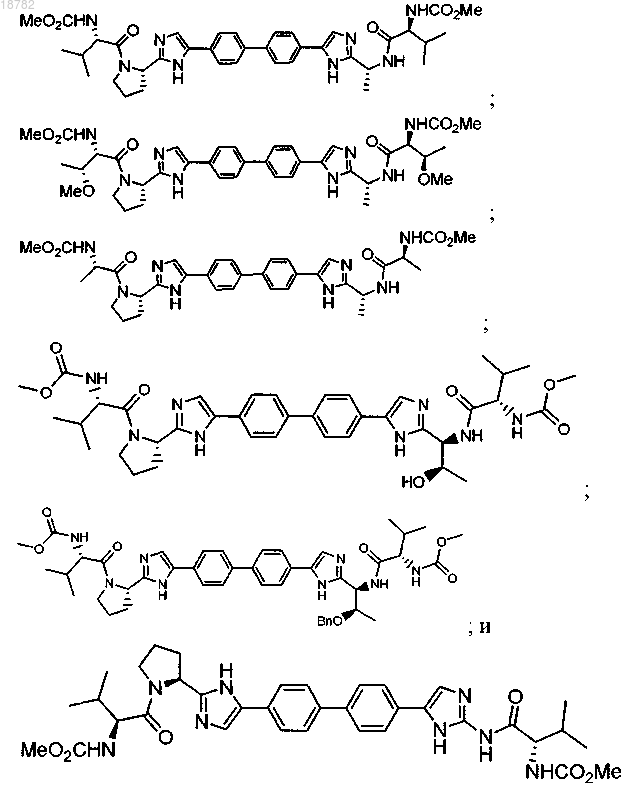
или фармацевтически приемлемой соли этих соединений.
3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 или фармацевтически приемлемую соль этого соединения и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, дополнительно содержащая одно или два дополнительных соединения, обладающих активностью против вируса гепатита С (ВГС).
5. Фармацевтическая композиция по п.4, в которой по меньшей мере одно из дополнительных соединений - это интерферон или рибавирин.
6. Фармацевтическая композиция по п.5, в которой интерферон представляет собой интерферон альфа 2В, пегилированный интерферон альфа, консенсус интерферон, интерферон альфа 2А или лимфобластоидный интерферон тау.
7. Фармацевтическая композиция по п.4, в которой по меньшей мере одно из дополнительных соединений представлено интерлейкином 2, интерлейкином 6, интерлейкином 12, соединением, которое стимулирует ответ Т-хелперов 1-го типа, интерферирующей РНК, антисмысловой РНК, имикимодом, рибавирином, ингибитором инозин-5'-монофосфатдегидрогеназы, амантадином или ремантадином.
8. Фармацевтическая композиция по п.4, в которой по меньшей мере одно из дополнительных соединений эффективно подавляет функцию мишени, представленной металлопротеазой ВГС, сериновой протеазой ВГС, полимеразой ВГС, геликазой ВГС, протеином NS4B ВГС, проникновением ВГС, сборкой ВГС, выходом ВГС, протеином NS5A ВГС или ИМФДГ (инозин-монофосфатдегидрогеназой), использующейся для лечения инфекции, вызванной ВГС.
9. Способ лечения инфекции, вызванной ВГС, включающий введение пациенту терапевтически эффективного количества соединения по п.1 или 2 или фармацевтически приемлемой соли этого соединения.
10. Способ по п.9, дополнительно включающий введение одного или двух дополнительных соединений, обладающих активностью против ВГС, до, во время или после применения соединения по п.1 или 2, или фармацевтически приемлемой соли этого соединения.
11. Способ по п.10, в котором по меньшей мере одно из дополнительных соединений - это интерферон или рибавирин.
12. Способ по п.11, в котором интерферон представляет собой интерферон альфа 2В, пегилированный интерферон альфа, консенсус интерферон, интерферон альфа 2А или лимфобластоидный интерферон тау.
13. Способ по п.10, в котором по меньшей мере одно из дополнительных соединений представлено интерлейкином 2, интерлейкином 6, интерлейкином 12, соединением, которое стимулирует ответ Т-хелперов 1-го типа, интерферирующей РНК, антисмысловой РНК, имикимодом, рибавирином, ингибитором инозин-5'-монофосфатдегидрогеназы, амантадином или ремантадином.
14. Способ по п.10, в котором по меньшей мере одно из дополнительных соединений эффективно подавляет функцию мишени, представленной металлопротеазой ВГС, сериновой протеазой ВГС, полимеразой ВГС, геликазой ВГС, протеином NS4B ВГС, проникновением ВГС, сборкой ВГС, выходом ВГС, протеином NS5A ВГС или ИМФДГ (инозин-монофосфатдегидрогеназой), использующейся для лечения инфекции, вызванной вирусом гепатита С.
Текст
ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С Изобретение относится к композициям (4-4'-диимидазолил)бифенилов и способам лечения инфекции, вызванной вирусом гепатита С. Также раскрываются фармацевтические композиции,содержащие такие соединения и применение таких соединений для лечения инфекции, вызванной вирусом гепатита С.(CA), Минвелл Николас А., Нгуен Ван Н., Ромин Джеффри Ли (US), Рюдигер Эдвард Х. (CA), Снайдер Лоуренс Б., Ст. Лоран Денис Р., Янг Фуканг,Лэнгли Дэвид Р., Ванг Гэн, Хаманн Лоуренс Г. (US) Дементьев В.Н. (RU) Область техники, к которой относится изобретение Изобретение в целом направлено на антивирусные соединения, а именно - на соединения, которые могут подавлять функцию протеина NS5A, кодируемого вирусом гепатита С (ВГС (HCV, композиции,содержащие такие соединения, а также методы подавления функции протеина NS5A. Сведения о предшествующем уровне техники ВГС (вирус гепатита С) является главным патогенным фактором для человека, вызывающим инфекцию у приблизительно 170 миллионов человек по всему миру - приблизительно в пять раз больше,чем число людей, инфицированных вирусом иммунодефицита человека 1 типа. У значительной доли данных ВГС-инфицированных людей развивается серьезное прогрессирующее заболевание печени,включая цирроз и гепатоцеллюлярный рак. В настоящее время наиболее эффективный метод лечения ВГС заключается в применении комбинации интерферона альфа и рибаварина, что приводит к длительному эффекту у 40% пациентов. Последние клинические исследования показывают, что пегилированный интерферон альфа более эффективен,чем немодифицированный интерферон альфа при использовании в качестве монотерапии. Однако даже при использовании экспериментальных режимов лечения с применением комбинаций пегилированного интерферона альфа и рибаварина у существенной доли пациентов не наблюдается длительно сохраняющегося уменьшения вирусной нагрузки. Таким образом, в течение многих лет существует очевидная необходимость в создании эффективных терапевтических средств для лечения инфекции ВГС. ВГС - это РНК-содержащий вирус с положительной цепью. На основании выведенной последовательности аминокислот и значительного подобия 5' нетранслируемой области ВГС был выделен в отдельный класс, принадлежащий семейству Флавивирусов (Flaviviridae). Все вирусы данного семейства имеют заключенные в оболочку вирионы, которые содержат геном на основе положительной цепи РНК,кодирующий все известные вирус-специфические протеины путем трансляции одиночной, непрерывной,открытой рамки считывания. Была обнаружена значительная гетерогенность внутри нуклеотида, а также кодированная последовательность аминокислот по всему геному ВГС. Было охарактеризовано как минимум шесть основных генотипов, а также описано более 50 подтипов. Распространенность основных генотипов ВГС по всему миру различна, поэтому клиническая значимость генетической гетерогенности ВГС все еще с трудом поддается определению несмотря на многочисленные исследования возможного влияния генотипов на патогенез и лечение. Одиночная нить РНК генома ВГС составляет около 9500 нуклеотидов в длину, а также имеет одиночную открытую рамку считывания (ОРС), кодирующую одиночный крупный протеин, состоящий из приблизительно 3000 аминокислот. В инфицированных клетках данный протеин разделяется во многих областях клеточными и вирусными протеазами для продуцирования структурных и неструктурных (НС) протеинов. В случае с ВГС генерирование зрелых неструктурных протеинов (NS2, NS3, NS4A, NS4B,NS5A и NS5B) осуществляется при помощи двух вирусных протеаз. Первая протеаза, скорее всего, является металлопротеазой и разделяет соединение NS2-NS3, вторая является сериновой протеазой, которая содержится в области N-терминала NS3 (также упоминается как NS3 протеаза) и является посредником во всех последующих расщеплениях после NS3, как цис (в месте разрыва NS3-NS4A), так и транс (для оставшихся областей NS4A-NS4B, NS4B-NS5A, NS5A-NS5B). NS4A протеин выполняет множественные функции, действуя как кофактор для. NS3 протеазы и, возможно, способствуя мембранной локализацииNS3 и других вирусных соединений, участвующих в репликации. Комплексная структура NS3 протеина и NS4A кажется необходимой для осуществления данных процессов, поскольку усиливает протеолитическую активность для всех областей NS3 протеин также проявляет активность как нуклеозидтрифосфатаза и РНК-хеликаза. NS5B (также упоминается как ВГС полимераза) является РНК-зависимой РНК полимеразой, которая вовлечена в процесс репликации ВГС. Желательно, чтобы соединения, полезные при лечении ВГС-инфицированных пациентов, избирательно подавляли репликацию вируса ВГС. В частности, предпочтительно применение соединений, эффективных в отношении подавления функции NS5A протеина. Описание NS5A протеин ВГС содержится, например, в Tan, S.-L., Katzel, M G - Virology 2001, 284, 1-12 и в Park, K.-J., Choi, S.-H.-J. BiologicalChemistry, 2003. Сущность изобретения В первом аспекте настоящее изобретение относится к соединению, выбранному из диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил 1S)-2-метил-1,1-пропандиил)имино 2S)-1 оксо-1,2-пропандиилбискарбамата; диметил (4,4'-бифенилдиилбис(1 Н-имидазол-4,2-диил 1S)-2-метил-1,1-пропандиил)имино 2S,3R)3-метокси-1-оксо-1,2-бутандиилбискарбамата; диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил 1S)-2-метил-1,1-пропандиил)имино 2S)-3 метил-1-оксо-1,2-бутандиилбискарбамата; диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил 1S)-2-метил-1,1-пропандиил)имино 2S)-4 метокси-1-оксо-1,2-бутандиилбискарбамата; диметил (4,4'-бифенилдиилбис(1H-имидазол-4,2-диил 1R)-2-метил-1,1-пропандиил)имино 2S)-3-1 018782N2-(метоксикарбонил)-N-1R)-1-(4-(4'-(2-2S)-1-(N-(метоксикарбонил)-L-валил)-2-пирролидинил)1 Н-имидазол-4-ил)-4-бифенилил)-1 Н-имидазол-2-ил)-2-метилпропил)-L-валинамида; метил 1S,2R)-2-метокси-1-2S)-2-(4-(4'-(2-1R)-1-N-(метоксикарбонил)-О-метил-L-треонил) амино)-2-метилпропил)-1 Н-имидазол-4-ил)-4-бифенилил)-1 Н-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата,метил 1S)-3-метокси-1-2S)-2-(4-(4'-(2-1R)-1-N-(метоксикарбонил)-О-метил-L-гомосерил) амино)-2-метилпропил)-1 Н-имидазол-4-ил)-4-бифенилил)-1 Н-имидазол-2-ил)-1-пирролидинил)карбонил)пропил)карбамата,метил 1S)-2-2S)-2-(4-(4'-(2-1R)-1-N-(метоксикарбонил)-L-аланил)амино)-2-метилпропил)-1 Нимидазол-4-ил)-4-бифенилил)-1 Н-имидазол-2-ил)-1-пирролидинил)-1-метил-2-оксоэтил)карбамата,или фармацевтически приемлемой соли этих соединений. Во втором аспекте настоящее изобретение относится к соединению, выбранному из или фармацевтически приемлемой соли этих соединений. В третьем аспекте настоящее изобретение относится к фармацетвической композиции, содержащей соединение, относящееся к первому или второму аспекту настоящего изобретения, или фармацевтически приемлемую соль данного соединения, а также фармацевтически приемлемый носитель. В первом варианте осуществления третьего аспекта соединение содержит одно или два дополнительных соединения,обладающих противовирусной активностью в отношении ВГС. Во втором варианте осуществления третьего аспекта как минимум одно из дополнительных соединений является интерфероном или рибавирином. В третьем варианте осуществления третьего аспекта интерферон выбран из группы, состоящей из интерферона альфа 2 В, пегилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона тау. В четвертом варианте осуществления третьего аспекта настоящего изобретения как минимум одно из дополнительных соединений выбрано из группы, состоящей из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое стимулирует развитие ответа Т-хелперов I типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина и ингибитора инозин-5'-монофосфат-дегидрогеназы, амантадина и ремантадина. В пятом варианте осуществления третьего аспекта настоящего изобретения как минимум одно из дополнительных соединений эффективно подавляет функцию мишени, выбранной из группы, состоящей из металлопротеазы, сериновых протеаз, полимераз и хеликаз ВГС, протеина NS4B, а также посадки ВГС, сборки ВГС, выхода ВГС, протеина NS5A ВГС, а также инозин-монофосфат-дегидрогеназы(ИМФДГ) для лечения гепатита С. В четвертом аспекте осуществления настоящего изобретения представлен способ лечения инфекции, вызванной ВГС, у пациентов, включающий введение пациенту терапевтически эффективного количества соединения, относящегося к первому и второму аспектам настоящего изобретения, или его фармацевтически приемлемой соли. В первом варианте осуществления четвертого аспекта способ включает введение одного или двух дополнительных соединений, обладающих противовирусной активностью в отношении ВГС до, после или одновременно с соединением, относящимся к первому и второму аспектам настоящего изобретения, или его фармацевтически приемлемой солью. Во втором варианте осуществления четвертого аспекта по меньшей мере одно из дополнительных соединений является интерфероном или рибавирином. В третьем варианте осуществления четвертого аспекта интерферон выбран из группы,состоящей из интерферона альфа 2 В, пегилированного интерферона альфа, консенсусного интерферона,интерферона альфа 2 А и лимфобластоидного интерферона тау. В четвертом варианте осуществления четвертого аспекта настоящего изобретения представлен способ лечения ВГС у пациентов, в котором как минимум одно из дополнительных соединений выбрано из группы, состоящей из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое стимулирует развитие ответа Т-хелперов I типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, а также ингибитора инозин-5'-монофосфат-дегидрогеназы, амантадина и римантадина. В пятом варианте осуществления четвертого аспекта настоящего изобретения представлен способ лечения ВГС у пациентов в котором как минимум одно из дополнительных соединений эффективно подавляет функцию мишени, выбранной из группы, состоящей из металлопротеаз, сериновых протеаз, полимераз и хеликаз ВГС, протеина NS4B, а также посадки ВГС, сборки ВГС, выхода ВГС, протеина NS5A ВГС, а также ИМФДГ для лечения гепатита С. Другие варианты осуществления настоящего изобретения могут включать приемлемые сочетания двух или более вариантов и(или) аспектов, описанных выше. Тем не менее, как будет показано далее, возможны и другие варианты и аспекты приведенного изобретения. Соединения настоящего изобретения могут существовать и в форме таутомеров, поэтому данное описание охватывает также все таутомерные формы. Необходимо понимать, что соединения, охватываемые настоящим описанием, относятся к обладающим стабильностью, приемлемой для использования в качестве фармацевтических агентов. Все патенты, заявки на получение патента, а также литературные источники, упоминаемые в описании, включены в настоящее описание посредствм отсылки. В случае возникновения противоречий следует руководствоваться настоящим описанием, включая определения терминов. Термины, используемые в данном описании, имеют следующие значения. Термины "Структура" и "структура" в данном описании относятся к группе, которая помещается на атом азота терминального азотсодержащего кольца, например пирролидиновых колец соединения настоящего изобретения. Необходимо понимать, что "Структура" и "структура" могут относиться к реагенту, используемому для присоединения группы к терминальному азотсодержащему кольцу или фрагменту в готовом продукте, например "Структура-51" или "Фрагмент структуры-51, описанный в примере 5". В соединениях настоящего описания существуют асимметричные центры. Данные центры обозначены символом R или S, в зависимости от конфигурации заместителей вокруг хирального атома углерода. Необходимо понимать, что описание охватывает все стереохимические изомерные формы или их комбинации, обладающие способностью ингибировать NS5A. Отдельные стереоизомеры соединений могут быть изготовлены синтетически из коммерчески доступных исходных материалов, содержащих хиральные центры, или путем приготовления смесей энантиомерных продуктов с последующим их разделением путем преобразования в комбинацию диастереомеров с последующим разделением или вторичной кристаллизацией, хроматографическими методами или путем прямого разделения энантиомеров на хиральных хроматографических колонках Исходные соединения конкретной стереохимии либо являются коммерчески доступными на рынке, либо могут быть изготовлены и получены с помощью общеизвестных методов. Некоторые соединения, охватываемые настоящим описанием, могут также существовать в различных стабильных конформационных формах, которые могут быть разделены. Асимметрия поворота связей, связанная с ограниченным вращением вокруг асимметричной одинарной связи, например, вследствие пространственного затруднения или напряжения кольца, позволяет осуществлять разделение различных конформеров. В настоящее описание включены все конформационные изомеры данных соединений и их комбинаций. Термин "соединения, охватываемые настоящим описанием" и эквивалентные выражения, охватывает соединения настоящего изобретения, фармацевтически приемлемые энантиомеры, диастереомеры и их соли. Подобным образом, в тех случаях, когда исходя из контекста, это является приемлемым, ссылки на промежуточные химические соединения охватывают все их соли. Соединения, охватываемые настоящим описанием, могут существовать в виде фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" в данном описании относится к солям или цвиттер-ионным формам соединений, охватываемых настоящим описанием, которые растворимы в воде или масле или диспергируемы, и которые, на основании общепринятой медицинской оценки, пригодны для применения при контакте с тканями пациентов, т.е. не имеют значительного токсического воздействия, не вызывают раздражения, аллергических реакций, других проблем или осложнений, соразмерно целесообразному соотношению ожидаемой пользы/риска, и являются эффективными при их использовании по назначению. Соли могут быть приготовлены на этапе окончательного выделения в чистом виде и очистки соединения или же отдельно, путем вступления в реакцию с подходящим атомом азота с использованием соответствующей кислоты. Кислотно-аддитивные соли включают ацетат, адипат,альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат,диглюконат, дигидробромид, дигидрохлорид, дигидроиодид, глицерофосфат, гемисульфат, гептаноат,гексаноат, формиат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат,малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталинсульфонат,оксалат, пальмоат, пектинат, персульфат, 3-фенилпроприонат, пикрат, пивалат, пропионат, сукцинат,тартрат, трихлороацетат, трифтороацетат, фосфат, глютамат, двууглекислая соль, пара-толуолсульфонат и ундеканоат. Примеры кислот, которые могут использоваться для формирования фармацевтически приемлемых кислотно-аддитивных солей, включают неорганические кислоты, такие как соляная, бромистоводородная, серная и фосфорная, и органические кислоты, такие как щавелевая, малеиновая, янтарная и лимонная. Основные кислотно-аддитивные соли могут быть приготовлены во время этапа окончательного выделения в чистом виде и очистки соединения путем вступления в реакцию карбоксильной группы с соответствующим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла, или с аммиаком, или органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают в себя литий, натрий, калий, кальций, магний и алюминий, а также катионы нетоксичных четвертичных аминов, таких как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин,N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенетиламин и N,N'-дибензилэтилендиамин. Другие органические амины, которые могут использоваться для формирования основы кислотно-аддитивных солей, включают в себя этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. При использовании в терапевтических целях в тех случаях, когда это возможно, терапевтически эффективные дозы соединения настоящего изобретения, а также их фармацевтически приемлемые соли могут назначаться для применения в виде исходного химического вещества; при этом активный ингредиент может рассматриваться в качестве лекарственного препарата. В соответствии с этим, в дальнейшем в описании охватываются лекарственные препараты, которые включают терапевтически эффективные дозы соединения настоящего изобретения или их фармацевтически приемлемые соли, а также один или более фармацевтически приемлемых носителей, разбавителей или наполнителей. Термин "терапевтически эффективная доза" в данном описании относится к общему количеству каждого активного компонента, которое достаточно для выявления значимой пользы, приносимой пациенту, например снижения вирусной нагрузки. В отношении отдельного активного ингредиента, назначаемого отдельно, термин относится только к данному ингредиенту. Применительно к комбинации веществ, термин относится к общему количеству активных ингредиентов, которые приводят к возникновению терапевтического эффекта, вне зависимости от комбинированного, последовательного или одновременного способа их назначения. Описание соединений настоящего изобретения и их фармацевтически приемлемых солей приведено выше. Носитель(-и), разбавитель(-и) или наполнитель(-и) должны быть приемлемыми с точки зре-4 018782 ния совместимости с другими ингредиентами препарата и не должны оказывать вредного действия на лица, их принимающие. В соответствии с другим аспектом настоящего описания также приводится описание процесса для приготовления лекарственного препарата, включая введение добавок в соединение настоящего изобретения или их фармацевтически приемлемых солей, посредством одного или более фармацевтически приемлемых носителей, разбавителей или наполнителей. Термин "фармацевтически приемлемые" в данном описании относится к таким соединениям, материалам, композициям препаратов и(или) формам дозировки, которые, на основании общепринятой медицинской оценки, пригодны для применения при контакте с тканями пациентов и не вызывают чрезмерного токсического действия, раздражения, аллергических реакций, других проблем или осложнений, соразмерно целесообразному соотношению ожидаемой пользы/риска, и являются эффективными при их использовании по назначению. Описание фармацевтического состава может быть представлено в форме однократной дозы, содержащей предварительно установленное количество активного ингредиента на единицу дозы. Уровни дозировки соединений настоящего описания от примерно 0,01 и до примерно 250 миллиграмм на килограмм массы тела ("мг/кг") в сутки, предпочтительно от примерно 0,05 и до примерно 100 мг/кг массы тела в сутки, являются стандартными при проведении монотерапии с целью профилактики и лечения опосредованных ВГС заболеваний. Как правило, лекарственные препараты, охватываемые настоящим описанием, назначаются для приема от примерно 1 до примерно 5 раз в сутки или, в качестве альтернативы, в форме непрерывного вливания. Такое назначение может применяться при проведении лечения острых и хронических заболеваний. Количество активного ингредиента, которое может применяться в сочетании с материалами носителя с целью получения однократной лекарственной формы, может меняться в зависимости от состояния заболевания, степени тяжести заболевания, времени назначения препарата, способа введения, скорости вывода используемого соединения, длительности лечения, а также возраста, пола, веса и состояния здоровья пациента. Предпочтительными единицами дозировки препаратов являются дозировки, содержащие ежедневную дозу или субдозу активных ингредиентов, как приведено выше в настоящем документе, или их соответствующих долей. Проведение лечения может быть начато с невысоких уровней дозировки, значительно меньших, чем оптимальная доза соединения. Впоследствии, дозировка постепенно повышается с незначительным увеличением дозы до достижения оптимального эффекта в данных условиях. В целом, наиболее желательным способом назначения соединения является его введение с уровнем концентрации, который в целом позволяет достигнуть эффективного противовирусного результата, не причиняя при этом вреда или не вызывая вредных нежелательных явлений. В случаях, когда композиции препаратов в настоящем описании содержат комбинацию соединений,охватываемых настоящим описанием, а также одно или более дополнительных терапевтических или профилактических веществ, как само соединение, так и дополнительные вещества обычно присутствуют с уровнями дозировки в диапазоне от примерно 10 до 150%, однако, более предпочтительный уровень составляет от примерно 10 до 80% от уровня дозировки, обычно назначаемой при проведении монотерапии. Фармацевтические составы могут адаптироваться для введения одним из подходящих способов, например, в виде перорального приема (включая буккальный или подъязычный прием), ректального, назального, местного (включая буккальный или подъязычный прием, а также трансдермальное применение), вагинального или парентерального введения (включая подкожное, внутрикожное, внутримышечное, интраартикулярное, внутрисуставное, интрастернальное, интратекальное, введение внутрь поражнных тканей, внутривенные или внутрикожные инъекции или инфузии). Такие препараты могут изготавливаться любым известным в области фармакологии методом, например путем вступления в связь активного ингредиента с носителем(-ями) или наполнителем(-ями). Пероральное введение или инъекционное введение являются наиболее предпочтительными способами. Фармацевтические составы, адаптированные для перорального введения, могут создаваться в форме дискретных компонентов в виде капсул или таблеток; порошков или гранул; растворов или суспензий в водных и неводных жидкостях; съедобных пен или взбитых масс; или жидких эмульсий типа масло-вводе или эмульсий типа вода-в-масле. Например, для перорального введения в виде таблетки или капсулы, активное лекарственное вещество может быть скомбинировано с принимаемым перорально нетоксичным, фармацевтически приемлемым инертным носителем типа этанола, глицерина, воды и им подобным веществам. Приготовление порошков производится путем измельчения соединения в порошок до частиц подходящего размера и перемешивания со сходным образом измельченным фармацевтическим носителем типа съедобного углевода,например крахмала или маннитола. Также допускается присутствие ароматизаторов, консервантов, регуляторов сыпучести и окрашивающих веществ. Капсулы изготавливаются путем приготовления порошковой смеси, как описано выше, и заполнения сформированных желатиновых оболочек. Перед началом выполнения операции заполнения в порошковые смеси могут добавляться регуляторы сыпучести и смазывающие вещества типа коллоидной окиси кремния, талька, магния стеарата, кальция стеарата или твердого полиэтиленгликоля. Для улучшения доступности медикамента при проглатывании капсулы, в состав могут также добавляться вещества,-5 018782 способствующие распаду или солюбилизирующие компоненты типа агар-агара, карбоната кальция или карбоната натрия. Более того, при желании или в случае необходимости, в состав смесей также могут включаться необходимые связующие вещества, смазывающие вещества, вещества, способствующие расщеплению и окрашивающие вещества. Приемлемые связующие вещества включают в себя крахмал, желатин, природные виды сахара типа глюкозы или бета-лактозы, сахаристые вещества из кукурузы, природные и синтетические смолы типа камеди, траганта или натриевого альгината, карбоксиметилцеллюлозы, полиэтиленгликоля и им подобные вещества. Смазывающие вещества, используемые в данных лекарственных формах, включают в себя олеиновокислый натрий, натрий хлорид и им подобные вещества. Вещества, способствующие распаду, включают, без ограничений, крахмал, метилцеллюлозу, агар, бетонит,ксантановую камедь и им подобные вещества. Например, таблетки могут изготавливаться путем приготовления смеси порошка, гранулирования или агрегирования, добавления смазывающего вещества и вещества, способствующего распадению, и прессования в таблетки. Порошкообразная смесь приготовляется путем смешивания соединения, соответствующим образом измельченным, с разбавителем или основой, как указано выше, и при желании, со связующими веществами типа карбоксиметилцеллюлозы, альгината, желирующими веществами или поливинилпирролидоном, замедлителями для растворов типа парафина, ускорителями всасывания типа четвертичной соли и(или) поглощающими веществами типа бетонита, каолина или дифосфата кальция. Порошкообразная смесь может быть гранулирована путем смачивания связующими веществами, такими как сироп, крахмальная паста, акадийский растительный клей, или растворами из целлюлозных или полимерных материалов и пропускания под давлением через сетку-фильтр. В качестве альтернативы методу гранулирования, порошкообразная смесь может быть пропущена через машину для таблетирования, в результате чего будут получены не полностью сформированные заготовки, раздробленные на гранулы. К гранулам добавляются смазывающие вещества типа стеариновой кислоты, соли стеарата, талька или минерального масла, предотвращающие прилипание смеси к поверхностям пуассонов пресса, формирующих таблетки. Затем смесь с добавленными смазывающими веществами прессуется в таблетки. Соединения, охватываемые настоящим описанием, могут также применяться совместно с сыпучими инертными носителями и прессоваться в таблетки непосредственно, без прохождения через этапы гранулирования или агрегирования. На препараты может наноситься прозрачное или матовое защитное покрытие, состоящее из защитного покрытия шеллаком, покрытия из сахара или полимерного материала и полирующего покрытия из воска. Для различения разных дозировок к данным покрытиям могут добавляться красящие вещества. Принимаемые перорально жидкости типа растворов, сиропов и эликсиров приготавливаются в таких единицах дозирования, которое обеспечивает содержание необходимого количества предварительно установленного количества соединения. Сиропы могут быть приготовлены путем растворения соединения в соответствующем ароматизированном водном растворе, в то время как эликсиры приготовляются посредством использования нетоксичной среды для лекарства. К ним могут добавляться солюбилизаторы и эмульгаторы типа этоксилированных изостеариловых спиртов и полиоксиэтиленовых сорбитоловых эфиров, консерванты, ароматизирующие добавки типа мятного масла или натуральных подсластителей, сахарина или других искусственных подсластителей и им подобных веществ. При необходимости, дозировка препаратов для перорального введения может быть микроинкапсулирована. Препарат может быть также приготовлен для замедленного или пролонгированного высвобождения, например, путем нанесения покрытия или включения зернистого материала в полимеры, воск или им подобные вещества. Соединения настоящего изобретения и их фармацевтически приемлемых солей могут также вводиться в виде липосомных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные (многослойные) везикулы. Липосомы могут быть образованы из множества фосфолипидов, таких как холестерол, стеариламин или фосфадилхолины. Соединения настоящего изобретения и их фармацевтически приемлемые соли могут также доставляться путем использования моноклональных антител в качестве индивидуальных носителей, с которыми соединены молекулы соединения. Соединения также могут комбинироваться с растворимыми полимерами в качестве нацеленных носителей лекарственного средства. Такие полимеры могут включать в себя поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтил аспартамидфенол, или полиэтиленоксидполилизин, замещенный остатками пальмитоила. Кроме того, соединения могут быть соединены с классом биоразлагаемых полимеров, используемых в достижении контролируемого высвобождения лекарственного средства, например, полимолочной кислотой, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей. Фармацевтические составы, приспособленные для трансдермального применения, могут быть приготовлены в виде отдельных пластырей, предназначенных для применения в плотном контакте с эпидермисом пациента в течение продолжительного периода времени. Например, активный ингредиент может быть доставлен из пластыря путем применения электрофореза, как это в целом описано в "Фармацевти-6 018782 ческом Исследовании" 1986, 3(6), 318. Фармацевтические составы, приспособленные для местного применения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, присыпок, растворов, паст, гелей, спреев, аэрозолей или масел. Фармацевтические составы, приспособленные для ректального введения, могут быть доставлены с помощью суппозитариев или клизм. Фармацевтические составы, приспособленные для назального введения, где носителем является твердое вещество, включают в себя крупный порошок, с размером частиц в диапазоне от 20 до 500 мкм,который вводится путем вдыхания через нос, например быстрым вдыханием порошка через носовой ход из контейнера, поднесенного близко к носу. Подходящие препараты для введения в виде назального спрея или назальных капель, где носителем является жидкость, включают в себя водные или масляные растворы активного ингредиента. Фармацевтические составы, приспособленные для введения путем вдыхания, включают в себя присыпки из мельчайших частиц порошка или аэрозоли различных типов, с точной дозировкой препарата(аэрозоли под давлением, распылители или инсуффляторы). Фармацевтические составы, приспособленные для вагинального введения, могут быть приготовлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические составы, приспособленные для парентерального введения, включают в себя водные и неводные стерильные растворы для инъекций, которые содержат антиоксиданты, буферные растворы, бактериостатические средства и добавки, которые доводят препарат до изотонического состояния для введения в кровь предполагаемого пациента, водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие вещества и загустители. Препараты могут быть приготовлены и расфасованы в однодозовые или многодозовые контейнеры, например герметично запаянные ампулы и флаконы, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующим только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед их применением. Приготовленные для немедленного приема растворы для инъекций и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток. Необходимо понимать, что дополнительно к ингредиентам, конкретно упомянутым выше, состав препаратов может включать в себя другие вещества, традиционно используемые в фармацевтике с учетом типа обсуждаемого препарата, например, для перорального введения такими подходящими веществами могут служить ароматизирующие вещества. Термин "пациент" включает в себя человека и других млекопитающих. Термин "лечение" относится к (i) предупреждению возникновения заболевания, нарушения или состояния у пациента, который может быть предрасположен к возникновению заболевания, нарушения и(или) состояния, но еще не был диагностирован как имеющий таковые, (ii) приостановление развития заболевания, нарушения или состояния, например, посредством купирования их развития, и (iii) купирование заболевания, нарушения или состояния, например, добиваясь у пациента возникновения состояния ремиссии заболевания, нарушения или состояния. Соединения настоящего описания могут также вводиться с циклоспорином, например циклоспорином А. В. ходе клинических исследований была подтверждена активность циклоспорина при лечении ВГС (Hepatology 2003, 38, 1282, Biochem. Biophys. Res. Commun 2004, 313, 42, J Gastroenterol 2003, 38,567). В табл. 1 ниже приведены некоторые пояснительные примеры соединений, которые могут вводиться с соединениями настоящего описания. Соединения, охватываемые настоящим описанием, могут вводиться совместно с иными анти-ВГС активными соединениями при проведении комбинированной терапии, либо совместно или по отдельности, либо путем объединения соединений в композицию. Таблица 1 Соединения, упоминаемые в данном описании, также могут быть использованы в качестве лабораторных реагентов, для проведения исследований, в частности анализа вирусной репликации, валидации системы испытаний на животных, а также исследований в сфере структурной биологии для дальнейшего изучения механизмов действия ВГС. Кроме того, упомянутые соединения будут полезны при установлении или определении центров связывания других противовирусных соединений, например, путем конкурентного ингибирования. Соединения данного описания могут быть использованы для уничтожения вирусов, попавших на материалы, или профилактики их попадания и, следовательно, уменьшить риск инфицирования вирусами сотрудников лаборатории и медперсонала, а также пациентов, контактирующих с такими материалами, например, кровью, тканями, хирургическими и лабораторными инструментами и медицинской спецодеждой, аппаратами и материалами для забора и переливания крови. Настоящее описание охватывает соединения настоящего изобретения, образованные в результате процесса синтеза или метаболических процессов, включая процессы, характерные для организма человека или животного in vivo или процессов, происходящих in vitro. Аббревиатуры, используемые в настоящем приложении, в частности нижеследующих иллюстративных схемах и примерах, являются широко употребляемыми среди специалистов в данной области. Далее приводятся некоторые из них: время удерживания, ЭДКИ - 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, ДМАП - 4-диметиламинопиридин, ТГФ - тетрагидрофуран, ДБУ - 1,8-диазабицикло[5.4.0]ундец-7-ен, t-Bu, ДЭА - диэтиламин, ГМДС - гексаметилдисилазид, ДМФ - N,N-диметилформамид, Бзл - бензил, EtOH - этанол, изо-PrOH изопропанол, Me2S - диметилсульфид, Et3N или ТЭА - триэтиламин, Ph - фенил, ОАс - ацетат, EtOAc - этилацетат, дффф - 1,1'-бис(дифенилфосфино)ферроцен, изо-Pr2EtN или ДИПЭА - диизопропилэтиламин, Кбз карбобензилокси, n-BuLi-n-бутиллитий, АЦН - ацетонитрил, ч - час или часы, мин - минуты, с - секунды, LiГМДС - лития гексаметилдисилазид, ДИБ-Al - диизобутилалюминия гидрид, ТБДМС-Cl - трет-бутилдиметилсилилхлорид, Me - метил, ОАс - ацетат, изо-Pr - изопропил, Et - этил, Bn - бензил, и ГОАТ - 1-гидрокси 7-азабензотриазол. Для лучшего понимания соединений и процессов, о которых идет речь в данном изобретении, ниже приведены схемы синтеза. На них наглядно проиллюстрированы методы, при помощи которых могут быть получены соединения настоящего описания. Исходные материалы могут быть получены из коммерческих источников или подготовлены с использованием известных методов, описанных в узкоспециальной литературе. Для специалистов в данной сфере будет очевидным, что вышеупомянутые соединения могут быть синтезированы и путем замены соответствующих реагентов и агентов в указанных схемах синтеза, представленных ниже. Очевидным является и то, что этапы по селективной защите и снятию защиты, а также порядок этих этапов носят вариативный характер (в зависимости от особенностей переменных), который не влияет на успешность завершения процесса синтеза. Переменные соответствуют определениям, приведенным выше, если только прямо не указано иное. Схема 1. Симметричные или асимметричные бифенилы Арилгалогенид 1 и эфир бориновой кислоты 2 могут вступать в реакцию сочетания в стандартных условиях реакции сочетания Судзуки-Мияура [Suzuki-Miayura] (Angew Chem Int Ed Engl 2001, 40, 4544),что приводит к образованию биарила 3. Следует также отметить, что вместо эфира 2 возможно применение его аналога - бориновой кислоты. Если R12 и R13 - это различные заместители, то возможно удаление защитной группы с одной пирролидиновой группы. Если R12 = бензил, a R13 = трет-бутил, то обработка полученного соединения в гидрогенолитических условиях приводит к получению соединения 4. Например, может использоваться катализатор Pd/C в присутствии основания, такого как калия карбонат. Ацилирование соединения 4 может проводиться в стандартных условиях реакции ацилирования. В этом смысле может использоваться сочетающий реагент, такой как Н-АТУ, в комбинации с аминовым основанием, таким как основание Хунига. Кроме того, соединение 4 может реагировать с изоцианатом или карбамиолхлоридом, в результате получится соединение 5, где R9 - это амин. Удаление защитной группы из соединения 5 может осуществляться путм обработки сильной кислотой, такой как HCl или трифторуксусная кислота. Условия, аналогичные условиям превращения соединения 4 в 5, могут применяться и для получения соединения 7 из 6. В другом варианте осуществления изобретения, когда R12 = R13 = третBu, можно сразу получить соединение 8, обработав соединение 3 сильной кислотой, такой как HCl или трифторуксусная кислота. Превращение соединения 8 в 7 проводится аналогично превращению соединения 4 в 5 или соединения 6 в 7. В данном случае защитные группы ("крышки") в соединении 7 будут одинаковыми. Схема 2. Асимметричные молекулы бифенилов Превращение соединения 6 (из схемы 1) в 10 может проводиться в стандартных условиях реакции сочетания амида, таких как присутствие Н-АТУ и аминового основания, такого как основание Хунига. Удаление защитной группы может проводиться с помощью сильной кислоты, такой как HCl или трифторуксусная кислота, в результате чего получается соединение 11. Соединение 11 затем может быть превращено в соединения 12, 13 или 14; для этого применяется хлорангидрид, изоцианат или карбамоилхлорид, а также хлороформат (соответственно). Схема 3. Молекулы сложных симметричных бифенилов Соединение 15 (15 = 7 из схемы 1, где каждый из R9 - это -CH(NH-БОК)R18), может превращаться в соединение 16 путм обработки сильной кислотой, такой как HCl или трифторуксусная кислота. Из соединения 16 можно получить соединения 17, 18 и 19 путм обработки соединения 16, соответственно,хлороформиатом, изоцианатом или карбамоилхлоридом, а также хлорангидридом. Схема 4. Симметричные бифенилы Симметричные аналоги бифенилов (соединения с формулой 7, где обе половины молекулы одинаковы) могут синтезироваться из бромкетона 20. Аминирование путем замещения нуклеофилом, таким как азид, фталимид или (предпочтительно) натрия диформиламид (Yinglin and Hongwen, Synthesis 1990,122), с последующим удалением защитной группы приводит к образованию соединения 21. Конденсация в стандартных условиях реакции аминирования, таких как присутствие Н-АТУ и основания Хунига, с надлежащим образом защищенной аминокислотой приводит к образованию соединения 22. Нагревание с аммония ацетатом в тепловом или микроволновом режиме приводит к образованию соединения 3, защитная группа которого может быть удалена сильной кислотой, такой как HCl или трифторуксусная ки- 12018782 слота (R12 = R13 = трет-Bu), или путем гидрогенолиза в присутствии газообразного водорода и катализатора на основе металла, такого как Pd/C (R12 = R13 = бензил). Ацилирование может проводиться с карбоновой кислотой (R9CO2H), таким же образом, как превращение соединения 21 в 22. Обработка соответствующим изоцианатом (R9 = R24R25N, R25 = Н) или карбамоилхлоридом (R9 = R24R25N, R25 - любой радикал, за исключением атома Н) приводит к образованию мочевины Схема 5. Исходные соединения 25 и 2 Схема 5 описывает получение некоторых исходных соединений требуемых для цепочек синтеза,приведенных в схемах 1-4. Основное промежуточное соединение 25 (аналог 1 в схеме 1) получается из кетоамида 24 или кетоэфира 27 путем нагревания с аммония ацетатом в тепловом или микроволновом режиме. Кетоамид 24 может получаться из соединения 23 путем конденсации с соответствующей циклической или ациклической аминокислотой в стандартных условиях реакции образования амидов. Бромид 26 может использоваться для получения соединения 23 путем обработки нуклеофилом, таким как азид,фталимид или натрия диформиламид (Synthesis 1990, 122), с последующим удалением защитной группы. Бромид 26 может также превращаться в соединение 27, вступая в реакцию с соответствующей циклической или ациклической N-защищенной аминокислотой в присутствии основания, такого как калия карбонат или натрия бикарбонат. Бромирование соединения 28 источником иона бромония, таким как бром,N-БС или CBr4, приводит к образованию соединения 26 Бромид 25 может превращаться в эфир бориновой кислоты 2 путем обработки бис-пинаколатодибором в присутствии палладиевого катализатора, в соответствии с методикой, описанной в научной литературе (Journal of Organic Chemistry 1995, 60, 7508),или по другим методикам. Схема 6. Исходное соединение 31 а В другом варианте осуществления настоящего изобретения исходное соединение, такое как 31 а(аналог соединения 25 в схеме 5 и соединения 1 в схеме 1), может получаться в результате реакции производных бромимидазола 31 в условиях реакции сочетания Судзуки с различными хлорзамещенными арилбориновыми кислотами, которые могут быть получены по стандартным методикам (см., например,Organic Letters 2006, 8, 305, и литературные источники, указанные в этой статье) или приобретены у поставщиков химических реактивов. Бромимидазол 31 может получаться путем бромирования имидазола 30 источником иона бромония, таким как бром, CBr4 или N-бромсукцинимид. Имидазол 30 может полу- 13018782 чаться из N-защищенных аминокислот, соответствующим образом замещенных в реакции с глиоксалом в метаноловом растворе аммония гидроксида Схема 7. Гетероарилы. В ещ одном варианте осуществления этого изобретения арилгалогенид 32 может вступать в реакцию сочетания в условиях реакции Судзуки-Мияуры (Suzuki-Miyaura) и в присутствии палладиевого катализатора. В результате получается гетероарильное производное 34. Соединение 34 может быть превращено в соединение 35 путм обработки в гидрогенолитических условиях водородом в присутствии катализатора переноса на основе металла, такого как палладиево-угольный катализатор (R13 = бензил). Ацилирование соединения 35 может проводиться путм обработки соответствующим хлорангидридом(R9COCl) в присутствии основания, такого как триэтиламин, соответствующим образом замещнной карбоновой кислотой (R9CO2H) в присутствии стандартного реагента реакции сочетания, такого как НАТУ, изоцианатом (R27NCO, где R9 = R27R28N-; R28 =Н) или карбамоилхлоридом (R27R28NCOCl, гдеR9=R27R28N-). Соединение 37 может синтезироваться из соединения 36 (R=трет-Bu) путм обработки сильной кислотой, такой как HCl или трифторуксусная кислота. Ацилирование получившегося в результате амина 37 с образованием соединения 38 может проводиться таким же образом, как превращение соединения 35 в 36. В случаях, когда R12 = R13, соединение 34 может сразу же превращаться в соединение 39 путм обработки сильной кислотой, такой как HCl или трифторуксусная кислота (R12 = R13 = трет-Bu),или В условиях реакции гидрогенолиза в присутствии водорода и катализатора на основе металла, такого как палладиево-угольный катализатор (R12=R13= бензил). Ацилирование соединения 39 может проводиться по такой же методике, что и превращение соединения 35 в 36. Схема 8 Гетероарилхлорид 29 может превращаться в симметричный аналог 40 путм обработки источником палладия, таким как дихлорбис(бензонитрил)палладий, в присутствии тетракис(диметиламино)этилена при повышенной температуре. Удаление эфира СЭМ и карбамата БОК, которые входят в состав соединения 40, может проводиться в один этап путм обработки сильной кислотой, такой как HCl или трифто- 14018782 руксусная кислота, что приведт к получению соединения 41. Превращение в соединение 42 может проводиться в условиях, аналогичных тем, что используются для превращения соединения 38 в 39 в схеме 7. Схема 9. Молекулы асимметрично замещенных гетероакрилов Соединение 43 (аналог соединения 42, где R23 = -CH(NHBoc)R24) может превращаться в соединения 45, 46 и 47 по таким же методикам, которые описаны в схеме 3 В случаях, когда R20 = алкоксиметил (например, СЭМ), удаление защитной группы может проводиться одновременно с удалением карбамата БОК (превращение соединения 43 в 44) путем обработки сильной кислотой, такой как HCl или трифторуксусная кислота Схема 10. Исходное соединение 29 Гетероарилбромид 54 может вступать в реакцию с винилстаннаном, таким как трибутил(1-этоксивинил)тин, в присутствии источника палладия, такого как дихлорбис(трифенилфосфин)палладий (II), что приведет к получению соединения 55, которое далее может превращаться в бромкетон 51 путем обработки источником ионов бромония, таким как N-бромсукцинимид, CBr4 или бром. С другой стороны,кето-замещенные гетероарильные бромиды 53 могут непосредственно превращаться в соединение 51 путем обработки источником иона бромония, таким как бром, CBr4 или N-бромсукцинимид. Бромид 57 может превращаться в аминокетон 48 путем обработки натрия азидом, калия фталимидом или натрия диформиламидом (Synthesis 1990, 122) с последующим удалением защитной группы Аминокетон 48 может затем сочетаться с соответствующим образом замещенной аминокислотой в стандартных условиях реакции образования амидов (т.е. присутствие реагента реакции сочетания, такого как Н-АТУ, и мягкого основания, такого как основание Хунига), что приведет к получению соединения 49. Соединение 49 может затем превращаться в имидазол 50, вступая в реакцию с аммония ацетатом при нагревании в тепловом или микроволновом режиме. С другой стороны, соединение 57 может вступать в реакцию непосредственно с соответствующим образом замещенной аминокислотой в присутствии основания, такого как натрия бикарбонат или калия карбонат, что приведет к получению соединения 52 Это соединение, в свою очередь, может вступать в реакцию с ацетатом аммония при нагревании в тепловом или микроволновом режиме, что приведт к получению соединения 50. Имидазол 50 может приобретать защитную алкоксиметиловую группу путм обработки соответствующим алкоксиметилгалогенидом, таким как 2(триметилсилил)этоксиметилхлорид, после депротонирования сильным основанием, таким как натрия гидрид. Схема 11. Замещенные фенилглициновые производные соединения Замещенные фенилглициновые производные соединения можно получить с помощью ряда методов,иллюстрируемых ниже. Фенилглициновый t-бутил эфир может быть подвергнут восстановительному алкилированию (реакционный путь А) соответствующим альдегидом и восстановителем, как, например,натрий цианоборогидрид в кислотной среде. Гидролиз t-бутил эфира может выполняться сильной кислотой, например, HCl или трифторуксусной кислотой. Альтернативно, фенилглицин может алкилироваться галоидалкилом, например, йодистым этилом, и таким основанием, как бикарбонат натрия или карбонат калия (реакционный путь В). Реакционный путь С иллюстрирует восстановительное алкилирование фенилглицина, как в реакционном пути А, с последующим вторичным восстановительным алкилированием дополнительным=альтернативным альдегидом, например формальдегидом, при наличии восстановителя и кислоты. Реакционный путь D иллюстрирует синтез замещенных фенилглицинов с помощью соответствующих аналогов миндальной кислоты. Преобразование вторичного спирта в компетентную уходящую группу может выполняться с помощью р-толуолсульфонил хлорида. Смещение тозилатной группы соответствующим амином с последующим восстановительным удалением бензилового эфира может дать замещенные фенилглициновые производные соединения. В реакционном пути Е рацемическое замещенное фенилглициновое производное соединение растворяется путем эстерификации энантиомерно чистым хиральным вспомогательным ингредиентом, как например, но не ограничиваясь этим, (+)-1-фенилэтанол, (-)-1-фенилэтанол, оксазолидинон Эвана, или энантиомерно чистым пантолактоном. Разделение диастереомеров выполняется с помощью хроматографии (силикагель, HPLC- высокоэффективная жидкостная хроматография, кристаллизация, и т.д.) с последующим удалением хирального вспомогательного ингредиента с получением энантиомерно чистых фенилглициновых производных. Реакционный путь Н иллюстрирует синтетическую последовательность, которая пересекается с реакционным путем Е, в котором вышеупомянутый хиральный вспомогательный ингредиент вводится до добавления амина. Альтернативно, эфир арилуксусной кислоты может бромироваться источником иона бромониума, например,бром, N-бромосукцинимид или CBr4. Получающийся бензиновый бромид может быть заменен рядом моно- или ди-замещенных аминов при наличии основания третичного амина, как например триэтиламин или основание Хунига. Гидролиз метилового эфира с помощью обработки гидроокисью лития при низкой температуре или 6N HCl при повышенной температуре дает замещенные фенилглициновые производные. Другой метод демонстрируется маршрутом реакции G. Аналоги глицина могут быть дериватизированы рядом арилгалогенидов при наличии источника палладия (0), например палладий бис(трибутилфосфин), и такого основания, как например фосфорнокислый калий. Получающийся эфир может быть затем гидролизован путем обработки основанием или кислотой. Следует знать, что существуют другие известные методы получения фенилглициновых производных соединений, которые можно корректировать для получения нужных соединений в соответствии с данным описанием. Следует также понимать, что конечные фенилглициновые производные соединения можно очистить до энантиомерной чистоты свыше 98% энантиомерного избытка с помощью препаративной HPLC. Схема 12. Ацилированные аминокислотные производные В другом примере осуществления настоящего изобретения ацилированные фенилглициновые производные можно получить, как показано ниже. Фенилглициновые производные, в которых карбоновая кислота защищена как легко удаляемый эфир, можно ацилировать хлорангидридом при наличии основания, как, например, триэтиламин, для получения соответствующих амидов (реакционный путь А). Реакционный путь В иллюстрирует ацилирование исходного фенилглицинового производного соответствующим хлороформатом, тогда как реакционный путь. С показывает реакцию с соответствующим изоцианатом или карбамоил хлоридом. Каждый из трех интермедиатов, показанных в реакционных путях А- С, может быть лишен защиты методами, известными специалистам в данной области (то есть, обработка трет-бутилового эфира сильной кислотой, как, например, HCl или трифторуксусная кислота). Схема 13. Аминозамещенные фенилуксусные кислоты можно получить путем обработки хлорометилфенилуксусной кислотой с избытком амина. Условия анализа соединения Оценка чистоты и массовый анализ с низким разрешением выполнены на системе жидкостной хроматографии Shimadzu, соединенной с масс-спектрометрической системой Waters Micromass ZQ MS. Следует отметить, что время отстаивания может немного отличаться в зависимости от приборов. Условия ЖХ, используемые для определения времени удерживания (ВУ), были следующие. Дополнительные условия ЖХ применимы и к настоящему разделу, если прямо не указано иное. Синтез общих структур Структура 1 Суспензия 10% Pd/C (2,0 г) в метаноле (10 мл) была добавлена к смеси (R)-2-фенилглицина (10 г,66,2 ммоль), формальдегида (33 мл из 37 мас.% в воде), 1N HCl (30 мл) и метанола (30 мл) и подвергнута воздействию Н 2 (60 фунт/дюйм 2) в течение 3 ч. Реакционную смесь отфильтровали через диатомитовый фильтр (Celite), фильтрат подвергли концентрированию в вакууме. Полученное сырье перекристаллизовали из изопропанола для получения HCl-соли структуры-1 в виде белых игл (4,0 г). Оптическое вращение -117,1 [с = 9,95 мг/мл в Н 2 О,= 589 нм], 1 Н спектрометрия ЯМР -30 (ДМСО-d6, = 2,5 м.д., 500 МГц)7,43-7,34 (m, 5H), 4,14 (s, 1H), 2,43 (s, 6H), ЖХ (условие 1) ВУ=0,25, жидкостная хроматография/масс-спектрометрия (ЖХ/МС) аналогично рассчитанному для [М+Н]+ C10H14NO2 180,10, обнаружено 180,17, масс-спектрометрия высокого разрешения аналогично рассчитанному для [М+Н]+ C10H14NO2 180,1025, обнаружено 180,1017. Структура 2NaBH3CN (6,22 г, 94 ммоль) порциями, с интервалами в нескольких минут, добавляют в охлажденную (лед/вода) смесь (R)-2-фенилглицина (6,02 г, 39,8 ммоль) и метанола (100 мл) и перемешивают в течение 5 мин. Ацетальдегид (10 мл) добавляют по каплям в течение 10 мин и продолжают перемешивать при той же пониженной температуре в течение 45 мин и затем при комнатной температуре в течение 6,5 ч. Реакционную смесь охлаждают в ванне с водой и льдом, обрабатывают водой (3 мл) и затем гасят с использованием концентрированной HCl, вводимой по каплям, в течение 45 мин, пока рН смеси не достигнет 1,5-2,0. Охлаждающую ванну убирают и продолжают перемешивание, добавляя концентрированную HCl для поддержания рН смеси на уровне 1,5-2,0. Реакционную смесь перемешивают в течение ночи, фильтруют, чтобы удалить белую суспензию, полученный фильтрат концентрируют в вакууме. Сырой материал перекристаллизовывают из этанола для получения HCl-соли структуры-2 в виде блестящего белого твердого тела в двух порциях (порция 1 4,16 г, порция 2 2,19 г). 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 400 МГц) 10,44 (1,00, Br s, 1H), 7,66 (m, 2H), 7,51 (m, 3H), 5,30 (s, 1H), 3,15(br m, 2H), 2,98 (br m, 2H), 1,20 (арр br s, 6H). Порция 1 []25 -102,21 (с = 0,357, Н 2 О), порция 2 []25 99,7 (с = 0,357, Н 2 О). ЖХ (условие 1) ВУ = 0,43 мин, ЖХ/МС аналогично рассчитанному для [М+Н]+HCl (30 мл) и метанола (40 мл). Охлаждающую ванну убирают, а реакционную смесь перемешивают в присутствии Н 2 в течение 17 ч. Затем опять добавляют ацетальдегид (10 мл, 178,2 ммоль) и продолжают перемешивание в присутствии Н 2 в течение 24 ч. [Примечание: объемы Н 2 восполняют по мере необходимости, пока идет реакция]. Реакционную смесь фильтруют через диатомитовый фильтр (Celite),фильтрат подвергают концентрированию в вакууме полученное сырье перекристаллизовывают из изопропанола для получения HCl-соли (R)-2-(этиламино)-2-фенилуксусной кислоты в виде блестящего белый твердого тела (2,846 г). 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м д, 400 МГц)14,15 (br s, 1H),9,55 (br s, 2H), 7,55-7,48 (m, 5H), 2,88 (br m, 1H), 2,73 (br m, 1H), 1,20 (app t, J=7,2, 3 Н) ЖХ (условие 1) ВУ=0,39 мин, индекс гомогенности 95 %, ЖХ/МС аналогично рассчитанному для [М+Н]+ C10H14NO2 180,10, обнаружено 180,18. Суспензию 10% Pd/C (536 мг) в метаноле/ Н 2 О (3 мл/1 мл) добавляют к смеси (R)-2-(этиламино)-2 фенилуксусной кислоты/ HCl (1,492 г, 6,918 ммоль), формальдегида (20 мл 37% массы в воде), 1N HCl(20 мл) и метанола (23 мл) Реакционную смесь перемешивают в присутствии Н 2 в течение 72 ч, запасы Н 2 восполняют по мере необходимости. Реакционную смесь отфильтровывают через диатомитовый фильтр (Celite), фильтрат подвергают концентрированию в вакууме. Полученное сырье перекристаллизовывают из изопропанола (50 мл) для получения HCl-соли структуры-3 в виде белого твердого тела (985 мг). 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 400 МГц)10,48 (br s, 1H), 7,59-7,51 (m, 5 Н), 5,26 (s,1H), 3,08 (арр br s, 2H), 2,65 (br s, 3H), 1,24 (br т, 3 Н). ЖХ (условие 1) ВУ=0,39 мин, индекс гомогенности- 1901878295%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C11H16NO2 194,12, обнаружено 194,18, МСВР аналогично рассчитанному для [М+Н]+ C11H16NO2 194,1180, обнаружено 194,1181. Структура 4ClCO2Me (3,2 мл, 41,4 ммоль) добавляют по каплям к охлажденному (лед/вода) тетрагидрофурану(410 мл), полураствору (R)-трет-бутил 2-амино-2-фенилацетату/HCl (9,877 г, 40,52 ммоль) и диизопропилэтиламину (14,2 мл, 81,52 ммоль) в течение 6 мин и перемешивают при аналогичной температуре в течение 5,5 ч. Летучие компоненты удаляют в вакууме, остаток распределяют между водой (100 мл) и этилацетатом (200 мл). Органический слой промывают при помощи 1N HCl (25 мл) и насыщенного раствора NaHCO3 (30 мл), сушат (MgSO4), фильтруют и подвергают концентрированию в вакууме. Полученное бесцветное масло тритурируют от гексанов, фильтруют и промывают гексанами (100 мл), получая таким образом (R)-трет-бутил 2-(метоксикарбониламино)-2-фенилацетат в виде белого твердого вещества (7,7 г). 1 Н спектрометрия ЯМР (ДМСО-d6, =2,5 м. д., 400 МГц) 7,98 (d, J = 8,0, 1H), 7,37-7,29 (m,5H), 5,09 (d, J = 8, 1H), 3,56 (s, 3H), 1,33 (s, 9H). ЖХ (условие 1) ВУ = 1,53 мин, индекс гомогенности 90%, ЖХ/МС аналогично рассчитанному для [М+Na]+ C14H19NNaO4 288,12, обнаружено 288,15. Трифторуксусную кислоту, ТФУК (16 мл) добавляют по каплям в охлажденный (лед/вода) растворCH2Cl2 (160 мл) вышеописанного продукта в течение 7 мин. Затем охлаждающую ванну удаляют, а реакционную смесь перемешивают в течение 20 ч. Поскольку снятие защиты еще не завершено, вводят дополнительное количество ТФУК (1,0 мл) и продолжают перемешивание еще в течение 2 ч. Летучие компоненты удаляют в вакууме, а полученный в результате масляный остаток обрабатывают диэтиловым эфиром (15 мл) и гексанами (12 мл), до выпадения осадка. Полученный осадок фильтруют и промывают в диэтиловом эфире и гексане (в соотношении 13,30 мл), затем высушивают в вакууме. Таким образом,получают структуру-4 в виде вспененного белого твердого тела (5,57 г). Оптическое вращение -176,9 [с= 3,7 мг/мл в H2O, = 589 нм], 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 400 МГц)12,84 (br s, 1H),7,96 (d, J = 8,3, 1H), 7,41-7,29 (m, 5 Н), 5,14 (d, J = 8,3, 1H), 3,55 (s, 3 Н). ЖХ (условие 1) ВУ = 1,01 мин,индекс гомогенности 95%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C10H12NO4 210,08, обнаружено 210,17, МСВР аналогично рассчитанному для [М+Н]+ C10H12NO4 210,0766, обнаружено 210,0756. Структура 5 Смесь (R)-2-фенилглицина (1,0 г, 6,62 ммоль), 1,4-дибромбутана (1,57 г, 7,27 ммоль) и Na2CO3 (2,10 г, 19,8 ммоль) в этаноле (40 мл) нагревают при температуре 100 С в течение 21 ч. Реакционную смесь охлаждают до комнатной температуры и фильтруют, фильтрат подвергают концентрированию в вакууме. Остаток растворяют в этаноле и подкисляют в 1N HCl до рН 3-4, летучие компоненты удаляют в вакууме. Полученное сырье очищают с использованием обращенно-фазовой ВЭЖХ (вода/метанол/ТФУК),получая таким образом ТФУК-соль структуры-5 в виде полувязкой белой пены (1,0 г). 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м д , 500 МГц)10,68 (br s, 1 Н), 7,51 (m, 5 Н), 5,23 (s, 1H), 3,34 (арр br s, 2 Н), 3,05(арр br s, 2H), 1,95 (арр br s, 4H), ВУ=0,30 мин (условие 1), индекс гомогенности 98%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C12H16NO2 206,12, обнаружено 206,25 Структура 6 ТФУК-соль структуры-6 был синтезирован из (R)-2-фенилглицина и 1-бром-2-(2-бромэтокси)этана с помощью метода, использованного для получения структуры-5. 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 500 МГц)12,20 (br s, 1H), 7,50 (m, 5H), 4,92 (s, 1H), 3,78 (арр br s, 4H), 3,08 (арр br s, 2H), 2,81(арр br s, 2H), ВУ = 0,32 мин (условие 1), 98%, ЖХ/МС аналогично рассчитанному для [М+Н]+C12H16NO3 222,11, обнаружено 222,20, МСВР аналогично рассчитанному для [М+Н]+ C12H16NO3 222,1130, обнаружено 222,1121 Структура 7CH2Cl2 (200 мл) раствор р-толуолсульфонилхлорида (8,65 г, 45,4 ммоль) добавляют по каплям к охлажденному (-5 С) CH2Cl2 (200 мл) раствору (S)-бензил 2-гидрокси-2-фенилацетата (10,0 г, 41,3 ммоль),триэтиламина (5,75 мл, 41,3 ммоль) и 4-диметиламинопиридина (0,504 г, 4,13 ммоль), поддерживая температуру в диапазоне от -5 С до 0 С. Реакционную смесь перемешивают при 0 С в течение 9 ч, а затем помещают в морозильную камеру (-25 С) на 14 ч. Затем смеси дают оттаять при комнатной температуре и промывают ее водой (200 мл), 1N HCl (100 мл) и солевым раствором (100 мл), высушивают (MgSO4),фильтруют и концентрируют в вакууме, получая таким образом бензил 2-фенил-2-(тосилкоси)ацетат в виде вязкого масла, которое через некоторое время затвердевает (16,5 г). Хиральная целостность продукта не проверялась, продукт был использован в дальнейшей цепи превращений без дальнейшей очистки. 1(m, 2 Н), 6,12 (s, 1H), 5,16 (d, J = 12,5, 1H), 5,10 (d, J = 12,5, 1H), 2,39 (s, 3 Н) ВУ = 3,00 (условие 21), индекс гомогенности 90%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C22H20NaO5S 419,09, обнаружено 419,04. Тетрагидрофуран (75 мл) раствор бензил 2-фенил-2-(тосилокси)ацетата (6,0 г, 15,1 ммоль), 1 метилпиперазина (3,36 мл, 30,3 ммоль) и N, N-диизопропилэтиламина (13,2 мл, 75,8 ммоль) нагревают при температуре 65 С в течение 7 ч. Реакционную смесь охлаждают до комнатной температуры, летучие компоненты удаляют в вакууме. Остаток распределяют между этилацетатом и водой, органический слой промывают водой и солевым раствором, высушивают (MgSO4), фильтруют и концентрируют в вакууме. Полученный сырьевой материал очищают с помощью флэш-хроматографии (силикагель, этил ацетат), в результате чего образуется бензил 2-(4-метилпиперазин-1-ил)-2-фенилацетат в виде оранжевокоричневого вязкого масла (4,56 г). Хиральный ВЭЖХ-анализ (на аппарате Chiralcel OD-H) показал, что образец представляет собой смесь энантиомеров в соотношении 38,2 к 58,7. Разделение энантиомеров производится следующим образом продукт растворяют в 120 мл этанола/гептана (1 1) и вводят (5 мл/ ввод) в хиральную колонку ВЭЖХ (аппарат Chiracel OJ, 5 см ID50 см L, 20 моль), элюируя с 85 15 гептаном/этанолом при скорости потока 75 мл/мин и длине волны 220 нм. В результате получают энантиомер-1 (1,474 г) и энантиомер-2 (2,2149 г), оба в виде вязкого масла. 1 Н спектрометрия ЯМР (дейтерированный хлороформ CDCl3,= 7,26, 500 МГц) 7,44-7,40 (m, 2 Н), 7,33-7,24 (m, 6 Н), 7,21-7,16 (m, 2 Н),5,13 (d, J = 12,5, 1H), 5,08 (d, J = 12,5, 1H), 4,02 (s, 1H), 2,65-2,38 (арр br s, 8H), 2,25 (s, 3 Н) ВУ=2,10 (Условие 21), индекс гомогенности 98%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C20H25N2O2 325,19, обнаружено 325,20. Метанол (10 мл) раствор любого из двух энантиомеров бензил 2-(4-метилпиперазин-1-ил)-2 фенилацетат (1,0 г, 3,1 ммоль) добавляют к суспензии 10% Pd/C (120 мг) в метаноле (5,0 мл). Реакционную смесь подвергают воздействию водорода, под тщательным наблюдением, на 50 мин. Сразу после завершения реакции, катализатор фильтруют через диатомитовый фильтр (Celite) и фильтрат концентрируют в вакууме, в результате получают структуру-7, контаминированную с фенилуксусной кислотой,в виде желто-коричневой пены (867,6 мг, масса выше теоретического выхода). Продукт был использован для следующего этапа без дополнительной очистки 1 Н спектрометрия ЯМР (ДМСО-d6, =2,5 м.д., 500 МГц)7,44-7,37 (m, 2H), 7,37-7,24 (m, 3H), 3,92 (s, 1H), 2,63-2,48 (арр br s, 2H), 2,48-2,32 (m, 6 Н), 2,19 (s,3H), ВУ=0,31 (условие 2), индекс гомогенности 90%, ЖХ/МС аналогично рассчитанному для [М+Н]+C13H19N2O2 235,14, обнаружено 235,15, МСВР аналогично рассчитанному для [М+Н]+ C13H19N2O2 235,1447, обнаружено 235,1440. Синтез структуры-8 и структуры-9 проводится по аналогии с синтезом 15 структуры-7 при помощи соответствующих аминов для смещения SN2 (например, 4-гидроксипиперидин для структуры-8 и (S)-3 фторопирролидин для структуры-9), однако при измененных условиях разделения соответствующих стереоизомерных интермедиатов, которые описаны ниже. Структура 8 Разделение энантиомеров интермедиата бензил 2-(4-гидроксипиперидин-1-ил)-2-фенилацетата осуществляется при следующих условиях: соединение (500 мг) растворяют в этаноле/гептане (5 мл/45 мл) Полученный раствор вводят (5 мл/ввод) в хиральную колонку ВЭЖХ (Chiracel OJ, 2 см ID25 см L,10 моль), элюируя с 80 20 гептаном/этанолом при скорости 10 мл/мин, длине волны 220 нм В результате получают 186,3 мг энантиомера-1 и 209,1 мг энантиомера-2 в виде светло-желтого вязкого масла. Эти бензиловые эфиры подвергают гидрогенолизу, подобно приготовлению структуры-7, получая таким образом структуру-8. 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 500 МГц) 7,40 (d, J =7, 2 Н), 7,28-7,20(m, 3H), 3,78 (s 1 Н), 3,46 (m, 1H), 2,93 (m, 1 Н), 2,62 (m, 1H), 2,20 (m, 2 Н), 1,70 (m, 2 Н), 1,42 (m, 2 Н) ВУ = 0,28 (условие 2), индекс гомогенности 98%, ЖХ/МС аналогично рассчитанному для [М+Н]+ Ci3H18NO 236,13, обнаружено 236,07, МСВР рассчитано для [М+Н]+ C13H18NO3 236,1287, обнаружено 236,1283 Разделение диастереомеров интермедиата бензил 2-S)-3-фторопирролидин-1-ил)-2-фенилацетата осуществляется при следующих условиях: эфир (220 мг) разделяют в хиральной колонке ВЭЖХ (ChiracelOJ-H, 0,46 см ID25 см L, 5 моль), элюируя с 95% СО 2/5% метанола с 0,1% ТФУК, при давлении 10 бар, скорости потока 70 мл/мин и температуре 35 С. Элюат ВЭЖХ для соответствующих стереоизомеров концентрируют, остаток растворяют в CH2Cl2 (20 мл) и промывают в водной среде (10 мл воды + 1 мл насыщенного раствора NaHCO3). Органическую фазу сушат (MgSO4), отфильтровывают и концентрируют в вакууме. В результате получают 92,5 мг фракции-1 и 59,6 мг фракции-2. Эти бензиловые эфиры подвергают гидрогенолизу способом, аналогичным использованному для получения структуры-7, таким образом, образуются структуры 9 а и 9b структура-9 а (диастереомер-1, образец представляет собой соль ТФУК, полученной в результате очистки на обратной фазовой ВЭЖХ с использованием растворителяm, J =53,7, 1H), 5,09 (br s, 1H), 3,84-2,82 (br m, 4 Н), 2,31-2,09 (m, 2 Н) ВУ = 0,42 (условие 1), индекс гомогенности 95%, ЖХ/МС аналогично рассчитанному для [М+Н]+ C12H15FNO2 224,11, обнаружено 224,14. Структура-9b (диастереомер-2): 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м д, 400 МГц) 7,43-7,21 (m,5H), 5,19 (d от m, J =55,9, 1H), 3,97 (s, 1H), 2,95-2,43 (m, 4H), 2,19-1,78 (m, 2 Н) ВУ=0,44 (условие 1),ЖХ/МС аналогично рассчитанному для [М+Н]+ C12H15FNO2 224,11, обнаружено 224,14. Структура 10 К раствору D-пролина (2,0 г, 17 ммоль) и формальдегида (2,0 мл 37% массы в H2O) в метаноле (15 мл) добавить суспензию 10% Pd/C (500 мг) в метаноле (5 мл). Смесь перемешивают в присутствии водорода в течение 23 ч. Реакционную смесь фильтруют через диатомитовый фильтр (Celite) и концентрируют в вакууме. В результате получают структуру-10 в виде белого твердого вещества (2,15 г). 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 500 МГц): 3,42 (m, 1H), 3,37 (dd, J = 9,4, 6,1, 1 Н), 2,85-2,78 (m,1H), 2,66 (s, 3H), 2,21-2,13 (m, 1H), 1,93-1,84 (m, 2 Н), 1,75-1,66 (m, 1H). ВУ = 0,28 (Условие 2); индекс гомогенности 98%; ЖХ/МС: аналогично рассчитанному для [М+Н]+ C6H12NO2: 130,09; обнаружено 129,96. Структура 11 Смесь (2S,4R)-4-фторопирролидин-2-карбоновой кислоты (0,50 г, 3,8 ммоль), формальдегида (0,5 мл 37 мас.% в Н 2 О), 12 N HCl (0,25 мл) и 10% Pd/C (50 мг) в метаноле (20 мл) перемешивают в присутствии водорода в течение 19 ч. Реакционную смесь фильтруют через диатомитовый фильтр (Celite); фильтрат концентрируют в вакууме. Остаток рекристаллизируют из изопропанола, в результате получают HCl-соль структуры-11 в виде белого твердого вещества (337,7 мг). 1 Н спектрометрия ЯМР (ДМСОd6, = 2,5 м.д., 500 МГц): 5,39 (d m, J =53,7, 1H), 4,30 (m, 1H), 3,90 (ddd, J =31,5, 13,5, 4,5, 1H), 3,33 (dd, J=25,6, 13,4, 1H), 2,85 (s, 3H), 2,60-2,51 (m, 1H), 2,39-2,26 (m, 1H). ВУ=0,28 (условие 2); индекс гомогенности 98%; ЖХ/МС: аналогично рассчитанному для [М+Н]+ C6H11FNO2: 148,08; обнаружено 148,06. Структура 12L-аланин (2,0 г, 22,5 ммоль) растворяют в 10%-ном водном растворе карбоната натрия (50 мл), к нему добавляют тетрагидрофуран (50 мл) раствор метил хлорформиата (4,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4,5 ч и концентрируют в вакууме. Полученное белое твердое вещество растворяют в воде и подкисляют при помощи 1N HCl до рН 2-3. Полученный раствор экстрагируют с помощью этилацетата (3100 мл); объединенную органическую фазу сушат (Na2SO4),фильтруют и концентрируют в вакууме, получают бесцветное масло (2,58 г). 500 мг этого материала очищают посредством обращенно-фазовой ВЭЖХ (H2O/метанол/ТФУК), в результате образуется 150 мг структуры-12 в виде бесцветного масла. 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 500 МГц): 7,44 (d,J =7,3, 0,8 Н), 7,10 (br s, 0,2H), 3,97 (m, 1H), 3,53 (s, 3H), 1,25 (d,=7,3, 3 Н). Структура 13 Смесь L-аланина (2,5 г, 28 ммоль), формальдегида (8,4 г, 37 мас.%), 1N HCl (30 мл) и 10% Pd/C (500 мг) в метаноле (30 мл) перемешивают в присутствии водорода (50 фунт/дюйм 2) в течение 5 ч. Реакционную смесь фильтруют через диатомитовый фильтр (Celite), фильтрат концентрируют в вакууме. В результате образуется HCl соль структуры-13 в виде масла, которое затвердевает в вакууме (4,4 г; масса выше теоретического выхода). Продукт был использован без дополнительной очистки. 1 Н спектрометрия ЯМР (ДМСО-d6, = 2,5 м.д., 500 МГц):12,1 (br s, 1H), 4,06 (q, J =7,4, 1H), 2,76 (s, 6H), 1,46 (d,J =7,3,3 Н). Структура 14 Этап 1. Смесь (R)-(-)-D-фенилглицин трет-бутилового эфира (3,00 г, 12,3 ммоль), NaBH3CN (0,773 г, 12,3 ммоль), KOH (0,690 г, 12,3 ммоль) и уксусной кислоты (0,352 мл, 6,15 ммоль) перемешивают в метаноле при 0 С. К этой смеси добавляют глутаровый диальдегид (2,23 мл, 12,3 ммоль) по каплям в течение 5 мин. Реакционную смесь перемешивают и дают нагреться до комнатной температуры; затем продолжают перемешивание при той же температуре в течение 16 ч. Растворитель впоследствии удаляют, а остаток разводят 10% водным раствором NaOH и этилацетата. Органическую фазу отделяют, сушат(MgSO4), фильтруют и концентрируют досуха, чтобы получилось прозрачное масло. Этот материал очищают обращенно-фазовой ВЭЖХ (Primesphere C-18, 30100 мм; CH3CN-H2O-0,1% ТФУК), получая таким образом промежуточный эфир (2,70 г, 56%) в виде прозрачного масла. 1 Н спектрометрия ЯМР (400 МГц, CDCL3)7,53-7,44 (m, 3H), 7,40-7,37 (m, 2 Н), 3,87 (d, J =10,9 Гц, 1H), 3,59 (d, J =10,9 Гц, 10 1 Н),2,99 (t, J =11,2 Гц, 1H), 2,59 (t, J =11,4 Гц, 1H), 2,07-2,02 (m, 2H), 1,82 (d, J =1,82 Гц, 3H), 1,40 (s, 9H). ЖХ/МС: аналогично рассчитанному для C17H25NO2: 275; обнаружено: 276 (М+Н)+. Этап 2. К размешанному раствору промежуточного эфира (1,12 г, 2,88 ммоль) в дихлорметане (10 мл) добавляют ТФУК (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, а затем ее концентрируют до сухости, чтобы получилось светло-желтое масло. Масло очищают с использованием обратно-фазовой ВЭЖХ (Primesphere C-18, 30100 мм; CH3CN-H2O-0,1% TFA). Соответствующие фракции объединяют и концентрируют в вакууме до сухости. Остаток растворяют в минимальном количестве метанола и наносят на МСХ LP экстракционные патроны (картриджи) (26 г). Патроны промывают метанолом (40 мл), а затем желаемое соединение элюируют с использованием 2 М аммиака в метаноле (50 мл). Фракции, содержащие продукт, объединяют и концентрируют, остаток растворяют в воде. Лиофилизация этого раствора позволяет получить целевое соединение (0,492 г, 78%) в виде светло-желтого твердого вещества. 1 Н спектрометрия ЯМР (ДМСО-d6)7,50 (s, 5H), 5,13 (s, 1H), 3,09 (brs, 2H), 2,92-2,89 (m, 2H), 1,74 (m, 4 Н), 1,48 (br s, 2H). ЖХ/МС: аналогично рассчитанному для C13H17NO2: 219; обнаружено: 220 (М+Н)+. Структура 15 Этап 1. (S)-1-Фенилэтил 2-бром-2-фенилацетат. К смесибромфенилуксусной кислоты (10,75 г, 0,050 моль), (S)-(-)-1-фенилэтанола (7,94 г, 0,065 моль) и DMAP (0,61 г, 5,0 ммоль) в сухом дихлорметане (100 мл) добавляют твердый EDCI (12,46 г,0,065 моль) в один прием. Полученный раствор перемешивают при комнатной температуре в присутствии аргона в течение 18 ч, затем его разбавляют этилацетатом, промывают (Н 2 О 2, солевой раствор),сушат (Na2SO4), фильтруют и концентрируют до получения бледно-желтого масла. Флэш-хроматография(SiO2/гексан-этилацетат, 4:1) этого масла позволяет получить целевое соединение (11,64 г, 73%) в виде белого твердого вещества. 1 Н спектрометрия ЯМР (400 МГц, CDCl3)7,53-7,17 (m, 10H), 5,95 (q, J =6,6Hz, 0,5H), 5,94 (q, J =6,6 Hz, 0,5H), 5,41 (s, 0,5H), 5,39 (s, 0,5H), 1,58 (d, J =6,6 Hz, 1,5H), 1,51 (d, J =6,6 Hz,1,5H). Этап 2. (S)-1-Фенилэтил (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилацетат. К раствору (S)-1-фенилэтил 2-бром-2-фенилацетата (0,464 г, 1,45 ммоль) в ТГФ (8 мл) добавляют триэтиламин (0,61 мл, 4,35 ммоль), вслед за ним - тетрабутиламмония йодид (0,215 г, 0,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 мин, а затем добавляют раствор 4-метил-4-гидроксипиперидина (0,251 г, 2,18 ммоль) в ТГФ (2 мл). Смесь перемешивают в течение 1 ч при комнатной температуре, а затем нагревают при 55-60 С (температура масляной бани) в течение 4 ч. Охлажденную реакционную смесь разбавляют этилацетатом (30 мл), промывают (Н 2 О 2, солевой раствор), сушат (MgSO4), фильтруют и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (0-60% этилацетат-гексан) для получения первого (S, R)-изомера целевого соединения (0,306 г, 60%) в виде белого твердого вещества, а затем соответствующего (S, S)-изомера (0,120 г, 23%), также в виде белого твердого вещества (S, R)-изомер. 1 Н спектрометрия ЯМР (CD3OD)7,51-7,45 (m, 2H), 7,417,25 (m, 8H), 5,85 (q, J =6,6 Hz, 1H), 4,05 (s, 1H), 2,56-2,45 (m, 2H), 2,41-2,29 (m, 2H), 1,71-1,49 (m, 4H),1,38 (d, J =6,6 Hz, 3H), 1,18 (s, 3 Н) ЖХ/МС аналогично рассчитанному для C22H27NO3 353, обнаружено 354 (М+Н)+. (S,S)-изомер 1 Н спектрометрия ЯМР (CD3OD)7,41-7,30 (m, 5H), 7,20-7,14 (m, 3H), 7,067,00 (m, 2H), 5,85 (q, J =6,6 Hz, 1H), 4,06 (s, 1H), 2,70-2,60 (m, 1H), 2,51 (dt, J =6,6, 3,3 Гц, 1H), 2,44-2,31(m, 2H), 1,75-1,65 (m, 1H), 1,65-1,54 (m, 3H), 1,50 (d, J =6,8 Hz, 3H), 1,20 (s, 3 Н). ЖХ/МС аналогично рассчитанному для C22H27NO3 353, обнаружено 354 (М+Н)+. Этап 3. (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилуксусная кислота. К раствору (S)-1-фенилэтил (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилацетата (0,185 г,0,52 ммоль) в дихлорметане (3 мл) добавляют трифторуксусную кислоту (1 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Летучие вещества впоследствии удаляют в вакууме. Остаток очищают с помощью обращенно-фазовой ВЭЖХ (Primesphere С-18, 20100 мм, CH3CN-H2O-0,1% TFA),в результате получают целевое соединение (как соль ТФУК) в виде бледно-голубоватого твердого тела(0,128 г, 98%) ЖХ/МС аналогично рассчитанному для C14H19NO3 249, обнаружено 250 (М+Н)+. Структура 16 Этап 1. (S)-1-Фенилэтил 2-(2-фторфенил)ацетата. Смесь 2-фторфенилуксусной кислоты (5,45 г, 35,4 ммоль), (S)-1-фенилэтанола (5,62 г, 46,0 ммоль),EDCI (8,82 г, 46,0 ммоль) и DMAP (0,561 г, 4,60 ммоль) в CH2Cl2 (100 мл) перемешивают при комнатной температуре в течение 12 ч. Затем растворитель концентрируют и остаток разделяют с H2Oэтилацетатом. Фазы разделяют и водный слой снова экстрагируют этилацетатом (2). Объединенные органические фазы промывают (H2O, солевой раствор), сушат (Na2SO4) фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле (Biotage/0-20% этилацетат-гексан),в результате получают целевое соединение в виде бесцветного масла (8,38 г, 92%). 1 Н спектрометрия ЯМР (CD3OD)7,32-7,23 (m, 7H), 7,10-7,04 (m, 2), 5,85 (q, J =6,5 Гц, 1H), 3,71 (s, 2H), 1,48 (d, J =6,5 Гц,3 Н). Этап 2. (R)-S)-1-Фенилэтил) 2-(2-фторфенил)-2-(пиперидин-1-ил)-ацетат. К раствору (S)-1-фенилэтил 2-(2-фторфенил)ацетата (5,00 г, 19,4 ммоль) в ТГФ (1200 мл) при 0 С добавляют DBU (6,19 г, 40,7 ммоль) и дают раствору нагреться до комнатной температуры, перемешивая в течение 30 мин. Затем раствор охлаждают до -78 С, добавляют раствор CBr4 (13,5 г, 40,7 ммоль) в ТГФ(100 мл), полученную смесь нагревают до -10 С и перемешивают при этой температуре в течение 2 ч. Реакционную смесь гасят насыщенным водным раствором NH4Cl, слои сепарируют. Водный слой снова экстрагируют этилацетатом (2). Объединенные органические фазы промывают (H2O, солевой р-р), сушат (Na2SO4), фильтруют и концентрируют в вакууме. К остатку добавляют пиперидин (5,73 мл, 58,1 ммоль) и перемешивают раствор при комнатной температуре в течение 24 ч. Летучие вещества затем концентрируют в вакууме и остаток очищают с помощью хроматографии на силикагеле (Biotage / 0-30% диэтиловый эфир-гексан). В результате получают чистую смесь диастереомеров (в соотношении 2:1 по 1 Н спектрометрии ЯМР) в виде желтого масла (2,07 г, 31%), а также непрореагировавший исходный материал (2,53 г, 51%). Последующая хроматография смеси диастереомеров (Biotage / 0-10% диэтиловый эфира-толуол) позволяет получить целевое соединение в виде бесцветного масла (0,737 г, 11%). 1H спектрометрия ЯМР (400 МГц, CD3OD)7,52 (ddd, J =9,4, 7,6, 1,8 Гц, 1H), 7,33-7,40 (m, 1), 7,23-7,23 (m, 4 Н),7,02 - 7,23 (m, 4 Н), 5,86 (q, J =6,6 Hz, 1H), 4,45 (s, 1H), 2,39 -2,45 (m, 4H), 1,52 - 1,58 (m, 4H), 1,40 - 1,42(m, 1H), 1,38 (d, J =6,6 Hz, 3 Н). ЖХ/МС: Аналогично рассчитанному для C21H24FNO2:341; обнаружено: 342 (М+Н). Этап 3. (R)-2-(2-Фторфенил)-2-(пиперидин-1-ил)-уксусная кислота. Смесь (R)-S)-1-фенилэтил)-2(2-фторфенил)-2-(пиперидин-1-ил)ацетата (0,737 г, 2,16 ммоль) и 20% Pd(OH)2/C (0,070 г) в этаноле (30 мл) подвергают гидрогенированию при комнатной температуре и атмосферном давлении (баллон Н 2) в течение 2 ч. Затем раствор продувают Ar, фильтруют через диатомитовый фильтр (Celite) и концентрируют в вакууме. В результате получают целевое соединение в виде бесцветного твердого вещества (0,503 г, 98%). 1 Н спектрометрия ЯМР (400 МГц, CD3OD)7,65 (ddd, J =9,1, 7,6, 1,5 Гц, 1H), 7,47-7,53 (m, 1H),7,21-7,30 (m, 2 Н), 3,07-3,13 (m, 4 Н), 1,84 (br s, 4 Н), 1,62 (br s, 2H) ЖХ/МС Аналогично рассчитанному для Этап 1. (S)-1-Фенилэтил (R)-2-(4-гидрокси-4-фенилпиперидин-1-ил)-2-фенилацетат. К раствору (S)-1-фенилэтил 2-бром-2-фенилацетата (1,50 г, 4,70 ммоль) в ТГФ (25 мл) добавляют триэтиламин (1,31 мл, 9,42 ммоль), после чего тетрабутиламмония йодида (0,347 г, 0,94 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 мин, а затем добавляют раствор 4 фенил-4-гидроксипиперидина (1,00 г, 5,64 ммоль) в ТГФ (5 мл). Смесь перемешивают в течение 16 ч, а затем разбавляют ее этилацетатом (100 мл), промывают (H2O2, солевой раствор), сушат (MgSO4, фильтруют и концентрируют. Остаток очищают в колонке с силикагелем (0-60% этилацетат-гексан), в результате получают смесь диастереомеров в соотношении примерно 2:1 согласно данным 1 Н спектрометрии ЯМР. Разделение этих изомеров выполняют с использованием сверхкритической флюидной хроматографии (Chiralcel OJ-H, 30250 мм, 20% этанола в СО 2 при 35 С), получая таким образом первый (R)-изомер целевого соединения (0,534 г, 27%) в виде желтого масла, а затем соответствующей (S)-изомер (0,271 г,14%), также в виде желтого масла (S, R)-изомер. 1H ЯМР (400 МГц, CD3OD)7,55-7,47 (m, 4H), 7,44-7,25=12,1, 4,6 Гц, 1H), 1,73 (dd, J =13,6, 3,0 Гц, 1 Н), 1,64 (dd, J =13,6, 3,0 Гц, 1H), 1,40 (d, J =6,6 Гц, 3 Н) ЖХ/МС анал. вычисл. для C27H29NO3 415, найденное значение 416(М+Н)+. Эфиры, перечисленные ниже, получают аналогичным способом с использованием этапа 1 синтеза Сар-17: Условия проведения сверхкритической флюидной хроматографии хиральных элементов для определения времени удерживания (ВУ). Условие 1. Структура 17, этап 2. (R)-2-(4-Гидрокси-4-фенилпиперидин-1-ил)-2-фенилуксусная кислота. К раствору (S)-1-фенилэтил (R)-2-(4-гидрокси-4-фенилпиперидин-1-ил)-2-фенилацетата (0,350 г,0,84 ммоль) в дихлорметане (5 мл) добавляют трифторуксусную кислоту (1 мл), смесь перемешивают при комнатной температуре в течение 2 ч. Летучие вещества впоследствии удаляют в вакуумных условиях, остаток очищают с помощью обращенно-фазовой ВЭЖХ (Primesphere С-18, 20100 мм, CH3CN-H2O- 0,1% TFA), в результате получают целевое соединение (как соль ТФУК) в виде белого твердого вещества (0,230 г, 88%). ЖХ/МС: анал. вычисл. для C19H21NO3: 311; найденное значение: 312 (М+Н)+. Карбоновые кислоты, перечисленные ниже, получают аналогичным способом в оптически чистой форме: Условия проведения ЖХ/МС для определения времени удерживания. Условие 1. Этап 1. (R,S)-этил-2-(4-пиридил)-2-бромацетат. К раствору этил 4-пиридилацетата (1,00 г, 6,05 ммоль) в сухом ТГФ (150 мл) при 0 С в присутствии аргона добавляют DBU (0,99 мл, 6,66 ммоль). Реакционную смесь нагревают до комнатной температуры в течение 30 мин, а затем охлаждают до -78 С. К этой смеси добавляют CBr4 (2,21 г, 6,66 ммоль) и продолжают перемешивание при температуре -78 С в течение 2 ч. Затем реакционную смесь гасят насыщенным водным р-ром NH4Cl, после чего разделяют фазы. Органическую фазу промывают (солевой р-р),сушат (Na2SO4), фильтруют и концентрируют в вакуумных условиях. Полученное желтое масло сразу очищают при помощи флэш-хроматографии (SiO2 / гексан-этилацетат, 1 1), в результате получается целевое соединение (1,40 г, 95%) в виде несколько неустойчивого желтого масла. 1 Н ЯМР (400 МГц,CDCl3)8,62 (dd, J = 4,6, 1,8 Гц, 2 Н), 7,45 (dd, J = 4,6, 1,8 Гц, 2 Н), 5,24 (s, 1H), 4,21-4,29 (m, 2 Н), 1,28 (t, J= 7,1 Гц, 3 Н) ЖХ/МС анал вычисл для C9H10BrNO2 242,244, найденное значение 243,245 (М+Н)+. Этап 2. (R,S)-этил-2-(4-пиридил)-2-(N,N-диметиламино)ацетат. К раствору (R,S)-этил 2-(4-пиридил)-2-бромацетата (1,40 г, 8,48 ммоль) в DMF (10 мл) при комнатной температуре добавляли диметиламин (2 М в ТГФ, 8,5 мл, 17,0 ммоль). После завершения реакции (по данным тонкослойной хроматографии) летучие вещества удаляют в вакуумных условиях, остаток очищают с помощью флэш-хроматографии (Biotage, колонка 40+М SiO2, 50-100% этилацетат-гексан), таким образом получая целевое соединение (0,539 г, 31%) в виде светло-желтого масла 1 Н ЯМР (400 МГц,CDCl4)8,58 (d, J = 6,0 Гц, 2 Н), 7,36 (d, J = 6,0 Гц, 2 Н), 4,17 (m, 2H), 3,92 (s, 1H), 2,27 (s, 6H), 1,22 (t, J = 7,0 Гц). ЖХ/МС анал. вычисл. для C11H16N2O2 208, найденное значение 209 (М+Н)+. Этап 3. (R, S)-2-(4-пиридил)-2-(N,N-диметиламино) уксусная кислота. К раствору (R,S)-этил-2-(4-пиридил)-2-(N,N-диметиламино) ацетата (0,200 г, 0,960 ммоль) в смеси ТГФ-метанол-Н 2 О (1 1 1, 6 мл) добавляют порошкообразный LiOH (0,120 г, 4,99 ммоль) при комнатной температуре. Раствор перемешивают в течение 3 ч, а затем подкисляют до рН 6, используя 1N HCl. Водную фазу промывают этилацетатом, а затем лиофилизируют, в результате чего образуется дигидрохлорид целевого соединения в виде желтого твердого вещества (содержащего LiCl). В таком виде продукт был использован в преобразованиях, описанных в последующих этапах. 1 Н ЯМР (400 МГц, ДМСО-d6)8,49 (d, J =5,7 Гц, 2 Н), 7,34 (d, J =5,7 Гц, 2 Н), 3,56 (s, 1H), 2,21 (s, 6H). Следующие вещества получают способом, аналогичным вышеописанному(0,090 г, 0,176 ммоль) и толуола (10 мл) дегазируют в потоке пузырьков аргона в течение 15 мин. Затем реакционную смесь нагревают при температуре 100 С в течение 12 ч, после чего ее охлаждают до комнатной температуры и заливают в H2O. Смесь экстрагируют этилацетатом (2). Объединенные органические фазы промывают (H2O, солевой раствор), сушат (Na2SO4), фильтруют и концентрируют в вакуумных условиях. Остаток очищают сначала при помощи обращенно-фазовой ВЭЖХ (Primesphere C-18, 30 100 мм; CH3CN-H2O-5 мМ NH4OAc), а затем флэш-хроматографии (SiO2/гексан-этилацетат, 1:1), в результате получают целевое соединение (0,128 г, 17%), в виде оранжевого масла. 1 Н ЯМР (400 МГц,CDCl3)8,90 (d, J =2,0 Гц, 1H), 8,32 (d, J =2,0 Гц, 1H), 8,03-8,01 (m, 2H), 7,77 (ddd, J =8,3, 6,8, 1,5 Гц, 1H),7,62 (ddd, J =8,3, 6,8, 1,5 Гц, 1H), 4,35 (s, 1H), 4,13 (m, 2H), 2,22 (s, 6H), 1,15 (t, J =7,0 Гц, 3 Н). ЖХ/МС: анал. вычисл. для C15H18N2O2: 258; найденное значение: 259 (М+Н)+. Этап 2. (R,S) 2-(хинолин-3-ил)-2-(N,N-диметиламино)уксусная кислота. Смесь (R,S)-этил-2-(хинолин-3-ил)-2-(N,N-диметиламино) ацетата (0,122 г, 0,472 ммоль) и 6 М HCl(3 мл) нагревают при температуре 100 С в течение 12 ч. Растворитель удаляют в вакуумных условиях, в результате получают дигидрохлорид целевого соединения (0,169 г, 100%) в виде светло-желтой пены. В последующих этапах был использован неочищенный материал, без дополнительной очистки. ЖХ/МС: анал. вычисл. для C13H14N2O2: 230; найденное значение: 231 (М+Н)+. Структура 38
МПК / Метки
МПК: C07D 403/10, C07D 403/14, A61P 31/22, A61K 31/4164
Метки: вируса, ингибиторы, гепатита
Код ссылки
<a href="https://eas.patents.su/30-18782-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита с</a>
Предыдущий патент: Сельскохозяйственное транспортное средство и способ регулирования распределения нагрузки в таком транспортном средстве
Следующий патент: Трубное соединение
Случайный патент: 3-({[3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидpо-1,4-бензотиазепин-8-ил]метил}амино)пентандиовая кислота












