Хиназолиндионовые производные, их получение и их применения в терапии
Номер патента: 18766
Опубликовано: 30.10.2013
Авторы: Клосс Анни, Виве Бертран, Сейэр Андре, Гласс Кристоф, Марсиньяк Жильбер, Нав Жан-Франсуа, Мюзе Николя
Формула / Реферат
1. Соединение, отвечающее общей формуле (I)
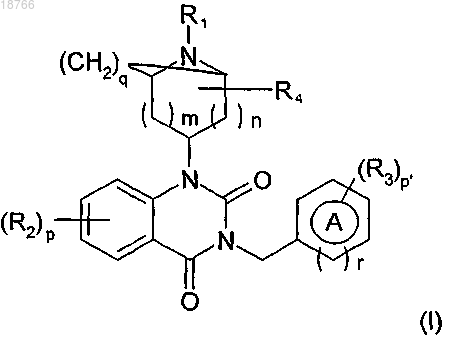
в которой
А означает фенильную или гетероарильную группу;
R1 означает атом водорода, -C(O)R, в котором R означает атом водорода, (C1-C6)-алкоксильную группу или (C1-C6)-алкильную группу, причем вышеуказанный алкил возможно замещен одной или несколькими гидроксильными группами, (C1-C6)-алкоксильной группой, возможно замещенной фенилом, (С3-С6)-циклоалкильной группой;
R2 означает атом водорода, атом галогена, цианогруппу, нитрогруппу, (C1-C6)-алкильную группу, возможно замещенную группой -NH2 или же группой -NHC(O)Rb, группу -ORa, в которой
Ra означает атом водорода, (C1-С6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, фенильной группой и/или одной или несколькими цианогруппами, (С2-С6)-алкинильную группу;
R3 означает атом водорода, атом галогена, гидроксильную группу, цианогруппу, группу -SCF3, нитрогруппу, оксогруппу, -S(О)0-2-алкильную группу, -S(О)0-2-гетероциклоалкильную группу, включающую два гетероатома, выбранных из атома азота и атома кислорода, -О-SO2-фенильную группу, возможно замещенную одним или несколькими атомами галогена;
-алкиламиноалкильную или -циклоалкиламиноалкильную группу, причем каждая возможно замещена по концевому алкилу,
возможно замещенную сульфонамидную группу,
фенильную группу или гетероарильную группу, причем вышеуказанная группа является моноциклической или полициклической и, кроме того, возможно замещена (C1-C6)-алкильной группой, одним или несколькими атомами галогена или (C1-С6)-алкоксильной группой,
гетероциклоалкильную группу, возможно замещенную (C1-C6)-алкильной группой,
(C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена, арильной группой, возможно замещенной одним или несколькими атомами галогена или одной или несколькими гидроксильными группами, гетероарильной группой, одной или несколькими гидроксильными группами, возможно замещенными арильной группой, которая сама возможно замещена одним или несколькими атомами галогена, или гетероциклоалкильной группой, возможно замещенной группой CO(O)Ra или (С1-С6)-алкильной группой,
группу-C(O)NRbRc,
группу-C(O)ORc или группу -O-C(O)ORc,
(C1-C6)-алкоксильную группу, возможно замещенную аминоалкильной группой, цикло(С3-С8)алкильной группой, гетероциклоалкильной группой, моноциклической или полициклической гетероарильной группой, одной или несколькими гидроксильными группами, одим или несколькими атомами галогена, (C1-C6)-алкоксильной группой, группой -C(O)ORc, группой -C(O)NRbRc, оксогруппой и/или арильной группой, которая сама возможно замещена одним или несколькими атомами галогена, цианогруппой, (C1-C6)-алкоксильной группой, -О-галогеналкильной группой и/или галогеналкильной группой,
-О-цикло(С3-С6)алкильную группу, -О-арильную группу или -О-гетероциклоалкильную группу, причем каждая возможно замещена арильной группой, которая сама возможно замещена одним или несколькими атомами галогена или (C1-C6)-алкильной группой, оксогруппой, одим или несколькими атомами галогена и/или (C1-C6)-алкильной группой, которая сама возможно замещена арильной группой и/или оксогруппой,
-NH-CO-NH-арильную группу, -NH-CO-NH-гетероарильную группу или -NH-CO-NH-(C1-C6)-алкильную группу, причем каждая возможно замещена одним или несколькими атомами галогена, цианогруппой, нитрогруппой, одной или несколькими гидроксильными группами или (C1-C6)-алкоксильной группой,
-N-(C1-C6)-алкильную группу, (C1-C6)-алкильную группу, возможно замещенную одной или несколькими оксогруппами и/или одной или несколькими арильными группами, возможно замещенными одним или несколькими атомами галогена и/или группой SO2,
-NH-CO-арильную группу, -NH-CO-гетероарильную группу, причем каждая возможно замещена одним или несколькими атомами галогена;
или R3 вместе с А образует полициклическую гетероарильную группу, возможно замещенную (C1-C6)-алкоксильной группой, (C1-С6)-алкильной группой, возможно замещенной арильной группой, которая сама может быть замещена одним или несколькими атомами галогена;
R4 означает атом водорода, оксогруппу или (C1-C6)-алкильную группу;
Rb означает атом водорода,
(C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, цианогруппами, аминогруппами, гетероциклоалкильными группами, (C1-C6)-алкоксильными группами или арильной группой, возможно замещенной одним или несколькими атомами галогена,
(С3-С6)-циклоалкильную группу,
(С2-С6)-алкинильную группу,
(C1-C6)-алкоксильную группу,
арильную группу, возможно замещенную одним или несколькими атомами галогена;
Rc означает атом водорода или (C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена;
или тогда Rb и Rc вместе с атомом азота, с которым они связаны, образуют полициклическую гетероарильную группу или гетероциклоалкильную группу;
m и n независимо друг от друга имеют значение 0, 1 или 2 при условии, что m+n ≤ 3;
р и р' независимо друг от друга имеют значение 1, 2 или 3 при условии, что, когда р выше или равно 2, тогда группы R2 находятся у различных атомов углерода и могут быть отличными одни от других, и, когда р' выше или равно 2, тогда группы R3 находятся у различных атомов углерода и могут быть отличными одни от других;
q имеет значение 0 или 2 при условии, что, когда q=0, тогда азотсодержащая гетероциклическая группа, связанная с атомом азота, находящимся в положении 1 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового цикла, не является более соединенной мостиковой связью и представляет собой фрагмент типа
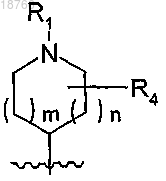
r имеет значение 0 или 1,
причем арил означает возможно замещенную моноциклическую ароматическую систему, включающую 5-14 звеньев в цикле, предпочтительно 5-10 звеньев в цикле;
гетероарил означает моноциклическую ароматическую систему, включающую 5-14 звеньев, предпочтительно 5-10 звеньев, и включающую от одного до нескольких гетероатомов, таких как атомы азота, кислорода или серы; и
гетероциклоалкил означает возможно замещенный насыщенный цикл, включающий от 3 до 8 атомов и включающий от одного до нескольких гетероатомов, таких как атомы азота, кислорода или серы, по меньшей мере в одним из циклов, или несколько одинаковых или различающихся между собой гетероатомов.
2. Соединение общей формулы (I) по п.1, отличающееся тем, что А означает фенильную группу или пиридильную группу.
3. Соединение общей формулы (I) по п.1 или 2, отличающееся тем, что q=0, m и n=1.
4. Соединение общей формулы (I) по любому из пп.1-3, отличающееся тем, что R2 означает (C1-C6)-алкильную группу, в частности метил, замещенную группой -NH-CO-Rb, причем Rb имеет указанное в п.1 значение.
5. Соединение общей формулы (I) по любому из пп.1-3, отличающееся тем, что R2 означает группу -ORa, причем Ra имеет указанное в п.1 значение.
6. Соединение общей формулы (I) по любому из пп.1-3, отличающееся тем, что R2 означает атом галогена или цианогруппу или атом водорода или гидроксил или (C1-C6)-алкил, возможно замещенный группой -NH2 или же группой -NH(CO)Rb.
7. Соединение общей формулы (I) по п.1, отличающееся тем, что А означает фенил, R1 означает группу
-C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1 и R2 означает -ORa.
8. Соединение общей формулы (I) по п.1, отличающееся тем, что А означает фенил, R1 означает группу
-C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1 и R2 означает метил, замещенный группой -NH-CO-Rb, причем Rb имеет указанное в п.1 значение.
9. Соединение общей формулы (I) по п.1, отличающееся тем, что А означает фенил, R1 означает группу
-C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1, р равно 2, один из R2 означает
-ORa, причем Ra имеет указанное в общей формуле (I) значение, а другой из R2 означает атом галогена.
10. Соединение общей формулы (I) по любому из пп.1-9, отличающееся тем, что группа R2 находится в положении 6 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового цикла и, кроме того, также может иметься группа R2, одинаковая или другая, в положении 7 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового цикла; в виде основания, гидрата или сольвата, изомеров или их смесей.
11. Соединение общей формулы (I) по п.1, выбираемое из следующих соединений:
№1: 2-{[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]окси}пропаннитрил,
№2: 1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-6-гидроксихиназолин-2,4(1Н,3Н)-дион,
№3: {[1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]окси}ацетонитрил,
№4: 2-{[1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]окси}пропаннитрил,
№5: {[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]окси}ацетонитрил,
№11: 4-[3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№12: 1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]хиназолин-2,4(1Н,3Н)-дион,
№13: 4-[3-(3,4-диметоксибензил)-2,4-диоксо-6-(2,2,2-трифторэтокси)-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№14: 1-(1-ацетилпиперидин-4-ил)-6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)хиназолин-2,4(1Н,3Н)-дион,
№16: 4-[6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№20: N-{[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метил}ацетамид,
№22: 1-(1-ацетилпиперидин-4-ил)-6-(атгипометил)-3-(3,4-диметоксибензил)хиназолин-2,4(1Н,3Н)-дион гидрохлорид,
№23: N-{[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метил}формамид,
№24: N-{[1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метил}формамид,
№25: N-{[1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метил}ацетамид,
№32: 4-[6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№33: 4-[3-(3,4-дихлорбензил)-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№34: 4-[3-(4-хлорбензил)-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№35: 4-{[6-(2,2-дифторэтокси)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил]метил}метил бензоат,
№36: 4-{[6-(2,2-дифторэтокси)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил]метил}бензойная кислота,
№37: 4-{[6-(2,2-дифторэтокси)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил]метил}-N-(2-метоксиэтил)бензамид,
№38: 4-[3-(3,4-диметоксибензил)-6-метил-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№39: 4-[6-(2,2-дифторэтокси)-3-(3-гидрокси-4-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№40: 4-[6-(2,2-дифторэтокси)-3-[3-(2-гидроксиэтокси)-4-метоксибензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдгид,
№41: 4-[6-(2,2-дифторэтокси)-3-(3-этокси-4-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№42: 4-[6-(2,2-дифторэтокси)-3-[4-метокси-3-(2-метоксиэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№43: 4-[6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]азепан-1-карбальдегид,
№47: 4-[6-(2,2-дифторэтокси)-3-[3-(3-гидроксипропокси)-4-метоксибензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№48: 4-[5-хлор-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№49: 4-{3-[3-(циклопентилокси)-4-метоксибензил]-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№50: 2-(5-{[6-(2,2-дифторэтокси)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил]метил}-2-метоксифенокси)ацетамид,
№51: 4-[6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]-3-метилпиперидин-1-карбальдегид,
№52: 3-[6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]-8-азабицикло[3.2.1]октан-8-карбальдегид,
№56: 4-{3-[4-(циклопентилокси)-3-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№57: 4-[3-(3-хлорбензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№58: 4-[3-(4-хлорбензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№59: 4-{3-[3-(циклопентилокси)-4-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№72: 4-[3-(3,4-диметоксибензил)-6-(2-гидроксиэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№74: 4-[3-(3,4-дихлорбензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№76: 4-{3-[(6-хлорпиридин-3-ил)метил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№78: 4-[3-(3-хлор-4-метоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№79: 4-[3-(3,4-диметоксибензил)-6-(2-фторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№89: 2-[5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенокси]ацетамид,
№90: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-гидрокси-4-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№91: 4-[3-(3,4-диметоксибензил)-6-этокси-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№97: 4-[5,7-дихлор-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-лигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№102: 4-[7-хлор-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№108: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-фтор-4-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№111: 4-[6-(дифторметокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№112: 4-[3-(3,4-диметоксибензил)-6-(1-метилэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№114: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-метокси-3-(1-метилэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№116: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№117: 4-{3-[3,5-бис(трифторметил)бензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№118: 4-[3-(3-этоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№124: 4-{3-[3-хлор-4-(2-метоксиэтокси)бензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№130: 4-[3-(3,4-диэтоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№131: 4-[3-(4-этокси-3-метоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№133: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(4-метокси-3-метилбензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№134: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[4-(трифторметил)бензил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№135: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[4-(трифторметил)бензил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№143: 4-{3-[4-(бензилокси)-3-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№145: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-нитробензил)-2,4-диоксо-3,4-дигидрохиназолин-1 (2Н)-ил}пиперидин-1-карбальдегид,
№155: 4-[3-(4-этоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№158: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-(морфолин-4-илметил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№160: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(4-морфолин-4-илбензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№165: 4-[3-(бифенил-4-илметил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№166: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-(метилсульфанил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№167: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-пиридин-3-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№170: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-метилбензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№175: 2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]ацетамид,
№178: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-пропоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№183: 2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]-N-метилацетамид,
№184: 2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]-N,N-диметилацетамид,
№185: 2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]-N-метокси-N-метилацетамид,
№186: 4-{3-[4-(циклопентилокси)-3-этоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№188: 4-{3-[4-(циклопентилокси)-3-(1-метилэтокси)бензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№189: 4-{3-[4-(циклопентилокси)-3-пропоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№190: 4-{3-[4-(циклопентилокси)-3-гидроксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№193: 4-{3-[4-(дифторметокси)-3-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№194: 4-{3-[4-(дифторметокси)-3-этоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№200: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-тиофен-3-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№201: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-пиридин-4-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№203: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(1-метил-1Н-индол-6-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№206: 4-{3-[4-(циклопропилметокси)-3-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№207: 2-[4-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенокси]-N-метилацетамид,
№212: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[4-(1Н-пиразол-1-ил)бензил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№213: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-пиридин-2-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№215: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-тиофен-2-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№216: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(хинолеин-7-илметил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№218: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(6-метоксинафталин-2-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№223: 4-{3-[4-(1Н-бензимидазол-1-ил)бензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№224: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(2-метилпропокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№226: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(тетрагидрофуран-3-илокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№228: 4-[3-{4-[(1-бензилпирролидин-3-ил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№230: 4-[3-(1-бензотиофен-5-илметил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№232: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(1-метилэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№233: 4-[3-(3,4-диметоксибензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№234: 4-[3-{4-[(1-ацетилпирролидин-3-ил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№239: 4-[3-{4-[(4-фторбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№240: 4-[3-{4-[(4-хлорбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№242: 4-[3-{4-[(3-хлорбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№243: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(3-тиофен-3-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№245: 4-[3-(4-этокси-3-метоксибензил)-6-(2-гидроксиэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№246: 4-[3-{4-[2-(2,3-дигидро-1Н-индол-1-ил)-2-оксоэтокси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№250: 4-[3-{4-[(3,4-дихлорбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№251: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(2-оксо-2-пиперидин-1-илэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№254: 4-{3-[3-этокси-4-(тиофен-2-илметокси)бензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№258: 4-[3-(3,4-диметоксибензил)-6-[2-фтор-1-(гидроксиметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№263: (2R)-2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]пропановая кислота,
№264: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(1-метил-3-тиофен-2-ил-1Н-пиразол-5-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№270: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-(5-метил-1,2,4-оксадиазол-3-ил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№275: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-пиримидин-5-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№276: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(1-метил-3-фенил-1Н-пиразол-5-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№278: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-{[6-(1Н-пиразол-1-ил)пиридин-3-ил]метил}-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№279: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[(2-тиофен-2-илпиримидин-5-ил)метил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№280: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-(1-метил-1Н-пиразол-3-ил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№282: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[4-(3-метил-1,2,4-оксадиазол-5-ил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№283: [2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]уксусная кислота,
№285: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(тиено[2,3-b]пиридин-2-илметил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№286: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[(6-фенилпиридин-3-ил)метил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№287: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(6-морфолин-4-илпиридин-3-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№289: 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[(6-тиофен-2-илпиридин-3-ил)метил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№292: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[(1-метил-5-фенил-1Н-пиразол-3-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№294: 4-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)бифенил-2-карбонитрил,
№295: (2R)-2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]-N-метилпропанамид,
№297: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-тиофен-2-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№298: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(морфолин-4-илметил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№299: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(пиперидин-1-илметил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№300: 4-[3-{4-[(3,4-дихлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№301: 2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]-N-этилацетамид,
№302: (2S)-2-[2-(циклопентилокси)-5-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенокси]пропановая кислота,
№305: 4-{6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-{[(3R)-2-оксо-1-фенилпирролидин-3-ил]окси}бензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№306: 4-{3-[4-(циклобутилметокси)-3-метоксибензил]-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№307: 4-{3-[4-(бензилокси)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№308: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-(4-гидрокси-3-метоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№309: 4-{3-[4-(циклопропилметокси)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№310: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(2-метилпропокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№311: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(1-метилэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№312: 4-[3-(4-этокси-3-метоксибензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№315: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{[6-(3-метоксифенил)пиридин-3-ил]метил}-2,4-диоксо-3,4 -дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№316: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{[6-(2-фторфенил)пиридин-3-ил]метил}-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№317: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{[6-(4-фторфенил)пиридин-3-ил]метил}-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№318: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{[6-(4-метоксифенил)пиридин-3-ил]метил}-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№319: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[(6-тиофен-2-илпиридин-3-ил)метил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№320: 4-{3-[3-этокси-4-(тиофен-2-илметокси)бензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№321: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[4-(1-метил-1Н-пиразол-3-ил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№322: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-пиримидин-5-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№323: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[(1-метил-3-тиофен-2-ил-1Н-пиразол-5-ил)метил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№324: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(2-оксо-2-пиперидин-1-илэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№325: 4-[3-{4-[2-(2,3-дигидро-1Н-индол-1-ил)-2-оксоэтокси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№326: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[4-(5-метил-1,2,4-оксадиазол-3-ил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№327: 4-[3-{4-[(3-хлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№328: 4-[3-{[6-(3,5-дихлорфенил)пиридин-3-ил]метил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№329: 4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)бифенил-2-карбонитрил,
№330: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[4-(1Н-пиразол-1-ил)бензил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№331: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{[6-(3-фторфенил)пиридин-3-ил]метил}-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№332: 3-[5-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)пиридин-2-ил]бензонитрил,
№333: 4-[3-(3,4-диэтоксибензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№334: 4-[3-{4-[(4-хлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№335: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-[4-(морфолин-4-илметил)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№336: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-{[6-(1Н-пиразол-1-ил)пиридин-3-ил]метил}-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№337: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-(4-морфолин-4-илбензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№338: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-пропоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№339: 4-{3-[4-(1Н-бензимидазол-1-ил)бензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№340: 5-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксибензонитрил,
№341: 3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-7-карбонитрил,
№342: 4-[3-(4-бромбензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№343: 4-[3-{4-[(3,4-дихлорбензил)окси]-3-(2-метоксиэтокси)бензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№344: 4-{3-[4-(бензилокси)бензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№345: 4-[3-{4-[(3,4-дихлорбензил)окси]-3-этоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№349: 4-[3-{4-[(3,4-дихлорбензил)окси]-3-(2-фторэтокси)бензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№350: 4-[3-{4-[(2-хлор-4-фторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№351: 4-[3-{4-[(2,4-дихлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№352: 4-[3-{4-[(2-хлор-6-фторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№353: 4-[3-{4-[(2,6-дихлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№354: 4-[3-{4-[(2-хлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№355: 4-[7-фтор-3-{4-[(2-фторбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№357: 2-[(3,4-дихлорбензил)окси]-5-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)бензонитрил,
№358: 4-[3-{4-[(3,4-дихлорфенокси)метил]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№360: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-[4-(2-фенилэтил)бензил]-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№362: 4-[3-{4-[(4,5-дихлор-2-фторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№369: 4-[3-{4-[(4-хлорфенокси)метил]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№371: 4-[3-{3-хлор-4-[(4-хлорбензил)окси]-5-этоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№373: 4-[3-{3-хлор-4-[(2,4-дихлорбензил)окси]-5-этоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№375: 4-[7-фтор-3-{4-[(4-фторбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№376: 4-[3-{4-[(3,5-дихлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№377: 4-[3-(4-{[4-хлор-3-(трифторметил)бензил]окси}-3-метоксибензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№379: 4-[3-{4-[(3-хлорфенокси)метил]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№380: 4-[3-{4-[(3,5-дифторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№381: 4-{3-[4-(бензилокси)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№382: 4-[3-{4-[(3-хлор-5-фторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№383: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-{[4-(трифторметил)бензил]окси}бензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№384: 4-[3-{4-[(2,5-дихлорбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№385: 4-{[4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенокси]метил}бензонитрил,
№386: 3-{[4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенокси]метил}бензонитрил,
№387: 4-[3-{4-[(4-хлор-2-фторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№388: 4-[3-{4-[1-(3,4-дихлорфенил)этокси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№389: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-{4-[(3-гидроксибензил)окси]-3-метоксибензил}-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№390: 4-[7-фтор-3-{4-[(3-фторбензил)окси]-3-метоксибензил}-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№391: 4-[3-{4-[(3,4-дифторбензил)окси]-3-метоксибензил}-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид,
№392: 4-{3-[4-(5,6-дихлор-1Н-бензимидазол-1-ил)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид,
№393: 4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)фенил 3,4-дихлорбензолсульфонат,
№394: 4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенил 3,4-дихлорбензолсульфонат,
№403: 3,4-дихлор-N-[4-({7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)-2-метоксифенил]бензамид.
12. Способ получения соединения по любому из пп.1-11, отличающийся тем, что соединение формулы (XVIII)
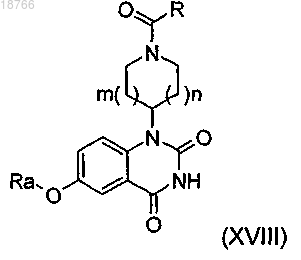 в которой R, Ra, m и n имеют указанные в п.1 значения и в которой, кроме того, может иметься группа R2, такая как указанная в случае соединений формулы (I), в положении 7 хиназолиндионовой структуры,вводят в реакцию с соединением формулы
в которой R, Ra, m и n имеют указанные в п.1 значения и в которой, кроме того, может иметься группа R2, такая как указанная в случае соединений формулы (I), в положении 7 хиназолиндионовой структуры,вводят в реакцию с соединением формулы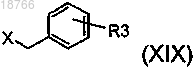 или формулы
или формулы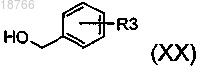 по реакции алкилирования или реакции Mitsunobu соответственно.
по реакции алкилирования или реакции Mitsunobu соответственно.13. Соединение общей формулы (XVIII):
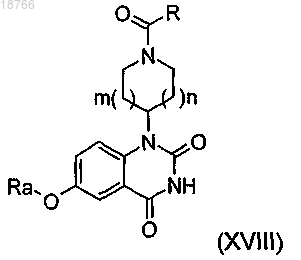
в которой R, Ra, m и n имеют указанные в п.1 значения и в которой, кроме того, может иметься группа R2, такая как указанная в случае соединений формулы (I), в положении 7 хиназолиндионовой структуры.
14. Соединение общей формулы (XVIII) по п.12, выбираемое среди соединения № 32 4-[6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегида и соединения № 55 4-{6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегида; в виде основания, гидрата, сольвата или их смесей.
15. Лекарственное средство, являющееся ингибитором ФДЭ7 или ФДЭ7 и ФДЭ8, отличающееся тем, что оно включает по меньшей мере одно соединение формулы (I) по любому из пп.1-11.
16. Фармацевтическая композиция для ингибирования ФДЭ7 или ФДЭ7 и ФДЭ8, отличающаяся тем, что она включает по меньшей мере одно соединение формулы (I) по любому из пп.1-11, а также по меньшей мере один фармацевтически приемлемый эксципиент.
17. Применение соединения формулы (I) по любому из пп.1-11 для получения лекарственного средства, предназначенного для лечения и/или профилактики воспалительных или иммуновоспалительных заболеваний, включающих астму, хроническую обструктивную бронхопневмопатию (COPD), аллергический ринит, аллергии, болезнь Крона, язвенный колит, миастению, атопический дерматит, псориаз, системную красную волчанку, ревматоидный полиартрит, диабет, рассеянный склероз, в случае лечения трансплантаций органов, для лечения и/или профилактики ракового заболевания, в частности остеосаркомы или аденокарциномы, для лечения и/или профилактики костных заболеваний, включая остеопению и остеопороз, для лечения и/или профилактики острой недостаточности, для лечения и/или профилактики боли невропатической боли и висцеральной боли.
18. Применение соединения формулы (I) по п.17 для получения лекарственного средства, предназначенного для лечения и/или профилактики невропатической боли.
Текст
Объектом настоящего изобретения являются соединения формулы (I) в виде основания, гидрата,сольвата или их смесей. Изобретение также относится к способу получения, а также к применениям в терапии соединений формулы (I) Объектом настоящего изобретения являются хиназолиндионовые производные, способы их получения и их применения в терапии. Настоящее изобретение относится к хиназолиндионовым производным, ингибиторам фосфодиэстеразы 7 (PDE7). Некоторые из этих производных также ингибируют фосфодиэстеразу 8 (PDE8). Фосфодиэстеразы (PDE) представляют собой внутриклеточные ферменты, ответственные за гидролиз вторичных мессенджеров, цАМФ (циклический аденозин-3',5'-монофосфат) и ГМФ (циклический гуанозин-3',5'-монофосфат), до инактивных нуклеотидов 5'-монофосфатов. цАМФ и цГМФ играют существенную роль в случае путей клеточной сигнализации и принимают активное участие в многочисленных физиологических процессах. Ингибирование фосфодиэстераз выражается в увеличении внутриклеточных концентраций цАМФ и цГМФ, вызывающее специфическую активацию путей фосфорилирования, принимающих активное участие в различных функциональных реакциях. Увеличение внутриклеточных концентраций цАМФ или цГМФ с помощью селективных ингибиторов фосфодиэстераз кажется многообещающим подходом для лечения различных заболеваний (Bender и Beavo, Pharmacol. Rev., 58, 488-620 (2006. Ингибиторы фосфодиэстераз, следовательно, представляют интерес в качестве терапевтических агентов и в качестве фармакологических инструментов. На сегодняшний день идентифицированы одиннадцать семейств фосфодиэстераз. Они различаются своей первичной структурой, субстратной специфичностью и чувствительностью по отношению к различным эффекторам и ингибиторам, специфичным в отношении PDE. Каждое семейство образовано одним или несколькими генами, которые экспрессируются в различных тканях в форме гибридных вариантов (Bender и Beavo, Pharmacol. Rev., 58, 488-620 (2006); Lugnier, Pharmacol. Therapeut., 109, 366-393PDE4, PDE7 и PDE8 специфически гидролизуют цАМФ и PDE5, PDE6 и PDE9 специфически гидролизуют цГМФ. Семейство PDE7 представлено изоформами PDE7A и PDE7B, происходящими от двух различных генов. Человеческая PDE7A (Michaeli и др., J. Biol. Chem., 268, 12925-12932 (1993); Han и др., J. Biol.Chem., 272, 16152-16157 (1997); Wang и др., Biochem. Biophys. Res. Commun, 276, 1271-1277 (2000 и человеческая PDE7B (Sasaki и др., Biochem. Biophys. Res. Commun, 271, 575-583 (2000); Gardner и др.,Biochem. Biophys. Res. Commun, 272, 186-192 (2000 селективно гидролизуют цАМФ с константами Михаэлиса (Km) 0,1-0,2 мкМ и 0,13-0,2 мкМ соответственно. Каталитическая часть PDE7B имеет примерно 67% гомологии с таковой PDE7A. Для PDE7A известны три гибридных варианта. PDE7A1 и PDE7A3 экспрессируются, главным образом, в клетках иммунной системы и легких, тогда как PDE7A2 экспрессируется, в особенности, в скелетных мышцах, сердце и почках. В случае PDE7B также недавно были идентифицированы три варианта(Giembycz и Smith, Drug Future, 31, 207-229 (2006. Профили тканевого распределения PDE7A и PDE7B являются очень различными, что наводит на мысль, что эти две изоформы обладают разными функциями с точки зрения физиологии. Тогда какPDE7A в изобилии экспрессируется в гематопоэтических клетках, легких, плаценте, клетках Leydig, селезенки, собирательных трубках почек и надпочечников, высокая экспрессия PDE7B обнаружена в поджелудочной железе, сердце, щитовидной железе и скелетных мышцах (Giembycz Smith, Drugs Future, 31,207-229 (2006. Однако в некоторых тканях наблюдалась коэкспрессия матричных РНК (мРНК) PDE7A и PDE7B. Это имеет место в остеобластах (Ahlstrom и др., Cell Mol. Biol. Lett., 10, 305-319 (2005 и в некоторых областях головного мозга: несколько зон коры, зубчатая извилина, большая часть компонентов обонятельной системы, полосатое тело, многочисленные ядра таламуса и пирамидальные клетки гиппокампа (Miro и др., Synapse, 40, 201-214 (2001); Reyes-Irisarri и др., Neuroscience, 132, 1173-1185(2005. Напротив, в некоторых зонах головного мозга экспрессируется только одна из двух изоформ. Таким образом, одни мРНК PDE7A присутствуют в многочисленных ядрах ствола мозга. Точно также,мРНК PDE7B присутствуют в высоких концентрациях в ядре Accumbens и дорсальном моторном ядре блуждающего нерва, тогда как мРНК PDE7A там не обнаружены (Miro и др., Synapse, 40, 201-214 (2001);Reyes-Irisarri и др., Neuroscience, 132, 1173-1185 (2005. Белок PDE7A1 хорошо экспрессируется в Т-лимфоцитах крови, эпителиальных клеточных линиях бронхов, фибробластов легких и эозинофилах (Smith и др., Am. J. Physiol. Lung Cell. Mol. Physiol., 284,L279-L289 (2003. Ряд сообщений наводит на мысль, что PDE7A может играть роль в активации Тлимфоцитов (Li и др., Science, 283, 848-851 (1999); Glaves и др., PNAS, 98, 6319-6324 (2001); Nakata и др.,Clin. Exp. Immunol., 128, 460-466 (2002); Smith и др., Mol. Pharmacol., 66, 1679-1689 (2004. БелокPDE7A1 также экспрессируется в клетках, которые играют центральную роль в патогенезе астмы и хронической обструктивной бронхопневмопатии (COPD), таких, как Т-лимфоциты (CD4+ и CD8+), моноциты, нейтрофилы, альвеолярные макрофаги, гладкомышечные клетки воздушных путей и легочных сосудов (Smith и др., Am. J. Physiol. Lung. Cell. Vol. Physiol., 284, L279-L289 (2003. Локализация PDE7A в провоспалительных клетках и клетках иммунной системы и ее потенциальная роль в активации Тлимфоцитов наводят на мысль, что селективные ингибиторы PDE7 могут найти применения в области заболеваний, связанных с Т-лимфоцитами, и в области заболеваний легочных путей. Белок PDE7A также присутствует в В-лимфоцитах и в клеточной линии В-лимфоцитов WSU-CLL,происходящей от пациента, больного хроническим лимфоцитарным лейкозом. Обработка клеток WSUCLL с помощью IC242, специфичного в отношении PDE7 ингибитора, увеличивает экспрессию PDE7A(Lee и др., Cell Signal, 14, 277-284 (2002. Кроме того, показано, что экспрессия белка PDE7B примерно в 5-90 раз более высока в мононуклеарных клетках периферической крови (РВМС) пациентов, больных хроническим лимфоцитарным лейкозом (CLL-PBMC), чем в РВМС, выделенных из крови здоровых субъектов (WO-2007/067946). BRL-50481, селективный в отношении PDE7 ингибитор, индуцирует зависимым от дозы образом апоптоз CLL-PBMC, но он не оказывает воздействия на РВМС здоровых лиц. Эти наблюдения наводят на мысль, что селективные в отношении PDE7 ингибиторы могут быть эффективными в случае лечения этого типа лейкоза. Селективные в отношении PDE4 ингибиторы повышают костную минеральную плотность у крысы и мыши и их воздействия представляются связанными со снижением активности остеокластов и с увеличением таковой остеобластов (Miyamoto и др., Biochem. Pharmacol., 54, 613-617 (1997); Waki и др., Jpn. J.Pharmacol, 79, 477-483 (1999); Kinoshita и др., Bone, 27, 811-817 (2000. Активность PDE7 определена в случае остеобластов (Achistrom и др., Cell. Mol. Biol. Latt., 10, 305-319 (2005. Повышая внутриклеточную концентрацию цАМФ, ингибиторы PDE7, как и ингибиторы PDE4, могут оказываться эффективными при лечении остеопении и остеопороза. Кроме того, в недавних исследованиях (WO-2006/092691, WO-2006/092692) сообщаются фармакологические активности различных ингибиторов PDE7 в случае моделей невропатической боли у крысы,наводящие на мысль об использованиях при лечении различных типов болей и, более конкретно, при лечении невропатической боли. Объектом настоящего изобретения, в частности, являются хиназолиндионовые производные, сильные ингибиторы PDE7, или ингибиторы PDE7 и PDE8, согласно производным, их получение и их применения в терапии. Объектом настоящего изобретения являются соединения нижеследующей общей формулы (I): в которой А означает арильную или гетероарильную группу;R1 означает атом водорода, -C(O)R, в котором R означает атом водорода, (C1-С 6)-алкоксильную группу, арильную группу, (С 3-С 6)-циклоалкильную группу или (C1-С 6)-алкильную группу, причем вышеуказанный алкил возможно замещен одной или несколькими гидроксильными группами, бензилоксигруппой, (C1-C6)-алкоксильной группой, возможно замещенной арилом, (С 3-С 6)-циклоалкильной группой, возможно замещенную (C1-С 6)-алкильную группу;R2 означает атом водорода, атом галогена, цианогруппу, нитрогруппу, (C1-С 6)-алкильную группу,возможно замещенную группой -NH2 или же группой -NHC(O)Rb, группу-ORa, в которой Ra означает атом водорода, (C1-С 6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, арильной группой или одной или несколькими цианогруппами, (С 2-С 6)-алкинильную группу, арильную группу;R3 означает атом водорода, атом галогена, гидроксильную группу, цианогруппу, группу -SCF3, нитрогруппу, оксогруппу,-S(О)0-2-алкильную группу, -S(О)0-2-гетероциклоалкильную группу, -O-SO2-арильную группу, возможно замещенную одним или несколькими атомами галогена,-алкиламиноалкильную или -циклоалкиламиноалкильную группу, причем каждая возможно замещена по концевому алкилу,возможно замещенную сульфонамидную группу,арильную группу или гетероарильную группу, причем вышеуказанная группа является моноциклической или полициклической и, кроме того, возможно замещена (C1-C6)-алкильной группой, одним или несколькими атомами галогена или (C1-С 6)-алкоксильной группой,гетероциклоалкильную группу, возможно замещенную (C1-С 6)-алкильной группой,(C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена,арильной группой, возможно замещенной одним или несколькими атомами галогена или одной или несколькими гидроксильными группами,гетероарильной группой,одной или несколькими гидроксильными группами, возможно замещенными арильной группой, ко-2 018766 торая сама возможно замещена одним или несколькими атомами галогена, или гетероциклоалкильной группой, возможно замещенной группой CO(O)Ra или (C1-C6)-алкильной группой,группу -C(O)NRbRc,группу -C(O)ORc или группу -O-C(O)ORc,(C1-С 6)-алкоксильную группу, возможно замещенную аминоалкильной группой, аминоциклоалкильной группой, циклоалкильной группой, гетероциклоалкильной группой, моноциклической или полициклической гетероарильной группой, одной или несколькими гидроксильными группами, одним или несколькими атомами галогена, (C1-C6)-алкоксильной группой, группой -C(O)ORc, группой -C(O)NRbRc,оксогруппой и/или арильной группой, которая сама возможно замещена одним или несколькими атомами галогена, цианогруппой, (C1-С 6)-алкоксильной группой, -О-галогеналкильной группой и/или галогеналкильной группой,-О-циклоалкильную группу, -О-арильную группу или -O-гетероциклоалкильную группу, причем каждая возможно замещена арильной группой, которая сама возможно замещена одним или несколькими атомами галогена или (C1-С 6)-алкильной группой, оксогруппой, одним или несколькими атомами галогена и/или (C1-С 6)-алкильной группой, которая сама возможно замещена арильной группой и/или оксогруппой,-NH-CO-NH-арильную группу, -NH-CO-NH-гетероарильную группу или -NH-CO-NH-(C1-С 6)алкильную группу, причем каждая возможно замещена одним или несколькими атомами галогена, цианогруппой, нитрогруппой, одной или несколькими гидроксильными группами или (C1-C6)-алкоксильной группой,-N-(C1-C6)-алкильную группу, (C1-C6)-алкильную группу, возможно замещенную одной или несколькими оксогруппами и/или одной или несколькими арильными группами, возможно замещенными одним или несколькими атомами галогена и/или группой SO2,-NH-CO-арильную группу, -NH-CO-гетероарильную группу, причем каждая возможно замещена одним или несколькими атомами галогена; или R3 вместе с А образует полициклическую гетероарильную группу, возможно замещенную (C1C6)-алкоксильной группой, (C1-C6)-алкильной группой, возможно замещенной арильной группой, которая сама может быть замещена одним или несколькими атомами галогена;Rb означает атом водорода,(C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, цианогруппами, аминогруппами, гетероциклоалкильными группами, (C1-C6)-алкоксильными группами или арильной группой, возможно замещенной одним или несколькими атомами галогена,(C3-C6)-циклоалкильную группу,(C2-C6)-алкинильную группу,(C1-C6)-алкоксильную группу,арильную группу, возможно замещенную одним или несколькими атомами галогена;Rc означает атом водорода или (C1-C6)-алкильную группу, возможно замещенную одним или несколькими атомами галогена; или тогда Rb и Rc вместе с атомом азота, с которым они связаны, образуют полициклическую гетероарильную группу или гетероциклоалкильную группу;m и n, независимо друг от друга, имеют значение 0, 1 или 2, имея в виду, что m+n3; р и р', независимо друг от друга, имеют значение 1, 2 или 3, имея в виду, что, когда р выше или равно 2, тогда группы R2 находятся у различных атомов углерода и могут быть отличными одни от других,и, когда р' выше или равно 2, тогда группы R3 находятся у различных атомов углерода и могут быть отличными одни от других;q имеет значение 0 или 2, при условии, что, когда q=0, тогда азотсодержащая гетероциклическая группа, связанная с атомом азота, находящимся в положении 1 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового цикла, не является более соединенной мостиковой связью и типа:r имеет значение 0 или 1. Соединения общей формулы (I) могут включать один или несколько асимметрических атомов углерода. Следовательно, они могут находиться в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая туда рацемические смеси, составляют часть изобретения. По их структуре соединения общей формулы (I) также могут находиться в форме изомеров рота-3 018766 мерного или атропоизомерного типа. Соединения формулы (I) также могут находиться в виде оснований или аддитивных солей кислот. Такие аддитивные соли составляют часть изобретения. Эти соли преимущественно получают при использовании фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или отделения соединений общей формулы (I),также составляют часть изобретения. Соединения общей формулы (I) также могут находиться в кристаллической, аморфной или маслянистой форме, причем эти формы составляют часть изобретения. Соединения общей формулы (I), кроме того, могут находиться в форме гидратов или сольватов, а именно, в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. Согласно нстоящему изобретению, N-оксиды соединений, включающих аминогруппу, также составляют часть изобретения. Соединения формулы (I) согласно настоящему изобретению также включают соединения, в которых один или несколько атомов водорода, углерода или галогена, в частности, хлора или фтора, заменены их радиоактивными изотопами, как, например, тритий в случае замены водорода или углерод-14 в случае замены углерода-12. Такие меченые соединения пригодны в качестве инструментов при научноисследовательских работах, исследованиях в отношении метаболизма или фармакокинетики, при биологических и фармакологических испытаниях. В рамках настоящего изобретения уточняют следующее: в случае (C1-C6), числовые показатели определяют возможное число атомов углерода, присутствующих в цепи или цикле. Так, в качестве примера, (C1-C6) означает углеродную цепь, которая может иметь 1-6 атомов углерода. Точно также, в качестве примера, (С 1-С 5) означает углеродную цепь, которая может иметь 1-5 атомов углерода, или еще (C3-C6) может означать насыщенный углеродный цикл, который может иметь 3-6 атомов углерода; алкоксил означает -О-алкильную группу с насыщенной, линейной или разветвленной, алифатической цепью; алкинил означает моно- или полиненасыщенную, линейную или разветвленную, алифатическую группу, включающую, например, одну или две ацетиленовые ненасыщенности. Например, (C2-C6)алкинильная группа может означать этинил, пропинил; алкил означает насыщенную, линейную или разветвленную, алифатическую группу; например, (C1C6)-алкильная группа означает линейную или разветвленную углеродную цепь с 1-6 атомами углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил; аминоалкил означает -NH-(C1-C6)-алкильную группу или еще -N-C1-C6)-алкил)2; арил означает возможно замещенную моноциклическую ароматическую систему, включающую 514 звеньев в цикле, предпочтительно, 5-10 звеньев в цикле. В качестве примеров моноциклических арильных групп можно назвать фенил или нафтил; арильная группа может быть замещена группой, которой может быть, например, один или несколько атомов галогена, гидроксильная группа, цианогруппа,трифторметилтиогруппа, нитрогруппа, алкильная группа, алкоксильная группа, алкилтиогруппа, метилсульфонильная группа, алкиламиноалкильная группа или алкиламиноциклоалкильная группа, возможно замещенная, алкиламиноалкоксильная группа или циклоалкиламиноалкоксильная группа или сульфонамидная группа; полициклический арил означает возможно замещенную полициклическую ароматическую систему,включающую 5-14 звеньев в цикле, предпочтительно 5-10 звеньев в цикле, и включающую 2-10 циклов,в которых по меньшей мере один из циклов является ароматическим. В качестве примера полициклических арильных групп можно назвать ацеантрилен, антрацен, азулен, коронен, рубицен, нафталин; полициклическая арильная группа может быть замещена группой, которой может быть, например, один или несколько атомов галогена, гидроксильная группа, цианогруппа, трифторметилтиогруппа, нитрогруппа,алкильная группа, алкоксильная группа, алкилтиогруппа, метилсульфонильная группа, алкиламиноалкильная группа или алкиламиноциклоалкильная группа, возможно замещенная, алкиламиноалкоксильная группа или циклоалкиламиноалкоксильная группа или сульфонамидная группа; соединенный мостиковой связью цикл означает бициклическую структуру, включающую атом азота, в которой по меньшей мере 2 атома углерода связаны ординарной связью или углеродной цепью, которая может включать 2 атома углерода. В качестве примера вышеуказанным циклом является таковой типа: где q=1 или 2 циклоалкил означает насыщенную циклическую алифатическую группу, включающую 3-8 атомов углерода. В качестве примера можно назвать группы: циклопропил, метилциклопропил,-4 018766 циклобутил, циклопентил, циклогексил; галоген означает фтор, хлор, бром или иод; галогеналкил означает (C1-C6)-алкил, замещенный от одного до трех атомами галогена; гетероарил означает моноциклическую ароматическую систему, включающую 5-14 звеньев, предпочтительно 5-10 звеньев, и включающую от одного до нескольких гетероатомов, таких как атомы азота,кислорода или серы. Атомы азота могут быть в форме N-оксидов. Например, моноциклическим гетероциклом может быть пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, изотиазол, изоксазол, фуран, имидазол, морфолин, тиофен, пиперазин, диазетидин, дигидропирролидин, пиперидин или азепин и т.д.; бициклическим гетероциклом может быть изохинолин, птеридин, хроман и т.д.; трициклическим гетероциклом может быть фенантролин, ксантен и т.д.; полициклический гетероарил означает возможно замещенную полициклическую ароматическую систему, включающую 5-14 звеньев в цикле, предпочтительно 5-10 звеньев в цикле, и включающую 2-10 циклов, содержащих, кроме того, от одного до нескольких гетероатомов, таких как атомы азота, кислорода или серы, по меньшей мере в одном из циклов и где по меньшей мере один из циклов является ароматическим. В качестве примера полициклических гетероарильных групп можно назвать индол, бензофуран, бензимидазол, бензотиофен, бензотриазол, бензотиазол, бензоксазол, хинолин, изохинолин, индазол, хиназолин, фталазин, хиноксалин, нафтиридин, 2,3-дигидро-1 Н-индол, 2,3-дигидробензофуран, 2,3 дигидроинден, тетрагидрохинолин, тетрагидроизохинолин, тетрагидроизохиназолин; гетероциклоалкил означает возможно замещенный насыщенный цикл, включающий от 3 до 8 атомов и включающий от одного до нескольких гетероатомов, таких как атомы азота, кислорода или серы,по меньшей мере в одним из циклов, или несколько одинаковых или различающихся между собой гетероатомов. Например, гетероциклоалкилом может быть пирролидин, морфолин, пиперазин, диазетидин,дигидропирролидин, пиперидин, пиперадин, азепан, имидазолидин, тиоморфолин, тетрагидропиран, тетрагидротиопиран, пиперазин, диазепан и т.д.; гидроксил означает группу -ОН; нитрогруппа означает группу -NO2; оксогруппа означает группу -С(О)-; сульфонамидная группа означает группу, отвечающую формуле SO2-N-алкил или SO2-Nциклоалкил, причем алкил и циклоалкил являются такими, как указанные выше; трифторметилтиогруппа определяется формулой -S-CF3. Кроме того, согласно настоящему описанию, когда атом или группа замещен(на) или возможно замещен(на) одной или несколькими определенными группами или атомами, заместители могут быть одинаковыми или различающимися между собой и, в случае необходимости, могут находиться у одного и того же атома или у различных атомов. Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений формулы (I), в которой А означает арильную группу, в частности, фенил, или гетероарильную группу, в особенности, пиридильную группу, и все другие заместители и индексы являются такими, как указанные в общей формуле (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений формулы (I), в которой q=0, m и n=1, и все другие заместители и индексы являются такими, как указанные в общей формуле (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений формулы (I), в которой R2 означает (C1-C6)-алкильную группу, в частности, метил, замещенную группой -NHC(O)Rb, где Rb, другие группы и индексы являются такими, как указанные в случае соединения общей формулы (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений общей формулы (I), в которой R2 означает группу -ORa, причем группа Ra и все другие группы являются такими, как указанные в случае соединения формулы (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений общей формулы (I), в которой R2 означает атом галогена или цианогруппу или атом водорода или гидроксил, возможно замещенный группой -NH2 или же группой -NHC(O)Rb, причем другие группы являются такими, как указанные в случае соединения формулы (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений общей формулы (I), в которой А означает фенил, R1 означает группу -C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1 и R2 означает -ORa, причем Ra является таким, как указанный в общей формуле (I). Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений общей формулы (I), в которой А означает фенил, R1 означает группу -C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1, р равен 2, один из R2 означает -ORa, причем Ra является таким, как указанный в общей формуле (I), а другой из R2 означает атом галогена. Среди соединений, являющихся объектами настоящего изобретения, можно назвать группу соединений общей формулы (I), в которой А означает фенил, R1 означает группу -C(O)R, в которой R означает атом водорода, q равно 0, n и m означают 1 и R2 означает метил, замещенный группой -NH-CO-Rb, причем Rb является таким, как указанный в общей формуле (I). Преимущественно в соединениях формулы (I), группа R2 находится в положении 6 2,4-диоксо 1,2,3,4-тетрагидрохиназолинового цикла. Соединения формулы (I) также могут иметь группу R2 в положении 7 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового цикла. Преимущественно в соединениях формулы (I) р=1 или 2. Согласно особому варианту осуществления изобретения, когда р'=2, тогда две группы R3 находятся в положениях 3 и 4 цикла А и могут быть отличными друг от друга. Комбинации вышеуказанных групп соединений согласно изобретению также составляют часть изобретения в качестве вариантов осуществления согласно изобретению. В качестве примера предпочтительных соединений можно назвать следующие соединения: 1: 2-[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксипропаннитрил; 2: 1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-6-гидроксихиназолин-2,4(1 Н,3 Н)дион; 3: [1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксиацетонитрил; 4: 2-[1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксипропаннитрил; 5: [3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксиацетонитрил; 11: 4-[3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 12: 1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]хиназолин-2,4(1H,3H)дион; 13: 4-[3-(3,4-диметоксибензил)-2,4-диоксо-6-(2,2,2-трифторэтокси)-3,4-дигидрохиназолин-1(2 Н)ил]пиперидин-1-карбальдегид; 14: 1-(1-ацетилпиперидин-4-ил)-6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)хиназолин-2,4 369: 4-[3-4-[(4-хлорфенокси)метил]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 371: 4-[3-3-хлор-4-[(4-хлорбензил)окси]-5-этоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 373: 4-[3-3-хлор-4-[(2,4-дихлорбензил)окси]-5-этоксибензил-7-фтор-6-[2-фтор-1-(фторметил) этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 375: 4-[7-фтор-3-4-[(4-фторбензил)окси]-3-метоксибензил-6-[2-фтор-1-(фторметил)этокси]-2,4 диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 376: 4-[3-4-[(3,5-дихлорбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 377: 4-[3-(4-[4-хлор-3-(трифторметил)бензил]окси-3-метоксибензил)-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 379: 4-[3-4-[(3-хлорфенокси)метил]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 380: 4-[3-4-[(3,5-дифторбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 381: 4-3-[4-(бензилокси)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо 3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбальдегид; 382: 4-[3-4-[(3-хлор-5-фторбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил) этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 383: 4-7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-(3-метокси-4-[4-(трифторметил)бензил]окси 2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбальдегид; 384: 4-[3-4-[(2,5-дихлорбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 385: 4-[4-(7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-илметил)-2-метоксифенокси]метилбензонитрил; 386: 3-[4-(7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-илметил)-2-метоксифенокси]метилбензонитрил; 387: 4-[3-4-[(4-хлор-2-фторбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил) этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 388: 4-[3-4-[(3,4-дихлорфенил)этокси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 389: 4-7-фтор-6-[2-фтор-1-(фторметил)этокси]-3-4-[(3-гидроксибензил)окси]-3-метоксибензил 2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбальдегид; 390: 4-[7-фтор-3-4-[(3-фторбензил)окси]-3-метоксибензил-6-[2-фтор-1-(фторметил)этокси]-2,4 диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 391: 4-[3-4-[(3,4-дифторбензил)окси]-3-метоксибензил-7-фтор-6-[2-фтор-1-(фторметил)этокси]2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид; 392: 4-3-[4-(5,6-дихлор-1 Н-бензимидазол-1-ил)-3-метоксибензил]-7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбальдегид; 393: 4-(7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)-илметил)фенил-3,4-дихлорбензолсульфонат; 394: 4-(7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)-илметил)-2-метоксифенил-3,4-дихлорбензолсульфонат; 403: 3,4-дихлор-N-[4-(7-фтор-6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4 диоксо-1,4-дигидрохиназолин-3(2 Н)-илметил)-2-метоксифенил]бензамид. Объектом настоящего изобретения также являются способы получения соединения общей формулы(I). Соединения согласно изобретению могут быть получены способами, представленными на нижеследующих схемах 1-4. В нижеследующем контексте под удаляемой группой понимают группу, которая может быть легко замещена, с удалением электронной пары за счет гетеролитического разрыва связи. Эта группа, таким образом, может быть легко заменена другой группой, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как мезилат, тозилат, трифлат и т.д. Примеры удаляемых групп, а также ссылки на их получение приводятся в "Advanced Organic Chemistry" J. March, 3-е издание, Wiley Interscience, cc. 310-316. Под защитной группой PG понимают группу, позволяющую противодействовать реакционной способности функции или положения во время химической реакции, способной ее(его) затрагивать, и которая восстанавливает молекулу после отщепления в соответствии с известными специалисту в данной области способами. Под временной защитной группой аминов или спиртов понимают защитные группы, такие как группы, описанные в руководстве "Protective Groups in Organic Synthesis" Greene T. W. и Wuts P. G. M.,- 12018766 изд. Wiley Intersciences, 1999, и в руководстве "Protecting Groups" Kocienski P. J., 1994, Georg Thierae Verlag. Можно назвать, например, временные защитные группы аминов: бензилы, карбаматы (такие, как трет-бутоксикарбонил, отщепляемый в кислой среде, бензилоксикарбонил, отщепляемый путем гидрогенолиза); временные защитные группы карбоновых кислот: сложные алкиловые эфиры (такие, как метиловый или этиловый, трет-бутиловый эфиры, гидролизуемые в щелочной или кислой среде) и сложные бензиловые эфиры, подвергающиеся гидрогенолизу; временные защитные группы спиртов или фенолов,такие как тетрагидропиранильный, метоксиметильный или метилэтоксиметильный, трет-бутиловый и бензиловый простые эфиры; временные защитные группы карбонилированных производных, такие как линейные или циклические ацетали, как, например, 1,3-диоксан-2-ил или 1,3-диоксолан-2-ил; и следует сослаться на хорошо известные общие способы, описанные в вышеуказанном руководстве "ProtectiveGroups". В зависимости от случая, специалист в данной области также выбирает соответствующие защитные группы. Соединения формулы (I) могут включать группы, предшественники других функциональных групп, которые генерируются в дальнейшем на одной или нескольких других стадиях. В случае нижеследующих общих схем синтеза исходные соединения и реагенты, когда способ их получения не описан, являются коммерчески доступными или описанными в литературе или же могут быть получены согласно способам, которые там описаны или которые известны специалисту в данной области. Чистые энантиомеры соединений согласно изобретению могут быть получены из энантиомерночистых предшественников или же путем хроматографии на хиральных фазах или же, когда соединения включают кислотные функциональные группы или аминогруппы, путем селективных кристаллизаций диастереоизомерных солей, получаемых путем введения во взаимодействие соединений формулы (I) с,соответственно, хиральными аминами или кислотами. Согласно одному способу осуществления изобретения соединения общей формулы (I) могут быть получены в соответствии с нижеприводимыми схемами 1-4. Ради наглядности, выбирают группу R4 как означающую водород, р и р' означают 1 и 2, соответственно, и фиксируют группы R2 и R3, такие как указанные на схемах. Однако само собой разумеется, что R4 может быть таким, как указанный в общей формуле (I), R2 и R3 могут находиться в положениях, указанных в общей формуле (I), и р и р' могут быть такими, как указанные в общей формуле (I). Пути синтеза, описанные ниже, служат только в качестве поясняющих и ни в коем случае не являются ограничивающими объем охраны изобретения. Специалист в данной области без затруднений может применять нижеприводимую техническую инструкцию к соединениям формулы (I), в которых R, R1,R2, R3, R4, Ra, Rb, Rc, m, n, p, p' и q имеют значения, указанные в общей формуле (I). Согласно схеме 1, соединение формулы (IV) получают за счет реакции восстановительного аминирования путем введения во взаимодействие соединения формулы (II), в котором R' означает (C1-С 6)алкильную группу и R2 является таким, как указанный в случае соединения формулы (I), с соединением формулы (III) в кислой среде и в присутствии восстановителя, такого, как триацетоксиборгидрид натрия. Группа GP соединения формулы (III) представляет собой защитную группу функциональной аминогруппы, которая преимущественно может быть трет-бутилоксикарбонилом (boc). Таким образом полученное соединение формулы (IV) затем ацилируют согласно способам, хорошо известным специалисту в данной области, с помощью алкилхлорформиата или арилхлорформиата, получая соединение формулы (V), в котором R" означает (C1-C6)-алкильную группу или замещенную арильную группу. Реакция гидролиза в щелочной среде позволяет получать соединения формулы (VI), которые за счет реакции связывания с соединением формулы (VII), в котором R3 является таким, как указанный в случае соединения формулы(I), приводят к соединениям формулы (VIII). Реакция внутримолекулярной циклизации в щелочной среде позволяет получать хиназолиндионовые производные формулы (IX). Защитную группу GP функциональной аминогруппы затем отщепляют, например, в кислой среде, когда GP означает boc, получая соединения формулы (Ia), которые за счет реакции ацилирования приводят к соединениям формулы (Ib). Соединения формулы (Ia) представляют собой соединения формулы (I) и могут служить промежуточным продуктом для получения других соединений формулы (I), таких как соединения формулы (Ib). Соединения формулы (I), в которых R2 означает -ORa, причем Ra имеет значение, указанное в случае соединения формулы (I), отвечают формуле (Id). Они могут быть получены из соединений формулы(X) согласно следующей схеме 2. Соединения формулы (Ic), получаемые путем реакции гидролиза соединений формулы (X), подвергают, например, реакции алкилирования при использовании алкилирующего агента типа Ra-X, в котором Ra имеет значение, как указанное в случае соединения формулы (I), иX означает удаляемую группу (такую, как, например, атом галогена), в присутствии основания, такого как карбонат цезия (Cs2CO3), или реакции Mitsunobu (Synthesis, I, 1981) со спиртом типа Ra-OH, причемRa имеет значение, как указанное в случае соединения формулы (I), получая соединения формулы (Id). Соединения формулы (X), а также соединения формулы (Ic) представляют собой соединения формулы (I) и могут служить промежуточным продуктом для получения других соединений формулы (I),таких как соединения формулы (Id). Схема 2 Альтернативно, соединения формулы (Id) могут быть получены согласно способу, представленному на схеме 3. Соединения формулы (XII) получают путем реакции ароматического нуклеофильного замещения,используя соединение формулы (XI), в котором R' имеет вышеуказанное значение, спирт типа RaOH, в котором Ra имеет значение, как указанное в случае соединения формулы (I), в присутствии основания. Восстановление нитрогруппы соединений формулы (XII) приводит к соответствующим анилиновым производным (XIII). Реакция восстановительного аминирования при использовании соединения формулы (III), в котором GP означает защитную группу функциональных аминогрупп, такую как, например,boc, приводит к соединениям формулы (XIV). Соединения формулы (XV) получают путем введения во взаимодействие соединения формулы (XIV) с изоцианатом калия (KNCO) в кислой среде. Реакция внутримолекулярной циклизации в щелочной среде позволяет получать соединения формулы (XVI). Защитную группу GP отщепляют известными специалисту в данной области способами, получая соединения формулы (XVII). Реакция ацилирования приводит к соединениям формулы (XVIII). Наконец, соединения формулы (Id) получают либо путем реакции алкилирования при использовании производного типа(XIX), в котором X означает удаляемую группу, такую, как атом галогена, в присутствии основания, как,например, карбонат цезия, либо еще путем реакции Mitsunobu при использовании бензилового спирта-СН 2-NHC(О)Rb, причем Rb имеет значение, как указанное в случае соединения формулы (I), могут быть получены согласно следующей схеме 4. На схеме 3 указанная группа R2 является группой типа -O-Ra и находится в положении 6 хиназолиндионовой структуры (см., например, соединение (XVIII, но также может иметься вторая группа R2,такая как указанная в общей формуле (I), в положении 7 той же самой хиназолиндионовой группы. Восстановление нитрогруппы соединений типа (XXI), где R' и GP' имеют вышеуказанные значения,причем группа GP' является преимущественно boc-группой, приводит к соответствующим анилиновым производным (XXII), которые за счет реакции восстановительного аминирования путем введения во взаимодействие, в кислой среде и преимущественно в присутствии восстановителя, такого как триацетоксиборгидрид натрия, с соединением формулы (III), в котором GP означает защитную для аминогруппы бензилоксикарбонильную группу, приводят к соединениям формулы (XXIII). Реакция ацилирования при использовании алкил- или арилхлорформиата, в котором R" означает (C1-C6)-алкильную группу или замещенную арильную группу, приводит к соединениям формулы (XXIV). Хиназолиндионовые аналоги формулы (XXV) могут быть получены путем реакции гидролиза в щелочной среде, затем путем реакции связывания с соединением формулы (VII), в котором R3 имеет значение, как указанное в случае соединения формулы (I), затем путем реакции внутримолекулярной циклизации в щелочной среде. Группу GP'(предпочтительно boc) затем отщепляют в кислой среде, получая соединения формулы (XXVI), которые путем ацилирования приводят к соединениям формулы (XXVII), в которых Rb имеет значение, как указанное в случае соединения формулы (I). Защитную группу GP соединения (XXVII) отщепляют путем реакции гидрогенолиза, получая соединения формулы (Ie). Наконец, соединения формулы (If) получают путем реакции ацилирования соединений формулы (Ie). Само собой разумеется, специалист в данной области также может выбирать на основании своих знаний и литературы другие соответствующие защитные группы, позволяющие вводить все группы,описанные в общей формуле (I). Когда соединение формулы (I) включает соединенный мостиковой связью цикл, оно может быть получено безразлично одним из вышеописанных путей синтеза. В нижеследующих методиках и примерах описывается получение некоторых соединений согласно изобретению. Эти методики и примеры не являются ограничивающими объем охраны изобретения и служат только для пояснения настоящего изобретения. В нижеприводимых методиках и примерах: масс-спектры снимают на квадрупольном спектрометре типа Platform LCZ (WATERS) или типа ZQ 4000 (WATERS) при использовании метода ионизации электронным распылением с образованием положительных ионов; спектры ЯМР (ядерный магнитный резонанс) снимают на спектрометре с преобразованием Фурьеs=синглет (с),d=дублет (д),m=мультиплет (м),br=уширенный сигнал (уш.),t=триплет (т),q=квадруплет (кв),DMSO-d6=дейтерированный диметилсульфоксид (ДМСО-d6),CDCl3=дейтерохлороформ; смеси растворителей указывают в объемных соотношениях; ЯМР-спектры и масс-спектры подтверждают структуры соединений, получаемых согласно нижеприводимым примерам. В нижеследующих примерах используют следующие аббревиатуры:EtOH: этанол,HBTU: О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний-гексафторфосфат,IBCF: изобутилхлорформиат,MeOH: метанол,NaBH(ОАс)3: триацетоксиборгидрид натрия,ТА: комнатная температура,min: минута,THF: тетрагидрофуран (ТГФ),NEt3: триэтиламин,TFA: трифторуксусная кислота (ТФУК). Примеры В следующих примерах описывается получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объем охраны изобретения и служат только для пояснения настоящего изобретения. Номера подтверждаемых примерами соединений соответствуют таковым, приводимым в нижеследующей таблице, в которой поясняются химические структуры и физические свойства некоторых соединений согласно изобретению. Пример 1. Соединение 6. Получение [3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксиацетонитрила Облучают в микроволновом поле (Biotage Initiator Sixty) в течение 20 мин при температуре 110 С смесь 2 г метил-2-амино-5-(бензилокси)бензоата, 3,1 г 1,1-диметилэтил-4-оксопиперидин-1-карбоксилата и 3,29 г NaBH(OAc)3 в 10 мл уксусной кислоты. Ту же самую реакцию повторяют при использовании двух других партий 2 г метил-2-амино-5-(бензилокси)бензоата. Объединяют три реакционные среды. Обрабатывают с помощью этилацетата. Органическую фазу промывают водой, насыщенным растворомNH4Cl, насыщенным раствором NaHCO3, сушат над Na2SO4, отфильтровывают и растворитель выпаривают при пониженном давлении. Хроматографируют остаток на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (5/95, об./об.) вплоть до (30/70, об./об.), получая 10,2 г ожидаемого продукта. Стадия 1.2. 1,1-Диметилэтил-4-[4-(бензилокси)-2-(метоксикарбонил)фенил][(2-метилпропокси) карбонил]аминопиперидин-1-карбоксилат Облучают в микроволновом поле, в течение 30 мин при температуре 80 С смесь 2 г 1,1-диметилэтил-4-[4-(бензилокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата, полученного на стадии 1.1, 0,87 мл DIEA, 1,78 мл IBCF, 1 г NaOH в 10 мл 1,2-дихлорэтана. Повторяют ту же самую реакцию с четырьмя другими партиями 2 г 1,1-диметилэтил-4-[4-(бензилокси)-2-(метоксикарбонил)фенил] аминопиперидин-1-карбоксилата. Объединяют 5 реакционных сред. Обрабатывают с помощью этилацетата, отфильтровывают и фильтрат выпаривают при пониженном давлении. Хроматографируют остаток на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (10/90, об./об.) вплоть до В течение 3 ч при температуре 100 С нагревают смесь 9,3 г 1,1-диметилэтил-4-[4-(бензилокси)-2(метоксикарбонил)-фенил][(2-метилпропокси)карбонил]аминопиперидин-1-карбоксилата, полученного на стадии 1.2, 34,4 мл 2 н. раствора NaOH в 57 мл метанола. Раствор выпаривают при пониженном давлении и добавляют дихлорметан. Сушат над Na2SO4, отфильтровывают и растворитель выпаривают при пониженном давлении, получая 8,7 г ожидаемого продукта. Стадия 1.4. 1,1-Диметилэтил-4-[4-(бензилокси)-2-[(3,4-диметоксибензил)карбамоил]фенил (изобутоксикарбонил)амино]пиперидин-1-карбоксилат При комнатной температуре в течение 15 мин перемешивают смесь 6 г натриевой соли 5(бензилокси)-2-(1-[(1,1-диметилэтокси)карбонил]пиперидин-4-ил[(2-метилпропокси)карбонил]амино) бензойной кислоты, полученной на стадии 1.3, 4,42 г DIEA в 250 мл ДМФА. Добавляют 6,48 г HBTU и выдерживают при перемешивании в течение 30 мин. Добавляют 2,48 г вератриламина и реакционную смесь перемешивают в течение 48 ч. Выпаривают при пониженном давлении, остаток обрабатывают этилацетатом, промывают насыщенным раствором NH4Cl, насыщенным раствором NaHCO3, сушат надNa2SO4, отфильтровывают и растворитель выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (20/80, об./об.) вплоть до Облучают в микроволновом поле, в течение 30 мин при температуре 110 С смесь 2,5 г 1,1 диметилэтил-4-[4-(бензилокси)-2-[(3,4-диметоксибензил)карбамоил]фенил(изобутоксикарбонил)амино]пиперидин-1-карбоксилата, полученного на стадии 1.4, 7,4 г NaOH в 18,5 мл 1,2-дихлорэтана. Повторяют такую же реакцию с 2 другими партиями 2,5 г 1,1-диметилэтил-4-[4-(бензилокси)-2-[(3,4 диметоксибензил)карбамоил]фенил(изобутоксикарбонил)-амино]пиперидин-1-карбоксилата. Объединяют 3 реакционные среды. Обрабатывают с помощью дихлорметана, промывают водой, сушат надNa2SO4, отфильтровывают и растворитель выпаривают при пониженном давлении, получая 6,6 г ожидаемого продукта. Стадия 1.6. 6-(Бензилокси)-3-(3,4-диметоксибензил)-1-пиперидин-4-ил-хиназолин-2,4(1 Н,3 Н)дион В течение 2,00 ч при комнатной температуре перемешивают смесь 3,5 г 1,1-диметилэтил-4-[6(бензилокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 1.5, и 2 5 мл ТФУК в 50 мл дихлорметана. Нейтрализуют с помощьюK2CO3. Отфильтровывают, фильтрат выпаривают при пониженном давлении. Обрабатывают с помощью дихлорметана, промывают насыщенным раствором NaHCO3, затем 8%-ным раствором NaOH. Сушат надNa2SO4, отфильтровывают и растворитель выпаривают при пониженном давлении, получая 2,67 г ожидаемого продукта. Облучают в микроволновом поле, в течение 1 ч при температуре 140 С, смесь 0,6 г 6-(бензилокси)3-(3,4-диметоксибензил)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)диона, полученного на стадии 1.6, 0,113 г формиата аммония в 5 мл ацетонитрила. Отфильтровывают, фильтрат выпаривают при пониженном давлении, получая 0,62 г ожидаемого продукта. Стадия 1.8. Соединение 5. 4-[3-(3,4-Диметоксибензил)-6-гидрокси-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1 карбальдегид Облучают в микроволновом поле, в течение 2 ч при температуре 80 С, смесь 0,618 г 4-[6(бензилокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида, полученного на стадии 1.7, 0,44 г формиата аммония и 0,124 г Pd/C (10%) в 10 мл этанола, предварительно продутую азотом. Отфильтровывают, фильтрат выпаривают при пониженном давлении, получая 0,513 г ожидаемого продукта. Стадия 1.9. Соединение 6. При комнатной температуре в течение 15 мин перемешивают 0,17 г 4-[3-(3,4-диметоксибензил)-6 гидрокси-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида, полученного на стадии 1.8, 0,25 г Cs2CO3 в 3 мл ДМФА. Добавляют 0,056 г бромацетонитрила и затем реакционную смесь облучают в микроволновом поле в течение 15 мин при температуре 100 С. Отфильтровывают, выпаривают при пониженном давлении. Хроматографируют остаток на силикагеле, элюируя смесью метанол/дихлорметан, в соотношении от (1/99, об./об.) вплоть до (4/96, об./об.), получая 0,112 г ожидаемого продукта. Пример 2. Соединение 3. Получение [1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксиацетонитрила пиперидин-4-илхиназолин-2,4(1 Н,3 Н)диона, полученного на стадии 1.6, 0,24 г триэтиламина в 10 мл дихлорметана, предварительно охлажденной до температуры 0 С. Перемешивают при комнатной температуре в течение всей ночи. Промывают 2 раза насыщенным раствором NH4Cl, отфильтровывают, затем фильтрат выпаривают при пониженном давлении, получая 0,64 г ожидаемого продукта. Стадия 2.2. Соединение 2. 1-(1-Ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-6-гидроксихиназолин-2,4(1 Н,3 Н)дион Облучают в микроволновом поле, в течение 2 ч при температуре 80 С, смесь 0,64 г 1-(1 ацетилпиперидин-4-ил)-6-(бензилокси)-3-(3,4-диметоксибензил)хиназолин-2,4(1 Н,3 Н)диона, полученного на стадии 2.1, 0,44 г формиата аммония и 0,125 г Pd/C (10%) в 10 мл этанола, предварительно продутую азотом. Отфильтровывают, фильтрат выпаривают при пониженном давлении, получая 0,48 г ожидаемого продукта. Стадия 2.3. Соединение 3. При комнатной температуре в течение 15 мин перемешивают 0,12 г 1-(1-ацетилпиперидин-4-ил)-3(3,4-диметоксибензил)-6-гидроксихиназолин-2,4(1 Н,3 Н)диона, полученного на стадии 2.2, 0,172 г Cs2CO3 в 3 мл ДМФА. Добавляют 0,038 г бромацетонитрила и затем реакционную смесь облучают в микроволновом поле в течение 15 мин при температуре 100 С. Отфильтровывают, фильтрат выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью метанол/дихлорметан,в соотношении от (1/99, об./об.) вплоть до (4/96, об./об.), получая 0,094 г ожидаемого продукта. Пример 3. Соединение 34. Синтез 4-[3-(4-хлорбензил)-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида Добавляют 8,53 г 2,2-дифторэтанола к раствору 17,31 г метил-5-фтор-2-нитробензоата, 9,64 г триэтиламина, 32,71 г 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3,3,3]ундекана в 250 мл безводного ТГФ. Перемешивают в течение 30 мин при комнатной температуре. Растворитель выпаривают при пониженном давлении. Добавляют воду и экстрагируют этилацетатом. Промывают 1 н. водным раствором HCl, затем насыщенным раствором NaCl. Сушат над MgSO4, отфильтровывают, выпаривают растворитель при пониженном давлении, получая 21 г ожидаемого продукта. Стадия 3.2. Метил-2-амино-5-(2,2-дифторэтокси)бензоат Перемешивают в атмосфере водорода в течение 24 ч при комнатной температуре 21 г метил-5-(2,2 дифторэтокси)-2-нитробензоата, полученного на стадии 3.1, и 1 г Pd/C (10%) в смеси из 300 мл этилацетата, 50 мл этанола и 5 мл уксусной кислоты. Отфильтровывают, выпаривают при пониженном давлении, получая 18,8 г ожидаемого продукта. Стадия 3.3. 1,1-Диметилэтил-4-[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилат Нагревают при температуре 90 С в течение 10 мин смесь 4 г метил-2-амино-5-(2,2-дифторэтокси) бензоата, полученного на стадии 3.2, 6,88 г 1,1-диметилэтил-4-оксопиперидин-1-карбоксилата в 15 мл уксусной кислоты. Оставляют охлаждаться до комнатной температуры и добавляют 7,3 г NaBH(OAc)3. Выдерживают при перемешивании в течение 12 ч при комнатной температуре. Экстрагируют этилацетатом, промывают насыщенным раствором K2CO3, затем водой. Сушат над MgSO4, отфильтровывают, выпаривают при пониженном давлении, получая 6, 63 г ожидаемого продукта. Стадия 3.4. 1,1-Диметилэтил-4-карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилат Добавляют 1,95 г изоцианата калия в виде раствора в 4 мл воды к раствору 6,63 г 1,1-диметилэтил 4-[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата, полученного на стадии 3.3, в 40 мл уксусной кислоты. Перемешивают в течение 12 ч при комнатной температуре. Экстрагируют этилацетатом, промывают насыщенным раствором K2CO3, затем водой. Сушат над MgSO4,отфильтровывают, выпаривают при пониженном давлении, получая 6,95 г ожидаемого продукта. Стадия 3.5. 1,1-Диметилэтил-4-[6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил] пиперидин-1-карбоксилат Облучают в микроволновом поле в течение 30 мин при температуре 130 С, 2,5 г 1,1-диметилэтил-4 карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата, полученного на стадии 3.4, в виде раствора в смеси из 10 мл диоксана и 5 мл 1 н. водного раствора NaOH. Экстрагируют этилацетатом, нейтрализуют 1 н водным раствором НС 1, промывают водой, сушат над MgSO4,отфильтровывают, выпаривают при пониженном давлении. Полученный остаток порошкуют в смеси этилацетат/пентан, получая ожидаемый продукт. Такую же реакцию воспроизводят с двумя другими партиями 2,5 г 1,1-диметилэтил-4-карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]амино пиперидин-1-карбоксилата, полученного на стадии 3.4, получая, в целом, 5,63 г ожидаемого продукта. Стадия 3.6. 6-(2,2-Дифторэтокси)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)дион В течение 2 ч при комнатной температуре перемешивают раствор 5,63 г 1,1-диметилэтил-4-[6-(2,2 дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 3.5, в 70 мл муравьиной кислоты. Растворитель выпаривают при пониженном давлении, получая 6,13 г ожидаемого продукта в виде соли муравьиной кислоты. Стадия 3.7. 4-[6-(2,2-Дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегид Облучают в микроволновом поле в течение 1 ч при температуре 140 С смесь 6,13 г 6-(2,2 дифторэтокси)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)диона, полученного на стадии 3.6, 3,12 г формиата аммония в 28 мл акрилонитрила и 28 мл диоксана. Реакционную смесь выливают в воду. Отфильтровывают, осадок промывают водой, затем диэтиловым эфиром, получая 4,47 г ожидаемого продукта. Стадия 3.8. Соединение 34. 4-[3-(4-Хлорбензил)-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1 карбальдегид В течение 1 ч при комнатной температуре перемешивают смесь 0,15 г 4-[6-(2,2-дифторэтокси)-2,4 диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида, полученного на стадии 3.7, 0,096 г 1-(бромметил)-4-хлорбензола и 0,3 г Cs2CO3 в 3 мл ДМФА. Добавляют этилацетат, промывают водой,затем насыщенным раствором NaCl. Сушат над MgSO4, отфильтровывают, выпаривают при пониженном давлении. Хроматографируют на силикагеле, элюируя этилацетатом, получая 0,116 г ожидаемого продукта. Пример 4. Соединение 49. Синтез 4-3-[3-(циклопентилокси)-4-метоксибензил]-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбальдегида Добавляют 0,172 г DIAD к раствору 0,15 г 4-[6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида, полученного на стадии 3.7, 0,142 г [4-(циклопентилокси)-3 метоксифенил]метанола и 0,223 г PPh3 в 3 мл безводного ТГФ. Перемешивают в течение 12 ч при комнатной температуре, затем в течение 1,00 ч при температуре 60 С. Выпаривают при пониженном давлении и остаток очищают на силикагеле, элюируя этилацетатом, получая 0,083 г ожидаемого продукта. Пример 5. Соединение 20. Синтез N-[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метилацетамида Облучают в микроволновом поле, в течение 5 мин при температуре 120 С смесь 0,273 г метил-5[(трет-бутоксикарбонил)амино]метил-2-нитробензоата, 0,166 г формиата аммония и 0,094 г Pd/C (10%) в 10 мл этанола, предварительно продутую азотом. Отфильтровывают, фильтрат выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (5/95, об./об.) вплоть до (30/70, об./об.), получая 0,2 г ожидаемого продукта. Стадия 5.2. Бензил-4-[4-([(1,1-диметилэтокси)карбонил]аминометил)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилат этокси)карбонил]аминометил)бензоата, полученного на стадии 5.1, в 20 мл дихлорметана добавляют по каплям, при комнатной температуре, к суспензии 2,04 г NaBH(OAc)3 в смеси из 20 мл дихлорметана и 0,41 мл уксусной кислоты. Перемешивают в течение 15 ч при комнатной температуре, затем повторно добавляют 2,04 г NaBH(OAc)3. После перемешивания в течение 6 ч добавляют 1,66 г бензил-4 оксопиперидин-1-карбоксилата и перемешивают в течение 48 ч при комнатной температуре. Добавляют насыщенный раствор NaHCO3, экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором NaHCO3, 2 раза насыщенным раствором NH4Cl. Сушат над Na2SO4, отфильтровывают,фильтрат выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (5/95, об./об.) вплоть до (40/60, об./об.), получая 1,6 г ожидаемого продукта. Стадия 5.3. Бензил-4-[4-([(1,1-диметилэтокси)карбонил]аминометил)-2-(метоксикарбонил)фенил](этоксикарбонил)аминопиперидин-1-карбоксилат Добавляют 2,08 г DIEA, затем 1,745 г этилхлорформиата к раствору 1,6 г бензил-4-[4-([(1,1 диметилэтокси)карбонил]аминометил)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата,полученного на стадии 5.2, в 11 мл дихлорметана. Перемешивают при комнатной температуре в течение 4 дней. Выпаривают при пониженном давлении. Остаток обрабатывают с помощью 10 мл пиридина и добавляют 0,7 г этилхлорформиата. Перемешивают в течение 4,00 ч при комнатной температуре. Выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/гептан, в соотношении от (10/90, об./об.) вплоть до (30/70, об./об.), получая 0,875 г ожидаемого продукта. Стадия 5.4. Бензил-4-[3-(3,4-диметоксибензил)-6-([(1,1-диметоксиэтокси)карбонил]аминометил)2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилат В течение 15 ч при комнатной температуре перемешивают смесь 0,165 г бензил-4-[4-([(1,1 диметилэтокси)карбонил]аминометил)-2-метоксикарбонил)фенил](этоксикарбонил)аминопиперидин 1-карбоксилата, полученного на стадии 5.3, 0,028 г LiOH в 5 мл смеси ТГФ/Н 2 О (70/30). Затем облучают в микроволновом поле в течение 1 ч при температуре 100 С. Отфильтровывают и фильтрат выпаривают при пониженном давлении. Остаток обрабатывают с помощью 5 мл ДМФА. Добавляют 0,108 г DIEA и перемешивают в течение 10 мин при комнатной температуре. Добавляют 0,159 г HBTU и перемешивают в течение 30 мин при комнатной температуре. После этого добавляют 0,061 г вератриламина и перемешивают в течение 1 ч при комнатной температуре. Добавляют 0,5 мл DBU и перемешивают в течение 48 ч при комнатной температуре. Выпаривают при пониженном давлении, остаток обрабатывают этилацетатом. Промывают 3 раза насыщенным раствором NH4Cl и 2 раза водой. Сушат над Na2SO4, отфильтровывают, фильтрат выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле,элюируя смесью этилацетат/дихлорметан, в соотношении от (10/90, об./об.) вплоть до (20/80, об./об.),получая 0,104 г ожидаемого продукта. Стадия 5.5. Бензил-4-[6-(аминометил)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин 1(2 Н)-ил]пиперидин-1-карбоксилат Перемешивают в течение 2 ч при комнатной температуре раствор 0,102 г бензил-4-[3-(3,4 диметоксибензил)-6-([(1,1-диметоксиэтокси)карбонил]аминометил)-2,4-диоксо-3,4-дигидрохиназолин 1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 5.4, и 0,5 мл ТФУК в 9,5 мл дихлорметана. Добавляют насыщенный раствор NaHCO3. Органическую фазу сушат над Na2SO4, отфильтровывают,- 23018766 фильтрат выпаривают при пониженном давлении, получая 0,09 г ожидаемого продукта. Стадия 5.6. Бензил-4-6-[(ацетиламино)метил]-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин-1-карбоксилат Добавляют 0,049 г уксусного ангидрида к раствору 0,09 г бензил-4-[6-(аминометил)-3-(3,4 диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 5.5, 0,09 мл триэтиламина в 3 мл дихлорметана и перемешивают в течение 1 ч при комнатной температуре. Добавляют дихлорметан и промывают насыщенным раствором NH4Cl, затем 1 н растворомHCl, 2 н. раствором NaOH, после этого водой. Органическую фазу сушат над Na2SO4, отфильтровывают,фильтрат выпаривают при пониженном давлении, получая 0,104 г ожидаемого продукта. Стадия 5.7. N-[3-(3,4-Диметоксибензил)-2,4-диоксо-1-пиперидин-1,2,3,4-тетрагидрохиназолин-6 ил]метилацетамид Облучают в микроволновом поле в течение 30 мин при температуре 80 С смесь 0,1 г бензил-4-6[(ацетиламино)метил]-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-илпиперидин 1-карбоксилата, полученного на стадии 5.6, 0,016 г формиата аммония и 0,018 г Pd/C (10%) в 2 мл этанола, предварительно продутую азотом. Отфильтровывают, фильтрат выпаривают при пониженном давлении, получая 0,077 г ожидаемого продукта. Стадия 5.8. Соединение 20. Облучают в микроволновом поле в течение 1 ч при температуре 140 С смесь 0,070 г N-[3-(3,4 диметоксибензил)-2,4-диоксо-1-пиперидин-4-ил-1,2,3,4-тетрагидрохиназолин-6-ил]метилацетамида,полученного на стадии 5.7, 0,028 г формиата аммония в 2 мл акрилонитрила. Отфильтровывают, фильтрат выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью метанол/дихлорметан, в соотношении от (0,5/99,5, об./об.) вплоть до (7/93, об./об.), получая 0,035 г ожидаемого продукта. В нижеследующей таблице представлены химические структуры и физические свойства соединений, отвечающих общей формуле (I) согласно изобретению, а также некоторых из их промежуточных продуктов (в частности, соединения 32, 55, 120 и 257).
МПК / Метки
МПК: C07D 403/04, A61P 21/00, A61P 19/00, A61P 29/00, A61K 31/517
Метки: производные, терапии, хиназолиндионовые, получение, применения
Код ссылки
<a href="https://eas.patents.su/30-18766-hinazolindionovye-proizvodnye-ih-poluchenie-i-ih-primeneniya-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Хиназолиндионовые производные, их получение и их применения в терапии</a>
Предыдущий патент: Векторы и конструкции для доставки гриппозного антигена
Следующий патент: Способ идентификации металлов платиновой группы
Случайный патент: Устройство для измерения и индикации веса транспортного средства












