Замещенные 3-арилсульфонилпиразоло[1,5-a]пиримидины, антагонисты серотониновых 5-ht6-рецепторов, способы их получения и применения
Номер патента: 17630
Опубликовано: 30.01.2013
Авторы: Митькин Олег Дмитриевич, Иващенко Андрей Александрович, Иващенко Александр Васильевич, Кадиева Мадина Георгиевна, Лавровский Ян, Савчук Николай Филиппович
Формула / Реферат
1. Замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1 и их фармацевтически приемлемые соли
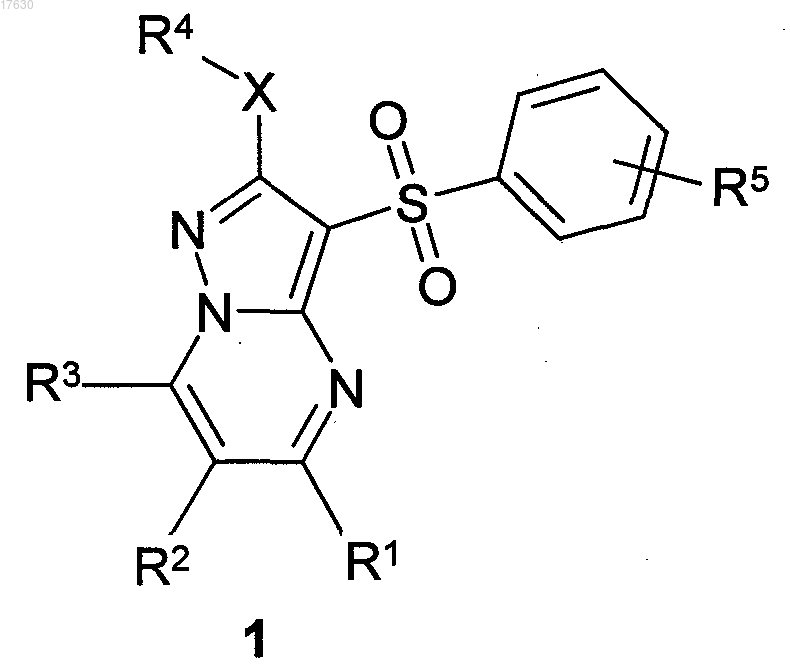
где X=S, SO;
R1 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкил тиогруппой, галогеном, фенилом, необязательно замещенным C1-C3-алкилом или галогеном; C3-C6 циклоалкил; адамантил; фенил, необязательно замещенный галогеном, C1-C3-алкилом, C1-C3-алкоксигруппой; или 5-6-членный необязательно аннелированный гетероциклил, в котором гетероатом выбран из азота или кислорода, необязательно замещенный галогеном или C1-C3-алкилом; C1-C3-алкоксикарбонил; карбоксил; амидную группу;
R2 представляет собой атом водорода; галоген; C1-C3-алкил, необязательно замещенный C1-C3-алкоксикарбонилом, карбоксигруппой, амидной группой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкокси, C3-C6-циклоалкилом, пиперидинилом, возможно замещенным C1-C3-алкилом, бензилом, необязательно замещенным галогеном, C1-C3-алкилом; феноксигруппу; пиридилоксигруппу; фенилдиазенил, необязательно замещенный галогеном или C1-C3-алкилом; аминогруппу, необязательно моно- или дизамещенную C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкокси, C3-C6-циклоалкилом, пиперидинилом, возможно замещенным C1-C3-алкилом, бензилом, который необязательно замещен галогеном, C1-C3-алкилом, C1-C3-алкоксигруппой;
R3 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, необязательно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилтиогруппой, галогеном, фенилом, который возможно замещен C1-C3-алкилом или галогеном; C1-C3-алкокси; C1-C3-алкоксикарбонил; пиридил, карбоксил или амидную группу;
R4 представляет собой C1-C3-алкил;
R5 представляет собой водород, один или два атома галогена, C1-C3-алкил, гидроксигруппу, C1-C3-алкокси, феноксигруппу, необязательно замещенную галогеном или C1-C3-алкилом.
или при X=NH
R1, R2, R4, R5 имеют вышеуказанные значения;
R3 представляет собой атом водорода, C1-C3-алкил, необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилтиогруппой, галогеном, фенилом, необязательно замещенным C1-C3-алкилом или галогеном; C1-C3-алкокси; C1-C3-алкоксикарбонил; аминогруппу, необязательно моно- или дизамещенную C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкилтиогруппой, галогеном, фенилом, который возможно замещен C1-C3-алкилом или галогеном; или насыщенный 6-членный азагетероциклил, содержащий дополнительный гетероатом, выбранный из кислорода или азота, необязательно замещенный галогеном или C1-C3-алкилом; пиридил; C1-C3-алкоксикарбонил, карбоксил или амидную группу.
2. Соединения по п.1, представляющие собой замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1, 1.2 и их фармацевтически приемлемые соли
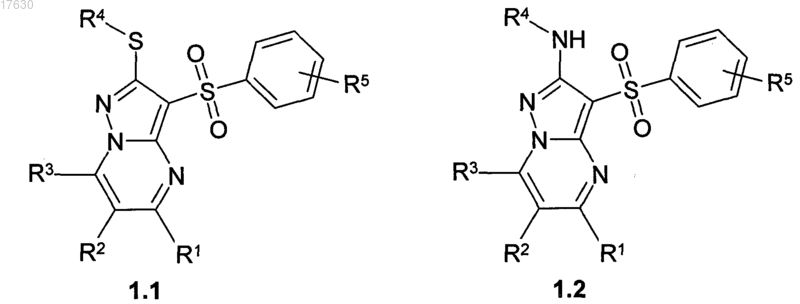
где R1, R2, R3, R4 и R5 имеют вышеуказанные значения.
3. Соединения по пп.1, 2, представляющие собой замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10, 1.2.1, 1.2.2, 1.2.3, 1.2.4, 1.2.5, 1.2.6, 1.2.7, 1.2.8, 1.2.9 и 1.2.10 и их фармацевтически приемлемые соли

где R4 и R5 имеют вышеуказанное значение;
R6 и R7 независимо друг от друга представляют собой водород или C1-C3-алкил;
R8 представляет собой C1-C3-алкил, C1-C3-алкилфенил, фенил, пиридил, C1-C3-ацил;
R9 представляет собой C1-C3-алкил или пиридил;
Py представляет собой пиридил;
X=S для соединений общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10;
X=NH для соединений общей формулы 1.2.1, 1.2.2, 1.2.3, 1.2.4, 1.2.5, 1.2.6, 1.2.7, 1.2.8, 1.2.9, 1.2.10.
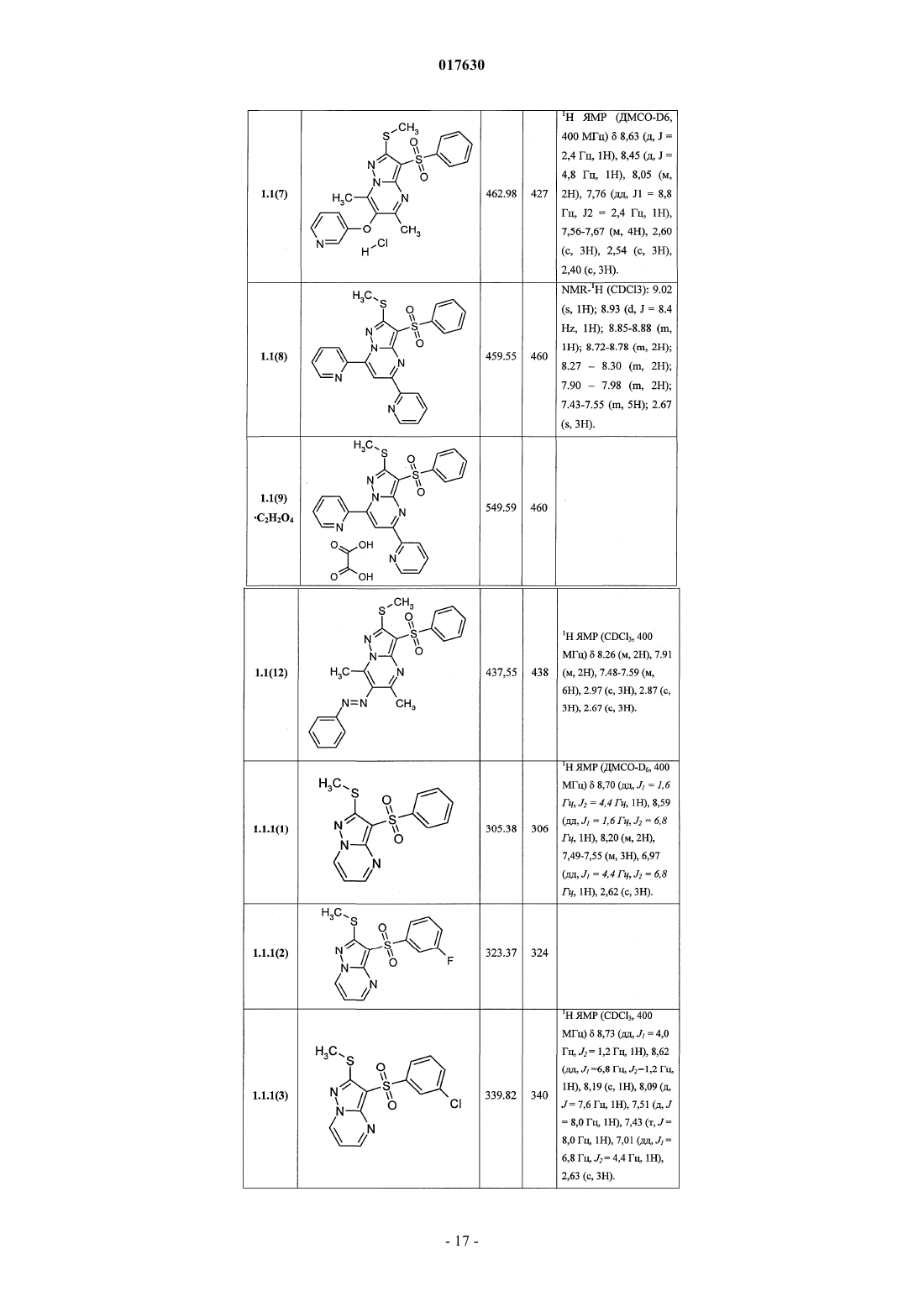
4. Соединения по пп.1-3, представляющие собой
7-(гидроксиметил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метиламино-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил) -5-метил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(гидроксиметил)-5-метил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метиламино-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(гидроксиметил)-7-метил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
и их фармацевтически приемлемые соли.
5. Соединения по пп.1, 2, представляющие собой замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.11, 1.1.12, 1.1.13, 1.1.14, 1.1.15, 1.1.16, 1.1.17, 1.1.18, 1.1.19, 1.2.13, 1.2.14, 1.2.15, 1.2.16, 1.2.17, 1.2.18, 1.2.19, 1.2.20 и 1.2.21 и их фармацевтически приемлемые соли
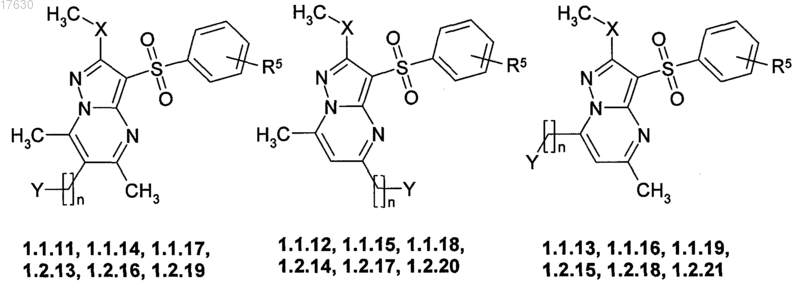
где R5 имеет вышеуказанное значение;
n=0, 1, 2;
X=S для соединений общей формулы 1.1.11, 1.1.12, 1.1.13, 1.1.14, 1.1.15, 1.1.16, 1.1.17, 1.1.18, 1.1.19;
X=NH для соединений общей формулы 1.2.13, 1.2.14, 1.2.15, 1.2.16, 1.2.17, 1.2.18, 1.2.19, 1.2.20, 1.2.21;
Y = C1-С3-алкилоксикарбонил для соединений общей формулы 1.1.11, 1.1.12, 1.1.13, 1.2.13, 1.2.14, 1.2.15;
Y = карбоксил для соединений общей формулы 1.1.14, 1.1.15, 1.1.16, 1.2.16, 1.2.17, 1.2.18;
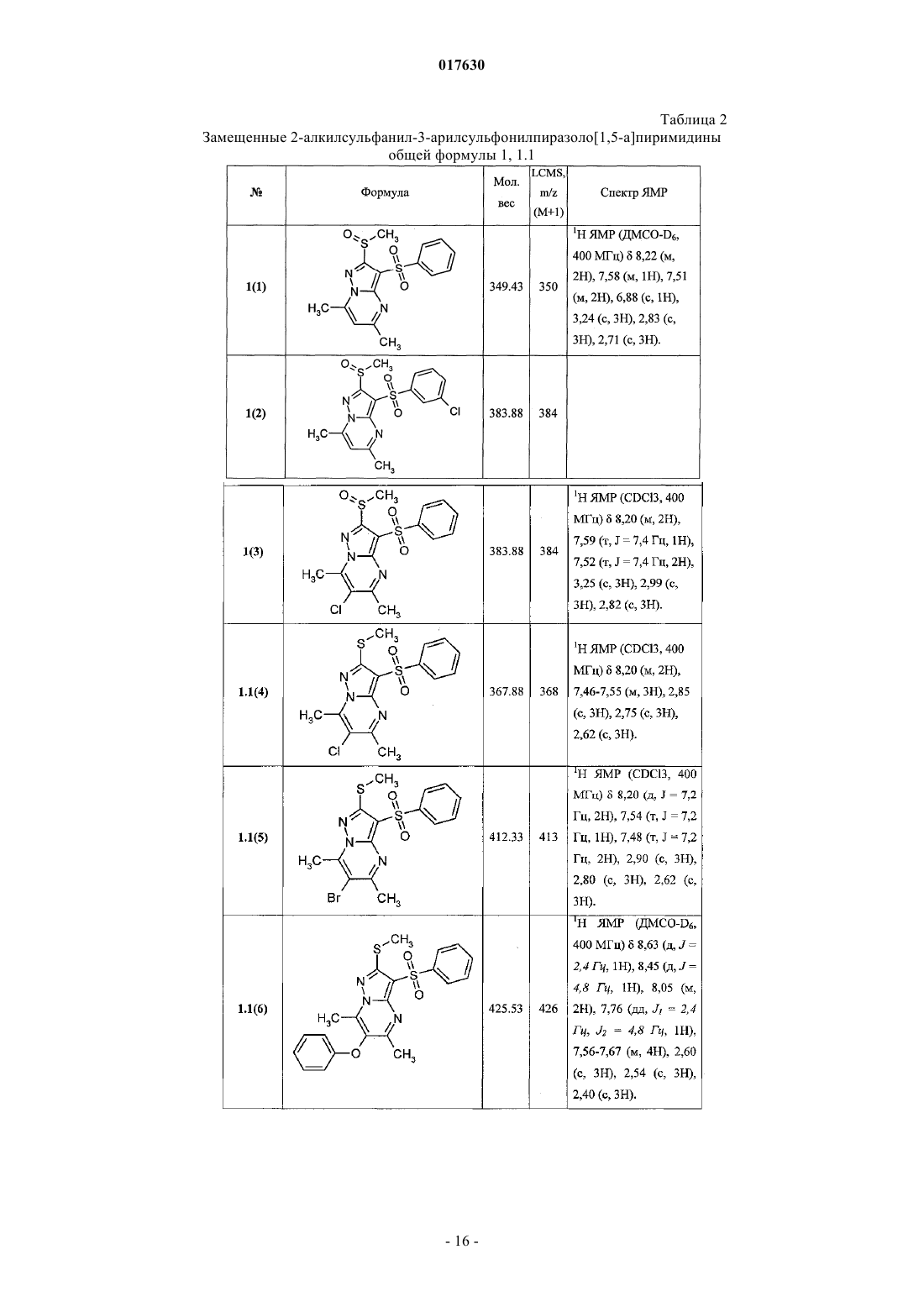
Y = замещенная амидная группа CONR10R11, в которой R10 и R11 представляют собой атом водорода, линейный или разветвленный C1-C5-алкил, необязательно замещенный аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, или R10 и R11 вместе с атомом азота, с которым они связаны, образуют 6-членный азагетероциклил, необязательно замещенный C1-C3-алкилом, галогеном, для соединений общей формулы 1.1.17, 1.1.18, 1.1.19, 1.2.19, 1.2.20, 1.2.21.
6. Соединения по пп.1, 2, представляющие собой замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.20, 1.1.21, 1.1.22, 1.2.22, 1.2.23 и 1.2.24, и их фармацевтически приемлемые соли

где n=1, 2, когда X=S для соединений общей формулы 1.1.22;
n=0, 1, 2, когда X=S для соединений общей формулы 1.1.20, 1.1.21;
n=0, 1, 2, 3, когда X=NH для соединений общей формулы 1.2.22, 1.2.23, 1.2.24;
R5, R10, R11, а также R10 и R11 вместе с атомом азота, с которым они связаны, имеют вышеуказанное значение.
7. Соединения по пп.1, 6, представляющие собой
6-амино-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(3-аминопропил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(аминометил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5-(2-аминоэтил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5-(диметиламинометил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5-(диметиламинометил)-7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5-(2-диметиламиноэтил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(аминометил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(2-аминоэтил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(диметиламинометил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
7-(диметиламинометил)-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
7-(2-диметиламиноэтил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-амино-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(3-аминопропил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(аминометил)-5,7-диметил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин,
5,7-диметил-6-(2-диметиламиноэтил)-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин,
и их фармацевтически приемлемые соли.
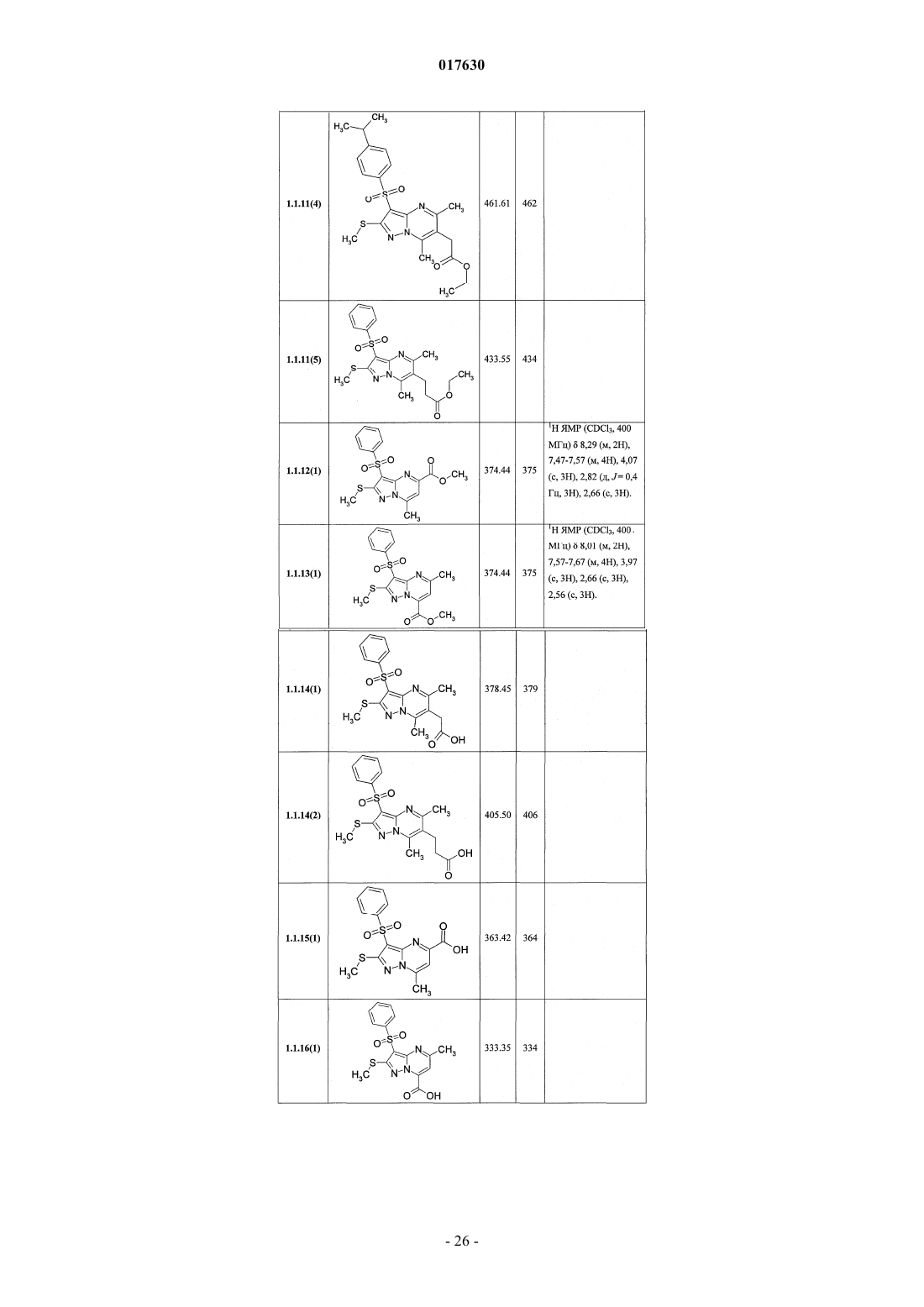
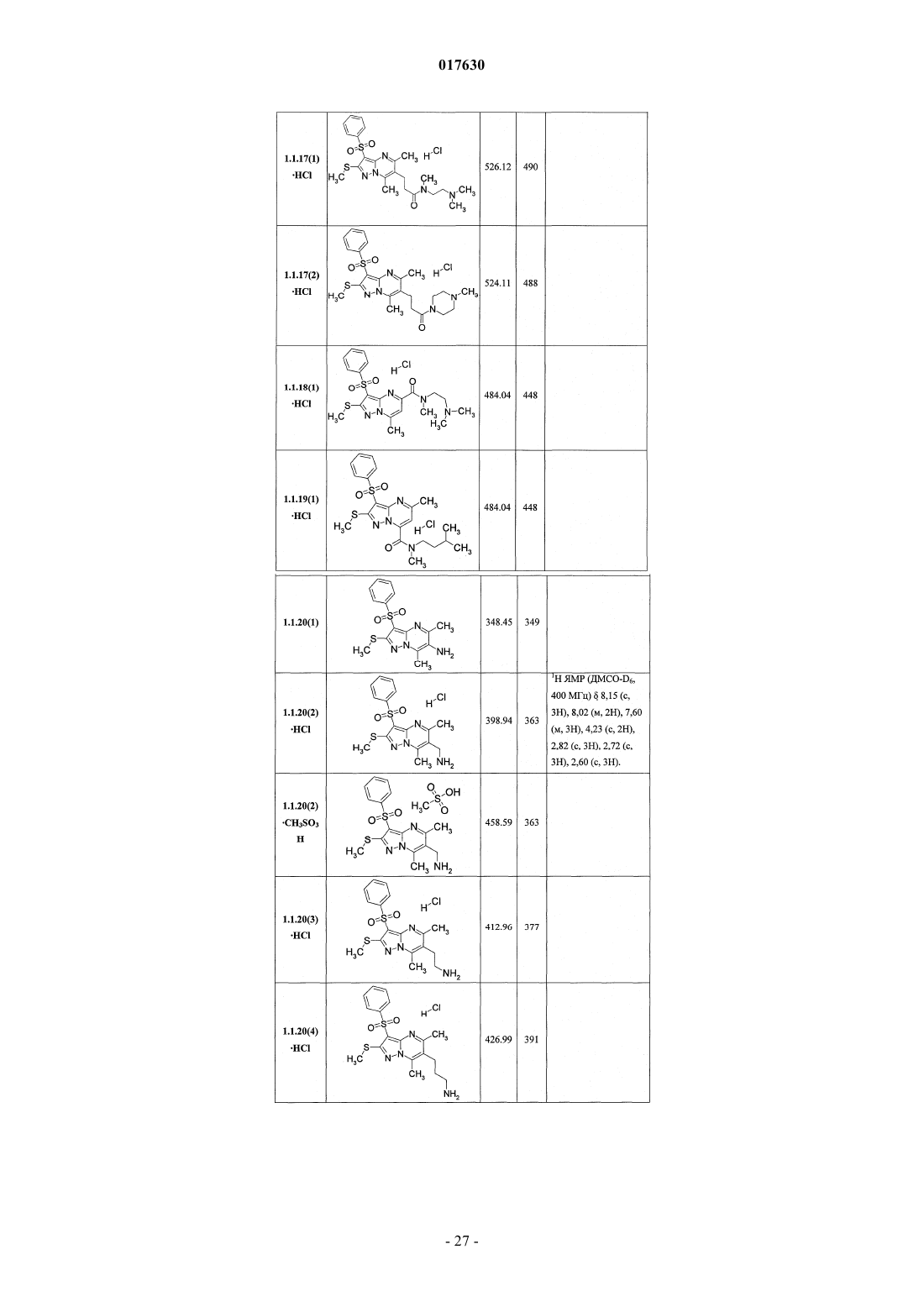
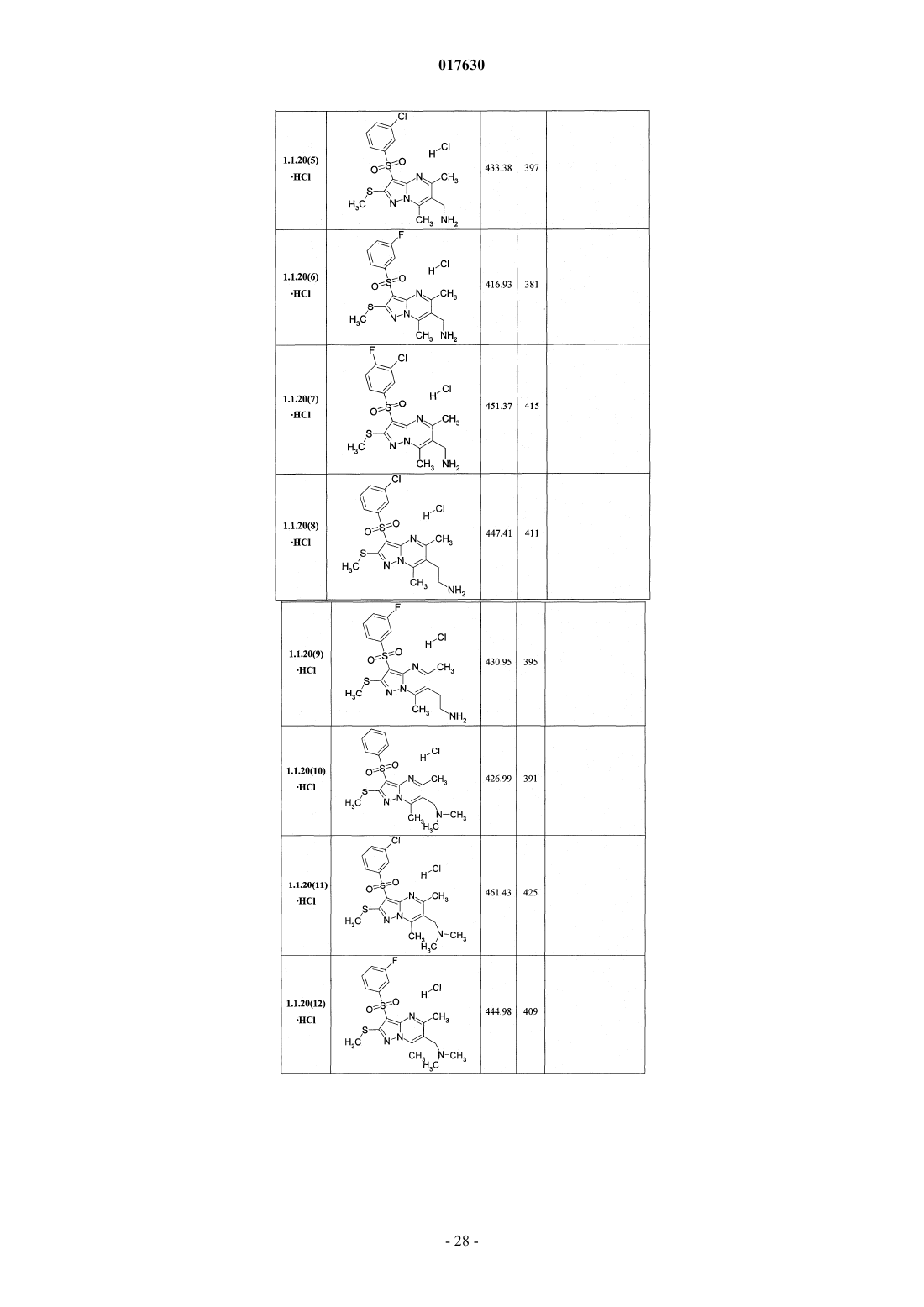
8. Способ получения замещенных 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 и их фармацевтически приемлемых солей взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 2 с соответствующими β-дикарбонильными соединениями или их производными общей формулы 3 с последующим выделением или разделением продуктов реакции (А, В) по схеме, представленной ниже, где в качестве производных могут быть использованы ацетали или диацетали
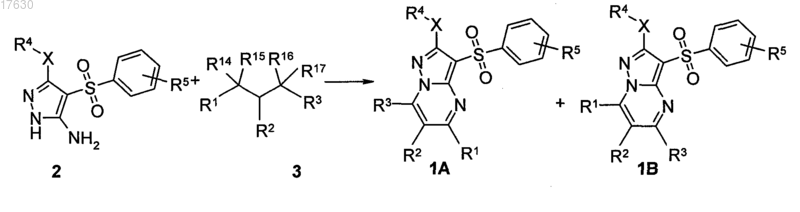
где R1, R2, R3, R4 и R5 имеют вышеуказанное значение;
X=S или NH;
R14 и R15, R16 и R17 независимо друг от друга вместе с атомами углерода, с которыми они связаны, образуют карбонильную группу или R14 и R15 и R16 и R17 вместе с атомами углерода, с которыми они связаны, независимо друг от друга образуют ацетальную группу.
9. Способ получения замещенных 2-сульфинил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1, где X=SO, окислением 2-сульфанил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1, где X=S.
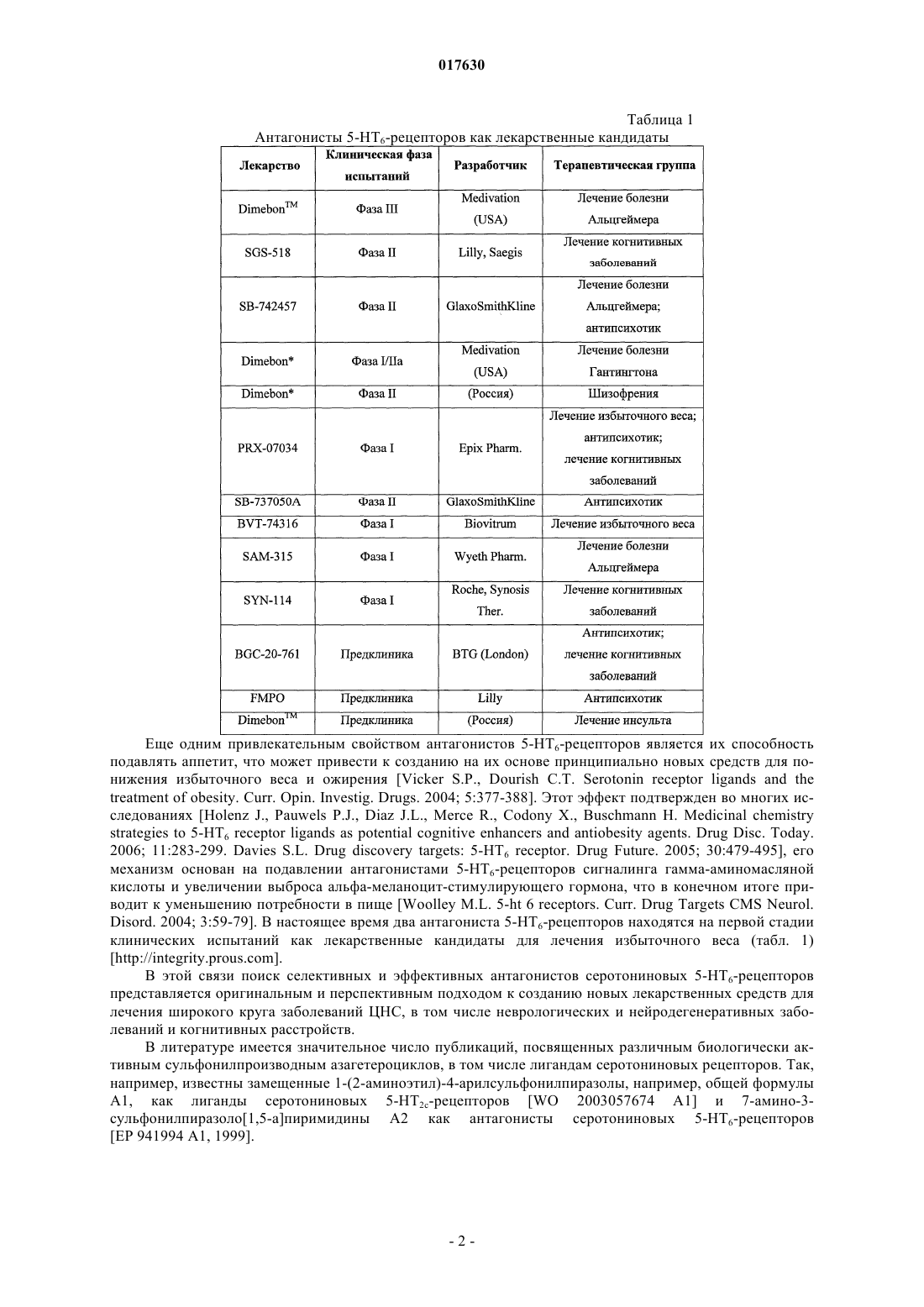
10. Способ получения замещенных 7-гидроксиметил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.6, 1.2.6 и 5-гидроксиметил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.7, 1.2.7 действием трехбромистого бора на 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.4, 1.2.4 или 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.5, 1.2.5 соответственно.
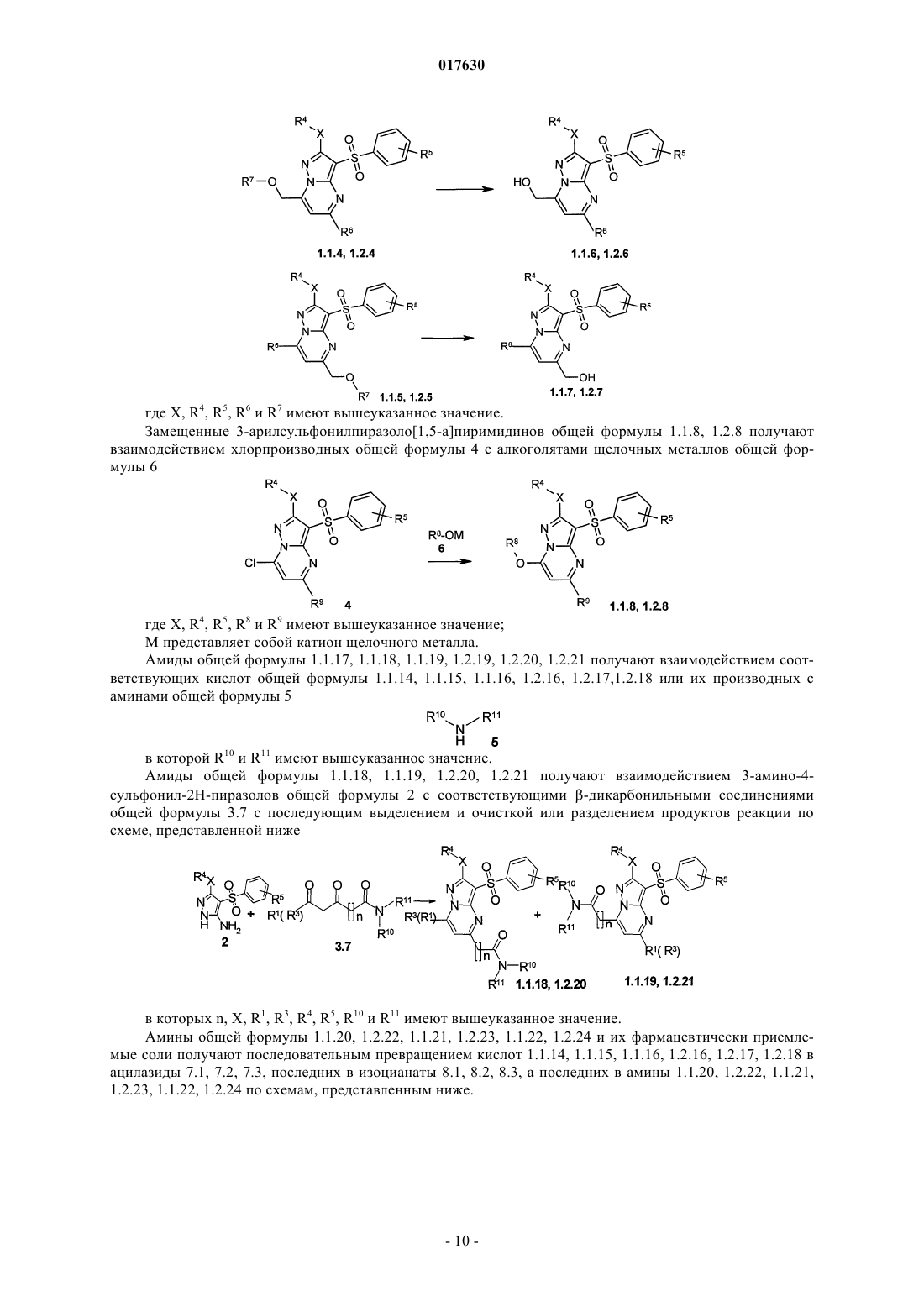
11. Способ получения аминов общей формулы 1.1.20, 1.2.22, в которых одновременно n=0, a R10=R11=H, и их фармацевтически приемлемых солей гидрированием в органическом растворителе 6-(арилдиазенил)-3-(арилсульфонил)пиразоло[1,5-а]пиримидинов общей формулы 1, где R2 = арилдиазенил, или щелочным гидролизом N-(3-фенилсульфонил)пиразоло[1,5-а]пиримидин-6-ил)ацетамидов общей формулы 1, где R2 = ациламиногруппа.
12. Применение замещенных 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 по любому из пп.1-7 в качестве антагонистов серотониновых 5-HT6-рецепторов.
13. Фармацевтическая композиция для лечения и предупреждения развития различных состояний и заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами, у людей и теплокровных животных, содержащая фармацевтически эффективное количество замещенного 3-арилсульфонилпиразоло[1,5-а]пиримидина общей формулы 1 или его фармацевтически приемлемую соль, по любому из пп.1-7.
14. Лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для лечения и предупреждения развития различных состояний и заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами, у людей и теплокровных животных, включающее фармацевтическую композицию по п.13 в эффективном количестве.
15. Способ профилактики и лечения различных заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами, у животных и людей введением лекарственного средства по п.14 в эффективном количестве.
16. Способ по п.15, где заболеваниями являются неврологические расстройства, нейродегенеративные заболевания, когнитивные заболевания, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гантингтона, психические расстройства и шизофрения, гипоксия-ишемия, гипогликемия, судорожные состояния, мозговые травмы, латиризм, боковой амиотрофический склероз, ожирение и инсульт.
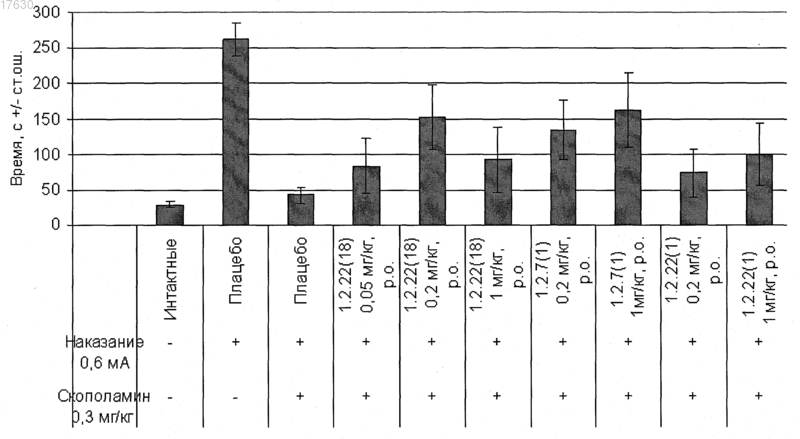
Текст
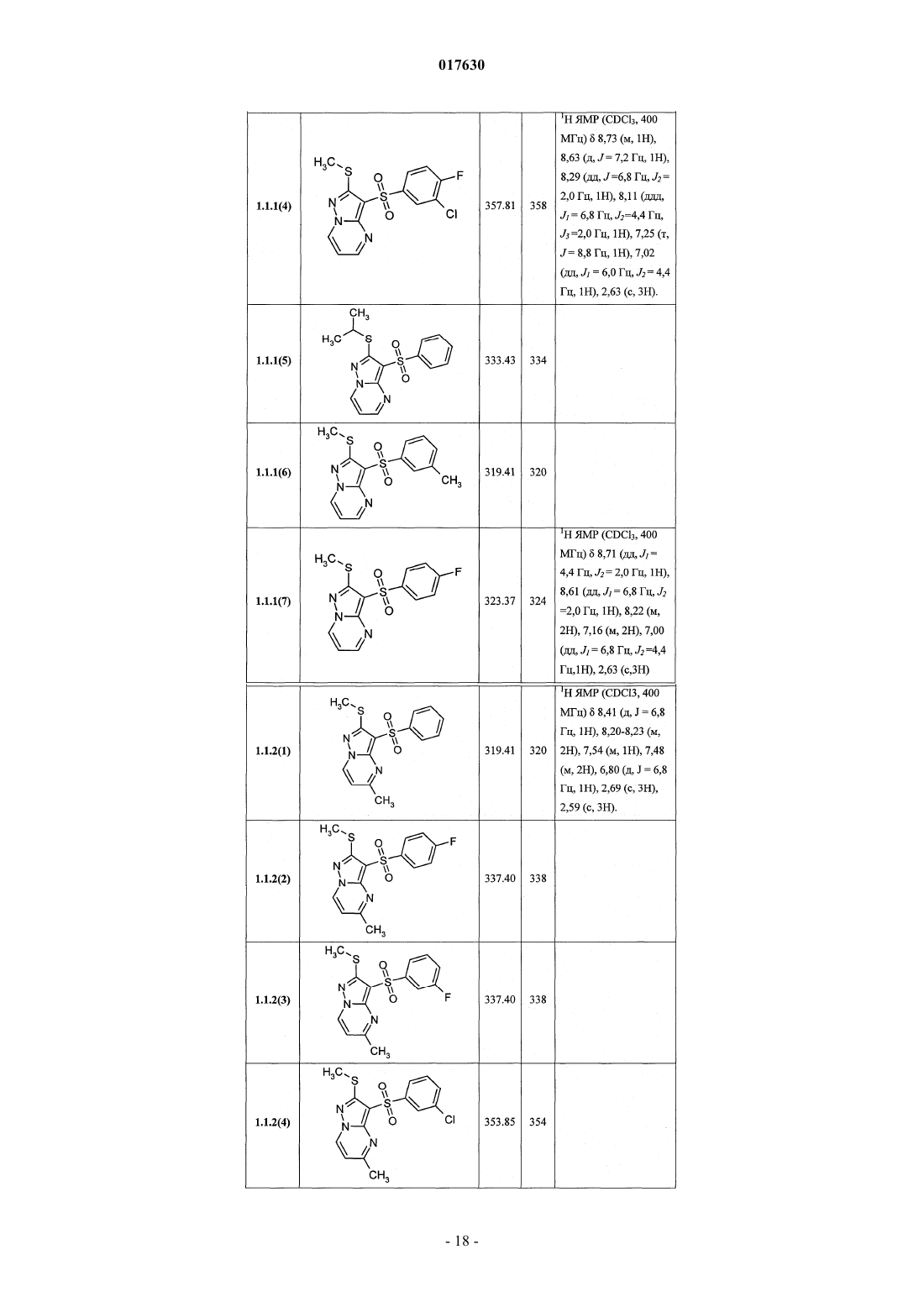
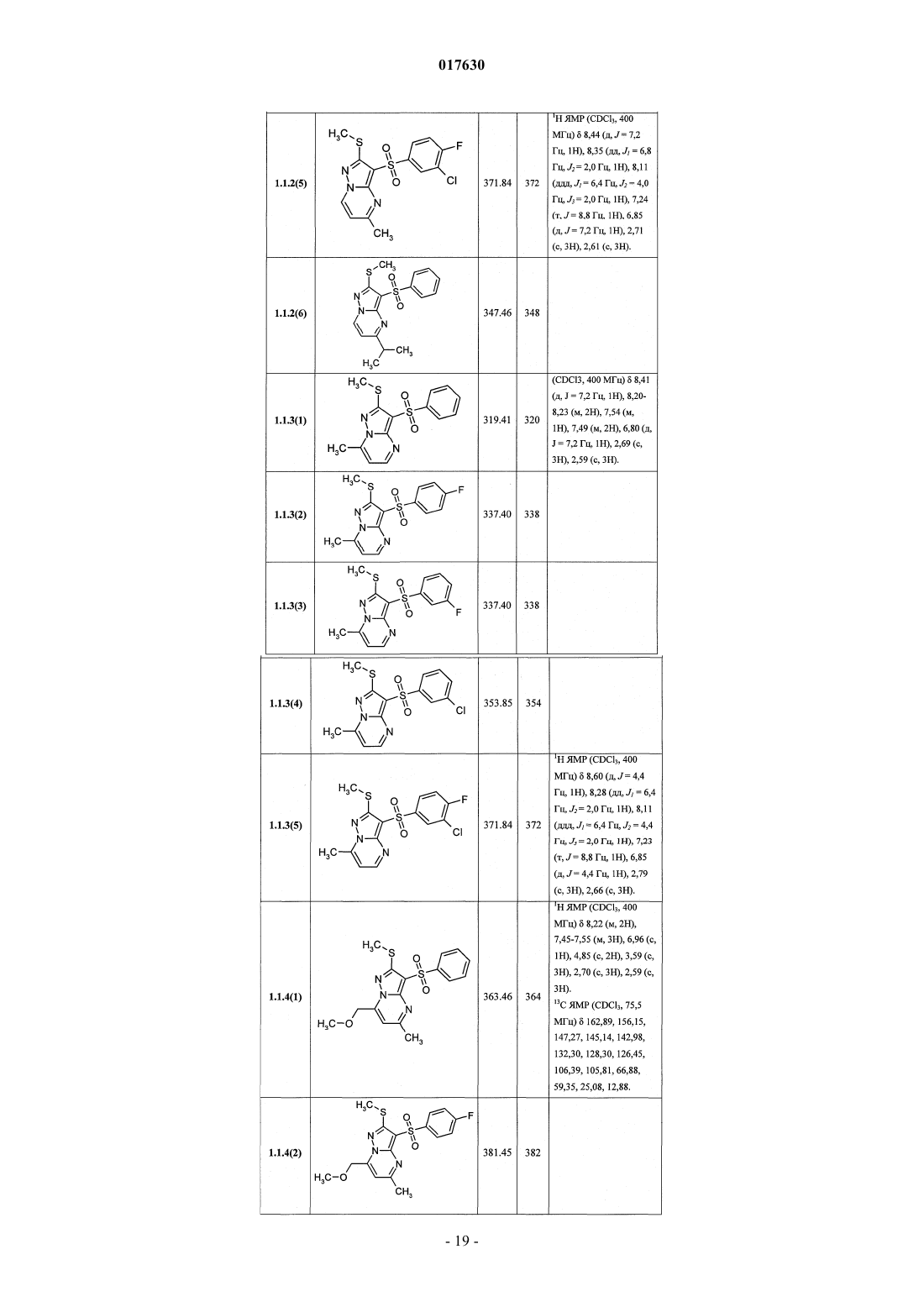
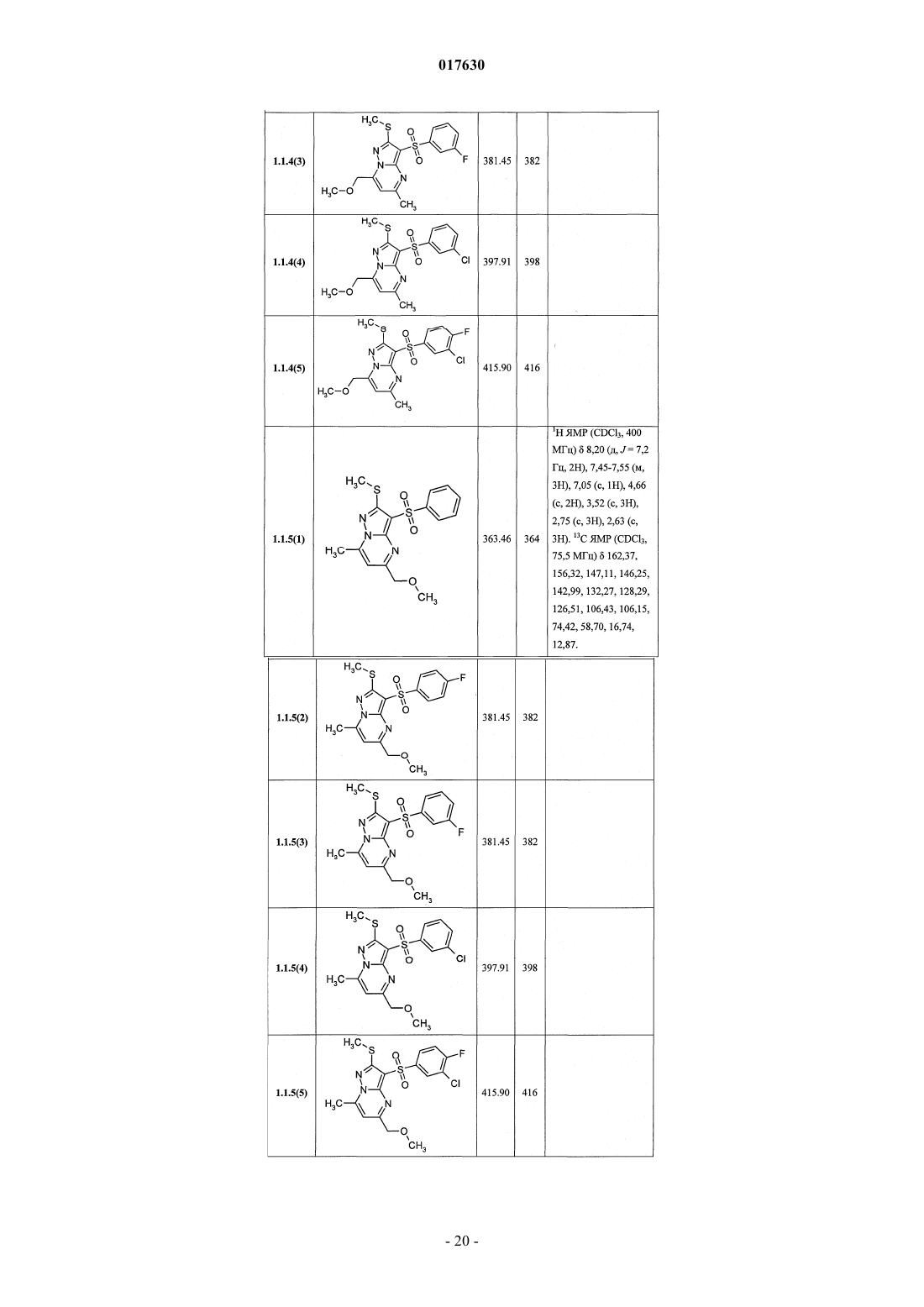
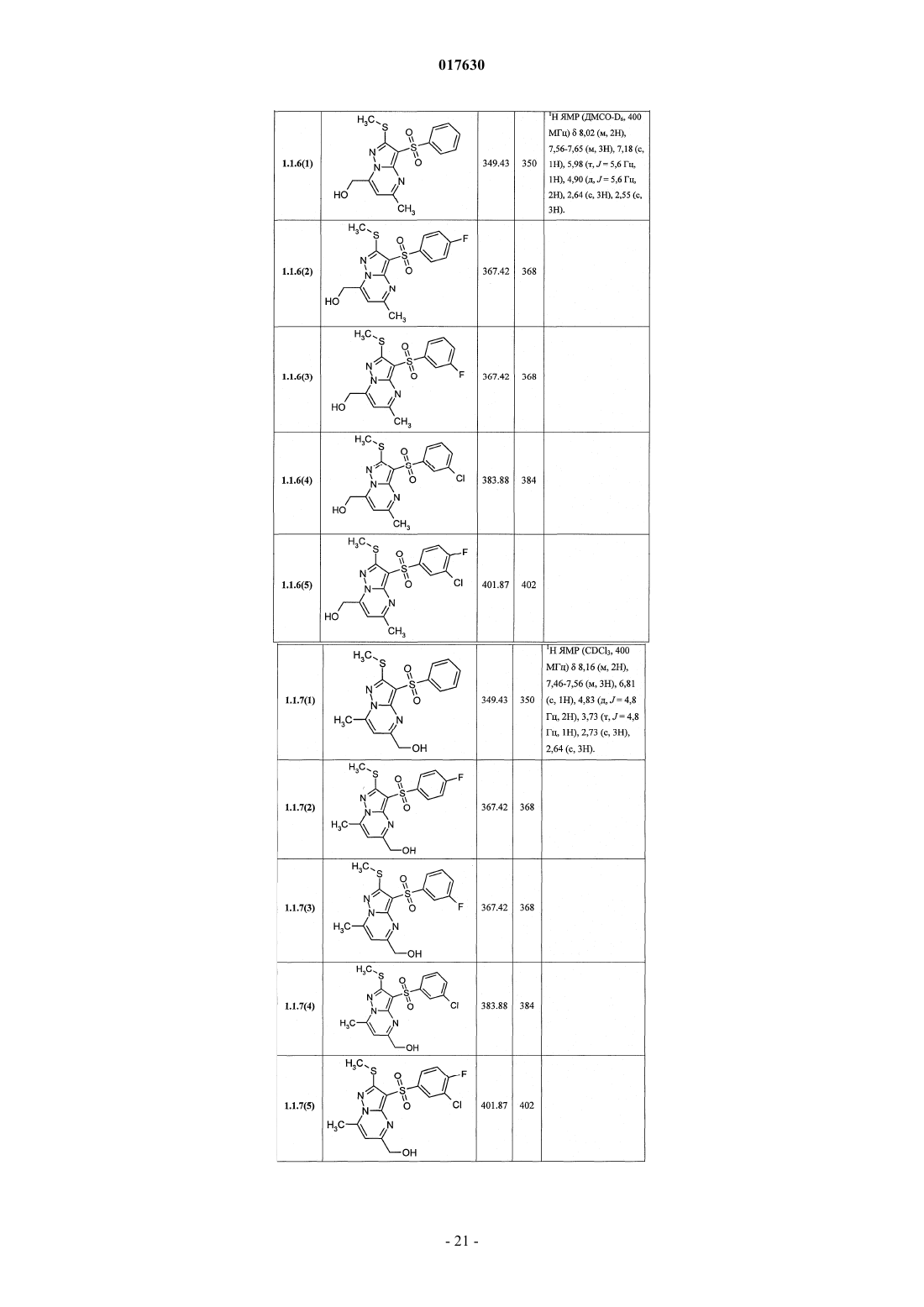
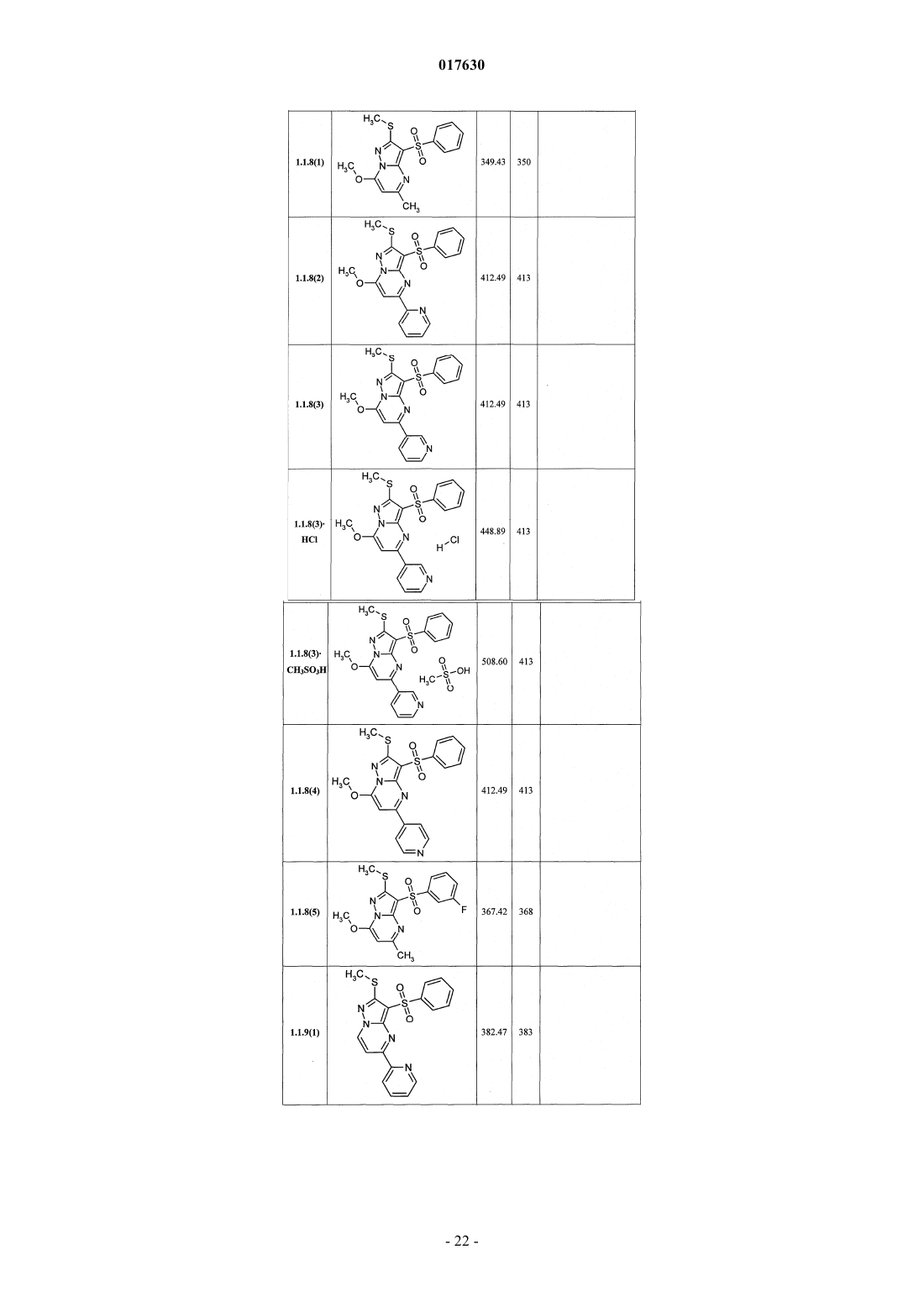
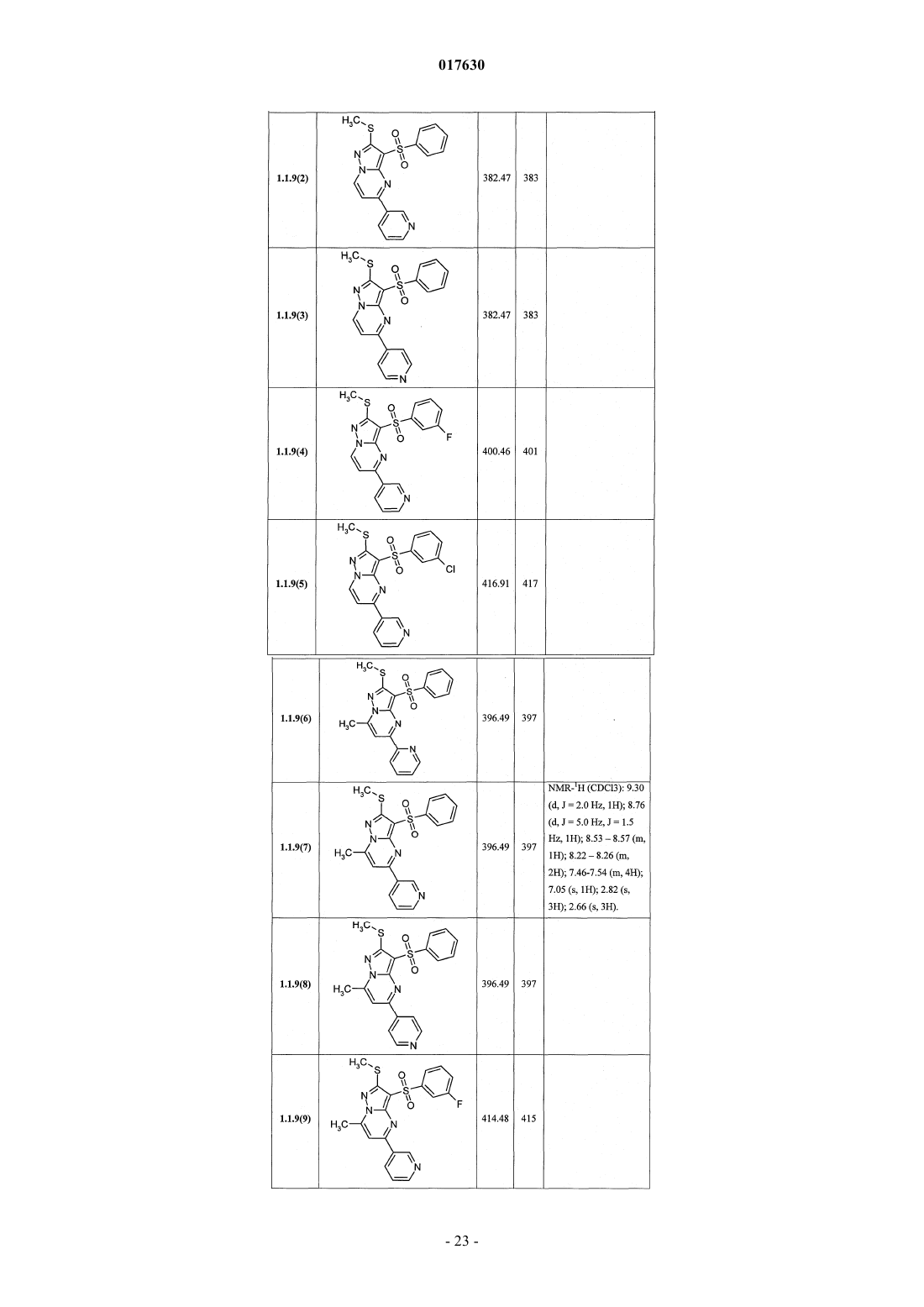
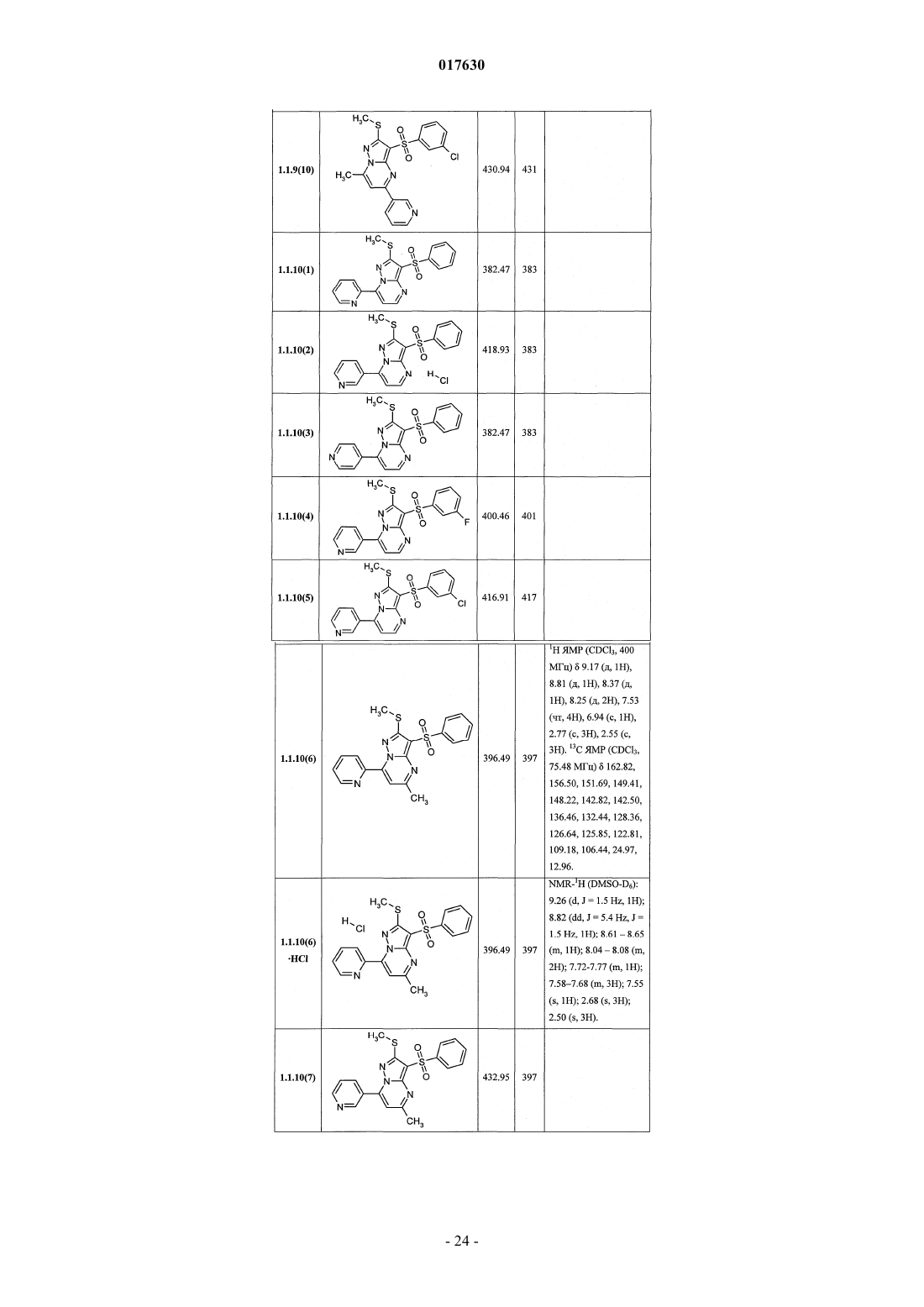
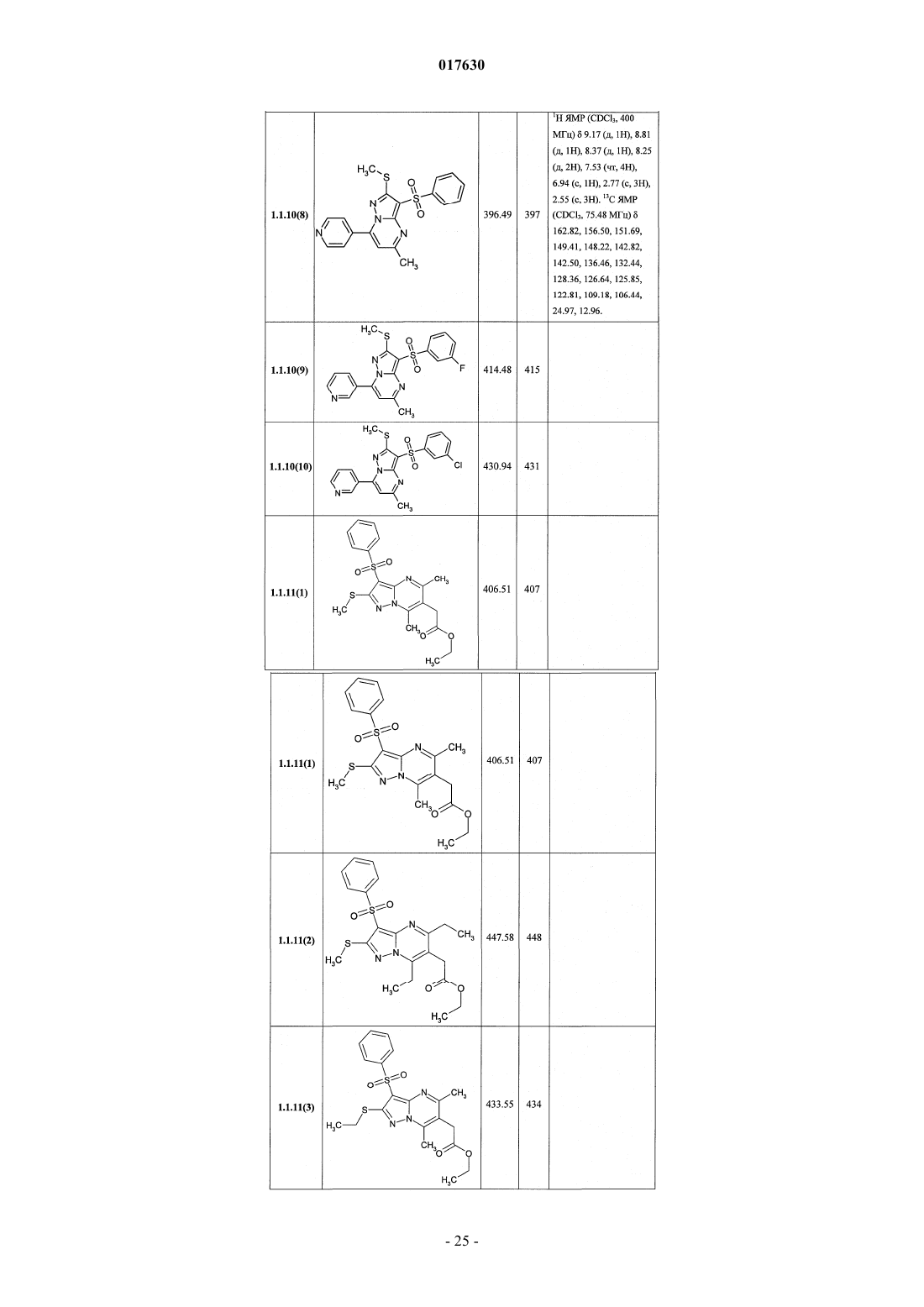
ЗАМЕЩЕННЫЕ 3-АРИЛСУЛЬФОНИЛПИРАЗОЛО[1,5-a]ПИРИМИДИНЫ,АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT6-РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ Васильевич, Савчук Николай Филиппович, Лавровский Ян (US),Митькин Олег Дмитриевич, Кадиева Мадина Георгиевна (RU) Изобретение относится к новым замещенным 3-арилсульфонилпиразоло[1,5-а]пиримидинам общей формулы 1, их фармацевтически приемлемым солям, антагонистам серотониновых 5-HT6-рецепторов,фармацевтическим композициям, лекарственным средствам и к способу лечения и предупреждения развития различных заболеваний центральной нервной системы у людей и теплокровных животных, патогенез которых связан с 5-HT6-рецепторами, в частности болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона,шизофрении, других нейродегенеративных заболеваний, когнитивных расстройств и ожирения где X=S, SO или NH; R1 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3 алкилом, C1-C3-алкилтиогруппой, галогеном, фенилом, необязательно замещенным C1-C3-алкилом или галогеном; C3-C6-циклоалкил; адамантил; фенил, необязательно замещенный галогеном, C1-C3-алкилом, C1C3-алкоксигруппой; или 5-6-членный необязательно аннелированный гетероциклил, в котором гетероатом выбран из азота или кислорода, и необязательно замещенный галогеном или C1-C3-алкилом; C1-C3 алкоксикарбонил; карбоксил; амидную группу; R2 представляет собой атом водорода; галоген; C1C3-алкил, необязательно замещенный C1-C3-алкоксикарбонилом, карбоксигруппой, амидной группой,Zhurnal Organichnoi ta Farr atsevtichnoi K hit ii, 2006,4(3), 62-68, соединения с рег.861209-12-3P,95822897-2P, [онлайн]. Найдено из БД ACS on(71)(73) Заявитель и патентовладелец: ИВАЩЕНКО АНДРЕЙ АЛЕКСАНДРОВИЧ (RU) аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкокси,C3-C6-циклоалкилом, пиперидинилом, возможно замещенным C1-C3-алкилом, бензилом, необязательно замещенным галогеном, C1-C3-алкилом; феноксигруппу; пиридилоксигруппу; фенилдиазенил, необязательно замещенный галогеном или C1-C3-алкилом; аминогруппу, необязательно моно- или дизамещеннуюC1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкокси, C3-C6-циклоалкилом, пиперидинилом, возможно замещенным C1-C3-алкилом, бензилом, который необязательно замещен галогеном, C1-C3-алкилом, C1C3-алкоксигруппой; R3 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, необязательно моно- или дизамещенной C1-C3 алкилом, C1-C3-алкилтиогруппой, галогеном, фенилом, который возможно замещен C1-C3-алкилом или галогеном; C1-C3-алкокси; C1-C3-алкоксикарбонил; пиридил, карбоксил или амидную группу; R4 представляет собой C1-C3-алкил; R5 представляет собой водород, один или два атома галогена, C1-C3-алкил, гидроксигруппу,C1-C3-алкокси, феноксигруппу, необязательно замещенную галогеном или C1-C3-алкилом; или при X=NHR1, R2, R4, R5 имеют вышеуказанные значения; R3 представляет собой атом водорода, C1-C3-алкил,необязательно замещенный гидроксигруппой, C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилтиогруппой, галогеном, фенилом, необязательно замещеннымC1-C3-алкилом или галогеном; C1-C3-алкокси; C1-C3-алкоксикарбонил; аминогруппу, необязательно моноили дизамещенную C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкилтиогруппой, галогеном, фенилом,который возможно замещен C1-C3-алкилом или галогеном; или насыщенный 6-членный азагетероциклил,содержащий дополнительный гетероатом, выбранный из кислорода или азота, необязательно замещенный галогеном или C1-C3-алкилом; пиридил; C1-C3-алкоксикарбонил, карбоксил или амидную группу. 017630 Область техники Данное изобретение относится к новым замещенным 3-арилсульфонилпиразоло[1,5 а]пиримидинам, антагонистам серотониновых 5-HT6-рецепторов, лекарственным субстанциям и фармацевтическим композициям, содержащим лекарственные субстанции в виде указанных соединений, а также к способу лечения и предупреждения развития различных заболеваний центральной нервной системы (ЦНС), когнитивных и нейродегенеративных заболеваний. В основе фармакологического эффекта новых лекарственных субстанций лежит их способность взаимодействовать с серотониновыми 5-HT6 рецепторами, играющими важную роль для лечения заболеваний ЦНС, в частности болезни Альцгеймера(БА), болезни Паркинсона, болезни Гантингтона, шизофрении, других нейродегенеративных заболеваний, когнитивных расстройств и ожирения. Предшествующий уровень техники Использование эффективных и селективных антагонистов серотониновых 5-HT6-рецепторов для лечения заболеваний ЦНС, в частности шизофрении, БА и других нейродегенеративных заболеваний и когнитивных расстройств, является перспективным направлением, также как и для получения новых лекарств [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategiesto 5-HT6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Эти рецепторы у млекопитающих находятся исключительно в центральной нервной системе(ЦНС), причем главным образом в участках головного мозга, ответственных за обучение и памятьBrain Research. 1997; 746:207-219]. Кроме того показано [Dawson L.A., Nguyen H.Q., Li P. The 5-HT(6)hippocampus. Neuropsychopharmacology. 2001; 25:662-668], что 5-HT6-рецепторы являются модуляторами нескольких нейромедиаторных систем, включая холинергическую, норадренергическую, глутаматергическую и допаминергическую. Учитывая фундаментальную роль этих систем в нормальных когнитивных процессах, а также их дисфункцию при нейродегенерации, становится очевидной исключительная роль 5-HT6-рецепторов в формировании нормальной или "патологической" памяти. В большом числе современных работ показано, что блокирование 5-HT6-рецепторов приводит к значительному усилению консолидации памяти в различныхживотных моделях обучения-запоминания-воспроизведенияto NMDA receptor antagonism. Neuropharmacology. 2004; 47:195-204]. Также показано значительное улучшение когнитивных функций у старых крыс в модели водного лабиринта Моррисона при воздействии антагонистом 5-HT6-рецепторов [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N.,Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disruptedconsolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100]. В последнее время достигнуто не только более глубокое понимание роли 5-HT6 рецепторов в когнитивных процессах, но более четкое формирование представлений о возможных фармакофорных свойствах их антагонистов [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X.,Buschmann H. Medicinal chemistry strategies to 5-HT6 receptor ligands as potential cognitive enhancers andantiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Это привело к созданию высокоаффинных селективных лигандов ("молекулярных инструментов"), а затем и клинических кандидатов. В настоящее время ряд антагонистов 5-HT6-рецепторов находятся на разных стадиях клинических испытаний в качестве лекарственных кандидатов для лечения БА, болезни Гантингтона, шизофрении (антипсихотики) и других нейродегенеративных и когнитивных заболеваний (табл. 1) [http://integrity.prous.com]. Еще одним привлекательным свойством антагонистов 5-HT6-рецепторов является их способность подавлять аппетит, что может привести к созданию на их основе принципиально новых средств для понижения избыточного веса и ожирения [Vicker S.P., Dourish C.T. Serotonin receptor ligands and thetreatment of obesity. Curr. Opin. Investig. Drugs. 2004; 5:377-388]. Этот эффект подтвержден во многих исследованиях [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistrystrategies to 5-HT6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299. Davies S.L. Drug discovery targets: 5-HT6 receptor. Drug Future. 2005; 30:479-495], его механизм основан на подавлении антагонистами 5-HT6-рецепторов сигналинга гамма-аминомасляной кислоты и увеличении выброса альфа-меланоцит-стимулирующего гормона, что в конечном итоге приводит к уменьшению потребности в пище [Woolley M.L. 5-ht 6 receptors. Curr. Drug Targets CMS Neurol.Disord. 2004; 3:59-79]. В настоящее время два антагониста 5-HT6-рецепторов находятся на первой стадии клинических испытаний как лекарственные кандидаты для лечения избыточного веса (табл. 1)[http://integrity.prous.com]. В этой связи поиск селективных и эффективных антагонистов серотониновых 5-HT6-рецепторов представляется оригинальным и перспективным подходом к созданию новых лекарственных средств для лечения широкого круга заболеваний ЦНС, в том числе неврологических и нейродегенеративных заболеваний и когнитивных расстройств. В литературе имеется значительное число публикаций, посвященных различным биологически активным сульфонилпроизводным азагетероциклов, в том числе лигандам серотониновых рецепторов. Так,например, известны замещенные 1-(2-аминоэтил)-4-арилсульфонилпиразолы, например, общей формулы А 1, как лиганды серотониновых 5-HT2c-рецепторов [WO 2003057674 А 1] и 7-амино-3 сульфонилпиразоло[1,5-а]пиримидины А 2 как антагонисты серотониновых 5-HT6-рецепторов А 1: Ar = алкил, арил; R1 и R2 = Н, ОН, алкил, алкокси; R3 и R4 = Н, алкил, арил. А 2: Ar = арил, гетероциклил; R1 = Н, алкил, алкилтио; R2 = Н, алкил, галоген; R3 = Н, алкил, гидроксиалкил; R4 и R5 = Н; NR4R5 = пиперазинил. С целью разработки новых высокоэффективных лекарственных препаратов авторами данного изобретения выполнены широкие исследования в ряду замещенных 3-арилсульфонилпиразоло[1,5 а]пиримидинов, в результате чего неожидано найдены новые замещенные 3-арилсульфонилпиразоло[1,5 а]пиримидины и лекарственные субстанции, представляющие собой селективные антагонисты 5-HT6 рецепторов. Раскрытие изобретения Ниже приведены определения терминов, которые использованы в описании этого изобретения."Агонисты" означают лиганды, которые, связываясь с рецепторами данного типа, активно способствуют передаче этими рецепторами свойственного им специфического сигнала и тем самым вызывают биологический ответ клетки."Алкил" означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько "низших алкильных" заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей ("алкильных заместителей"), включая галоген, алкенилокси, циклоалкил, арил, гетероарил,гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси,аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-,RkaRk+1aNC(=O)-, RkaRk+1aNC(=S)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой "заместители аминогруппы", значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, этил, пропил, циклопропилметил, циклопентилметил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 3-пентил,метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил,пиридилметилоксикарбонилметил. Предпочтительными "алкильными заместителями" являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил."Алкилокси" означает CnH2n+1O-группу, в которой алкил определен в данном разделе. Предпочтительными алкилоксигруппами являются метокси, этокси, н-пропокси, изопропокси и н-бутокси."Алкилоксиалкил" означает CnH2n+1OCmH2m-группу, в которой алкил определен в данном разделе."Антагонисты" означают лиганды, которые связываются с рецепторами определенного типа и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами и тем самым блокируют передачу специфического рецепторного сигнала."Арил" означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более "заместителей циклической системы", которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом."Арилсульфонил" означает арил-SO2-группу, в которой значение арил определено в данном разделе."Гидроксиалкил" означает HOCmH2m-группу, в которой алкил определен в данном разделе."Заместитель" означает химический радикал, который присоединяется к скэффолду (фрагменту),например "заместитель алкильный", "заместитель аминогруппы", "заместитель гидроксильный", "заместитель карбамоильный", "заместитель циклической системы", значения которых определены в данном"Лекарственное начало" (лекарственная субстанция, лекарственное вещество, drag-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства)."Лекарственное средство (препарат)" - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего."Лиганды" (от лат. ligo - связывать) представляют собой химические вещества (малая молекула, неорганический ион, пептид, белок и прочее), способные взаимодействовать с рецепторами, которые трансформируют это взаимодействие в специфический сигнал."Низший алкил" означает линейный или разветвленный алкил с 1-4 атомами углерода."Сульфанильная группа" означает R-S-группу, в которой R представляет собой алкил, циклоалкил,арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе."Сульфинильная группа" означает R-SO-группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе."Сульфонильная группа" означает R-SO2-группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе."Фармацевтическая композиция" обозначает композицию, включающую в себя соединение формулы I и по крайней мере один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей,вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты,загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза,метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального,внутримышечного, внутривенного, подкожного, местного или ректального введения может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные,трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, преду-4 017630 сматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем."Фармацевтически приемлемая соль" означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты,нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты,пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные. (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts". J. Pharm. Sci. 1977, 66: 1-19.). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин,диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин,трис-(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как, холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин. Предметом настоящего изобретения являются новые замещенные 3-арилсульфонилпиразоло[1,5 а]пиримидины общей формулы 1 и их фармацевтически приемлемые соли и/или гидратыR1 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой,C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом,C1-C3-алкилтиогруппой, галогеном, фенилом, необязательно замещенным C1-C3-алкилом или галогеном;C3-C6-циклоалкил; адамантил; фенил, необязательно замещенный галогеном, C1-C3-алкилом,C1-C3-алкоксигруппой; или 5-6-членный необязательно аннелированный гетероциклил, в котором гетероатом выбран из азота или кислорода, необязательно замещенный галогеном или C1-C3-алкилом;R2 представляет собой атом водорода; галоген; C1-C3-алкил, необязательно замещенныйC1-C3-алкоксикарбонилом, карбоксигруппой, амидной группой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкокси, C3-C6-циклоалкилом, пиперидинилом, возможно замещенным C1-C3-алкилом, бензилом, необязательно замещенным галогеном,C1-C3-алкилом; феноксигруппу; пиридилоксигруппу; фенилдиазенил, необязательно замещенный галогеном или C1-C3-алкилом; аминогруппу, необязательно моно- или дизамещенную C1-C3-алкилом,C1-C3-алкилкарбонилом, C1-C3-алкокси, C3-C6-циклоалкилом, пиперидинилом, возможно замещеннымR3 представляет собой атом водорода; C1-C3-алкил, необязательно замещенный гидроксигруппой,C1-C3-алкоксигруппой, аминогруппой, необязательно моно- или дизамещенной C1-C3-алкилом,C1-C3-алкилтиогруппой, галогеном, фенилом, который возможно замещен C1-C3-алкилом или галогеном;C1-C3-алкокси; C1-C3-алкоксикарбонил; пиридил, карбоксил или амидную группу;R5 представляет собой водород, один или два атома галогена, C1-C3-алкил, гидроксигруппу,C1-C3-алкокси, феноксигруппу, необязательно замещенную галогеном или C1-C3-алкилом; или при X=NHR3 представляет собой атом водорода, C1-C3-алкил, необязательно замещенный гидроксигруппой,C1-C3-алкоксигруппой, аминогруппой, возможно моно- или дизамещенной C1-C3-алкилом,C1-C3-алкилтиогруппой, галогеном, фенилом, необязательно замещенным C1-C3-алкилом или галогеном;C1-C3-алкилом, C1-C3-алкилкарбонилом, C1-C3-алкилтиогруппой, галогеном, фенилом, который возможно замещен C1-C3-алкилом или галогеном; или насыщенный 6-членный азагетероциклил, содержащий дополнительный гетероатом, выбранный из кислорода или азота, необязательно замещенный галогеном или C1-C3-алкилом; пиридил; C1-C3-алкоксикарбонил, карбоксил или амидную группу. Предпочтительными замещенными 3-арилсульфонилпиразоло[1,5-а]пиримидинами общей формулы 1 являются соединения общей формулы 1.1, 1.2 и их фармацевтически приемлемые соли и/или гидраты где R1, R2, R3, R4 и R5 имеют вышеуказанное значение. Более предпочтительными замещенными 3-арилсульфонилпиразоло[1,5-а]пиримидинами являются соединения общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9 и 1.1.10, 1.2.1, 1.2.2,1.2.3, 1.2.4, 1.2.5, 1.2.6, 1.2.7, 1.2.8, 1.2.9 и 1.2.10 и их фармацевтически приемлемые солиR6 и R7 независимо друг от друга представляют собой водород или C1-C3-алкил;X=S для соединений общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10;X=NH для соединений общей формулы 1.2.1, 1.2.2, 1.2.3, 1.2.4, 1.2.5, 1.2.6, 1.2.7, 1.2.8, 1.2.9, 1.2.10. Более предпочтительными являются следующие соединения: 7-(гидроксиметил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.6(1),7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.6(2),7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.6(3),7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.6(4),7-(гидроксиметил)-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.6(5),5-(гидроксиметил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.7(1),5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.7(2),5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.7(3),5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.7(4),5-(гидроксиметил)-7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.7(5),-6 017630 7-(гидроксиметил)-5-метил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.6(1),7-(гидроксиметил)-5-метил-2-метиламино-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.6(2),7-(гидроксиметил)-5-метил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.6(3),7-(гидроксиметил)-5-метил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.6(4),7-(гидроксиметил)-5-метил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.6(5),5-(гидроксиметил)-7-метил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.7(1),5-(гидроксиметил)-7-метил-2-метиламино-3-(4-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.7(2),5-(гидроксиметил)-7-метил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.7(3),5-(гидроксиметил)-7-метил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.7(4) и 5-(гидроксиметил)-7-метил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.7(5),и их фармацевтически приемлемые соли. Предпочтительными замещенными являются 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.11, 1.1.12, 1.1.13, 1.1.14, 1.1.15, 1.1.16, 1.1.17, 1.1.18, 1.1.19, 1.2.13, 1.2.14, 1.2.15, 1.2.16,1.2.17, 1.2.18, 1.2.19, 1.2.20 и 1.2.21 и их фармацевтически приемлемые солиX=S для соединений общей формулы 1.1.11, 1.1.12, 1.1.13, 1.1.14, 1.1.15, 1.1.16, 1.1.17, 1.1.18, 1.1.19;X=NH для соединений общей формулы 1.2.13, 1.2.14, 1.2.15, 1.2.16, 1.2.17, 1.2.18, 1.2.19, 1.2.20,1.2.21;Y = C1-C3-алкилоксикарбонил для соединений общей формулы 1.1.11, 1.1.12, 1.1.13, 1.2.13, 1.2.14,1.2.15;Y = карбоксил для соединений общей формулы 1.1.14, 1.1.15, 1.1.16, 1.2.16, 1.2.17, 1.2.18;Y = замещенная амидная группа CONR10R11, в которой R10 и R11 представляют собой атом водорода, линейный или разветвленный C1-C5-алкил, необязательно замещенной аминогруппой, возможно моно- или дизамещенный C1-C3-алкилом, или R10 и R11 вместе с атомом азота, с которым они связаны, образуют 5-6-членный азагетероциклил, необязательно замещенный C1-C3-алкилом, галогеном, для соединений общей формулы 1.1.17, 1.1.18, 1.1.19, 1.2.19, 1.2.20, 1.2.21. Предпочтительными замещенными являются 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.20, 1.1.21, 1.1.22, 1.2.22, 1.2.23, 1.2.24 и их фармацевтически приемлемые соли где n=1, 2, когда X=S для соединений общей формулы 1.1.22;n=0, 1, 2, когда X=S для соединений общей формулы 1.1.20, 1.1.21;n=0, 1, 2, 3, когда X=NH для соединений общей формулы 1.2.22, 1.2.23, 1.2.24;-7 017630 Более предпочтительными являются следующие соединения: 6-амино-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.20(1),6-(аминометил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.20 (2),6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.20(3),6-(3-аминопропил)-5,7-диметил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.20(4),6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(5),6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.20(6),6-(аминометил)-5,7-диметил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(7),6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(8),6-(2-аминоэтил)-5,7-диметил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(9),5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5 а]пиримидин формулы 1.1.20(10),5,7-диметил-6-диметиламинометил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(11),5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин формулы 1.1.20(12),5,7-диметил-6-(диметиламинометил)-2-метилсульфанил-3-(4-фтор-3 хлорфенилсульфонил)пиразоло[1,5-а]пиримидин формулы 1.1.20(13),5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5 а]пиримидин 1.1.20(14),5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.20(15),5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.1.20(16),5,7-диметил-6-(2-диметиламино)этил-2-метилсульфанил-3-(4-фтор-3 хлорфенилсульфонил)пиразоло[1,5-а]пиримидин формулы 1.1.20(17),5-(аминометил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.21(1),5-(2-аминоэтил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.21(2),5-(диметиламинометил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.21(3),5-(диметиламинометил)-7-метил-2-метилсульфанил-3-(4-фтор-3 хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.1.21(4),5-(2-диметиламиноэтил)-7-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.21(5),7-(аминометил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.22(1),7-(2-аминоэтил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.22(2),7-(диметиламинометил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.22(3),7-(диметиламинометил)-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.1.22(4),7-(2-диметиламиноэтил)-5-метил-2-метилсульфанил-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.1.22(5),6-амино-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(1),6-(аминометил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(2),6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(3),6-(3-аминопропил)-5,7-диметил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(4),6-(аминометил)-5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.22(5),6-(аминометил)-5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.22(6),6-(аминометил)-5,7-диметил-2-метиламино-3-(4-фтор-3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.22(7),6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5-а]пиримидин-8 017630 1.2.22(8),6-(2-аминоэтил)-5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.22(9),5,7-диметил-6-(диметиламинометил)-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(10),5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.22(11),5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.22(12),5,7-диметил-6-(диметиламинометил)-2-метиламино-3-(4-фтор-3 хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.22(13),5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-фенилсульфонилпиразоло[1,5-а]пиримидин 1.2.22(14),5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-(3-хлорфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.22(15),5,7-диметил-6-(2-диметиламино)этил-2-метиламино-3-(3-фторфенилсульфонил)пиразоло[1,5 а]пиримидин 1.2.22(16),5,7-диметил-6-(2-диметиламиноэтил)-2-метиламино-3-(4-фтор-3 хлорфенилсульфонил)пиразоло[1,5-а]пиримидин 1.2.22(17) и их фармацевтически приемлемые соли. Предметом настоящего изобретения является способ получения замещенных 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 и их фармацевтически приемлемых солей взаимодействием 3-амино-4-сульфонил-2 Н-пиразолов общей формулы 2 с соответствующими-дикарбонильными соединениями или их производными общей формулы 3 с последующим выделением или разделением продуктов реакции (А, В) по схеме, представленной ниже, где в качестве производных могут быть использованы ацетали или диацеталиR14 и R15, R16 и R17 независимо друг от друга вместе с атомами углерода, с которыми они связаны,образуют карбонильную группу или R14 и R15 и R16 и R17 вместе с атомами углерода, с которыми они связаны, независимо друг от друга образуют ацетальную группу. Предметом настоящего изобретения является способ получения замещенных 2-сульфинил-3 арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1, в которых X=SO, окислением 2 сульфанил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1, в которых X=S, по схеме,представленной ниже где R1, R2, R3, R4 и R5 имеют вышеуказанное значение. Предметом настоящего изобретения является также способ получения замещенных 7-гидроксиметил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.6, 1.2.6 и 5-гидроксиметил-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.7, 1.2.7 действием трехбромистого бора на 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.4, 1.2.4 или на 3-арилсульфонилпиразоло[1,5-а]пиримидины общей формулы 1.1.5, 1.2.5 соответственно по схемам,представленным ниже где X, R4, R5, R6 и R7 имеют вышеуказанное значение. Замещенные 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.8, 1.2.8 получают взаимодействием хлорпроизводных общей формулы 4 с алкоголятами щелочных металлов общей формулы 6 где X, R4, R5, R8 и R9 имеют вышеуказанное значение; М представляет собой катион щелочного металла. Амиды общей формулы 1.1.17, 1.1.18, 1.1.19, 1.2.19, 1.2.20, 1.2.21 получают взаимодействием соответствующих кислот общей формулы 1.1.14, 1.1.15, 1.1.16, 1.2.16, 1.2.17,1.2.18 или их производных с аминами общей формулы 5 в которой R10 и R11 имеют вышеуказанное значение. Амиды общей формулы 1.1.18, 1.1.19, 1.2.20, 1.2.21 получают взаимодействием 3-амино-4 сульфонил-2 Н-пиразолов общей формулы 2 с соответствующими -дикарбонильными соединениями общей формулы 3.7 с последующим выделением и очисткой или разделением продуктов реакции по схеме, представленной ниже в которых n, X, R1, R3, R4, R5, R10 и R11 имеют вышеуказанное значение. Амины общей формулы 1.1.20, 1.2.22, 1.1.21, 1.2.23, 1.1.22, 1.2.24 и их фармацевтически приемлемые соли получают последовательным превращением кислот 1.1.14, 1.1.15, 1.1.16, 1.2.16, 1.2.17, 1.2.18 в ацилазиды 7.1, 7.2, 7.3, последних в изоцианаты 8.1, 8.2, 8.3, а последних в амины 1.1.20, 1.2.22, 1.1.21,1.2.23, 1.1.22, 1.2.24 по схемам, представленным ниже. где n, X, R1, R3, R4 и R5 имеют вышеуказанное значение. Амины общей формулы 1.1.20, 1.2.22, 1.1.21, 1.2.23, 1.1.22, 1.2.24 и их фармацевтически приемлемые соли получают восстановительным алкилированием аминов 1.1.20, 1.2.22, 1.1.21, 1.2.23, 1.1.22,1.2.24, в которых R10=R11=Н, карбонильными соединениями общей формулы 9 где R12 и R3 представляют собой атом водорода, необязательно замещенный C1-C3-алкил, необязательно замещенный арил или R12 и R13 вместе с атомом углерода, с которым они связаны, образуют необязательно замещенный C5-C7-циклоалкилен или гетероциклен, включающий один гетероатом и 4-6 атомов углерода. Предметом настоящего изобретения является также способ получения аминов общей формулы 1.1.20, 1.2.22, в которых одновременно n=0, a R10=R11=Н, и их фармацевтически приемлемых солей гидрированием в органическом растворителе 6-(арилдиазенил)-3-(арилсульфонил)пиразоло[1,5a]пиримидинов общей формулы 1, в которых R2 = арилдиазенил, или щелочным гидролизомR2 = ациламиногруппа. Предметом настоящего изобретения являются также применение замещенных 3 арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 в качестве антагонистов серотониновых 5-HT6-рецепторов. Предметом данного изобретения является также фармацевтическая композиция для лечения и предупреждения развития различных состояний и заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами, у людей и теплокровных животных, содержащая фармацевтически эффективное количество замещенного 3-арилсульфонилпиразоло[1,5-а]пиримидина общей формулы 1 или его фармацевтически приемлемую соль. Фармацевтическая композиция может включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с субстанцией по настоящему изобретению может включать и другие активные субстанции при условии, что они не вызывают нежелательных эффектов, например аллергических реакций. При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут быть изготовлены в виде традиционных фармацевтических форм, например пероральных форм (таких как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); форм для инъекций (таких как растворы или суспензии для инъекций или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местных форм (таких как мази или растворы). Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты,бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты,солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.- 11017630 Фармацевтическую композицию получают смешиванием с инертным наполнителем и/или растворителем по крайней мере одного 3-арилсульфонилпиразоло[1,5-а]пиримидин общей формулы 1 или его фармацевтически приемлемой соли. Предметом данного изобретения является лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для лечения и предупреждения развития различных состояний и заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами у людей и теплокровных животных, включающее новую фармацевтическую композицию в эффективном количестве. Более предпочтительным является лекарственное средство для профилактики и лечения болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона, психических расстройств, шизофрении, тревожных расстройств, гиперкинетических расстройств, для улучшения умственных способностей, для профилактики и лечения ожирения. Предметом данного изобретения является способ профилактики и лечения различных заболеваний центральной нервной системы, патогенез которых связан с 5-HT6-рецепторами у животных и людей, который заключается во введении нового лекарственного средства в эффективном количестве. Более предпочтительным является способ профилактики и лечения неврологических расстройств,нейродегенеративных заболеваний, когнитивных заболеваний, болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона, психических расстройств и шизофрении, гипоксии-ишемии, гипогликемии,судорожных состояний, мозговых травм, латиризма, бокового амиотрофического склероза, ожирения и инсульта. Клиническая дозировка лекарственного средства,включающего фармацевтическую композицию, содержащую фармацевтически эффективное количество по крайней мере одного 3-арилсульфонилпиразоло[1,5-а]пиримидина общей формулы 1 или его фармацевтически приемлемой соли, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10500 мг, предпочтительно 50300 мг. Поэтому в процессе приготовления фармацевтических композиций необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10500 мг по крайней мере одного 3-арилсульфонилпиразоло[1,5-а]пиримидина общей формулы 1 или его фармацевтически приемлемой соли. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно от 1 до 6 раз). Лучший вариант осуществления изобретения Изобретение поясняется чертежами. Фиг. 1. Латентный период 1-го захода в темный отсек через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,01; р 0,001. Фиг. 2. Продолжительность пребывания в светлом отсеке через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках доза вещества в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,01; р 0,001. Фиг. 3. Число заходов в темный отсек через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,001. Фиг. 4. Латентный период 1-го захода в темный отсек через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,01; р 0,001. Фиг. 5. Продолжительность пребывания в светлом отсеке через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,01; р 0,001. Фиг. 6. Число заходов в темный отсек через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей скополамин: р 0,05; р 0,01; р 0,001.- 12017630 Фиг. 7. Результаты теста на распознавание новых объектов на мышах (среднее значениестандартная ошибка). В скобках приведены значения доз веществ 1.2.7(1), 1.2.22(1) и 1.2.22(18) в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до теста. Отличие от группы,которой вводили только скополамин: р 0,05 в соответствии с критерием 2. Фиг. 8. Латентный период 1-го захода в темный отсек через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,01; р 0,001. Фиг. 9. Продолжительность пребывания в светлом отсеке через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках доза вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,01; р 0,001. Фиг. 10. Число заходов в темный отсек через 24 ч после обучения крыс избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества 1.2.7(1),1.2.22(1) и 1.2.22(18) в мг/кг. Изучавшиеся вещества 1.2.7(1), 1.2.22(1) и 1.2.22(18) вводили внутрь за 60 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,001. Фиг. 11. Латентный период 1-го захода в темный отсек через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,01; р 0,001. Фиг. 12. Продолжительность пребывания в светлом отсеке через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,01; р 0,001. Фиг. 13. Число заходов в темный отсек через 24 ч после обучения мышей избеганию темного отсека в челночной камере (средняя величинастандартная ошибка). Число в скобках - доза вещества 1(1) и 1.1.7(1) в мг/кг. Изучавшиеся вещества 1(1) и 1.1.7(1) вводили внутрибрюшинно за 30 мин до опыта. Отличие от группы, получавшей MK-801: р 0,05; р 0,01; р 0,001. Фиг. 14. Отношение времени, проведенного животными в открытых рукавах, к общему времени пребывания в открытых и закрытых рукавах (среднеестандартная ошибка). В скобках приведены дозы веществ 1.1(11), 1.2.3(1), 1.2.6(1), 1.2.7(1), 1.2.11(1), 1.2.22(1), 1.2.22(18) в мг/кг. Отличие от групп, получавших плацебо: р 0,05; р 0,01; р 0,001. Фиг. 15. Отношение числа входов в открытые рукава к общему числу входов в рукава обоих типов(среднеестандартная ошибка). В скобках приведены дозы веществ 1.1(11), 1.2.3(1), 1.2.6(1), 1.2.7(1),1.2.11(1), 1.2.22(1), 1.2.22(18) в мг/кг. Отличие от групп, получавших плацебо: р 0,05; р 0,01; р 0,001. Фиг. 16. Число дефекаций в тесте "лабиринт-плюс" (среднеестандартная ошибка). В скобках приведены дозы веществ 1.1(11), 1.2.3(1), 1.2.6(1), 1.2.7(1), 1.2.11(1), 1.2.22(1), 1.2.22(18) в мг/кг. Отличие от групп, получавших плацебо: р 0,05; р 0,01; р 0,001. Фиг. 17. Результаты теста препульсного торможения вздрагивания у мышей. Фиг. 18. Неподвижность в последние 5 мин в тесте Порсольта. Фиг. 19. Результаты испытаний соединений 1.2.7(1) и 1.2.22(18) в тесте подвешивания мышей за хвост. Представленные ниже примеры демонстрируют, но не ограничивают, данное изобретение. Пример 1. Общий способ получения замещенных 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 (X=S, NH). Перемешивают 0,005 моль аминопиразола 2 и 0,0055 моль соответствующего дикарбонильного соединения или его производного общей формулы 3 в 5 мл уксусной кислоты или другого подходящего растворителя в течение 4-12 ч. Выпавший осадок фильтруют, промывают метанолом и водой. В случае необходимости продукт подвергают перекристаллизации из подходящего растворителя, или хроматографической очистке, или хроматографическому разделению. В табл. 2 представлены некоторые примеры новых 2-алкилсульфанил-3 арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 (X=S), 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5,1.1.9, 1.1.10, 1.1.11, 1.1.12, 1.1.13, 1.1.17, 1.1.18, 1.1.19 и их солей и данные их LCMS анализов и ЯМР-спектров. В табл. 3 представлены некоторые примеры новых 2-алкиламино-3 арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 (X=NH), 1.2, 1.2.1, 1.2.2, 1.2.3, 1.2.4, 1.2.5,1.2.8, 1.2.9, 1.2.13, 1.2.14, 1.2.15, 1.2.19, 1.2.20, 1.2.21 и их солей и данные их LCMS анализов и ЯМРспектров.- 13017630 Пример 2. Общий способ получения замещенных 2-алкилсульфинил-3-арилсульфонилпиразоло[1,5 а]пиримидинов общей формулы 1 (X=SO). К раствору 1 ммоль 2-алкилсульфанил-3-арилсульфонилпиразоло[1,5-а]пиримидин общей формулы 1 (X=S) в 10 мл уксусной кислоты добавляют 88 мкл (1 ммоль, 35%) перекиси водорода и смесь перемешивают при 80 С в течение 7 ч. Смесь упаривают в вакууме и очищают продукт методом колоночной хроматографии на силикагеле (система хлороформ/этилацетат = 5:1). Выход 75-87%. В табл. 2 представлены некоторые примеры новых 2-алкилсульфинил-3 арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1 (X=SO) и данные их LCMS анализов и ЯМР-спектров. Пример 3. Общий способ получения замещенных 3-арилсульфонил-7-(омегагидроксиалкил)пиразоло[1,5-а]пиримидинов общей формулы 1.1.6, 1.2.6 и замещенных 3 арилсульфонил-5-(омега-гидроксиалкил)пиразоло[1,5-а]пиримидинов общей формулы 1.1.7, 1.2.7. Раствор 0,36 ммоль 7-алкилоксиалкил-3-арилсульфонилпиразоло[1,5-а]пиримидина общей формулы 1.1.4, 1.1.5, 1.2.4, 1.2.5 в 10 мл перегнанного хлористого метилена прикапывают при комнатной температуре к раствору 0,1 мл (0,27 мг) BBr3 (3,0 экв.) в 10 мл перегнанного хлористого метилена. Реакционную массу выдерживают при комнатной температуре в течение 12 ч, после чего при интенсивном перемешивании добавляют 20 мл воды и оставляют перемешиваться в течение 30 мин. Органический слой отделяют, а водный слой экстрагируют два раза эфиром. Органические фазы объединяют, упаривают в вакууме, а остаток хроматографируют. Получают соединения общей формулы 1.1.6, 1.2.6, 1.1.7, 1.2.7,некоторые из них представлены в табл. 2 и 3. Пример 4. Общий способ получения замещенных 3-арилсульфонил-7-алкоксипиразоло[1,5 а]пиримидинов общей формулы 1.1.8, 1.2.8. К раствору 2,5 ммоль алкоголята натрия в 25 мл подходящего растворителя (спирт, диметилформамид и т.п.) добавляют 3-арилсульфонил-7-хлорпиразоло[1,5-а]пиримидин общей формулы 4. Реакционную массу выдерживают в микроволновом реакторе 2 ч при температуре 75 С, охлаждают, выпавший осадок отфильтровывают, промывают метанолом, растворяют в хлористом метилене, пропускают через тонкий слой силикагеля и упаривают досуха. В случае необходимости полученный продукт 1.1.8, 1.2.8 перекристаллизовывают из подходящего растворителя. В табл. 2 и 3 представлены некоторые примеры новых замещенных 3-арилсульфонил-7 гидроксипиразоло[1,5-а]пиримидинов общей формулы 1.1.8, 1.2.8 и данные их LCMS анализов и ЯМРспектров. Пример 5. Общий способ получения 3-арилсульфонилпиразоло[1,5-а]пиримидинкарбоновых кислот общей формулы 1.1.14, 1,1.15, 1.1.16, 1.2.16, 1.2.17 и 1.2.18. К 2,0 ммоль эфира общей формулы 1.1.11, 1.1.12, 1.1.13, 1.2.13, 1.2.14 или 1.2.15 в 50 мл этанола прибавляют раствор 4,0 ммоль (263 мг) 85% KOH в 20 мл воды и перемешивают полученную смесь при комнатной температуре в течение 6-18 ч. Полноту протекания реакции контролируют методом LCMS. Из реакционной массы отгоняют этанол в вакууме, остаток разбавляют водой до объема 200 мл. Полученный раствор подкисляют соляной кислотой до рН 4-5. Образовавшийся белый осадок отфильтровывают,промывают водой и сушат на воздухе. В табл. 2 и 3 представлены некоторые примеры новых 3 арилсульфонилпиразоло[1,5-а]пиримидинкарбоновых кислот общей формулы 1.1.14, 1,1.15, 1.1.16,1.2.16, 1.2.17 и 1.2.18 и данные их LCMS анализов и спектров ЯМР. Пример 6. Общий способ получения амидов 3-арилсульфонилпиразоло[1,5 а]пиримидинкарбоновых кислот общей формулы 1.1.17, 1.1.18, 1.1.19, 1.2.19, 1.2.20 и 1.2.21. К раствору 0,902 ммоль кислоты общей формулы 1.1.14, 1,1.15, 1.1.16, 1.2.16, 1.2.17 или 1.2.18 в 5 мл диметилформамида добавляют 259 мг карбонилдиимидазола (0,992 ммоль). Реакционную массу перемешивают при температуре 75 С в течение 1 ч, добавляют 0,992 ммоль амина общей формулы 5 и выдерживают в течение ночи при температуре 75 С. Полноту протекания реакции контролируют методом LCMS. После завершения реакции реакционную массу выливают в 5% раствор карбоната натрия. Продукт экстрагируют дихлорметаном. Экстракт сушат безводным сульфатом натрия, упаривают в вакууме. Получают амиды общей формулы 1.1.17, 1.1.18, 1.1.19, 1.2.19, 1.2.20 и 1.2.21, которые без дополнительной очистки используют для получения солей. В табл. 2 и 3 представлены некоторые примеры новых амидов 3-арилсульфонилпиразоло[1,5-а]пиримидинкарбоновых кислот общей формулы 1.1.17,1.1.18, 1.1.19, 1.2.19, 1.2.20 и 1.2.21 и данные их LCMS анализов и ЯМР-спектров. Пример 7. Общий способ получения 3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.20, 1.1.21, 1.1.22, 1.2.22, 1.2.23 и 1.2.24 (R10=R11=H). А. К смеси 1,0 ммоль соответствующей кислоты общей формулы 1.1.14, 1,1.15, 1.1.16, 1.2.16, 1.2.17 или 1.2.18 в 10 мл ацетона по каплям добавляют последовательно раствор 139 мкл (101 мг, 1,18 ммоль) триэтиламина в 1 мл ацетона и раствор 109 мкл (123 мг, 1,29 ммоль) этоксикарбонилхлорида в 1 мл ацетона. Полученную смесь перемешивают при 0 С в течение 30 мин, затем добавляют по каплям раствор 109 мг (1,53 ммоль) азида натрия в 0,35 мл воды и перемешивают при 0 С в течение 1 ч. Полученную реакционную массу выливают в 30 мл ледяной воды. Продукт экстрагируют охлажденным до 0 С дихлорметаном, растворитель упаривают в вакууме до объема 2-3 мл при комнатной температуре. Полу- 14017630 ченный раствор ацилазида общей формулы 7.1, 7.2, 7.3 разбавляют диоксаном до объема 5 мл. Этот раствор добавляют по каплям к 20 мл кипящего диоксана и реакционную массу кипятят в течение 1 ч. Полученный раствор изоцианата общей формулы 8.1, 8.2, 8.3 охлаждают до 70 С, добавляют 5 мл 20% водного раствора соляной кислоты, перемешивают при температуре 80 С в течение 3 ч до завершения гидролиза изоцианата (контроль методом LCMS). Амины общей формулы 1.1.20, 1.1.21, 1.1.22, 1.2.22, 1.2.23 или 1.2.24 выпадают в виде гидрохлоридов после охлаждения реакционной массы. Б. К раствору 1 ммоль соответствующего амина общей формулы 1.1.20, 1.2.22, 1.1.21, 1.2.23, 1.1.22,1.2.24, в которых R10 и R11 представляют собой атом водорода, в 10 мл дихлорэтана добавляют 3 ммоль карбонильного соединения общей формулы 9 и 2,5 ммоль триацетоксиборгидрида натрия. Смесь перемешивают 3 ч при комнатной температуре. Контроль реакции осуществляют по LCMS. Для доведения реакции до конца добавляют еще 3 ммоль карбонильного соединения общей формулы 9 и 2,5 ммоль триацетоксиборгидрида натрия и перемешивают 12 ч. Смесь разбавляют водой и экстрагируют дихлорметаном, промывают 10% раствором поташа, сушат сульфатом натрия и упаривают. Продукты общей формулы 1.1.20, 1.1.21, 1.1.22, 1.2.22, 1.2.23 и 1.2.24, в которых R10=Н, R11=CHR12R13, где R12 и R13 представляют собой атом водорода, необязательно замещенный C1-C3-алкил, необязательно замещенный арил илиR12 и R11 вместе с атомом углерода, с которым они связаны, образуют необязательно замещенный C5-C7 циклоалкилен или гетероциклен, включающий один гетероатом и 4-6 атомов углерода, выделяют методом колоночной хроматографии на силикагеле (система гексан:этилацетат:триэтиламин = 30:10:1). Гидрохлорид получают добавлением избытка раствора HCl в диоксане к раствору амина в ацетоне, при необходимости высаживают эфиром. В табл. 2 и 3 представлены некоторые примеры новых 3 арилсульфонилпиразоло[1,5-а]пиримидиналкиламинов 1.2.12(7), 1.2.22(18, 19-21), их солей и данные ихLCMS анализов и спектров ЯМР. Пример 8. Общий способ получения 6-амино-3-арилсульфонилпиразоло[1,5-а]пиримидинов общей формулы 1.1.20 и 1.2.22, в которых n=0, R10=R11=Н. А. Раствор 0,63 ммоль 6-(арилдиазенил)-3-(арилсульфонил)пиразоло[1,5-а]пиримидина общей формулы 1, в которых R2=Ar-N=N-, в 9 мл МеОН и 3 мл бензола гидрируют над 30 мг 10% Pd/C при 1 атм в течение 12 ч. Продукт выделяют методом ВЭЖХ. Пролучают 6-амино-3-арилсульфонилпиразоло[1,5 а]пиримидины общей формулы 1.1.20 и 1.2.22, в которых n=0; R10=R11=Н.B. К суспензии 0,268 моль N-(3-арилсульфонил)пиразоло[1,5-а]пиримидин-6-ил)ацетамида общей формулы 1, в которых R2=Ac-NH-, в 1 л МеОН добавляют раствор 135 г (2.41 моль) KOH в 350 мл воды. Реакционную массу перемешивают при кипячении в течение 72 ч. После окончания реакции (LCMS контроль) образовавшуюся массу тщательно измельчают с помощью роторного диспергатора либо ультразвука, после чего осадок отфильтровывают, промывают водой и сушат в вакууме. Пролучают 6-амино-3 арилсульфонилпиразоло[1,5-а]пиримидин общей формулы 1.1.20 и 1.2.22, в которых n=0, R10=R11=H.C. К суспензии 0,236 ммоль 2-(метилсульфанил)-3-(фенилсульфонил)пиразоло[1,5-a]пиримидин-6 амина общей формулы 1.1.20, в которых n=0; R10=R11=Н, в 3,5 мл диоксана добавяют 0,275 мл 3 М H2SO4 и 2,1 ммоль алкилальдегида. К полученному раствору при перемешивании в течение 2 ч небольшими порциями добавляют 92 мг (2,42 ммоль) NaBH4. Реакционную массу выливают в 100 мл 10% раствораK2CO3, экстрагируют дихлорметаном, сушат Na2SO4 и упаривают на роторном испарителе. Очистку проводят методом флэш-хроматографии. Получают 2-(метилсульфанил)-3-(фенилсульфонил)пиразоло[1,5 а]пиримидин-6-диалкиламины общей формулы 1.1.20, в которых n=0, a R10=R11=C1-C3-алкил.D. К суспензии 0,227 моль N2,5,7-триметил-3-(фенилсульфонил)пиразоло[1,5-а]пиримидин-2,6 диамина общей формулы 1.2.22, в которых n=0, a R10=R11=Н, в 3750 мл этанола добавляют 450 мл 3 МH2SO4. Полученную суспензию нагревают до 90 С и затем охлаждают до комнатной температуры. К полученной смеси приливают 2,5 моль альдегида. Через 30 мин при интенсивном перемешивании небольшими порциями прибавляют 56 г (1,47 моль) NaBH4 с такой скоростью, чтобы температура реакционной смеси не превышала 25 С (при необходимости охлаждают водяной баней). По окончании реакцииR10=R11=C1-C3-алкил. В табл. 2 и 3 представлены некоторые примеры 6-амино-3-арилсульфонилпиразоло[1,5 а]пиримидинов общей формулы 1.1.20 и 1.2.22, в которых n=0, и данные их LCMS анализов и спектров ЯМР.
МПК / Метки
МПК: A61P 25/08, A61P 9/10, A61K 9/48, A61P 3/08, A61P 25/28, A61K 31/519, A61P 25/16, A61P 25/18, A61K 9/08, C07D 487/04, A61P 3/04, A61P 25/26
Метки: получения, 3-арилсульфонилпиразоло[1,5-a]пиримидины, серотониновых, 5-ht6-рецепторов, применения, способы, антагонисты, замещенные
Код ссылки
<a href="https://eas.patents.su/30-17630-zameshhennye-3-arilsulfonilpirazolo15-apirimidiny-antagonisty-serotoninovyh-5-ht6-receptorov-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 3-арилсульфонилпиразоло[1,5-a]пиримидины, антагонисты серотониновых 5-ht6-рецепторов, способы их получения и применения</a>
Предыдущий патент: Гербицидные соединения
Следующий патент: Кристаллическое основание транс-1-((1r,3s)-3-фенил-6-хлороиндан-1-ил)-3,3-диметилпиперазина
Случайный патент: Замкнутое крыло