Антагонисты аденозиновых рецепторов и способы их получения и использования
Номер патента: 10260
Опубликовано: 30.06.2008
Авторы: Кумаравел Гнанасамбандам, Даулинг Джеймс Е., Энсингер Кэрол, Петтер Расселл С.
Формула / Реферат
1. Соединение и его фармацевтически приемлемые соли формулы
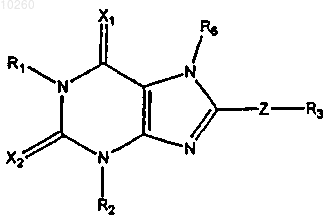
где R1 и R2 независимо выбраны из алкила;
X1 и Х2 представляют собой О;
Z простая связь; и
R6 водород;
R3 представляет бициклическую или трициклическую группу, выбранную из группы, состоящей из
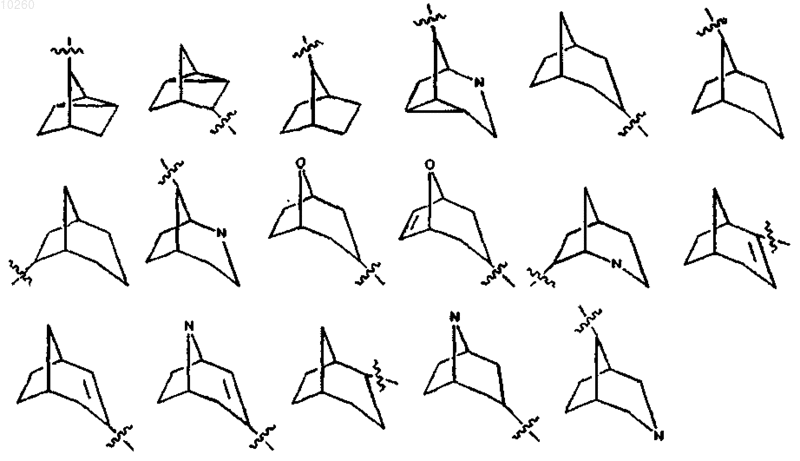
где указанная бициклическая или трициклическая группа является незамещенной либо замещена одним или несколькими заместителями, выбранными из группы, состоящей из
(а) алкила и алкенила; и где указанные алкил и алкенил являются либо незамещенными, либо замещены одним или несколькими заместителями, выбранными из группы, состоящей из алкокси, алкоксикарбониламиноалкиламино, фенилалкоксикарбонила, нафтилалкоксикарбонила, карбокси, диалкиламино, аминоалкиламино, гетероциклилалкиламино, гидрокси и нитрозамещенного гетероциклиламиноалкиламино;
(b) ациламиноалкиламино, алкениламино, алкоксикарбонила, алкоксикарбонилалкиламино, алкоксикарбониламиноацилокси, алкоксикарбониламиноалкиламино, алкиламино, амино, аминоацилокси, карбокси, карбоксиалкокси, карбоксиалкиламино, диалкиламиноалкиламино, гетероциклила, гетероциклилалкиламино, гидрокси, оксо, фосфата, нитрозамещенного гетероциклиламиноалкиламино и оксозамещенного гетероциклил алкиламино;
где каждая из указанных групп:
алкила может содержать от 1 до 6 атомов углерода в цепи и быть прямой или разветвленной,
алкенила может содержать от 3 до 6 атомов углерода в цепи и быть прямой или разветвленной,
гетероциклила представляет собой 5-9-членную ароматическую или неароматическую карбоциклическую кольцевую систему, в которой один или два атома углерода кольца независимо замещены азотом, кислородом или серой;
либо, когда R1 и R2 каждый означают группу СН3-СН2-СН2-, R3 представляет собой трициклическую группу, выбранную из следующих:
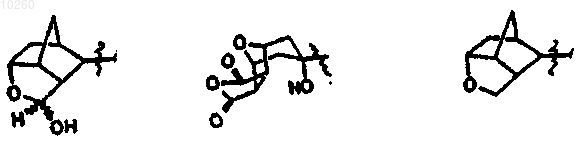
а также соединение или его фармацевтически приемлемую соль формулы
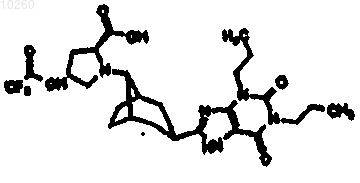
2. Соединение по п.1, где указанное соединение принимает форму, выбранную из группы, состоящей из ахирального соединения, рацемата, оптически активного соединения, чистого диастереомера, смеси диастереомеров или фармацевтически приемлемой аддитивной соли.
3. Соединение по п.1, где каждый из R1 и R2 представляет н-пропил.
4. Соединение по п.1, где R3 выбран из группы, состоящей из

и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, гидроксиалкила, карбокси, карбоксиалкенила, карбоксиалкила, аминоацилокси, карбоксиалкокси, диалкиламиноалкенила и диалкиламиноалкила.
5. Соединение по п.1, где R3 представляет
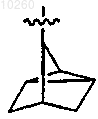
и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, карбоксиалкенила, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила.
6. Соединение по п.5, где R3 замещен заместителями, выбранными из группы, состоящей из гидрокси, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила.
7. Соединение по п.1, которое представляет собой 8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
8. Соединение по п.1, которое представляет собой 8-(5-гидроксиметилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
9. Соединение по п.1, которое представляет собой 8-[5-(3-диметиламинопропилиден)трицикло [2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион.
10. Соединение по п.1, которое представляет собой 8-[5-(3-диметиламинопропил)трицикло [2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион.
11. Соединение по п.1, где R3 выбран из
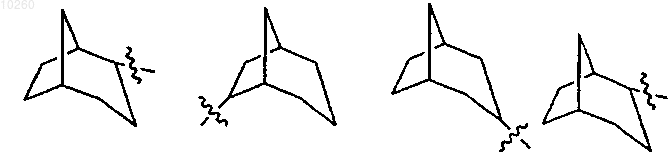
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, алкила, карбокси, карбоксиалкила, диалкиламиноалкиламино, алкоксикарбонилалкиламино, карбоксиалкиламино, гетероциклила, алкениламино, амино, алкиламино, гетероциклилалкиламино, фосфата, гетероциклиламиноалкиламино и гетероциклиламиноалкил аминоалкила.
12. Соединение по п.1, где R3 представляет
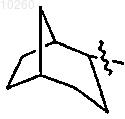
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, карбокси, карбоксиалкила и гидроксиалкила.
13. Соединение по п.1, которое представляет собой 4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1Н-пурин-8-ил)-бицикло[3.2.1]октан-1-карбоновую кислоту.
14. Соединение по п.1, где R3 представляет
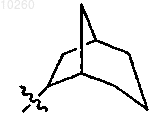
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкила, гидрокси, карбокси, карбоксиалкила.
15. Соединение по п.1, которое представляет собой 8-(4-гидроксибицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
16. Соединение по п.1, которое представляет собой 8-(4-оксобицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
17. Соединение по п.1, где R3 представляет
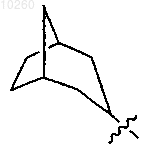
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из карбокси, гидрокси, диалкиламиноалкиламино и замещенного гетероциклиламиноалкиламиноалкила.
18. Соединение по п.1, которое представляет собой 8-[8-(2-диметиламиноэтиламино)бицикло [3.2.1]окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион.
19. Соединение по п.1, которое представляет собой 8-(8-гидроксибицикло[3.2.1]окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион.
20. Соединение по п.1, где R3 представляет
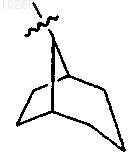
и замещен одним или несколькими карбокси и гидрокси заместителями.
21. Соединение по п.1, которое представляет собой 8-(3-гидроксибицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион.
22. Соединение по п.4, где R3 выбран из группы, состоящей из
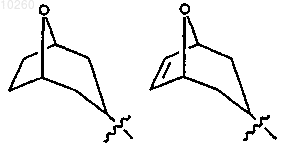
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидроксиалкила, гидрокси и алкоксикарбонила.
23. Соединение по п.1, которое представляет собой 8-(8-оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
24. Соединение по п.1, где R3 представляет
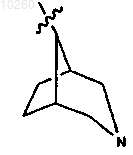
и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкоксикарбонилалкила.
25. Соединение по п.1, которое представляет собой 8-(2-оксо-3-азабицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион.
26. Лекарственная композиция, включающая соединение по п.1 вместе с подходящим наполнителем.
27. Способ лечения индивидуума, страдающего состоянием, характеризующимся повышенной концентрацией аденозина и/или повышенной чувствительностью к аденозину, предусматривающий введение указанному индивидууму эффективного количества соединения по п.1 в качестве антагониста аденозина.
28. Способ по п.27, где указанное состояние выбрано из нарушений работы сердца и кровообращения, дегенеративных расстройств центральной нервной системы, заболеваний дыхательных путей, заболеваний, при которых показано лечение диуретиками, болезни Паркинсона, депрессии, травматического поражения головного мозга, постинсультного неврологического расстройства, угнетеэшя дыхания, травмы головного мозга у новорожденных, дислексии, гиперактивности, кистозного фиброза, циррозных асцитов, апное новорожденных, почечной недостаточности, диабета, астмы и состояний, сопровождающихся отеками.
29. Способ по п.27, где указанное состояние выбрано из застойной сердечной недостаточности или дисфункции почек.
30. Способ получения соединений по п.1, включающий стадии:
a) получения N7,С8-дигидроксантина;
b) введения защиты указанного ксантина в N7-положении;
c) депротонирования С8-положения сильным основанием с получением аниона;
d) связывания (захвата) указанного аниона карбоксильным, карбонильным, альдегидным или кетонным соединением; и
e) снятия защиты в защищенном N7-положении с получением 8-замещенного ксантина.
Текст
010260 Предшествующий уровень техники Настоящее изобретение относится к антагонистам аденозиновых рецепторов и к способам их получения и использования для лечения заболеваний. Аденозин является внутриклеточным и внеклеточным мессенджером, генерируемым всеми клетками в организме. Он продуцируется также внеклеточно путем ферментативного превращения. Аденозин связывается с рецепторами, имеющими 7 трансмембранных доменов, сопряженных с трансмембраннымg-белком, и активирует их, вызывая ряд физиологических ответов. Сам аденозин, а также вещества, которые имитируют действие аденозина (агонисты) и вещества, которые ингибируют его действие, имеют важное клиническое применение. Аденозиновые рецепторы делятся на четыре известных подтипа (т.е.,A1, A2a, A2b и A3). Рецепторы указанных подтипов продуцируют уникальные, а иногда и противоположные друг другу эффекты. Активация аденозинового рецептора A1, например, приводит к повышению резистентности почечных сосудов, а активация аденозинового рецептора А 2 а приводит к снижению резистентности почечных сосудов. В системах большинства органов периоды метаболических стрессов приводят к значительному увеличению концентрации аденозина в ткани. Например, в сердце продуцируется и высвобождается аденозин, опосредующий адаптивные ответы на стресс, такие как снижение частоты сердечных сокращений и коронарная вазодилатация. Аналогичным образом, концентрации аденозина в почках повышаются в ответ на гипоксию, метаболический стресс и присутствие многих нефротоксических веществ. Почки также продуцируют аденозин конститутивно. Почки корректируют количество конститутивно продуцируемого аденозина в результате чего происходит регуляция гломерулярной фильтрации и реабсорбции электролитов. Что касается регуляции гломерулярной фильтрации, то активация рецепторов A1 приводит к сокращению приносящих(афферентных) артериол, а активация рецепторов А 2 а приводит к расширению выносящих(эфферентных) артериол. Активация рецепторов A2a может также оказывать сосудорасширяющее действие на приносящую артериолу. В целом, эффект активации этих гломерулярных аденозиновых рецепторов направлен на снижение скорости гломерулярной фильтрации. Кроме того, аденозиновые рецепторы A1 локализуются в проксимальных канальцах и дистальных канальцах. Активация этих рецепторов стимулирует реабсорбцию натрия из просвета этих канальцев. В соответствии с этим, блокирование воздействия аденозина на эти рецепторы будет приводить к увеличению скорости гломерулярной фильтрации и к увеличению экскреции натрия. Краткое описание изобретения Настоящее изобретение основано на неожиданном обнаружении того факта, что соединения формулы I являются сильнодействующими и селективными ингибиторами конкретных подтипов аденозиновых рецепторов. Антагонисты аденозина могут быть использованы для предупреждения и/или лечения многих заболеваний, включая нарушение работы сердца и кровообращения, дегенеративные расстройства центральной нервной системы, заболевания дыхательных путей, и многие болезни, для которых показано лечение диуретиками. В одном из вариантов своего осуществления настоящее изобретение относится к соединению формулы (I) и его фармацевтически приемлемым солям формулы где R1 и R2 независимо выбраны из алкила; X1 и Х 2 представляют собой О; Z простая связь; иR3 представляет бициклическую или трициклическую группу, выбранную из группы, состоящей из-1 010260 где указанная бициклическая или трициклическая группа является незамещенной, либо замещена одним или несколькими заместителями, выбранными из группы, состоящей из(a) алкила и алкенила; и где указанные алкил и алкенил являются либо незамещенными, либо замещены одним или несколькими заместителями, выбранными из группы, состоящей из алкокси, алкоксикарбониламиноалкиламино, фенилалкоксикарбонила, нафтилалкоксикарбонила, карбокси, диалкиламино, аминоалкиламино, гетероциклилалкиламино, гидрокси, и нитрозамещенного гетероциклиламиноалкиламино;(b) ациламиноалкиламино, алкениламино, алкоксикарбонила, алкоксикарбонилалкиламино, алкоксикарбониламиноацилокси, алкоксикарбониламиноалкиламино, алкиламино, амино, аминоацилокси,карбокси, карбоксиалкокси, карбоксиалкиламино, диалкиламиноалкиламино, гетероциклила, гетероциклилалкиламино, гидрокси, оксо, фосфата, нитрозамещенного гетероциклиламиноалкиламино и оксозамещенного гетероциклилалкиламино; где каждая из указанных групп алкила может содержать от 1 до 6 атомов углерода в цепи и быть прямой или разветвленной,алкенила может содержать от 3 до 6 атомов углерода в цепи и быть прямой или разветвленной,гетероциклила представляет собой 5-9-членный ароматическую или неароматическую карбоциклическую кольцевую систему, в которой один или два атома углерода кольца независимо замещены азотом,кислородом или серой; либо, когда R1 и R2 каждый означают группу СН 3-СН 2-СН 2-,R3 представляет собой трициклическую группу, выбранную из следующих: а также соединение или его фармацевтически приемлемую соль формулы В следующем варианте осуществления изобретения каждый из R1 и R2 представляет н-пропил. В еще одном варианте осуществления изобретения R3 выбран из группы, состоящей из и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, гидроксиалкила, карбокси, карбоксиалкенила, карбоксиалкила, аминоацилокси, карбоксиалкокси, диалкиламиноалкенила и диалкиламиноалкила. В другом варианте осуществления изобретения, R3 представляет и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, карбоксиалкенила, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила. В другом варианте осуществления изобретения R3 замещен заместителями, выбранными из группы,состоящей из гидрокси, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила. В следующем варианте осуществления изобретение относится к следующим соединениям 8-(5-гидрокситрицикло [2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион,8-(5-гидроксиметилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион,8-[5-(3-диметиламинопропилиден)трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин 2,6-дион,8-[5-(3-диметиламинопропил)трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6 дион. В другом варианте осуществления изобретения R3 выбран из-2 010260 и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси,алкила, карбокси, карбоксиалкила, диалкиламиноалкиламино, алкоксикарбонилалкиламино, карбоксиалкиламино, гетероциклила, алкениламино, амино, алкиламино, гетероциклилалкиламино, фосфата, гетероциклиламиноалкиламино и гетероциклиламиноалкиламино алкила. В другом варианте осуществления изобретения R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси,карбокси, карбоксиалкила и гидроксиалкила. В следующем варианте осуществления изобретения соединение представляет собой 4-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-1-карбоновую кислоту. В другом варианте осуществления изобретения, R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкила,гидрокси, карбокси, карбоксиалкила. В другом варианте осуществления изобретения соединение представляет собой 8-(4-гидроксибицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион,8-(4-оксо-бицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. В еще одном варианте осуществления изобретения R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из карбокси,гидрокси, диалкиламиноалкиламино, и замещенного гетероциклиламиноалкиламиноалкила. В другом варианте осуществления изобретения соединение представляет собой 8-[8-(2-диметиламиноэтиламино)бицикло[3.2.1]окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион, 8-(8-гидроксибицикло[3.2.1]окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. В следующем варианте осуществления изобретения R3 представляет и замещен одним или несколькими карбокси и гидрокси заместителями. В другом варианте осуществления изобретения соединение представляет собой 8-(3-гидроксибицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. В еще одном осуществления изобретения R3 выбран из группы, состоящей из и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидроксиалкила, гидрокси и алкоксикарбонила. В другом варианте осуществления изобретения соединение представляет собой 8-(8-оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. В следующем варианте осуществления изобретения R3 представляет: и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкоксикарбонилалкила. В еще одном варианте осуществления изобретения соединение представляет собой 8-(2-оксо-3-азабицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. В другом варианте осуществления изобретения указанное соединение принимает форму, выбран-3 010260 ную из группы, состоящей из ахирального соединения, рацемата, оптически активного соединения, чистого диастереомера, смеси диастереомеров или фармацевтически приемлемой аддитивной соли. Соединения настоящего изобретения могут быть также модифицированы путем присоединения соответствующих функциональных групп для усиления селективных биологических свойств. Такие модификации известны специалистам и к ним относятся модификации, которые усиливают биологическую проницаемость в данную биологическую систему (например, в кровь, лимфатическую систему, центральную нервную систему), повышают доступность соединений при пероральном введении, повышают растворимость, позволяющую осуществлять введение путем инъекции, изменяют метаболизм и/или изменяют скорость экскреции. Примерами таких модификаций являются, но не ограничиваются ими, этерификация полиэтиленгликолями, дериватизация пиволатами или заместителями в виде жирных кислот,превращение в карбаматы, гидроксилирование ароматических колец и замещение по гетероатому в ароматических кольцах. Настоящее изобретение также относится к лекарственной композиции, включающей любое из вышеуказанных соединений, в комбинации с подходящим наполнителем. Настоящее изобретение также относится к способу лечения индивидуума, страдающего состоянием, характеризующимся повышенной концентрацией аденозина и/или повышенной чувствительностью к аденозину, предусматривающий введение указанному индивидууму эффективного количества соединения по изобретению в качестве антагониста аденозина. Настоящее изобретение также относится к способу лечения индивидуума, страдающего состоянием, выбраным из нарушений работы сердца и кровообращения, дегенеративных расстройств центральной нервной системы, заболеваний дыхательных путей, заболеваний, при которых показано лечение диуретиками, болезни Паркинсона, депрессии, травматического поражения головного мозга, постинсультного неврологического расстройства, угнетения дыхания, травмы головного мозга у новорожденных, дислексии, гиперактивности, кистозного фиброза, циррозных асцитов, апное новорожденных, почечной недостаточности, диабета, астмы и состояний, сопровождающихся отеками. Настоящее изобретение также относится к способу лечения индивидуума, страдающего состоянием, выбраным из застойной сердечной недостаточности или дисфункции почек. Настоящее изобретение также относится к способу получения 8-замещенных ксантинов. Указанный способ включает стадии:b) введение защиты указанного ксантина в N7-положении;d) связывания (захвата) указанного аниона карбоксильным, карбонильным, альдегидным или кетонным соединением иe) снятия защиты в защищенном N7-положении с получением 8-замещенного ксантина. Используемый здесь термин "алкильная группа" означает насыщенную алифатическую углеводородную группу. Алкильная группа может быть прямой или разветвленной и может содержать, например,от 1 до 6 атомов углерода в цепи. Примерами прямых алкильных групп являются, но не ограничиваются ими, этил и бутил. Примерами разветвленных алкильных групп являются, но не ограничиваются ими,изопропил и трет-бутил."Алкенильная группа" означает алифатическую углеводородную группу, которая имеет по крайней мере одну двойную связь. Алкенильная группа может быть прямой или разветвленной и может иметь,например, от 3 до 6 атомов углерода в цепи и 1 или 2 двойные связи. Примерами алкенильных групп являются, но не ограничиваются ими, аллил и изопренил."Алкинильная группа" означает алифатическую углеводородную группу, которая имеет по крайней мере одну тройную связь. Алкенильная группа может быть прямой или разветвленной и может иметь,например, от 3 до 6 атомов углерода в цепи и 1 или 2 тройные связи. Примерами алкинильных групп являются, но не ограничиваются ими, пропаргил и бутинил."Арильная группа" означает фенильную или нафтильную группу или их производное. "Замещенная арильная группа" означает арильную группу, замещенную одним или несколькими заместителями, такими как алкил, алкокси, амино, нитро, карбокси, карбоалкокси, циано, алкиламино, диалкиламино, галоген, гидрокси, гидроксиалкил, меркаптил, алкилмеркаптил, тригалогеналкил, карбоксиалкил, сульфокси или карбамоил."Аралкильная группа" означает алкильную группу, замещенную арильной группой. Примером аралкильной группы является бензил."Циклоалкильная группа" означает алифатическое кольцо, состоящее, например, из 3-8 атомов углерода. Примерами циклоалкильных групп являются циклопропил и циклогексил."Ацильная группа" означает прямую или разветвленную алкил-С(=O)-группу или формильную группу. Примерами ацильных групп являются алканоильные группы (например, имеющие от 1 до 6 атомов углерода в алкильной группе). Примерами ацильных групп являются ацетил и пивалоил. Ацильные группы могут быть замещенными или незамещенными."Алкилкарбамоил" и "диалкилкарбамоил" означают карбамоильные группы, в которых у азота имеется одна или две алкильные группы, присоединенные вместо атомов водорода, соответственно. Аналогично, "арилкарбамоильные" и "арилалкилкарбамоильные группы" включают арильную группу вместо одного из атомов водорода, а в последнем случае - алкильную группу вместо второго атома водорода."Гетероциклильная группа" означает кольцевую структуру, имеющую от 5 до около 10 членов, где один или несколько атомов в кольце представляют элементы, не являющиеся углеродом, например, N, О,S. Гетероциклильная группа может быть ароматической или неароматической, т.е., она может быть насыщенной, либо частично или полностью ненасыщенной. Примерами гетероциклильных групп являются пиридил, имидазолил, фуранил, тиенил, тиазолил, тетрагидрофуранил, тетрагидропиранил, морфолинил,тиоморфолинил, индолил, индолинил, изоиндолинил, пиперидинил, пиримидинил, пиперазинил, изоксазолил, изоксазолидинил, тетразолил и бензимидазолил."Замещенная гетероциклильная группа" означает гетероциклильную группу, в которой один или несколько атомов водорода замещены заместителями, такими как алкокси, алкиламино, диалкиламино,карбалкокси, карбамоил, циано, галогено, тригалогенметил, гидрокси, карбонил, тиокарбонил, гидроксиалкил или нитро."Сульфамоильная группа" имеет структуру -S(O)2NH2. "Алкилсульфамоил" и "диалкилсульфамоил" означают сульфамоильные группы, в которых у азота имеется одна или две алкильные группы, присоединенные вместо атомов водорода, соответственно. Аналогично, "арилсульфамоильная" и "арилалкилсульфамоильная" группы включают арильную группу вместо одного из атомов водорода, а в последнем случае, алкильную группу вместо второго атома водорода."Антагонист" представляет собой молекулу, которая связывается с рецептором без активации указанного рецептора. Эта молекула конкурирует с эндогенным лигандом за связывание в данном участке и,таким образом, ослабляет способность эндогенного лиганда стимулировать этот рецептор. В контексте настоящего изобретения "селективный антагонист" означает антагонист, который связывается с аденозиновым рецептором данного конкретного подтипа с более высокой аффинностью, чем с рецепторами других подтипов. Антагонисты настоящего изобретения могут, например, обладать высокой аффинностью по отношению к рецептору A1 или по отношению к рецептору А 2 а и являются селективными, имея при этом (а) наномолярную аффинность связывания по отношению к одному из этих двух подтипов, и (b) аффинность связывания по отношению к одному подтипу, которая, по крайней мере, в 10 раз, более предпочтительно, в 50 раз, а наиболее предпочтительно, в 100 раз превышает аффинность по отношению к другому подтипу. Настоящее изобретение имеет множество преимуществ. Указанные соединения могут быть легко получены из легко доступных исходных материалов при осуществлении относительно небольшого числа стадий. Указанные соединения имеют ряд вариабельных участков, что позволяет осуществлять систематическую оптимизацию. Поскольку указанные соединения являются A1-специфическими антагонистами,то они могут иметь широкое применение в медицине. Так как указанные соединения обладают сильной активностью и являются Ai-специфическими антагонистами, то они (1) могут быть использованы в низких дозах для минимизации вероятности возникновения побочных эффектов и (2) они могут быть введены в виде многочисленных лекарственных форм, включая, но не ограничиваясь ими, драже, таблетки,капсулы, аэрозоли, суппозитории, жидкие композиции для перорального введения или инъекций, пищевые добавки или препараты для местного применения. Помимо применений в медицине указанное соединение-антагонист может быть использовано для лечения крупного рогатого скота и домашних животных. Если это не оговорено особо, то все технические и научные термины, используемые в данном описании, имеют общепринятые значения, обычно используемые в области, к которой относится настоящее изобретение. Хотя для осуществления или для тестирования настоящего изобретения могут быть использованы методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам,однако, наиболее подходящие методы и материалы описаны ниже. Все публикации, патентные заявки,патенты и другие упомянутые здесь работы во всей своей полноте приведены в настоящем описании в качестве ссылки. Кроме того, описанные материалы, методы и примеры имеют лишь иллюстративный характер и не ограничивают настоящего изобретения. Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания и из формулы изобретения. Краткое описание графического материала В графическом материале, представленном после формулы изобретения, показана серия веществантагонистов аденозина A1.-5 010260 Описание предпочтительных вариантов осуществления изобретения В общих чертах, настоящее изобретение относится к сильнодействующим и селективным антагонистам аденозиннового рецептора A1. Также описаны селективные антагонисты аденозинового рецептора А 2 а. Синтез соединений-антагонистов аденозина Соединения настоящего изобретения могут быть получены рядом известных методов. В общих чертах, ксантины могут быть получены посредством взаимодействия 1,3-дизамещенных 5,6-диаминоурацилов с альдегидами или карбоновыми кислотами или хлорангидридами карбоновых кислот с последующим замыканием кольца. Альтернативно, 1,3-дизамещенные 6-амино-5-нитрозоурацилы могут быть конденсированы с альдегидами с получением нужных ксантинов. 1,3-Дизамещенные 5,6-диаминоурацилы могут быть получены посредством обработки соответствующей симметрично или несимметрично замещенной мочевины цианоуксусной кислотой с последующим нитрозированием и восстановлением (см. например, J.Org. Chem. 16, 1879, 1951; Can. J. Chem. 46,3413, 1968). Альтернативно, нессиметрично замещенные ксантины могут быть получены методом Mueller (J.Med.Soc. 36,3341,1993). В данном методе 6-аминоурацил подвергают специфическому моноалкилированию у N3 указанного урацила в условиях Форбрюггена. После нитрозирования, восстановления, реакции с альдегидом или карбоновой кислотой или хлорангидридом карбоновой кислоты, алкилирования у N1 урацила и замыкания кольца получают ксантины. В конкретном случае анти-3-оксотрицикло [2.2.1.02,6]-гептан-3-карбоновая кислота может быть легко синтезирована из норборнадина, параформальдегида, муравьиной кислоты и серной кислоты (см. например, J.Am.Chem.Soc. 99, 4111, 1977; Tetrahedron 37 Supplement1 411, 1981. Она может быть легко выделена с использованием липазы A Candida antartica (Tetrahedron Lett. 37, 3975, 1996). Во многих случаях нужные альдегиды, кетоны, карбоновые кислоты и хлорангидриды карбоновых кислот являются коммерчески доступными (например, от Aldrich Chemical Co., Inc., Milwaukee, Wisc.),либо они могут быть легко получены из коммерчески доступных материалов хорошо известными методами синтеза. Такими методами синтеза являются, но не ограничиваются ими, окисление, восстановление, гидролиз, алкилирование и реакции гомологизации Виттига. Бициклоалканкарбоновые кислоты настоящего изобретения могут быть также получены ранее опубликованными методами (см. например, Aust. J. Chem. 38, 1705, 1985; Aust. J. Chem. 39, 2061, 1986; J.Chem., 46, 4795, 1981; и J. Org. Chem. 60, 6873, 1995). Использование соединений антагонистов аденозина Активация аденозиновых рецепторов индуцирует многие физиологические ответы, включая снижение уровня кровотока в почках, снижение скорости гломерулярной фильтрации и повышение реабсорбции натрия в почках. Активация аденозиновых рецепторов приводит к снижению частоты сердечных сокращений, к снижению скорости проводимости и к снижению сократимости. Эти и другие эффекты активации аденозиновых рецепторов в других органах представляют собой нормальные регуляторные процессы. Однако указанные эффекты становятся аномальными при многих патологических состояниях. Таким образом, антагонисты аденозина имеют широкое применение как для предупреждения, так и для лечения заболевания. Заболеваниями, которые могут быть предупреждены и/или подвергнуты лечению антагонистами аденозиновых рецепторов являются любые состояния, (а) характеризующиеся присутствием аномального уровня аденозина и/или (b) требующие для своего лечения ингибирования или стимуляции продуцирования и/или высвобождения аденозина. Такими состояниями являются, но не ограничиваются ими, застойная сердечная недостаточность, сердечно-легочная реанимация, геморрагический шок и другие нарушения работы сердца и кровообращения, дегенеративные расстройства центральной нервной системы, заболевания дыхательных путей (например, бронхиальная астма, аллергические заболевания легких), и многие заболевания, для которых показано лечение диуретиками (например, острая и хроническая почечная недостаточность, недостаточность почечной функции, гипертензия). С активностью адонозиновых рецепторов связаны все дегенеративные болезни, такие как болезнь Паркинсона, депрессия, травматическое поражение головного мозга, послешоковое неврологическое расстройство, травма головного мозга у новорожденных, дислексия, гиперактивность и кистозный фиброз. Другими состояниями, при которых лечение антагонистами аденозиновых рецепторов может оказаться терапевтически эффективным, являются циррозные асциты, апное новорожденных, почечная недостаточность, ассоциированная с традиционной терапией диуретиками, диабет и астма. Кроме того, заявителями было обнаружено, что введение высокоселективных и сильнодействующих антагонистов аденозинового рецептора A1, может, например, индуцировать диуретический ответ при их введении отдельно и может потенцировать диуретический ответ на традиционные диуретики. Кроме того, введение антагонистов аденозиновых рецепторов вместе с другими традиционными диуретиками замедляют снижение скорости гломерулярной фильтрации, индуцированной традиционными диуретиками. Заявленные методы являются применимыми, например, при состояниях, сопровождающихся отеками, таких как застойная сердечная недостаточность и асциты.-6 010260 Введение соединений-антагонистов аденозина Указанные соединения могут быть введены животному (например, млекопитающему, такому как человек, примат, отличный от человека, лошадь, собака, корова, свинья, овца, коза, кошка, мышь, крыса,морская свинка, кролик, хомяк, песчанка, хорек, ящерица, рептилии или птицы). Указанные соединения могут быть введены в любой форме, подходящей для введения фармацевтических соединений, включая,но не ограничиваясь ими, драже, таблетки, капсулы, аэрозоли, суппозитории, жидкие композиции для глотания или инъекций или для использования в виде глазных или ушных капель, диетические добавки или препараты для местного применения. Указанные соединения могут быть введены перорально, интраназально, чрезкожно, внутрикожно, вагинально, в уши, в глаза, трансбуккально, ректально, через слизистую или путем ингаляции, имплантации (например, хирургически) или внутривенного введения. Указанные соединения могут быть, но необязательно, введены в сочетании с не модифицирующей аденозин фармацевтической композицией (например, в комбинации с не модифицирующим аденозин диуретиком, описанным, например, в одновременно рассматриваемой заявке PCT/US 99/08879, поданной 23 апреля 1999, которая во всей своей полноте вводится в настоящее описание в качестве ссылки. Настоящее изобретение подробно описано на нижеследующих примерах, которые не должны рассматриваться как ограничение объема изобретения, определенного в формуле изобретения. Примеры Пример 1. 8-(5-Оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Анти-3-оксотрицикло (2.2.1.02,6) гептан-7-карбоновую кислоту (837 мг) растворяют в CH2Cl2 (20 мл) при 0 С. Затем добавляют триэтиламин (1,74 мл), изобутилхлорформиат (724 мкл) и смесь перемешивают при 0 С в течение 15 мин. После этого добавляют 1,3-дипропил-5,6-диаминоурацилHCl и перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение ночи. На следующий день реакционную смесь разбавляют водой (50 мл) и экстрагируют CH2Cl2 (325 мл). Объединенные органические слои промывают нас. NaHCO3, водой, насыщенным раствором соли и сушат над Na2SO4. После концентрирования растворителя получают неочищенный продукт, который используют в следующей стадии без дополнительной очистки. МС (ES+ 361).[2.2.1.02,6]гептан-3-карбоновой кислоты (360 мг), полученный в стадии 1, растворяют в смеси (1:1) изопропанол:вода (5 мл) и добавляют KOH (84 мг). Реакционную смесь кипятят с обратным холодильником в течение полутора часов. После охлаждения реакционной смеси до комнатной температуры iPrOH удаляют на роторном испарителе. Водный слой нейтрализуют 2 н. HCl и экстрагируют этилацетатом (350 мл). Объединенный органический слой промывают водой и насыщенным раствором соли и сушат надNa2SO4. После концентрирования неочищенный продукт очищают хроматографией на силикагеле, элюируя смесью этилацетат:гексан (1:1). Выход 75 мг. МС (ES+ 343). Пример 2. Эндо/экзо 8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин 2,6-дион. 8-(5-оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (700 мг) растворяют в МеОН (50 мл). Затем добавляют NaBH4 (100 мг) при 0 С и перемешивают в течение 5 мин. После этого добавляют воду и перемешивают 30 мин. МеОН удаляют на роторном испарителе при пониженном давлении. Реакционную смесь экстрагируют этилацетатом, промывают водой, насыщенным раствором соли и сушат над MgSO4. После концентрирования получают 700 мг смеси эндо:экзо-спиртов в отношении 6:4. Пример 3. 8-(5-Метилентрицикло [2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Бромид метилтрифенилфосфония (2,08 г) растворяют в ТГФ (50 мл) при -78 С. Затем медленно добавляют n-BuLi (3,66 мл, 1,6 М) при -78 С и перемешивают в течение 1 ч. 8-(5-оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (пример 1) (1 г) растворяют в ТГФ и медленно добавляют к реакционной смеси при -78 С. После завершения добавления реакционную смесь медленно нагревают до комнатной температуры и перемешивают при комнатной температуре в течение ночи. На следующий день реакционную смесь гасят 1 н. HCl и экстрагируют этилацетатом (350 мл). Объединенный органический слой промывают водой, насыщенным раствором соли и сушат над Na2SO4. После концентрирования продукт очищают на колонке с силикагелем. МС (ES+ 341). Пример 4. 8-(5-Метоксиметилентрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. Хлорид метоксиметилтрифенилфосфония (1,1 г) растворяют в толуоле (10 мл) при 0 С. Затем добавляют бис(триметилсилил)амид калия (0,5 М в толуоле, 12,8 мл) и перемешивают при 0 С в течение 1 ч. К реакционной смеси добавляют 8-(5-оксотрицикло-[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (пример 1) (1 г), а затем нагревают до комнатной температуры и перемешивают в течение ночи. На следующий день реакционную смесь гасят водой и экстрагируют этилацетатом (350 мл). Объединенный органический слой промывают водой и насыщенным раствором соли и сушат надNa2SO4. После концентрирования неочищенный продукт очищают на колонке. МС (ES+ 371). Пример 5. 8-(5-эндо-Гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-7 010260 дион. Борогидрид натрия (22 мг) растворяют в МеОН (5 мл) при 0 С. Затем к реакционной смеси при 0 С добавляют 8-(5-оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (пример 1)(200 мг) в МеОН (5 мл). После перемешивания при 0 С в течение 1 ч, реакционную смесь гасят 1 н. HCl и экстрагируют этилацетатом (325 мл). Объединенный органический слой промывают водой, насыщенным раствором соли и сушат над Na2SO4. После концентрирования растворителя продукт очшищают препаративной ВЭЖХ. МС (ES+ 345). Продукт представляет собой смесь двух изомеров (2:1). Главный изомер представляет собой эндогидроксильное соединение. Пример 6. 8-(5-экзо-Гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. К раствору 8-(5-оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 1) (2 г) в ТГФ (40 мл) при -78 С по каплям добавляют раствор К-селектрида (20 мл, 1 М в ТГФ). Смесь перемешивают при -78 С в течение 30 мин, а затем нагревают до 0 С, гасят водой и экстрагируют этилацетатом (350 мл). Объединенный органический слой промывают насыщенным раствором соли и сушат над MgSO4. После фильтрации и концентрирования при пониженном давлении получают нужный продукт (1,97 г) в виде смеси (20:1) экзо- и эндо-спиртов. МС (ES+ 345). Пример 7. 8-(5-эндо-Гидроксиметил-5-метилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион и 8-(5-экзогидрокси-5-гидроксиметилтрицикло-[2.2.1.02,6]гепт-3-ил)-1,3-дипропил 3,7-дигидропурин-2,6-дион. 8-(5-Метоксиметилентрицикло [2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (368 мг) растворяют в ТГФ (5 мл). К реакционной смеси добавляют 1 н. HCl (2 мл) и перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь экстрагируют этилацетатом (325 мл). Обеъединенный экстрат промывают нас. NaHCO3, водой и насыщенным раствором соли и сушат над Na2SO4. Продукт представляет собой смесь эндо- и экзо-альдегидов, которую используют в следующей стадии без дополнительной очистки. Указанную смесь альдегидов восстанавливают с использованием NaBH4 в МеОН, а затем осуществляют процедуру, описанную в примере 5. Полученный продукт в виде смеси эндо- и экзогидроксилметильных соединении разделяют препаративной ВЭЖХ. МС (ES+ 359). Аналогичными методами были получены следующие соединения: Пример 7 а. Эндо-8-(5-эндогидроксиметил-5-метилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион. Пример 7b. Эндо-8-(5-эндогидроксиметил-5-метилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион. Пример 8. 8-(5-Гидрокси-5-гидроксиметилтрицикло[2.2.1.02,6]гепт-3-ил)1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(5-Метилентрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (284 мг) растворяют в смеси ацетон:вода (1:1, 5 мл) при 0 С. Затем добавляют OsO4 (2 мл), и смесь перемешивают в течение 15 мин. После этого добавляют N-метилморфолин-N-оксид (120 мг) и смесь перемешивают при комнатной температуре в течение ночи. На следующий день реакционную смесь гасят растворомNaHSO3 и экстрагируют этилацетатом (325 мл). Объединенный органический слой промывают водой,насыщенным раствором соли и сушат над Na2SO4. После концентрирования неочищенный продукт очищают на колонке с двуокисью кремния (ES+ 375). Пример 9. Эндо-5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6]гептан-3-эндокарбоновая кислота. 8-(5-эндогидроксиметил-5-метилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион и 8-(5-зкзогидрокси-5-гидроксиметилтрицикло-[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (100 мг) растворяют в ДМФ (5 мл). Затем добавляют PDC (232 мг) при 0 С и перемешивают при температуре в пределах от 0 С до комнатной температуры в течение ночи. На следующий день добавляют еще 232 мг PDC и перемешивают при комнатной температуре в течение 24 ч. ДМФ удаляют при пониженном давлении. Затем растворяют в насыщенном растворе NaHCO3 и экстрагируют этилацетатом (250 мл). Водный слой подкисляют 1 н. HCl и экстрагируют этилацетатом (3100 мл). Этилацетатный слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Смесь экзои эндокислот разделяют препаративной ВЭЖХ. МС (ES+ 373). Аналогичным методом были получены следующие соединения. Пример 9 а. Экзо-5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло(триметилсилил)амид калия (0,5 М в толуоле, 2,2 мл) и перемешивают при 0 С в течение 1 ч. К реакционной смеси добавляют 8-(5-оксотрицикло-[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-8 010260 дион (пример 1) (171 мг), растворенный в 5 мл толуола, после чего смесь нагревают до комнатной температуры и перемешивают в течение ночи. На следующий день реакционную смесь гасят водой, подкисляют 1 н. HCl и экстрагируют этилацетатом (2100 мл). Объединенный органический слой промывают водой и насыщенным раствором соли и сушат над Na2SO4. После концентрирования неочищенный продукт (156 мг) используют в последующей стадии без дополнительной очистки. МС (ES+ 399). Сложный эфир (156 мг), полученный в стадии 1, гидролизуют с использованием LiOH (34 мг). Продукт очищают препаративной ВЭЖХ. Выход 52 мг. МС (ES+ 385) . Пример 11. [5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6] гепт-3-илиден]уксусная кислота. Продукт (100 мг), полученный в стадии 1 примера 10, гидрируют в EtOH (5 мл) с использованием 5% Pd/C под давлением Н 2 60 фунт/кв.дюйм в течение 24 ч. Катализатор отфильтровывают и растворитель концентрируют. Этот продукт используют в следующей стадии. Сложный эфир (90 мг), полученный в стадии 1, гидролизуют с использованием LiOH (19 мг) в смеси МеОН:Н 2 О (5:1,5 мл) при комнатной температуре в течение ночи. Продукт очищают препаративной ВЭЖХ. Выход 51 мг. МС (ES+ 387). Пример 12. 8-(5-оксобицикло[2.2.1]гепт-7-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 2-Оксобицикло[2.2.1]гептан-7-карбоновую кислоту (308 мг) подвергают реакции сочетания с 1,3 дипропил-3,6-диаминоурацилHCl (576 мг) и циклизуют в соответствии с процедурами, описанными в примере 1. Выход 320 мг. МС (ES+ 345). Пример 13. 8-(2-Гидроксибицикло[2.2.1]гепт-7-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(2-Оксобицикло[2.2.1]гепт-7-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (200 мг) восстанавливают с использованием NaBH4 (44 мг) в МеОН (10 мл). Выход 120 мг. МС (ES+ 347). Пример 14. [5-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)-3-гидроксиметилтрицикло[2.2.1.02,6]гептан]-3-карбоновая кислота. Анти-3-оксотрицикло [2.2.1.02,6] гептан-7-карбоновую кислоту (2,0 г) растворяют в МеОН (50 мл),добавляют конц. H2SO4 (0,2 мл) и кипятят с обратным холодильником в течение ночи. На следующий день, после охлаждения, реакционную смесь выливают в насыщенный раствор NaHCO3 и экстрагируют этилацетатом. После концентрирования этилацетата получают 2,61 г метилового сложного эфира 5,5 диметокситрицикло [2.2.1.02,6] гептан-3-карбоновой кислоты. Метиловый эфир 5,5-диметокситрицикло[2.2.1.02,6]гептан-3-карбоновой кислоты (1,01 г), полученный в стадии 1, растворяют в сухом ТГФ (20 мл) при -78 С и по каплям добавляют LDA (3,53 мл, 2 М в ТГФ). Полученную смесь оставляют на 1 ч при -78 С. Затем по каплям добавляют BOMCl (2,29 г). После выдерживания в течение 30 мин при -78 С смесь нагревают до 0 С и перемешивают 1 ч. Реакцию гасят нас. NH4Cl и экстрагируют этилацетатом (250 мл). После концентрирования неочищенный продукт растворяют в ТГФ (20 мл) и добавляют 1 н. HCl (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, разбавляют водой и экстрагируют этилацетатом. Этилацетат промывают насыщенным раствором соли и сушат MgSO4. После концентрирования продукт очищают на колонке с двуокисью кремния. Выход 515 мг. Стадия 3. Метиловый эфир 3-бензилоксиметил-5-оксотрицикло[2.2.1.02,6]-гептан-3-карбоновой кислоты, полученный в стадии 2, превращают в метиловый эфир 3-бензилоксиметил-5-формилтрицикло[2.2.1.02,6]гептан-3-карбоновой кислоты в соответствии с процедурами, описанными в примере 4 и в примере 7. В раствор метилового эфира 3-бензилоксиметил-5-формилтрицикло[2.2.1.02,6]гептан-3-карбоновой кислоты (475 мг) в 10 мл t-BuOH и 8 мл 2-метил-бут-2-ена при 0 С добавляют NaClO2 (904 мл) иNaH2PO4 Н 2 О (1,37 г) в воде (5 мл). Смесь перемешивают при комнатной температуре в течение 5 ч. Реакционную смесь подкисляют НОАс, экстрагируют этилацетатом, промывают водой и сушат. После концентрирования получают нужную кислоту (175 мг). Метиловый эфир 3-бензилоксиметилтрицикло[2.2.1.02,6]-гептан-3,5-дикарбоновой кислоты (168 мг),полученный как описано выше, подвергают реакции сочетания с 1,3-дипропил-5,6-диаминоурацилHCl(263 мг) с использованием EDC (191 мг), DIEA (258 мг) в CH2Cl2 (20 мл) при комнатной температуре в течение ночи. После обработки продукт циклизуют с использованием водного KOH в iPrOH. 3-Бензилоксиметил-5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6]гептан]-3-карбоновую кислоту (50 мг) гидрируют в этилацетате с использованием 5% Pd/C при давлении Н 2 в 1 атм. в течение ночи. Катализатор фильтруют через двуокись кремния, элюируя 10%[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (110 мг). Полученную смесь перемешивают при комнатной температуре в течение ночи. На следующий день реакционную смесь разбавляют этилацетатом, промывают HCl, нас. NaHCO3 и насыщенным раствором соли и сушат над MgSO4. Продукт фильтруют, концентрируют и очищают на двуокиси кремния с получением нужного соединения. Выход 155 мг. МС (ES+ 544). Пример 16 а. Экзо-2-трет-бутоксикарбониламино-3-метилмасляной кислоты 5-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил) -трицикло [2.2.1.02,6] гепт-3-иловый эфир. Пример 17. Эндо-2-амино-3-метилмасляной кислоты 5-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрадигидро-1 Н-пурин-8-ил)трицикло [2.2.1.02,6]-гепт-3-иловый эфир, HCl. 5-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-трицикло[2.2.1.02,6]гепт-3-иловый эфир эндо-2-трет-бутоксикарбониламино-3-метилмасляной кислоты (120 мг) растворяют в ТГФ (2 мл). Затем добавляют 1 М HCl в эфире (2 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении. Неочищенный остаток растворяют в ТГФ, после чего продукт осаждают добавлением эфира. Выход 55 мг. МС (ES+ 444). Пример 18. (+)Эндо-8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин 2,6-дион.(+) Анти-3-оксотрицикло [2.2.1.02,6] гептан-7-карбоновую кислоту, полученную в соответствии с процедурами, описанными в Tetrahedron Letters, 37, 3975-3976, 1996, подвергают реакции сочетания с 1,3-дипропил-5,6-диаминоурацилом и циклизуют в соответствии с процедурой, описанной в примере 1. Полученный кетон восстанавливают до спирта в соответствии с процедурой, описанной в примере 5. Пример 18 а. (-)Эндо-эндо-8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Пример 19. Экзо-2-амино-3-метилмасляной кислоты 5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)-трицикло[2.2.1.02,6]-гепт-3-иловый эфир; соединение с трифторуксусной кислотой. 5-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6]гепт-3-иловый эфир экзо-2-трет-бутоксикарбониламино-3-метилмасляной кислоты (100 мг) обрабатывают смесьюCH2Cl2:TFA (1:1, 5 мл) при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и неочищенный остаток очищают ВЭЖХ. МС (ES+ 444). Пример 20. Эндо-[5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6]гепт-3-илокси]уксусная кислота. 8-(5-Оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (1 г) растворяют в ДМФ (10 мл), добавляют Cs2CO3 (5,85 г), а затем BOMCl (810 мкл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Cs2CO3 отфильтровывают и ДМФ удаляют при пониженном давлении. Неочищенный продукт очищают на колонке с двуокисью кремния. Полученный кетон восстанавливают с использованием NaBH4, как описано в данном примере. Выход: 1,3 г смеси эндо- и экзо-спиртов.NaH (240 мг, 60% суспензия в минеральном масле) 3 раза промывают сухим пентаном и растворяют в сухом ТГФ при 0C. К реакционной смеси добавляют смесь спиртов, полученную как описано выше,(500 мг) в ТГФ (5 мл), и перемешивают при 0 С в течение 1 ч. Затем добавляют бром-трет-бутилацетат(420 мг) при 0 С и перемешивают при температуре в пределах от 0 С до комнатной температуры в течение ночи. На следующий день реакционную смесь нагревают при 60 С в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь разбавляют водой и экстрагируют этилацетатом (350 мл). Объединенный этилацетатный слой промывают водой, насыщенным раствором соли и сушат надNa2SO4. После концентрирования, неочищенную смесь используют в следующей стадии. Продукт, полученный как описано выше, растворяют в этилацетате (5 мл) и и добавляют 100 мгPd/C (10%) 1 мл конц. HCl. Реакционную смесь гидрируют в атмосфере Н 2 под давлением 60 фунт/кв.дюйм в течение ночи. Катализатор отфильтровывают и растворитель удаляют на роторном испарителе. Остаток растворяют в 5 мл МеОН и добавляют LiOH (100 мг). Реакционную смесь перемешивают при комнатной температуре в течение ночи. На следующий день растворитель удаляют, разбавляют водой и экстрагируют этилацетатом (250 мл). Водный слой подкисляют 1 н. HCl и экстрагируют этилацетатом (350 мл). Этилацетатный слой промывают водой и насыщенным раствором соли и сушат надNa2SO4. После концентрирования этилацетатного слоя получают 390 мг смеси эндо- и экзопродуктов,которую разделяют с помощью ВЭЖХ. МС (ES+ 403). Пример 20 а. Экзо-[5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2. 2.1. 02,6]гепт-3-илокси]уксусная кислота. Пример 21. (-)Эндо-2-трет-бутоксикарбониламино-3-метилмасляной кислоты 5-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло [2.2.1.02,6] гепт-3-иловый эфир.(-) Эндо-8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион под- 10010260 вергают реакции сочетания с Boc-L-валином в соответствии с процедурой, описанной в примере 16. Пример 22. (-)Эндо-2-амино-3-метилмасляной кислоты 5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло [2.2.1.02,6]-гепт-3-иловый эфир, HCl. 5-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)трицикло[2.2.1.02,6]гепт-3-иловый эфир(-)эндо-2-трет-бутоксикарбониламино-3-метилмасляной кислоты превращают в нужный продукт в соответствии с процедурой, описанной в примере 17. МС (ES+ 444). Пример 23. 8-[5-(3-Диметиламинопропилиден)трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7 дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. Бромид (3-диметиламинопропил)трифенилфосфония (514 мг) растворяют в ТГФ (20 мл) при 0 С. Затем добавляют бис(триметилсилил)амид калия (0,5 М в толуоле, 5 мл) и перемешивают при 0 С в течение 1 ч. К реакционной смеси добавляют 8-(5-оксотрицикло-[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион (342 мг), растворенный в 5 мл ТГФ, при 0 С. Реакционную смесь перемешивают при температуре в пределах от 0 С до комнатной температуры в течение ночи. На следующий день ТГФ удаляют на роторном испарителе при пониженном давлении, остаток растворяют в воде (10 мл), подкисляют 1 н. HCl и экстрагируют этилацетатом (2 х 100 мл). Водный слой концентрируют и очищают ВЭЖХ. Выход 140 мг. МС (ES+ 412). Пример 24. 8-[5-(3-Диметиламинопропил)трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-[5-(3-Диметиламинопропилиден)-трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин 2,6-дион, соединение с трифторуксусной кислотой, гидрируют в атмосфере Н 2 при 60 фунт/кв.дюйм в течение ночи с использованием 5% Pt/C в EtOH (10 мл) и 1 мл конц.HCl. Катализатор отфильтровывают и растворитель удаляют при пониженном давлении. Неочищенный продукт очищают с помощью ВЭЖХ. Выход 30 мг. МС (ES+ 414). Пример 25. 8-(4-Гидроксибицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 4-Ацетоксибицикло[3.2.1]октан-6-карбоновую кислоту (425 мг) растворяют в CH2Cl2 (5 мл) при 0 С. Затем добавляют TEA (700 мкл) и изо-бутилхлорформиат (285 мкл) и перемешивают при 0 С в течение 30 мин. После этого добавляют 1,3-диизопропил-5,6-диаминоурацилHCl (524 мг) и перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение ночи. На следующий день реакционную смесь разбавляют CH2Cl2 (25 мл), промывают водой, сушат над Na2SO4 и концентрируют. Неочищенный продукт (820 мг) используют в следующей стадии без дополнительной очистки. Полученный продукт циклизуют в смеси iPrOH/вода (1:1, 15 мл) с использованием KOH (280 мг) при кипячении с обратным холодильником в течение 1 ч. Затем проводят процедуру, описанную в примере 1. Выход 450 мг. МС (ES+ 361). Пример 26. 8-(4-Оксобицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(4-гидроксибицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (140 мл), полученный в стадии 1, растворяют в CH2Cl2 (5 мл). После этого добавляют целит (2 г), а затем РСС (90 мг) и перемешивают при комнатной температуре в течение 1 ч. Затем снова добавляют РСС (90 мг) и перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют простым эфиром (100 мл), фильтруют через целит и концентриуют. После очистки на колонке с двуокисью кремния при элюировании смесью этилацетат:гексан (25:75) получают 65 мг нужного продукта. МС (ES+ 369). Пример 27. 8-(4-Гидрокси-4-метилбицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. 8-(4-Оксобицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (51 мг) растворяют в ТГФ (3 мл) при 0 С. Затем добавляют CH3MgBr (1 мл, 3,0 М) и перемешивают 2 ч. Реакционную смесь гасят нас. NH4Cl и экстрагируют этилацетатом. Органический слой промывают водой, насыщенным раствором соли и сушат Na2SO4. После концентрирования и последующей очистки на колонке с двуокисью кремния получают нужный продукт. МС (ES+ 375). Пример 28. 8-(3-оксо-2-аза-бицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-Бицикло[2.2.1]гепт-5-ен-2-ил-1,3-дипропил-3,7-дигидропурин-2,6-дион (5 г) обрабатывают NaH(878 мг) в ТГФ при 0 С. Через один час, по каплям добавляют BOMCl (2,52 мл) и перемешивают в течение ночи. На следующий день реакцию гасят водой, экстрагируют этилацетатом, промывают водой и сушат над Na2SO4. После концентрирования неочищенный продукт используют в следующей стадии. 7-Бензилоксиметил-8-бицикло[2.2.1]гепт-5-ен-2-ил-1,3-дипропил-3,7-дигидропурин-2,6-дион (5 г),полученный в стадии 1, растворяют в ТГФ (25 мл) при 0 С. Затем добавляют ВН 3 ТГФ (12 мл, 1 М). Через два часа добавляют 6 н. NaOH (1 мл) и Н 2 О 2 (12 мл) и перемешивают еще 2 ч. Реакционную смесь подкисляют 1 HCl и экстрагируют этилацетатом. Органический слой промывают водой, насыщенным раствором соли и сушат над Na2SO4. После концентрирования органического слоя получают смесь двух продуктов, которую разделяют колоночной хроматографией. Менее полярное соединение, 7 бензилоксиметил-8-(6-гидроксибицикло[2.2.1]гепт-2-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (главный продукт) получают с выходом 1,7 г. МС (ES+ 467). 7-Бензилоксиметил-8-(6-гидроксибицикло[2.2.1]гепт-2-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион (1,6 г) окисляют с использованием РСС (855 мг) в соответствии с процедурой, описанной в примере(435 мг), полученный в стадии 3, растворяют в уксусной кислоте (5 мл). Затем добавляют гидроксиламино-О-сульфоновую кислоту (211 мг) и кипятят с обратным холодильником в течение 3 ч. После охлаждения реакционную смесь экстрагируют этилацетатом (325 мл). Органический слой промывают нас.NaHCO3, водой, насыщенным раствором соли и сушат над Na2SO4. Растворитель удаляют на роторном растворителе и нужный продукт очищают на колонке с двуокисью кремния. МС (ES+ 360) . Пример 29. 8-(2-Оксо-3-аза-бицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,9-дигидропурин-2,6-дион. В раствор NaN3 (65 мг) в CHCl3 (2 мл) добавляют H2SO4 (0,5 мл). Полученный раствор охлаждают до 0 С. Затем добавляют 8-(2-оксобицикло[2.2.1]гепт-7-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион(173 мг) в CHCl3 (3 мл). Полученный раствор перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь выливают на лед, нейтрализуют NaHCO3 и экстрагируют этилацетатом (325 мл). Объединенный экстракт сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают перекристаллизацией из МеОН. Выход 155 мг. МС (ES+ 360). Пример 30. Бензиловый эфир [8-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)-3 аза-бицикло[3.2.1]окт-3-ил]уксусной кислоты. 8-(2-Оксо-3-аза-бицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,9-дигидропурин-2,6-дион (85 мг) растворяют в ТГФ (2 мл), добавляют 1 мл 1 М LAH в эфире и кипятят с обратным холодильником в течение ночи. На следующий день, после охлаждения, реакцию гасят льдом, добавляют 1 н. KOH и экстрагируют этилацетатом (325 мл). Объединенный экстракт промывают насыщенным раствором соли и сушат надMgSO4. Растворитель удаляют при пониженном давлении. Продукт (14 мг) растворяют в 2 мл CH2Cl2,добавляют бензиловый эфир бромуксусной кислоты (23 мг) и перемешивают при комнатной температуре в течение ночи. На следующий день реакционную смесь подщелачивают 1 н. NaOH и экстрагируют этилацетатом. Неочищенный продукт очищают на колонке с двуокисью кремния. Выход 7 мг. МС (ES+ 494). Пример 31. [8-(3-Оксо-2-аза-бицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(2-Оксобицикло[2.2.1]гепт-7-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (278 мг) превращают в нужный продукт (185 мг) в соответствии с процедурой, описанной в примере 27. МС (ES+ 360). Пример 32. [8-(3-Оксо-4-аза-трицикло[3.2.1.02,7]окт-6-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(5-Оксотрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (150 мг) превращают в нужный продукт (135 мг) в соответствии с процедурой, описанной в примере 27. МС (ES+ 358). Пример 33. [8-(3-Оксобицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. Этиловый эфир 3-оксобицикло[3.2.1]октан-8-карбоновой кислоты, полученный в соответствии с процедурой, описанной в литературе (J. Org. Chem., 1997, 62, 174-181) гидролизуют в кето-кислоту с использованием KOH в МеОН. 3-Оксобицикло[3.2.1]октан-8-карбоновую кислоту (205 мг), полученную в стадии 1, подвергают реакции сочетания с диаминоурацилHCl (395 мг) с использованием EDC (287 мг), в CH2Cl2 в присутствииDIEA (490 мг) и циклизуют в iPrOH (50 мл), 1 н. KOH (10 мл) при кипячении с обратным холодильником в течение ночи. Неочищенный продукт очищают на колонке с двуокисью кремния. Выход 210 мг. МС(ES+ 359). Пример 34. Экзо-8-(3-Гидроксибицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(3-Оксобицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2, 6-дион (30 мг) растворяют в МеОН (2 мл) и к реакционной смеси при 0 С добавляют NaBH4 (20 мг), а затем перемешивают 10 мин. Реакцию гасят водой и экстрагируют этилацетатом. Органический слой сушат над MgSO4 и концентрируют. Неочищенные продукты (смесь эндо- и экзо-спиртов) очищают с помощью ВЭЖХ. Экзоспирт - 4 мг. МС (ES+ 361). Пример 34 а. Эндо-8-(3-гидроксибицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Эндо-спирт (12 мг). МС (ES + 361). Пример 35. 3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрадигидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-2 ен-8-карбоновая кислота. В раствор этилового эфира 3-оксобицикло[3.2.1]октан-8-карбоновой кислоты (100 мг), полученный в соответствии с процедурой, описанной в J. Org. Chem., 62, 174-181,1997, в ТГФ (5 мл) при -78 С по каплям добавляют раствор LDA (0,3 мл, 2 М). Реакционную смесь перемешивают при -78 С в течение 30 мин. Полученный энолят гасят бис(трифторметилсульфонил)аминобензолом (214 мг). После выдерживания в течение еще 30 мин при -78 С реакционную смесь гасят нас. NH4Cl. Реакционную смесь растворяют в этилацетате, промывают водой, насыщенным раствором соли и сушат над MgSO4. Растворитель удаляют при пониженном давлении, и неочищенный продукт используют в следующей стадии без дополнительной очистки. Продукт, полученный в стадии 1, растворяют в ДМФ (10 мл). Затем добавляют 1,3-дипропил-5,6 диаминоурацилHCl (263 мг), PPh3 (15 мг), Pd(OAc)2 (7 мг) и DIEA (194 мг). Реакционную смесь перемешивают при 100 С при медленном барботировании моноокиси углерода в течение 1 дня. Раствор охлаждают до комнатной температуры, разбавляют этилацетатом, промывают 1 н. HCl и насыщенным раство- 12010260 ром соли и сушат над MgSO4. Растворитель удаляют при пониженном давлении и неочищенный продукт используют в следующей стадии без дополнительной очистки. Продукт, полученный в стадии 2, циклизуют в iPrOH (15 мл), 1 н KOH (5 мл) при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, растворитель концентрируют при пониженном давлении, подкисляют 1 н. HCl, насыщают твердым NaCl, экстрагируют этилацетатом, промывают насыщенным раствором соли и сушат над MgSO4. После концентрирования,неочищенный продукт очищают на колонке с двуокисью кремния. Выход: 50 мг. МС (ES+ 387). Пример 35 а. Этиловый эфир 3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-8 азабицикло[3.2.1]окт-2-ен-8-карбоновой кислоты. МС (ES+ 416). Пример 36. 3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-8 карбоновая кислота. 3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт-2-ен-8 карбоновую кислоту (пример 29) гидрируют с использованием Pd/C в этилацетате. МС (ES+ 389). Пример 37. 8-(8-Оксобицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Продукт (390 мг), полученный в примере 35, растворяют в ТГФ (10 мл) 6 н. HCl (3 мл) и нагревают до температуры дефлегмации в течение ночи. На следующий день, после охлаждения до комнатной температуры, выливают на лед, нейтрализуют NaHCO3, экстрагируют этилацетатом, промывают насыщенным раствором соли и сушат над MgSO4. Затем фильтруют, концентрируют и очищают на двуокиси кремния. Выход 321 мг. МС (ES+ 359) . Пример 38. 8-(8-Гидроксибицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(8-Оксобицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (25 мг) восстанавливают с использованием NaBH4 (30 мг) в МеОН при 0 С. Продукт очищают с помощью ВЭЖХ. Выход 7 мг. МС (ES+ 361). Пример 39. 2-[3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт-8 ил]малоновая кислота. 8-(8-Гидроксибицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (30 мл) растворяют в CHCl3 (5 мл). К этому раствору добавляют кислоту Meldrum (58 мг), пиперидин (10 мг) и нагревают до температуры дефлегмации в течение ночи. На следующий день, после охлаждения до комнатной температуры, смесь разбавляют этилацетатом, промывают 1 н. HCl, нас.NaHCO3, насыщенным раствором соли и сушат. Растворитель удаляют при пониженном давлении, неочищенный остаток растворяют в МеОН,охлаждают до 0 С, добавляют NaBH4 (30 мг), и смесь перемешивают в течение 15 мин. Реакционную смесь разбавляют 1 н. HCl, и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток растворяют в ТГФ (5 мл), добавляют 4 н.HCl (5 мл) и перемешивают в течение 1 дня. Реакционную смесь экстрагируют этилацетатом, промывают насыщенным раствором соли и концентрируют. Неочищенный продукт очищают с помощью ВЭЖХ. Выход 6 мг. МС (ES+ 447). Пример 40. 8-[3-(2-Диметиламиноэтиламино)бицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. К раствору 8-(3-оксобицикло[3.2.1]окт-8-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (60 мг) вCH2Cl2 (10 мл) при 0 С добавляют N1,N1-диметилэтан-1,2-диамин (100 мг), Na(OAc)3BH (100 мг) и НОАс (5 капель). Реакционную смесь перемешивают при комнатной температуре в течение ночи. На следующий день реакцию гасят водой и подкисляют 1 н. HCl. Водный слой промывают CH2Cl2, а затем нейтрализуют 1 н. KOH, экстрагируют этилацетатом (325 мл), промывают насыщенным раствором соли,сушат над MgSO4 и концентрируют. Неочищенный остаток очищают препаративной ВЭЖХ. Выход 31 мг. МС (ES+ 431). Пример 40 а. Этиловый эфир [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-иламино]уксусной кислоты. МС (ES+ 446). Пример 40b. 8-[8-(2-Диметиламиноэтиламино)бицикло[3.2.1]окт-8-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион; соединение трифторуксусной кислоты с 8-(8-оксобицикло[3.2.1]окт-3-ил)-1,3-дипропил 3,7-дигидропурин-2,6-дионом. МС (ES+ 431). Пример 40 с. Метиловый эфир 1-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[3.2.1]окт-8-ил]пирролидин-2-карбоновой кислоты; соединение с трифторуксусной кислотой. МС- 13010260 окт-8-иламино]этилацетамид; соединение с трифторуксусной кислотой. МС (ES+ 445). Пример 40i. 8-[8-(3-Диметиламинопропиламино)бицикло[3.2.1]-окт-8-ил]-1,3-дипропил-3,7 дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (ES+ 445). Пример 40j. 8-[8-(3-Морфолин-4-илпропиламино)бицикло[3.2.1]-окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (ES+ 487). Пример 40k. 8-[8-(3-Имидазол-1-илпропиламино)бицикло[3.2.1]окт-3-ил]-1,3-дипропил-3,7 дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (ES+ 468). Пример 40l. 8-8-[3-(2-Оксопирролидин-1-ил)пропиламино]бицикло[3.2.1]окт-3-ил-1,3-дипропил 3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (ES+ 468). Пример 41. 8-(8-(1,4-Диоксаспиро-4-бицикло[3.2.1]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. К раствору 1-циклопент-1-енил-пирролидина (1/01 г) и триэтиламина (0,82 г) в CH3CN (20 мл) добавляют раствор этилового эфира 3-бром-2-бромметилпропионовой кислоты (2,03 г) в CH3CN (10 мл). Затем реакционную смесь нагревают до температуры дефлегмации в течение ночи, охлаждают до комнатной температуры, добавляют 5% НОАс (5 мл), а затем нагревают до температуры дефлегмации в течение 30 мин. Смесь охлаждают до комнатной температуры, разбавляют этилацетатом, промывают 1 н.HCl, нас. NaHCO3, насыщенным раствором соли, а затем сушат. Растворитель удаляют при пониженном давлении, неочищенное вещество растворяют в этиленгликоле (30 мл), добавляют TsOH (50 мг), и смесь нагревают до температуры дефлегмации в течение 1 дня. Затем смесь охлаждают до комнатной температуры, разбавляют этилацетатом, промывают водой и насыщенным раствором соли и сушат. После концентрирования, неочищенный продукт очищают на двуокиси кремния, с получением 1,90 г вещества. Продукт, полученный в стадии 1, растворяют в ТГФ (30 мл), МеОН (30 мл), 1 н. KOH (30 мл) и нагревают при 50 С в течение ночи. На следующий день раствор охлаждают до комнатной температуры,концентрируют, подкисляют 1 н. HCl, насыщают твердым NaCl, экстрагируют этилацетатом, промывают насыщенным раствором соли и концентрируют. Продукт, полученный в стадии 2 (кеталькислота) подвергают реакции сочетания с диаминоурацилом-HCl с использованием EDC, DIEA в метиленхлориде и циклизуют с использованием KOH в смеси IPrOH-вода. MC (ES+ 403). Пример 42. [3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8 иламино]уксусная кислота. Этиловый эфир [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт 8-иламино]уксусной кислоты (пример 40 а) гидролизуют с использованием 1 н. KOH в МеОН/ТГФ. MC[3.2.1]окт-2-ен-8-карбоновой кислоты гидрируют с использованием 10% Pd/C в МеОН. В результате образуется смесь (1:3) эндо- и экзо-продуктов. Указанные продукты разделяют с помощью ВЭЖХ. Экзоизомер. МС (ES+ 418). Пример 43 а. Эндо-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-8-азабицикло[3.2.1]октан-8-карбоновой кислоты этиловый эфир. Пример 44. Эндо 8-(8-азабицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. Смесь этилового эфира экзо-3-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)-8-аза-бицикло[3.2.1]октан-8-карбоновой кислоты и этилового эфира эндо-3(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-8-аза-бицикло-[3.2.1]октан-8-карбоновой кислоты (1:3) растворяют в 10 мл CH2Cl2. Затем добавляют TMSI (1 мл) и перемешивают при комнатной температуре в течение 48 ч. После этого добавляют МеОН (3 мл), смесь растворяют в этилацетате, промывают нас. NaHCO3, промывают 10% раствором Na2S2O3, насыщенным раствором соли и сушат надMgSO4. Затем смесь фильтруют и концентрируют. После очистки ВЭЖХ получают эндо-изомер. МС- 14010260 Пример 46 а. 1,3-Дипропил-8-(8-пропиламинобицикло[3.2.1]окт-3-ил)-3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (ES+ 402). Пример 47. [3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8 ил]уксусная кислота. 2-[3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт-8-ил]малоновую кислоту превращают в нужный продукт путем кипячения с обратным холодильником в МеОН в присутствии 1 н. KOH (1 мл) в течение 2 дней. МС (ES+ 403). Пример 48. 8-(8-Гидрокси-8-метилбицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. Этиловый эфир транс-8-оксобицикло[3.2.1]октан-3-карбоновой кислоты синтезируют в соответствии с процедурой, описанной в J. Org. Chem., 1969, vol.34, page 1225-1229. Вышеуказанный кетон (6,55 г, 33 ммоль), моногидрат толуолсульфоновой кислоты (0,63 г, 3 ммоль) и этиленгликоль (20 мл) в толуоле (100 мл) кипятят с обратным холодильником с использованием ловушки Дина-Старка для азеотропного удаления воды. Через 8 ч смесь охлаждают, промывают бикарбонатом натрия, сушат над сульфатом магния и концентрируют с получением соответствующего кеталя в виде транс-изомера (7,26 г неочищенного продукта). Вышеуказанный транс-кеталь обрабатывают 1 н. NaOH в метаноле в течение ночи при 50 С. Метанол выпаривают в вакууме, подкисляют 2 н. HCl (охлажденной льдом) и экстрагируют этилацетатом. Этилацетат выпаривают с получением 6,42 г цис-8-оксобицикло[3.2.1]октан-3-карбоновой кислоты с карбонильной группой, защищенной в кеталевой форме. Вышеуказанную цис-кислоту (6,42 г, 30 ммоль), гидрохлоридную соль 5,6-диамино-1,3-дипропил 1 Н-пиримидин-2,4-диона (10,34 г, 39 ммоль), 5,6-диамино-1,3-дипропил-1 Н-пиримидин-2,4-дион (7,51 г,39 ммоль) и диэтилизопропиламин (14 мл, 80 ммоль) в метиленхлориде (200 мл) перемешивают при комнатной температуре в течение ночи. Затем смесь промывают 1 н. HCl, бикарбонатом натрия и насыщенным раствором соли, сушат над сульфатом магния и концентрируют в вакууме. Остаток кипятят с обратным холодильником в смеси 1 н. NaOH/изопропанол в течение ночи. Смесь охлаждают, подкисляют 3 н. HCl, экстрагируют этилацетатом и концентрируют. Затем остаток обрабатывают смесью 6 н. HCl/ТГФ при 75 С в течение 3 ч с получением цис-8-(8-оксо-бицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-диона в виде неочищенного продукта. После очистки колоночной хроматографией получают 4,5 г продукта (выход 40%). Вышеуказанный кетон (40 мг, 0,11 ммоль) растворяют в ТГФ (7 мл). К раствору добавляют бромид метилмагния (0,4 мл, 1 н. в ТГФ). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем реакцию гасят раствором NH4Cl. После очистки на колонке получают 25 мг указанного в заголовке соединения (выход 60%). МС (М+1 375). Пример 49. Транс-3-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1] окт-8-ил]пропионовая кислота. Хлорид (метоксиметил)трифенилфосфония (296 мг, 0,86 ммоль) в толуоле охлаждают на ледяной бане. Затем через шприц по каплям добавляют бис(триметилсилил)амид калия (2,5 мл, 0,5 М в толуоле). Смесь перемешивают при 0 С в течение 1 ч. После этого к смеси добавляют 8-(8-оксобицикло[3.2.1.]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (100 мг), и полученную смесь оставляют для нагревания до комнатной температуры и перемешивают в течение ночи. Толуол выпаривают и остаток обрабатывают 1 н. HCl в ТГФ при 70 С в течение 3 ч. Для экстракции продукта используют этилацетат. После проведения колоночной хроматографии получают 94 мг 3-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-8-карбальдегида в виде смеси цис- и транс-продуктов(выход 90%). Альдегид, полученный как описано выше, (300 мг, 0,80 ммоль) в ТГФ (10 мл) подвергают взаимодействию с метиловым эфиром (трифенил-15-фосфанилиден)уксусной кислоты (540 мг, 1,6 ммоль), и смесь кипятят с обратным холодильником в течение 16 ч. Растворитель выпаривают и после очистки колоночной хроматографией получают 300 мг метилового эфира 3-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт-8-ил]акриловой кислоты в виде смеси цис- и транспродуктов (выход 70%). После гидрирования в метаноле с использованием 10% Pd/C под давлением 40 фунт/кв.дюйм в течение 4 ч получают метиловый эфир 3-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8 ил)бицикло[3.2.1]окт-8-ил]-пропионовой кислоты. Вышеуказанный метиловый эфир гидролизуют в смеси 1 н. NaOH/метанол при 60 С в течение 30 минут. После препаративной ВЭЖХ и последующей обработки получают 19 мг указанного в заголовке соединения в виде транс-изомера. МС (М+1 417). Пример 43 а. цис-3-[3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетра-гидро-1 Н-пурин-8-ил)бицикло[3.2.1] окт-8-ил]пропионовая кислота. Цис-изомер (5 мг), полученный в вышеописанном эксперименте, представляет собой указанное в заголовке соединение. МС (М+1 417). Пример 50. Транс-3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1] октан-8-карбоновая кислота.(94 мг, 0,25 ммоль) и 2-метил-2-бутен (2,5 мл, 2,5 ммоль) в трет-бутаноле перемешивают на ледяной бане. Затем по каплям добавляют моногидрат дигидрофосфата натрия (348 мг, 2,5 ммоль) и хлорит натрия(285 мг, 2,5 ммоль) в воде. Смесь постепенно доводят до комнатной температуры и продолжают перемешивать в течение ночи. Для экстракции продукта используют этилацетат. После очистки колоночной хроматографией получают 20 мг указанного в заголовке соединения в виде транс-изомера. МС (М+1 389). Пример 51. Моно-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1] окт-8-ил]эфир фосфорной кислоты. В соответствии с процедурой, описанной для получения моно-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]эфира фосфорной кислоты (в одновременно рассматриваемой заявке), указанное в заголовке соединение получают с использованием 8-(8-гидроксибицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона в качестве исходного материала. Общий выход 70%. МС (М+1 441). Пример 52. трет-Бутиловый эфир 2-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8 ил)бицикло[3.2.1]окт-8-иламино]этилкарбаминовой кислоты; соединение с трифторуксусной кислотой. Цис-8-(8-оксобицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (50 мг, 0,12 ммоль),трет-бутиловый эфир (2-аминоэтил)карбаминовой кислоты (35 мг, 0,2 ммоль) и уксусную кислоту (2 капли) в CH2Cl2/MeOH перемешивают в течение 30 мин. К смеси добавляют цианоборогидрид натрия (0,5 мл, 1 н. в ТГФ). Реакционную смесь перемешивают в течение ночи. Смесь промывают бикарбонатом натрия и насыщенным раствором соли и концентрируют в вакууме. После препаративной ВЭЖХ получают 10 мг продукта в виде TFA-соли. МС (М+1 503). Аналогичным образом получают следующие соединения: Пример 52 а. 1,3-Дипропил-8-8-[(тиофен-2-илметил)амино]бицикло[3.2.1]окт-3-ил-3,7-дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (М+1 456). Пример 52b. 2-[3-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]окт 8-иламино]этил-амид 5-диметиламинонафталин-1-сульфоновой кислоты; соединение с трифторуксусной кислотой. МС (М+1 636). Пример 52 с. 8-8-[2-(1 Н-индол-3-ил)этиламино]бицикло[3.2.1]-окт-3-ил-1,3-дипропил-3,7 дигидропурин-2,6-дион; соединение с трифторуксусной кислотой. МС (М+1 503). Пример 52d. 8-8-[2-(5-Нитропиридин-2-иламино)этиламино]бицикло[3.2.1]-окт-3-ил-1,3-дипропил-3,7-дигидропурин-2,6-дион; МС (М+1 525). Пример 52 е. 1,3-Дипропил-8-[8-[2-пиридин-2-ил)этиламино]бицикло[3.2.1]окт-3-ил]-3,7-дигидропурин-2,6-дион; МС (М+1 465). Пример 52f. Трифторуксусная кислота; 8-8-[2-(2-метил-5-нитроимидазол-1-ил)этиламино]бицикло[3.2.1]окт-3-ил-1,3-дипропил-3,7-дигидропурин-2,6-дион; МС (М+1 513). Пример 52g. (1 Н-Бензоимидазол-2-илметил)-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]окт-8-ил]аммония трифторацетат; МС (М+1 490). Пример 53. (1 Н-Бензоимидазол-2-илметил)-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]аммония трифторацетат. Проводят процедуру восстановительного аминирования, аналогичную описанной в примере 52. Указанное в заголовке соединение синтезируют с использованием 3-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-8-карбальдегида и С-(1 Н-бензоимидазол-2-ил)метиламина в качестве исходного соединения. МС (М+1 514). Аналогичным образом получают следующие соединения. Пример 53 а. Трифторацетат [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]-(3-имидазол-1-ил-пропил)аммония; МС (М+1 482). Пример 53b. Трифторацетат (2-трет-бутоксикарбониламиноэтил)-[3-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]аммония; МС (М+1 517). Пример 53 с. Трифторацетат [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]тиофен-2-илметиламмония; МС (М+1 470). Пример 53d. Трифторацетат [2-(5-диметиламинонафталин-1-сульфониламино)этил)-[3-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]аммония; МС (М+1 650). Пример 53 е. Трифторацетат [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]-[2-(1 Н-индол-3-ил)этил]аммония; МС (М+1 517). Пример 53f. Трифторацетат [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]-[2-(5-нитропиридин-2-иламино)этил]аммония; МС (М+1 539). Пример 53g. Трифторацетат [3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-8-илметил]-(2-пиридин-2-ил-этил)аммония; МС (М+1 479). Пример 53h. Трифторацетат [2-(1 Н-бензоимидазол-2-ил)этил]-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]-окт-8-илметил]аммония; МС (М+1 518). Пример 53i. Трифторацетат [2-(1 Н-бензоимидазол-2-ил)этил]-[3-(2,6-диоксо-1,3-дипропил-2,3,6,7- 16010260 тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]-окт-8-ил]аммония; МС (М+1 504). Пример 54. 8-(3-Оксо-4-аза-трицикло[3.2.1.02,7]окт-6-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 8-(5-Оксо-трицикло [2.2.1.02,6] гепт-3-ил) -1,3-дипропил-3,7-дигидропурин-2,6-дион (150 мг) растворяют в НОАс (5 мл), добавляют H2NOSO3H (100 мг) и кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры, обрабатывают льдом, нас. NaHCO3, а затем экстрагируют этилацетатом, промывают насыщенным раствором соли и сушат над MgSO4. После концентрирования неочищенный продукт кристаллизуют из смеси ацетон/вода. Выход: 135 мг. МС (ES+ 358). Пример 55. 1,3-Дипропил-7-пирролидин-1-илметил-3,7-дигидропурин-2,6-дион. Раствор 1,3-дипропил-3,9-дигидропурин-2,6-диона (446 мг, 1,89 ммоль), 37% водного формальдегида (1,2 экв., 2,26 ммоль, 0,190 мл) и пирролидина (1,2 экв., 2,26 ммоль, 161 мг) в EtOH (25 мл) кипятят с обратным холодильником в течение 36 ч. Охлажденную реакционную смесь концентрируют в вакууме с получением твердого вещества, которое сушат в вакууме в течение 24 ч (598 мг, 99%). 1(пример 48) (522 мг, 1,63 ммоль) в ТГФ (50 мл) при -78 С добавляют н-BuLi (1,55 М в гексане, 1,2 экв.,1,3 мл). Полученная желтая смесь приобретает оранжево-красный цвет, после чего ее перемешивают при указанной температуре в течение 0,5 ч. Затем с помощью шприца в течение 20 мин добавляют раствор 8 окса-бицикло[3.2.1]окт-6-ен-3-она (1,1 экв, 222 мг, 1,79 ммоль) в ТГФ (4 мл). Смесь выдерживают 2 ч при -78 С, и оставляют на ночь для нагревания до комнатной температуры (12 ч). Реакционную смесь распределяют между насыщенным водным NH4Cl (20 мл) и EtOAc (20 мл), и водную фазу экстрагируютEtOAc (20 мл). Объединенные органические экстракты промывают насыщенным водным NaCl (20 мл),сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученное оранжевое масло очищают хроматографией на двуокиси кремния с использованием 5% МеОН в CH2Cl2 в качестве элюента, в результате чего получают прозрачное масло, которое отверждается после отстаивания (50 мг, 8%). 1 Н ЯМР (300 МГц, CDCl3); d 0,94 (соответствует т, 6 Н), 1,66 (м, 2 Н), 1,77 (м, 2 Н), 1,83 (д, 2 Н, J = 14,6 Гц), 2,77 (дд, 2 Н, J = 4,0, 14,7 Гц), 3,97 (т, 2 Н), 4,05 (т, 2 Н), 4,30 (шир. с, 1 Н), 4,91 (д, 2 Н, J = 3,7 Гц),6,59 (с, 2 Н); МС: 361 (МН+). Пример 57. 8-(8-Оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. К охлажденной льдом суспензии хлорида (метоксиметил)трифенилфосфония (1,77 ммоль, 0,61 мг) вPhMe (6 мл) добавляют раствор гексаметилдисилазида калия (0,5 M, 3,48 мл). Полученную краснооранжевую смесь перемешивают при температуре льда в течение 30 мин. К охлажденной смеси добавляют 8-окса-бицикло[3.2.1]окт-6-ен-3-она (Mann, J. et al., J. Chem. Soc. Perkin Trans I, 1992, 787) (1,61 ммоль, 0,200 г) в виде раствора в PhMe (6 мл). Реакционную смесь перемешивают в течение ночи при нагревании до комнатной температуры, а затем распределяют между насыщенным NH4Cl и Et2O. Водный слой экстрагируют Et2O и объединенные органические экстракты промывают насыщенным NH4Cl, H2O и насыщенным раствором соли, а затем сушат (MgSO4). После фильтрации и выпаривания, с последующим проведением колоночной флеш-хроматографии и элюированием градиентной смесью Et2O/CH2Cl2, получают нужный продукт (0,179 г, 73%) в виде желтой жидкости. ТСХ (двуокись кремния, смесьEt2O/гексан, 1:1, I2-визуализация), Rf (нужный продукт) = 0,59. К раствору 3-метоксиметилен-8-окса-бицикло[3.2.1]окт-6-ена (1,18 ммоль, 0,18 г) в ТГФ (1,2 мл) при комнатной температуре добавляют 1 н. HCl (1,2 мл) . Реакционную смесь перемешивают в течение ночи при комнатной температуре, а затем гасят 5% NaHCO3 и экстрагируют Et2O. Объединенные органические экстракты промывают 5% NaHCO3, насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания получают указанное в заголовке соединение (0,155 г, 95%) в виде масла. ТСХ (двуокись кремния, смесь Et2O/гексан, 1:1, I2-визуализация), Rf (нужный продукт) = 0,22. К раствору 8-оксабицикло[3.2.1]окт-6-ен-3-карбальдегида (0,434 ммоль, 0,060 г) в EtOH (2,2 мл) при комнатной температуре добавляют 1 н. NaOH (2,2 мл), а затем Ag2O (0,521 ммоль, 0,121 г). Реакционную смесь, которая слегка нагревается, быстро перемешивают в течение 1 ч. Полученную смесь фильтруют через слой целита, промывая колбу и осадок на фильтре смесью (1:1) EtOH/H2O. Фильтрат концентрируют для удаления основного количества EtOH и водный остаток экстрагируют Et2O. Эти экстракты отбрасывают. Водную фазу подкисляют (рН 4) конц. HCl и экстрагируют Et2O. Эти экстракты промывают насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания получают нужный продукт (0,0386 г, 58%) в виде масла, которое отверждается при отстаивании. В 1 Н-ЯМР-анализе, эндоизомер не был детектирован. 1 Н ЯМР (300 МГц, CDCl3): 1,67 (шир. дд, 2 Н, J = 5,88, 13,7 Гц), 1,92 (ддд, 2 Н, J=3,62, 11,6, 13,7 Гц),2,80 (тт, 1 Н, J=5,88, 11,6 Гц), 4,78 (шир. с, 2 Н), 6,16 (с, 2 Н). К раствору 8-окса-бицикло[3.2.1]окт-6-ен-3-карбсновой кислоты (0,25 ммоль, 0,0386 г), HATU (0,25 ммоль, 0,0952 г) и гидрохлорида 5,6-диамино-1,3-дипропил-1 Н-пиримидин-2,4-диона (Daly J.W. et al., J.- 17010260 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Эту смесь концентрируют с помощью насоса для удаления ДМФ. Остаток растворяют в EtOAc и промывают 1 н. HCl, 5%NaHCO3 и насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания, с последующим проведением колоночной флеш-хроматографии и элюированием градиентной смесью ТГФ/CH2Cl2 получают нужный продукт (0,067 г, 74%) в виде масла, которое отверждается после отстаивания. 1 Н ЯМР (300 МГц, CDCl3) : 0,90 (т, 3 Н, J = 7,4 Гц), 0,97 (т, 3 Н, J = 7,3 Гц), 1,53-1,72 (м, 6 Н), 1,952,03 (м, 2 Н), 3,0 (шир. м, 1 Н), 3,82-3,91 (м, 4 Н), 4,79 (шир. с, 2 Н), 6,18 (с, 2 Н). Раствор(6-амино-2,4-диоксо-1,3-дипропил-1,2,3,4-тетра-гидропиримидин-5-ил)амида 8-оксабицикло[3.2.1]окт-6-ен-3-карбоновой кислоты (0,185 ммоль, 0,067 г) в 20% NaOH (1,23 мл) и МеОН (6,2 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, а затем концентрируют для удаления МеОН. Водный остаток экстрагируютEt2O и экстракты отбрасывают. Водный слой подкисляют (рН 2-3) конц. HCl, а затем экстрагируютEtOAc. Объединенные EtOAc-экстракты промывают Н 2 О и насыщенным раствором соли и сушат(MgSO4). После фильтрации и выпаривания с последующим проведением колоночной флешхроматографии и элюированием градиентной смесью (1:1) EtOAc/CH2Cl2 получают указанное в заголовке соединение (0,037 г, 58%) в виде твердого вещества бежевого цвета. 1H ЯМР (300 МГц, CDCl3): 0,93-0,99 (м, 6 Н), 1,62-1,83 (м, 6 Н), 2,14-2,25 (м, 2 Н), 3,40-3,51 (м, 1 Н),4,05-4,10 (м, 4 Н), 4,86 (шир. с, 2 Н), 6,25 (с, 2 Н). Пример 58. 8-(8-Оксабицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. К раствору 8-(8-оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 50) (0,029 ммоль, 0,010 г) в МеОН (5 мл) добавляют 10% Pd/C (50% Н 2 О) и полученную суспензию быстро перемешивают в атмосфере Н 2 (1 атм) в течение 2 ч. Смесь фильтруют через целит, и осадок на фильтре промывают МеОН. После фильтрации и выпаривания с последующей очисткой ПТСХ и элюированием градиентной смесью (1:1) EtOAc/CH2Cl2 получают указанное в заголовке соединение (0,010 г,100%). 1 Н ЯМР (300 МГц, CDCl3) : 0,93-0,99 (м, 6 Н), 1,68-1,89 (м, 8 Н), 2,04-2,07 (м, 2 Н), 2,16-2,25 (м, 2 Н),3,34-3,42 (м, 1 Н), 4,05-4,12 (м, 4 Н), 4,50 (шир. с, 2 Н), 8,9 (шир. с, 1 Н). Пример 59. 1,3-Дипропил-7-(тетрагидропиран-2-ил)-3,7-дигидропурин-2,6-дион. Суспензию 1,3-дипропил-3,9-дигидропурин-2,6-диона (1,0 мг, 4,2 ммоль) и PPTS (0,42 ммоль, 106 мг) в 3,4-дигидропиране (15 мл) и CHCl3 (5 мл) перемешивают при комнатной температуре в течение 48 ч. Растворитель удаляют в вакууме с получением бледно-желтого твердого вещества, которое растворяют в CH2Cl2, промывают водой (220 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением белого твердого вещества (1,2 г, 89%). МС 343 (МН+). Пример 60. Диметиловый эфир 3-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-3 гидрокси-8-окса-бицикло[3.2.1]октан-6,7-дикарбоновой кислоты. Раствор LDA получают добавлением при -78 С, n-BuLi (1,8 М в гексане, 1,7 мл) к раствору iPr2NH(3,61 ммоль, 0,506 мл) в ТГФ (25 мл). После добавления LDA выдерживают при -78 С в течение 45 мин. Затем медленно, при -78 С, добавляют раствор 1,3-дипропил-7-(тетрагидропиран-2-ил)-3,7-дигидропурин-2,6-диона (пример 52) (2,78 ммоль, 0,89 г) в ТГФ (35 мл). После перемешивания еще в течение 1 ч при -78 С добавляют раствор 8-окса-бицикло[3.2.1]окт-6-ен-3-она (Mann, J. et al., J. Chem. Soc. PerkinTrans I, 1992, 787) (2,78 ммоль, 0,345 г) в ТГФ (5 мл). Реакционную смесь перемешивают в течение ночи с нагреванием до комнатной температуры. Затем реакцию гасят добавлением насыщенного NH4Cl и экстрагируют EtOAc. Объединенные органические экстракты промывают насыщенным NH4Cl, Н 2 О и насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания с последующим проведением колоночной флеш-хроматографии и элюированием градиентной смесью EtOAc/CH2Cl2, получают нужный продукт (0,55 г, 45%). МС (ESP+, 60 В): 445,07 (М+Н, 35%), 361,06 (48%), 343,05 (100%). Раствор 8-(3-гидрокси-8-оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3-дипропил-7-(тетрагидропиран-2-ил)3,7-дигидропурин-2,6-дион (0,113 ммоль, 0,050 г) и Et3N (1,13 ммоль, 0,16 мл) в МеОН (3 мл) насыщают СО, барботруемым из лекционного баллончика в течение 30 мин. Затем к реакционной смеси добавляютPdCl2 (0,023 ммоль, 0,0041 г) и CuCl2 (0,339 ммоль, 0,046 г). Реакционную смесь перемешивают в течение ночи при комнатной температуре в статической атмосфере СО. Завершенную реакцию гасят добавлением концентрированного NH4OH, разбавляют EtOAc и фильтруют через целит для удаления твердых веществ. Двухфазный фильтрат разделяют и водную фазу экстрагируют EtOAc. Объединенные органические слои промывают 1 н. HCl, насыщенным NaHCO3, Н 2 О и насыщенным раствором соли, а затем сушат(MgSO4). После фильтрации и выпаривания получают нужный продукт (0,060 г, 94%). МС (ESP+, 60 В): 563,13 (М+Н, 28%), 479,10 (100%). К раствору диметилового эфира 3-[2,6-диоксо-1,3-дипропил-7-(тетрагидропиран-2-ил)-2,3,6,7 тетрагидро-1 Н-пурин-8-ил]-3-гидрокси-8-оксабицикло-[3.2.1]октан-6,7-дикарбоновой кислоты (0,060 ммоль, 0,030 г) в смеси (1:1) ТГФ/МеОН (6 мл) добавляют 1 н. HCl (3 капли). Реакционную смесь перемешивают при комнатной температуре в течение 3 дней, а затем концентрируют досуха. Остаток очищают ПТСХ на 1 мм-слое, элюируя 20% ТГФ/CH2Cl2, и получают указанное в заголовке соединение(0,0162 г, 56%). 13 С ЯМР (100 МГц, CDCl3): 11,53 (кв.), 11,50 (кв.), 21,72 (т), 21,75 (т), 41,74 (т), 43,82 (т),- 18010260 45,85 (т), 51,02 (d), 52,64 (кв.), 70,37 (с), 77,12 (д), 107,53 (с), 149,12 (с), 151,17 (с), 156,32 (с), 159,98 (с),173,36 (с). Пример 61. 8-(3-Гидрокси-6,7-бис-гидроксиметил-8-окса-бицикло[3.2.1]окт-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион. К раствору диметилового эфира 3-[2,6-диоксо-1,3-дипропил-7-(тетрагидропиран-2-ил)-2,3,6,7 тетрагидро-1 Н-пурин-8-ил]-3-гидрокси-8-оксабицикло-[3.2.1]октан-6,7-дикарбоновой кислоты (пример 53) (0,060 ммоль, 0,030 г) в ТГФ (3 мл) добавляют раствор LiBH4 (2M, 0,050 мл). Реакционную смесь перемешивают при комнатной температуре 3 дня. Затем реакцию осторожно гасят добавлением 1 н. HCl и экстрагируют EtOAc. Объединенные органические экстракты промывают насыщенным NaHCO3 (1X) и насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания получают нужный продукт (0,028 г, 92%)в виде масла. МС (ESP+, 60 В): 529,7 (M+Na, 20%), 507,32 (М+Н, 43%), 423,20(87%), 223,08 (100%). К раствору 8-(3-гидрокси-6,7-бис-гидроксиметил-8-оксабицикло[3.2.1]окт-3-ил)-1,3-дипропил-7(тетрагидропиран-2-ил)-3,7-дигидропурин-2,6-диона (0,059 ммоль, 0,030 г) в смеси (1:1) ТГФ/МеОН (6 мл) добавляют 1 н. HCl (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи, а затем концентрируют досуха. Остаток очищают обращенно-фазовой ВЭЖХ с получением указанного в заголовке соединения (0,0024 г, 10%). МС (ESP+, 60 В): 423,15 (М+Н, 100%); МС (ESP-, 60 В): 421,01 (М-Н, 100%) . Пример 62. 4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло[3.2.1]октан-1 карбоновая кислота. С использованием процедуры, описанной в примере 50, этиловый эфир 4-оксобицикло[3.2.1]октан 1-карбоновой кислоты (Kraus, W. et al. Liebigs Ann. Chem. 1981, 10, 1826; Kraus W. et al. Tetrahedron Lett. 1978, 445; Filippini, M.-H. et al. J.Org.Chem. 1995, 60, 6872) (6,17 ммоль, 1,21 г) превращают в нужный продукт. После проведения флеш-хроматографии и элюирования смесью 10% Et2O/гексан получают чистый продукт (0,96 г, 69%) в виде жидкости (смесь изомеров E/Z). 13 С ЯМР (100 МГц, CDCl3): 14,31 (кв.),19,15 (т), 22,97 (т), 23,61 (т), 23,91 (т), 29,97 (т), 31,13 (т), 32,04 (т), 32,36 (т), 34,61 (т), 34,85 (д), 35,81 (т),43,18 (т), 43,63 (т), 50,47 (с), 50,77 (с), 59,63 (кв.), 59,69 (т), 121,04 (с), 121,44 (с), 137,18 (д), 138,16 (д),177,60 (с), 177,63 (с). С использованием процедуры, описанной в примере 50, этиловый эфир 4-метоксиметиленбицикло[3.2.1]октан-1-карбоновой кислоты (3,84 ммоль, 0,86 г) превращают в нужный продукт (0,81 г,100%). ТСХ (двуокись кремния, 20% Et2O/гексан, 20% PMA/EtOH-визуализация) Rf (нужный продукт) = 0,29. К охлажденному льдом раствору этилового эфира 4-формилбицикло[3.2.1]октан-1-карбоновой кислоты (3,85 ммоль, 0,81 г) медленно добавляют реагент Джонса (2,7 М, 1,43 мл). Реакционную смесь перемешивают при температуре льда в течение 20 мин, а затем гасят добавлением iPrOH, разбавляют Н 2 О и экстрагируют Et2O. Объединенные органические экстракты промывают Н 2 О, насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания получают нужный вязкий маслянистый продукт (0,76 г, 87%) в виде смеси аксиальной и экваториальной кислот. 13 С ЯМР (100 МГц, CDCl3): 14,16[3.2.1]октан-1,4-дикарбоновой кислоты (0,84 ммоль, 0,19 г) подвергают взаимодействию с гидрохлоридом 5,6-диамино-1,3-дипропил-1 Н-пиримидин-2,4-диона (0,84 ммоль, 0,22 г) с получением нужного продукта (0,36 г, 100%) в виде смеси аксиального и экваториального амидов. МС (ESP+, 60 В): 456,95 (М +Na, 45%), 435,00 (М+Н, 8%), 325,12 (42%), 280,05 (100%). В соответствии с процедурой, описанной в примере 50, этиловый эфир 4-(6-амино-2,4-диоксо-1,3 дипропил-1,2,3,4-тетрагидропиримидин-5-илкарбамоил)бицикло[3.2.1]октан-1-карбоновой кислоты (0,84 ммоль, 0,36 г) превращают в указанное в заголовке соединение. После флеш-хроматографии и элюирования смесью (95:5:0,1) CH2Cl2/ТГФ/AcOH достигается частичное разделение аксиального (первая полоса, 0,032 г) и экваториального (вторая полоса, 0,055 г) изомеров. МС (ESP+, 60 В): (аксиальный изомер) 389,12 (М+Н, 100%), 343,11 (15%); (экваториальный изомер) 389,12 (М+Н, 100%), 347,05 (8%). Пример 63. 4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]окт-3-ен 1-карбоновая кислота. К раствору этилового эфира 4-оксобицикло[3.2.1]октан-1-карбоновой кислоты (Kraus, W. et al. Liebigs Ann. Chem. 1981, 10, 1826; Kraus W. et al. Tetrahedron Lett. 1978, 445; Filippini, M.-H. et al. J. Org.Chem. 1995, 60, 6872) (0,51 ммоль, 0,100 г) в ТГФ (2,5 мл) при -78 С добавляют LiHMDS (1,0 М в ТГФ,0,56 мл). После выдерживания в течение 1 ч при -78 С добавляют раствор PhNTf2 (0,56 ммоль, 0,200 г) в ТГФ (1 мл). Реакционную смесь перемешивают в течение ночи с нагреванием до комнатной температуры. После завершения реакции реакционную смесь концентрируют досуха и остаток очищают путем пропускания через слой силикагеля, элюируя смесью EtOAc/CH2Cl2. После выпаривания фильтрата получают нужный продукт (0,15 г, 90%). Раствор этилового эфира 4-трифторметансульфонилоксибицикло[3.2.1]окт-3-ен-1-карбоновой ки- 19010260 слоты (0,46 ммоль, 0,15 г), гидрохлорида 5,6-диамино-1,3-дипропил-1 Н-пиримидин-2,4-диона (0,55 ммоль, 0,146 г), iPr2NEt (0,92 ммоль, 0,16 мл), Pd(OAc)2 (0,02 ммоль, 0,0046 г) и Ph3P (0,035 ммоль, 0,092 г) в ДМФ (5 мл) насыщают СО, барботируемым из лекционного баллончика в течение 30 минут. Реакционную смесь перемешивают и нагревают при 100 С в течение 6 ч в статической атмосфере СО. ДМФ удаляют с использованием насоса. Остаток растворяют в EtOAc, промывают 1 н. HCl, насыщенным NaHCO3, H2O и насыщенным раствором соли и сушат (MgSO4). После фильтрации и выпаривания с последующим проведением колоночной флеш-хроматографии и элюированием смесью 10% ТГФ/CH2Cl2, получают нужный чистый продукт (0,054 г, 27%) в виде масла. МС (ESP+, 60 В): 455,16 (M+Na, 13%), 433,1(0,125 ммоль, 0,054 г) превращают в указанное в заголовке соединение. Чистый продукт (0,0031 г, 6,5%) получают с обращенно-фазовой ВЭЖХ. МС (ESP+, 60 В): 387,06 (М+Н, 103%). Пример 64. 1,3-Дипропил-7-(тетрагидропиран-2-ил)-3,7-дигидропурин-2,6-дион. Суспензию 1,3-дипропил-3,9-дигидропурин-2,6-диона (1,0 мг, 4,2 ммоль) и PPTS (0,42 ммоль, 106 мг) в 3,4-дигидропиране (15 мл) и CHCl3 (5 мл) перемешивают при комнатной температуре в течение 48 ч. Растворитель удаляют в вакууме с получением бледно-желтого твердого вещества, которое растворяют в CH2Cl2, промывают водой (220 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением белого твердого вещества (1,2 г, 89%). МС 343 (МН+). Пример 65. Было получено 106 производных ксантина, имеющих структуры, представленные на фиг. 1. Для некоторых из этих соединений, величины Ki для крысиных и человеческих A1 аденозиновых рецепторов и для человеческих аденозиновых А 2 а рецепторов определяли в соответствии с нижеследующим протоколом анализа на связывание. Было также вычислено отношение A2a/A1. Материалы Аденозиндезаминазу и HEPES закупали у Sigma (St. Louis, МО). Среду Хэмса F12 для культивирования клеток и фетальную бычью сыворотку закупали у GIBCO Life Technologies (Gaithersburg, MD). Антибиотик G-418, 150 мМ-планшеты для культивирования Falcon и 12-луночные планшеты для культивирования Costar закупали у Fisher (Pittsburg, PA). [3 Н]СРХ закупали у DuPont-New England Nuclear Research Products (Boston, MA). Смесь антибиотиков пенициллин/стрептомицин закупали у Mediatech(Washington, DC). HEPES-буферированный раствор Хэнкса имел следующий состав: 130 мМ NaCl, 5,0 мМ Cl, 1,5 мМ CaCl2, 0,41 мМ MgSO4, 0,49 мМ Na2HPO4, 0,44 мМ KH2PO4, 5,6 мМ декстроза и 5 мМHEPES (рН 7,4). Получение мембран Крысиный рецептор A1. Мембраны получали из коры головного мозга, извлеченной у крыс сразу после эфтаназии. Ткани гомогенизировали в буфере А (10 мМ EDTA, 10 мМ Na-HEPES, рН 7,4), который содержал ингибиторы протеазы (10 мкг/мл бензамидина, 100 мкМ PMSF и 2 мкг/мл (каждого) апротинина, пепстатина и лейпептина) и центрифугировали при 20000g в течение 20 мин. Осадок ресуспендировали и дважды промывали буфером НЕ (10 мМ Na-HEPES, 1 мМ EDTA, рН 7,4, плюс ингибиторы протеазы). Конечный осадок ресуспендировали в буфере НЕ, который содержал 10% (мас./об) сахарозу и ингибиторы протеазы, и замораживали в аликвотах при -80 С. Концентрации белка определяли с использованием набора для анализа на белок, ВСА (Pierce). Человеческий рецептор A1. кДНК человеческого аденозинового рецептора A1 получали с помощью ОТ-ПЦР и субклонировали в pcDNA3 (Invitrogen). Стабильную трансфекцию клеток СНО-К 1 осуществляли, используя среду LIPOFECTAMINE-PLUS (GIBCO-BRL) и колонии отбирали на среде, содержащей 1 мг/мл G418 и скрининг проводили с помощью анализов на связывание с радиолигандом. Для получения мембранных препаратов клетки СНО-К 1, растущие как монослои на полной среде (F12+10% FCS+ 1 мг/мл G418) промывали в PBS и собирали в буфере А, который содержал ингибиторы протеазы. Клетки гомогенизировали, центрифугировали и дважды промывали буфером НЕ как описано выше. Конечный осадок хранили в аликвотах при -80 С. Анализы на связывание с радиолигандом Мембраны (50 мкг мембранного белка для крысиных A1AR и 25 мкг мембранного белка СНО-К 1 для человеческого A1AR), радиолиганды и различные концентрации конкурирующих лигандов инкубировали в тройной репликации в 0,1 мл буфера НЕ, который содержал 2 ед/мл аденозин-дезаминазы, в течение 2,5 ч при 21 С. Для анализов на конкурентное связывание с A1AR использовали радиолиганд[3 Н]DPCPX (112 Ки/ммоль от NEN, конечная концентрация: 1 мМ). Неспецифическое связывание определяли в присутствии 10 мкМ BG9719. Анализы на связывание завершали фильтрацией через стекловолоконные фильтры Whatman GF/C с использованием сборщика клеток BRANDEL. Фильтры три раза промывали 3-4 мл охлажденного на льду 10 мМ Трис-HCl, рН 7,4, и 5 мМ MgCl2 при 4 С. Фильтровальную бумагу переносили в сосуд и добавляли 3 мл сцинтилляционной смеси ScintiVersell (Fisher). Радиоактивность определяли р-счетчиком Wallac.- 20010260 Анализ данных по связыванию Для определения K1. Данные по конкурентному связыванию соответствовали модели моносайтового связывания, и по этим данным строили кривые с использованием Prizm GraphPad. Для вычисления KI исходя из величин IC50 использовали уравнение Ченга-Прусова KI = IC50/(1+[I]/KD), где KI означает аффинную константу для конкурентного связывания лиганда, [I] означает концентрацию свободного радиолиганда, a KD означает константу аффинности для радиолиганда. Для % связывания: Для анализов на моносайтовое связывание, данные были представлены как % от общего специфического связывания конкурирующего соединения при концентрации 1 мкМ: % всего связывания = 100 (специфическое связывание с 1 мкМ конкурирующего соединения/общее специфическое связывание). Результаты Для всех протестированных соединений, величины Ki для крысиного рецептора A1 составляли 0,47-1225 нМ, величины Ki для человеческого рецептора A1 составляли 12 -1000 нМ, а величины Ki для человеческого рецептора А 2 составляли 18-100000 нМ. Все соединения, за исключением одного, имели отношения A2a/A1 по крайней мере 8, большинство из них имели отношение более чем 50, значительное число - более чем 100 и по крайней мере одно соединение имело отношение выше чем 200. Пример 66. Альтернативная методика анализа. Материалы См. пример 65. Клеточная культура. Клетки СНО, стабильно экспрессирующие рекомбинантный человеческий A1AdoR (клетки СНО:A1AdoR) получали как описано в литературе (Kollias-Barker et al., J. Pharma. Exp. Ther. 281(2), 761, 1997) и культивировали так же, как клетки СНО дикого типа. Клетки СНО культивировали в виде монослоев на пластиковых чашках в среде Хэмса F-12, которая дополнительно содержала 10% фетальную бычью сыворотку, 100 ед. пенициллина G и 100 мкг стрептомицина в атмосфере 5% СО 2/95% воздуха с повышенной влажностью при 37 С. Плотность сайтов связывания с [3 Н]СРХ в клетках СНО составляла 262(n=4) фмоль/мг белка. После отделения клеток с использованием 1 мМ EDTA в HEPES-буферированном растворе Хэнкса, не содержащем Са 2+-Mg2+, эти клетки субкультивировали два раза в неделю. Для данного эксперимента использовали три различных клона клеток СНО: A1AdoR, и все результаты были подтверждены для клеток от двух или трех клонов. Плотность A1AdoR в этих клетках составляла 4000-8000 фмоль/мг белка, как было определено в анализе на специфическое связывание с [3 Н]СРХ. Связывание с радиолигандом Клетки СНО, выращенные на 150 мм-чашках для культивирования, промывали HEPESбуферированным раствором Хэнкса, а затем удаляли с помощью скребка-сборщика клеток и гомогенизировали в охлажденном льдом 50 мМ Трис-HCl, рН 7,4. Клеточные мембраны осаждали посредством центрифугирования клеточного гомогената при 48000g в течение 15 минут. Мембранный осадок дважды промывали посредством ресуспендирования в свежем буфере и центрифугирования. Конечный осадок ресуспендировали в небольшом объеме 50 мМ Трис-HCl, рН 7,4, и хранили в аликвотах 1 мл при-80 С вплоть до использования в анализах. Для определения плотности A1AdoR в мембранах клеток СНО, 100 мкл-аликвоты мембран (5 мкг белка) инкубировали в течение 2 ч при 25 С с 0,15-20 нМ [3 Н]СРХ и с аденозин-дезаминазой (2 ед/мл) в 100 мкл 50 мМ Трис-HCl, рН 7,4. Инкубирование прекращали путем разведения 4 мл охлажденного льдом 50 мМ Трис-HCl, немедленно собирая мембраны на стекловолоконные фильтры (SchleicherSchuell, Keene, NH) посредством вакуумной фильтрации (Brandel, Gaithersburg, MD). Фильтры три раза быстро промывали охлажденным льдом буфером для удаления несвязанного радиолиганда. Фильтровальные диски, содержащие иммобилизованный связанный с мембранами радиолиганд, помещали в 4 мл сцинтилляционной смеси Scintiverse BD (Fisher), и определяли радиоактивность с использованием жидкостного сцинтилляционного счетчика. Для определения неспецифического связывания с [3 Н]СРХ, мембраны инкубировали как описано выше, и в буфер для инкубирования добавляли 10 мкМ СРТ. Неспецифическое связывание определяли как связывание [3 Н]СРХ в присутствии 10 мкМ СРТ. Специфическое связывание радиолиганда с A1AdoR определяли путем вычитания неспецифического связывания из общего связывания. Было обнаружено, что неспецифическое связывание линейно возрастает с возрастанием концентрации [3 Н]СРХ. Анализ с тремя повторностями проводили для каждой тестируемой концентрации [3 Н]СРХ. Для определения аффинностей антагонистов A1AdoR для человеческого рекомбинантного A1AdoR,экспрессированного в клетках СНО, оценивали связывание 2 нм [3 Н]СРХ в присутствии возрастающих концентраций антагониста. Аликвоты мембран клеток СНО (100 мкл: 5 мкг белка), [3 Н]СРХ, антагониста(0,1 нМ-100 мкМ) и аденозин-дезаминазы (2 ед./мл) инкубировали в течение 3 часов при 25 С в 200 мкл 50 мМ Трис-HCl-буфера (рН 7,4). Анализы завершали как описано выше. Анализ данных Параметры связывания (т.е., Bmax, KD, IC50, Ki и коэффициенты Хилла) определяли с использованием программы для анализа на связывание с радиолигандами, LIGAND 4.0 (Elsevier-Biosoft). Большинство- 21010260 протестированных соединений имели отношения A2a/A1, составляющие по крайней мере 20, значительное число из них превышало 50, а некоторые превышали 100. Другие варианты осуществления изобретения Следует отметить, что несмотря на приведенное выше подробное описание настоящего изобретения, указанное описание носит лишь иллюстративный характер и не ограничивает объема настоящего изобретения, который определен в представленной ниже формуле изобретения. Другие аспекты, преимущества и модификации входят в объем нижеследующей формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение и его фармацевтически приемлемые соли формулы где R1 и R2 независимо выбраны из алкила;R3 представляет бициклическую или трициклическую группу, выбранную из группы, состоящей из где указанная бициклическая или трициклическая группа является незамещенной либо замещена одним или несколькими заместителями, выбранными из группы, состоящей из(а) алкила и алкенила; и где указанные алкил и алкенил являются либо незамещенными, либо замещены одним или несколькими заместителями, выбранными из группы, состоящей из алкокси, алкоксикарбониламиноалкиламино, фенилалкоксикарбонила, нафтилалкоксикарбонила, карбокси, диалкиламино, аминоалкиламино, гетероциклилалкиламино, гидрокси и нитрозамещенного гетероциклиламиноалкиламино;(b) ациламиноалкиламино, алкениламино, алкоксикарбонила, алкоксикарбонилалкиламино, алкоксикарбониламиноацилокси, алкоксикарбониламиноалкиламино, алкиламино, амино, аминоацилокси,карбокси, карбоксиалкокси, карбоксиалкиламино, диалкиламиноалкиламино, гетероциклила, гетероциклилалкиламино, гидрокси, оксо, фосфата, нитрозамещенного гетероциклиламиноалкиламино и оксозамещенного гетероциклил алкиламино; где каждая из указанных групп: алкила может содержать от 1 до 6 атомов углерода в цепи и быть прямой или разветвленной,алкенила может содержать от 3 до 6 атомов углерода в цепи и быть прямой или разветвленной,гетероциклила представляет собой 5-9-членную ароматическую или неароматическую карбоциклическую кольцевую систему, в которой один или два атома углерода кольца независимо замещены азотом,кислородом или серой; либо, когда R1 и R2 каждый означают группу СН 3-СН 2-СН 2-, R3 представляет собой трициклическую группу, выбранную из следующих: а также соединение или его фармацевтически приемлемую соль формулы 2. Соединение по п.1, где указанное соединение принимает форму, выбранную из группы, состоящей из ахирального соединения, рацемата, оптически активного соединения, чистого диастереомера,смеси диастереомеров или фармацевтически приемлемой аддитивной соли. 3. Соединение по п.1, где каждый из R1 и R2 представляет н-пропил. 4. Соединение по п.1, где R3 выбран из группы, состоящей из и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, гидроксиалкила, карбокси, карбоксиалкенила, карбоксиалкила, аминоацилокси, карбоксиалкокси, диалкиламиноалкенила и диалкиламиноалкила. 5. Соединение по п.1, где R3 представляет и замещен одним или несколькими заместителями, выбранными из гидрокси, алкенила, карбоксиалкенила, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила. 6. Соединение по п.5, где R3 замещен заместителями, выбранными из группы, состоящей из гидрокси, гидроксиалкила, диалкиламиноалкенила и диалкиламиноалкила. 7. Соединение по п.1, которое представляет собой 8-(5-гидрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3 дипропил-3,7-дигидропурин-2,6-дион. 8. Соединение по п.1, которое представляет собой 8-(5-гидроксиметилтрицикло[2.2.1.02,6]гепт-3 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 9. Соединение по п.1, которое представляет собой 8-[5-(3-диметиламинопропилиден)трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. 10. Соединение по п.1, которое представляет собой 8-[5-(3-диметиламинопропил)трицикло и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси,алкила, карбокси, карбоксиалкила, диалкиламиноалкиламино, алкоксикарбонилалкиламино, карбоксиалкиламино, гетероциклила, алкениламино, амино, алкиламино, гетероциклилалкиламино, фосфата, гетероциклиламиноалкиламино и гетероциклиламиноалкил аминоалкила. 12. Соединение по п.1, где R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси,карбокси, карбоксиалкила и гидроксиалкила. 13. Соединение по п.1, которое представляет собой 4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)-бицикло[3.2.1]октан-1-карбоновую кислоту. 14. Соединение по п.1, где R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкила,гидрокси, карбокси, карбоксиалкила. 15. Соединение по п.1, которое представляет собой 8-(4-гидроксибицикло[3.2.1]окт-6-ил)-1,3 дипропил-3,7-дигидропурин-2,6-дион.- 23010260 16. Соединение по п.1, которое представляет собой 8-(4-оксобицикло[3.2.1]окт-6-ил)-1,3-дипропил 3,7-дигидропурин-2,6-дион. 17. Соединение по п.1, где R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из карбокси,гидрокси, диалкиламиноалкиламино и замещенного гетероциклиламиноалкиламиноалкила. 18. Соединение по п.1, которое представляет собой 8-[8-(2-диметиламиноэтиламино)бицикло[3.2.1]окт-3-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. 19. Соединение по п.1, которое представляет собой 8-(8-гидроксибицикло[3.2.1]окт-3-ил]-1,3 дипропил-3,7-дигидропурин-2,6-дион. 20. Соединение по п.1, где R3 представляет и замещен одним или несколькими карбокси и гидрокси заместителями. 21. Соединение по п.1, которое представляет собой 8-(3-гидроксибицикло[3.2.1]окт-8-ил]-1,3 дипропил-3,7-дигидропурин-2,6-дион. 22. Соединение по п.4, где R3 выбран из группы, состоящей из и замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидроксиалкила, гидрокси и алкоксикарбонила. 23. Соединение по п.1, которое представляет собой 8-(8-оксабицикло[3.2.1]окт-6-ен-3-ил)-1,3 дипропил-3,7-дигидропурин-2,6-дион. 24. Соединение по п.1, где R3 представляет и замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкоксикарбонилалкила. 25. Соединение по п.1, которое представляет собой 8-(2-оксо-3-азабицикло[3.2.1]окт-8-ил)-1,3 дипропил-3,7-дигидропурин-2,6-дион. 26. Лекарственная композиция, включающая соединение по п.1 вместе с подходящим наполнителем. 27. Способ лечения индивидуума, страдающего состоянием, характеризующимся повышенной концентрацией аденозина и/или повышенной чувствительностью к аденозину, предусматривающий введение указанному индивидууму эффективного количества соединения по п.1 в качестве антагониста аденозина. 28. Способ по п.27, где указанное состояние выбрано из нарушений работы сердца и кровообращения, дегенеративных расстройств центральной нервной системы, заболеваний дыхательных путей, заболеваний, при которых показано лечение диуретиками, болезни Паркинсона, депрессии, травматического поражения головного мозга, постинсультного неврологического расстройства, угнетения дыхания, травмы головного мозга у новорожденных, дислексии, гиперактивности, кистозного фиброза, циррозных асцитов, апное новорожденных, почечной недостаточности, диабета, астмы и состояний, сопровождающихся отеками. 29. Способ по п.27, где указанное состояние выбрано из застойной сердечной недостаточности или дисфункции почек. 30. Способ получения соединений по п.1, включающий стадии:b) введения защиты указанного ксантина в N7-положении;
МПК / Метки
МПК: C07D 473/06, A61P 9/00, A61K 31/505, A61K 31/52
Метки: использования, аденозиновых, получения, рецепторов, антагонисты, способы
Код ссылки
<a href="https://eas.patents.su/28-10260-antagonisty-adenozinovyh-receptorov-i-sposoby-ih-polucheniya-i-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты аденозиновых рецепторов и способы их получения и использования</a>
Предыдущий патент: Система и способ для автоматического создания и/или обработки заказа на фотомаску с использованием системы профилирования сценариев
Следующий патент: Производные имидазопиридина как ингибиторы индуцируемой no – синтазы
Случайный патент: Замещенные триазольные производные как модуляторы гамма-секретазы












