Антагонисты рецептора гонадотропин-рилизинг-фактора и способы их применения
Номер патента: 17029
Опубликовано: 28.09.2012
Авторы: Роуботтом Мартин, Чжу Юнь-Фэй, Лоу Ричард, Эшвик Нейл, Битон Грэхэм, Цзян Ваньлун, Эвинг Тодд, Мори Вилли, Чжао Лижэнь, Кун Тимоти Ричард, Смит Николь, Уэйд Уоррен, Чэнь Ми
Формула / Реферат
1. Соединение, имеющее следующую структуру (I):
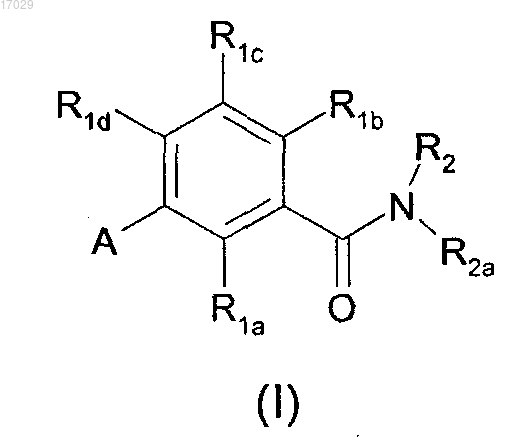
и его стереоизомеры, сложные эфиры, сольваты и фармацевтически приемлемые соли,
где А представляет собой пиридил, фенил, хинолинил, тиенопиримидинил или 2-оксопиримидинил, где указанный пиридил, фенил, хинолинил, тиенопиримидинил или 2-оксопиримидинил замещен 0-5 R4;
R1a представляет собой Н, галоген, С1-4алкил, метокси, этокси или трифторметил;
R1b и R1c являются одинаковыми или различными и независимо представляют собой Н, галоген, гидрокси, галоген-С1-4алкил, -C1-6алкил-(R5)р, -O-С1-6алкил-(R5)p, -С1-6алкил-O-С1-6алкил-(R5)p, -NR7-С1-6алкил-(R5)p или -S(О)m-С1-6алкил-(R5)p;
R1d представляет собой Cl, F, метил, CF3 или циано;
R2 представляет собой -С1-4алкил-(R5)р;
R2a представляет собой фенил, замещенный 0-4 R3, гетероарил, замещенный 0-4 R3, С1-6алкил, замещенный 0-4 R3, арил-С1-4алкил, замещенный 0-4 R3, или гетероарил-С1-4алкил, замещенный 0-4 R3, где гетероарил представляет собой 5-10-членное ароматическое гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из N, О и S;
R3 в каждом случае независимо представляет собой галоген, циано, галоген-С1-4алкил, R5, -С1-6алкил-(R5)p,
-С1-6алкил-O-C1-6алкил-(R5)р, -O-С1-6алкил-(R5)p, -NR7-C1-6алкил-(R5)p, -S(O)m-C1-6алкил-(R5)р, -O-C1-6алкил-NR7-C1-6алкил-(R5)p, гетероцикл-(R5)p;
R4 в каждом случае независимо представляет собой галоген, С1-6алкил, галоген-С1-4алкил, С1-6алкокси, гидрокси, циано, тио-С1-6алкил, -C(O)NR7R8 или 5-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из N, О и S;
R5 в каждом случае независимо представляет собой Н, гидрокси, -ОС(О)-C1-6алкил, -ОС(О)O-С1-6алкил,
-ОС(О)-С1-6алкил-NR7R8, -COOR6, -C(O)NR7R8, -NR7C(О)NR7R8, -S(O)2NR9R9, -S(O)m-C1-4алкил, -NR7R8,
С1-6алкокси, -О-гетероцикл или гетероцикл, где указанный гетероцикл и указанный -О-гетероцикл замещены 0-4 группами, выбранными из галогена, C1-6алкила, С1-4галогеналкила, гидрокси, оксо, тио, -NH2, -S(О)2С1-4алкила и -СООН;
R6 в каждом случае независимо представляет собой Н, С1-4алкил, С1-4алкил-O-С(О)-С1-6алкил или С1-4алкил-О-С(О)-O-C1-6алкил;
R7 в каждом случае независимо представляет собой Н, C1-4алкил, гидрокси или гетероцикл, где указанный гетероцикл замещен 0-4 группами, выбранными из галогена, С1-6алкила, гидрокси, кето, -NH2 и -СООН;
R8 в каждом случае независимо представляет собой Н, С1-4алкил, галоген-С1-4алкил, -С(О)-С1-4алкил, -С(О)-галоген-С1-4алкил, -S(О)m-галоген-С1-4алкил или -S(О)m-С1-4алкил;
R9 в каждом случае независимо представляет собой Н, C1-4алкил или -С(О)С1-4алкил;
где гетероцикл представляет собой 5-7-членное моноциклическое или 7-14-членное полициклическое гетероциклическое кольцо, которое является насыщенным, ненасыщенным или ароматическим и которое содержит от 1 до 4 гетероатомов, выбранных из N, О и S;
m равно 0-2;
р в каждом случае независимо равно 1-3.
2. Соединение по п.1, имеющее следующую структуру (Ia):
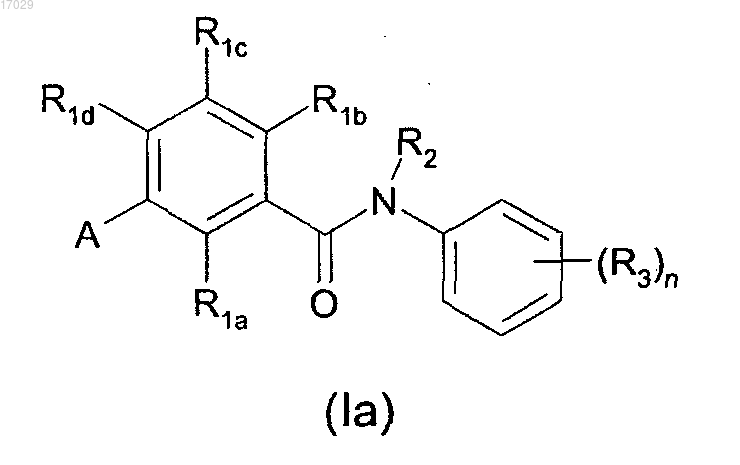
или его стереоизомер, сложный эфир, сольват или фармацевтически приемлемая соль,
где А представляет собой пиридил, фенил, хинолинил, тиенопиримидинил или 2-оксопиримидинил, где указанный пиридил, фенил, хинолинил, тиенопиримидинил или 2-оксопиримидинил замещен 0-4 R4;
R1a представляет собой Н, галоген, С1-4алкил, метокси, этокси или трифторметил;
R1b и R1c являются одинаковыми или различными и независимо представляют собой Н, галоген, гидрокси, галоген-С1-4алкил, -С1-6алкил-(R5)р, -O-C1-6алкил-(R5)р, -С1-6алкил-О-С1-6алкил-(R5)p, -NR7-C1-6алкил-(R5)р или -S(О)m-С1-6алкил-(R5)p;
R1d представляет собой Cl, метил, CF3 или циано;
R2 представляет собой С1-4алкил-(R5)р;
R3 в каждом случае независимо представляет собой галоген, галоген-С1-4алкил, гидрокси, -С1-6алкил-(R5)р,
-С1-6алкил-О-С1-6алкил-(R5)p, -O-С1-6алкил-(R5)р, -NR7-С1-6алкил-(R5)p, -S(O)m-C1-6алкил-(R5)p, -CO2R6,
-С(О)NR7R8;
R4 в каждом случае независимо представляет собой галоген, C1-6алкил, галоген-С1-4алкил, С1-4алкокси, гидрокси, циано, тио-С1-4алкил, -C(O)NR7R8 или 5-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из N, О и S;
R5 в каждом случае независимо представляет собой Н, гидрокси, -ОС(О)-С1-6алкил, -ОС(О)О-С1-6алкил,
-ОС(О)-С1-6алкил-NR7R8, -COOR6, -C(O)NR7R8, -S(O)2NR9R9, -S(О)mC1-4алкил, -NR7R8, C1-6алкокси или гетероцикл, выбранный из группы, состоящей из
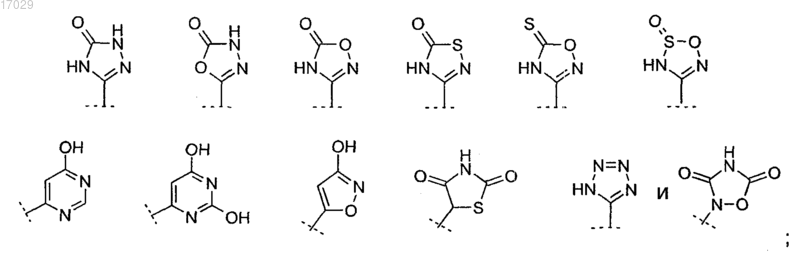
R6 в каждом случае независимо представляет собой Н, С1-4алкил, С1-4алкил-O-С(О)-С1-6алкил или С1-4алкил-O-С(О)-O-С1-6алкил;
R7 представляет собой Н, С1-4алкил или гидрокси;
R8 представляет собой Н, С1-4алкил, -С(О)-С1-4алкил или -S(О)m-С1-4алкил;
R9 в каждом случае независимо представляет собой Н, С1-4алкил или -С(О)С1-4алкил;
m равно 0-2;
n равно 0-4;
р в каждом случае независимо равно 1-3.
3. Соединение по п.1, где А представляет собой пиридил, замещенный 0-4 R4.
4. Соединение по п.3, где А представляет собой 2-пиридил, замещенный 0-4 R4.
5. Соединение по п.3, где А представляет собой 3-пиридил, замещенный 0-4 R4.
6. Соединение по п.1, где А представляет собой фенил, замещенный 0-4 R4.
7. Соединение по п.1, где А представляет собой хинолинил, замещенный 0-4 R4.
8. Соединение по п.1, где А представляет собой тиенопиримидинил, замещенный 0-4 R4.
9. Соединение по п.1, где А представляет собой 2-оксопиримидинил, замещенный 0-4 R4.
10. Соединение по п.1, где R1a и R1c представляют собой Н.
11. Соединение по п.1, где R1b представляет собой -С1-6алкил-(R5)р или -О-С1-6алкил-(R5)р, р равно 1 и R5 представляет собой Н, гидрокси или -COOR6.
12. Соединение по п.1, где R2a представляет собой фенил, замещенный 1 или 2 R3, где один из R3 представляет собой -О-С1-6алкил-(R5)р, р равно 1 и R5 представляет собой Н, гидрокси или -COOR6.
13. Соединение по п.1, где R3 представляет собой -С1-6алкил-(R5)р, -С1-6алкил-О-С1-6алкил-(R5)p или -О-С1-6 алкил-(R5)р.
14. Соединение по п.1, которое представляет собой
3-(2-{[4-хлор-3-(6-хлор-4-метилпиридин-3-ил)бензоил]метиламино}фенокси)пропионовую кислоту,
3-(2-{[4-хлор-3-(4-метил-6-трифторметилпиридин-3-ил)бензоил]метиламино}фенокси)пропионовую кислоту,
3-(2-{[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино}фенокси)пропионовую кислоту,
3-(2-{[4-хлор-3-(4-метил-6-трифторметилпиридин-3-ил)бензоил]метиламино}-3-метилфенокси)пропионовую кислоту,
3-(2-{[4-хлор-3-(6-циано-4-метилпиридин-3-ил)бензоил]метиламино}-3-метилфенокси)пропионовую кислоту,
3-(2-{[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино}-3-метилфенокси)пропионовую кислоту,
4-(2-{[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино}фенил)масляную кислоту,
метиловый эфир 2-{[4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-метоксибензоил]метиламино}бензойной кислоты,
4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-N-(2-фтор-6-метоксифенил)-2-метокси-N-метилбензамид,
или его фармацевтически приемлемая соль.
15. Соединение по п.1, которое представляет собой
4-{5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метокси-6-метилфенил)метилкарбамоил]фенокси}масляную кислоту,
3-{5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метокси-6-метилфенил)метилкарбамоил]фенокси}пропионовую кислоту,
4-{5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]фенокси}масляную кислоту,
4-[5-хлор-2-[(5-хлор-2-метоксифенил)метилкарбамоил]-4-(4-циано-6-трифторметилпиридин-3-ил)фенокси]масляную кислоту,
метиловый эфир 2-{[2-(3-карбоксипропокси)-4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино}бензойной кислоты,
4-{5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[метил(2-оксазол-5-илфенил)карбамоил]фенокси}масляную кислоту,
4-{5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-фтор-6-метоксифенил)метилкарбамоил]фенокси}масляную кислоту,
4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-N-(2-метоксифенил)-N-метил-2-[3-(2Н-тетразол-5-ил)пропокси]бензамид,
4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)-N-метил-N-{2-[2-(1Н-тетразол-5-ил)этокси]фенил}бензамид,
или его фармацевтически приемлемая соль.
16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или разбавитель.
17. Применение соединения по любому из пп.1-15 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения эндометриоза, фибромы матки, синдрома поликистозных яичников, дисменореи, диспареунии, меноррагии, несвязанной с менструацией боли в области таза, болезненности в области таза, индурации, общих расстройств менструального цикла, преждевременного угасания функции яичников вследствие химиотерапии или ранней менопаузы, гирсутизма, преждевременного полового созревания, гонадной стероид-зависимой неоплазии, злокачественной опухоли простаты, злокачественной опухоли молочной железы, злокачественной опухоли яичников, гонадотропной аденомы гипофиза, аденомиоза, апноэ во время сна, синдрома раздраженной толстой кишки, предменструального синдрома, доброкачественной гипертрофии предстательной железы, симптомов нижних мочевыводящих путей, отсутствия беременности или бесплодия.
18. Применение соединения по любому из пп.1-15 или его фармацевтически приемлемой соли в качестве лекарственного средства для лечения эндометриоза, фибромы матки, синдрома поликистозных яичников, дисменореи, диспареунии, меноррагии, несвязанной с менструацией боли в области таза, болезненности в области таза, индурации, общих расстройств менструального цикла, преждевременного угасания функции яичников вследствие химиотерапии или ранней менопаузы, гирсутизма, преждевременного полового созревания, гонадной стероид-зависимой неоплазии, злокачественной опухоли простаты, злокачественной опухоли молочной железы, злокачественной опухоли яичников, гонадотропной аденомы гипофиза, аденомиоза, апноэ во время сна, синдрома раздраженной толстой кишки, предменструального синдрома, доброкачественной гипертрофии предстательной железы, симптомов нижних мочевыводящих путей, отсутствия беременности или бесплодия.
19. Применение по п.18 в качестве лекарственного средства для лечения эндометриоза, дисменореи, синдрома поликистозных яичников или фибромы матки.
20. Применение по п.18 в качестве лекарственного средства для лечения доброкачественной гипертрофии предстательной железы, симптомов нижних мочевыводящих путей, миомы матки, рака предстательной железы, рака матки, рака молочной железы или гонадотропной аденомы гипофиза.
21. Применение соединения по любому из пп.1-15 или его фармацевтически приемлемой соли для лечения эндометриоза, фибромы матки, синдрома поликистозных яичников, дисменореи, диспареунии, меноррагии, несвязанной с менструацией боли в области таза, болезненности в области таза, индурации, общих расстройств менструального цикла, преждевременного угасания функции яичников вследствие химиотерапии или ранней менопаузы, гирсутизма, преждевременного полового созревания, гонадной стероид-зависимой неоплазии, злокачественной опухоли простаты, злокачественной опухоли молочной железы, злокачественной опухоли яичников, гонадотропной аденомы гипофиза, аденомиоза, апноэ во время сна, синдрома раздраженной толстой кишки, предменструального синдрома, доброкачественной гипертрофии предстательной железы, симптомов нижних мочевыводящих путей, отсутствия беременности или бесплодия.
Текст
Предложены антагонисты рецептора GnRH, которые применяют в лечении ряда расстройств,связанных с половыми гормонами, как у мужчин, так и у женщин. Соединения по настоящему изобретению имеют структуру Битон Грэхэм, Чэнь Ми, Кун Тимоти Ричард, Эвинг Тодд, Цзян Ваньлун, где R1a, R1b, R1c, R1d, R2, R2a и А являются такими, как определено в настоящем документе, включая их стереоизомеры, сложные эфиры, сольваты и фармацевтически приемлемые соли. Также описаны композиции, содержащие соединение по настоящему изобретению в сочетании с фармацевтически приемлемым носителем, а также способы, относящиеся к их применению для антагонистического воздействия на гонадотропин-рилизинг-фактор пациента, нуждающегося в этом. 017029 Область техники, к которой относится изобретение Настоящее изобретение в основном относится к антагонистам рецептора гонадотропин-рилизингфактора (GnRH) и к способам лечения расстройств путем введения таких антагонистов теплокровным животным. Описание уровня техники Гонадотропин-рилизинг-фактор (GnRH), также известный как рилизинг фактор лютеинизирующего гормона (LHRH), представляет собой декапептид (pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2), который играет важную роль в репродукции человека. GnRH секретируется в гипоталамусе и действует на гипофиз, стимулируя биосинтез и высвобождение лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH). LH, высвобождающийся из гипофиза, отвечает за регуляцию продукции стероидов половыми железами как у мужчин, так и у женщин, при этом FSH регулирует сперматогенез у мужчин и развитие фолликулов у женщин. Благодаря своей биологической важности, синтетическим антагонистам и агонистам GnRH уделяли большое внимание, в частности применительно к раку предстательной железы, раку молочной железы,эндометриозу, лейомеоме матки (фиброма), раку яичников, гиперплазии простаты, вспомогательной репродуктивной терапии и преждевременному половому созреванию (The Lancet 358:1793-1803, 2001; Mol.Cell. Endo. 166:9-14, 2000). Например, для лечения таких расстройств использовали пептидные агонистыGnRH, такие как лейпрорелин (pGlu-His-Trp-Ser-Tyr-d-Leu-Leu-Arg-Pro-NHEt). Функция таких агонистов проявляется в связывании с рецептором GnRH в гипофизе, тем самым стимулируя синтез и высвобождение гонадотропинов. Длительное применение агонистов GnRH истощает гонадотропины и затем ингибирует рецептор, что приводит к супрессии стероидных гормонов после некоторого периода времени (например, порядка 2-3 недель после начала длительного применения). В отличие от этого антагонисты GnRH, как полагают, подавляют гонадотропины и соответственно в течение последних двух десятилетий им уделяли большое внимание. В настоящее время некоторыми наиболее важными препятствиями для клинического применения таких антагонистов была их относительно низкая биодоступность и вредные побочные эффекты, вызванные высвобождением гистамина. Тем не менее, сообщалось о некоторых пептидных антагонистах, обладающих свойствами низкого высвобождения гистамина, хотя их все равно требуется доставлять способами, обеспечивающими замедленное высвобождение (такими как подкожная инъекция или интраназальный спрей) вследствие ограниченной биодоступности. Учитывая ограничения, связанные с пептидными GnRH антагонистами, был предложен ряд непептидных соединений. Недавно опубликованные заявки РСТ, которые описывают соединения и их использование в качестве GnRH антагонистов, включают WO 00/69859, WO 01/29044, WO 01/55119,WO 03/013528, WO 03/011870, WO 03/011841, WO 03/011839, WO 03/011293, WO 05/007164,WO 05/007165 и WO 05/007633. Несмотря на то что были проведены существенные исследования в этой области, остается потребность в эффективных низкомолекулярных антагонистах рецептора GnRH. Также существует потребность в фармацевтических композициях, содержащих такие антагонисты рецептора GnRH, а также способах,относящихся к их применению для лечения, например, расстройств, связанных с половыми гормонами. Настоящее изобретение отвечает этим потребностям и обеспечивает другие соответствующие преимущества. Сущность изобретения Вкратце, настоящее изобретение в основном относится к антагонистам рецептора гонадотропинрилизинг-фактора (GnRH), a также к способам их получения и применения и к фармацевтическим композициям, содержащим их. Более конкретно, антагонисты рецептора GnRH по настоящему изобретению представляют собой соединения, имеющие следующую общую структуру (I): включая стереоизомеры, сложные эфиры, сольваты и фармацевтически приемлемые соли, где R1a,R1b, R1c, R1d, R2, R2a и А являются такими, как определено ниже. Антагонисты рецептора GnRH по настоящему изобретению могут широко применяться в терапии и могут применяться для лечения ряда расстройств, связанных с половыми гормонами, как у мужчин, так и у женщин, а также млекопитающих вообще (также называемых в настоящем документе как "пациент"). Например, такие расстройства включают эндометриоз, фиброму матки, поликистоз яичников, дисменорею, диспареунию, меноррагию, несвязанные с менструацией боли в области таза, болезненность в области таза, индурацию, общие расстройства менструального цикла, преждевременное угасание функции яичников вследствие химиотерапии или ранняя менопауза, гирсутизм, преждевременное половое созре-1 017029 вание, гонадная стероид-зависимая неоплазия, такая как злокачественные опухоли простаты, молочной железы и яичников, гонадотропную аденому гипофиза, аденомиоз, апноэ во время сна, синдром раздраженной толстой кишки, предменструальный синдром, доброкачественную гипертрофию предстательной железы, симптомы нижних мочевыводящих путей (LUTS), отсутствие беременности и бесплодие (например, с помощью репродуктивной терапии, такой как in vitro фертилизация). Соединения по настоящему изобретению могут также быть использованы в качестве вспомогательного средства для лечения дефицита гормона роста и невысокого роста, для лечения системной красной волчанки. Также соединения могут быть использованы в сочетании с андрогенами, эстрогенами, прогестеронами, антиэстрогенами, антипрогестогенами, ингибитором ангиотензин-I-превращающего фермента, антагонистами ангиотензин II-рецептора, ингибиторами ренина, бифосфонатами и другими средствами для лечения и/или профилактики расстройств метаболизма кальция, фосфата и костей, ингибиторами ароматазы, анальгетиками, такие как нестероидные противовоспалительные препараты (NSAID), другими ингибиторами СОХ ингибиторы и анти-NGF средствами. Способы по настоящему изобретению включают введение млекопитающему эффективного количества антагониста рецептора GnRH предпочтительно в форме фармацевтической композиции. Таким образом, в дополнительном варианте осуществления описанные фармацевтические композиции содержат один или несколько антагонистов рецептора GnRH по настоящему изобретению в сочетании с фармацевтически приемлемым носителем и/или разбавителем. Эти и другие аспекты изобретения будут очевидны со ссылкой на следующее подробное описание. С этой целью в настоящем документе приведены различные ссылки, более подробно описывающие данные известные из уровня техники способы, соединения и/или композиции, и каждая ссылка приведена в описании в качестве ссылки в полном объеме. Подробное описание Как отмечено выше, настоящее изобретение в основном относится к соединениям, применяемым в качестве антагонистов рецептора гонадотропин-рилизинг-фактора (GnRH). Соединения по настоящему изобретению имеют следующую структуру (I):R1b и R1c являются одинаковыми или различными и независимо представляют собой Н, галоген,гидрокси,галоген-С 1-4 алкил,-С 1-6 алкил-(R5)p,-O-C1-6 алкил-(R5)p,-С 1-6 алкил-O-С 1-6 алкил-(R5)p,-NR7-C1-6 алкил-(R5)р или -S(O)m-С 1-6 алкил-(R5)р;R2a представляет собой фенил, замещенный 0-4 R3, гетероарил, замещенный 0-4 R3, С 1-6 алкил, замещенный 0-4 R3, арил-С 1-4 алкил, замещенный 0-4 R3, или гетероарил-С 1-4 алкил, замещенный 0-4 R3, где гетероарил представляет собой 5-10-членное ароматическое гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из N, О и S;R3 в каждом случае независимо представляет собой галоген, циано, галоген-С 1-4 алкил, R5,-С 1-6 алкил-(R5)p, -С 1-6 алкил-O-С 1-6 алкил-(R5)р, -O-C1-6 алкил-(R5)р, -NR7-С 1-6 алкил-(R5)p, -S(O)m-C1-6 алкил(R5)p, -O-С 1-6 алкил-NH7-С 1-6 алкил-(R5)p, гетероцикл-(R5)р;R4 в каждом случае независимо представляет собой галоген, С 1-6 алкил, галоген-С 1-4 алкил,С 1-6 алкокси, гидрокси, циано, тио-С 1-6 алкил, -C(O)NR7R8 или 5-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из N, О и S;R5 в каждом случае независимо представляет собой Н, гидрокси, -ОС(О)-С 1-6 алкил,-ОС(О)O-С 1-6 алкил, -ОС(О)-С 1-6 алкил-NR7R8, -COOR6, -C(O)NR7R8, -NR7C(О)NR7R8,-S(O)2NR9R9, -S(O)mC1-4 алкил, -NR7R8, С 1-6 алкокси, -О-гетероцикл или гетероцикл, где указанный гетероцикл и указанныйR6 в каждом случае независимо представляет собой Н, С 1-4 алкил, С 1-4 алкил-O-С(О)-С 1-6 алкил или С 1-4 алкил-O-С(О)-O-С 1-6 алкил;R7 в каждом случае независимо представляет собой Н, С 1-4 алкил, гидрокси или гетероцикл, где ука-2 017029 занный гетероцикл замещен 0-4 группами, выбранными из галогена, С 1-6 алкила, гидрокси, кето, -NH2 иR8 в каждом случае независимо представляет собой Н, С 1-4 алкил, галоген-С 1-4 алкил,-С(О)-С 1-4 алкил, -С(О)-галоген-С 1-4 алкил, -S(O)m-галоген-С 1-4 алкил или -S(О)m-С 1-4 алкил;R9 в каждом случае независимо представляет собой Н, С 1-4 алкил или -С(О)С 1-4 алкил; где гетероцикл представляет собой 5-7-членное моноциклическое или 7-14-членное полициклическое гетероциклическое кольцо, которое является насыщенным, ненасыщенным или ароматическим и которое содержит от 1 до 4 гетероатомов, выбранных из N, О и S;m равно 0-2; в каждом случае р независимо равно 1-3. Как используется в настоящем документе, указанные выше термины имеют следующие значения. Термин "алкил" означает нециклический или циклический ненасыщенный или насыщенный алифатический углеводород с прямой или разветвленной цепью, содержащий от 1 до 10 атомов углерода. Термин "С 1-4 алкил" имеет аналогичное алкилу значение, но содержит от 1 до 4 атомов углерода, тогда как термин "С 1-6 алкил" имеет аналогичное алкилу значение, но содержит от 1 до 6 атомов углерода. Представленные в качестве примера насыщенные алкилы с прямой цепью включают метил, этил, н-пропил, нбутил, н-пентил, н-гексил и т.п.; в то же время насыщенные разветвленные алкилы включают изопропил,втор-бутил, изобутил, трет-бутил, изопентил и т.п. Представленные в качестве примера насыщенные циклические алкилы включают циклопропил, циклобутил, циклопентил, циклогексил, -СН 2 циклопропил, -СН 2-циклобутил, СН 2-циклопентил, -СН 2-циклогексил и т.п.; в то же время ненасыщенные циклические алкилы включают циклопентенил и циклогексенил и т.п. Циклические алкилы, также означаемые как "гомоциклические кольца", включают ди- и полигомоциклические кольца, такие как декалин и адамантил. Ненасыщенные алкилы содержат по меньшей мере одну двойную или тройную связь между смежными атомами углерода (называемые как "алкенил" или "алкинил" соответственно). Представленные в качестве примера алкенилы с прямой и разветвленной цепью включают этиленил, пропиленил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2 бутенил, 2,3-диметил-2-бутенил и т.п.; в то же время представленные в качестве примера алкинилы с прямой и разветвленной цепью включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2 пентинил, 3-метил-1-бутинил и т.п. Термин "арил" означает ароматический карбоциклический фрагмент, такой как фенил или нафтил. Термин "арилалкил" означает алкил, содержащий по меньшей мере один алкильный атом водорода,замененный на арильный фрагмент, такой как -СН 2-фенил и т.п. Термин "гетероарил" означает 5-10-членное ароматическое гетероциклическое кольцо и содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода и серы, и где гетероатомы азота и серы могут быть необязательно окислены, и содержит по меньшей мере 1 атом углерода, включая как моно-, так и бициклические кольцевые системы. Представленные в качестве примера гетероарилы включают (но ими не ограничиваются) фурил, бензофуранил, тиофенил, бензотиофенил, пирролил, индолил,изоиндолил, азаиндолил, пиридил, хинолинил, изохинолинил, оксазолил, изооксазолил, оксадиазолил,тиадиазолил, бензоксазолил, пиразолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, пиридизинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил и хиназолинил. Термин "гетероарилалкил" означает алкил, содержащий по меньшей мере один алкильный атом водорода, замененный на гетероарильный фрагмент, такой как -СН 2 пиридинил, -СН 2 пиримидинил и т.п. Термин "гетероцикл" (также называемый в настоящем документе как "гетероциклическое кольцо") означает 5-7-членное моноциклическое или 7-14-членное полициклическое гетероциклическое кольцо,которое является или насыщенным, ненасыщенным или ароматическим и которое содержит от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода и серы, и где гетероатомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно кватернизированным,включая бициклические кольца, в которых любой из вышеуказанных гетероциклов конденсирован с бензольным кольцом, также как трициклические (и выше) гетероциклические кольца. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Гетероциклы включают гетероарилы, как определено выше. Таким образом, помимо ароматических гетероарилов, перечисленных выше, гетероциклы также включают (но ими не ограничиваются) морфолинил, пирролидинонил, пирролидинил, пиперизинил, пиперидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и т.п. Термин "галогеналкил" означает алкильную группу, содержащую по меньшей мере один атом водорода, замененный на галоген, такой как трифторметил и т.п. Термин "галоген" означает фтор, хлор, бром или йод, обычно фтор или хлор. Термин "гидрокси" означает -ОН. Термин "оксо" означает кислород, связанный двойной связью с углеродом (означает С=O). Термин "тио" означает атом серы, связанный двойной связью с углеродом (означает C=S). Термин "алкокси" означает алкильный фрагмент, присоединенный посредством кислородного мос-3 017029 тика (т.е. -О-алкил), и включает группы, такие как метокси и этокси. Термин "алкилтио" означает алкильный фрагмент, присоединенный посредством серного мостика(т.е. -S-алкил), и включает группы, такие как метилтио и этилтио. В одном из вариантов осуществления по настоящему изобретению R2a представляет собой фенил,замещенный n R3 группами, как показано на структуре (Ia)R1b и R1c являются одинаковыми или различными и независимо представляют собой Н, галоген,гидрокси,галоген-С 1-4 алкил,-С 1-6 алкил-(R5)р,-O-С 1-6 алкил-(R5)р,-С 1-6 алкил-O-С 1-6 алкил-(R5)p,-NR7-С 1-6 алкил-(R5)p или -S(O)m-С 1-6 алкил-(R5)p;R3 в каждом случае независимо представляет собой галоген, галоген-С 1-4 алкил, гидрокси,-С 1-5 алкил-(R5)p, -С 1-6 алкил-O-С 1-6 алкил-(R5)p, -O-С 1-6 алкил-(R5)p, -NR7-C1-6 алкил-(R5)p, -S(О)m-С 1-6 алкил(R5)p, -CO2R6, -C(O)NR7R8;R4 в каждом случае независимо представляет собой галоген, C1-6 алкил, галоген-С 1-4 алкил,С 1-4 алкокси, гидрокси, циано, тио-С 1-4 алкил, -C(O)NR7R8 или 5-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из N, О и S;R5 в каждом случае независимо представляет собой Н, гидрокси, -ОС(О)-С 1-6 алкил,-ОС(О)O-С 1-6 алкил, -ОС(О)-С 1-6 алкил-NR7R8, -COOR6, -C(O)NR7R8, -S(O)2NR9R9, -S(О)mC1-4 алкил,-NR7R8, С 1-6 алкокси или гетероцикл, выбранный из группы, состоящей изR6 в каждом случае независимо представляет собой Н, С 1-4 алкил, С 1-4 алкил-O-С(О)-С 1-6 алкил или С 1-4 алкил-O-С(O)-O-С 1-6 алкил;R9 в каждом случае независимо представляет собой Н, С 1-4 алкил или -С(О)С 1-4 алкил;n равно 0-4; р в каждом случае независимо равно 1-3. В одном из вариантов осуществления А, имеющийся в структуре (I), представляет собой пиридил,замещенный 0-4 R4. В одном из вариантов осуществления А, имеющийся в структуре (I), представляет собой 2-пиридил,замещенный 0-4 R4. В одном из вариантов осуществления А, имеющийся в структуре (I), представляет собой 3-пиридил,замещенный 0-4 R4. В одном из вариантов осуществления А, имеющийся в структуре (I), представляет собой фенил, замещенный 0-4 R4. В дополнительном варианте осуществления А в структуре (I) представляет собой хинолинил, замещенный 0-4 R4. В одном из вариантов осуществления А, имеющийся в структуре (I), представляет собой тиенопиримидинил, замещенный 0-4 R4. В одном из вариантов осуществления А представляет собой 2-оксопиримидинил, замещенный 0-4R4. Еще в одном из вариантов осуществления R1a и R1c в структуре (I) представляют собой Н.-4 017029 В другом варианте осуществления соединения формулы (I) R1b представляет собой -С 1-6 алкил-(R5)p или -O-C1-6 алкил-(R5)p, p равно 1, R5 представляет собой Н, гидрокси или -COOR6. Еще в одном из вариантов осуществления соединения формулы (I) R2a представляет собой фенил,замещенный 1 или 2 R3, где один из R3 представляет собой -O-С 1-6 алкил-(R5)p, p равно 1 и R5 представляет собой Н, гидрокси или -COOR6. В дополнительном варианте осуществления соединения формулы (I) R3 представляет собой-С 1-6 алкил-(R5)р, -С 1-6 алкил-O-С 1-6 алкил-(R5)p или -O-С 1-6 алкил-(R5)р. Представленные в качестве примеров соединения по настоящему изобретению включают следующие: 4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)-N-(2-метансульфонилфенил)-N-метилбензамид; 4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)-N-(2-гидрокси-6-метилфенил)-N-метилбензамид; 4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)-N-[2-(2-гидроксиэтокси)-6-метилфенил]-Nметилбензамид; 4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)-N-[2-(2-метоксиэтокси)-6-метилфенил]-Nметилбензамид; 4-(2-[4-хлор-3-(3-циано-6-фторхинолин-2-ил)бензоил]метиламинофенокси)масляная кислота; 2-(2-[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино-3 метилфенокси)этиловый эфир уксусной кислоты; 3-(5-хлор-2-[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино-3 метилфенокси)пропионовая кислота; метиловый эфир 4-(2-[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино-3 метоксифенил)масляной кислоты; 4-(2-[4-хлор-3-(4-циано-6-трифторметилпиридин-3-ил)бензоил]метиламино-3 метоксифенил)масляная кислота; 4-(2-[4-хлор-3-(4-метил-6-трифторметилпиридин-3-ил)бензоил]метиламино-3 метоксифенил)масляная кислота; 4-хлор-2-(3-диметиламинопропокси)-N-(2-метокси-6-метилфенил)-N-метил-5-(4-метил-6 трифторметилпиридин-3-ил)бензамид; этиловый эфир 4-[5-хлор-2-[(2-метокси-6-метилфенил)метилкарбамоил]-4-(4-метил-6 трифторметилпиридин-3-ил)фенокси]масляной кислоты; 4-5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]феноксимасляная кислота; 3-5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]феноксипропионовая кислота; 5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]феноксиуксусная кислота; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(4-гидроксибутокси)-N-(2-метоксифенил)-Nметилбензамид; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(3-гидроксипропокси)-N-(2-метоксифенил)-Nметилбензамид; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(2-гидроксиэтокси)-N-(2-метоксифенил)-Nметилбензамид; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(3-гидроксипропил)-N-(2-метоксифенил)-Nметилбензамид; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(3-гидроксипропил)-N-(2-метокси-6 метилфенил)-N-метилбензамид; 3-5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]фенилпропионовая кислота; 3-5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метокси-6-метилфенил)метилкарбамоил]фенилпропионовая кислота; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(2-гидроксиэтилсульфанил)-N-(2 метоксифенил)-N-метилбензамид; 4-хлор-5-(4-циано-6-трифторметилпиридин-3-ил)-2-(2-гидроксиэтилсульфанил)-N-(2-метокси-6 метилфенил)-N-метилбензамид; 5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]фенилсульфанилуксусная кислота; 5-хлор-4-(4-циано-6-трифторметилпиридин-3-ил)-2-[(2-метокси-6-метилфенил)метилкарбамоил]фенилсульфанилуксусная кислота; 4-хлор-5-(4,6-дицианопиридин-3-ил)-2-(2-гидроксиэтокси)-N-(2-метоксифенил)-N-метилбензамид; 4-хлор-5-(4,6-дицианопиридин-3-ил)-2-(2-гидроксиэтокси)-N-(2-метокси-6-метилфенил)-Nметилбензамид; 4-хлор-5-(4,6-дицианопиридин-3-ил)-2-(3-гидроксипропокси)-N-(2-метоксифенил)-N-5 017029 метилбензамид; 4-хлор-5-(4,6-дицианопиридин-3-ил)-2-(3-гидроксипропокси)-N-(2-метокси-6-метилфенил)-Nметилбензамид; 4-5-хлор-4-(4,6-дицианопиридин-3-ил)-2-[(2-метоксифенил)метилкарбамоил]феноксимасляная кислота; 4-5-хлор-4-(4,6-дицианопиридин-3-ил)-2-[(2-метокси-6-метилфенил)метилкарбамоил]феноксимасляная кислота;-7 017029 Перечень соединений, приведенных выше в качестве примеров, включает также фармацевтически приемлемые соли перечисленных соединений. Соединения по настоящему изобретению могут быть получены известными в области органического синтеза способами, включая способы, описанные более подробно в примерах. Обычно соединения,имеющие указанную выше структуру (I), могут быть получены взаимодействиями, представленными на следующих схемах, где все заместители являются такими, как определено выше, если не указано иное. Схема 1(R2)R2aNH (II) с образованием амида (III). Альтернативно, соединение (III) может быть получено реакцией конденсации (I) с соединением (II) в присутствии активирующего реагента, такого как HBTU. КогдаR2 из (II) представляет собой водород, дополнительная стадия N-алкилирования может быть выполнена в ДМФ с помощью сильного основания, такого как гидрид натрия, и R2X (X=Br, I). Затем соединение (III) преобразуют в эфир борной кислоты (IV) путем реакции, катализируемой палладием(0). Взаимодействие соединения (IV) с соответствующим арил- или гетероарилгалогенидом (А-Х) в условиях реакции Сузуки дает желаемый продукт (V). Примеры соответствующих арильных или гетероарильных групп для А представлены на схеме 1. Схема 2 Кроме того, соединения по настоящему изобретению могут быть получены путем модификации химических групп, как представлено на схеме 1. В соответствии со схемой 2 амид (III), где один из R3 представляет собой метокси, может быть получен в соответствии со схемой 1. Дезалкилирование метоксифенильной группы дает фенол (VI). Алкилирование с помощью замещенных бромалканов (Br-алкилR5), включая, например, бромалкильные сложные эфиры (Br(CH2)nCO2R6), дает замещенные эфиры (VII). Это промежуточное соединение, в свою очередь, преобразуют в эфир борной кислоты (VIII) путем реакции, катализируемой палладием(0). Последующая реакция Сузуки (VIII) с соответствующим арил- или гетероарилгалогенидом дает (IX). Альтернативно, соответствующая арил- или гетарилборная кислота может быть конденсирована с (VII) в условиях реакции Сузуки с получением (IX). Схема 3 В случае, когда заместитель R5 представлен эфиром карбоновой кислоты (X), для получения свободной карбоновой кислоты (XI) используют удаление сложноэфирной защитной группы в кислотных или основных условиях, как показано на схеме 3. При необходимости, соединения общей формулы (X) могут быть вновь получены преобразованием кислоты (XI) в сложный эфир. Альтернативно, соединения общей формулы (IX) могут также быть получены из фенола (VI). Как показано на схеме 4, реакцию, катализируемую палладием(0), сначала проводят с получением эфира борной кислоты (XII). Это промежуточное соединение, в свою очередь, подвергают взаимодействию с различными арилбромидами в условиях реакции Сузуки с получением фенолов (XIII). Последующее алкилирование фенольной группы дает соединения общей структуры (IX). Схема 5 Альтернативный синтез соединений формулы (IX) представлен на схеме 5. В этом случае, фенол(XIII) алкилируют 3-бромпропанолом с получением (XIV). Окисление спирта дает карбоновую кислоту Альтернативно, соединение (VI) может быть получено взаимодействием ацилхлорида, полученного непосредственно из кислоты (I), с N-замещенным гидроксианилином, как показано на схеме 6. Промежуточное соединение (VI) алкилируют соответствующим замещенным алкилбромидом, таким как бромалкиловый эфир (Br-алкил-COOR6), с получением эфира (VII), который может быть дополнительно преобразован в соединения формулы (IX), как показано выше на схеме 2. На схеме 6 амид (VI) может или быть получен описанным способом, или синтезирован из соответствующего замещенного 2-аминокрезола(R2=H). Алкилирование амидного азота может быть выполнено на более поздней стадии в последовательности реакций. Обычно, в случае, когда R2 группа представляет собой водород, дополнительную стадию Nалкилирования выполняют в ДМФ с сильным основанием, таким как гидрид натрия, и R2X (X=Br, I) с получением промежуточного соединения (VII) с последующим завершением дополнительных стадий в последовательности реакций. Схема 7 Промежуточное производное фенола (VI) алкилируют 3-бромпропанолом. Промежуточное производное бромида (XVI) преобразуют в соответствующий эфир борной кислоты (XVII). Реакция Сузуки с соответствующим арил- или гетероарилгалогенидом дает спирт (XVIIa). Далее это производное может быть окислено с получением кислоты (XVIII). Кислота необязательно может быть преобразована в алкиловый эфир (XIX) непосредственно из самой кислоты. В продолжение схемы 3, как указано на схеме 8, сложные эфиры (где R6 представляет собой, например, метил или этил) могут быть подвергнуты аминолизу с получением амида (XX). Схема 9-Тетралон (XXI) преобразуют в соответствующий лактам (XXII) и затем раскрывают цикл с образованием сложного метилового эфира анилинового производного (XXIII). Этот анилин конденсируют с бензоилхлоридом, образованным из кислоты (I, см. также схему 1), с образованием амида (XXIV, R2=H). Следующую стадию N-алкилирования выполняют в ДМФ с сильным основанием, таким как гидрид натрия, и R2X (X=Br, I), с получением полностью замещенного (XXIV, R2=алкил, R6=метил). Затем бромид(XXIV) преобразуют в эфир борной кислоты (XXV) путем реакции, катализируемой палладием(0). Реакция Сузуки с соответствующим арил- или гетероарилгалогенидом дает сложный эфир (XXVI). При необходимости сложный эфир может быть преобразован в кислоту (XXVII). В случаях, когда введенная группа "А" реагирует на условия снятия защитной группы, необходимые для удаления метилового эфира, замещение сложноэфирного R6 может быть изменено, если необходимо. В связи с этим у сложного эфира (XXIV) сначала удаляют защитную группу в условиях щелочного гидролиза и затем подвергают переэтерификации с соответствующим спиртом (примерами которого являются R6=трет-бутил). Конечные стадии, представленные на схеме 9, остаются неизменными для обоих промежуточных соединений. Схема 10 В варианте схемы 1 алкилирование амидного азота может быть отложено для облегчения замещения в этом положении. Таким образом, как показано на схеме 10, амид (R2=H) (III) может быть преобразован сначала в эфир борной кислоты (XXVIII) и затем в промежуточное соединение (XXIX) путем проведения реакции Сузуки. Алкилирование амидного азота выполняют взаимодействием с соответствующим электрофильным реагентом в присутствии сильного основания с получением полностью замещенного продукта (V). Схема 11 В модификации схемы 1 реакции конденсации в присутствии палладия могут быть выполнены в последовательности реакций раньше. Таким образом, бензойную кислоту (I) сначала преобразуют в эфир карбоновой кислоты и затем в эфир борной кислоты (XXX). Это промежуточное соединение подвергают конденсации в условиях реакции Сузуки с получением соединения (XXXI) гидролизованного эфира. Альтернативно, для получения (XXXI) в одну стадию путем реакции конденсации Сузуки может быть использован коммерчески доступный (XXX.а). Кислоту (XXXI) непосредственно активируют в виде- 10017029 хлорангидрида кислоты и конденсируют с анилинами общей структуры (II) с получением амидов (V). В случае, когда R2 представляет собой водород, последующая стадия N-алкилирования может быть выполнена в ДМФ с сильным основанием, таким как гидрид натрия, и R2X (X=Br, I) с получением (V). Схема 12 Синтез соответствующим образом замещенного анилина (II) может быть непосредственно выполнен путем восстановительного аминирования первичного анилина (XXXII) с карбонильным эквивалентом, таким как альдегид, кетон или замещенный кеталь или в две стадии, включая прямое ацилирование. В этом случае, промежуточное соединение (XXXIII, R представляет собой Н, алкил или замещенный алкил) восстанавливают с помощью, например, алюмогидрида лития, с получением желаемого продукта. Схема 13 4-Замещенную-2-фтор-5-нитробензойную кислоту (XLI) преобразуют в соответствующий ацилхлорид и подвергают реакции конденсации с замещенным анилином (II) с образованием амида (XLII). Альтернативно, (XLII) может быть получен реакцией конденсации (XLI) с (II) в присутствии активирующего реагента, такого как HBTU. Когда R2 группа в (II) представляет собой водород, выполняют дополнительное N-алкилирование, используя алкил галогенид [R2X (X=Br, I)], в условиях, таких как в ДМФ, с сильным основанием, таким как гидрид натрия. Затем (XLII) преобразуют в бромид (XLIII) путем сначала восстановлением нитрогруппы и затем диазотированием анилина в присутствии бромида меди (II). Соединение (XLV) может быть получено несколькими способами, включая замещение фтор группы в(XLIII) с использованием соответствующим образом замещенного спирта непосредственно для введения алкильной боковой цепи. Альтернативно, замещение выполняют с помощью метоксида натрия с образованием метоксипроизводного. Деметилирование этого метоксисоединения обычно выполняют с помощью BBr3 для облегчения получения фенола, который может быть затем алкилирован с помощью замещенного алкилбромида (например, Br-алкил-R5) с получением промежуточного соединения (XLV). Бромид (XLV) может быть использован в катализируемой палладием(0) реакции с получением эфира борной кислоты (XLVI). В условиях реакции Сузуки этот сложный эфир может быть подвергнут взаимодействию с соответствующим арил- или гетероарилгалогенидом с получением (XLVII). Соединения общей структуры (XLVII, R5 представляет собой -COOR6) могут быть преобразованы в (XLVIII) путем удаления сложноэфирной защитной группы в кислотных или щелочных средах. С другой стороны, окисление соответствующего спирта (XLVII, R5 представляет собой гидрокси) может также дать структуру (XLVIII). Во всех случаях,при необходимости, кислота может быть повторно преобразована в соответствующий сложный эфир, как описано выше. Когда А представляет собой замещенный пиридин, возможны несколько дополнительных синтетических преобразований, некоторые представлены в настоящем документе. Например, замещенный пиридин (XLIX) может быть окислен с получением в качестве продукта N-оксида (L). Кроме того, когда пиридиновое кольцо содержит один или несколько галогенов, таких как хлор в активированном положении(орто или пара по отношению к азоту пиридинового кольца), галоген в (LI) может быть заменен на соответствующий нуклеофил с получением продукта (LII). Такие нуклеофилы представляют собой меркаптаны или нуклеофильные гетероциклы, такие как пиразол или имидазол. Другие виды замещения в пиридине могут также быть изменены в соответствии с известными общими способами преобразования функциональных групп, присоединенных к гетероарильным или арильным кольцам. В качестве примера указанное представлено в описанном гидролизе нитрила (LIII), в результате чего обработка соединений этой общей структуры водным основанием позволила получить амиды общей структуры (LIV). Схема 15 Промежуточное производное фенола (VI) алкилируют в щелочной среде с образованием алкилнитрила (LV). Это промежуточное соединение конденсируют с активированным азидом для синтеза тетразола (LVI). На этом этапе тетразольную группу защищают взаимодействием с соответствующим замещенным алкилгалогенидом (например, триметилсилилэтоксиметилхлорид), что, возможно, приводит к образованию изомеров. Затем полученный алкилтетразол (LVII) преобразуют в эфир борной кислоты(LVIII), как описано выше, и затем подвергают взаимодействию с соответствующим арил- или гетероарил-галогенидом с получением защищенного промежуточного соединения (LIX). Последующее удаление защитных групп этих видов дает тетразол (LX). Аминобензойную кислоту (LXI) конденсируют с мочевиной в уксусной кислоте при высокой температуре. Полученное производное мочевины (LXII) подвергают повторной конденсации с соответственно замещенным 1,3-дикетоном в присутствии сильной кислоты с получением сложного эфира арила(LXIII). Удаление сложноэфирной группы осуществляют путем кислотного гидролиза с получением кислоты (LXIV), которую затем подвергают реакции конденсации с соответственно замещенными анилинами (II) с получением амидов (LXV). Схема 17 В качестве варианта схемы 13, сначала бромид (XLIII) преобразуют в эфир борной кислоты (LXVI),потом выполняют конденсацию Сузуки с получением (LXVII). Затем фторидную группу в (LXVII) заменят на спирт (R5-алкил-ОН) с получением конечного соединения (LXVIII). Группа R5 может быть защищена в процессе реакции обмена, таким образом, перед образованием конечной структурой (LXVIII) может быть необходимо удаление защитной группы. Схема 18 Альтернативно, коммерчески доступный (LXIX) может быть избирательно алкилирован по фенольной и кислотной группам с образованием (LXX). После удаления защитной группы (защиты), может быть образован амид для получения (LXXI). В процессе осуществления этого способа функциональная группа в R5 может быть защищена, таким образом удаление защитной группы может быть необходимо. Схема 19 В качестве варианта схемы 11, аминофенол (LXXIII) подвергают взаимодействию с акрилонитрилом с образованием (LXXIV), который может быть преобразован в промежуточное производное тетразола (LXXV). Далее (XXXI) активируют преобразованием его в соответствующий ацилхлорид, который затем подвергают взаимодействию с (LXXV) в водном растворе с получением желаемого продукта 5-Бром-4-R1d-2-гидроксибензойную кислоту подвергают реакции конденсации с замещенным анилином (II) в присутствии Р 2 О 5 с образованием амида (LXXVII). Альтернативно, (LXXVII) может быть получен реакцией конденсации с (II) в присутствии активирующего реагента, такого как HBTU. В катализируемой палладием(0) реакции может быть использован амид (LXXVII) с получением эфира борной кислоты (LXXVIII). В условиях реакции Сузуки этот эфир борной кислоты может быть подвергнут взаимодействию с соответствующим арил- или гетероарил-галогенидом с получением (LXXIX), который может быть преобразован в (LXXX) путем алкилирования с алкилгалогенидами или мезилатами или путем реакции Митсунобу с алкильными спиртами. Соединения по настоящему изобретению могут обычно быть использованы в качестве свободной кислоты или свободного основания. Альтернативно, соединения по настоящему изобретению могут быть использованы в форме солей присоединения кислот или оснований. Соли присоединения кислот свободных аминосоединений по настоящему изобретению могут быть получены способами, хорошо известными в данной области, и могут быть образованы из органических и неорганических кислот, которые дают нетоксичные соли. Соответствующие органические кислоты включают малеиновую, фумаровую, бензойную, аскорбиновую, янтарную, метансульфоновую, уксусную, трифторуксусную, щавелевую, пропионовую, винную, салициловую, лимонную, глюконовую, молочную, миндальную, коричную, аспартамовую, стеариновую, пальмитиновую, гликолевую, глутаминовую и бензолсульфоновую кислоты. Соответствующие неорганические кислоты включают хлороводородную, бромоводородную, серную, фосфорную и азотную кислоты. Соли присоединения оснований включают соли, которые образованы с помощью карбоксилат аниона, и включают соли, образованные с помощью органических и неорганических катионов, например выбранные из щелочных и щелочно-земельных металлов (например, литий, натрий,калий, магний, барий и кальций), а также иона аммония и его замещенных производных (например, дибензиламмоний, бензиламмоний, 2-гидроксиэтиламмоний и т.п.). Таким образом, термин "фармацевтически приемлемая соль", имеющая структуру (I), включает любые и все приемлемые формы солей. Кроме того, в объем настоящего изобретения также включены пролекарства. Пролекарства представляют собой любые ковалентно связанные носители, которые высвобождают соединение, имеющее структуру (I) in vivo, когда такое пролекарство вводят пациенту. Обычно пролекарства получают, модифицируя функциональные группы таким образом, что модификация расщепляется либо путем обычных манипуляций, либо in vivo, с получением исходного соединения. Пролекарства включают, например,соединения по настоящему изобретению, где гидрокси, амино или кислотные группы связаны с любой группой, которая, при введении пациенту, отщепляется с образованием гидрокси, амино или кислотных групп. Таким образом, представленные в качестве примеров пролекарств включают (но ими не ограничиваются) ацетатные, формиатные и бензоатные производные спиртовых и аминовых функциональных групп соединений, имеющих структуру (I). Кроме того, в случае карбоновой кислоты (-СООН) могут быть использованы сложные эфиры, такие как метиловые эфиры, этиловые эфиры и т.п. В отношении стереоизомеров соединения, имеющие структуру (I), могут иметь хиральные центры и могут существовать в виде рацематов, рацемических смесей и в виде отдельных энантиомеров или диастереомеров. Все такие изомерные формы включены в настоящее изобретение, включая их смеси. Соединения по настоящему изобретению могут находиться в различных твердых состояниях, от полностью аморфного до полностью кристаллического. Кроме того, некоторые из кристаллических форм соединений, имеющих структуру (I), могут существовать в виде полиморфов, которые включены в настоящее изобретение. К тому же, некоторые соединения, имеющие структуру (I), могут также образовывать сольваты с водой или другими органическими растворителями. Термин "сольват" используется в настоящем документе для описания молекулярного комплекса, содержащего соединение по настоящему изобретению и одну или несколько фармацевтически приемлемых молекул растворителя. Такие сольваты также включены в объем настоящего изобретения. Настоящее изобретение также включает все фармацевтически приемлемые изотопно меченные соединения, имеющие структуру (I), где один или несколько атомов заменены на атомы, имеющие такой же атомный номер, но другую атомную массу. Примеры включают 2 Н и 3 Н для водорода, 11 С, 13 С и 14 С для углерода, 36Cl для хлора, 18F для фтора, 123I и 125I для йода, 13N и 15N для азота и 35S для серы.- 14017029 Соединения по настоящему изобретению включают соединения, имеющие структуру (I), как определено, включая все их полиморфы, пролекарства, изомеры (включая оптические, геометрические и таутомерные), соли, сольваты и изотопы. Эффективность соединения, как антагониста рецептора GnRH, может быть определена различными аналитическими способами. Аналитические способы, хорошо известные в данной области, включают использование культивированных питуитарных клеток для измерения активности GnRH (Vale et al., Endocrinology 91:562-572, 1972) и измерения связывания радиолиганда с гипофизарными мембранами крысы (Perrin et al., Mol. Pharmacol. 23:44-51, 1983) или с мембранами клеток, экспрессирующих клонированные рецепторы, как описано ниже. Другие способы анализа включают (но ими не ограничиваются) измерение эффектов антагонистов рецептора GnRH на ингибирование GnRH-стимулированного кальциевого потока, модулирование гидролиза фосфоинзитола, активацию ERK1/2, высвобождение гистамина мастоцитами и циркулирующих концентраций гонадотропинов у кастрированного животного. Описание этих способов, синтез меченных радиоактивным изотопом лиганд, использование меченных радиоактивным изотопом лиганд в радиоиммуноанализе и измерение эффективности соединения в качестве антагониста GnRH рецептора описаны ниже. Клонирование и экспрессия рецепторов GnRH. ДНК рецепторов GnRH человека, макаки-резус, кролика, собаки и крысы клонировали в pcDNA3,1(+) (Invitrogen). Полную длину последовательностей всех рецепторов подтверждали секвенированием ДНК. Клетки HEK 293, СНО, COS-7 или клетки базофильного лейкоза крыс (RBL) стабильно трансфицировали ДНК рецепторов GnRH человека, крысы или макаки, и выделяли высоко экспрессирующие единичные клеточные клоны (Bmax0,4 пмоль/мг мембранного белка), которые поддерживали в среде Игла, модифицированной по методу Дульбекко (DMEM) со следующими добавками: 10 мМ HEPES; 2 мМ L-глутамин; 1 мМ пируват натрия; 50 Ед/мл пенициллин, 50 мкг/мл стрептомицин; 10% инактивированный нагреванием бычий сывороточный альбумин и 200 мкг/мл генетицин (G-418-Sulfate). В среду клеток RBL вводили аминокислоты, не являющиеся незаменимыми (0,1 мМ) (Irvine Scientific; Santa Ana,CA). Как правило, сначала проводили радиолигандный анализ связывания пептида, используя мембраны стабильно трансфецированных клеток RBL. Как было обнаружено, стабильные клоны RBL более единообразно экспрессируют высокие уровни рецептора GnRH и, следовательно, могут быть использованы для последующих анализов связывания, а также для исследований потока Са и накопления инозитолфосфата. Временно трансфицированные клетки COS-7 использовали для получения мембран, содержащих рецепторы GnRH различных видов (а также мембран, содержащих мутантные рецепторы для других исследований) благодаря удобству для быстрого анализа множественных рецепторов. Стабильно трансфицированные клетки СНО используют для анализа стимуляции ERK1/2 благодаря повышенным характеристикам сигнал/шум в этом ангализе. Препараты мембран. Клетки HEK 293, стабильно трансфицированные рецептором GnRH человека, выращивали в течение двух дней после достижения конфлюентности, затем собирали, постукивая колбы для культур тканей о твердую поверхность. Клетки собирали центрифугированием при 1000g в течение 5 мин. Клеточные осадки ресуспендировали в 5% сахарозе и гомогенизировали, используя политронный гомогенизатор в течение двух 15-секундных стадий гомогенизации. Затем клеточные гомогенаты центрифугировали в течение 5 мин при 3000g для удаления ядер, а супернатант затем центрифугировали в течение 30 мин при 44000g для сбора мембранной фракции. Мембранный осадок ресуспендировали в буфере для связыванияGnRH (10 мМ HEPES, рН 7,5, 150 мМ NaCl и 0,1% BSA), аликвоты немедленно замораживали в жидком азоте и хранили при -80 С. Содержание белка в суспензии мембран определяли, используя набор для анализа белка Bio-Rad (Bio-Rad). Клетки RBL, стабильно трансфицированные рецептором GnRH человека, выращивали до 80% конфлюентности, а затем собирали. Клетки инкубировали при 37 С в течение 10 мин в 0,5 мМ EDTA/PBS(Са, Mg свобод.) и снимали с планшета, аккуратно постукивая колбы. Клетки собирали и осадок центрифугировали при 1000g в течение 5 мин. Клеточные осадки ресуспендировали в буфере (буфер DPBS с добавлением 10 мМ MgCl2, 2 мМ EGTA, pH 7,4) и клетки лизировали, сдавливая клетки и прикладываяN2 при давлении 900 psi в течение 30 мин при 4 С. Неповрежденные клетки и крупный дебрис удаляли центрифугированием при 1200g в течение 10 мин при 4 С. Затем супернатант клеточных мембран центрифугировали при 45000g, полученный мембранный осадок ресуспендировали в аналитическом буфере и гомогенизировали на льду, используя гомогенизатор для измельчения тканей. Определяли концентрацию белка, используя набор реагентов для белка Coomassie Plus. Мембраны разделяли на аликвоты и хранили при -80 С перед использованием. Клетки COS-7, временно трансфицированные рецепторами GnRH различных видов (человека, макаки, собаки, кролика, крысы) или мутантными рецепторами GnRH, получали масштабной электропорацией. Клетки COS-7 получали из American Type Cell Culture (Manassas, VA) и поддерживали в среде Игла, модифицированной по методу Дульбекко (DMEM) (MediaTech Inc., Herndon, VA), содержащей 10% бычьей фетальной сыворотки, 10 мМ HEPES, 2 мМ L-глутамина, 1 мМ пирувата натрия, 50 Ед/мл пени- 15017029 циллина, 50 мкг/мл стрептомицина. Клетки COS-7 высеивали в 500 см 2 плашки для культуры тканей и выращивали до конфлюентности, а затем трансфицировали. Клетки в количестве 5107 трансфицировали 50 мкг соответствующей конструкции ДНК рецептора GnRH путем электропорации в манипуляторе ВТХElectrocell Manipulator ECM 600 (Fisher Scientific, Pittsburgh, PA), используя следующие установки: емкость - 1000 мкФ, сопротивление - 48 Ом и зарядное напряжение - 300 В/см. Трансфицированные клетки культивировали в течение 36-48 ч, а затем получали препарат мембран. Временно трансфицированные клетки COS-7 собирали, промывали и ресуспендировали в буфере для мембран (20 мМ HEPES рН 7,2,6 мМ MgCl2, 1 мМ EDTA). Клетки центрифугировали и клеточные осадки ресуспендировали в небольшом объеме буфера для мембан. Клетки лизировали под давлением, а затем инкубировали при 900 пси в течение 30 мин при 4 С в камере с азотом. Гомогенат центрифугировали при 1000g в течение 10 мин при 4 С для удаления ядер и клеточного дебриса. Мембраны собирали из супернатанта центрифугированием при 44000g в течение 45 мин при 4 С. Мембраны ресуспендировали в буфере для мембран при концентрации 1 мг/мл, подвергали быстрой заморозке в жидком азоте и хранили при -80 С перед использованием. Радиолигандный анализ связывания. Метод радиолигандного замещения, используя радиолиганды для пептидов, проводили в буфере,содержащем 10 мМ HEPES, 150 мМ NaCl и 0,1% BSA, pH 7,5. Радиолигандный анализ связывания с использованием[3 Н]-1-(2,6-дифторбензил)-3-[(2R)амино-2-фенетил]-5-(2-фтор-3-метоксифенил)-6 метилурацила (в настоящем описании 3-метоксигруппу метили тритием) проводили в буфере, содержащем 50 мМ Трис, 150 мМ NaCl, 5 мМ MgCl2, 0,01% сапонин и 0,5 мМ EDTA, pH 7,5. Анализ радиолигандного замещения проводили, инкубируя радиолиганд ([125I-Tyr5, DLeu6, NMeLeu7, Pro9-NEt]GnRH(0,1 нМ), [His5, 125I-DTyr6]GnRH (0,2 нМ) (31) или [3 Н]-1-(2,6-дифторбензил)-3-[(2R)амино-2-фенетил]-5(2-фтор-3-метоксифенил)-6-метилурацил (1 нМ, немеченое конкурентное соединение при концентрации от 0,3 пМ до 10 мкМ, и мембраны в течение 2 ч при комнатной температуре. Каждый препарат мембран для рецептора GnRH человека, обезьяны и кролика использовали в количестве 10-20 мкг белка/лунку. В случае мембран для рецептора GnRH крысы и собаки использовали 5 и 60 мкг/лунка соответственно. Анализы связывания проводили либо в 96-луночных фильтровальных плашках GF/CMillipore (для анализа [125I-Tyr5, DLeu6, NMeLeu7, Pro9-NEt]GnRH) или в 96-луночных плашках с низким связыванием, которые затем фильтровали на фильтрах GF/C Unifilter. Фильтры перед использованием обрабатывали 0,5% PEI в течение 30 мин. Реакции останавливали быстрой вакуумной фильтрацией, и фильтры дважды промывали 250 мкл ледяного PBS pH 7,4 (в среду для промывки радиолигандов [His5,125I-DTyr6] GnRH и [3 Н]-1-(2,6-дифторбензил)-3-[(2R)амино-2-фенетил]-5-(2-фтор-3-метоксифенил)-6 метилурацила добавляли 0,01% Tween-20). Фильтры сушили и фильтры Millipore контролировали для оценки радиоактивности, используя гамма-счетчик Cobra II (Perkin Elmer Life Sciences). Для анализов с фильтрацией плашек на фильтре GF/C Unifilter, к каждому фильтру добавляли 50 мкл синциляционный жидкости, и радиоактивность оценивали, используя TopCount NXT. Для радиолигандов, меченных йодом, общее количество радиолигандов измеряли с помощью гамма счетчика, а для радиолигандов, меченных тритием, общее количество радиолиганда измеряли, используя жидкостной сцинтилляционный счетчик Perkin Elmer 1600TR. Общее связывание с радиолигандами не превышало 10% от общего количества добавленного радиолиганда; такой уровень уменьшения не оказывает значительное влияния на измерение Ki. Неспецифическое связывание не превышало 2% от общего количества добавленного радиолиганда в любом анализе замещения. Ингибирование радиолигандного связывания соответствует уравнению конкурентного связывания по одному и двум сайтам, а набольшее соответствие было определено с помощью F-теста. Для всех экспериментов замещения наиболее подходящей являлась модель со связыванием одного сайта (р 0,05). Значения Ki рассчитывали, исходя из значений IC50, используя способ Ченга и Прусоффа (Biochem. Pharmacol. 22:3099, 1973), и эти значения могут быть преобразованы в значения pKi (отрицательный логарифм значения Ki). где L=радиолиганд и KD=аффинность связывания радиолиганда с рецептором. Антагонисты рецептора GnRH по настоящему изобретению имеют значение Ki, равное 10 мкМ или меньше. В других вариантах осуществления настоящего изобретения антагонисты рецептора GnRH имеют значение Ki меньше 1 мкМ, а в большинстве случаев значение Ki меньше 0,1 мкМ (т.е. 100 нМ). Соединения по настоящему изобретению, показанные в примерах 2-52 ниже (исключая синтезированные промежуточные соединения), которые тестировали в одном или нескольких анализах конкурентного связывания пептидов с рецептором человека, показали значение Ki, равное 1 мкМ или меньше. Кроме того, следующие соединения по настоящему изобретению, показанные в примерах 2-52 ниже (исключая синтезированные промежуточные соединения), которые тестировали в одном или нескольких анализах конкурентного связывания пептидов с рецептором человека, показали значение Ki, равное 100 нМ или меньше, тогда как подчеркнутые соединения показали значение Ki, равное 10 нМ или меньше: Агглютинин из проростков пшеницы (WGA), связанный с полистирольными (PS) гранулами (Amersham Biosciences, Piscataway, NJ), использовали для анализа сцинциляционного приближения, при котором возможно получить световое изображение всей плашки с помощью системы визуализации CCD, используя Viewlux (PerkinElmer Life Sciences, Boston, MA). Целостность рецептора и радиометки оценивали в анализе насыщения, измеряя в каждый момент времени для подтверждения постоянного Kd. Обычно анализ SPA GnRH давал достоверные данные связывания в течение до 16 ч инкубации. Оптимальное соотношение количество мембран/гранул SPA определяли для каждого препарата мембран, и оно обычно составляло 40 мкг мембран/0,5 мг гранул на лунку. Как правило, оборудование устанавливали для измерения люминесценции в течение 300 с, используя 613-нм фильтр для улавливания излучения со смещением в красную (длинноволновую) сторону при визуализации гранул, и использовали программуmMed для записи с 60-минутными интервалами в течение 11 ч. Реакционные смеси обычно состояли из 50 мкл немеченых соединений с различной концентрацией 50 мкл лигандов GnRH, меченных радиоактивным изотопом [125I]-His5, D-Tyr6 (300 пМ, 2200 Кю/ммоль;NaCl, 0,1% бычий сывороточный альбумин [BSA; фракция V], рН 7,5). Фракции клеточных мембран получали способом, описанным выше, и ресуспендировали в аналитическом буфере. Гранулы SPA и мембраны (клеток базофильного лейкоза [RBL] крыс, стабильно экспрессирующихGnRH-R человека) инкубировали в течение 2 ч, а затем добавляли соединения и радиолиганд. Смесь быстро встряхивали и оставляли отстаиваться при комнатной температуре в аппарате Viewlux. Количество связавшегося радиолиганда определяли в указанных временных интервалах. Модель связывания в одном сайте использовали для всех экспериментов замещения, определяя с помощью частичного F теста (р 0,05). Кривую зависимости "доза-ответ" для обоих временных точек всех протестированных соединений нормализовали до нуля и подсчитывали 100% специфичное связывание и значение Ki, используя уравнение Ченга-Прусоффа с сигмоидальной подгонкой "доза-ответ",используя программное обеспечение Prism 4,0 (GraphPad Software, San Diego, CA), используя Kd значения 0,2 нМ для [125I]-His5, D-Tyr6 GnRH, как определено из экспериментов насыщенного связывания. Наклон пика для всех кривых обычно находится в пределах от -0,8 до -1,1. Эксперименты с радиолигандами для определения аффиности связывания соединений по настоящему изобретению начинают с добавления клеточных мембран в лунки, содержащие соответствующее- 17017029 количество меченных радиоактивным изотопов индикаторов, в отсутствие и в присутствии соединений в определенном диапазоне концентраций (Sullivan et al., Biochemical Pharmacology, 72, 2006, 838-849). Перед началом эксперимента все буферы предварительно нагревали до 37 С и аналитические планшеты поддерживали при этой температуре в течение всего эксперимента. Аналитическую смесь (общий объем 200 мкл) инкубировали при 37 С в течение промежутка времени от 1 мин до 3 ч (15 временных точек) и анализ завершали быстрым вакуумным фильтрованием через устройство для сбора клеток (UniFilter-96Filtermate; Packard, PerkinElmer Life Sciences) на планшете с фильтром GF/B Unifilter, заранее обработанном 0,5% полиэтиленимином в дистиллированной воде в течение 30 мин. После фильтрования мембраны два раза промывали 400 мкл промывочным буфером (фосфатно-солевой буфер Дульбекко, 0,01% Tween20, pH 7,5). Фильтровальные планшеты сушили, добавляли 50 мкл сцинтилляционной жидкости (Microscint 20; PerkinElmer Life Sciences) и измеряли радиоактивности планшета, используя TopCount NXT с эффективностью 30% (PerkinElmer Life Sciences). Общее количество добавленного радиолиганда в анализе определяли, используя жидкостной сцинтилляционный счетчик 1600TR (PerkinElmer Life Sciences) с 47% эффективностью. Анализы проводили, используя программное обеспечение Prism 4,1 (GraphPadSoftware, San Diego, CA). Измерение потока Са. Для определения ингибирования GnRH-стимулируемого потока кальция в клетках, экспрессирующих рецептор GnRH человека, на 96-луночный планшет высевали клетки RBL, стабильно трансфицированные рецептором GnRH человека с плотностью 50000 клетки/лунка, и оставляли для прикрепления на ночь. Клетки погружали на 1 ч при 37 С в следующую среду: DMEM с 20 мМ HEPES, 10% FBS, 2 мкМFluo-4, 0,02% плюроновая кислота и 2,5 мМ пробенецид. После погружения клетки промывали 4 раза промывочным буфером (сбалансированный солевой буфер Хэнкса, 20 мМ HEPES, 2,5 мМ пробенецид),оставляя 150 мкл в лунке после последней промывки. GnRH разбавляли в 0,1% BSA, содержащем буферFLIPR (сбалансированный солевой буфер Хэнкса, 20 мМ HEPES) до концентрации 20 нМ, и диспергировали в 96-луночном планшете с низким связыванием. В третьем 96-луночном планшете готовили различные концентрации антагонистов в буфере 0,1% BSA/FLIPR. Плашки с клетками, агонистами и антагонистами погружали в флуорометрический счетчик для визуализации планшетов (FLIPR) (MolecularDevices, система FLIPR384, Sunnyvale, CA) для измерения обработки в жидкости и флуоресценции в соответствии с инструкциями производителя. Аппарат был запрограммирован таким образом, чтобы антагонист (50 мкл в различных концентрациях) добавлялся в планшеты с клетками, и перед добавлением агониста (конечная концентрация GnRH 50 мкл или 4 нМ) происходила предварительная инкубация в течение 1 мин. Измерение продукции [3 Н]IP. Процедуру, описанную в опубликованном протоколе (Zhou et al., J. Biol. Chem. 270:18853-7), модифицировали. Коротко, клетки RBL, стабильно трансфицированные рецепторами GnRH человека, высеивали в 24-луночные плашки с плотностью 200000 клеток/лунку в течение 24 ч. Клетки один раз промывали средой, свободной от инозитола, содержащей 10% диализированный FBS, и затем метили 1 мкКю/мл [myo-3 Н]инозитолом. Через 20-24 ч клетки промывали буфером (140 мМ NaCl, 4 мМ KCl,20 мМ Hepes, 8,3 мМ глюкоза, 1 мМ MgCl2, 1 мМ CaCl2 и 0,1%BSA) и обрабатывали пептидом GnRH в том же самом буфере вместе или без антагониста при различных концентрациях и 10 мМ LiCl в течение 1 ч при 37 С. Клетки экстрагировали 10 мМ муравьиной кислотой при 4 С в течение 30 мин и загружали в колонку Dowex AG1-X8, промывали и элюировали 1 М формиатом аммония и 0,1 М муравьиной кислотой. Элюат подсчитывали на сцинтилляционном счетчике. Данные анализа PI гидролиза использовали для построения графической зависимости, используя нелинейную среднеквадратичную регрессию с помощью программы Prism (GraphPad Software, San Diego, CA), из которой также рассчитывали соотношение дозы. Линейный график Senild получали из соотношений доз, полученных в четырех независимых экспериментах путем линейной регрессии, отрезок на оси X использовали для определения аффинности связывания антагониста. Активация ERK1/2. Клетки СНО, стабильно экспрессирующие рецептор GnRH, обрабатывали бессывороточной средой в течение 1 ч, инкубировали в течение 5 мин при различных дозах антагониста, и стимулировали 1 нМGnRH в течение 5 мин при 37 С. Клетки промывали один раз PBS, и собирали непосредственно в 2 ХSDS буфере для образцов. Клеточные экстракты обрабатывали ультразвуком, нагревали при 55 С в течение 5 мин и разделяли SDS-PAGE. Полученные белки переносили на нитроцеллюлозные мембраны. Детектировали активированную фосфорилированную форму ERK1/2, используя антитело антифосфоМАРК р 42/44 (Cell Signaling Technology, Danvers, MA), разведенное 1:3000 в 1% обезжиренном сухом молоке в TBST(20 мМ Трис-HCl, рН 7,4, 137 мМ NaCl, 0,1% Tween20). Общее ERK1/2 определяли с помощью анти-ЕРК 2 антитела (К 23, Santa Cruz Biotechnology, Santa Cruz, CA). Хемилюминисцентную визуализацию проводили с помощью реагента SuperSignal West Pico (Pierce,Rockford, IL) и выражали количественно в системе визуализации VersaDoc3000 (Bio-Rad). Данные "дозаответ" представляли графически и анализировали с помощью программы GraphPad Prism.- 18017029 Высвобождение гистамина. Перитониальные мастоциты крысы получали в соответствии с действующими NIH инструкциями для человека, в соответствии с этическими нормами содержания и работы с лабораторными животными и в соответствии с одобренным протоколом IACUC. Этот способ ранее был описан для оценки высвобождения гистамина тучными клетками под действием пептидных антагонистов GnRH (Sundaram et al.,Agents Actions 25:307-13). Кратко, шесть самцов крыс Sprague Dawley 240-300 г умерщвляли путем CO2 асфикции, в брюшную полость вводили инъекцию 40 мл холодного буфера PIPES (25 мМ PIPES, 110 мМNaCl, 5 мМ KCl, 1 мг/мл глюкоза, 1 мг/мл BSA и 20 Ед/мл гепарина, рН 7,4) и брюшинную полость мягко массировали. Получали перитонеальный смыв и хранили его на льду. Клетки перитонеального смыва промывали 3 раза 5 мл буфера PIPES, объединяли и очищали на градиенте Percoll (Wells and Mann, Biochem Pharmacol 32:837-42). Для анализа стимуляции в 1,5 мл пробирку eppendorf помещали приблизительно 2105 клеток в 300 мкл PIPES буфер и к клеточной суспензии добавляли тестируемое соединение(100 мкл). Пробирки инкубировали при 37 С в течение 15 мин и реакцию останавливали с помощью 600 мкл ледяного буфера PIPES. После цинтрифугирования при 4 С определяли уровень гистамина в супернатанте с помощью набора EIA для оценки гистамина от SPI-BIO (Cayman Chemical, Ann Arbor,MI) в соответствии с инструкциями производителя. Супрессия LH у кастрированных макак. Это исследование на макаках выполняли в соответствии с действующими NIH инструкциями для человека, в соответствии с этическими нормами содержания и работы с лабораторными животными и в соответствии с одобренным протоколом IACUC. Полную орхиэктомию (оба семенника) выполняли приблизительно за 4 недели до введения первой дозы самцам человекообразных обезьян в возрасте приблизительно 3,7-6,5 лет (3,7-4,8 кг). Половую зрелость оценивали по тестикулярному объему и уровням тестостерона перед хирургической операцией. Образцы крови собирали еженедельно в течение 4 недель послеоперационного периода восстановления для измерения тестостерона, FSH и LH для проверки повышения гонадотропинов. Антагонист вводили в желудок с помощью назогастрального зонда или путем внутривенной инфузии (в течение 15 мин). Образцы крови собирали до и после введения каждой дозы для анализа сывороточного LH и концентраций антагониста в плазме. При внутренней инфузии образцы собирали через 0,25, 0,33, 0,5, 1, 1,5, 4, 8 и 24 ч после начала инфузия. В случае перорального введения образцы собирали через 0,25, 0,5, 1, 1,5, 2, 4, 8 и 24 ч после введения. Биоактивные концентрации LH в образцах сыворотки измеряли в Oregon Regional Primate Center (Beaverton, OR) или Yerkes Primate Research Center университета Эмери, используя предварительно полученный биоанализ на клетках Лейдига мышей, определяя как 3 нг LH/мл, используя LH RP-1 Cynomolgus в качестве эталонного препарата (Ellenwood и Resko, Endocrinology 207:902-7). Как указано выше, антагонисты рецептора GnRH по настоящему изобретению могут широко применяться в терапии и могут быть использованы для лечения ряда расстройств, в общем случае связанных с половыми гормонами, как у мужчин, так и у женщин, а также млекопитающих. Например, такие расстройства включают эндометриоз, фиброма матки, синдром поликистозных яичников, дисменорею, диспареунию, меноррагию, несвязанные с менструацией боли в области таза, болезненность в области таза,индурацию, общие расстройства менструального цикла, преждевременное угасание функции яичников вследствие химиотерапии или ранняя менопауза, гирсутизм, преждевременное половое созревание, гонадную стероид-зависимую неоплазию, такую как злокачественные опухоли простаты, молочной железы и яичников, гонадотропную аденому гипофиза, аденомиоз, апноэ во время сна, синдром раздраженной толстой кишки, предменструальный синдром, доброкачественную гипертрофию предстательной железы,симптомы нижних мочевыводящих путей (LUTSV, отсутствие беременности и бесплодие (например, с помощью репродуктивной терапии, такой как, in vitro фертилизация). Соединения по настоящему изобретению могут также применяться в качестве вспомогательного средства для лечения дефицита гормона роста и карликовости, и для лечения системной красной волчанки. Кроме того, соединения могут применяться в сочетании с андрогенами, эстрогенами, прогестеронами, антиэстрогенами, антипрогестогенами, ингибиторами ангиотензин-I-превращающего фермента,антагонистами ангиотензин II-рецептора, ингибиторами ренина, бифосфонатами и другими средствами для лечения и/или профилактики расстройств кальциевого, фосфатного и костного метаболизма, ингибиторами ароматазы, анальгетиками, такими как нестероидные противовоспалительные препараты(NSAIDS), другими ингибиторами СОХ и анти-NGF средствами. В другом варианте осуществления изобретения описаны фармацевтические композиции, содержащие один или несколько антагонистов рецептора GnRH. Для достижения успешного введения соединения по настоящему изобретению могут быть представлены в составе фармацевтических композиций. Фармацевтические композиции по настоящему изобретению содержат антагонист рецептора GnRH по настоящему изобретению и фармацевтически приемлемый носитель и/или разбавитель. Антагонист рецептора GnRH присутствует в композиции в количестве, которое эффективно для лечения определенного расстройства, т.е. в количестве, достаточном для достижения активности антагониста рецептора GnRH и предпочтительно с приемлемой для пациента токсичностью. Соответствующие концентрации и дозы могут быть легко определены любым специалистом в данной области.- 19017029 Фармацевтически приемлемый носитель и/или разбавители хорошо известны специалисту в данной области. Для композиций, представленных в виде жидких растворов, приемлемые носители и/или разбавители включают физиологический раствор и стерилизованную воду, и могут необязательно включать антиоксиданты, буферы, антимикробные и другие обычно применяемые добавки. Композиции могут также быть представлены в виде пилюль, капсул, гранул или таблеток, которые содержат, помимо антагониста рецептора GnRH, разбавители, диспергирующие и поверхностно-активные вещества, связующие вещества и лубриканты. Специалист в данной области может дополнительно ввести в состав препарата антагонист рецептора GnRH соответствующим способом и в соответствии с принятыми технологиями,например, описанными в Remington's Pharmaceutical Sciences, Gennaro, Ed., Mack Publishing Co., Easton,PA 1990. В другом варианте осуществления настоящее изобретение обеспечивает способ лечения расстройств, связанных с половыми гормонами, как рассмотрено выше. Такие способы включают введение соединения по настоящему изобретению теплокровному животному в количестве, достаточном для лечения расстройств. В этом случае, термин "лечение" включает профилактическое введение. Такие способы включают системное введение антагониста рецептора GnRH по настоящему изобретению, предпочтительно в форме фармацевтической композиции, как рассмотрено выше. Как используется в настоящем документе, системное введение включает пероральный и парентеральный способы введения. Для перорального введения соответствующие фармацевтические композиции антагонистов рецептора GnRH включают порошки, гранулы, пилюли, таблетки, пастилки, жевательные резинки, гели и капсулы, а также жидкости, сиропы, суспензии, эликсиры и эмульсии. Соединения по изобретению могут также быть использованы в быстро растворяющихся, быстро разлагающихся лекарственных формах. Эти композиции могут также включать антиоксиданты, вкусовые добавки, консерванты, суспендирующие вещества, загустители и эмульгаторы, красители, ароматизирующие вещества и другие фармацевтически приемлемые добавки. Композиции для перорального введения могут быть составлены способом, который обеспечивает немедленное высвобождение активного вещества или модифицированное высвобождение, где модифицированное высвобождение включает замедленное, пролонгированное, прерывистое,контролируемое, целевое и программируемое высвобождение. Для парентерального введения соединения по настоящему изобретению вводят непосредственно в кровоток, в мышцу или во внутренний орган посредством внутривенной, внутриартериальной, внутрибрюшинной, внутримышечной, подкожной или другой инъекции или инфузии. Парентеральные композиции могут быть получены в виде водных растворов для инъекций, которые могут содержать, помимо антагониста рецептора GnRH, буферы, антиоксиданты, антимикробные добавки, соли, углеводы и другие добавки, обычно применяемые в таких растворах. Парентеральные введения могут представлять собой немедленное или модифицированное высвобождение (например, препараты с пролонгированным действием или имплантированные препараты). Соединения по настоящему изобретению могут также вводится местно, (интра)дермально или трансдермально в кожный покров или слизистую оболочку. Композиции для местного введения включают гели, гидрогели, лосьоны, растворы, крема, мази, повязки, пены, кожные пластыри, облатки, импланты и микроэмульсии. Соединения по настоящему изобретению могут также быть введены путем ингаляции или интраназального введения, например в виде сухого порошка, распыляемого аэрозоля или капель. Другие пути введения для соединений по настоящему изобретению включают интравагинальный и ректальный (в виде свечей, маточного кольца или клизмы) и офтальмологический и ушной. Для введения пациенту суммарная дневная доза соединений по настоящему изобретению может находится в пределах 1-500 мг, обычно 5-300 мг, более типично 25-250 мг, в зависимости, разумеется, от ряда факторов, включая возраст, пол и вес пациента, а также способа введения. Суммарная дневная доза может быть введена целиком или разделенными дозами. Следующие примеры приведены с целями иллюстрации, а не ограничения. В заключение, антагонисты рецептора GnRH по настоящему изобретению могут быть анализированы с помощью общих описанных выше способов, тогда как следующие примеры описывают синтез представленных в качестве примера соединений по настоящему изобретению. Примеры ВЭЖХ метод анализа образцов. Время удерживания, tR, в минутах. Способ 1: колонка: Synergi 4 мк, Max-RP 80A, 502 мМ; Градиенты: от 95% Н 2 О+0,025% ТФУ/MeCN до 95% MeCN+0,025% ТФУ/H2O в течение 3 мин; Скорость потока: 1 мл/мин; УФ: 222 и 254 нМ. Способ 2: колонка: Synergi 4 мк, Max-RP 80A, 502 мМ; Градиенты: от 95% Н 2 О+0,025% ТФУ/MeCN до 95% MeCN+0,025% ТФУ/H2O в течение 13 мин; Скорость потока: 1 мл/мин; УФ: 222 и 254 нМ. Способ 3: колонка: Phenomenex 5 мк, Gemini C18 110 А, 1504,6 мМ; Градиенты: от 95% Н 2 О+0,04% NH4OH до 90% MeCN+0,04% NH4OH в течение 9,86 мин; Стадия 1 А. 5-Бром-2-трифторметилизоникотиновая кислота. В 100-мл круглодонную колбу, снабженную резиновой пробкой и впускным отверстием для подачи азота, загружали 5 г (22,1 ммоль) 5-бром-2-трифторметилпиридина. К твердому веществу добавляли 30 мл безводного ТГФ в атмосфере азота. После того как раствор становился гомогенным, его охлаждали на бане со смесью сухой лед/ацетон при -78 С. В отдельную 100-мл круглодонную колбу, оборудованную резиновой пробкой и впускным отверстием для подачи азота, загружали 3,4 мл (24,2 мл, 1,1 экв.) безводного диизопропиламина. К раствору добавляли 16,9 мл безводного ТГФ, помещали в атмосферу азота и охлаждали на ледяной бане. К раствору осторожно добавляли 9,7 мл (24,3 ммоль, 1,1 экв.) 2,5 М н-бутиллитий в гексане. Светло-желтый раствор LDA охлаждали на бане со смесью сухой лед/ацетон при -78 С. 100 мл грушевидную колбу, оборудованную резиновой пробкой, впускным отверстием для подачи азота, мешалкой, термопарой и иглой с двухголовой канюлей, помещали в атмосферу азота и охлаждали на бане со смесью сухой лед/ацетон при -78 С. В 250-мл круглодонную колбу, оборудованную резиновой пробкой, впускным отверстием для СО 2, игольчатым выпускным отверстием и мешалкой, загружали 30 мл безводного ТГФ. Раствор охлаждали на бане со смесью сухой лед/ацетон при -78 С и в течение 10 мин в раствор барботировали безводный СО 2. В пустую 100-мл колбу загружали 5 мл раствора LDA. Туда помещали 5 мл раствора 5-бром-2 трифторметилпиридина с такой скоростью, чтобы поддерживать температуру раствора, равной -60 С. В процессе добавлении смесь перемешивали в течение 1 мин, затем переносили с помощью канюли при избыточном давлении азота в раствор, насыщенный CO2. Это давало раствор светло-бордового цвета. Процесс повторяли до тех пор, пока все исходные вещества не переместили в раствор с СО 2. CO2 раствор оставляли перемешиваться на бане со смесью сухой лед/ацетон при -78 С в течение 1 ч. Охлаждающую баню удаляли и раствор оставляли нагреваться до комнатной температуры. К реакционной смеси осторожно добавляли 150 мл насыщенного раствора хлорида аммония. Смесь помещали в 500 мл делительную воронку. Слой водной фазы отделяли и органическую фазу экстрагировали 100 мл 1 н. раствора гидроксида натрия. Объединенные водные фазы экстрагировали 100 мл МТВЕ. Водную фазу подкисляли концентрированной соляной кислотой до рН 1. Мутную водную смесь дважды экстрагировали с помощью 200 мл МТВЕ. Объединенные органические фазы промывали один раз 100 мл насыщенного солевого раствора, сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 5-бром-2-трифторметилизоникотиновой кислоты (4,7 г) в виде твердого вещества кремового цвета с выходом 78%. Стадия 1 В. 5-Бром-2-трифторметилизоникотинамид. В 500-мл круглодонную колбу, оборудованную мешалкой, конденсатором и впускным отверстием для подачи азота, загружали 38,9 г (144 ммоль) 5-бром-2-трифторметилизоникотиновой кислоты. К твердому веществу добавляли 250 мл безводного дихлорметана, затем 13,2 мл (151 ммоль, 1,05 экв.) оксалилхлорида. К смеси добавляли 0,5 мл безводного диметилформамида и смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакция завершалась, что подтверждали данные ВЭЖХ (гашение аликвоты метанолом). Растворитель удаляли в вакууме с получением масла янтарного цвета. В 1-л колбу Эрленмейера, оборудованную мешалкой на ледяной бане, загружали 500 мл водного раствора гидроксида аммония. К охлажденному раствору по каплям добавляли неочищенный хлорангидрид. К остатку добавляли небольшое количество ацетонитрила. После добавления смесь перемешивали в течение 20 мин. Полученный осадок собирали фильтрованием и промывали водой. Фильтрат сушили в вакууме при 45 С с получением 31,8 г 5-бром-2-трифторметилизоникотинамида в виде твердого вещества кремового цвета с выходом 82%. Соединение может также быть очищено, путем суспендирования в эфире и сбора твердого вещества.- 21017029 Стадия 1 С. 5-Бром-2-трифторметилизоникотинонитрил. В 100-мл круглодонную колбу, оборудованную мешалкой, конденсатором и впускным отверстием для подачи азота, загружали 5,2 г (19,3 ммоль) 5-бром-2-трифторметилизоникотинамида. Твердое вещество разбавляли 12 мл оксихлорида фосфора. Смесь нагревали при 70 С в течение 3 ч. Смесь охлаждали до комнатной температуры и выливали на лед. Смесь нейтрализовали осторожным добавлением 50%ного гидроксида натрия. Полученное твердое вещество кремового цвета собирали фильтрованием, промывали водой и сушили в вакууме при 50 С в течение 18 ч. Это давало 4,5 г 5-бром-2 трифторметилизоникотинонитрила 1-1 в виде твердого вещества кремового цвета с выходом 94%. 1 Н ЯМР (CDCl3):9,03 (с, 1 Н), 7,91 (с, 1 Н). 5-Бром-4-метил-2-(трифторметил)пиридин. Стадия 1E. 5-Бром-4-метил-2-(трифторметил)пиридин. В высушенную 250-мл круглодонную 3-горловую колбу, оборудованную мешалкой, термометром,и продутую азотом, помещали безводный ТГФ (16 мл, Aldrich, без ингибитора), затем N,Nдиизопропиламин (0,895 г, 8,85 ммоль, Aldrich, дважды перегнанный, с чистотой 99,95%). После охлаждения перемешиваемого раствора до -70 С добавляли по каплям н-бутиллитий (3,54 мл 2,5 М раствора в гексане, 8,85 ммоль), поддерживая температуру реакции ниже чем -60 С. Полученный раствор перемешивали при -70 С в течение еще 10 мин, затем нагревали до -20 С и сразу охлаждали до -90 С. Добавляли по каплям раствор 5-бром-2-(трифторметил)пиридина (2 г, 8,85 ммоль) в безводном ТГФ (8 мл, Aldrich, без ингибитора), поддерживая температуру реакции меньше чем -85 С. Образовывавшийся раствор оранжевого цвета перемешивали при -90 С в течение 40 мин. В отдельную высушенную 250-мл 3-горловую круглодонную колбу, оборудованную мешалкой,термометром и продутую азотом, помещали безводный ТГФ (5 мл, Aldrich, без ингибитора), затем метилйодид (5 мл, 80 ммоль). Раствор охлаждали до -90 С. К нему добавляли (через канюлю) раствор предварительно полученного литированного пиридина, контролируя скорость для поддержания температуры реакции в приемной колбе ниже -80 С. Полученный раствор темного цвета перемешивали при -90 С в течение еще 15 мин (ЖХМС показывала завершение реакции). Реакцию гасили насыщенным водным раствором NH4Cl (50 мл), затем оставляли медленно нагреваться до комнатной температуры. Органические вещества экстрагировали с помощью EtOAc (250 мл), затем объединенные органические слои промывали водой (50 мл), затем насыщенным солевым раствором (50 мл), отделяли, сушили над MgSO4 и затем фильтровали. Концентрирование в вакууме давало 1,68 г масла коричневого цвета, которое очищали посредством вакуумной дистилляции с коротким путем (45-46 С, приблизительно 5 мм рт.ст.) с получением 5-бром-4-метил-2-(трифторметил)пиридина 1-2 (0,289 г, 14%) в виде масла желтого цвета(14 мл, 123 ммоль) и охлаждали до 2 С на бане со смесью соль/лед. Добавляли по каплям бром (1,65 мл,32,1 ммоль), поддерживая внутреннюю температуру ниже 2 С. Добавляли раствор нитрита натрия(3,69 г, 53,5 ммоль) в воде (5 мл), поддерживая внутреннюю температуру ниже 5 С, и перемешивали в течение 1 ч в интервале температур между 0 и 5 С. рН доводили до 13 путем медленного добавления охлажденного 50%-ного NaOH (водный). После нагревания до комнатной температуры реакционную смесь экстрагировали с помощью эфира, органические вещества сушили над MgSO4 и концентрировали с получением масла коричневого цвета. Флэш-хроматография на силикагеле, элюируя смесью 5% эфира/гексан, давала продукт в виде твердого вещества белого цвета (1,83 г, 7,29 ммоль, 68%). МС (М+Н)+: 251,9; tR=2,3 мин (способ 1). Стадия 1G. Амид (5-бром-4-метилпиридин-2-ил)-N-трет-бутилкарбоновой кислоты. 2,5-Дибром-4-метилпиридин (1,83 г, 7,29 ммоль) растворяли в толуоле (100 мл), охлаждали до-78 С и добавляли по каплям раствор H-BuLi (4,4 мл, 8,8 ммоль, 2,0 М в пентане) и перемешивали при-78 С в течение 2 ч. Добавляли по каплям раствор трет-BuNCO (1,1 мл, 9,5 ммоль) в толуоле (3 мл) и перемешивали в течение 1 ч при -78 С, затем нагревали до -10 С и гасили добавлением NH4Cl (водный). После нагревания до комнатной температуры реакционную смесь экстрагировали эфиром и органические вещества сушили над Na2SO4 и концентрировали. Продукт использовали без дополнительной очистки.- 22017029 МС (М+Н)+: 271,0; tR=2,44 мин (способ 1). Стадия 1 Н. 5-Бром-2-циано-4-метилпиридин. Этот продукт растворяли в толуоле (10 мл). Добавляли POCl3 (10 мл) и раствор кипятили с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры растворители удаляли в вакууме, реакционную смесь подщелачивали добавлением 2 М NaOH (водный) и экстрагировали эфиром. Органический экстракт промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали. Хроматография на силикагеле, элюируя смесью 20% EtOAc/гексан, давала 5-бром-2-циано-4 метилпиридин 1-3 в виде кристаллического твердого вещества кремового цвета (920 мг, 4,7 ммоль, 64% с 2-х стадий). 1 Н ЯМР (300 МГц, CDCl3): 8,73 (1 Н, с), 7,56 (1 Н, с), 2,46 (3 Н, с). МС (М+Н)+: 196,8,0; tR=2,04 мин (способ 1). 2-Бром-3,5-дихлор-6-метилпиридин Стадия 1I. 2-Бром-3,5-дихлор-6-метилпиридин. 2-Амино-3,5-дихлор-6-метилпиридин (3,54 г, 20 ммоль) суспендировали в водном 48%-ном растворе HBr при комнатной температуре и смесь охлаждали до -20 С. Температуру суспензии поддерживали при -20 С по мере того, как по каплям добавляли бром (2,87 мл, 56 ммоль). Полученную пасту перемешивали в течение 30 мин при этой температуре и добавляли по каплям охлажденный раствор нитрита натрия (3,59 г, 52 ммоль) в воде (5 мл). На данном этапе реакционную смесь оставляли нагреваться до комнатной температуры. После перемешивания в течение дополнительных 60 мин смесь вновь охлаждали до -20 С и обрабатывали раствором гидроксида натрия (16 г, 0,4 моль) в воде (20 мл). Эту смесь экстрагировали этилацетатом и органический слой промывали водой и затем насыщенным солевым раствором. Органический раствор сушили над MgSO4, фильтровали и остаток, полученный после упаривания растворителя, очищали хроматографией с силикагелем [элюент: 10% этилацетат в гексане]. 2-Бром-3,5 дихлор-6-метилпиридин 1-4 (2,14 г, 45%) получали в виде твердого вещества. 5-Бром-4-хлор-2-метилпиридин Стадия 1J. Оксид 5-бром-2-метил-4-нитропиридина. Смесь 5-бром-2-метилпиридина (10,0 г, 58,0 ммоль), перекиси водорода (28 мл, 30% вводе) в уксусной кислоте (28 мл) нагревали при 90 С в течение 2 дней, затем добавляли дополнительное количество перекиси водорода (14 мл). Смесь нагревали в течение еще 1 дня. При охлаждении до комнатной температуры смесь экстрагировали три раза с помощью CHCl3. Затем органический раствор сушили надMgSO4 и концентрировали с получением неочищенного оксида пиридина. МС (М+Н)+: 187,7; tR=2,22 мин (способ 1). Вышеуказанный оксид пиридина добавляли в смесь HNO3 (18 мл) и H2SO4 (16 мл) при 0 С. Затем смесь нагревали до 90 С в течение 48 ч, оставляли охлаждаться до комнатной температуры и выливали в воду со льдом с получением осадка. Затем твердое вещество фильтровали и сушили с получением оксида 5-бром-2-метил-4-нитропиридина (7,32 г). МС (М+Н)+: 232,7; tR=1,94 мин (способ 1). Стадия 1K. 5-Бром-4-хлор-2-метилпиридин. Оксид 5-бром-2-метил-4-нитропиридина (7,0 г, 30 ммоль) кипятили с обратным холодильником в конц. HCl (80 мл) в течение 16 ч. Смесь оставляли охлаждаться до комнатной температуры, частично концентрировали и затем нейтрализовали NaOH (10 н.) до рН 7. Неочищенный продукт распределяли между CHCl3 и водой. Органический раствор отделяли, сушили и концентрировали с получением оксида 5-бром-4-хлор-2-метилпиридина в виде твердого продукту белого цвета (6,71 г). МС (М+Н)+: 223,7; tR=1,91 мин (способ 1). К твердому продукту (6,71 г, 30 ммоль) в CHCl3 (60 мл) при 0 С медленно добавляли POCl3(7,85 мл, 90 ммоль). Смесь кипятили с обратным холодильником в течение 3 ч и оставляли охлаждаться до комнатной температуры. Продукт экстрагировали CHCl3. Экстрагированный раствор промывали насыщенным NaHCO3, водой и сушили над MgSO4. Затем фильтрат концентрировали с получением 5 бром-4-хлор-2-метилпиридина 1-5 в виде масла желтого цвета (5,9 г). МС (М+Н-Cl)+: 171,9; tR=2,13 мин (способ(0,5 мл), затем медленно добавляли оксалилхлорид (22,5 мл, 55 ммоль, 2 М в DCM). Смесь перемешивали в течение 1 ч, затем концентрировали с получением 3-бром-4-хлорбензоилхлорида в виде твердого вещества кремового цвета. Стадия 2 В. 3-Бром-4-хлор-N-(2-метоксифенил)бензамид. 3-Бром-4-хлорбензоилхлорид в DCM (200 мл) охлаждали на ледяной бане и медленно добавляли триэтиламин (11,1 мл, 80 ммоль), затем добавляли по каплям о-анизидин (4,5 мл, 40 ммоль) в DCM(50 мл). На данном этапе ледяную баню удаляли и смесь перемешивали в течение 12 ч, затем распределяли между DCM и водой. Органический слой промывали 1 н. HCl, насыщенным NaHCO3, насыщенным солевым раствором и сушили над MgSO4. Концентрирование фильтрата давало 3-бром-4-хлор-N-(2 метоксифенил)бензамид в виде твердого вещества розоватого цвета (13,5 г). Стадия 2 С. 3-Бром-4-хлор-N-(2-метоксифенил)-N-метилбензамид. К 3-бром-4-хлор-N-(2-метоксифенил)бензамиду (13,5 г, 39 ммоль) в ДМФ (100 мл) при 0-5 С добавляли NaH (1,9 г, 46,8 ммоль, 60% в минеральном масле) несколькими частями, потом добавляли йодметан (3,15 мл, 50,7 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч и распределяли между этилацетатом и водой. Затем органический слой промывали 1 н. HCl, насыщенным NaHCO3,насыщенным солевым раствором и сушили над MgSO4. Фильтрование через слой силикагеля, затем концентрирование и кристаллизация из смеси эфир/гексан давали 3-бром-4-хлор-N-(2-метоксифенил)-Nметилбензамид (10,9 г) в виде твердого вещества белого цвета. МС (М+Н)+: 353,9; tR=2,812 мин (способ 1). 1 Н ЯМР (CDCl3):7,62 (1 Н, д, J=1,5 Гц), 7,23-7,09 (3 Н, м), 7,06-7,00 (1 Н, м), 6,88-6,78 (2 Н, м), 3,75(3 Н, с), 3,34 (3 Н, с). Стадия 2 С. 3-Бром-4-хлор-N-(2-метоксифенил)-N-метилбензамид (альтернативный синтез). К 3-бром-4-хлорбензоил хлориду (5,4 г, 21,4 ммоль) в DCM (100 мл), охлажденному на ледяной бане, добавляли метокси-N-метиланилин (3,2 г, 23,4 ммоль), затем медленно добавляли триэтиламин(5,9 мл, 42,5 ммоль). После завершения добавления ледяную баню удаляли и смесь перемешивали при комнатной температуре в течение 12 ч, затем распределяли между DCM и водой. Затем органический слой промывали 1 н. HCl, насыщенным NaHCO3, насыщенным солевым раствором и сушили над MgSO4. Концентрирование и очистка хроматографией на колонке с силикагелем, элюируя смесью гексан/этилацетат (4/1), давали 3-бром-4-хлор-N-(2-метоксифенил)-N-метилбензамид (5,1 г) в виде твердого вещества. Стадия 2D. 4-Хлор-N-(2-метоксифенил)-N-метил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2 ил)бензамид. К 3-бром-4-хлор-N-(2-метоксифенил)-N-метилбензамиду (9,7 г, 27,4 ммоль) в диоксане (150 мл) добавляли бис-(пинаколато)дибор (10,4 г, 41,1 моль), ацетат калия (8,05 г, 82,2 ммоль) и Pd(dppf)2Cl2CH2Cl2 (1,1 г, 1,35 ммоль). В смесь барботировали N2 в течение 10 мин и затем нагревали в атмосфере N2 при 80 С в течение 24 ч. Смесь охлаждали до комнатной температуры, фильтровали через слой силикагеля, затем концентрировали. Полученное масло очищали хроматографией на колонке с силикагелем,элюируя этилацетатом в гексане 20-30% с получением 4-хлор-N-(2-метоксифенил)-N-метил-3-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)бензамида (10,7 г). 1 Н ЯМР (CDCl3):7,66 (1 Н, д, J=2,4 Гц), 7,32-7,23 (1 Н, м), 7,17-7,07 (2 Н, м), 7,02-6,95 (1 Н, м), 6,826,74 (2 Н, м), 3,74 (3 Н, с), 3,33 (3 Н, с), 1,30 (12 Н, с). Стадия 2E. 4-Хлор-3-(6-хлорпиридин-3-ил)-N-(2-метоксифенил)-N-метилбензамид 2-1. В смесь толуола (1,5 мл) и воды (0,5 мл), содержащую 4-хлор-N-(2-метоксифенил)-N-метил-3(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензамид (60 мг, 0,15 ммоль), 5-бром-2-хлорпиридин(29 мг, 0,15 ммоль), Pd(PPh3)4 (12 мг, 0,01 ммоль), Na2CO3 (2N, 0,15 мл, 0,3 ммоль), барботировали N2 в течение 5 мин, затем нагревали при 100 С в течение 12 ч. Потом смесь фильтровали и очищали с помощью препаративной ЖХМС с получением 4-хлор-3-(6-хлорпиридин-3-ил)-N-(2-метоксифенил)-Nметилбензамида 2-1 (22,6 мг). МС (М+Н)+: 386,7; tR=7,77 мин (способ 2). Стадия 2 Е. 4-Хлор-3-(6-хлорпиридин-3-ил)-N-(2-метоксифенил)-N-метилбензамид (альтернативный синтез). Смесь 4-хлор-N-(2-метоксифенил)-N-метил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензамида (60 мг, 0,15 ммоль), 5-бром-2-хлорпиридина (29 мг, 0,15 ммоль), Pd(PPh3)4 (12 мг, 0,01 ммоль),- 24017029K2CO3 (41 мг, 0,3 ммоль) в диоксане (1 мл), нагревали при 100 С в течение 12 ч. Затем смесь фильтровали и очищали с помощью препаративной ЖХМС с получением 4-хлор-3-(6-хлорпиридин-3-ил)-N-(2 метоксифенил)-N-метилбензамида 2-1. Следующие соединения получали в соответствии со способами, описанными выше.- 28017029 бане, добавляли метокси-N-метиланилин (2 г, 14,6 ммоль) в DCM (10 мл), затем медленно добавляли диизопропилэтиламин (3,4 мл, 18,95 ммоль). После завершения добавления ледяную баню удаляли и смесь перемешивали при комнатной температуре в течение 48 ч. Смесь промывали 1 н. HCl, насыщенным(5,1 г, 96%). МС (М+Н)+: 355,7; tR=2,89 мин (способ 1). Аналогичным образом получали 9,2 г (88%) 3-бром-4-хлор-N-(2-метокси-6-метилфенил)бензамид из 2-метокси-6-метилфениламина (4,2 г, 30,3 ммоль). МС (М+Н)+: 355,9; tR=2,80 мин (способ 1). Аналогичным образом получали 2,35 г (931) 3-бром-4-хлор-N-(3-фтор-2-метоксифенил)бензамида из 3-фтор-2-метоксифениламина (1 г, 7,08 ммоль) с той разницей, что для очистки использовали хроматографию на колонке с силикагелем (элюент: EtOAc/гексан=1/4). МС (М+Н)+: 359,9; tR=2,56 мин (способ 1). Стадия 3 А.1. 3-Бром-4-хлор-N-(2-метокси-6-метилфенил)-N-метилбензамид. Эту стадию применяли только, если анилин, использованный на стадии 3 А, не был N-метилирован. 3-Бром-4-хлор-N-(2-метокси-6-метилфенил)-N-метилбензамид (4,2 г) получали из 3-бром-4-хлор-N(2-метокси-6-метилфенил)бензамида (4 г, 11,3 ммоль), используя способ, описанный для стадии 2 С. МС (М+Н)+: 369,9; tR=2,89 мин (способ 1). Аналогичным образом получали 2,3 г (98%) 3-бром-4-хлор-N-(3-фтор-2-метоксифенил)-Nметилбензамид из 3-бром-4-хлор-N-(3-фтор-2-метоксифенил)бензамида (2,3 г, 6,4 ммоль). Для очистки использовали хроматографию на колонке с силикагелем (элюент: EtOAc/гексан=1/4 с градиентом до 2/3). МС (М+Н)+: 373,9; tR=2,44 мин (способ 1). Стадия 3 В. 3-Бром-4-хлор-N-(2-гидроксифенил)-N-метилбензамид. К охлажденному раствору (-70 С) 3-бром-4-хлор-N-(2-метоксифенил)-N-метилбензамида (2 г,5,64 ммоль) в DCM (20 мл) по каплям добавляли BBr3 (1,7 мл, 18 ммоль) в течение 20 мин. Температуру реакции повышали до комнатной в течение 12 ч до завершения реакции. После концентрирования в вакууме смесь распределяли между DCM и водой. Для повышения рН до 5 добавляли 1 н. NaOH. Органический слой отделяли и промывали насыщенным солевым раствором и сушили над Na2SO4. Концентрирование и очистка хроматографией на колонке с силикагелем, элюируя смесью гексан/этилацетат (4/1 с градиентом до 3/2), давали 3-бром-4-хлор-N-(2-гидроксифенил)-N-метилбензамид (1,78 г, 93%). МС (М+Н)+: 341,9; tR=2,56 мин (способ 1). Аналогичным способом получали 1,9 г (100%) 3-бром-4-хлор-N-(2-гидрокси-6-метилфенил)-Nметилбензамид из 3-бром-4-хлор-N-(2-метокси-6-метилфенил)-N-метилбензамида (2 г, 5,4 ммоль). МС (М+Н)+: 355,9; tR=2,60 мин (способ 1). Аналогичным способом получали 1,65 г (90%) 3-бром-4-хлор-N-(3-фтор-2-гидроксифенил)-Nметилбензамид из 3-бром-4-хлор-N-(3-фтор-2-метоксифенил)-N-метилбензамида (1,9 г, 5,1 ммоль). МС (М+Н)+: 359,9; tR=2,22 мин (способ 1). Стадия 3 С. Метиловый эфир 2-[(3-бром-4-хлорбензоил)метиламино]феноксиуксусной кислоты. Смесь 3-бром-4-хлор-N-(2-гидроксифенил)-N-метилбензамида (442 мг, 1,3 ммоль), метилбромацетата (0,247 мл, 2,6 ммоль) и K2CO3 (717 мг, 5,2 ммоль) нагревали в ДМФ (8 мл) при 80 С в течение 5 ч. После охлаждения до комнатной температуры смесь распределяли между этилацетатом и водой. Органический слой отделяли и промывали насыщенным солевым раствором, сушили над Na2SO4, затем очищали хроматографией на колонке с силикагелем, элюируя смесью этилацетат/гексан,(1/4), с получением метилового эфира 2-[(3-бром-4-хлорбензоил)метиламино]феноксиуксусной кислоты (495 мг). МС (М+Н)+: 413,9; tR=2,75 мин (способ 1). Аналогичным способом получали метиловый эфир 4-2-[(3-бром-4-хлорбензоил)метиламино]феноксимасляной кислоты (0,41 г) с выходом 72%. МС (М+Н)+: 441,9; tR=2,87 мин (способ 1). Аналогичным образом получали метиловый эфир 5-2-[(3-бром-4-хлорбензоил)метиламино]феноксипентановой кислоты (0,53 г) с выходом 99%. МС (М+Н)+: 456,0; tR=2,94 мин (способ 1). Аналогичным образом получали метиловый эфир 4-2-[(3-бром-4-хлорбензоил)метиламино]-3 метилфеноксимасляной кислоты (0,54 г) с выходом 85%. МС (М+Н)+: 456,0; tR=2,94 мин (способ 1). Аналогичным образом получали метиловый эфир 4-2-[(3-бром-4-хлорбензоил)метиламино]-6 фторфеноксимасляной кислоты (0,93 г) с выходом 93%. МС (М+Н)+: 460,0; tR=2,45 мин (способ 1). Аналогичным образом получали трет-бутиловый эфир 4-2-[(3-бром-4-хлорбензоил)метиламино]-3 метилфеноксимасляной кислоты (0,78 г) с выходом 79%. МС (М+Н)+: 498,1; tR=2,75 мин (способ 1). Стадия 3D. Метиловый эфир
МПК / Метки
МПК: C07C 255/57, C07D 417/12, A61K 31/435, C07D 239/36, C07D 213/61, C07D 495/02, C07D 401/12, C07D 215/14, C07D 213/84, C07D 413/12, C07D 213/56, A61P 35/00, C07D 213/70, C07C 233/88, C07D 215/54
Метки: гонадотропин-рилизинг-фактора, рецептора, применения, антагонисты, способы
Код ссылки
<a href="https://eas.patents.su/30-17029-antagonisty-receptora-gonadotropin-rilizing-faktora-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецептора гонадотропин-рилизинг-фактора и способы их применения</a>
Предыдущий патент: Антибактериальная композиция
Следующий патент: Способ выемки твердого полезного ископаемого
Случайный патент: Бесшатунный двигатель внутреннего сгорания и способ изготовления этого двигателя












