Биарилзамещенные гетероциклические ингибиторы lta4h для лечения воспаления
Номер патента: 17618
Опубликовано: 30.01.2013
Авторы: Гарни Марк, Чжао Лей, Санданаяка Винсент, Юй Пэн, Беделл Луис, Сингх Джасбир, Мамат Бьерн, Мишра Рама К.
Формула / Реферат
1. Соединение формулы
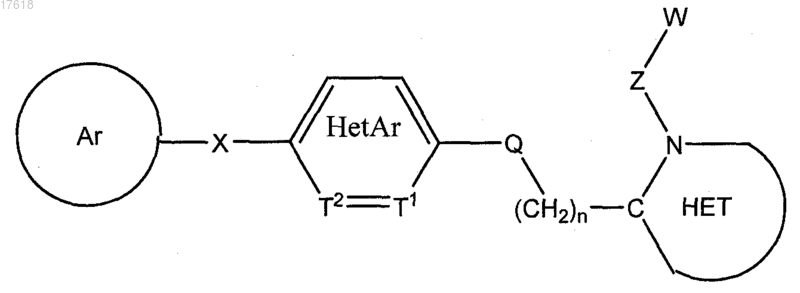
где Ar выбирают из группы, состоящей из
арила;
гетероарила;
арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, гидрокси, гидрокси(C1-C4)алкила, формила, формил(C1-C4)алкила, циано, циано(C1-C4)алкила, бензила, бензилокси, фенила, гетероарила, гетероциклилалкила, замещенного гетероарила и нитро; и
гетероарила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси и нитро;
X выбирают из группы, состоящей из О, SO, S(O2), NR1, CH2, CF2, CH2CH2, CH2NR1, NR1CH2, CH=CH, C=O, CH2C=O, CR1aR1b, OCR1aR1b, CR1aR1bO, C(=O)NR1 и NR1C(=O);
R1 выбирают отдельно в каждом случае из группы, состоящей из Н и низшего алкила;
R1a выбирают из группы, состоящей из Н, ОН и низшего алкила;
R1b выбирают из группы, состоящей из Н и низшего алкила, или R1a и R1b, взятые вместе, могут образовывать 3-6-членное кольцо, которое может необязательно содержать гетероатом, выбранный из О, S, и N;
Т1 и Т2 представляют собой атомы углерода, образующие бензольное кольцо, или один из Т1 и Т2 может представлять собой атом азота, образующий пиридиновое кольцо;
Q выбирают из -O-, -NR1- и S(O)p;
р равно 0, 1 или 2;
n равно целому числу, выбранному из 1-5;
НЕТ выбирают из группы, состоящей из
4-7-членного насыщенного азотсодержащего гетероцикла и
4-7-членного насыщенного азотсодержащего гетероцикла, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, амино, карбокси, низшего алкила, низшего ацила, низшего алкокси, N-оксида, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро; и
взятые вместе ZW представляют собой Н или
Z представляет собой (CH2)1-10, где одна или две (СН2) могут быть необязательно заменены -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или
-C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере одной -(СН2)-;
W выбирают из группы, состоящей из ацила, гидроксила, карбоксила, амино, -C(O)NHR4, аминоацила,
-СОО-алкила, -СНО, гетероциклила, замещенного арила, замещенного гетероциклила, сульфонамида,
-С(О)фторалкила, -С(О)СН2С(О)Оалкила, -С(O)СН2С(O)Офторалкила, -SH, -C(O)NH(OH), -С(O)N(ОН)R4,
-N(ОН)С(О)ОН, -N(OH)C(O)R4; и
R4 выбирают из группы, состоящей из Н, (С1-С4)алкила и фенил(C1-C4)алкила; при условии, что:
(a) если Q представляет собой -O-, НЕТ представляет собой (S)-пирролидин, rac-пирролидин или пиперидин, Ar представляет собой фенил или галогензамещенный фенил, HetAr представляет собой п-фенилен, тогда сочетание Z-W является отличным от Н; и
(b) если Q представляет собой -O-, НЕТ представляет собой азетидин, Ar представляет собой фенил, n равно 1, HetAr представляет собой 2,5-замещенный пиридин, тогда сочетание Z-W является отличным от Н;
где низшим алкилом называют алкильную группу, содержащую от 1 до 6 атомов углерода;
циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, содержащие от 3 до 8 атомов углерода;
низший алкокси означает группу, содержащую от 1 до 4 атомов углерода;
ацил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации, насыщенные, ненасыщенные и ароматические, а также их комбинации, присоединенные к исходной структуре через карбонильные связи;
низший ацил означает группу, содержащую от 1 до 4 атомов углерода;
арил и гетероарил означает 5- или 6-членное ароматическое или гетероароматическое кольцо, содержащее 0-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S.
2. Соединение по п.1, где T1/T2 кольцо представляет собой пиридинил, формулы
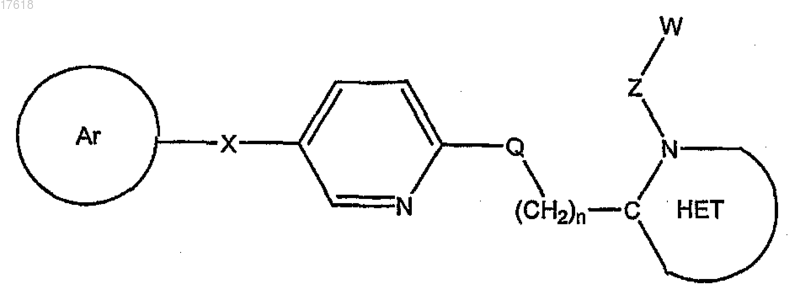
3. Соединение по п.1, где T1/Т2 кольцо представляет собой пиридинил, формулы
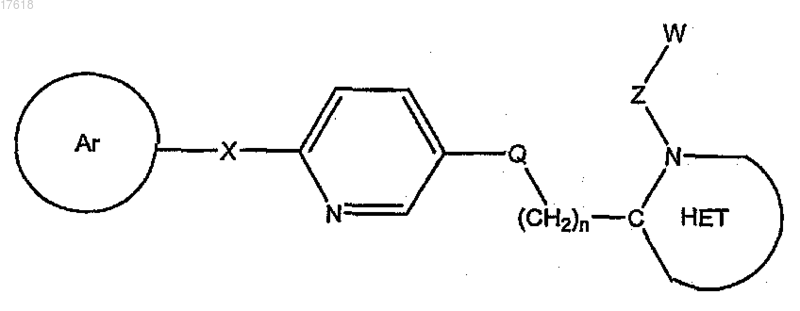
4. Соединение по п.1, где T1/Т2 кольцо представляет собой парафенилен, формулы
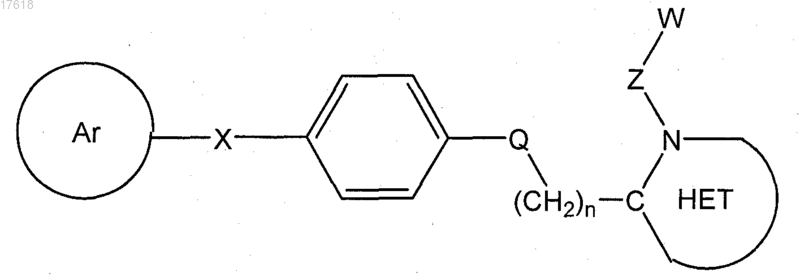
5. Соединение по п.4, где Q представляет собой -NR1-, формулы
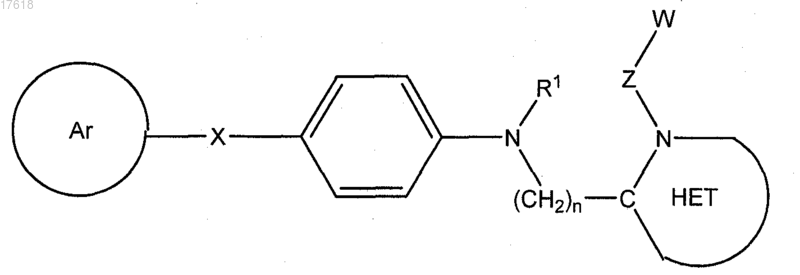
6. Соединение по п.4, где Q представляет собой -S(O)p-, формулы
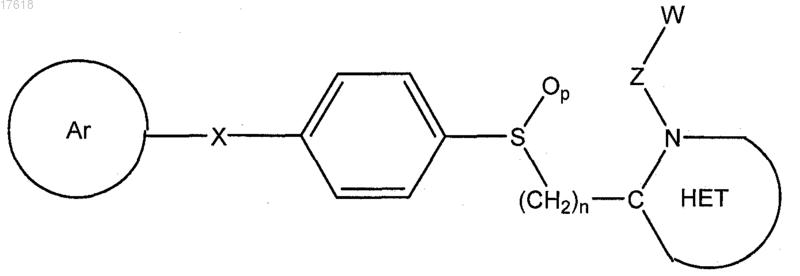
7. Соединение по п.4, где Q представляет собой -О-, формулы
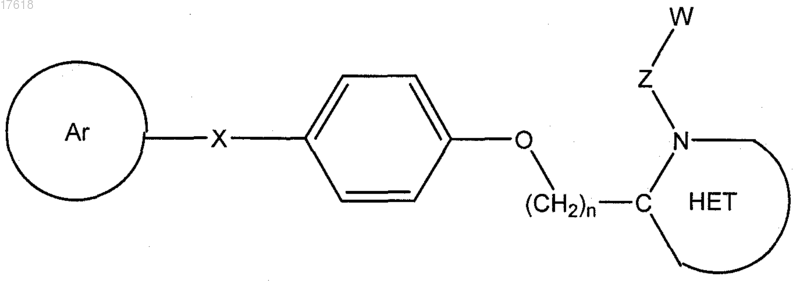
где Ar выбирают из группы, состоящей из
арила;
гетероарила;
арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро; и
гетероарила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано и нитро;
X выбирают из группы, состоящей из О, SO, S(O2), NR1, CH2, CF2, CH2O, С=O и СН2С=O;
R1 выбирают независимо в каждом случае из группы, состоящей из Н и низшего алкила;
n равно целому числу, выбранному из 1-5;
НЕТ выбирают из группы, состоящей из
4-7-членного насыщенного азотсодержащего гетероцикла и
4-7-членного насыщенного азотсодержащего гетероцикла, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро;
Z представляет собой (CH2)1-10, где одна или две (СН2) могут быть необязательно заменены -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере двумя -(СН2)-;
W выбирают из ацила, гидроксила, карбоксила, амино, карбоксамидо, аминоацила, -СООалкила, -СНО, гетероциклила, замещенного арила и замещенного гетероциклила.
8. Соединение по п.7, где X выбирают из СН2, О и NR1.
9. Соединение по п.7, где НЕТ выбирают из группы, состоящей из пирролидинона, пирролидина, пиперидина, пиперидинона, пиперазина, морфолина, тиоморфолина, тиазолидина, тиазолидинона, оксазолидина и оксазолидинона, а также замещенного пирролидинона, замещенного пирролидина, замещенного пиперидина, замещенного пиперидинона, замещенного пиперазина, замещенного морфолина, замещенного тиоморфолина, замещенного тиазолидина, замещенного тиазолидинона, замещенного оксазолидина и замещенного оксазолидинона.
10. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы

где R3 выбирают из галогена, CF3, метила, метокси и CF3O.
11. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы
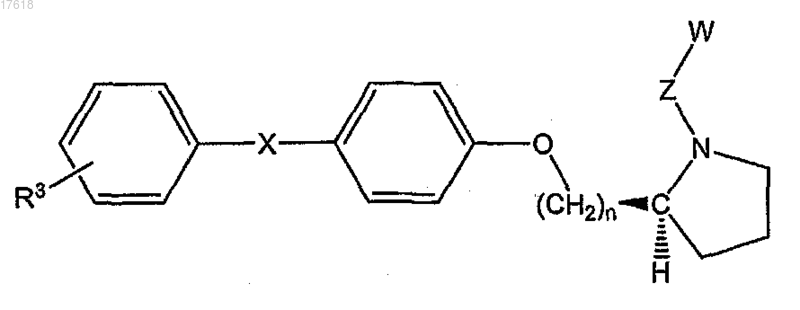
где X представляет собой О или СН2 и R3 выбран из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро.
12. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы
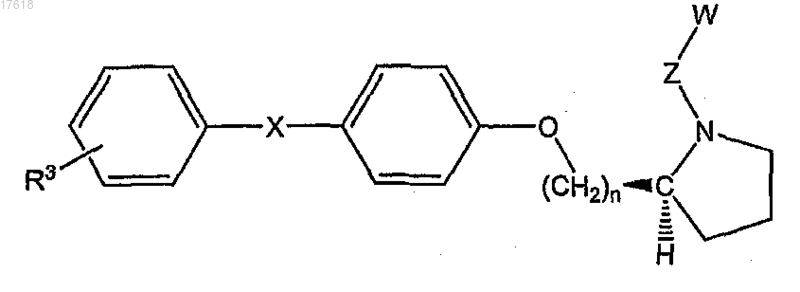
где n равно 1 или 2 и R3 выбран из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро.
13. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы
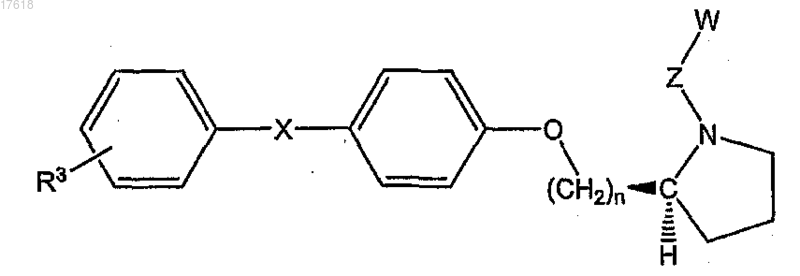
где Z представляет собой С1-С4 алкилен и R3 выбран из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро.
14. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы
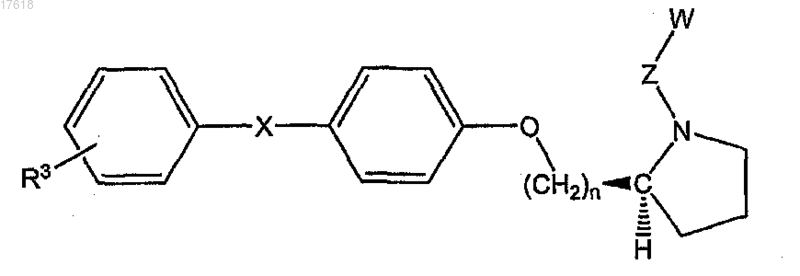
где W представляет собой СООН и R3 выбран из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро.
15. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы
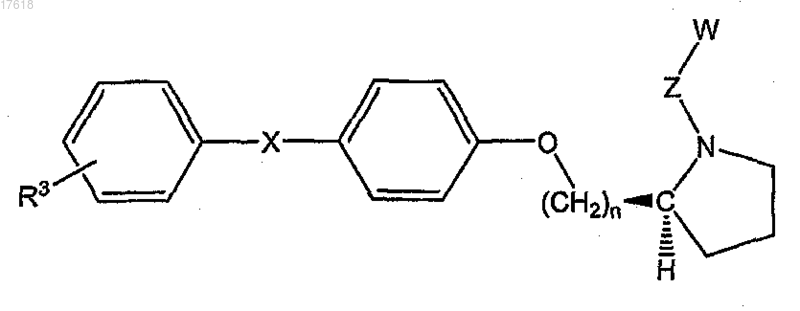
где R3 выбирают из галогена, CF3, метила, метокси, CF3O;
X представляет собой О или СН2;
n равно 1 или 2;
Z представляет собой C1-C4 алкилен и
W представляет собой СООН.
16. Соединение по п.9, где НЕТ представляет собой пирролидин и сочетание Z-W является отличным от Н.
17. Соединение по п.16, где HET-Z-W выбирают из группы, состоящей из пиридинилметилпирролидина, оксадиазолилметилпирролидина, карбоксиалкилпирролидина и алкоксикарбонилалкилпирролидина.
18. Соединение по п.17, где HET-Z-W представляет собой карбоксиалкилпирролидин, формулы
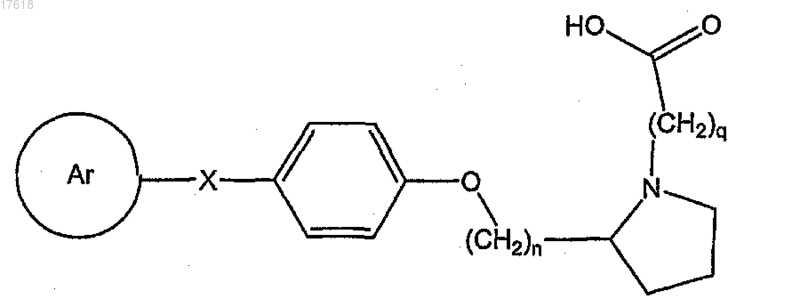
где q равно целому числу, выбранному из 2-6.
19. Соединение по п.17, где HET-Z-W представляет собой карбоксиалкил-(S)-пирролидин, формулы
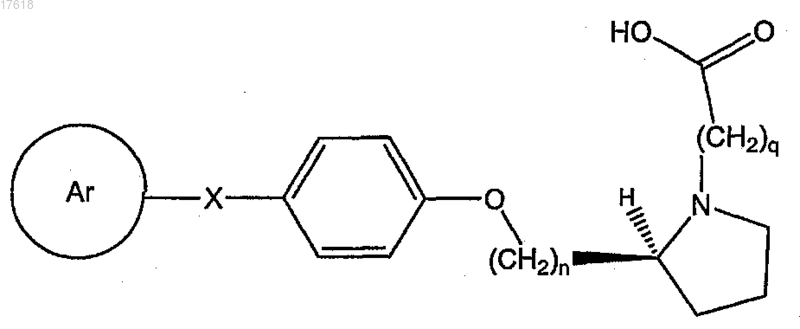
где q равно целому числу, выбранному из 2-6.
20. Соединение по п.9, где НЕТ выбирают из группы, состоящей из пирролидина, пирролидинона, пиперидина и пиперидинона.
21. Соединение по п.7, где НЕТ представляет собой (R)-пирролидин, формулы
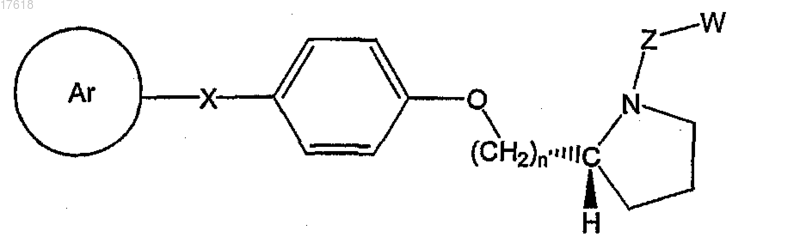
где Ar выбирают из группы, состоящей из
арила;
гетероарила;
арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, гидрокси, гидрокси(C1-C4)алкила, формила, формил(C1-C4)алкила, циано, циано(С1-С4)алкила, бензила, бензилокси, фенила, гетероарила, гетероциклилалкила, замещенного гетероарила и нитро; и
гетероарила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, (С1-С4)алкила, (C1-C4)алкокси, бензила и бензилокси;
X выбирают из группы, состоящей из О, SO, S(O2), NR1, CH2, CF2, СН2СН2, CH2NH, NHCH2, CH=CH, C=O и CH2C=O;
взятые вместе ZW представляют собой Н или
Z представляет собой (CH2)1-10, где одна или две (СН2) могут быть необязательно заменены -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или
-C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере одной -(СН2)-; и
W выбирают из группы, состоящей из ацила, гидроксила, карбоксила, амино, карбоксамидо, аминоацила,
-СООалкила, -СНО, гетероциклила, замещенного арила и замещенного гетероциклила.
22. Соединение по п.21, где ZW представляет собой Н, формулы
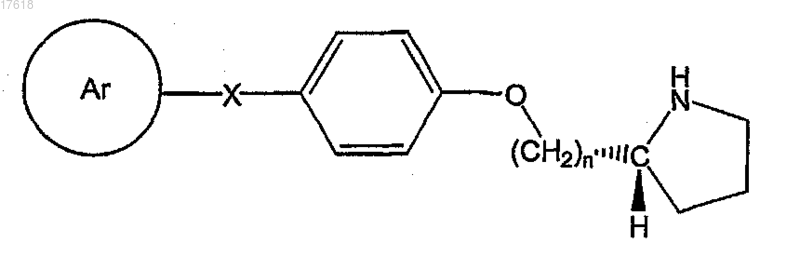
23. Соединение по п.22, где X выбирают из СН2, О и NR1.
24. Соединение по п.23, где X представляет собой СН2 или О, n равно 1 и Ar представляет собой паразамещенный фенил.
25. Соединение по п.24, где Ar представляет собой гетероарилфенил.
26. Соединение по п.7, где НЕТ представляет собой (S)-пирролидин, формулы

где R3 представляет собой один-три остатка, независимо выбранных из группы, состоящей из бензила, бензилокси, фенила, гетероарила и гетероарила, замещенного галогеном, метилом, метокси или трифторметокси.
27. Соединение по любому из пп.1-9 или 16-25, где Ar представляет собой
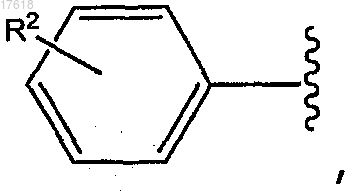
где волнистая линия указывает на точку присоединения к X и R2 выбирают из водорода, галогена, трифторметила, метила, метокси, триенила, фуранила, а также триенила или фуранила, замещенных галогеном, трифторметилом, метилом или метокси.
28. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере одного соединения по любому из пп.1-26.
29. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере одного соединения по п.27.
30. Способ ингибирования лейкотриен А4 гидролазы, включающий приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы
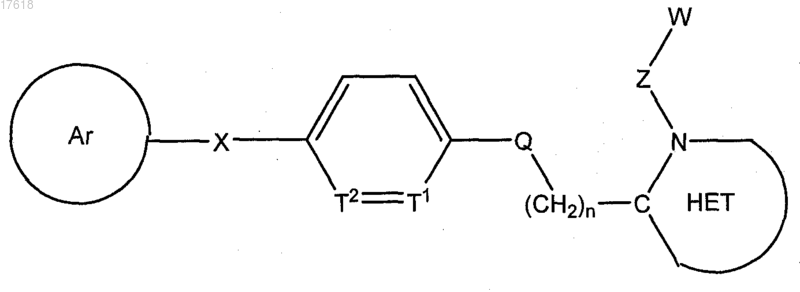
где Ar выбирают из группы, состоящей из
арила;
гетероарила;
арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, гидрокси, гидрокси(C1-C4)алкила, формила, формил(С1-С4)алкила, циано, циано(C1-C4)алкила, бензила, бензилокси, фенила, гетероарила, гетероциклилалкила, замещенного гетероарила и нитро; и
гетероарила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси и нитро;
X выбирают из группы, состоящей из О, SO, S(O2), NR1, CH2, CF2, СН2СН2, CH2NR1, NR1CH2, CH=CH, C=O, CH2C=O, CR1aR1b, OCR1aR1b, CR1aR1bO, C(=O)NR1 и NR1C(=O);
R1 выбирают отдельно в каждом случае из группы, состоящей из Н и низшего алкила;
R1a выбирают из группы, состоящей из Н, ОН и низшего алкила;
R1b выбирают из группы, состоящей из Н и низшего алкила, или R1a и R1b, взятые вместе, могут образовывать 3-6-членное кольцо, которое может необязательно содержать гетероатом, выбранный из О, S, и N;
Т1 и Т2 представляют собой атомы углерода, образующие бензольное кольцо, или один из Т1 и Т2 может представлять собой атом азота, образующий пиридиновое кольцо;
Q выбирают из -О-, -NR1- и S(O)p;
р равно 0, 1 или 2;
n равно целому числу, выбранному из 1-5;
НЕТ выбирают из группы, состоящей из
4-7-членного насыщенного азотсодержащего гетероцикла и
4-7-членного насыщенного азотсодержащего гетероцикла, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, амино, карбокси, низшего алкила, низшего ацила, низшего алкокси, N-оксида, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро; и
взятые вместе ZW представляют собой Н или
Z представляет собой (CH2)1-10, где одна или две (СН2) могут быть необязательно заменены -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR1-, -SO-, -S(O)2-, -C(=O)- или
-C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере одной -(СН2)-;
W выбирают из группы, состоящей из ацила, гидроксила, карбоксила, амино, -C(O)NHR4, аминоацила,
-СООалкила, -СНО, гетероциклила, замещенного арила, замещенного гетероциклила, сульфонамида,
-С(О)фторалкила, -С(О)СН2С(О)Оалкила, -С(O)СН2С(O)Офторалкила, -SH, -C(O)NH(OH), -С(O)N(ОН)R4,
-N(ОН)С(О)ОН, -N(OH)C(O)R4; и
R4 выбирают из группы, состоящей из Н, (С1-С4)алкила и фенил(С1-С4)алкила;
где низшим алкилом называют алкильную группу, содержащую от 1 до 6 атомов углерода;
циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, содержащие от 3 до 8 атомов углерода;
низший алкокси означает группу, содержащую от 1 до 4 атомов углерода;
ацил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации, насыщенные, ненасыщенные и ароматические, а также их комбинации, присоединенные к исходной структуре через карбонильные связи;
низший ацил означает группу, содержащую от 1 до 4 атомов углерода;
арил и гетероарил означает 5- или 6-членное ароматическое или гетероароматическое кольцо, содержащее 0-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S.
31. Способ ингибирования лейкотриен А4 гидролазы, включающий приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы
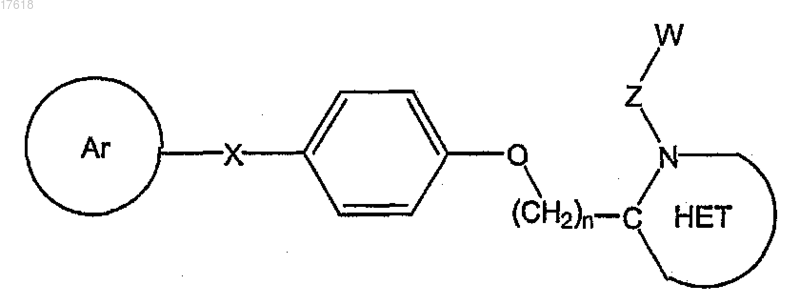
где Ar выбирают из группы, состоящей из
арила;
гетероарила;
арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро; и
гетероарила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано и нитро;
X выбирают из группы, состоящей из О, SO, S(O2), NR1, CH2, CF2, CH2O, С=O и СН2С=O;
R1 выбирают независимо в каждом случае из группы, состоящей из Н и низшего алкила;
n равно целому числу, выбранному из 1-5;
НЕТ выбирают из группы, состоящей из
4-7-членного насыщенного азотсодержащего гетероцикла и
4-7-членного насыщенного азотсодержащего гетероцикла, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро;
взятые вместе ZW представляют собой Н или
Z представляет собой (CH2)1-10, где одна или две (СН2) могут быть необязательно заменены -O-, -NR-, -SO-,
-S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере двумя -(СН2)-; и
W выбирают из ацила, гидроксила, карбоксила, амино, карбоксамидо, аминоацила, -СООалкила, -СНО, гетероциклила, замещенного арила и замещенного гетероциклила;
где низшим алкилом называют алкильную группу, содержащую от 1 до 6 атомов углерода;
циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, содержащие от 3 до 8 атомов углерода;
низший алкокси означает группу, содержащую от 1 до 4 атомов углерода;
ацил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации, насыщенные, ненасыщенные и ароматические, а также их комбинации, присоединенные к исходной структуре через карбонильные связи;
низший ацил означает группу, содержащую от 1 до 4 атомов углерода;
арил и гетероарил означает 5- или 6-членное ароматическое или гетероароматическое кольцо, содержащее 0-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S.
32. Способ лечения заболевания, связанного с лейкотриен А4 гидролазой, включающий введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1-26.
33. Способ по п.32, где указанное заболевание, связанное с лейкотриен А4 гидролазой, представляет собой воспаление, аллергическое воспаление, острое воспаление и хроническое воспаление, астму, хроническую стенозную болезнь легких (COPD), ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника (IBD), псориаз, атеросклероз, тромбоз, острый коронарный синдром, стабильную стенокардию, болезнь периферических сосудов, критическую ишемию ног, перемежающуюся хромоту, аневризм абдоминальной аорты и инфаркт миокарда.
34. Способ лечения заболевания, связанного с лейкотриен А4 гидролазой, включающий введение млекопитающему терапевтически эффективного количества соединения по п.27.
Текст
БИАРИЛЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ LTA4H ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ Изобретение относится к химическому классу биарилзамещенных гетероциклических ингибиторов LTA4H (лейкотриен А 4 гидролаза), полезных для лечения, а также предотвращения и профилактики воспалительных заболеваний и расстройств. Соединения имеют общую формулу(71)(73) Заявитель и патентовладелец: ДЕКОД ДЖЕНЕТИКС ЕХФ (IS) 017618 Область техники изобретения Изобретение относится к химическому классу биарилзамещенных гетероциклических ингибиторовLTA4H (лейкотриен А 4 гидролаза), пригодных для лечения, а также предотвращения и профилактики воспалительных заболеваний и расстройств. Уровень техники Конечные продукты лейкотриенового пути являются сильными липидными медиаторами воспаления, производными арахидоновой кислоты. Они потенциально могут вносить вклад в развитие атеросклероза и дестабилизацию атеросклеротических бляшек за счет окисления липидов и/или провоспалительных эффектов. Как описано в других источниках, на хромосоме 13q12 идентифицировали ген, играющий основную роль при инфаркте миокарда (ИМ) (MI), [Helgadottir et al., Nature Geneticsdoi:10.1038/ng1311, 8 февраля 2004]. Данный ген (ALOX5AP), далее в данном описании называемый геном болезни ИМ, содержит нуклеиновую кислоту, которая кодирует белок, активирующий 5 липоксигеназу (FLAP), далее называемый FLAP. Модификации ДНК в гене FLAP увеличивают риск инфаркта миокарда в 1,8 раз и инсульта в 1,7 раз. Лейкотриеновый путь через посредство FLAP ведет к продуцированию лейкотриена В 4 при помощи фермента лейкотриен А 4 гидролазы (LTA4H). Лейкотриен В 4 является одним из наиболее сильных хемокиновых медиаторов артериального воспаления. Определенные модификации ДНК в гене, кодирующем LTA4H, также увеличивают риск ИМ и инсульта, как описано в других источниках [Hakonarsson et al., J. Am. Med. Assoc. 293, 2245-2256 (2005)]. Если нейтрофилы, полученные от индивидуумов, имеющих в анамнезе ИМ, стимулировать иономицином, они продуцируют больше лейкотриена В 4. Увеличенное продуцирование LTB4 особенно выражено у пациентовмужчин, имеющих в анамнезе ИМ, которые имеют модификации риска в гене FLAP [Helgadottir et al.]. Воздействие (профилактическое и/или терапевтическое) на определенные заболевания и состояния (например, ИМ, острый коронарный синдром (ОКС) (ACS), инсульт, атеросклероз), связанные с FLAP или сLTA4H, можно осуществлять, ингибируя LTA4H. Ингибирование LTA4H дает преимущества для способов лечения ИМ или предрасположенности к ИМ; ОКС (например, нестабильная стенокардия, инфаркт миокарда без увеличения ST (NSTEMI) или инфаркт миокарда с увеличением ST (STEMI); для снижения риска второго ИМ; для инсульта (включая преходящее нарушение мозгового кровообращения) или предрасположенности к инсульту; для атеросклероза у таких пациентов, которые нуждаются в лечении (например, ангиопластике, стентах, аортокоронарном шунтировании) для восстановления кровотока в коронарных артериях, у таких пациентов, которые нуждаются в лечении болезни периферических сосудов,включая периферическое окклюзионное поражение артерий, критическую ишемию конечностей (например, гангрена, изъязвление) и перемежающуюся хромоту, для восстановления кровотока в нижних конечностях; для атеросклеротической нефро-васкулярной болезни; для аневризмы абдоминальной аорты и/или для снижения синтеза лейкотриенов (например, для лечения ИМ). Публикации патентных заявок США 20050043378 и 20050043379 относятся к бензооксазол-2 ильным, бензотиазол-2-ильным и 1 Н-бензоимидазол-2-ильным соединениям и их производным, полезным в качестве ингибиторов лейкотриен А 4 гидролазы (LTA4H) при лечении воспаления и заболеваний,связанных с воспалением. Данные описания, насколько они применительны, включены в данное описание посредством ссылок. Сущность изобретения Настоящее изобретение относится к соединениям, способным ингибировать фермент LTA4H,имеющим общую формулу где Ar выбирают из группы, состоящей из арила; гетероарила; арила, замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего алкокси, низшего фторалкила, низшего фторалкокси, гидрокси, гидрокси(C1-C4)алкила, формила, формил (C1-C4) алкила, циано, циано (C1-C4) алкила, бензила, бензилокси, фенила, гетероарила, гетероциклилалкила, замещенного гетероарила и нитро; и гетероарила,замещенного от одного до трех заместителями, независимо выбранными из группы, состоящей из галогена, низшего алкила, низшего ацила, низшего алкокси, низшего фторалкила, низшего фторалкокси,формила, циано, бензила, бензилокси и нитро;R1 выбирают отдельно в каждом случае из группы, состоящей из Н и низшего алкила;R1b выбирают из группы, состоящей из Н и низшего алкила, или R1a и R1b, взятые вместе, могут об-1 017618 разовывать 3-6-членное кольцо, которое может необязательно содержать гетероатом, выбранный из О, S,и N; Т 1 и Т 2 представляют собой атомы углерода, образующие бензольное кольцо, или один из Т 1 и Т 2 может представлять собой атом азота, образующий пиридиновое кольцо;n равно целому числу, выбранному из 1-5; НЕТ выбирают из группы, состоящей из 4-7-членного насыщенного азотсодержащего гетероцикла и 4-7-членного насыщенного азотсодержащего гетероцикла, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, амино, карбокси, низшего алкила, низшего ацила, низшего алкокси, N-оксида, низшего фторалкила, низшего фторалкокси, формила, циано, бензила, бензилокси, фенила, гетероарила и нитро; и взятые вместе, ZW представляют собой Н или Z представляет собой (CH2)1-10, где одна или две (СН 2) могут быть необязательно заменены -O-,-NR1-, -SO-, -S(O)2-, -C(=O)- или -C=O(NH)-, при условии, что указанные -O-, -NR1-, -SO-, -S(O)2-,-C(=O)- или -C=O(NH)- не находятся в точке присоединения к НЕТ и разделены по меньшей мере одной(a) если Q представляет собой -O-, НЕТ представляет собой (S)-пирролидин, rac-пирролидин или пиперидин, Ar представляет собой фенил или галогензамещенный фенил, HetAr представляет собой пфенилен, тогда сочетание Z-W является отличным от Н; и(b) если Q представляет собой -O-, НЕТ представляет собой азетидин, Ar представляет собой фенил,n равно 1, HetAr представляет собой 2,5-замещенный пиридин, тогда сочетание Z-W является отличным от Н; где низшим алкилом называют алкильную группу, содержащую от 1 до 6 атомов углерода; циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, содержащие от 3 до 8 атомов углерода; низший алкокси означает группу, содержащую от одного до четырех атомов углерода; ацил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации, насыщенные, ненасыщенные и ароматические, а также их комбинации, присоединенные к исходной структуре через карбонильные связи; низший ацил означает группу,содержащую от одного до четырех атомов углерода; арил и гетероарил означает 5- или 6-членное ароматическое или гетероароматическое кольцо, содержащее 0-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S. Во втором аспекте изобретение относится к способу ингибирования лейкотриен А 4 гидролазы,включающему приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы. В третьем аспекте изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы. В четвертом аспекте изобретение относится к способам лечения, а также предотвращения и профилактики заболевания, состояния или расстройства, связанных с лейкотриен А 4 гидролазой. Способы включают введение млекопитающему терапевтически эффективного количества соединения, описанного выше. Заболевание или состояние может относиться к аллергическому, острому или хроническому воспалению. Заболевание может представлять собой, например, контактный или атопический дерматит, артрит, аллергический ринит, астму или аутоиммунные заболевания, такие как болезнь Крона, псориаз, язвенный колит, воспалительное заболевание кишечника, рассеянный склероз, анкилозирующий спондилоартрит и тому подобное. Аналогично, соединения, указанные выше, можно применять для предотвращения рецидивирующих воспалительных приступов. Данные соединения также полезны для лечения и предотвращения атеросклероза, тромбоза, инсульта, острого коронарного синдрома, стабильной стенокардии, болезни периферических сосудов, критической ишемии ног, перемежающейся хромоты, аневризмы абдоминальной аорты и инфаркта миокарда. Соединения по изобретению, которые ингибируют рост опухолей и метастазов, находят применение в лечении и предотвращении рака, включая рак пищевода, рак головного мозга. Подробное описание изобретения На протяжении данного описания заместителям даны определения при первом упоминании о них и эти определения далее сохраняются. Данное изобретение относится к соединениям общей формулы, приведенной ниже. Все соединения, попадающие под категорию указанного выше исходного класса и его подклассов,полезны в качестве ингибиторов лейкотриен А 4 гидролазы, однако не все соединения являются новыми. В частности, определенные известные виды попадают под категорию класса, хотя для данных видов не подразумевается применение для ингибирования LTA4H. При исследовании данного описания можно обнаружить, что соединения, которые исключены из формулы изобретения по соединениям, являются патентоспособными для авторов настоящего изобретения; также можно обнаружить, что дополнительные виды и классы, в настоящее время не исключенные, не являются патентоспособными для авторов настоящего изобретения. В любом случае, исключение видов и классов из заявляемой формулы изобретения следует рассматривать как артефакты при процедуре выдачи патента, что не отражает концепцию авторов изобретения или описание их изобретения. Изобретением, в аспекте композиции, являются все соединения формулы, за исключением тех, которые являются общественными. В частности, литературный поиск свидетельствует о том, что следующие три подкласса охватывают соединения, которые не могут быть заявлены в формуле изобретения:(1) если Q представляет собой -O-, НЕТ представляет собой (S)-пирролидин, rac-пирролидин или пиперидин, Ar представляет собой фенил или галогензамещенный фенил, HetAr представляет собой пфенилен и сочетание Z-W представляет собой Н;(2) если Q представляет собой -O-, НЕТ представляет собой азетидин, Ar представляет собой фенил,n равно 1, HetAr представляет собой 2,5-замещенный пиридин и сочетание Z-W представляет собой Н. Класс охватывает четыре подкласса в зависимости от T1/Т 2 кольца: 2,5-пиридинил, обратный 2,5 пиридинил и парафенилен: В одном варианте осуществления изобретение относится к биарильным гетероциклам, полезным в качестве ингибиторов фермента LTA4H, имеющим общую формулу: В некоторых вариантах осуществления Q выбирают из О, S(O)P и NR1: В некоторых вариантах осуществления X выбирают из СН 2, О и NR1. В некоторых вариантах осуществления T1/T2 кольцо представляет собой парафенилен: В некоторых вариантах осуществления НЕТ выбирают из группы, состоящей из пирролидинона,пирролидина, пиперидина, пиперидинона, пиперазина, морфолина, тиоморфолина, тиазолидина, тиазолидинона, оксазолидина и оксазолидинона, а также замещенного пирролидинона, замещенного пирролидина, замещенного пиперидина, замещенного пиперидинона, замещенного пиперазина, замещенного морфолина, замещенного тиоморфолина, замещенного тиазолидина, замещенного тиазолидинона, заме-3 017618 щенного оксазолидина и замещенного оксазолидинона. В некоторых вариантах осуществления НЕТ представляет собой пирролидин и сочетание Z-W является отличным от водорода. В некоторых вариантах осуществления HET-Z-W выбирают из пиридинилметилпирролидина, оксадиазолилметилпирролидина, карбоксиалкилпирролидина и алкоксикарбонилалкилпирролидина. В некоторых вариантах осуществления HET-Z-W представляет собой карбоксиалкилпирролидин,имеющий химическую формулу, как представлено ниже: где q равно целому числу, выбранному из 2-6. В некоторых вариантах осуществления НЕТ выбирают из группы, состоящей из незамещенного пирролидина, пирролидинона, пиперидина и пиперидинона (то есть, Z-W представляет собой Н). В других вариантах осуществления HET-Z-W представляет собой карбоксиалкил-(S)-пирролидин,имеющий химическую формулу, как представлено ниже: где q равно целому числу, выбранному из 2-6. В определенных вариантах осуществления НЕТ представляет собой (R)пирролидин, имеющий химическую формулу, как представлено ниже: В некоторых вариантах осуществления НЕТ представляет собой В определенных вариантах осуществления НЕТ представляет собой (R)пирролидин, X выбирают из СН 2, О и NR1. В определенных вариантах осуществления НЕТ представляет собой (R)пирролидин, X представляет собой СН 2 или О, n равно 1, и Ar выбирают из фенила и замещенного фенила, и X выбирают из СН 2, О и NR1. В дополнительных вариантах осуществления X представляет собой СН 2 или О, n равно 1, и Ar представляет собой паразамещенный фенил. В других вариантах осуществления Ar представляет собой гетероарилфенил. В других вариантах осуществления Ar представляет собой где волнистая линия указывает на точку присоединения к X, и R2 выбирают из водорода, галогена,трифторметила, метила, метокси, триенила, фуранила, а также триенила или фуранила, замещенных галогеном, трифторметилом, метилом или метокси. В некоторых вариантах осуществления НЕТ представляет собой (S)пирролидин, имеющий химическую формулу, как представлено ниже: где R3 представляет собой галоген, CF3, метил, метокси или CF3O. X представляет собой O или СН 2,n равно 1 или 2, Z представляет собой С 1-С 4 алкилен и W представляет собой СООН. В некоторых вариантах осуществления НЕТ представляет собой (S)пирролидин, Q представляет собой кислород и Ar представляет собой замещенный фенил, имеющий химическую формулу, как представлено ниже: где R3 представляет собой один-три остатка, независимо выбранных из группы, состоящей из бензила, бензилокси, фенила и гетероарила.-4 017618 В некоторых вариантах осуществления Ar представляет собой фенил, замещенный гетероарилом,или гетероарил, замещенный заместителем, выбранным из группы, состоящей из галогена, метила, метокси и трифторметокси. Триенил и фуранил являются примерами гетероарила. В других вариантах осуществления Т 1/Т 2 кольцо представляет собой либо пиридин и Q представляет собой кислород, либо Т 1/Т 2 кольцо представляет собой парафенилен и Q представляет собой -NR1- или-S(O)P-. Примерами общих формул являются: В данных соединениях переменные могут являться такими, как описано выше для класса, в которомQ представляет собой -О- и Т 1/Т 2 кольцо представляет собой п-фенилен. В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере одного соединения, как описано выше. В способах по изобретению проводят параллель между композициями и препаратами. Способы включают введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение относится к способу ингибирования лейкотриен А 4 гидролазы, включающему приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы. Способ ингибирования лейкотриен А 4 гидролазы включает приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы: и любым из его подклассов, как описано выше. Например, изобретение также относится к способу ингибирования лейкотриен А 4 гидролазы, включающему приведение в контакт фермента LTA4H с терапевтически эффективным количеством соединения формулы: Кроме того, настоящее изобретение относится к способу подавления заболевания, связанного с лейкотриен А 4 гидролазой, включающему введение млекопитающему терапевтически эффективного количества соединения или его соли, гидрата или сложного эфира формулы. В некоторых вариантах осуществления заболевание связано с воспалением. В некоторых вариантах осуществления заболевание выбирают из аллергического воспаления, острого воспаления и хронического воспаления. Настоящее изобретение также относится к способу лечения воспаления, включающему введение млекопитающему терапевтически эффективного количества соединения формулы и ингибитора белка,активирующего 5-липоксигеназу (FLAP) [например, МК-0591 (Merck), BAY-X1005 (Bayer) и R-(-)-2-[(4 хинолин-2-илметокси)фенил]-2-циклопентилуксусной кислоты] и/или терапевтически эффективного количества соединения формулы и антагониста лейкотриена В 4 (LTB4) [например, SC 41930 (Searle), SC 53228 (Searle), акколата (зафирлукаст; Zeneca), сингулера (монтелукаст; Merck), ультаира (пранлукаст;Pharmacol Exp Ther 273: 176-184 (1995)]. Соединения класса, представленного выше формулой, являются ингибиторами фермента LTA4H. Вследствие этого они являются полезными для лечения и предотвращения воспалительных заболеваний и расстройств, как описано выше, особенно таких состояний как астма, хроническая стенозная болезнь легких (COPD), атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника (IBD; включая болезнь Крона и язвенный колит), или псориаз, каждое из которых характеризуется избыточным или продолжительным воспалением на некоторой стадии заболевания. Недавние исследования свидетельствуют о том, что данные соединения также являются полезными для лечения и предотвращения атеросклероза, тромбоза, инсульта, острого коронарного синдрома, стабильной стенокардии, болезни периферических сосудов, критической ишемии ног, перемежающейся хромоты, аневризмы абдоминальной аорты и инфаркта миокарда. Соединения могут представлять собой соли. Термин "фармацевтически приемлемая соль" означает соли, противоион которых происходит из фармацевтически приемлемых нетоксичных кислот и оснований. Соответствующие фармацевтически приемлемые основно-аддитивные соли соединений по настоящему изобретению включают, но не ограничиваются ими: соли металлов, полученные из алюминия,кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина, N,Nдиалкильных производных аминокислот (например, N,N-диметилглицина, пиперидин-1-уксусной кислоты и морфолин-4-уксусной кислоты), N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метилглюкамина) и прокаина. Если соединения содержат остаток основания, соответствующие фармацевтически приемлемые основно-аддитивные соли соединений по настоящему изобретению включают неорганические кислоты и органические кислоты. Примеры включают ацетат, бензолсульфонат (безилат), бензоат, бикарбонат, бисульфат, карбонат, камфорсульфонат,цитрат, этансульфонат, малеат, малат, манделат, метансульфонат, мукат, нитрат, памоат, пантотенат,фосфат, сукцинат, сульфат, тартрат, п-толуолсульфонат и тому подобное. Для удобства и ясности описаны определенные термины, используемые в описании, примерах и формуле изобретения. Алкил подразумевается как включающий линейные, разветвленные или циклические углеводородные структуры, а также их комбинации. Низшим алкилом называют алкильные группы, содержащие от 1 до 6 атомов углерода. Примеры низших алкильных групп включают метил, этил, пропил, изопропил,бутил, втор- и трет-бутил и тому подобное. Предпочтительными алкильными группами являются такие,которые содержат С 20 или меньше. Циклоалкил представляет собой подгруппу алкила и включает циклические углеводородные группы, содержащие от 3 до 8 атомов углерода. Примеры циклоалкильных групп включают втор-пропил, втор-бутил, втор-пентил, норборнил и тому подобное. Углеводороды C1-С 20 включают алкил, циклоалкил, алкенил, алкинил, арил, арилалкил и их комбинации. Примеры включают фенетил, циклогексилметил, камфорил, адамантил и нафтилэтил. Алкокси или алкоксил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации и их комбинации, присоединенные к исходной структуре через атом кислорода. Примеры включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и тому подобное. Низший алкокси означает группы, содержащие от одного до четырех атомов углерода. Алкоксиалкил означает эфирные группы, содержащие от 3 до 8 атомов прямой, разветвленной,циклической конфигурации и их комбинации, присоединенные к исходной структуре через алкил. Примеры включают метоксиметил, метоксиэтил, этоксипропил и тому подобное. Алкоксиарил означает алкокси заместители, присоединенные к арилу, где арил присоединен к исходной структуре. Арилалкокси означает арильные заместители, присоединенные к атому кислорода, где атом кислорода присоединен к исходной структуре. Замещенный арилалкокси означает замещенный арильный заместитель, присоединенный к атому кислорода, где атом кислорода присоединен к исходной структуре. Ацил означает группы, содержащие от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации, насыщенные, ненасыщенные и ароматические, а также их комбинации, присоединенные к исходной структуре через карбонильные связи. Один или более атомов углерода в ацильном остатке могут быть замещены атомом азота, кислорода или серы, при условии, что точка присоединения к исходной структуре остается на карбониле. Примеры включают ацетил, бензоил, пропионил, изобутирил,трет-бутоксикарбонил, бензилоксикарбонил и тому подобное. Низший ацил означает группы, содержащие от одного до четырех атомов углерода. Арил и гетероарил означает 5- или 6-членное ароматическое или гетероароматическое кольцо, содержащее 0-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему,содержащую 0-3 гетероатома, выбранных из О, N или S. Ароматические 6-14-членные карбоциклические-6 017618 кольца включают, например, бензол и нафталин, и в соответствии с изобретением бензоксалан и остатки,в которых одно или более колец, но не обязательно все, являются ароматическими. 5-10-членные ароматические гетероциклические кольца включают, например, имидазол, пиридин, индол, тиофен, бензопиранон, тиазол, фуран, бензимидазол, хинолин, изохинолин, хиноксалин, пиримидин, пиразин, тетразол и пиразол. Арилалкил означает заместитель, в котором арильный остаток присоединен к исходной структуре через алкил. Примерами являются бензил, фенетил и тому подобное. Гетероарилалкил означает заместитель, в котором гетероарильный остаток присоединен к исходной структуре через алкил. Примеры включают, например, пиридинилметил, пиримидинилэтил и тому подобное. Гетероциклилалкил означает заместитель, в котором гетероциклильный остаток присоединен к исходной структуре через алкил. Примеры включают морфолинэтил и пирролидинилметил. Гетероцикл означает циклоалкильный или арильный остаток, в котором от одного до трех атомов углерода заменены гетероатомом, выбранным из группы, состоящей из N, О и S. Гетероатомы азота и серы, по желанию, могут быть окислены, и гетероатом азота, по желанию, может быть четвертичным. Примеры гетероциклов включают пирролидин, пиразол, пиррол, индол, хинолин, изохинолин, тетрагидроизохинолин, бензофуран, бензодиоксан, бензодиоксол (обычно называемый метилендиоксифенилом,когда выступает в качестве заместителя), тетразол, морфолин, тиазол, пиридин, пиридазин, пиримидин,тиофен, фуран, оксазол, оксазолин, изоксазол, диоксан, тетрагидрофуран и тому подобное. Следует отметить, что гетероарил представляет собой подкласс гетероциклов, в котором гетероцикл является ароматическим. Примеры гетероциклильных остатков дополнительно включают пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиразинил, оксазолидинил, изоксазолидинил,тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон, оксадиазолил, триазолил и тетрагидрохинолинил. Кислородсодержащий гетероцикл представляет собой гетероцикл, содержащий по меньшей мере один атом кислорода в кольце; он может содержать дополнительные атомы кислорода, а также другие гетероатомы. Серосодержащий гетероцикл представляет собой гетероцикл, содержащий по меньшей мере один атом серы в кольце; он может содержать дополнительные атомы серы, а также другие гетероатомы. Азотсодержащий гетероцикл представляет собой гетероцикл, содержащий по меньшей мере один атом азота в кольце; он может содержать дополнительные атомы азота, а также другие гетероатомы. Кислородсодержащий гетероарил представляет собой подкласс кислородсодержащего гетероцикла; примеры включают фуран и оксазол. Серосодержащий гетероарил представляет собой подкласс серосодержащего гетероцикла; примеры включают тиофен и тиазин. Азотсодержащий гетероарил представляет собой подкласс азотсодержащего гетероцикла; примеры включают пиррол, пиридин и пиразин. Насыщенный азотсодержащий гетероцикл представляет собой подкласс азотсодержащего гетероцикла. Насыщенный азотсодержащий гетероцикл содержит по меньшей мере один атом азота и может содержать дополнительные атомы азота, а также другие гетероатомы. Примеры включают пирролидин,пиразолидин, пиперидин, морфолин и тиоморфолин. Замещенные алкил, арил, циклоалкил, гетероциклил и так далее, означают алкил, арил, циклоалкил или гетероциклил, где вплоть до трех атомов Н в каждом остатке заменены галогеном, галогеналкилом,гидрокси, низшим алкокси, карбокси, карбоалкокси (также называемым алкоксикарбонилом), карбоксамидо (также называемым алкиламинокарбонилом), циано, карбонилом, нитро, амино, алкиламино, диалкиламино, меркапто, алкилтио, сульфоксидом, сульфоном, ациламино, амидино, фенилом, бензилом,гетероарилом, фенокси, бензилокси или гетероарилокси. Термины "галоген" и "гало" означают фтор, хлор, бром или йод. Следует понимать, что соединения по данному изобретению могут существовать в радиоактивно меченой форме, то есть соединения могут содержать один или более атомов, обладающих атомной массой или массовым числом, отличным от атомной массы или массового числа, обычно встречающихся в природе. Радиоизотопы водорода, углерода, фосфора, фтора и хлора включают 2 Н, 3 Н, 13 С, 14 С, 15N, 35S,18F и 36Cl, соответственно. Соединения, которые содержат данные радиоизотопы и/или другие радиоизотопы других атомов, входят в объем данного изобретения. Радиоизотопы трития, то есть 3 Н, и углерода 14, то есть, 14 С, являются особенно предпочтительными благодаря легкости их получения и выявления. Радиоактивно меченые соединения формулы по данному изобретению и их пролекарства, обычно, могут быть получены способами, хорошо известными специалистам в данной области. Подобные радиоактивно меченые соединения удобно получать при помощи способов, описанных в разделах примеров и схем,заменяя немеченые реагенты легко доступными радиоактивно мечеными реагентами. Как использовано в данном описании и как понятно специалисту в данной области, использование термина "соединение" подразумевает включение солей, сольватов, сокристаллов и комплексов включения данного соединения. Он также включает все полиморфы данного соединения в кристаллической форме. Термин "сольват" означает соединение формулы I в твердом состоянии, где молекулы соответст-7 017618 вующего растворителя встроены в кристаллическую решетку. Соответствующий растворитель для терапевтического введения является физиологически переносимым в дозах введения. Примерами соответствующих растворителей для терапевтического введения являются этанол и вода. Если растворителем является вода, сольват называют гидратом. В основном, сольваты получают растворением соединения в соответствующем растворителе и выделением сольвата путем охлаждения, либо при использовании антирастворителя. Обычно сольват сушат или подвергают азеотропной перегонке в условиях окружающей среды. Сокристаллы представляют собой комбинацию двух или более различных молекул, расположенных таким образом, что образуется уникальная кристаллическая форма, физические свойства которой отличаются от свойств ее отдельных составляющих. Фармацевтические сокристаллы с недавнего времени привлекают значительный интерес с точки зрения улучшения растворимости, составления препарата и биодоступности таких лекарственных средств, как итраконазол [см. Remenar et al. J. Am. Chem. Soc,125, 8456-8457 (2003)] и флуоксетин. Комплексы включения описаны в Remington: The Science and Practice of Pharmacy 19th Ed. (1995) volume 1, page 176-177. Наиболее широко используемыми комплексами включения являются комплексы с циклодекстринами, и все циклодекстриновые комплексы, природные и синтетические, с добавленными дополнительными компонентами и полимером(ами), или без них, как описано в патентах США 5324718 и 5472954, специально охвачены формулой изобретения. ОписанияRemington и патентов '718 и '954 включены в данное описание посредством ссылок. Соединения, описанные в данном описании, могут обладать асимметричными центрами и, таким образом, могут давать начало энантиомерам, диастереомерам и другим стереоизомерным формам. Каждый хиральный центр может быть определен в терминах абсолютной стехиометрии, как (R)- или (S)-. Подразумевается, что настоящее изобретение охватывает все возможные изомеры, а также их рацемические и оптически чистые формы. Оптически активные (R)- и (S)-изомеры могут быть получены, используя хиральные синтоны или хиральные реагенты или обратное растворение, с использованием общепринятых методов. Префикс "rac" обозначает рацемат. Если соединения, описанные в данном описании, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не оговорено особо, подразумевается, что соединения содержат как Е, так и Z геометрические изомеры. Изображение конфигурации любой углерод-углеродной двойной связи, представленное в данном описании, выбирают только для удобства, и если в прямой форме не указано, оно не предусмотрено для обозначения конкретной конфигурации. Таким образом, углерод-углеродная двойная связь, изображенная произвольно как Е,может представлять собой Z, Е или их смесь в любой пропорции. Аналогичным образом, подразумевается, что все таутомерные формы также включены. Графические изображения рацемических, амбискалемических и скалемических или энантиомерно чистых соединений, используемых в данном описании, взяты из Maehr J. Chem. Ed. 62, 114-120 (1985): сплошные или прерывистые клинья используют для обозначения абсолютной конфигурации хирального элемента; волнистые линии и одиночные тонкие линии указывают на отрицание любой подразумеваемой стереохимической предпосылки, которую связь, обозначаемая ею, может создавать; сплошные или прерывистые жирные линии представляют собой геометрические идентификаторы, указывающие на представленную относительную конфигурацию, но обозначающие рацемический тип; и контуры клина, а также пунктирные или прерывистые линии обозначают энантиомерно чистые соединения неопределенной абсолютной конфигурации. Терминология, относящаяся к "защите", "снятию защиты" и "защищенным" связям встречается в данном описании повсеместно. Данная терминология хорошо понятна специалистам в данной области и используется в контексте способов, которые включают последовательную обработку серией реагентов. В данном контексте защитная группа означает группу, которую используют, чтобы замаскировать связь на стадии способа, на которой она иначе может вступить в реакцию, но на данной стадии реакция является нежелательной. Защитная группа предотвращает реакцию на данной стадии, однако впоследствии ее можно удалить, чтобы открыть исходную связь. Удаление или "снятие защиты" происходит после завершения реакции или реакций, при которых данная связь создает препятствие. Таким образом, когда определяют последовательность реагентов, как это происходит в способах по изобретению, специалист в данной области сможет легко предсказать такие группы, которые можно использовать в качестве "защитных групп". Соответствующие группы для данной цели обсуждены в стандартных руководствах в области химии, таких как Protective Groups in Organic Synthesis автора T.W. Greene [John WileySons,New York, 1991], которое включено в данное описание посредством ссылки. Исчерпывающий список сокращений, используемых специалистами в области органической химии,присутствует в первом номере каждого тома Journal of Organic Chemistry. Список, который обычно представлен в виде таблицы, озаглавленной "Стандартный список сокращений" ("Standard List of Abbreviations"), включен в данное описание посредством ссылки. Как правило, соединения по настоящему изобретению можно получать при помощи способов, проиллюстрированных на общих схемах реакций, как, например, описано ниже, или их модификаций, используя легко доступные исходные вещества, реагенты и общепринятые методики синтеза. В данных реакциях также возможно использовать варианты, которые являются известными сами по себе, но не приведены в данном описании. Исходные вещества, например, в случае соединений с соответствующим-8 017618 образом замещенным бензимидазольным кольцом, являются либо коммерчески доступными, синтезированными, как описано в примерах, либо их можно получать способами, хорошо известными специалистам в данной области. Как показали доклинические исследования, ингибиторы LTA4H являются эффективными противовоспалительными средствами. Например, пероральное введение ингибитора LTA4H SC57461 грызунам приводит к ингибированию индуцированной ионофором продукции LTB4 в крови мышей ex vivo, и в брюшной полости крыс in vivo (Kachur et al., 2002, J. Pharm. Exp. Ther. 300(2), 583-587). Кроме того, лечение на протяжении восьми недель тем же самым ингибирующим соединением существенно уменьшило симптомы колита на модели приматов (Penning, 2001, Curr. Pharm. Des. 7(3): 163-179). Спонтанный колит, который развивается у данных животных, обладает сильным сходством с IBD человека. Вследствие этого, специалисты в данной области признают данные положительные результаты на LTA4H моделях, как обладающие прогностической ценностью относительно применения в терапии данного и других воспалительных заболеваний человека. Воспалительный ответ характеризуется болью, повышенной температурой, покраснением, припухлостью или снижением функции, либо сочетанием двух или нескольких таких симптомов. Термины воспаление, воспалительные заболевания или опосредованные воспалением заболевания или состояния включают, но без ограничения, острое воспаление, аллергическое воспаление и хроническое воспаление. Аутоиммунные заболевания ассоциированы с хроническим воспалением. Известно примерно 75 различных аутоиммунных заболеваний, которые можно отнести к двум типам: органоспецифические(направленные в основном на один орган) и неорганоспецифические (поражающие множественные органы). Примерами органоспецифических аутоиммунных заболеваний являются инсулинозависимый диабет (тип I), который поражает поджелудочную железу, тиреоидит Хашимото и болезнь Грейвса, которые поражают щитовидную железу, пернициозная анемия, которая поражает желудок, болезнь Кушинга и болезнь Аддисона, которые поражают надпочечники, хронический активный гепатит, который поражает печень; синдром поликистоза яичников (PCOS), глютеиновая болезнь, псориаз, воспалительное заболевание кишечника (IBD) и анкилозирующий спондилоартрит. Примерами неорганоспецифических аутоиммунных заболеваний являются ревматоидный артрит,рассеянный склероз, системная красная волчанка и злокачественная миастения. Кроме того, соединения, композиции и способы по настоящему изобретению полезны для лечения рака. Как было показано, имеется связь между синтезом лейкотриенов и различными формами рака,включая рак пищевода, рак головного мозга, рак поджелудочной железы, рак прямой кишки. Термины "способы лечения или предотвращения" означают уменьшение, предотвращение или облегчение симптомов и/или эффектов, связанных с липидами заболеваниями. Термин "предотвращение",как использовано в данном описании, означает введение лекарственного средства заранее, чтобы предупредить или смягчить острый эпизод. Специалисту в области медицины (для которого предназначен заявляемый способ) будет очевидно, что термин "предотвращать" не является абсолютным термином. В области медицины под ним понимают профилактическое введение лекарственного средства, чтобы существенно снизить вероятность или серьезность состояния, и именно такой смысл подразумевается авторами изобретения. Как использовано в данном описании, ссылка на "лечение" пациента предусматривает и профилактику, включительно. На всем протяжении данного описания присутствуют ссылки на различные источники. Полное содержание описаний данных публикаций включено в данное описание посредством ссылок."Введение" соединения по изобретению включает введение пролекарственных форм (например,сложных эфиров) таким образом, чтобы обеспечить эффективные уровни соединения у субъекта. Термин"пролекарство" означает соединение, которое становится более активным in vivo. Активация in vivo может происходить в результате химического воздействия или через посредство ферментов. Микрофлора вGI тракте может также принимать участие в активации in vivo. Обычные сложные эфиры, применяемые в качестве пролекарств, представляют собой метиловые, этиловые и оксиалкиловые сложные эфиры. Например, в соответствующих условиях Разнообразные пути введения являются возможными, включая, но, необязательно ограничиваясь ими, парентеральный (например, внутривенная, внутриартериальная, внутримышечная, подкожная инъекция), пероральный (например, заглатывание или ингаляция), местный, назальный, ректальный или при помощи микроносителей с замедленным высвобождением, в зависимости от заболевания или состояния,-9 017618 которое подвергается лечению. Пероральное, парентеральное и внутривенное введения являются предпочтительными. Термин "млекопитающее" используют в его словарном смысле. Люди входят в группу млекопитающих, и люди будут являться предпочтительными субъектами. Хотя введение соединений формулы в виде исходного химического соединения может являться возможным, предпочтительно представлять их в виде фармацевтической композиции. В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемые соль или сольват, вместе с одним или несколькими фармацевтическими носителями и, необязательно, с одним или несколькими другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в том смысле, что должен являться совместимым с другими ингредиентами препарата и не оказывать вредного влияния на реципиента. Препараты включают композиции, пригодные для перорального, парентерального (включая подкожное, внутрикожное, внутримышечное, внутривенное и внутриглазное), ректального и местного(включая кожное, трансбуккальное, подъязычное и внутриглазное) введения. Наиболее подходящий путь может зависеть от состояния и заболевания реципиента. Препараты могут быть для удобства предоставлены в единичной дозированной форме и получены любым из способов, хорошо известных в фармацевтической области. Все способы включают стадию объединения соединения формулы или его фармацевтически приемлемой соли или сольвата ("активный ингредиент") с носителем, который представляет собой один или несколько вспомогательных ингредиентов. Как правило, препараты получают, равномерно и однородно соединяя активный ингредиент с жидкими носителями или тонкоизмельченными твердыми носителями, или теми и другими, с последующим, при необходимости, приданием продукту формы желаемого препарата. Препараты по настоящему изобретению, применяемые для перорального введения, можно предоставлять в виде дискретных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошка (включая порошки микронизированные и в виде наночастиц) или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; либо в виде жидкой эмульсии типа "масло в воде" или "вода в масле". Активный ингредиент можно также предоставлять в виде болюса, электуария или пасты. Таблетка может быть получена прессованием или формованием, по желанию, с одним или несколькими вспомогательными ингредиентами. Спрессованные таблетки можно получать прессованием в соответствующем аппарате активного ингредиента в сыпучем состоянии, таком как порошок или гранулы, по желанию смешивая со связующим веществом, лубрикантом, инертным диспергирующим средством. Формованные таблетки можно получать формованием в соответствующем аппарате смеси порошкообразного соединения, смоченного инертным жидким растворителем. На таблетки можно, по желанию,наносить покрытие или делать шероховатыми, и их можно составлять таким образом, чтобы обеспечить продолжительное, отсроченное или контролируемое высвобождение из них активного ингредиента. Фармацевтические композиции могут содержать "фармацевтически приемлемый инертный носитель", и данное выражение подразумевает включение одного или нескольких инертных эксципиентов,которые включают крахмалы, высокомолекулярные спирты, гранулирующие средства, микрокристаллическую целлюлозу, разбавители, лубриканты, связующие вещества, дезинтегрирующие средства и тому подобное. При желании на таблетированные дозы описываемых композиций можно наносить покрытие при помощи стандартных водных и неводных методов. "Фармацевтически приемлемый носитель" также охватывает средства с контролируемым высвобождением. Композиции по настоящему изобретению могут также, по желанию, содержать другие терапевтические ингредиенты, средства против спекания, консерванты, подсластители, пигменты, отдушки, осушители, пластифицирующие добавки, красители и тому подобное. Любой такой необязательный ингредиент должен быть, безусловно, совместим с соединением по изобретению, чтобы гарантировать стабильность препарата. Диапазон доз для взрослых людей обычно составляет от 0,1 мкг до 10 г/сутки перорально. Таблетки или другие лекарственные формы, выполненные в виде дискретных единиц, могут для удобства содержать количество соединения по изобретению, которое является эффективным при данной дозировке или при многократных дозах, например единицах, содержащих от 0,1 до 500 мг, обычно примерно от 5 до 200 мг. Точное количество соединения, вводимого пациенту, должно оставаться на усмотрение лечащего врача. Однако применяемая доза будет зависеть от ряда факторов, включая возраст и пол пациента, конкретное заболевание, подвергаемое лечению, и степень его тяжести. Частота введения будет зависеть от фармакодинамики отдельного соединения и дозированной формы препарата, которую можно оптимизировать способами, хорошо известными в данной области (например, таблетки с контролируемым или замедленным высвобождением, энтеросолюбильным покрытием и так далее). Комбинированную терапию можно осуществлять, вводя два или несколько средств, каждое из которых составляют и вводят отдельно, либо вводя два или несколько средств в составе одного препарата. Другие комбинации также охватываются комбинированной терапией. Например, два средства можно объединить в одном препарате и вводить в комбинации с отдельным препаратом, содержащим третье средство. Хотя два или более средств при комбинированной терапии можно вводить одновременно, в- 10017618 этом нет необходимости. Например, введение первого средства (или комбинации средств) можно проводить перед введением второго средства (или комбинации средств) за минуты, часы, дни или недели. Таким образом, два или более средств можно вводить на протяжении нескольких минут одно за другим или на протяжении любого количества часов одно за другим, или на протяжении любого количества дней или недель одно за другим. В некоторых случаях возможными являются даже более длительные интервалы. Хотя во многих случаях желательно, чтобы два или более средств, применяемых в комбинированной терапии, присутствовали в организме пациента в одно и то же время, в этом нет необходимости. Комбинированная терапия может также включать два или более введений одного или нескольких средств, используемых в комбинации. Например, если средство X и средство Y используют в комбинации, их можно вводить последовательно в любой комбинации один или несколько раз, например, в следующем порядке X-Y-X, X-X-Y, Y-X-Y, Y-Y-X, X-X-Y-Y и так далее. В качестве ингибиторов LTA4H соединения формулыможно применять для лечения и предотвращения, в числе прочего, воспаления. Соединения и композиции можно применять преимущественно в комбинации с другими средствами, пригодными для лечения и предотвращения воспалительных состояний, а также для лечения и предотвращения атеросклероза, тромбоза, инсульта, острого коронарного синдрома, стабильной стенокардии, болезни периферических сосудов, критической ишемии ног, перемежающейся хромоты, аневризмы абдоминальной аорты и инфаркта миокарда. Такие средства включают ингибиторы FLAP и антагонисты LTB4. В основном, соединения по настоящему изобретению могут быть получены при помощи способов,проиллюстрированных на общих схемах реакций, как, например, описано ниже, или их модификаций,используя легкодоступные исходные вещества, реагенты и общепринятые методики синтеза. Схема IX=Br, I; R1=как определено на схеме I. Схема II. (i) (a) CuI, Cs2CO3, N,N-диметилглицин, (b) BBr3, CH2Cl2. Схема III Схема XXII: (I) ArB(OH)2, Pd/C, i-PrOH/H2O, кипячение с обратным холодильником, (II) ArBr, nBuLi, -78C, ТГФ, (III) Et3SiH, ТФУК, (IV) BBr3, (V) NaH, тозилат пирролидина, ДМФА, (VI) галоидалкил, K2CO3, ДМФА. Следующие конкретные неограничивающие примеры иллюстрируют данное изобретение. Пример 1.(565 мг, 2,96 ммоль) в пиридине (1 мл) при 0 С и полученную смесь перемешивали при 0 С в течение 20- 16017618 мин перед тем, как дать ей нагреться до комнатной температуры. Смесь перемешивали в течение 8 ч при данной температуре. Из полученной суспензии удаляли растворитель и водную 1 н. HCl добавляли к неочищенному продукту и экстрагировали EtOAc. Органический слой промывали насыщенным воднымNaHCO3 и затем водой и насыщенным раствором соли. Органический слой сушили над безводнымNa2SO4 и растворитель удаляли в вакууме с получением указанного в заголовке продукта (800 мг, 91%) в виде густого маслянистого вещества: МС (MS); m/z 378 (M+Na); 1H ЯМР (400 МГц, CDCl3);1,38 (м,9 Н), 1,79 (мм, 2 Н), 1,93 (м, 2 Н), 2,44 (с, 3 Н), 3,26-3,32 (м, 3 Н), 3,88-3,97 (м, 2 Н), 4,07-4,14 (м, 2 Н), 7,34(ушир.с, 2 Н), 7,77 (д, 2 Н, J=8,0 Гц); ВЭЖХ (ELSD); 99%. Стадия 2. трет-Бутиловый эфир (R)-2-(4-бензилфеноксиметил)пирролидин-1-карбоновой кислоты. К раствору 4-бензилфенола (103 мг, 0,56 ммоль) в ДМФА (1 мл) добавляли 95% NaH (19 мг, 0,75 ммоль) при 0 С и полученную смесь перемешивали при 0 С в течение 10 мин. Раствор тозилата (200 мг,0,56 ммоль) стадии 1 в ДМФА (2 мл) добавляли к реакционной смеси по каплям на протяжении 5 мин и реакционную смесь нагревали при 95 С в течение 10 ч. Смесь концентрировали, добавляли воду и экстрагировали EtOAc. Органический слой промывали насыщенным водным NaHCO3 и затем водой и насыщенным раствором соли. Органический слой сушили над безводным Na2SO4 и растворитель удаляли в вакууме, получая неочищенный продукт, который очищали флэш-хроматографией на силикагеле, с получением указанного в заголовке продукта (150 мг, 73%) в виде твердого вещества: МС; m/z 368 (М+Н); 1H ЯМР (400 МГц, CDCl3);1,46 (м, 9 Н), 1,84-2,03 (м, 4 Н), 3,39 (м, 2 Н), 3,73-3,93 (м, 3 Н), 4,10 (м, 2 Н),6,84 (м, 2 Н), 7,08 (м, 2 Н), 7,17 (м, 2 Н), 7,26 (м, 3 Н). ВЭЖХ (УФ), 99,8%. Стадия 3. (R)-2-(4-бензилфеноксиметил)пирролидин. К раствору продукта (4,5 г, 2,48 ммоль) стадии 2 в диоксане (2 мл) добавляли 4 М HCl в диоксане (8 мл) при комнатной температуре и полученную смесь перемешивали в течение 1 ч при данной температуре. Растворитель удаляли в вакууме с получением густого маслянистого вещества. Маслянистое вещество растирали с эфиром, с получением белого твердого вещества (2,5 г). Твердое вещество перекристаллизовывали из толуола (20 мл) с получением указанного в заголовке продукта (1,8 г, 53%) в виде кристаллического твердого вещества: МС; m/z 268 (М+Н): 1 Н ЯМР (400 МГц, ДМСО-d6);1,73 (м, 1 Н), 1,89 Стадия 1. Трет-бутиловый эфир (S)-2-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты. К раствору S-(-)-1-Boc-2-пирролидинметанола (22 г, 110 ммоль) в пиридине (56 мл) при 0 С добавляли раствор п-толуолсульфонилхлорида (22,9 г, 120 ммоль) в пиридине (56 мл) порциями на протяжении 5 мин. Полученную бледно-желтую реакционную смесь перемешивали при 0 С в течение 2 ч и затем при температуре окружающей среды в течение ночи. Пиридин удаляли в вакууме. Неочищенное маслянистое вещество экстрагировали этилацетатом (400 мл) и последовательно промывали 0,5 М HCl (100 мл), насыщенным водным NaHCO3 (100 мл) и насыщенным раствором соли (100 мл). Объединенный органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме, с получением указанного в заголовке продукта (39 г, 100%) в виде желтого маслянистого вещества. Стадия 2. Трет-бутиловый эфир (S)-2-(4-бенэилфеноксиметил)пирролидин-1-карбоновой кислоты. К раствору 4-гидроксидифенилметана (0,77 г, 4,18 ммоль) в безводном ДМФА (22,5 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,23 г, 5,75 ммоль) порциями на протяжении 5 мин. Полученную взвесь перемешивали при 0 С в течение 45 мин, перед тем, как раствор тозилата стадии 1 (1,50 г, 4,22 ммоль) в ДМФА (11 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 60 С в течение ночи. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и последовательно промывали водой, насыщенным водным NaHCO3, водой и насыщенным раствором соли. Объединенный органический слой сушили безводным Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке продукта (1,8 г, 100%) в виде желтовато-коричневого маслянистого вещества. Стадия 3. (S)-2-(4-Бензилфеноксиметил)пирролидин. К раствору продукта стадии 2 (2,9 г, 7,89 ммоль) добавляли 4 М HCl в диоксане (15 мл) при температуре окружающей среды. Полученную смесь перемешивали в течение ночи. Растворитель удаляли при пониженном давлении, с получением не совсем белого твердого вещества. Твердое вещество растирали с эфиром с получением продукта примера 2 (2,0 г, 74%) в виде белого твердого вещества; МС; m/z 268 Стадия 1. Метиловый эфир 4-[(S)-2-(4-бензилфеноксиметил)пирролидин-1-ил]масляной кислоты. К раствору соединения примера 2 (1,5 г, 4,94 ммоль) в ДМФА (23 мл) добавляли карбонат калия(1,4 г, 10,1 ммоль) и метил-4-бромбутират (0,72 мл, 6,26 ммоль). Полученную взвесь перемешивали при температуре окружающей среды в течение ночи. Растворитель концентрировали при пониженном давлении и неочищенный продукт поглощали этилацетатом. Органическую фракцию промывали водой, промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc(градиентная система), с получением указанного в заголовке соединения (0,73 г, 40%) в виде желтого маслянистого вещества. Стадия 2. 4-[(S)-2-(4-Бензилфеноксиметил)пирролидин-1-ил]масляная кислота. К раствору продукта стадии 1 (0,13 г, 0,35 ммоль) добавляли 2 н. NaOH (0,29 мл, 0,58 ммоль) и 80%MeOH/H2O (4 мл). Полученную взвесь перемешивали при 50 С в течение 67 ч. Растворитель удаляли при пониженном давлении и к остатку добавляли воду. рН доводили до 4, используя 1 н. раствор HCl. Неочищенный продукт экстрагировали этилацетатом. Объединенные органические слои промывали водой,промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения (0,09 г, 77%) в виде желтого полутвердого вещества. 1 Н ЯМР (400 МГц, CDCl3);1,96-2,26 (м, 6 Н), 2,41 (т, J=6,6 Гц, 2 Н), 3,02 (м, 2 Н), 3,47 (м, 1 Н), 3,67 (м, 2 Н),3,89 (с, 2 Н), 3,85 (дд, J1=4,0 Гц, J2=10,8 Гц, 1 Н), 4,50 (м, 1 Н), 6,84 (д, J=8,8 Гц, 2 Н), 7,09-7,19 (м, 5 Н),7,25-7,28 (м, 2 Н); МС (m/z) 352,4 (М-1); ЖХ (97,6%); ВЭЖХ (96,6%). Пример 4. 2-[(R)-2-(4-Бензилфеноксиметил)пирролидин-1-илетил]пиридин. К раствору соединения примера 1 (0,20 г, 0,66 ммоль) в ДМФА (5 мл) добавляли гидрохлорид 2 пиколилхлорида (0,10 г, 0,61 ммоль) и триэтиламин (0,24 мл, 1,72 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт экстрагировали этилацетатом (25 мл) и промывали водой(25 мл) и затем насыщенным раствором соли (25 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,07 г, 36%); 1 Н ЯМР (400 МГц, CDCl3);1,73-1,80 (м, 3 Н), 2,05 (м, 1 Н), 2,40 (м, 1 Н),3,02-3,08 (м, 2 Н), 3,71 (д, J=13,6 Гц, 1 Н), 3,83 (м, 1 Н), 3,91 (с, 2 Н), 3,95 (м, 1 Н), 4,25 (д, J=13,6 Гц, 1 Н),6,79 (д, J=8,8 Гц, 2 Н), 7,07 (д, J=8,8 Гц, 2 Н), 7,15-7,20 (м, 4 Н), 7,25-7,27 (м, 2 Н), 7,41 (м, 1 Н), 7,61 (м, 1 Н),8,53 (м, 1 Н); МС (m/z) 359,2 (М+1); ЖХ (100,0%). Пример 5. 3-[(R)-2-(4-Бензилфеноксиметил)пирролидин-1-илметил]пиридин. Следуя основной методике примера 4, продукт примера 1 (0,20 г, 0,66 ммоль) в ДМФА (5 мл) обрабатывали гидрохлоридом 3-пиколилхлорида (0,10 г, 0,61 ммоль) и триэтиламином (0,24 мл, 1,72 ммоль),с получением указанного в заголовке соединения (0,09 г, 46%); 1 Н ЯМР (400 МГц, CDCl3);1,71-1,78 (м,3 Н), 2,04 (м, 1 Н), 2,29 (м, 1 Н), 2,94-3,03 (м, 2 Н), 3,51 (д, J=13,6 Гц, 1 Н), 3,86 (м, 1 Н), 3,92 (с, 2 Н), 3,95 (м,1 Н), 4,18 (д, J=13,2 Гц, 1 Н), 6,81 (д, J=8,8 Гц, 2 Н), 7,09 (д, J=8,4 Гц, 2 Н), 7,16-7,30 (м, 5 Н), 7,67 (м, 2 Н),8,48 (ушир.с, 1 Н), 8,56 (ушир.с, 1 Н). ; МС (m/z) 359,2 (М+1); ЖХ (100,0%). Пример 6.- 18017618 4-[(R)-2-(4-Бензилфеноксиметил)пирролидин-1-илметил]пиридин. К раствору соединения примера 1 (0,25 г, 0,82 ммоль) в дихлорметане (2 мл) добавляли гидрохлорид 4-пиколилхлорида (0,13 г, 0,79 ммоль) и триэтиламин (0,29 мл, 2,08 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Неочищенный продукт экстрагировали дихлорметаном, промывали водой и затем насыщенным раствором соли. Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,11 г, 45%); 1 Н ЯМР (400 МГц, CDCl3);1,70-1,81 (м, 3 Н), 2,03 (м,1 Н), 2,27 (м, 1 Н), 2,94-3,03 (м, 2 Н), 3,49 (д, J=14,4 Гц, 1 Н), 3,86 (м, 1 Н), 3,92 (с, 2 Н), 3,94 (м, 1 Н), 4,19 (д,J=14,4 Гц, 1 Н), 6,79 (д, J=8,8 Гц, 2 Н), 7,08 (д, J=8,8 Гц, 2 Н), 7,15-7,20 (м, 3 Н), 7,26-7,29 (м, 4 Н), 8,51 (м,2 Н); МС (m/z) 359,5 (М+1); ЖХ (99,7%); ВЭЖХ (91,6%). Пример 7. Метиловый эфир 3-[(R)-2-(4-бензилфеноксиметил)пирролидин-1-ил]пропионовой кислоты. К раствору соединения примера 1 (0,2 г, 0,66 ммоль) в ДМФА (5 мл) добавляли триэтиламин (0,16 мл, 1,14 ммоль) и метил-3-бромпропионат (0,07 мл, 0,64 ммоль). Полученную взвесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли при пониженном давлении и неочищенный остаток экстрагировали этилацетатом. Органическую фракцию промывали водой, затем насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc Метиловый эфир 4-[(R)-2-(4-бензилфеноксиметил)пирролидин-1-ил]масляной кислоты. К раствору соединения примера 1 (0,5 г, 1,65 ммоль) в дихлорметане (4,8 мл) добавляли триэтиламин (0,46 мл, 3,30 ммоль) и метил-4-бромбутират (0,24 мл, 1,90 ммоль). Полученный раствор перемешивали при температуре окружающей среды в течение 16 ч. В реакционную смесь добавляли воду (25 мл) и дихлорметан (25 мл) и неочищенный остаток экстрагировали дихлорметаном. Органическую фракцию промывали водой (25 мл), промывали насыщенным раствором соли (25 мл), сушили над безводнымNa2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,15 г, 24%); 1 Н ЯМР (400 МГц, CDCl3);1,66-1,86 (м, 5 Н), 1,96 (м, 1 Н),2,20-2,45 (м, 4 Н), 2,86 (м, 2 Н), 3,14 (м, 1 Н), 3,63 (с, 3 Н), 3,74 (м, 1 Н), 3,89 (м, 1 Н), 3,92 (с, 2 Н), 6,82 (д,J=8,4 Гц, 2 Н), 7,08 (д, J=8,0 Гц, 2 Н), 7,16-7,20 (м, 3 Н), 7,27 (м, 2 Н); МС (m/z) 368,4 (М+1); ЖХ (90,6%). Пример 9. Гидрохлорид 3-[(R)-2-(4-бензилфеноксиметил)пирролидин-1-ил]пропионовой кислоты. К раствору соединения примера 7 (0,02 г, 0,05 ммоль) добавляли 2 н. NaOH (0,04 мл, 0,08 ммоль) и 80% MeOH/H2O (0,5 мл). Полученную взвесь перемешивали при 50 С в течение 24 ч. Растворитель удаляли при пониженном давлении и к остатку добавляли воду. рН доводили до 4, используя 1 н. растворHCl. Неочищенный продукт экстрагировали этилацетатом. Объединенные органические слои промывали водой, промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (12 мг, 67%); 1 Н ЯМР (400 МГц, CDCl3);1,41-1,63 (м, 2 Н), 1,92-2,22 (м, 2 Н), 2,75 (м, 3 Н), 3,02 (м, 1 Н), 3,50 (м, 3 Н), 3,90 (с, 2 Н), 4,09 (дд, J1=4,0 Гц,J2=10,4 Гц, 1 Н), 4,25 (м, 1 Н), 6,82 (д, J=8,4 Гц, 2 Н), 7,08-7,20 (м, 5 Н), 7,25-7,29 (м, 2 Н); МС (m/z) 340,7 Гидрохлорид 4-[(R)-2-(4-бензилфеноксиметил)пирролидин-1-ил]масляной кислоты. Следуя основной методике примера 9, раствор примера 8 (11 мг, 0,03 ммоль) в 80% МеОН/Н 2 О (0,4 мл) обрабатывали 2 н. NaOH (0,03 мл, 0,06 ммоль), с получением указанного в заголовке соединения (9 мг, 8 6%) в виде желтого маслянистого вещества; 1 Н ЯМР (400 МГц, CDCl3);1,95-2,28 (м, 6 Н), 2,49 (м,2 Н), 2,94 (м, 2 Н), 3,42-3,65 (м, 3 Н), 3,91 (с, 2 Н), 4,14 (дд, J1=3,6 Гц, J2=10,8 Гц, 1 Н), 4,42 (м, 1 Н), 6,83 (д,J=8,8 Гц, 2 Н), 7,10 (д, J=8,4 Гц, 2 Н), 7,15-7,20 (м, 3 Н), 7,27 (м, 2 Н); МС (m/z) 354,7 (М+1); ЖХ (99,7%). Пример 11. Стадия 1. К раствору 4-(трифторметокси)йодбензола (0,54 мл, 3,45 ммоль), 4-метоксифенола (0,28 г,2,26 ммоль) и карбоната цезия (1,54 г, 4,73 ммоль) в диоксане (10 мл) добавляли гидрохлорид N,Nдиметилглицина (0,03 г, 0,22 ммоль). Емкость продували азотом перед добавлением йодида Cu(I) (0,02 г,0,08 ммоль). Коричневато-зеленую реакционную смесь нагревали до 90 С в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Органическую фракцию промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (0,8 г, 100%) в виде коричневого маслянистого вещества. Стадия 2. 4-(4-Трифторметоксифенокси)фенол. К раствору продукта стадии 1 (0,5 г, 1,76 ммоль) в дихлорметане (10 мл) при -78 С добавляли трибромид бора (1,0 М раствор в дихлорметане, 5,28 мл, 5,28 ммоль) по каплям на протяжении 5 мин. Полученную смесь перемешивали при -78 С в течение 30 мин и затем при температуре окружающей среды в течение 90 мин. После охлаждения реакционной смеси до 0 С, ее медленно добавляли к холодной смеси вода/дихлорметан (50 мл/50 мл). Органическую фракцию промывали водой, насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,35 г, 74%) в виде темного маслянистого вещества. Стадия 3. трет-Бутиловый эфир (R)-2-[4-(4-трифторметоксифенокси)феноксиметил]пирролидин-1 карбоновой кислоты. К раствору продукта стадии 2 (0,2 г, 0,7 4 ммоль) в безводном ДМФА (6 мл) при 0 С добавляли 60% дисперсию. NaH в минеральном масле (0,04 мг, 0,98 ммоль) порциями на протяжении 5 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин нагревали до температуры окружающей среды и затем нагревали до 35 С в течение 15 мин, раствор промежуточного соединения тозила (0,33 г, 0,93 ммоль) в ДМФА (4 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 75 С в течение ночи. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc(градиентная система), с получением указанного в заголовке соединения (0,24 г, 70%) в виде желтого маслянистого вещества. Стадия 4. Гидрохлорид (R)-2-[4-(4-трифторметоксифенокси)феноксиметил]пирролидина. К продукту продукта стадии 3 (0,23 г, 0,51 ммоль) добавляли 4 М HCl в диоксане (5 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли в вакууме. Неочищенный продукт растирали с эфиром и сушили при пониженном давлении с получением указанного в заголовке соединения (0,12 г, 61%) в виде светло-зеленого маслянистого вещества; 1 Н ЯМР Стадия 1. 4-(4-Метоксифенокси)бифенил. К раствору 4-бромбифенила (1,00 г, 4,29 ммоль), 4-метоксифенола (0,35 г, 2,82 ммоль) и карбоната цезия (1,85 г, 5,68 ммоль) в диоксане (10 мл) добавляли гидрохлорид N,N-диметилглицина (0,04 г, 0,26 ммоль). Емкость продували азотом перед добавлением йодида Cu(I) (0,02 г, 0,11 ммоль). Реакционную- 20017618 смесь нагревали до 90 С в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Органическую фракцию промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения (1,00 г, 100%) в виде светло-зеленого твердого вещества. Стадия 2. 4-(Бифенил-4-илокси)фенол. К раствору продукта стадии 1 (0,5 г, 1,81 ммоль) в дихлорметане (10 мл) при -78 С добавляли трибромид бора (1,0 М раствор в дихлорметане, 5,43 мл, 5,43 ммоль) по каплям на протяжении 5-10 мин. Полученную смесь перемешивали при -78 С в течение часа и затем при температуре окружающей среды в течение 1 ч. После охлаждения реакционной смеси до 0 С ее медленно добавляли к холодной смеси вода/дихлорметан (50 мл/50 мл). Органическую фракцию промывали водой, насыщенным раствором соли,сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,24 г, 47%) в виде не совсем белого твердого вещества. Стадия 3. трет-Бутиловый эфир (R)-2-[4-(бифенил-4-илокси)феноксиметил]пирролидин-1 карбоновой кислоты. К раствору продукта стадии 2 (0,24 г, 0,91 ммоль) в безводном ДМФА (4 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,05 г, 1,20 ммоль) порциями на протяжении 5 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин, нагревали до температуры окружающей среды и затем нагревали до 35 С в течение 15 мин раствор промежуточного соединения тозила (0,4 г,1,13 ммоль) в ДМФА (2 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 75 С в течение 60 ч. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc(градиентная система), с получением требуемого соединения (0,40 г, 98%) в виде желтого маслянистого вещества. Стадия 4. Гидрохлорид (R)-2-[4-(бифенил-4-илокси)феноксиметил]пирролидина. Следуя основной методике примера 11 (стадия 4), продукт стадии 3 (0,2 г, 0,4 5 ммоль) обрабатывали 4 М HCl в диоксане (5 мл) с получением указанного в заголовке продукта (0,11 г, 62%) в виде белого твердого вещества; 1H ЯМР (400 МГц, ДМСО-d6) 1,75 (м, 1 Н), 1,88-2,02 (м, 2 Н), 2,12 (м, 1 Н), 3,23 (м, 2 Н),3,91 (м, 1 Н), 4,14 (м, 1 Н), 4,26 (дд, J1=3,8 Гц, J2=10,4 Гц, 1 Н), 7,00 (д, J=8,8 Гц, 2 Н), 7,04-7,11 (м, 4 Н),7,34 (м, 1 Н), 7,45 (м, 2 Н), 7,61-7,66 (м, 4 Н); МС (m/z) 346,7 (М+1); ЖХ (98,9%); элементный анализ (рассчитано): С 72,34, Н 6,33, N 3,67; (найдено): С 71,72, Н 6,29, N 3,66. Пример 13. Стадия 1. 1-Метокси-4-(4-хлорфенокси)бензол. Следуя основной методике примера 12 (стадия 1), гидрохлорид N,N-диметилглицина (0,04 г, 0,26 ммоль), карбонат цезия (1,85 г, 5,68 ммоль) и йодид Cu(I) (0,02 г, 0,11 ммоль) добавляли к раствору 4 бромхлорбензола (0,82 г, 4,28 ммоль) и 4-метоксифенола (0,35 г, 2,82 ммоль) в диоксане (10 мл) с получением указанного в заголовке соединения (0,76 г, 100%) в виде коричневого маслянистого вещества. Стадия 2. 4-(4-Хлорфенокси)фенол. Следуя основной методике примера 12 (стадия 2), трибромид бора (1,0 М раствор в дихлорметане,9,66 мл, 9,66 ммоль)-добавляли к продукту стадии 1 (0,76 г, 3,22 ммоль) в дихлорметане (15 мл) с получением указанного в заголовке соединения (0,37 г, 52%) в виде светло-зеленого твердого вещества. Стадия 3. трет-Бутиловый эфир (R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-карбоновой кислоты. К раствору продукта стадии 2 (0,25 г, 1,13 ммоль) в безводном ДМФА (б мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,06 г, 1,50 ммоль) порциями на протяжении 5 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин нагревали до температуры окружающей среды и затем нагревали до 35 С в течение 15 мин, раствор промежуточного соединения тозила (0,49 г,1,38 ммоль) в ДМФА (4 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 75 С в течение 16 ч. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc(градиентная система), с получением указанного в заголовке соединения (0,37 г, 81%) в виде желтого маслянистого вещества. Стадия 4. Гидрохлорид (R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидина. К продукту стадии 3 (0,36 г, 0,89 ммоль) добавляли 4 М HCl в диоксане (5 мл). Полученную смесь- 21017618 перемешивали при температуре окружающей среды в течение 2 ч. Растворитель удаляли в вакууме. Неочищенный продукт растирали с эфиром и сушили при пониженном давлении, с получением указанного в заголовке соединения (0,19 г, 70%) в виде светло-желтого твердого вещества; 1 Н ЯМР (400 МГц,DMCO-d6) 1,75 (м, 1 Н), 1,87-2,01 (м, 2 Н), 2,12 (м, 1 Н), 3,21 (м, 2 Н), 3,89 (м, 1 Н), 4,17 (м, 1 Н), 4,24 (дд,J1=4,0 Гц, J2=10,8 Гц, 1 Н), 6,94 (д, J=9,2 Гц, 2 Н), 7,05 (с, 4 Н), 7,40 (д, J=8,8 Гц, 2 Н); МС (m/z) 304,2 Стадия 1. 1-Метокси-4-(4-метилфенокси)бензол. Следуя основной методике примера 11 (стадия 1), гидрохлорид N,N-диметилглицина (0,03 г, 0,22 ммоль), карбонат цезия (1,59 г, 4,88 ммоль) и йодид Cu(I) (0,02 г, 0,09 ммоль) добавляли к раствору 4 йодтолуола (0,8 г, 3,67 ммоль) и 4-метоксифенола (0,3 г, 2,42 ммоль) в диоксане (10 мл), с получением указанного в заголовке соединения (0,92 г, 100%) в виде коричневого маслянистого вещества. Стадия 2. 4-п-Толилоксифенол. Следуя основной методике примера 12 (стадия 2), трибромид бора (1,0 М раствор в дихлорметане,7,75 мл, 7,75 ммоль) добавляли к продукту стадии 1 (0,75 г, 3,50 ммоль) в дихлорметане (10 мл), с получением указанного в заголовке соединения (0,26 г, 36%) в виде желтого твердого вещества. Стадия 3. трет-Бутиловый эфир (R)-2-(4-п-толилоксифеноксиметил)пирролидин-1-карбоновой кислоты. К раствору продукта стадии 2 (0,25 г, 1,25 ммоль) в безводном ДМФА (6 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,06 г, 1,43 ммоль) порциями на протяжении 5 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин нагревали до температуры окружающей среды и затем нагревали до 35 С в течение 15 мин, раствор промежуточного соединения тозила (0,47 г,1,32 ммоль) в ДМФА (4 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 75 С в течение 16 ч. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc(градиентная система), с получением указанного в заголовке соединения (0,42 г, 88%) в виде желтого твердого вещества. Стадия 4. Гидрохлорид (R)-2-(4-п-толилоксифеноксиметил)пирролидина. Следуя основной методике примера 13 (стадия 4), продукт стадии 3 (0,39 г, 1,02 ммоль) обрабатывали 4 М HCl в диоксане (6 мл), с получением указанного в заголовке соединения (0,12 г, 67%) в виде не совсем белого твердого вещества; 1 Н ЯМР (400 МГц, ДМСО-d6) 1,74 (м, 1 Н), 1,94 (м, 2 Н), 2,11 (м, 1 Н),2,27 (с, 3 Н), 3,21 (м, 2 Н), 3,88 (м, 1 Н), 4,13 (м, 1 Н), 4,22 (дд, J1=3,8 Гц, J2=10,8 Гц, 1 Н), 6,83 (д, J=8,4 Гц,2 Н), 6,98 (м, 4 Н), 7,16 (д, J=8,4 Гц, 2 Н), 9,11 (ушир.с, 1 Н), 9,67 (ушир.с, 1 Н); МС (m/z) 284,4 (М+1); ЖХ Стадия 1. 4-(4-Метоксифенокси)бензонитрил. К раствору 4-йодбензонитрила (0,458 г, 2 ммоль), 4-метоксифенола (0,372 г, 3 ммоль) и карбоната цезия (1,30 г, 4 ммоль) в диоксане (4 мл) добавляли гидрохлорид N,N-диметилглицина (0,025 г, 0,18 ммоль). Емкость продували азотом перед добавлением йодида Cu(I) (0,014 г, 0,07 ммоль). Реакционную смесь нагревали до 90 С в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Органическую фракцию промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения (0,51 г, 100%); 1H ЯМР (400 МГц,CDCl3);3,83 (с, 3 Н), 6,92-7,02 (м,6 Н), 7,56-7,58 (м, 2 Н). Стадия 2. 4-(4-Гидроксифенокси)бензонитрил. Следуя основной методике примера 11 (стадия 2), трибромид бора (1,0 М раствор в дихлорметане,5,73 мл, 5,73 ммоль) добавляли к продукту стадии 1 (0,43 г, 1,91 ммоль) в дихлорметане (10 мл), с получением указанного в заголовке соединения (0,30 г, 74%) в виде не совсем белого твердого вещества. Стадия 3. трет-Бутиловый эфир 2-[4-(4-цианофенокси)феноксиметил]пирролидин-1-карбоновой кислоты. Следуя основной методике примера 12 (стадия 3), 60% дисперсию NaH в минеральном масле (0,05 г, 1,25 ммоль) и промежуточное соединение тозила (0,41 г, 1,15 ммоль) добавляли к раствору продукта- 22017618 стадии 2 (0,2 г, 0,95 ммоль) в безводном ДМФА (10 мл), с получением указанного в заголовке соединения (0,30 г, 81%) в виде желтого маслянистого вещества. Стадия 4. Гидрохлорид 4-[4-R)-1-пирролидин-2-илметокси)фенокси]бензонитрила. Следуя основной методике примера 11 (стадия 4), продукт стадии 3 (0,3 г, 0,7 6 ммоль) обрабатывали 4 М HCl в диоксане (5 мл) с получением указанного в заголовке соединения (0,21 г, 85%) в виде белого твердого вещества; 1 Н ЯМР; (400 МГц, ДМСО-d6) 1,75 (м, 1 Н), 1,88-2,02 (м, 2 Н), 2,12 (м, 1 Н), 3,22 (м,2 Н), 3,90 (м, 1 Н), 4,17 (м, 1 Н), 4,27 (дд, J1=3,8 Гц, J2=10,8 Гц, 1 Н), 7,03 (д, J=9,2 Гц, 2 Н), 7,09 (м, 2 Н),7,15 (м, 2 Н), 7,82 (д, J=8,8 Гц, 2 Н), 9,10 (ушир.с, 1 Н), 9,65 (ушир.с, 1 Н); МС (m/z) 295,5 (М+1); ЖХ Стадия 1. трет-Бутиловый эфир (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 карбоновой кислоты. Следуя основной методике примера 12 (стадия 3), 60% дисперсию NaH в минеральном масле (0,06 г, 1,58 ммоль) и промежуточное соединение тозила (0,51 г, 1,43 ммоль) добавляли к раствору 4-[(4 трифторметил)фенокси]фенола (0,3 г, 1,18 ммоль) в безводном ДМФА (10 мл) с получением указанного в заголовке соединения (0,41 г, 79%) в виде желтого маслянистого вещества; МС, m/z 437 (М+1). Стадия 2. Гидрохлорид (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидина. Следуя основной методике примера 11 (стадия 4), продукт стадии 1 (0,41 г, 0,94 ммоль) обрабатывали 4 М HCl в диоксане (5 мл), с получением указанного в заголовке соединения (0,22 г, 70%); 1 Н ЯМР-78 С добавляли трибромид бора (1,0 М раствор в дихлорметане, 6,2 мл, 6,2 ммоль) по каплям на протяжении 5 мин. Полученную смесь перемешивали при -78 С в течение часа и затем при температуре окружающей среды в течение часа. После охлаждения реакционной смеси до 0 С, ее медленно добавляли к холодной смеси вода/дихлорметан (50 мл/50 мл). Органическую фракцию промывали водой, насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (210 мг, 45%); 1 Н ЯМР (400 МГц, CDCl3);2,57 (с,3 Н), 6,86-6,88 (д, 2 Н, J=8,0 Гц), 6,93-6,98 (м, 4 Н), 7,91-7,93 (д, 2 Н, J=8,0 Гц). Стадия 2. трет-Бутиловый эфир (R)-2-[4-(4-ацетилфенокси)феноксиметил]пирролидин-1-ккарбоновой кислоты. К раствору продукта стадии 2 (0,11 г, 0,48 ммоль) в безводном ДМФА (3 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,03 г, 0,65 ммоль) порциями на протяжении 5 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин, нагревали до температуры окружающей среды и перемешивали в течение 45 мин, раствор промежуточного соединения тозила (0,21 г, 0,59 ммоль) в ДМФА (2 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 80 С в течение 16 ч. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный-продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,13 г, 67%) в виде желтого маслянистого вещества. Стадия 3. Гидрохлорид 1-4-[4-R)-1-пирролидин-2-илметокси)фенокси]фенилэтанона. Следуя основной методике примера 13 (стадия 4), продукт стадии 3 (0,13 г, 0,30 ммоль) обрабатывали 4 М HCl в диоксане (5 мл) с получением указанного в заголовке соединения (0,08 г, 80%) в виде желтовато-коричневого твердого вещества; 1 Н ЯМР (400 МГц, CD3OD)1,93 (м, 1 Н), 2,09-2,19 (м, 2 Н),2,29 (м, 1 Н), 2,56 (с, 3 Н), 3,37 (м, 2 Н), 4,05 (м, 1 Н), 4,13 (т, J=18,8 Гц, 1 Н), 4,35 (д, J=8,8 Гц, 1 Н), 6,96 (д,J=8,8 Гц, 2 Н), 7,08 (с, 4 Н), 7,97 (д, J=8,8 Гц, 2 Н); МС (m/z) 312,3 (М+1); ЖХ (100,0%); ВЭЖХ (98,9%). Стадия 1. 1-Метокси-4-(4-хлорфенокси)бензол. К раствору 1-хлор-4-йодбензола (15 г, 62,9 ммоль), 4-метоксифенола (11,7 г, 94 ммоль) и карбоната цезия (40,8 г, 126 ммоль) в диоксане (125 мл) добавляли гидрохлорид N,N-диметилглицина (0,790 г,5,661 ммоль). Емкость продували азотом перед добавлением йодида Cu(I) (0,431 г, 2,3 ммоль). Реакционную смесь нагревали до 90 С в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Органическую фракцию промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения (14,76 г, 100%); 1 Н ЯМР (400 МГц, CDCl3);3,81 (с, 3 Н), 6,77-6,78 (м, 2 Н), 6,87-6,90 (м, 2 Н), 6,95-6,97 (м, 2 Н), 7,23-7,26 (м, 2 Н). Стадия 2. 4-(4-Хлорфенокси)фенол. К раствору продукта стадии 1 (2,86 г, 12,18 ммоль) в дихлорметане (50 мл) при -78 С добавляли трибромид бора (1,0 М раствор в дихлорметане, 30 мл, 30,5 ммоль) по каплям на протяжении 5 мин. Полученную смесь перемешивали при -78 С в течение часа и затем при температуре окружающей среды в течение часа. После охлаждения реакционной смеси до 0 С, ее медленно добавляли к холодной смеси вода/дихлорметан (50 мл/50 мл). Органическую фракцию промывали водой, насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (2 г, 75%); 1 Н ЯМР (400 МГц, CDCl3);4,8 (с, 1 Н), 7,23-7,26 (м, 2 Н),6,81-6,92 (м, 6 Н). Стадия 3. трет-Бутиловый эфир (R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-карбоновой кислоты. Следуя основной методике примера 12 (стадия 3), 60% дисперсию NaH в минеральном масле (0,48 г, 12,0 ммоль) и промежуточное соединение тозила (3,90 г, 11,0 ммоль) добавляли к раствору 4-(4 хлорфенокси)фенола (2,00 г, 9,06 ммоль) в безводном ДМФА (38 мл) с получением указанного в заголовке соединения (3,6 г, 98%) в виде белого твердого вещества. Стадия 4. (R)-2-[4-(4-Хлорфенокси)феноксиметил]пирролидин. Следуя основной методике примера 11 (стадия 4), продукт стадии 3 (3,60 г, 8,91 ммоль) обрабатывали 4 М HCl в диоксане (6 мл) с получением указанного в заголовке соединения (2,56 г, 84%) в виде белого твердого вещества. Стадия 5. трет-Бутиловый эфир (R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илуксусной кислоты. К раствору продукта стадии 4 (0,8 г, 2,63 ммоль) в дихлорметане (7,6 мл) добавляли триэтиламин(0,78 мл, 5,60 ммоль) и трет-бутилбромацетат (0,45 мл, 3,05 ммоль). Полученный раствор перемешивали при 30 С в течение ночи. Реакционную смесь вливали в смесь вода/дихлорметан (50 мл/50 мл). Неочищенный остаток экстрагировали дихлорметаном. Органическую фракцию промывали водой (50 мл),промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (0,83 г,75%); Стадия 6. Гидрохлорид (R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илуксусной кислоты. К продукту стадии 5 (0,60 г, 1,42 ммоль) добавляли смесь 1:1 концентрированная HCl/диоксан (28 мл). Полученный раствор перемешивали при 60 С в течение 4 ч. Растворитель удаляли в вакууме. Неочищенный продукт растирали с эфиром и сушили при пониженном давлении с получением указанного в заголовке соединения (0,49 г, 52%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)1,83 (м, 1 Н), 2,03 (м, 2 Н), 2,24 (м, 1 Н), 3,30 (м, 1 Н), 3,70 (м, 1 Н), 4,02 Стадия 1. Метиловый эфир 3-(R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илпропионовой кислоты. К раствору соединения примера 18 (стадия 4) (0,8 г, 2,63 ммоль) в дихлорметане (7,6 мл) добавляли- 24017618 триэтиламин (0,78 мл, 5,60 ммоль) и метил-3-бромпропионат (0,32 мл, 2,93 ммоль). Полученный раствор перемешивали при 30 С в течение ночи. Реакционную смесь вливали в смесь вода/дихлорметан (50 мл/50 мл). Неочищенный остаток экстрагировали дихлорметаном. Органическую фракцию промывали водой(50 мл), промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения(0,79 г, 77%). Стадия 2. Гидрохлорид 3-(R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илпропионовой кислоты. Следуя основной методике примера 18, продукт стадии 1 (0,62 г, 1,59 ммоль) обрабатывали смесью 1:1 концентрированная HCl/диоксан (28 мл), с получением указанного в заголовке соединения (0,40 г,68%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)1,83 (м, 1 Н), 2,00 (м, 2 Н), 2,24 (м,1 Н), 2,86 (м, 2 Н), 3,18 (м, 1 Н), 3,38 (м, 1 Н), 3,63 (м, 2 Н), 3,96 (м, 1 Н), 4,28-4,37 (м, 2 Н), 6,94 (д, J=9,2 Гц,2 Н), 7,06 (с, 4 Н), 7,39 (д, J=8,8 Гц, 2 Н); МС (m/z) 374,5 (М-1); ЖХ (98,0%). Пример 20. Стадия 1. Метиловый эфир 4-(R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илмасляной кислоты. К раствору соединения примера 18 (стадия 4) (0,8 г, 2,63 ммоль) в дихлорметане (7,6 мл) добавляли триэтиламин (0,78 мл, 5,60 ммоль) и метил-4-бромбутират (0,35 мл, 3,04 ммоль). Полученный раствор перемешивали при 30 С в течение ночи. Реакционную смесь вливали в смесь вода/дихлорметан (50 мл/50 мл). Неочищенный остаток экстрагировали дихлорметаном. Органическую фракцию промывали водой(50 мл), промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения(0,60 г, 57%). Стадия 2. Гидрохлорид 4-(R)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илмасляной кислоты. Следуя основной методике примера 18, продукт стадии 1 (0,80 г, 1,99 ммоль) обрабатывали смесью 1:1 концентрированная HCl/диоксан (36 мл), с получением указанного в заголовке соединения (0,21 г, 2 6%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)1,82-2,03 (м, 5 Н), 2,24 (м, 1 Н), 2,38 Стадия 1. трет-Бутиловый эфир (S)-2-[4-(4-хлорбензил)феноксиметил]пирролидин-1-карбоновой кислоты. К раствору 4-(4-хлорбензил)фенола (2,20 г, 10,1 ммоль) в безводном ДМФА (30 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,75 г, 18,8 ммоль) порциями на протяжении 10 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин нагревали до температуры окружающей среды и перемешивали в течение 90 мин, раствор промежуточного соединения тозила (3,94 г,11,1 ммоль) в ДМФА (9,4 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 90 С в течение ночи. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (3,55 г, 88%). Стадия 2. Гидрохлорид (S)-2-[4-(4-хлорбензил)феноксиметил]пирролидина. К продукту стадии 1 (3,55 г, 8,83 ммоль) добавляли 4 М HCl в диоксане (35 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли в вакууме. Неочищенный продукт растирали с эфиром и сушили при пониженном давлении с получением указанного в заголовке продукта (2,00 г, 67%) в виде белого твердого вещества. Стадия 3. Метиловый эфир 4-(S)-2-[4-(4-хлорбензил)феноксиметил]пирролидин-1-илмасляной кислоты.- 25017618 К раствору продукта стадии 2 (1,50 г, 4,43 ммоль) в ДМФА (20 мл) добавляли карбонат калия (1,23 г, 8,90 ммоль) и метил-4-бромбутират (0,64 мл, 5,56 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Неочищенный остаток экстрагировали этилацетатом. Органическую фракцию промывали водой, промывали насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (1,22 г, 69%) в виде желтого маслянистого вещества. Стадия 4. Гидрохлорид 4-(S)-2-[4-(4-хлорбензил)феноксиметил]пирролидин-1-илмасляной кислоты. К раствору продукта стадии 3 (1,00 г, 2,49 ммоль) в МеОН (10 мл) добавляли 2 н. NaOH (3,30 мл,6,60 ммоль). Полученный розовый раствор перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли в вакууме. Неочищенное маслянистое вещество разбавляли в воде (20 мл) и рН доводили до 7 раствором 2 н. HCl. Неочищенный остаток экстрагировали этилацетатом. Объединенные органические фракции промывали насыщенным раствором соли, сушили над безводным Na2SO4,фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь МеОН/дихлорметан (градиентная система), с получением свободного основания указанного в заголовке соединения в виде желтовато-коричневого маслянистого вещества. К полученному маслянистому веществу добавляли 2 М HCl в диэтиловом эфире (20 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 6 ч. Растворители декантировали. Оставшееся не совсем белое твердое вещество растирали с диэтиловым эфиром (30 мл) в течение ночи. Взвесь фильтровали, промывали диэтиловым эфиром (10 мл 3) и сушили в вакууме при 45 С в течение ночи с получением указанного в заголовке соединения в виде белого твердого вещества (0,61 г, 58%). 1 Н ЯМР (400 МГц, ДМСО-d6)1,72-2,02 (м, 5 Н), 2,22 (м, 1 Н), 2,37 (м, 2 Н), 3,13 (м, 2 Н), 3,46 (м,1 Н), 3,61 (м, 1 Н), 3,85 (м, 1 Н), 3,88 (с, 2 Н), 4,27 (м, 2 Н), 6,92 (д, J=8,4 Гц, 2 Н), 7,17 (д, J=8,8 Гц, 2 Н), 7,22 Стадия 1. (4-Хлорфенокси)метоксибензол. Следуя основной методике примера 11 (стадия 1), гидрохлорид N,N-диметилглицина (0,51 г, 3,65 ммоль), карбонат цезия (26 г, 7 9,8 ммоль) и йодид Cu(I) (0,29 г, 1,52 ммоль) добавляли к раствору 4 хлорйодбензола (6,4 г, 26,8 ммоль) и 4-метоксифенола (5,00 г, 40,3 ммоль) в диоксане (10 мл), с получением указанного в заголовке соединения (8,2 г, 100%) в виде коричневого маслянистого вещества. Стадия 2. 4-(4-Хлорфенокси)фенол. К раствору продукта стадии 1 (6,3 г, 2 6,8 ммоль) в дихлорметане (72 мл) при -78 С добавляли трибромид бора (7,6 мл, 80,3 ммоль) по каплям на протяжении 5 мин. Полученную смесь перемешивали при -78 С в течение часа, нагревали до температуры окружающей среды и перемешивали в течение 1 ч. После охлаждения реакционной смеси до 0 С, ее медленно добавляли к холодной смеси вода/дихлорметан. Органическую фракцию промывали водой, насыщенным раствором соли, сушили над безводнымNa2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (4,50 г, 76%). Стадия 3. трет-Бутиловый эфир (S)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-карбоновой кислоты. К раствору 4-(4-хлорфенокси)фенола (4,00 г, 18,1 ммоль) в безводном ДМФА (65 мл) при 0 С добавляли 60% дисперсию NaH в минеральном масле (0,96 г, 24,0 ммоль) порциями на протяжении 10 мин. После перемешивания полученной взвеси при 0 С в течение 45 мин, нагревали до температуры окружающей среды и перемешивали в течение 90 мин, раствор промежуточного соединения тозила (7,20 г,20,3 ммоль) в ДМФА (11 мл) добавляли по каплям на протяжении 5 мин. Полученную смесь перемешивали при 90 С в течение ночи. Реакционную смесь выливали на лед и затем концентрировали при пониженном давлении. Неочищенный остаток экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Объединенные органические фракции сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (6,30 г, 86%) в виде не совсем белого твердого вещества.- 26017618 Стадия 4. Гидрохлорид (S)-2-[4-(4-хлорфенокси)феноксиметил]пирролидина. К продукту стадии 3 (6,30 г, 15,6 ммоль) добавляли 4 М HCl в диоксане (62 мл). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли в вакууме. Неочищенный продукт растирали с эфиром и сушили при пониженном давлении, с получением указанного в заголовке продукта (3,47 г, 65%) в виде не совсем белого твердого вещества. Стадия 5. Метиловый эфир 4-(S)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илмасляной кислоты. К раствору продукта стадии 4 (3,47 г, 10,2 ммоль) в ДМФА (46,0 мл) добавляли карбонат калия(2,85 г, 20,6 ммоль) и метил-4-бромбутират (1,48 мл, 12,9 ммоль). Полученную суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли водой и этилацетатом. Неочищенный остаток экстрагировали этилацетатом. Органическую фракцию промывали водой,промывали насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на силикагеле, используя смесь гексан/EtOAc (градиентная система), с получением указанного в заголовке соединения (2,30 г, 63%) в виде желтого маслянистого вещества. Стадия 6. Гидрохлорид 4-(S)-2-[4-(4-хлорфенокси)феноксиметил]пирролидин-1-илмасляной кислоты. К раствору продукта стадии 5 (2,20 г, 5,45 ммоль) в МеОН (22 мл) добавляли 2 н. NaOH (7,23 мл,14,5 ммоль). Полученный лилово-розовый раствор перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли в вакууме. Неочищенное маслянистое вещество разбавляли в воде(45 мл) и рН доводили до 7 раствором 2 н. HCl. Неочищенный остаток экстрагировали этилацетатом. Объединенные органические фракции промывали насыщенным раствором соли, сушили над безводнымNa2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией на силикагеле, используя смесь МеОН/дихлорметан (градиентная система), с получением свободного основания указанного в заголовке соединения в виде желтого маслянистого вещества. К полученному маслянистому веществу добавляли 2 М HCl в диэтиловом эфире (35 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 2 ч. Растворители декантировали. Оставшееся белое твердое вещество растирали с диэтиловым эфиром (50 мл) в течение 1 ч. Взвесь фильтровали, промывали диэтиловым эфиром (25 мл 3) и сушили в вакууме при 45 С в течение 48 ч с получением указанного в заголовке соединения в виде белого твердого вещества (0,84 г, 36%). 1 Н ЯМР (400 МГц, ДМСО-d6)1,82-2,03 (м, 5 Н), 2,23 (м, 1 Н), 2,38 (т, J=7,2 Гц, 2 Н), 3,14 (м, 2 Н),3,48 (м, 1 Н), 3,63 (м, 1 Н), 3,90 (м, 1 Н), 4,28-4,37 (м, 2 Н), 6,94 (д, J=8,8 Гц, 2 Н), 7,06 (с, 4 Н), 7,40 (д, J=8,8 Гц, 2 Н), 10,55 (ушир.с, 1 Н), 12,30 (ушир.с, 1 Н); ВЭЖХ (99,5%); элементный анализ (рассчитано) С 59,16,Н 5,91, N 3,29 (найдено) С 59,07, Н 5,88, N 3,21. Пример 23. Стадия 1. 4-(S)-2-[4-(4-Хлорфенокси)феноксиметил]пирролидин-1-илбутирамид. После перемешивания при температуре окружающей среды в течение 60 ч, ТСХ обнаружила исходное вещество плюс желаемое соединение. Реакционную смесь заливали в реактор Парра и нагревали до 100 С в течение 16 ч (наблюдали большое повышение давления в 95-100 фунт/кв. дюйм). Реакционную смесь барботировали азотом для удаления аммиака. Растворитель удаляли в вакууме. Неочищенный остаток очищали флэш-хроматографией на силикагеле, используя смесь МеОН/дихлорметан (градиентная система), с получением свободного основания указанного в заголовке соединения в виде вязкого желтого маслянистого вещества. К полученному твердому веществу добавляли 2 н. HCl в эфире (14 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 16 ч. Растворитель удаляли при пониженном давлении, с получением неочищенного продукта. Остаток растирали с эфиром,с получением указанного в заголовке соединения (0,58 г) в виде желтовато-коричневого порошка; 1 Н ЯМР (400 МГц, ДМСО-d6); 1,78-2,05 (м, 5 Н), 2,23 (м, 3 Н), 3,14 (м, 2 Н), 3,46 (м, 1 Н), 3,63 (м, 1 Н), 3,88 (м,1 Н), 4,33 (м, 1 Н), 6,94 (д, J=8,8 Гц, ЗН), 7,06 (с, 4 Н), 7,40 (д, J=8,8 Гц, 2 Н), 7,45 (ушир.с, 1 Н) 10,6 (ушир.с,1 Н); МС (m/z) 391,4 (М+1); ЖХ (94,3%); ВЭЖХ (93,8%). Приммер 24.NaH (5,0 ммоль) при 0 С и полученную смесь перемешивали при комнатной температуре в течение од- 27017618 ного часа. Затем добавляли трет-бутиловый эфир (S)-2-(толуол-4-сульфонилоксиметил)пирролидин-1 карбоновой кислоты (1,78 г, 5,0 ммоль) одной порцией к вышеуказанной реакционной смеси и реакционную смесь нагревали при 60 С в течение 16 ч. Смесь распределяли между водой и диэтиловым эфиром. Органический слой промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме с получением маслянистого вещества, представляющего собой (S)-N-Boc-2-[4-(4 трифторметилфенокси)феноксиметил]пирролидин, которое растворяли в 20 мл DCM и обрабатывали трифторуксусной кислотой (5 мл) при комнатной температуре в течение одного часа. Реакционную смесь выпаривали в вакууме с получением желтовато-коричневого маслянистого вещества. Добавляли воду и рН доводили до 10 насыщенным водным раствором Na2CO3. Водную фазу экстрагировали EtOAc, органический слой промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме, с получением маслянистого вещества, которое очищали флэш-хроматографией, элюируя 2-5% смесью гексан/EtOAc, с получением указанного в заголовке соединения (1,45 г, 86%) в виде светлого желтовато-коричневого твердого вещества: МС; m/z 338 (М+1). 1 Н ЯМР (400 МГц, CDCl3)1,56 (м, 1 Н), 1,81 (м, 2 Н), 1,95 (м, 1 Н), 2,92-3,07 (м, 2 Н), 3,52 (м, 1 Н),3,85 (дд, J1=6,8 Гц, J2=8,8 Гц, 1 Н), 3,92 (дд, J=4,8, 9,2 Гц, 1 Н), 6,91-6,99 (м, 6 Н), 7,53 (д, J=8,4 Гц, 2 Н). Приммер 25.(S)-2-[4-(4-Трифторметилфенокси)феноксиметил]пирролидин (34 0 мг, 1 ммоль) поглощали в ДМФА (4 мл) и добавляли этиловый эфир 4-броммасляной кислоты (195 мг, 1,0 ммоль) и затем карбонат калия (138 мг, 1,0 ммоль). Смесь нагревали до 60 С в течение ночи и затем разбавляли водой и экстрагировали EtOAc. Объединенные органические фракции промывали насыщенным, раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме досуха. Затем соединение очищали флэшхроматографией, элюируя ,1% метанолом в дихлорметане. Продукт (210 мг, выход 4 6%) подтверждали ЖХМС; m/z 4 52 (М+1). Стадия 2. (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1-илмасляная кислота. К раствору этилового эфира (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 илмасляной кислоты (210 мг, 0,46 ммоль) в метаноле (4 мл) добавляли 1 н NaOH (0,46 мл, 0,46 ммоль) и смесь перемешивали при 60 С в течение трех часов. Добавляли воду и рН доводили до 5, используя 1 н.HCl. Желаемый продукт экстрагировали EtOAc. Органическую фракцию промывали насыщенным раствором соли, сушили (безводный Na2SO4) и концентрировали в вакууме с получением указанного в заголовке соединения (60 мг, 30%) в виде белого твердого вещества: МС; m/z 424 (М+1). 1 Н ЯМР (400 МГц,ДМСО-d6)1,52-1,72 (м, 5 Н), 1,77-1,94 (м, 3 Н), 2,18 (м, 1 Н), 2,28 (м, 1 Н), 2,77 (м, 2 Н), 3,02 (м, 1 Н), 3,72 Стадия 1. Метиловый эфир (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1-ил пропионовой кислоты. Указанное в заголовке соединение (129 мг, 29%) получали из 1-(4-феноксифенил)пиперазина (337 мг, 1 ммоль) по методике, аналогично описанной для синтеза этилового эфира (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидинмасляной кислоты. МС; m/z 424 (М+1). Стадия 2. Натриевая соль (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1-ил пропионовой кислоты. Метиловый эфир (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1-илпропионовой кислоты (129 мг, 0,29 ммоль) растворяли в метаноле (4 мл), затем добавляли 1 н. водный раствор NaOH(0,29, 0,29 ммоль). Реакционный раствор перемешивали при 60 С в течение 3 ч и затем выпаривали в вакууме досуха. Остаток перемешивали с диэтиловым эфиром и гексаном. Супернатант удаляли с получением белого твердого вещества в качестве указанного в заголовке соединения (80 мг, 63%): МС; m/z 408 (М-1)-. 1 Н ЯМР (400 МГц, ДМСО-d6)1,60-1,70 (м, 3 Н), 1,88-2,11 (м, 3 Н), 2,15 (м, 1 Н), 2,46 (м, 1 Н),2,74 (м, 1 Н), 3,00 (м, 2 Н), 3,72 (дд, J1=7,2 Гц, J2=9,6 Гц, 1 Н), 3,96 (дд, J1=4,0 Гц J2=9,2 Гц, 1 Н), 6,99-7,08 Стадия 1. 4-(S)-2-[4-(4-Хлорфенокси)феноксиметил]пирролидин-1-ил-N-(тетрагидропиран-2 илокси)бутирамид. К раствору соединения примера 22 (0,500 г, 1,58 ммоль), гидроксибензотриазолгидрата (0,191 г,1,41 ммоль) и N-метилморфолина (0,42 мл, 3,85 ммоль) в безводном N,N-диметилформамиде (ДМФА) при комнатной температуре в атмосфере азота добавляли гидрохлорид 1-[3-(диметиламино)пропил]-3 этилкарбодиимида (0,295 г, 1,54 ммоль) и полученную смесь перемешивали при комнатной температуре в течение примерно 30 мин. Через 30 мин О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,225 г, 1,92 ммоль) добавляли к реакционной среде и перемешивали в течение 18 ч в атмосфере азота. Смесь вливали в 30 мл водного раствора и экстрагировали этилацетатом (EtOAc) (310 мл). Объединенные органические слои промывали насыщенным раствором соли (40 мл) и сушили над безводным Na2SO4. Органический слой концентрировали в вакууме, с получением неочищенной смеси, которую очищали флэшхроматографией на силикагеле, используя смесь метанол/дихлорметан (DCM) (градиентная система), с получением продукта (0,260 г, 24%). Стадия 2. Гидрохлорид 4-S)-1-[4-(4-хлорфенокси)феноксиметил]пропилэтиламино)-N-гидроксибутирамида. К раствору продукта (0,260 г, 0,532 ммоль) стадии 2 в 4 н. HCl в диоксане (0,203 мл, 10,6 ммоль) перемешивали при температуре окружающей среды в течение примерно 2 ч и затем концентрировали в вакууме. Остаток растирали с диэтиловым эфиром с получением желаемого продукта в виде красного твердого вещества (0,100 г, 43%): 1 Н ЯМР (400 МГц, CD3OD):2,01-2,406 (м, 7 Н), 3,24-3,28 (м, 3 Н),3,56-3,79 (м, 2 Н), 3,97-3,98 (м, 1 Н), 4,20-4,25 (м, 1 Н), 4,36-4,39 (м, 1 Н), 6,90 (д, 2 Н, J =8,8 Гц), 7,03 (дд,4 Н, J =9 Гц, J =27,6 Гц), 7,30 (д, 2 Н, J=8,8 Гц); МС: m/z 403 (МН); ЖХМС (УФ) 90%. Пример 28. Стадия 1. Метиловый эфир (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 илуксусной кислоты. Гидрохлорид (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидина (372 мг, 1,0 ммоль) поглощали в ДМФА (5 мл) и добавляли метиловый эфир 2-бромуксусной кислоты (153 мг,1,0 ммоль) и карбонат калия (260 мг, 2,0 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические фракции промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали в вакууме досуха. Затем соединение очищали флэш-хроматографией на силикагеле, элюируя 1-3% метанолом в дихлорметане. Продукт (276 мг, выход 67%) подтверждали ЖХМС; m/z 410 (М+1). Стадия 2. Натриевая соль (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 илуксусной кислоты. Указанное в заголовке соединение (250 мг, 89%) получали из метилового эфира (R)-2-[4-(4 трифторметилфенокси)феноксиметил]пирролидин-1-илуксусной кислоты (276 мг, 0,67 ммоль) по методике, аналогично описанной для синтеза натриевой соли (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1-илпропионовой кислоты, МС; m/z 394 (М-1)-. 1 Н ЯМР (400 МГц, ДMCO-d6)1,59-1,68 (м, 3 Н), 1,93 (м, 1 Н), 2,51 (м, 1 Н), 2,91 (д, J=15,6 Гц, 1 Н),3,02-3,11 (м, 2 Н), 3,15 (д, J=15,6 Гц, 1 Н), 3,71 (дд, J1=7,2 Гц, J2=9,2 Гц, 1 Н), 3,99 (дд, J1=3,6 Гц, J2=9,2,1 Н), 4,33 (м, 2 Н), 7,99-7,08 (м, 6 Н), 7,82 (д, J=8,4 Гц, 2 Н). Пример 29. Стадия 1. Метиловый эфир (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 илпропионовой кислоты. Указанное в заголовке соединение (251 мг, 59%) получали из 1-(4-феноксифенил)пиперазина (373 мг, 1 ммоль) по методике, аналогично описанной для синтеза (S)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидина: МС; m/z 424 (М+1). Стадия 2. Натриевая соль (R)-2-[4-(4-трифторметилфенокси)феноксиметил]пирролидин-1 илпропионовой кислоты.
МПК / Метки
МПК: C07D 401/12, C07D 413/06, C07D 207/12, A61P 29/00, C07D 207/09, C07D 401/06, A61K 31/40, C07D 409/12, C07D 207/46, C07D 417/12, C07D 413/12, C07D 241/04, C07D 211/22, C07D 207/26, C07D 403/12, C07D 207/08, C07D 405/12
Метки: lta4h, лечения, ингибиторы, биарилзамещенные, воспаления, гетероциклические
Код ссылки
<a href="https://eas.patents.su/30-17618-biarilzameshhennye-geterociklicheskie-ingibitory-lta4h-dlya-lecheniya-vospaleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Биарилзамещенные гетероциклические ингибиторы lta4h для лечения воспаления</a>
Предыдущий патент: Способ получения сыворотки для диагностики сибирской язвы и диагностический набор
Следующий патент: Лифтовая система
Случайный патент: Вагон-склад для сыпучих грузов












