Гетероциклические соединения как ингибиторы ферментов ротамаз
Номер патента: 3513
Опубликовано: 26.06.2003
Авторы: Кемп Марк Айан, Уайтс Мартин Джеймз, Саннер Марк Аллен, Памер Майкл Джон
Формула / Реферат
1. Соединение формулы (I)

или его фармацевтически приемлемая соль,
где A представляет собой неразветвленный C3-C5алкилен, возможно замещенный C1-C6алкилом,
X представляет собой O, S, NH или N(C1-C6алкил),
Y представляет собой O, S, NH или N(C1-C6алкил),
R представляет собой C-связанную 4-6-членную кольцевую неароматическую гетероциклическую группу, содержащую один гетероатом азота, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C2-C6алкенила, C3-C7циклоалкила, арила, гет, -CO2(C1-C6алкила), -CO(гет), -CONR5R6 и -CO(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7циклоалкила, арила, гет, -O(арила), -O(C1-C2алкилен)арила, -CO(гет), -CONR5R6 и -CO(арила),
R1, R2, R3 и R4, каждый независимо, выбран из H, галогено, C1-C6алкила, C3-C7циклоалкила, галогено(C1-C6)алкила, C1-C6алкокси, -CONR5R6, C3-C7циклоалкокси, C3-C7циклоалкил-(C2-C4)алкилена, C3-C7циклоалкил(C2-C4)алкокси и -CO2(C1-C6алкила),
R5 и R6 либо, каждый независимо, выбран из H и C1-C6алкила, либо, взятые вместе, представляют собой неразветвленный C3-C5алкилен,
"арил" означает фенил, возможно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено, -CONR5R6, галогено(C1-C6алкила) и -NR5R6 и
"гет" означает 5- или 6-членную моноциклическую или 8-, 9- или 10-членную бициклическую кольцевую гетероциклическую группу, содержащую от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, O и S, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено, галогено(C1-C6алкила), фенила и -NR5R6.
2. Соединение по п.1, имеющее стереохимическую формулу (IA)
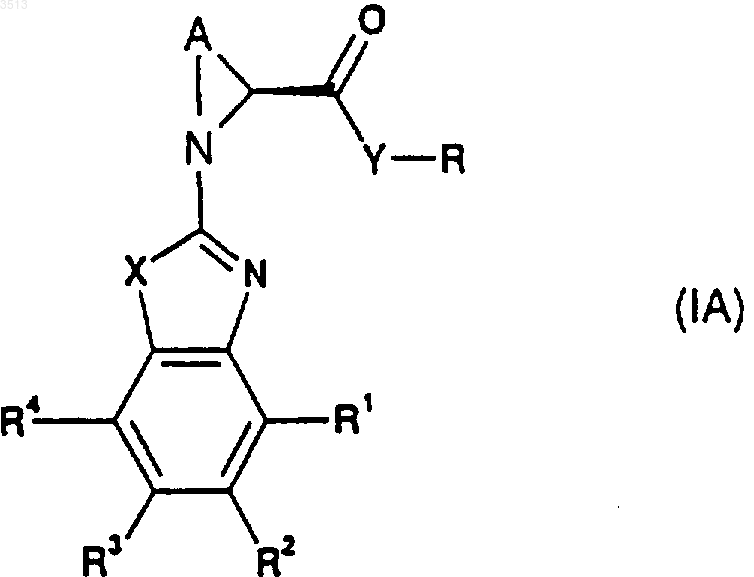
где R, R1, R2, R3, R4, A, X и Y являются такими, как определено для соединения формулы (I) в п.1.
3. Соединение по п.1 или 2, где A представляет собой 1,4-бутилен.
4. Соединение по любому из пп.1-3, где X представляет собой O, S или NH.
5. Соединение по п.4, где X представляет собой O или NH.
6. Соединение по любому из пп.1-5, где Y представляет собой O или NH.
7. Соединение по п.6, где Y представляет собой NH.
8. Соединение по любому из пп.1-7, где R представляет собой азетидинильную, пирролидинильную или пиперидинильную группу, каждая из которых возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C2-C6алкенила, C3-C7циклоалкила, арила, гет, -CO2(C1-C6алкила), -CO(гет), -CONR5R6 и -CO(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7циклоалкила, арила, гет, -O(арила), -O(C1-C2алкилен)арила, -CO(гет), -CONR5R6 и -CO(арила).
9. Соединение по любому из пп.1-8, где R представляет собой азетидинильную, пирролидинильную или пиперидинильную группу, каждая из которых возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, гет, -CO2(C1-C6алкила) и -CO(гет), причем указанный алкил возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7циклоалкила, арила, гет, -O(арила), -O(C1-C2алкилен)арила и -CONR5R6.
10. Соединение по любому из пп.1-9, где R представляет собой азетидинил, пирролидинил или пиперидинил, каждый возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из этила, 2-пиридила, трет-бутоксикарбонила, хинолин-2-илкарбонила, 2-фенилхинолин-4-илкарбонила, 4-метоксихинолин-2-илкарбонила, 6-метокси-2-фенилхинолин-4-илкарбонила, 2-пиперидинохинолин-4-илкарбонила, 2-хлорхинолин-4-илкарбонила, 1H-бензпиразол-6-илкарбонила, циклопропилметила, фенилметила, дифенилметила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-(2-пиридил)этила, 2-(2-метилимидазол-1-ил)этила, (1H-1,2,4-триазол-3-ил)метила, (2-хлорхинолин-3-ил)метила, хинолин-4-илметила, хинолин-2-илметила, хинолин-3-илметила, 1-(хинолин-4-ил)этила, (2-фторпиридин-4-ил)метила, феноксиметила, бензилоксиметила, аминокарбонилметила, 2-(аминокарбонил)этила и 3-(аминокарбонил)фенилметила.
11. Соединение по любому из пп.1-10, где R представляет собой возможно замещенную 3-азетидинильную, 3-пирролидинильную, 3-пиперидинильную или 4-пиперидинильную группу.
12. Соединение по любому из пп.1-11, где арильная группа представляет собой фенильную группу, возможно замещенную CONR5R6.
13. Соединение по любому из пп.1-12, где "гет" группа представляет собой пиридильную, имидазолильную, триазолильную, хинолинильную или бензпиразолильную группу, каждая возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, метокси, фторо, хлоро, фенила и пиперидино.
14. Соединение по любому из пп.1-13, где R1, R2, R3 и R4, каждый независимо, выбран из H, галогено(C1-C6)алкила и галогено.
15. Соединение по любому из пп.1-14, где R1, R2, R3 и R4, каждый независимо, выбран из H, фторо, хлоро, бромо и трифторметила.
16. Соединение по любому из пп.1-15, где группа формулы

в соединении формулы (I) по п.1 представляет собой 1,3-бензоксазол-2-ильную, 1,3-бензотиазол-2-ильную, 1H-бензимидазол-2-ильную, 6-бром-1,3-бензоксазол-2-ильную или 6-хлор-1,3-бензотиазол-2-ильную группу.
17. Соединение по любому из пп.1-16, где A представляет собой 1,4-бутилен, X представляет собой O или NH, Y представляет собой NH, R представляет собой 3-азетидинил, 3-пирролидинил, 3-пиперидинил или 4-пиперидинил, каждый возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из этила, 2-пиридила, трет-бутоксикарбонила, хинолин-2-илкарбонила, 2-фенилхинолин-4-илкарбонила, 4-метоксихинолин-2-илкарбонила, 6-метокси-2-фенилхинолин-4-илкарбонила, 2-пиперидинохинолин-4-илкарбонила, 2-хлорхинолин-4-илкарбонила, 1H-бензпиразол-6-илкарбонила, циклопропилметила, фенилметила, дифенилметила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-(2-пиридил)этила, 2-(2-метилимидазол-1-ил)этила, (1H-1,2,4-триазол-3-ил)метила, (2-хлорхинолин-3-ил)метила, хинолин-4-илметила, хинолин-2-илметила, хинолин-3-илметила, 1-(хинолин-4-ил)этила, (2-фторпиридин-4-ил)метила, феноксиметила, бензилоксиметила, аминокарбонилметила, 2-(аминокарбонил)этила и 3-(аминокарбонил)фенилметила.
18. Соединение по любому из пп.1-17, выбранное из группы, состоящей из
(2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1-бензилпирролидин-3-ил]-2-пиперидинкарбоксамида,
(2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1-(2-пиридинилметил)пирролидин-3-ил]-2-пиперидинкарбоксамида,
(2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1-(3-пиридинилметил)пирролидин-3-ил]-2-пиперидинкарбоксамида,
(2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1-(4-пиридинилметил)пирролидин-3-ил]-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[3-(аминокарбонил)фенилметил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[(2-хлорхинолин-3-ил)метил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[(хинолин-3-ил)метил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[(хинолин-4-ил)метил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[(хинолин-2-ил)метил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[1-(хинолин-4-ил)этил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[хинолин-2-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[2-фенилхинолин-4-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[4-метоксихинолин-2-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[6-метокси-2-фенилхинолин-4-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[2-пиперидинохинолин-4-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[2-хлорхинолин-4-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-{(3S)-1-[1Н-бензпиразол-6-илкарбонил]пирролидин-3-ил}-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-N2-[(3S)-1-бензилпирролидин-3-ил]-1-(6-бром-1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида,
(2S)-1-(1,3-бензоксазол-2-ил)-N2-(1-бензил-3-пиперидинил)-2-пиперидинкарбоксамида,
(2S)-1-(1,3-бензоксазол-2-ил)-N2-(3R,5S)-5-[(бензилокси)метил]пирролидин-3-ил-2-пиперидинкарбоксамида гидрохлорида и
1-(1Н-1,3-бензимидазол-2-ил)-N2-[(3S)-1-бензилпирролидин-3-ил]-2-пиперидинкарбоксамида.
19. Фармацевтическая композиция, содержащая соединение по любому из пп.1-18 или его фармацевтически приемлемые соль или сольват вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
20. Применение соединения по любому из пп.1-18 или его фармацевтически приемлемых соли, сольвата или композиции для изготовления лекарства для лечения дегенерации нейронов.
21. Применение соединения по любому из пп.1-18 или его фармацевтически приемлемых соли, сольвата или композиции для изготовления лекарства для стимуляции регенерации и роста нейронов.
22. Применение соединения по любому из пп.1-18 или его фармацевтически приемлемых соли, сольвата или композиции для изготовления лекарства для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание.
23. Применение по п.22, где неврологическое заболевание или расстройство выбрано из группы, состоящей из старческой деменции (болезни Альцгеймера) и других деменций, бокового амиотрофического склероза и других форм заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона, неврологических расстройств, связанных с ударом, всех форм дегенеративного заболевания, поражающего центральную или периферическую нервную систему (например атрофии мозжечка и ствола мозга, синдромов прогрессирующих атаксий), всех форм мышечной дистрофии, прогрессирующих мышечных атрофий, прогрессирующей бульбарной мышечной атрофии, физического или травматического повреждения центральной или периферической нервной системы (например, спинного мозга), синдромов грыжи, разрыва или выпадения межпозвонковых дисков, шейного спондилеза, расстройств сплетений, сдавлений плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, всех форм периферической невропатии (как диабетической, так и недиабетической), невралгии тройничного нерва, глоссофарингеальной невралгии, паралича Белла, всех форм заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы (например, рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома Гийена-Барре-Штроля), расстройств нервной системы, связанных со СПИДом, тиков вследствие применения дапсона, бульбарных и ретробульбарных поражений зрительного нерва (например, ретинопатии и ретробульбарного неврита), нарушений слуха, таких как шум в ушах, и прионных заболеваний.
24. Применение по п.22, где неврологическое заболевание или расстройство представляет собой старческую деменцию (болезнь Альцгеймера) или другую деменцию, боковой амиотрофический склероз или другую форму заболевания двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, неврологическое расстройство, связанное с ударом, физическое или травматическое повреждение центральной или периферической нервной системы (например, спинного мозга), периферическую невропатию (либо диабетическую, либо недиабетическую), рассеянный склероз или нарушение слуха, такое как шум в ушах.
25. Способ лечения человека, предназначенный для лечения дегенерации нейронов, при котором указанного человека лечат эффективным количеством соединения по любому из пп.1-18 или его фармацевтически приемлемыми солью, сольватом или композицией.
26. Способ лечения человека, предназначенный для стимуляции регенерации и роста нейронов, при котором указанного человека лечат эффективным количеством соединения по любому из пп.1-18 или его фармацевтически приемлемыми солью, сольватом или композицией.
27. Способ лечения человека, предназначенный для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание, при котором указанного человека лечат эффективным количеством соединения по любому из пп.1-18 или его фармацевтически приемлемыми солью, сольватом или композицией.
28. Способ получения соединений по любому из пп.1-18, имеющих формулу (I)
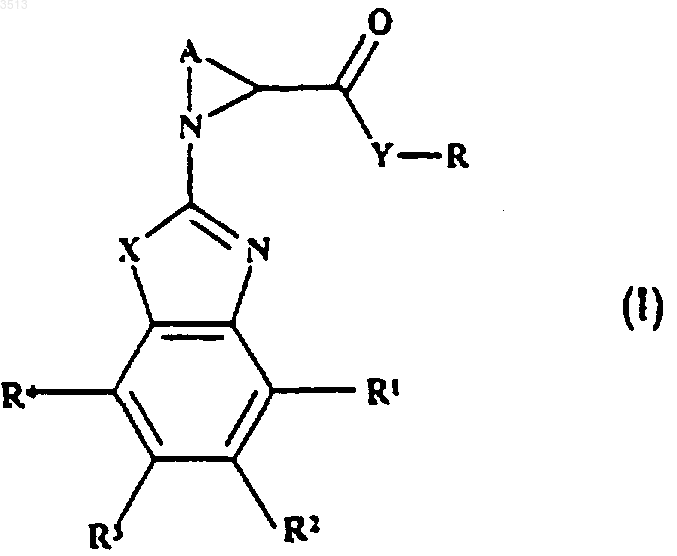
где X представляет собой O или S, A представляет собой неразветвленный C3-C5алкилен, возможно замещенный C1-C6алкилом,
Y представляет собой O, S, NH или N(C1-C6алкил),
R представляет собой C-связанную 4-6-членную кольцевую неароматическую гетероциклическую группу, содержащую один гетероатом азота, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C2-C6алкенила, C3-C7циклоалкила, арила, гет, -CO2(C1-C6алкила), -CO(гет), -CONR5R6 и -CO(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7циклоалкила, арила, гет, -O(арила), -O(C1-C2алкилен)арила, -CO(гет), -CONR5R6 и -CO(арила),
R1, R2, R3 и R4, каждый независимо, выбран из H, галогено, C1-C6алкила, C3-C7циклоалкила, галогено(C1-C6алкила), C1-C6алкокси, -CONR5R6, C3-C7циклоалкокси, C3-C7циклоалкил-(C2-C4)алкилена, C3-C7циклоалкил(C2-C4)алкокси и -CO2(C1-C6алкила),
R5 и R6 либо, каждый независимо, выбран из H и C1-C6алкила, либо, взятые вместх, представляют собой неразветвленный C3-C5алкилен,
"арил" означает фенил, возможно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено, -CONR5R6, галогено(C1-C6алкила) и -NR5R6 и
"гет" означает 5- или 6-членную моноциклическую или 8-, 9- или 10-членную бициклическую кольцевую гетероциклическую группу, содержащую от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, O и S,
причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено, галогено(C1-C6алкила), фенила и -NR5R6,
при котором осуществляют дегидратирующее сочетание соединения, имеющего общую формулу (II)
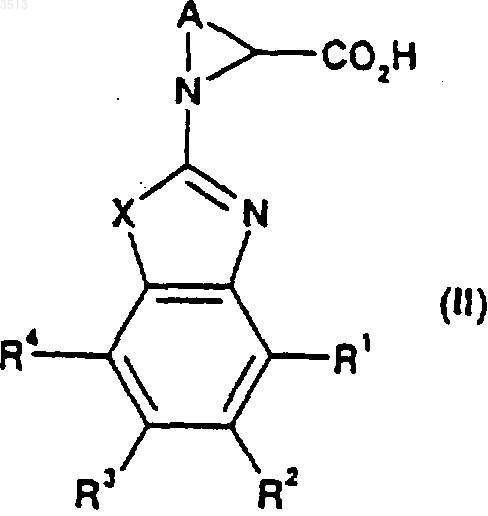
где X представляет собой O или S, a R1, R2, R3 и R4 являются такими, как определено ранее в этом пункте, с соединением, имеющим формулу (III)
H-Y-R (III),
где R и Y являются такими, как определено ранее в этом пункте, и где соединение формулы (I) может быть образовано в виде фармацевтически или ветеринарно приемлемой соли требуемого соединения или его фармацевтически или ветеринарно приемлемого сольвата.
29. Способ получения соединений по любому из пп.1-18, имеющих формулу (I)
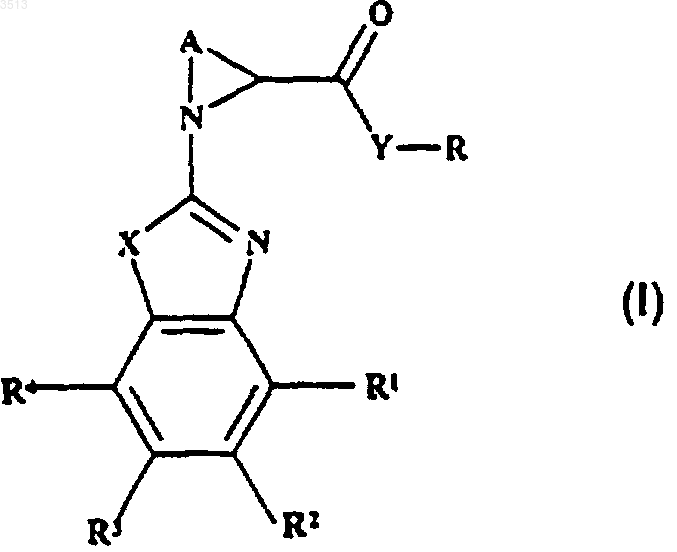
где X представляет собой NH или N(C1-C6алкил), A представляет собой неразветвленный C3-C5алкилен, возможно замещенный C1-C6алкилом,
Y представляет собой O, S, NH или N(C1-C6алкил),
R представляет собой C-связанную 4-6-членную кольцевую неароматическую гетероциклическую группу, содержащую один гетероатом азота, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C2-C6алкенила, C3-C7циклоалкила, арила, гет, -CO2(C1-C6алкила), -CO(гет), -CONR5R6 и -CO(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7циклоалкила, арила, гет, -O(арила), -O(C1-C2алкилен)арила, -CO(гет), -CONR5R6 и -CO(арила),
R1, R2, R3 и R4, каждый независимо, выбран из H, галогено, C1-C6алкила, C3-C7циклоалкила, галогено(C1-C6алкила), C1-C6алкокси, -CONR5R6, C3-C7циклоалкокси, C3-C7циклоалкил-(C2-C4)алкилена, C3-C7циклоалкил(C2-C4)алкокси и -CO2(C1-C6алкила),
R5 и R6 либо, каждый независимо, выбран из H и C1-C6алкила, либо, взятые вместе, представляют собой неразветвленный C3-C5алкилен,
"арил" означает фенил, возможно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6 алкокси, галогено, -CONR5R6, галогено(C1-C6алкила) и -NR5R6 и
"гет" означает 5- или 6-членную моноциклическую или 8-, 9- или 10-членную бициклическую кольцевую гетероциклическую группу, содержащую от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, O и S, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено, галогено(C1-C6алкила), фенила и -NR5R6,
при котором осуществляют реакцию присоединения соединения, имеющего общую формулу (XIIIA) или (XIIIB)
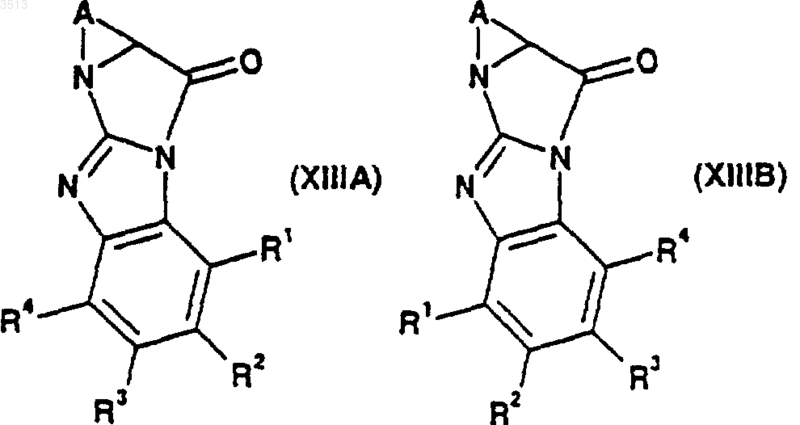
где X представляет собой NH или N(C1-C6алкил), a R1, R2, R3, R4 и A являются такими, как определено ранее в этом пункте, с соединением, имеющим формулу (III)
H-Y-R (III),
где R и Y являются такими, как определено ранее в этом пункте, и где соединение формулы (I) может быть образовано в виде фармацевтически или ветеринарно приемлемой соли требуемого соединения или его фармацевтически или ветеринарно приемлемого сольвата.
30. Способ получения соединения формулы (I) по п.28, при котором осуществляют реакцию N-замещения между соединением, имеющим формулу (V)
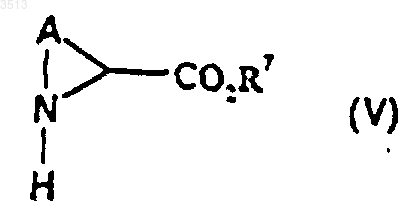
где A является таким, как определено для соединения формулы (I) в п.28, a R7 представляет собой C1-C4алкильную или бензильную группу, и соединением общей формулы (VI)

где X представляет собой O или S, a R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I) в п.28, и где L1 представляет собой подходящую уходящую группу, с образованием соединения формулы (VII)
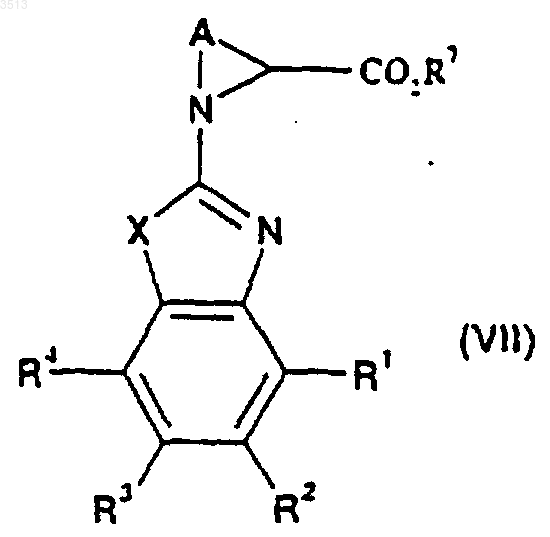
где A, X, R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I) в п.28, которое может быть превращено посредством щелочного гидролиза с образованием соединения формулы (II)

где X, R1, R2, R3 и R4 являются такими, как определено ранее в этом пункте, при этом указанное соединение формулы (II) может быть в свою очередь превращено посредством способа по п.28 с образованием соединения формулы (I).
31. Соединение, имеющее общую формулу (II)

где X представляет собой O или S и где R1, R2, R3 и R4 являются такими, как определено в п.28.
32. Соединение, имеющее общую формулу (VII)
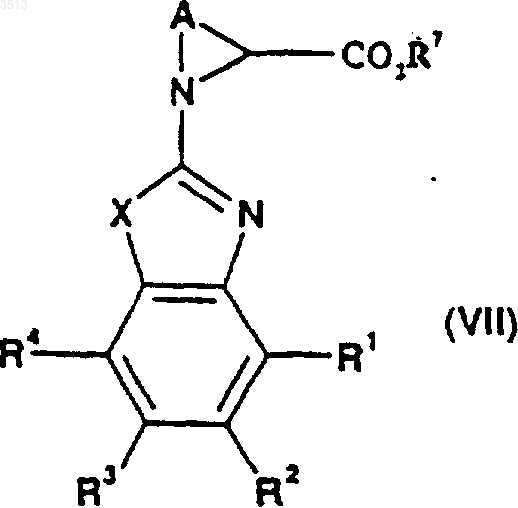
где R1, R2, R3, R4 и A являются такими, как определено в п.28, для соединения формулы (I), X представляет собой O или S, и где R7 представляет собой C1-C4алкильную или бензильную группу.
33. Способ получения соединений по любому из пп.1-18, имеющих общую формулу (I), при котором осуществляют реакцию N-замещения между соединением, имеющим общую формулу (X)
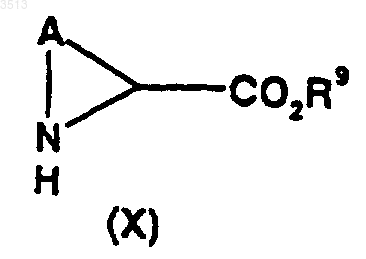
где A является таким, как определено для соединения, имеющего формулу (I), как определено в п.29, и где R9 представляет собой C1-C4алкильную или бензильную группу, и соединением, имеющим общую формулу (IX)
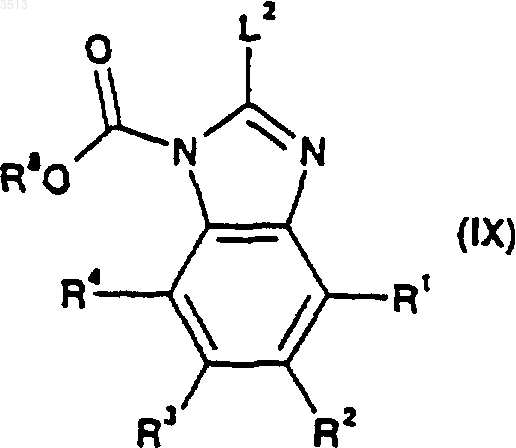
где R1, R2, R3 и R4 являются такими, как определено для соединения формулы (I) в п.29, R8 представляет собой C1-C4алкильную или бензильную группу, и где L2 представляет собой подходящую уходящую группу, с образованием соединения формулы (XI)
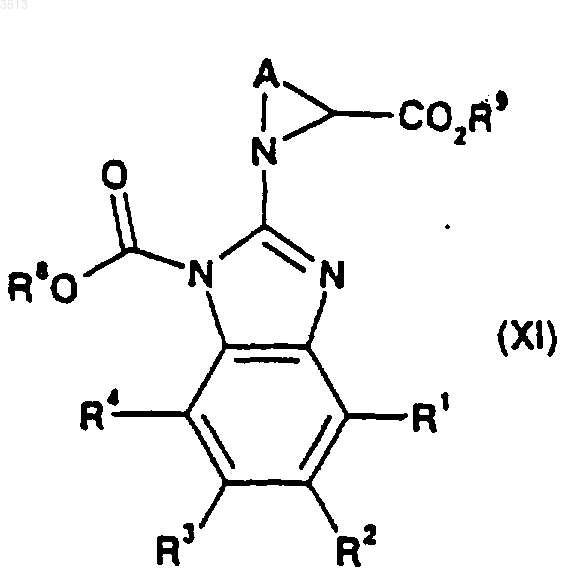
где A, R1, R2, R3, R4, R8 и R9 являются такими, как определено ранее в этом пункте, которое посредством эфирного расщепления может быть затем в свою очередь превращено в соединение формулы (XII)

где A, R1, R2, R3, R4 и R8 являются такими, как определено ранее в этом пункте, которое посредством реакции циклизации может быть превращено в соединение, имеющее формулу (XIIIA) или (XIIIB)
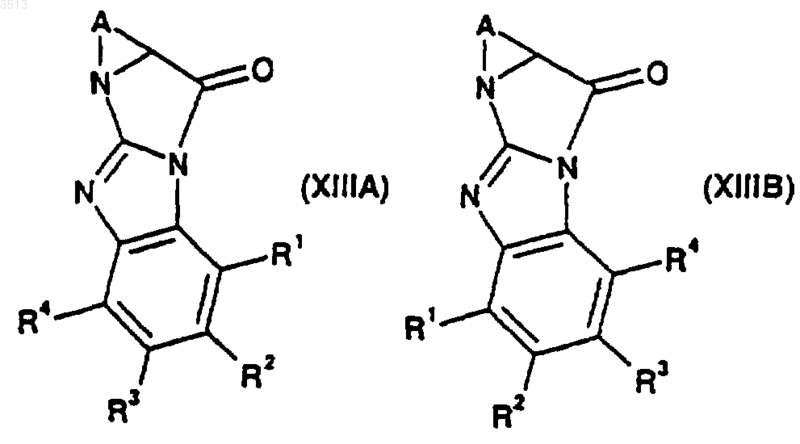
где R1, R2, R3, R4 и A являются такими, как определено ранее в этом пункте, при этом указанные соединения формулы (XIIIA) или (XIIIB) могут быть превращены с помощью способа по п.29 с образованием соединения формулы (I).
34. Соединение, имеющее общую формулу (IX)
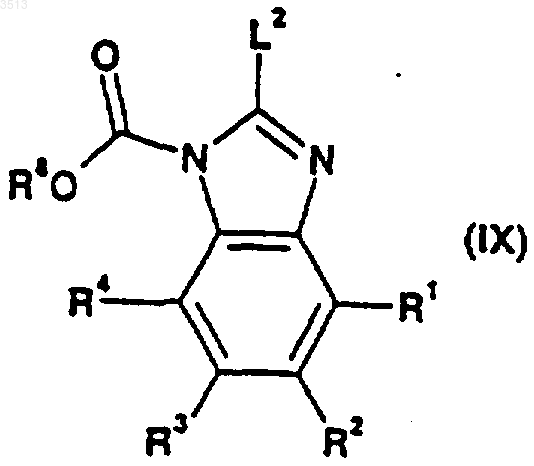
где R1, R2, R3 и R4 являются такими, как определено в п.29 для соединения формулы (I), R8 представляет собой C1-C4алкильную или бензильную группу и где L2 представляет собой подходящую уходящую группу.
35. Соединение формулы (XI)
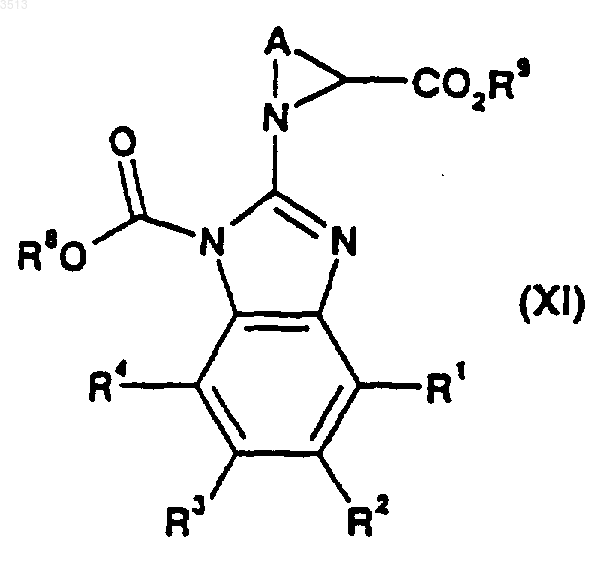
где A, R1, R2, R3, R4, R8 и R9 являются такими, как определено в п.33.
36. Соединение формулы (XII)
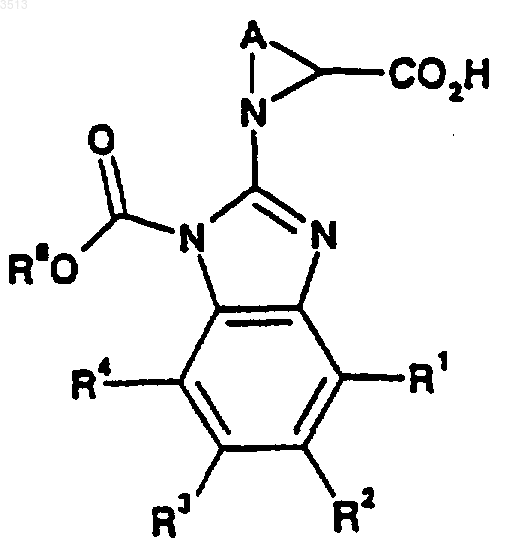
где A, R1, R2, R3, R4 и R8 являются такими, как определено в п.33.
37. Соединение формулы (XIIIA) или (XIIIB)
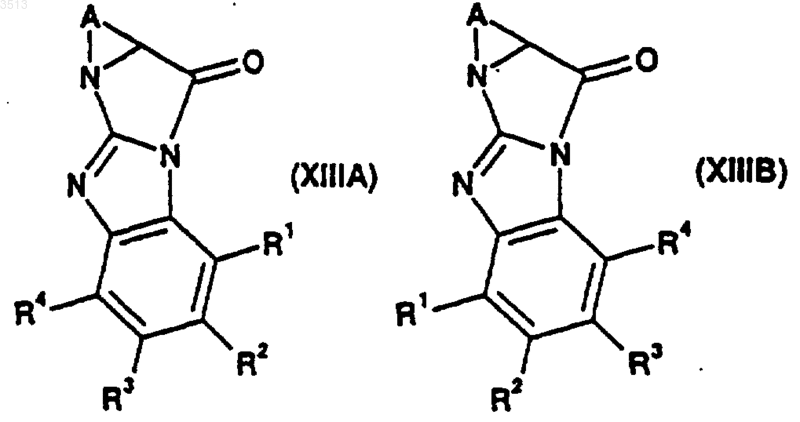
где R1, R2, R3, R4 и A являются такими, как определено в п.33.
Текст
1 Настоящее изобретение относится к производным 1-гетероарилпирролидина, -пиперидина и -гомопиперидина и к способам их получения, промежуточным соединениям, используемым при их получении, содержащим их композициям и к применениям таких производных. Сообщалось, что иммуносупрессор FK-506 стимулирует рост аксонов нервных клеток invitro в клеточной линии нейронов и моделях культур (см. Lyons et al., Pro. Natl. Acad. Sci.,1994, 91, 3191-95 and Snyder et al., Nature Medicine, 1995, 1, 32-37). В WO-A-96/40140, WO-A96/40633 и WO-A-97/16190 описаны соединения, которые обладают нейротрофической активностью, но у которых отсутствует ингибирующее действие на фосфопротеидфосфатазу кальциневрин и, следовательно, они не обладают иммуносупрессивной активностью. В US-A5721256 описаны сульфонамиды, а в WO-A98/13343 и WO-A-98/13355 описаны гетероциклы, которые обладают нейротрофической активностью, но которые не проявляют никакой значительной иммуносупрессивной активности. В WO-A-92/21313 описаны сульфонамиды с иммуносупрессивной активностью. В WO-A-96/40140 и WO-A-96/40633 предположили, что нейротрофический эффект этих соединений, по меньшей мере, частично опосредован высокоаффинным взаимодействием сFKBP-12 или FKBP-52. Однако механизм, с помощью которого это взаимодействие с иммунофилинами FKBP-типа приводит к нейротрофическому эффекту, в настоящее время неизвестен. Был исследован диапазон нейротрофической активности, который может быть реализован посредством этого нейротрофического/неиммуносупрессорного класса соединений,и было обнаружено, что можно стимулировать регенерацию аксонов после сдавления лицевого нерва и сдавления седалищного нерва у крысы. Также было отмечено, что функциональную регенерацию дофаминовых нейронов, поврежденных токсином МРТР (1-метил-4-фенил 1,2,3,6-тетрагидропиридин), стимулировали у мышей с помощью соединений, описанных там же. Дополнительно сообщалось, что восстановление стриарной иннервации у крысы стимулировали с помощью соединений, описанных там же, после повреждения дофаминергических нейронов 6-гидроксидофамином (см. HamiltonSteiner, Current Pharmaceutical Design, 1997,3, 405-428). Авторы данного изобретения обнаружили,что соединения по настоящему изобретению являются нейротрофическими агентами, которые обладают аффинностью к иммунофилинамFKBP-типа. Более конкретно, они являются сильнодействующими ингибиторами ферментативной активности и особенно цис-транспролилизомеразной (ротамазной) активности 2 иммунофилинов FKBP-типа, в частности иммунофилина FKBP-12. Соединения по настоящему изобретению незначительно ингибируют фосфопротеидфосфатазу кальциневрин и поэтому у них отсутствует какая-либо значительная иммуносупрессивная активность. Соединения по настоящему изобретению,таким образом, сдерживают дегенерацию нейронов и стимулируют регенерацию и рост нейронов и могут быть использованы для лечения неврологических расстройств, являющихся результатом нейродегенеративных заболеваний,или других расстройств, в которые вовлечено повреждение нерва. Неврологические расстройства, которые можно лечить, включают в себя старческую деменцию (болезнь Альцгеймера) и другие деменции, боковой амиотрофический склероз и другие формы заболевания двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, неврологические расстройства,связанные с ударом, все формы дегенеративного заболевания, поражающего центральную или периферическую нервную систему (например атрофию мозжечка и ствола мозга, синдромы прогрессирующих атаксий), все формы мышечной дистрофии, прогрессирующие мышечные атрофии, прогрессирующую бульбарную мышечную атрофию, физическое или травматическое повреждение центральной или периферической нервной системы (например, спинного мозга), синдромы грыжи, разрыва или выпадения межпозвонковых дисков, шейный спондилез, расстройства сплетений, сдавления плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, все формы периферической невропатии (как диабетической, так и недиабетической), невралгию тройничного нерва, глоссофарингеальную невралгию, паралич Белла, все формы заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы(например, рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома ГийенаБарре-Штроля),расстройства центральной нервной системы, связанные со СПИДом, тики вследствие применения дапсона, бульбарные и ретробульбарные поражения зрительного нерва(например, ретинопатии и ретробульбарный неврит), нарушения слуха, такие как шум в ушах, и прионные заболевания. Предпочтительно соединения по настоящему изобретению можно использовать для лечения старческой деменции (болезни Альцгеймера) или другой деменции, бокового амиотрофического склероза или другой формы заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона, неврологического расстройства, связанного с ударом, физического или травматического повреждения центральной или периферической нервной системы 3 невропатии (либо диабетической, либо недиабетической), рассеянного склероза или нарушения слуха, такого как шум в ушах. В настоящем изобретении предложено соединение формулы или его фармацевтически приемлемая соль, где А представляет собой неразветвленный С 3 С 5 алкилен, возможно замещенный C1-C6 алкилом,X представляет собой О, S, NH или N(C1C6 алкил),Y представляет собой О, S, NH или N(C1C6 алкил),R представляет собой С-связанную 4-6 членную кольцевую неароматическую гетероциклическую группу, содержащую один гетероатом азота, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила,C2-C6 алкенила, С 3-С 7 циклоалкила, арила, гет,-СО 2(С 1-С 6 алкила), -СО(гет), -CONR5R6 и-СО(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями,каждый из которых независимо выбран из С 3 С 7 циклоалкила, арила, гет, -О(арила), -О(C1-СО(гет),-CONR5R6 иC2 алкилен)арила,-СО(арила),R1, R2, R3 и R4, каждый независимо, выбран из Н, галогено, C1-C6 алкила, C3-C7 циклоалкила, галогено(C1-C6)алкила, C1-C6 алкокси,-CONR5R6, С 3-С 7 циклоалкокси, С 3-С 7 циклоалкил-(С 2-С 4)алкилена, С 3-С 7 циклоалкил-(С 2-С 4) алкокси и -СО 2(C1-C6)алкила,R5 и R6 либо, каждый независимо, выбран из Н и C1-C6 алкила, либо, взятые вместе, представляют собой неразветвленный C3-C5 алкилен,арил означает фенил, возможно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила, C1C6 алкокси, галогено, -CONR5R6, галогено(C1C6 алкила) и -NR5R6, и гет означает 5- или 6-членную моноциклическую или 8-, 9- или 10-членную бициклическую кольцевую гетероциклическую группу,содержащую от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, О и S, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила, C1-C6 алкокси, галогено,галогено(C1-C6)алкила, фенила и -NR5R6. Во всех вышеупомянутых определениях галогено означает фторо, хлоро, бромо или иодо, а алкильные, алкокси, алкенильные и алкиленовые группы, содержащие требуемое число атомов углерода, за исключением того, где 4 указано, могут представлять собой неразветвленную или разветвленную цепь. Фармацевтически приелемые соли соединений формулы (I) включают в себя соли присоединения кислот или оснований этих соединений. Подходящие соли присоединения кислот образованы из кислот, которые образуют нетоксичные соли, примерами которых являются соли гидрохлорид, гидробромид, гидроиодид,сульфат, бисульфат, нитрат, фосфат, кислый фосфат, ацетат, малеат, фумарат, лактат, тартрат, цитрат, глюконат, сукцинат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат. Подходящие соли оснований образованы из оснований, которые образуют нетоксичные соли, примерами которых являются соли натрия, калия, алюминия, кальция, магния, цинка и диэтаноламина. Для обзора подходящих солей см. Berge etal., J. Pharm. Sci., 1977, 66, 1-19. Фармацевтически приемлемые сольваты соединений формулы (I) включают в себя их гидраты. Также в объем настоящего изобретения включены полиморфы и радиомеченные производные соединений формулы (I). Соединение формулы (I) содержит один или более чем один асимметричный атом углерода и таким образом существует в двух или более чем двух стереоизомерных формах. Когда соединение формулы (I) содержит алкенильную или алкениленовую группу, может также иметь место цис (Е) и транс (Z) изомерия. Настоящее изобретение включает в себя отдельные стереоизомеры соединений формулы (I) и, когда подходит, их отдельные таутомерные формы, вместе с их смесями. Разделения диастереоизомеров или цис- и транс-изомеры можно достичь с помощью общепринятых методик, например, путем фракционированной кристаллизации, хроматографии или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли или производного. Отдельный энантиомер соединения формулы (I) может также быть получен из соответствующего оптически чистого промежуточного соединения или путем разделения, такого как ВЭЖХ соответствующего рацемата, с использованием подходящего хирального носителя, или путем фракционированной кристаллизации диастереоизомерных солей, образованных путем взаимодействия соответствующего рацемата с подходящей оптически активной кислотой или основанием, как подходит. Особенно предпочтительными являются соединения формулы где R, R1, R2, R3, R4, А, X и Y являются такими,как определено ранее для соединения формулы(I). В вышеупомянутых определениях соединения формулы (I) и (IA) предпочтительны следующие определения. Предпочтительно А представляет собой 1,4-бутилен. Предпочтительно X представляет собой О,S или NH. Предпочтительно X представляет собой О или NH. Предпочтительно Y представляет собой О или NH. Предпочтительно Y представляет собойNH. Предпочтительно R представляет собой азетидинил, пирролидинил или пиперидинил,каждый из которых возможно замещен, как ранее определено для R для соединения формулы(I). Предпочтительно R представляет собой 3 азетидинил, 3-пирролидинил, 3-пиперидинил или 4-пиперидинил, каждый из которых возможно замещен, как ранее определено для R для соединения формулы (I). Предпочтительно R представляет собой азетидинил, пирролидинил или пиперидинил,каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила, гет, -СO2(C1C6 алкила) и -СО(гет), причем указанный алкил возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C3C7 циклоалкила, арила, гет, -О(арила), -О(С 1 С 2 алкилен)арила и -CONR5R6. Предпочтительно R представляет собой 3 азетидинил, 3-пирролидинил, 3-пиперидинил или 4-пиперидинил, каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1C6 алкила, гет, -СО 2(C1-C6 алкила) и -СО(гет),причем указанный алкил возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C3-C7 циклоалкила, арила, гет,-О(арила), -О(C1-C2 алкилен)арила и -CONR5R6. Предпочтительно R представляет собой азетидинил, пирролидинил или пиперидинил,каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из этила, 2-пиридила, третбутоксикарбонила, хинолин-2-илкарбонила, 2 фенилхинолин-4-илкарбонила, 4-метоксихинолин-2-илкарбонила, 6-метокси-2-фенилхинолин 003513 6 4-илкарбонила, 2-пиперидинохинолин-4-илкарбонила, 2-хлорхинолин-4-илкарбонила, 1 Нбензпиразол-6-илкарбонила, циклопропилметила, фенилметила, дифенилметила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2(2-пиридил)этила,2-(2-метилимидазол-1-ил) этила, (1 Н-1,2,4-триазол-3-ил)метила, (2-хлорхинолин-3-ил)метила, хинолин-4-илметила, хинолин-2-илметила, хинолин-3-илметила, 1(хинолин-4-ил)этила, (2-фторпиридин-4-ил)метила, феноксиметила, бензилоксиметила, аминокарбонилметила, 2-(аминокарбонил)этила и 3-(аминокарбонил)фенилметила. Предпочтительно R представляет собой 3 азетидинил, 3-пирролидинил, 3-пиперидинил или 4-пиперидинил, каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из этила, 2 пиридила, трет-бутоксикарбонила, хинолин-2 илкарбонила, 2-фенилхинолин-4-илкарбонила,4-метоксихинолин-2-илкарбонила, 6-метокси-2 фенилхинолин-4-илкарбонила, 2-пиперидинохинолин-4-илкарбонила, 2-хлорхинолин-4-илкарбонила,1 Н-бензпиразол-6-илкарбонила,циклопропилметила, фенилметила, дифенилметила, 2-пиридилметила, 3-пиридилметила, 4 пиридилметила,2-(2-пиридил)этила,2-(2 метилимидазол-1-ил)этила, (1 Н-1,2,4-триазол-3 ил)метила, (2-хлорхинолин-3-ил)метила, хинолин-4-илметила, хинолин-2-илметила, хинолин 3-илметила, 1-(хинолин-4-ил)этила, (2-фторпиридин-4-ил)метила, феноксиметила, бензилоксиметила, аминокарбонилметила, 2-(аминокарбонил)этила и 3-(аминокарбонил)фенилметила. Предпочтительно R1, R2, R3 и R4, каждый независимо, выбран из Н, галогено(C1-C6)алкила и галогена. Предпочтительно R1, R2, R3 и R4, каждый независимо, выбран из Н, фторо, хлоро, бромо и трифторметила. Предпочтительно R5 и R6 либо каждый представляет Н, либо, взятые вместе, представляют собой 1,5-пентилен. Предпочтительно арил означает фенильную группу, возможно замещеннуюCONR5R6, где R5 и R6 оба предпочтительно представляют собой Н. Предпочтительно гет означает пиридил,имидазолил, триазолил, хинолинил или бензпиразолил, каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила, C1-C6 алкокси, галогено, фенила и -NR5R6. Предпочтительно гет означает пиридил,имидазолил, триазолил, хинолинил или бензпиразолил, каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, метокси, фторо,хлоро, фенила и пиперидино. Предпочтительно гет означает 2 пиридил, 3-пиридил, 4-пиридил, имидазол-1-ил, 7 1 Н-1,2,4-триазол-3-ил, хинолин-2-ил, хинолин 3-ил, хинолин-4-ил или 1 Н-бензпиразол-6-ил,каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6 алкила, C1-C6 алкокси, галогено, фенила и -NR5R6. Предпочтительно гет означает 2 пиридил, 3-пиридил, 4-пиридил, имидазол-1-ил,1 Н-1,2,4-триазол-3-ил, хинолин-2-ил, хинолин 3-ил, хинолин-4-ил или 1H-бензпиразол-6-ил,каждый из которых возможно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, метокси, фторо, хлоро,фенила и пиперидино. Предпочтительно гет означает 2 пиридил, 3-пиридил, 4-пиридил, 1 Н-1,2,4 триазол-3-ил, хинолин-2-ил, хинолин-3-ил, хинолин-4-ил, 1 Н-бензпиразол-6-ил, 2-метилимидазол-1-ил, 2-хлорхинолин-3-ил, 2-фенилхинолин-4-ил, 4-метоксихинолин-2-ил, 6-метокси-2 фенилхинолин-4-ил, 2-пиперидинохинолин-4 ил, 2-хлорхинолин-4-ил или 2-фторпиридин-4 ил. Предпочтительно группа формулы в соединении формулы (I) представляет собой 1,3-бензоксазол-2-ил, 1,3-бензотиазол-2-ил, 1 Нбензимидазол-2-ил, 6-бром-1,3-бензоксазол-2-ил или 6-хлор-1,3-бензотиазол-2-ил. Особенно предпочтительными примерами соединений формулы (I), которые описаны здесь далее в разделе примеров, являются(2S)-N2-(3S)-1-[(хинолин-4-ил)метил] пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоксамид,(2S)-N2-(3S)-1-[(хинолин-2-ил)метил] пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоксамид,(2S)-N2-(3S)-1-[1-(хинолин-4-ил)этил] пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоксамид,(2S)-N2-(3S)-1-[хинолин-2-илкарбонил] пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоксамид,(2S)-N2-(3S)-1-[2-фенилхинолин-4-илкарбонил]пирролидин-3-ил-1-(1,3-бензоксазол 2-ил)-2-пиперидинкарбоксамид,(2S)-N2-(3S)-1-[4-метоксихинолин-2 илкарбонил]пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамид,(2S)-N2-(3S)-1-[6-метокси-2-фенилхинолин-4-илкарбонил]пирролидин-3-ил-1-(1,3 бензоксазол-2-ил)-2-пиперидинкарбоксамид,(2S)-N2-(3S)-1-[2-пиперидинохинолин-4 илкарбонил]пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамид,(2S)-N2-(3S)-1-[2-хлорхинолин-4-илкарбонил]пирролидин-3-ил-1-(1,3-бензоксазол-2-ил)2-пиперидинкарбоксамид,(2S)-N2-(3S)-1-[1 Н-бензпиразол-6-илкарбонил]пирролидин-3-ил-1-(1,3-бензоксазол-2 ил)-2-пиперидинкарбоксамид,(2S)-N2-[(3S)-1-бензилпирролидин-3-ил]-1(6-бром-1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамид,(2S)-1-(1,3-бензоксазол-2-ил)-N2-(1-бензил 3-пиперидинил)-2-пиперидинкарбоксамид,(2S)-1-(1,3-бензоксазол-2-ил)-N2-(3R,5S)-5[(бензилокси)метил]пирролидин-3-ил-2-пиперидинкарбоксамида гидрохлорид, и 1-(1 Н-1,3-бензимидазол-2-ил)-N2-[(3S)-1 бензилпирролидин-3-ил]-2-пиперидинкарбоксамид. Соединения формулы (I) можно получить,используя общепринятые процедуры, такие как,например, с помощью следующих иллюстрирующих способов, где R, R1, R2, R3, R4, А, X и Y являются такими, как ранее определено для соединения формулы (I), если не указано иначе. 1) Соединения формулы (I), где X представляет собой О или S, могут быть получены путем дегидратирующего сочетания соединения формулы 9 Соединения, имеющие формулу (II), могут быть получены в соответствии со способом,проиллюстрированным в получении 3, который здесь подробно описан. Подходящие условия для таких получений используют общепринятые процедуры, хорошо известные специалисту,такие как те, на которые ссылаются в стандартных текстах, см., например, Advanced OrganicChemistry, Third Edition, Jerry March, 0-56, p. 371-4. Примерами подходящих условий являются следующие: (а) соединение формулы (II) можно сначала преобразовать в активированный эфир,используя гидрат 1-гидроксибензотриазола и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида в присутствии подходящего акцептора кислоты, например триэтиламина, и затем обработать in situ соединением формулы(III). Реакцию можно проводить в подходящем растворителе, таком как дихлорметан. Можно также использовать каталитическое количество подходящего катализатора, например 4 диэтиламинопиридина,(б) соединения формул (II) и (III) могут быть объединены с трифенилфосфином и диэтиловым эфиром азодикарбоновой кислоты в присутствии подходящего растворителя, такого как тетрагидрофуран,(в) соединения формул (II) и (III) могут быть объединены с 1,1'-карбонилдиимидазолом в присутствии подходящего растворителя, такого как тетрагидрофуран или дихлорметан,(г) непосредственное нагревание соединений формул (II) и (III) вместе возможно в присутствии подходящего растворителя, например,N,N-диметилацетамида, циклопентанола или дифенилового эфира, и возможно в присутствии подходящего кислотного катализатора, например, когда Y представляет собой О. Промежуточные соединения формулы (II) могут быть получены с помощью общепринятых способов, например путем, показанным на схеме 1. Соединения формул (III), (IV) и (VI) могут быть получены с помощью общепринятых процедур. 2) Соединения формулы (I), где X=NH (т.е. соединение формулы (IB могут быть получены с помощью пути, показанного на схеме 2, т.е. путем взаимодействия соединения формулы где R7 представляет собой С 1-С 4 алкил, предпочтительно метил или бензил, a L1 представляет собой подходящую уходящую группу, например галогено (предпочтительно хлоро), -SCH3, -SH,-SО 2 СН 3, -SO2CF3, -ОSО 2 СН 3 или -OSO2CF3. Схема 2(диметиламино)фосфония гексафторфосфатом,O-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборатом или пентафторфенолом,(III) группу, дающую смешанный ангидрид, такой как полученный путем взаимодействия соединения формулы (II) с изобутилхлорформиатом, или(IV) группу, дающую имидазолид, такой как полученный путем взаимодействия соединения формулы (II) с 1,1'-карбонилдиимидазолом. Эта реакция может быть осуществлена с использованием стандартных методик. Соединения формулы (XIV) могут быть получены с помощью общепринятых процедур,как, например, из соединений формулы (II). 4) Все соединения формулы (I) могут быть получены путем взаимодействия соединения формулы с соединением формулы где L2 представляет собой подходящую уходящую группу, например, как ранее определено для L1,R8 представляет собой С 1-С 4 алкил (предпочтительно трет-бутил) или бензил, аR9 представляет собой С 1-С 4 алкил или бензил. Соединения формул (VIII) и (X) могут быть получены с помощью общепринятых процедур. Реакции, использующие имеющиеся в продаже соединения, имеющие формулы (VIII) и (X), представлены в получениях 46 и 47. 3) Соединения формулы (I), где X представляет собой О или S, могут быть получены путем взаимодействия соединения формулы(III) где L3 представляет собой подходящую уходящую группу, такую как(I) галогено, предпочтительно хлоро или бромо,(II) группу, дающую активированный эфир, такой как полученный путем взаимодействия соединения формулы (II) с 1-гидрокси где L3 является таким, как ранее определено дляL1 для соединения формулы (VI) и предпочтительно представляет собой хлоро. В предпочтительной процедуре, где L3 представляет собой хлоро, реакцию можно проводить в присутствии подходящего акцептора кислоты, например этилдиизопропиламина, и в подходящем растворителе, например ацетонитриле или N,N-диметилацетамиде, при нагревании. Когда X=S, реакцию можно удобным образом проводить, используя порошок меди, гидрохлорид триэтиламина и ксилол, при нагревании. Соединения формулы (XV) могут быть получены с помощью общепринятых процедур,подобных тем, которые описаны здесь в получении 47. Соединения формулы (XVI) могут быть получены путем общепринятых процедур,таких как описаны здесь в получении 47. Следует понимать, что некоторые соединения формулы (I) могут быть превращены в другие соединения формулы (I) с помощью общепринятых способов, например с использованием стандартных методик взаимопревращения. Все вышеперечисленные реакции и получения новых исходных материалов, использованных в предшествующих способах, являются общепри 13 нятыми, а соответствующие реагенты и условия реакции для их осуществления или получения, а также процедуры для выделения желаемых продуктов должны быть хорошо известны специалистам в данной области, со ссылкой на литературу, а также на примеры и получения по данному изобретению. Специалистам в данной области следует понимать, что в пределах некоторых описанных способов порядок использованных стадий синтеза можно изменять, и он будет зависеть, среди прочего, от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступность ключевых промежуточных соединений и стратегия защиты групп (если есть), которую необходимо использовать. Очевидно, что такие факторы будут влиять на выбор реагента для использования в указанных стадиях синтеза. Фармацевтически приемлемую соль соединения формулы (I) можно легко получить путем смешения вместе растворов соединения формулы (I) и желаемой кислоты или основания, как подходит. Соль можно осадить из раствора и собрать путем фильтрования или можно выделить путем выпаривания растворителя. Аффинность соединений формулы (I) кChem. Soc., 1993, 115, 9925-9938). В этих способах цис-транс-изомеризацию связи гидрофобной аминокислоты пролина в тетрапептидном субстрате (например, связь фенилаланинпролин в N-сукцинил-ala-phe-pro-phe-п-нитроанилиде [сукцинил-AFPF-pNA]) можно определить, контролируя отщепление pNA от трансРrо-содержащего пептида с помощью избытка химотрипсина. Величины ИК 50 (концентрации соединения формулы (I), дающей 50% ингибирование) определяли, используя следующую методику анализа. Буфер для анализа (2,175 мл) (50 мМ 4-(2 гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES), 100 мМ NaCl, 1 мМ дитиотрейтол (ДТТ), рН 8,0) уравновешивали до 10 С в кювете. 12,5 мкл раствора соединения по настоящему изобретению в ДМСО (диметилсульфоксид), 250 мкл 60 мг/мл раствора химотрипсина в 1 мМ водной соляной кислоте и затем 50 мкл раствора человеческого рекомбинантного FKBP-12 (4,5 мкМ) в буфере для анализа добавляли и перемешивали. Реакцию инициировали добавлением 12,5 мкл раствора 20 мМ сукцинил-AFPF-pNA в ДМСО. Наблюдали поглощение при 390 нМ в течение одной минуты, собирая данные каждые 0,25 с. Данные подставляли в уравнение скорости первого порядка со сдвигом, и полученную константу скорости 14 корректировали для скорости некатализированной изомеризации субстрата. Константу скорости, определенную при различных концентрациях ингибитора (от 10 нМ до 100 мкМ), выражали как % ингибирования от константы скорости в контроле. ИК 50 оценивали, используя программу подбора нелинейной кривой методом наименьших квадратов для данных сигмоидальной зависимости эффекта от дозы.Ki,app (кажущуюся константу ингибирования) определяли для соединений по настоящему изобретению, используя процедуру анализа,описанную ниже. Буфер для анализа (2,175 мл)(50 мМ HEPES, 100 мМ NaCl, 1 мМ ДТТ, рН 8,0) уравновешивали до 10 С в кювете. 12,5 мкл раствора соединения по настоящему изобретению в ДМСО, 250 мкл 60 мг/мл раствора химотрипсина в 1 мМ водной соляной кислоте и затем 50 мкл раствора человеческого рекомбинантного FKBP-12 (1,5 мкМ) в буфере для анализа добавляли и перемешивали. Реакцию инициировали добавлением 12,5 мкл раствора безводного сукцинил-ALPF-pNA (100 мМ конечная концентрация) в 400 мМ растворе LiCl в трифторэтаноле. Наблюдали поглощение при 390 нМ в течение 3 мин, собирая данные каждые 0,5 с. Данные подставляли в уравнение скорости первого порядка со сдвигом и первоначальную скорость (v) рассчитывали из концентрации цис (releu-pro связи)-сукцинил-АLРF-рNА при to и константы скорости первого порядка при различных концентрациях ингибитора (I). Данные в форме Vinh/Vcontrolv.[l] подставляли в уравнение для обратимого ингибирования связывания, для получения величин для Ki,app (см. Morrison, J.F.,et al., Comments Mol. Cell Biophys., 1985, 2, 347368). Этот анализ используют, когда Ki,app достигает концентрации FKBP-12 в анализе (30 нМ). Анализ Диксона (см. Dixon, M., Biochem.J., 1953, 55, 170-171) используют для получения величин Ki,app для менее сильнодействующих соединений. Ту же методику используют для получения Ki,app для FKBP-52 со следующими модификациями: FKBP-12 заменяют 40 мкл человеческого рекомбинантного FKBP-52 (5,2 мкМ) и используют в анализе 2,185 мл буфера для анализа. Соединения по данному изобретению обладают ингибирующей активностью против фермента FKBP-12. Ранние эксперименты указывают на то, что соединения по данному изобретению также обладают ингибирующей активностью против фермента FKBP-52. Фермент FKBP-52 может быть экспрессирован и охарактеризован с помощью методики,описанной в Peattie, D.A., et al., Proc. Natl. Acad.et al., Molecular Endocrinology 9, 1549-1560,1995. Активность соединений формулы (I), стимулирующую рост аксонов нервных клеток,можно определить в культуре тканей ганглиев задних корешков спинного мозга эмбрионов цыпленка. Ганглии задних корешков (ГЗК) выделяли асептически в соответствии со способом Брея (см. Culturing Nerve Cells, Ed. G. Bankerand K. Goslin, MIT Press, Cambridge, MA, 1991,p. 119). Отдельные ганглии хранили в Са 2+/Mg2+-свободном буфере Tyrodes на льду, до тех пор пока ряд ганглиев не был собран. Отдельные ганглии переносили в покрытые коллагеном 24-луночные культуральные планшеты,содержащие нейробазальную (Neurobasal) среду плюс В 27 добавки и инкубировали при 37 С в атмосфере 5% СО 2. Соединение по настоящему изобретению добавили после того, как в течение 4 ч дали ганглиям присоединиться. Эксплантаты фиксировали и окрашивали кумасси голубым через 24 или 48 ч культивирования. Для каждой обработки анализировали 4-6 ганглиев и подсчитывали путем оценки степени роста аксонов нервных клеток относительно диаметра эксплантата, используя визуальный анализ. Соединения по настоящему изобретению были протестированы с 10 нг/мл фактора роста нервов(ФРН) и без него и сравнивались с ростом в присутствии только 10 нг/мл фактора роста нервов. Альтернативной системой для измерения активности, стимулирующей рост аксонов нервных клеток, РРl-азных ингибиторов FKBP12 является модель SH-SY-5Y нейробластомы,описанная Gold, B.G., et al., in Exp. Neurol.,1997, 147(2), 269-278. Клетки поддерживали в среде Игла, модифицированной по способу Дульбекко (DMEM), снабженной 10% фетальной телячьей сывороткой, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина, при 37 С в атмосфере 7% СО 2. Клетки высевали по 1x106 клеток на лунку и обрабатывали в течение 5 дней 400 нМ афидиколина. Клетки затем промывали и обрабатывали ФРН в концентрации 10 нг/млразличные концентрации соединения в течение 7 дней, чтобы определить стимулируют ли соединения рост аксонов нервных клеток в присутствии субоптимальных концентраций ФРН(и/или в отсутствии ФРН). Рост аксонов нервных клеток определяли, используя визуальный анализ для измерения длин аксонов 20 случайных полях. Нейротрофическую активность соединений по настоящему изобретению можно оценить in vivo, используя модель сдавления седалищного нерва у крыс в качестве модели регенерации периферического нерва (см. Bridge,P.M., et al., Experimental Neurology, 1994, 127,284-290, Medinaceli, L, et al., Expl. Neurology,1982, 77, 634-643, Gold, B.G., et al., Restorative 16 модель 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР) и 6-гидроксидофамина у различных видов в качестве модели регенерации при болезни Паркинсона (см. Mokry, J., Physiol.Res., 1995, 44(3), 143-150) и повреждения свода фимбрии в качестве модели регенерации при болезни Альцгеймера (см. Cassel, J.C., Duconseille, E., Jeltsch, H. and Will, В., Prog. Neural.,1997, 51, 663-716). Соединения формулы (I) можно вводить отдельно, но обычно следует вводить в смеси с подходящим фармацевтическим эксципиентом,разбавителем или носителем, выбранным с учетом предполагаемого пути введения и стандартной фармацевтической практики. Например, соединения формулы (I) можно вводить перорально или сублингвально в форме таблеток, капсул, овальных таблеток, эликсиров,растворов или суспензий, которые могут содержать корригенты или красящие агенты, для применений с немедленным или регулируемым высвобождением. Такие таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,дикальция фосфат и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный,картофельный и маниоковый крахмал), альгиновую кислоту и некоторые сложные силикаты,связующие вещества при гранулировании, такие как поливинилпирролидон, сахароза, желатин и аравийская камедь. Дополнительно могут быть включены смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа могут также быть использованы как наполнители в желатиновых капсулах. Предпочтительные эксципиенты в этом отношении включают в себя лактозу, или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть объединены с различными подслащивающими агентами или корригентами, с красящим веществом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин и их комбинациями. Соединения формулы (I) можно также вводить парентерально в виде инъекций, например, внутривенно, интраперитонеально, интратекально, интравентрикулярно, интрастернально, интракраниально, внутримышечно или подкожно, или они могут быть введены с помощью инфузионных методик. Их лучше всего использовать в форме стерильного водного раствора,который может содержать другие вещества, например, достаточно солей или глюкозы, чтобы сделать раствор изотоничным крови. Водные растворы должны быть подходящим образом забуферены (предпочтительно до рН от 3 до 9),если необходимо. Приготовление подходящих 17 парентеральных препаратов в стерильных условиях легко осуществимо с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области. Для перорального и парентерального введения людям уровень суточной дозировки соединений формулы (I) должен обычно составлять от 1 до 25 мг/кг (в разовой или разделенных дозах). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 0,05 мг до 1,0 г активного соединения для введения однократно или два или более чем два раза, как подходит. Лечащий врач в любом случае должен определить настоящую дозировку, которая должна быть наиболее подходящей для любого конкретного пациента, и она будет варьировать с возрастом, массой от реакций конкретного пациента. Вышеуказанные дозировки представляют собой обобщенный пример. Конечно, могут существовать отдельные примеры, когда оправданы более высокие или более низкие диапазоны дозировок и они находятся в объеме настоящего изобретения. Соединения формулы (I) можно также вводить интраназально или путем ингаляции, и их удобным образом доставляют в форме сухого порошкового ингалятора, или аэрозоля из контейнера под давлением или распылителя с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана,такого как 1,1,1,2-тетрафторэтан (HFA 134A(товарный знак или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA (товарный знак, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением стандартную дозу можно определить путем обеспечения клапаном для доставки отмеренного количества. Контейнер или распылитель может содержать раствор или суспензию активного соединения,например, с использованием смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее вещество, например, сорбитантриолеат. Капсулы и картриджи (сделанные, например, из желатина) для использования в ингаляторе или инсуффляторе могут быть приготовлены таким образом, чтобы содержать порошкообразную смесь соединения формулы (I) и подходящую порошкообразную основу, такую как лактоза или крахмал. Аэрозольные или сухие порошковые препараты предпочтительно приготавливают так,чтобы каждая отмеренная доза, или прыск,содержала от 20 мкг до 20 мг соединения формулы (I) для доставки пациенту. Общая суточная доза с использованием аэрозоля должна находиться в диапазоне от 20 мкг до 20 мг, которую можно вводить в виде разовой дозы или,более обычно, в разделенных дозах в течение дня. 18 Альтернативно, соединения формулы (I) можно вводить в форме суппозитория или пессария, или их можно наносить местно в форме лосьона, раствора, крема, мази или присыпки. Соединения формулы (I) могут также быть введены трансдермально путем применения кожного пластыря. Их можно также вводить в глаза,особенно для лечения неврологических расстройств глаз. Для офтальмического применения эти соединения могут быть приготовлены в виде микронизированных суспензий в изотоничном стерильном солевом растворе с отрегулированным значением рН или предпочтительно в виде растворов в изотоничном стерильном солевом растворе с отрегулированным значением рН возможно в комбинации с консервантом, таким как хлорид бензилалкония. Альтернативно, они могут быть приготовлены в виде мази, такой как вазелин. Для применения местно на кожу, соединения формулы (I) могут быть приготовлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или более чем одним из следующих компонентов: минеральное масло, жидкий вазелин, пропиленгликоль,соединение полиоксиэтилена полиоксипропилена, эмульгирующий воск и вода. Альтернативно, они могут быть приготовлены в виде подходящего раствора или крема, суспендированного или растворенного, например, в смеси с одним или более чем одним из следующих веществ: минеральное масло, сорбитанмоностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск цетиловых эфиров, стеариловый спирт,2-октилдодеканол, бензиловый спирт и вода. Соединения формулы (I) можно также вводить вместе с другими нейротрофическими агентами, такими как нейротрофический фактор роста (НФР), глиальный фактор роста, фактор роста, полученный из головного мозга, цилиарный нейротрофический фактор и/или нейротрофин-3. Уровень дозировки нейротрофического агента будет зависеть от нейротрофической эффективности данной комбинации и используемого пути введения. Следует понимать, что все ссылки здесь на лечение включают в себя целебное, паллиативное и профилактическое лечение. Таким образом, в данном изобретении далее предложены:(I) фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем,(II) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в медицине,(III) применение соединения формулы (I) или его фармацевтически приемлемых соли, 19 сольвата или композиции для производства лекарства для лечения дегенерации нейронов,(IV) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для стимуляции регенерации и роста нейронов,(V) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание,(VI) применение как в (V), где неврологическое заболевание или расстройство выбрано из группы, состоящей из старческой деменции(болезни Альцгеймера) и других деменций, бокового амиотрофического склероза и других форм заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона, неврологических расстройств, связанных с ударом,всех форм дегенеративного заболевания, поражающего центральную или периферическую нервную систему (например, атрофии мозжечка и ствола мозга, синдромов прогрессирующих атаксий), всех форм мышечной дистрофии, прогрессирующих мышечных атрофии, прогрессирующей бульбарной мышечной атрофии, физического или травматического повреждения центральной или периферической нервной системы(например спинного мозга), синдромов грыжи,разрыва или выпадения межпозвонковых дисков, шейного спондилеза, расстройств сплетений, сдавлений плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, всех форм периферической невропатии (как диабетической, так и недиабетической), невралгии тройничного нерва, глоссофарингеальной невралгии,паралича Белла, всех форм заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы (например рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома Гийена-Барре-Штроля), расстройств центральной нервной системы, связанных со СПИДом, тиков вследствие применения дапсона, бульбарных и ретробульбарных поражений зрительного нерва (например, ретинопатии и ретробульбарного неврита), нарушений слуха, таких как шум в ушах, и прионных заболеваний,(VII) применение как в (VI), где неврологическое заболевание или расстройство представляет собой старческую деменцию (болезнь Альцгеймера) или другую деменцию, боковой амиотрофический склероз или другую форму заболевания двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, неврологическое расстройство, связанное с ударом, физическое или травматическое повреждение центральной или периферической нервной системы(например спинного мозга), периферическую невропатию (либо диабетическую, либо недиабетическую), рассеянный склероз или нарушение слуха, такое как шум в ушах,(VIII) способ лечения человека, предназначенный для лечения дегенерации нейронов, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью,сольватом или композицией,(IX) способ лечения человека, предназначенный для стимуляции регенерации и роста нейронов, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью, сольватом или композицией,(X) способ лечения человека, предназначенный для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью, сольватом или композицией,(XI) способ как в (X), где неврологическое заболевание или расстройство выбрано из группы, состоящей из старческой деменции (болезни Альцгеймера) и других деменций, бокового амиотрофического склероза и других форм заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона, неврологических расстройств, связанных с ударом, всех форм дегенеративного заболевания, поражающего центральную или периферическую нервную систему (например, атрофии мозжечка и ствола мозга, синдромов прогрессирующих атаксий), всех форм мышечной дистрофии, прогрессирующих мышечных атрофии, прогрессирующей бульбарной мышечной атрофии, физического или травматического повреждения центральной или периферической нервной системы(например, спинного мозга), синдромов грыжи,разрыва или выпадения межпозвонковых дисков, шейного спондилеза, расстройств сплетений, сдавлений плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, всех форм периферической невропатии (как диабетической, так и недиабетической), невралгии тройничного нерва, глоссофарингеальной невралгии,паралича Белла, всех форм заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы (например, рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома Гийена-Барре-Штроля), расстройств нервной системы, связанных со СПИДом, тиков вследствие применения дапсона, бульбарных и ретробульбарных поражений зрительного нерва (например, ретинопатии и ретробульбарного неврита), нарушений слуха,таких как шум в ушах, и прионных заболеваний, 21(XII) способ, как в (XI), где неврологическое заболевание или расстройство представляет собой старческую деменцию (болезнь Альцгеймера) или другую деменцию, боковой амиотрофический склероз или другую форму заболевания двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, неврологическое расстройство, связанное с ударом, физическое или травматическое повреждение центральной или периферической нервной системы (например, спинного мозга), периферическую невропатию (либо диабетическую, либо недиабетическую), рассеянный склероз или нарушение слуха, такое как шум в ушах,(XIII) любые новые промежуточные соединения, описанные здесь,(XIV) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для лечения заболевания, являющегося результатом недостатка или сверх продукцииFKBP-12 или FKBP-52. Следующие примеры иллюстрируют получение соединений формулы (I). Програмное обеспечение ACD/IUPAC Pro использовали как основу для наименования полученных соединений. Пример 1. (2S)-1-(1,3-Бензоксазол-2-ил)N2-[(3R)-1-бензилпирролидин-3-ил]-2-пиперидинкарбоксамид. Триэтиламин (0,167 мл) добавили к раствору (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (100 мг) (см. получение 3), 1-гидроксибензотриазол гидрата (60,4 мг),(3R)-1-бензилпирролидин-3-иламина (78,7 мг) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида (85,4 мг) в дихлорметане (30 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, после чего смесь разбавляли водой и органический слой отделяли, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана, этилацетата и 0,88 водного раствора аммиака в соотношении от 50:50:0 по объему, меняя на 25:75:0, а затем на 20:80:1, с получением(2S)-1-(1,3-бензоксазол-2-ил)-N2[(3R)-1-бензилпирролидин-3-ил]-2-пиперидинкарбоксамида в виде желтого масла (94 мг). 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30-7.20 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 3) и(3S)-1-бензилпирролидин-3-иламина. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана,этилацетата и 0,88 водного раствора аммиака, с 10% приращением, в соотношении от 50:50:1 по объему, меняя затем на 20:80:1. Данный продукт далее очищали путем перекристаллизации из смеси этилацетата и гексана с получением (2S)1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1-бензилпирролидин-3-ил]-2-пиперидинкарбоксамида в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (1 Н,m), 7.20 (6 Н, s), 7.05 (1 Н, t), 6.60 (1 Н, d), 4.85 20% об./об. гидроксида палладия на угле(см. пример 1) в этаноле (10 мл). Реакционную смесь гидрогенизировали при 414 кПа (60 psi) в течение 56 ч, после чего катализатор отфильтровывали и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси этилацетата и диэтиламина в соотношении 95:5 по объему, меняя на 90:10, с получени 23 ем (2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3R)-пирролидин-3-ил]-2-пиперидинкарбоксамида (1 мг) в виде масла. 1 Н-ЯМР (CDCl3) : 7.35 (1 Н, d), 7.25 (1 Н,m), 7.20 (1 Н, t), 7.00 (1 Н, m), 6.65 (1 Н, bs), 4.85 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 3, из (2S)-1-(1,3-бензоксазол-2-ил)-N2[(3S)бензилпирролидин-3-ил]-2-пиперидинкарбоксамида (см. пример 2) и 20% гидроксида палладия на угле с получением (2S)-1-(1,3 бензоксазол-2-ил)-N2-[(3S)-пирролидин-3-ил]-2 пиперидинкарбоксамида в виде коричневой пены. 1 Н-ЯМР (CDCl3) : 7.30 (1 Н, d), 7.25 (1 Н,m), 7.20 (1 Н, m), 7.00 (1 Н, m), 6.60 (1 Н, d), 4.80(52,7 мг) в ацетонитриле (5 мл). Реакционную смесь нагревали до 75 С в течение 48 ч, после чего добавляли дополнительное количество гидрокарбоната натрия (28,6 мг) и данную смесь нагревали с обратным холодильником в течение дополнительных 24 ч. Растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и водой, органический слой отделяли, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле,элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, и за 003513 24 тем дополнительно очищали с помощью второй колонки, элюируя смесью этилацетата и диэтиламина в соотношении 95:5 по объему, с получением (2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)-1(2-пиридинил)пирролидин-3-ил]-2-пиперидинкарбоксамида (11 мг) в виде коричневого масла. 1 Н-ЯМР (CDCl3) : 8.15 (1 Н, d), 7.40 (1 Н,m), 7.25 (2 Н, m), 7.20 (1 Н, m), 7.05 (1 Н, m), 6.80(108,2 мг) (см. пример 4) и 2-(хлорметил) пиридина в ацетонитриле (6,8 мл, 0,055 М) при 0 С. [2-(Хлорметил)пиридин получали из гидрохлорида 2-(хлорметил)пиридина путем разделения между диэтиловым эфиром и насыщенным водным раствором гидрокарбоната натрия. Отделенную органическую фазу промывали солевым раствором, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Оставшееся свободное основание немедленно растворяли в ацетонитриле и использовали]. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, после чего растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и водой. Органический слой отделяли, сушили над сульфатом магния, и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, с получением (2S)-1(1,3-бензоксазол-2-ил)-N2-[(3S)-1-(2-пиридинилметил)пирролидин-3-ил]-2-пиперидинкарбоксамида (63,1 мг) в виде масла. 1 Н-ЯМР (CDCl3) : 8.45 (1 Н, d), 7.50 (1 Н,t), 7.40 (1 Н, d), 7.30-7.00 (5 Н, m), 6.80 (1 Н, d),4.85 (1 Н, s), 4.50 (1 Н, m), 4.25 (1 Н, d), 3.70 (2 Н,t), 3.20 (1 Н, t), 2.80 (1 Н, m), 2.65 (1 Н, m), 2.55 26 Примечание: 1. Гидрохлоридную соль получали способом,аналогичным способу по примеру 11. получали способом, аналогичным способу по примеру 6, из (2S)-1-(1,3-бензоксазол-2-ил)-N2[(3S)-пирролидин-3-ил]-2-пиперидинкарбоксамида (см. пример 4) и соответствующего галогенида.(53,6 мг) (см. пример 4) в диэтиловом эфире (5 мл). Добавили гидрохлорид бензилтриметиламмония (40% мас./мас. водный раствор) (1 мл) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 48 ч,после чего растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, и данный продукт затем дополнительно очищали на второй колонке, элюируя смесью этилацетата и диэтиламина в соотношении 95:5 по объему, с получением Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 5, из (2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)пирролидин-3-ил]-2-пиперидинкарбоксамида(см. пример 4) и 1-(2-хлорэтил)-2-метил-1 Нимидазола (см. патент США 3962274, CAN 85: 177416). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, с получением (2S)-1-(1,3-бензоксазол-2-ил)-N2-(3S)1-[2-(2-метил-1 Н-имидазол-1-ил)этил]пирролидин-3-ил-2-пиперидинкарбоксамида. Оставшуюся смолу растворяли в метаноле и обрабатыва 27 ли 1 Н раствором эфирного гидрохлорида. Полученную суспензию упаривали и сушили с получением гидрохлоридной соли продукта в виде окрашенного в красный цвет твердого вещества. 1 Н-ЯМР (DMSO-d6) : 8.55 (1 Н, m), 7.60(10 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч,после чего растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и водой. Органический слой отделяли,сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, с получением (2S)-1(1,3-бензоксазол-2-ил)-N2-[(3S)-1-(1 Н-1,2,4-триазол-3-илметил)пирролидин-3-ил]-2-пиперидинкарбоксамида (12,6 мг) в виде твердого вещества. 1 Н-ЯМР (CDCl3) : 8.00 (1 Н, s), 7.60 (1 Н,bs), 7.40 (1 Н, d), 7.25 (1 Н, m), 7.15 (1 Н, m), 7.00 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 5, из (2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S) 003513(см. пример 4) и 2-бромацетамида. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле,элюируя градиентом растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении от 93:7:1 по объему,меняя на 90:10:1, с получением (2S)-N2-[(3S)-1 аминокарбонил)метил)пирролидин-3-ил]-1(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида в виде масла. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (1 Н,m), 7.20 (1 Н, t), 7.10 (1 Н, t), 6.80 (1 Н, d), 6.60 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 5, из (2S)-1-(1,3-бензоксазол-2-ил)-N2-[(3S)пирролидин-3-ил]-2-пиперидинкарбоксамидаMed. Chem. 1998, 6, 721-734). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении от 98:1,75:0,25 по объему, меняя на 93:7:1, затем на 90:10:1, с получением (2S)-N2-(3S)-1-[3(аминокарбонил)метилфенил]пирролидин-3 ил-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида в виде беловатого твердого вещества. ЯМР (CDCl3) d: 7.80 (2 Н, m), 7.30 (4 Н, m),7.20 (1 Н, m), 7.05 (1 Н, m), 6.70 (2 Н, bm), 5.50(см. пример 4) в диэтиловом эфире (3 мл). Реакционную смесь кипятили с обратным холодильником в течение 18 ч, после чего эфирный слой разбавляли водой. Водный слой отделяли и затем экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении от 93:7:1 по объему, меняя на 90:10:1, с получением (2S)-N2[(3S)-1-(аминокарбонилэтил)пирролидин-3-ил]1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида (26,4 мг) в виде беловатой пены. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (1 Н,m), 7.20 (1 Н, m), 7.10 (1 Н, t), 6.70 (1 Н, bs), 5.10 получали способом, аналогичным способу по примеру 1, из (2S)-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 3) и соответствующего амина (см. получения 8 и 13-16), за исключением того, что в амидном сочетании также использовали каталитическое количество 4-диэтиламинопиридина (табл. 2b). Таблица 2 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-(6-бром-1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 6) и (3R)-1-бензилпирролидин-3-иламина. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана,этилацетата и триэтиламина в соотношении от 50:50:1 по объему, меняя на 40:60:1. Продукт далее очищали путем перекристаллизации из изопропилацетата, с получением (2S)-N2-[(3S)1-бензилпирролидин-3-ил]-1-(6-бром-1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида в виде масла. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, s), 7.30 (1 Н,d), 7.20 (6 Н, m), 6.60 (1 Н, d), 4.80 (1 Н, s), 4.40 получали способом, аналогичным способу по примеру 1, из (2S)-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 3) и соответствующего амина (см. получения 24-30), за исключением того, что в амидном сочетании также использовали каталитическое количество 4-диэтиламинопиридина (табл. 3b). Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1,изChem. (1997), 21(1), 78-82). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата в соотношении от 80:20 по объему, меняя на 60:40, затем на 50:50, с получением (2S)-N2-(1 дифенилметил-3-азетидинил)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоксамида в виде белой пены. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (5 Н,m), 7.20 (5 Н, m), 7.15 (2 Н, m), 7.10 (1 Н, t), 6.80 20% мас./мас. гидроксида палладия на угле(31 мг) добавили к раствору (2S)-N2-(1 бензгидрил-3-азетанил)-1-(1,3-бензоксазол-2 ил)-2-пиперидинкарбоксамида (120 мг) (см. пример 28) в этаноле (5 мл). Реакционную смесь гидрогенизировали при 414 кПа (60 psi) в течение 18 ч, после чего добавили дополнительное количество 20% мас./мас. гидроксида палладия на угле (32 мг), и данную смесь гидрогенизировали в течение дополнительных 72 ч. Затем катализатор отфильтровали и промывали этанолом, а растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси дихлорметана и метанола с 2% приращением, в соотношении от 100:0 по объему, меняя на 90:10, с получением (2S)-1-(1,3-бензоксазол 2-ил)-N2-(1-этил-3-азетанил)-2-пиперидинкарбоксамида (37,1 мг) в виде пены. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (1 Н,m), 7.20 (1 Н, t), 7.05 (1 Н, t), 4.95 (1 Н, s), 4.60 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 3) и 1 бензил-3-пиперидиниламина (см. J. Med. Chem.(1980), 23(8), 848-851). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата, с 10% приращением, в соотношении от 90:10 по объему, меняя на 40:60, с получением (2S)-1-(1,3 бензоксазол-2-ил)-N2-(1-бензил-3-пиперидинил) гексагидро-2-пиридинкарбоксамида в виде желтой смолы. 1 Н-ЯМР (CDCl3) : 7.40-7.00 (9 Н, m), 6.95(1,631 г) (см. получение 31) в дихлорметане (10 мл) при 0 С. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение 2 ч, после чего растворитель удаляли при пониженном давлении и остаток растворяли в воде. Добавляли гидрокарбонат натрия до тех пор, пока значение рН раствора не достигло 8, и данный продукт затем экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом магния и растворитель удаляли при пониженном давлении с получением (2S)-1(1,3-бензоксазол-2-ил)-N2-(4-пиперидинил)-2 пиперидинкарбоксамида (1,48 г) в виде белой пены. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30 (1 Н,m), 7.20 (1 Н, m), 7.10 (1 Н, t), 6.80 (1 Н, d), 4.85 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 6, из (2S)-1-(1,3-бензоксазол-2-ил)-N2-(4 пиперидинил)-2-пиперидинкарбоксамида (см. получение 31) и бензилбромида. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, с получением (2S)-1-(1,3 бензоксазол-2-ил)-N2-(1-бензил-4-пиперидинил)-2-пиперидинкарбоксамида в виде масла. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.30-7.20 4-(Хлорметил)пиридин (88,1 мг) добавили к раствору (2S)-1-(1,3-бензоксазол-2-ил)-N2-(4 пиперидинил)-2-пиперидинкарбоксамида (118 мг) (см. пример 31), карбоната калия (56,6 мг) и иодида натрия (6,7 мг) в ацетонитриле (10 мл) при 0 С. Реакционную смесь затем перемешивали при комнатной температуре в течение 18 ч,после чего растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении 93:7:1 по объему, с получением (2S)-1-(1,3-бензоксазол-2 ил)-N2-[1-(4-пиридинилметил)-4-пиперидинил]2-пиперидинкарбоксамида (14,8 мг) в виде окрашенной в красный цвет смолы. 1 Н-ЯМР (CDCl3) : 8.55 (2 Н, d), 7.40 (1 Н,m), 7.30 (2 Н, тm), 7.25 (2 Н, m), 7.10 (1 Н, t), 6.50 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 3) и трет-бутилового эфира(2S,4R)-4-амино-2[(бензилокси)метил]пирролидин-1-карбоновой кислоты (см. получение 34). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата в соотношении от 70:30 по объему, меняя на 50:50, с получением трет-бутилового эфира Соединение, указанное в заголовке, получали способом, подобным способу получения 8,из трет-бутилового эфира (2S,4R)-4-([(2S)-1(1,3-бензоксазол-2-ил)-2-пиперидинил]карбониламино)-2-[(бензилокси)метил]пирролидин-1 карбоновой кислоты (см. пример 34) и газа хлорида водорода, с получением гидрохлорида(2S)-1-(1,3-бензоксазол-2-ил)-N2-(3R,5S)-5[(бензилокси)метил]пирролидин-3-ил-2-пиперидинкарбоксамида в виде белого твердого вещества. 1 Н-ЯМР (DMSO-d6) : 9.60 (1 Н, bs), 8.95(см. получение 3), трифенилфосфина (192 мг) и диэтилового эфира азодикарбоновой кислоты(0,115 мл) в сухом тетрагидрофуране (6 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 16 ч,после чего растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и 0,5 М водной соляной кислотой. Водный слой затем подщелачивали 15% гидроксидом натрия и продукт экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетата и метанола в соотношении 98:2 по объему,с получением (3S)-1-(2-пиридинилметил)-3 пиперидинилового эфира (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты(140 мг) в виде желтого масла. Гидрохлоридную соль получали путем растворения соединения,указанного в заголовке, в этилацетате и барботирования газа хлорида водорода через раствор,с получением соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) (свободное основание) : 8.30-8.20 (1 Н, m), 7.60-7.30 (1 Н, m), 7.20-7.15 38 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 36, из (3R,5S)-5-(феноксиметил)-1-(4-пиридинилметил)пирролидин-3-ола (см. получение 38) и (2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 3). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси этилацетата и гексана в соотношении от 3:1 по объему, меняя на 10:1, с получением соединения, указанного в заголовке. Гидрохлоридную соль получали путем добавления насыщенного газа хлорида водорода в диэтиловом эфире к раствору продукта в этилацетате и выделяли в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) (свободное основание) : 8.54-8.50 (1 Н, d), 8.39-8.37 (1 Н, d), 7.34-7.27 (1 Н,m), 7.26-7.18 (4 Н, m), 7.18-7.09 (2 Н, m), 7.026.95 (1 Н, m), 6.95-6.87 (1 Н, m), 6.84-6.80 (1 Н, d),6.78-6.72 (1 Н, d), 5.08-5.00 (0,5 Н, m), 5.00-4.94 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 36, из (3R)-1-[(2-фтор-4-пиридинил)метил]-3 пиперидинола (см. получение 39) и (2S)-1-(1,3 бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 3). Неочищенный продукт частично очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси этилацетата и гексана в соотношении от 3:1 по объему, меняя на 1:1,данный продукт дополнительно очищали путем растирания в порошок со смесью горячего гексана и этилацетата в соотношении 95:5 по объему, с последующим растиранием в порошок со смесью горячего петролейного эфира и диэтилового эфира в соотношении 95:5, с получением(3S)-1-[(2-фтор-4-пиридинил)метил]-3-пипери 39 динилового эфира (2S)-1-(1,3-бензоксазол-2-ил)2-пиперидинкарбоновой кислоты. Гидрохлоридную соль получали путем добавления насыщенного газа хлорида водорода в диэтиловом эфире к раствору продукта в этилацетате и выделяли в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) (свободное основание) : 7.93-7.92 (1 Н, d), 7.29-6.85 (5 Н, m), 6.72 (1 Н, s),5.00-4.80 (2 Н, m), 4.20-4.10 (2 Н, dd), 4.08-3.99 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1,из(2S)-1-(1,3-бензотиазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 43) и (3S)-1-(3-пиридинилметил)пирролидин-3 амина (см. получение 41), за исключением того,что также использовали каталитическое количество 4-диметиламинопиридина, с получением(2S)-1-(1,3-бензотиазол-2-ил)-N-[(3S)-1-(3-пиридинилметил)пирролидин-3-ил]-2-пиперидинкарбоксамида в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 8.40 (1 Н, m), 7.60 (1 Н,m), 7.55-7.40 (2 Н, m), 7.22 (1 Н, m), 7.10 (2 Н, m),6.80 (1 Н, m), 4.95 (1 Н, d), 4.40 (1 Н, bs), 3.80 (1 Н,m), 3.60-3.40 (2 Н, m), 3.25 (1 Н, m), 2.70 (1 Н, m),2.60-2.30 (2 Н, m), 2.30-2.10 (3H, m), 1.80-1.40 Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-(6-хлор-1,3-бензотиазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 45) и (3S)-1-бензилпирролидин-3-иламина (см. 1,3,4,12 а-Тетрагидропиридо[1',2':3,4] имидазо[1,2-а][1,3]бензимидазол-12(2 Н)-он (73 мг) (см. получение 49) и (3S)-1-бензилпирролидин-3-иламин (62 мг) смешивали в 1,4 диоксане (0,5 мл). Реакционную смесь нагревали до 90 С и перемешивали в течение 4 ч, после чего растворитель удаляли при пониженном давлении и остаток растворяли в смеси дихлорметана и метанола и преабсорбировали на силикагель. Неочищенный продукт затем очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана, метанола и 0,88 водного раствора аммиака в соотношении от 99:1:0,1 до 97:3:0,3 по объему, с получением 1-(1H-1,3 бензимидазол-2-ил)-N2-[(3S)-1-бензил-1-пирролидин-3-ил]-2-пиперидинкарбоксамида (69 мг) в виде твердого вещества. 1 Н-ЯМР (CDCl3) : 8.90-8.70 (1 Н, d), 7.507.00 (9 Н, m), 4.80 (1 Н, d), 4.40 (1 Н, bs), 3.80 (2 Н,d), 3.60 (2 Н, d), 3.35 (1 Н, m), 2.75 (1 Н, m), 2.602.40 (2 Н, m), 2.20 (3H, m), 1.80-1.50 (5 Н, m). Анализ: обнаружено: С, 71,33, Н, 7,33; N,17,26, C24H29N5O требует С, 71,44; Н, 7,24; N,17,36%. Вращение: []D25 = +6,00 (с = 0,1, метанол). Следующие получения иллюстрируют получение некоторых исходных материалов, использованных в предшествующих примерах. Получение 1. (2S)-2-(метоксикарбонил) пиперидиния хлорид.L-тартрат (2S)-пиперидинкарбоновой кислоты (20,0 г) (см. WO-A-96/11185) добавляли по каплям к раствору тионилхлорида (54 мл) в метаноле (270 мл) при 0 С. Реакционную смесь затем перемешивали в течение 18 ч при комнатной температуре, после чего растворитель удаляли при пониженном давлении и остаток подвергали азеотропной перегонке с толуолом(3100 мл). Неочищенный продукт очищали путем перекристаллизации из метанола (15 мл) 41 с помощью добавления диэтилового эфира до появления мутности, с получением (2S)-2(метоксикарбонил)пиперидиния хлорида (11,06 мг) в виде белых кристаллов. 1 Н-ЯМР (D2O) : 3.95 (1 Н, d), 3.70 (3H, m),3.40 (1 Н, d), 3.00 (1 Н, t), 2.20 (1 Н, d), 1.80 (2 Н,m), 1.70-1.40 (3H, m). Вращение: []D25 = -8,40 (с = 0,1, метанол). МС: 144 (МН+). Получение 2. Метиловый эфир (2S)-1-(1,3 бензоксазол-2-ил)пиперидинкарбоновой кислоты. Этилдиизопропиламин (6,52 мл) добавили к раствору (2S)-2-(метоксикарбонил)пиперидиния хлорида (3,057 мг) (см. получение 1) и 2 хлорбензоксазола (2,13 мл) в ацетонитриле (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем при 50 С в течение дополнительных 2 ч. Растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и водой,органический слой отделяли, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана, этилацетата и метанола в соотношении от 80:10:1 по объему, меняя на 0:100:0, затем на 0:95:5, с получением метилового эфира (2S)-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (3,18 г) в виде твердого вещества. 1 Н-ЯМР (CDCl3) : 7.35 (1 Н, d), 7.25 (1 Н,d), 7.15 (1 Н, m), 7.00 (1 Н, m), 5.00 (1 Н, d), 4.20 Водный гидроксид лития (1 Н, 51 мл) добавили к раствору метилового эфира (2S)-1-(1,3 бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (8,987 г) (см. получение 2) в метаноле(306 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, после чего растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и водой. Водный слой отделяли и 42 подкисляли 2 Н водной соляной кислотой до рН 2, продукт экстрагировали этилацетатом, сушили над сульфатом магния и растворитель удаляли при пониженном давлении с получением(2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (8,17 г) в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, d), 7.25 (1 Н,m), 7.15 (1 Н, t), 7.00 (1 Н, t), 5.80 (1 Н, bs), 4.95(10 мл). Реакционную смесь нагревали с обратным холодильником и перемешивали в течение 18 ч, после чего белое твердое вещество отфильтровывали и растворитель удаляли при пониженном давлении. Остаток разделяли между диэтиловым эфиром и водой, отделенный органический слой затем промывали тиосульфатом натрия, сушили над сульфатом магния и растворитель удаляли при пониженном давлении с получением 1-(подметил)циклопропана(2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (3,0 г) (см. получение 2) в дихлорметане (60 мл) при -10 С в течение периода 10 мин. Реакционную смесь затем нагревали до комнатной температуры и разбавляли дихлорметаном. Органический слой промывали насыщенным гидрокарбонатом натрия, затем 1 Н раствором гидроксида натрия, сушили над сульфатом натрия и растворитель удаляли при пониженном давлении с получением метилового эфира (2S)-1-(6-бром-1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (3,7 г) в виде пурпурно окрашенного масла. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, s), 7.25 (1 Н,d), 7.20 (1 Н, d), 5.00 (1 Н, d), 4.20 (1 Н, d), 3.80 Соединение, указанное в заголовке, получали способом, подобным способу получения 3,из метилового эфира (2S)-1-(6-бром-1,3 бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 5) и 1 Н водного раствора гидроксида лития, с получением (2S)-1-(6-бром 1,3-бензоксазол-2-ил)-2-пиперидинкарбоновой кислоты в виде розовой пены. 1 Н-ЯМР (CDCl3) : 7.40 (1 Н, s), 7.25-7.20 Газ хлорид водород барботировали через раствор трет-бутилового эфира N-(3S)-1-[(2 хлор-3-хинолинил)метил]пирролидин-3-илкарбаминовой кислоты (1,6 г) (см. получение 7) в хлороформе (20 мл) до точки насыщения. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, после чего растворитель удаляли при пониженном давлении с получением(3S)-1-[(2-хлор-3-хинолинил) метил]пирролидин-3-амина гидрохлорида (1,5 г) в виде белого твердого вещества. МС: 262 (МН+). получали способом, аналогичным способу получения 7, из трет-бутилового эфира N-[(3S)пирролидин-3-ил]карбаминовой кислоты (см. J.Het. Chem. (1990), 27, 1527-1536) и соответствующего альдегида или кетона. Таблица 2 аJ. Chem. Soc. (1985), 24,1286-1287) в дихлорметане (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, после чего добавили воду (20 мл) и смесь перемешивали в течение еще 1 ч. Органический слой отделяли, промывали насыщенным водным раствором гидрокарбоната натрия, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси этилацетата и хлороформа в соотношении 1:1 по объему, с получением третбутилового эфира N-(3S)-1-[(2-хлор-3-хинолинил)метил]-1-пирролидин-3-илкарбаминовой кислоты (1,6 г) в виде масла. 1 Н-ЯМР (CDCl3) : 8.20 (1 Н, s), 7.98 (1 Н,d), 7.80 (1 Н, d), 7.68 (1 Н, m), 7.55 (1 Н, m), 5.85 Получения 13-16. Соединения следующих получений, приведенных в табл. 2b, получали способом, аналогичным способу получения 8, из соответствующего трет-бутилового эфира карбаминовой кислоты (см. таблицу 2 а). получали способом, аналогичным способу по примеру 1, из трет-бутилового эфира N-[(3S)пирролидин-3-ил]карбаминовой кислоты (см. J. Получения 24-30. Соединения следующих получений, приведенных в табл. 3b, получали способом, аналогичным способу получения 8, из соответствующего трет-бутилового эфира карбаминовой кислоты (см. табл. 3 а). Таблица 3b Исходный Получение материал Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1,из(2S)-1-(1,3-бензоксазол-2-ил)-2 пиперидинкарбоновой кислоты (см. получение 3) и трет-бутилового эфира 4-амино-1(2 Н)пиперидинкарбоновой кислоты (см. Takatani,Muneo et al., WO 9740051). Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана, этилацетата и метанола в соотношении от 2:1:0 по объему, меняя на 0:95:5, с получением трет-бутилового эфира 4-([(2S)-1-(1,3-бензоксазол-2-ил)-2-пиперидинил]карбониламино)пиперидинкарбоновой кислоты в виде белой пены. 1 Метиловый эфир 4-метил-1-бензолсульфоновой кислоты (0,8 г), трифенилфосфин (1,12 г) и диэтиловый эфир азодикарбоновой кислоты 48 в атмосфере азота. Реакционную смесь затем перемешивали при комнатной температуре в течение 48 ч, после чего растворитель удаляли при пониженном давлении, и остаток разделяли между этилацетатом и водой. Органический слой отделяли, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле,элюируя системой растворителей из смеси гексана и этилацетата в соотношении 85:15 по объему, с получением соединения, указанного в заголовке, в виде бесцветной смолы. 1 Н-ЯМР (CDCl3) : 7.80 (2 Н, d), 7.30 (7 Н,m), 5.05 (1 Н, m), 4.50 (2 Н, m), 4.00 (1 Н, m), 3.70 Азид натрия (0,32 г) добавили к раствору трет-бутилового эфира (2S,4S)-2-[(бензилокси) метил]-4-[(4-метилфенил)сульфонил]оксипирролидин-1-карбоновой кислоты (1,15 г) (см. получение 32) в этаноле (20 мл) и диметилформамиде (5 мл). Реакционную смесь нагревали до 80 С в течение 4 ч, после чего охлажденную смесь разделяли между диэтиловым эфиром и водой. Органический слой отделяли, а водный экстрагировали дважды диэтиловым эфиром,объединенные органические слои сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной перегонке с дихлорметаном с получением трет-бутилового эфира (2S,4R)-4 азидо-2-[(бензилокси)метил]пирролидин-1 карбоновой кислоты (820 мг) в виде масла. 1 Н-ЯМР (CDCl3) : 7.30 (5 Н, m), 4.50 (2 Н,s), 4.20-4.00 (2 Н, m), 3.70-3.40 (4 Н, m), 2.25 (1 Н,m), 2.15 (1 Н, m), 1.45 (9 Н, m). МС: 333 (МН+). Получение 34. трет-Бутиловый эфир 49 тетрагидрофуране (10 мл). Реакционную смесь затем перемешивали до тех пор, пока не прекратилось выделение газа азота, добавляли воду(0,036 мл) и данную смесь затем перемешивали в течение дополнительных 72 ч. Растворитель затем удаляли при пониженном давлении, остаток растворяли в диэтиловом эфире и добавляли гексан до тех пор, пока смесь не становилась мутной. Жидкость над слоем осадка отделяли и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле,элюируя системой растворителей из смеси дихлорметана и метанола в соотношении 90:10 по объему, с получением трет-бутилового эфира Гидрохлорид (3R)-3-пиперидинола (10,0 г) и триэтиламин (10,13 мл) в сухом 1,2 дихлорэтане (350 мл) перемешивали в течение 15 мин при 50 С. Добавили 2-пиридинкарбоксальдегид (7,63 мл) и ледяную уксусную кислоту (4,16 мл) и реакционную смесь затем перемешивали в течение 1,5 ч с обратным холодильником. Триацетоксиборгидрид натрия(34,65 г) затем добавили частями и полученную смесь охладили до комнатной температуры и перемешивали в течение еще 1 ч. Затем добавляли воду (350 мл) и 1 М водный раствор гидроксида натрия, до тех пор, пока значение рН смеси не достигло 12. Органический слой отделяли,а водный слой экстрагировали хлороформом,объединенные органические слои сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси хлороформа и метанола в соотношении 95:5 по объему, с получением (3R)-1(2-пиридинилметил)-3-пиперидинола (8,10 г) в виде коричневого масла. 1 Н-ЯМР (СDСl3) : 8.55-8.50 (1 Н, m), 7.657.60 (1 Н, m), 7.30-7.25 (1 Н, m), 7.15-7.10 (1 Н,m), 3.85-3.75 (1 Н, m), 3.60 (2 Н, s), 2.80-2.70 (1 Н,bs), 2.60-2.50 (1 Н, m), 2.50-2.40 (2 Н, bs), 2.402.25 (1 Н, m), 1.80-1.70 (1 Н, m), 1.70-1.60 (1 Н,m), 1.60-1.40 (2 Н, m).(1997), 3(12), 1997-2010) добавили к раствору фенола (1,12 г), трифенилфосфина (2,51 г) и диэтилового эфира азодикарбоновой кислоты(1,51 мл) в сухом тетрагидрофуране (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч, после чего растворитель удаляли при пониженном давлении и остаток растворяли в хлороформе. Органический раствор промывали 15% водным раствором гидроксида натрия, затем солевым раствором, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси гексана и этилацетата в соотношении 1:1 по объему, с получением бензилового эфира (2S,4R)-4 гидрокси-2-(феноксиметил)пирролидин-1-карбоновой кислоты (0,69 г) в виде чистого масла. 1 Н-ЯМР (CDCl3) : 7.40-7.20 (7 Н, m), 7.06.90 (1 Н, m), 6.85-6.75 (2 Н, d), 5.20-5.00 (3H, m),4.80 (1 Н, s), 4.30-3.75 (2 Н, m), 3.75-3.60 (3H, m),2.30-2.15 (1 Н, m), 2.10-2.00 (1 Н, m). 10% мас./мас. палладий на угле (0,05 г) добавили к раствору бензилового эфира (2S,4R)-4 гидрокси-2-(феноксиметил)пирролидин-1-карбоновой кислоты (0,25 г) (см. получение 36) и 5 М водного формиата аммония (1,45 мл) в метаноле (20 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 суток,после чего реакционную смесь фильтровали через целит и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси хлороформа, метанола и 0,88 водного раствора аммиака в соотношении 90:10:0,5 по объему, с получением (3R,5S)-5-(феноксиметил)пирролидин-3-ола (0,25 г) в виде коричневого масла. 1 Н-ЯМР (CDCl3) : 7.24-7.20 (2 Н, t), 6.916.85 (1 Н, t), 6.80-6.75 (2 Н, d), 4.78-4.71 (1 Н, m),3.80-3.68 (2 Н, bs), 3.64-3.59 (1 Н, dd), 3.56-3.49 Соединение, указанное в заголовке, получали способом, аналогичным способу получения 35, из (3R,5S)-5-(феноксиметил)пирролидин-3-ола (см. получение 37) и 4-пиридинкарбоксальдегида. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси хлороформа и метанола в соотношении 95:5 по объему, с получением (3R,5S)-5(феноксиметил)-1-(4-пиридинилметил)пирролидин-3-ола в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 8.45-8.40 (2 Н, m), 7.257.10 (4 Н, m), 6.90-6.80 (1 Н, m), 6.80-6.70 (2 Н,m), 4.73-4.66 (1 Н, m), 4.08-4.02 (1 Н, d), 3.73-3.66(0,188 г) добавляли к раствору 4-(бромметил)-2 фторпиридина (0,26 г) (см. Porter et al., WO 9622978) и карбоната калия (0,189 г) в ацетонитриле (15 мл). Реакционную смесь кипятили с обратным холодильником в течение 5 суток,после чего растворитель удаляли при пониженном давлении и остаток разделяли между дихлорметаном и водой. Органический слой отделяли, а рН водного слоя доводили до 12 и продукт экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси хлороформа и метанола в соотношении 95:5 по объему, с получением (3R)-1-[(2-фтор-4 пиридинил)метил]-3-пиперидинола (0,255 г) в виде бледно-желтого масла. Соединение, указанное в заголовке, получали способом, аналогичным способу получения 7, из трет-бутилового эфира N-[(3S)-1 пирролидин-3-ил]карбаминовой кислоты (см. J.Het. Chem., 1990, 27, 1286-1287) и 3 пиридинкарбоксальдегида, с получением третбутилового эфира N-[(3S)-1-(3-пиридинилметил)пирролидин-3-ил]карбаминовой кислоты,который сразу же использовали для получения 41. Получение 41. (3S)-1-(3-пиридинилметил) пирролидин-3-амин. Соединение, указанное в заголовке, получали способом, подобным способу получения 8,из трет-бутилового эфира N-[(3S)-1-(3-пиридинилметил)-1-пирролидин-3-ил]карбаминовой кислоты (см. получение 40) и хлороводорода, с получением (3S)-1-(3-пиридинилметил)пирролидин-3-амина в виде белого твердого вещества. МС: 178 (МН+). Получение 42. Этиловый эфир (2S)-1-(1,3 бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты.(J.A.C.S. (1993), 115(22), 9925-9938), триэтиламина гидрохлорида (414 мг) и порошка меди (38 мг) в ксилоле (5 мл). Реакционную смесь кипятили с обратным холодильником в течение 28 ч,после чего к охлажденной смеси добавили этилацетат (20 мл) и твердые частицы отфильтровали. Органический слой промывали водой, сушили над сульфатом магния и растворитель удаляли при пониженном давлении, с получением этилового эфира (2S)-1-(1,3-бензотиазол-2 53 ил)-2-пиперидинкарбоновой кислоты (705 мг) в виде коричневого твердого вещества. 1 Н-ЯМР (CDCl3) : 7.58 (1 Н, d), 7.50 (1 Н,d), 7.20 (1 Н, t), 7.00 (1 Н, t), 5.10 (1 Н, d), 4.18 (2 Н,q), 3.80 (1 Н, m), 3.42 (1 Н, m), 2.25 (1 Н, d), 1.951.80 (3H, m), 1.60 (1 Н, m), 1.40 (1 Н, m), 1.20 (3H,t). МС: 291 (МН+). Получение 43. (2S)-1-(1,3-бензотиазол-2 ил)-2-пиперидинкарбоновая кислота. Соединение, указанное в заголовке, получали способом, аналогичным способу получения 3, из этилового эфира (2S)-1-(1,3 бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 42) и 1 Н водного раствора гидроксида лития. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей из смеси дихлорметана и метанола в соотношении 10:1 по объему, с получением (2S)-1-(1,3 бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты в виде твердого вещества. 1 Н-ЯМР (CDCl3) : 7.42 (2 Н, m), 7.10 (1 Н,m), 6.95 (1 Н, m), 4.80 (1 Н, m), 3.50 (2 Н, m), 2.10 Соединение, указанное в заголовке, получали способом, аналогичным способу получения 42, из 2,6-дихлор-1,3-бензотиазола (см. J.(471 мг) (см. J.A.C.S. (1993), 115(22), 99259938), с получением этилового эфира (2S)-1-(6 хлор-1,3-бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты в виде твердого вещества. 1 Н-ЯМР (CDCl3) : 7.55 (1 Н, s), 7.40 (1 Н,d), 7.15 (1 Н, d), 5.05 (1 Н, d), 4.15 (2 Н, q), 3.65 Соединение, указанное в заголовке, получали способом, аналогичным способу получения 3, из этилового эфира (2S)-1-(6-хлор-1,3 бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты (см. получение 44) и 1 Н водного раствора гидроксида лития, с получением (2S)-1-(6-хлор 1,3-бензотиазол-2-ил)-2-пиперидинкарбоновой кислоты в виде твердого вещества. 1 Н-ЯМР (DMSO-d6) : 7.80 (1 Н, s), 7.70 2-Хлор-1 Н-1,3-бензимидазол (1,07 г) добавили к раствору ди-трет-бутилдикарбоната (1,83 г) и 4-диметиламинопиридина (86 мг) в ацетонитриле (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, после чего растворитель удаляли при пониженном давлении. Неочищенный продукт затем очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата в соотношении от 100:0 по объему, меняя на 90:10, с получением трет-бутилового эфира 2 хлор-1 Н-1,3-бензимидазол-1-карбоновой кислоты (1,68 г) в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 7.90 (1 Н, m), 7.35 (1 Н,m), 7.40 (2 Н, m), 1.80 (9 Н, s). МС: 253 (МH+). Получение 47. трет-Бутиловый эфир 2[(2S)-2-[(бензилокси)карбонил]-1-пиперидинил]-1 Н-1,3-бензимидазол-1-карбоновой кислоты. Соединение, указанное в заголовке, получали способом, аналогичным способу получения 2, из трет-бутилового эфира 2-хлор-1 Н-1,3 бензимидазол-1-карбоновой кислоты (см. получение 46) и бензилового эфира (2S)-2 пиперидинкарбоновой кислоты (см. J.A.C.S.(1996), 118(7), 1629-1644). Неочищенный про 55 дукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата, с 5% приращением, в соотношении от 90:10 по объему, меняя на 80:20, с получением третбутилового эфира 2-[(2S)-2-[(бензилокси)карбонил]-1-пиперидинил]-1 Н-1,3-бензимидазол-1 карбоновой кислоты в виде масла. 1 Н-ЯМР (CDCl3) : 7.65 (1 Н, d), 7.45 (1 Н,d), 7.40 (2 Н, s), 7.25 (5 Н, m), 5.20 (2 Н, s), 4.70 10% мас./мас. палладий на угле (300 мг) добавили к раствору трет-бутилового эфира 2[(2S)-2-[(бензилокси)карбонил]-1-пиперидинил]-1 Н-1,3-бензимидазол-1-карбоновой кислоты (900 мг) (см. получение 47) в этаноле (30 мл). Реакционную смесь гидрогенизировали при 103,5 кПа (15 psi) при комнатной температуре в течение 18 ч. Катализатор затем отфильтровывали и растворитель удаляли при пониженном давлении с получением Соединение, указанное в заголовке, получали способом, аналогичным способу по примеру 1, из (2S)-1-[1-(трет-бутоксикарбонил)-1 Н 1,3-бензимидазол-2-ил]-2-пиперидинкарбоновой кислоты (см. получение 48) и (3S)-1 бензилпирролидин-3-иламина. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом растворителей из смеси гексана и этилацетата в соотношении от 70:30 по объему, меняя на 50:50, а затем смесью дихлорметана, метанола и 0,88 аммиака в соотношении 90:10:1, с получением 1,3,4,12 а-тетрагидропиридо[1',2':3,4]ими 003513 56 дазо[1,2-а][1,3]бензимидазол-12(2 Н)-она в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 7.60 (1 Н, d), 7.40 (1 Н,d), 7.30 (1 Н, m), 7.10 (1 Н, t), 4.20 (2 Н, m), 3.20(I) соединение формулы (I) или его фармацевтически приемлемые соль или сольват,(II) способ получения соединения формулы (I) или его фармацевтически приемлемых соли или сольвата,(III) фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем,(IV) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в качестве лекарства,(V) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для лечения дегенерации нейронов,(VI) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для стимуляции регенерации и роста нейронов,(VII) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание,(VIII) применение как в (VII), где неврологическое заболевание или расстройство выбирают из группы, состоящей из старческой деменции (болезнь Альцгеймера) и других деменции, бокового амиотрофического склероза и других форм заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона,неврологических расстройств, связанных с ударом, всех форм дегенеративного заболевания,поражающего центральную или периферическую нервную систему (например атрофии мозжечка и ствола мозга, синдромов прогрессирующих атаксий), всех форм мышечной дистрофии, прогрессирующих мышечных атрофии,прогрессирующей бульбарной мышечной атрофии, физического или травматического повреждения центральной или периферической нервной системы (например спинного мозга), синдромов грыжи, разрыва или выпадения межпозвонковых дисков, шейного спондилеза, расстройств сплетений, сдавлений плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, всех форм периферической невропатии (как 57 диабетической, так и недиабетической), невралгии тройничного нерва, глоссофарингеальной невралгии, паралича Белла, всех форм заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы (например рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома Гийена-Барре-Штроля),расстройств центральной нервной системы, связанных со СПИДом, тиков вследствие применения дапсона, бульбарных и ретробульбарных поражений зрительного нерва (например ретинопатии и ретробульбарного неврита), нарушений слуха, таких как шум в ушах, и прионных заболеваний,(IX) применение, как в (VIII), где неврологическое заболевание или расстройство представляет собой старческую деменцию (болезнь Альцгеймера) или другую деменцию, боковой амиотрофический склероз или другую форму заболевания двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, неврологическое расстройство, связанное с ударом, физическое или травматическое повреждение центральной или периферической нервной системы(например спинного мозга), периферическую невропатию (либо диабетическую, либо недиабетическую), рассеянный склероз или нарушение слуха, такое как шум в ушах,(X) способ лечения человека, предназначенный для лечения дегенерации нейронов, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью,сольватом или композицией,(XI) способ лечения человека, предназначенный для стимуляции регенерации и роста нейронов, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью, сольватом или композицией,(XII) способ лечения человека, предназначенный для лечения неврологического заболевания или расстройства, такого как нейродегенеративное заболевание, при котором указанного человека лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемыми солью, сольватом или композицией,(XIII) способ, как в (XII), где неврологическое заболевание или расстройство выбирают из группы, состоящей из старческой деменции (болезнь Альцгеймера) и других деменции, бокового амиотрофического склероза и других форм заболевания двигательных нейронов, болезни Паркинсона, болезни Хантингтона, неврологических расстройств, связанных с ударом, всех форм дегенеративного заболевания, поражающего центральную или периферическую нервную систему (например, атрофии мозжечка и ствола мозга, синдромов прогрессирующих атаксий), всех форм мышечной дистрофии, про 003513 58 грессирующих мышечных атрофии, прогрессирующей бульбарной мышечной атрофии, физического или травматического повреждения центральной или периферической нервной системы(например, спинного мозга), синдромов грыжи,разрыва или выпадения межпозвонковых дисков, шейного спондилеза, расстройств сплетений, сдавлений плечевого сплетения и подключичной артерии прикрепляемыми мышцами в области первого ребра и ключицы, всех форм периферической невропатии (как диабетической, так и недиабетической), невралгии тройничного нерва, глоссофарингеальной невралгии,паралича Белла, всех форм заболевания, относящегося к аутоиммунному, приводящего к повреждению центральной или периферической нервной системы (например рассеянного склероза, тяжелой псевдопаралитической миастении, синдрома Гийена-Барре-Штроля), расстройств центральной нервной системы, связанных со СПИДом, тиков вследствие применения дапсона, бульбарных и ретробульбарных поражений зрительного нерва (например, ретинопатии и ретробульбарного неврита), нарушений слуха, таких как шум в ушах, и прионных заболеваний,(XV) любые новые промежуточные соединения, описанные здесь,(XVI) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарства для лечения заболевания, являющегося результатом недостатка или сверх продукцииFKBP-12 или FKBP-52. Соединения по изобретению проявляют ингибирующую активность против фермента ротамазы FKBP-12. Было обнаружено, что особенно некоторые из наилучших соединений, то есть соединения примеров 2, 6, 7, 8, 13 а, 15, 16,17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 30, 35 и 41 имеют ИК 50 для ингибирования ферментаFKBP-12 ниже 1200 нМ. Было обнаружено, что соединение примера 2 имеет ИK50 для ингибирования фермента FKBP-52 2790 нМ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль,где А представляет собой неразветвленный С 3-С 5 алкилен, возможно замещенный С 1 С 6 алкилом,X представляет собой О, S, NH или N(С 1 С 6 алкил), 59Y представляет собой О, S, NH или N(С 1 С 6 алкил),R представляет собой С-связанную 4-6 членную кольцевую неароматическую гетероциклическую группу, содержащую один гетероатом азота, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 6 алкила,С 2-С 6 алкенила, С 3-С 7 циклоалкила, арила, гет,-СO2(С 1-С 6 алкила), -СО(гет), -CONR5R6 и-СО(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями,каждый из которых независимо выбран из С 3 С 7 циклоалкила, арила, гет, -О(арила), -O(С 1 С 2 алкилен)арила,-СО(гет),-CONR5R6 и-СО(арила),R1, R2, R3 и R4, каждый независимо, выбран из Н, галогено, С 1-С 6 алкила, С 3 С 7 циклоалкила, галогено(С 1-С 6)алкила, С 1 С 6 алкокси, -CONR5R6, C3-С 7 циклоалкокси, С 3 С 7 циклоалкил-(С 2-С 4)алкилена, С 3-С 7 циклоалкил(С 2-С 4)алкокси и -СO2(С 1-С 6 алкила),R5 и R6 либо, каждый независимо, выбран из Н и С 1-С 6 алкила, либо, взятые вместе, представляют собой неразветвленный С 3-С 5 алкилен,арил означает фенил, возможно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 6 алкила, С 1 С 6 алкокси, галогено, -CONR5R6, галогено(С 1 С 6 алкила) и -NR5R6 и гет означает 5- или 6-членную моноциклическую или 8-, 9- или 10-членную бициклическую кольцевую гетероциклическую группу,содержащую от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, О и S, причем указанная группа возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 6 алкила, С 1-С 6 алкокси, галогено,галогено(С 1-С 6 алкила), фенила и -NR5R6. 2. Соединение по п.1, имеющее стереохимическую формулу (IA) где R, R1, R2, R3, R4, А, X и Y являются такими,как определено для соединения формулы (I) в п.1. 3. Соединение по п.1 или 2, где А представляет собой 1,4-бутилен. 4. Соединение по любому из пп.1-3, где X представляет собой О, S или NH. 5. Соединение по п.4, где X представляет собой О или NH. 6. Соединение по любому из пп.1-5, где Y представляет собой О или NH. 60 7. Соединение по п.6, где Y представляет собой NH. 8. Соединение по любому из пп.1-7, где R представляет собой азетидинильную, пирролидинильную или пиперидинильную группу, каждая из которых возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 6 алкила, С 2-С 6 алкенила, С 3 С 7 циклоалкила, арила, гет, -СO2(С 1-С 6 алкила),-СО(гет), -CONR5R6 и -СО(арила), причем указанный алкил и алкенил возможно замещены 1 или 2 заместителями, каждый из которых независимо выбран из С 3-С 7 циклоалкила, арила, гет,-О(арила), -О(С 1-С 2 алкилен)арила, -СО(гет),-CONR5R6 и -СО(арила). 9. Соединение по любому из пп.1-8, где R представляет собой азетидинильную, пирролидинильную или пиперидинильную группу, каждая из которых возможно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 6 алкила, гет, -СO2(С 1-С 6 алкила) и-СО(гет), причем указанный алкил возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из С 3-С 7 циклоалкила,арила, гет, -О(арила), -О(С 1-С 2 алкилен)арила и-CONR5R6. 10. Соединение по любому из пп.1-9, где R представляет собой азетидинил, пирролидинил или пиперидинил, каждый возможно замещен 1,2 или 3 заместителями, каждый из которых независимо выбран из этила, 2-пиридила, третбутоксикарбонила, хинолин-2-илкарбонила, 2 фенилхинолин-4-илкарбонила, 4-метоксихинолин-2-илкарбонила, 6-метокси-2-фенилхинолин 4-илкарбонила, 2-пиперидинохинолин-4-илкарбонила, 2-хлорхинолин-4-илкарбонила, 1 Нбензпиразол-6-илкарбонила, циклопропилметила, фенилметила, дифенилметила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2(2-пиридил)этила,2-(2-метилимидазол-1-ил) этила, (1 Н-1,2,4-триазол-3-ил)метила, (2-хлорхинолин-3-ил)метила, хинолин-4-илметила, хинолин-2-илметила, хинолин-3-илметила, 1(хинолин-4-ил)этила,(2-фторпиридин-4-ил) метила, феноксиметила, бензилоксиметила,аминокарбонилметила, 2-(аминокарбонил)этила и 3-(аминокарбонил)фенилметила. 11. Соединение по любому из пп.1-10, гдеR представляет собой возможно замещенную 3 азетидинильную,3-пирролидинильную,3 пиперидинильную или 4-пиперидинильную группу. 12. Соединение по любому из пп.1-11, где арильная группа представляет собой фенильную группу, возможно замещенную CONR5R6. 13. Соединение по любому из пп.1-12, где гет группа представляет собой пиридильную,имидазолильную, триазолильную, хинолинильную или бензпиразолильную группу, каждая возможно замещена 1, 2 или 3 заместителями,каждый из которых независимо выбран из ме
МПК / Метки
МПК: A61P 25/28, C07D 471/04, A61K 31/44, C07D 413/14
Метки: соединения, ротамаз, гетероциклические, ферментов, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-3513-geterociklicheskie-soedineniya-kak-ingibitory-fermentov-rotamaz.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические соединения как ингибиторы ферментов ротамаз</a>
Предыдущий патент: Желудочная и/или дуоденальная клейкая лекарственная форма
Следующий патент: Замещенные индолиноны, их получение и их применение в качестве лекарственных средств
Случайный патент: Иммуногенная композиция












