Производные индол-1-илуксусной кислоты и их терапевтическое применение
Номер патента: 17573
Опубликовано: 30.01.2013
Авторы: Ариэнцо Роза, Хайнд Джордж, Эвайтебайл-Ву Барбара, Финч Гарри, Домостой Матиас, Монтана Джон Гарри
Формула / Реферат
1. Соединение, представляющее собой производное индола формулы (I) или его фармацевтически приемлемую соль
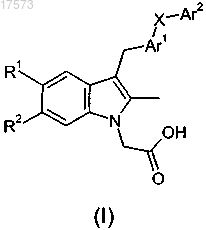
где X представляет собой -SO2- или *-SO2NR3-, где связь, отмеченная звездочкой, присоединена к Ar1;
R1 представляет собой фтор или хлор;
R2 представляет собой водород;
R3 представляет собой водород или С1-С6алкил;
Ar1 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, тиазолила, имидазолила, изотиазолила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена одним заместителем, выбранным из фтора, хлора, CN или метила;
Ar2 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена 1-2 заместителями, независимо выбранными из фтора или хлора.
2. Соединение по п.1, где X представляет собой *-SO2NR3-, где связь, отмеченная звездочкой, присоединена к Ar1.
3. Соединение по любому из пп.1, 2, где радикал Ar2SO2- или Ar2N(R3)SO2- находится в мета- или пара-положении кольца Ar1 относительно места присоединения Ar1 к остатку молекулы.
4. Соединение по любому из пп.1, 2, где радикал Ar2SO2- или Ar2N(R3)SO2- находится в орто-положении кольца Ar1 относительно места присоединения Ar1 к остатку молекулы.
5. Соединение по п.1, выбранное из группы, включающей в себя
{5-фтор-2-метил-3-[3-(тиофен-2-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту,
{5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту,
{5-фтор-3-[3-(пиридин-3-сульфонил)тиофен-2-илметил]-2-метилиндол-1-ил}уксусную кислоту,
{5-фтор-2-метил-3-[3-(пиридин-4-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту,
{5-хлор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту,
{5-фтор-2-метил-3-[5-(пиридин-2-сульфонил)тиазол-4-илметил]индол-1-ил}уксусную кислоту,
{5-фтор-2-метил-3-[5-метил-3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту,
{5-фтор-2-метил-3-[4-(пиридин-2-сульфонил)тиазол-5-илметил]индол-1-ил}уксусную кислоту,
{3-[5-хлор-3-(пиридин-2-сульфонил)тиофен-2-илметил]-5-фтор-2-метилиндол-1-ил}уксусную кислоту,
или его фармацевтически приемлемая соль.
6. Соединение, представляющее собой {5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-ил}уксусную кислоту или его фармацевтически приемлемую соль.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 и фармацевтически приемлемый носитель.
8. Применение соединения по любому из пп.1-6 для изготовления композиции для лечения астмы, хронической обструктивной болезни легких, ринита, аллергического синдрома дыхательных путей или аллергического ринобронхита.
9. Применение соединения по любому из пп.1-6 для изготовления композиции для лечения псориаза, атопического и неатопического дерматита, болезни Крона, язвенного колита или воспалительного заболевания кишечника.
10. Способ лечения астмы, хронической обструктивной болезни легких, ринита, аллергического синдрома дыхательных путей или аллергического ринобронхита, включающий введение пациенту, страдающему от такого заболевания, эффективного количества соединения по любому из пп.1-6.
11. Способ лечения псориаза, атопического и неатопического дерматита, болезни Крона, язвенного колита или воспалительного заболевания кишечника, включающий введение пациенту, страдающему от такого заболевания, эффективного количества соединения по любому из пп.1-6.
Текст
Соединения формулы (I) представляют собой лиганды рецептора CRTH2, полезные среди прочего для лечения воспалительных состояний. В формуле (I) X представляет собой -SO2- или -SO2NR3-,где связь, отмеченная звездочкой, присоединена к Ar1; R1 представляет собой фтор или хлор; R2 представляет собой водород; R3 представляет собой водород или С 1-С 6 алкил; Ar1 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, тиазолила, имидазолила,изотиазолила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена одним заместителем, выбранным из фтора, хлора, CN или метила; Ar2 представляет собой 5- или 6 членную гетероарильную группу, выбранную из тиенила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена 1-2 заместителями, независимо выбранными из фтора или хлора. 017573 Данное изобретение относится к классу соединений индолов, представляющих собой лиганды рецептора CRTH2 (молекулы-гомолога хемоаттрактантного рецептора, экспрессируемой на Т-хелперных клетках 2 типа), и их применению в лечении заболеваний, чувствительных к модулированию CRTH2 рецепторной активности, главным образом заболеваний с выраженным воспалительным компонентом. Данное изобретение также относится к новым членам этого класса лигандов и фармацевтическим композициям, содержащим их. Предшествующий изобретению уровень техники Известно, что тучные клетки играют важную роль в аллергических и иммунных ответах посредством высвобождения ряда медиаторов, таких как гистамин, лейкотриены, цитокины, простагландин D2 и т.д. (Воусе, Allergy Asthma Proa, 2004, 25, 27-30). Простагландин D2 (PGD2) является основным метаболитом, продуцируемым тучными клетками в ответ на стимуляцию аллергеном в результате действия циклооксигеназы на арахидоновую кислоту (Lewis et al., J. Immunol., 1982, 129, 1627-1631). Отмечено увеличение продукции PGD2 у пациентов с системным мастоцитозом (Roberts, N., Engl. J. Med., 1980,303, 1400-1404), аллергическим ринитом (Naclerio et al., Am. Rev. Respir. Dis., 1983, 128, 597-602; Brown(Heavey et al., J. Allergy Clin. Immunol., 1986, 78, 458-461). PGD2 опосредует эти эффекты посредством двух рецепторов, рецептора PGD2 (или DP (D-простаноидного рецептора (Boie et al., J. Biol. Chem.,1995, 270, 18910-18916) и молекулы-гомолога хемоаттрактантного рецептора, экспрессируемой на Th2Acids, 2003, 69, 179-185). Поэтому постулируется, что агенты, которые антагонизируют эффекты PGD2 путем воздействия на его рецепторы, могут оказывать полезное влияние в ряде болезненных состояний. Показано, что рецептор CRTH2 экспрессируется на клетках типов, ассоциируемых с аллергическим воспалением, таких как базофилы, эозинофилы и иммунные хелперные клетки Th2-типа (Hirai et al., J.Exp. Med., 2001, 193, 255-261). Показано, что рецептор CRTH2 опосредует PGO2-опосредованную клеточную миграцию в клетках этих типов (Hirai et al., J. Exp. Med., 2001, 193, 255-261) и также играет главную роль в клеточном рекрутменте нейтрофилов и эозинофилов в модели контактного дерматита (Takeshita et al., Int. Immunol., 2004, 16, 947-959). Показано, что раматробан 3R)-3-[(4-фторфенил)сульфонил-амино]-1,2,3,4-тетрагидро-9 Н-карбазол-9-пропановая кислота), двойной антагонист рецептора CRTH2 и тромбоксанового А 2 рецептора (ТР, Т-простаноидного рецептора), ослабляет эти ответы(Sugimoto et al., J. Pharmacol. Exp. Ther., 2003, 305, 347-352; Takeshita et al., в цитируемой работе). Способность PGD2 как усиливать аллергическое воспаление, так и индуцировать воспалительный ответ продемонстрирована на мышах и крысах. Трансгенные мыши, сверхэкспрессирующие PGD2-синтазу, демонстрируют усиленную легочную эозинофилию и повышенные уровни Th2 цитокинов в ответ на стимуляцию аллергеном (Fujitani et al., J. Immunol., 2002, 168, 443-449). В дополнение к этому, экзогенно введенные агонисты CRTH2 усиливают аллергический ответ у сенсибилизированных мышей (Spik et al., J. Immunol., 2005, 174, 3703-3708). У крыс экзогенно примененные агонисты CRTH2 вызывают легочную эозинофилию, однако агонист DP (BW 245C) или агонист ТР (I-BOP) не демонстрируют никакого эффекта(Shirashi et al., J. Pharmacol. Exp. Ther., 2005, 312, 954-960). В соответствии с этими данными высказано предположение, что антагонисты CRTH2 могут обладать чрезвычайно полезными свойствами для лечения заболеваний, опосредованных PGD2. В дополнение к раматробану описан ряд других антагонистов CRTH2. Примеры включают: индолуксусные кислоты (WO 2008/012511; WO 2007/065684; WO 2007/045867; WO 2006/034419; WO 2005/094816; WO 2005/044260; WO 2005/040114; WO 2005/040112; GB 2407318; WO 2005/019171; WO 2004/106302; WO 2004/078719; WO 2004/007451; WO 2003/101981; WO 2003/101961; WO 2003/097598;WO 2005/018529; WO 2004/089885; WO 2004/089884) и фенилуксусные кислоты (WO 2004/058164). Подробное описание изобретения Согласно одному из аспектов изобретения предложены производные индолов формулы (I):R1 представляет собой фтор или хлор;R3 представляет собой водород или С 1-С 6 алкил;Ar1 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, тиазолила, имидазолила, изотиазолила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена одним заместителем, выбранным из фтора, хлора, CN или метила;Ar2 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена 1-2 заместителями, независимо выбранными из фтора или хлора. Соединения (I), к которым относится данное изобретение, представляют собой антагонисты рецептора CRTH2, однако они также могут оказывать полезные эффекты на другие простаноидные рецепторы,такие как рецептор PGD2 или тромбоксановый А 2 рецептор. Вышеупомянутые соединения формулы (I) могут быть получены или извлечены в форме солей и в некоторых случаях в виде их N-оксидов, гидратов и сольватов. Любая ссылка в данном описании, включая формулу изобретения, приведенную в данном описании, на "соединения по изобретению", "соединения, к которым относится данное изобретение" или "соединения формулы (I)" и тому подобное включает ссылку на соли, в частности фармацевтически приемлемые соли, N-оксиды, гидраты и сольваты таких соединений. Изобретение также включает (1) применение соединения, к которому относится данное изобретение, в изготовлении лекарственного средства для применения в лечении состояний, чувствительных к модулированию CRTH2-рецепторной активности, и (2) способ лечения состояний, чувствительных к модулированию CRTH2-рецепторной активности, включающий введение пациенту, страдающему от такого заболевания, эффективного количества соединения, к которому относится данное изобретение. Примеры состояний, чувствительных к модулированию CRTH2-рецепторной активности, включают астму, ринит, аллергический синдром дыхательных путей, аллергический ринобронхит, бронхит, хроническую обструктивную болезнь легких (ХОБЛ), назальный полипоз, саркоидоз, экзогенный аллергический альвеолит, пневмофиброз, кистозный фиброз, хронический кашель, конъюнктивит, атопический дерматит, болезнь Альцгеймера, амиотрофический боковой склероз, СПИД-деменция-комплекс, болезнь Гентингтона, лобно-височную деменцию, деменцию с тельцами Леви, сосудистую деменцию, синдром Гийена-Барре, хроническую демиелинизирующую полирадикулонейропатию, многофокальную моторную нейропатию, плексопатию, множественный склероз, энцефаломиелит, панэнцефалит, мозжечковую дегенерацию и энцефаломиелит, травму ЦНС, мигрень, инсульт, ревматоидный артрит, анкилозирующий спондилит, болезнь Бехчета, бурсит, запястный синдром, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дерматомиозит, синдром Элерса-Данлоса (EDS), фибромиалгию, миофасциальный болевой синдром, остеоартрит (ОА), остеонекроз, псориатический артрит, синдром Рейтера(реактивный артрит), саркоидоз, склеродермию, синдром Шегрена, заболевание мягких тканей, болезнь Стилла, тендинит, полиартериит нодозный, гранулематоз Вегенера, миозит (полимиозит/дерматомиозит),подагру, атеросклероз, красную волчанку, системную красную волчанку (SLE), диабет I типа, нефритический синдром, гломерулонефрит, острую и хроническую почечную недостаточность, эозинофильный фасцит, синдром гиперпродукции IgE, сепсис, септический шок, ишемическое реперфузионное повреждение в сердце, отторжение аллотрансплантата после трансплантаций и реакцию "трансплантат против хозяина". Тем не менее, соединения, к которым относится данное изобретение, в первую очередь полезны для лечения астмы, хронической обструктивной болезни легких, ринита, аллергического синдрома дыхательных путей или аллергического ринобронхита. Псориаз, атопический и неатопический дерматит, болезнь Крона, язвенный колит и воспалительное заболевание кишечника являются другими конкретными состояниями, при которых соединения по настоящему изобретению могут найти особое применение. Другой аспект изобретения относится к фармацевтической композиции, содержащей соединение, к которому относится данное изобретение, в смеси с фармацевтически приемлемым носителем или эксципиентом. Терминология Использованный в данном описании термин "(Са-Сb)алкил", где а и b представляют собой целые числа, относится к прямому или разветвленному алкильному радикалу, имеющему от а до b атомов углерода. Таким образом, когда, например, а равно 1 и b равно 6, термин включает в себя метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Использованный в данном описании термин "циклоалкил" относится к моноциклическому насыщенному карбоциклическому радикалу, имеющему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Использованный в данном описании термин "соль" включает соли присоединения основания, соли присоединения кислоты и четвертичные соли. Соединения по изобретению, которые являются кислотными, могут образовывать соли, в том числе фармацевтически приемлемые соли, с такими основаниями,-2 017573 как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочноземельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например N-метил-D-глюкамином, холином, трис(гидроксиметил)аминометаном, L-аргинином, L-лизином,N-этилпиперидином, дибензиламином и тому подобным. Конкретные соли с основаниями включают соли пиперазина, этаноламина, бензатина, кальция, диоламина, меглумина, оламина, калия, прокаина, натрия, трометамина и цинка. Те соединения по изобретению, которые являются основными, могут образовывать соли, в том числе фармацевтически приемлемые соли, с неорганическими кислотами, например с галогенводородными кислотами, такими как соляная или бромисто-водородная кислоты, с серной кислотой, азотной кислотой или фосфорной кислотой и тому подобным, и с органическими кислотами, например уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, n-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и тому подобным. Если соединение содержит четвертичную аммониевую группу,приемлемыми противоионами могут быть, например, хлориды, бромиды, сульфаты, метансульфонаты,бензолсульфонаты, толуолсульфонаты (тозилаты), нападизилаты (нафталин-1,5-дисульфонаты или нафталин-1-(сульфоновая кислота)-5-сульфонаты), эдизилаты (этан-1,2-дисульфонаты или этан-1(сульфоновая кислота)-2-сульфонаты), изетионаты (2-гидроксиэтилсульфонаты), фосфаты, ацетаты, цитраты, лактаты, тартраты, мезилаты, малеаты, малаты, фумараты, сукцинаты, ксинафоаты, пацетамидобензоаты и тому подобное; при этом соответствующее количество четвертичных аммониевых группировок уравновешивает фармацевтически приемлемую соль, так что соединение не имеет никакого суммарного заряда. Данные соли рассмотрены в "Handbook of Pharmaceutical Salts. Properties, selection and use", P.Heinrich StahlCamilie G. Wermuth, Wiley-VCH, 2002. Термин "сольват" использован в данном изобретении для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество молекул одного или более фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" применяется, если указанным растворителем является вода. Соединения, к которым относится данное изобретение, могут существовать в одной или более чем одной стереоизомерной форме вследствие наличия асимметрических атомов или ограничений по вращению и в таких случаях могут существовать в виде ряда стереоизомеров с R- или S-стереохимией при каждом хиральном центре или в виде атропизомеров с R- или S-стереохимией по каждой хиральной оси. Изобретение включает все такие энантиомеры и диастереоизомеры и их смеси. Применение пролекарств, таких как сложные эфиры, соединений, к которым относится данное изобретение, также составляет часть изобретения. "Пролекарство" означает соединение, которое преобразуется in vivo посредством метаболического механизма (например, в результате гидролиза, восстановления или окисления) в соединение формулы (I). Например, сложноэфирное пролекарство соединения формулы (I) может быть преобразовано в результате гидролиза in vivo в исходную молекулу. Подходящими сложными эфирами соединений формулы (I) являются, например, ацетаты, цитраты, лактаты, тартраты,малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-идроксинафтоаты, гентизаты, изетионаты, ди-п-толуоилтартраты, метансульфонаты, этансульфонаты,бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинаты. Примерами сложноэфирных пролекарств являются пролекарства, описанные в F. J. Leinweber, Drug Metab. Res., 1987, 18, 379. Как использовано в данном описании, ссылки на соединения формулы (I) также означают включение пролекарственных форм. Структурные аспекты соединений, к которым относится данное изобретение При соблюдении условий в приведенном выше описании соединений, к которым относится данное изобретение:R1 представляет собой фтор или хлор;R3 представляет собой водород или С 1-С 6 алкил;Ar1 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, тиазолила, имидазолила, изотиазолила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена одним заместителем, выбранным из фтора, хлора, CN или метила;Ar2 представляет собой 5- или 6-членную гетероарильную группу, выбранную из тиенила, пиридинила или пиримидинила, где эта гетероарильная группа возможно замещена 1-2 заместителями, независимо выбранными из фтора или хлора.X может представлять собой -SO2NR3-, где связь, отмеченная звездочкой, присоединена к Ar1. Радикал Ar2SO2- или Ar2N(R3)SO2- может находиться в мета- или пара-положении кольца Ar1 относительно места присоединения Ar1 к остатку молекулы. Радикал Ar2SO2- или Ar2N(R3)SO2- может находиться в орто-положении кольца Ar1 относительно места присоединения Ar1 к остатку молекулы. Соединение по изобретению может быть выбрано из группы, включающей в себя-3 017573 5-фтор-2-метил-3-[3-(тиофен-2-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту,5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту,5-фтор-3-[3-(пиридин-3-сульфонил)тиофен-2-илметил]-2-метилиндол-1-илуксусную кислоту,5-фтор-2-метил-3-[3-(пиридин-4-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту,5-хлор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту,5-фтор-2-метил-3-[5-(пиридин-2-сульфонил)тиазол-4-илметил]индол-1-илуксусную кислоту,5-фтор-2-метил-3-[5-метил-3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту,5-фтор-2-метил-3-[4-(пиридин-2-сульфонил)тиазол-5-илметил]индол-1-илуксусную кислоту,3-[5-хлор-3-(пиридин-2-сульфонил)тиофен-2-илметил]-5-фтор-2-метилиндол-1-илуксусную кислоту,или его фармацевтически приемлемая соль. В предпочтительном случае соединение по изобретению представляет собой 5-фтор-2-метил-3-[3(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-илуксусную кислоту или е фармацевтически приемлемую соль. Композиции Как упомянуто выше, соединения, к которым относится данное изобретение, являются антагонистами рецептора CRTH2 и полезны в лечении заболеваний, на которые такое модулирование оказывает благоприятное действие. Примеры таких заболеваний приведены выше и включают астму, ринит, аллергический синдром дыхательных путей, бронхит и хроническую обструктивную болезнь легких. Очевидно, что конкретный уровень доз для любого конкретного пациента будет зависеть от ряда факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость экскреции, лекарственную комбинацию и тяжесть конкретного заболевания, подвергаемого лечению. Оптимальные уровни доз и частота введения будут определены в соответствии с клиническим испытанием, как это требуется в фармацевтической области. В общем случае, диапазон суточной дозы будет лежать в пределах от примерно 0,001 мг до примерно 100 мг на кг массы тела млекопитающего, зачастую от 0,01 мг до примерно 50 мг на кг,например от 0,1 до 10 мг на кг, в однократной или разделенных дозах. С другой стороны, в некоторых случаях может оказаться необходимым применить дозировки, превышающие эти пределы. Соединения, к которым относится данное изобретение, могут быть приготовлены для введения любым способом с учетом их фармакокинетических свойств. Перорально вводимые композиции могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких или гелевых препаратов, таких как растворы или суспензии для перорального, местного применения или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального введения могут быть представлены в форме стандартных доз и могут содержать традиционные эксципиенты, такие как связующие вещества, например сироп, аравийскую камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающие вещества для таблеток, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители,например картофельный крахмал, или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут иметь покрытие, нанесенное в соответствии с методами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие композиции могут быть в форме, например,водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для повторного разведения водой или другим подходящим разбавителем перед применением. Такие жидкие композиции могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, глюкозный сироп, желатин, гидрогенизированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитан-моноолеат или аравийскую камедь; неводные разбавители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил- или пропил-п-гидроксибензоат или сорбиновую кислоту, и при желании традиционные корригенты или красители. Для местного применения на кожу лекарственное средство может быть изготовлено в виде крема,лосьона или мази. Композиции в виде крема или мази, которые могут быть использованы для такого лекарственного средства, представляют собой традиционные композиции, хорошо известные в данной области техники, например, которые описаны в обычных руководствах по фармацевтике, таких как Британская фармакопея. Данное лекарственное средство также может быть изготовлено для ингаляции, например в виде назального спрея или сухого порошкового или аэрозольного ингаляторов. Для доставки путем ингаляции активное соединение предпочтительно должно быть в форме микрочастиц. Они могут быть получены с использованием ряда методик, включая распылительную сушку, сублимационную сушку и микронизацию. Образование аэрозоля может быть осуществлено с использованием, например, приводимых в действием давлением струйных атомайзеров или ультразвуковых атомайзеров, предпочтительно с использованием приводимых в действием пропеллентом дозированных аэрозолей или путем введения не содер-4 017573 жащих пропеллента микронизированных активных соединений из, например, капсул для ингаляций или других "сухих порошковых" систем доставки. Кроме того, активный ингредиент может быть введен парентерально в стерильной среде. В зависимости от используемых разбавителя и концентрации лекарственное средство может быть либо суспендировано, либо растворено в этом разбавителе. Предпочтительно, чтобы адъюванты, такие как местный анестетик, консервант и буферные агенты, могли быть растворены в данном разбавителе. Для предупреждения и лечения простагландин-опосредованных заболеваний с соединениями, к которым относится данное изобретение, могут быть комбинированы другие соединения. Таким образом,настоящее изобретение также относится к фармацевтическим композициям для предупреждения и лечения PGD2-опосредованных заболеваний, содержащим терапевтически эффективное количество соединения по изобретению и один или более чем один другой терапевтический агент. Подходящие терапевтические агенты для комбинированной терапии соединениями по изобретению включают, но не ограничиваются этим: (1) кортикостероиды, такие как флутиказон, циклесонид или будесонид; (2) агонисты 2 адренергических рецепторов, такие как салметерол, индакатерол или формотерол; (3) модуляторы лейкотриенов, например антагонисты лейкотриенов, такие как монтелукаст, зафирлукаст (zafirulast) или пранлукаст, или ингибиторы биосинтеза лейкотриенов, такие как зилейтон или BAY-1005; (4) антихолинергические агенты, например антагонисты мускаринового-3 (М 3) рецептора, такие как тиотропия бромид; (5) ингибиторы фосфодиэстеразы-IV (PDE-IV), такие как рофлумиласт или циломиласт; (6) антигистамины, например селективные антагонисты гистаминового-1 (Н 1) рецептора, такие как фексофенадин, цитиризин, лоратидин или астемизол; (7) противокашлевые агенты, такие как кодеин или декстраморфан; (8) неселективные ингибиторы СОХ-1/СОХ-2 (циклооксигеназа-1/2), такие как ибупрофен или кетопрофен; (9) ингибиторы СОХ-2, такие как целекоксиб и рофекоксиб; (10) антагонисты VLA-4 (очень позднего антигена-4), как например описанные в WO 97/03094 и WO 97/02289; (11) ингибиторы ТАСЕ(TNF-превращающего фермента) и ингибиторы TNF- (фактора некроза опухоли альфа), например анти-TNF моноклональные антитела, такие как ремикад и CDP-870, и TNF-рецепториммуноглобулиновые молекулы, такие как энбрел; (12) ингибиторы матриксной металлопротеазы, например ММР 12; (13) ингибиторы эластазы нейтрофилов человека, как например описанные в WO 2005/026124, WO 2003/053930 и WO 06/082412; (14) А 2 а-агонисты, как например, описанные в ЕР 1052264 и ЕР 1241176; (15) А 2b-антагонисты, как например, описанные в WO 2002/42298; (16) модуляторы функции хемокиновых рецепторов, например антагонисты CCR3 и CCR8; (17) соединения, которые модулируют действие других простаноидных рецепторов, например антагонист тромбоксанового А 2 рецептора; и (18) агенты, которые модулируют функцию Th2, такие как агонисты PPAR (рецептора, активируемого пролифератором пероксисом). Массовое соотношение соединения по изобретению и второго активного ингредиента может варьировать и будет зависеть от эффективной дозы каждого ингредиента. Как правило, будет использована эффективная доза каждого. Синтез Существует множество стратегий синтеза, подходящих для синтеза соединений, к которым относится настоящее изобретение, и в основе всех лежат химические превращения, известные химикуспециалисту в области органического синтеза. Так, соединения по изобретению могут быть синтезированы в соответствии с процедурами, описанными в нормативной литературе и хорошо известными специалисту в данной области техники. Типичными литературными источниками являются "Advanced organicchemistry", 4-е издание (Wiley), J. March, "Comprehensive Organic Transformation", 2-е издание (Wiley), R. С. Larock, "Handbook of Heterocyclic Chemistry", 2-е издание (Pergamon), A. R. Katritzky, обзорные статьи,как например, представленные в "Synthesis", "Acc. Chem. Res.", "Chem. Rev", или первичные литературные источники, идентифицированные посредством поисков нормативной литературы он-лайн или из вторичных источников, таких как "Chemical Abstracts" или "Beilstein". Несомненно, особенно релевантна обширная литература, относящаяся к синтезу соединений индолов. Может потребоваться защита реакционноспособных функциональных групп (например, гидрокси,амино, тио или карбокси) в промежуточных соединениях, используемых в получении соединений формулы (I), для предотвращения нежелательного участия их в реакции, приводящей к образованию соединений формулы (I). Можно использовать общепринятые защитные группы, например описанные Т. W.Greene и P. G. M. Wuts в "Protective groups in organic chemistry" (John Wiley and Sons, 1999). Соединения по изобретению формулы (I) могут быть выделены в форме своих фармацевтически приемлемых солей, например, изложенных в данном описании выше. Форма свободной кислоты, соответствующей выделенным солям, может быть образована путем подкисления подходящей кислотой, такой как уксусная кислота и соляная кислота, и экстрагирования высвобождаемой свободной кислоты в органический растворитель с последующим его выпариванием. Выделенную таким образом форму свободной кислоты далее можно превратить в другую фармацевтически приемлемую соль путем растворения в органическом растворителе, затем добавления соответствующего основания и последующего упаривания, осаждения или кристаллизации.-5 017573 Соединения формулы (Ia), где X, R1, R2, Ar1 и Ar2 такие, как они определены выше для формулы (I),удобно могут быть получены в результате взаимодействия между индолом формулы (II), где Е представляет собой водород или алкильную группу, и альдегидом формулы (III) (схема 1). Данную реакцию осуществляют в кислотных восстановительных условиях, например в смеси трифторуксусной кислоты и триэтилсилана. Следует понимать, что если данную реакцию осуществляют для защищенной формы соединения (II), то потребуется соответствующая стадия удаления защиты для получения желаемого соединения по изобретению (Ia). Соединения формулы (II) имеются в продаже или могут быть получены известными способами (Kim et al., J. Heterocycl. Chem., 1981, 18, 1365-71; Forbes et al., Syn. Commun.,1996, 26, 745-754). Схема 1 Промежуточные соединения формулы (III), где X представляет собой группу SO2, могут быть получены путем окисления соединений формулы (IV) подходящим окисляющим агентом, таким как пероксимоносульфат калия, мета-хлорперокси-бензойная кислота или другие общеизвестные окисляющие агенты (схема 2). Схема 2 Соединения формулы (IV) могут быть получены из соединений формулы (V), где Т представляет собой атом хлора, брома или йода либо группу трифторметансульфонилокси, путем приведения во взаимодействие с тиолом формулы (VI) в присутствии подходящего основания, такого как карбонат калия(схема 3). Альтернативно, данная реакция может быть проведена в присутствии подходящего катализатора, такого как тетракис(трифенилфосфин)палладий(0), в протонном растворителе, таком как этанол. Соединения формулы (V) и (VI) имеются в продаже или могут быть получены известными способами. Схема 3 Альтернативно, промежуточные соединения формулы (III), где X представляет собой группу SO2,могут быть получены путем приведения во взаимодействие соединений формулы (V) и (VII) (схема 4). Данная реакция может быть проведена в подходящем растворителе, таком как диметилсульфоксид, при температурах в диапазоне от комнатной температуры до 150C. Соединения формулы (VII) имеются в продаже или могут быть получены известными способами. Схема 4 Промежуточные соединения формулы (III), где X представляет собой группу SO2NR3, могут быть получены в результате взаимодействия между соединением формулы (VIII) и амином формулы (IX)(схема 5). Данная реакция может быть проведена в присутствии подходящего основания (например, триэтиламина или диизопропилэтиламина) и растворителя (например, дихлорметана или дихлорэтана) при температурах в диапазоне от 0C до температуры дефлегмации растворителя, предпочтительно при примерно комнатной температуре. Соединения формулы (VIII) и (IX) имеются в продаже или могут быть получены известными способами. Схема 5-6 017573 Примеры Н ЯМР-спектры регистрировали при температуре окружающей среды, используя спектрометр Varian Unity Inova (400 МГц) с 5 мм зондом тройного резонанса. Химические сдвиги выражены в млн-1 относительно тетраметилсилана. Использованы следующие сокращения: br s = уширенный синглет, s = синглет, d = дублет, dd = двойной дублет, t = триплет, q = квартет, m = мультиплет. Масс-спектрометрические (LCMS) эксперименты для определения времен удержания и ассоциированных с ними масс ионов выполняли с использованием следующих далее методов. Метод А: эксперименты проводили на LCT спектрометре на платформе для определения микромасс(Micromass Platform) с электрораспылением положительных ионов и детекцией на одной длине волны 254 нм в УФ-области, используя колонку Higgins Clipeus C18, 5 мкм, 1003,0 мм и скорость потока 2 мл/мин. Изначальная система растворителей состояла из 95% воды, содержащей 0,1% муравьиной кислоты, (растворитель А) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты, (растворитель В) в течение первой минуты, затем следовал градиент вплоть до 5% растворителя А и 95% растворителя В в течение следующих 14 мин. Конечную систему растворителей поддерживали без изменения в течение следующих 2 мин. Метод В: эксперименты проводили на LC спектрометре на платформе для определения микромасс с электрораспылением положительных и отрицательных ионов и детекцией с применением ELS/диодного матричного детектора, используя колонку Phenomenex Luna C18(2), 304,6 мм и скорость потока 2 мл/мин. Система растворителей состояла из 95% растворителя А и 5% растворителя В в течение первых 0,50 мин, затем следовал градиент вплоть до 5% растворителя А и 95% растворителя В в течение следующих 4 мин. Конечную систему растворителей поддерживали без изменения в течение следующих 0,50 мин. Эксперименты с облучением микроволнами проводили, используя Smith Synthesizer от PersonalChemistry, в котором используется одномодовый резонатор и динамическое переключение поля настройки, и то и другое обеспечивают воспроизводимость и контроль. Можно достичь температур 40-250 С и дойти до давлений вплоть до 20 бар (2 МПа). Для этой установки доступны два типа флаконов 0,5-2,0 мл и 2,0-5,0 мл. Стадии очистки с применением препаративной обращенно-фазовой HPLC (высокоэффективной жидкостной хроматографии) проводили, используя неподвижную фазу из связанного с С-18 диоксида кремния, 7 мкм, от Genesis в колонках длиной 10 см и с внутренним диаметром 2 см. Используемая подвижная фаза состояла из смеси ацетонитрила и воды (каждый из которых забуферен 0,1%-ной (об./об.) трифторуксусной кислотой или муравьиной кислотой) при скорости потока 10 мл в минуту и типичных градиентах 40-90% органического модификатора с линейным изменением в течение 30-40 мин. Фракции,содержащие необходимый продукт (идентифицированный посредством LCMS-анализа), собирали, органическую фракцию удаляли путем выпаривания и оставшуюся водную фракцию лиофилизировали, получая конечный продукт. Пример 1. 5-Фтор-3-[3-(4-фторбензолсульфонил)тиофен-2-илметил]-2-метилиндол-1-илуксусная кислота 1 Подготовительный пример 1 а: 3-(4-Фторфенилсульфанил)тиофен-2-карбальдегид Смесь гидрида натрия (0,20 г) и н-бутанола (10 мл) обрабатывали 4-фтортиофенолом (0,64 г) и полученную смесь добавляли к смеси 3-бромтиофен-2-карбальдегида(0,96 г),тетракис(трифенилфосфин)палладия(0) (0,12 г) и н-бутанола (5,0 мл). Полученную смесь перемешивали при 100C в течение 2 ч и затем при 120 С в течение 4 ч. Смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и остаток распределяли между водой и этилацетатом. Водную фазу экстрагировали этилацетатом, объединенный органический раствор сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и дихлорметана (от 2:1 до 0:1 по объему), что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,78 г). 1 Н ЯМР (CDCl3):6.72 (d, J=5.1 Гц, 1H), 7.08 (t, J=8.6 Гц, 2 Н), 7.42-7.48 (m, 2 Н), 7.62 (dd, J=1.0, 5.1 Гц, 1H), 10.11 (d, J=1.0 Гц, 1H). Подготовительный пример 1b: 3-(4-фторбензолсульфонил)тиофен-2-карбальдегид Раствор 3-(4-фторфенилсульфанил)тиофен-2-карбальдегида (0,60 г) в дихлорметане (6,0 мл) при 0 С обрабатывали по каплям раствором 3-хлорпероксибензойной кислоты (1,3 г) в дихлорметане (12 мл)-7 017573 и полученную смесь перемешивали при 0 С в течение 15 мин и затем при комнатной температуре в течение 3 ч. Смесь распределяли между насыщенным водным раствором гидрокарбоната натрия и этилацетатом. Водную фазу экстрагировали этилацетатом и объединенный органический раствор сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и дихлорметана (от 1:3 до 0:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,36 г). 1 Н ЯМР (CDCl3):7.22-7.26 (m, 2 Н), 7.46 (d, J=5.2 Гц, 1H), 7.71 (dd, J=1.2, 5.2 Гц, 1H), 7.96-8.01 (m,2 Н), 10.63 (d, J=1.2 Гц, 1 Н). Подготовительный пример 1 с: 5-фтор-3-[3-(4-фторбензолсульфонил)тиофен-2-илметил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Смесь триэтилсилана (0,79 г), трифторуксусной кислоты (0,47 г) и 1,2-дихлорэтана (2,0 мл) при -10 С обрабатывали по каплям смесью (5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,1 г), 3-(4-фторбензолсульфонил)тиофен-2-карбальдегида (0,15 г) и 1,2-дихлорэтана (3,0 мл) и полученную смесь перемешивали при -10 С в течение 15 минут и затем при комнатной температуре в течение ночи. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и дихлорметана (от 1:1 до 0:1 по объему), что позволило получить указанное в заголовке соединение в виде бесцветного смолообразного вещества (0,17 г). 1 Н ЯМР (CDCl3):2.29 (s, 3H), 3.76 (s, 3H), 4.44 (s, 2H), 4.81 (s, 2H), 6.66 (dd, J=2.5, 9.4 Гц, 1H),6.87-6.91 (m, 1H), 7.05-7.10 (m, 2 Н), 7.23 (t, J=8.6 Гц, 2 Н), 7.41 (d, J=5.4 Гц, 1H), 8.00 (dd, J=5.4, 8.9 Гц,2 Н). Подготовительный пример 1d: 5-фтор-3-[3-(4-фторбензолсульфонил)тиофен-2-илметил]-2 метилиндол-1-илуксусная кислота Смесь 5-фтор-3-[3-(4-фторбензолсульфонил)тиофен-2-илметил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,17 г), тетрагидрофурана (2,0 мл) и метанола (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (1,5 мл) и полученную смесь перемешивали при 40 С в течение ночи. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали для уменьшения объема при пониженном давлении. Полученный осадок собирали фильтрованием, промывали водой и сушили, что позволило получить указанное в заголовке соединение в виде кремового твердого вещества (0,11 г). 1 Н ЯМР (CDCl3):2.28 (s, 3H), 4.41 (s, 2H), 4.75 (s, 2H), 6.63 (dd, J=2.4, 9.5 Гц, 1H), 6.83 (td, J=2.5,9.0 Гц, 1H), 7.05-7.12 (m, 2 Н), 7.22 (t, J=8.4 Гц, 2 Н), 7.38 (s, 1H), 7.97 (dd, J=5.0, 8.5 Гц, 2 Н). Подготовительный пример 2 а: 4-(4-Фторфенилсульфанил)бензальдегид Смесь 4-фторбензолтиола (1,0 г), карбоната калия (2,4 г) и N,N-диметилформамида (25 мл) обрабатывали 4-бромбензальдегидом (0,73 г) и полученную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали кристаллизацией из смеси диэтилового эфира и циклогексана, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,89 г). 1 Н ЯМР (CDCl3):7.10-7.21 (m, 4H), 7.51-7.56 (m, 2H), 7.70-7.74 (m, 2H), 9.92 (s,1H). Подготовительный пример 2b: 4-(4-фторбензолсульфонил)бензальдегид Указанное в заголовке соединение получали способом из Подготовительного примера 1b, используя 4-(4-фторфенилсульфанил)-бензальдегид. 1 Н ЯМР (CDCl3):7.19 (t, J=8.5 Гц, 2 Н), 7.95-8.01 (m, 4H), 8.08 (d, J=8.2 Гц, 2 Н), 10.06 (s, 1H). Подготовительный пример 2 с: 5-фтор-3-[4-(4-фторбензолсульфонил)бензил]-2-метилиндол-1 илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 4-(4-фторбензолсульфонил)бензальдегид. 1 Н ЯМР (CDCl3):2.30 (s, 3H), 3.76 (s, 3H), 4.08 (s, 2H), 4.80 (s, 2H), 6.84-6.96 (m, 2 Н), 7.05-7.19 (m,3H), 7.29 (d, J=8.1 Гц, 2 Н), 7.79 (d, J=8.2 Гц, 2 Н), 7.92 (dd, J=5.1, 8.9 Гц, 2 Н). Подготовительный пример 2d: 5-фтор-3-[4-(4-фторбензолсульфонил)бензил]-2-метилиндол-1 илуксусная кислота-8 017573 Смесь 5-фтор-3-[4-(4-фторбензолсульфонил)бензил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,079 г) и тетрагидрофурана (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (1,5 мл) и полученную смесь перемешивали при 40 С в течение 1 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:3 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,056 г). 1 Н ЯМР (DMSO-d6):2.28 (s, 3H), 4.07 (s, 2H), 4.89 (s, 2H), 6.84 (td, J=2.5, 9.2 Гц, 1H), 7.12 (dd,J=2.5, 9.9 Гц, 1H), 7.32 (dd, J=4.4, 8.9 Гц, 1H), 7.36-7.44 (m, 4 Н), 7.82 (d, J=8.4 Гц, 2 Н), 7.94-7.99 (m, 2H),12.91 (br s, 1 Н). Подготовительный пример 3a: 3-фтор-4-(4-фторфенилсульфанил)бензальдегид Смесь 4-фторбензолтиола (0,93 г), карбоната калия (3,1 г) и N,N-диметилформамида (25 мл) обрабатывали 3,4-дифторбензальдегидом (1,0 г) и полученную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь распределяли между водой и этилацетатом и органическую фазу сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде бесцветного смолообразного вещества (0,18 г). 1 Н ЯМР (CDCl3):6.90 (t, J=7.6 Гц, 1H), 7.15 (t, J=8.6 Гц, 2 Н), 7.45-7.58 (m, 4 Н), 9.88 (d, J=1.9 Гц,1 Н). Подготовительный пример 3b: 3-фтор-4-(4-фторбензолсульфонил)бензальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 3-фтор-4-(4-фторфенилсульфанил)-бензальдегид. 1 Н ЯМР (CDCl3):7.23 (d, J=8.5 Гц, 2 Н), 7.62 (dd, J=1.4, 9.5 Гц, 1H), 7.84 (dd, J=1.4, 8.0 Гц, 1H),8.03-8.09 (m, 2 Н), 8.30 (t, J=7.3 Гц, 1H), 10.04 (d, J=1.8 Гц, 1 Н). Подготовительный пример 3 с: 5-фтор-3-[3-фтор-4-(4-фторбензолсульфонил)бензил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 3-фтор-4-(4-фторбензолсульфонил)бензальдегид. 1 Н ЯМР (CDCl3):2.29 (s, 3H), 3.74 (s, 3H), 4.05 (s, 2H), 4.76-4.80 (m, 2H), 6.82-6.94 (m, 3H), 7.057.08 (m, 1H), 7.10-7.20 (m, 3H), 9.91-8.02 (m, 3H). Подготовительный пример 3d: 5-фтор-3-[3-фтор-4-(4-фторбензолсульфонил)бензил]-2 метилиндол-1-илуксусная кислота Смесь 5-фтор-3-[3-фтор-4-(4-фторбензолсульфонил)бензил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,14 г) и тетрагидрофурана (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (2,0 мл) и полученную смесь перемешивали при 40C в течение 1 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 3,5:6,5 до 9:1, по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,046 г). 1 Н ЯМР (DMSO-d6):2.30 (s, 3H), 4.11 (s, 2H), 4.94 (s, 2H), 6.87 (td, J=2.5, 9.2 Гц, 1H), 7.16-7.23 (m,2 Н), 7.30 (dd, J=1.5, 8.2 Гц, 1H), 7.36 (dd, J=4.4, 8.9 Гц, 1H), 7.42-7.49 (m, 2 Н), 7.90-8.02 (m, 3H), 13.10 (br-9 017573 Подготовительный пример 4 а: 2-(4-хлорбензолсульфонил)пиридин-3-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 2-(4-хлорфенилсульфанил)пиридин-3-карбальдегид. 1 Н ЯМР (CDCl3):7.55-7.64 (m, 3H), 7.98-8.03 (m, 2 Н), 8.40 (dd, J=1.8, 7.9 Гц, 1H), 8.69 (dd, J=1.7,4.7 Гц, 1H), 11.13 (d, J=0.8 Гц, 1 Н). Подготовительный пример 4b: 3-[2-(4-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 2-(4-хлорбензолсульфонил)пиридин-3 карбальдегид. 1 Н ЯМР (CDCl3):2.31 (s, 3H), 3.77 (s, 3H), 4.64 (s, 2H), 4.83 (s, 2H), 6.80-6.94 (m, 2 Н), 7.11 (dd,J=4.2, 8.8 Гц, 1H), 7.22 (dd, J=4.6, 7.9 Гц, 1H), 7.36-7.40 (m, 1H), 7.54-7.59 (m, 2 Н), 7.98-8.03 (m, 2 Н), 8.30(dd, J=1.6, 4.6 Гц, 1 Н). Подготовительный пример 4 с: (3-[2-(4-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2 метилиндол-1-илуксусная кислота Смесь 3-[2-(4-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,19 г) и тетрагидрофурана (1,5 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (2,0 мл) и полученную смесь перемешивали при 40 C в течение 3 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 3,5:6,5 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,039 г). 1 Н ЯМР (DMSO-d6):2.30 (s, 3H), 4.57 (s, 2H), 4.98 (s, 2H), 6.85-6.92 (m, 2H), 7.37-7.50 (m, 3H),7.74-7.79 (m, 2 Н), 8.00-8.04 (m, 2 Н), 8.37 (dd, J=1.7, 4.4 Гц, 1H), 13.00 (br s, 1H). Подготовительный пример 5 а: 3-(4-фторбензолсульфонил)пиридин-4-карбальдегид Раствор 3-фторизоникотинальдегида (0,25 мл) в диметилсульфоксиде (2,0 мл) обрабатывали раствором натриевой соли 4-фторбензолсульфиновой кислоты (0,5 г) в диметилсульфоксиде (3,0 мл) и полученную смесь перемешивали при 100 С в течение 3 суток. Смесь охлаждали до комнатной температуры, распределяли между водой и этилацетатом (20 мл) и водную фазу экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (от 1:0 до 4:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,38 г). 1 Н ЯМР (CDCl3):7.24-7.29 (m, 2 Н), 7.76 (dd, J=0.7, 4.9 Гц, 1H), 7.95-8.01 (m, 2 Н), 9.02 (d, J=4.9 Гц,1H), 9.30 (s, 1H), 10.88 (d, J=0.7 Гц, 1 Н). Подготовительный пример 5b: (5-Фтор-3-[3-(4-фторбензолсульфонил)пиридин-4-илметил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 3-(4-фторбензолсульфонил)пиридин-4 карбальдегид. 1 Н ЯМР (CDCl3):2.16 (s, 3H), 3.76 (s, 3H), 4.25 (s, 2H), 4.79 (s, 2H), 6.34 (dd, J=2.5, 9.3 Гц, 1H),6.82-6.90 (m, 2 Н), 7.08 (dd, J=4.1, 8.9 Гц, 1H), 7.28 (dd, J=2.0, 8.3 Гц, 2 Н), 8.02 (dd, J=5.0, 8.9 Гц, 2 Н), 8.55(d, J=5.1 Гц, 1H), 9.32 (s, 1H). Подготовительный пример 5 с: 5-Фтор-3-[3-(4-фторбензолсульфонил)пиридин-4-илметил]-2 метилиндол-1-илуксусная кислота Смесь 5-фтор-3-[3-(4-фторбензолсульфонил)пиридин-4-илметил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,21 г) и тетрагидрофурана (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (3,0 мл) и полученную смесь перемешивали при 40C в течение 3 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали для уменьшения объема при пониженном давлении. Полученный осадок собирали фильтрованием, промывали водой и сушили, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,094 г). Подготовительный пример 6a: 2-[(4-фторфенил)метилсульфамоил]бензойной кислоты метиловый эфир Раствор 4-фтор-N-метиланилина (0,53 г), триэтиламина (0,65 г) и дихлорметана (2,0 мл) обрабатывали 2-хлорсульфонилбензойной кислоты метиловым эфиром (1,0 г) и полученную смесь перемешивали при комнатной температуре в течение 24 ч. Смесь распределяли между водой и дихлорметаном и органическую фазу промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на SCX-2 (сильная катионообменная смола-2), элюируя метанолом и затем 2,0 М аммиаком в метаноле, что позволило получить указанное в заголовке соединение в виде бледно-желтого твердого вещества(1,2 г). 1 Н ЯМР (CDCl3):3.26 (s, 3H), 3.86 (s, 3H), 6.96-7.04 (m, 2H), 7.11-7.18 (m, 2 Н), 7.36-7.49 (m, 3H),7.58 (ddd, J=1.7, 6.8, 7.7 Гц, 1 Н). Подготовительный пример 6b. N-(4-фторфенил)-2-гидроксиметил-N-метилбензолсульфонамид Раствор 2-[(4-фторфенил)метилсульфамоил]бензойной кислоты метилового эфира (0,80 г) в тетрагидрофуране при -20C обрабатывали по каплям 1,0 М раствором алюмогидрида лития в тетрагидрофуране (2,5 мл) и полученную смесь перемешивали при -20C в течение 3 ч. Смесь обрабатывали 1,0 М водным раствором соляной кислоты и сегнетовой солью и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (от 1:0 до 6:4 по объему), что позволило получить указанное в заголовке соединение в виде бесцветного масла (0,35 г). 1 Н ЯМР (CDCl3):3.21 (s, 3H), 4.38 (d, J=6.6 Гц, 2 Н), 6.95-7.12 (m, 4H), 7.44 (ddd, J=1.9, 7.0, 7.9 Гц,1H), 7.53-7.63 (m, 2 Н), 7.79 (dd, J=1.3, 7.9 Гц, 1 Н). Подготовительный пример 6c: N-(4-фторфенил)-2-формил-N-метилбензолсульфонамид Раствор N-(4-фторфенил)-2-гидроксиметил-N-метилбензолсульфонамида (0,35 г) в хлороформе (20 мл) обрабатывали диоксидом марганца (1,2 г) и полученную смесь перемешивали при 60 C в течение 16 ч. Смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение в виде бесцветного масла (0,23 г). 1 Н ЯМР (CDCl3):3.18 (s, 3H), 6.96-7.08 (m, 4H), 7.68-7.75 (m, 2H), 7.88-7.94 (m, 1H), 8.00-8.06 (m,1H), 9.99 (s, 1H). Подготовительный пример 6d:(5-фтор-3-2-[(4-фторфенил)метилсульфамоил]бензил-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и N-(4-фторфенил)-2-формил-Nметилбензол-сульфонамид. 1 Н ЯМР (CDCl3):2.20 (s, 3H), 3.29 (s, 3H), 3.75 (s, 3H), 4.17 (s, 2 Н), 4.80 (s, 2 Н), 6.78-6.92 (m, 2H),6.93-7.11 (m, 4H), 7.21-7.25 (m, 1H), 7.25-7.35 (m, 3H), 7.89 (dd, J=1.8, 7.6 Гц, 1 Н). Подготовительный пример 6e:(5-фтор-3-2-[(4-фторфенил)метилсульфамоил]бензил-2 метилиндол-1-ил)уксусная кислота Смесь (5-фтор-3-2-[(4-фторфенил)метилсульфамоил]бензил-2-метилиндол-1-илуксусной кислоты метилового эфира (0,22 г) и тетрагидрофурана (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (3,0 мл) и полученную смесь перемешивали при 40C в течение 3 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 3,5:6,5 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,10 г). 1 Н ЯМР (DMSO-d6):2.17 (s, 3H), 3.25 (s, 3H), 4.03 (s, 2H), 4.97 (s, 2H), 6.76-6.93 (m, 3H), 7.20-7.28(1,1 г) и диметилсульфоксида (7,0 мл) перемешивали при 100C в течение 18 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и полученный осадок удаляли фильтрованием. Фильтрат экстрагировали этилацетатом, объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде бледно-желтого масла(0,67 г). 1 Н ЯМР (CDCl3):7.23 (m, 2 Н), 7.22 (dd, J=4.7, 8.0 Гц, 1H), 8.03 (m, 2H), 8.63 (ddd, J=0.3, 1.5, 8.0 Гц, 1H), 8.97 (dd, J=1.5, 4.7 Гц, 1H), 10.36 (s, 1H). Подготовительный пример 7b: 5-фтор-3-[3-(4-фторбензолсульфонил)пиридин-2-илметил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 3-(4-фторбензолсульфонил)пиридин-2 карбальдегид. 1 Н ЯМР (CDCl3):2.26 (s, 3H), 3.75 (s, 3H), 4.45 (s, 2H), 4.74 (s, 2H), 6.32 (dd, J=2.5, 9.8 Гц, 1H), 6.78MS: ESI (+ve) (метод В): 471 (М+Н)+, время удерживания 3,7 мин. Подготовительный пример 7 с: 5-фтор-3-[3-(4-фторбензолсульфонил)пиридин-2-илметил]-2 метилиндол-1-илуксусная кислота Раствор 5-фтор-3-[3-(4-фторбензолсульфонил)пиридин-2-илметил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,18 г) в тетрагидрофуране (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,45 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC,элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,13 г). 1 Н ЯМР (DMSO-d6):2.15 (s, 3H), 4.36 (s, 2H), 4.88 (s, 2H), 6.21 (dd, J=2.5, 10.1 Гц, 1H), 6.75 (dt,J=2.5, 9.1 Гц, 1H), 7.25 (m, 1H), 7.40 (t, J=8.8 Гц, 2 Н), 7.58 (m, 1H), 7.96 (m, 2 Н), 8.53 (dd, J=1.6, 8.1 Гц,1H), 8.70 (dd, J=1.6, 4.7 Гц, 1H), 13.05 (br s, 1H). Подготовительный пример 8 а: 3-фтор-2-(4-фторфенилсульфанил)бензальдегид Указанное в заголовке соединение получали способом из подготовительного примера 3a, используя 2,3-дифторбензальдегид. 1 Н ЯМР (CDCl3):6.92-7.01 (m, 2 Н), 7.20-7.27 (m, 2 Н), 7.38 (td, J=1,5, 8.3 Гц, 1H), 7.48-7.56(m, 1H),7.81 (ddd, J=0.7, 1.5, 7.7 Гц, 1H), 10.70 (d, J=0.8 Гц, 1 Н). Подготовительный пример 8b: 3-фтор-2-(4-фторбензолсульфонил)бензальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 3-фтор-2-(4-фторфенилсульфанил)бензальдегид. Н ЯМР (CDCl3):7.20-7.35 (m, 3H), 7.63-7.73 (m, 2 Н), 8.07 (ddd, J=1.6, 5.0, 8.9 Гц, 2 Н), 11.00 (d,J=0.7 Гц, 1 Н). Подготовительный пример 8 с: 5-фтор-3-[3-фтор-2-(4-фторбензолсульфонил)бензил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 2-бензолсульфонил-3 фторбензальдегид. 1 Н ЯМР (CDCl3):2.30 (s, 3H), 3.77 (s, 3H), 4.68 (s, 2H), 4.84 (s, 2H), 6.66 (dd, J=2.5, 9.5 Гц, 1H),6.82-6.98 (m, 3H), 7.10 (dd, J=4.2, 8.7 Гц, 1H), 7.18 (m, 2 Н), 7.31 (td, J=5.5, 7.9 Гц, 1H), 7.98 (ddd, J=1.4, 5.1,8.8 Гц, 2 Н). Подготовительный пример 8d: 5-фтор-3-[3-фтор-2-(4-фторбензолсульфонил)бензил]-2 метилиндол-1-илуксусная кислота Указанное в заголовке соединение получали способом из подготовительного примера 2d, используя 5-фтор-3-[3-фтор-2-(4-фторбензолсульфонил)бензил]-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (DMSO-d6):2.23 (s, 3H), 4.60 (s, 2H), 5.00 (s, 2H), 6.70 (dd, J=2.4, 9.6 Гц, 1H), 6.84-6.89 (m,2 Н), 7.24 (dd, J=8.3, 10.9 Гц, 1H), 7.39 (dd, J=4.5, 8.9 Гц, 1H), 7.46 (m, 2 Н), 7.53 (ddd, J=1.4, 5.1, 8.8 Гц, 1H),8.04 (dd, J=5.1, 8.3 Гц, 2 Н), 13.06 (br s, 1H). Подготовительный пример 9 а: 3-фенилсульфанилтиофен-2-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1 а, используя бензолтиол и 3-бромтиофен-2-карбальдегид. 1H ЯМР (CDCl3):6.81 (d, J=5.07 Гц, 1H), 7.32-7.38 (m, 3H), 7.40-7.44 (m, 2 Н), 7.63 (dt, J=1.0, 5.0 Гц, 1H), 10.13 (d, J=1.2 Гц, 1 Н). Подготовительный пример 9b: 3-бензолсульфонилтиофен-2-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 3-фенилсульфанилтиофен-2-карбальдегид. 1 Н ЯМР (CDCl3):7.49 (d, J=5.2 Гц, 1H), 7.54-7.61 (m, 2 Н), 7.62-7.68 (m, 1H), 7.70 (dd, J=1.2, 5.2 Гц,1H), 7.95-8.00 (m, 2 Н), 10.64 (d, J=1.2 Гц, 1 Н).MS: ESI (+ve) (метод В): 253 (М+Н)+, время удерживания 3,2 мин. Подготовительный пример 9 с: [3-(3-бензолсульфонилтиофен-2-илметил)-5-фтор-2-метилиндол-1 ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя(5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир и 3-бензолсульфонилтиофен-2 карбальдегид. 1 Н ЯМР (DMSO-d6):2.20 (s, 3H), 3.67 (s, 3H), 4.45 (s, 2H), 5.12 (s, 2H), 6.69 (dd, J=2.5, 9.8 Гц, 1H),6.87 (dt, J=2.5, 9.2 Гц, 1H), 7.35-7.41 (m, 2H), 7.44 (d, J=5.4 Гц, 1H), 7.65-7.79 (m, 3H), 8.03-8.07 (m, 2H).MS: ESI (+ve) (метод В): 458 (М+Н)+, время удерживания 3,9 мин. Подготовительный пример 9d: [3-(3-бензолсульфонилтиофен-2-илметил)-5-фтор-2-метилиндол-1 ил]уксусная кислота Раствор [3-(3-бензолсульфонилтиофен-2-илметил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,19 г) в тетрагидрофуране (10 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,8 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия,сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему),что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,17 г). 1 Н ЯМР (DMSO-d6):2.14 (s, 3H), 4.38 (s, 2 Н), 4.88 (s, 2H), 6.61 (dd, J=2.5, 9.8 Гц, 1H), 6.80 (dt,J=2.5, 9.2 Гц, 1H), 7.30 (dd, J=4.3, 8.8 Гц, 1H), 7.33 (d, J=5.5 Гц, 1H), 7.37 (d, J=5.5 Гц, 1H), 7.60-7.64 (m,2H), 7.67-7.72 (m, 1H), 7.97-7.99 (m, 2 Н), 13.02 (br s, 1H). Подготовительный пример 10 а: 2-бензолсульфонилпиридин-3-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 2-фенилсульфанилпиридин-3-карбальдегид. 1 Н ЯМР (DMSO-d6):7.62-7.73 (m, 2H), 7.78-7.88 (m, 2H), 8.03-8.08 (m, 2H), 8.33 (dd, J=1.7, 7.7 Гц,1H), 8.82 (dd, J=1.7, 4.7 Гц, 1H), 10.90 (d, J=0.7 Гц, 1 Н). Подготовительный пример 10b: [3-(2-бензолсульфонилпиридин-3-илметил)-5-фтор-2-метилиндол 1-ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-бензолсульфонилпиридин-3-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.28 (s, 3H), 3.77 (s, 3H), 4.60 (s, 2H), 4.82 (s, 2H), 6.71 (dd, J=2.4, 9.4 Гц, 1H), 6.88MS: ESI (+ve) (метод В): 453 (М+Н)+, время удерживания 3,8 мин. Подготовительный пример 10 с: [3-(2-бензолсульфонилпиридин-3-илметил)-5-фтор-2-метилиндол 1-ил]уксусная кислота Смесь [3-(2-бензолсульфонилпиридин-3-илметил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,16 г) и тетрагидрофурана (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 5:95 до 98:2 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,11 г). 1 Н ЯМР (DMSO-d6):2.26 (s, 3H), 4.55 (s, 2H), 4.94 (s, 2H), 6.86-6.89 (m, 2H), 7.35-7.42 (m, 2 Н), 7.45 Подготовительный пример 11 а: 3-бензолсульфонилпиридин-2-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 5 а, используя 3-фторпиридин-2-карбальдегид и натриевую соль бензолсульфиновой кислоты. 1 Н ЯМР (DMSO-d6):7.62-7.73 (m, 2H), 7.72-7.79 (m, 1H), 7.95 (dd, J=4.7, 8.1 Гц, 1H), 8.01-8.06 (m,2 Н), 8.67 (dd, J=1.4, 8.1 Гц, 1H), 9.05 (dd, J=1.4, 4.7 Гц, 1H), 10.36 (s, 1 Н). Подготовительный пример 11b: [3-(3-бензолсульфонилпиридин-2-илметил)-5-фтор-2-метилиндол 1-ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 3-бензолсульфонилпиридин-2-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1MS: ESI (+ve) (метод В): 453 (М+Н)+, время удерживания 3,7 мин. Подготовительный пример 11 с: [3-(3-бензолсульфонилпиридин-2-илметил)-5-фтор-2-метилиндол- 14017573 1-ил]уксусная кислота Смесь [3-(3-бензолсульфонилпиридин-2-илметил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,19 г) и тетрагидрофурана (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,62 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,15 г). 1 Н ЯМР (DMSO-d6):2.10 (s, 3H), 4.33 (s, 2H), 4.88 (s, 2H), 6.33 (dd, J=2.5, 10.1 Гц, 1H), 6.75 (dt,J=2.5, 9.2 Гц, 1H), 7.24 (dd, J=4.4, 8.9 Гц, 1H), 7.56 (dd, J=4.7, 8.0 Гц, 1H), 7.60-7.64 (m, 2 Н), 7.71-7.73 (m,1H), 7.91-7.94 (m, 2 Н), 8.53 (dd, J=1.7, 8.0 Гц, 1H), 8.67 (dd, J=1.7, 4.7 Гц, 1H), 13.01 (br s, 1H). Подготовительный пример 12 а: 2-(тиофен-2-илсульфанил)бензальдегид Смесь тиофен-2-тиола (1,5 мл), карбоната калия (8,0 г) и N,N-диметилформамида обрабатывали по каплям 2-фторбензальдегидом (1,7 мл) и полученную смесь перемешивали при комнатной температуре в течение 42 ч. Смесь обрабатывали, используя смесь лед/вода, экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (от 1:0 до 9:1 по объему), с последующей дистилляцией при 50C/11 мбар (1,1 кПа), что позволило получить указанное в заголовке соединение в виде красного масла (1,9 г). 1 Н ЯМР (CDCl3):6.97 (d, J=8.1 Гц, 1H), 7.16 (dd, J=3.6, 5.4 Гц, 1 Н), 7.29 (ddd, J=1.1, 7.5, 7.5 Гц,1H), 7.34 (dd, J=1.3, 3.6 Гц, 1H), 7.40 (ddd, J=1.7, 7.3, 8.1 Гц, 1H), 7.59 (dd, J=1.2, 5.3 Гц, 1H), 7.82 (dd,J=1.6, 7.5 Гц, 1H), 10.27 (s, 1H).MS: ESI (+ve) (метод В): время удерживания 3,8 мин. Подготовительный пример 12b: 2-(тиофен-2-сульфонил)бензальдегид Смесь 2-(тиофен-2-илсульфанил)бензальдегида (0,30 г) и дихлорметана (13 мл) обрабатывали порциями 3-хлорпероксибензойной кислоты (67%-ной в воде; 0,70 г) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли дихлорметаном (150 мл), промывали насыщенным водным раствором бикарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,29 г). 1 Н ЯМР (CDCl3):7.13 (dd, J=4.9, 3.9 Гц, 1H), 7.71-7.80 (m, 4H), 8.05 (m, 1H), 8.18 (m, 1H), 11.01 (d,J=0.6 Гц, 1H).MS: ESI (+ve) (метод В): время удерживания 3,3 мин. Подготовительный пример 12 с: 5-фтор-2-метил-3-[2-(тиофен-2-сульфонил)бензил]индол-1 илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-(тиофен-2-сульфонил)бензальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.21 (s, 3H), 3.76 (s, 3H), 4.42 (s, 2H), 4.81 (s, 2H), 6.43 (dd, J=2.4, 9.5 Гц, 1H), 6.85MS: ESI (+ve) (метод В): 458 (М+Н)+, время удерживания 4,0 мин. Подготовительный пример 12d: 5-фтор-2-метил-3-[2-(тиофен-2-сульфонил)бензил]индол-1 илуксусная кислота Смесь 5-фтор-2-метил-3-[2-(тиофен-2-сульфонил)бензил]индол-1-илуксусной кислоты метилового эфира (0,21 г) и тетрагидрофурана (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития(1,2 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли водой (25 мл), концентрировали для уменьшения объема при пониженном давлении и рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты. Смесь экстрагировали этилацетатом, объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата, содержащей 0,1% муравь- 15017573 иной кислоты (от 1:0 до 0:1 по объему), затем препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 3:7 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,14 г). 1 Н ЯМР (DMSO-d6):2.10 (s, 3H), 4.30 (s, 2H), 4.92 (S, 2H), 6.39 (dd, J=2.6, 9.7 Гц, 1H), 6.79 (ddd,J=2.3, 9.3, 9.3 Гц, 1H), 6.88 (dd, J=2.4, 6.9 Гц, 1H), 7.23 (dd, J=3.7, 4.8 Гц, 1H), 7.32 (dd, J=4.4, 8.8 Гц, 1H),7.41-7.49 (m, 2H), 7.89 (dd, J=1.3, 4.0 Гц, 1H), 8.08-8.12 (m, 2H), 13.00 (s, 1H). Подготовительный пример 13 а: 3-(тиофен-2-илсульфанил)тиофен-2-карбальдегид Смесь 3-хлортиофен-2-карбальдегида (1,0 г), карбоната калия (2,8 г) и N,N-диметилформамида (6,8 мл) обрабатывали по каплям тиофен-2-тиолом (0,87 г) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь выливали в воду (150 мл) и экстрагировали диэтиловым эфиром. Объединенный органический экстракт промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде красного масла (1,5 г). 1 Н ЯМР (CDCl3):6.72 (d, J=5.3 Гц, 1H), 7.09 (dd, J=3.5, 5.6 Гц, 1H), 7.34 (dd, J=1.3, 3.5 Гц, 1H),7.52 (dd, J=1.3, 5.3 Гц, 1H), 7.58 (dd, J=0.9, 5.2 Гц, 1H), 10.09 (d, J=1.0 Гц, 1 Н).MS: ESI (+ve) (метод В): время удерживания 3,6 мин. Подготовительный пример 13b: 3-(тиофен-2-сульфонил)тиофен-2-карбальдегид Смесь 3-(тиофен-2-илсульфанил)тиофен-2-карбальдегида (1,5 г) и дихлорметана (68 мл) обрабатывали 3-хлорпероксибензойной кислотой (70%-ной в воде; 4,6 г) и полученную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь разбавляли насыщенным водным раствором тиосульфата натрия (50 мл), экстрагировали диэтиловым эфиром, объединенный органический экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде коричневого твердого вещества (1,2 г). 1 Н ЯМР (CDCl3):7.15 (dd, J=3.8, 5.1 Гц, 1H), 7.53 (d, J=5.3 Гц, 1 Н), 7.70 (dd, J=1.3, 5.1 Гц, 1 Н),7.75 (dd, J=1.3, 4.8 Гц, 1H), 7.77 (dd, J=1.4, 3.8 Гц, 1H), 10.66 (d,J=1.3 Гц).MS: ESI (+ve) (метод В): время удерживания 3,3 мин. Подготовительный пример 13 с: 5-фтор-2-метил-3-[3-(тиофен-2-сульфонил)тиофен-2 илметил]индол-1-илуксусной кислоты метиловый эфир Смесь (5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,14 г), 3-(тиофен-2 сульфонил)тиофен-2-карбальдегида (0,12 г) и дихлорэтана (5,0 мл) при 0C обрабатывали по каплям смесью триэтилсилана (1,4 мл), трифторуксусной кислоты (0,35 мл) и дихлорэтана (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь охлаждали до 0C, разбавляли насыщенным водным раствором гидрокарбоната натрия и фазы разделяли. Водную фазу экстрагировали дихлорметаном, объединенный органический раствор сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (от 1:0 до 1:1 по объему), что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,17 г). 1 Н ЯМР (DMSO-d6):2.23 (s, 3H), 3.68 (s, 3H), 4.50 (s, 2 Н), 5.12 (s, 2 Н), 6.83 (dd, J=2.5, 9.7 Гц, 1H),6.89 (ddd, J=2.5, 9.2, 9.2 Гц, 1H), 7.28 (dd, J=3.8, 4.9 Гц, 1H), 7.36 (d, J=5.6 Гц, 1H), 7.39 (dd, J=4.3, 9.0 Гц,1H), 7.44 (d, J=5.6 Гц, 1H), 7.95 (dd, J=1.5, 3.8 Гц, 1H), 8.13 (dd, J=1.5,4.8 Гц, 1 Н).MS: ESI (+ve) (метод В): 464 (М+Н)+, время удерживания 3,9 мин. Подготовительный пример 13d: 5-фтор-2-метил-3-[3-(тиофен-2-сульфонил)тиофен-2 илметил]индол-1-илуксусная кислота Смесь 5-фтор-2-метил-3-[3-(тиофен-2-сульфонил)тиофен-2-илметил]индол-1-илуксусной кислоты метилового эфира (0,17 г), тетрагидрофурана (0,35 мл) и воды (0,35 мл) обрабатывали гидроксидом лития (0,088 г) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь охлаждали до 0C, рН подводили до 5 путем добавления 1,0 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Оста- 16017573 ток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 3:7 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,089 г). 1 Н ЯМР (DMSO-d6):2.19 (s, 3H), 4.46 (s, 2H), 4.93 (s, 2H), 6.77 (dd, J=2.6, 9.8 Гц, 1H), 6.83 (ddd,J=2.5, 9.2, 9.2 Гц, 1H), 7.24 (dd, J=4.0, 4.8 Гц), 7.31 (d, J=5.5 Гц), 7.34 (dd, J=4.4, 4.4 Гц), 7.39 (d, J=5.4 Гц,1H), 7.91 (dd, J=1.3, 3.5 Гц, 1H), 8.09(dd, J=1.3, 4.9 Гц,1H), 12.96 (br s, 1H). Подготовительный пример 14 а: 2-бензолсульфонил-4-хлорбензальдегид Указанное в заголовке соединение получали способом из подготовительного примера 5 а, используя 4-хлор-2-фторбензальдегид и натриевую соль бензолсульфиновой кислоты. 1 Н ЯМР (CDCl3):7.54-7.61 (m, 2 Н), 7.62-7.71 (m, 2 Н), 7.89-7.93 (m, 2 Н), 7.98 (d, J=8.3 Гц, 1H), 8.18(d, J=2.0 Гц, 1H), 10.79 (d, J=0.8 Гц, 1 Н). Подготовительный пример 14b: [3-(2-Бензолсульфонил-4-хлорбензил)-5-фтор-2-метилиндол-1 ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-бензолсульфонил-4-хлорбензальдегид и (5-фтор-2-метилиндол-1-ил)уксусной кислоты метиловый эфир. 1 Н ЯМР (DMSO-d6):2.04 (s, 3H), 3.67 (s, 3H), 4.11 (s, 2H), 5.08 (s, 2H), 6.18 (dd, J=2.5, 9.8 Гц, 1H),6.79-6.88 (m, 2 Н), 7.35 (dd, J=4.4, 8.9 Гц, 1H), 7.59-7.72 (m, 3H), 7.78 (d, J=7.3 Гц, 1H), 8.01-8.06 (m, 2 Н),8.21 (d, J=2.3 Гц, 1 Н).MS: ESI (+ve) (метод В): 486 (М+Н)+, время удерживания 4,2 мин. Подготовительный пример 14 с: [3-(2-бензолсульфонил-4-хлорбензил)-5-фтор-2-метилиндол-1 ил]уксусная кислота Раствор [3-(2-бензолсульфонил-4-хлорбензил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,16 г) в тетрагидрофуране (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,15 г). 1 Н ЯМР (DMSO-d6):2.04 (s, 3H), 4.10 (s, 2H), 4.92 (s, 2H), 6.18 (dd, J=2.5, 9.7 Гц, 1H), 6.81 (dt,J=2.5, 9.2 Гц, 1H), 6.87 (d, J=8.4 Гц, 1H), 7.34 (dd, J=4.4, 8.9 Гц, 1H), 7.61 (dd, J=2.4, 8.4 Гц, 1H), 7.67-7.71 Подготовительный пример 15 а: 3-бензолсульфонил-4-формилбензонитрил Указанное в заголовке соединение получали способом из подготовительного примера 5 а, используя 3-фтор-2-фенилсульфанилбензальдегид. 1 Н ЯМР (CDCl3):7.74-7.58 (m, 3H), 7.91-8.01 (m, 3H), 8.11 (d, J=8.0 Гц, 1H), 8.42 (d, J=1.6 Гц, 1H),10.89 (d, J=0.8 Гц, 1 Н). Подготовительный пример 15b: [3-(2-бензолсульфонил-4-цианобензил)-5-фтор-2-метилиндол-1 ил]уксусной кислоты метиловый эфир- 17017573 Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 3-бензолсульфонил-4-формилбензонитрил и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (DMSO-d6):2.02 (s, 3H), 3.65 (s, 3H), 4.19 (s, 2H), 5.07 (s, 2H), 6.17 (dd, J=2.6, 9.7 Гц, 1H),6.83 (dt, J=2.4, 9.0 Гц, 1H), 7.01 (d, J=8.1 Гц, 1H), 7.36 (dd, J=4.4, 9.0 Гц, 1H), 7.70 (t, J=7.8 Гц, 2 Н), 7.79 (t,J=7.8 Гц, 1H), 8.00 (dd, J=1.9, 8.1 Гц, 1H), 8.07 (d, J=7.1 Гц, 2 Н), 8.61 (d, J=1.8 Гц, 1 Н). Подготовительный пример 15 с: [3-(2-бензолсульфонил-4-цианобензил)-5-фтор-2-метилиндол-1 ил]уксусная кислота Раствор [3-(2-бензолсульфонил-4-цианобензил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,11 г) в тетрагидрофуране (0,30 мл) обрабатывали 1,0 М водным раствором гидроксида лития (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь подкисляли путем добавления 1,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 19:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,058 г). 1 Н ЯМР (DMSO-d6):2.04 (s, 3H), 4.21 (s, 2H), 4.93 (s, 2H), 6.16 (dd, J=2.5, 9.7 Гц, 1H), 6.82 (dt,J=2.5, 9.1 Гц, 1H), 7.03 (d, J=8.2 Гц, 1H), 7.35 (dd, J=4.4, 8.7 Гц, 1H), 7.69 (t, J=7.4 Гц, 2 Н), 7.80 (m, 1H),7.98 (dd, J=1.8, 8.2 Гц, 1H), 8.08 (dd, J=1.5, 7.9 Гц, 2 Н), 8.62 (d, J=1.8 Гц, 1H), 13.03 (br s, 1 Н). Подготовительный пример 16 а: 3-(пиридин-2-сульфонил)тиофен-2-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 5 а, используя 2-формил-3-хлортиофен и натриевую соль пиридин-2-сульфиновой кислоты. 1 Н ЯМР (CDCl3):7.52 (ddd, J=1.2, 4.6, 7.5 Гц, 1H), 7.58 (d, J=5.2 Гц, 1H), 7.69 (dd, J=1.2, 5.2 Гц,1H), 7.98 (td, J=1.7, 7.8 Гц, 1H), 8.24 (dt, J=1.0, 7.9 Гц, 1H), 8.70 (ddd, J=0.9,1.7, 4.7 Гц, 1H), 10.70 (d, J=1.2 Гц, 1 Н). Подготовительный пример 16b. 5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2 илметил]индол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 3-(пиридин-2-сульфонил)тиофен-2-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.34 (s, 3H), 3.76 (s, 3H), 4.71 (s, 2H), 4.81 (s, 2H), 6.82-6.95 (m, 2 Н), 7.01-7.10 (m,2 Н), 7.41 (d, J=5.4 Гц, 1H), 7.53 (ddd, J=1.2, 4.7, 7.7 Гц, 1H), 7.96 (td, J=1.8. 7.8 Гц, 1H), 8.21 (dt, J=1.0, 7.9 Гц, 1H), 8.79 (ddd, J=0.9, 1.7, 4.7 Гц, 1 Н). Подготовительный пример 16 с: 5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2 илметил]индол-1-илуксусная кислота Раствор 5-фтор-2-метил-3-[3-(пиридин-2-сульфонил)тиофен-2-илметил]индол-1-илуксусной кислоты метилового эфира (0,050 г) в тетрагидрофуране (0,30 мл) обрабатывали 1,0 М водным раствором гидроксида лития (1,0 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь обрабатывали 5,0 М водным раствором гидроксида натрия (1,0 мл) и перемешивали при комнатной температуре в течение 3 ч и затем при 40C в течение ночи. Смесь подкисляли путем добавления водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 19:1 по объему),что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,020 г). 1 Н ЯМР (DMSO-d6):2.20 (s, 3H), 4.50 (s, 2H), 4.89 (s, 2H), 6.82 (m, 2H), 7.27-7.33 (m, 2 Н), 7.37 (d,J=5.4 Гц, 1H), 7.71 (ddd, J=1.2, 4.7, 7.6 Гц, 1H), 8.13 (td, J=1.8, 7.8 Гц, 1H), 8.19 (dt, J=1.1, 7.7 Гц, 1H), 8.73 Подготовительный пример 17 а: 4-(4-хлорфенилсульфанил)тиофен-3-карбоновой кислоты метиловый эфир Смесь 4-(4-хлорфенилсульфанил)тиофен-3-карбоновой кислоты (1,0 г), гидрокарбоната натрия (1,6 г), йодметана (2,3 мл) и N,N-диметилформамида (10 мл) перемешивали при 40 C в течение 5 часов. Смесь охлаждали до комнатной температуры, разбавляли водой (100 мл) и водную фазу экстрагировали этилацетатом. Объединенный органический экстракт сушили над сульфатом магния и концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение в виде желтого масла (1,0 г). 1 Н ЯМР (DMSO-d6):3.77 (d, J=0.6 Гц, 3H), 6.96 (dd, J=0.6, 3.4 Гц, 1H), 7.41-7.52 (m, 4 Н), 8.49 (dd,J=0.6, 3.4 Гц, 1 Н). Подготовительный пример 17b: 4-(4-хлорбензолсульфонил)тиофен-3-карбоновой кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1b, используя 4-(4-хлорфенилсульфанил)тиофен-3-карбоновой кислоты метиловый эфир. 1 Н ЯМР (DMSO-d6):3.7 (d, J=0.5 Гц, 3H), 7.67-7.73 (m, 2H), 7.88-7.93 (m, 2 Н), 8.45 (dd, J=0.5, 3.4 Гц, 1H), 8.74 (dd, J=0.5, 3.4 Гц, 1 Н). Подготовительный пример 17 с: [4-(4-хлорбензолсульфонил)тиофен-3-ил]метанол Указанное в заголовке соединение получали способом из подготовительного примера 6b, используя 4-(4-хлорбензолсульфонил)тиофен-3-карбоновой кислоты метиловый эфир. 1 Н ЯМР (CDCl3):4.62 (d, J=6.3 Гц, 2 Н), 4.69 (s, 1H), 7.37 (d, J=3.5 Гц, 1H), 7.48-7.54 (m, 2 Н), 7.857.91 (m, 2 Н), 8.19 (d, J=3.4 Гц, 1 Н). Подготовительный пример 17d: 4-(4-хлорбензолсульфонил)тиофен-3-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 6 с, используя[4-(4-хлорбензолсульфонил)тиофен-3-ил]метанол. 1 Н ЯМР (DMSO-d6):7.67-7-73 (m, 2H), 7.97-8.02 (m, 2H), 8.69-8.72 (m, 2H), 9.96 (s, 1H). Подготовительный пример 17 е: 3-[4-(4-хлорбензолсульфонил)тиофен-3-илметил]-5-фтор-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 4-(4-хлорбензолсульфонил)тиофен-3-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир.MS: ESI (+ve) (метод В): 492 (М+Н)+, время удерживания 4,1 мин. Подготовительный пример 17f: 3-[4-(4-хлорбензолсульфонил)тиофен-3-илметил]-5-фтор-2 метилиндол-1-илуксусная кислота Смесь 3-[4-(4-хлорбензолсульфонил)тиофен-3-илметил]-5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,35 г) и тетрагидрофурана (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (1,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,30 г). 1 Н ЯМР (DMSO-d6):2.13 (s, 3H), 3.94 (s, 2H), 4.89 (s, 2 Н), 6.35 (dd, J=2.5, 9.8 Гц, 1H), 6.80 (dt,J=2.5, 9.2 Гц, 1H), 6.96 (d, J=3.3 Гц, 1H), 7.28 (dd, J=4.4, 8.9 Гц, 1H), 7.57-7.60 (m, 2H), 7.77-7.80 (m, 2 Н),8.60 (d, J=3.3 Гц, 1H), 13.0 (br s, 1H).- 19017573 Подготовительный пример 18 а: [3-(4-бензолсульфонилтиофен-3-илметил)-5-фтор-2-метилиндол-1 ил]уксусная кислота Смесь 3-[4-(4-хлорбензолсульфонил)тиофен-3-илметил]-5-фтор-2-метилиндол-1-илуксусной кислоты (0,031 г), триэтиламина (0,300 мл), палладия на угле (0,012 г) и этанола (5,0 мл) перемешивали в атмосфере водорода при 40C в течение 15 ч. Смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде бледно-желтого твердого вещества (0,024 г). 1 Н ЯМР (DMSO-d6):2.07 (s, 3H), 3.89 (s, 2H), 4.80 (s, 2H), 6.39 (dd, J=2.5, 9.8 Гц, 1H), 6.77-6.82 (m,2 Н), 7.28 (dd, J=4.4, 8.8 Гц, 1H), 7.61-7.65 (m, 2H), 7.70-7.74 (m, 1H), 7.89-7.92 (m, 2 Н), 8.56 (d, J=3.4 Гц,1H), 13.0 (br s, 1H). Подготовительный пример 19 а: [5-фтор-3-(2-бензолсульфонилтиофен-3-илметил)-2-метилиндол-1 ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-фенилсульфонилтиофен-3-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.20 (s, 3H), 3.74 (s, 3H), 4.16 (s, 2H), 4.75 (s, 2H), 6.49 (dd, J=2.5, 9.5 Гц, 1H), 6.57MS: ESI (+ve) (метод В): 458 (М+Н)+, время удерживания 3,9 мин. Подготовительный пример 19b: [5-фтор-3-(2-бензолсульфонилтиофен-3-илметил)-2-метилиндол-1 ил]уксусная кислота Смесь [5-фтор-3-(2-бензолсульфонилтиофен-3-илметил)-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,18 г), тетрагидрофурана (4,0 мл) и метанола (2,0 мл) обрабатывали 1,0 М водным раствором гидроксида натрия (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления 1,0 М водного раствора соляной кислоты и концентрировали для уменьшения объема при пониженном давлении. Полученный осадок собирали фильтрованием, промывали водой и сушили, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,16 г). 1 Н ЯМР (DMSO-d6):2.11 (s, 3H), 4.09 (s, 2H), 4.88 (s, 2H), 6.51-6.56 (m, 2H), 6.78 (td, J=2.6, 9.2 Гц,1H), 7.28 (dd, J=4.4, 8.9 Гц, 1H), 7.59-7.65 (m, 2 Н), 7.67-7.73 (m, 1H), 7.82 (d, J=5.2 Гц, 1H), 7.94-7.98 (m,2 Н), 12.95 (br s, 1H). Подготовительный пример 20 а: [5-фтор-2-метил-3-(2-сульфобензил)индол-1-ил]уксусной кислоты метиловый эфир Смесь (5-фтор-2-метилиндол-1-ил)уксусной кислоты метилового эфира (1,0 г), натриевой соли 2 формилбензолсульфоновой кислоты (0,94 г) и 1,2-дихлорэтана (15 мл) при 0C обрабатывали по каплям смесью триэтилсилана (4,3 мл), трифторуксусной кислоты (1,0 мл) и 1,2-дихлорэтана (10 мл) и полученную смесь перемешивали при комнатной температуре в течение 6 ч. Смесь экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью метанола и дихлорметана (от 0:1 до 1:9 по объему), что позволило получить указанное в заголовке соединение в виде пурпурного смолообразного вещества (1,3 г). Подготовительный пример 20b: [3-(2-хлорсульфонилбензил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метиловый эфир- 20017573 Смесь [5-фтор-2-метил-3-(2-сульфобензил)индол-1-ил]уксусной кислоты метилового эфира (0,30 г) и дихлорметана (1,5 мл) обрабатывали порциями пентахлорида фосфора (0,15 г), затем N,Nдиметилформамидом (0,070 мл) и полученную смесь нагревали при температуре дефлегмации в течение ночи. Смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и разбавляли дихлорметаном. Смесь промывали водой, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя дихлорметаном, что позволило получить указанное в заголовке соединение в виде желтого твердого вещества[5-фтор-2-метил-3-(2-фенилсульфамоил-бензил)индол-1 ил]уксусной кислоты метиловый эфир Смесь анилина (0,022 мл), триэтиламина (0,051 мл) и дихлорметана (0,5 мл) обрабатывали [3-(2 хлорсульфонилбензил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метиловым эфиром (0,10 г) и полученную смесь перемешивали при комнатной температуре в течение 4 суток. Смесь разбавляли дихлорметаном, промывали водой и концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение в виде бесцветного смолообразного вещества (0,078 г).(0,078 г) и тетрагидрофурана (0,5 мл) обрабатывали 2,0 М водным раствором гидроксида натрия (1,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь подкисляли путем добавления 2,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 19:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,055 г). 1 Н ЯМР (DMSO-d6):2.21 (s, 3H), 4.41 (s, 2H), 4.97 (s, 2H), 6.75 (dd, J=2.5, 9.8 Гц, 1H), 6.82-6.89 (m,2 Н), 7.02 (t, J=7.3 Гц, 1H), 7.16 (d, J=7.8 Гц, 2 Н), 7.25 (t, J=7.3 Гц, 2 Н), 7.29-7.40 (m, 3H), 7.97 (dd, J=1.8,7.5 Гц, 1H), 10.60 (br s, 1H), 12.95 (br s, 1H). Подготовительный пример 21 а: 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)бензил]индол-1 илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 20 с, используя [3-(2-хлорсульфонилбензил)-5-фтор-2-метилиндол-1-ил]уксусной кислоты метиловый эфир и Nметиланилин.MS: ESI (+ve) (метод В): 481 (М+Н)+, время удерживания 4,2 мин. Подготовительный пример 21b: 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)бензил]индол-1 илуксусная кислота Смесь 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)бензил]индол-1-илуксусной кислоты метилового эфира (0,10 г) и тетрагидрофурана (0,5 мл) обрабатывали 2,0 М водным раствором гидроксида натрия (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 15 ч. Смесь подкисляли путем добавления 2,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 1:9 по объему), что позволило получить указанное в заголовке соединение в виде бледно-желтого твердого вещества (0,083 г). 1 Н-ЯМР (DMSO-d6):2.10 (s, 3H), 3.23 (s, 3H), 3.95 (s, 2H), 4.88 (s, 2H), 6.73 (dd, J=2.5, 9.9 Гц, 1H),6.82 (td, J=2.2, 9.1 Гц, 1H), 6.85 (d, J=7.4 Гц, 1H), 7.32 (m, 8H), 7.79 (dd, J=2.0, 7.9 Гц, 1 Н). Подготовительный пример 22 а: 4-фенилсульфонилпиридин-3-карбальдегид Смесь 4-бромпиридин-3-карбальдегида (0,90 г), натриевой соли бензолсульфиновой кислоты (4,0 г),иодида меди(I) (4,6 г) и 1-метил-2-пирролидинона (50 мл) нагревали при 60C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через Целит. Фильтрат промывали водой, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (от 1:0 до 0:1 по объему), что позволило получить указанное в заголовке соединение в виде желтого масла(1,9 г). 1 Н ЯМР (CDCl3):7.56-7.74 (m, 3H), 7.88-7.98 (m, 3H), 9.05 (s, 1H), 9.21 (s, 1H), 10.92 (s, 1H). Подготовительный пример 22b: [5-фтор-3-(4-фенилсульфонилпиридин-3-илметил)-2-метилиндол-1 ил]уксусной кислоты метиловый эфир Смесь триэтилсилана (5,1 г), трифторуксусной кислоты (3,1 г) и 1,2-дихлорэтана (20 мл) при -10C обрабатывали по каплям смесью 4-фенилсульфонилпиридин-3-карбальдегида (1,9 г), (5-фтор-2 метилиндол-1-ил)уксусной кислоты метилового эфира (0,66 г) и 1,2-дихлорэтана (20 мл) и полученную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь обрабатывали дополнительным количеством триэтилсилана (5,1 г) и трифторуксусной кислоты (3,1 г), перемешивали при комнатной температуре в течение 3 ч и затем при 60C в течение 20 ч. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле,элюируя смесью циклогексана и этилацетата (от 1:0 до 0:1 по объему), с последующим растиранием с диэтиловым эфиром, что позволило получить указанное в заголовке соединение в виде желтого порошка(0,19 г). 1 Н ЯМР (CDCl3):2.16 (s, 3H), 3.72 (s, 3H), 4.23 (s, 2H), 4.75 (S, 2H), 6.25 (dd, J=2.6, 9.3 Гц, 1H),6.81 (dt, J=2.6, 8.9 Гц, 1H), 7.03 (dd, J=4.1, 8.9 Гц, 1H), 7.57 (t, J=7.8 Гц, 2 Н), 7.67 (t, J=7.5 Гц, 1H), 7.95 (d,J=7.6 Гц, 2 Н), 8.00 (d, J=5.0 Гц, 1H), 8.19 (s, 1H), 8.67 (d, J=5.0 Гц, 1 Н). Подготовительный пример 22 с. [5-фтор-3-(4-фенилсульфонилпиридин-3-илметил)-2-метилиндол-1 ил]уксусная кислота Смесь [5-фтор-3-(4-фенилсульфонилпиридин-3-илметил)-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,19 г) и тетрагидрофурана (1,0 мл) обрабатывали 2,0 М водным раствором гидроксида натрия (3,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь подкисляли путем добавления 1,0 М водного раствора соляной кислоты и полученный осадок собирали фильтрованием, что позволило получить указанное в заголовке соединение в виде бледно-желтого порошка (0,15 г). 1 Н ЯМР (DMSO-d6):2.08 (s, 3H), 4.17 (s, 2H), 4.90 (s, 2H), 6.23 (dd, J=2.7, 9.8 Гц, 1H), 6.78 (td,J=2.6, 9.3 Гц, 1H), 7.31 (dd, J=4.5, 8.9 Гц, 1H), 7.65 (t, J=7.6 Гц, 2 Н), 7.76 (t, J=7.5 Гц, 1H), 7.96-8.01 (m,3H), 8.08 (s, 1H), 8.71 (d, J=5.1 Гц, 1H), 12.91 (br s, 1H).(0,30 г) и диметилсульфоксида (2,0 мл) нагревали при 80C в течение 3 ч и затем при 90C в течение 3 ч. Смесь разбавляли водой, экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде серого твердого вещества (0,079 г). 1 Н ЯМР (CDCl3):7.50-7.57 (m, 2 Н), 7.75 (dd, J=1.2, 5.2 Гц, 1H), 8.23-8.28 (m, 1H), 8.88 (s, 1H), 9.20- 22017573 Смесь триэтилсилана (0,42 г), трифторуксусной кислоты (0,25 г) и 1,2-дихлорэтана (2,0 мл) при -10C обрабатывали по каплям смесью (5-фтор-2-метилиндол-1-ил)уксусной кислоты метилового эфира (0,055 г), 3(пиридин-3-сульфонил)тиофен-2-карбальдегида (0,075 г) и 1,2-дихлорэтана (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь обрабатывали дополнительным количеством триэтилсилана (0,42 г) и трифторуксусной кислоты (0,25 г), перемешивали при комнатной температуре в течение 3 ч и затем при 60 С в течение 20 ч. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью диэтилового эфира и этилацетата (от 1:0 до 0:1 по объему), с последующим растиранием с диэтиловым эфиром, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,027 г). 1 Н ЯМР (CDCl3):2.26 (s, 3H), 3.72 (s, 3H), 4.43 (s, 2H), 4.77 (s, 2H), 6.67 (dd, J=2.4, 6.9 Гц, 1H), 6.83(5-фтор-3-[3-(пиридин-3-сульфонил)тиофен-2-илметил]-2 метилиндол-1-илуксусная кислота Смесь 5-фтор-3-[3-(пиридин-3-сульфонил)тиофен-2-илметил]-2-метилиндол-1-илуксусной кислоты метилового эфира (0,025 г) и тетрагидрофурана (0,8 мл) обрабатывали 2,0 М водным раствором гидроксида натрия (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления 1,0 М водного раствора соляной кислоты, экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток растирали с диэтиловым эфиром, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,020 г). 1 Н ЯМР (DMSO-d6):2.17 (s, 3H), 4.45 (s, 2H), 4.92 (S, 2H), 6.72 (dd, J=2.5, 9.8 Гц, 1H), 6.82 (td,J=2.6, 9.1 Гц, 1H), 7.32 (dd, J=4.4, 8.8 Гц, 1H), 7.40-7.44 (m, 2 Н), 7.63 (dd, J=4.8, 8.1 Гц, 1H), 8.35-8.39 (m,1H), 8.85 (dd, J=1.8, 4.9 Гц, 1H), 9.13-9.16 (m, 1H), 12.98 (br s, 1H). Подготовительный пример 24 а: 3-(пиридин-4-илсульфанил)тиофен-2-карбальдегид Смесь 4-меркаптопиридина (1,0 г), карбоната калия (3,7 г) и диметилсульфоксида (10 мл) при 0 С обрабатывали 3-хлортиофен-2-карбальдегидом (1,3 г) и полученную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь распределяли между этилацетатом и водой, органическую фазу промывали водой и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и петролейного эфира (от 1:9 до 3:2 по объему), что позволило получить указанное в заголовке соединение в виде желтого масла (1,3 г). 1 Н-ЯМР (CDCl3)7.01 (m, 2 Н), 7.16 (d, J=5.0 Гц, 1H), 7.85 (dd, J=1.3, 5.0 Гц, 1H), 8.44 (d, J=5.0 Гц,2 Н), 10.12 (s, 1H). Подготовительный пример 24b: 5-фтор-2-метил-3-[3-(пиридин-4-илсульфанил)тиофен-2 илметил]индол-1-илуксусной кислоты метиловый эфир Смесь 3-(пиридин-4-илсульфанил)тиофен-2-карбальдегида (1,3 г), (5-фтор-2-метилиндол-1 илуксусной кислоты метилового эфира (1,3 г) и 1,2-дихлорэтана (30 мл) при -10C обрабатывали смесью триэтилсилана (5,8 мл), трифторуксусной кислоты (2,4 мл) и 1,2-дихлорэтана (20 мл) и полученную смесь перемешивали при комнатной температуре в течение 48 ч. Смесь разбавляли дихлорметаном, промывали водным раствором бикарбоната натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом, что позволило получить указанное в заголовке соединение в виде желтого пенообразного вещества (2,4 г). 1 Н-ЯМР (CDCl3)2.28 (s, 3H), 3.73 (s, 3H), 4.21 (s, 2 Н), 4.69 (s, 2H), 6.81 (dd, J=1.6, 4.5 Гц, 2 Н), 6.87(m, 1H), 7.02 (m, 2 Н), 7.08 (dd, J=2.4, 9.5 Гц, 1H), 7.20 (d, J=5.3 Гц, 1H), 8.28 (dd, J=1.6, 4.6 Гц, 2 Н). Подготовительный пример 24 с: 5-фтор-2-метил-3-[3-(пиридин-4-сульфонил)тиофен-2 илметил]индол-1-илуксусной кислоты метиловый эфир Смесь 5-фтор-2-метил-3-[3-(пиридин-4-илсульфанил)тиофен-2-илметил]индол-1-илуксусной ки- 23017573 слоты метилового эфира (0,20 г) и дихлорметана (2 мл) при 0 С обрабатывали по каплям раствором 3 хлорпероксибензойной кислоты (0,16 г) в дихлорметане (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь охлаждали до 0 С, обрабатывали дополнительным количеством 3-хлорпероксибензойной кислоты (0,16 г) и перемешивали при температуре 0 С в течение 1 ч. Смесь распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия и водную фазу экстрагировали этилацетатом. Объединенную органическую фазу сушили над сульфатом натрия и концентрировали при пониженном давлении, что позволило получить коричневое масло. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (от 9:1 до 0:10 по объему). После дополнительной очистки препаративной обращенно-фазовой HPLC с элюированием смесью ацетонитрила и воды (от 1:9 до 9:1 по объему) получали указанное в заголовке соединение в виде желтого твердого вещества (0,026 г).MS: ESI (+ve) (метод В): 459 (М+Н)+, время удерживания 2,4 мин. Подготовительный пример 24d: 5-фтор-2-метил-3-[3-(пиридин-4-сульфонил)тиофен-2 илметил]индол-1-илуксусная кислота Смесь 5-фтор-2-метил-3-[3-(пиридин-4-сульфонил)тиофен-2-илметил]индол-1-илуксусной кислоты метилового эфира (0,026 г) и тетрагидрофурана (0,5 мл) обрабатывали 2,0 М водным раствором гидроксида натрия (2,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь подкисляли путем добавления 2,0 М водного раствора соляной кислоты и концентрировали при пониженном давлении. Остаток очищали препаративной HPLC, элюируя смесью ацетонитрила и воды(от 1:19 до 1:1 по объему), что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,015 г). 1 Н-ЯМР (CDCl3)1.76 (s, 3H), 3.39 (d, J=17.0 Гц, 1H), 4.39 (d, J=17.7 Гц, 1H), 4.52 (d, J=17.7 Гц,1H), 4.56 (d, J=17.0 Гц, 1H), 6.90 (m, 2H), 7.11 (d, J=5.3 Гц, 1H), 7.22 (m, 1H), 7.42 (dd, J=8.3, 2.9 Гц, 1H),7.49 (d, J=5.3 Гц, 1H), 7.63 (dd, J=8.7, 5.0 Гц, 1H), 8.30 (m,2H). Подготовительный пример 25 а: натриевая соль 3-хлорбензолсульфиновой кислоты Раствор 3-хлорбензолсульфонилхлорида (3,0 г) в диоксане (40 мл) обрабатывали смесью гидрокарбоната натрия (2,7 г), сульфита натрия (3,6 г) и воды (20 мл) и полученную смесь перемешивали при 75C в течение 30 мин. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растирали с этанолом, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,20 г). Подготовительный пример 25b: 2-(3-хлорбензолсульфонил)пиридин-3-карбальдегид Указанное в заголовке соединение получали способом из подготовительного примера 5 а, используя 2-хлорпиридин-3-карбальдегид и натриевую соль 3-хлорбензолсульфиновой кислоты. 1 Н ЯМР (CDCl3):7.40-7.56 (m, 1H), 7.60-7.67 (m, 2H), 7.92-7.96 (m, 1H), 8.02-8.04 (m, 1H), 8.40(dd, J=1.7, 7.9 Гц, 1H), 8.71 (dd, J=1.7, 4.6 Гц, 1H), 11.12 (d, J=0.8 Гц, 1 Н). Подготовительный пример 25 с: 3-[2-(3-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2 метилиндол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-(3-хлорбензолсульфонил)пиридин-3-карбальдегид и (5-фтор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.30 (s, 3H), 3.77 (s, 3H), 4.63 (s, 2 Н), 4.83 (s, 2H), 6.84 (dd, J=2.3, 9.5 Гц, 1H), 6.91MS: ESI (+ve) (метод В): 487 (M+H)+, время удерживания 4,0 мин. Подготовительный пример 25d: 3-[2-(3-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2 метилиндол-1-илуксусная кислота Смесь 3-[2-(3-хлорбензолсульфонил)пиридин-3-илметил]-5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,10 г) и тетрагидрофурана (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,31 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении и рН подводили до 4 путем добавления 0,1 М водного- 24017573 раствора соляной кислоты. Смесь экстрагировали этилацетатом, объединенный экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,085 г). 1 Н ЯМР (DMSO-d6):2.24 (s, 3H), 4.53 (s, 2H), 4.93 (s, 2 Н), 6.84 (dt, J=2.5, 9.2 Гц, 1H), 6.88 (dd,J=2.5, 9.8 Гц, 1H), 7.34-7.37 (m, 1H), 7.40 (dd, J=1.6, 8.0 Гц, 1H), 7.43-7.46 (m, 1H), 7.67-7.71 (m, 1H), 7.827.86 (m, 1H), 7.93-7.95 (m, 2H), 8.33 (dd, J=1.6, 4.4 Гц, 1H), 13.1 (br s, 1H). Подготовительный пример 26 а: (5-хлор-2-метилиндол-1-ил)уксусной кислоты метиловый эфир Смесь (5-хлор-2-метилиндол-1-илуксусной кислоты (25 г), карбоната калия (100 г) и N,Nдиметилформамида (220 мл) обрабатывали по каплям метилбромацетатом (37 г) и полученную смесь перемешивали при 60 С в течение 2 суток. Смесь охлаждали до комнатной температуры и распределяли между водой и этилацетатом. Водный слой экстрагировали этилацетатом и объединенный органический раствор промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и пентана (от 1:10 до 1:0 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (27 г). 1 Н ЯМР (CDCl3):2.36 (s, 3H), 3.72 (s, 3H), 4.74 (s, 2H), 6.23 (s, 1H), 7.03-7.09 (m, 2H), 7.47 (d, J=1.5 Гц, 1 Н). Подготовительный пример 26b: 5-хлор-3-[2-(бензолсульфонил)пиридин-2-илметил]-3-метилиндол 1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 2-(бензолсульфонил)пиридин-3-карбальдегид и (5-хлор-2-метилиндол-1-илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.25 (s, 3H), 3.72 (s, 3H), 4.52 (s, 2H), 4.88 (s, 2H), 7.01-7.08 (m, 2 Н), 7.36-7.40 (m,3H), 7.65-7.70 (m, 3H), 7.95 (dt, J=1.5, 8.4 Гц, 2 Н), 8.30 (dd, J=1.6,4.6 Гц, 1 Н). Подготовительный пример 26 с: 5-хлор-3-[2-(бензолсульфонил)пиридин-2-илметил]-3-метилиндол 1-илуксусная кислота Смесь 5-хлор-3-[2-(бензолсульфонил)пиридин-2-илметил]-3-метилиндол-1-илуксусной кислоты метилового эфира (0,15 г) и тетрагидрофурана (1,3 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (1,7 мл) и полученную смесь перемешивали при 40 С в течение 2 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,23 г). 1 Н ЯМР (DMSO-d6):2.23 (s, 3H), 4.51 (s, 2H), 4.95 (s, 2H), 7.00 (dd, J=2.2, 8.7 Гц, 1H), 7.08 (d, J=1.9 Гц, 1H), 7.32-7.44 (m, 3H), 7.66 (m, 2H), 7.76 (tt, J=1.3, 7.5 Гц, 1H), 7.97 (dt, J=1.6, 8.3 Гц, 2 Н), 8.33 (dd,J=1.6, 4.5 Гц, 1H), 13.00 (br s, 1H).- 25017573 Смесь 2-хлорбензолсульфонилхлорида (2,5 г) и диоксана (35 мл) обрабатывали смесью бикарбоната натрия (2,0 г), сульфита натрия (3,0 г) и воды (17 мл) и полученную смесь нагревали при 75 С в течение 30 мин. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растирали с этанолом, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растирали с ацетонитрилом, что позволило получить указанное в заголовке соединение в виде белого твердого вещества (2,3 г). 1 Н ЯМР (CD3OD):7.31 (dd, J=1.2, 4.8 Гц, 2 Н), 7.34-7.40 (m, 1H), 7.86 (ddd, J=0.8, 1.2, 7.5 Гц, 1 Н). Подготовительный пример 27b: 2-(2-Хлорбензолсульфонил)пиридин-3-карбальдегид Смесь натриевой соли 2-хлорбензолсульфиновой кислоты (0,55 г), 2-хлорпиридинкарбальдегида(0,35 г) и диметилсульфоксида (10 мл) нагревали при 100 С в течение 2 суток. Смесь охлаждали до комнатной температуры и распределяли между водой и дихлорметаном. Водный слой экстрагировали дихлорметаном и объединенный органический раствор промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и пентана (от 0:1 до 3:2 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества(dd, J=1.9, 7.6 Гц, 1H), 8.67 (dd, J=1.7, 4.6 Гц, 1H), 11.20 (d, J=0.8 Гц, 1 Н). Подготовительный пример 27 с: 5-фтор-3-[2-(2-хлорбензолсульфонил)пиридин-3-илметил]-2 метилиндол-1-илуксусной кислоты метиловый эфир Смесь триэтилсилана (0,76 мл), трифторуксусной кислоты (0,61 мл) и 1,2-дихлорэтана (3,0 мл) при -10C обрабатывали по каплям смесью (5-фтор-2-метилиндол-1-илуксусной кислоты метилового эфира (0,070 г), 2(2-хлорбензолсульфонил)пиридин-3-карбальдегида (0,089 г) и 1,2-дихлорэтана (6,0 мл) и полученную смесь перемешивали при -10 С в течение 15 мин и затем при комнатной температуре в течение 4 ч. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и пентана (от 1:4 до 4:1 по объему). После дополнительной очистки кристаллизацией из этилацетата и пентана получали указанное в заголовке соединение в виде белого твердого вещества (0,11 г). 1 Н ЯМР (CDCl3):2.31 (s, 3H), 3.77 (s, 3H), 4.66 (s, 2H), 4.84 (s, 2 Н), 6.91 (dddd, J=2.4, 2.5, 6.8, 8.9 Гц, 2 Н), 7.12 (dd, J=4.1, 8.7 Гц, 1H), 7.23 (dd, J=4.5, 7.9 Гц, 1H), 7.40 (dd, J=1.0, 7.9 Гц, 1H), 7.51-7.64 (m,3H), 8.29 (dd, J=1.3, 4.5 Гц, 1H), 8.40 (dd, J=1.8, 7.5 Гц, 1 Н). Подготовительный пример 27d: 5-Фтор-3-[2-(2-хлорбензолсульфонил)пиридин-3-илметил]-2 метилиндол-1-илуксусная кислота Смесь 5-фтор-3-[2-(2-хлорбензолсульфонил)пиридин-3-илметил]-2-метилиндол-1-илуксусной кислоты метилового эфира и тетрагидрофурана (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (1,2 мл) и полученную смесь перемешивали при 45 С в течение 4 ч. Смесь подкисляли путем добавления 5,0 М водного раствора соляной кислоты и экстрагировали дихлорметаном. Объединенный органический экстракт сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 2:3 до 9:1 по объему), что позволило получить указанное в заголовке соединение в виде белого твердого вещества (0,10 г). 1 Н ЯМР (DMSO-d6):2.28 (s, 3H), 4.54 (s, 2H), 4.96 (s, 2H), 6.85 (dt, J=2.7, 9.3 Гц, 1H), 7.05 (dd,J=2.7, 9.7 Гц, 1H), 7.35-7.47 (m, 3H), 7.68 (dt, J=1.4, 8.0 Гц, 2 Н), 7.76 (dt, J=1.6, 6.7 Гц, 1H), 8.25 (dd. J=1.8,7.9 Гц, 1H), 8.29 (dd, J=1.7, 4.3 Гц, 1H), 12.95 (br s, 1H). Подготовительный пример 28 а: 5-бензолсульфонил-2-метилсульфанилпиримидин-4-карбоновой кислоты метиловый эфир Смесь 5-бром-2-метилсульфанилпиримидин-4-карбоновой кислоты метилового эфира (2,3 г), натриевой соли бензолсульфиновой кислоты (1,9 г) и диметилсульфоксида (35 мл) обрабатывали бензольным комплексом бис[трифлата меди(I)] (3,3 г) и полученную смесь перемешивали при 65 С в течение 1,5- 26017573 ч. Смесь охлаждали до 40 С и фильтровали через целит. Фильтрат разбавляли этилацетатом, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле,элюируя смесью дихлорметана и этилацетата (от 1:0 до 4:1 по объему), что позволило получить указанное в заголовке соединение в виде бледно-желтого твердого вещества (1,8 г).(1,4 г) и тетрагидрофурана (20 мл) обрабатывали 1,0 М водным раствором гидроксида лития (2,2 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение в виде бледно-желтого твердого вещества (1,3 г). 1 Н ЯМР (CDCl3):2.62 (s, 3H), 7.52-7.66 (m, 3H), 8.02-8.05 (m, 2H), 9.21 (s, 1 Н).MS: ESI (+ve) (метод В): 311 (М+Н)+, время удерживания 2,4 мин. Подготовительный пример 28 с: 5-(5-бензолсупьфонил-2-метилсульфанилпиримидин-4-ил)метанол Смесь 5-бензолсульфонил-2-метилсульфанилпиримидин-4-карбоновой кислоты (0,99 г), дихлорметана (50 мл) и N,N-диметилформамида (0,2 мл) обрабатывали оксалилхлоридом (0,83 мл) и полученную реакционную смесь перемешивали при комнатной температуре в течение двух часов. Смесь концентрировали при пониженном давлении и остаток растворяли в смеси ацетонитрила (20 мл) и тетрагидрофурана (30 мл). Смесь охлаждали до -78 C и обрабатывали 2,0 М раствором боргидрида натрия в N,Nдиметилформамиде (1,6 мл). Смесь нагревали до -50C в течение 2 ч, разбавляли 1,0 М водным раствором соляной кислоты и концентрировали при пониженном давлении. Остаток разбавляли этилацетатом,промывали водой и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, что позволило получить указанное в заголовке соединение в виде желтого масла (0,59 г). 1 Н ЯМР (DMSO-d6):2.61 (s, 3H), 4.66 (d, J=6.1 Гц, 2 Н), 5.36 (t, J=6.1 Гц, 1H), 7.62-7.68 (m, 3H),8.00-8.03 (m, 2H), 9.12 (s, 1H).(100 мл) обрабатывали периодинаном Десса-Мартина (0,72 г) и полученную смесь перемешивали при 0C в течение 30 мин. Смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (от 1:0 до 0:1 по объему), что позволило получить указанное в заголовке соединение в виде бледно-желтого масла (0,30 г). 1 Н ЯМР (CDCl3):.2.64 (s, 3H), 7.54-7.60 (m, 3H), 7.98-8.01 (m, 2H), 9.25 (s, 1H), 10.21 (s, 1H).MS: ESI (+ve) (метод В): 295 (М+Н)+, время удерживания 2,8 мин. Подготовительный пример 28 е: [3-(5-бензолсульфонил-2-метилсульфанилпиримидин-4-илметил)-5 фтор-2-метилиндол-1-ил]уксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 1 с, используя 5-бензолсульфонил-2-метилсульфанилпиримидин-4-карбальдегид и(5-фтор-2-метилиндол-1 илуксусной кислоты метиловый эфир. 1 Н ЯМР (CDCl3):2.20 (s, 3H), 2.23 (s, 3H), 3.73 (s, 3H), 4.32 (s, 2H), 4.74 (s, 2 Н), 6.55 (dd, J=2.5, 9.6 Гц, 1H), 6.81 (dd, J=2.5, 9.1 Гц, 1H), 7.00 (dd, J=4.2, 8.9 Гц, 1H), 7.53-7.59 (m, 2 Н), 7.64-7.69 (m, 1H), 7.907.93 (m, 2H), 9.08 (s, 1H).[3-(5-бензолсульфонил-2-метилсульфанилпиримидин-4-илметил)-5-фтор-2-метилиндол-1 ил]уксусной кислоты метилового эфира (0,23 г) и тетрагидрофурана (30 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,93 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали при пониженном давлении, рН подводили до 4 путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенный экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде желтого твердого вещества (0,20 г).[3-(5-бензолсульфонил-2-метилсульфанилпиримидин-4-илметил)-5-фтор-2-метилиндол-1 ил]уксусной кислоты (0,20 г), этанола (12 мл) и воды (12 мл) обрабатывали никелем Ренея 2800 (0,050 г) и полученную реакционную смесь перемешивали при 60 С в течение 45 мин. Смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной обращенно-фазовой HPLC, элюируя смесью ацетонитрила и воды (от 1:19 до 49:1 по объему), что позволило получить указанное в заголовке соединение в виде почти белого твердого вещества (0,058 г). 1 Н ЯМР (DMSO-d6):2.09 (s, 3H), 4.35 (s, 2H), 4.87 (s, 2H), 6.40 (dd, J=2.5, 9.9 Гц, 1H), 6.78 (dd,J=2.5, 9.2 Гц, 1H), 7.27 (dd, J=4.3, 8.8 Гц, 1H), 7.68 (m, 2H), 7.79 (tt, J=1.1, 7.6 Гц, 1H), 8.07 (m, 2 Н), 9.24 (s,1H), 9.40 (s, 1H). Подготовительный пример 29 а. [3-(3-бензолсульфонилтиофен-2-илметил)-5-хлор-2-метилиндол-1 ил]уксусной кислоты метиловый эфир Смесь триэтилсилана (2,7 г), трифторуксусной кислоты (1,6 г) и дихлорэтана (8,0 мл) при -20 С обрабатывали по каплям смесью (5-хлор-2-метилиндол-1-ил)уксусной кислоты метилового эфира (0,36 г),3-фенилсульфонил-2-тиофенальдегида (0,39 г) и дихлорэтана (8,0 мл) и полученную смесь нагревали до комнатной температуры в течение периода времени 1,5 ч. Смесь обрабатывали дополнительным количеством триэтилсилана (2,7 г) и трифторуксусной кислоты (1,6 г) и затем перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли насыщенным водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном. Объединенный органический экстракт промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (от 1:0 до 0:1 по объему), что позволило получить указанное в заголовке соединение (0,55 г).MS: ESI (+ve) (метод В): 474 (М+Н)+, время удерживания 4,1 мин. Подготовительный пример 29b: [3-(3-бензолсульфонилтиофен-2-илметил)-5-хлор-2-метилиндол-1 ил]уксусная кислота Смесь [3-(3-бензолсульфонилтиофен-2-илметил)-5-хлор-2-метилиндол-1-ил]уксусной кислоты метилового эфира (0,47 г), 1,0 М водного раствора гидроксида лития (2,0 мл) и тетрагидрофурана (2,0 мл) перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли 1,0 М водным раствором соляной кислоты и экстрагировали этилацетатом. Объединенный органический экстракт сушили, используя картридж для разделения фаз, и концентрировали при пониженном давлении. Остаток очищали кристаллизацией из смеси пентана и этилацетата, что позволило получить указанное в заголовке соединение в виде белого порошка (0,39 г). 1 Н ЯМР (DMSO-d6):2.17 (s, 3H), 4.41 (s, 2 Н), 4.93 (s, 2H), 6.88 (d, J=2.0 Гц, 1H), 6.98 (dd, J=2.0, 8.7 Гц, 1H), 7.33 (s, 1H), 7.35 (d, J=5.5 Гц, 1H), 7.39 (d, J=5.5 Гц, 1H), 7.61-7.67 (m, 2 Н), 7.69-7.74 (m, 1H),7.98-8.02 (m, 2H). Подготовительный пример 30 а: 2-фенилсульфамоилникотиновой кислоты метиловый эфир Смесь 2-меркаптоникотиновой кислоты метилового эфира (1,4 г), дихлорметана (50 мл) и 1,0 М водного раствора соляной кислоты (50 мл) при -10C обрабатывали гипохлоритом натрия (8%-ным в воде, 50 мл) в течение периода времени 5 мин и полученную смесь нагревали до 0C в течение периода времени 15 мин. Фазы разделяли и органическую фазу обрабатывали 4 молекулярными ситами и ани- 28017573 лином (1,5 г) и полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. Смесь фильтровали и фильтрат промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали кристаллизацией из смеси циклогексана и дихлорметана, что позволило получить указанное в заголовке соединение (1,8 г).MS: ESI (+ve) (метод В): 293 (М+Н)+, время удерживания 3,0 мин. Подготовительный пример 30b: 2-(метилфенилсульфамоил)никотиновой кислоты метиловый эфир Смесь 2-фенилсульфамоилникотиновой кислоты метилового эфира (1,8 г), ацетонитрила (100 мл) и карбоната калия (1,9 г) обрабатывали смесью метилбромида (1,5 мл) и ацетонитрила (6,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 24 ч. Смесь концентрировали при пониженном давлении, растирали с дихлорметаном и фильтровали. Фильтрат концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение в виде рыжевато-коричневого масла (1,5 г).MS: ESI (+ve) (метод В): 307 (M+H)+, время удерживания 3,4 мин. Подготовительный пример 30 с: 3-гидроксиметилпиридин-2-сульфоновой кислоты метилфениламид Смесь 2-(метилфенилсульфамоил)никотиновой кислоты метилового эфира (1,5 г) и тетрагидрофурана (50 мл) при -78C обрабатывали 1,0 М раствором алюмогидрида лития в тетрагидрофуране (10 мл) и полученную смесь перемешивали при -78 С в течение 1 ч и затем при комнатной температуре в течение 2 ч. Смесь разбавляли водой, экстрагировали этилацетатом и объединенный органический экстракт сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (от 1:0 до 19:1 по объему), что позволило получить указанное в заголовке соединение (0,25 г).MS: ESI (+ve) (метод В): 279 (М+Н)+, время удерживания 3,0 мин. Подготовительный пример 30d: 3-формилпиридин-2-сульфоновой кислоты метилфениламид Смесь 3-гидроксиметилпиридин-2-сульфоновой кислоты метилфениламида (0,25 г), хлороформа(20 мл) и оксида марганца(IV) (3,9 г) перемешивали при комнатной температуре в течение 2 ч. Смесь обрабатывали дополнительным количеством оксида марганца(IV) (1,6 г) и перемешивали при комнатной температуре в течение следующих 2 ч. Смесь фильтровали через гифло (hyflo - торговая марка диатомовой земли) и фильтрат концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение (0,10 г).MS: ESI (+ve) (метод В): 277 (М+Н)+, время удерживания 3,4 мин. Подготовительный пример 30e: 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)пиридин-3 илметил]индол-1-илуксусной кислоты метиловый эфир Указанное в заголовке соединение получали способом из подготовительного примера 29 а, используя (5-фтор-2-метилиндол-1-ил)уксусной кислоты метиловый эфир и 3-формилпиридин-2-сульфоновой кислоты метилфениламид.MS: ESI (+ve) (метод В): 482 (М+Н)+, время удерживания 4,2 мин. Подготовительный пример 30f: 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)пиридин-3 илметил]индол-1-илуксусная кислота Смесь 5-фтор-2-метил-3-[2-(метилфенилсульфамоил)пиридин-3-илметил]индол-1-илуксусной кислоты метилового эфира (0,14 г), 1,0 М водного раствора гидроксида натрия (1,0 мл) и метанола (10 мл) перемешивали при комнатной температуре в течение 1,5 ч. Смесь разбавляли 1,0 М водным раствором соляной кислоты и концентрировали при пониженном давлении. Остаток разбавляли 1,0 М водным раствором соляной кислоты, полученный осадок собирали фильтрованием и сушили, получая указанное в заголовке соединение в виде белого твердого вещества (0,10 г). 1 Н ЯМР (DMSO-d6):2.17 (s, 3H), 3.53 (s, 3H), 4.23 (s, 2H), 4.93 (s, 2H), 6.78-6.89 (m, 2 Н), 7.21-7.39 Подготовительный пример 31 а: 3-(4-фторбензолсульфонил)тиофен-2-карбальдегид Смесь 3-бромтиофенкарбальдегида (5,0 г), диметилсульфоксида (50 мл) и натриевой соли 4 фторфенилсульфината (5,2 г) перемешивали при 100C в течение 3 ч. Добавляли дополнительное количество натриевой соли 4-фторфенилсульфината (1,9 г) и смесь перемешивали при 100 С в течение 18 ч.
МПК / Метки
МПК: C07D 403/12, C07D 401/06, C07D 417/06, C07D 409/06, C07D 209/04, A61K 31/404, C07D 409/14, C07D 403/06
Метки: применение, производные, терапевтическое, кислоты, индол-1-илуксусной
Код ссылки
<a href="https://eas.patents.su/30-17573-proizvodnye-indol-1-iluksusnojj-kisloty-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индол-1-илуксусной кислоты и их терапевтическое применение</a>
Предыдущий патент: Катализатор для получения монооксида азота
Следующий патент: Барабан для белья машины по уходу за бельем
Случайный патент: Получение (2r,3r)-3-(3-метоксифенил)-n,n,2-триметилпентанамина


































