Получение (2r,3r)-3-(3-метоксифенил)-n,n,2-триметилпентанамина
Номер патента: 15003
Опубликовано: 29.04.2011
Авторы: Брукс Руди Лоран Мария, Филлье Вальтер Фердинанд Мария
Формула / Реферат
1. Способ получения (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамина или его кислотно-аддитивной соли, включающий следующие стадии:
a) ацилирование (2S,3R)-1-(диметиламино)-3-(3-метоксифенил)-2-метил-3-пентанола
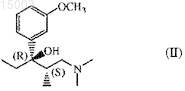
ацилирующим агентом;
b) гидрогенолиз полученного таким образом соединения (III)
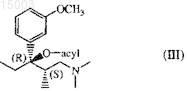
с использованием подходящего катализатора в инертном в условиях реакции растворителе в присутствии водорода и
c) в случае необходимости превращение полученного таким образом (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамина
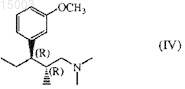
в кислотно-аддитивную соль.
2. Способ по п.1, где ацилирующий агент на стадии a) представляет собой органический ацилгалогенид или ангидрид органической кислоты.
3. Способ по п.2, где органический ацилгалогенид или ангидрид органической кислоты выбирают из уксусного ангидрида, ацетилхлорида, трифторуксусного ангидрида, хлоруксусного ангидрида, хлорацетилхлорида, дихлоруксусного ангидрида, трихлоруксусного ангидрида, бензойного ангидрида, бензоилхлорида, фталевого ангидрида, фталоилдихлорида, терефталоилдихлорида, янтарного ангидрида, сукцинилхлорида, этилоксалилхлорида, метилоксалилхлорида, кислоты Мелдрума, этилхлорформиата, метилхлорформиата или ацетилсалицилоилхлорида.
4. Способ по п.3, где ангидрид кислоты представляет собой трифторуксусный ангидрид.
5. Способ по п.3, где органический ацилгалогенид представляет собой ацетилхлорид или этилоксалилхлорид.
6. Способ по любому из пп.1-5, где катализатор на стадии b) выбран из никеля Ренея, палладия, палладия на угле, платины, платины на угле, рутения или родия на угле или любого другого подходящего катализатора.
7. Способ по п.6, где катализатор представляет собой палладий на угле.
8. Способ по любому из пп.1-7, где инертный в условиях реакции растворитель на стадии b) выбран из диэтилового эфира, тетрагидрофурана, 2-метилтетрагидрофурана или их смесей.
9. Способ по любому из пп.1-8, где (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамин превращают в его гидрохлоридную кислотно-аддитивную соль.
10. Способ по любому из предшествующих пунктов, где стадии a) и b) проводят как однореакторный синтез.
11. Соединение формулы (III), где ацил представляет собой CH3-CO-, CF3-CO-, CH2Cl-CO-, CHCl2-CO-, CCl3-CO-, CH3O-CO-, CH3CH2O-CO-, CH3O-CO-СО, CH3CH2O-CO-СО-, фенил-CO- или мета-CH3COO-фенил-CO-.

12. Соединение формулы (III) по п.11, где ацил представляет собой CF3-CO-.
13. Соединение формулы (III) по п.11, где ацил представляет собой CH3-CO- или CH3CH2O-CO-CO-.
Текст
Филлье Вальтер Фердинанд Мария, Брукс Руди Лоран Мария (BE) Представитель: Настоящее изобретение относится к улучшенному способу получения (2R,3R)-3-(3 метоксифенил)-N,N,2-триметилпентанамина, являющегося промежуточным продуктом для получения анальгетика тапентадола.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) 015003 Настоящее изобретение относится к улучшенному способу получения (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина, являющегося промежуточным продуктом для получения анальгетика тапентадола. Тапентадол - это INN (международное непатентованное название) моногидрохлорида 3-[(1R,2R)-3(диметиламино)-1-этил-2-метилпропил]фенола, формула которого представлена ниже Химическая структура тапентадола описана в EP-A-0693475 как соединение (+21). Синтез тапентадола в свободной форме описан в примере 1 и примере 24, стадии 1-3, и приведен ниже с теми же номерами соединений, которые использованы в указанном патенте EP-A-0693475. Синтетическим предшественником тапентадола на приведенной выше схеме является (2R,3R)-3-(3 метоксифенил)-N,N,2-триметилпентанамин (промежуточный продукт (+23) на приведенной выше схеме), который можно получить удалением третичной гидроксигруппы из (2S,3R)-1-(диметиламино)-3-(3 метоксифенил)-2-метил-3-пентанола последовательным превращением в соответствующий галогенид взаимодействием с тионилхлоридом и последующим удалением Cl обработкой боргидридом цинка, цианоборгидридом цинка и/или цианоборгидридом олова. Данная методика имеет недостаток, заключающийся в том, что галогенид получают с использованием избытка тионилхлорида, представляющего собой агрессивный хлорирующий агент. Кроме того, гидрирующие агенты, такие как боргидрид цинка,цианоборгидрид цинка и цианоборгидрид олова, представляют значительную пожарную опасность и угрозу здоровью при использовании в промышленных масштабах. В WO 2004/108658 раскрывается альтернативный способ получения (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина путем превращения (2S,3S)-1-(диметиламино)-3-(3-метоксифенил)-2-метил 3-пентанола в смесь (2R,3R) и (2R,3S)-3-(3-метоксифенил)-N,N,2-триметилпентанамина, как показано ниже. Полученную смесь (2R,3R) и (2R,3S)-3-(3-метоксифенил)-N,N,2-триметилпентанамина необходимо разделить на индивидуальные стереоизомеры для получения целевого (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина, который затем можно превратить в тапентадол, например, нагреванием с концентрированной бромоводородной кислотой, как описано в EP-A-0693475. В WO 2005/000788 раскрывается альтернативный способ получения (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина путем превращения (2S,3S)-1-(диметиламино)-3-(3-метоксифенил)-2-метил 3-пентанола в смесь (2R,3R) и (2R,3S)-3-(3-метоксифенил)-N,N,2-триметилпентанамина, как изображено ниже. Полученную смесь (2R,3R) и (2R,3S)-3-(3-метоксифенил)-N,N,2-триметилпентанамина необходимо разделить на индивидуальные стереоизомеры для получения целевого (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина, который затем можно превратить в тапентадол, например, нагреванием с концентрированной бромоводородной кислотой, как описано в EP-A-0693475. Оба альтернативных способа, описанных в WO 2004/108658 и 2005/00078, имеют недостаток, заключающийся в том, что 3-(3-метоксифенил)-N,N,2-триметилпентанамин получают в виде смеси (2R,3R) и (2R,3S) стереоизомеров, которые необходимо разделить для получения целевого (2R,3R) стереоизомера. Нежелательный (2R,3S) стереоизомер невозможно превратить в целевой (2R,3R) стереоизомер, и его приходится утилизировать как химические отходы, что с экономической точки зрения нежелательно для любого промышленного производства. Задача настоящего изобретения состоит в разработке улучшенного способа синтеза (2R,3R)-3-(3 метоксифенил)-N,N,2-триметилпентанамина, более удобного и более эффективного, чем ранее известные способы. Настоящее изобретение позволяет решить поставленную задачу посредством разработки улучшенного способа получения (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамина или его кислотноаддитивной соли, который характеризуется следующими стадиями:b) стереоселективный гидрогенолиз полученного таким образом соединения (III) с использованием подходящего катализатора в инертном, в условиях реакции, растворителе в присутствии водорода и с) необязательно превращение полученного таким образом (2R,3R)-3-(3-метоксифенил)-N,N,2 триметилпентанамина в кислотно-аддитивную соль. Ацилирующий агент на стадии a) представляет собой органический ацилгалогенид или ангидрид органической кислоты, выбранный из уксусного ангидрида, ацетилхлорида, трифторуксусного ангидрида, хлоруксусного ангидрида, хлорацетилхлорида, дихлоруксусного ангидрида, трихлоруксусного ангидрида, бензойного ангидрида, бензоилхлорида, фталевого ангидрида, фталоилдихлорида, терефталоилдихлорида, янтарного ангидрида, сукцинилхлорида, этилоксалилхлорида, метилоксалилхлорида, кислоты Мелдрума, этилхлорформиата, метилхлорформиата, ацетилсалицилоилхлорида или любого другого подходящего ацилирующего агента. Реакцию ацилирования на стадии а) можно осуществлять в присутствии подходящего основания,такого как карбонат натрия, карбонат калия или триэтиламин, для связывания высвобождающейся в ходе реакции кислоты. Катализатор на стадии b) выбран из палладиевого катализатора или любого другого подходящего-2 015003 катализатора, такого как никель Ренея, платина, платина на угле, рутений или родий на угле. Палладиевый (Pd) катализатор может представлять собой гомогенный Pd катализатор, такой как,например, Pd(OAc)2, PdCl2, Pd(PPh3)4, Pd(PPh3)2Cl2, Pd2(dba)3 (трис-(дибензилиденацетон)дипалладий),палладиевый тиометилфенилглутарамидный металлоцикл и тому подобные, или гетерогенный Pd катализатор, такой как, например, палладий на угле, палладий на оксидах металлов, палладий на цеолитах. Предпочтительно палладиевый катализатор представляет собой гетерогенный Pd катализатор, более предпочтительно палладий на активированном угле или палладий на угле (Pd/C). Pd/C является регенерируемым катализатором, устойчив и относительно недорог. Его можно легко отделить (фильтрованием) от реакционной смеси, уменьшая таким образом риск присутствия следов Pd в конечном продукте. Использование Pd/C также устраняет потребность в лигандах, таких как, например, фосфиновые лиганды,которые дороги, токсичны и загрязняют синтезируемые продукты. Инертный в условиях реакции растворитель на стадии b) выбран из диэтилового эфира, тетрагидрофурана, 2-метилтетрагидрофурана или их смесей. В одном варианте осуществления настоящего изобретения стадии a) и b) осуществляются по методике "однореакторного синтеза". Настоящее изобретение относится также к новым соединениям формулы (III) Ацильная группа в соединениях формулы (III) представляет собой CH3-CO-, CF3-CO-, CH2Cl-CO-,CHCl2-CO-, CCl3-CO-, CH3O-CO-CO-, CH3O-CO-, CH3CH2O-CO-, CH3CH2O-CO-СО, фенил-CO- или метаCH3COO-фенил-CO-, когда ацилирующий агент, применяющийся для получения соединений формулы(III), как описано выше, выбран из уксусного ангидрида, ацетилхлорида, трифторуксусного ангидрида,хлоруксусного ангидрида, хлорацетилхлорида, дихлоруксусного ангидрида, трихлоруксусного ангидрида, метилоксалилхлорида, этилоксалилхлорида, метилхлорформиата, этилхлорформиата, бензойного ангидрида, бензоилхлорида или ацетилсалицилоилхлорида. Исходное вещество для способа по настоящему изобретению, т.е. (2S,3R)-1-(диметиламино)-3-(3 метоксифенил)-2-метил-3-пентанол (соединение 4), получали взаимодействием (2S)-3-(диметиламино)-1(3-метоксифенил)-2-метил-1-пропанона (соединение 3) с этилмагнийхлоридом в ТГФ в условиях реакции Гриньяра. При взаимодействии реактива Гриньяра с кетоном (3) образуется второй асимметрический атом углерода. Реакция Гриньяра (2S)-3-(диметиламино)-1-(3-метоксифенил)-2-метил-1-пропанона (соединение 3) с этилмагнийгалогенидом высоко стереоспецифична. Было обнаружено, что оптическая чистота исходного соединения (3) составляла 98,0%. Анализ соединения (4) показал, что оно содержит 96,8% целевого (2S,3R) энантиомера, менее 0,4% (2S,3S) энантиомера и 3,0% (2R,3S) энантиомера. В таблице приведены значения стереоизомерной чистоты соединения (4) при получении указанным выше способом. Соединение (4) можно превратить в соединение (5) ацилированием соединения (4) трифторуксусным ангидридом и последующим гидрогенолизом на палладиевом катализаторе, используя в качестве растворителя 2-метилтетрагидрофуран, по методике "однореакторного синтеза". Оптическая чистота исходного соединения (4) составила 96,8% энантиомера (2S,3R). Было обнаружено, что гидрогенолиз после ацилирования соединения (4) высоко стереоспецифичен и дает в результате целевой (2R,3R) энантиомер соединения (5) с оптической чистотой 96,3%. Образование соли соединения (5) дополнительно повышает оптическую чистоту соединения (5). Например, диастереомерный избыток 99% был достигнут превращением соединения (5) в его гидрохлорид (соединение (6 при использовании 2-пропанола в качестве растворителя для кристаллизации. Стереоизомерная чистота соединений (4), (5) и (6) Экспериментальная часть Пример 1. Синтез 3-(диметиламино)-1-(3-метоксифенил)-2-метил-1-пропанона (1). Смесь 1-(3-метоксифенил)-1-пропанона (240 г) в 2-пропаноле (584 мл) перемешивали при температуре окружающей среды. Добавляли гидрохлорид диметиламина (238,3 г), затем параформальдегид(109,5 г) и водный раствор HCl (26,5 мл, 35% вес./вес.). Реакционную смесь нагревали до температуры кипения и кипятили при перемешивании 5 ч. Реакционную смесь охлаждали до 20C и добавляли воду(730 мл) и толуол (146 мл). Верхний органический слой отбрасывали и к нижнему водному слою добавляли водный раствор NaOH (50% вес./вес, 175,2 мл) при перемешивании в течение 10 мин, поддерживая температуру ниже 25C. Через 10 мин слои разделяли, верхний органический слой отделяли и промывали водой (219 мл). Органический слой отделяли и концентрировали, получая 3-(диметиламино)-1-(3 метоксифенил)-2-метил-1-пропанон в виде маслянистого остатка (294,9 г). Пример 2. Синтез и выделение (2S)-3-(диметиламино)-1-(3-метоксифенил)-2-метил-1-пропанонаa. Соединение (1) (114,7 г) в этаноле (50 мл) добавляли к раствору моногидрата L-(-)-дибензоилвинной кислоты (188,2 г) в этаноле (950 мл), реакционную смесь нагревали до 38C и перемешивали 48 ч при 38C. Затем реакционную смесь охлаждали до 22C и перемешивали 14 ч при 22C. Осадок отфильтровывали, дважды промывали этанолом (50 мл) и сушили в вакууме при температуре 40C, получая соединение (2) (207,5 г).b. Соединение (2) (202,9 г) суспендировали в бутил-трет-метиловом эфире (1050 мл) и добавляли диэтиламин (72,4 мл). Суспензию перемешивали 3 ч при температуре окружающей среды и удаляли осадок фильтрованием. Фильтрат концентрировали при пониженном давлении, получая (2S)-3-(диметиламино)-1-(3-метоксифенил)-2-метил-1-пропанон (3) в виде масла (73,9 г). Методика, альтернативная методике b.c. Соединение (2) (312,8 г) суспендировали в 2-метилтетрагидрофуране (405 мл) и воде (540 мл). Добавляли водный NH4OH (93 мл, 51% вес./вес.) и смесь перемешивали в течение 30 мин. Слои разделяли и отделенный верхний органический слой промывали водой (100 мл), затем концентрировали при пониженном давлении, получая (2S)-3-(диметиламино)-1-(3-метоксифенил)-2-метил-1-пропанон (3) в виде желтого масла (109,0 г). Соединение (3), полученное согласно методике, описанной в примере 2, обычно имеет энантиомерную чистоту 97% или выше. Раствор EtMgCl в ТГФ (242 мл, 2 М) перемешивали и охлаждали до 2C. Соединение (3) (101,3 г,0,44 моль) медленно добавляли в течение 50 мин, поддерживая температуру реакционной смеси ниже 25C. Смесь перемешивали 3 ч при 22C, затем медленно гасили в смеси лед-вода (352 мл) и уксусной кислоты (63,9 мл). Полученную смесь перемешивали 30 мин при температуре окружающей среды, затем добавляли водный раствор NH4OH (98,8 мл, 51% вес./вес.) и смесь перемешивали 10 мин при температуре окружающей среды. Слои разделяли, отделенный верхний органический слой промывали водой (44 мл), затем упаривали при пониженном давлении досуха, получая (2S,3R)-1-(диметиламино)-3-(3-метоксифенил)-2-метил-3 пентанол (4) в виде желтого масла, затвердевающего при стоянии при температуре окружающей средыa. Раствор соединения (4) (50,3 г) в 2-метилтетрагидрофуране (120 мл) перемешивали и охлаждали до 5C. Затем медленно добавляли трифторуксусный ангидрид (30,6 мл) в течение 10 мин, поддерживая температуру реакционной смеси ниже 20C. По окончании добавления реакционную смесь оставляли перемешиваться в течение 1 ч при 20C.b. Добавляли палладий 10% на активированном угле (50% влажность) (2,52 г) и перемешивали реакционную смесь при 800 об/мин, повышая давление до 2 атм (202,65 кПа) водорода. Реакционную смесь нагревали до 40C и перемешивали 4 ч при 40C. Смесь оставляли охлаждаться до 20C и фильтровали в атмосфере азота. Фильтр промывали 2-метилтетрагидрофураном (10 мл). К фильтрату добавляли воду(160 мл) и смесь перемешивали, затем в течение 10 мин добавляли водный раствор NaOH (28,6 мл,50% вес./вес.), поддерживая температуру ниже 20C. Органический и водный слои оставляли разделяться, органический слой отделяли и промывали водой (50 мл) и концентрировали при пониженном давлении, получая (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамин (5) в виде бесцветного масла(2R,3R) энантиомера, 2,5% (2S,3S) энантиомера и 1,2% (2R,3S) энантиомера. Используя методику, аналогичную описанной в а), но заменяя трифторуксусный ангидрид ацетилхлоридом или этилоксалилхлоридом и добавляя в реакционную смесь триэтиламин, получали соединения (7) и (8) соответственно. Указанные соединения (7) и (8) превращали в соединение (8), применяя приведенную выше методику b). Соединение (5) (23,0 г) растворяли в 2-пропаноле (50 мл) и перемешивали при комнатной темпера-5 015003 туре. Затем медленно добавляли раствор HCl в 2-пропаноле (20,3 г, 17,9% вес./вес.) в течение 5 мин. В смесь добавляли затравку соединения (6) (10 мг) и реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Смесь охлаждали до температуры 0C и перемешивали 4 ч. Осадок отфильтровывали, промывали 2-пропанолом (5 мл) и сушили в вакууме, получая моногидрохлорид(2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамина (6) в виде белого твердого вещества (22,9 г). Соединение (6), полученное согласно методике, описанной в примере 6, содержит 99,7% целевого(2R,3R) энантиомера и 0,3% (2R,3S) энантиомера. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамина или его кислотноаддитивной соли, включающий следующие стадии:b) гидрогенолиз полученного таким образом соединения (III) с использованием подходящего катализатора в инертном в условиях реакции растворителе в присутствии водорода иc) в случае необходимости превращение полученного таким образом (2R,3R)-3-(3-метоксифенил)N,N,2-триметилпентанамина в кислотно-аддитивную соль. 2. Способ по п.1, где ацилирующий агент на стадии a) представляет собой органический ацилгалогенид или ангидрид органической кислоты. 3. Способ по п.2, где органический ацилгалогенид или ангидрид органической кислоты выбирают из уксусного ангидрида, ацетилхлорида, трифторуксусного ангидрида, хлоруксусного ангидрида, хлорацетилхлорида, дихлоруксусного ангидрида, трихлоруксусного ангидрида, бензойного ангидрида, бензоилхлорида, фталевого ангидрида, фталоилдихлорида, терефталоилдихлорида, янтарного ангидрида, сукцинилхлорида, этилоксалилхлорида, метилоксалилхлорида, кислоты Мелдрума, этилхлорформиата, метилхлорформиата или ацетилсалицилоилхлорида. 4. Способ по п.3, где ангидрид кислоты представляет собой трифторуксусный ангидрид. 5. Способ по п.3, где органический ацилгалогенид представляет собой ацетилхлорид или этилоксалилхлорид. 6. Способ по любому из пп.1-5, где катализатор на стадии b) выбран из никеля Ренея, палладия,палладия на угле, платины, платины на угле, рутения или родия на угле или любого другого подходящего катализатора. 7. Способ по п.6, где катализатор представляет собой палладий на угле. 8. Способ по любому из пп.1-7, где инертный в условиях реакции растворитель на стадии b) выбран из диэтилового эфира, тетрагидрофурана, 2-метилтетрагидрофурана или их смесей. 9. Способ по любому из пп.1-8, где (2R,3R)-3-(3-метоксифенил)-N,N,2-триметилпентанамин превращают в его гидрохлоридную кислотно-аддитивную соль. 10. Способ по любому из предшествующих пунктов, где стадии a) и b) проводят как однореакторный синтез. 11. Соединение формулы (III), где ацил представляет собой CH3-CO-, CF3-CO-, CH2Cl-CO-, CHCl2CO-, CCl3-CO-, CH3O-CO-, CH3CH2O-CO-, CH3O-CO-СО, CH3CH2O-CO-СО-, фенил-CO- или мета-6 015003 12. Соединение формулы (III) по п.11, где ацил представляет собой CF3-CO-. 13. Соединение формулы (III) по п.11, где ацил представляет собой CH3-CO- или CH3CH2O-CO-CO-.
МПК / Метки
МПК: C07C 217/72, C07C 213/08
Метки: 2r,3r)-3-(3-метоксифенил)-n,n,2-триметилпентанамина, получение
Код ссылки
<a href="https://eas.patents.su/8-15003-poluchenie-2r3r-3-3-metoksifenil-nn2-trimetilpentanamina.html" rel="bookmark" title="База патентов Евразийского Союза">Получение (2r,3r)-3-(3-метоксифенил)-n,n,2-триметилпентанамина</a>
Предыдущий патент: Применение полиолов для получения устойчивых полиморфных форм рифаксимина
Следующий патент: Секционированный реактор
Случайный патент: Болеутоляющая композиция для перорального применения с регулируемым высвобождением опиоида












