Ингибиторы цистеиновой протеазы
Номер патента: 17395
Опубликовано: 28.12.2012
Авторы: Грабовска Урсула, Канберг Пиа, Оден Лурдес, Нильссон Магнус
Формула / Реферат
1. Соединение формулы IIa
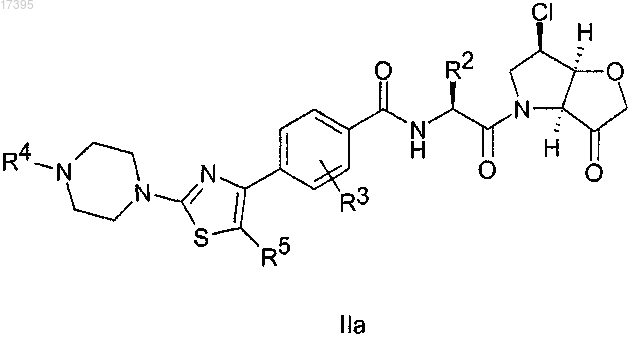
где R2 представляет собой боковую цепь лейцина, циклогексилглицина или 4-фторлейцина;
R3 представляет собой Н или F;
R4 представляет собой C1-C6-алкил;
R5 представляет собой Н, метил или F,
или его фармацевтически приемлемая соль или N-оксид.
2. Соединение по п.1, где R2 представляет собой боковую цепь лейцина или 4-фторлейцина.
3. Соединение по п.2, где R2 представляет собой боковую цепь лейцина.
4. Соединение по любому из пп.1-3, где R3 представляет собой фтор в мета-положении относительно бензильного амида.
5. Соединение по любому из пп.1-3, где R3 представляет собой Н.
6. Соединение по любому из пп.1-5, где R5 представляет собой фтор.
7. Соединение по любому из пп.1-6, где R4 представляет собой метил.
8. Соединение по п.1, выбранное из
N-[1-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-3-фтор-3-метилбутил]-4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамида;
N-[2-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-ил)-1-циклогексил-2-оксоэтил]-4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамида;
N-[1-(6-хлор-3-оксогексагидрофуро[3,2-b)]пиррол-4-карбонил)-3-метилбутил]-4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамида;
N-[1-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4-[5-метил-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамида,
или его фармацевтически приемлемая соль или N-оксид.
9. Соединение по п.1, обозначенное как N-[1-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамид, или его фармацевтически приемлемая соль или N-оксид.
10. Применение соединения, как определено по любому из пп.1-9, для лечения или изготовления лекарственного средства для лечения расстройств, опосредованных катепсином K.
11. Применение соединения по любому из пп.1-9 для изготовления лекарственного средства для лечения или предотвращения расстройства, опосредованного катепсином K.
12. Применение по п.10 или 11, где расстройство выбрано из остеопороза; заболеваний десны, таких как гингивит и периодонтит; болезни Пэджета; гиперкальциемии при злокачественных заболеваниях; метаболического заболевания костей; заболеваний, характеризующихся избыточной деградацией хряща или матрикса, таких как остеоартрит и ревматоидный артрит; рака костей, включая неоплазию; боли.
13. Способ лечения или предотвращения расстройства, опосредованного катепсином K, включающий введение безопасного и эффективного количества соединения по любому из пп.1-9 субъекту, нуждающемуся в нем.
14. Способ по п.13, где расстройство выбрано из остеопороза; заболеваний десны, таких как гингивит и периодонтит; болезни Пэджета; гиперкальциемии при злокачественных заболеваниях; метаболического заболевания костей; заболеваний, характеризующихся избыточной деградацией хряща или матрикса, таких как остеоартрит и ревматоидный артрит; рака костей, включая неоплазию; боли.
Текст
где R2 представляет собой боковую цепь лейцина, циклогексилглицина или 4-фторлейцина; R3 представляет собой Н или F; R4 представляет собой C1-C6-алкил; R5 представляет собой Н,метил или F; или его фармацевтически приемлемой соли или N-оксида, полезного при лечении расстройств, характеризующихся несоответствующей экспрессией или активацией катепсина K,таких как остеопороз, остеоартрит, ревматоидный артрит или метастазы кости. 017395 Область изобретения Настоящее изобретение относится к ингибиторам цистеиновых протеаз, в частности к представителям папаинового надсемейства. Изобретение предусматривает новые соединения, применимые для профилактики или лечения расстройств, происходящих от дисбаланса нормальных протеаз, таких как катепсин K. Уровень техники Папаиновое надсемейство цистеиновых протеаз широко распространено у различных биологических видов, включая млекопитающих, беспозвоночных, простейших, растений и бактерий. Ряд ферментов катепсинов млекопитающих, включая катепсины В, F, Н, K, L, О и S, приписаны к этому надсемейству, и неадекватная регуляция их активности участвует в ряде метаболических расстройств, включая артрит, мышечную дистрофию, воспаление, гломерулонефрит и опухолевую инвазию. Патогенные подобные катепсину ферменты включают бактериальные гингипаины, малярийные фальципаины I, II, III и далее, а также цистеиновые протеазы из Pneumocystis carinii, Trypanosoma cruzei и brucei, Crithidiafusiculata, Schistosoma spp. Неадекватная регуляция катепсина K участвует во многих расстройствах, включая остеопороз, заболевания десен, такие как гингивит и периодонтит, болезнь Пэджета, гиперкальциемию при злокачественных новообразованиях и метаболических заболеваниях костей. Учитывая его повышенные уровни в хондрокластах синовии при остеоартрите, катепсин K участвует в заболеваниях, характеризующихся избыточной деградацией хряща или матрикса, таких как остеоартрит и ревматоидный артрит. Вероятно, что лечение заболеваний костей и хрящей, таких как остеоартроз и остеопороз, будет требовать пожизненного введения ингибитора катепсина K, часто группе пациентов старческого возраста или приближающихся к нему. Это определяет необычайно высокие требования к простоте введения лекарственных препаратов, предназначенных для таких расстройств. Например, предпринимаются попытки растянуть режимы дозирования общепринятых лекарств для лечения остеопороза класса бисфосфонатов до недельных или более длительных режимов приема для повышения приверженности пациентов лечению. Тем не менее, даже при улучшении режима дозирования другие побочные эффекты бисфосфонатов остаются. Бисфосфонаты блокируют ремоделирование костей скорее, чем ослабляют его, как это делает ингибитор катепсина K. Для здоровой кости важно поддерживать процесс ремоделирования, который бисфосфонаты блокируют полностью. Кроме того, бисфосфонаты имеют очень длительный период полувыведения из костей так, что, если проявляются такие эффекты, как некроз челюстной кости, невозможно удалить бисфосфонат из кости. Наоборот, ингибиторы катепсина K обычно обладают быстрым наступлением эффекта и диссоциативным способом действия, это означает, что, если обнаруживается проблема, введение может быть приостановлено и не будет накопления ингибитора в костном матриксе. Таким образом, существует потребность в альтернативных лекарственных средствах от остеопороза и остеоартрита с улучшенными фармакокинетическими и/или фармакодинамическими свойствами.WO 02/057270 раскрывает соединения формулы IA где остаток UVWXY в значительной мере соответствует P3 и P2 (их значения приведены ниже) ингибиторов дипептидцистеинпротеазы;P1 и Q, каждый, являются, помимо прочего, метиленом. Хотя общее раскрытие в этом патентном описании допускает очень широкий спектр заместителейP1 и Q, ни один не приведен индивидуально или приводится в качестве примера, и не приводится путь их синтеза. В действительности, единственные предложения по синтезу, присутствующие в WO 02/05720,не подразумевают замещение по P1 или Q вовсе. Соединения предполагаются быть применимыми, помимо прочего, для лечения протозойных инфекций, таких как трипаносомы. Пример 9 в WO 2005/066180 раскрывает, помимо прочего, соединение формулы IB Соединение является активным ингибитором катепсина K, но, как показано ниже, дальнейшая модификация структуры приводит к улучшениям относительно фармакокинетики и/или фармакодинамики,заметно улучшая стабильность в цельной крови и, следовательно, к лучшей экспозиции.WO 2008/007127, которая не была опубликована до даты приоритета данной заявки, раскрывает соединения формулы IC которые описаны как ингибиторы цистеиновой протеазы, в частности как ингибиторы катепсина K. Краткое описание изобретения В соответствии с настоящим изобретением обеспечивается соединение формулы IIa где R2 представляет собой боковую цепь лейцина, циклогексилглицина, 4-фторлейцина;R5 представляет собой Н, метил или F,или их фармацевтически приемлемая соль или N-оксид. Выражение "С 1-6 алкил" означает алкильную цепь, имеющую от одного до шести атомов углерода(например, C1-4 алкильная группа или С 1-3 алкильная группа). Алкильные группы могут иметь прямую или разветвленную цепь. Подходящие С 1-6 алкильные группы включают, например, метил, этил, пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил, втор-бутил и трет-бутил), пентил(например, н-пентил) и гексил (например, н-гексил). Особенно интересной алкильной группой является метил. В предпочтительном воплощении изобретения R2 представляет собой боковую цепь лейцина,4-фторлейцина. Особенно подходящие значения R2 включают те, которые воплощены частичными структурами в особенности значение R2 соответствует боковой цепи L-лейцина. Воплощения, приведенные в абзаце непосредственно выше, преимущественно применяют к соединениям, где R3 или R5 представляют собой фтор. Как правило, радикал R3, такой как фтор, если присутствует, расположен по мета-положению относительно бензиламидной связи, как показано ниже на частичной структуре Соединение, которое представляет данное воплощение, имеет формулу-2 017395 В определенных воплощениях изобретения R5 представляет собой F, в особенности, когда R3 представляет собой Н и/или R4 представляет собой метил. Подходящие соединения в этом воплощении имеютR2 в виде боковой цепи 4-фторлейцина и более предпочтительно лейцина. Соединение, которое представляет данное воплощение, имеет формулу Предпочтительные воплощения изобретения включают те, которые представлены ниже в каждом случае со стереохимией, определенной выше в формуле IIa. Предпочтительные воплощения изобретения включают соединения формулы IIa, представленные какN-[1-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4-[5-метил-2-(4 метилпиперазин-1-ил)тиазол-4-ил]бензамид или их фармацевтически приемлемую соль или N-оксид. Особенно предпочтительные воплощения изобретения включают соединения формулы IIa, представленные как N-[1-(6-хлор-3-оксогексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4-[5-фтор 2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензамид, или их фармацевтически приемлемую соль илиN-оксид. Дальнейшим аспектом изобретения является применение соединения, описанного выше, для лечения или для производства лекарственного средства для лечения расстройств, опосредованных катепсином K, таких как остеопороз; заболевания десны, такие как гингивит и периодонтит; болезнь Пэджета; гиперкальциемия при злокачественных заболеваниях; метаболическое заболевание костей; заболевания, характеризующиеся избыточной деградацией хряща или матрикса, такие как остеоартрит и ревматоидный артрит; рак костей, включая неоплазию; боль. Также предусматривается способ лечения или предотвращения заболевания, опосредованного катепсином K, включающий введение безопасного и эффективного количества соединения согласно изобретению, который в этом нуждается. Такие субъекты обычно являются млекопитающими, в частности людьми. Соединения по изобретению могут образовывать соли, которые образуют дополнительный аспект изобретения. Соответствующие фармацевтически приемлемые соли соединений формулы IIa включают соли органических кислот, в особенности карбоновых кислот, включая, но без ограничения, ацетат,трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат, альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат,гептаноат, гексаноат, фумарат, никотиноат, пальмоат, пектинат, 3-фенилпропиноат, пикрат, пивалат,пропионат, лактобионат, пиволат, камфорат, ундеканоат и сукцинат, органические сульфоновые кислоты, такие как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат,2-нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и неорганические кислоты, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, гемисульфат, тиоцианат, персульфат, фосфорные и сульфоновые кислоты.N-оксиды соединений по изобретению могут быть получены с помощью способов, известных среднему специалисту. Например, N-оксиды могут быть получены путем обработки неокисленной формы соединения по изобретению агентом окисления (например, трифторперуксусной кислотой, пермалеиновой кислотой, пербензойной кислотой, перуксусной кислотой, метахлорпероксибензойной кислотой или им подобные) в подходящем инертном органическом растворителе (например, галогенированном углеводороде, таком как дихлорметан) при температуре приблизительно 0 С. Альтернативно, N-оксиды соединений по изобретению могут быть получены из N-оксида соответствующего исходного продукта.-3 017395 Примеры N-оксидов по изобретению включают те, в которых есть частичные структуры: Соединения по изобретению в неокисленной форме могут быть получены из N-оксидов соответствующих соединений по изобретению путем обработки агентом восстановления (например, серой, диоксидом серы, трифенилфосфином, боргидридом лития, боргидридом натрия, дихлоридом фосфора,трибромидом фосфора или им подобными) в подходящем инертном органическом растворителе (например, ацетонитриле, этаноле, водном растворе диоксана или им подобных) в интервале температур от 0 до 80 С. Следует отметить, что расположения радикала, встречающегося в определениях, в любом остатке молекулы могут быть по любому его положению при условии, что соединение является химически стабильным. Радикалы, используемые в определениях переменных, включают все возможные изомеры, если иное не указано. Когда любая переменная появляется более чем один раз в любом компоненте, каждое определение является независимым. Если иное не упомянуто или не указано, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которым указанное соединение может располагать. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений настоящего изобретения как в чистой форме, так и в смеси друг с другом подразумеваются как охваченные границами настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как упомянуто в настоящем описании, определены как изомеры, по существу, свободные от других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистые" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по крайней мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и ни одного другого), более предпочтительно соединений или промежуточных соединений, имеющих стереоизомерный избыток от 90 вплоть до 100%, даже более предпочтительно имеющих стереоизомерный избыток от 94 вплоть до 100% и наиболее предпочтительно имеющих стереоизомерный избыток от 97 вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" должны быть понятны по аналогии, но при этом имея отношение к энантиомерному избытку и диастереомерному избытку по отношению к обсуждаемой смеси. Соединения по изобретению могут быть получены в виде их индивидуальных стереоизомеров, путем взаимодействия рацемической смеси соединения с оптически активным разрешающим агентом для образования пары диастереоизомерных соединений, разделения диастереомеров и выделения оптически чистого энантиомера. Разделение энантиомеров может быть осуществлено при использовании ковалентных диастереомерных производных соединений формулы (I), диссоциирующиеся комплексы являются предпочтительными (например, кристаллические диастереоизомерные соли). Диастереомеры имеют особые физические свойства (например, точки плавления, точки кипения, растворимость, реакционность и т.д.) и могут быть легко разделены за счет использования преимуществ этих различий. Диастереомеры могут быть разделены с помощью хроматографии, например HPLC, или предпочтительно путем методик отделения/разделения основанных на различиях в растворимости. Оптически чистый энантиомер затем выделяют вместе с агентом разделения, любыми практическими способами, которые не приводят к рацемизации. Более подробное описание методик, подходящих к разложению стереоизомеров соединений из их рацемической смеси, могут быть найдены в Jean Jacques Andre Collet, Samuel H. Wilen, Enantiomers,Racemates and Resolutions, John WileySons, Inc. (1981). В то время как возможно введение соединения по изобретению как активного агента в чистом виде,предпочтительно вводить его в виде части фармацевтического препарата. Такой препарат будет содержать вышеуказанный активный агент вместе с одним или более приемлемыми носителями/наполнителями и, необязательно, другими терапевтическими компонентами. Носитель(и) должен быть подходящим в отношении совместимости с другими компонентами препарата и не оказывать вредное действие на реципиента. Такие препараты включают таковые, подходящие для ректального, интраназального, местного(включая защечное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения, но предпочтительно такой препарат является препаратом для перорального введения. Такие препараты могут традиционно быть представлены в дозированной лекарственной форме, например таблетки и капсулы с замедленным высвобождением, и могут-4 017395 быть приготовлены с помощью любых методов, хорошо известных в области фармацевтики. Указанные методы включают стадию объединения вышеуказанного активного агента с носителем. В общем, препараты приготавливают путем однородного и тщательного объединения активного агента с жидкими носителями или хорошо измельченными твердыми носителями или с обоими и затем, если необходимо, придания формы продукту. Если производство фармацевтических препаратов включает тщательное смешивание фармацевтических наполнителей и активного ингредиента в форме соли, тогда часто предпочтительно использовать наполнители, которые не являются основными по природе, т.е. либо кислые, либо нейтральные. Препараты для перорального введения могут быть представлены в виде дискретных единиц, таких как капсулы, крахмальные облатки или таблетки, каждая из которых содержит заранее определенное количество активного агента; в виде порошка или гранул; в виде раствора или суспензии активного агента в водной жидкости или в неводной жидкости или в виде жидкой эмульсии "масло-в-воде" или жидкой эмульсии "вода-в-масле" и в виде болюса и т.д. В отношении композиций для перорального введения (например, таблетки и капсулы) термин "подходящий носитель" включает носители, такие как обычные наполнители, например связывающие агенты,например сироп, гуммиарабик, желатин, сорбит, трагакант, поливинилпирролидон (повидон), метилцеллюлоза, этилцеллюлоза, натрий-карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например кукурузный крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальция фосфат, хлорид натрия и альгиновая кислота; и смазывающие вещества, такие как стеарат магния, стеарат натрия и другие стеараты металлов, стеарат глицерина, стеариновая кислота, силиконовое масло, тальковые воски, масла и коллоидный оксид кремния. Ароматизаторы, такие как перечная мята, винтергриновое масло, вишневый ароматизатор или т.п. также могут быть использованы. Может быть желательно добавить краситель, чтобы сделать лекарственную форму легко идентифицируемой. Таблетки могут быть также покрыты оболочкой с помощью методов,хорошо известных в данной области. Таблетка может быть приготовлена путем прессования или формованием, необязательно, с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть приготовлены путем прессования в соответствующей машине активного агента в сыпучей форме, такой как порошок или гранулы, необязательно смешанных со связывающим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть получены путем формования в соответствующей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут быть необязательно покрыты оболочкой или снабжены риской и могут быть приготовлены таким образом, чтобы обеспечить замедленное или контролируемое высвобождение активного агента. Другие препараты, подходящие для перорального введения, включают пастилки, содержащие активный агент в ароматизированной основе, обычно в сахарозе и гуммиарабике или трагаканте; пастилки,содержащие активный агент в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; и зубной эликсир, содержащий активный агент в подходящем жидком носителе. Соответствующая дозировка для соединений по изобретению будет зависеть от показаний и от пациента и легко определяется с помощью традиционных исследований на животных моделях и подтверждается в клинических исследованиях на пациентах. Обычно желательными и достижимыми являются дозировки, обеспечивающие внутриклеточные концентрации (для ингибирования нормальных протеаз папаинового надсемейства) порядка 0,01-100 мкМ, более предпочтительно 0,01-10 мкМ, такие как 0,1-25 мкМ. Соединения по изобретению получают с помощью ряда методов жидкостной и твердофазной химии. Соединения, как правило, получают в виде строительных блоков, относящихся к остаткам P1, P2 иP3 конечного ингибиторного продукта. В любом случае, не желая быть связанными с теорией или экспериментальными способами определения связывания для определенных переменных, отвлеченные понятия P1, P2 и P3, как используют в настоящем описании, обеспечены только для удобства и имеют, по существу, их обычные значения по Шлектеру и Бергеру (SchlecterBerger) и обозначают те части ингибитора, которые, как полагают, заполняют сайты соответственно фермента S1, S2 и S3, где S1 представляет собой смежный сайт расщепления и S3 отдален от сайта расщепления. Соединения, определенные формулой II, предназначены, чтобы быть в объеме изобретения, независимо от способа связывания.-5 017395 В общем строительный блок P1 будет иметь формулу где PG представляет собой обычную N-защитную группу или свободный амин; две Rb группы определяют кеталь, такой как бис-метилкеталь, или вместе определяют циклический кеталь, такой как 1,3-диоксолан;Rc представляет собой защитную группу гидроксила или реже представляет собой Н или представляет собой кетофункцию целевого ингибитора в случаях, когда строительный блок P1 в виде кетона удлиняется с помощью P2 и P3;P3, как правило, включает головную группу, такую как производное бензойной кислоты сN-алкилпиперазинил-Е остатком, уже введенным или обеспеченным с помощью синтона в параположение. Подходящие защищенные индивидуальные строительные блоки могут быть вначале получены и последовательно связаны вместе предпочтительно в последовательности P2+P1P2-P1, а затемN-алкилпиперазинилтиазолилбензойная кислота+P2-P1N-алкилпиперазинилтиазолилбензоат-P2-P2P1, гдеозначает активированную форму, для того, чтобы минимизировать рацемизацию на P2. Связывание между двумя аминокислотами, аминокислотой и пептидом или двумя пептидными фрагментами может быть осуществлено с использованием стандартных методик связывания, таких как азидный способ, смешанный углерод-карбоксиангидридный (изобутилхлорформиат) способ, карбодиимидный (дициклогексилкарбодиимид, диизопропилкарбодиимид или растворимый в воде карбодиимид) способ, способ на основе активного сложного эфира (п-нитрофениловый эфир, N-гидроксиянтарный имидоэфир), K-способ с реагентом Вудварда (Woodward), карбонилдиимидазольный способ, способы с реагентами фосфора или окисления-восстановления. Некоторые из указанных способов (в особенности карбодиимидный способ) могут быть улучшены путем добавления 1-гидроксибензотриазола или 4-DMAP. Указанные реакции связывания могут быть выполнены или в растворе (жидкая фаза), или в твердой фазе. Более подробно, стадия связывания включает дегидративное связывание свободного карбоксила одного из реагентов со свободной аминогруппой другого реагента в присутствии агента связывания для образования связующей амидной связи. Описания таких агентов связывания приведены в общих руководствах по пептидной химии, например М. Bodanszky, "Peptide Chemistry", 2nd rev ed., Springer-Verlag,Berlin, Germany (1993), в дальнейшем просто названные как Бодански (Bodanszky), содержание которых при этом включено как ссылка. Примерами подходящих агентов связывания являютсяN,N'-дициклогексилкарбодиимид, 1-гидроксибензотриазол в присутствии N,N'-дициклогексилкарбодиимида или N-этил-N'-[(3-диметиламино)пропил]карбодиимида. Возможный и пригодный агент связывания является коммерчески доступным - это гексафторфосфат (бензотриазол-1-илокси)-трис(диметиламино)фосфония или отдельно, или в присутствии 1-гидроксибензотриазола или 4-DMAP. Другим возможным и пригодным агентом связывания является коммерчески доступный тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Еще другим возможным и пригодным агентом связывания является коммерчески доступный гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония. Реакцию связывания проводят в инертном растворителе, например дихлорметане, ацетонитриле или диметилформамиде. Добавляют избыток третичного амина, например диизопропилэтиламина,N-метилморфолина, N-метилпирролидина или 4-DMAP, чтобы поддерживать pH реакционной смеси при значении, равном приблизительно 8. Температура реакции, как правило, находится в интервале между 0 и 50 С, и время реакции, как правило, - в интервале между 15 мин и 24 ч. Функциональные группы элементов неприродных аминокислот, как правило, могут быть защищены во время реакции связывания, чтобы избежать образования нежелательных связей. Защитные группы,которые могут быть использованы, представлены в Greene, "Protective Groups in Organic Chemistry", JohnYork (1981), в дальнейшем просто названные как Грин (Greene), включены в настоящее описание посредством ссылки. Альфа-карбоксильная группа С-конца остатка является, как правило, защищенной в виде сложного эфира, который может быть отщеплен, что дает карбоновую кислоту. Защитные группы, которые могут быть использованы, включают 1) алкильные сложные эфиры, такие как метил, триметилсилил и третбутил; 2) аралкильные сложные эфиры, такие как бензил и замещенный бензил; или 3) сложные эфиры,-6 017395 которые могут быть расщеплены с помощью мягкого основания или мягких агентов восстановления,таких как трихлорэтильные и фенацильные сложные эфиры. Альфа-аминогруппа каждой аминокислоты, которая должна быть связанной, как правило, являетсяN-защищенной. Может быть использована любая защитная группа, известная из уровня техники. Примеры таких групп включают 1) ацильные группы, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы и 9-флуоренилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как трет-бутилоксикарбонил (Boc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкилкарбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилил, такой как триметилсилил; и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Предпочтительной альфа-аминозащитной группой является или Boc, или Fmoc. Большинство аминокислотных производных, приемлемо защищенных для пептидного синтеза, являются коммерчески доступными. Альфа-аминозащитную группу, как правило, отщепляют до следующей стадии связывания. Когда используют Boc группу, выбранными реагентами являются трифторуксусная кислота, чистая или в дихлорметане, или HCl в диоксане или в этилацетате. Полученную аммонийную соль затем нейтрализуют или до связывания, или in situ с основными растворами, такими как водные буферные растворы, или третичных аминов в дихлорметане или ацетонитриле, или диметилформамиде. Когда используют Fmoc группу, выбранными реагентами являются пиперидин или замещенный пиперидин в диметилформамиде, но может быть использован любой вторичный амин. Снятие защиты проводят при температуре в интервале между 0 С и комнатной температурой, как правило, 20-22 С. Как только заканчивается ингибиторная последовательность, любые остающиеся защитные группы удаляют любым способом, продиктованным выбором защитных групп. Указанные методики хорошо известны среднему специалисту. Первую стадию в синтезе соединений по изобретению, таких как те, которые представлены общей формулой IIa, обычно получают в растворе функционирующего P1 строительного блока, например, как показано на схеме 1. Хотя схема, представленная выше, иллюстрирована с помощью стратегии, использующей отличную защитную группу, включая ацетил, мезил, TBDPS и Boc группу, является очевидным, что могут использоваться другие перестановки обычных защитных групп, как описано у Грина (там же). Кроме того,может быть приемлемо использовать диметилполуацеталь кетоновой группы во время связывания P2 иP3 остатков с последующим восстановлением функции кетона на последней стадии. Увеличение длины строительных блоков с помощью P2 и P3 строительных блоков, как правило,осуществляют в присутствии подходящего агента связывания, например гексафторфосфата бензотриазол-1-илокси-трис-пирролидинофосфония (PyBOP), гексафторфосфата О-бензотриазол-1-илN,N,N',N'-тетраметилурония(HBTU),гексафторфосфата О-(7-азабензотриазол-1-ил)-1,1,3,3 тетраметилурония (HATU), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) или 1,3-дициклогексилкарбодиимида (DCC), необязательно в присутствии 1-гидроксибензотриазола (НОВТ) и основания, такого как N,N-диизопропилэтиламин, триэтиламин, N-метилморфолин и им подобные. Реакции, как правило, осуществляют в интервале температур от 20 до 30 С, предпочтительно при температуре приблизительно 25 С и требуют от 2 до 24 ч для завершения. Подходящими реакционными растворителями являются инертные органические растворители, такие как галогенированные органические растворители (например, хлористый метилен, хлороформ и им подобные), ацетонитрил,N,N-диметилформамид, эфирные растворители, такие как тетрагидрофуран, диоксан и им подобные. Альтернативно, указанная выше стадия связывания для удлинения может быть осуществлена вначале путем превращения Р 3/P2 строительного блока в активное производное кислоты, такое как сукцинимидный сложный эфир, с последующим его взаимодействием с амином P1. Реакция, как правило, требует от 2 до 3 ч для своего завершения. Условия, используемые в этой реакции, зависят от природы-8 017395 производного активной кислоты. Например, если оно является таким производным, как хлорангидрид кислоты, реакцию проводят в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, пиридина и им подобным). Подходящими реакционными растворителями являются полярные органические растворители, такие как ацетонитрил, N,N-диметилформамид, дихлорметан или любые их подходящие смеси.P2 строительные блоки в виде N-защищенных L-аминокислот являются коммерчески легко доступными, например L-лейцин, L-изолейцин, L-циклогексилглицин, О-метил-L-треонин и др. являются коммерчески доступными с рядом различных защитных групп, таких как CBz, Boc или Fmoc. Соединения с другими значениями R2 легко получают из коммерчески доступных исходных продуктов. Например, соединения, где R2 представляет собой -С(СН 3)2 ОСН 3, могут быть получены путем взаимодействия CBz защищенной (S)-(+)-2-амино-3-гидрокси-3-метилбутановой кислоты с 3,3-диметоксигексагидрофуро(3,2b)пирролом для образования требуемого P2-P1 блока. Боковая цепь P2 спирта может тогда быть метилирована, используя метилиодид в обычных условиях гидрида натрия, имидазола, ТГФ, чтобы получить требуемый P2 без существенной рацемизации альфа-центра. Этот P2-P1 остаток может затем быть пронесен через синтез, как определено в настоящем описании, а именно через удаление CBz и связывание.WO 05/565299 описывает получение гамма-фторлейцинового P2 строительного блока. Альтернативный синтез Fmoc и N-Boc-гамма-фторлейциновых строительных блоков представлен в Truong et al.SynLett, 2005, no 8, 1278-1280. Получение P3 строительных блоков написано в WO 05/66180 или их легко получают с помощью аналогичных способов. Например, на схеме 2 показано получение фтор-замещенного тиазолила. Схема 2-положению кетона выполняют с помощью брома в уксусной кислоте, чтобы обеспечить требуемый метиловый эфир 4-(2-бромацетил)бензойной кислоты. Последовательная обработка метилового эфира 4(2-бромацетил)бензойной кислоты фторидом калия в присутствии 18-краун-эфира-6 при температуре 90 С обеспечивает метиловый эфир 4-(2-фторацетил)бензойной кислоты после хроматографии на колонке. Повторное бромирование по -положению кетона выполняют с помощью брома в уксусной кислоте,чтобы обеспечить требуемый метиловый эфир 4-(2-бром-2-фторацетил)бензойной кислоты. Образование тиазола, как правило, осуществляют путем нагревания метилового эфира 4-(2-бром-2 фторацетил)бензойной кислоты с 4-метилпиперазин-1-карботиоамидом при температуре 70 С в течение 2 ч. При охлаждении требуемый метиловый эфир 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4 ил]бензойной кислоты высаживается. Снятие защиты с метилового эфира проводят, используя раствор гидроксида лития и требуемую кислоту, 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойную кислоту, как правило, получают с хорошим выходом в виде дигидрохлоридной соли при обработке соляной кислотой.WO 05/066159 и WO 05/065578 описывают получение соединений, где P2 и P3 блоки связывают вместе через C(CF3) остаток, включая те, где P3 представляет собой бифенилсульфон. Пример получения такого P2-P3 строительного блока, подходящего для получения соединений формулы II, где Rq представляет собой трифторметил и Rq' представляет собой Н, показан на схеме 3. Защиту кислотной функции бромпроизводного (3 а) получают в соответствии с методикой, описанной в Bioorg. Med. Chem. Lett. 2006, 16, 1985, с помощью реакции, например с изопропиловым спиртом в присутствии кислоты, такой как серная кислота, обеспечивая соответствующий сложный эфир. Требуемое производное тиазола может затем быть связано с ароматической группой из предоставленного сложного эфира, используя, например, условия связывания по Штилле или Сузуки. Например, сложный эфир бромпроизводного 3 а может взаимодействовать с борановым реагентом, подобным пинакол-борановому комплексу в присутствии хлорида [1,1'-бис-(дифенилфосфино)ферроцен]палладия(II), чтобы обеспечить соответствующее диоксоборолановое производное. Последующее замещение бороновой группы требуемым производным тиазола 3b в присутствии хлорида [1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) затем дает биарильное производное 3 с. Тиазольные производные 3b могут быть получены, например, как определено в J. Med. Chem. 2005, 48, 7520-7534. Удаление кислотной защитной группы, например, путем обработки кислотой, такой как хлористо-водородная кислота в диоксане, обеспечивает P2-P3 строительный блок, готовый для связывания с P1 строительным блоком, чтобы обеспечить соединения по изобретению. WO 07/006716 демонстрирует получение и связывание строительных блоков, таких как P3 иP3-P2. Термин "N-защитная группа" или "N-защищенный", как используют в настоящем описании, относится к группам, предназначенным, чтобы защитить N-концы аминокислоты или пептида или чтобы защитить аминогруппу от нежелательной реакции во время синтеза. Как правило, используемыеYork, 1981), что включено в настоящее описание посредством ссылки. N-защитные группы включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил,2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил,бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и им подобные; сульфонильные группы,такие как бензолсульфонил, п-толуолсульфонил и им подобные, образуют карбаматные группы,такие как бензилоксикарбонил,п-хлорбензилоксикарбонил,п-метоксибензилоксикарбонил,п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил,4-метоксибензилоксикарбонил,2-нитро-4,5-диметоксибензилоксикарбонил,3,4,5-триметоксибензилоксикарбонил,1-(п-бифенилил)-1-метилэтоксикарбонил-диметил-3,5 диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутоксикарбонил, диизопропилметоксикарбонил,изопропилоксикарбонил,этоксикарбонил,метоксикарбонил,аллилоксикарбонил,2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и им подобные; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и им подобные; и силильные группы, такие как триметилсилил и им подобные. Подходящие N-защитные группы включают формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, бензил (bz),трет-бутоксикарбонил (Boc) и бензилоксикарбонил (Cbz). Гидрокси- и/или карбоксизащитные группы также широко рассмотрены в той же книге у Грина и включают эфиры, такие как метил, замещенные метиловые эфиры, такие как метоксиметил, метилтиометил, бензилоксиметил, трет-бутоксиметил, 2-метоксиэтоксиметил и им подобные, силиловые эфиры, такие как триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), трибензилсилил, трифенилсилил,трет-бутилдифенилсилил, триизопропилсилил и им подобные, замещенные этиловые эфиры, такие как 1-этоксиметил, 1-метил-1-метоксиэтил, трет-бутил, аллил, бензил, п-метоксибензил, дифенилметил, трифенилметил и им подобные, аралкильные группы, такие как тритил и пиксил (9-гидрокси-9 фенилксантеновые производные, в особенности хлорид). Гидроксизащитные группы сложного эфира включают эфиры, такие как формиат, бензилформиат, хлорацетат, метоксиацетат, феноксиацетат, пивалоат, адамантоат, мезитоат, бензоат и им подобные. Карбонатные гидроксизащитные группы включают- 10017395 метил, винил, аллил, циннамил, бензил и им подобные. Подробное описание воплощений Различные воплощения изобретения будут затем описаны путем иллюстрации со ссылкой на следующие примеры. Пример 1. Получение строительного блока P1. Стадия а).Schwarzenbach, Dominique; Barbalat-Rey, Francoise; Tronchet, Jeannine. Carbohydrate Research (1977), 59(1),87-93) растворяют в сухом пиридине (50 мл) и раствор охлаждают до температуры 0 С. К раствору медленно добавляют мезилхлорид и дают возможность ему нагреться вплоть до комнатной температуры. Реакционную смесь перемешивают в течение ночи и через 14 ч добавляют MeOH (10 мл), а затем EtOAc(150 мл). Раствор промывают трижды 2 М H2SO4 (водный раствор) (3100 мл) и дважды NaHCO3 насыщенный (водный раствор) (2100 мл) и после этого органическую фазу сушат Na2SO4, фильтруют и концентрируют в вакууме. Затем продукт помещают в вакуумный насос на ночь, чтобы удалить оставшиеся растворители, продукт 2 получают в виде масла бледно-желтого цвета с количественным выходомNaOAc (23,4 г, 285 ммоль) и АС 2 О (48,6 мл, 0,514 моль), который затем нагревают до температуры 125 С в течение 86 ч. Некоторое количество растворителя удаляют путем выпаривания на роторе перед добавлением 500 мл EtOAc. Раствор очень темного цвета фильтруют через целит. Органическую фазу промывают Н 2 О (3350 мл). Затем ее сушат Na2SO4, фильтруют и растворитель удаляют путем выпаривания на роторе. Сырые продукты очищают с помощью колоночной флэш-хроматографии (смесь гептан:этилацетат 7:32:1), получая требуемое соединение 3 с 61% выходом (5,70 г) и соединение 4 с 22% выходом (2,34 г). Соединение 3: 1H ЯМР (CDCl3, 400 МГц) 1,34 (с, 3 Н), 1,53 (с, 3 Н), 2,09 (с, 3 Н), 2,11 (с, 3 Н), 3,94 (д,1 Н, J=3,4 Гц), 4,19 (дд, 1 Н, J=12,2, 5,0 Гц), 4,32 (дд, 1H, J=8,0, 3,3 Гц), 4,37 (дд, 1 Н, J=12,3, 3,5 Гц), 4,73 Триэтилсилан (27,6 мл, 173 ммоль) добавляют к соединению 3 (5,70 г, 17,3 ммоль), растворенному в сухом DCM (40 мл). Круглодонную колбу помещают в инертную атмосферу (N2) на бане со льдом и дают возможность остыть перед медленным добавлением BF3Et2O (23,1 мл, 173 ммоль). Реакция медленно продолжается и полученную реакционную смесь перемешивают в течение 3 дней. После указанного времени исходный продукт еще присутствует. Медленно добавляют NaHCO3 (насыщенный водный раствор) (70 мл), а затем добавляют ложкой твердый NaHCO3, пока не прекратится выделение газа. Водные фазы экстрагируют с помощью DCM (150 мл) и затем последовательно промывают NaHCO3 (насыщенный водный раствор) (70 мл) и NH4Cl (насыщенный водный раствор) (70 мл). Органическую фазу сушатNa2SO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью колоночной флэшхроматографии (смесь гептан:этилацетат (2:1), что дает выход 41% (1,95 г) соединения 5. 0,69 г оставше- 11017395 гося исходного продукта также выделяют. 1(50 мл). Через несколько минут добавляют TBDPSCl и полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют этилацетат (200 мл) и раствор промывают 10% лимонной кислотой (водный раствор) (350 мл) и NaHCO3 (насыщенный водный раствор) (50 мл). Органическую фазу сушат Na2SO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью колоночной флэш-хроматографии (смесь гептан:этилацетат (4:1), что дает соединение 6 с выходом 92% (3,39 г). 1 Н ЯМР (CDCl3, 400 МГц) 1,09 (с, 9 Н), 2,04 (с, 3 Н), 2,05 (с, 3 Н), 3,71 (дд, 1 Н, J=4,3, 2,1 Гц), 3,78 (дд,1 Н, J=9,5, 2,2 Гц), 3,99 (дд, 1 Н, J=9,6, 4,6 Гц), 4,12 (дд, 1 Н, J=12,2, 5,1 Гц), 4,28-4,33 (м, 2 Н), 4,36-4,40 (м,1 Н), 5,17-5,22 (м, 1 Н), 7,37-7,51 (м, 6 Н), 7,58-7,74 (м, 4 Н). Стадия е).(60 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч перед нейтрализацией раствора путем добавления смолы Dowex 50 WX8 (Н+ форма), пока значение pH не достигнет нейтрального значения. Гранулы смолы отфильтровывают и растворитель удаляют путем выпаривания на роторе, а затем в высоком вакууме. Продукт 7 получают с количественным выходом (2,66 г). 1 Соединение 7 (1,4 г, 3,27 ммоль), растворенное в хлороформе (10 мл) и пиридине (4,77 мл,58,9 ммоль), охлаждают на бане с сухим льдом и ацетоном. Добавляют SO2Cl2 (1,56 мл, 19,6 ммоль) и после этого баню удаляют. Реакционную смесь перемешивают в течение ночи, и со временем она становится более темной. Через 16 ч реакционную смесь разбавляют DCM (15 мл) и промывают 10% лимонной кислотой (водный раствор) (15 мл) и NaHCO3 (насыщенный водный раствор) (15 мл). Органическую фазу сушат Na2SO4, фильтруют и концентрируют в вакууме. Масло коричневого цвета растворяют вMeOH (10 мл) и к полученному раствору добавляют приблизительно 0,5 мл NaI (0,8% в MeOH: Н 2 О(1:1, который перемешивают в течение 15 мин. Затем растворитель упаривают и сырой продукт очищают с помощью колоночной флэш-хроматографии (смесь гептан:этилацетат (4:1), что дает выход 68% соединения 8. 1 Н ЯМР (CDCl3, 400 МГц) 1,10 (с, 9 Н), 3,80-3,85 (м, 2 Н), 3,89 (дд, 1 Н, J=12,1, 5,8 Гц), 3,96 (дд, 1 Н,J=9,7, 3,8 Гц), 4,00 (дд, 1 Н, J=12,3, 2,6 Гц), 4,15 (ддд, 1 Н, J=9,7, 5,9, 2,6 Гц), 4,32-4,36 (м, 2 Н), 7,35-7,52 (м,6 Н), 7,58-7,75 (м, 4 Н).PPh3 (882 мг, 3,36 ммоль) добавляют к раствору соединения 8 (1,04 г, 2,24 ммоль) в MeOH (50 мл) и Н 2 О (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. LC-MS показывает отсутствие исходного продукта, но очень небольшое количество циклизованного продукта. TEA(9,38 мл, 67,2 ммоль) и Н 2 О (5 мл) добавляют к раствору, который нагревают до температуры 50 С. Через 4 ч LC-MS показывает отсутствие нециклизованного амина. Растворитель упаривают и сырой продукт очищают с помощью флэш-хроматографии (смесь гептан:этилацетат (3:2, что дает продукт 9 с 54% вы- 12017395 ходом (0,49 г).Boc-ангидрид (0,52 г, 2,40 ммоль) добавляют к раствору соединения 9 (0,48 г, 1,20 ммоль) в 50 мл смеси MeOH:ТЕА (9:1). Реакционную смесь перемешивают в течение ночи и после этого растворитель удаляют путем концентрации в вакууме. Сырой продукт очищают с помощью колоночной флэшхроматографии (смесь гептан:этилацетат (4:12:1, что дает продукт 10 с количественным выходом Фторид тетрабутиламмония (1,79 мл, 1,79 ммоль) добавляют к раствору соединения 10 (0,60 г,1,19 ммоль), растворенному в ТГФ (12 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч перед удалением растворителя путем концентрации в вакууме. Сырой продукт очищают с помощью колоночной флэш-хроматографии (смесь гептан:этилацетат (1:10:1), и получают с 94% выходом (0,29 г) соединение 11. 1 Н ЯМР (CDCl3, 400 МГц) 1,45-1,52 (м, 9H), 3,16-3,32 (м, 1H), 3,83-4,22 (м, 5 Н), 4,41-4,54 (м,1 Н), 4,66-4,71 (м, 1 Н). Обозначает ротамеры. Стадия j). Периодинан Десс-Мартина (0,60 г, 1,42 ммоль) добавляют к раствору соединения 11 (0,34 г,1,29 ммоль), растворенному в сухом DCM. Реакционную смесь перемешивают в атмосфере N2 в течение 2 ч, когда, как полагают, реакция достигает завершения, что определяют с помощью ТСХ. Раствор промывают трижды (320 мл) смесью 1:1 10% Na2S2O3 (водный раствор) и NaHCO3 (насыщенный водный раствор). Органическую фазу сушат Na2SO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью флэш-хроматографии (смесь гептан:этилацетат (3:1, что дает выход 84% (284 мг) соединения 12. 1 Предварительно смешанный раствор AcCl (42 мкл, 0,601 ммоль) и MeOH (5 мл) добавляют к раствору соединения 12 (263 мг, 1,01 ммоль). После перемешивания в течение 2 ч вводят дополнительное количество AcCl (0,98 мл, 14 ммоль) и снова после перемешивания в течение 16 ч вводят дополнительное количество AcCl (9,8 мл, 140 ммоль). Реакцию быстро заканчивают, после чего реакционную смесь концентрируют в вакууме и затем любой оставшийся растворитель удаляют в высоком вакууме, что дает сырой выход 103% (253 мг) соединения 13. 1(112 мг, 0,460 ммоль), растворенному в ДМФА (6 мл). Реакционную колбу охлаждают на бане со льдом в течение 10 мин, перед добавлением HATU (193 мг, 0,506 ммоль). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре перед концентрацией в вакууме. Сырой остаток растворяют вCHCl3 (15 мл) и промывают 10% лимонной кислотой (водный раствор) (10 мл) и NaHCO3 (насыщенный водный раствор) (10 мл). Органическую фазу сушат Na2SO4, фильтруют и упаривают. Сырой продукт очищают с помощью флэш-хроматографии (смесь гептан:этилацетат (2:11:1, что дает продукт 14 с выходом 62% (121 мг). Пример 3. Строительный блок P3. 4-[5-Метил-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойная кислота Как описано в методике получения 4-цианоацетофенона (Synth. Commun, 1994, 887-890), смесь из 4-бромпропиофенона (5,65 г, 26,4 ммоль), Zn(CN)2 (1,80 г, 15,3 ммоль) и Pd(PPh3)4 (2,95 г, 2,6 ммоль) нагревают при температуре кипения с обратным холодильником при температуре 80 С в дезоксигенированном ДМФА (35 мл, хранящийся над 4 молекулярными ситами, барботированием Ar до применения) в течение 18 ч. Смесь распределяют между толуолом (100 мл) и 2 н. раствором NH4OH (100 мл). Органическую фазу экстрагируют раствором 2 н. NH4OH (100 мл), промывают насыщенным водным растворомNaCl (2100 мл), сушат и концентрируют в вакууме. Аналогичным образом получают 10 ммоль реакционной смеси и сырые продукты объединяют. Флэш-хроматография (330 г силикагеля, 6/1 петролейный эфир - EtOAc) дает требуемое соединение в виде твердого вещества белого цвета (5,17 г, 89%). 1 Н ЯМР (CDCl3)част./млн: 1,22 (т, 3 Н, J=7,2 Гц), 3,00 (кв., 2 Н, J=7,3 Гц), 7,75 (д, 2 Н, J=8,8 Гц),8,03 (д, 2 Н, J=8,4 Гц). 13 С ЯМР (CDCl3)част./млн: 7,8, 32,1, 116,1, 117,9, 128,3, 132,4, 139,7, 199,2. Стадия b). 4-Пропионилбензойная кислота 4-Цианопропиофенон (4,67 г, 29,3 ммоль) нагревают при температуре кипения с обратным холодильником с 2 н. раствором NaOH (90 мл, 180 ммоль) и диоксаном (90 мл) при температуре 95 С в течение ночи. Смесь разбавляют водой (150 мл), промывают эфиром (75 мл), подкисляют до значения pH,равного 2, с помощью концентрированной HCl и экстрагируют эфиром (375 мл). Органическую фазу промывают насыщенным водным раствором NaCl (375 мл), сушат и концентрируют, что дает твердое вещество желтого цвета (5,12 г, 98%). 1(935 мкл, 15 ммоль) в ДМФА (10 мл) перемешивают при комнатной температуре в течение ночи. Смесь разбавляют насыщенным водным раствором NaCl (50 мл) и экстрагируют эфиром (350 мл). Органическую фазу промывают водой (50 мл), сушат и концентрируют. Флэш-хроматография (90 г силикагель, 2/1 петролейный эфир - EtOAc) дает твердое вещество белого цвета (744 мг, 77%). 1 Метил-4-пропионилбензоат (744 мг, 3,87 ммоль), гидротрибромид пирролидона (1,98 г) и 2-пирролидинон (380 мг, 4,5 ммоль) в ТГФ (38 мл) нагревают при температуре 50 С в атмосфере азота в течение 3 ч. Смесь охлаждают, фильтруют, концентрируют в вакууме и затем повторно растворяют в эфире (50 мл). Раствор эфира промывают последовательно водой (20 мл), насыщенным водным раствором Na2S2O5 (20 мл), насыщенным водным раствором NaCl (20 мл) и водой (20 мл), сушат и концентрируют в вакууме, что дает масло желтого цвета (1,025 г), которое используют непосредственно в реакции связывания по Хантчу (Hantzsch). Указанный продукт содержит 91% требуемого бромкетона, 5% исходного кетона и 4% 4-бром-1-бутанола, как определяют с помощью 1 Н ЯМР. 1 Н ЯМР (CDCl3)част./млн: 1,92 (д, 3 Н, J=7 Гц), 3,96 (с, 3 Н), 5,28 (кв., 1 Н, J=7 Гц), 8,07 и 8,14 Все -бромкетоны, полученные выше, и трет-бутиловый эфир 4-тионокарбонилпиперазин-1 карбоновой кислоты (J. Med. Chem., 1998, 5037-5054, 917 мг, 3,73 ммоль) нагревают при температуре кипения с обратным холодильником в 36 мл ТГФ при температуре 70 С в течение 2 ч в атмосфере N2. Осадок отфильтровывают и фильтрат концентрируют в вакууме, что дает твердое вещество желтого цвета. Колоночная флэш-хроматография (силикагель, 5/1 петролейный эфир - EtOAc) дает 624 мг твердого вещества светло-желтого цвета. Хроматография осадка (силикагель, 2/1 петролейный эфир - EtOAc) дает дополнительно 32 мг соединения. Общий выход 44%. 1 Н ЯМР (CDCl3)част./млн: 1,46 (с, 9 Н), 2,43 (с, 3 Н), 3,42 (м, 4 Н), 3,54 (м, 4 Н), 3,90 (с, 3 Н), 7,68 и 8,04 (ABq, 4 Н). Стадия f). 4-[2-(4-трет-Бутоксикарбонилпиперазин-1-ил)-5-метилтиазол-4-ил]бензойная кислота Указанный выше метиловый эфир (564 мг, 1,35 ммоль) нагревают с 1,35 мл 2 н. раствора NaOH,5 мл ТГФ и 3,65 мл воды при температуре 60 С в течение 4 ч. Реакционную смесь упаривают, выливают в 20 мл насыщенного водного раствора NaCl и 20 мл CH2Cl2 и затем подкисляют до значения pH, равного 3, с помощью 5% раствора лимонной кислоты, на бане со льдом. Слои разделяют и органическую фазу экстрагируют дополнительно 210 мл CH2Cl2. Органические фазы объединяют, промывают водой(10 мл), сушат и концентрируют в вакууме, что дает твердое вещество светло-желтого цвета (537 мг,98%). 1(0,421 ммоль) растворяют в 4 М растворе HCl в 1,4-диоксане и перемешивают при комнатной температуре в течение 1 ч. Затем растворитель удаляют в вакууме и остаток в виде 4-(5-метил-2-пиперазин-1 илтиазол-4-ил)бензойной кислоты суспендируют в метаноле (10 мл) и обрабатывают буферомAcOH/AcONa (pH5,5; 5 мл), затем формальдегидом (0,547 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем обрабатывают NaCNBH3 (0,547 ммоль) и перемешивают при комнатной температуре в течение ночи. Затем растворитель удаляют в вакууме и остаток очищают с помощью колоночной хроматографии, что дает указанное в заголовке соединение (0,403 ммоль, 95%). Ацетилхлорид (0,4 мл) добавляют по каплям к раствору соединения 14 (0,121 г, 0,288 ммоль) в метаноле (4 мл) при температуре 0 С. Затем реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют в вакууме. Остаток повторно растворяют дважды в сухом ДМФА (5 мл) и концентрируют досуха, затем снова растворяют в ДМФА (6 мл). К раствору добавляют 4-[5-метил-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойную кислоту HCl (112 мг, 0,316 ммоль) и DIEA(190 мкл, 1,15 ммоль) перед его охлаждением до температуры 0 С и затем добавляют HATU (120 мг,0,316 ммолъ). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре перед удалением растворителя путем выпаривания на роторе. Сырую смесь растворяют в CHCl3 (15 мл) и промывают 10% лимонной кислотой (водный раствор) (10 мл) и NaHCO3 (насыщенный водный раствор) (10 мл). Органическую фазу сушат Na2SO4, фильтруют и упаривают. Сырой продукт очищают с помощью колоночной флэш-хроматографии (1:1 смесь этилацетат:ацетон + 0,2% TEA), что дает продукт в виде бесцветного масла/твердого вещества с 84% выходом (150 мг).H ЯМР (CDCl3, 400 МГц) для основного ротамера (13:1 смесь ротамеров): 0,98 (д, 3 Н, J=6,5 Гц),1,04 (д, 3 Н, J=6,4 Гц), 1,55-1,89 (м, 3 Н), 2,34 (с, 3 Н), 2,42 (с, 3 Н), 2,49-2,54 (м, 2 Н), 3,25 (с, 3 Н), 3,43 (с,3 Н), 3,45-3,51 (м, 3H), 3,72 (д, 1 Н, J=10,5 Гц), 3,91 (д, 1 Н, J=10,5 Гц), 4,05-4,15 (м, 1 Н), 4,46-4,53 (м, 1 Н),4,59 (дд, 1 Н, J=5,2, 5,1 Гц), 4,74 (д, 1 Н, J=5,6 Гц), 4,96-5,04 (м, 1 Н), 6,83 (д, 1 Н, J=8,0 Гц), 7,68 (д, 2 Н,J=8,3 Гц), 7,79 (д, 2 Н, J=8,5 Гц). Пример 5. Соединение 15 (137 мг, 0,220 ммоль) растворяют в 20 мл TFA:H2O (97,5:2,5) и перемешивают в течение 4 ч. Растворитель удаляют в вакууме и сырой продукт предварительно абсорбируют на силикагеле,чтобы очистить с помощью колоночной флэш-хроматографии (смесь EtOAc:ацетон (1:2) с 0,2% TEA),что дает продукт (лиофилизованный из диоксана) в виде твердого вещества грязно-белого цвета с 71% выходом (90 мг). 1H ЯМР (CDCl3, 400 МГц) для основного ротамера (10:1 смесь ротамеров): 0,98 (д, 3 Н, J=6,5 Гц),1,02 (д, 3 Н, J=6,2 Гц), 1,58-1,86 (м, 3 Н), 2,34 (с, 3 Н), 2,42 (с, 3H), 2,50-2,54 (м, 2 Н), 3,44-3,53 (м, 2 Н), 3,68 К перемешиваемому раствору сырого соединения 12 (приблизительно 0,56 ммоль) в триметилортоформиате (0,8 мл) и метаноле (3 мл) добавляют моногидрат п-толуолсульфоновой кислоты (п-TsOH,0,007 г, 0,037 ммоль), затем нагревают до температуры 50 С в течение ночи. После этого ход реакции контролируют с помощью ТСХ (3:2 смесь гексан-этилацетат, окрашивание нингидрином). Реакционную- 16017395 смесь нагревают до температуры 60 С и добавляют общее количество 21 мг п-TsOH в течение более 4 ч,что дает кеталь со снятой Вос-защитой в виде основного продукта (как регистрируют с помощью ТСХ). Затем реакционную смесь охлаждают до комнатной температуры и добавляют триэтиламин(0,32 мл, 2,24 ммоль), а затем ди-трет-бутилдикарбонат (0,184 г, 0,84 ммоль). Реакционную смесь оставляют при комнатной температуре на 2,5 ч, затем концентрируют в вакууме и остаток абсорбируют на силикагеле. Колоночная флэш-хроматография остатка (ступенчатый градиент элюирования, этилацетат в гексане, 20-25%), последующая концентрация в вакууме соответствующих фракций и удаление оставшегося растворителя путем дополнительного высушивания на вакуумной линии в течение ночи дает продукт 31 в виде твердого вещества грязно-белого цвета (0,069 г, 0,022 ммоль, 40% после 2 стадий). 1 К перемешиваемому раствору соединения 31 (0,074 г, 0,24 ммоль) в метаноле (2,7 мл) при температуре 0 С добавляют по каплям ацетилхлорид (0,3 мл) в течение более 1 мин. Ход реакции контролируют с помощью ТСХ (3:2 смесь гексан-этилацетат и полученную смесь 95:5 дихлорметан-метанол, окрашивание нингидрином) и после 4,5 ч исходный продукт полностью вступает в реакцию. Затем реакционную смесь концентрируют в вакууме и затем повторно растворяют в диоксане с несколькими каплями Н 2 О,после чего лиофилизуют. Полученное аморфное твердое вещество грязно-белого цвета и моногидратN-(трет-бутоксикарбонил)-L-лейцина (0,066 г, 0,26 ммоль) растворяют в ДМФА (3 мл) и концентрируют в вакууме. Остаток повторно растворяют в ДМФА (3 мл) и добавляют N-этилдиизопропиламин (0,13 мл,0,72 ммоль). К этому раствору добавляют гексафторфосфат N-O-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония (HATU, 0,12 г, 0,31 ммоль) при температуре 0 С. Реакционную смесь оставляют при температуре 0 С на 40 мин и еще на 75 мин при комнатной температуре. Затем реакционную смесь разбавляют этилацетатом (25 мл), промывают последовательно водным раствором 10% лимонной кислоты(315 мл) и насыщенным водным раствором гидрокарбоната натрия (315 мл) и затем сушат (сульфат натрия), фильтруют и концентрируют в вакууме. Колоночная флэш-хроматография на силикагеле остатка, используя 2:1 смесь гексан-этилацетат в виде элюента, последующая концентрация в вакууме соответствующих фракций, дает соединение 32b в виде бесцветного сиропа (0,089 г, 0,21 ммоль, 88%), который используют непосредственно на следующей стадии. Стадия с). К раствору соединения 32b (0,089 г, 0,21 ммоль) в метаноле (2,7 мл) при температуре 0 С добавляют по каплям ацетилхлорид (0,3 мл) в течение 0,5 мин. Затем реакционную смесь перемешивают при комнатной температуре в течение 5,5 ч (контролируют с помощью ТСХ: 95:5 смесь дихлорметанметанол, окрашивания, используя смесь молибдат аммония - сульфат церия в 10% водном растворе серной кислоты) и затем концентрируют в вакууме. Остаток повторно растворяют в диоксане (5 мл) и добавляют небольшое количество воды и затем раствор лиофилизуют. Полученное бесцветное аморфное твердое вещество и 4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты HBr соль (0,089 г,0,23 ммоль) растворяют в ДМФА (3 мл) и затем добавляют N-этилдиизопропиламин (0,15 мл,0,85 ммоль) и раствор охлаждают до температуры 0 С и добавляют HATU (0,105 г, 0,275 ммоль). Реакционную смесь перемешивают при температуре 0 С в течение 1 ч и еще в течение 1 ч при комнатной температуре (контролируют с помощью ТСХ: 95:5 смесь дихлорметан-метанол, наблюдают с помощью УФ-излучения и окрашивания, используя смесь молибдат аммония-сульфат церия в 10% водном растворе серной кислоты). Затем реакционную смесь разбавляют этилацетатом (25 мл), промывают 3:1 насыщенным водным раствором гидрокарбоната натрия/рассолом (320 мл), затем сушат (сульфат натрия),фильтруют и концентрируют в вакууме. Колоночная флэш-хроматография остатка, используя ступенчатый градиент элюирования (метанол в дихлорметан, 0-5%), последующая концентрация в вакууме соответствующих фракций и лиофилизация из диоксана (5 мл) с несколькими каплями воды дает продукт 32 с в виде бесцветного аморфного твердого вещества (0,121 г, 0,20 ммоль, 94%). К продукту 32 с (0,114 г, 0,188 ммоль) добавляют раствор 97,5:2,5 TFA-вода (6 мл) при комнатной температуре, полученный раствор контролируют с помощью LC-MS и после перемешивания в течение 2 ч при комнатной температуре реакционную смесь концентрируют в вакууме. Остаток повторно растворяют в этилацетате (25 мл), промывают насыщенным водным раствором гидрокарбоната натрия(315 мл) и рассолом (115 мл), затем сушат (сульфат натрия), фильтруют и концентрируют в вакууме. Остаток, полученный в виде аморфного твердого вещества, растворяют в смеси ДМСО-ацетонитрилвода-диоксан (приблизительно 12 мл) и очищают с помощью препаративной HPLC-MS (колонка:Sunfire 19100 мм (C18), элюент А: 10 мМ ацетата аммония в воде, элюент В: 10 мМ ацетата аммония в 9:1 ацетонитрил-вода, градиент: от 30% В до 80% В в течение 8 мин, скорость потока: 20 мл/мин). Соответствующие фракции концентрируют в вакууме. Остаток повторно растворяют в диоксане с несколькими каплями воды, замораживают и лиофилизуют, получая соединение 32d в виде аморфного твердого вещества грязно-бело-желтого цвета (0,055 г, 0,10 ммоль, 52%). Аликвоту полученного продукта растворяют в CDCl3 и анализируют с помощью ЯМР-спектра, который определяет выход продукта в кетоформе(гидратная форма не обнаруживается) в 9:1 смеси ротамеров. ЯМР-данные относятся к основному ротамеру. Когда анализируют с помощью HPLC-MS, гидратная форма представляет собой основную форму. 1HCl соль (3aS,6R,6aS)-6-хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррола (13) (0,23 ммоль) и Bocциклогексил-Gly-OH (64,4 мг, 0,25 ммоль) совместно упаривают из ДМФА, повторно растворяют в 3 мл ДМФА и охлаждают на бане со льдом. Добавляют DIEA (160 мкл, 0,92 ммоль), а затем HATU (108 мг,0,28 ммоль). Через 20 мин смесь перемешивают при комнатной температуре в течение 2 ч 20 мин и концентрируют в вакууме. Остаток растворяют в EtOAc (10 мл), промывают последовательно 10% раствором лимонной кислоты (5 мл), насыщенным раствором NaHCO3 (5 мл) и насыщенным раствором NaCl(25 мл). Органическую фазу сушат (Na2SO4) и концентрируют. Колоночная флэш-хроматография (силикагель, 2/1 пентан - EtOAc) дает твердое вещество белого цвета (86,6 мг, 84% выход). Ацетилхлорид (0,25 мл) добавляют к охлажденному льдом раствору трет-бутилового эфира карбаминовой кислоты, полученного выше (86,6 мг, 0,194 ммоль) в метаноле (2,20 мл). Смесь перемешивают при комнатной температуре в течение 3 ч 45 мин и упаривают. Сушка сублимацией из раствора диоксанвода дает незащищенную HCl соль амина, которую затем вначале совместно упаривают из ДМФА с 4-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты HBr солью (83 мг, 0,22 ммоль) и затем повторно растворяют в 2,5 мл ДМФА. Смесь охлаждают на бане со льдом, добавляют DIEA (140 мкл,0,80 ммоль), а затем HATU (83,8 мг, 0,22 ммоль). Через 15 мин смесь перемешивают при комнатной температуре в течение 2,5 ч. Смесь концентрируют, растворяют в EtOAc (20 мл), промывают последовательно насыщенным раствором NaHCO3 (10 мл) и насыщенным раствором NaCl (210 мл). Органическую фазу сушат (Na2SO4) и концентрируют. Колоночная флэш-хроматография (силикагель, CH2Cl2 MeOH - Et3N) дает твердое вещество белого цвета (121,2 мг, 99% выход).(97,5:2,5 об./об., 6,0 мл) путем перемешивания при комнатной температуре в течение 2 ч 15 мин. Смесь концентрируют, растворяют в EtOAc (25 мл), промывают последовательно насыщенным растворомNaHCO3 (315 мл) и насыщенным раствором NaCl (15 мл). Органическую фазу сушат (Na2SO4) и упаривают. Сырой продукт очищают с помощью HPLC-MS (колонка Sunfire PrepC18OBD 5 мкм 19100 мм; градиент от 60 до 80% В в А, мобильные фазы А 10 нМ NH4OAc в воде и В 10 мМ NH4OAc в 90%MeCN), что дает конечное соединение в виде твердого вещества белого цвета (63 мг, 59% выход). Ацетилхлорид (0,4 мл) добавляют по каплям к раствору соединения 11 (60 мг, 0,228 ммоль) в метаноле (4 мл) при температуре 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч, концентрируют, повторно растворяют в 1,4-диоксане и сушат сублимацией в течение ночи. Остаток растворяют в 5 мл ДМФА. К раствору добавляют -фтор-Boc-Leu-OH (Truong et al. SynLett, 2005, 8, 1279-1280, 50 мг, 0,201 ммоль) и DIEA (133 мкл, 0,802 ммоль) перед его охлаждением до температуры 0 С и затем добавляют HATU (80 мг, 0,211 ммоль). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре перед концентрированием растворителя в вакууме. Продукт растворяют в EtOAc (20 мл) и промывают NaHCO3 (насыщенный водный раствор) (10 мл). Органическую фазу сушат(этилацетат), что дает продукт 42 с 99% выходом (79 мг) Стадия b). Ацетилхлорид (0,4 мл) добавляют по каплям к раствору соединения 42 (79 мг, 0,199 ммоль) в метаноле (4 мл) при температуре 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч, концентрируют, повторно растворяют в 1,4-диоксане и сушат сублимацией в течение ночи. Остаток растворяют в 5 мл ДМФА. К раствору добавляют 4-[2-(4-метилпиперазин-1-ил)тиазол-4 ил]бензойной кислоты HBr (76 мг, 0,198 ммоль). Добавляют DIEA (119 мкл, 0,721 ммоль), перед его охлаждением до температуры 0 С, и HATU (72 мг, 0,189 ммоль). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре перед удалением растворителя в вакууме. Продукт растворяют вNa2SO4, фильтруют и упаривают. Продукт очищают с помощью флэш-хроматографии (7:3 смесь хлороформ:этанол + 0,1% TEA), что дает на выходе в достаточной мере чистое соединение 43, которое может быть использовано непосредственно на следующей стадии. Стадия с).(111 мкл, 0,797 ммоль), а затем SO3 пиридин (48 мг, 0,299 ммоль). Реакционную смесь перемешивают при комнатной температуре и контролируют с помощью LC-MS. Через 4 ч добавляют другую порцию(48 мг) SO3 пиридина и более чем через 4 ч другую порцию. Через 22 ч (в течение ночи) вводят дополнительную порцию и более чем через 2 ч добавляют конечную порцию. Раствор выливают в делительную воронку с 40 мл DCM и промывают 20 мл NaHCO3 (насыщенный водный раствор). Органическую фазу сушат Na2SO4, фильтруют и концентрируют в вакууме. Продукт очищают с помощью полупрепаративной HPLC на Sunfire C18 колонке с мобильной фазой А (90:10 H2O:ацетонитрил, 10 мМ NH4Ac) и В(10:90 Н 2 О:ацетонитрил, 10 мМ NH4Ac), идя от 40-75% В. Продукт получают в виде твердого вещества грязно-белого цвета с 29% выходом (30 мг). 1 Н ЯМР (CDCl3, 400 МГц): 1,37-1,52 (м, 6 Н), 2,10-2,30 (м, 2 Н), 2,37 (с, 3 Н), 2,58-2,63 (м, 2 Н), 3,573,62 (м, 2 Н), 3,73 (дд, 1H, J=10,5, 8,7 Гц), 4,10 (д, 1H, J=16,9 Гц), 4,28 (д, 1H, J=16,9 Гц), 4,43-4,50 (м, 1 Н),4,71 (дд, 1 Н, J=10,6, 6,9 Гц), 4,78 (д, 1H, J=6,0 Гц), 4,87-4,93 (м, 1 Н), 4,95-5,03 (м, 1H), 6,86 (с, 1 Н), 7,37 (д,1 Н, J=7,3 Гц), 7,73 (д, 2 Н, J=8,3 Гц), 7,82 (д, 2H, J=8,6 Гц).LRMS (М+Н) 578. Пример 9. Альтернативный строительный блок P3. 4-Бром-3-фторбензойную кислоту (2,46 г, 11,2 ммоль) растворяют в MeOH (9 мл) и толуоле (4 мл) и охлаждают на бане со льдом. Добавляют по каплям (триметилсилил)диазометан (11 мл, 2,0 М в гексане,22 ммоль), пока сохраняется желтый цвет. Раствор перемешивают при комнатной температуре в течение 40 мин и затем концентрируют в вакууме. Вторую порцию карбоновой кислоты (2,43 г) обрабатывают аналогичным образом. Сырой продукт из обеих порций объединяют и подвергают флэш-хроматографии(силикагель, 5/1 пентан - EtOAc), что дает метиловый эфир в виде твердого вещества белого цвета Аллилхлорид (105 мкл, 1,28 ммоль) и TFA (20 мкл, 0,26 ммоль) добавляют к суспензии цинкового порошка (480 мг, 7,34 ммоль) и безводный бромид кобальта(II) (96,6 мг, 0,44 ммоль) в MeCN (4 мл) в инертном газе. После перемешивания при комнатной температуре в течение 10 мин добавляют арилбромид (1,003 г, 4,30 ммоль растворенный в 5 мл MeCN) из стадии (а), а затем уксусный ангидрид (0,45 мл,4,79 ммоль) и дополнительное количество MeCN (1 мл). Смесь перемешивают в течение ночи, гасят 1 М раствором HCl (20 мл) и затем экстрагируют с помощью EtOAc (320 мл). Органическую фазу промывают последовательно насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором NaCl(220 мл), сушат (Na2SO4) и концентрируют. Флэш-хроматография (силикагель, от 6/1 до 4/1 смесь петролейный эфир-EtOAc) дает регенерированный бромид (161,1 мг, 16%) и требуемый кетон (твердое вещество белого цвета, 305,5 мг, 36%). 1 Н ЯМР (400 МГц, CDCl3)част./млн: 7,94-7,86 (м, 2 Н), 7,80 (дд, 1 Н, J=11,2, 1,6 Гц), 3,95 (с, 3 Н),2,67 (д, 3 Н, J=4,4 Гц); 19 ТГФ (10 мл) и 2-пирролидинон (91 мкл, 1,20 ммоль) добавляют к смеси кетона со стадии b)(198 мг, 1,01 ммоль) и гидротрибромиду пирролидона (532 мг, 1,07 ммоль). После нагревания при температуре 60-65 С в течение 2 ч смесь концентрируют в вакууме и затем распределяют между EtOAc (20 мл) и насыщенным раствором Na2S2O3 (10 мл). Водные фазы экстрагируют с помощью EtOAc (10 мл). Органические фазы объединяют, промывают насыщенным раствором NaCl (210 мл), сушат (Na2SO4) и концентрируют. Флэш-хроматография (силикагель, 7/1 петролейный эфир - EtOAc) дает твердое вещество белого цвета (0,2634 г), содержащее 84% требуемого бромида (как определяют с помощью интегрирования 19F ЯМР пиков). 1 Н ЯМР (400 МГц, CDCl3)част./млн: 7,93 (м, 1 Н), 7,88 (м, 1 Н), 7,79 (дд, 1 Н, J=11,2, 1,6 Гц), 4,50EtOH (5,0 мл) добавляют к бромкетону, полученному выше (193 мг, 0,70 ммоль), и амиду 4-метилпиперазин-1-карботиокислоты (113 мг, 0,71 ммоль), после чего полученную смесь нагревают при температуре 70 С в течение 2 ч 15 мин. Осадки отфильтровывают, промывают холодным EtOH, сушат в вакууме и идентифицируют. Методику повторяют в большем масштабе для 1,75 г бромкетонаLCMS [М+Н]+=336. Осадки из обоих приготовлений объединяют и суспендируют в насыщенном растворе NaHCO3(50 мл). Смесь экстрагируют с помощью EtOAc. Органическую фазу промывают водой, сушат (Na2SO4) и упаривают, что дает указанное в заголовке соединение в виде твердого вещества кремового цвета Метиловый эфир (1,76 г, 5,25 ммоль) (9d) нагревают при температуре 80 С с 6 М раствором HCl(40 мл) в течение 5,5 ч. Вводят дополнительное количество 6 М раствора HCl (10 мл) и полученную смесь нагревают при температуре 90 С в течение 1 ч 15 мин. Затем после охлаждения смесь упаривают в вакууме и сушат сублимацией из воды, что дает конечный продукт в виде твердого вещества кремового Указанное соединение получают из трет-бутилового эфира N-[(S)-1-3S,3aS,6R,6aS)-6-хлор-3 гидроксигексагидрофуро[3,2-b]пиррол-4-карбоновой кислоты путем серий из снятия защиты (ацетилхлорид, MeOH) и HATU-опосредованных стадий связывания первоначально с Вос-лейцином и, наконец, сF ЯМР (376 МГц, CDCl3+CD3OD)част./млн: -113,3 (м). Стадия b). Триэтиламин (20 мкл) и комплекс триоксид серы-пиридин (20 мг, 0,125 ммоль) добавляют к раствору спирта (16,6 мг, 0,03 ммоль) со стадии (а) в 0,9 мл CH2Cl2 и 0,45 мл ДМСО и перемешивают при комнатной температуре. Через 2 ч вводят дополнительное количество триэтиламина (10 мкл) и комплекса триоксид серы-пиридин (10 мг) и полученную смесь перемешивают в течение ночи, чтобы полностью завершить окисление до кетона. Смесь разбавляют CH2Cl2 и промывают насыщенным растворомNaHCO3, а затем насыщенным водным раствором NaCl. Органическую фазу сушат (Na2SO4), упаривают и получают масло. Сырой продукт очищают с помощью HPLC-MS (колонка Sunfire PrepC18um 19100 мм; OBD 5 градиент от 30 до 80% В в А, мобильные фазы А 10 мМ NH4OAc в воде и В 10 мМNH4OAc в 90% MeCN), что дает указанное в заголовке соединение в виде твердого вещества белого цвета (4,4 мг). 1 Н ЯМР (CDCl3, 500 МГц, регистрируют 2 ротамера, основной ротамер описывают) част./млн: 8,22 (м, 1 Н, фенил Н 5), 7,56-7,54 (м, 2 Н, фенил Н 2 и Н 6), 7,21 (м, 1 Н, тиазол), 6,81 (д, 1 Н, J=8,5 Гц, NH),4,94-4,85 (м, 2 Н, NHCHC=O и ClCCHO), 4,84 (д, 1 Н, J=6,0 Гц, (O=C)NCHC=O, 4,56 (дд, 1 Н, J=10,5,7,0 Гц), 4,42 (м, 1 Н, ClCH), 4,32 и 4,14 (ABq, 1H каждый), 3,70 (дд, 1H, J=10,9 Гц), 3,59 (м, 4 Н), 2,57 (м,4 Н), 2,37 (с, 3 Н, NMe), 1,8-1,6 (м, 3 Н, СН 2 СНМе 2), 1,03 (д, 3 Н, J=6,0 Гц, i-Pr), 0,96 (д, 3 Н, J=6,5 Гц, i-Pr); 19LCMS: моноизотопная молярная масса 577,4 Da; ES+=578,4 (М+Н)+, 596,5 [М+Н 2 О+Н]+.- 22017395 Пример 11. Альтернативный строительный блок P3/P2 Стадия а). Изопропиловый метилпентановой кислоты (11 а)(S)-2-[(S)-1-(4-бромфенил)-2,2,2-трифторэтиламино]-4 метилпентановой кислоты, полученной, как показано в Li, C.S. et al. Bioorg. Med. Chem. Lett. 2006, 16,1985 (1,80 г, 4,9 ммоль) в изопропиловом спирте (100 мл) добавляют концентрированную серную кислоту (2 мл). Полученный раствор нагревают при температуре 80 С в течение 4 ч. Реакционной смеси дают возможность остыть и затем концентрируют в вакууме. Полученное масло диспергируют в CH2Cl2(100 мл), промывают насыщенным раствором NaHCO3 (250 мл), сушат (MgSO4) и концентрируют в вакууме, что дает на выходе указанное в заголовке соединение в виде масла коричневого цвета (1,77 г,88%). К перемешиваемому раствору бромпроизводного 1k (2,2 г, 5,36 ммоль) в ДМФА (30 мл) добавляют бис-(пинаколато)бор (2,0 г, 8,04 ммоль), ацетат калия (1,6 г, 16,1 ммоль) и хлорид[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) 1:1 комплекс с CH2Cl2 (0,438 г, 0,54 ммоль). Полученный раствор герметизируют в трубке и нагревают при микроволновом облучении до температуры 160 С в течение 20 мин. Реакционной смеси дают возможность остыть до комнатной температуры и затем фильтруют через короткую колонку с силикагелем, элюируя этилацетатом (500 мл). Полученный раствор концентрируют в вакууме и сырой продукт очищают с помощью С 18 колоночной хроматографии с обращенной фазой (H2O:MeCN, 50-100% градиент), что дает на выходе указанное в заголовке соединение в виде масла коричневого цвета (0,920 г, 38%). К перемешиваемому раствору бороланового производного 1k (0,72 г, 1,57 ммоль) в ДМФА:Н 2 О(0,129 г, 0,16 ммоль). Полученный раствор герметизируют в трубке и нагревают при микроволновом облучении до температуры 160 С в течение 20 мин. Реакционной смеси дают возможность остыть и затем разбавляют CH2Cl2 (100 мл). Органическую фазу разделяют, сушат (MgSO4) и концентрируют в вакууме. Сырой продукт очищают с помощью колоночной флэш-хроматографии (этилацетат:MeOH, 9:1), чтобы получить на выходе указанное в заголовке соединение в виде твердого вещества темно-красного цвета К перемешиваемой смеси 2 М раствора соляной кислоты и диоксана (1:1, 10 мл) добавляют изопропиловый эфирJ. Med. Chem. 2005, 48, 7520-7534. Раствор нагревают в течение 20 ч при температуре 100 С и затем концентрируют в вакууме, что дает указанное в заголовке соединение в виде твердого вещества темнокоричневого цвета (0,14 г, 98%), которое может быть связано со строительным блоком P1 и кетоном, регенерированием с помощью любого из способов, описанных выше, как правило, без дополнительной очистки.MS М-Н 469. Пример 11 А. Альтернативный строительный блок P3. Схема 4 К раствору метилового эфира 4-ацетилбензойной кислоты (8,4 ммоль) в уксусной кислоте (20 мл) добавляют бром (8,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, в течение которых красный цвет исчезает и образуется осадок грязно-белого цвета. Продукт собирают фильтрованием и промывают холодным раствором метанол/вода (200 мл 1:1), что дает на выходе порошок белого цвета (55%). 1 Н ЯМР (400 МГц, CDCl3): 3,98 (3 Н, с), 4,20 (2 Н, с), 8,02 (2 Н, д, J=8 Гц), 8,18 (2 Н, д, J=8 Гц). Стадия b). Метиловый эфир 4-(2-фторацетил)бензойной кислоты К суспензии фторида калия (3,11 ммоль) в ацетонитриле (1 мл) добавляют 18-краун эфир-6(0,1 ммоль) и полученную реакционную смесь нагревают при температуре 90 С в течение 30 мин. Добавляют 4-(2-бромацетил)бензойную кислоту (1,56 ммоль) и полученную реакционную смесь нагревают при температуре 90 С в течение 16 ч. Реакционную смесь разбавляют водой (10 мл) и экстрагируют этилацетатом (320 мл). Продукт очищают на силикагеле, элюируя 5-15% этилацетат в изогексане, что дает на выходе при концентрации в вакууме требуемые фракции указанного в заголовке продукта, в виде твердого вещества белого цвета (31%). 1 К суспензии 4-(2-фторацетил)бензойной кислоты (1,19 ммоль) в уксусной кислоте (5 мл) добавляют бром (1,19 ммоль). Реакционную смесь нагревают при температуре 45 С в течение 4 ч, в течение которых образуется раствор зеленого цвета. Реакционную смесь концентрируют в вакууме и отгоняют азеотропно дважды с толуолом, что дает на выходе указанное в заголовке соединение в виде твердого вещества зеленого цвета (100%). Продукт используют сырым на следующей стадии. 1 Н ЯМР (400 МГц, CDCl3): 3,98 (3 Н, с), 7,04 (1 Н, с), 8,05-8,10 (4H, м). Стадия d). Метиловый эфир 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты Метиловый эфир 4-(2-бром-2-фторацетил)бензойной кислоты (1,18 ммоль) и амид 4-метилпиперазин-1-карботиокислоты (1,18 ммоль) растворяют в этаноле (10 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч. Затем ее охлаждают до комнатной температуры, вызывая выпадение в осадок продукта. Продукт собирают фильтрованием и промывают холодным этанолом. Продукт подвергают обработке водным раствором гидрокарбоната натрия, что дает на выходе указанное в заголовке соединение в виде бесцветного масла (74%). К раствору метилового эфира 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты(0,43 ммоль) в смеси тетрагидрофуран/вода (2,5 мл, 4:1) добавляют гидроксид лития (0,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Затем ее концентрируют в вакууме и добавляют соляную кислоту (2 н. раствор, 3 мл), вызывая выпадение продукта в осадок в виде твердого вещества белого цвета. Продукт собирают фильтрованием, что дает на выходе указанный в заголовке продукт в виде твердого вещества белого цвета (79%). Периодинан Десс-Мартина (12,5 г, 30 ммоль) растворяют в DCM (250 мл). К перемешиваемому раствору соединения 10, полученного, как описано в WO 07/066180 (7,4 г, 20 ммоль) в DCM (50 мл), добавляют окислитель при комнатной температуре в атмосфере азота в течение 45 мин. Когда реакция, как полагают, окончательно закончится в соответствии с ТСХ, добавляют 10% водный раствор Na2S2O3(200 мл) и полученную смесь перемешивают при комнатной температуре в течение еще 15 мин. Двухфазную систему переносят в делительную колбу и экстрагируют дважды EtOAc (200 и 100 мл соответственно). Объединенные органические фазы промывают один раз насыщенным водным раствором NaHCO3(100 мл) и рассолом (100 мл), сушат над Na2SO4, фильтруют и растворитель упаривают в вакууме, получая на выходе сырой продукт 2 в виде прозрачного масла (7,69 г).(30 мл) и pTsOH (0,2 г) при комнатной температуре в атмосфере азота. Смесь нагревают при температуре 60 С в течение 8 ч. Когда реакция, как определяют в соответствии с ТСХ, окончательно закончится, реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографической колонки с силикагелем, элюируя смесью этилацетат-гептан(1:4), что дает после концентрации в вакууме кеталь 12b в виде прозрачного масла (5,9 г, 71% после 2 стадий). Раствор соединения 12b (2,5 г, 6,4 ммоль) в метаноле (60 мл) и Pd(OH)2 (0,7 г) перемешивают при комнатной температуре в атмосфере водорода в течение 48 ч. Смесь фильтруют и концентрируют в вакууме. Остаток (2,8 г, 14,8 ммоль) растворяют в 75 мл смеси диоксан/вода (2:1). Добавляют по каплям 10% раствор Na2CO3 (25 мл) до значения pH, равного 9-9,5. Смесь охлаждают до температуры 0 С на бане воды со льдом и добавляют одной порцией Boc ангидрид. Реакционную смесь перемешивают при комнатной температуре в течение ночи и pH смеси поддерживают при значении, равном 9-9,5, путем введения дополнительного количества 10% раствора Na2CO3, если необходимо. Смесь фильтруют и растворитель удаляют в вакууме. Водную смесь экстрагируют 3100 мл EtOAc, объединенные органические фазы промывают 100 мл воды и 100 мл рассола, сушат над Na2SO4, фильтруют и растворитель упаривают в вакууме, что дает 3,79 г карбамата в виде прозрачного масла (89%). К перемешиваемому раствору соединения 12 с (3,8 г, 13,13 ммоль) в CH2Cl2 (100 мл) добавляют 2 М раствор HCl в MeOH (50 мл). Полученный раствор перемешивают в течение ночи и затем концентрируют в вакууме и отгоняют азеотропно с толуолом (3100 мл). Сырой остаток растворяют в CH2Cl2(100 мл), охлаждают до температуры 0 С и добавляют пиридин (1071 мкл, 13,13 ммоль), а затем по каплям добавляют CbzCl (1875 мкл, 13,13 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем промывают 2 М раствором HCl (250 мл), насыщенным раствором NaHCO3(250 мл), сушат (MgSO4) и концентрируют. Остаток очищают с помощью колоночной флэшхроматографии (5-100% изогексан:EtOAc), что дает указанное в заголовке соединение в виде прозрачного масла (2510 мг, 59%). К перемешиваемому раствору соединения 12d (500 мг, 1,55 ммоль) в CH2Cl2 (20 мл) добавляют триэтиламин (332 мкл, 2,32 ммоль) и мезилхлорид (266 мг, 2,32 ммоль). После перемешивания в течение 30 мин реакционную смесь промывают насыщенным раствором NaHCO3 (120 мл), 2 М HCl (120 мл),сушат MgSO4 и концентрируют, что дает указанное в заголовке соединение (655 мг, 99%) в виде масла желтого цвета. К перемешиваемому раствору соединения 12 е (550 мг, 1,37 ммоль) в ДМФА (30 мл) добавляют хлорид лития (721 мг, 13,7 ммоль). После перемешивания в течение 120 мин при температуре 120 С реакционную смесь концентрируют в вакууме. Остаток разбавляют CH2Cl2 (50 мл), промывают водой(120 мл), сушат MgSO4 и концентрируют в вакууме. Остаток очищают с помощью колоночной флэшхроматографии (5-66% изогексан:EtOAc), что дает указанное в заголовке соединение (330 мг, 72%) в виде масла желтого цвета.(68 мг, 0,20 ммоль) снимают защиту путем каталитического гидрирования, используя 10% палладий-наугле и водород при атмосферном давлении. После перемешивания в течение 2 ч суспензию фильтруют через целит и фильтрат упаривают на роторе, что дает сырой 6-хлор-3,3-диметоксигексагидрофуро[3,2b]пиррол, который связывают с N-Вос-лейцином, используя HATU по способу, аналогичному тому, который описан в примере 2, что дает указанное в заголовке соединение (78 мг, 93%).MS m/z: 421,2 (М+Н)+. Стадия h). N-[2-(6-Хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4[5-фтор-2- (4-метилпиперазин-1-ил)тиазол-4-ил]бензамид (12 h). С трет-бутилового эфира [2-(6-хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4-карбонил)-3 метилбутил]карбаминовой кислоты (78 мг, 0,185 ммоль) снимают защиту в кислотных условиях (ацетилхлорид в метаноле), как описано в примере 4, и затем промежуточный сырой гидрохлорид пиррола связывают с HCl солью 4-[5-фтор-2-(4-метилпиперазин-1-ил)тиазол-4-ил]бензойной кислоты, используяHATU условия, как описано в примере 2, что дает указанное в заголовке соединение (98 мг, 85%).N-[2-(6-Хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4-карбонил)-3-метилбутил]-4-[5-фтор-2(4-метилпиперазин-1-ил)тиазол-4-ил]бензамид (98 мг, 0,157 ммоль) гидролизуют в кислотных условиях,как описано в примере 5. Остаток очищают с помощью препаративной HPLC хроматографии (С 8, градиент 10-90% MeCN/Н 2 О), что дает чистое указанное в заголовке соединение 41,8 мг (46%), в виде смеси 2 ротамеров, оба из которых являются кетонами (27%) [MS m/z: 578,1 (М+Н)+], и гидрат (73%) [MS m/z: 596,1 (М+Н 2 О+Н)+].(55 мг, 0,16 ммоль) снимают защиту путем каталитического гидрирования, используя 10% палладий-наугле и водород при атмосферном давлении. После перемешивания в течение 2 ч суспензию фильтруют через целит и фильтрат концентрируют. Затем полученный амин связывают с 4-метил-2-[2,2,2-трифтор 1-(4'-метансульфонилбифенил-4-ил)этиламино]пентановой кислотой (76 мг, 0,17 ммоль), полученной,как описано в WO 07/006716, используя HATU условия, как описано в примере 2, что дает указанное в заголовке соединение (101 мг, 50%). Стадия b). Соединение 13 а (47 мг, 0,07 ммоль) гидролизуют в кислотных условиях, как описано в примере 5. Полученный остаток очищают с помощью колоночной хроматографии (EtOAc-петролейный эфир 3:2),что дает чистое указанное в заголовке соединение (26 мг). Стадия а). 1-(6-Хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4-ил)-4-метил-2-(2,2,2-трифтор-14-[2-(4-метилпиперазин-1-ил)тиазол-4-ил]фенилэтиламино)пентан-1-он (14 а). Бензильную группу бензилового эфира 6-хлор-3,3-диметоксигексагидрофуро[3,2-b]пиррол-4 карбоновой кислоты (35 мг, 0,10 ммоль) удаляют путем каталитического гидрирования, используя 10% палладий-на-угле и водород при атмосферном давлении. После перемешивания в течение 2 ч суспензию фильтруют через целит и фильтрат концентрируют. Затем полученный амин связывают с кислотой примера 11, стадия d (42 мг, 0,09 ммоль), используя HATU условия, как описано в примере 2, что дает указанное в заголовке соединение (45 мг). Стадия b). Соединение 14 а (47 мг, 0,07 ммоль) гидролизуют в кислотных условиях, как описано в примере 5. Полученный остаток очищают с помощью колоночной хроматографии (CH2Cl2-ацетон 2:1 + 0,05%DIEA), что дает чистое указанное в заголовке соединение (20 мг). Пример 15. Альтернативный синтез строительного блока P1 Стадия i). Соединение со стадии g) примера 1 оптимизируют следующим образом. Смесь, указанную выше,включающую моно- и бициклические амины (приблизительно 1,8 ммоль) из первой реакции стадии g),растворяют в этилацетате (25 мл) и добавляют триэтиламин (1,5 мл). Раствор нагревают при температуре кипения с обратным холодильником в течение 3 ч, контролируют с помощью LC-MS, затем вводят дополнительное количество триэтиламина (1,5 мл) и полученную реакционную смесь нагревают при температуре кипения с обратным холодильником в течение еще 15 ч. Затем реакционную смесь охлаждают до температуры приблизительно 0 С и добавляют одной порцией бензилхлорформиат (0,38 мл,2,7 ммоль), затем дают возможность достичь комнатной температуры. Ход реакции контролируют с помощью ТСХ (4:1 и 3:2 смесь гексан-этилацетат, наблюдают с помощью УФ-излучения и АМСокрашивания) и через 4 ч реакционную смесь разбавляют этилацетатом (15 мл), промывают последовательно водным раствором 10% лимонной кислоты (325 мл) и насыщенным водным раствором гидрокарбоната натрия (325 мл), затем сушат (сульфат натрия), фильтруют и концентрируют. Флэш- 28017395 хроматография остатка (ступенчатый градиент элюирования, этилацетат в гексане, 10-20%), последующая концентрация соответствующих фракций и высушивание в вакууме в течение ночи дает продукт в виде бесцветной пены (0,57 г, 1,06 ммоль). 1 К перемешиваемому раствору продукта со стадии i) (0,56 г, 1,05 ммоль) в ТГФ (6 мл) добавляют 1 М раствор фторида тетрабутиламмония в ТГФ (1,26 мл) и перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь концентрируют на силикагеле и колоночная флэшхроматография остатка (ступенчатый градиент элюирования, этилацетат в гексане, 50-100%), последующая концентрация соответствующих фракций и высушивание в вакууме в течение ночи дают продукт в виде бесцветного сиропа (0,27 г, 0,91 ммоль, 87%). 1 Н ЯМР (400 МГц, 298 К, CDCl3):2,22 и 3,00 (2 д, 1 Н, JOH,3=3,5 Гц, ОН основной и второстепенный), 3,30 (м, 1H, CHH), 3,89 (м, 1H, CHH), 4,00-4,16 (м, 3 Н, 2CHH и CH), 4,24 (д, 1 Н, СН), 4,43 и 4,54 (2 ушир.с, 1 Н, Н-3 основной и второстепенный), 4,70 (м, 1 Н, СН), 5,08-5,23 (м, 2 Н, OCH2Ph), 7,32-7,40 (м,5H, Ar-H). Стадия iii). К перемешиваемому раствору продукта со стадии ii) (0,26 г, 0,88 ммоль) в дихлорметане (6 мл) добавляют периодинан Десс-Мартина (0,41 г, 0,97 ммоль) при комнатной температуре. Ход реакции контролируют с помощью ТСХ (3:2 смесь этилацетат-гексан, наблюдают с помощью окрашивания АМС) и через 3,5 ч реакционную смесь разбавляют дихлорметаном (20 мл), промывают 1:1 смесью насыщенный водный раствор гидрокарбоната натрия/10% водный раствор тиосульфата натрия (320 мл), затем сушат(сульфат натрия), фильтруют и концентрируют. Остаток повторно растворяют в метаноле (5 мл) и добавляют триметилортоформиат (1,25 мл) и моногидрат п-толуолсульфоновой кислоты (0,03 г, 0,16 ммоль). Реакционную смесь оставляют при температуре 60 С на ночь, затем добавляют диизопропилэтиламин(0,5 мл) и полученную реакционную смесь концентрируют. Флэш-хроматография (ступенчатый градиент элюирования, этилацетат в гексане, 20-40%) остатка, последующая концентрация соответствующих фракций и высушивание в вакууме в течение 2 дней дают продукт в виде бесцветного густого сиропа Хлорсодержащий строительный блок 6-S получают, как показано на схеме 4.
МПК / Метки
МПК: C07D 491/048, A61K 31/407, A61P 19/02, A61P 29/00, A61P 19/08
Метки: протеазы, ингибиторы, цистеиновой
Код ссылки
<a href="https://eas.patents.su/30-17395-ingibitory-cisteinovojj-proteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы цистеиновой протеазы</a>
Предыдущий патент: Микрооптическая система формирования визуальных изображений
Следующий патент: Бумага для офсетной печати
Случайный патент: Способ введения пептида тимозин &alpha 1


































