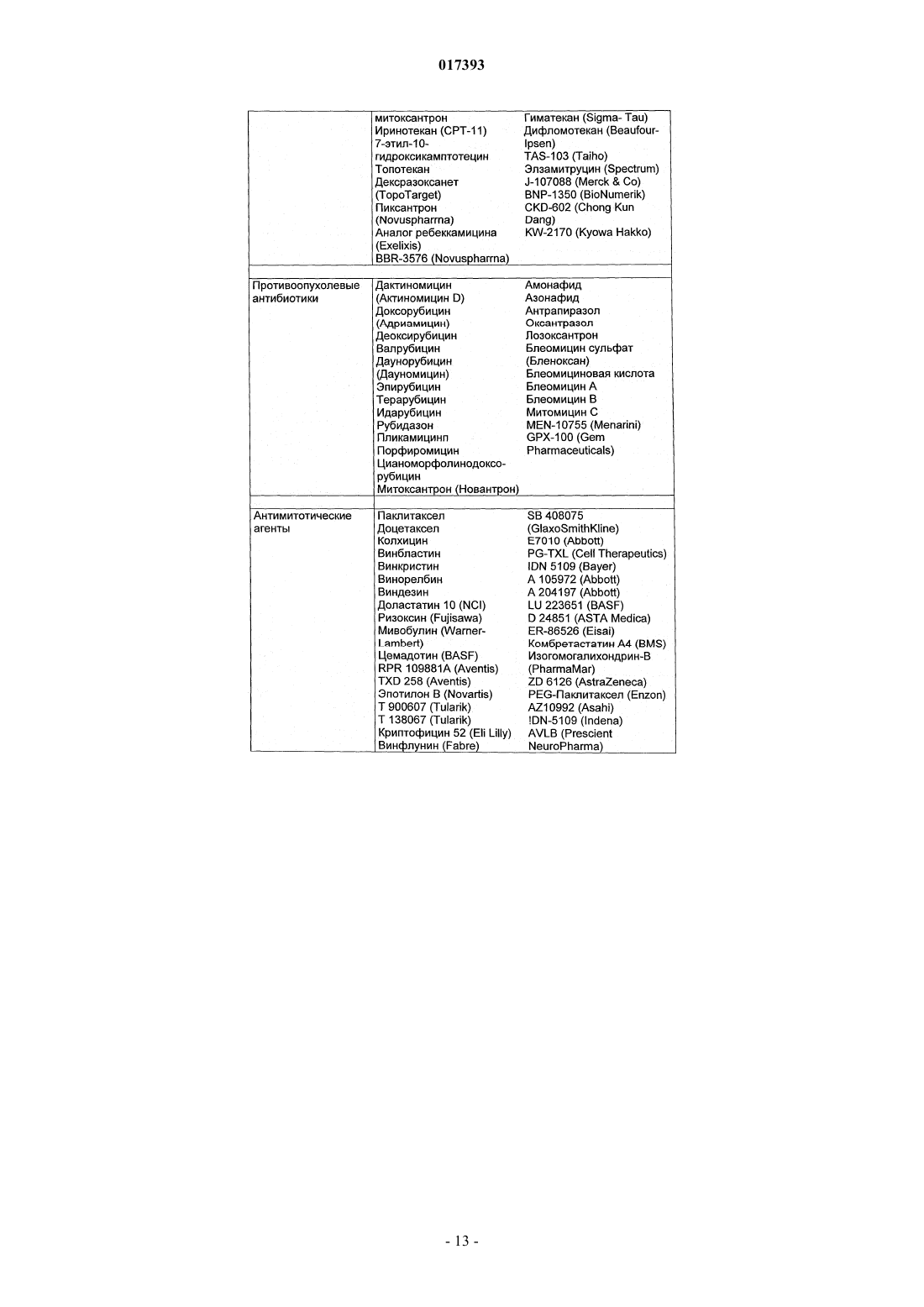
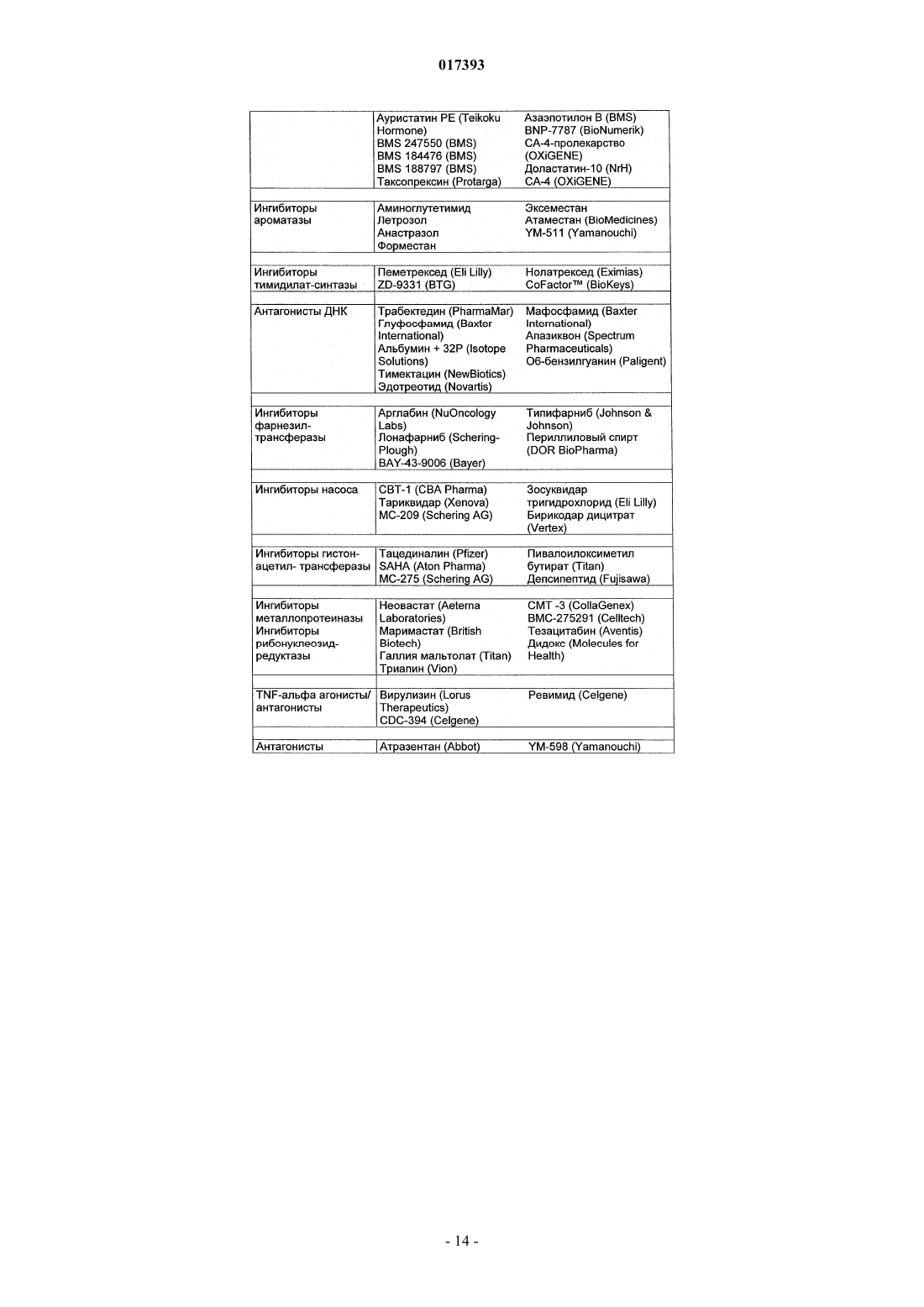
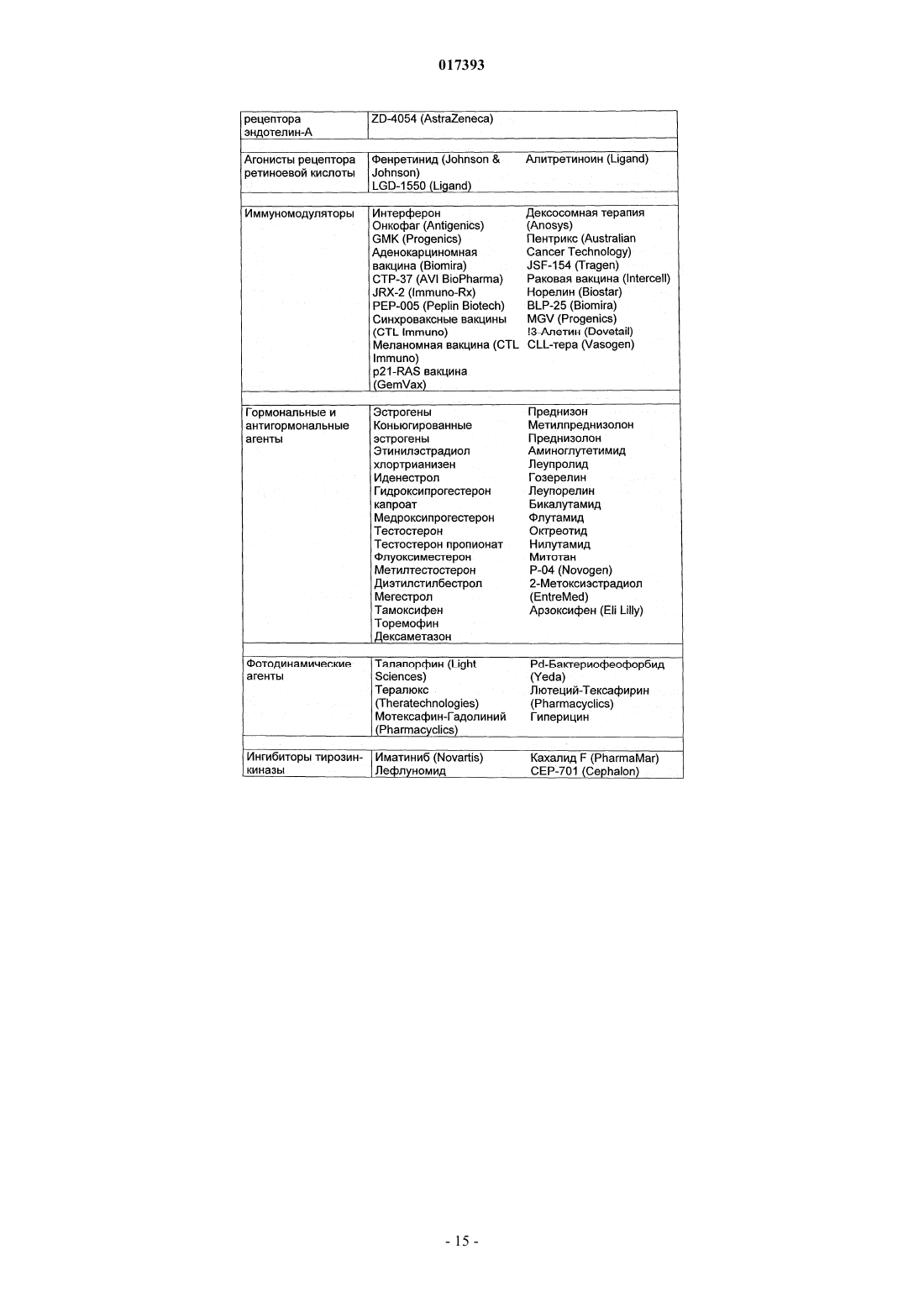
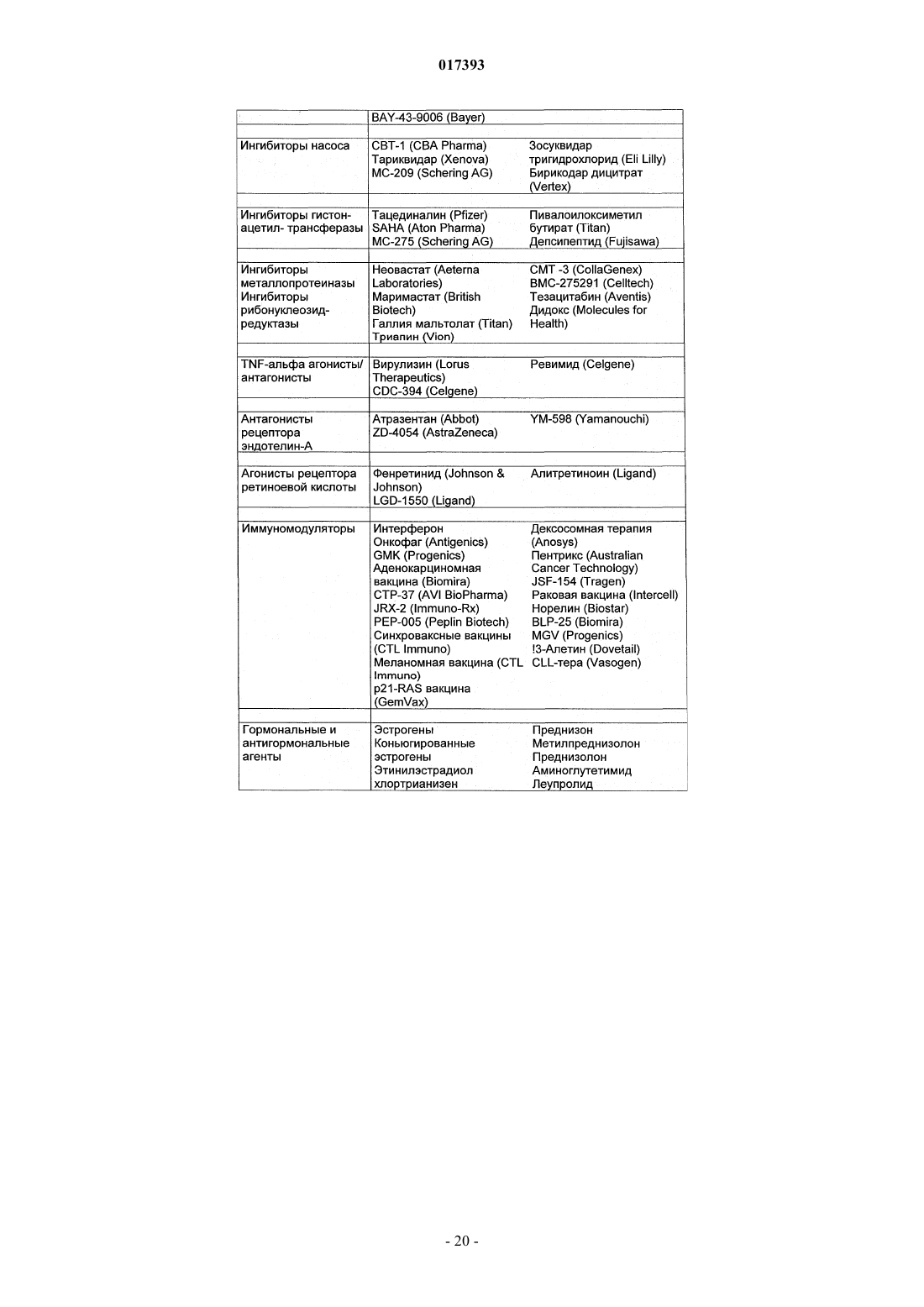
Производные тиадиазинона
Номер патента: 17393
Опубликовано: 28.12.2012
Авторы: Дорш Дитер, Шадт Оливер, Штибер Франк, Блаукат Андре
Формула / Реферат
1. Соединения формулы I
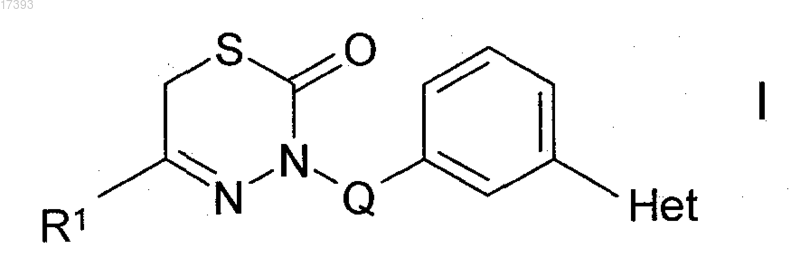
в которой R1 представляет собой Ar1 или Het1;
Het представляет собой 2-, 4-, 5- или 6-пиримидинил, 1,2,4-оксадиазол-3- или -5-ил, которые могут быть незамещенными или моно-, ди- или тризамещенными В;
Ar1 представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным Hal, ОН, ОА и/или CN;
Het1 представляет собой 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 2-, 3- или 4-пиридил, которые могут быть незамещенными или моно-, ди- или тризамещенными А;
Q отсутствует или представляет собой алкилен, содержащий 1-4 С атомов;
В представляет собой A, NH2, NHA, NAA', O(CH2)nR2, N=CH-N(CH3)2,
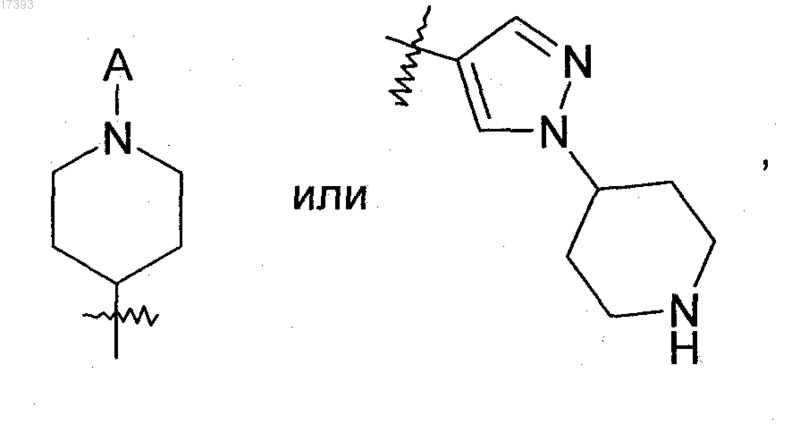
R2 представляет собой NH2, NHA, NAA',
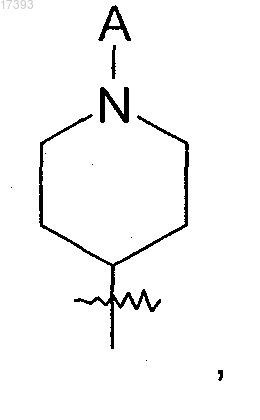
А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 Н атомов могут быть замещены F и/или Cl;
Hal представляет собой F, Cl, Br или I;
n представляет собой 0, 1, 2 или 3,
и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
2. Соединения по п.1, выбранные из группы

и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях.
3. Способ получения соединений формулы I по пп.1, 2 и их фармацевтически пригодных солей и стереоизомеров, который отличается тем, что соединение формулы II
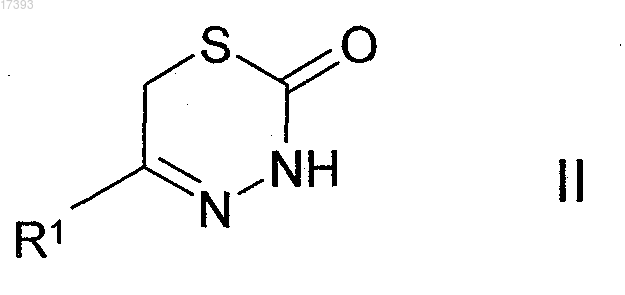
где R1 имеет значение, указанное в п.1,
подвергают реакции с соединением формулы III
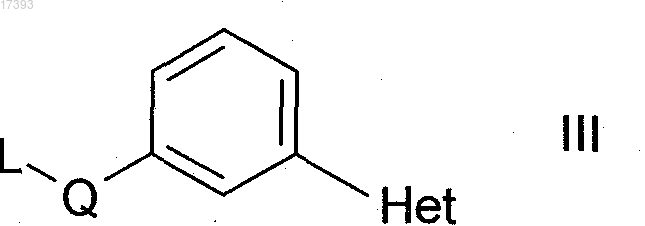
где Q и Het имеют значения, указанные в п.1;
L представляет собой Cl, Br, I или свободную или реакционноспособную функционально модифицированную ОН-группу,
и/или основание или кислоту формулы I превращают в одну из его (ее) солей.
4. Лекарственные средства, содержащие по меньшей мере одно соединение формулы I по пп.1, 2 и/или их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества.
5. Применение соединений по пп.1, 2 и их фармацевтически пригодных солей и стереоизомеров, включая их смеси во всех соотношениях, для получения лекарственного средства для лечения заболеваний, в которых играет роль ингибирование, регуляция и/или модуляция передачи сигналов с помощью киназы.
6. Применение по п.5 для получения лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование тирозинкиназ соединениями по пп.1, 2.
7. Применение по п.5 для получения лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование Met-киназы соединениями по пп.1, 2.
8. Применение по п.6 или 7, где заболевание, подвергаемое лечению, представляет собой солидную опухоль.
9. Применение по п.8, где солидная опухоль представляет собой опухоль плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани и/или легкого.
10. Применение по п.8, где солидная опухоль имеет происхождение из группы аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом и рака молочной железы.
11. Применение по п.9, где солидная опухоль имеет происхождение из группы аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом, рака толстой кишки и рака молочной железы.
12. Применение по п.6 или 7, где заболевание, подвергаемое лечению, представляет собой опухоль крови и иммунной системы.
13. Применение по п.12, где опухоль имеет происхождение из группы острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфолейкоза, хронического лимфолейкоза и/или моноцитарного лейкоза.
14. Лекарственные средства, содержащие по меньшей мере одно соединение формулы I по одному или нескольким из пп.1, 2, и/или их фармацевтически пригодные стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства.
Текст
(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 017393 Предпосылки создания изобретения Объектом изобретения является выявление новых соединений, обладающих ценными свойствами, в частности тех, которые могут применяться для приготовления лекарственных средств. Настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощью киназ, в особенности тирозинкиназ и/или серин/треонин киназ, а также к фармацевтическим композициям, которые содержат указанные соединения, и к применению соединений для лечения заболеваний, индуцированных киназой. В частности, настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощьюMet киназы. Одним из основных механизмов, с помощью которого осуществляется клеточная регуляция, является трансдукция внеклеточных сигналов через мембрану, что, в свою очередь, моделирует биохимические пути передачи сигналов в клетке. Фосфорилирование белков представляет собой один путь, с помощью которого внутриклеточные сигналы передаются от молекулы к молекуле, что в результате приводит к ответной реакции в клетке. Эти каскады трансдукции сигналов в высокой степени регулируются и часто перекрываются, очевидно, вследствие существования многих протеинкиназ, а также фосфатаз. Фосфорилирование белков преимущественно происходит в остатках серина, треонина или тирозина, поэтому протеинкиназы классифицируют по специфичности их участков фосфорилирования, т.е. серин/треониновые киназы и тирозинкиназы. Поскольку фосфорилирование представляет собой широко распространенный процесс в клетках, а фенотипы клеток значительно зависят от активности этих путей,то в настоящее время полагают, что многие болезненные состояния и/или заболевания могут быть вызваны или аберрантной активацией, или функциональными мутациями в молекулярных компонентах киназных каскадов. Следовательно, характеристике этих белков и соединений, способных модулировать их активность, уделяется пристальное внимание (для обзора см. Weinstein-Oppenheimer и др. Pharma. .Therap., 2000, 88, 229-279). Роль рецепторной тирозинкиназы Met в образовании и развитии опухолей у людей и возможность ингибирования HGF (фактор роста гепатоцитов)-зависимой активации Met описаны S. Berthou и др. вOncogene, том 23,31, c. 5387-5393 (2004). Ингибитор SU11274, раскрытый в этом источнике, пирролиндолиновое соединение, потенциально пригоден для борьбы со злокачественным новообразованием. Другой ингибитор Met киназы для лечения злокачественного новообразования описан J.G. Christensen и др. в Cancer Res. 2003, 63(21), 7345-55. Дальнейший ингибитор тирозинкиназы для борьбы со злокачественным новообразованием описан Н. Hov и др. в Clinical Cancer Research, том 10, 6686-6694(2004). Соединение РНА-665752, производное индола, направлено против HGF рецептора c-Met. Кроме того, в этом документе описано, что HGF и Met оказывают существенное влияние на злокачественность различных видов рака, таких как, например, множественная миелома. Поэтому является желательным синтезировать небольшие соединения, которые специфически ингибируют, регулируют и/или модулируют передачу сигналов с помощью тирозинкиназ и/или серин/треонин киназ, в частности Met киназы, и это составляет задачу настоящего изобретения. Было обнаружено, что соединения в соответствии с изобретением и их соли обладают чрезвычайно ценными фармакологическими свойствами, а также хорошей переносимостью. Настоящее изобретение, в частности, относится к соединениям формулы I, которые ингибируют,регулируют и/или модулируют передачу сигнала с помощью Met киназы, к композициям, которые содержат эти соединения, и к способам их применения для лечения заболеваний, индуцированных Met киназой и болезней, таких как ангиогенез, злокачественное образование, образование, рост и распространение опухоли, атерослероз, глазные заболевания, такие как дегенерация желтого пятна, связанная со старением, хороидальная неоваскуляризация и диабетическая ретинопатия, воспалительные заболевания,артриты, тромбозы, фиброзы, гломерулонефриты, нейродегенерация, псориаз, рестеноз, заживление ран,отторжение трансплантанта, метаболические заболевания и заболевания иммунной системы, также аутоиммунные заболевания, цирроз, диабет и заболевания кровеносных сосудов, такие как неустойчивость и проницаемость, и подобные у млекопитающих. Солидные опухоли, в особенности быстрорастущие опухоли, можно подвергать лечению с применением ингибиторов Met киназы. Такие солидные опухоли включают моноцитарный лейкоз, рак головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легкого, включая аденокарциному легкого и мелкоклеточный рак легкого. Настоящее изобретение относится к способам регуляции, модуляции или ингибирования Met киназы для предотвращения и/или лечения заболеваний, связанных с нерегулируемой или нарушенной активностью Met киназы. В частности, соединения формулы I также могут применяться для лечения определенных типов злокачественных новообразований. Кроме того, соединения формулы I могут применяться для обеспечения дополнительного или синергетического действий при определенных существующих химиотерапиях при лечении злокачественных новообразований и/или могут применяться для восстановления эффективности определенных существующих химиотерапий и лучевых терапий злока-1 017393 чественных новообразований. Соединения формулы I также могут применяться для выделения и исследования активности или экспрессии Met киназы. Дополнительно, они чрезвычайно пригодны для применения в диагностических способах при заболеваниях, связанных с нерегулируемой или нарушенной активностью Met киназы. Может быть продемонстрировано, что соединения в соответствии с изобретением обладают антипролиферативным действием в условиях in vivo на модели ксенотрансплантированной опухоли. Соединения в соответствии с изобретением вводятся пациенту с гиперпролиферативным заболеванием, например, для ингибирования роста опухоли, для уменьшения воспаления, связанного с лимфопролиферативным заболеванием, для ингибирования отторжения трансплантата или неврологического повреждения в результате восстановления ткани и т.д. Эти соединения пригодны для профилактических или терапевтических целей. Как используется в настоящем изобретении, термин "лечение" применяется для обозначения как предотвращения заболеваний, так лечения ранее существующих состояний. Предотвращение пролиферации достигают путем введения соединений в соответствии с изобретением до явного развития заболевания, например для предотвращения роста опухолей, предотвращения метастатического роста,уменьшения рестеноза, связанного с сердечно-сосудистой хирургией и т.д. Альтернативно, соединения применяются для лечения продолжающихся заболеваний путем стабилизации или улучшения клинических симптомов у пациента. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как,приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков, кролики; лошади, коровы, собаки, кошки и т.д. Животные модели представляют интерес для экспериментальных исследований,поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. В общем случае культуру клеток объединяют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам индуцировать гибель клетки или ингибировать миграцию, обычно в интервале времени приблизительно от 1 ч до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из образца биопсии. Затем подсчитывают жизнеспособные клетки, оставшиеся после обработки. Доза будет изменяться в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени, при поддержании жизнеспособности пациента. Лечение в общем случае продолжают до тех пор, пока не будет достигнуто существенного уменьшения, например, по меньшей мере приблизительно 50% уменьшения популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока, по существу, в организме не будет определяться нежелательных клеток. Для идентификации пути сигнальной трансдукции и определения взаимодействий между различными сигнальными путями различными учеными были разработаны приемлемые модели или модельные системы, например модели на основе культур клеток (например, Khwaja и др., ЕМВО, 1997, 16, 2783-93) и модели трансгенных животных (например, White и др., Oncogene, 2001, 20, 7064-7072). С целью проверки определенных этапов каскада для сигнальной трансдукции можно использовать соединения, которые препятствуют этому процессу, для модуляции сигнала (например, Stephens и др., Biochemical J.,2000, 351, 95-105). Соединения в соответствии с изобретением могут также быть полезными в виде реагентов для тестирования зависимых от киназы путей сигнальной трансдукции у животных и/или на моделях культур клеток, а также на любом из клинических расстройств, указанных в данном изобретении. Измерение киназной активности представляет собой известный способ, который может осуществить любой специалист в данной области. Общие аналитические системы для определения киназной активности с субстратами, например, гистоном (например, Alessi и др., FEBS Lett. 1996, 399, 3, с. 333-338) или основным миелиновым белком описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr.,J.R. 1992, J. Biol. Chem. 267, с. 14535). Для идентификации ингибиторов киназы доступными являются различные аналитические системы. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19) и анализе флэш-планшетов измеряют радиоактивное фосфорилирование белка или пептида в виде субстрата с ATP. В присутствии ингибиторного соединения выявляется снижение радиоактивного сигнала или не выявляется никакого сигнала. Кроме того, в виде аналитических способов являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени (HTRFRET) и флуоресцентной поляризации (FP) (Sills и др., J. of Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфо-антитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антиовечьего антитела, конъюгированного с пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Существует много заболеваний, связанных с нарушением регулирования пролиферации клеток и клеточной гибели (апоптоза). Состояния, которые представляют интерес, включают, но не ограничива-2 017393 ются только ими, следующие состояния. Соединения в соответствии с изобретением являются полезными для лечения разнообразных состояний, при которых существует пролиферация и/или миграция клеток гладкой мускулатуры и/или воспалительных клеток в слой интимы сосудов, что приводит к ограниченному потоку крови через этот сосуд, например, в случае неоинтимальных окклюзивных повреждений. Окклюзивные заболевания трансплантированных сосудов, которые представляют интерес, включают атеросклероз, коронарное сосудистое заболевание после трансплантации, стеноз в результате пересадки вен, перианастомотический рестеноз в результате введения протеза, рестеноз после ангиопластики или внедрения стента и т.п. Уровень техники Другие тиадиазиноны описаны в DE 19604388, WO 2003/037349, WO 2007/057093 илиWO 2007/057092. Дигидропиридазиноны для борьбы со злокачественным новообразованием описываются вWO 03/037349 А 1. Другие пиридазины для лечения заболеваний иммунной системы, ишемических и воспалительных заболеваний известны из ЕР 1043317 А 1 и ЕР 1061077 А 1. ЕР 0738716 А 2 и ЕР 0711759 В 1 описывают другие дигидропиридазиноны и пиридазиноны в виде фунгицидов и инсектицидов. Другие пиридазиноны описываются в виде кардиотонических средств в US 4397854.JP 57-95964 раскрывает другие пиридазиноны. Краткое изложение сущности изобретения Изобретение относится к соединениям формулы IHet представляет собой 2-, 4-, 5- или 6-пиримидинил, 1,2,4-оксадиазол-3- или -5-ил, которые могут быть незамещенными или моно-, ди- или тризамещенными В;Ar1 представляет собой фенил который является незамещенным или моно-, ди- или тризамещеннымHet1 представляет собой 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 2-, 3- или 4-пиридил, которые могут быть незамещенными или моно-, ди- или тризамещенными А;Q отсутствует или представляет собой алкилен, содержащий 1-4 С атомов; В представляет собой A, NH2, NHA, NAA', O(CH2)nR2, N=CH-N(CH3)2,R2 представляет собой NH2, NHA, NAA', А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 Н атомов могут быть замещены F и/или Cl;n представляет собой 0, 1, 2 или 3,и их фармацевтически пригодным солям и стереоизомерам, включая их смеси во всех соотношениях. Изобретение также относится к оптически активным формам (стереоизомерам), энантиомерам, рацематам, диастереомерам указанных соединений. Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую ответную реакцию, которую предполагает или желает получить, например, исследователь или лечащий врач. Кроме того, выражение "терапевтически эффективное количество" обозначает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминацию заболевания, синдрома, состояния, жалобы, расстройства или побочных действий, или также уменьшения прогрессирования заболевания, жалобы или расстройства.-3 017393 Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для усиления нормальной физиологической функции. Изобретение также относится к применению смесей соединений формулы I, например смесей двух диастереомеров, например в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Изобретение относится к соединениям формулы I и их солям и к способу получения соединений формулы I по пп.1, 2 и их фармацевтически пригодных солей и стереоизомеров, который отличается тем,что соединение формулы IIL представляет собой Cl, Br, I или свободную или реакционноспособную функционально модифицированную ОН группу,и/или основание или кислоту формулы I превращают в одну из его (ее) солей. Выше и ниже радикалы R1, Het и Q имеют значения, указанные для формулы I, если специально не указано иначе. А, А' представляют собой, в каждом случае независимо друг от друга, алкил, который является неразветвленным (линейным) или разветвленным, и имеет 1, 2, 3, 4, 5, 6, 7 или 8 атомов С. А, А' предпочтительно представляют собой метил, кроме того, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1 этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2 этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2- триметилпропил, более предпочтительно, например трифторметил. А, А' наиболее предпочтительно представляет собой алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов С,предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил.Ar1 представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным Hal, ОН, ОА и/или CN.Het предпочтительно представляет собой 2-, 4-, 5- или 6-пиримидинил, 1,2,4-оксадиазол-3- или -5 ил, которые могут быть незамещенными или моно-, ди- или тризамещенными В.Het1 предпочтительно представляет собой 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 2-, 3- или 4-пиридил, которые могут быть незамещенными или моно-, ди- или тризамещенными А.R1 предпочтительно представляет собой Het1, к тому же Ar1.R2 предпочтительно представляет собой NH2, NHA, NAA', В особенно предпочтительно представляет собой A, NH2, NHA, NAA', O(CH2)nR2, N=CH-N(CH3)2,Q предпочтительно представляет собой метилен, к тому же этилен.Hal предпочтительно представляет собой F, Cl или Br, а также I, особенно предпочтительно F или Для всего изобретения все радикалы, такие как, например, X, А или R2, которые встречаются более одного раза, могут быть одинаковыми или разными, т.е. их значения являются независимыми друг от друга. Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы. Таким образом, изобретение относится, в частности, к соединениям формулы I, в которых по мень-4 017393 шей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных выше. Некоторые предпочтительные группы соединений могут быть представлены следующими подформулами Ia-Ig, которые соответствуют формуле I и в которых радикалы, не обозначенные более подробно,имеют значения, указанные для формулы I, но в которых в Ia R2 представляет собой NH2, NHA, NAA', в Ib Ar1 представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным Hal, ОН, ОА и/или CN; в Ic Het представляет собой 2-, 4-, 5- или 6-пиримидинил, 1,2,4-оксадиазол-3- или -5-ил, которые могут быть незамещенными или моно-, ди- или тризамещенными В; в Id Het1 представляет собой 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 2-, 3- или 4-пиридил,которые могут быть незамещенными или моно-, ди- или тризамещенными А; в Ie В представляет собой A, NH2, NHA, NAA', O(CH2)nR2, N=CH-N(CH3)2, в If А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 Н атомов могут быть замещены F и/или Cl; в Ig R1 представляет собой Ar1 или Het1;Het представляет собой 2-, 4-, 5- или 6-пиримидинил, 1,2,4-оксадиазол-3- или -5-ил, которые могут быть незамещенными или моно-, ди- или тризамещенными В;Ar1 представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным Hal, ОН, ОА и/или CN;Het1 представляет собой 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 2-, 3- или 4-пиридил, которые могут быть незамещенными или моно-, ди- или тризамещенными А;Q отсутствует или представляет собой алкилен, содержащий 1-4 С атомов; В представляет собой A, NH2, NHA, NAA', O(CH2)nR2, N=CH-N(CH3)2,R2 представляет собой NH2, NHA, NAA', А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 Н атомов могут быть замещены F и/или Cl;n представляет собой 0, 1, 2 или 3; и их фармацевтически пригодные соли и стереоизомеры, включая их смеси во всех соотношениях. Соединения формулы I, а также исходные вещества для их получения могут, кроме того, быть получены при помощи методов, известных per se, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], GeorgThieme-Verlag, Штутгарт), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные варианты, которые известные per se,но о которых здесь подробно не упоминается. Исходные соединения формул II и III, как правило, известны. Однако если они являются новыми, то они могут быть получены методами, известными per se. Используемые пиридазиноны формулы II, если они не являются коммерчески доступными, обычно могут быть получены с помощью способа W.J.Coates, A. McKillop, Synthesis, 1993, 334-342. Соединения формулы I предпочтительно могут быть получены путем взаимодействия соединения-5 017393 формулы II с соединением формулы III. В соединениях формулы III L предпочтительно представляет собой Cl, Br, I или свободную или реакционноспособную модифицированную ОН-группу, такую как,например, активированная сложноэфирная, имидазолидная группа или алкилсульфонилокси, содержащий 1-6 атомов углерода (предпочтительно метилсульфонилокси или трифторметилсульфонилокси) или арилсульфонилокси, содержащий 6-10 атомов С (предпочтительно фенил- или п-толилсульфонилокси). Обычно реакцию осуществляют в присутствии вещества, связывающего кислоту, предпочтительно органического основания, такого как DIPEA, триэтиламин, диметиланилин, пиридин или хинолин. Добавление гидроксида щелочного или щелочно-земельного металла, карбоната или бикарбоната или другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия, натрия,кальция или цезия, также может являться благоприятным. В зависимости от применяемых условий, продолжительность реакции находится в интервале от нескольких минут до 14 дней, температура реакции находится в интервале приблизительно от -30 до 140,обычно в интервале от -10 до 90, в частности от приблизительно 0 до приблизительно 70. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, нпропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод; карбоновые кислоты,такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительными являются ацетонитрил, дихлорметан и/или ДМФА. Фармацевтические соли и другие формы. Соединения, раскрытые в изобретении, могут использоваться в своей заключительной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые формы солей соединений формулы I готовят, главным образом, при использовании традиционных способов. В случае, если соединение формулы I содержит карбоксильную группу, то одна из его приемлемых солей может быть образована с помощью реакции с приемлемым основанием для получения соответствующей соли присоединения основания. Такими основаниями являются, например, гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этанолят калия и пропанолят натрия; а также различные органические основания, такие как пиперидин, диэтаноламин и Nметилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например галогеноводородами, такими как хлороводород, бромоводород или йодоводород; другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат или фосфат и др.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат,сукцинат, цитрат, бензоат, салицилат, аскорбат и др. Соответственно, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующее: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат,камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты),галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид,изотионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат, фталат, но указанное не является ограничением. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничиваются только ими, соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия; и соли щелочно-земельных металлов кальция и магния. Соли соединений формулы I, которые имеют происхождение от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваются только ими, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещен-6 017393 ные амины, циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин,хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины,тристеобромин,триэтаноламин,триэтиламин,триметиламин,трипропиламин и(гидроксиметил)метиламин (трометамин). Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С 1-С 4-алкилгалогениды, например метил-, этил-, изопропил-и трет-бутилхлориды, бромиды и йодиды; ди-С 1-С 4-алкилсульфаты,например диметил-, диэтил- и диамилсульфаты; С 10-С 18-алкилгалогениды, например децил-, додецил-,лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-С 1-С 4-алкилгалогениды, например бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваются только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Особенное предпочтение предоставляется гидрохлориду, дигидрохлориду, гидробромиду, малеату,мезилату, фосфату, сульфату и сукцинату. Кислотно-аддитивные соли основных соединений формулы I получают путем приведения в контакт формы свободных оснований с достаточным количеством желаемой кислоты для получения соли обычным способом. Свободное основание можно регенерировать путем приведения в контакт формы соли с основанием и выделения свободного основания обычным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих форм солей своими определенными физическими свойствами, такими как растворимость в полярных растворителях; однако, для целей настоящего изобретения, соли являются эквивалентными своим соответствующим формам свободных оснований. Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуются с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт формы свободной кислоты с достаточным количеством желаемого основания для получения соли обычным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт формы соли с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях; однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает сложные соли. Примеры типичных форм сложных солей включают, например, битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид, но не ограничиваются только ими. В отношении описанного выше можно увидеть, что выражение "фармацевтически приемлемая соль" в настоящей связи предназначено для обозначения активного компонента, который включает соединение формулы I в форме одной из своих солей, особенно в том случае, если указанная форма соли обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или другой солью указанного активного компонента, которые использовались ранее. Фармацевтически приемлемая форма соли активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым он ранее не обладал, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его стереоизомеры, включая их смеси во всех соотношениях, и, необязательно, наполнители и/или вспомогательные вещества. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг соединения в соответствии с изобретением в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут-7 017393 вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше,или соответствующую порцию их активного компонента. К тому же, лекарственные средства этого типа могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут быть адаптированы для введения при помощи любого подходящего способа, например путем перорального (включая буккальное или подъязычное), ректального, назального, местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например путем объединения активного компонента с наполнителем(ями) или вспомогательным(и) веществом(ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевые пены или пенистые пищевые продукты; или жидкие эмульсии масло-в-воде или жидкие эмульсии вода-в-масле. Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем,измельченным аналогичным способом, таким как, например, пищевой углевод, такой как, например,крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполняют ею желатиновые капсулы определенной формы. Скользящие и смазывающие вещества, такие как, например,высоко дисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме может быть добавлено к порошковой смеси перед заполнением капсул. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза,подсластители, приготовленные из кукурузы, естественных и синтетических резин, такие как, например,аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах,включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваются только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Таблетки получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием, как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин, усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ, и прессования ее через сито. В виде альтернативы грануляции порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно смазывать путем добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спир-8 017393 тового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например,этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения формулы I и их соли также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например,холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их соли также могут доставляться с помощью моноклональных антител в виде индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в виде нацеливающих носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой,полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестносшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде отдельных пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом,например, активный компонент может доставляться из пластыря путем ионофореза, как в общих терминах описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым, или смешивающимся с водой кремовым основанием. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, т.е. путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в виде носителя включают растворы активного вещества в воде или в масле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приго-9 017393 товлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к частично вышеописанным составляющим лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конченом счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением для лечения роста опухолей, например рака ободочной кишки или молочной железы, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде серий частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день,таким образом, что общая суточная доза является такой же. Эффективное количество соли может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить, что аналогичные дозы пригодны для лечения других состояний, описанных выше. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства. Применение. Настоящие соединения пригодны в виде фармацевтически активных компонентов для млекопитающих, в особенности для людей, для лечения заболеваний, вызванных тирозинкиназой. Эти заболевания включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию (или ангиогенез),которые вызывают рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию,дегенерацию желтого пятна, связанную со старением и т.д.) и воспаление (псориаз, ревматоидный артрит и т.д.). Настоящее изобретение охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения злокачественного новообразования. Предпочтительные карциномы для лечения выбирают из группы рака головного мозга, рака мочеполового тракта, рака лимфатической системы, рака желудка,рака гортани и рака легкого. Дальнейшей группой предпочтительных типов рака являются моноцитарный лейкоз, аденокарцинома легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы и рак молочной железы. Также охватывается применение соединений согласно п.1 в соответствии с изобретением и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, в которое вовлечен ангиогенез. Такое заболевание, в которое вовлечен ангиогенез, представляет собой заболевание глаз, такое как васкуляризация сетчатки, диабетическая ретинопатия, дегенерация желтого пятна, связанная со старением, и т.п. Применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения воспалительных заболеваний также подпадает под объем настоящего изобретения. Примеры таких воспалительных заболеваний включают ревматоидный артрит, псориаз, контактный дерматит, аллергическая реакция замедленного типа и т.п. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, индуцированного тирозинкиназой, или состояния, индуцированного тирозинкиназой, у млекопитающего, при котором в этом способе терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему, нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и легко может быть определено специалистом в данной области. Настоящее изобретение также охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения васкуляризации сетчатки. Способы лечения или предотвращения глазных заболеваний, такие как диабетическая ретинопатия и дегенерация желтого пятна, связанная со старением, также являются частью изобретения. Применение для лечения или предотвращения воспалительных заболеваний, таких как ревматоидный артрит, псориаз,контактный дерматит и аллергическая реакция замедленного типа, а также лечение или предотвращение патологий костей из группы, включающей остеосаркому, остеоартрит и рахит, также подпадает под объем настоящего изобретения.- 10017393 Выражение "заболевания или состояния, индуцированные тирозинкиназой" относится к патологическим состояниям, которые зависят от активности одной или несколько тирозикиназ. Тирозинкиназы непосредственно или опосредованно принимают участие в путях передачи сигналов различных активностей клеток, включая пролиферацию, адгезию, миграцию и дифференциацию. Заболевания, связанные с активностью тирозинкиназы, включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию, которая стимулирует рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением, и т.д.) и воспаление (псориаз, ревматоидный артрит и т.д.). Соединения формулы I могут вводиться пациентам для лечения злокачественного новообразования,в особенности быстрорастущих опухолей. Изобретение также относится к применению соединений формулы I, и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, при которых играет роль ингибирование,регуляция и/или модуляция передачи сигналов с помощью киназы. Предпочтение отдается Met киназе. Предпочтение отдается применению соединений формулы I, и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование тирозинкиназ соединениями в соответствии с п.1. Особенное предпочтение отдается применению для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование Met киназы соединениями в соответствии с п.1. Наиболее предпочтительным является применение для лечения заболевания, где заболевание представляет собой солидную опухоль. Солидную опухоль предпочтительно выбирают из группы опухолей легкого, плоского эпителия,мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы,желудка и/или гортани. Солидную опухоль также предпочтительно выбирают из группы, включающей аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы, рак толстой кишки и рак молочной железы. Кроме того, предпочтительным является применение для лечения опухоли крови и иммунной системы, предпочтительно для лечения опухоли, выбранной из группы, включающей острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз и/или хронический лимфолейкоз. Раскрытые соединения формулы I могут вводиться в комбинации с другими известными лекарственными средствами, включая противораковые средства. Как используется в настоящем изобретении,термин "противораковое средство" относится к любому средству, которое вводят пациенту со злокачественным новообразованием для лечения рака. Противораковое лечение, описанное здесь, может применяться в виде отдельного лечения, или может включать, в дополнение к соединению изобретения, обычные хирургические методы или радиотерапию или химиотерапию. Такая химиотерапия может включать один или несколько следующих классов противоопухолевых средств:(i) антипролиферативные/противоопухолевые/повреждающие ДНК лекарственные средства и их комбинации, которые применяются в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, карбоплатин, циклофосфамид, азотный иприт, мельфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, такие как 5 фторурацил и тегафур, ралтитрексед, метотрексат, арабинозид цитозина, гидроксимочевина и гемцитабин); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин,доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин и таксоиды, такие как таксол и таксотер); ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие этопозид и тенипозид, амсакрин, топотекан, иринотекан и камптотецин) и цитодифференцирующие средства (например, ретиноевая кислота, полностью находящаяся в трансконфигурации, 13-цис-ретиноевая кислота и фенретинид);(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и йодоксифен), ингибиторы рецептора эстрогена (например, фульвестрант); антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерон ацетат), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестогены (например, мегестрол ацетат), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5-редуктазы, такие как финастерид;(iii) средства, которые ингибируют инвазию злокачественных клеток (например, ингибиторы металлопротеиназы, такие как маримастат, и ингибиторы функции рецептора урокиназного активатора плазминогена);(iv) ингибиторы действия фактора роста, например, такие ингибиторы включают антитела к фактору роста, антитела к рецептору фактора роста (например, анти-erbb2 антитело трастузумаб [Herceptin] и анти-erbb1 антитело цетуксимаб [С 225]), ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназы и ингибиторы серин-треонин киназы, например ингибиторы семейства фактора роста эпидермиса (например, ингибиторы EGFR семейства тирозинкиназ, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3 морфолинопропокси)хиназолин-4-амин(гефитиниб,AZD1839),N-(3-этинилфенил)-6,7-бис-(2 метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3 морфолинопропокси)хиназолин-4-амин (CI1033, например ингибиторы семейства фактора роста производных тромбоцитов и, например, ингибиторы семейства фактора роста гепатоцитов;(v) антиангиогенные вещества, такие как те, которые ингибируют действие фактора роста эндотелия сосудов, (например, антитело к фактору роста клеток эндотелия сосудов бевацизумаб [Avastin],соединения, которые описаны в опубликованных международных заявках на патент WO 97/22596,WO 97/30035, WO 97/32856 и WO 98/13354) и соединения, которые действуют по другому механизму(например, линомид, ингибиторы действия интегрина v3 и ангиостатин);(vi) вещества, повреждающие сосуды, такие как комбретастатин А 4 и соединения, раскрытые в международных заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и(vii) антисмысловая терапия, например, такая, которая направлена на вышеперечисленные мишени,такая как ISIS 2503, антисмысловая терапия на основе гена ras;(viii) способы генной терапии, включая, например, способы замены аберрантных генов, такие как способы аберрации р 53 или аберрации BRCA1 или BRCA2, GDEPT (пролекарственная терапия, направленная на ген фермента), способы с использованием деаминазы цитозина, тимидинкиназы или бактериальной нитроредуктазы и способы повышения устойчивости пациента к химиотерапии или радиотерапии, такие как генная терапия резистентности ко многим лекарственным средствам; и(ix) способы иммунотерапии, включая, например, способы повышения иммуногенности опухолевых клеток пациента в условиях ex vivo и in vivo, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или фактор стимуляции колоний гранулоцитов-макрофагов, способы снижения активности Т-клеток, способы с использованием трансфектированных иммунных клеток, таких как цитокин-трансфектированные дендритные клетки, способы с использованием цитокин-трансфектированных линий опухолевых клеток и способы с использованием анти-идиотипичных антител. Лекарственные средства, приведенные ниже в таблице, предпочтительно, но не исключительно,комбинируют с соединениями формулы I. Комбинированное лечение этого типа можно осуществлять с помощью одновременного, последовательного или отдельного дозирования отдельных компонентов для лечения. В комбинированных продуктах этого типа используют соединения в соответствии с изобретением. Исследования. Соединения формулы I, описанные в примерах, исследовались в анализах, описанных ниже, и было обнаружено, что они обладают ингибирующей активностью по отношению к киназе. Из литературы известны другие исследования, и они легко могут быть осуществлены специалистом в данной области (см.,например, Dhanabal и др., Cancer Res. 59:189-197; Xin и др., J. Biol. Chem. 274:9116-9121; Sheu и др.,Anticancer Res. 18:4435-4441; Ausprunk и др., Dev. Biol. 38:237-248; Gimbrone и др., J. Natl. Cancer Inst. 52:413-427; Nicosia и др., In Vitro 18:538- 549). Измерение активности Met киназы. Согласно данным производителя (Met, активная, upstate,по каталогу 14-526), Met киназу экспрессировали для получения белка в клетках насекомых (Sf21; S. frugiperda) и затем очищали с помощью аффинной хроматографии в виде "N-концевого 6His-меченого" рекомбинантного белка человека в бакуловирусном экспрессионном векторе. Активность киназы может быть измерена с помощью различных доступных измерительных систем. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19),- 22017393 анализе флэш-планшетов или тесте связывания на фильтре измеряют радиоактивное фосфорилирование белка или пептида в виде субстрата с помощью радиоактивно меченного АТР (32 Р-АТР, 33 Р-АТР). В присутствии ингибиторного соединения может быть обнаружено снижение радиоактивного сигнала или отсутствие сигналов. Кроме того, в виде методов исследования могут быть способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени (HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. of Biomolecular Screening, 2002, 191-214). Другие нерадиоактивные способы анализа на основе ELISA используют специфические фосфоантитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антитела, конъюгированного пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Метод флэш-планшетов (Met киназа). Применимыми тестируемыми планшетами являются микротитровальные планшеты на 96 лунокFlashplateR от Perkin Elmer ( кат. SMP200). Компоненты киназной реакции, описанные ниже, питетировали в планшет для исследования. Met киназу и субстрат поли Ala-Glu-Lys-Tyr, (pAGLT, 6:2:5:1), инкубировали в течение 3 ч при комнатной температуре с радиоактивно меченным 33 Р-АТР в присутствии и отсутствии тестируемых веществ в общем объеме 100 мкл. Реакцию останавливали с помощью 150 мкл 60 мМ раствора EDTA. После инкубирования дополнительно в течение 30 мин при комнатной температуре супернататы отфильтровывали с отсасыванием и лунки три раза промывали каждый раз с помощью 200 мкл 0,9% раствора NaCl. Связанную радиоактивность измеряли с помощью прибора для измерения сцинтилляции (Topcount NXT, Perkin-Elmer). Используемое истинное значение составляло киназную реакцию без ингибитора. Это приблизительно должно находиться в интервале 6000-9000 имп. в минуту. Используемое значение фармакологического нуля представляло собой стауроспорин в конечной концентрации 0,1 мМ. Значения ингибирования (IC50) определяли с помощью RS1MTS программы. Условия киназной реакции на лунку: 30 мкл буфера для исследования; 10 мкл тестируемого субстрата в буфере для исследования с 10% ДМСО; 10 мкл АТР (конечная концентрация 1 мкМ холодн., 0,35 мкКи 33 Р-АТР); 50 мкл смеси Met киназа/субстрат в буфере для исследования; (10 нг фермента/лунку, 50 нгPoly-Ala-Glu-Lys-Tyr, 6:2:5:1: Sigmaкат. Р 1152. Тестирование в условиях in-vivo (фиг. 1/1). Экспериментальная методика. Самкам мышей Balb/C (от Charles River Wiga) на момент прибытия было 5 недель. Их акклиматизировали, выдерживая в условиях в течение 7 дней. После этого каждой мыши подкожно вводили в тазовую область в количестве 4 млн TPR-Met/NIH3T3 клеток в 100 мкл PBS (без Са и Mg). Через 5 дней,животных рандомизировали на 3 группы, таким образом, чтобы каждая группа из 9 мышей имела средний размер опухоли 110 мкл (интервал: 55-165). 100 мкл наполнителя (0,25% метил целлюлозы/100 мМ ацетатный буфер, рН 5,5) вводили ежедневно контрольной группе и 200 мг/кг "А 56" или "А 91", растворенного в наполнителе (объем приблизительно 100 мкл/животное), вводили ежедневно подопытным группам, в каждом случае с помощью желудочного зонда. Через 9 дней в контроле средний объем опухоли составлял 1530 мкл и опыт заканчивали. Измерения объема опухоли. Длину (L) и ширину (В) измеряли с помощью штангенциркуля с нониусом и объем опухоли рассчитывали согласно формуле LВВ/2. Условия содержаний: 4 или 5 животных в клетке, питание с помощью коммерчески доступного корма для мышей (Sniff). Выше и ниже все температуры приведены в градусах Цельсия (С). В последующих примерах"обычная обработка" обозначает, что при необходимости добавляют воду, рН устанавливают, при необходимости, на значение от 2 до 10, в зависимости от состава конечного продукта, смесь экстрагируют- 23017393 этилацетатом или дихлорметаном, фазы разделяют, органическую фазу высушивают над сульфатом натрия, упаривают и остаток очищают при помощи хроматографии на силикагеле и/или кристаллизации. Rf значения на силикагеле; элюент: этилацетат/метанол 9:1. Масс-спектрометрия (МС): EI (ионизация электронным ударом) М+APCI-MC (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. Масс-спектрометрия (МС): EI (ионизация электронным ударом) М+APCI-MC (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. ВЭЖХ методы. ВЭЖХ/МС исследования проводили в 3 мкм колонке Silica-Rod с 210-секундным градиентом от 20 до 100% вода/ацетонитрил/0,01% трифторуксусной кислоты, при скорости потока 2,2 мл/мин и детектировании при 220 нм. ВЭЖХ исследования (метод А). Колонка: Chromolith RP18e 1003 мм; Скорость потока: 2 мл/мин; Растворитель А: H2O + 0,1% трифторуксусной кислоты; Растворитель В: ацетонитрил + 0,1% трифторуксусной кислоты; Градиент 5 мин 0-4 мин: 99:1-1:99; 4-5 мин: 1:99-1:99. ВЭЖХ исследования (метод В). Колонка: Chromolith RP18e 1003 мм; Скорость потока: 4 мл/мин; Растворитель А: H2O + 0.05% НСООН; Растворитель В: ацетонитрил + 10% растворителя А; Градиент 8 мин 0-1 мин: 99:1-99:1; 1-7 мин: 99:1-1:99; 7-8 мин: 1:99-1:99. Время удержания Rt в минутах [мин]. Примеры Получение исходных веществ. а) Получение [3-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метанола. 50,86 г метил 3-(5-метил-1,2,4-оксадиазол-3-ил)бензоата растворяют в 500 мл ТГФ и добавляют порциями 5,59 г LiBH4 с охлаждением льдом/Н 2 О и перемешиванием. По завершении добавления смесь перемешивают на протяжении дальнейших 20 ч без охлаждения. Для исследования рН доводят до 7 путем медленного добавления по каплям 1 н. HCl с помешиванием. Реакционную смесь в дальнейшем растворяют с помощью 500 мл Н 2 О, экстрагируют 3300 мл ДХМ, объединенную органическую фазу высушивают над сульфатом натрия и упаривают до сухого состояния в роторном испарителе. Очищение проводят с помощью хроматографии (дихлорметан/метанол: 98:2). Исследования: ВЭЖХ RT=2,88 мин; т.пл.: 42 С. Выход: 15,87 г (83,42 ммоль) = 36% [3-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метанол.b) Получение 3-гидроксиметилбензамидин ацетата. 5 г Ni Ренея (смоченного водой) добавляют к 18,107 г [3-(5-метил-1,2,4-оксадиазол-3 ил)фенил]метанола (95,2 ммоль) в смеси 200 мл метанола, 10 мл безводной уксусной кислоты и 10 мл воды, смесь гидрогенезируют при комнатной температуре и атмосферном давлении до поглощения 1,9 л водорода (16 ч). Для исследования катализатор фильтруют и оставшийся раствор упаривают до сухого состояния, остаток кипятят в метил-трет-бутиловом эфире и фильтруют. Кристаллы сушат на протяжении 16 ч в вакууме. ВЭЖХ (А) RT=0,51 мин; ЖХ-МС: 0,554 мин/М+Н+: 151,2 г/моль; т.пл.: 188-9 С. Выход: 18,891 г (89,86 ммоль) = 94% 3-гидроксиметилбензамидин ацетата. с) Получение N'-[2-(3-гидроксиметилфенил)пиримидин-5-ил]-N,N-диметилформамидина. 16,85 г 3-гидроксиметилбензамидин ацетата (80,14 ммоль) и 39,13 г предшественника аминоредуктона (80,14 ммоль) суспендируют в 300 мл сухого МеОН в аппарате продувки азотом, добавляют по каплям свежеизготовленный раствор 5,527 г натрия в 100 мл МеОН с помешиванием и смесь в дальнейшем перемешивают при температуре 60 С на протяжении 30 мин до получения чистого раствора. Для исследования реакционную смесь растворяют с помощью дихлорметана, дважды промывают водой, сушат над сульфатом натрия и упаривают до сухого состояния в роторном испарителе. Очищение проводят с помощью хроматографии (дихлорметан/метанол (1-5%. Исследования: ВЭЖХ RT=2,24 мин; ЖХ-МС: 1,177 мин/М+Н+: 257,2 г/моль; т.пл.: 105-106 С. Выход: 15,30 г (59,69 ммоль) = 74% N'-[2-(3-гидроксиметилфенил)пиримидин-5-ил]-N,Nдиметилформамидина в виде желтоватых кристаллов.d) Получение [3-(5-аминопиримидин-2-ил)фенил]метанола. 15,30 г [2-(3-гидроксиметилфенил)пиримидин-5-ил]-N,N-диметилформамидина (59,69 ммоль) растворяют в 140 мл диоксана, добавляют раствор 28,87 г (208,91 ммоль) K2CO3 в 280 мл H2O и смесь перемешивают в противотоке на протяжении 20 ч. Для исследования реакционную смесь упаривают до сухого состояния, остаток перемешивают с приблизительно 200 мл изопропанола в противотоке на протяжении 10 мин, фильтруют, пока свежая, и фильтрат упаривают до начальной кристаллизации. Реакционную смесь охлаждают, сформированные кристаллы фильтруют с отсасыванием и промывают эфиром. Исследования: ВЭЖХ RT=2,54 мин; ЖХ-МС: 1,163 мин/М+Н+: 202,2 г/моль; т.пл.: 141-142 С. Выход: 11,435 г (56,83 ммоль) = 95% [3-(5-аминопиримидин-2-ил)фенил]метанола в виде бесцветных кристаллов. е) Получение [3-(5-гидроксипиримидин-2-ил)фенил]метанола. 11,276 г [3-(5-аминопиримидин-2-ил)фенил]метанола (56,04 ммоль) суспендируют в 200 мл H2O,добавляют 24,89 мл конц. H2SO4 (448,3 ммоль) и смесь перемешивают при температуре масляной ванны 130 С на протяжении 4 ч, во время которого откладывается темно-зеленый осадок. Для исследования осадок отделяют, промывают в большом количестве воды, маточный раствор доводят до рН 6, применяяNaHCO3 и экстрагируют 5 х с 200 мл дихлорметана. Объединенные органические экстракты упаривают до сухого состояния и хроматографируют в 100 г силикатного геля (дихлорметан + 1-10% метанола). Продукт рекристаллизуется из метанола/дихлорметана. Исследования: ВЭЖХ RT=2,61 мин; ЖХ-МС: 1,315 мин/М+Н+: 203,2 г/моль; т.пл.: 166-167 С. Выход: 2,053 г (10,15 ммоль) = 18% [3-(5-гидроксипиримидин-2-ил)фенил]метанола.a) Получение [3-(5-бромпиримидин-2-ил)фенил]метанола. 9,107 г K3PO43H2O (42,9 моль) растворяют в 120 мл диоксана и 14 мл воды в 250-мл колбе, добавляют 6,111 г 5-бромо-2-йодопиримидина (21,5 ммоль) и 3,91 г 3-(гидроксиметил)фенилбороновой кислоты (25,74 ммоль) и реакционный сосуд продувают N2 в течение 15 мин с помешиванием. Затем добавляют 0,75 г тетракис-(трифенилфосфин)палладия(0) (0,65 ммоль) и смесь перемешивают в атмосфере N2 при температуре масляной ванны 90 С на протяжении 14 ч. Для исследования реакционную смесь растворяют с помощью МТБЭ, добавляют воды, смесь фильтруют через целит с отсасыванием, водную фазу отделяют от органической фазы, экстрагируют дополнительно 2 х с МТБЭ, объединенную органическую фазу сушат над Na2SO4 и упаривают до сухого состояния. Очищение проводят с помощью хроматографии. Выход: 2,49 г [3-(5-бромпиримидин-2-ил)фенил]метанола (8,83 ммоль) = 41% в виде бледножелтого твердого вещества.b) Получение трет-бутил 4-4-[2-(3-гидроксиметилфенил)пиримидин-5-ил]пиразол-1 илпиперидин-1-карбоксилата. 4,186 г [3-(5-бромпиримидин-2-ил)фенил]метанола (15 ммоль) и 5,942 г трет-бутил 4-[4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)пиразол-1-ил]пиперидин-1-карбоксилата (15,75 ммоль) растворяют в 150 мл этиленгликольдиметиловом эфире в 500-мл трехгорлой колбе с холодильником, пузырьковым счетчиком и входным отверстием для азота, перемешивают при комнатной температуре в течение 10 мин(оранжевый раствор). В дальнейшем добавляют 6,37 г трикалий фосфат тригидрата (30 ммоль) и 842 мг хлорида бис-(трифенилфосфин)палладия(II) (1,2 ммоль) и смесь перемешивают при температуре масляной ванны 80 С на протяжении 14 ч. Образовывается темно-коричневая суспензия. Для исследования остаток фильтруют с отсасыванием и хроматографируют. Продукт кипятят в изопропаноле, охлаждают, фильтруют с отсасыванием, промывают с холодным изопропанолом и сушат. ВЭЖХ-МС: 2,054 мин/М+Н+: 436,0 г/моль. Выход: 3,47 г трет-бутил 4-4-[2-(3-гидроксиметилфенил)пиримидин-5-ил]пиразол-1 илпиперидин-1-карбоксилата (7,73 ммоль) = 52% в виде бледно-желтого порошка. а) Получение метил 3-карбамимидоилбензоатацетата. 40 г Ni Ренея (смоченного водой) добавляют к 124,84 г метил 3-(5-метил-1,2,4-оксадиазол-3 ил)бензоата (569,39 ммоль) в смеси 1300 мл метанола, 100 мл безводной уксусной кислоты и 100 мл воды и смесь гидрогенезируют при комнатной температуре и атмосферном давлении до поглощения 14,7 л- 26017393 водорода (45 ч). Для исследования катализатор фильтруют и оставшийся раствор упаривают до сухого состояния, остаток кипятят в метил-трет-бутиловом эфире и фильтруют. Кристаллы сушат в течение ночи в вакууме. ЖХ-МС: 1,030 мин/М+Н+: 179,2 г/моль. Выход: 120,2 г (499,49 ммоль) = 88% метил 3-карбамимидоилбензоатацетата.b) Получение метил 3-[5-(диметиламинометиленамино)пиримидин-2-ил]бензоата. 100 г 3-гидроксиметилбензамидин ацетата (419,75 ммоль) и 204,93 г предшественника аминоредуктона (419,74 ммоль) суспендируют в 1000 мл сухого МеОН в N2-продуваемой 2-л трехгорлой колбе, добавляют по каплям свежее приготовленный раствор 28,99 г натрия в 300 мл МеОН с помешиванием и смесь в дальнейшем перемешивают при температуре 60 С на протяжении 30 мин, до получения чистого раствора. Для исследования реакционную смесь охлаждают, растворяют с помощью дихлорметана, промывают дважды водой, сушат над сульфатом натрия и упаривают до сухого состояния в роторном испарителе. Остаток кристаллизуется из небольшого количества метанола и диэтилэфира. Исследования: ЖХ-МС: 1,253 мин/М+Н+: 285,1 г/моль. Выход: 103,5 г (364,04 ммоль) = 87% метил 3-[5-(диметиламинометиленамино)пиримидин-2 ил]бензоата в виде желтоватых кристаллов. с) Получение 3-(5-гидроксипиримидин-2-ил)бензойной кислоты. 103,5 г метил 3-[5-(диметиламинометиленамино)пиримидин-2-ил]бензоата (364,04 ммоль) суспендируют в 1300 мл воды в 2-л одногорлой колбе, в дальнейшем добавляют 160 мл конц. серной кислоты(95-97%) (2,88 моль) и реакционную смесь нагревают при 130 С (температура масляной ванны) на протяжении 4 ч. Для исследования реакционную смесь охлаждают, сформированный осадок фильтруют,промывают водой и сушат при температуре 50 С в вакуумной сушильной камере. Исследования: ВЭЖХ RT=2,75 мин; ЖХ-МС: 1,449 мин/М+Н+: 217,0 г/моль. Выход: 78,9 г (364,5 ммоль) = 3-(5-гидроксипиримидин-2-ил)бензойной кислоты.d) Получение метил 3-(5-гидроксипиримидин-2-ил)бензоата. 78,8 г 3-(5-гидроксипиримидин-2-ил)бензойной кислоты суспендируют в 1,4 л абсолютизированного метанола и в дальнейшем осторожно добавляют по каплям 32,7 мл тионилхлорида (449,8 ммоль) при комнатной температуре. Реакционную смесь нагревают при температуре 80 С на протяжении 2 ч. Далее добавляют 20 мл тионилхлорида (275,7 ммоль) и смесь нагревают при температуре 80 С на протяжении дальнейших 2 ч. Для того чтобы завершить реакцию, далее добавляют 10 мл тионилхлорида(137,8 ммоль) и смесь нагревают при температуре 80 С на протяжении дальнейших 2 ч. Для исследования 1000 мл метанола помещают в роторный испаритель и полученный в результате остаток фильтруют. Маточный раствор уменьшают приблизительно до 200 мл в роторном испарителе и сформированные кристаллы фильтруют. Две кристаллические порции объединяют, сушат до постоянной массы при температуре 50 С в вакуумной сушильной камере. Исследования: ВЭЖХ RT=3,39 мин; ЖХ-МС: 1,750 мин/М+Н+: 231,0 г/моль. Выход: 87 г (377,9 ммоль) = метил 3-(5-гидроксипиримидин-2-ил)бензоата. е) Получение метил 3-[5-(3-диметиламинопропокси)пиримидин-2-ил]бензоата. 45 г метил 3-(5-гидроксипиримидин-2-ил)бензоата (195,47 ммоль) и 77,68 г трифенилфосфина(293,24 ммоль) растворяют в 1200 мл абсолютизированного ТГФ под слоем N2 в аппарате, который был просушен нагреванием, и продувают с N2, добавляют 35,078 мл 3-(диметиламино)-1-пропанола, смесь перемешивают при комнатной температуре в течение 10 мин, медленно (приблизительно 30 мин) добавляют по каплям 61 мл диизопропил азодикарбоксилата (293,2 ммоль) с охлаждением льдом/Н 2 О и помешиванием, смесь перемешивают при комнатной температуре на протяжении дальнейших 2 ч. Для целей завершения реакции далее добавляют 23,3 г трифенилфосфина (88 ммоль) и 18,2 мл диизопропил азодикарбоксилата (88 ммоль). Для исследования реакционную смесь упаривают до сухого состояния и в дальнейшем растворяют с помощью 250 мл ДХМ, добавляют 2 н. HCl и смесь встряхивают. Органическая фаза, которая отделяется очень медленно, содержит большую часть окиси трифенилфосфина и удаляется. Водную фазу доводят до рН 14, применяя водную NaOH, и экстрагируют 2 х с помощью ДХМ. Объединенные органические фазы сушат над Na2SO4 и упаривают до сухого состояния. Очищение проводят с помощью хроматографии (ДХМ + 0-30% МеОН). Исследования: ВЭЖХ RT=2,69 мин; ЖХ-МС: 1,586 мин/М+Н+: 316,2 г/моль.f) Получение 3-[5-(3-диметиламинопропокси)пиримидин-2-ил]фенилметанола. 11,35 г метил 3-[5-(3-диметиламинопропокси)-2-пиримидил]бензоата (36 ммоль) растворяют в 180 мл тетрагидрофурана в 1-л трехгорлой колбе, снабженной магнитной мешалкой, холодильником, капельной воронкой, слоем N2 и сушильной лампой, 180,00 мл 1-молярного раствора диизобутилалюминий гидрида в тетрагидрофуране (180 ммоль) добавляют по каплям на протяжении приблизительно 5 мин при комнатной температуре, во время реакции наблюдается легкое нагревание раствора и слабое выделение газа и смесь перемешивают при комнатной температуре на протяжении последующего 1 ч. Затем смесь осторожно растворяют, применяя 10 мл раствора насыщенного сульфата натрия с охлаждением и помешиванием, смесь отделяют, промывают с дихлорметаном, маточный раствор сушат, фильтруют и упаривают до сухого состояния. Остаток кристаллизуют из эфира/петролейного эфира, отделяют, промывают с петролейным эфиром и сушат. Исследования: ВЭЖХ RT=2,35 мин; ЖХ-МС: 1,278 мин/М+Н+: 288,2 г/моль; т.пл.: 95-97 С. Выход: 8,35 г (29,06 ммоль) = 81% 3-[5-(3-диметиламинопропокси)пиримидин-2-ил]фенилметанола. Пример 1. Получение 3-[3-(5-метилпиримидин-2-ил)бензил]-5-тиазол-2-ил-3,6-дигидро-1,3,4-тиадиазин-2-она("А 1") проводят аналогично следующей схеме а) 30 г 3-(5-метил-1,2,4-оксадиазол-3-ил)бензойной кислоты (146,93 ммоль) суспендируют в 150 мл метанола, добавляют по каплям 7,83 мл конц. H2SO4 (146,9 ммоль) и смесь нагревают в колбе с обратным холодильником в течение ночи при температуре 80 С (DrySyn) с помешиванием. Для исследования реакционную смесь охлаждают до комнатной температуры (легкое образование кристаллов), растворяют водой во время охлаждения льдом, фильтруют с отсасыванием и сушат. Выход: 30,47 г метил 3-(5-метил-1,2,4-оксадиазол-3-ил)бензоата (134 ммоль) = 91%. ВЭЖХ RT=2,91 мин; ЖХ-МС: 1,986 мин/М+Н+: 219,2 г/моль.b) 5 г Ni Ренея (смоченного водой) добавляют к 30,47 г метил 3-(5-метил-1,2,4-оксадиазол-3 ил)бензоата (134,05 ммоль) в смеси 300 мл метанола, 10 мл безводной уксусной кислота и 10 мл воды и смесь гидрогенезируют при комнатной температуре и атмосферном давлении до поглощения 2,7 л водорода. Для исследования катализатор фильтруют, оставшийся раствор упаривают до сухого состояния и остаток кипятят в метил-трет-бутиловом эфире и фильтруют. Кристаллы сушат в течение ночи в вакууме. Выход: 31,12 г (129,32 ммоль) = 96% метил 3-карбамимидоилбензоатацетата. ВЭЖХ RT=2,20 мин; ЖХ-МС: 1,030 мин/М+Н+: 179,2 г/моль. с) 2,406 г метил 3-карбамимидоилбензоатацетата (10 ммоль) частично растворяют в 40 мл абсолютизированного МеОН в 250-мл трехгорлой колбе, добавляют 1,312 мл 3-этоксиметакролеина (11 ммоль) и 2,042 мл раствора метилата натрия (30%) (11 ммоль), во время чего образуется чистый раствор. Реакционную смесь перемешивают в течение ночи при температуре 50 С. Для исследования реакцион- 28017393 ную смесь упаривают до сухого состояния, растирают в порошок в воде, фильтруют с отсасыванием и сушат в течение ночи в вакууме. Выход: 1,65 г метил 3-(5-метилпиримидин-2-ил)бензоата (7,16 ммоль (72% в виде бежевого порошка. ВЭЖХ RT=3,01 мин; ЖХ-МС: 2,066 мин/М+Н+: 229,2 г/моль.d) 271 мг LiAlH4 (7,16 ммоль) суспендируют в 7 мл абсолютизированного ТГФ в атмосфере N2 в 50-мл трехгорлой колбе и в дальнейшем медленно по каплям добавляют 1,65 г метил 3-(5 метилпиримидин-2-ил)бензоата (7,16 ммоль), растворенные в 7 мл ТГФ. Реакционную смесь перемешивают при комнатной температуре на протяжении 5 дней. Добавляют дополнительные 271 мг LiAlH4(7,16 ммоль) и смесь перемешивают при комнатной температуре на протяжении дальнейших 4 ч. Для исследования избыток LiAlH4 гасится добавлением по каплям 4 мл смеси ТГФ/воды (1:1), реакционную смесь фильтруют, остаток кипятят дважды в ТГФ/EtOAc и опять фильтруют с отсасыванием. Объединенные фильтраты упаривают до сухого состояния, поглощенного в CH2Cl2, сушат над Na2SO4, фильтруют и опять упаривают до сухого состояния. Очищение проводят с помощью хроматографии. Выход: 587 мг [3-(5-метилпиримидин-2-ил)фенил]метанола (2,93 ммоль) = 40% в виде белого порошка; ВЭЖХ (A) RT=2,23 мин; ЖХ-МС: 1,467 мин/М+Н+: 201,2 г/моль. е) 210 мг 5-тиазол-2-ил-3,6-дигидро-1,3,4-тиадиазин-2-она [получение, как описано, например, вWO 2007/057092 или WO 2007/057093] (0,75 ммоль) суспендируют в 5 мл ТГФ в N2-продуваемом аппарате с защитой CaCl2, 180 мг [3-(5-метилпиримидин-2-ил)фенил]метанола (0,9 ммоль) и добавляют 238 мг трифенилфосфина (0,9 ммоль), смесь затем перемешивают при комнатной температуре на протяжении 30 мин и в дальнейшем добавляют по каплям 186 мкл диизопропил азодикарбоксилата(0,9 ммоль) с охлаждением льдом/H2O и помешиванием. Реакционный раствор перемешивают при комнатной температуре на протяжении 2 ч. Смесь подвергается традиционному исследованию. Остаток очищается с помощью хроматографии (линейный градиент 30 мин ДХМ + 0-1% МеОН/20 мл/мин). Объединенные фракции, содержащие продукт, упаривают до сухого состояния и кристаллизуют из метанола/диэтилэфира. Выход: 93,5 мг 3-[3-(5-метилпиримидин-2-ил)бензил]-5-тиазол-2-ил-3,6-дигидро-1,3,4-тиадиазин-2 она ("А 1") (0,245 ммоль) = 33%. ВЭЖХ (B) RT=4,77 мин; ЖХ-МС: 2,276 мин/М+Н+: 382,0 г/моль; 1 Н ЯМР (300 МГц, ДМСО-d6)[м.д.] 8,754 (S, 2 Н), 8,407 (S, 1 Н), 8,291 (М, 1 Н), 7,984 (М, 1 Н), 7,912
МПК / Метки
МПК: A61K 31/54, A61P 35/00, C07D 417/10
Метки: производные, тиадиазинона
Код ссылки
<a href="https://eas.patents.su/30-17393-proizvodnye-tiadiazinona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиадиазинона</a>
Предыдущий патент: Производные 2-гетероариламинопиримидина в качестве ингибиторов киназ
Следующий патент: Микрооптическая система формирования визуальных изображений
Случайный патент: Способ определения местоположений скважин, исходя из трехмерной модели пласта