Производные 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола
Номер патента: 1714
Опубликовано: 27.08.2001
Авторы: Ропер Томас Дейвис IV, Аллен Дейвид Джордж, Килинг Сюзанн Элейн, Редгрейв Элисон Джудит, Хоббс Хизер, Кокс Брайан, Баркер Майкл Дейвид, Гиден Джоанна Виктория
Формула / Реферат
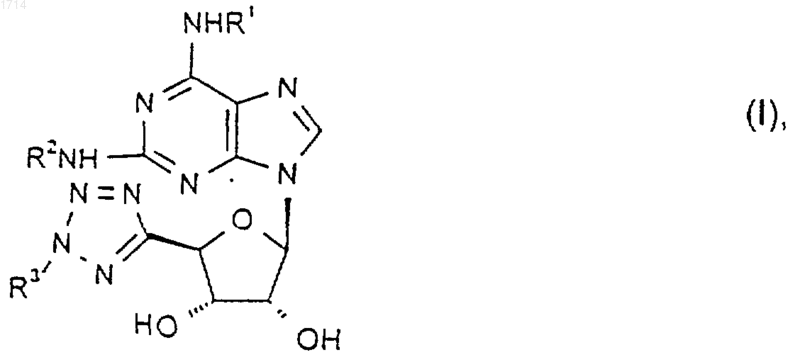
1. Соединение формулы I
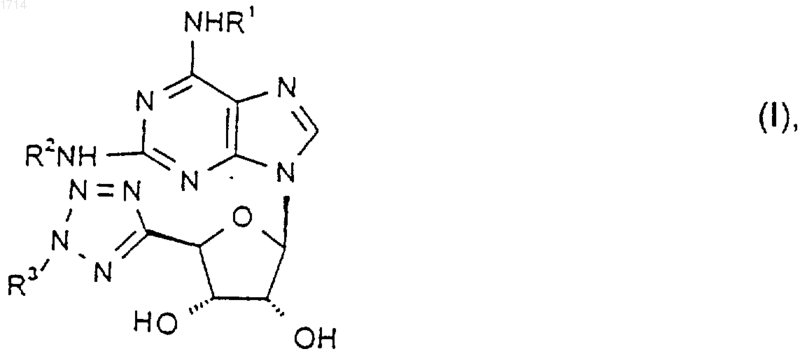
где R1 и R2 независимо представляют собой группу, выбранную из
(1) С3-8циклоалкила;
(2) водорода;
(3) арил2СНСН2-;
(4) С3-8циклоалкилС1-6алкила;
(5) С1-8алкила;
(6) арилС1-6алкила;
(7) R4R5N-С1-6алкила;
(8) С1-6алкил-СН(СН2OН)-;
(9) арилС1-5алкил-СН(СН2OН)-;
(10) арилС1-5алкил-С(СН2OН)2-;
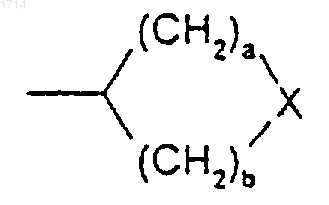
(11) С3-8циклоалкила, независимо замещенного одной или более чем одной группой -(CH2)pR6;
(12) группы формулы
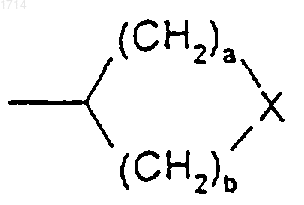
или такой группы, в которой один метиленовый атом углерода, примыкающий к X, либо оба, если такие существуют, замещены метилом;
(13) -C1-6алкил-ОН;
(14) -C1-8галогеноалкила;
(15) группы формулы
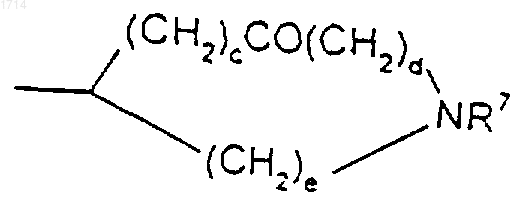 и
и
(16) арила;
R3 представляет собой метил, этил или изопропил;
R4 и R5 независимо представляют собой водород, С1-6алкил, арил, арилС1-6алкил- или NR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил, азетидинил, азепинил, пиперазинил или N-C1-6 алкилпиперазинил;
R6 представляет собой ОН, NH2 или галоген;
R7 представляет собой водород, C1-6алкил или C1-6алкиларил;
Х представляет собой NR7, О, S, SO или SO2;
р представляет собой 0 или 1;
а и b независимо представляют собой целое число от 0 до 4 при условии, что а + b находится в интервале от 3 до 5;
с, d и е независимо представляют собой целое число от 0 до 3 при условии, что с + d + е находится в интервале от 2 до 3;
и его соли и сольваты.
2. Соединение формулы I по п.1, где R1 и R2 независимо представляют собой группу, выбранную из
(1) С3-8циклоалкила;
(2) водорода;
(3) арил2СНСН2-;
(4) С3-8циклоалкилС1-6алкила;
(5) C1-8алкила;
(6) арилС1-6алкила;
(7) R4R5N-С1-6алкила;
(8) С1-6алкил-СН(СН2OН)-;
(9) арилС1-5алкил-СН(СН2ОН)-;
(10) арилС1-5алкил-С(СН2OН)2-;
(11) С3-8циклоалкила, независимо замещенного одной или более чем одной группой -(СН2)pR6;
(12) группы формулы
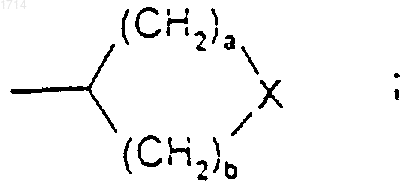
(13) группы формулы
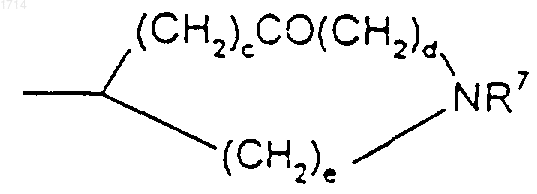 и
и
(14) арила;
R4 и R5 независимо представляют собой водород, С1-6алкил, арил, или NR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил, азетидинил, азепинил, пиперазинил или N-метилпиперазинил;
R6 представляет собой ОН или NH2;
Х представляет собой NR7 или SO2; и
а и b независимо представляют собой целое число от 0 до 4 при условии, что а + b находится в интервале от 3 до 4.
3. Соединение по п.1 или 2, где R1 представляет собой Рh2СНСН2-, арилС1-6алкил-, C1-8алкил-, арилС1-5алкилСН(СН2ОН)-, С3-8циклоалкил-, С3-8циклоалкилС1-6алкил-, R4R5N-C1-6aлкил-, водород, тетрагидропиран-4-ил, тетрагидротиопиран-4-ил или 1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-ил.
4. Соединение по любому из пп.1-3, где R2 представляет собой R4R5NС1-6алкил-, арил, С3-8циклоалкилС1-6алкил-, -C1-6алкил-ОН, арилС1-5алкилСН(СН2ОН)-, тетрагидро-1,1-диоксид тиофен-3-ил, С3-8циклоалкил, С3-8циклоалкил, независимо замещенный одной или более чем одной группой -(CH2)pR6, С1-6алкил-СН (СН2OН)-, арилС1-6алкил- либо пирролидин-3-ил, 2-оксопирролидин-4-ил, 2-оксопирролидин-5-ил, пиперидин-3-ил или пиперидин-4-ил, в которых кольцевой азот возможно замещен С1-6алкилом или арилС1-6алкилом, либо тетрагидропиран-4-ил, тетрагидротиопиран-4-ил или 1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-ил.
5. Соединение по любому из пп.1-4, где R3 представляет собой этил.
6. Соединение формулы I, которое представляет собой (2R,3R,4S,5R)-2-[6-амино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол или его соль либо сольват.
7. Соединение формулы I, которое представляет собой (2R,3R,4S,5R)-2-[6-амино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диола малеат.
8. Соединение формулы I, которое представляет собой
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-{2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]-6-фенетиламинопурин-9-ил}тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(тpанс-4-аминоциклогексиламино)-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(2R-гидроксициклопент-1R-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино-2-пирролидин-3-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-{6-(3-иодбензиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-бензиламино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-циклопентиламино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-{6-(1S-гидроксиметил-2-фенилэтиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(3,3-диметилбутиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-(6-амино-2-циклопентиламинопурин-9-ил)-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(4-фторфениламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(4-аминофенил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(3,4-дигидроксифенил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(4-гидроксифенил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
4-(2-{6-амино-9-[5R-(2-этил-2Н-тетразол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9Н-пурин-2-иламино}этил)бензолсульфамид;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(4-метоксифенил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(бицикло[2.2.1]гепт-2-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(3,4-диметоксифенил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-[2-(6-аминопиридин-2-ил)этиламино]-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(3-иодбензиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(2,2-дифенилэтиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(3,3-диметилбутиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(3-иодбензиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-бензиламино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(2-циклогексилэтиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(18-гидроксиметил-2-фенилэтиламино)-2-[2(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(1-этилпропиламино)2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]-6-фенетиламинопурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрoфуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(3,4-диметоксифенил)этиламино]пурин-9-ил}-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(бицикло[2.2.1]гепт-2-иламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(1S-гидроксиметил-2-фенилэтиламино)-2-[2(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-циклопентиламино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(3,4-диметоксифенил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-пирролидин-1илэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1,1-диоксотетрагидро-1.лямбда.6-тиофен-3-иламино)-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-гидроксиэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(3-иодбензиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[2-(2-морфолин-4-илэтиламино)-6-фенетиламинопурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]-6-(2-морфолин-4-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(3,3-диметилбутиламино)-2-[2-(пиридин-2-иламино)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(3,3-диметилбутиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(тpанс-4-аминоциклогексиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-амино-2-[2-(пиридин-2-иламино)этиламино]пурин-9-ил}-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(3,3-диметилбутиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-изопропил-2Н-тетразол-5-ил)-5-{2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]-6-фенетиламинопурин-9-ил}тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-бензиламино-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)этиламино]пурин-9-ил}-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(3,3-диметилбутиламино)-2-(2R-гидрокси-(R)-циклопентиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-бензиламино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(пирролидин-3-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пиридин-2-илэтиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(пирролидин-3S-иламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1-бензилпирролидин-3-иламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1-бензилпирролидин-3-иламино)-6-циклопентиламинопурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2-циклогексилэтиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2-циклогексилэтиламино)-2-(пирролидин-3S-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-фенетиламино-2-(пирролидин-3R-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1-бензилпирролидин-3-иламино)-6-фенетиламинопурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(3-иодбензиламино)-2-(пирролидин-3S-иламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1-бензилпирролидин-3-иламино)-6-(3-иодбензиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-фенетиламинопурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(2-пирролидин-1-илэтиламино)пурин-9-ил]-5-(2-изопропил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
N-(2-{6-(2,2-дифенилэтиламино)-9-[5R-(2-этил-2Н-тетразол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9Н-пурин-2-иламино}этил)гуанидин;
(2R,3R,4S,5R)-2-[2-(2-аминоэтиламино)-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(пирролидин-3S-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(2-морфолин-4-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-амино-2-(2-гидроксиметилбензиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2R-гидрокси-(R)-циклопентиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-пиридин-2-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-пирролидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1-этилпропиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-циклопентиламинопурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(2,2дифенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2R-гидрокси-(R)-циклопентиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-пиридин-2-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(1S-гидроксиметил-2-метилпропиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(3-иодбензиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-циклопентиламинопурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-фенетиламино-2(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диол;
(2R,3S,4R,5R)-2-(2-этил-2Н-тетразол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(транс-4-аминоциклогексиламино)-6-(3-иодбензиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(3-иодбензиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(3-иодбензиламино)-2-(2-пирролидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(3-иодбензиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[2,6-бис-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пирролидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-циклопентиламино-2-(2-пирролидин-1-илэтиламино)пурин-9-ил]-5-(2-метил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(тетрагидропиран-4-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(тетрагидротиопиран-4-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
(2R,3R,4S,5R)-2-[6-(2,2-дифенилэтиламино)-2-(1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-иламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол;
или соль либо сольват любого из них.
9. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-8 в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем.
10. Применение соединения формулы I
где R1 и R2 независимо представляют собой группу, выбранную из
(1) С3-8циклоалкила;
(2) водорода;
(3) арил2СНСН2-;
(4) С3-8циклоалкилС1-6алкила;
(5) C1-8алкила;
(6) арилС1-6алкила;
(7) R4R5N-С1-6алкила;
(8) С1-6алкил-СН(СН2OН)-;
(9) арилС1-5алкил-СН(СН2ОН)-;
(10) арилС1-5алкил-С(СН2OН)2-;
(11) С3-8циклоалкила, независимо замещенного одной или более чем одной группой -(CH2)pR6,
(12) группы формулы
или такой группы, в которой один метиленовый атом углерода, примыкающий к X, либо оба, если такие существуют, замещены метилом;
(13) -C1-6алкил-ОН;
(14) -С1-8галогеноалкила;
(15) группы формулы
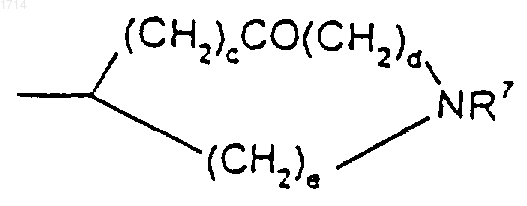 и
и
(16) арила;
R3 представляет собой метил, этил или изопропил;
R4 и R5 независимо представляют собой водород, C1-6алкил, арил, арилС1-6алкил- или NR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил, азетидинил, азепинил, пиперазинил или N-C1-6 алкилпиперазинил;
R6 представляет собой ОН, NH2 или галоген;
R7 представляет собой водород, C1-6алкил или C1-6алкиларил;
Х представляет собой NR7, О, S, SO или SO2;
р представляет собой 0 или 1;
а и b независимо представляют собой целое число от 0 до 4 при условии, что а + b находится в интервале от 3 до 5;
с, d и е независимо представляют собой целое число от 0 до 3 при условии, что с + d + е находится в интервале от 2 до 3;
и его солей и сольватов в качестве фармацевтического средства.
11. Применение соединения формулы (I) по любюьу из пп.1-8 в производстве лекарственного средства для лечения воспалительных заболеваний, например астмы или хронической обструктивной легочной недостаточности (COPD).
12. Способ лечения или профилактики воспалительных заболеваний, например астмы или COPD, при котором пациенту вводят эффективное количество соединения формулы (I) по любому из пп.1-8.
13. Соединение формулы II
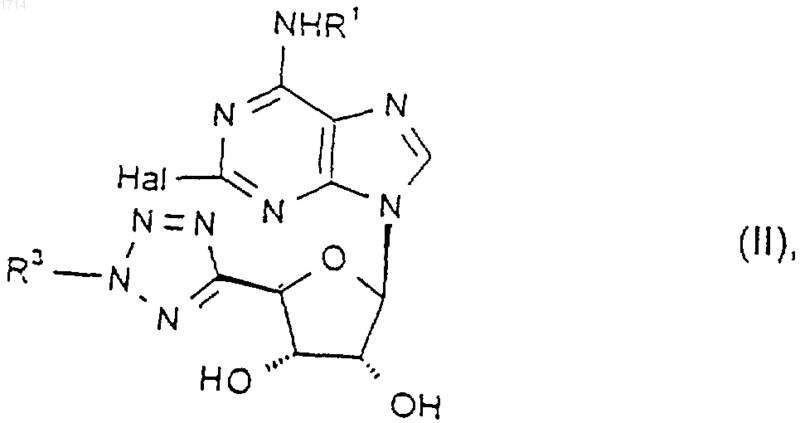
где Hal представляет собой галоген, a R1 и R3 такие, как определено в п.1, или его защищенное производное.
14. Соединение по п.13, где Hal представляет собой хлор или фтор.
15. Соединение по п.13 или 14, где R1 представляет собой водород.
16. Соединение формулы III
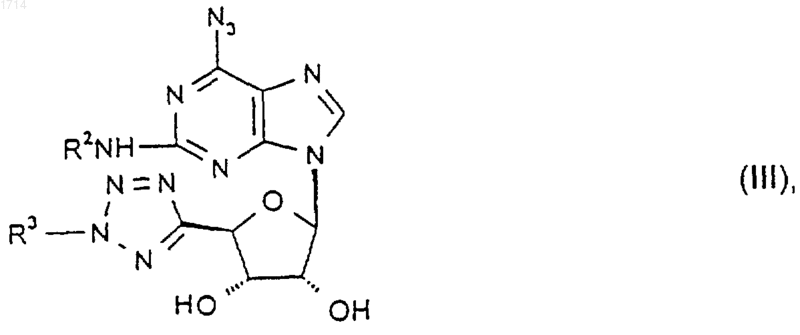
где R2 и R3 такие, как определено в п.1, или его защищенное производное.
17. Соединение формулы IIIA
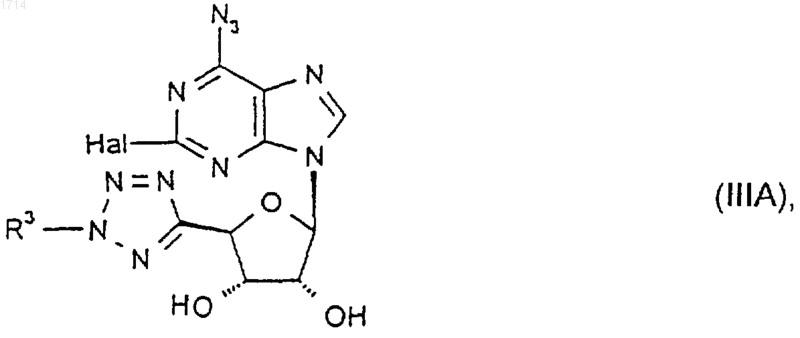
где R3 такой, как определено в п.1, a Hal представляет собой галоген, или его защищенное производное.
18. Соединение формулы IV
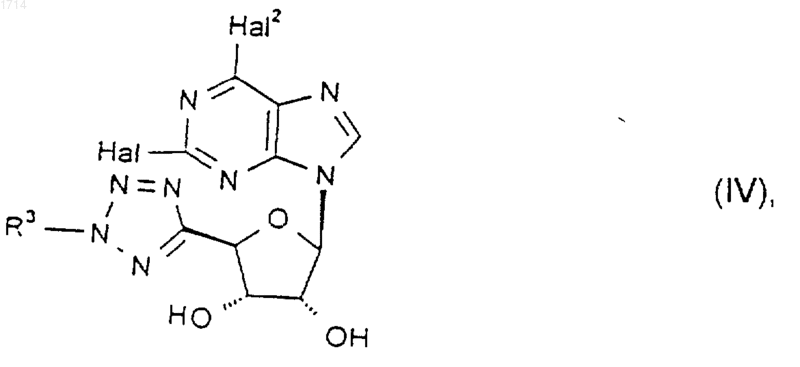
где Hal и Hal2 независимо представляют собой галоген, а R3 такой, как определено в п.1, или его защищенное производное.
19. Соединение по п.18, где Hal и Hal2 представляют собой хлор.
20. Соединение формулы V
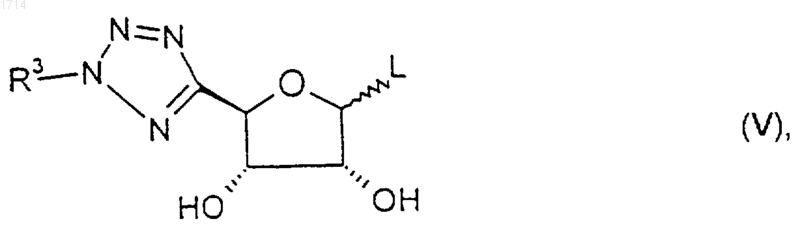
где R3 такой, как определено в п.1, a L представляет собой уходящую группу, или его защищенное производное.
21. Соединение по п.20 формулы Va или VI
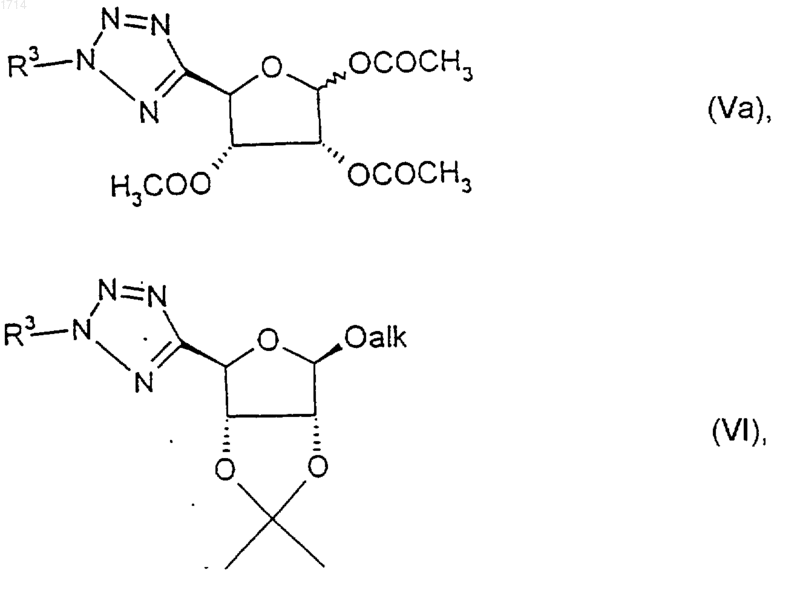
где alk представляет собой C1-6алкил, в особенности метил, и где R3 такой, как определено в п.1.
22. Соединение по любому из пп.13-21, где R3 представляет собой этил.
23. Соединение формулы (VII1)
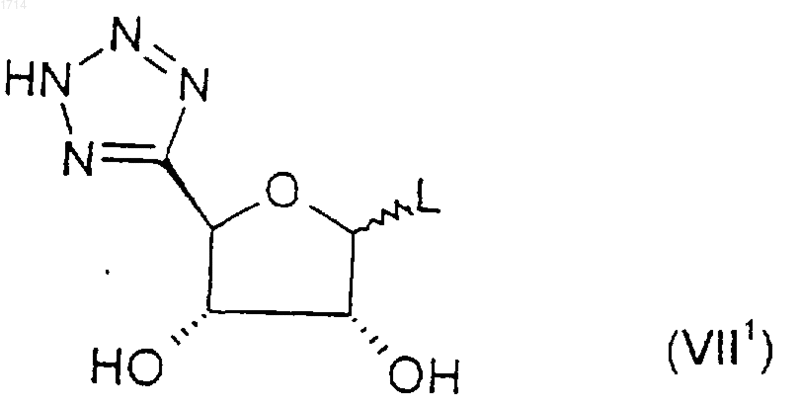
где L представляет собой уходящую группу, или его защищенное производное.
24. Соединение по п.23 формулы (VIl1a)
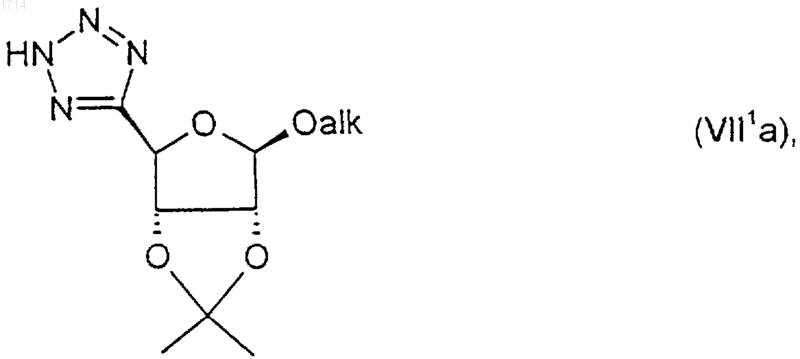
где alk представляет собой C1-6алкил, в особенности метил.
25. Способ получения соединения формулы I по любому из пп.1-8, при котором осуществляют взаимодействие соответствующего соединения формулы II
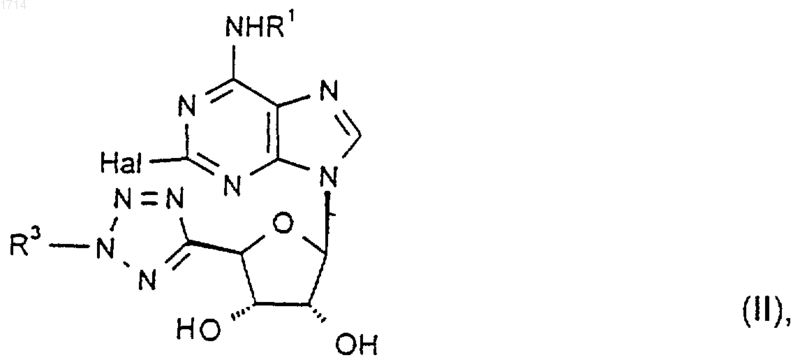
где Hal представляет собой галоген, а R1 и R3 такие, как определено в п.1, или его защищенного производного с соединением формулы R2NH2, где R2 такой, как определено в п.1, или его защищенным производным.
26. Способ получения соединения формулы I по любому из пп.1-8, в котором R1 представляет собой водород, при котором восстанавливают соединение формулы III
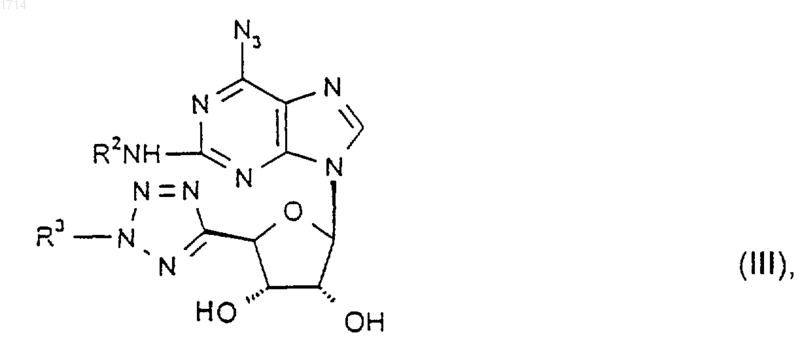
где R2 и R3 такие, как определено в п.1, либо его защищенное производное.
27. Способ получения соединения формулы I по любому из пп.1-8, при котором снимают защиту с соединения формулы I, которое защищено; и при желании или необходимости превращают соединение формулы I или его соль в другую его соль.
28. Способ по п.25, где Hal представляет собой хлор или фтор.
29. Способ получения соединения формулы II или его защищенного производного, при котором осуществляют взаимодействие соединения формулы V

где R3 такой, как определено в п.1, a L представляет собой уходящую группу, или его защищенного производного, с соединением формулы VIII

где R1 такой, как определено в п.1, a Hal представляет собой галоген, возможно с последующим снятием защиты или снятием защиты и переустановкой защиты.
30. Способ по п.29, где Hal представляет собой фтор.
31. Способ по п.29 или 30, где R1 представляет собой водород.
32. Способ по любому из пп.29-31, где L представляет собой ацетилоксигруппу, а каждая из двух гидроксильных групп соединения формулы V защищена в виде ацетилового эфира.
33. Способ по любому из пп.29-32, при котором дополнительно осуществляют стадии превращения соединения формулы II в соединение формулы I путем взаимодействия соединения формулы II с соединением формулы R2NH2 или его защищенным производным.
34. Способ по любому из пп.25-33, где R3 представляет собой этил.
35. Способ по п.34, где соединение формулы I представляет собой (2R,3R,4S,5R)-2-[6-амино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-этил-2Н-тетразол-5-ил)тетрагидрофуран-3,4-диол или его соль либо сольват.
Текст
1 Данное изобретение относится к новым химическим соединениям, способам их получения, к содержащим их фармацевтическим препаратам и их применению в терапии. Воспаление является первичным ответом на повреждение ткани или микробную инвазию и характеризуется адгезией лейкоцитов на эндотелии, диапедезом и активацией лейкоцитов внутри ткани. Активация лейкоцитов может приводить к генерированию токсичных кислородных разновидностей (таких как пероксиданион) и высвобождению продуктов гранул (таких как пероксидазы и протеазы). Лейкоциты кровотока включают в себя нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты. В различные формы воспалений вовлекаются различные типы инфильтрирующих лейкоцитов,причем конкретный профиль регулируется профилем адгезионной молекулы, цитокина и экспрессии хемотаксического фактора внутри ткани. Первичной функцией лейкоцитов является защита хозяина от вторжения таких организмов,как бактерии и паразиты. Как только ткань поражается или инфицируется, происходит ряд событий, вызывающих локальный рекрутмент лейкоцитов из системы кровообращения в пораженную ткань. Рекрутмент лейкоцитов контролируется, что позволяет осуществлять методичное разрушение и фагоцитоз чужеродных и мертвых клеток с последующим восстановлением ткани и рассасыванием воспалительного инфильтрата. Однако при хронических воспалительных состояниях рекрутмент часто протекает нецелесообразно, рассасывание контролируется неадекватно, и воспалительная реакция приводит к разрушению ткани. В результате исследований как in vitro, так и in vivo имеются все данные предполагать, что соединения, активные в отношении аденозинА 2 а-рецептора, будут обладать противовоспалительным действием. Обзор в данной области представлен Cronstein (1994). Исследования на изолированных нейтрофилах показывают наличие опосредованного А 2-рецептором ингибирования образования пероксида, дегрануляции,агрегации и слипания (Cronstein et al, 1983 и 1985; Burkey and Webster, 1993; Richter, 1992;CGS21680), характер ингибирования, повидимому, согласуется с действием на А 2 арецепторный подтип (Dianzani et al, 1994). Кроме того, агонисты аденозина могут осуществлять понижающую регуляцию других классов лейкоцитов (Elliot and Leonard, 1989; Peachell etal, 1989). Исследования на интактных животных показывают, что противовоспалительные эффекты метотрексата опосредуются через аденозин и активацию А 2-рецептора (Asako et al,1993;Cronstein et al, 1993 and 1994). Сам по себе аденозин и соединения, повышающие уровень аденозина в кровотоке, также показывают противовоспалительные эффекты in vivo (Green etal, 1991; Rosengren et al, 1995). Кроме того, повышенный уровень аденозина в кровотоке у мужчины (как результат дефицита аденозиндеаминазы) приводит к иммуносупрессии(Hirschorn, 1993). Конкретные замещенные 4'-карбоксамидои 4'-тиоамидоаденозиновые производные, которые полезны для лечения воспалительных заболеваний, описаны в международных заявках на патент WО 94/17090, WО 96/02553, WО 96/02543 (Glaxo Group). Замещенные 4'карбоксамидоаденозиновые производные, полезные при лечении деменции, описаны в AU 8771946 (Hoechst Japan). Замещенные 4'гидроксиметиладенозиновые производные, которые полезны для лечения расстройств перистальтики желудочно-кишечного тракта, описаны в ЕР-А-423776 и ЕР-А-423777 (Searle). Замещенные 4'-гидроксиметиладенозиновые производные, которые полезны в качестве ингибиторов агрегации тромбоцитов, описаны в ВЕ 768925 (Takeda). 4'-Гидроксиметиладенозиновые производные и их 4'-эфиры, которые полезны в качестве гипотензивных агентов или обладают другой сердечно-сосудистой активностью, описаны в US 4663313, ЕР 139358 и US 4767747 (Warner Lambert), US 4985409 (NipponZoki) и US 5043325 (Whitby Research). 4'Гидроксиметиладенозиновые производные, полезные при лечении аутоиммунных нарушений,описаны в US 5106837 (Scripps Research Institute). 4'-Гидроксиметиладенозиновые производные, полезные в качестве противоаллергических агентов, описаны в US 4704381 (BoehringerMannheim). Конкретные 4'-тетразолилалкиладенозиновые производные, которые полезны при лечении нарушений сердечной деятельности или кровообращения, описаны в основном вDT-A-2621470 (Pharma-Waldhof). Другие 4'карбоксамидоаденозиновые производные, полезные при лечении сердечно-сосудистых состояний, описаны в US 5219840, GB 2203149 иLambert). Другие 4'-карбоксамидоаденозиновые производные, не имеющие замещения по положению 2 пуринового кольца, описаны в DT 2317770, DT 2213180, US 4167565, US 3864483 и US 3966917 (Abbott Labs), DT 2034785 (Boehringer Mannheim), JP 58174322 и JP 58167599 3 93/14102 (Lab UPSA). 4'-Гидроксиметиладенозиновые производные, не имеющие замещения по положению 2 пуринового кольца,описаны в WО 95/11904 (Univ. Florida). 4'-3 амещенные аденозиновые производные, полезные в качестве ингибиторов аденозинкиназы, описаны в WО 94/18215 (Gensia). Другие 4'-галогенметил-, метил-, тиоалкилметил- или алкоксиметиладенозиновые производные описаны в ЕР 161128 и ЕР 181129Health). Конкретные тетразолсодержащие дезоксинуклеотиды, для которых не обнаружено антибактериального действия, описаны в Baker et al(1974) Tetrahedron 30, 2939-2942. Другие тетразолсодержащие аденозиновые производные,которые показывают активность ингибиторов агрегации тромбоцитов, описаны в Mester andMester (1972) Pathologie-Biologie, 20 (Suppl.) 1114. Конкретные нитрилсодержащие производные рибозы описаны в Schmidt et al (1974) Liebigs. Ann. Chem. 1856-1863. В настоящее время обнаружена новая группа соединений с широким кругом противовоспалительных свойств, которые ингибируют рекрутмент и активацию лейкоцитов и которые являются агонистами аденозин-2 а-рецептора. Поэтому данные соединения, возможно, будут оказывать благоприятное терапевтическое действие в обеспечении защиты от индуцированного лейкоцитами повреждения ткани при заболеваниях, когда лейкоциты вовлекаются в место воспаления. Кроме того, при лечении воспалительных заболеваний соединения по данному изобретению могут представлять собой более безопасную альтернативу кортикостероидам, использование которых может быть ограничено особенностями их побочного действия. В частности, соединения по этому изобретению могут показывать улучшенную характеристику в сравнении с известными А 2 аселективными агонистами, поскольку большей частью они не обладают значительной агонистической активностью по отношению к А 3 рецептору человека. Кроме того, они даже могут обладать А 3-антагонистической активностью. Эту особенность можно считать полезной,так как А 3-рецепторы также обнаруживают на лейкоцитах (например эозинофиле) и других воспалительных клетках (например тучной клетке), и активация этих рецепторов может оказывать провоспалительное действие (Kohnoet al, 1996; Van Schaick et al, 1996). Считают даже, что бронхостенозные эффекты аденозина при астматических проявлениях могут быть(Kohno et al, 1996). Таким образом, согласно данному изобретению предложены соединения формулы I где R1 и R2 независимо представляют собой группу, выбранную из(11) С 3-8 циклоалкила, независимо замещенного одной или более чем одной группой или такой группы, в которой один метиленовый атом углерода, примыкающий к X, либо оба,если такие существуют, замещены метилом;R4 и R5 независимо представляют собой водород, C1-6 алкил, арил, арилС 1-6 алкил-, илиNR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил, азетидинил, азепинил, пиперазинил или N-C1-6 алкилпиперазинил;SO2; р представляет собой 0 или 1; а и b независимо представляют собой целое число от 0 до 4 при условии, что а + b находится в интервале от 3 до 5; с, d и е независимо представляют собой целое число от 0 до 3 при условии, что с + d + е находится в интервале от 2 до 3; и его соли и сольваты. 5 Ссылки на С 1-6 алкил включают в себя ссылки на алифатическую углеводородную группировку, содержащую от 1 до 6 углеродных атомов, которая может быть прямоцепочечной или разветвленной и может быть насыщенной или ненасыщенной. Ссылки на С 1-4 алкил, С 15 алкил и C1-8 алкил могут интерпретироваться подобным же образом. Ссылки на арил включают в себя ссылки на моно- и бициклические карбоциклические ароматические кольца (например фенил, нафтил), и гетероциклические ароматические кольца, содержащие 1-3 гетероатома, выбранные изN, O и S (например пиридинил, пиримидинил,тиофенил, имидазолил, хинолинил, фуранил,пирролил, оксазолил), которые все могут быть возможно замещены, например С 1-6 алкилом,галогеном, гидрокси-, нитро-, С 1-6 алкокси-, циано-, аминогруппой, SO2NH2 или -СН 2OН. Примеры С 3-8 циклоалкила для R1 и R2 включают в себя моноциклические алкильные группы (например циклопентил, циклогексил) и бициклические алкильные группы (например норборнил, такой как экзонорборн-2-ил). Примеры (арил)2 СНСН 2- для R1 и R2 включают в себя Ph2CHCH2- или такую группу, в которой одна или более чем одна фенильная составляющая замещена, например галогеном или С 1-4 алкилом. Примеры С 3-8 циклоалкилС 1-6 алкила для R1 2 и R включают в себя этилциклогексил. Примеры C1-8 алкила для R1 и R2 включают в себя -(СН 2)2 С(Ме)3, -CH(Et)2 и СН 2= С(Ме)СН 2 СН 2-. Примеры арилС 1-6 алкила для R1 и R2 включают в себя -(CH2)2Ph, -CH2Ph или каждую из них, в которых Ph замещен (один или более чем один раз) галогеном (например, иодом), амино-,метокси-, гидроксигруппой, -CH2OH или(например,-(СН 2)2 пиридин-2-ил), возможно замещенный аминогруппой; (СН 2)2 имидазолил или эту группу, в которой имидазолил замещен по Nположению C1-6 алкилом (в особенности метилом). Примеры R4R5N-С 1-6 алкила для R1 и R2 включают в себя этилпиперидин-1-ил, этилпирролидин-1-ил, этилморфолин-1-ил, -(СН 2)2R1 и R2 включают в себя PhCH2C(CH2OH)2-. Примеры С 3-8 циклоалкила, независимо замещенного одной или более чем одной группой для R1 и R2 включают в себя пирролидин-3-ил,пиперидин-3-ил, пиперидин-4-ил или производное, в котором кольцевой азот замещен С 16 алкилом (например, метилом) либо бензилом,тетрагидро-1,1 -диоксид тиофен-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-4-ил и 1,1 диоксо-тетрагидро-1.лямбда.6-тиопиран-4-ил. Примеры групп -C1-6 алкил-ОН для R1 и R2 включают в себя -СН 2 СН 2OН. Примеры С 1-8 галогеналкила для R1 и R2 включают в себя для R1 и R2 включают в себя 2-оксопирролидин 4-ил, 2-оксо-пирролидин-5-ил или производное,в котором кольцевой азот замещен C1-6 алкилом(например, метилом) или бензилом. Примеры арила для R1 и R2 включают в себя фенил, возможно замещенный галогеном(например, фтором, в особенности 4-фтором). Примеры C1-6 алкила для R7 включают в себя метил, а C1-6 алкиларила для R7 включают в себя бензил. Предпочтительно, R1 и R2 не представляют собой водород оба одновременно. Предпочтительную группу соединений представляют собой такие соединения формулыR1 и R2 независимо представляют собой группу, выбранную из(11) С 3-8 циклоалкила, независимо замещенного одной или более чем одной группойR4 и R5 независимо представляют собой водород, C1-6 алкил, арил, или NR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил, азетидинил, азепинил, пиперазинил или N-метилпиперазинил;R6 представляет собой ОН или NH2; Х представляет собой NR7 или SО 2; и а и b независимо представляют собой целое число от 0 до 4 при условии, что а + b находится в интервале от 3 до 4. Предпочтительно, R1 представляет собойPh2CHCH2-, арилС 1-6 алкил-, C1-8 алкил-, арилС 1-5 алкилСН(СН 2OН)-, С 3-8 циклоалкил, С 3-8 циклоалкилС 1-6 алкил-, R4R5N-С 1-6 алкил- или водород. Также предпочтительно, R1 представляет собой тетрагидропиран-4-ил, тетрагидротиопиран-4-ил и 1,1-диоксотетрагидро-1.лямбда.6 тиопиран-4-ил. Особенно предпочтительно, R1 представляет собой Ph2CHCH2-, РhСН 2-, (СН 3)3 С(СН 2)2-,PhCH2CH2-, арилСН 2- (в особенности, где арил представляет собой возможно замещенный фенил, в частности, фенил или фенил, замещенный галогеном,особенно иодом,по метаположению), PhCH2CH(CH2OH)-, циклопентил,Et2CH-, (циклогексил)(СН 2)2-, (пирролидин-1 ил)(СН 2)2-, (морфолин-1-ил)(СН 2)2- или водород. Более предпочтительно, в частности, R1 представляет собой Ph2CHCH2-, PhCH2CH2-,PhCH2CH(CH2OH)-,циклопентил,Et2CH-,(СН 3)3 С(СН 2)2-, (циклогексил)(СН 2)2- и водород. Предпочтительно, R2 представляет собой 4 5R R NС 1-6 алкил-, арил, С 3-8 циклоалкилС 1-6 алкил-, -C1-6 алкил-ОН, арилС 1-5-алкилСН(СН 2OН)-,тетрагидро-1,1-диоксид тиофен-3-ил, С 3-8 циклоалкил, Н 2NС(=NН)NНС 1-6 алкил-, С 3-8 циклоалкил, независимо замещенный одной или более чем одной (например, 1, 2 или 3) группой-(CH2)pR6, С 1-6 алкил-СН(СН 2OН)-, арилС 1-6 алкил- либо пирролидин-3-ил, 2-оксопирролидин 4-ил, 2-оксопирролидин-5-ил, пиперидин-3-ил или пиперидин-4-ил, в которых кольцевой азот возможно замещен C1-6 алкилом или арилС 1-6aлкилом (например, бензилом). Также предпочтительно, R2 представляет собой тетрагидропиран-4-ил, тетрагидротиопиран-4-ил и 1,1-диоксотетрагидро-1.лямбда.6 тиопиран-4-ил. Предпочтительно, в частности, R2 представляет собой арил (в особенности, когда арил представляет собой замещенный фенил, особенно фенил, замещенный фтором по параположению), (морфолин-1-ил)(СН 2)2-, (пирролидин-1 ил)(СН 2)2-, норборнил, (циклогексил)(СН 2)2-,NН 2(СН 2)2-, PhCH2CH(CH2OH)-, циклопентил,-(СН 2)2OН,пирролидин-3-ил,2-гидроксициклопентил, Ме 2 СНСН-(СН 2OН)-, тетрагидро 1,1-диоксид тиофен-3-ил, N-бензилпирролидин 3-ил, 4-аминоциклогексил, (пиридин-2-ил)NН 8 особенности, когда арил представляет собой замещенный фенил, особенно фенил, замещенный по параположению аминогруппой, SO2NH2,гидрокси- или метоксигруппой, либо по мета- и параположению гидрокси- или метоксигруппой,или когда арил представляет собой N-метилимидазолил или пиридинил (в особенности, пиридин-2-ил или пиридин-2-ил, замещенный по мета-положению аминогруппой или (3 СН 2OН)фенил(СН 2). Также предпочтительно, в частности, R2 представляет собой (2-СН 2OН)фенил(СН 2)- или(3-амино-пиридин-2-ил)СН 2 СН 2-. Предпочтительно, R3 представляет собой метил или этил, в особенности, этил. Предпочтительно, R4 и R5 независимо представляют собой водород, C1-6 алкил либо арил, или NR4R5 вместе могут представлять собой пирролидинил, пиперидинил, морфолинил,азетидинил, азепинил, пиперазинил или Nметилпиперазинил. Предпочтительно, Х представляет собойNR7, О, S или SO2, в частности NR7 или SO2, в особенности NR7. Предпочтительно, оба а и b представляют собой 2 или а представляет собой 1, а b представляет собой 2. Предпочтительно, R7 представляет собой водород. Предпочтительно, р представляет собой 0. Предпочтительно, R6 представляет собой ОН или NH2, в особенности, NН 2. Предпочтительно, с представляет собой 0 и либо d представляет собой 2, а е представляет собой 0, либо d представляет собой 1, а е представляет собой 1. Наиболее предпочтительную группу соединений составляют такие соединения формулы (I), в которыхR3 представляет собой этил и Группу соединений, которые также могут быть упомянуты, составляют соединения формулы (I), в которых R3 представляет собой этил,R1 представляет собой Н и R2 представляет собой Следующую наиболее предпочтительную группу соединений составляют соединения формулы (I), в которых R3 представляет собой этил, R1 представляет собой Н и R2 представляет собой Изображение формулы (I) указывает на абсолютную стереохимию в положениях вокруг тетрагидрофуранового кольца. В том случае,когда боковые цепи содержат хиральные центры, изобретение охватывает смеси энантиомеров (включая рацемические смеси) и диастереомеров, равно как и индивидуальные энантиомеры. Как правило, предпочтительно использовать соединение формулы I в форме очищенного единственного энантиомера. Кроме того, предложен способ получения соединений формулы I, при котором(а) осуществляют взаимодействие соответствующего соединения формулы II или его защищенного производного с соединением формулы R2NH2 или его защищенным производным;(b) получают соединение формулы (I), в котором R1 представляет собой водород, восстановлением соединения формулы III либо его защищенного производного; илиI, которое защищено; и при желании или необходимости превращают соединение формулы I или его соль в другую его соль. В способе (a) Hal представляет собой галоген, например хлор или фтор. Реакцию способа(а) обычно будут проводить при нагревании реагентов до температуры 50-150 С в присутствии растворителя, такого как ДМСО. Кроме того, для данной реакции предпочтительно присутствие органического основания, например тризамещенного органического амина (такого как диизопропилэтиламин). В этих условиях особенно предпочтительно, Hal представляет собой фтор (в особенности, когда R1 представляет собой водород), так как реакция имеет тен 001714 10 денцию к быстрому протеканию с высокой эффективностью. Реакция восстановления в способе (b) может быть осуществлена путем каталитического гидрирования, например над Pd/C в стандартных условиях. Примеры защитных групп в способе (с) и способы их удаления можно найти в T.W.(J. Wiley and Sons, 1991). Подходящие защитные группы гидроксила включают в себя алкил (например, метил), ацеталь (например, ацетонид) и ацил (например, ацетил или бензоил), которые могут быть удалены путем гидролиза, и арилалкил (например, бензил), который может быть удален путем каталитического гидрогенолиза. Подходящие защитные группы амина включают в себя сульфонил (например, тозил), ацил (например,бензилоксикарбонил или третбутоксикарбонил) и арилалкил (например, бензил), которые могут быть удалены путем гидролиза или гидрогенолиза, как целесообразно. Подходящие соли соединений формулы (I) включают в себя физиологически приемлемые соли, такие как соли присоединения кислоты,полученные из неорганических или органических кислот, например, гидрохлориды, гидробромиды, 1-гидрокси-2-нафтоаты, мезилаты,сульфаты, фосфаты, ацетаты, бензоаты, цитраты, сукцинаты, лактаты, тартраты, фумараты и малеаты, и, если целесообразно, соли неорганических оснований, такие как соли щелочных металлов, например натриевые соли. Другие соли соединений формулы (I) включают в себя соли, которые могут не быть физиологически приемлемыми, но могут быть полезны при получении соединений формулы (I) и их физиологически приемлемых солей. Примеры таких солей включают в себя трифторацетаты и формиаты. Примеры подходящих сольватов соединений формулы (I) включают в себя гидраты. Соединения формулы I, представляющие собой соли присоединения кислот, могут быть получены путем обработки свободного основания формулы I соответствующей кислотой. Соединения формулы II или их защищенное производное могут быть получены путем взаимодействия соединения IV или его защищенного производного с соединением формулы R1NH2.Hal и Hal2 независимо представляют собой галоген, например хлор или фтор. Эту реакцию предпочтительно будут осуществлять в присутствии основания, такого как органический амин(например диизопропилэтиламина), в сольвате, 11 таком как спирт (например, изопропанол), при повышенной температуре (например, температуре дефлегмации). Соединения формулы III или их защищенное производное могут быть получены путем взаимодействия соединения формулы IIIА где Hal представляет собой галоген, например хлор или фтор, или его защищенного производного с соединением формулы R2NH2 в стандартных условиях. Соединения формулы IIIА или их защищенное производное могут быть получены путем взаимодействия соединения формулы IV или его защищенного производного с азидом,например азидом натрия, в стандартных условиях. Соединение формулы IV или его защищенное производное могут быть получены путем взаимодействия соединения формулы V где L представляет собой уходящую группу, или его защищенного производного с 2,6-дигалогенпурином, например, 2,6-дихлорпурином. Предпочтительно использовать соединение формулы V, где 2- и 3-гидроксильные группы рибозы защищены, например, ацетилом. Уходящая группа L может представлять собой ОН, но предпочтительно будет представлять собой С 1-6 алкоксигруппу (например, метокси или этокси), эфирную группировку (например, ацетилокси или бензоилокси) или галоген. Предпочтительной группой L является ацетилокси. Реакция может быть осуществлена путем объединения реагентов в инертном растворителе, таком как МеСN, в присутствии кислоты Льюиса (например, TMCOTf) и ДБУ, и нагревания до, скажем, 70-80 С. Соединения формулы V могут быть получены из соединения формулы VI где alk представляет собой С 1-6 алкил, например,метил, путем обработки соединения формулыVI трифторуксусной кислотой в воде с последующей переустановкой защиты, например,путем взаимодействия с уксусным ангидридом в пиридине. Соединения формулы V, в которой L представляет собой галоген, могут быть получены из соответствующих 1-спирта или 1-эфира, такого 12 как ацетат. Обычно реакция будет протекать при обработке безводными HCl или НВr. 1 Иодиды могут быть получены непосредственно при обработке триметилсилилиодидом, а 1 фториды могут быть получены при обработке ДАСТ. Как правило, подходящим будет инертный растворитель, например диэтиловый эфир,ДХМ, THF или CCl4. Соединение формулы VI может быть получено по cхеме 1. Схема 1 Основные условия для cтадий 1-6 известны специалистам. Также понятно, что реагенты и условия, изложенные на cхеме 1, представлены в качестве образца, а другие реагенты и условия для достижения тех же химических превращений могут быть известны специалистам. Например, для получения в соединениях формул VII иVI другой уходящей C1-6 алкоксигруппы на cтадии 1 может быть использован другой спирт,например, C1-6 алкиловый спирт. Соединения формулы VII, для которых желательна уходящая группа помимо ОМе, могут быть получены по аналогии с методом, описанным выше для получения соединений формулы V. Для защиты 3'- и 4'-гидроксильных групп на рибозе на cтадии 1 могут быть использованы другие группы. Кроме того, обнаружено, что cтадия 5 при желании может быть осуществлена с использованием азидотриметилсилана и оксида дибутилолова в толуоле. После cтадии 6 загрязненный примесями продукт может быть очищен с использованием общепринятых методик и, в особенности, с использованием флэш-хроматографии под давлением азота. Обнаружено, что удовлетворительные условия включают в себя загрузку загрязненного примесями продукта в минимальном объеме дихлорметана на колонку с Keiselgel 60(Merck 9385) и элюирование, применяя градиентную систему растворителей с использованием этилацетата (10-40%) в циклогексане. Кроме того, соединения формулы II и их защищенные производные могут быть получены путем взаимодействия соединения формулы V или его защищенного производного с соединением формулы VIII в которой Hal представляет собой галоген, например хлор или фтор, возможно с последующим снятием защиты или снятием защиты и переустановки защиты. Предпочтительно использование соединений формулы V в защищенной форме. В частности, предпочтительно, по меньшей мере гидроксильная группа в положении 2 на рибозе защищена в виде эфирной группы, например ацетилом или бензоилом, поскольку она имеет тенденцию приводить к большей стереоспецифичности в реакции сочетания. Предпочтительно, гидроксильные группы в положениях 2 и 3 защищены ацетилом. Подходящие уходящие группы L описаны ранее. Предпочтительной уходящей группой L является ацетилокси. Этот способ предпочтителен, в частности,когда Hal представляет собой фтор (и в особенности, когда R1 представляет собой водород),поскольку обычно данная реакция протекает быстро и эффективно и поскольку данная реакция имеет тенденцию продуцировать продукт высокой степени кристалличности. При желании с продукта этой реакции может быть снята защита в общепринятых условиях, например обработкой спиртом (например,изопропанолом) в мягких щелочных условиях(например, в присутствии карбоната калия). Взаимодействие соединений формулы V (в защищенной форме) и соединений формулыVIII может быть осуществлено в присутствии кислоты Льюиса (например TMCOTf) и возможно силилирующего агента (например, БСА) в инертном растворителе, таком как ацетонитрил, с последующей обработкой, например, водой. В том случае, когда L представляет собой галоген, кислоту Льюиса обычно опускают, если присутствует силилирующий агент. Известны некоторые соединения формулыVIII. Другие соединения формулы VIII могут быть получены путем взаимодействия соединения формулы IX в которой Hal и Hal2 независимо представляют собой галоген, например хлор или фтор, сR1NH2 в общепринятых условиях. Соединения формулы R1NH2, R2NH2 и IX либо известны, либо могут быть получены общепринятыми методами, известными per se. Способность соединений формулы (I) к ингибированию функции лейкоцитов может быть продемонстрирована, например, по их способности ингибировать образование пероксида (O1-) из нейтрофилов, стимулированных 14 хемоаттрактантами, такими как N-формилметионил-лейцил-фенилаланин (fMLP). Соответственно, соединения формулы (I) возможно будут оказывать благоприятное терапевтическое действие в обеспечении защиты от индуцированного лейкоцитами повреждения ткани при заболеваниях, когда лейкоциты вовлекаются в место воспаления. Примеры болезненных состояний, при которых соединения по изобретению обладают возможными благоприятными противовоспалительными эффектами, включают в себя заболевания дыхательных путей, такие как респираторный дистресс-синдром у взрослых (ARDS),бронхит (включая хронический бронхит), муковисцидоз, астма (включая вызванные аллергенами астматические реакции), хроническое обструктивное заболевание легких (COPD), эмфизема, ринит и септический шок. Другие родственные болезненные состояния включают в себя заболевания желудочно-кишечного тракта, такие как кишечные воспалительные заболевания,включая воспалительное заболевание толстой кишки (например болезнь Крона или неспецифический язвенный колит), индуцированныйHelicobacter-pylori гастрит и побочные кишечные воспалительные заболевания, вызванные радиоактивным облучением и экспозицией аллергенами, и гастропатия, индуцированная нестероидными противовоспалительными лекарственными средствами. Более того, соединения по изобретению могут быть использованы для лечения заболеваний кожи, таких как псориаз,аллергический дерматит и реакции повышенной чувствительности, и заболеваний центральной нервной системы, которые имеют воспалительный компонент, например, болезнь Альцгеймера и рассеянный склероз. Следующие примеры болезненных состояний, для которых соединения по изобретению обладают возможными благоприятными эффектами, включают в себя кардиальные состояния,такие как заболевание периферических сосудов,постишемическое реперфузионное повреждение и синдром повышенного содержания эозинофилов у новорожденных. Соединения по изобретению, которые ингибируют функцию лимфоцитов, могут оказаться полезными в качестве иммунодепрессивных агентов и, таким образом, полезными при лечении аутоиммунных заболеваний, таких как ревматоидный артрит и диабет. Кроме того, соединения по изобретению могут оказаться полезными для ингибирования образования метастазов. Самые важные заболевания включают в себя астму и COPD. Специалистам будет ясно, что упоминание здесь о лечении распространяется как на профилактику, так и на лечение установленных состояний. 15 Как упомянуто выше, соединения формулы (I) полезны в медицине и в ветеринарии, в частности, в качестве противовоспалительных агентов. Таким образом, в качестве еще одного аспекта изобретения предложено соединение формулы (I) или его физиологически приемлемые соль либо сольват для использования в медицине или ветеринарии, в частности, при лечении пациентов с воспалительными состояниями,которые восприимчивы к индуцированному лейкоцитами повреждению ткани. Согласно еще одному аспекту изобретения предложено применение соединения формулы(I) или его физиологически приемлемых соли либо сольвата с целью производства лекарственных средств для лечения пациентов с воспалительными состояниями, которые восприимчивы к индуцированному лейкоцитами повреждению ткани. Еще в одном или альтернативном аспекте изобретения предложен способ лечения субъекта, человека или животного, с воспалительным состоянием, восприимчивого к индуцированному лейкоцитами повреждению ткани, при котором указанному субъекту, человеку или животному, вводят эффективное количество соединения формулы (I) или его физиологически приемлемых соли либо сольвата. Соединения по изобретению могут быть приготовлены в виде препарата для введения любым удобным способом, и, следовательно,изобретение в свое объеме охватывает, кроме того, фармацевтические композиции для использования в противовоспалительной терапии,содержащие соединение формулы (I) или его физиологически приемлемые соль либо сольват вместе, при желании, с одним или более чем одним физиологически приемлемым разбавителем или носителем. Кроме того, предложен способ получения такой фармацевтической композиции, который включает в себя смешивание ингредиентов. Например, соединения по изобретению могут быть приготовлены в виде препарата для перорального, трансбуккального, парентерального, местного или ректального введения, предпочтительно для парентерального или местного(например с помощью аэрозоля) введения. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например,сироп, аравийскую камедь, желатин, сорбит,трагакант, растительный клей крахмала, целлюлозу или поливинилпирролидон; наполнители,например, лактозу, микрокристаллическую целлюлозу, сахар, кукурузный крахмал, фосфат кальция или сорбит; смазывающие вещества,например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например, картофельный крахмал, натриевую соль кроскармелозы 16 или натрий крахмал гликолат; либо увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными специалистам. Жидкие препараты для перорального введения могут быть в форме например водных либо масляных суспензий, растворов, эмульсий, сиропов или эликсиров, либо могут быть представлены в виде сухого продукта для смешивания с водой или другим подходящим разбавителем перед употреблением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например, сироп сорбита, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенизированные пищевые жиры; эмульгирующие агенты,например, лецитин, сорбитана моноолеат или аравийскую камедь; разбавители неводной природы (которые могут включать в себя пищевые масла), например, миндальное масло, фракционированное кокосовое масло, масляные эфиры,пропиленгликоль или этиловый спирт; или консерванты, например метил- либо пропил-парагидроксибензоаты или сорбиновую кислоту. Данные препараты могут также содержать буферные соли, корригенты, красители и/или подсластители (например, маннит), как целесообразно. Композиции для трансбуккального введения могут принимать форму таблеток или лепешек, изготовленных традиционным способом. Кроме того, соединения могут быть приготовлены в виде суппозиториев, например содержащих традиционные основы для суппозиториев, такие как масло какао или другие глицериды. Кроме того, соединения по данному изобретению могут быть приготовлены для парентерального введения путем инъекции ударной дозы вещества или непрерывной инфузии и могут быть представлены в форме стандартной дозы, например в ампулах, флаконах, инфузорах малого объема или предварительно заполненных шприцах, либо в многодозовых контейнерах с добавленным консервантом. Композиции могут принимать такие формы, как растворы,суспензии или эмульсии в водных либо неводных разбавителях, и могут содержать составляющие препарат агенты, такие как антиокислители, буферы, антимикробные агенты и/или регулирующие тоничность. С другой стороны,активный ингредиент может быть в форме порошка для смешивания перед применением с подходящим разбавителем, например, стерильной апирогенной водой. Данная форма представления препарата в виде сухого твердого вещества может быть получена путем заполнения стерильного порошка в отдельные стерильные емкости в асептических условиях или путем 17 заполнения стерильного раствора в каждую емкость в асептических условиях и лиофилизации. Местное применение, используемое здесь,включает в себя применение посредством инсуффляции и ингаляции. Примеры различных типов препарата для местного применения включают в себя мази, кремы, лосьоны, порошки, пессарии, спреи, аэрозоли, капсулы или картриджи для использования в ингаляторах или инсуффляторах, растворы для распыления или капли (например глазные капли или капли в нос). Мази и кремы могут быть приготовлены,например, на водной или масляной основе с добавлением подходящих загущающих и/или гелеобразующих агентов и/или растворителей. Такие основы могут, таким образом, включать в себя, например, воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или касторовое масло,либо растворитель, такой как полиэтиленгликоль. Загустители, которые могут быть использованы, включают в себя мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Лосьоны могут быть приготовлены на водной или масляной основе и обычно будут содержать, кроме того, один или более чем один эмульгирующий агент, стабилизирующий агент,диспергирующий агент, суспендирующий агент или загущающий агент. Порошки для наружного употребления могут быть сформированы с помощью любой подходящей порошковой основы, например талька,лактозы или крахмала. Капли могут быть приготовлены на водной или неводной основе, содержащей также один или более чем один диспергирующий агент, солюбилизирующий агент или суспендирующий агент. Композиции для распыления могут быть приготовлены, например, в виде водных растворов или суспензий либо в виде аэрозолей, доставляемых из находящихся под давлением упаковок, с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, 1,1,1,2,3,3,3-гептафторпропана, 1,1,1,2-тетрафторэтана, диоксида углерода или другого подходящего газа. Интраназальные спреи могут быть приготовлены с использованием водных или неводных наполнителей с добавлением агентов, таких как загущающие агенты, буферные соли, или кислота либо щелочь, для регулирования рН,агенты, регулирующие изотоничность, или антиоксиданты. Капсулы и картриджи, например, из желатина, или пластыри, например, из ламинированной алюминиевой фольги, для использования в ингаляторах или инсуффляторах могут быть приготовлены содержащими порошковую смесь 18 соединения по изобретению и подходящую порошковую основу, такую как лактоза или крахмал. Растворы для ингаляции путем распыления могут быть приготовлены на основе водного разбавителя с добавлением агентов, таких как кислота или щелочь, буферные соли, агенты,регулирующие изотоничность, или антимикробные средства. Их можно стерилизовать фильтрацией или нагреванием в автоклаве, либо представлять в виде нестерильного продукта. Кроме того, фармацевтические композиции по изобретению могут применяться в комбинации с другими терапевтическими агентами,например с противовоспалительными агентами(такими как кортикостероиды (например, с флутиказона пропионатом, беклометазона дипропионатом, мометазона фуроатом, триамцинолона ацетонидом или будесонидом) либо НСПВЛ(например, с натрия кромогликатом, или с бета-адренергическими агентами (такими как салметерол, салбутамол, формотерол, фенотерол или тербуталин и их соли), или с противоинфекционными агентами (например, с антибиотиками, противовирусными средствами). Таким образом, согласно следующему аспекту изобретения предложена комбинация,содержащая соединение формулы (I) или его физиологически приемлемые соль либо сольват вместе с другим терапевтически активным агентом, например с противовоспалительным агентом, таким как кортикостероид или НСПВЛ. Для удобства упомянутая выше комбинация может быть предложена для применения в форме фармацевтического препарата, и такие фармацевтические препараты, содержащие комбинацию, как она определена выше, вместе с их физиологически приемлемым разбавителем или носителем, представляют собой еще один аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить либо последовательно,либо одновременно в разделенных или комбинированных фармацевтических препаратах. Подходящие дозы известных терапевтических агентов специалисты легко смогут определить. Для удобства соединения по изобретению могут вводиться в количествах, например от 0,01 до 500 мг/кг веса тела, предпочтительно от 0,01 до 100 мг/кг веса тела, от 1 до 4 раз в сутки. Точная доза будет, конечно, зависеть от возраста и состояния пациента и выбранного конкретного способа введения. Соединения по изобретению имеют преимущество в том, что они могут быть более эффективными, показывать большую селективность, иметь меньше побочных эффектов, иметь большую продолжительность действия, быть более биодоступными предпочтительным путем, демонстрировать меньшую системную активность при введении посредством ингаляции 19 или иметь другие более желаемые свойства,нежели известные подобные соединения. В частности, соединения по изобретению имеют преимущество в том, что они могут демонстрировать большую, чем известные до настоящего времени соединения, селективность к аденозин-2 а-рецепторному подтипу по сравнению с другими аденозин-рецепторными подтипами (в особенности, с А 1-и А 3-рецепторными подтипами). Согласно еще одному аспекту изобретения предложены некоторые соединения в качестве новых и полезных промежуточных соединений. Соединения по изобретению были испытаны на биологическую активность in vitro и invivo в соответствии со следующими скринингами:(1) Агонистическая активность в отношении аденозин-2 а-, аденозин-1- и аденозин-3 рецепторных подтипов. Селективность соединений-агонистов в отношении других аденозиновых рецепторов человека определяли, используя клетки яичников китайского хомяка (СНО), подвергнутые трансфекции геном родственного аденозинового рецептора человека, согласно методу на основе метода Castanon и Spevak (1994). Клетки СНО,кроме того, подвергали трансфекции циклоАМФ-чувствительными элементами, стимулирующими ген секреторной плацентарной щелочной фосфатазы (SPAP) (Wood, 1995). Эффект тестируемых соединений определяли по их влиянию на базальные уровни цАМФ (А 2 а) или на уровень цАМФ, усиленный форсколином (А 1 и A3), что отражается в изменениях уровнейSPAP. Значения EC50 для соединений затем определяли как отношение к EC50 для неселективного агониста N-этилкарбоксамидаденозина(2) Антиген-индуцированное накопление легочных эозинофилов у сенсибилизированных морских свинок. Сенсибилизированным овальбумином морским свинкам дозировали мепирамин (1 мг/кг, внутрибрюшинно) с целью защиты против анафилактического бронхоспазма. Затем давали соединение по изобретению ингаляционным способом (30 минутным вдыханием аэрозоля соединения) непосредственно перед введением овальбумина (30 минутным вдыханием аэрозоля, образованного из раствора овальбумина 50 мкг/мл). Через двадцать четыре часа после введения морских свинок умерщвляли и производили промывание легких. Затем получали общее и дифференцированное число лейкоцитов для бронхоальвеолярной промывной жидкости и определяли (Sanjar et al, 1992) дозу тестируемого соединения, вызывающую 50%ное уменьшение накопления эозинофиловAA, Pole SM, (1992), Am. Rev. Respir. Dis. 145,A40. 18. Skubitz KM, Wickman NW, Hammerschmidt DE, (1988), Blood 72, pp 29-33. 19. Van Schaick EA, Jacobson KA, Kim HO,Ijzerman AP, Danhof M, (1996), Eur. J. Pharmacol. 308, pp 311-314. 20. Wood KV, (1995), Curr. Opinion Biotechnology 6, pp 50-58. Данное изобретение иллюстрируется следующими примерами. Примеры Общие детали эксперимента В тех случаях, когда продукты очищают колоночной хроматографией, "флэш-кремнезем" означает силикагель для хроматографии 0,0400,063 мм меш (например, Merck Art 9385), где элюирование колонки ускоряется в результате приложенного давления азота вплоть до 5 фунт./кв.дюйм (34475 Па). В тех случаях, когда используют тонкослойную хроматографию(ТСХ), это означает применение ТСХ на сили 21 кагеле с использованием пластинок силикагеля 60 F254 размером 5 х 10 см (например, Merck Art 5719). В тех случаях, когда продукты очищают препаративной ВЭЖХ, ее осуществляют на С 18 обращенно-фазовой колонке (1" Dynamax),элюируя с использованием градиента ацетонитрила (содержащего 0,1% трифторуксусную кислоту) в воде (содержащей 0,1%-ную трифторуксусную кислоту), и соединения выделяют в виде трифторацетатных солей, если не оговорено особо. Колонка для стандартной автоматизированной препаративной ВЭЖХ, условия и элюент Автоматизированную препаративную высокоэффективную жидкостную хроматографию(автопреп. ВЭЖХ) осуществляют с использованием колонки Supelco ABZ+, 5 мкм, 100 мм х 22 мм внутр. диам., элюируемой смесью растворителей, состоящей из i) 0,1%-ной муравьиной кислоты в воде и ii) 0,05%-ной муравьиной кислоты в ацетонитриле, причем элюент выражен как процент ii) в смеси растворителей, при объемной скорости потока 4 мл в минуту. Если не оговорено особо, элюент используют как градиент 5-95% за период 20 мин. ЖХ/МС СИСТЕМА Используют следующие системы жидкостной хромато-масс-спектрометрии (ЖХ/МС). ЖХ/МС СИСТЕМА А - колонка A SupelcoABZ+, 3.3 см х 4,6 мм внутр. диам., элюируемая растворителями: А - 0.1% об./об. муравьиной кислоты + 0,077% мас./об. ацетата аммония в воде, и Б - смесь ацетонитрил:вода в соотношении 95:5 + 0,05% об./об. муравьиной кислоты. Применяют следующий градиентный режим: 100% А в течение 0,7 мин, смеси А+Б с профилем градиента 0-100% Б за период 3,5 мин; выдержка при 100% Б в течение 3,5 мин; возврат к 0% Б за период 0,3 мин. Используют положительную и отрицательную электрораспылительную ионизацию. ЖХ/МС СИСТЕМА Б - колонка А SupelcoABZ+, 5 см х 2,1 мм внутр. диам., элюируемая растворителями: А - 0,1% об./об. муравьиной кислоты + 0,077% мас./об. ацетата аммония в воде, и Б - смесь ацетонитрил:вода в соотношении 95:5 + 0,05% об./об. муравьиной кислоты. Применяют следующий градиентный режим: 0100% Б за период 3,5 мин; выдержка при 100% Б в течение 1,50 мин; возврат к 0% Б за период 0,50 мин. Используют положительную и отрицательную электрораспылительную ионизацию. Промежуточное соединение 1. (3 аS,4S,6R,6 аR)-6-Метокси-2,2-диметил-тетрагидрофуро[3,4-d][1,3]ди-оксолан-4-карбоновая кислота. В реакционный сосуд помещают D-рибозу(1 вес) и ацетон (8 объемов), 2,2 диметоксипропан (2 объема) и перхлорную кислоту (HClO4; 0,4 объема). Реакционную смесь перемешивают в течение 2-3 ч при температуре 22 окружающей среды. Добавляют метанол (1,4 объема), и реакционную смесь перемешивают в течение 2-3 ч. Реакционную смесь охлаждают до 5-10 С и нейтрализуют с помощью 30%-ного раствора карбоната натрия (2-3 объемa). Полученный осадок отфильтровывают, и солевой остаток на фильтре промывают этилацетатом (1 объем). Фильтрат концентрируют в вакууме до приблизительно 4 остаточных объемов. Добавляют технологическую воду (4 объема) и этилацетат (8 объемов), и после достаточного перемешивания производят разделение слоев. Далее водный слой экстрагируют этилацетатом (2 х 4 объема). Объединенные этилацетатные слои концентрируют в вакууме до приблизительно 4 остаточных объемов. Концентрат заново разводят до 8 объемов этилацетатом. В реакционный сосуд помещают продукт предыдущей стадии (6R-метокси-2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]-диоксолан-4R-ил)-метанол) (1 вес) в этилацетате (типичная концентрация 0,124 г/мл) и 6%-ный бикарбонат натрия (3,5 объема). Добавляют бромид калия (0,05 веса) и 2,2,6,6-тетраметил-1 пиперидинилокси (ТЕМПО, свободный радикал; 0,0037 веса), и раствор охлаждают до температуры от -5 до 0 С. К раствору NaOCl (1013%; 8,9 объемов) добавляют бикарбонат натрия (0,15 веса). Белильный раствор добавляют со скоростью, позволяющей поддерживать температуру 10 С. По окончании добавления охлаждение убирают, и реакционную смесь перемешивают в течение приблизительно 1 - 2 ч при температуре окружающей среды. Затем к реакционной смеси добавляют 10% раствор сульфита натрия (2 объема), и производят разделение слоев. рН водной фазы доводят до значения 2 с использованием 4 М HCl с последующей экстракцией этилацетатом (2 х 5 объемов). Объединенные органические экстракты концентрируют в вакууме до 2-3 объемов, заново разводят 8 объемами циклогексана и повторно концентрируют до 2-3 объемов. Кристаллы выращивают в течение, по меньшей мере, получаса при 17-22 С, отфильтровывают и осадок на фильтре промывают циклогексаном(2 объема). Продукт сушат в вакууме в течение,по меньшей мере, 18 ч при 45-50 С. Точка плавления: 126-129 С. Промежуточное соединение 1 (альтернативный способ). В трехгорлую круглодонную колбу емкостью 1 л, снабженную капельной воронкой,термопарой и патрубком для ввода азота, помещают D-рибозу (50 г) и ацетон (400 мл). Смесь охлаждают до -5 С и после этого добавляют 2,2 диметоксипропан (100 мл) с последующим добавлением перхлорной кислоты (20 мл). Реакционную смесь оставляют для нагревания до комнатной температуры, а затем перемешивают в течение короткого периода времени. Добавляют метанол (70 мл), и реакционную смесь перемешивают в течение ночи. Реакционный 23 раствор охлаждают до приблизительно 5 С, и по каплям добавляют приблизительно 95 мл 30% раствора карбоната натрия. Смесь оставляют для нагревания, затем фильтруют. Полученный остаток на фильтре промывают этилацетатом(50 мл). Фильтрат концентрируют в вакууме приблизительно при 200 мбар (20 кПа) до остаточного объема 250 мл, разбавляют этилацетатом(200 мл) и заново концентрируют до остаточного объема 170 мл. Добавляют этилацетат (200 мл) и воду (200 мл), фазы перемешивают и разделяют. Водную фазу дважды экстрагируют этилацетатом (200 мл), и производят разделение слоев. Объединенные органические экстракты концентрируют до остаточного объема 200 мл и заново растворяют в этилацетате (200 мл), получая этилацетатный раствор 6R-метокси-2,2 диметил-тетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3] диоксол-4R-ил)-метанола. В трехгорлую круглодонную колбу емкостью 2 л, помещают этилацетатный раствор 6Rметокси-2,2-диметил-тетрагидро(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-метанола, 6% бикарбонат натрия (158 мл), бромид калия (2,3 г) и ТЕМПО (0,167 г). Реакционную смесь охлаждают до -7 С. Тем временем бикарбонат натрия(400,5 мл). Белильный раствор по каплям добавляют за период приблизительно 40 минут, поддерживая температуру ниже 15 С. Реакционную смесь перемешивают в течение приблизительно 2 ч и добавляют 10% водный раствор сульфита натрия (47 мл). Реакционную смесь перемешивают в течение 15 мин, фазы разделяют, рН водной фазы доводят до значения 2 с помощью 4 М HCl и дважды экстрагируют этилацетатом(225 мл). Этилацетатные экстракты концентрируют в вакууме, получая остаток белого цвета, который растирают с циклогексаном (90 мл). Твердые вещества отфильтровывают и сушат в вакууме при 45 С, получая указанный в заголовке продукт (33,6 г) (с 46% выходом по отношению к D-рибозе) в виде твердого вещества белого цвета: т.пл. 126-129 С. Промежуточное соединение 2. (3 аS,4S,6R,6 аR)-6-Метокси-2,2-диметил-тетрагидро-фуро[3,4-d][1,3]диоксолан-4-карбоновой кислоты амид. В реакционный сосуд помещают промежуточное соединение 1 (1 вес) и этилацетат (8 объемов). Добавляют тионилхлорид (0,47 объема; 1,4 экв.), и реакционную смесь нагревают до 5055 С в течение 2-3 ч. Реакционную смесь охлаждают до 50 С. Безводный аммиак (0,8-1,2 веса; 10-15 экв.) медленно барботируют через реакционную смесь с такой скоростью, чтобы температура оставалась 60 С. Реакционную смесь охлаждают до 15-20 С, добавляют: технологическую воду (6 объемов), и после достаточного перемешивания производят разделение слоев. 24 Водный слой промывают этилацетатом (2 х 4 объема). Объединенные органические экстракты концентрируют в вакууме при 25-45 С до остаточных 3 объемов, разбавляют 8 объемами циклогексана и заново концентрируют до 3 объемов. Продукт перемешивают при 18-22 С в течение получаса, фильтруют, и остаток на фильтре промывают циклогексаном (2 объема). Продукт сушат в вакууме при 45-50 С, по меньшей мере, в течение 18 ч. Точка плавления: 134-136 С. ТСХ (95/5 хлороформ/метанол/приблизительно 5 капель ТФУ на 50 мл/опрыскивание фосфомолибденовой кислотой) Rf = 0,49. Промежуточное соединение 2 (альтернативный процесс). В трехгорлую круглодонную колбу емкостью 500 мл помещают промежуточное соединение 1 (20 г) и этилацетат (160 мл) с последующим добавлением тионилхлорида (9,4 мл). Реакционный раствор нагревают при 50 С в течение 2 ч. Газообразный аммиак (16 г) добавляют с такой скоростью, чтобы температура оставалась между 40 и 60 С. Добавляют воду(120 мл). Слои разделяют и водный слой дважды промывают этилацетатом (80 мл). Объединенные органические промывные воды концентрируют в вакууме досуха. Остаток растирают с циклогексаном (40 мл) и твердые вещества отфильтровывают. Остаток на фильтре промывают циклогексаном (40 мл) и твердые вещества сушат в вакууме при 45 С, получая указанный в заголовке продукт (16,7 г) (с 83,9% выходом) в виде твердого вещества светло-рыжеватокоричневой окраски: т.пл. 134-136 С. ТСХ (95/5 хлороформ/ метанол/ приблизительно 5 капель ТФУ на 50 мл/ опрыскивание фосфомолибденовой кислотой) Rf = 0,49. Промежуточное соединение 3.(3 аS,4S,6R,6 аR)-6-Метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксолан-4-карбонитрил. Реакционный сосуд продувают азотом и заполняют промежуточным соединением 2 (1 вес; 1 экв.), этилацетатом (12 объемами), ДМФ(1,97 объема; 5,5 экв.) и триэтиламином (3,3 объема; 5,2 экв.). Реакционную смесь охлаждают до приблизительно 5 С. Оксихлорид фосфора (2,14 объема; 5 экв.) добавляют с такой скоростью, чтобы температура бани оставалась 40-45 С. Реакционную смесь перемешивают в течение 1 ч. Реакционную смесь охлаждают до приблизительно 5 С. Органический слой "гасят" с помощью 20%-ного гидрокарбоната калия (10 объемами) и слои разделяют. Водный слой промывают этилацетатом (5 объемами), слои разделяют. Объединенные органические экстракты промывают 20% гидрокарбонатом калия (2 х 5 объемов). Органический слой концентрируют,получая указанное в заголовке соединение в виде масла. 25 ТСХ (1:1, этилацетат/циклогексан; проявление фосфомолибденовой кислотой) Rf = 0,73. Промежуточное соединение 3 (альтернативный процесс). В трехгорлую круглодонную колбу емкостью 22 л помещают промежуточное соединение 2 (643 г), этилацетат (7,72 л), N,Nдиметилформамид (1,26 л) и триэтиламин (2,15 л). Реакционный раствор охлаждают до приблизительно 0 С, а затем добавляют оксихлорид фосфора (1,38 л) с такой скоростью, чтобы температура поддерживалась ниже 25 С. Реакционную смесь перемешивают в течение полутора часов. Добавляют по каплям водный гидрокарбонат калия (20%-ный; 6,5 л), поддерживая температуру около или ниже 20 С. Слои разделяют,и водный слой повторно экстрагируют этилацетатом (3,5 л). Объединенные органические слои дважды промывают 20% гидрокарбонатом калия (3,5 л) и концентрируют до остаточного объема приблизительно 1 л. К разбавленному маслу добавляют активированный уголь (15 граммов), и смесь фильтруют через целит (80 г). Остаток на фильтре промывают этилацетатом(с 88% выходом) в виде масла красноватооранжевой окраски. ТСХ (1:1, этилацетат/циклогексан; проявление реагентом на основе фосфомолибденовой кислотой) Rf = 0,73. Промежуточное соединение 4. 5-(6R-Метокси-2,2-диметил-тетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксолан-4R-ил)-1 Н-тетразол. Реакционный сосуд заполняют промежуточным соединением 3 (1 вес), толуолом (10 объемов), ТМС азидом (2,5 экв.; 1,67 объема) и оксидом дибутилолова (0,1 экв.; 0,12 веса). Реакционную смесь нагревают до 60 С и перемешивают в течение 10 ч. Реакционную смесь перегоняют (до остаточных 2-3 объемов), удаляя как толуол, так и избыток ТМС азида. Добавляют толуол (3,5 объема) и раствор повторно концентрируют до 2-3 объемов. Добавляют воду(1,1 экв.; 0,05 объема) и толуол (2 объема) и раствор перемешивают в течение 1-2 ч. Раствор концентрируют до 2-3 объемов, добавляют толуол (3 объема), раствор оставляют для нагревания до приблизительно 75 С с последующим медленным охлаждением до температуры окружающей среды и вносят затравку соответствующего соединения. Смесь охлаждают до 05 С и перемешивают в течение 2 ч. Продукт отфильтровывают, промывают толуолом (приблизительно 1,5 объема) и сушат в вакууме, получая указанное в заголовке соединение в виде кристаллического твердого вещества от белой до беловатой окраски. Точка плавления: 122127 С. Промежуточное соединение 4 (альтернативный процесс). 26 В реакционный сосуд помещают промежуточное соединение 3 (26 г), N,N-диметилформамид (650 мл) и хлорид аммония (14,5 г). Реакционную смесь охлаждают до 5 С и порциями в течение 5 мин добавляют азид натрия (17,2 г). Реакционную смесь нагревают при 40 С в течение 1 ч, а затем температуру медленно поднимают в течение двух с половиной часов до 90 С. Реакционную смесь перемешивают в течение ночи при 90 С, затем охлаждают до 5 С. Добавляют воду (600 мл) с последующим добавлением 6%-ного раствора нитрита натрия (216 мл) и далее смесь перемешивают при 0 С в течение 1 ч. рН доводят до значения 1-3 2 М серной кислотой. Реакционную смесь трижды экстрагируют этилацетатом (1 л) и объединенные органические слои промывают насыщенным водным хлоридом натрия (1 л). Органический слой сушат над сульфатом магния, фильтруют и концентрируют, получая указанный в заголовке продукт (31,85 г) (с 100% выходом) в виде масла желтого цвета. Промежуточное соединение 4 (альтернативный процесс). В трехгорлую круглодонную колбу емкостью 3 л помещают промежуточное соединение 3 (200 г), толуол (2 л), азидотриметилсилан (332 мл) и оксид дибутилолова (24,9 г). Реакционную смесь нагревают до 60 С в течение 15 ч. Реакционную смесь концентрируют 1 в вакууме до остаточного объема приблизительно 300 мл. Добавляют толуол (1 л) и раствор повторно концентрируют до остаточного объема приблизительно 470 мл. Добавляют толуол (400 мл) и воду (19,8 мл) и смесь перемешивают при комнатной температуре в течение приблизительно 2 ч. Смесь концентрируют, получая приблизительно 250 мл остатка. Остаток растворяют в толуоле (800 мл) с нагреванием, далее оставляют охлаждаться до комнатной температуры и перемешивают в течение более 3 дней. Твердые вещества отфильтровывают и дважды промывают толуолом (250 мл). Продукт сушат в вакууме, получая указанный в заголовке продукт(135 г) (с 55% выходом) в виде твердого вещества белого цвета: т.пл. 130 С. Промежуточное соединение 5. 2-Этил-5(6R-метокси-2,2-диметил-тетрагидро-(3 аR,6 аR)фуро[3,4-d][1,3]диоксол-4R-ил)-2 Н-тетразол. Этилиодид (1,3 экв.) при температуре окружающей среды добавляют к суспензии промежуточного соединения 4 (1,0 экв.) и карбоната калия (1,3 экв.) в ацетоне (7 объемах). Полученную смесь нагревают до 40-45 С и перемешивают от 3 до 4 ч. Реакционную смесь охлаждают до температуры окружающей среды и разбавляют циклогексаном (7 объемов), затем фильтруют для удаления неорганических веществ. Фильтрат концентрируют до приблизительно 4 объемов, затем разбавляют циклогексаном (7 объемов) и кристаллизуют при 0-5 С в течение 18-48 ч. Закристаллизовавшийся мате 27 риал удаляют фильтрованием, и фильтрат концентрируют до масла. Для достижения отношения N2:N1 этилированных тетразолей до приблизительно 94/6 может потребоваться дальнейшая перекристаллизация масла из циклогексана. ТСХ SiO2, (20% этилацетата в циклогексане) Rf = 0,21. Промежуточное соединение 5 (альтернативный процесс). В трехгорлую круглодонную колбу емкостью 1 л помещают промежуточное соединение 4 (31,8 г), карбонат калия (12,7 г) и ацетон (238 мл). С помощью шприца добавляют этилиодид(14,1 мл) и реакционную смесь нагревают при 42 С в течение 2,5-3 ч. Реакционную смесь оставляют для охлаждения до комнатной температуры, затем добавляют циклогексан (238 мл). Полученный осадок отфильтровывают и трижды промывают циклогексаном (65 мл). Фильтрат концентрируют до остаточного объема 195 мл, затем еще раз разбавляют циклогексаном(238 мл). Циклогексановый раствор охлаждают при 0-5 С в течение 3 дней, полученное твердое кристаллическое вещество (продукт N1 алкилирования) отфильтровывают и трижды промывают циклогексаном (65 мл). Объединенные фильтраты концентрируют в вакууме, получая указанный в заголовке продукт промежуточной степени очистки в виде масла. Масло растворяют в циклогексане (200 мл) при 60 С,раствор оставляют для охлаждения до комнатной температуры и фильтруют. Полученное кристаллическое твердое вещество отфильтровывают и трижды промывают циклогексаном(65 мл). Объединенный фильтрат концентрируют, получая указанный в заголовке продукт в виде масла желтого цвета. ТСХ (1:1, этилацетат/гексан; визуализация с помощью реагента на основе фосфомолибденовой кислоты) Rf = 0,68. Промежуточное соединение 6. rel-Уксусной кислоты 4R,5-диацетокси-2R-(2-этил-2 Нтетразол-5-ил)тетрагидрофуран-3R-иловый эфир. Раствор промежуточного соединения 5(3,90 г; 14,4 ммоль) в воде (1 мл) и трифторуксусной кислоте (9,5 мл) перемешивают при 21 С в течение 6 ч перед концентрированном в вакууме. Остаток несколько раз азеотропно отгоняют с толуолом для удаления любой остаточной влаги. Полученную бесцветную жидкость растворяют в пиридине (35 мл) и добавляют уксусный ангидрид (24 мл; 288 ммоль). Реакционную смесь перемешивают при 21 С в течение 20 ч перед концентрированием в вакууме. Этот материал очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 50% этилацетата в циклогексане, что позволяет получить указанное в заголовке соединение как неразделяемую смесь - и -аномеров в виде прозрачной смолы (2,86 г). 28 ТСХ SiO2, (50% этилацетата в циклогексане) Rf = 0,36. Промежуточное соединение 6 (альтернативный процесс). В круглодонную колбу помещают промежуточное соединение 5 (5,0 г). В колбу добавляют раствор ацетилхлорида (0,73 г) в метаноле(50 мл) и реакционный раствор нагревают до температуры дефлегмации при давлении 300 мбар (30 кПа). Реакционную смесь перегоняют в течение 8-9 ч, добавляя порциями в течение этого периода времени метанол (135 мл) для пополнения объема реакционной смеси. Реакционную смесь оставляют для охлаждения до комнатной температуры и добавляют пиридин(15 мл). Смесь концентрируют в вакууме и повторно разбавляют пиридином. К пиридиновому раствору добавляют этилацетат (25 мл) и уксусный ангидрид (6,6 г) и полученную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь охлаждают до 510 С и по каплям в течение 20 мин добавляют 2 М серную кислоту (приблизительно 45 мл),поддерживая температуру ниже 10 С. Производят разделение слоев и органический слой промывают приблизительно 0,7 М серной кислотой(приблизительно 25 мл). Органический слой промывают насыщенным бикарбонатом натрия и солевым раствором и затем концентрируют в вакууме, получая масло бледно-желтой окраски,которое растворяют в 50 мл этилацетата. Добавляют уксусный ангидрид (3,04 г) и концентрированную серную кислоту (0,65 г) и реакционную смесь нагревают до 50 С в течение приблизительно 3,5 ч. Реакцию останавливают насыщенным раствором бикарбоната натрия (25 мл). Органический слой концентрируют в вакууме,получая указанный в заголовке продукт (5,1 г)(с 82% выходом) в виде масла желтого цвета. ТСХ (1:1, этилацетат/гексан; визуализация с помощью реагента на основе фосфомолибденовой кислоты) Rf = 0,44. Промежуточное соединение 7. Уксусной кислоты 4R-ацетокси-2R-(2,6 дихлорпурин-9-ил)-5R-(2-этил-2 Н-тетразол-5 ил)-тетрагидрофуран-3R-иловый эфир. К смеси промежуточного соединения 6(2,69 г; 7,86 ммоль) и 2,6-дихлорпурина (1,92 г; 10,2 ммоль) в безводном ацетонитриле (34 мл) в атмосфере азота добавляют 1,8-диазобицикло[5.4.0]ундец-7-ен (1,76 мл; 11,8 ммоль) с последующим добавлением по каплям триметилсилилтрифлата (2,58 мл; 13,4 ммоль). Смесь перемешивают при 20 С в течение 20 ч, а затем кипятят с обратным холодильником в течение 2 ч. Реакцию в охлажденной реакционной смеси останавливают с помощью Н 2 О (200 мл), смесь экстрагируют этилацетатом (3 х 200 мл), сушат(MgSO4). Удаление растворителя дает смолу светло-коричневой окраски, которую очищают колоночной хроматографией на флэшкремнеземе, элюируя смесью 30-50% этилацета 29 та-циклогексан и получая указанное в заголовке соединение в виде пены белого цвета (3,26 г). Масс-спектр m/z 471 (МН+ для C16H1635Cl2N8O5). Промежуточное соединение 8. Уксусной кислоты 4R-ацетокси-2R-(2 хлор-6-(2,2-дифенилэтиламино)-пурин-9-ил)5R-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран 3R-иловый эфир. 2,2-Дифенилэтиламин (0,544 г; 2,76 ммоль) добавляют к перемешиваемой смеси промежуточного соединения 7 (1,00 г; 2,12 ммоль) и диизопропилэтиламина (0,551 мл; 3,18 ммоль) в изопропаноле (33 мл) и нагревают при 50 С в течение 20 ч. Реакционную смесь выпаривают в вакууме до пены, которую очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 30% этилацетата-циклогексан и получая указанное в заголовке соединение в виде пены белого цвета (1,39 г). Масс-спектрC30H30 СlN9O5). Промежуточное соединение 9. (2R,3R,4S,5R)-2-[2-Хлор-6-(2,2-дифенил-этиламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диол. Промежуточное соединение 8 (0,660 г) растворяют в безводном метаноле (4 мл), обрабатывают метилатом натрия (25 маc.% в метаноле; 0,043 мл) и смесь оставляют перемешиваться при 21 С в течение 16 ч. Ионообменную смолу (Amberlite H+ форма, IR-120; 0,600 г) промывают метанолом и добавляют к смеси. Смесь перемешивают при 21 С в течение 5 мин. Смолу отфильтровывают и промывают метанолом. Фильтрат выпаривают в вакууме, получая указанное в заголовке соединение в виде твердого вещества белого цвета (0,496 г). ЖХ-МС m/z 548 (МH+ для С 26 Н 30N10 О 3). Промежуточное соединение 10. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(пирролидин-3R-иламино)-пурин-9-ил]-5-(2-этил-2 Нтетразол-5-ил)-тетрагидрофуран-3,4-диол. Смесь промежуточного соединения 9(0,981 г), пирролидиy-3R-иламина (1,54 г) в диметилсульфоксиде (5 мл) нагревают при 100 С в течение 18 ч. Охлажденную смесь распределяют между этилацетатом (250 мл) и водой (250 мл). Водный слой экстрагируют этилацетатом (2 х 250 мл). Объединенные органические экстракты промывают водой (250 мл), сушат (MgSO4) и выпаривают в вакууме, получая масло оранжевого цвета. Этот материал очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью дихлорметан-этанол-880 аммиак(100:8:1), что позволяет получить указанное в заголовке соединение в виде бесцветного масла 30 2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. Смесь промежуточного соединения 7 (2,20 г; 4,67 ммоль), диизопропилэтиламина (1,2 мл; 7,01 ммоль) и 2-фенилэтиламина (0,586 мл; 6,07 ммоль) в пропан-2-оле (70 мл) кипятят с обратным холодильником в атмосфере азота в течение 20 ч. Растворитель удаляют в вакууме и остаток очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью этилацетатциклогексан 1:1), (3:1), (4:1 и получая указанное в заголовке соединение в виде пены белого цвета (2,26 г). ТСХ SiO2 (этилацетат:циклогексан (1:1 Rf= 0,32. МС m/z 556 (МН+ для C24H2035ClN9O5). Промежуточное соединение 12. (2R,3R,4S,5R)-2-(6-Амино-2-хлор-пурин-9-ил)-5-(2 этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4 диол. Раствор промежуточного соединения 7(4,25 г; 9,02 ммоль) в безводном тетрагидрофуране (100 мл) охлаждают до 4 С, через него при перемешивании в течение 45 мин барботируют аммиак. Гетерогенную смесь оставляют для нагревания до 20 С и перемешивают в течение 24 ч. Смесь вторично охлаждают до 4 С и аммиак еще раз барботируют в течение 45 мин, реакционную смесь снова перемешивают в течение 24 ч при 20 С. Далее растворитель удаляют в вакууме и остаток обрабатывают безводным метанолом (250 мл) с последующей обработкой метилатом натрия (0,9 мл 0,5 М раствора в метаноле). После перемешивания в течение 1 ч в атмосфере азота еще раз добавляют метилат натрия(0,9 мл 25% мас./мас. раствора в метаноле) и перемешивание продолжают в течение дальнейших 3 ч. Растворитель удаляют в вакууме, и остаток дважды очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью метанол:дихлорметан 1:19),(7:93 и получая указанное в заголовке соединение в виде твердого вещества беловатой окраски (3,2 г). МС m/z 368 (MH+ для С 12 Н 1435 СlN9 О 3). Промежуточное соединение 13. 5-(6RМетокси-2,2-диметилтетрагидро-(3 аR,6 аR)фуро[3,4-d][1,3]диоксол-4R-ил)-2-метил-2 Н-тетразол. Раствор промежуточного соединения 4(10,08 г; 32,0 ммоль) в безводном N,Nдиметилформамиде (64 мл) обрабатывают карбонатом калия (5,30 г; 38,4 ммоль), перемешивая в атмосфере азота. Добавляют метилиодид и полученный раствор перемешивают при 21 С в течение 5 ч. Реакционную смесь концентрируют в вакууме, разбавляют водой (250 мл), экстрагируют этилацетатом (2 х 200 мл; 2 х 100 мл), сушат (MgSO4) и концентрируют в вакууме, получая смесь N2:N1-изомеров в виде масла коричневой окраски. Смесь очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 20-25% этилацетата в циклогексане, 31 получая указанное в заголовке соединение в виде бесцветного масла (3,86 г). ТСХ SiO2 (25% этилацетата в циклогексане) Rf = 0,17. Промежуточное соединение 14. Уксусной кислоты 4R,5S-диацетокси-2R-(2-метил-2 Нтетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. Раствор промежуточного соединения 13(3,86 г; 15,1 ммоль) в воде (0,7 мл) и трифторуксусной кислоте (13 мл) перемешивают при 21 С в течение 6 ч перед концентрированием в вакууме. Остаток азеотропно отгоняют с толуолом(х 3), полученный остаток растворяют в дихлорметане (46 мл) и охлаждают до 0 С. К этому раствору в атмосфере азота добавляют 4 диметиламинопиридин (0,55 г; 4,5 ммоль), триэтиламин (94,6 мл; 679,0 ммоль) с последующим добавлением уксусного ангидрида (28,5 мл; 302,0 ммоль). Реакционную смесь оставляют для нагревания до 21 С и перемешивают в течение 4 дней перед концентрированием в вакууме и азеотропной перегонкой с толуолом (х 3). Полученную смесь очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 30-60% этилацетата в циклогексане, получая указанное в заголовке соединение в виде прозрачной смолы (1,38 г). ТСХ SiO2 (70% этилацетата в циклогексане) Rf = 0,71. Промежуточное соединение 15. Уксусной кислоты 4R-ацетокси-5-метокси-2R-(2-метил 2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 16. Уксусной кислоты 4R,5R-диацетокси-2R-(2-метил-2 Нтетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. Не очищенные от примесей промежуточное соединение 15 (ТСХ SiO2 (70% этилацетата в циклогексане) Rf = 0,66) и промежуточное соединение 16 (ТСХ SiO2 (70% этилацетата в циклогексане) Rf = 0,56) получают как неразделяемую смесь в виде прозрачной смолы (1,59 г) в результате последней стадии хроматографии,описанной для промежуточного соединения 14. Промежуточное соединение 17. Уксусной кислоты 4R-ацетокси-2R-(2,6-дихлор-пурин-9 ил)-5R-(2-метил-2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. К объединенной смеси промежуточного соединения 14, промежуточного соединения 15,промежуточного соединения 16 (2,97 г; 9,04 ммоль) и 2,6-дихлорпурина (2,22 г; 11,8 ммоль) в безводном ацетонитриле (20 мл) в атмосфере азота добавляют 1,8-диазобицикло[5,4,0]ундец 7-ен (2,11 г; 13,6 ммоль) с последующим добавлением по каплям триметилсилилтрифлата (2,97 мл; 15,4 ммоль). Смесь перемешивают при 20 С в течение 5 дней, а затем кипятят с обратным холодильником в течение 4 ч. В охлажденной реакционной смеси реакцию останавливают 32 насыщенным водным NаНСО 3 (20 мл), смесь экстрагируют этилацетатом (4 х 100 мл), сушат(МgSO4). Удаление растворителя в вакууме дает смолу светло-коричневой окраски, которую очищают колоночной хроматографией на флэшкремнеземе, элюируя смесью 40-50% этилацетата-циклогексан и получая указанное в заголовке соединение в виде пены желтого цвета (2,94 г). ТСХ SiO2 (50% этилацетата в циклогексане) Rf = 0,21. Промежуточное соединение 18. 2-Изопропил-5-(6-метокси-2,2-диметил-тетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-2 Н-тетразол. Раствор промежуточного соединения 4 (8 г; 33,0 ммоль) в безводном N,N-диметилформамиде (12 мл) обрабатывают карбонатом калия(5,48 г; 39,7 ммоль), перемешивая в атмосфере азота. Добавляют 2-иодпропан (4,96 мл; 49,6 ммоль) и полученный раствор перемешивают при 21 С в течение 48 ч. Реакционную смесь фильтруют и затем концентрируют в вакууме. Коричневый остаток очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 16% этилацетата в циклогексане и получая указанное в заголовке соединение в виде бесцветного масла (6,4 г). ТСХ SiO2 (25% этилацетата в циклогексане) Rf = 0,38. Промежуточное соединение 19. Уксусной кислоты 4R,5S-диацетокси-2R-(2-изопропил 2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. Раствор промежуточного соединения 18(6,00 г; 21,0 ммоль) в воде (1,4 мл) и трифторуксусной кислоте (20,5 мл) перемешивают при 21 С в течение 6 ч перед концентрированием в вакууме. Остаток азеотропно перегоняют с толуолом (х 3). Полученный остаток растворяют в пиридине (50 мл), добавляют при 0 С уксусный ангидрид (35 мл) и смесь оставляют перемешиваться при 20 С в течение 12 ч. Реакционную смесь концентрируют в вакууме, получая масло коричневатой окраски. Этот материал очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 25% этилацетата в циклогексане и получая указанное в заголовке соединение в виде прозрачной смолы (1,25 г). ТСХ SiO2 (25% этилацетата в циклогексане) Rf = 0,19. Промежуточное соединение 20. Уксусной кислоты 4R-ацетокси-2R-(2,6-дихлор-пурин-9 ил)-5R-(2-изопропил-2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. К смеси промежуточного соединения 19(1,20 г; 3,4 ммоль) и 2,6-дихлорпурина (0,83 г; 4,4 ммоль) в безводном ацетонитриле (15 мл) в атмосфере азота добавляют 1,8-диазобицикло[5.4.0]ундец-7-ен (0,76 мл; 5,1 ммоль) с последующим добавлением по каплям триметилсилилтрифлата (1,10 мл; 5,78 ммоль). Смесь перемешивают при 20 С в течение 16 ч, а затем кипятят с обратным холодильником в течение 3 ч. 33 Охлажденную реакционную смесь выпаривают досуха, получая смолу светло-коричневой окраски, которую очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 50% этилацетата-циклогексан и получая указанное в заголовке соединение в виде пены желтого цвета (1,58 г). ТСХ SiO2 (50% этилацетата в циклогексане) Rf = 0,40. Промежуточное соединение 21. 2-[N,NБис(триметилсилил)амино]-6-метилпиридин. К раствору 2-амино-6-пиколина (17,30 г; 160 ммоль) в безводном тетрагидрофуране (130 мл) в атмосфере азота по каплям при перемешивании в течение 1 ч при температуре от -20 до-30 С добавляют н-бутиллитий (1,6 М в гексане,250 мл; 400 ммоль). Смесь перемешивают при температуре от -8 до -10 С в течение 30 мин,затем к ней при температуре от -25 до -5 С в течение 40 мин добавляют хлортриметилсилан(50,7 мл; 400 ммоль). Полученную смесь перед фильтрованием через набивку из Keiselgel 60(Merck 9385; 50 г) оставляют для нагревания до 20 С, перемешивают в течение 16 ч и промывают тетрагидрофураном. Объединенный фильтрат концентрируют в вакууме, и остаточное масло перегоняют в вакууме. Указанное в заголовке соединение получают в виде масла бледно-желтоватой окраски с температурным интервалом кипения 106-114 С при 10 мбар (1 кПа). ТСХ SiO2 (25% циклогексана в этилацетате) Rf = 0,70. Промежуточное соединение 22. Этил(6 аминопиридин-2-ил)ацетат. Раствор н-бутиллития (1,6 М в гексане; 50 мл; 79,2 ммоль) в атмосфере азота при температуре от -30 до -40 С в течение 30 мин добавляют по каплям к раствору промежуточного соединения 21 (10,0 г; 39,6 ммоль) в безводном тетрагидрофуране (30 мл), после чего реакционную смесь перемешивают в течение 30 мин при 20 С. Полученную смесь при перемешивании добавляют порциями к твердому диоксиду углерода (в гранулах, 100 г). Перемешивание продолжают до достижения температуры 20 С, после чего растворитель удаляют в вакууме. К остатку добавляют этанол (100 мл) с последующим медленным добавлением при температуре от -5 до -10 С безводной соляной кислоты (30%ной) в этаноле (66 мл). Газообразный хлористый водород затем барботируют через реакционную смесь в течение 30 мин при 0-5 С и полученный раствор перемешивают при 15 С в течение 16 ч. Растворитель удаляют при пониженном давлении, остаток растворяют в воде (200 мл) и промывают этилацетатом (3 х 200 мл). рН водной фазы доводят до значения 7, добавляя NаНСО 3,и экстрагируют этилацетатом (6 х 100 мл). Объединенные экстракты промывают солевым раствором (200 мл), сушат над MgSO4 и растворитель удаляют в вакууме. Содержащий примеси остаток очищают колоночной хроматографией 34 на флэш-кремнеземе, элюируя смесью 20% циклогексана в этилацетате, получая указанное в заголовке соединение в виде твердого вещества бледно-желтой окраски (2,10 г). ТСХ SiO2 (25% циклогексана в этилацетате) Rf = 0,36. Промежуточное соединение 23. (6-Аминопиридин-2-ил)ацетамид. Промежуточное соединение 22 (0,800 г; 4,43 ммоль) растворяют в метаноле (5 мл), насыщенном аммиаком, и перемешивают при 20 С в течение 5 дней. Реакционную смесь нагревают при 40 С в течение 2 дней и растворитель удаляют в вакууме, получая твердое вещество коричневой окраски. Остаток растворяют в метаноле (5 мл) и добавляют жидкий аммиак (20 мл). Реакционную смесь помещают в аппарат высокого давления, постепенно нагревая в течение 4 ч до 20 С. Перед концентрированием в вакууме раствор оставляют испаряться на открытом воздухе. Остаток очищают колоночной хроматографией на флэш-кремнеземе, элюируя смесью 5% метанола в дихлорметане, получая указанное в заголовке соединение в виде твердого вещества бледно-кремовой окраски (0,371 г). Масс-спектр m/z 151,9 (MH+ для С 7 Н 10N3 О). Промежуточное соединение 24. 2-(2-Аминоэтил)-6-аминопиридин. Промежуточное соединение 23 (0,350 г; 2,32 ммоль) добавляют порциями к раствору алюмогидрида лития в тетрагидрофуране (5,8 мл; 5,79 ммоль) в атмосфере азота при 20 С и перемешивают при 20 С в течение 24 ч. Водный раствор гидроксида натрия (1 М) добавляют до прекращения газовыделения, осадок отфильтровывают,промывают тетрагидрофураном. Фильтрат сушат над МgSO4 и концентрируют в вакууме, получая указанное в заголовке соединение в виде масла желтого цвета (0,272 г). ТСХ SiO2 (25% метанола в дихлорметане)Rf = 0,08. Промежуточное соединение 25. Уксусной кислоты 4R-ацетокси-2R-(6-амино-2-фторпурин-9-ил)-5R-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3R-иловый эфир. В круглодонную колбу, оснащенную капельной воронкой, помещают 2-фтораденин (12 г) и безводный ацетонитрил (240 мл). Бистриметилсилилацетамид (57,9 мл) добавляют по каплям в течение трех минут и полученную суспензию нагревают в течение 1 ч и 45 мин. Раствор охлаждают до комнатной температуры и с помощью шприца добавляют промежуточное соединение 6 (приблизительно 27 г) в ацетонитриле (70 мл) с последующим добавлением 17 мл ТМС трифлата (17 мл). Реакционную смесь кипятят с обратным холодильником в течение 6 ч,затем оставляют для охлаждения до комнатной температуры. Реакционную смесь концентрируют в вакууме, полученное масло растворяют в 35 метиленхлориде (200 мл) и выливают в ледяную воду (приблизительно 150 мл). Слои разделяют,и водный слой дважды экстрагируют метиленхлоридом (150 мл). Объединенные органические экстракты промывают водой (200 мл) и солевым раствором (250 мл), сушат над сульфатом натрия (33 г) и концентрируют в вакууме,получая указанный в заголовке продукт промежуточной степени очистки в виде твердого вещества желтого цвета. К этому твердому веществу добавляют этанол (100 мл) и суспензию нагревают до 50 С. Смесь охлаждают в ледяной/водной бане в течение одного часа и затем фильтруют. Полученный продукт сушат в вакууме при 50 С в течение 3 дней, получая указанный в заголовке продукт (23,4 г) (с 67% выходом) в виде порошка беловатой окраски: т.пл. 208-210 С. ТСХ (90:10 метиленхлорид/метанол) Rf = 0,53. Промежуточное соединение 26. (2R,3R,4S,5R)-2-(6-Амино-2-фтор-пурин-9-ил)-5-(2-этил 2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол. В круглодонную колбу помещают промежуточное соединение 25 (3,0 г) в изопропиловом спирте (23 мл), воду (4,9 мл) и карбонат калия (1,91 г). Суспензию белого цвета перемешивают при комнатной температуре в течение 3,5 дня и затем разбавляют этилацетатом (50 мл). Реакционную смесь выливают в воду (40 мл) и водную фазу четыре раза экстрагируют этилацетатом (30 мл). Объединенные органические экстракты промывают солевым раствором(40 мл) и концентрируют в вакууме, получая указанный в заголовке продукт (2,42 г) (с 100% выходом) в виде твердого вещества белого цвета. ТСХ (90:10 метиленхлорид/метанол, затем 1:1 гексан/этилацетат) Rf = 0,50. Промежуточное соединение 27. 2-(Пиридин-2-иламино)этиламин. 2-Бромпиридин (10,00 г; 63,3 ммоль) при перемешивании в атмосфере азота добавляют по каплям при 20 С к 1,2-диаминоэтану (76,00 г; 126,6 ммоль). Реакционную смесь перемешивают при 20 С в течение 4 ч, а затем кипятят с обратным холодильником при перемешивании в течение 24 ч. Реакционную смесь концентрируют в вакууме и очищают колоночной хроматографией на флэш-кремнеземе, элюируя дихлорметаном, этанолом и аммиаком (30:8:1), получая указанное в заголовке соединение в виде масла красного цвета (1,23 г). ТСХ SiO2 (дихлорметан, этанол, аммиак; 30:8:1) Rf = 0,14. Масс-спектр m/z 138 (MH+ для С 7 Н 11N3). Промежуточное соединение 28. 4R-Ацетокси-2R-[2-хлор-6-(3,3-диметил-бутиламино)пурин-9-ил]-5R-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 7 (0,188 г; 0,40 ммоль), 3,3-диметилбутиламин (0,040 г; 0,40 36 ммоль) и диизопропилэтиламин (0,052 г; 0,40 ммоль) в изопропаноле (12 мл) перемешивают при 20 С в течение 16 ч. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде окрашенного твердого вещества (0,214 г). ЖХ/МС СИСТЕМА A - Rt = 4,89 мин; ЖХ/МС СИСТЕМА A - m/z 536 (МН+). Промежуточное соединение 29. 2-Гидроксиметилбензиламин. Алюмогидрид лития (12,4 мл; 1,0 М в диэтиловом эфире) осторожно добавляют в атмосфере азота при перемешивании в течение 10 мин к 2-цианометилбензоату (1,00 г; 6,2 ммоль) в безводном диэтиловом эфире (40 мл), поддерживая температуру не выше 15-20 С с помощью ледяной бани. По окончании добавления реакционную смесь оставляют для нагревания до 21 С, а затем кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают приблизительно до -10 С. Смесь осторожно по каплям обрабатывают водой (0,5 мл), 20% водным гидроксидом натрия (0,37 мл) и водой(1,74 мл). Полученную гетерогенную смесь зеленого цвета фильтруют, и остаток промывают диэтиловым эфиром (150 мл), объединенные промывные воды и фильтрат сушат (MgSO4), и растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде масла зеленого цвета (0,807 г). Масс-спектр m/z 138 (МH+ для C8H12NO). Пример 1. rel-(2R,3R,4S,5R)-2-[2-(транс-4 Амино-циклогексиламино)-6-(2,2-дифенилэтиламино)-пурин-9-ил]-5-(2-этил-2 Н-тетразол 5-ил)-тетрагидро-фуран-3,4-диол. Смесь промежуточного соединения 8(0,942 г; 1,72 ммоль) и транс-1,4-диаминоциклогексана (может быть получен в соответствии со способами, описанными в международной заявке на патент WО 94/17090) (1,19 г; 10,3 ммоль) в безводном диметилсульфоксиде (5 мл) нагревают при 120 С в течение 60 ч. Охлажденную реакционную смесь распределяют между этилацетатом (100 мл) и солевым раствором (100 мл). Органическую фазу отделяют, промывают смесью Н 2 О и солевого раствора (1:1; 100 мл). Объединенный водный раствор экстрагируют этилацетатом (100 мл). Объединенный органический раствор сушат над MgSO4, фильтруют и выпаривают в вакууме, что позволяет получить смолу беловатой окраски (1,22 г), которую очищают колоночной хроматографией на флэшкремнеземе, элюируя смесью CH2Cl2-MeOH-880NН 3 (40:10:1) и получая продукт в виде свободного основания как твердое вещество бежевого цвета (0,785 г). ТСХ SiO2 (СН 2 Сl2 : метанол : 880 NН 3; 40:10:1) Rf = 0,36. Пример 1 а. rel 0-(2R,3R,4S,5R)-2-[2-(транс 4-Амино-циклогексиламино)-6-(2,2-дифенилэтиламино)-пурин-9-ил]-5-(2-этил-2-1 Н-0-тетра 37 зол-5-ил)-тетрагидрофуран-3,4-диол дигидрохлорид Соединение из примера 1 (свободное основание) (0,780 г; 1,25 ммоль) растворяют в смеси этанола (3 мл) и этилацетата (20 мл), обрабатывают хлористым водородом в эфире (1 М; 2,5 мл; 2,5 ммоль), и осадок белого цвета образуется немедленно. К этой гетерогенной смеси добавляют эфир (40 мл) и перемешивают на открытом воздухе в течение 18 ч при 20 С. Твердое вещество белого цвета отфильтровывают,промывают эфиром (3 х 10 мл), сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества белого цвета (0,84 г). Т.пл. 141,2 С (разлагается); ЖХ/МС m/z 626 (MH+ для С 32 Н 39N11 О 3). Анализ. Обнаружено: С 53,35%; Н 6,35%;N 21,03%. С 32 Н 39N11 О 32 НСl1,4 Н 2O: С 53,10%; Н 6,10%; N 21,28%. Пример 1 б. rel 0-(2R,3R,4S,5R)-2-[2-(транс 4-Амино-циклогексиламино)-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол 5-ил)-тетрагидрофуран-3,4-диол сульфат. Соединение из примера 1 (свободное основание) (0,305 г; 0,49 ммоль) растворяют в промышленном метилированном спирте (3 мл) и в течение 30 мин обрабатывают, добавляя по каплям промышленный метилированный спирт (2 мл), содержащий серную кислоту (0,49 мл); осадок белого цвета образуется незамедлительно. К этой гетерогенной смеси добавляют промышленный метилированный спирт (1 мл) и перемешивают в течение 24 ч при 20 С. Твердое вещество белого цвета отфильтровывают, промывают промышленным метилированным спиртом (2 мл) и перекристаллизовывают из смеси метанола (60 мл), этанола (10 мл) и изопропанола (3 мл), что дает указанное в заголовке соединение в виде кристаллического твердого вещества белого цвета (0,263 г). ЖХ/МС СИСТЕМА A Rt = 3,79 мин; ЖХ/МС СИСТЕМА A m/z 626 (МН+). Пример 2. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(пирролидин-3-иламино)-пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола трис(трифторацетат). Промежуточное соединение 9 (0,050 г; 0,091 ммоль), 3-аминопирролидин (0,040 г; 0,45 ммоль) в н-бутаноле (0,5 мл) нагревают при 130 С в течение 28 ч. Реакционную смесь разбавляют метанолом (10 мл), очищают, используя препаративную ВЭЖХ (20-70% ацетонитрил) и растворитель удаляют 1 в вакууме, получая указанное в заголовке соединение в виде твердого вещества коричневой окраски (0,034 г). ТСХ SiO2 (16%-ный метанол в дихлорметане) Rf = 0,12. Точное значение массы по данным МС (электрораспыление): измеренное МН+ 598,301184; вычисленное для С 30 Н 36N11 О 3 = 598,300259. 38 Пример 3. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-6-(3-иод-бензиламино)-2-[2(1-метил-1 Н-имидазол-4-ил)-этиламино]-пурин 9-ил-тетрагидро-фуран-3,4-диол. Промежуточное соединение 7 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,006 г; 0,025 ммоль) с последующим добавлением 3 иодбензиламина (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют 1-метилгистамин(0,038 г; 0,30 ммоль) в изопропаноле (0,50 мл) и растворитель удаляют под током азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (6 каплях) и смесь нагревают при 120 С в течение 4 дней. Одновременно промежуточное соединение 7 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,006 г; 0,025 ммоль) с последующим добавлением 3-иодбензиламина (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют метилат натрия (0,001 г; 0,025 ммоль) в изопропаноле (0,25 мл) с диметилсульфоксидом (3 каплями). Через 6 ч при 20 С добавляют 1 метилгистамин (0,038 г; 0,30 ммоль) в изопропаноле (0,50 мл) и растворитель удаляют в токе азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (6 каплях), и смесь нагревают при 120 С в течение 4 дней. Реакционные смеси из этих двух экспериментов объединяют и очищают, используя картриджи для твердофазной экстракционной (SPE) хроматографии (NH2 аминопропил Bondelute), остаток растворяют в дихлорметане (5 мл) и наносят на 1 SPEкартридж (5 мл картридж); картридж последовательно промывают дихлорметаном (5 мл),хлороформом (5 мл), диэтиловым эфиром (5 мл), этилацетатом (2 х 5 мл), ацетонитрилом (2 х 5 мл) и ацетоном (2 х 5 мл). Объединенные ацетоновые фракции концентрируют в вакууме и подвергают дальнейшей очистке, растворяя остаток в дихлорметане (1 мл) и нанося на 1 SPE картридж (1 мл картридж); картридж последовательно промывают дихлорметаном (1 мл),хлороформом (1 мл), диэтиловым эфиром (1 мл), этилацетатом (2 х 1 мл), ацетонитрилом (2 х 1 мл) и ацетоном (2 х 1 мл). Объединенные ацетоновые фракции концентрируют в вакууме, что позволяет получить указанное в заголовке соединение в виде твердого вещества белого цвета(0,008 г). ЖХ/МС СИСТЕМА A - Rt = 3,62 мин; ЖХ/МС СИСТЕМА A - m/z 673 (MH+). Пример 4. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]-6-фенетиламино-пурин-9-илтетрагидрофуран-3,4-диол дигидрохлорид. Раствор гидроксида натрия (2,52 г; 63,0 ммоль) в метаноле (90 мл) обрабатывают 1 39 метилгистамином бисгидрохлоридом (6,50 г; 32,5 ммоль) и перемешивают при 20 С в течение 15 мин. Раствор концентрируют в вакууме до одной четвертой объема, обрабатывают промежуточным соединением 11 (2,26 г; 4,07 ммоль) и гетерогенную смесь перемешивают при 20 С в течение 30 мин. Растворитель удаляют в токе азота, получая остаток, который растворяют в диметилсульфоксиде (2,0 мл), затем нагревают при 115 С в течение 24 ч и позволяют охладиться. Смесь распределяют между дихлорметаном (300 мл) и водой (30 мл). Органическую фазу промывают водой (30 мл), разбавленным водным хлоридом натрия (50 мл),затем сушат (MgSO4) и выпаривают в вакууме,получая оранжевую пену. Ее очищают препаративной ВЭЖХ (профиль градиента: 17-38% ацетонитрила/вода, подкисленная 0,1% уксусной кислоты; Rt = 12 мин), получая твердое вещество бежевого цвета. Его растворяют в смеси воды(75 мл), 1,4-диоксана (2,5 мл), ацетонитрила,подкисленного 0,1% уксусной кислоты (50 мл),и метанола (20 мл) и лиофильно сушат, получая твердое вещество бежевого цвета. Это твердое вещество растворяют в дихлорметане (200 мл),раствор последовательно промывают насыщенным водным гидрокарбонатом натрия (3 х 30 мл) и водой (30 мл), затем сушат (MgSO4) и концентрируют в вакууме, получая желтую пену. Ее растворяют в метаноле (15 мл), этилацетате (20 мл) и диэтиловом эфире (20 мл), затем обрабатывают хлористым водородом (6,1 мл 1 М раствора в диэтиловом эфире). Далее порциями в течение 5 мин добавляют диэтиловый эфир(120 мл) и гетерогенную смесь перемешивают при 20 С в течение 1 ч. Полученное на стенках сосуда твердое вещество соскабливают в объем и взвесь перемешивают в течение дополнительных 10 мин. Далее удаляют супернатант, твердое вещество обрабатывают диэтиловым эфиром (250 мл), смесь перемешивают в течение 15 мин, затем удаляют супернатант. Твердое вещество еще раз обрабатывают диэтиловым эфиром(250 мл), перемешивают в течение 15 мин, затем удаляют супернатант и твердое вещество сушат под током азота, получая указанное в заголовке соединение в виде беловатого порошка (1,92 г). Анализ. Обнаружено: С, 46,5; Н, 5,9; N,23,9; С 26 Н 32N12O32,0 НСl2,5 Н 2O0,2 С 4 Н 10 О соответствует С, 46,4; Н, 6,0; N, 24,2%. для Масс-спектр(МН+ С 26 Н 32N12O3). Пример 5. (2R,3R,4S,5R)-2-6-Бензиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]-пурин-9-ил-5-(2-этил-2 Н-тетразол-5 ил)-тетрагидрофуран-3,4-диол. Соединение примера 5 получают аналогично способу, изложенному в примере 3, используя бензиламин (0,003 г; 0,025 ммоль). Указанное в заголовке соединение получают после 40 выпаривания растворителя в вакууме в виде твердого вещества белого цвета (0,005 г). ЖХ/МС СИСТЕМА A - Rt = 3,42 мин; ЖХ/МС СИСТЕМА A - m/z 547 (MH+). Пример 6. (2R,3R,4S,5R)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-(2-этил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диол ацетат. Промежуточное соединение 7 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,006 г; 0,025 ммоль) с последующим добавлением 3 пентиламина (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют 1-метилгистамин (0,038 г; 0,30 ммоль) в изопропаноле (0,50 мл) и растворитель удаляют под током азота. Оставшуюся смолу суспендируют в диметилсульфоксиде(3 каплях) и смесь нагревают при 120 С в течение 16 ч. Неочищенный продукт реакции очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества (0,003 г). ЖХ/МС СИСТЕМА А - Rt = 3,36 мин; ЖХ/МС СИСТЕМА A - m/z 527 (MH+). Пример 7. (2R,3R,4S,5R)-(2-6-Циклопентиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]-пурин-9-ил-5-(2-этил-2 Н-тетразол 5-ил)-тетрагидро-фуран-3,4-диол ацетат. Соединение примера 7 получают аналогично способу, изложенному в примере 6, используя циклопентиламин (0,002 г; 0,025 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества (0,005 г). ЖХ/МС СИСТЕМА A - Rt = 3,29 мин; ЖХ/МС СИСТЕМА A - m/z 525 (МH+). Пример 8. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-6-(1S-гидроксиметил-2 фенилэтиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-илтетрагидрофуран-3,4 диола ацетат. Соединение примера 8 получают аналогично способу, изложенному в примере 6, используя(0,004 г; 0,025 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества (0,005 г). ЖХ/МС СИСТЕМА А - Rt = 3,37 мин; ЖХ/МС СИСТЕМА A - m/z 591 (МН+). Пример 9. (2R,3R,4S,5R)-2-6-(3,3-Диметилбутиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)-этиламино]пурин-9-ил-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола ацетат. Соединение примера 9 получают аналогично способу, изложенному в примере 6, используя 3,3-диметилбутиламин (0,004 г; 0,025 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества (0,004 г). ЖХ/МС СИСТЕМА А Rt = 3,53 мин;Chem., 1985, 50, 4154] (3,74 г; 27,0 ммоль) в безводном диметилсульфоксиде (4 мл) перемешивают при 110 С в течение 64 ч перед концентрированием в вакууме. Неочищенный продукт очищают, используя картриджи для твердофазной экстракционной (SPE) хроматографии (NН 2 аминопропил Bondelute), остаток растворяют в дихлорметане (100 мл) и наносят на 5 SPEкартриджи (20 мл на картридж); картриджи последовательно промывают дихлорметаном (5 х 50 мл) и ацетонитрилом (5 х 50 мл) и неочищенный продукт элюируют метанолом (5 х 50 мл). Объединенные метанольные фракции концентрируют в вакууме и подвергают дальнейшей очистке с помощью колоночной хроматографии на флэш-кремнеземе, элюируя смесью 10% метанола в дихлорметане и получая продукт, содержащий примеси (1,00 г). Этот содержащий примеси материал очищают препаративной ВЭЖХ (14% ацетонитрила в воде [уксусная кислота в качестве модификатора] за период 30 мин,= 254), получая после лиофилизации белую пену (502 мг). Продукт растворяют в воде(50 мл) и добавляют водную 2 н. соляную кислоту (0,44 мл). Полученный раствор лиофильно сушат, получая указанное в заголовке соединение в виде белой пены (497 мг). Анализ. Обнаружено: С, 42,52%; Н, 5,56%;C21H26N10O4HCl0,8H2O соответствует С,42,25%; Н, 5,55%; N, 28,98%. Аналитическая ВЭЖХ (профиль градиента: смесь 10-60% ацетонитрила/вода за период 25 мин [трифторуксусная кислота в качестве модификатора]), Rt = 9,59 мин. Пример 11. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенилэтиламино)пурин-9 ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол. Смесь (S)-(-)-2-амино-3-фенил-1-пропанола (1,403 г; 9,3 ммоль), промежуточного соединения 12 (0,683 г; 1,86 ммоль) и бикарбоната натрия (0,393 г; 4,68 ммоль) в диметилсульфоксиде (2 мл) нагревают при перемешивании при 120 С в течение 48 ч, затем смесь оставляют для охлаждения и при пониженном давлении при 75 С удаляют растворитель. Остаток растворяют в дихлорметане (25 мл) и наносят на 2 картриджа для твердофазной экстракционной (SPE) хроматографии (NH2 аминопропил Bondelute),картриджи последовательно промывают дихлорметаном (25 мл) и ацетонитрилом (25 мл) и неочищенный продукт элюируют метанолом (3 42 х 25 мл). Объединенные метанольные фракции концентрируют в вакууме и содержащий примеси материал очищают с помощью препаративной ВЭЖХ (22% ацетонитрила в воде [уксусная кислота в качестве модификатора] за период 30 мин,= 254); растворитель удаляют в вакууме,получая свободное основание в виде белой пены(379 мг). ЖХ/МС СИСТЕМА A - Rt = 3,54 мин; ЖХ/МС СИСТЕМА A - m/z 483 (MH+). Пример 11 (альтернативный процесс). В трехгорлую круглодонную колбу емкостью 100 мл помещают промежуточное соединение 26 (1,21 г), L-фенилаланинол (1,09 г), диметилсульфоксид (3,0 мл) и диизопропилэтиламин (9,0 мл). Смесь кипятят с обратным холодильником в течение приблизительно 23 ч, затем концентрируют в вакууме. Полученное масло обрабатывают водой (20 мл) и этилацетатом(25 мл). Слои разделяют, и водный слой трижды экстрагируют этилацетатом (15 мл). Объединенные органические слои четырежды промывают солевым раствором (20 мл), сушат над безводным сульфатом натрия и концентрируют в вакууме, получая указанное в заголовке соединение промежуточной степени чистоты в виде масла. Указанное масло очищают хроматографией на силикагеле (230-400 меш; 42 г). Элюирование смесью дихлорметан: метанол (90:10) дает указанный в заголовке продукт (1,33 г) (с 80% выходом) в виде твердого вещества коричневой окраски. ТСХ (метиленхлорид/метанол (90:10), затем гексан/этилацетат (1:1 Rf = 0,45. Пример 11 а. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенилэтиламино)пурин-9 ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол гидрохлорид. Соединение примера 11 (свободное основание) (0,379 г; 0,79 ммоль) растворяют в воде(50 мл) и добавляют 2 н. водную соляную кислоту (0,39 мл). Полученный раствор лиофильно сушат, что позволяет получить указанное в заголовке соединение в виде белой пены (0,368 г). Т.пл. 174,1 С (разлагается). Анализ. Обнаружено: С, 46,35; Н, 5,40; N,25,58%;C21H26N10O4). Пример 11 б. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенилэтиламино)пурин-9 ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол 1-гидрокси-2-нафтоат. Соединение примера 11 (свободное основание) (0,300 г; 0,62 ммоль) растворяют в промышленном метилированном спирте (3 мл), все не растворившиеся вещества отфильтровывают и промывают промышленным метилированным спиртом (0,5 мл). 1-Гидрокси-2-нафтойную ки 43 слоту (0,117 г; 0,62 ммоль) растворяют в промышленном метилированном спирте (1,5 мл),фильтруют и промывают/прополаскивают промышленным метилированным спиртом (0,5 мл). Два раствора объединяют, хорошо перемешивают, что приводит к образованию мутной суспензии. Смесь оставляют при 20 С на 19 ч, супернатант удаляют, кристаллическое твердое вещество промывают промышленным метилированным спиртом (3 х 1 мл) и сушат на воздухе,что позволяет получить указанное в заголовке соединение в виде порошкообразного кристаллического не совсем белого твердого вещества(0,296 г). ЖХ/МС СИСТЕМА A - Rt = 3,57 мин; ЖХ/МС СИСТЕМА А - m/z 483 (МН+). Пример 11 в. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенилэтиламино)пурин-9 ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола сульфат. Соединение примера 11 (свободное основание) (0,325 г; 0,67 ммоль) растворяют в промышленном метилированном спирте (6 мл) и в течение 30 мин обрабатывают, добавляя по каплям промышленный метилированный спирт (4 мл), содержащий серную кислоту (0,67 мл). Полученную смесь перемешивают в атмосфере азота в течение 24 ч, после чего образуется мутная суспензия. Смесь выдерживают при 4 С в течение 72 ч, и образуется смола. Через 30 мин после соскребания с помощью шпателя образуется кристаллическое твердое вещество. Добавляют промышленный метилированный спирт (5 мл) и твердое вещество белого цвета отфильтровывают. Фильтрат объединяют с оставшейся смолой и перемешивают в течение дополнительных 30 мин, объем смеси уменьшают в вакууме, при этом образуется твердое вещество белого цвета, которое перекристаллизовывают из охлажденного промышленного метилированного спирта и объединяют с предыдущим сбором, что дает указанное в заголовке соединение в виде кристаллического твердого вещества белого цвета (0,242 г). ЖХ-МС СИСТЕМА A - Rt = 3,43 мин; ЖХ-МС СИСТЕМА A - m/z 483 (МН+). Пример 11 г. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенил-этиламино)-пурин 9-ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола мезилат. Раствор соединения примера 11 (свободного основания) (0,300 г; 0,62 ммоль) в промышленном метилированном спирте (3 мл) обрабатывают по каплям раствором метансульфоновой кислоты (0,042 г; 0,62 ммоль) в промышленном метилированном спирте (3 мл). Образовавшийся мутный раствор охлаждают приблизительно до 4 С в течение 16 ч перед удалением супернатанта, твердое вещество дважды промывают промышленным метилированным спиртом, отфильтровывают и сушат в вакууме, что позволя 001714 44 ет получить указанное в заголовке соединение в виде твердого вещества белого цвета (0,306 г). ЖХ-МС СИСТЕМА А - Rt = 3,56 мин; ЖХ-МС СИСТЕМА А - m/z 483 (MH+). Пример 11 д. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенил-этиламино)-пурин 9-ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола малеат. Соединение примера 11 (свободное основание) (0,301 г; 0,62 ммоль) растворяют в промышленном метилированном спирте (2,5 мл),все не растворившиеся вещества отфильтровывают и промывают промышленным метилированным спиртом (0,5 мл). Малеиновую кислоту(0,072 г; 0,62 ммоль) растворяют в промышленном метилированном спирте (1 мл), фильтруют и промывают/прополаскивают промышленным метилированным спиртом (0,2 мл). Два раствора объединяют, хорошо перемешивают, что приводит к образованию мутного раствора. Смесь оставляют при 20 С на 19 ч, образуется небольшое количество твердого вещества. Смесь слегка нагревают в течение короткого промежутка времени и оставляют стоять при 20 С в течение 4 ч. Полученные кристаллы отфильтровывают, промывают промышленным метилированным спиртом (1 х 1 мл, 1 х 2 мл) и сушат на воздухе, что дает указанное в заголовке соединение в виде порошкообразного кристаллического твердого вещества белового цвета (0,290 г). ЖХ/МС СИСТЕМА A - Rt = 3,54 мин; ЖХ/МС СИСТЕМА A - m/z 483 (МН+). Пример 11 д (альтернативный процесс). В круглодонную колбу помещают соединение примера 11 (свободное основание) (1,29 г) и смесь 10% метанола-этанол (10 мл). Смесь нагревают и фильтруют через фильтровальную бумагу Whatman No. 2. Фильтр промывают смесью 10% метанола-этанол (2,1 мл) и дополнительные 2 мл смеси 10% метанола-этанол добавляют к фильтрату, когда мутный раствор становится прозрачным. К этому раствору добавляют раствор малеиновой кислоты (311 мг в 2 мл смеси 10% метанола-этанол). В раствор помещают затравку из подходящих кристаллов и оставляют при комнатной температуре на три с половиной часа. Смесь фильтруют, и осадок на фильтре промывают абсолютным этанолом(3 мл). Твердое вещество сушат при 60 С, получая указанный в заголовке продукт (1,42 г) (с 89% выходом) в виде кристаллического твердого вещества белого цвета: т.пл. 169,5 С. ТСХ (90:10, метиленхлорид/метанол) Rf = 0,45. Пример 12. (2R,3R,4S,5R)-2-(6-Амино-2 циклопентиламино-пурин-9-ил)-5-(2-этил-2 Нтетразол-5-ил)-тетрагидрофуран-3,4-диола бис(трифторацетат). Промежуточное соединение 12 (0,050 г; 0,14 ммоль) и циклопентиламин (0,08 мл; 0,68 ммоль) в безводном диметилсульфоксиде (0,1 45 мл) нагревают при 120 С в течение 7 дней. Дополнительную порцию циклопентиламина (0,04 мл; 0,34 ммоль) с дополнительным диметилсульфоксидом (2 каплями) и реакционную смесь нагревают при 120 С в течение дополнительных 24 ч. Реакционную смесь разбавляют метанолом(3 мл) и очищают, используя препаративную ВЭЖХ (10-60% ацетонитрил). Растворитель удаляют в вакууме, остаток азеотропно отгоняют с метанолом и сушат в вакууме. После растирания с диэтиловым эфиром указанное в заголовке соединение получают в виде твердого вещества бледно-желтой окраски (0,034 г). ЖХ/МС СИСТЕМА A - Rt = 3,34 мин; ЖХ/МС СИСТЕМА A - m/z 417 (МН+). Пример 13. (2R,3R,4S,5R)-2-[6-Амино-2(4-фтор-фениламино)пурин-9-ил]-5-(2-этил-2 Нтетразол-5-ил)-тетрагидрофуран-3,4-диола трифторацетат. Соединение примера 13 получают аналогично способу, изложенному в примере 12, используя 4-фторанилин (0,06 мл; 0,68 ммоль) и нагревание при 120 С в течение 48 ч. Реакционную смесь разбавляют метанолом (3 мл) и очищают, используя препаративную ВЭЖХ (1060% ацетонитрил). Растворитель удаляют в вакууме, остаток азеотропно отгоняют с метанолом и сушат в вакууме, получая указанное в заголовке соединение в виде не совсем белого твердого вещества (0,049 г). ЖХ/МС СИСТЕМА А - Rt = 3,74 мин; ЖХ/МС СИСТЕМА А - m/z 443 (MH+). Пример 14. (2R,3R,4S,5R)-2-6-Амино-2[2-(4-аминофенил)-этиламино]-пурин-9-ил-5(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4 диола формиат. Промежуточное соединение 12 (0,050 г; 0,14 ммоль) и 2-(4-аминофенилэтил)амин (0,074 г; 0,68 ммоль) в безводном диметилсульфоксиде(0,2 мл) нагревают при 120 С в атмосфере азота в течение 48 ч и неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде окрашенной в желтый цвет пленки (0,032 г). ЖХ/МС СИСТЕМА А - Rt = 3,21 мин; ЖХ/МС СИСТЕМА А - m/z 468 (МН+). Пример 15. (2R,3R,4S,5R)-2-6-Амино-2[2-(3,4-дигидроксифенил)этиламино]пурин-9 ил-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Промежуточное соединение 12 (0,030 г; 0,08 ммоль) и 3-гидрокситирамин (0,112 г; 0,82 ммоль) в безводном диметилсульфоксиде (0,2 мл) нагревают при 115 С в атмосфере азота в течение 24 ч и неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде окрашенной в коричневый цвет пленки (0,043 г). ЖХ/МС СИСТЕМА A - Rt = 3,53 мин; 46 ЖХ/МС СИСТЕМА A - m/z 485 (МН+). Пример 16. (2R,3R,4S,5R)-2-6-Амино-2[2-(4-гидроксифенил)этиламино]пурин-9-ил-5(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4 диола формиат. Соединение примера 16 получают аналогично способу, изложенному в примере 15, используя тирамин (0,112 г; 0,82 ммоль). Неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде окрашенной в коричневый цвет пленки (0,033 г). ЖХ/МС СИСТЕМА А Rt = 3,53 мин; ЖХ/МС СИСТЕМА A - m/z 469 (МН+). Пример 17. 4-(2-6-Амино-9-[5R-(2-этил 2 Н-тетразол-5-ил)-3R,4S-дигидрокси-тетрагидрофуран-2R-ил]-9 Н-пурин-2-иламиноэтил) бензолсульфамида формиат. Соединение примера 17 получают аналогично способу, изложенному в примере 15, используя 4-(2-аминоэтил)бензолсульфамид (0,163 г; 0,82 ммоль). Неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде окрашенной в желтый цвет пленки (0,038 г). ЖХ/МС СИСТЕМА А Rt = 3,42 мин; ЖХ/МС СИСТЕМА А m/z 532 (МН+). Пример 18. (2R,3R,4S,5R)-2-6-Амино-2[2-(4-метоксифенил)этиламино]пурин-9-ил-5(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4 диола формиат. Соединение примера 18 получают аналогично способу, изложенному в примере 15, используя 4-метоксифенетиламин (0,12 мл; 0,82 ммоль). Неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде прозрачной бесцветной пленки (0,024 г). ЖХ/МС СИСТЕМА A - Rt = 3,80 мин; ЖХ/МС СИСТЕМА A - m/z 483 (MH+). Пример 19. (2R,3R,4S,5R)-2-[6-Амино-2(бицикло[2.2.1]гепт-2-иламино)пурин-9-ил]-5(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4 диола трифторацетат. Промежуточное соединение 12 (0,030 г; 0,08 ммоль) и -экзо-2-аминонорборнан (0,10 мл; 0,82 ммоль) в безводном диметилсульфоксиде (0,2 мл) нагревают при 115 С в атмосфере азота в течение 24 ч. Реакционную смесь объединяют с неочищенным реакционным продуктом, полученным из промежуточного соединения 12 (0,050 г; 0,14 ммоль), и -экзо-2 аминонорборнаном (0,10 мл; 0,82 ммоль) в безводном диметилсульфоксиде (0,2 мл), нагретыми при 120 С в атмосфере азота в течение 16 ч; эту смесь нагревают при 115 С в атмосфере азота в течение 96 ч. Неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая со 47 держащий примеси продукт, который очищают с помощью препаративной ВЭЖХ (10-60% ацетонитрил). Растворитель удаляют в вакууме,остаток азеотропно отгоняют с метанолом и сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества белого цвета (0,009 г). ЖХ/МС СИСТЕМА А - Rt = 3,70 мин; ЖХ/МС СИСТЕМА А - m/z 443 (МН+). Пример 20. (2R,3R,4S,5R)-2-6-Амино-2[2-(3,4-диметоксифенил)этиламино]пурин-9 ил-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола трифторацетат. Промежуточное соединение 12 (0,050 г; 0,14 ммоль) и 3,4-диметоксифенетиламин (0,123 г; 0,68 ммоль) в безводном диметилсульфоксиде(0,1 мл) нагревают при 120 С в атмосфере азота в течение 24 ч. Реакционную смесь разбавляют метанолом (3 мл) и очищают, используя препаративную ВЭЖХ (10-60% ацетонитрил). Растворитель удаляют в вакууме, остаток азеотропно отгоняют с метанолом и сушат в вакууме,получая указанное в заголовке соединение в виде смолы желтого цвета (0,089 г). ЖХ/МС СИСТЕМА A - Rt = 3,61 мин; ЖХ/МС СИСТЕМА A - m/z 513 (MH+). Пример 21. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола дигидрохлорид. Промежуточное соединение 10 (0,849 г; 1,42 ммоль) растворяют в метаноле (4 мл), этилацетате (20 мл) и по каплям обрабатывают эфирным хлористым водородом (1 М; 2,84 мл). Добавляют эфир (30 мл) и смесь перемешивают в течение 0,75 ч. Смолу растворяют в метаноле и при перемешивании понемногу добавляют эфир до тех пор, пока смесь не станет мутной,после чего понемногу добавляют смесь этилацетат-эфир (1:1), что приводит к образованию другой смолы. Смолу растворяют в метаноле и понемногу добавляют эфир до тех пор, пока не перестанет образовываться осадок. Смесь оставляют перемешиваться при комнатной температуре в течение 16 ч. Смесь оставляют отстаиваться и растворитель декантируют. Осадок промывают эфиром. Над взвесью в течение 0,5 ч продувают азот. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде твердого вещества кремовой окраски (0,77 г). ЖХ/МС m/z 598 (MH+ для C30H35N11O3). 48 нагревают при 130 С в атмосфере азота в течение 24 ч. Реакционную смесь разбавляют метанолом (8 мл) и очищают, используя препаративную ВЭЖХ (20-90% ацетонитрил). Растворитель удаляют в вакууме, остаток азеотропно отгоняют с метанолом и сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества бледно-желтой окраски(0,25 мл). Смесь оставляют при 20 С на 16 ч,после чего добавляют пирролидин-3R-иламин(0,026 г; 0,30 ммоль) в изопропаноле (0,50 мл), и растворитель удаляют под током азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (0,1 мл), и смесь нагревают при 120 С в течение 60 ч. Неочищенный реакционный продукт очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества белого цвета (0,005 г). ЖХ/МС СИСТЕМА А - Rt =4,13 мин; ЖХ/МС СИСТЕМА А - m/z 634 (МH+). Пример 24. (2R,3R,4S,5R)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-ил-этиламино)пурин-9-ил]-5-(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 17 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,003 г; 0,025 ммоль) с последующим добавлением 3 пентиламина (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 48 ч, после чего добавляют 2-пиперидиноэтиламин(0,032 г; 0,25 ммоль) в изопропаноле (0,50 мл), и растворитель удаляют под током азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (3-5 каплях), и смесь нагревают при 130 С в течение 24 ч. Неочищенный реакционный продукт очищают, используя автопреп. ВЭЖХ,получая после лиофилизации указанное в заголовке соединение в виде твердого вещества коричневой окраски (0,004 г). ЖХ/МС СИСТЕМА A - Rt = 3,59 мин; ЖХ/МС СИСТЕМА A - m/z 515 (МН+). Пример 25. (2R,3R,4S,5R)-2-[6-Циклопентиламино-2-(2-пиперидин-1-ил-этиламино)пурин-9-ил]-5-(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола диформиат. 49 Соединение примера 25 получают аналогично способу, изложенному в примере 24, используя циклопентиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и используя 2-пиперидиноэтиламин (0,032 г; 0,25 ммоль) при 130 С в течение 40 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества коричневой окраски (0,003 г). ЖХ/МС СИСТЕМА А - Rt = 3,20 мин; ЖХ/МС СИСТЕМА А - m/z 514 (МН+). Пример 26. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(2-пиперидин-1-ил-этиламино) пурин-9-ил]-5-(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 26 получают аналогично способу, изложенному в примере 24, используя 2,2-дифенилэтиламин (0,005 г; 0,025 ммоль) при 21 С в течение 20 ч и используя 2 пиперидиноэтиламин (0,032 г; 0,25 ммоль), нагревая при 100 С в течение 96 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бежевого цвета(0,003 г). ЖХ/МС СИСТЕМА A - Rt = 3,78 мин; ЖХ/МС СИСТЕМА A - m/z 626 (МН+). Пример 27. (2R,3R,4S,5R)-2-6-(2,2-Дифенилэтиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-(2-метил-2 Нтетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 27 получают аналогично способу, изложенному в примере 24, используя 2,2-дифенилэтиламин (0,005 г; 0,025 ммоль) при 21 С в течение 20 ч и используя 1 метилгистамин (0,032 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества белого цвета (0,006 г). ЖХ/МС СИСТЕМА A - Rt = 3,71 мин; ЖХ/МС СИСТЕМА А - m/z 623 (МН+). Пример 28. (2R,3R,4S,5R)-2-6-(3,3-Диметилбутиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)-этиламино]-пурин-9-ил-5-(2-метил-2 Нтетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 28 получают аналогично способу, изложенному в примере 24, используя 3,3-диметилбутиламин (0,003 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль),нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества белого цвета 50 и 1-метилгистамин (0,031 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледно-желтой окраски (0,006 г). ЖХ/МС СИСТЕМА A - Rt = 3,57 мин; ЖХ/МС СИСТЕМА A - m/z 659 (МН+). Пример 30. (2R,3R,4S,5R)-2-6-Бензиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)-этиламино]пурин-9-ил-5-(2-метил-2 Н-тетразол-5 ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 30 получают аналогично способу, изложенному в примере 24, используя бензиламин (0,003 г; 0,025 ммоль) при 21 С в течение 20 ч и используя 1-метилгистамин (0,032 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде смолы оранжевого цвета (0,004 г). ЖХ/МС СИСТЕМА А - Rt = 3,32 мин; ЖХ/МС СИСТЕМА А - m/z 533 (МН+). Пример 31. (2R,3R,4S,5R)-2-6-(2-Циклогексилэтиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]-пурин-9-ил-5-(2-метил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 31 получают аналогично способу, изложенному в примере 24, используя 2-циклогексилэтиламин (0,003 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль),нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде смолы желтого цвета (0,003 г). ЖХ/МС СИСТЕМА А Rt = 3,62 мин; ЖХ/МС СИСТЕМА A m/z 553 (MH+). Пример 32. (2R,3R,4S,5R)-2-6-(1S-Гидроксиметил-2-фенилэтиламино)-2-[2-(1-метил-1 Нимидазол-4-ил)-этиламино]-пурин-9-ил-5-(2 метил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4 диола формиат. Соединение примера 32 получают аналогично способу, изложенному в примере 24, используя(0,004 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества светло-коричневой окраски (0,003 г). ЖХ/МС СИСТЕМА А - Rt = 3,32 мин; ЖХ/МС СИСТЕМА A - m/z 577 (MH+). Пример 33. (2R,3R,4S,5R)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-(2-метил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 33 получают аналогично способу, изложенному в примере 24, используя 3-пентиламин (0,002 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества белого цвета (0,003 г). 51 ЖХ/МС СИСТЕМА А - Rt = 3,26 мин; ЖХ/МС СИСТЕМА A - m/z 513 (МН+). Пример 34. (2R,3R,4S,5R)-2-2-[2-(1-Метил-1 Н-имидазол-4-ил)-этиламино]-6-фенетиламинопурин-9-ил-5-(2-метил-2 Н-тетразол-5 ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 34 получают аналогично способу, изложенному в примере 24, используя 2-фенилэтиламин (0,003 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль), нагревая при 100 С в течение 16 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества кремовой окраски(0,004 г; 0,025 ммоль) при 21 С в течение 20 ч и используя транс-циклогексан-1,4-диамин (может быть получен, следуя способам, описанным в международной заявке на патент WО 94/17090) (0,029 г; 0,25 ммоль), нагревая при 130 С в течение 48 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества коричневой окраски(0,004 г). ЖХ/МС СИСТЕМА А - Rt = 3,38 мин; ЖХ/МС СИСТЕМА А - m/z 566 (МH+). Пример 36. (2R,3R,4S,5R)-2-[6-Циклопентиламино-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(2-метил-2 Н-тетразол 5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 36 получают аналогично способу, изложенному в примере 24, используя циклопентиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и используя (S)-(-)-2 амино-3-фенил-1-пропанол (0,038 г; 0,25 ммоль), нагревая при 130 С в течение 40 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества кремовой окраски (0,004 г). ЖХ/МС СИСТЕМА А - Rt = 4,03 мин; ЖХ/МС СИСТЕМА А - m/z 537 (МН+). Пример 37. (2R,3R,4S,5R)-2-[6-Амино-2(1S-гидроксиметил-2-фенилэтиламино)пурин-9 ил]-5-(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Газообразный аммиак барботируют через охлажденный (в ледяной бане) тетрагидрофуран(10 мл) в течение 1 ч, добавляют промежуточное соединение 17 (0,12 г; 0,25 ммоль), и полученный раствор перемешивают при 20 С в течение 20 ч. Газообразный аммиак еще раз барботируют через раствор в течение 1,5 ч перед перемешиванием при 20 С в течение следующих 52 18 ч. Газообразный аммиак еще раз барботируют через раствор в течение 1,5 ч перед перемешиванием при 20 С в течение следующих 15 ч. Реакционную смесь выпаривают досуха в вакууме, получая твердое вещество белого цвета,которое растворяют в смеси дихлорметана (2 мл) и диметилсульфоксида (5 мл). Отбирают аликвоту этого раствора (0,7 мл; 0,025 ммоль) и концентрируют, выпаривая растворитель, к остатку добавляют неразбавленный (S)-(-)-2 амино-3-фенил-1-пропанол (0,038 г; 0,25 ммоль). Смесь нагревают при 130 С в течение 42 ч и неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества коричневой окраски (0,005 г). ЖХ/МС СИСТЕМА A - Rt = 3,43 мин; ЖХ/МС СИСТЕМА А - m/z 469 (МН+). Пример 38. (2R,3R,4S,5R)-2-6-Амино-2[2-(3,4-диметоксифенил)этиламино]пурин-9 ил-5-(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 38 получают аналогично способу, изложенному в примере 37, используя 2-(3,4-диметоксифенил)этиламин (0,038 г; 0,25 ммоль) и нагревая при 130 С в течение 20 часов. Указанное в заголовке соединение получают после лиофилизации в виде масла желтого цвета (0,003 г). ЖХ/МС СИСТЕМА А - Rt = 3,44 мин; ЖХ/МС СИСТЕМА A - m/z 499 (МН+). Пример 39. (2R,3R,4S,5R)-2-[6-Амино-2(бицикло[2.2.1]гепт-2-иламино)пурин-9-ил]-5(2-метил-2 Н-тетразол-5-ил)тетрагидрофуран 3,4-диола формиат. Соединение примера 39 получают аналогично способу, изложенному в примере 37, используя -экзо-2-аминонорборнан (0,028 г; 0,25 ммоль) и нагревая при 130 С в течение 42 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества кремовой окраски (0,003 г). ЖХ/МС СИСТЕМА A - Rt = 3,57 мин; ЖХ/МС СИСТЕМА A - m/z 429 (МH+). Пример 40. (2R,3R,4S,5R)-2-6-(1S-Гидроксиметил-2-фенилэтиламино)-2-[2-(1-метил-1 Нимидазол-4-ил)-этиламино]-пурин-9-ил-5-(2 изопропил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Промежуточное соединение 20 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,003 г; 0,025 ммоль) с последующим добавлением (S)-(-)-2 амино-3-фенил-1-пропанола (0,004 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют 1 метилгистамин (0,031 г; 0,25 ммоль) в изопропаноле (0,50 мл), и растворитель удаляют в токе азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (3-5 каплях) и смесь нагревают 53 при 130 С в течение 12 ч. Неочищенный реакционный продукт очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества бледно-коричневой окраски (0,003 г). ЖХ/МС СИСТЕМА А - Rt = 3,63 мин; ЖХ/МС СИСТЕМА А - m/z 605 (MH+). Пример 41. (2R,3R,4S,5R)-2-6-Циклопентиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]пурин-9-ил 5-(2-изопропил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 41 получают аналогично способу, изложенному в примере 40, используя циклопентиламин (0,002 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледно-коричневой окраски (0,005 г). ЖХ/МС СИСТЕМА А - Rt = 3,62 мин; ЖХ/МС СИСТЕМА А - m/z 539 (МН+). Пример 42. (2R,3R,4S,5R)-2-6-Амино-2[2-(3,4-диметоксифенил)этиламино]пурин-9 ил 5-(2-изопропил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Газообразный аммиак барботируют через охлажденный (в ледяной бане) тетрагидрофуран(5 мл) в течение 1 ч. Добавляют промежуточное соединение 20 (0,12 г; 0,25 ммоль) и полученный раствор перемешивают при 20 С в течение 12 ч. Газообразный аммиак еще раз барботируют через раствор в течение 2 ч перед перемешиванием при 20 С в течение следующих 12 ч. Реакционную смесь выпаривают досуха, получая твердое вещество белого цвета, которое растворяют в диметилсульфоксиде (4 мл). Аликвоту этого раствора (0,4 мл; 0,025 ммоль) добавляют в герметизированную пробирку (Reactivial) (1 мл) с последующим добавлением 2(3,4-диметоксифенил)этиламина (0,045 г; 0,25 ммоль). Реакционную смесь нагревают при 120 С в течение 3 дней и неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества (0,002 г). ЖХ/МС СИСТЕМА A - Rt = 3,92 мин; ЖХ/МС СИСТЕМА А - m/z 527 (МН+). Пример 43. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(2-пирролидин-1-ил-этиламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола трис(трифторацетат). Промежуточное соединение 9 (0,050 г; 0,09 ммоль) и 1-(2-аминоэтил)пирролидин (0,052 г; 0,46 ммоль) в диметилсульфоксиде (0,5 мл) нагревают при 130 С в атмосфере азота в течение 20,5 ч. Реакционную смесь разбавляют метанолом (10 мл) и очищают, используя препаративную ВЭЖХ (20-100%-ный ацетонитрил). Растворитель удаляют в вакууме, сушат в вакууме,получая указанное в заголовке соединение в 54 виде твердого вещества желто-коричневой окраски (0,046 г). Масс-спектр(2R,3R,4S,5R)-2-[6-(2,2 Дифенилэтиламино)-2-(2-морфолин-4-ил-этиламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола трис(трифторацетат). Промежуточное соединение 9 (0,050 г; 0,09 ммоль) и 4-(2-аминоэтил)морфолин (0,059 г; 0,46 ммоль) в диметилсульфоксиде (0,5 мл) нагревают при 130 С в атмосфере азота в течение 13 ч. Реакционную смесь разбавляют метанолом(10 мл) и очищают, используя препаративную ВЭЖХ (20-100% ацетонитрил). Растворитель удаляют в вакууме, сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества бледно-желтой окраски (0,053 г). ТСХ SiO2 (дихлорметан/метанол; 5:1) Rf = 0,52. Масс-спектр(0,099 г; 0,73 ммоль) нагревают при 130 С в атмосфере азота в течение 20 ч. Реакционную смесь очищают, используя препаративную ВЭЖХ (20-100% ацетонитрил). Растворитель удаляют в вакууме и сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества бледно-коричневой окраски(МH+ С 30 Н 35N10O5S). Пример 46. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(2-пиперидин-1-ил-этиламино)-пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола бис(трифторацетат). Промежуточное соединение 9 (0,050 г; 0,09 ммоль) и 2-этиламинопиперидин (0,117 г; 0,91 ммоль) нагревают при 130 С в атмосфере азота в течение 18 ч. Реакционную смесь разбавляют метанолом (10 мл) и очищают, используя препаративную ВЭЖХ (20-100% ацетонитрил). Растворитель удаляют в вакууме и сушат в вакууме, получая указанное в заголовке соединение в виде пены бледно-желтой окраски (0,049 г). ТСХ SiO2 (дихлорметан/метанол; 5:1) Rf = 0,24.(МН+ для С 33H42N11 О 3). Пример 47. (2R,3R,4S,5R)-2-[6-(2,2-Дифенилэтиламино)-2-(2-гидроксиэтиламино)пурин 9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола трифторацетат. Промежуточное соединение 9 (0,050 г; 0,09 ммоль) и 2-аминоэтанол (0,056 г; 0,91 ммоль) нагревают при 130 С в атмосфере азота в течение 20 ч. Реакционную смесь разбавляют метанолом (10 мл) и очищают, используя препаративную ВЭЖХ (20-100% ацетонитрил). Растворитель удаляют в вакууме и сушат в вакууме,получая указанное в заголовке соединение в виде твердого вещества желтого цвета (0,042 г). ТСХ SiO2 (дихлорметан/метанол; 5:1) Rf = 0,50. Масс-спектр(МН+ для С 28 Н 33N10O4). Пример 48. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-[6-(3-иод-бензиламино)-2-(2 морфолин-4-ил-этиламино)пурин-9-ил]тетрагидрофуран-3,4-диол. Промежуточное соединение 7 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,006 г; 0,025 ммоль), и 3-иодбензиламин (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют 4(2-аминоэтил)морфолин (0,039 г; 0,30 ммоль) в изопропаноле (0,50 мл) и растворитель удаляют в токе азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (6 каплях), и смесь нагревают при 120 С в течение 4 дней. Одновременно промежуточное соединение 7 (0,012 г; 0,025 ммоль) растворяют в изопропаноле (0,25 мл), добавляют изопропанол (0,25 мл), содержащий диизопропилэтиламин (0,006 г; 0,025 ммоль) и 3-иодбензиламин (0,002 г; 0,025 ммоль) в изопропаноле (0,25 мл). Смесь оставляют при 20 С на 12 ч, после чего добавляют метилат натрия (0,001 г; 0,025 ммоль) в изопропаноле (0,25 мл) с диметилсульфоксидом (3 каплями). Через 6 ч при 20 С добавляют 4-(2 аминоэтил)морфолин (0,039 г; 0,30 ммоль) в изопропаноле (0,50 мл) и растворитель удаляют под током азота. Оставшуюся смолу суспендируют в диметилсульфоксиде (6 каплях) и смесь нагревают при 120 С в течение 4 дней. Реакционные смеси из этих двух экспериментов объединяют и очищают, используя картриджи для твердофазной экстракционной (SPE) хроматографии (NН 2 аминопропил Bondelute), остаток растворяют в дихлорметане (5 мл) и наносят на 1 SPE картридж (5 мл картридж); картридж последовательно промывают дихлорметаном (5 мл), хлороформом (5 мл), диэтиловым эфиром(2 х 5 мл), ацетоном (2 х 5 мл) и метанолом (2 х 5 мл). Объединенные метанольные фракции концентрируют в вакууме и подвергают дальней 001714(1 мл) и нанося на 1 SPE картридж (1 мл картридж); картридж последовательно промывают дихлорметаном (1 мл), хлороформом (1 мл),диэтиловым эфиром (1 мл), этилацетатом (2 х 1 мл), ацетонитрилом (2 х 1 мл), ацетоном (2 х 1 мл) и метанолом (2 х 1 мл). Объединенные метанольные фракции концентрируют в вакууме, что позволяет получить указанное в заголовке соединение в виде твердого вещества бежевого цвета (0,004 г). ЖХ-МС СИСТЕМА A Rt = 3,62 мин; ЖХ-МС СИСТЕМА A m/z 678 (MH+). Пример 49. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-[2-(2-морфолин-4-ил-этиламино)-6-фенетиламино-пурин-9-ил]-тетрагидрофуран-3,4-диол. Соединение примера 49 получают аналогично способу, изложенному в примере 48, используя 2-фенетиламин (0,003 г; 0,025 ммоль). Указанное в заголовке соединение получают в виде твердого вещества бежевого цвета (0,004 г). ЖХ/МС СИСТЕМА A - Rt = 3,50 мин; ЖХ/МС СИСТЕМА А - m/z 566 (MH+). Пример 50. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-[2-[2-(1-метил-1 Н-имидазол-4 ил)-этиламино]-6-(2-морфолин-4-ил-этиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диацетат. Соединение примера 50 получают аналогично способу, изложенному в примере 6, используя 4-(2-аминоэтил)морфолин (0,002 г; 0,025 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества (0,008 г). ЖХ/МС СИСТЕМА A - Rt = 2,86 мин; ЖХ/МС СИСТЕМА A - m/z 570 (MH+). Пример 51. (2R,3R,4S,5R)-2-6-(3,3-Диметилбутиламино)-2-[2-(пиридин-2-иламино)этиламино]пурин-9-ил-5-(2-этил-2 Н-тетразол 5-ил)-тетрагидро-фуран-3,4-диола ацетат. Промежуточное соединение 7,3,3 диметилбутиламин (0,188 г; 0,4 ммоль) и диизопропилэтиламин (0,051 г; 0,4 ммоль) в изопропиловом спирте (12 мл) перемешивают при 20 С в течение 16 ч. Аликвоту (0,75 мл) этой реакционной смеси добавляют к промежуточному соединению 27 (0,034 г; 0,25 ммоль) в изопропиловом спирте (0,25 мл), и растворитель удаляют в токе азота перед добавлением диметилсульфоксида (0,25 мл). Смесь нагревают при 120 С в течение 16 ч, и неочищенный реакционный продукт очищают, используя автопреп. ВЭЖХ, получая после лиофилизации указанное в заголовке соединение в виде твердого вещества (0,004 г). ЖХ/МС СИСТЕМА А - Rt = 3,61 мин; ЖХ/МС СИСТЕМА А - m/z 553 (МН+). Пример 52. (2R,3R,4S,5R)-2-[6-(3,3-Диметилбутиламино)-2-(1S-гидроксиметил-2-фенил 57 этиламино)пурин-9-ил]-5-(2-этил-2 Н-тетразол 5-ил)тетрагидрофуран-3,4-диола ацетат. Соединение примера 52 получают аналогично способу, изложенному в примере 51, используя(0,038 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества (0,002 г). ЖХ/МС СИСТЕМА А - Rt = 4,28 мин; ЖХ/МС СИСТЕМА A - m/z 567 (МH+). Пример 53. (2R,3R,4S,5R)-2-[6-Амино-2(транс-4-амино-циклогексиламино)-пурин-9 ил]-5-(2-этил-2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диол. Промежуточное соединение 12 (0,050 г; 0,14 ммоль), транс-1,4-диаминоциклогексан(0,154 г; 1,4 ммоль) и диметилсульфоксид (0,2 мл) нагревают при 120 С в течение 16 ч. Неочищенный реакционный продукт очищают,используя автопреп. ВЭЖХ, получая после азеотропной отгонки с метанолом (х 3) указанное в заголовке соединение в виде пленки светло-коричневой окраски (0,013 г). ЖХ/МС СИСТЕМА A - Rt = 2,89 мин; ЖХ/МС СИСТЕМА А - m/z 446 (МH+). Пример 54. (2R,3R,4S,5R)-2-6-Амино-2[2-(1-метил-1 Н-имидазол-4-ил)-этиламино]пурин-9-ил-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Промежуточное соединение 12 (0,030 г; 0,08 ммоль) и 1-метилгистамин (0,101 г; 0,82 ммоль) в изопропаноле (1,63 мл) объединяют, и растворитель удаляют в токе азота, добавляют безводный диметилсульфоксид (0,2 мл), нагревают при 115 С в атмосфере азота в течение 24 ч, и неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ. Растворитель удаляют в вакууме, получая указанное в заголовке соединение в виде пленки коричневой окраски (0,013 г). ЖХ/МС СИСТЕМА А - Rt = 3,06 мин; ЖХ/МС СИСТЕМА А - m/z 457 (МН+). Пример 55. (2R,3R,4S,5R)-2-6-Амино-2[2-(пиридин-2-иламино)этиламино]пурин-9-ил 5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран 3,4-диола трифторацетат. Соединение примера 55 получают аналогично способу, изложенному в примере 54, используя 2-(пиридин-2-иламино)этиламин (0,112 г; 0,82 ммоль). Неочищенную реакционную смесь очищают, используя автопреп. ВЭЖХ с последующей очисткой препаративной ВЭЖХ(10-40% ацетонитрил). Растворитель удаляют в вакууме, и остаток азеотропно отгоняют с метанолом, получая указанное в заголовке соединение в виде смолы коричневой окраски (0,006 г). ЖХ/МС СИСТЕМА A - Rt =3,13 мин; ЖХ/МС СИСТЕМА A - m/z 469 (МН+). Пример 56. (2R,3R,4S,5R)-2-6-(3,3-Диметилбутиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)-этиламино]-пурин-9-ил-5-(2-изопропил 001714 58 2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 56 получают аналогично способу, изложенному в примере 40, используя 3,3-диметилбутиламин (0,003 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледно-коричневой окраски (0,004 г). ЖХ/МС СИСТЕМА А - Rt = 3,88 мин; ЖХ/МС СИСТЕМА А - m/z 555 (MH+). Пример 57. (2R,3S,4R,5R)-2-(2-Изопропил 2 Н-тетразол-5-ил)-5-2-[2-(1-метил-1 Н-имидазол-4-ил)-этиламино]-6-фенетиламинопурин-9 ил-тетрагидрофуран-3,4-диола формиат. Соединение примера 57 получают аналогично способу, изложенному в примере 40, используя 2-фенетиламин (0,003 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледно-коричневой окраски (0,002 г). ЖХ/МС СИСТЕМА A - Rt = 3,81 мин; ЖХ/МС СИСТЕМА A - m/z 575 (МH+). Пример 58. (2R,3R,4S,5R)-2-6-Бензиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)-этиламино]-пурин-9-ил-5-(2-изопропил-2 Н-тетразол 5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 58 получают аналогично способу, изложенному в примере 40, используя бензиламин (0,003 г; 0,025 ммоль) и 1 метилгистамин (0,031 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледнокоричневой окраски (0,013 г). ЖХ/МС СИСТЕМА A - Rt = 3,72 мин; ЖХ/МС СИСТЕМА А - m/z 561 (MH+). Пример 59. (2R,3R,4S,5R)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)-этиламино]-пурин-9-ил-5-(2-изопропил 2 Н-тетразол-5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 59 получают аналогично способу, изложенному в примере 40, используя 1-этилпропиламин (0,002 г; 0,025 ммоль) и 1-метилгистамин (0,031 г; 0,25 ммоль). Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества бледно-коричневой окраски (0,001 г). ЖХ/МС СИСТЕМА А - Rt = 3,71 мин; ЖХ/МС СИСТЕМА А - m/z 541 (MH+). Пример 60. (2R,3R,4S,5R)-2-[6-(3,3-Диметилбутиламино)-2-(2R-гидрокси-(R)-циклопентиламино)-пурин-9-ил]-5-(2-этил-2 Н-тетразол-5 ил)-тетрагидрофуран-3,4-диола бис(трифторацетат). Промежуточное соединение 8 (0,030 г; 0,06 ммоль) и (R,R)-аминоциклопентан-2-ол (0,100 г; 0,99 ммоль) в диметилсульфоксиде (0,5 мл) нагревают при 130 С в атмосфере азота в течение 72 ч. Неочищенную реакционную смесь очищают, используя препаративную ВЭЖХ (10 59 100% ацетонитрил). Растворитель удаляют в вакууме и сушат в вакууме, получая указанное в заголовке соединение в виде смолы коричневой окраски (0,015 г). ЖХ/МС СИСТЕМА A - Rt = 4,13 мин; ЖХ/МС СИСТЕМА А - m/z 517 (МН+). Пример 61. (2R,3R,4S,5R)-2-[6-Бензиламино-2-(1S-гидроксиметил-2-фенил-этиламино) пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 61 получают аналогично способу, изложенному в примере 23, используя бензиламин (0,003 г; 0,025 ммоль) при 21 С в течение 20 ч и (S)-(-)-2-амино-3-фенил-1 пропанол (0,038 г; 0,25 ммоль) при 130 С в течение 40 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества желтого цвета (0,005 г). ЖХ/МС СИСТЕМА A - Rt = 4,24 мин; ЖХ/МС СИСТЕМА A - m/z 573 (МН+). Пример 62. (2R,3S,4R,5R)-2-(2-Этил-2 Нтетразол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(пирролидин-3R-иламино)пурин 9-ил]-тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 62 получают аналогично способу, изложенному в примере 23, используя(0,004 г; 0,025 ммоль) при 21 С в течение 20 ч и пирролидин-3R-иламин (0,022 г; 0,25 ммоль) при 130 С в течение 40 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества желтого цвета (0,002 г). ЖХ/МС СИСТЕМА A - Rt = 2,28 мин; ЖХ/МС СИСТЕМА А - m/z 552 (МН+). Пример 63. (2R,3R,4S,5R)-2-[6-(1S-Гидроксиметил-2-фенилэтиламино)-2-(2-пиридин-2 ил-этиламино)пурин-9-ил]-5-(2-изопропил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 63 получают аналогично способу, изложенному в примере 23, используя промежуточное соединение 20 (0,012 г; 0,025 ммоль) и (S)-(-)-2-амино-3-фенил-1 пропанол (0,004 г; 0,025 ммоль) при 21 С в течение 20 ч и 2-(2-аминоэтил)пиридин (0,031 г; 0,25 ммоль) при 130 С в течение 40 ч. Указанное в заголовке соединение получают после лиофилизации в виде пены коричневой окраски(0,002 г). ЖХ/МС СИСТЕМА A - Rt = 3,79 мин; ЖХ/МС СИСТЕМА A - m/z 528 (МН+). Пример 64. (2R,3R,4S,5R)-2-[6-(1S-Гидроксиметил-2-фенилэтиламино)-2-(пирролидин 3S-иламино)пурин-9-ил]-5-(2-изопропил-2 Нтетразол-5-ил)тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 64 получают аналогично способу, изложенному в примере 23, используя промежуточное соединение 20 (0,012 г; 0,025 ммоль) и (S)-(-)-2-амино-3-фенил-1 пропанол (0,004 г; 0,025 ммоль) при 21 С в течение 20 ч и неразбавленный пирролидин-3R 001714 60 иламин (0,021 г; 0,25 ммоль) при 130 С в течение 14 ч. Указанное в заголовке соединение получают после лиофилизации в виде пены коричневой окраски (0,002 г). Масс-спектр(MH+ для С 26 Н 35N11O4). Пример 65. (2R,3R,4S,5R)-2-[2-(1-Бензилпирролидин-3-иламино)-6-(1-этилпропиламино) пурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 65 получают аналогично способу, изложенному в примере 23, используя 1-этилпропиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и 1-бензил-3 аминопирролидин (0,044 г; 0,25 ммоль) при 120 С в течение 60 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества желто-коричневой окраски (0,002 г). ЖХ/МС СИСТЕМА A - Rt = 3,73 мин; ЖХ/МС СИСТЕМА A - m/z 578 (МН+). Пример 66. (2R,3R,4S,5R)-2-[2-(1-Бензилпирролидин-3-иламино)-6-циклопентиламинопурин-9-ил]-5-(2-этил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 66 получают аналогично способу, изложенному в примере 23, используя циклопентиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и 1-бензил-3-аминопирролидин (0,044 г; 0,25 ммоль) при 120 С в течение 60 ч. Указанное в заголовке соединение получают после лиофилизации в виде твердого вещества желто-коричневой окраски (0,002 г). ЖХ/МС СИСТЕМА А - Rt = 3,73 мин; ЖХ/МС СИСТЕМА А - m/z 578 (MH+). Пример 67. (2R,3R,4S,5R)-2-[2-(транс-4 Аминоциклогексиламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(2-изопропил-2 Н-тетразол-5 ил)тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 67 получают аналогично способу, изложенному в примере 23, используя промежуточное соединение 20 (0,012 г; 0,025 ммоль) и 1-этилпропиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и транс-1,4 диаминоциклогексан (0,029 г; 0,25 ммоль) при 120 С в течение 14 ч. Указанное в заголовке соединение получают после лиофилизации в виде пены коричневой окраски (0,002 г). ЖХ/МС СИСТЕМА А - Rt = 3,47 мин; ЖХ/МС СИСТЕМА А - m/z 530 (МН+). Пример 68. (2R,3R,4S,5R)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-ил-этиламино)пурин-9-ил]-5-(2-изопропил-2 Н-тетразол-5-ил)тетрагидрофуран-3,4-диола бис(формиат). Соединение примера 68 получают аналогично способу, изложенному в примере 23, используя промежуточное соединение 20 (0,012 г; 0,025 ммоль) и 1-этилпропиламин (0,002 г; 0,025 ммоль) при 21 С в течение 20 ч и 2-пиперидиноэтиламин (0,032 г; 0,25 ммоль) при 120 С в течение 14 ч. Указанное в заголовке соединение
МПК / Метки
МПК: C07H 19/167, A61P 11/06, A61K 31/7064, C07D 473/00
Метки: производные, 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола
Код ссылки
<a href="https://eas.patents.su/30-1714-proizvodnye-2-purin-9-il-tetragidrofuran-34-diola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола</a>
Предыдущий патент: Соединения, полезные для использования в качестве нейрозащитных средств
Следующий патент: Гидрат n-(4-ацетил-1-пиперазинил)-4-фторбензамида
Случайный патент: Повторно закрываемый сливной элемент для комбинированных картонно-пластиковых упаковок


































