Производные пиридазинона
Номер патента: 16782
Опубликовано: 30.07.2012
Авторы: Блаукат Андре, Штибер Франк, Шадт Оливер, Дорш Дитер
Формула / Реферат
1. Соединения формулы I
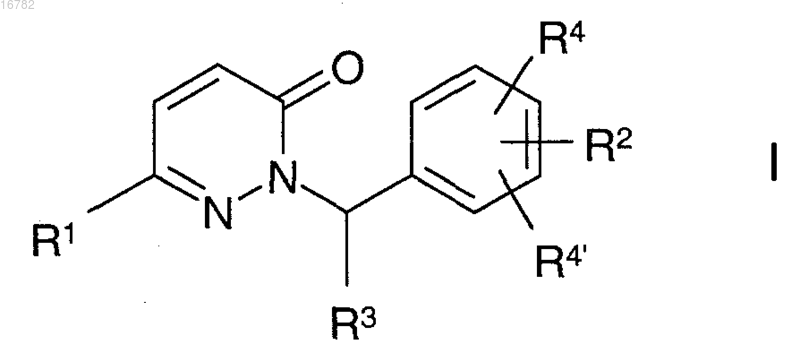
в которой R1 представляет собой Ar или Het,
R2 представляет собой пиримидинил, пиридазинил, пиридинил, 1,3-оксазинанил, морфолинил, пиперидинил или пиперазинил, каждый из которых является незамещенным или моно-, ди- или тризамещенным Hal, A, [C(R3)2]nOR3, N=CR3N(R3)2, CN, COOR3, [C(R3)2]nN(R3)2, [C(R3)2]nHet, O[C(R3)2]pOR3, O[C(R3)2]nN(R3)2, O[C(R3)2]nCºC[C(R3)2]nN(R3)2, O[C(R3)2]nN+O-(R3)2, O[C(R3)2]nHet, NR3[C(R3)2]nN(R3)2) NR3[C(R3)2]nHet, [C(R3)2]nNHCO[C(R3)2]nN(R3)2, [C(R3)2]nNHCO[C(R3)2]nHet, CONR3[C(R3)2]nN(R3)2, CONR3[C(R3)2]nNR3COOA, CONR3[C(R3)2]nOR3, CONR3[C(R3)2]nHet, COHet, CH=CH-COOR3, CH=CH-N(R3)2 и/или =O (карбонильным кислородом),
R3 представляет собой Н, метил, этил или пропил,
R4, R4' представляют собой Н,
Ar представляет собой фенил, нафтил или бифенил, каждый из которых является незамещенным или моно-, ди- или тризамещенным A, Hal, CN, S(O)mA, NR3COA, CON(R3)2, O[C(R3)2]nN(R3)2, [C(R3)2]nOR3, CONR3[C(R3)2]nN(R3)2 и/или CONR3[C(R3)2]nHet,
Het представляет собой пиперидинил, пиперазинил, пирролидинил, морфолинил, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримидинил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиразинил, бензимидазолил, бензотриазолил, индолил, бензо-1,3-диоксолил, индазолил, азабицикло[3.2.1]октил, азабицикло[2.2.2]октил, имидазолидинил, азепанил или бензо-2,1,3-тиадиазолил, каждый из которых является незамещенным или моно-, ди-, три-, тетра- или пентазамещенным А, СНО, COOR3, CON(R3)2, [C(R3)2]nHet1, [C(R3)2]nOR3, [C(R3)2]nN(R3)2, O[C(R3)2]nHet1 и/или =O (карбонильным кислородом),
и где атом азота цикла может быть окисленным,
Het1 представляет собой пирролидин, пиперидин, пиперазин или морфолин,
каждый из которых является незамещенным или моно- или дизамещенным А и/или =O (карбонильным кислородом), А представляет собой неразветвленный или разветвленный алкил,
содержащий 1-8 С атомов, в котором 1-7 Н атомов может быть замещено F и/или Cl,
Hal представляет собой F, Cl, Br или I,
m представляет собой 0, 1 или 2,
n представляет собой 0, 1, 2, 3 или 4,
р представляет собой 1, 2, 3 или 4;
и их фармацевтически пригодные сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях.
2. Соединения по п. 1, выбранные из группы

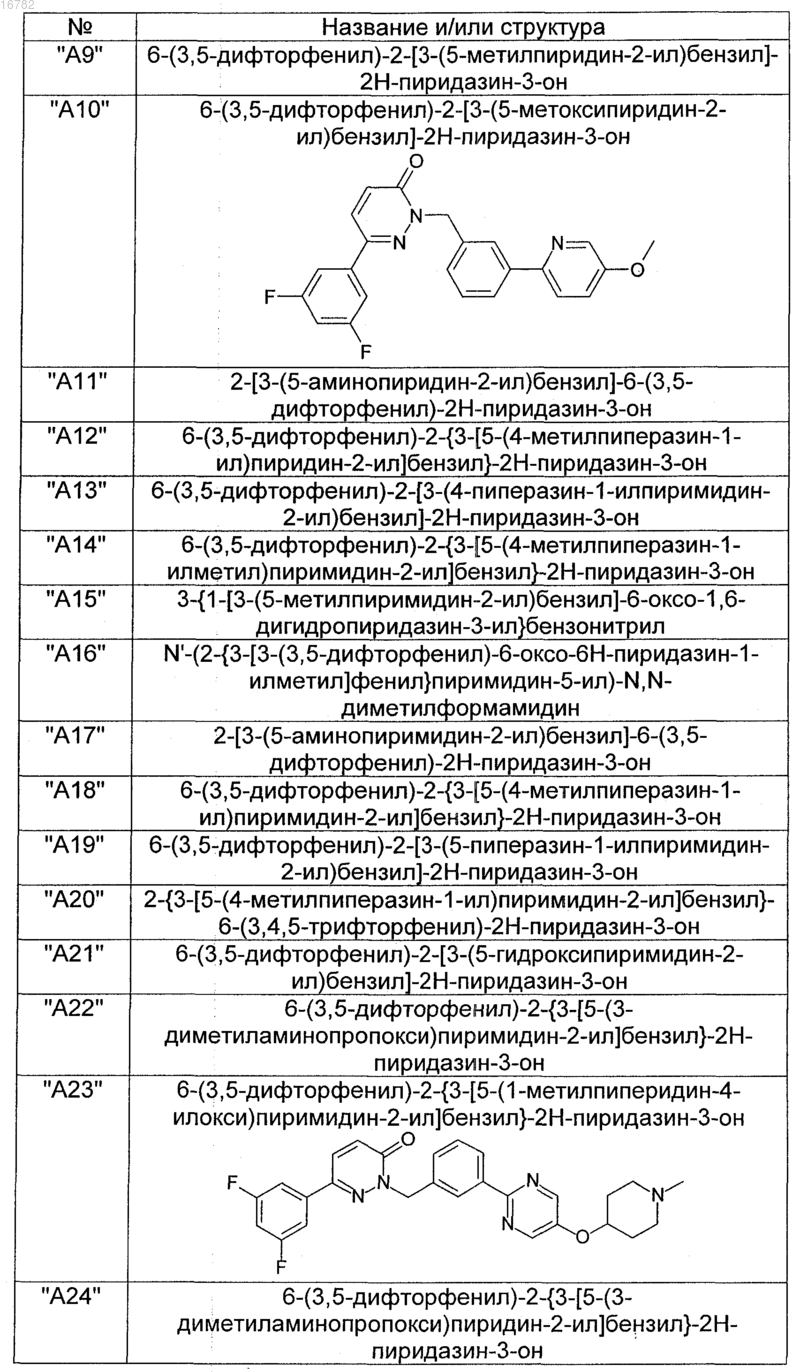
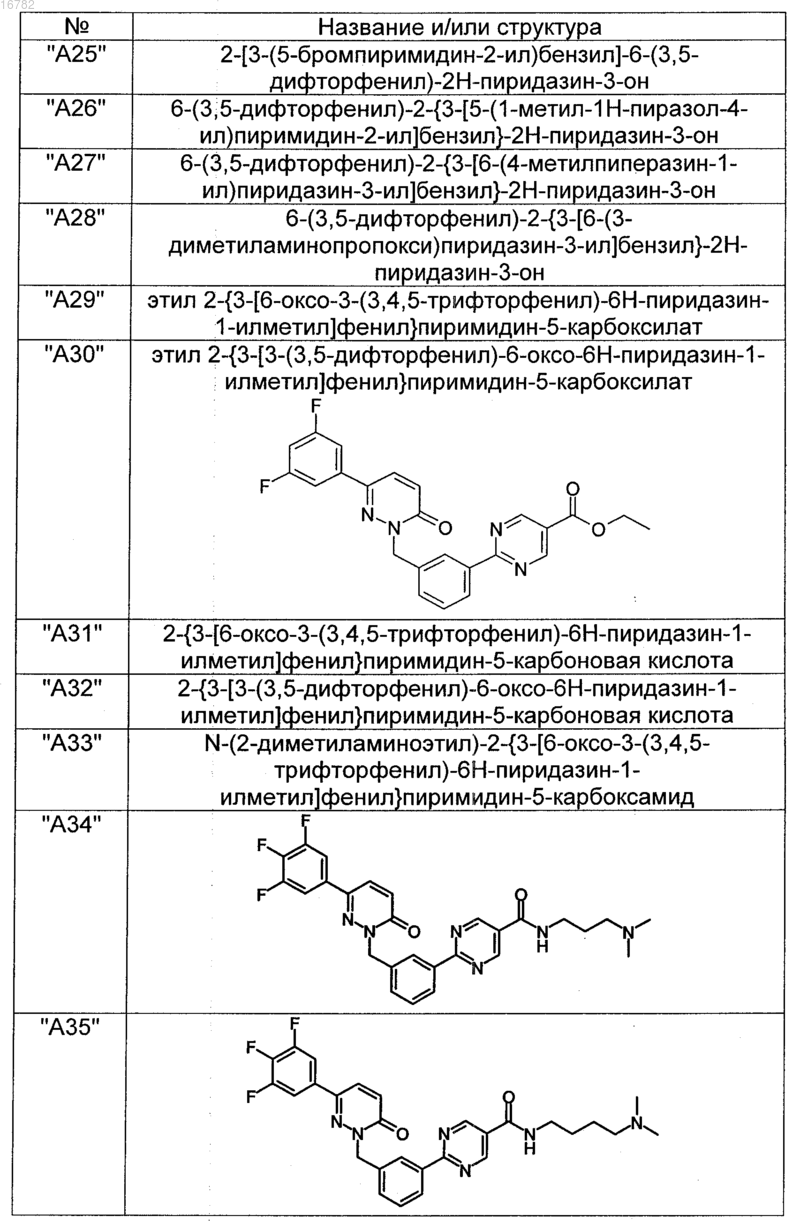
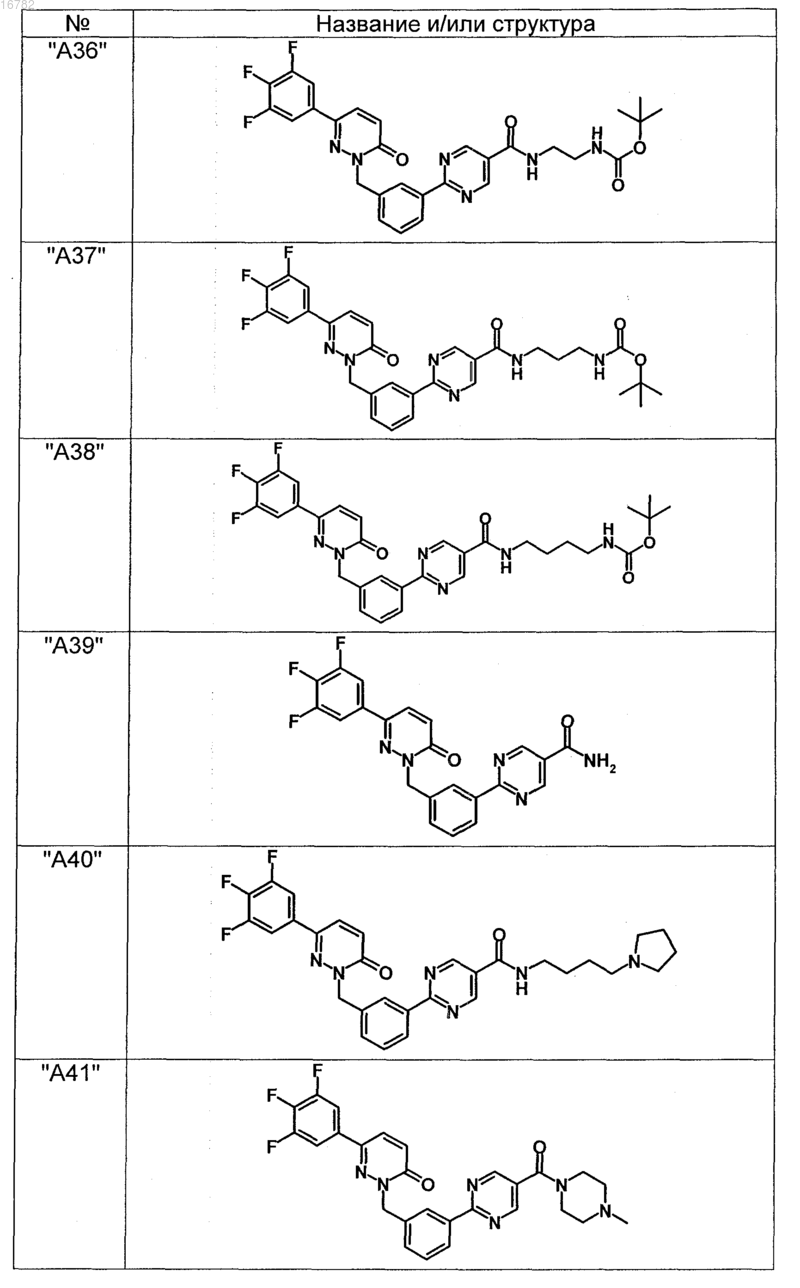
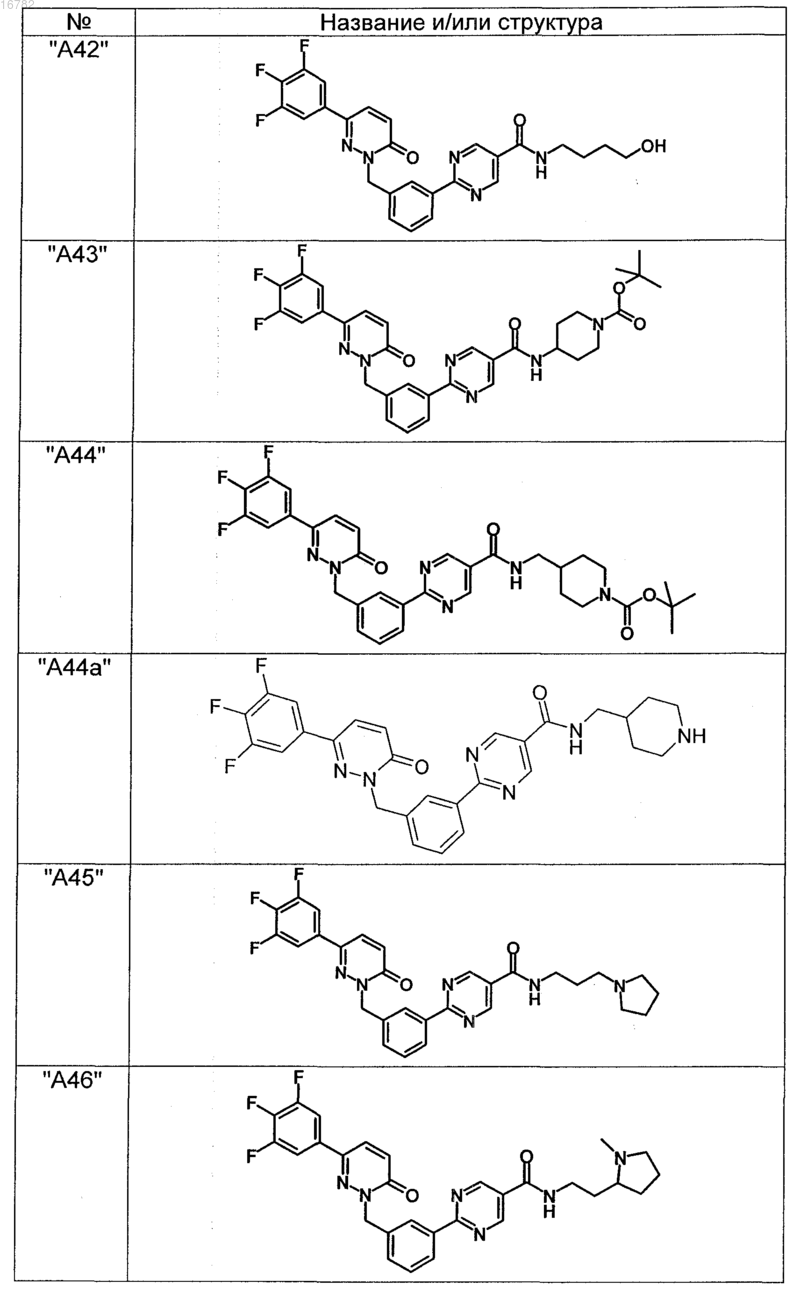
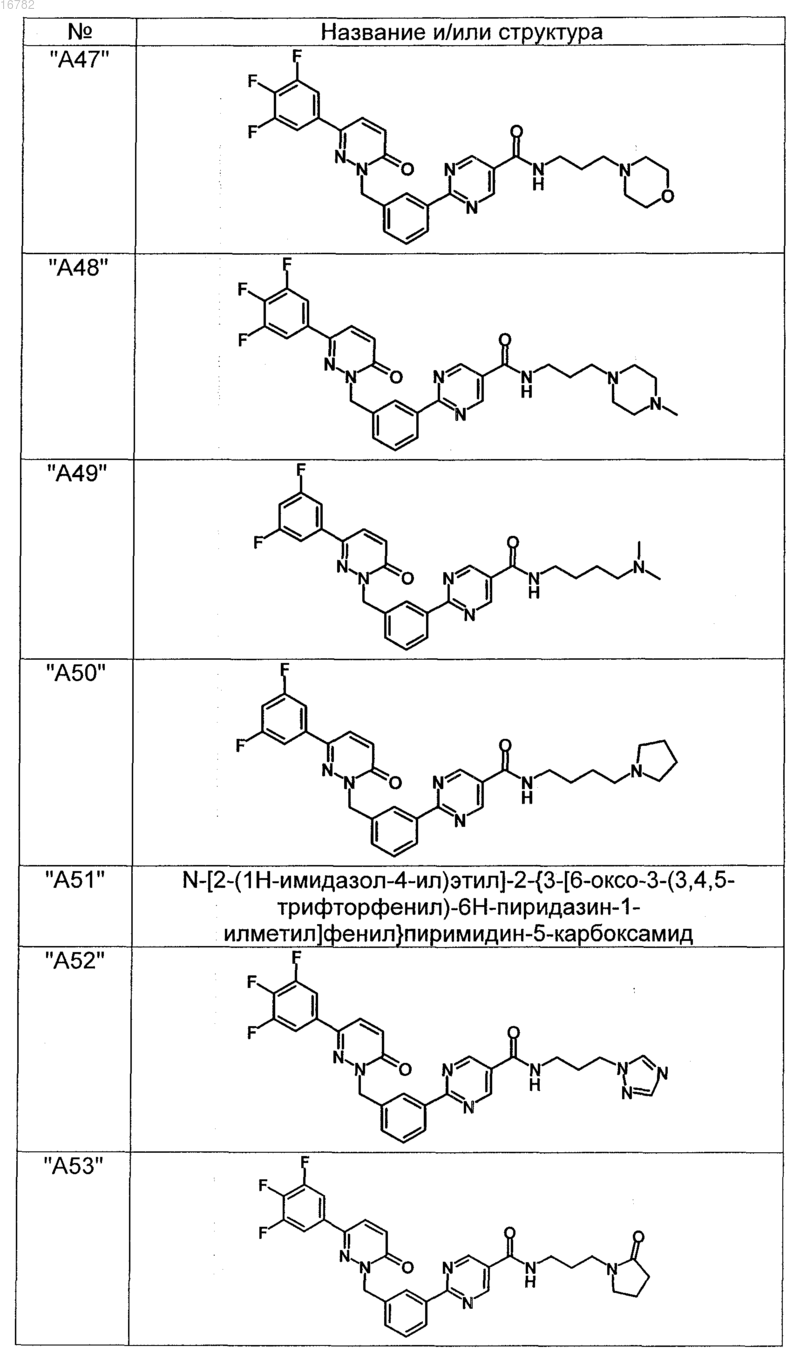
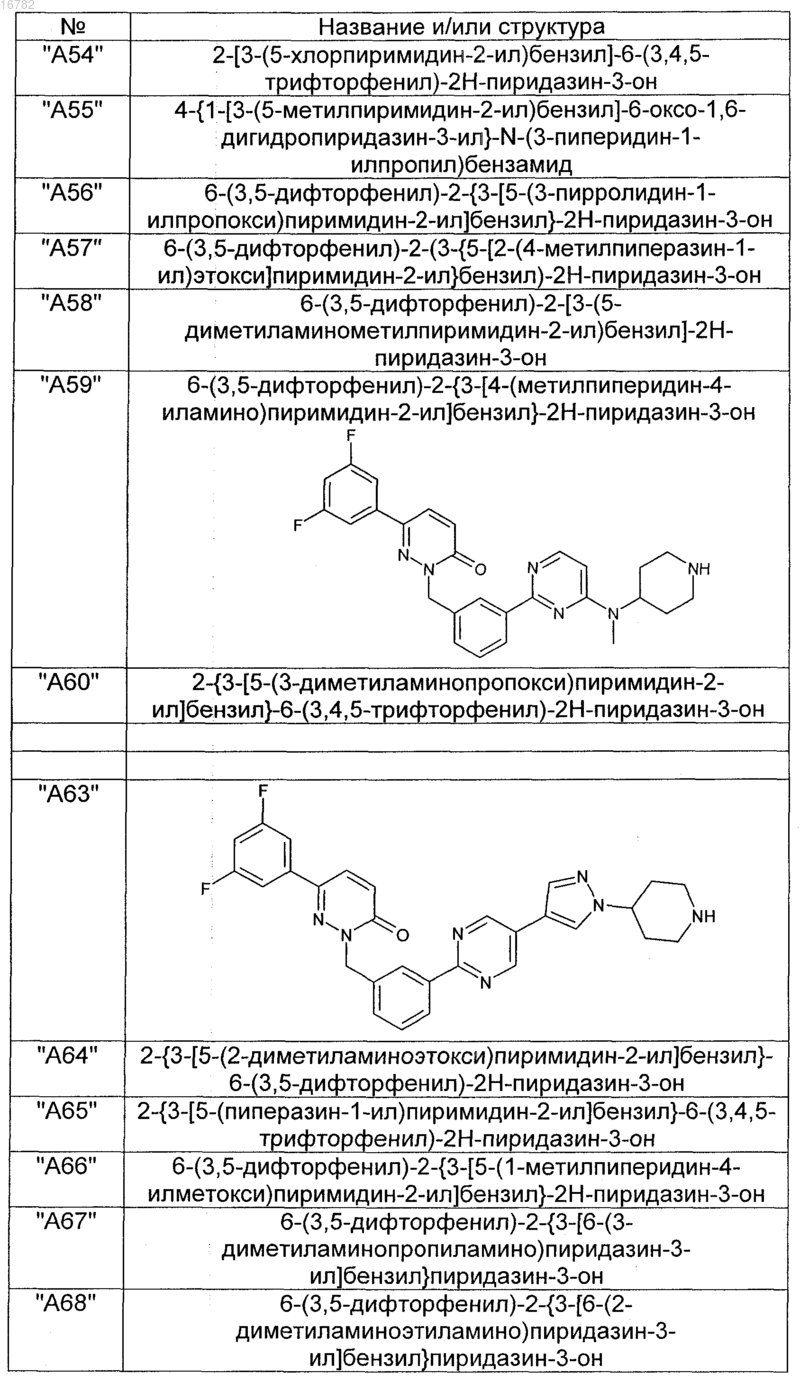
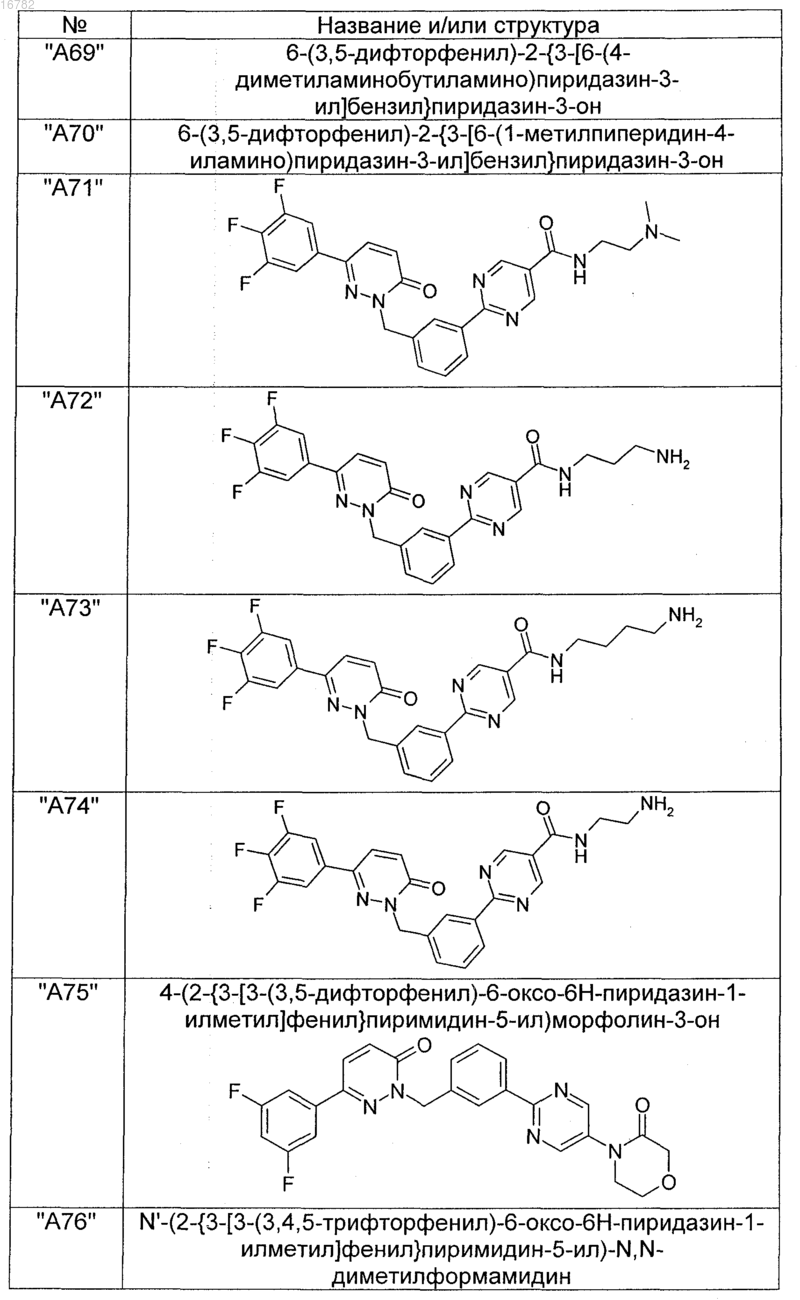

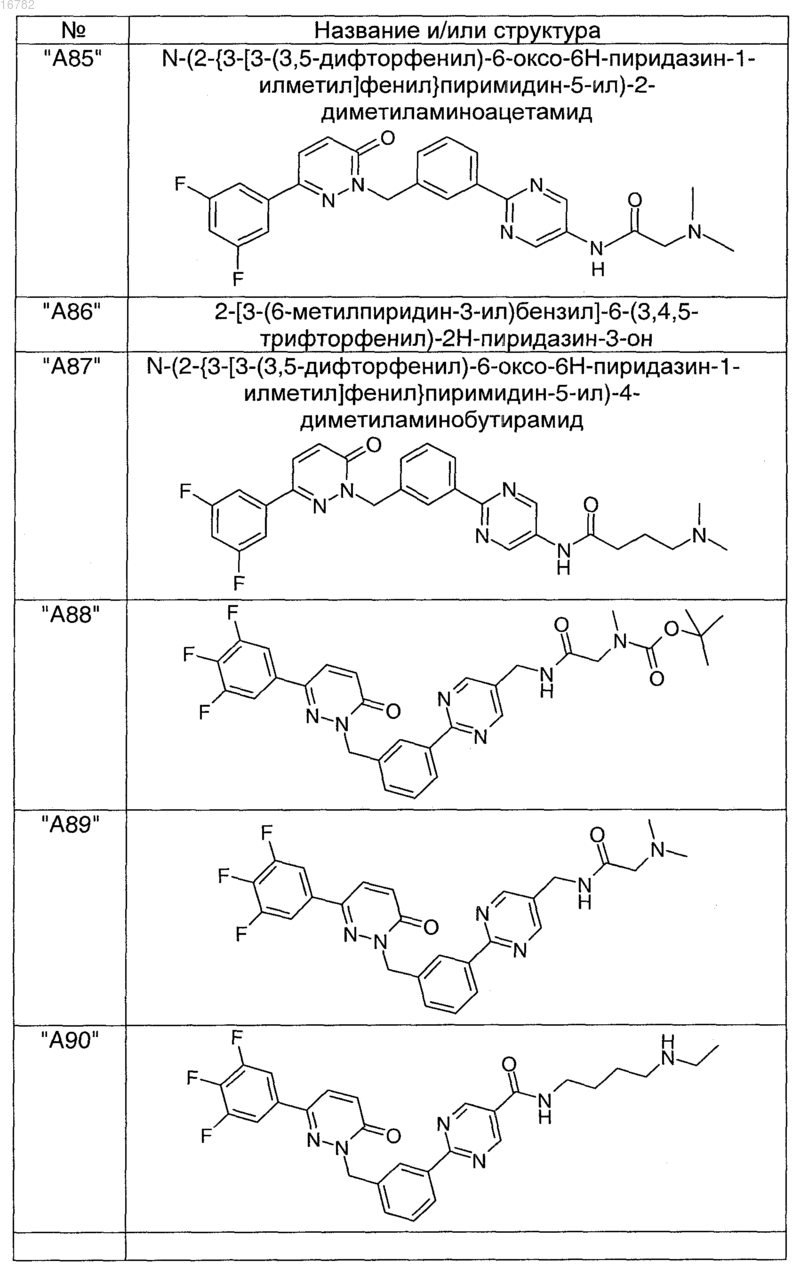
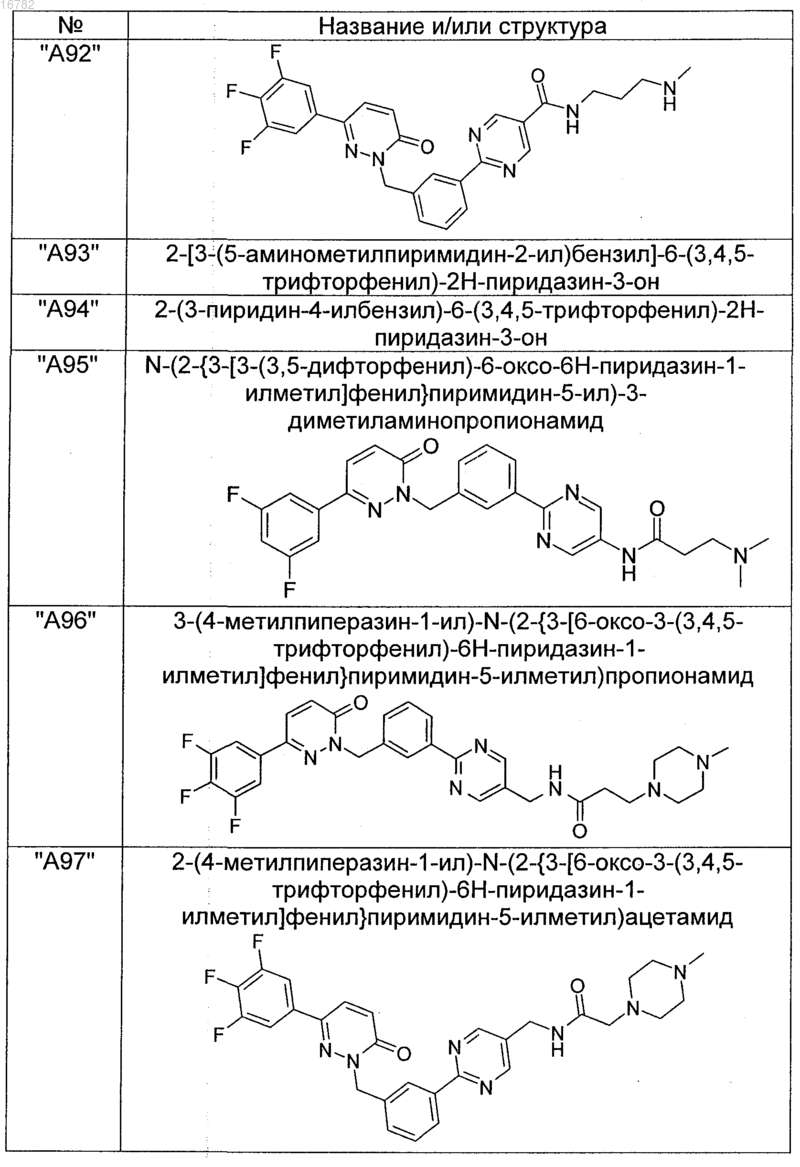

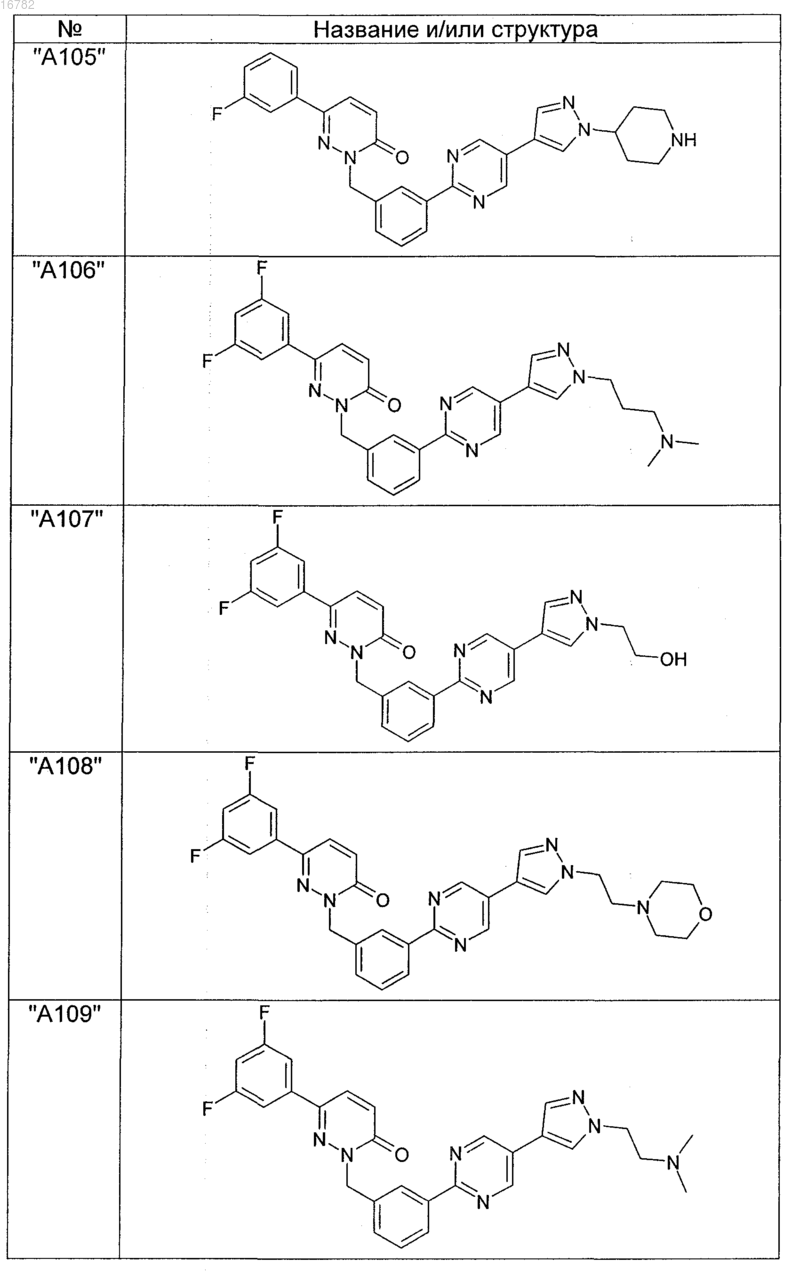


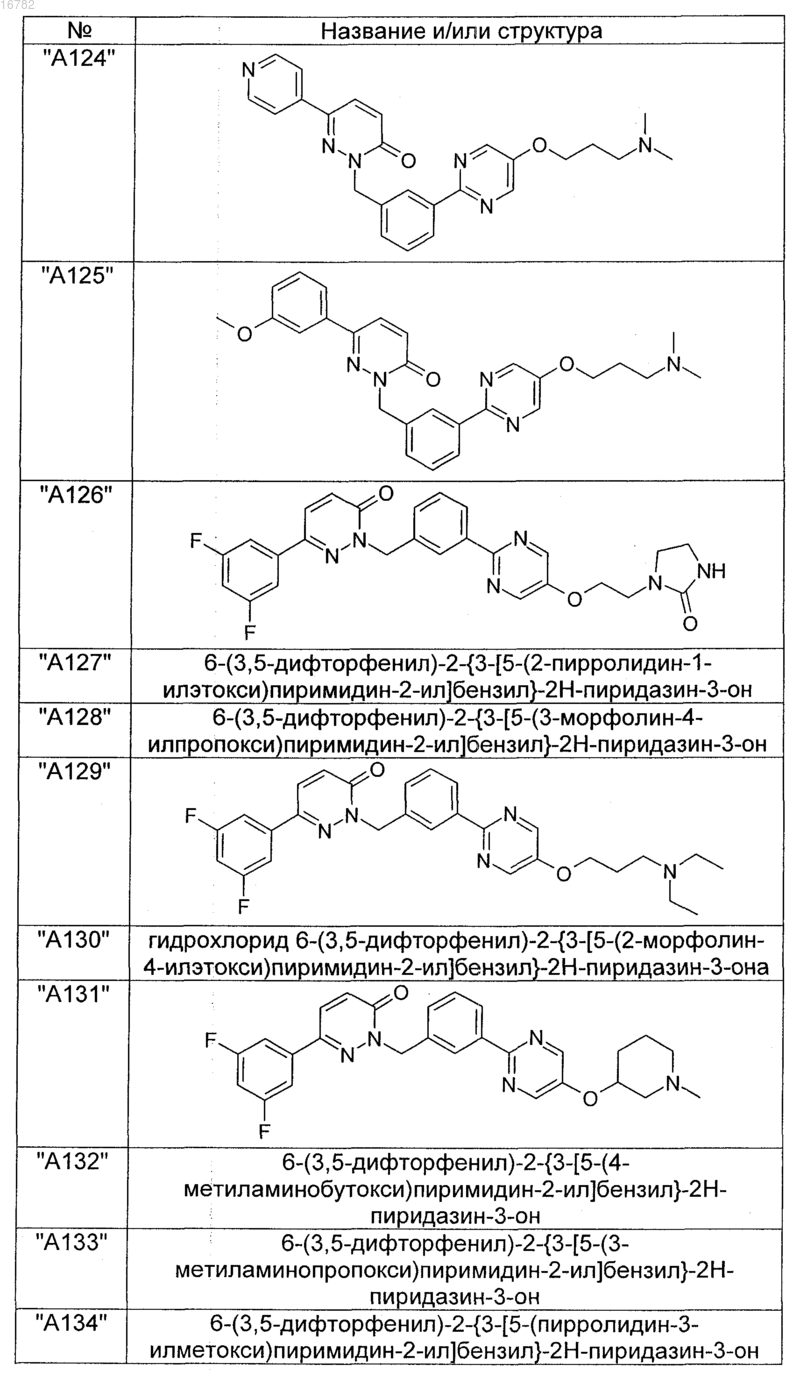
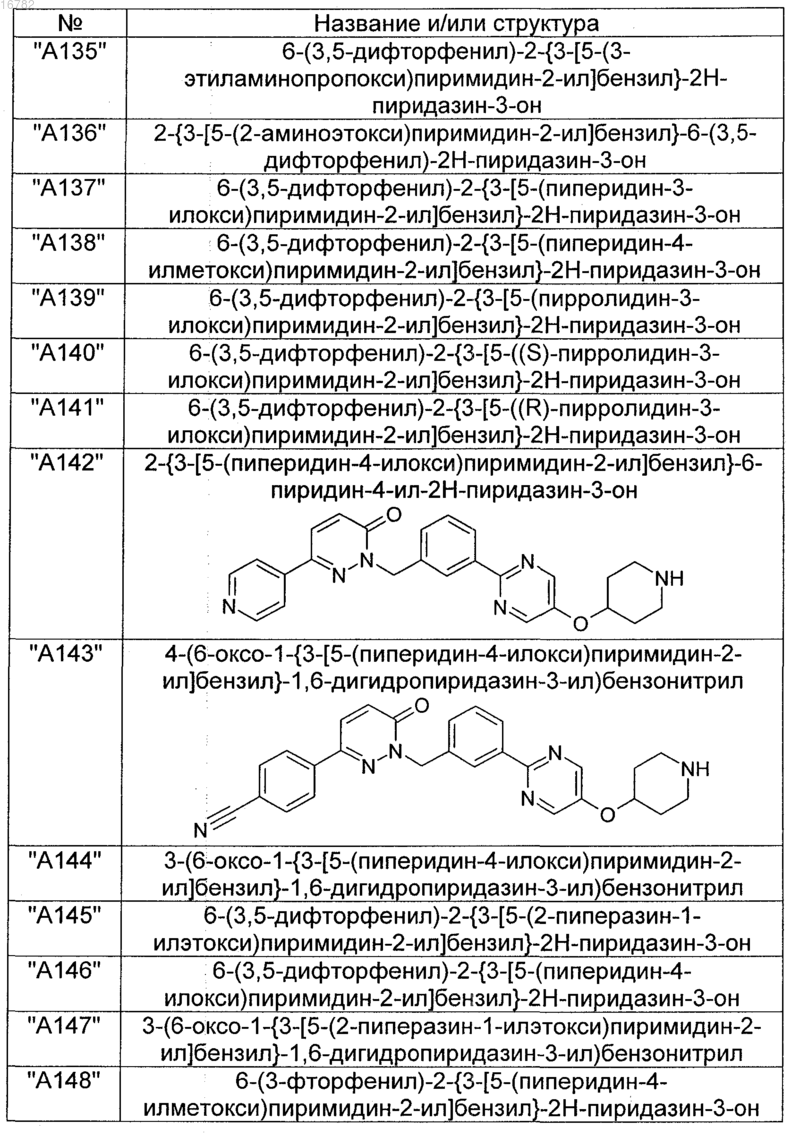
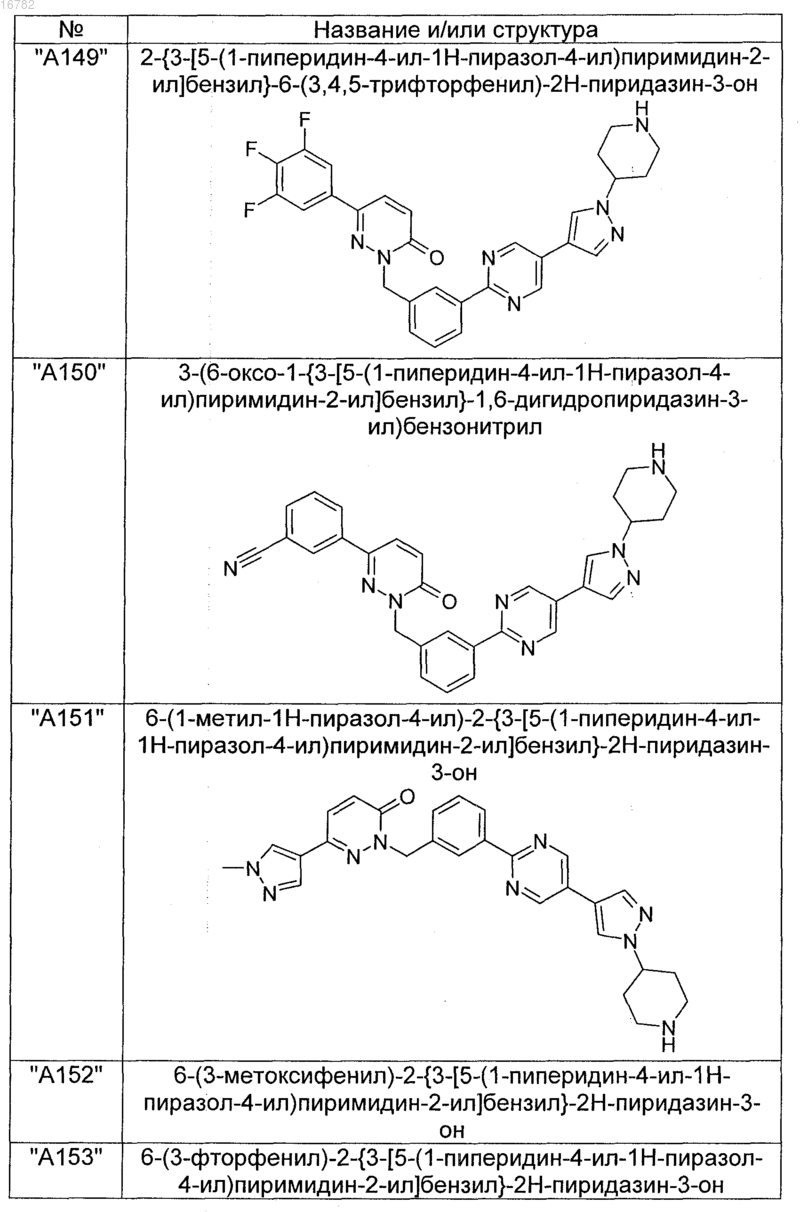
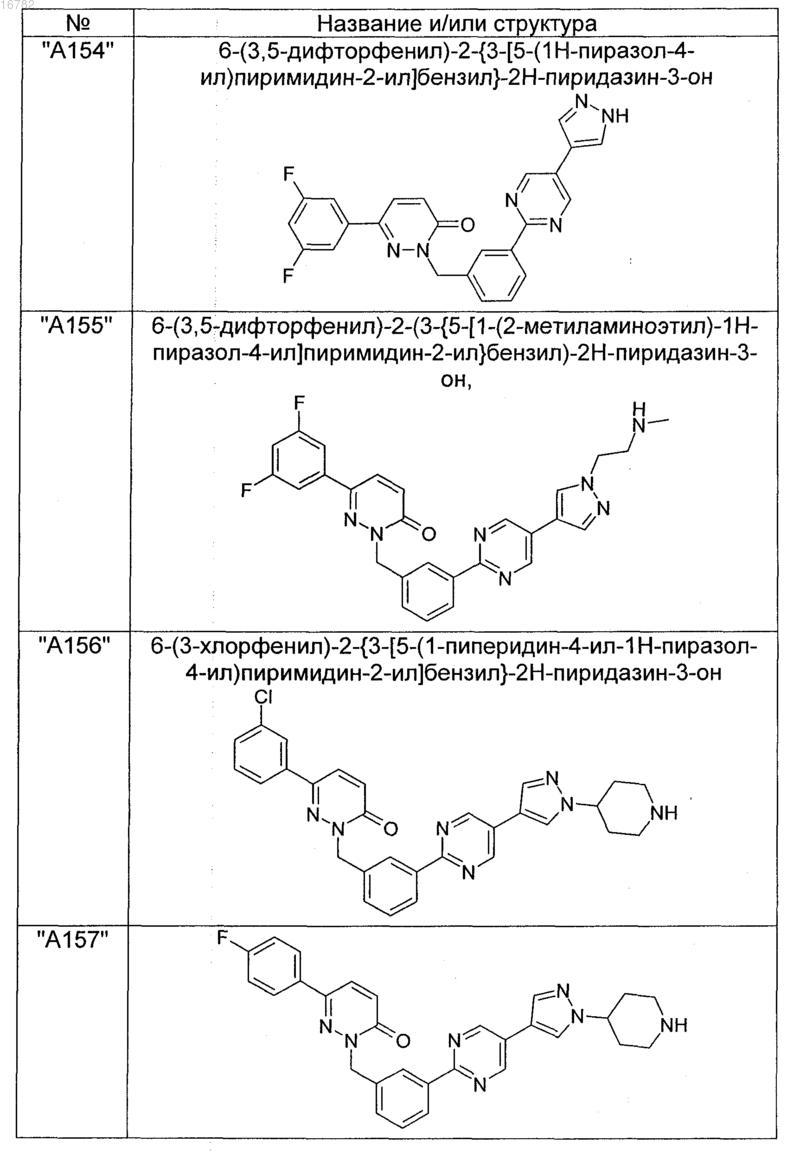
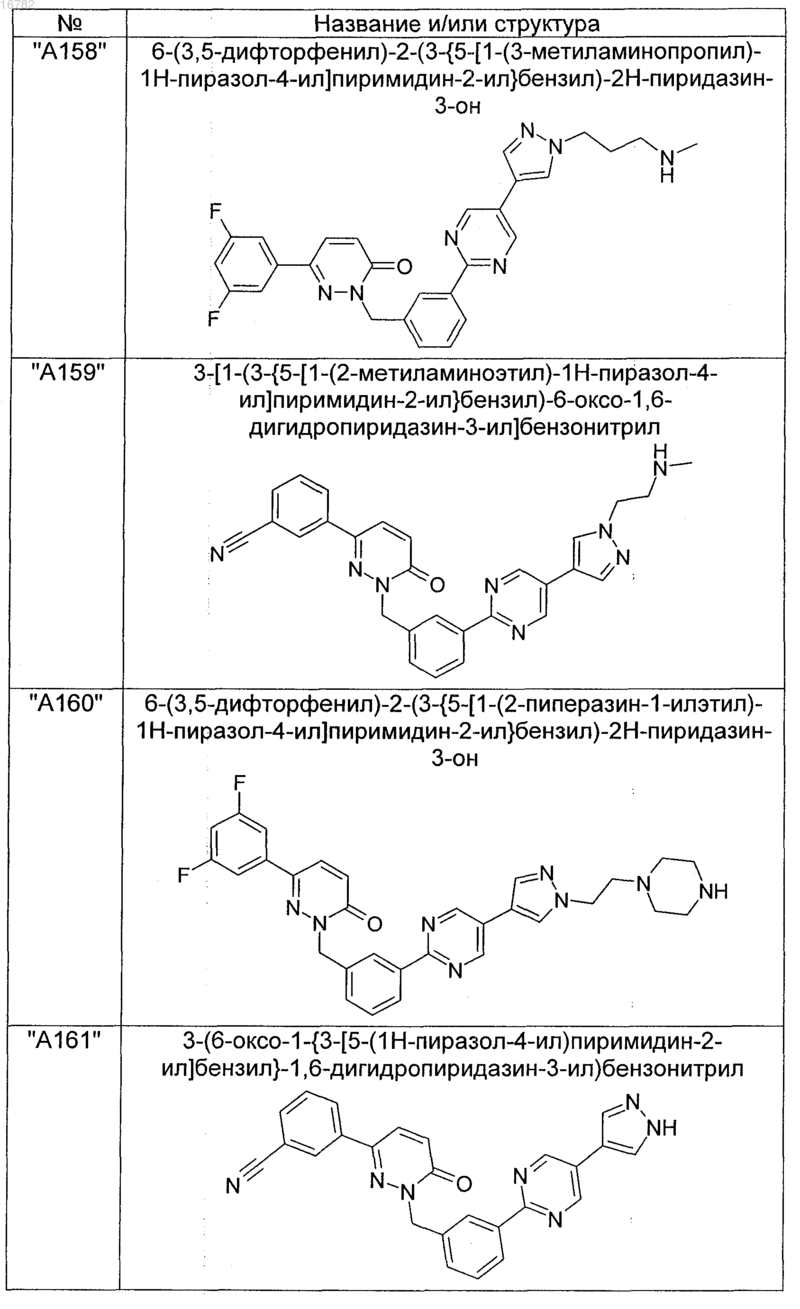

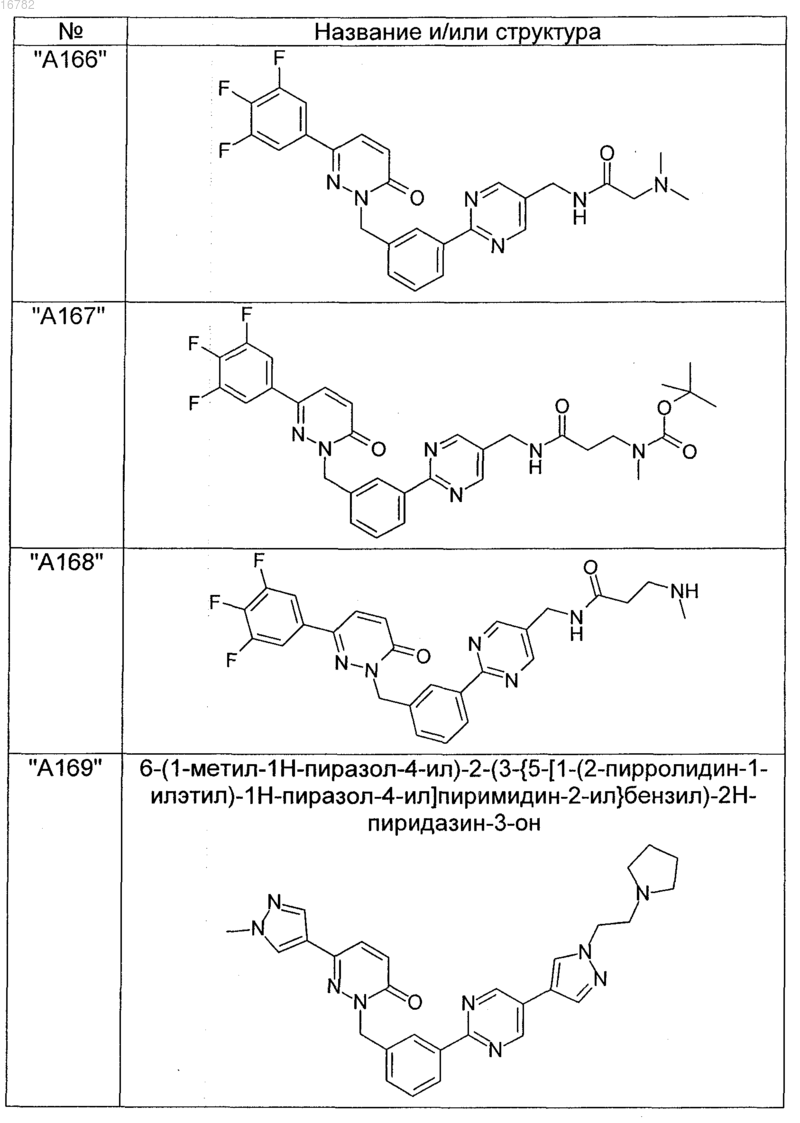
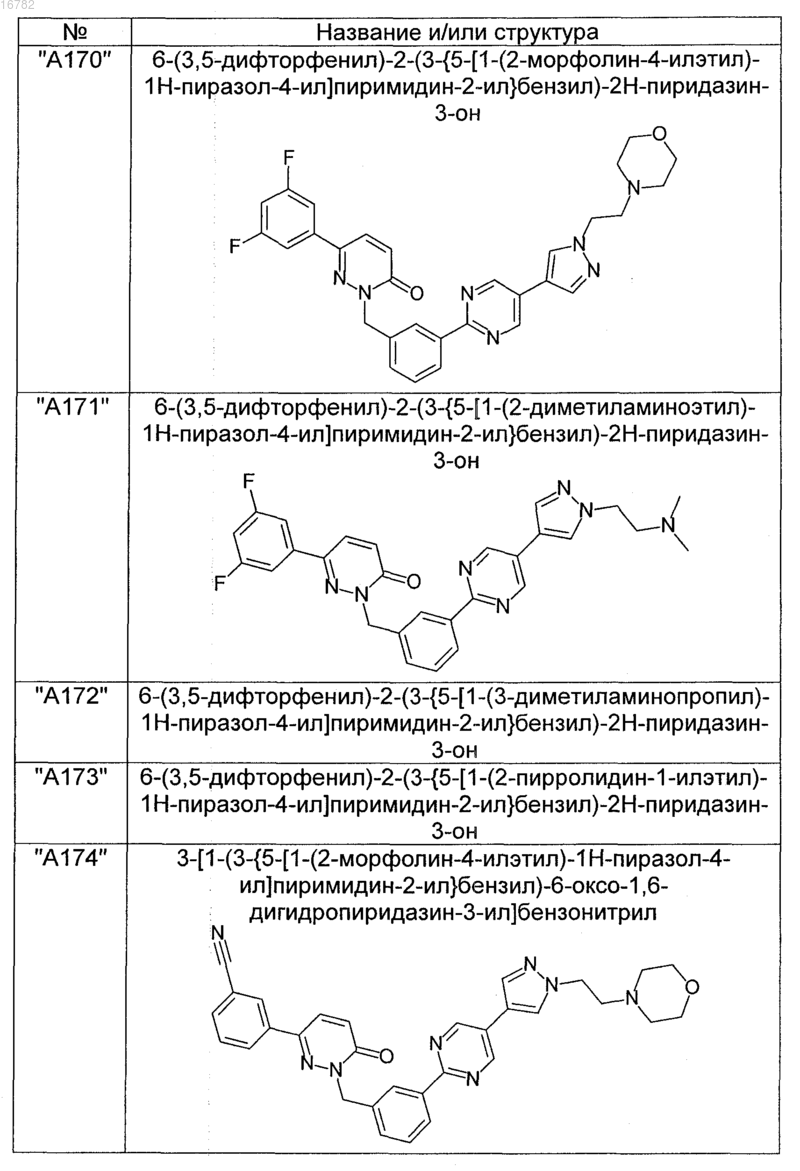

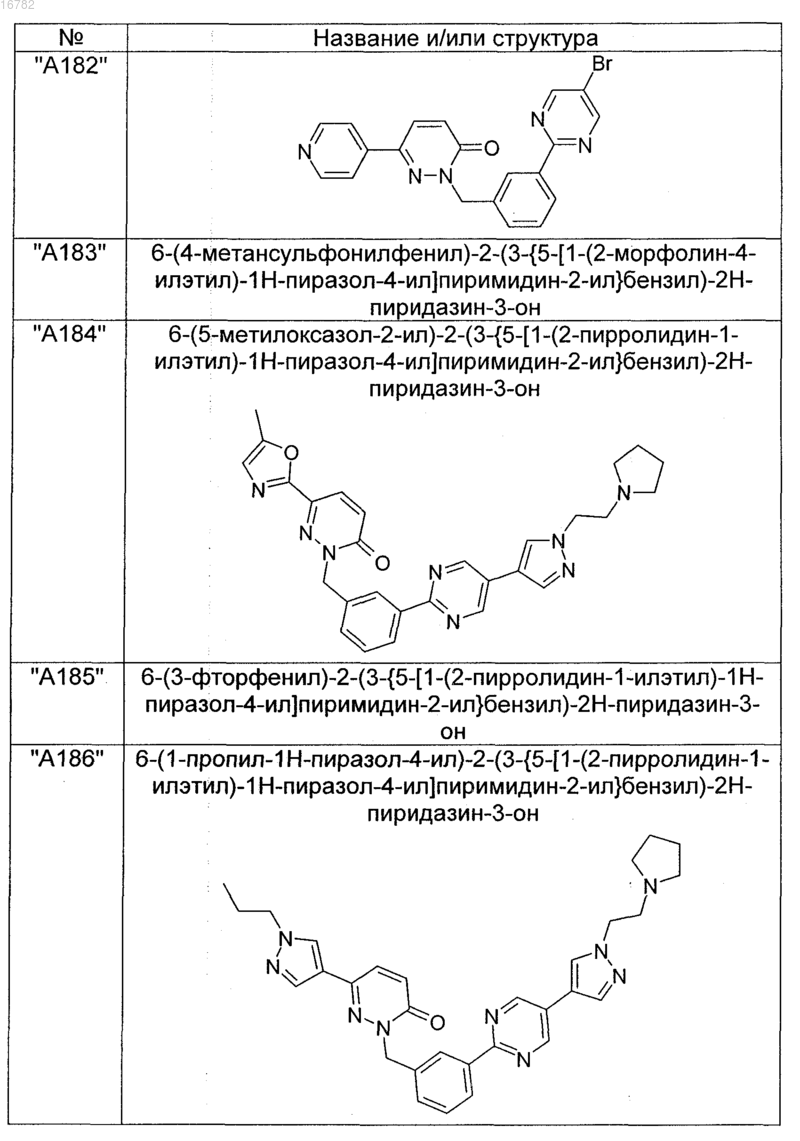
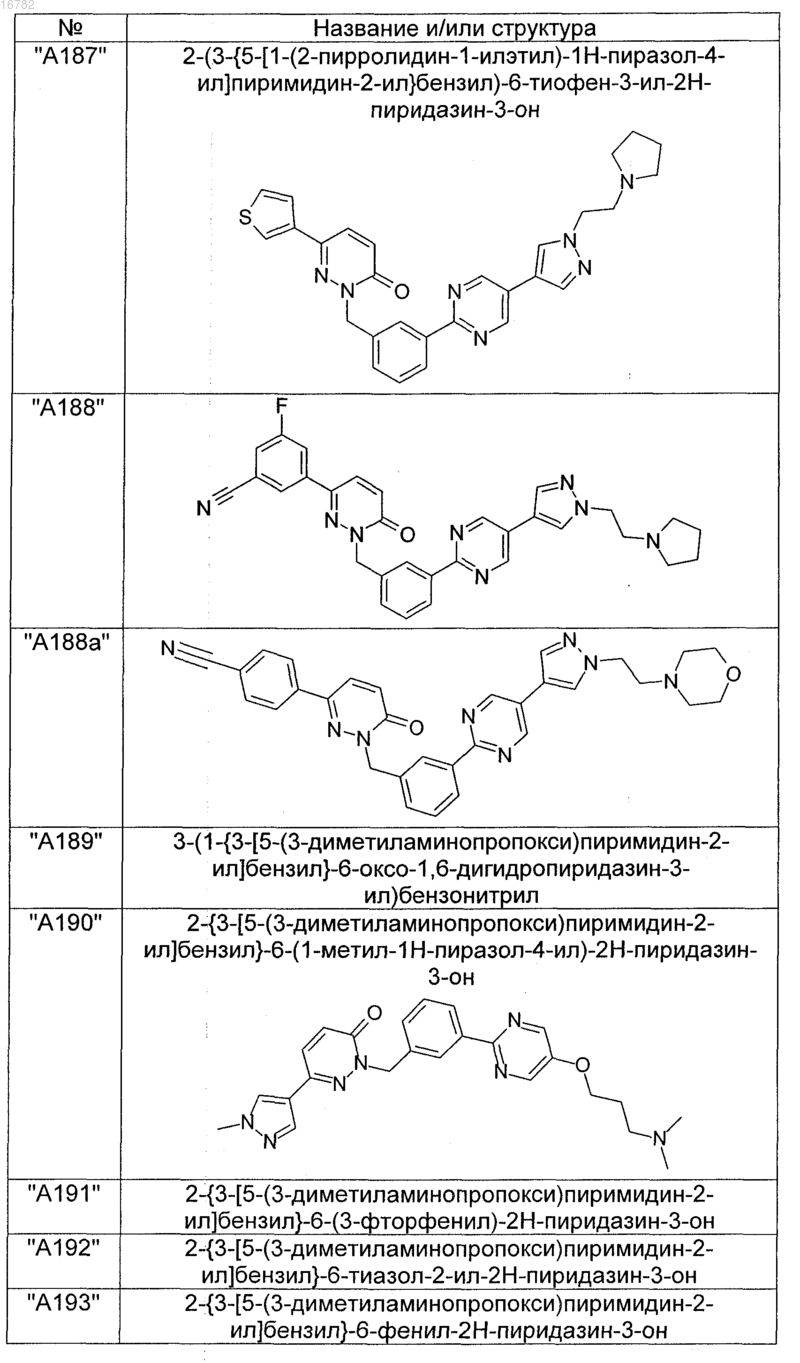

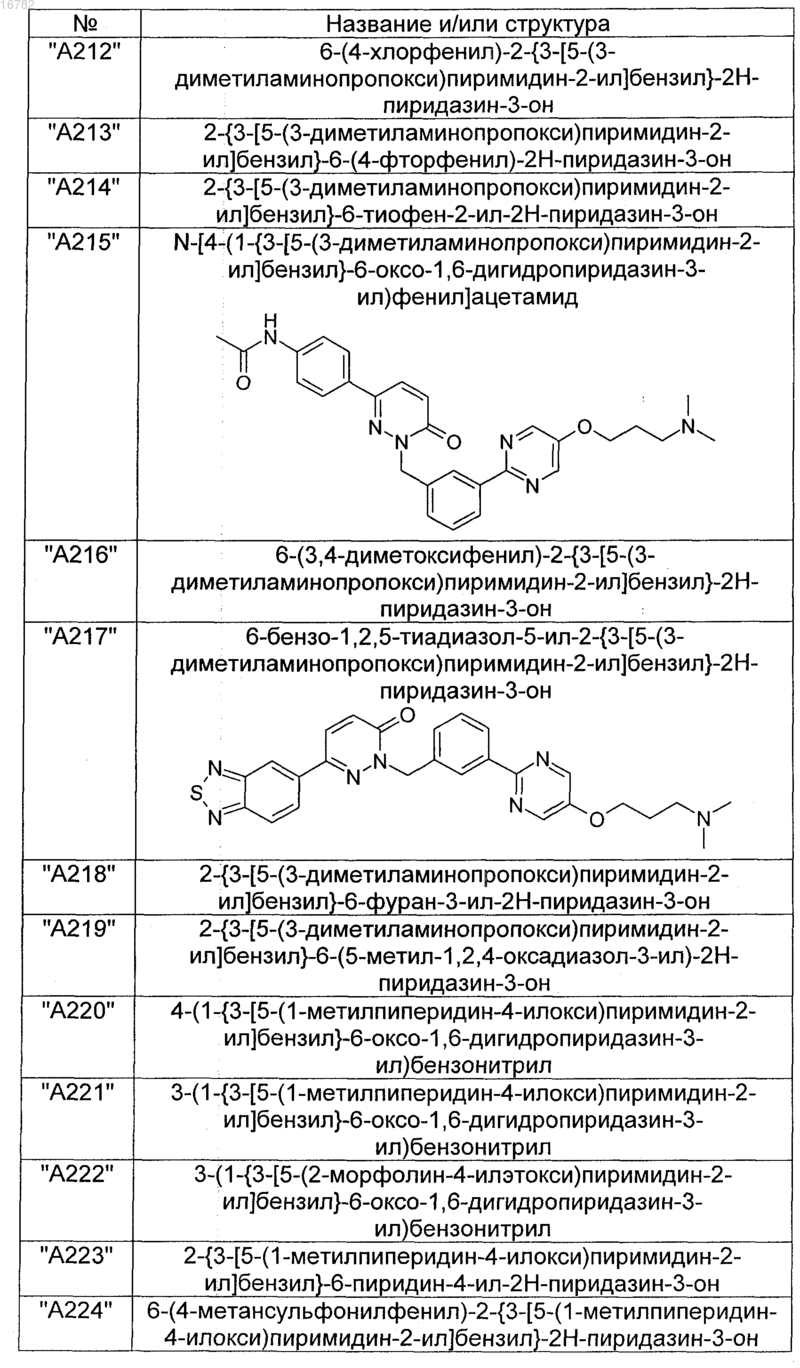

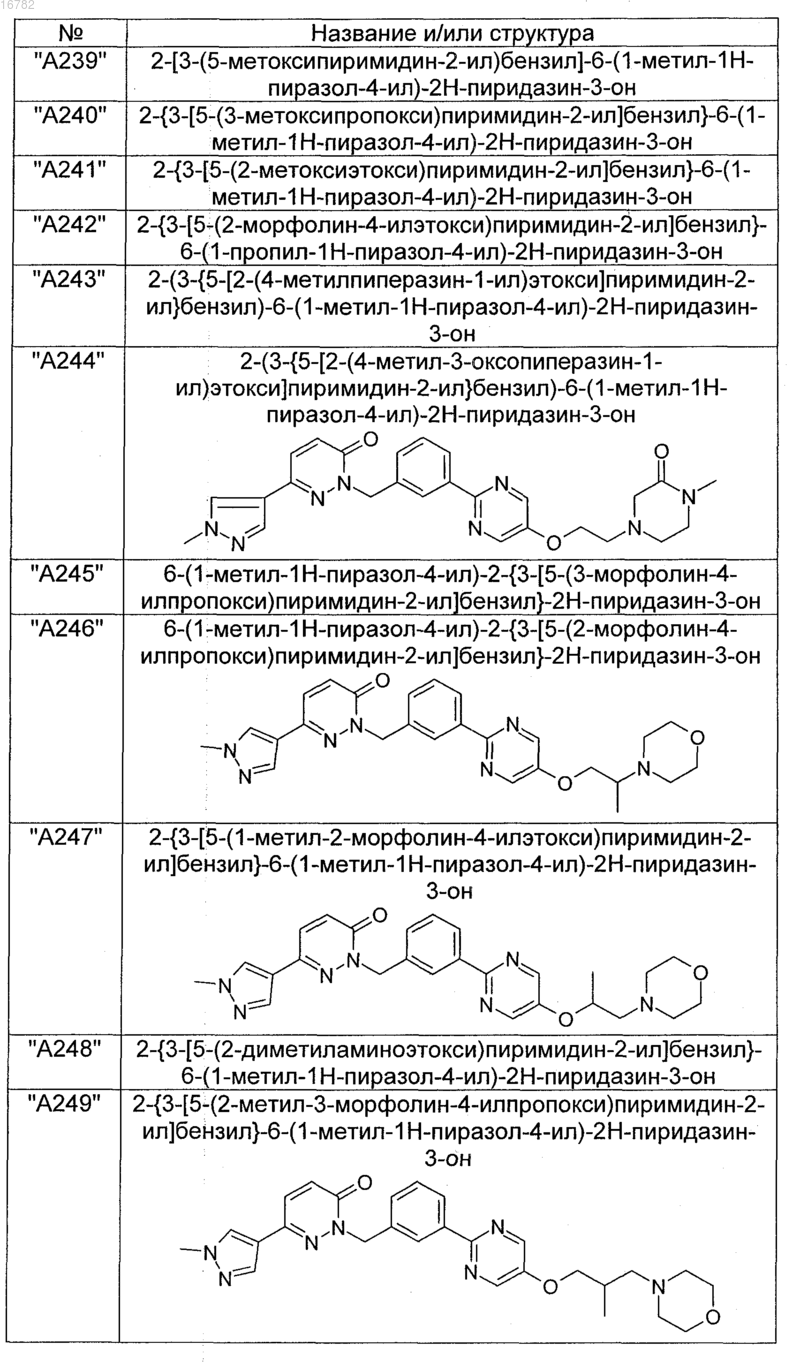
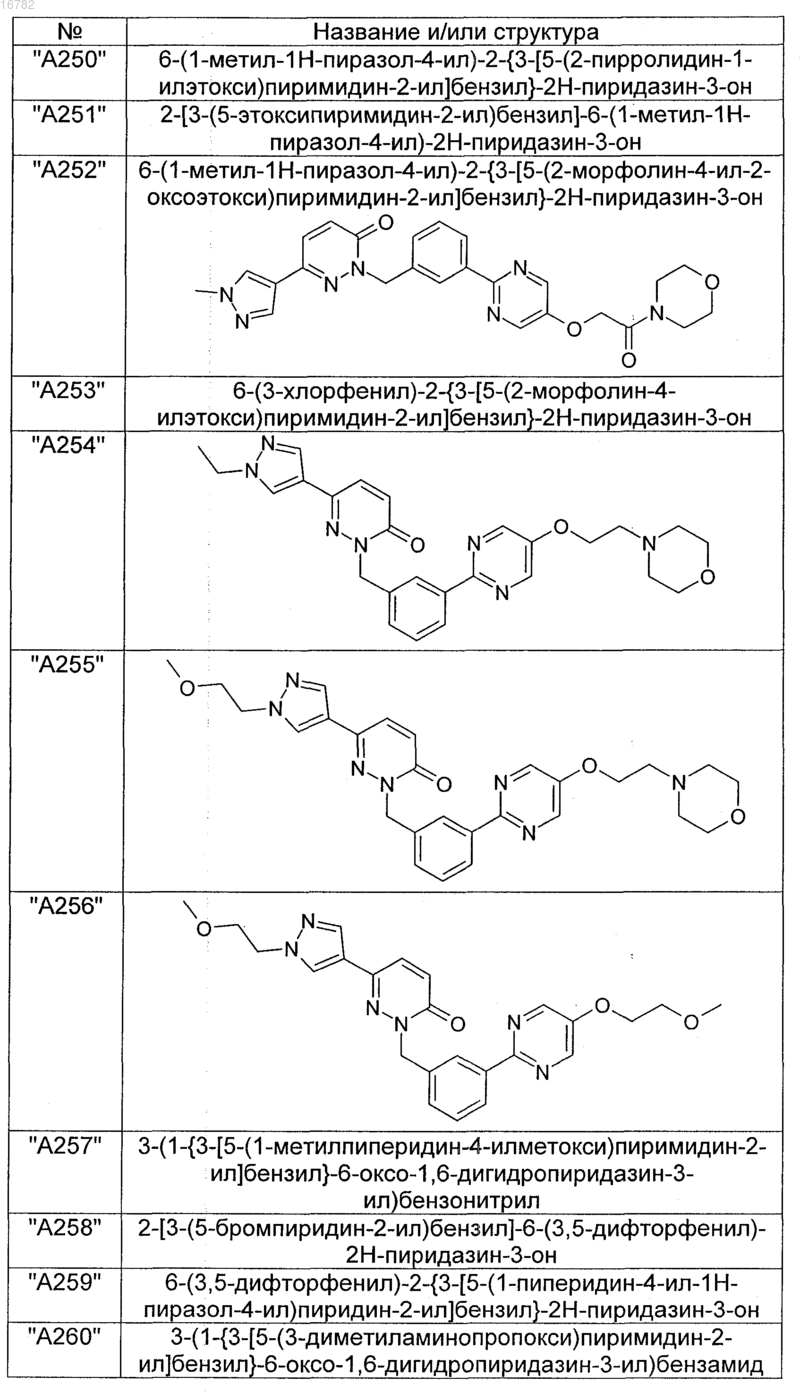
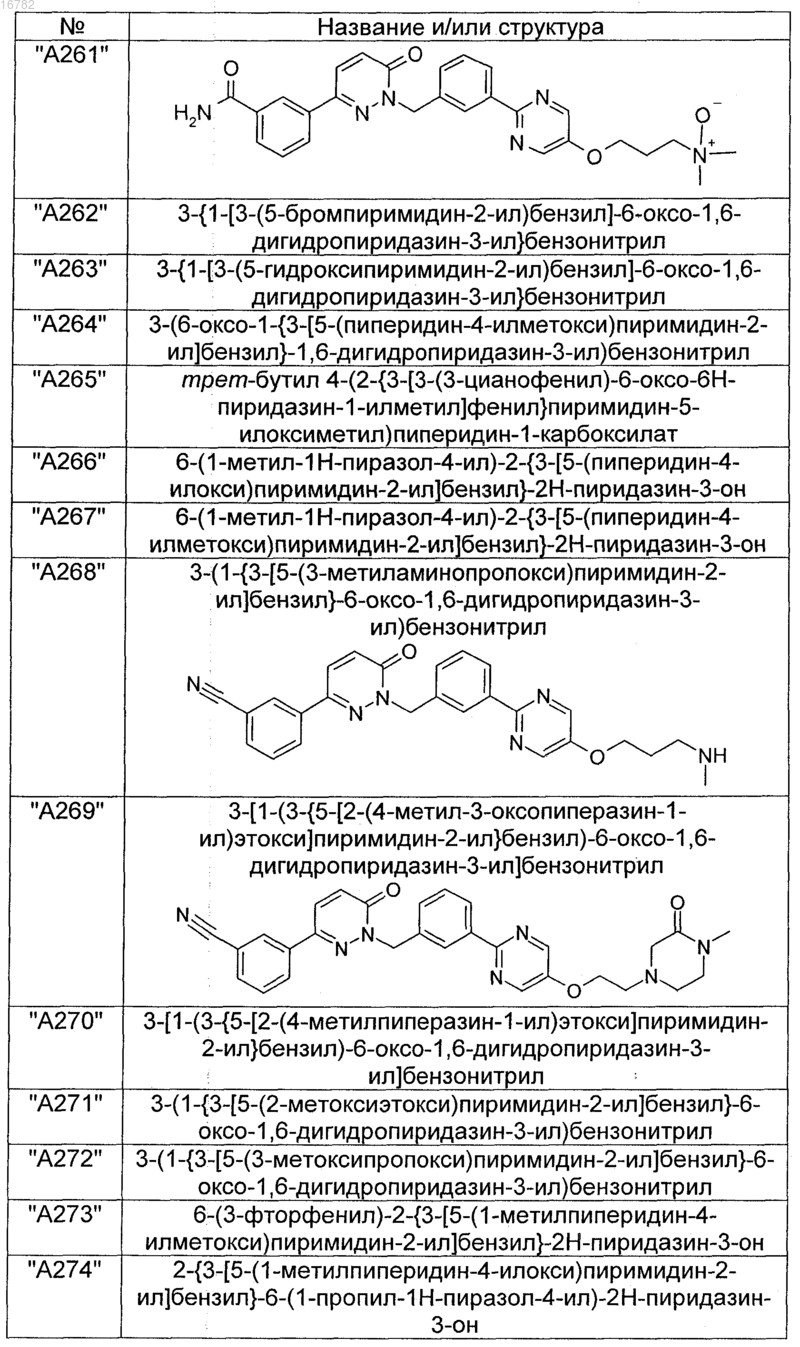
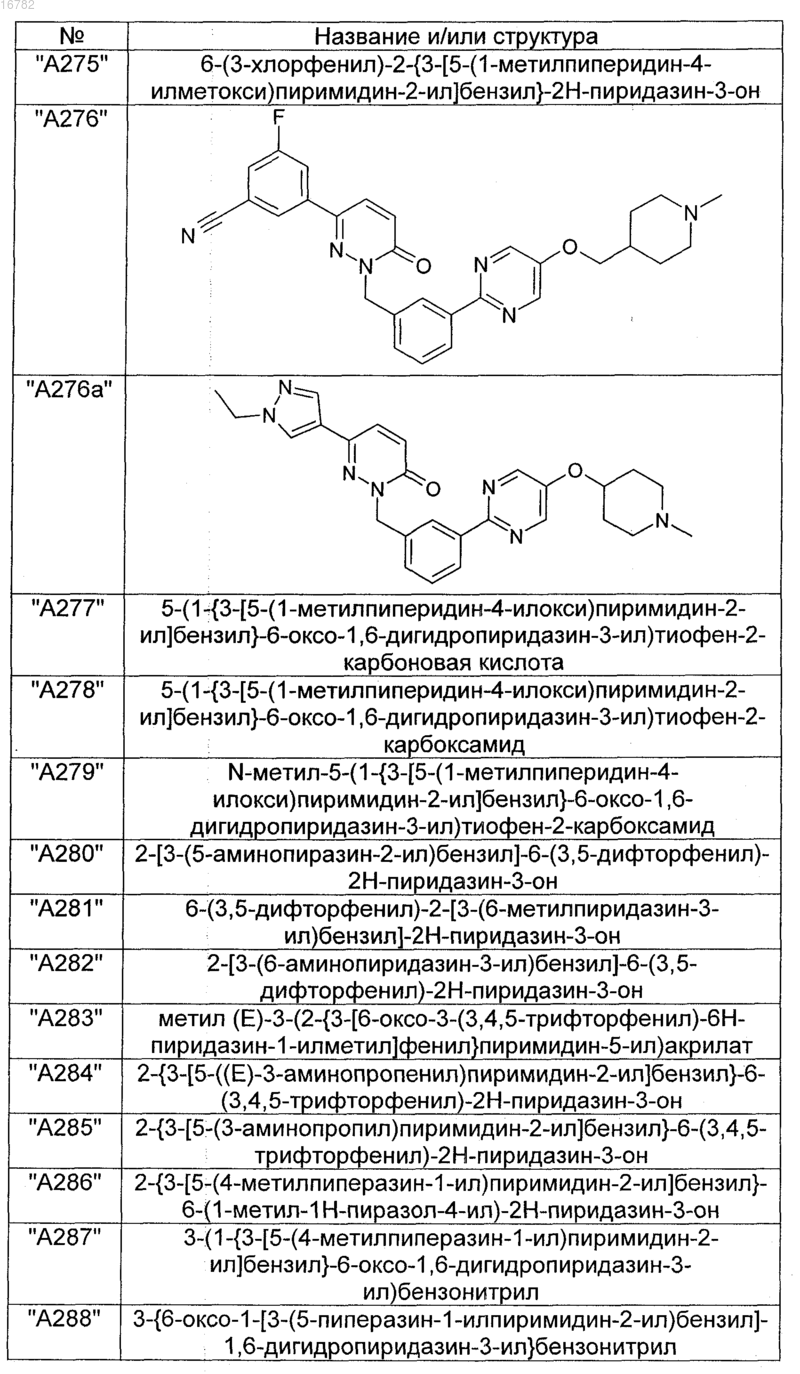

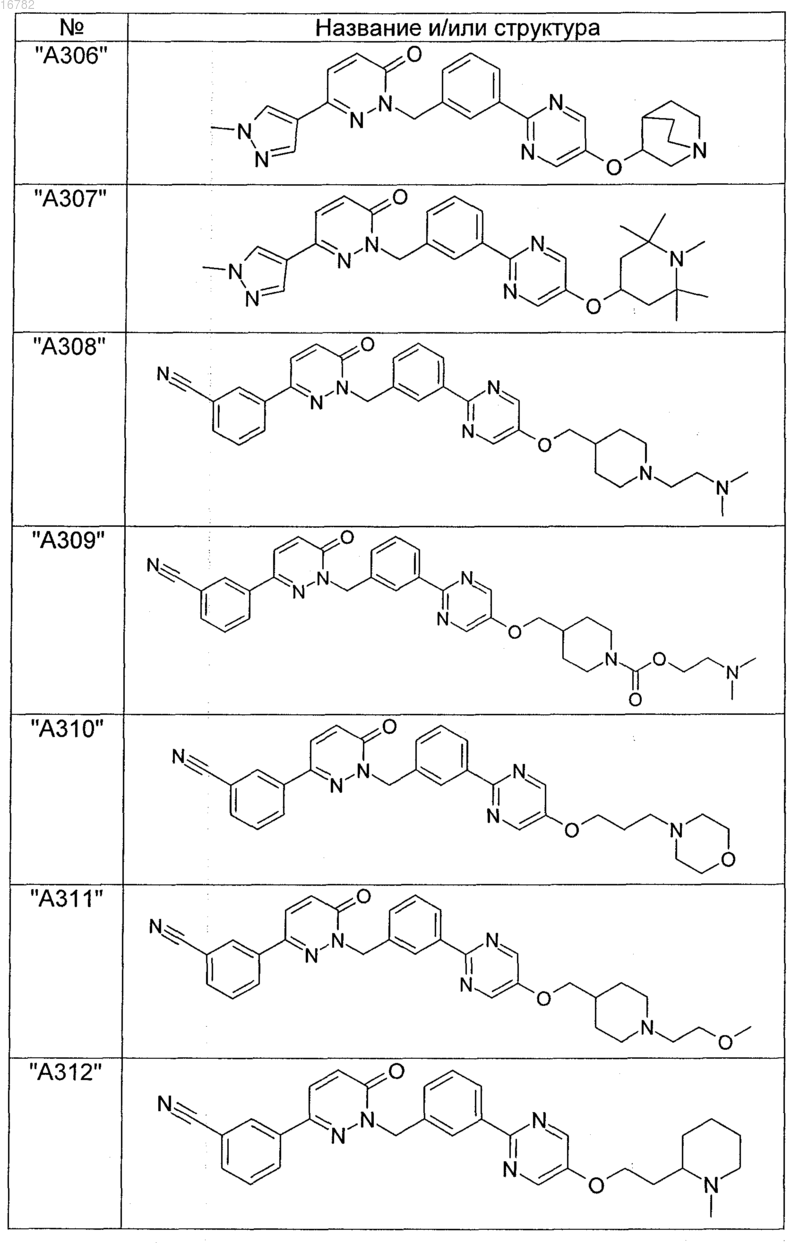
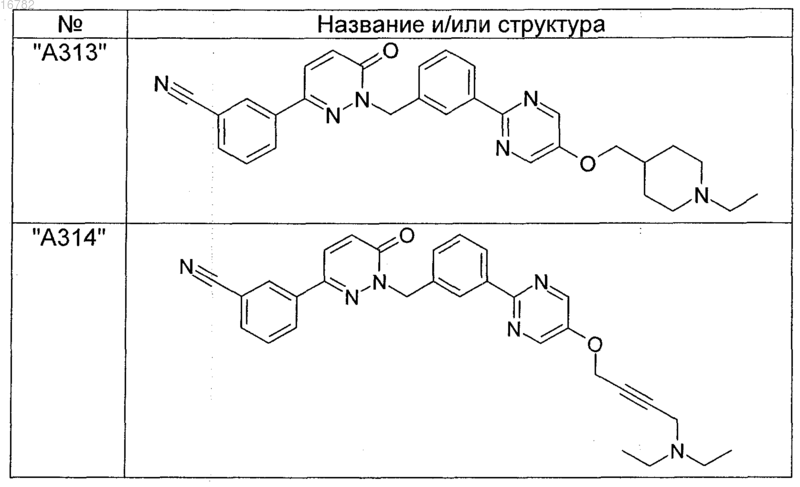
и их фармацевтически пригодные сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях.
3. Способ получения соединений формулы I по пп.1 и 2 и их фармацевтически пригодных солей, сольватов, таутомеров и стереоизомеров, который отличается тем, что
а) соединение формулы II
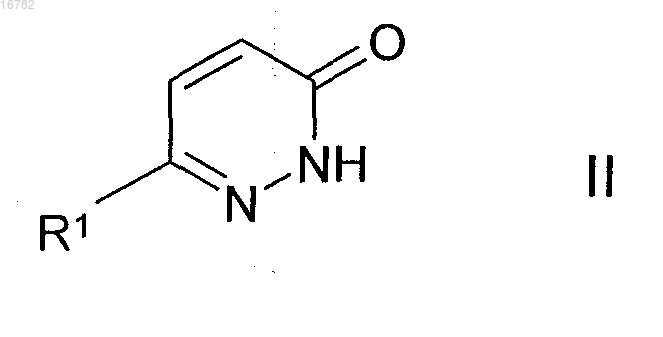
в которой R1 имеет значение, указанное в п.1, подвергают реакции с соединением формулы III
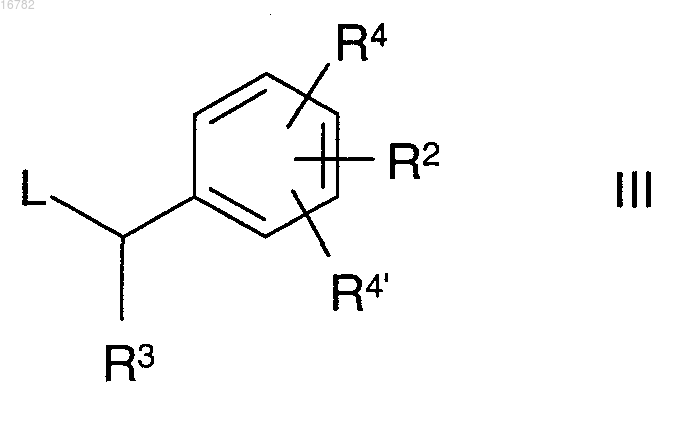
в которой R2, R3, R4 и R4' имеют значения, указанные в п.1, и
L представляет собой Cl, Br, I или свободную или реакционноспособную функционально модифицированную ОН группу,
при необходимости
b) радикал R2 превращают в другой радикал R2 путем
i) превращения оксадиазольного радикала в пиримидинильный радикал,
ii) ацилирования или алкилирования аминогруппы,
и при необходимости
c) соединение выделяют в свободном состоянии из одного из его функциональных производных путем обработки сольволизирующим или гидрогенолизирующим агентом, и/или
основание или кислоту формулы I превращают в одну из его(ее) солей.
4. Лекарственное средство, содержащее по меньшей мере одно соединение формулы I по пп.1 и 2 и/или его фармацевтически пригодные соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях, и наполнители и/или вспомогательные вещества.
5. Применение соединений по пп.1 и 2 и их фармацевтически пригодных солей, сольватов, таутомеров и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, при которых играет роль ингибирование, регуляция и/или модуляция передачи сигналов с помощью киназы.
6. Применение по п.5 соединений по пп.1 и 2 и их фармацевтически пригодных сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование тирозинкиназ соединениями по пп.1-2.
7. Применение по п.5 для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование Met киназы соединениями по пп.1 и 2.
8. Применение по п.6 или 7, где заболевание, подвергаемое лечению, представляет собой солидную опухоль.
9. Применение по п.8, где солидная опухоль выбрана из группы опухолей плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани и/или легкого.
10. Применение по п.8, где солидная опухоль выбрана из группы аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом и рака молочной железы.
11. Применение по п.9, где солидная опухоль выбрана из группы аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом, рака толстой кишки и рака молочной железы.
12. Применение по п.6 или 7, где заболевание, подвергаемое лечению, представляет собой опухоль крови и иммунной системы.
13. Применение по п.12, где опухоль выбрана из группы острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфолейкоза, хронического лимфолейкоза и/или моноцитарного лейкоза.
Текст
(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 016782 Объектом изобретения является выявление новых соединений, обладающих ценными свойствами, в частности тех, которые могут применяться для приготовления лекарственных средств. Настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощью киназ, в особенности тирозинкиназ и/или серин/треонин киназ, а также к фармацевтическим композициям, которые содержат указанные соединения, и к применению соединений для лечения заболеваний, индуцированных киназой. В частности, настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощьюMet киназы. Одним из основных механизмов, с помощью которого осуществляется клеточная регуляция, является трансдукция внеклеточных сигналов через мембрану, что, в свою очередь, моделирует биохимические пути передачи сигналов в клетке. Фосфорилирование белков представляет собой один путь, с помощью которого внутриклеточные сигналы передаются от молекулы к молекуле, что в результате приводит к ответной реакции в клетке. Эти каскады трансдукции сигналов в высокой степени регулируются и часто перекрываются, очевидно, вследствие существования многих протеинкиназ, а также фосфатаз. Фосфорилирование белков преимущественно происходит в остатках серина, треонина или тирозина, поэтому протеинкиназы классифицируют по специфичности их участков фосфорилирования, то есть серин/треониновые киназы и тирозинкиназы. Поскольку фосфорилирование представляет собой широко распространенный процесс в клетках, а фенотипы клеток значительно зависят от активности этих путей,то в настоящее время полагают, что многие болезненные состояния и/или заболевания могут быть вызваны или аберрантной активацией, или функциональными мутациями в молекулярных компонентах киназных каскадов. Следовательно, характеристике этих белков и соединений, способных модулировать их активность, уделяется пристальное внимание (для обзора см.: Weinstein-Oppenheimer и др. Pharma. .Therap., 2000, 88, 229-279). Роль рецепторной тирозинкиназы Met в образовании и развитии опухолей у людей и возможность ингибирования HGF (фактор роста гепатоцитов)-зависимой активации Met описаны S. Berthou и др. вOncogene, том 23,31, cc. 5387-5393 (2004). Ингибитор SU11274, раскрытый в этом источнике, пирролиндолиновое соединение, потенциально пригоден для борьбы со злокачественным новообразованием. Другой ингибитор Met киназы для лечения злокачественного новообразования описан J.G. Christensen и др. в Cancer Res. 2003, 63(21), 7345-55. Дальнейший ингибитор тирозинкиназы для борьбы со злокачественным новообразованием описан Н. Hov и др. в Clinical Cancer Research том 10, 6686-6694 (2004). Соединение РНА-665752, производное индола, направлено против HGF рецептора c-Met. Кроме того, в этом документе описано, что HGF и Met оказывают существенное влияние на злокачественность различных видов рака, таких как, например, множественная миелома. Поэтому является желательным синтезировать небольшие соединения, которые специфически ингибируют, регулируют и/или модулируют передачу сигналов с помощью тирозинкиназ и/или серин/треонин киназ, в частности Met киназы, и это составляет задачу настоящего изобретения. Было обнаружено, что соединения в соответствии с изобретением и их соли обладают чрезвычайно ценными фармакологическими свойствами, а также хорошей переносимостью. Более подробно, настоящее изобретение относится к соединениям формулы I, которые ингибируют,регулируют и/или модулируют передачу сигналов Met киназами, к композициям, которые содержат эти соединения, и к способам их применения для лечения заболеваний и состояний, индуцированных Met киназой, таких как ангиогенез, рак, образование, рост и распространение опухолей, артериосклероз, заболевания глаз, такие как дегенерация желтого пятна, связанная со старением, образование новых сосудов в хориоидальной оболочке и диабетическая ретинопатия, воспалительные заболевания, артрит,тромбоз, фиброз, гломерулонефрит, нейродегенерация, псориаз, рестеноз, заживление ран, отторжение трансплантата, нарушения обмена веществ и заболевания иммунной системы, а также аутоиммунные заболевания, цирроз, диабет и заболевания кровеносных сосудов, включая нестабильность и проницаемость, и др., у млекопитающих. Солидные опухоли, в особенности быстрорастущие опухоли, можно подвергать лечению с применением ингибиторов Met киназы. Такие солидные опухоли включают моноцитарный лейкоз, рак головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легкого, включая аденокарциному легкого и мелкоклеточный рак легкого. Настоящее изобретение относится к способам регуляции, модуляции или ингибирования Met киназы для предотвращения и/или лечения заболеваний, связанных с нерегулируемой или нарушенной активностью Met киназы. В частности, соединения формулы I также могут применяться для лечения определенных типов злокачественных новообразований. Кроме того, соединения формулы I могут применяться для обеспечения дополнительного или синергетического действий при определенных существующих химиотерапиях при лечении злокачественных новообразований и/или могут применяться для восстановления эффективности определенных существующих химиотерапий и лучевых терапий злокачественных новообразований.-1 016782 Соединения формулы I также могут применяться для выделения и исследования активности или экспрессии Met киназы. Дополнительно, они чрезвычайно пригодны для применения в диагностических способах при заболеваниях, связанных с нерегулируемой или нарушенной активностью Met киназы. Может быть продемонстрировано, что соединения в соответствии с изобретением обладают антипролиферативным действием в условиях in vivo на модели ксенотрансплантированной опухоли. Соединения в соответствии с изобретением вводятся пациенту с гиперпролиферативным заболеванием, например, для ингибирования роста опухоли, для уменьшения воспаления, связанного с лимфопролиферативным заболеванием, для ингибирования отторжения трансплантата или неврологического повреждения в результате восстановления ткани, и т.д. Эти соединения пригодны для профилактических или терапевтических целей. Как используется в настоящем изобретении, термин "лечение" применяется для обозначения как предотвращения заболеваний, так лечения ранее существующих состояний. Предотвращение пролиферации достигают путем введения соединений в соответствии с изобретением до явного развития заболевания, например, для предотвращения роста опухолей, предотвращения метастатического роста,уменьшения рестеноза, связанного с сердечно-сосудистой хирургией и т.д. Альтернативно, соединения применяются для лечения продолжающихся заболеваний путем стабилизации или улучшения клинических симптомов у пациента. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков, кролики; лошади, коровы, собаки, кошки и т.д. Животные модели представляют интерес для экспериментальных исследований,поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. В общем случае культуру клеток объединяют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам индуцировать гибель клетки или ингибировать миграцию, обычно в интервале времени приблизительно от одного часа до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из образца биопсии. Затем подсчитывают жизнеспособные клетки, оставшиеся после обработки. Доза будет изменяться в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени, при поддержании жизнеспособности пациента. Лечение в общем случае продолжают до тех, пока не будет достигнуто существенного уменьшения, например, по меньшей мере приблизительно 50% уменьшения популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока по существу в организме не будет определяться нежелательных клеток. Для идентификации пути сигнальной трансдукции и определения взаимодействий между различными сигнальными путями различными учеными были разработаны приемлемые модели или модельные системы, например, модели на основе культур клеток (например, Khwaja и др., ЕМВО, 1997, 16, 2783-93) и модели трансгенных животных (например, White и др., Oncogene, 2001, 20, 7064-7072). С целью проверки определенных этапов каскада для сигнальной трансдукции можно использовать соединения, которые препятствуют этому процессу, для модуляции сигнала (например, Stephens и др., Biochemical J.,2000, 351, 95-105). Соединения в соответствии с изобретением могут также быть полезными в качестве реагентов для тестирования зависимых от киназы путей сигнальной трансдукции у животных и/или на моделях культур клеток, а также на любом из клинических расстройств, указанных в данной заявке. Измерение киназной активности представляет собой известный способ, который может осуществить любой специалист в данной области. Общие аналитические системы для определения киназной активности с субстратами например, гистоном (например, Alessi и др., FEBS Lett. 1996, 399, 3, стр. 333-338) или основным миелиновым белком описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr.,J.R. 1992 J. Biol. Chem. 267, стр. 14535). Для идентификации ингибиторов киназы доступными являются различные аналитические системы. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19) и анализе флэш-планшетов измеряют радиоактивное фосфорилирование белка или пептида в качестве субстрата с АТР. В присутствии ингибиторного соединения не выявляется никакого сигнала или выявляется снижение радиоактивного сигнала. Кроме того, в качестве аналитических способов являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени(HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. of Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфо-антитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антиовечьего антитела, конъюгированного с пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Существует много заболеваний, связанных с нарушением регулирования пролиферации клеток и клеточной гибели (апоптоза). Состояния, которые представляют интерес, включают, но не ограничиваясь только ими, следующие состояния. Соединения в соответствии с изобретением являются полезными для-2 016782 лечения разнообразных состояний, при которых существует пролиферация и/или миграция клеток гладкой мускулатуры и/или воспалительных клеток в слой интимы сосудов, что приводит к ограниченному потоку крови через этот сосуд, например, в случае неоинтимальных окклюзивных повреждений. Окклюзивные заболевания трансплантированных сосудов, которые представляют интерес, включают атеросклероз, коронарное сосудистое заболевание после трансплантации, стеноз в результате пересадки вен,пери-анастомотический рестеноз в результате введения протеза, рестеноз после ангиопластики или внедрения стента и т.п. Уровень техники Другие производные пиридазина описываются в качестве ингибиторов Met киназы в WO 2007/065518. Тиадиазиноны описываются в DE19604388, WO2003/037349, WO2007/057093 или WO2007/057092. Дигидропиридазиноны для борьбы со злокачественным новообразованием описываются в WO 03/037349 А 1. Другие пиридазины для лечения заболеваний иммунной системы, ишемических и воспалительных заболеваний известны из ЕР 1043317 А 1 и ЕР 1061077 А 1. ЕР 0738716 А 2 и ЕР 0711759 В 1 описывают другие дигидропиридазиноны и пиридазиноны в качестве фунгицидов и инсектицидов. Другие пиридазиноны описываются в качестве кардиотонических средств в US 4397854.JP 57-95964 раскрывает другие пиридазиноны. Применение других ингибиторов Met киназы для борьбы со злокачественными новообразованиями описывается в WO 2007/075567. Краткое изложение сущности изобретения Изобретение относится к соединениям формулы IR1 представляет собой Ar или Het,R2 представляет собой пиримидинил, пиридазинил, пиридинил, 1,3-оксазинанил, морфолинил, пиперидинил или пиперазинил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью Hal, A, [C(R3)2]nOR3, N=CR3N(R3)2, CN, COOR3, [C(R3)2]nN(R3)2, [C(R3)2]nHet,O[C(R3)2]pOR3, O[C(R3)2]nN(R3)2, O[C(R3)2]nCC[C(R3)2]nN(R3)2, O[C(R3)2]nN+O-(R3)2, O[C(R3)2]nHet,NR3[C(R3)2]nN(R3)2,NR3[C(R3)2]nHet,[C(R3)2]nNHCO[C(R3)2]nN(R3)2,[C(R3)2]nNHCO[C(R3)2]nHet,3 3 3 3 3 3 3 3 3CONR [C(R )2]nN(R )2, CONR [C(R )2]nNR COOA, CONR [C(R )2]nOR , CONR3[C(R3)2]nHet, COHet,CH=CH-COOR3, CH=CH-N(R3)2 и/или =O (карбонильным кислородом),R3 представляет собой Н, метил, этил или пропил,R4, R4' представляют собой Н,Ar представляет собой фенил, нафтил или бифенил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью А, Hal, CN, S(O)mA, NR3COA, CON(R3)2, O[C(R3)2]nN(R3)2, [C(R3)2]nOR3, CONR3[C(R3)2]nN(R3)2 и/или CONR3[C(R3)2]nHet,Het представляет собой пиперидинил, пиперазинил, пирролидинил, морфолинил, фурил, тиенил,пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримидинил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиразинил, бензимидазолил, бензотриазолил, индолил, бензо-1,3-диоксолил, индазолил, азабицикло[3.2.1]октил, азабицикло[2.2.2]октил,имидазолидинил, азепанил или бензо-2,1,3-тиадиазолил, каждый из которых является незамещенным или моно-, ди-, три-, тетра- или пентазамещенным с помощью А, СНО, COOR3, CON(R3)2, [C(R3)2]nHet1,[C(R3)2]nOR3, [C(R3)2]nN(R3)2, O[C(R3)2]nHet1 и/или =O (карбонильным кислородом),и где атом азота цикла может быть окисленным, Het1 представляет собой пирролидин, пиперидин,пиперазин или морфолин,каждый из которых является незамещенным или моно- или дизамещенным с помощью А и/или =O(карбонильным кислородом), А представляет собой неразветвленный или разветвленный алкил,содержащий 1-8 С атомов, в котором 1-7 Н атомов может быть замещено F и/или Cl, Hal представляет собой F, Cl, Br или I, m представляет собой 0, 1 или 2, n представляет собой 0, 1, 2, 3 или 4, р представляет собой 1,2,3 или 4,и их фармацевтически пригодные сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. Изобретение также относится к оптически активным формам (стереоизомерам), энантиомерам, рацематам, диастереомерам, а также гидратам и сольватам указанных соединений. Под сольватами соединений подразумевают аддукты молекул инертного растворителя на соединениях, которые образуются-3 016782 благодаря их силе взаимного притяжения. Сольваты представляют собой, например, моно- или дигидраты или алкоголяты. Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую ответную реакцию, которую предполагает или желает получить, например,исследователь или лечащий врач. Кроме того, выражение "терапевтически эффективное количество" обозначает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминацию заболевания, синдрома, состояния, жалобы, расстройства или побочных действий, или также уменьшения прогрессирования заболевания, жалобы или расстройства. Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для усиления нормальной физиологической функции. Изобретение также относится к применению смесей соединений формулы I, например смесей двух диастереомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Изобретение относится к соединениям формулы I и их солям и к способу получения соединений формулы I в соответствии с пунктами 1-2 и их фармацевтически пригодных солей, сольватов, таутомеров и стереоизомеров, который отличается тем, что а) соединение формулы IIL представляет собой Cl, Br, I или свободную или реакционно-способную функционально модифицированную ОН группу, илиi) превращения оксадиазольного радикала в пиримидинильный радикал,и) ацилирования или алкилирования аминогруппы,iii) этерифицирования гидроксильной группы, илиc) соединение выделяют в свободном состоянии из одного из его функциональных производных путем обработки сольволизирующим или гидрогенолизирующим агентом, и/или основание или кислоту формулы I превращают в одну из его(ее) солей. При указании выше и ниже, радикалы R1, R2, R3, R4, R4 имеют значения, указанные для формулы I,если специально не указано иначе. А представляет собой алкил, который является неразветвленным (линейным) или разветвленным, и имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов С. А предпочтительно представляет собой метил, кроме того,этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2 или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил,1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2 метилпропил, 1,1,2- или 1,2,2-триметилпропил, более предпочтительно, например, трифторметил. А наиболее предпочтительно представляет собой алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов С,предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил.Ar более предпочтительно представляет собой фенил, нафтил или бифенил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью A, Hal, CN, S(O)mA, NR3COA,CON(R3)2, O[C(R3)2]nN(R3)2, [C(R3)2]nOR3, CONR3[C(R3)2]nN(R3)2 и/или CONR3[C(R3)2]nHet. Независимо от дальнейших замещений, Het представляет собой, например, 2-или 3-фурил, 2- или 3 тиенил, 1-, 2- или 3-пирролил, 1-, 2, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5 оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4-или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил,2-, 4-, 5- или 6-пиримидинил, более предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3 или 5-ил, 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4 тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3-или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 3- или 4-пиридазинил,пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил, 4- или 5-изоиндолил, индазолил, 1-, 2-, 4- или 5 бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6- или 7- бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7-бензизотиазолил, 4-, 5-, 6- или 7 бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 3-, 4-, 5-,6-, 7- или 8-циннолинил, 2-, 4-, 5-, 6-, 7- или 8-хиназолинил, 5- или 6-хиноксалинил, 2-, 3-, 5-, 6-, 7- или 82 Н-бензо-1,4-оксазинил, более предпочтительно 1,3-бензодиоксол-5-ил, 1,4-бензодиоксан-6-ил, 2,1,3 бензотиадиазол-4-, -5-ил или 2,1,3-бензоксадиазол-5-ил, азабицикло[3.2.1]октил или дибензофуранил. Гетероциклические радикалы также могут быть частично или полностью гидрированы. Независимо от дальнейших замещений, Het также может представлять собой, например, 2,3 дигидро-2-, -3-, -4- или -5-фурил, 2,5-дигидро-2-, -3-, -4- или 5-фурил, тетрагидро-2- или -3-фурил, 1,3 диоксолан-4-ил, тетрагидро-2- или -3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пирролил, 2,5-дигидро-1-,-2-, -3-, -4-или -5-пирролил, 1-, 2- или 3-пирролидинил, тетрагидро-1-, -2- или -4-имидазолил, 2,3 дигидро-1-, -2-, -3-, -4- или -5-пиразолил, тетрагидро-1-, -3- или -4-пиразолил, 1,4-дигидро-1-, -2-, -3- илиHet предпочтительно представляет собой пиперидинил, пиперазинил, пирролидинил, морфолинил,фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримидинил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиразинил, бензимидазолил, бензотриазолил, индолил, бензо-1,3-диоксолил, индазолил, азабицикло[3.2.1]октил, азабицикло[2.2.2]октил, имидазолидинил, азепанил или бензо-2,1,3-тиадиазолил, каждый из которых является незамещенным или моно-, ди-, три-, тетра- или пентазамещенным с помощью А, СНО, COOR3,CON(R3)2, [C(R3)2]nHet1, [C(R3)2]nOR3, [C(R3)2]nN(R3)2, O[C(R3)2]nHet1 и/или =O (карбонильным кислородом), и где атом азота цикла может быть окисленным.Het1 предпочтительно представляет собой пирролидин, пиперидин, пиперазин или морфолин, каждый из которых является незамещенным или моно- или дизамещенным с помощью А и/или =O (карбонильным кислородом).R1 предпочтительно представляет собой Ar или бензо-2,1,3-тиадиазолил.R2 предпочтительно представляет собой пиримидинил, пиридазинил, пиридинил, 1,3-оксазинанил,-5 016782 морфолинил, пиперидинил или пиперазинил, каждый из которых является незамещенным или моно-, диили тризамещенным с помощью Hal, A, [C(R3)2]nOR3, N=CR3N(R3)2) CN, COOR3, [C(R3)2]nN(R3)2,[C(R3)2]nHet, O[C(R3)2]pOR3, O[C(R3)2]nN(R3)2) O[C(R3)2]nCC[C(R3)2]nN(R3)2, O[C(R3)2]nN+O(R3)2,O[C(R3)2]nHet, NR3[C(R3)2]nN(R3)2, NR3[C(R3)2]nHet, [C(R3)2]nNHCO[C(R3)2]nN(R3)2, [C(R3)2]nNHCOR3 предпочтительно представляет собой Н, метил, этил или пропил.R4, R4' предпочтительно представляют собой Н.Hal предпочтительно представляет собой F, Cl или Br, но также и I, особенно предпочтительно F или Cl. Для всего изобретения все радикалы, которые встречаются более одного раза, могут быть одинаковыми или разными, то есть их значения являются независимыми друг от друга. Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы. Таким образом, изобретение относится, в частности, к соединениям формулы I, в которых по меньшей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных выше. Некоторые предпочтительные группы соединений могут быть представлены следующими подформулами Ib, Ic, If - II, которые соответствуют формуле I и в которых радикалы, не обозначенные более подробно, имеют значение, указанное для формулы I, но в которых в Ib Ar представляет собой фенил, нафтил или бифенил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью A, Hal, CN, S(O)mA, NR3COA, CON(R3)2, O[C(R3)2]nN(R3)2, [C(R3)2]nOR3, CONR3[C(R3)2]nN(R3)2 и/или CONR3[C(R3)2]nHet; в Ic R4, R4' представляют собой Н; в If А представляет собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 H атомов может быть замещено F и/или Cl; в Ig R1 представляет собой Ar или бензо-2,1,3-тиадиазолил; в Ih R3 представляет собой Н, метил, этил или пропил; в Ii R2 представляет собой пиримидинил, пиридазинил, пиридинил, 1,3-оксазинанил, морфолинил,пиперидинил или пиперазинил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью Hal, A, [C(R3)2]nOR3, N=CR3N(R3)2, CN, COOR3, [C(R3)2]nN(R3)2, [C(R3)2]nHet,O[C(R3)2]pOR3, O[C(R3)2]nN(R3)2, O[C(R3)2]nCC[C(R3)2]nN(R3)2, O[C(R3)2]nN+O'(R3)2lO[C(R3)2]nHet,NR3[C(R3)2]n,N(R3)2)NR3[C(R3)2]nHet,[C(R3)2]nNHCO[C(R3)2]nN(R3)2,[C(R3)2]nNHCO[C(R3)2]nHet,3 3 3 3 3 3 3 3 3CONR [C(R )2]nN(R )2, CONR [C(R )2]nNR COOA, CONR [C(R )2]nOR , CONR3[C(R3)2]nHet, COHet,CH=CH-COOR3, CH=CH-N(R3)2 и/или =O (карбонильным кислородом); в Ij Het представляет собой пиперидинил, пиперазинил, пирролидинил, морфолинил, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримидинил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиразинил, бензимидазолил,бензотриазолил, индолил, бензо-1,3-диоксолил, индазолил, азабицикло[3.2.1]октил, азабицикло[2.2.2]октил, имидазолидинил, азепанил или бензо-2,1,3-тиадиазолил, каждый из которых является незамещенным или моно-, ди-, три-, тетра- или пентазамещенным с помощью А, СНО, COOR3,CON(R3)2, [C(R3)2]nHet1, [C(R3)2]nOR3, [C(R3)2]nN(R3)2, O[C(R3)2]nHet1 и/или =O (карбонильным кислородом),и где атом азота цикла может быть окисленным; в Ik Het1 представляет собой пирролидин, пиперидин, пиперазин или морфолин, каждый из которых является незамещенным или моно- или дизамещенным с помощью А и/или =O (карбонильным кислородом); в Il R1 представляет собой Ar или Het,R2 представляет собой пиримидинил, пиридазинил, пиридинил, 1,3-оксазинанил, морфолинил, пиперидинил или пиперазинил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью Hal, A, [C(R3)2]nOR3, N=CR3N(R3)2, CN, COOR3, [C(R3)2]nN(R3)2, [C(R3)2]nHet,O[C(R3)2]pOR3, O[C(R3)2]nN(R3)2, O[C(R3)2]nCC[C(R3)2]nN(R3)2, O[C(R3)2]nN+O-(R3)2, O[C(R3)2]nHet,NR3[C(R3)2]nN(R3)2,NR3[C(R3)2]nHet,[C(R3)2]nNHCO[C(R3)2]nN(R3)2,[C(R3)2]nNHCO[C(R3)2]nHet,3 3 3 3 3 3 3 3 3CONR [C(R )2]nN(R )2, CONR [C(R )2]nNR COOA, CONR [C(R )2]nOR , CONR3[C(R3)2]nHet, COHet,CH=CH-COOR3, CH=CH-N(R3)2 и/или =O (карбонильным кислородом),R3 представляет собой Н, метил, этил или пропил,R4, R4' представляют собой Н,Ar представляет собой фенил, нафтил или бифенил, каждый из которых является незамещенным или моно-, ди- или тризамещенным с помощью A, Hal, CN, S(O)mA, NR3COA, CON(R3)2,O[C(R3)2]nN(R3)2, [C(R3)2]nOR3, CONR3[C(R3)2]nN(R3)2 и/или CONR3[C(R3)2]nHet,Het представляет собой пиперидинил, пиперазинил, пирролидинил, морфолинил, фурил, тиенил,пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримиди-6 016782 нил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиразинил, бензимидазолил, бензотриазолил, индолил, бензо-1,3-диоксолил, индазолил, азабицикло[3.2.1]октил, азабицикло[2.2.2]октил,имидазолидинил, азепанил или бензо-2,1,3-тиадиазолил, каждый из которых является незамещенным или моно-, ди-, три-, тетра- или пентазамещенным с помощью А, СНО, COOR3, CON(R3)2, [C(R3)2]nHet1,[C(R3)2]nOR3, [C(R3)2]nN(R3)2, O[C(R3)2]nHet1 и/или =O (карбонильным кислородом),и где атом азота цикла может быть окисленным,Het1 представляет собой пирролидин, пиперидин, пиперазин или морфолин, каждый из которых является незамещенным или моно- или дизамещенным с помощью А и/или =O (карбонильным кислородом),А представляет собой неразветвленный или разветвленный алкил, содержащий 1-8 С атомов, в котором 1-7 Н атомов может быть замещено F и/или Cl,Hal представляет собой F, Cl, Br или I,m представляет собой 0, 1 или 2,n представляет собой 0, 1, 2, 3 или 4,р представляет собой 1, 2, 3 или 4; и их фармацевтически пригодными солями, сольватами, таутомерами и стереоизомерами, включая их смеси во всех соотношениях. Соединения формулы I, а также исходные вещества для их получения могут, кроме того, быть получены при помощи методов, известных per se, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie методы органической химии], GeorgThieme-Verlag, Штутгарт), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные модификации, которые известные perse, но о которых здесь подробно не упоминается. Исходные соединения формул II и III, как правило, известны. Однако если они являются новыми, то они могут быть получены методами, известными per se. Используемые пиридазиноны формулы II, если они не являются коммерчески доступными, обычно могут быть получены с помощью способа W. J.Coates, A. McKillop, Synthesis, 1993, 334-342. Соединения формулы I предпочтительно могут быть получены путем взаимодействия соединения формулы II с соединением формулы III. В соединениях формулы III L предпочтительно представляет собой Cl, Br, I или свободную или реакционноспособную модифицированную ОН-группу, такую как,например, активированная сложноэфирная, имидазолидная группа или алкилсульфонилокси, содержащий 1-6 атомов углерода (предпочтительно метилсульфонилокси или трифторметилсульфонилокси), или арилсульфонилокси, содержащий 6-10 атомов углерода (предпочтительно фенил- или птолилсульфонилокси). Обычно реакцию осуществляют в присутствии вещества, связывающего кислоту, предпочтительно органического основания, такого как DIPEA, триэтиламин, диметиланилин, пиридин или хинолин. Прибавление гидроксида щелочного или щелочноземельного металла, карбоната или бикарбоната или другой соли слабой кислоты щелочных или щелочноземельных металлов, предпочтительно калия, натрия,кальция или цезия, также может являться благоприятным. В зависимости от применяемых условий, продолжительность реакции находится в интервале от нескольких минут до 14 дней, температура реакции находится в интервале приблизительно от -30 до 140,обычно в интервале от -10 до 90, более предпочтительно от приблизительно 0 до приблизительно 70. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод,карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительными являются ацетонитрил, дихлорметан и/или ДМФА. Реакцию соединения формулы II с соединением формулы III, в которой L представляет собой ОН,предпочтительно проводят в условиях реакции Мицунобу путем добавления, например, трифенилфосфина и диалкилазодикарбоксилата. В качестве растворителя является предпочтительным ТГФ. Кроме того, можно превратить соединение формулы I в другое соединение формулы I, например,путем восстановления нитрогрупп до аминогрупп (например, путем гидрирования на никеле Ренея илиPd/углероде в инертном растворителе, таком как метанол или этанол). Свободные аминогруппы, кроме того, могут быть ацилированы подходящим образом с помощью хлорангидрида или ангидрида кислоты или алкилированы с помощью незамещенного или замещенного-7 016782 алкилгалогенида, благоприятно в инертном растворителе, таком как дихлорметан или ТГФ, и/или в присутствии основания, такого как триэтиламин или пиридин, при температуре в интервале от -60 до +30. Соединения формулы I также могут быть получены их выделением в свободном состоянии из их функциональных производных путем сольволиза, в частности гидролиза, или путем гидрогенолиза. Предпочтительными исходными веществами для сольволиза или гидрогенолиза являются те, которые содержат соответствующие защищенные амино и/или гидроксильные группы вместо одной или больше свободных амино и/или гидроксильных групп, предпочтительно те, которые несут аминозащитную группу вместо атома водорода, связанного с атомом азота, например, те, которые соответствуют формуле I, но несут NHR' группу (в которой R' представляет собой амино-защитную группу, например ВОС или CBZ) вместо NH2 группы. Кроме того, предпочтительными являются исходные вещества, которые несут гидроксилзащитную группу вместо атома водорода гидроксильной группы, например, те, которые соответствуют формуле I,но содержат RO-фенильную группу (в которой R" представляет собой гидроксилзащитную группу) вместо гидроксифенильной группы. Также существует возможность присутствия в молекуле исходного вещества множества - одинаковых или различных - защищенных амино и/или гидроксильных групп. Если присутствующие защитные группы отличаются друг от друга, то во многих случаях они могут быть отщеплены селективно. Понятие "аминозащитная группа" в общем известно и относится к группам, которые являются подходящими для защиты (блокирования) аминогруппы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются, в частности, незамещенная или замещенная ацильная группа, арильная группа, аралкоксиметильная группа или аралкильная группа. Так как аминозащитные группы удаляют после желательной реакции (или последовательности реакций), то их тип и размер не являются, кроме того, критическими; однако предпочтение отдается тем, которые имеют 1-20, в особенности 1-8, атомов углерода. Понятие "ацильная группа" следует понимать в самом широком смысле в связи с настоящим способом. Оно включает ацильные группы, производные от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфоновых кислот и, в частности, алкоксикарбонильные, арилоксикарбонильные и особенно аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил и бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил и толил; арилоксиалканоил, такой как РОА; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2.2.2-трихлорэтоксикарбонил, ВОС и 2-йодэтоксикарбонил; аралкоксикарбонил, такой как CBZ ("карбобензокси"), 4-метоксибензилоксикарбонил и FMOC; и арилсульфонил, такой как Mtr, Pbf и Pmc. Предпочтительными аминозащитными группами являются ВОС и Mtr,кроме того, CBZ, Fmoc, бензил и ацетил. Понятие "гидроксилзащитная группа" также в общем известно и относится к группам, которые являются подходящими для защиты гидроксильной группы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются указанные выше незамещенные или замещенные арильная, аралкильная или ацильная группы, кроме того, также алкильные группы. Природа и размер гидроксилзащитных групп не являются критическими, так как их удаляют после желательной химической реакции или последовательности реакций; предпочтение отдается группам, которые имеют 1-20, особенности 110, атомов углерода. Примерами гидроксилзащитных групп являются, в числе других, третбутоксикарбонил, бензил, п-нитробензоил, п-толуолсульфонил, трет-бутил и ацетил, где бензил и третбутил являются особенно предпочтительными. Группы СООН в аспарагиновой кислоте и глутаминовой кислоте предпочтительно защищены в виде их трет-бутиловых эфиров (например, Asp(OBut. Соединения формулы I выделяют в свободном состоянии из их функциональных производных - в зависимости от используемых защитных групп - например, применяя сильные кислоты, преимущественно применяя ТФУ или перхлорную кислоту, но также используют другие сильные неорганические кислоты, такие как соляная кислота или серная кислота, сильные органические карбоновые кислоты, такие как трихлоруксусная кислота, или сульфоновые кислоты, такие как бензол- или п-толуолсульфоновая кислота. Присутствие дополнительного инертного растворителя допускается, но не всегда необходимо. Приемлемыми инертными растворителями предпочтительно являются органические, например, карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан,амиды, такие как ДМФА, галогенированные углеводороды, такие как дихлорметан, кроме того, также спирты, такие как метанол, этанол или изопропанол, и вода. Также приемлемыми являются смеси указанных выше растворителей. ТФУ предпочтительно используют в избытке без добавления другого растворителя, и перхлорную кислоту предпочтительно используют в виде смеси уксусной кислоты и 70% перхлорной кислоты в соотношении 9:1. Температура реакций для осуществления расщепления предпочтительно находится в интервале между приблизительно 0 и приблизительно 50, предпочтительно между 15 и 30 (комнатная температура). ВОС, OBut, Pbf, Pmc и Mtr группы могут, например, предпочтительно быть отщеплены при использовании ТФУ в дихлорметане или используя приблизительно 3-5 н. HCl в диоксане при 15-30, и FMOC-8 016782 группа может быть отщеплена, используя приблизительно 5-50% раствор диметиламина, диэтиламина или пиперидина в ДМФА при 15-30. Тритильная группа применяется для защиты аминокислот гистидина, аспарагина, глутамина и цистеина. Их отщепляют, в зависимости от желательного конечного продукта, с помощью ТФУ/ 10% тиофенол, где тритильная группа отщепляется от всех указанных аминокислот; с помощью ТФУ/анизол или ТФУ/тиоанизол, отщепляется только тритильная группа от His, Asn и Gln, тогда как она остается на боковой цепи Cys. Pbf (пентаметилбензофуранил) группа используется для защиты Arg. Она отщепляется,например, с помощью ТФУ в дихлорметане. Защитные группы, которые могут быть удалены гидрогенолитически (например, CBZ или бензил),могут быть отщеплены, например, обработкой водородом в присутствии катализатора (например, катализатора на основе благородного металла, такого как палладий, предпочтительно на подложке, такой как уголь). При этом подходящими растворителями являются растворители, указанные выше, в частности,например, спирты, такие как метанол или этанол, или амиды, такие как ДМФА. Гидрогенолиз в основном проводится при температурах в интервале между приблизительно 0 и 100 и давлении между приблизительно 1 и 200 бар, предпочтительно при 20-30 и 1-10 бар. Гидрогенолиз CBZ группы происходит успешно, например, на 5-10% Pd/C в метаноле или при использовании формиата аммония (вместо водорода) на Pd/C в метаноле/ДМФА при 20-30. Фармацевтические соли и другие формы Соединения, раскрытые в изобретении, могут использоваться в своей заключительной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые формы солей соединений формулы I готовят, главным образом, при использовании традиционных способов. В случае, если соединение формулы I содержит карбоксильную группу, то его приемлемая соль может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например, этанолят калия и пропанолят натрия; а также различные органические основания, такие как пиперидин, диэтаноламин и Nметилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например, галогеноводородами, такими как хлороводород, бромоводород или йодоводород; другими минеральными кислотами, и их соответствующими солями, такими как сульфат, нитрат или фосфат, и др.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и др. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующие соли, но не ограничиваясь только ими: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат,бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат, малат, малеат,малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3 фенилпропионат, фосфат, фосфонат, фталат. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничиваясь только ими, соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия и соли щелочно-земельных металлов кальция и магния. Соли соединений формулы I, которые имеют происхождение от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например, аргинин, бетаин, кофеин,хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины,теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин).-9 016782 Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С 1-С 4-алкилгалогениды, например, метил-, этил-, изопропил-и трет-бутилхлориды, бромиды и йодиды; ди-С 1-С 4-алкилсульфаты,например, диметил-, диэтил- и диамилсульфаты; С 10-С 18-алкилгалогениды, например, децил-, додецил-,лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-С 1-С 4-алкилгалогениды, например,бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Особенно предпочтительными являются гидрохлорид, дигидрохлорид, гидробромид, малеат, мезилат, фосфат, сульфат и сукцинат. Кислотно-аддитивные соли основных соединений формулы I получают путем приведения в контакт формы свободных оснований с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт формы соли с основанием и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих форм солей своими определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных оснований для целей настоящего изобретения. Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуются с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт формы свободной кислоты с достаточным количеством желаемого основания для получения соли традиционным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт формы соли с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает сложные соли. Примеры типичных форм сложных солей включают, но не ограничиваясь только ими, битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид. В свете описанного выше можно увидеть, что выражение "фармацевтически приемлемая соль" в контексте данной заявки предназначено для обозначения активного компонента, который включает соединение формулы I в форме своей соли, особенно в том случае, если указанная форма соли обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или другой солью указанного активного компонента,которые использовались ранее. Фармацевтически приемлемая форма соли активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым он ранее не обладал, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные сольваты и стереоизомеры, включая их смеси во всех соотношениях, и, необязательно, наполнители и/или вспомогательные вещества. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 мг до 700 мг, более предпочтительно от 5 мг до 100 мг, соединения в соответствии с изобретением, в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую порцию их активного компонента. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например, путем перорального (включая буккальное или подъязычное), ректального, назально- 10016782 го, местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например,путем объединения активного компонента с наполнителем(ями) или вспомогательным(и) веществом(ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероралыным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем,измельченным аналогичным способом, таким как, например, пищевой углевод, такой как, например,крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполняют ею желатиновые капсулы определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высоко дисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза,подсластители, приготовленные из кукурузы, естественных и синтетических резин, такие как, например,аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах,включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием,как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин,усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции, порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы,которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например,этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может- 11016782 быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут доставляться с помощью моноклинальных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилетакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями,полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блоксополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может доставляться из пластыря путем ионофореза, как в общем описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффлятоами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы.- 12016782 Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конченом счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением для лечения роста опухолей, например рака ободочной кишки или молочной железы, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день,таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли или сольвата или физиологически функционального производного может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить,что аналогичные дозы пригодны для лечения других состояний, описанных выше. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные сольваты и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства. Применение Соединения согласно настоящему изобретению пригодны в качестве фармацевтически активных компонентов для млекопитающих, в особенности для людей, для лечения заболеваний, вызванных тирозинкиназой. Эти заболевания включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию (или ангиогенез), которые вызывают рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением и т.д.) и воспаление(псориаз, ревматоидный артрит и т.д.). Настоящее изобретение охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения злокачественного новообразования. Предпочтительные карциномы для лечения выбирают из группы рака головного мозга, рака мочеполового тракта, рака лимфатической системы, рака желудка,рака гортани и рака легкого. Дальнейшей группой предпочтительных типов рака являются моноцитарный лейкоз, аденокарцинома легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы и рак молочной железы. Также охватывается применение соединений согласно п.1 в соответствии с изобретением и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, в которое вовлечен ангиогенез. Такое заболевание, в которое вовлечен ангиогенез, представляет собой заболевание глаз, такое как васкуляризация сетчатки, диабетическая ретинопатия, дегенерация желтого пятна, связанная со старением, и т.п. Применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения воспалительных заболеваний также подпадает под объем настоящего изобретения. Примерами таких воспалительных заболеваний являются ревматоидный артрит, псориаз, контактный дерматит, аллергическая реакция замедленного типа и т.п. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, индуцированного тирозинкиназой, или состояния, индуцированного тирозинкиназой, у млекопитающего, при котором в этом способе терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему, нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и легко может быть определено специалистом в данной области. Настоящее изобретение также охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения васкуляризации сетчатки. Способы лечения или предотвращения глазных заболеваний, такие как диабетическая ретинопатия и дегенерация желтого пятна, связанная со старением, также являются частью изобретения. Применение для лечения или предотвращения воспалительных заболеваний, таких как ревматоидный артрит, псориаз,контактный дерматит и аллергическая реакция замедленного типа, а также лечение или предотвращение патологий костей из группы, включающей остеосаркому, остеоартрит и рахит, также подпадает под объем настоящего изобретения. Выражение "заболевания или состояния, индуцированные тирозинкиназой" относится к патологическим состояниям, которые зависят от активности одной или несколько тирозикиназ. Тирозинкиназы непосредственно или опосредованно принимают участие в путях передачи сигналов различных активностей клеток, включая пролиферацию, адгезию, миграцию и дифференциацию. Заболевания, связанные с- 13016782 активностью тирозинкиназы, включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию, которая стимулирует рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением, и т.д.) и воспаление (псориаз, ревматоидный артрит и т.д.). Соединения формулы I могут вводиться пациентам для лечения злокачественного новообразования,в особенности быстрорастущих опухолей. Изобретение также относится к применению соединений формулы I и их фармацевтически пригодных сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, при которых играет роль ингибирование, регуляция и/или модуляция передачи сигналов с помощью киназы. Предпочтение в настоящем изобретении отдается Met киназе. Предпочтительным является применение соединений формулы I и их фармацевтически пригодных сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование тирозинкиназ соединениями в соответствии с п.1. Особенно предпочтительным является применение для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование Met киназы соединениями в соответствии с п.1. Наиболее предпочтительным является применение для лечения заболевания, где заболевание представляет собой солидную опухоль. Солидную опухоль предпочтительно выбирают из группы опухолей легкого, плоского эпителия,мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы,желудка и/или гортани. Солидную опухоль также предпочтительно выбирают из группы, включающей аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы, рак толстой кишки и рак молочной железы. Кроме того, предпочтительным является применение для лечения опухоли крови и иммунной системы, предпочтительно для лечения опухоли, выбранной из группы, включающей острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз и/или хронический лимфолейкоз. Описанные соединения формулы I могут вводиться в комбинации с другими известными лекарственными средствами, включая противораковые средства. Как используется в настоящем изобретении, термин "противораковое средство" относится к любому средству, которое вводят пациенту со злокачественным новообразованием для лечения рака. Противоопухолевое лечение, описанное в изобретении, может применяться в виде монотерапии,или, дополнительно к соединению по изобретению, можно также применять обычные хирургические методы, или радиотерапию, или химиотерапию. Такая химиотерапия может включать один или несколько следующих классов противоопухолевых средств: (i) антипролиферативные/противоопухолевые/повреждающие ДНК лекарственные средства и их комбинации, которые применяются в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, карбоплатин, циклофосфамид, азотный иприт, мельфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, такие как 5-фторурацил и тегафур, ралтитрексед, метотрексат, арабинозид цитозина, гидроксимочевина и гемцитабин); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин,митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин и таксоиды, такие как таксол и таксотер); ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие этопозид и тенипозид, амсакрин,топотекан, иринотекан и камптотецин) и цитодифференцирующие средства (например, ретиноевая кислота, полностью находящаяся в трансконфигурации, 13-цис-ретиноевая кислота и фенретинид);(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и йодоксифен), ингибиторы рецептора эстрогена (например, фульвестрант); антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерон ацетат), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестогены (например, мегестрол ацетат), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5-редуктазы, такие как финастерид;(iii) средства, которые ингибируют инвазию злокачественных клеток (например, ингибиторы металлопротеиназы, такие как маримастат, и ингибиторы функции рецептора урокиназного активатора плазминогена);(iv) ингибиторы действия фактора роста, например, такие ингибиторы включают антитела к фактору роста, антитела к рецептору фактора роста (например, анти-erbb2 антитело трастузумаб [Herceptin] и анти-erbb1 антитело цетуксимаб [С 225]), ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназы и ингибиторы серин-треонин киназы, например, ингибиторы семейства фактора роста эпидермиса(гефитиниб,AZD1839),N-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3 морфолинопропокси)хиназолин-4-амин (Cl 1033, например, ингибиторы семейства фактора роста производных тромбоцитов и, например, ингибиторы семейства фактора роста гепатоцитов; (v) антиангиогенные вещества, такие как те, которые ингибируют действие фактора роста эндотелия сосудов, (например, антитело к фактору роста клеток эндотелия сосудов бевацизумаб [Avastin], соединения, которые описаны в опубликованных международных заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354), и соединения, которые действуют по другому механизму (например, линомид, ингибиторы действия интегрина v3 и ангиостатин);(vi) вещества, повреждающие сосуды, такие как комбретастатин А 4, и соединения, описанные в международных заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213; (vii) антисмысловая терапия, например, такая, которая направлена на вышеперечисленные мишени, такая как ISIS 2503, антисмысловая терапия на основе гена ras;(viii) способы генной терапии, включая, например, способы замены аберрантных генов, такие как способы аберрации р 53 или аберрации BRCA1 или BRCA2, GDEPT (пролекарственная терапия, направленная на ген фермента), способы с использованием деаминазы цитозина, тимидинкиназы или бактериальной нитроредуктазы и способы повышения устойчивости пациента к химиотерапии или радиотерапии, такие как генная терапия резистентности ко многим лекарственным средствам; и (ix) способы иммунотерапии, включая, например, способы повышения иммуногенности опухолевых клеток пациента в условиях ex vivo и in vivo, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или фактор стимуляции колоний гранулоцитов-макрофагов, способы снижения активности Т-клеток,способы с использованием трансфектированных иммунных клеток, таких как цитокинтрансфектированные дендритные клетки, способы с использованием цитокинтрансфектированных линий опухолевых клеток и способы с использованием антиидиотипичных антител. Лекарственные средства, приведенные ниже в табл. 1, предпочтительно, но не исключительно, комбинируют с соединениями формулы I. Комбинированное лечение этого типа можно осуществлять с помощью одновременного, последовательного или отдельного дозирования отдельных компонентов для лечения. В комбинированных продуктах этого типа используют соединения в соответствии с изобретением. Исследования Соединения формулы I, описанные в примерах, исследовались в анализах, описанных ниже, и было обнаружено, что они обладают ингибирующей активностью по отношению к киназе. Из литературы известны другие исследования и они легко могут быть осуществлены специалистом в данной области (см.,например, Dhanabal и др., Cancer Res. 59:189-197; Xin и др., J. Biol. Chem. 274:9116-9121; Sheu и др.,Anticancer Res. 18:4435-4441; Ausprunk и др., Dev. Biol. 38:237-248; Gimbrone и др., J. Natl. Cancer Inst. 52:413-427; Nicosia и др., In Vitro 18:538-549). Измерение активности Met киназы Согласно данным производителя (Met, активная, upstate,по каталогу 14-526), Met киназу экспрессировали для получения белка в клетках насекомых (Sf21; S. frugiperda) и затем очищали с помощью аффинной хроматографии в виде "N-концевого 6His-меченого" рекомбинантного белка человека в бакуловирусном экспрессионном векторе. Активность киназы может быть измерена с помощью различных доступных измерительных систем. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19),анализе флэш-планшетов или тесте связывания на фильтре измеряют радиоактивное фосфорилирование белка или пептида в качестве субстрата с помощью радиоактивно меченного АТР (32 Р-АТР, 33 Р-АТР). В присутствии ингибиторного соединения может быть обнаружено снижение радиоактивного сигнала или отсутствие сигналов. Кроме того, в качестве методов исследования являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени (HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. of Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфо-антитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антитела, конъюгированного в пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Метод флэш-планшетов (Met киназа) Используемыми тестируемыми планшетами являлись микротитровальные планшеты на 96 лунокFlashplateR от Perkin Elmer ( кат. SMP200). Компоненты киназной реакции, описанные ниже, питетировали в планшет для исследования. Met киназу и субстрат поли Ala-Glu-Lys-Tyr, (pAGLT, 6:2:5:1), инкубировали в течение 3 ч при комнатной температуре с радиоактивно меченным 33 Р-АТР в присутствии и отсутствие тестируемых веществ в общем объеме 100 мкл. Реакцию останавливали с помощью 150 мкл 60 мМ раствора EDTA. После инкубирования дополнительно в течение 30 мин при комнатной темпера- 18016782 туре супернататы отфильтровывали с отсасыванием, и лунки три раза промывают каждый раз 200 мкл 0,9% раствора NaCl. Связанную радиоактивность в крови измеряли с помощью прибора для измерения сцинтилляции (Topcount NXT, Perkin-Elmer). Используемое истинное значение составляло киназную реакцию без ингибитора. Это приблизительно должно находиться в интервале 6000-9000 имп. в минуту. Используемое значение фармакологического нуля представляло собой стауроспорин в конечной концентрации 0,1 мМ. Значения ингибирования (IC50) определяли с помощью RS1MTS программы. Условия киназной реакции на лунку: 30 мкл буфера для исследования; 10 мкл тестируемого субстрата в буфере для исследования с 10% ДМСО; 10 мкл АТР (конечная концентрация 1 мкМ холодн., 0,35 мкКи 33 Р-АТР); 50 мкл смеси Met киназа/субстрат в буфере для исследования;(10 нг фермента/лунку, 50 нг pAGLT/лунку) Используемые растворы: Буфер для исследования: 50 мМ HEPES; 3 мМ хлорид магния; 3 мкМ ортованадат натрия; 3 мМ хлорид марганца (II); 1 мМ дитиотреитол (DTT); рН 7,5 (устанавливали с помощью гидроксида натрия). Стоп-раствор: 60 мМ Titriplex III (EDTA). 33 Р-АТР: Perkin-Elmer;Poly-Ala-Glu-Lys-Tyr, 6:2:5:1 : Sigmaкат. Р 1152. Тестирование в условиях in-vivo Экспериментальная методика. Самки мышей Balb/C (от: Charles River Wiga) получали в возрасте 5 недель. Их акклиматизировали,выдерживая в условиях в течение 7 дней. После этого каждой мыши подкожно вводили в тазовую область в количестве 4 млн TPR-Met/NIH3T3 клеток в 100 мкл PBS (без Са и Mg). Через 5 дней животных рандомизировали на 3 группы, таким образом, чтобы каждая группа из 9 мышей имела средний размер опухоли 110 мкл (интервал: 55-165). 100 мкл наполнителя (0,25% метилцеллюлозы/ 100 мМ ацетатный буфер, рН 5,5) вводили ежедневно контрольной группе и 200 мг/кг "А 56" или "А 91", растворенного в наполнителе (объем приблизительно 100 мкл/животное) вводили ежедневно подопытным группам, в каждом случае с помощью желудочного зонда. Через 9 дней в контроле средний объем опухоли составлял 1530 мкл и опыт заканчивали. Измерения объема опухоли: длину (L) и ширину (В) измеряли с помощью штангенциркуля и объем опухоли рассчитывали согласно формуле LВВ/2. Условия содержаний: 4 или 5 животных в клетке, питание с помощью коммерчески доступного корма для мышей (Sniff). Соединения "А 18" и "А 22" обладали значительным противоопухолевым действием. Выше и ниже все температуры приведены в градусах Цельсия (С). В последующих примерах"обычная обработка" обозначает, что при необходимости добавляют воду, рН устанавливают, при необходимости, на значение от 2 до 10 в зависимости от состава конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу высушивают над сульфатом натрия и выпаривают и остаток очищают при помощи хроматографии на силикагеле и/или кристаллизации.Rf значения на силикагеле; элюент: этилацетат/метанол 9:1. Масс-спектрометрия (МС): EI (ионизация электронным ударом) М+ FAB (бомбардировка быстрыми атомами) (М+Н)+ ESI (электрораспылительная ионизация) (М+Н)+ APCI-MC (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. Масс-спектрометрия (МС): EI (ионизация электронным ударом) М+ FAB (бомбардировка быстрыми атомами) (М+Н)+ ESI (электрораспылительная ионизация) (М+Н)+ APCI-MC (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. ВЭЖХ/МС исследования. Проводили в 3-мкм колонке Silica-Rod с 210-секундным градиентом от 20 до 100% вода/ацетонитрил/0.01%трифторуксусной кислоты, при скорости потока 2.2 мл/мин и детектировании при 220 нм. ВЭЖХ исследования (Метод А). Колонка: Chromolith RP18e 1003 мм. Скорость потока: 2 мл/мин. Растворитель А: H2O + 0.1% трифторуксусной кислоты. Растворитель В: ацетонитрил + 0.1% трифторуксусной кислоты- 19016782 Градиент 5 мин; 0-4 мин: 99:1 - 1:99; 4-5 мин: 1:99 - 1:99. ВЭЖХ исследования (метод В). Колонка: Chromolith RP18e 1003 мм. Скорость потока: 4 мл/мин. Растворитель А: H2O + 0,05% НСООН. Растворитель В: ацетонитрил + 10% растворителя А. Градиент 8 мин; 0-1 мин: 99:1 - 99:1; 1-7 мин: 99:1 - 1:99; 7-8 мин: 1:99- 1:99. ВЭЖХ исследования (Метод С). Скорость потока: 2 мл/мин; 99:01 - 0:100 вода + 0.1% (об.) ТФУ : ацетонитрил + 0.1% (об.) ТФУ; от 0.0 до 0.2 мин: 99:01; от 0.2 до 3.8 мин: 99:01- 0:100; от 3.8 до 4.2 мин: 0:100. Колонка: Chromolith Performance RP18e; длина 100 мм, внутренний диаметр 3 мм,длина волны: 220 нм; время удержания Rt в минутах [мин]. Примеры получения исходных пиридазиноновых соединений Пиридазиноны обычно получают с помощью способов, описанных в работе W. H. Coates, A. McKillop, Synthesis 1993, с. 334. Примером таких способов является синтез 3-(6-оксо-1,6-дигидропиридазин-3-ил)бензонитрила: 927 г (10.6 моль) моногидрата глиоксиловой кислоты вносят порциями в раствор 1278 г (8.80 моль) 3-ацетилбензонитрила в 1.5 л уксусной кислоты. Получающийся в результате раствор нагревают при 95 С в течение 18 ч. Смесь оставляют охладиться до 30 С и последовательно добавляют 7 л воды и 899 мл (18.5 моль) гидроксида гидразиния. Реакционную смесь перемешивают при 95 С в течение 4 ч. Смесь оставляют охладиться до 60 С и получающийся в результате осадок отфильтровывают с отсасыванием и промывают 5 л воды и 2 л ацетона. Остаток нагревают до кипения в 5 л ацетона и отфильтровывают с отсасыванием, после чего к остатку добавляют 5 л горячей уксусной кислоты и смесь нагревают при 90 С в течение 2 ч при перемешивании. Смесь оставляют охладиться до комнатной температуры и остаток отфильтровывают с отсасыванием и промывают ацетоном. Остаток вновь нагревают до 90 С с 5 л уксусной кислоты, охлаждают до комнатной температуры, отфильтровывают с отсасыванием и промывают ацетоном. Остаток сушат в вакууме: 3-(6-оксо-1,6-дигидропиридазин-3-ил)бензонитрил в виде бежевых кристаллов; ESI 198. Некоторые пиридазиноны могут быть получены в соответствии с работой А. J. Goodman и др., Tetrahedron 55 (1999), 15067-15070. Примером такого способа является альтернативный синтез 3-(6-оксо 1,6-дигидропиридазин-3-ил)бензонитрила: 2.70 кг (18.0 моль) иодида натрия добавляют порциями при комнатной температуре к смеси 5.0 л воды и 11.3 л 57%-ной водной йодистоводородной кислоты (75.2 моль). Затем к раствору, удерживая его температуру на отметке 20 С, порциями добавляют 2.00 кг (13.4 моль) 3,6-дихлорпиридазина. Реакционную смесь перемешивают при 20 С в течение 18 ч. К реакционной смеси добавляют 10 л третбутилметилового эфира и 4 л воды. Органическую фазу отделяют и промывают водой и водным раствором сульфита натрия. Органическую фазу концентрируют, добавляют гептан и получающееся в результате твердое вещество отфильтровывают с отсасыванием и промывают гептаном. Остаток сушат в вакууме: 3-хлор-6-йодпиридазин в виде бесцветных листообразных кристаллов; ESI 241.- 20016782 К раствору, находящемуся под азотом, 240 мг (1.00 ммоль) 3-хлор-6-йодпиридазина в 1 мл толуола добавляют раствор 212 мг (2.0 ммоль) карбоната натрия в 1 мл воды и смесь нагревают до 80 С. Добавляют 7.0 мг (0.010 ммоль) хлорида бис(трифенилфосфин)палладия(II), и затем по каплям добавляют раствор 147 мг (1.00 ммоль) 3-цианобензолбороновой кислоты. Реакционную смесь перемешивают при 80 С в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры, добавляют воду и твердое вещество отфильтровывают с отсасыванием и промывают водой. Остаток сушат в вакууме: 3-(6 хлорпиридазин-3-ил)бензонитрил в виде бесцветных кристаллов; ESI 216. Суспензию 85 мг (0.396 моль) 3-(6-хлорпиридазин-3-ил)бензонитрила в 0.5 мл уксусной кислоты нагревают до 80 С и перемешивают при этой температуре в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют воду и твердое вещество отфильтровывают с отсасыванием. Остаток промывают водой и сушат в вакууме: 3-(6-оксо-1,6-дигидропиридазин-3-ил)бензонитрил в виде бесцветных кристаллов. Следующие пиридазиноны предпочтительно получают с помощью этого способа: Некоторые пиридазиноны получают с помощью следующего способа. Примером этого является синтез 6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-она:(3.39 моль) пинаколинового эфира 1-метил-1 Н-пиразол-4-бороновой кислоты и 1.44 кг тригидрата трикалий фосфата. Получающуюся в результате суспензию под азотом и при перемешивании нагревают до 80 С и добавляют 59.5 г (85 ммоль) хлорида бис(трифенилфосфин)палладия(II). Реакционную смесь перемешивают при 80 С в течение 3 ч. Смесь оставляют охладиться до комнатной температуры и добавляют 9 л воды. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают водой и сушат в вакууме: 3-хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазин в виде коричневых кристаллов; ESI 195. Суспензию 615 г (2.90 моль) 3-хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазина в смеси 1.86 л муравьиной кислоты и 2.61 л воды нагревают до 80 С при перемешивании и перемешивают при этой температуре в течение 28 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют небольшое количество активированного угля и твердое вещество отфильтровывают с отсасыванием. Значение рН фильтрата устанавливают на 7, используя 40%-ный водный раствор гидроксида натрия при охлаждении льдом, и оставляют стоять при 6 С в течение 16 ч. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают водой и сушат в вакууме: 6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-он в виде бесцветных кристаллов; ESI 177. Следующие пиридазиноны предпочтительно получают с помощью этого способа: К раствору 10.0 г (69.2 ммоль) моногидрата 6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты и 3.85 г (69.2 ммоль) пропаргиламина в 200 мл ДМФА добавляют 10.6 г (69.2 ммоль) гидрата 1- 21016782 гидроксибензотриазола и 17.3 г гидрохлорида N-(3-диметиламинопропил)-N-этилкарбодиимида и получающийся в результате раствор перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь распределяют между водой и дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия, сушат над сульфатом натрия и упаривают: N-проп-2-инил-6-оксо-1,6 дигидропиридазин-3-карбоксамид в виде бесцветных кристаллов; ESI 178. К раствору 3.69 г (20.5 ммоль) N-проп-2-инил-6-оксо-1,6-дигидропиридазин-3-карбоксамида в 41 мл ацетонитрила добавляют 622 мг (2.05 ммоль) хлорида золота(III) и смесь перемешивают при комнатной температуре в течение 3 дней. Добавляют дополнительные 622 мг (2.05 ммоль) хлорида золота(III), и смесь перемешивают при комнатной температуре в течение 7 дней. Реакционную смесь упаривают и хроматографируют на силикагелевой колонке смесью дихлорметан/метанол в качестве элюента: 6-(5 метилоксазол-2-ил)-2 Н-пиридазин-3-он в виде желтоватых кристаллов; ESI 178. Получение 6-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]-2 Н-пиридазин-3-она: 1 г (4.62 ммоль) гидрохлорида 6-пиперазин-1-ил-2 Н-пиридазин-3-она (Eur. J. Med. Chem. 1992, 27,545-549) суспендируют в 10 мл ТГФ и добавляют 1.34 мл (9.69 ммоль) триэтиламина и 1.09 мл (5.08 ммоль) ди-трет-бутилдикарбоната. Смесь перемешивают при КТ в течение 15 ч и растворитель удаляют. К остатку добавляют этилацетат и воду. Белое твердое вещество остается нерастворенным. Остаток отфильтровывают с отсасыванием и промывают водой и этилацетатом и сушат в вакууме; выход 0.9 г; ВЭЖХ: Rt = 2.27 мин. (метод В); ВЭЖХ-МС: 281 (М+Н). Получение 6-(5-метил-1,2,4-оксадиазол-3-ил)-2 Н-пиридазин-3-она 20 г (125 ммоль) гидрата 6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты суспендируют в 400 мл метанола и медленно при охлаждении льдом добавляют 10.7 мл (147 ммоль) тионилхлорида. Суспензию перемешивают при 70 С в течение 15 ч, на протяжении которых все растворяется. Реакционную смесь концентрируют до объема приблизительно 100 мл, на протяжении чего образуется белый осадок. Осадок отфильтровывают с отсасыванием и промывают метанолом и сушат в вакууме. Выход 19.2 г; ВЭЖХ: Rt = 1.27 мин (метод В); ВЭЖХ-МС: 155 (М+Н). 19.27 г (125 ммоль) метил 6-оксо-1,6-дигидропиридазин-3-карбоксилата растворяют в 300 мл аммиачного метанола и смесь перемешивают при комнатной температуре в течение 16 ч. Растворитель удаляют и остаток вводят в следующую реакцию без дополнительной обработки; выход 16.5 г. 15 г (108 ммоль) 6-оксо-1,6-дигидропиридазин-3-карбоксамида суспендируют в 200 мл дихлорметана. Суспензию охлаждают до 0 С и затем по каплям добавляют 45 мл пиридина и 18 мл (129 ммоль) трифторуксусного ангидрида. Смесь перемешивают при КТ в течение 5 дней. К суспензии добавляют- 22016782 400 мл воды и затем экстрагируют 3300 мл ДХМ. Объединенные органические фазы сушат, используя сульфат натрия и упаривают досуха. В фильтрате образуется осадок. Этот осадок отфильтровывают с отсасыванием, промывают водой и сушат в вакууме. Водную фазу насыщают хлоридом натрия и экстрагируют 3300 мл этилацетата. Органическую фазу сушат и упаривают. Все 3 фракции объединяют и вводят в следующую реакцию без дополнительной очистки; выход: 14.3 г; ГХ-МС: 121 (М+). 1 г (8.26 ммоль) 6-оксо-1,6-дигидропиридазин-3-карбонитрила и 2.87 г (41.3 ммоль) хлорида гидроксиламмония суспендируют в 200 мл этанола и добавляют 5.7 мл (41.3 ммоль) триэтиламина. Реакционную смесь перемешивают при комнатной температуре в течение 5 дней. Растворитель удаляют и остаток перемешивают с водой, отфильтровывают и сушат; выход: 754 мг, буро-красное твердое вещество; ЖХМС: 155 (М+Н). К 375 мг (2.43 ммоль) N-гидрокси-6-оксо-1,6-дигидропиридазин-3-карбоксамидина добавляют 2.8 мл ледяной уксусной кислоты, 2.3 мл уксусного ангидрида и 200 мкл пиридина и смесь перемешивают при 90 С в течение 15 ч. Во время охлаждения реакционной смеси образуется осадок, который отфильтровывают с отсасыванием, промывают водой и сушат в вакууме; выход: 253 мг, желтое твердое вещество; ВЭЖХ: Rt = 1.51 мин; ЖХ-МС: 179 (М+Н). Пример 1. Получение 2-[3-(5-метилпиримидин-2-ил)бензил]-6-(3,4,5-трифторфенил)-2 Н-пиридазин 3-она ("А 1") проводят согласно следующей схеме: 1.1 К раствору 4.52 г (20 ммоль) 6-(3,4,5-трифторфенил)-2 Н-пиридазин-3-она и 5.06 г (20 ммоль) 3(3-бромметилфенил)-5-метил-1,2,4-оксадиазола (получен с помощью метода, описанного в работе W. W. К. R. Mederski и др., Tetrahedron 55, 1999, 12757-12770) в 40 мл 1-метилпирролидинона (NMP) добавляют 6.52 г (20 ммоль) карбоната цезия и получающуюся в результате суспензию перемешивают при комнатной температуре в течение 18 ч. К реакционной смеси добавляют воду и получающийся в результате осадок отфильтровывают, промывают водой и сушат. Сырой продукт перекристаллизовывают из 2 пропанола: 6-(3,4,5-трифторфенил)-2-[3-(5-метил-1,2,4-оксадиазол-3-ил)бензил]-2 Н-пиридазин-3-он в виде бледно-желтоватых кристаллов; ESI 399. 1.2 К раствору 6.00 г (14.9 ммоль) 6-(3,4,5-трифторфенил)-2-[3-(5-метил-1,2,4-оксадиазол-3 ил)бензил]-2 Н-пиридазин-3-она в 60 мл метанола добавляют 2 мл уксусной кислоты, 2 мл воды и 6 г никеля Ренея и смесь гидрируют при комнатной температуре и атмосферном давлении в течение 44 ч. Реакционную смесь отфильтровывают и фильтрат упаривают. Кристаллический остаток кипятят в третбутилметиловом эфире. Смесь оставляют охладиться и твердое вещество отфильтровывают с отсасыванием и промывают трет-бутилметиловым эфиром. Остаток сушат в вакууме и оставляют охладиться. Ацетат 3-[6-оксо-3-(3,4,5-трифторфенил)-6 Н-пиридазин-1-илметил]бензамидиния в виде бесцветных кристаллов; ESI 359. Ацетат 3-[6-оксо-3-(3,5-дифторфенил)-6 Н-пиридазин-1-илметил]бензамидиния, бесцветные кристаллы, получают аналогично; ESI 341. 1.3 К суспензии 4.18 г (10.0 ммоль) ацетата 3-[6-оксо-3-(3,4,5-трифторфенил)-6 Н-пиридазин-1 илметил]бензамидиния в 40 мл метанола добавляют 1.31 мл (11.0 ммоль) 3-этоксиметакролеина и 2.04- 23016782 мл (11.0 ммоль) 30%-ного раствора метилата натрия в метаноле и смесь нагревают при 50 С в течение 18 ч. Смесь оставляют охладиться и получающийся в результате осадок отфильтровывают с отсасыванием,промывают метанолом и сушат в вакууме: 2-[3-(5-метилпиримидин-2-ил)бензил]-6-(3,4,5 трифторфенил)-2 Н-пиридазин-3-он ("А 1") в виде бесцветных кристаллов; ESI 409; 1 Н-ЯМР (ДМСО-d6):[м.д.] = 2.32 (s, 3 Н), 5.45 (s, 2 Н), 7.16 (d, J = 9.5 Гц, 1 Н), 7.52 (m, 2 Н), 7.90 (m, 2 Н), 8.13 (d, J = 9.5 Гц, 1 Н),8.30 (dt, J1 = 7.5 Гц, J2 = 1.5 Гц, 1 Н), 8.46 (t, J = 1.5 Гц, 1 Н), 8.75 (s, 2H). Аналогичная реакция ацетата бензамидиния с 4-триметилсилил-3-бутин-1-оном и с карбонатом калия/в ацетонитриле при 120 С в микроволновой печи дает следующие соединения 6-(3,5-дифторфенил)2-[3-(5-метилпиримидин-2-ил)бензил]-2 Н-пиридазин-3-он ("А 2"), ESI 391; 2-[3-(4-метилпиримидин-2-ил)бензил]-6-(3,4,5-трифторфенил)-2 Н-пиридазин-3-он ("A3"), ESI 409. Нагревание ацетата бензамидиния при 175 С с бисдиметилацеталем малондиальдегида аналогичным образом дает соединение 2-(3-пиримидин-2-илбензил)-6-(3,4,5-трифторфенил)-2 Н-пиридазин-3-он("А 4"), ESI 395. Пример 2. Получение 4-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилморфолин-3-она ("А 5") проводят согласно следующей схеме: 2.1. К суспензии, находящейся под азотом, 3.12 г (15.0 ммоль) 6-(3,5-дифторфенил)-2 Н-пиридазин 3-она в 80 мл ТГФ добавляют 2.83 г (22.5 ммоль) 3-аминобензилового спирта и 5.96 г (22.5 ммоль) трифенилфосфина и смесь перемешивают при комнатной температуре в течение 30 мин. Суспензию охлаждают до 0 С, и по каплям добавляют 4.65 мл (22.5 ммоль) диизопропилазодикарбоксилата (DIAD). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь упаривают и остаток нагревают в 50 мл изопропанола и оставляют охладиться. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают изопропанолом и трет-бутилметиловым эфиром и сушат в вакууме: 2-(3-аминобензил)-6-(3,5-дифторфенил)-2 Н-пиридазин-3-он в виде бесцветных кристаллов; ESI 314. 2.2. К суспензии 313 мг (1.00 ммоль) 2-(3-аминобензил)-6-(3,5-дифторфенил)-2 Н-пиридазин-3-она в 2 мл толуола добавляют 235 мг (1.5 ммоль) (2-хлорэтокси)ацетилхлорида и смесь кипятят в течение 18 ч. Смесь оставляют охладиться и получающийся в результате осадок отфильтровывают с отсасыванием,промывают трет-бутилметиловым эфиром и сушат в вакууме: 2-(2-хлорэтокси)-N-3-[3-(3,5 дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилацетамид в виде бесцветных кристаллов; ESI 434. 2.3. К раствору 339 мг (0.78 ммоль) 2-(2-хлорэтокси)-N-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилацетамида в 2 мл ацетонитрила добавляют 509 мг (1.56 ммоль) карбоната цезия и смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь отфильтровывают и фильтрат упаривают. Остаток вносят в трет-бутилметиловый эфир, отфильтровывают с отсасыванием и промывают трет-бутилметиловым эфиром: 4-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1 илметил]фенилморфолин-3-он ("А 5") в виде бесцветных кристаллов; ESI 398. Аналогичная реакция производного анилина с 3-хлорпропилхлорформиатом дает следующие соединения: 3-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенил-1,3-оксазинан-2-он. 3-3-[6-оксо-3-(3,4,5-трифторфенил)-6 Н-пиридазин-1-илметил]фенил-1,3-оксазинан-2-он ("А 7"),ESI 416. Пример 3. Получение 1-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенил-3-метил 6 Н-пиридазин-6-она ("А 8") проводят согласно следующей схеме: 3.1 К суспензии, находящейся под азотом, 2.92 г (14.0 ммоль) 6-(3,5-дифторфенил)-2 Н-пиридазин 3-она в 100 мл ТГФ добавляют 5.03 г (21.1 ммоль) 3-йодбензилового спирта и 5.55 г (20.9 ммоль) трифенилфосфина и смесь перемешивают при комнатной температуре в течение 30 мин. Суспензию охлаждают до 0 С и по каплям добавляют 4.33 мл (20.9 ммоль) диизопропилазодикарбоксилата. Реакционную смесь перемешивают при комнатной температуре в течение 1.5 ч. Реакционную смесь упаривают и остаток нагревают в 50 мл изопропанола и оставляют охладиться. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают изопропанолом и петролейным эфиром и сушат в вакууме: 6-(3,5-дифторфенил)-2-(3-йодбензил)-2 Н-пиридазин-3-он в виде бесцветных кристаллов; ESI 425. 3.2 К раствору 212 мг (0.50 ммоль) 6-(3,5-дифторфенил)-2-(3-йодбензил)-2 Н-пиридазин-3-она и 55.1 мг (0.5 ммоль) 6-метилпиридазин-3(2 Н)-она в 2 мл ДМФА добавляют 14.3 мг (0.08 ммоль) йодида меди(I), 76 мг (0.55 ммоль) карбоната калия и 11 мг (0.08 ммоль) 8-гидроксихинолина и смесь нагревают при 120 С в течение 24 ч. Реакционную смесь оставляют охладиться и добавляют 10%-ный водный раствор аммиака и этилацетат. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают водой и сушат. Остаток кипятят в этилацетате, отфильтровывают с отсасыванием и промывают этилацетатом. Остаток сушат в вакууме: 1-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1 илметил]фенил-3-метил-6 Н-пиридазин-6-он ("А 8") в виде коричневатых кристаллов; ESI 407. Пример 4. Получение 6-(3,5-дифторфенил)-2-[3-(5-метилпиридин-2-ил)бензил]-2 Н-пиридазин-3-она("А 9") проводят согласно следующей схеме: 4.1. К суспензии, находящейся под азотом, 849 мг (4.0 ммоль) трикалий фосфата, 344 мг (2.0 ммоль) 2-бром-5-метилпиридина и 304 мг (2.0 ммоль) 3-гидроксиметилбензолбороновой кислоты в 12 мл диоксана и 1 мл воды добавляют 92 мг (0.08 ммоль) тетракис(трифенилфосфин)палладия, и смесь кипятят при перемешивании в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и распределяют между водой и этилацетатом. Органическую фазу сушат над сульфатом натрия и упаривают, и остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: [3-(5-метилпиридин-2-ил)фенил]метанол в виде желтоватого масла; ESI 200. 4.2. К раствору 88 мг (0.44 ммоль) [3-(5-метилпиридин-2-ил)фенил]метанола, 138 мг (0.66 ммоль) 6(3,5-дифторфенил)-2 Н-пиридазин-3-она и 174 мг (0.66 ммоль) трифенилфосфина в 3.5 мл ТГФ добавляют 134 мг (0.66 ммоль) диизопропилазодикарбоксилата. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Смесь упаривают и остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: 6-(3,5-дифторфенил)-2-[3-(5 метилпиридин-2-ил)бензил]-2 Н-пиридазин-3-он ("А 9") в виде бесцветных кристаллов; ESI 390. Следующие соединения получают аналогично. 6-(3,5-Дифторфенил)-2-[3-(5-метоксипиридин-2-ил)бензил]-2 Н-пиридазин-3-он.("А 11") и 6-(3,5-дифторфенил)-2-3-[5-(4-метилпиперазин-1-ил)пиридин-2-ил]бензил-2 Н-пиридазин-3 она ("А 12") проводят согласно следующей схеме: 5.1. Суспензию, находящуюся под азотом, 3.69 г (18.2 ммоль) 2-бром-5-нитропиридина, 840 мг (0.73 ммоль) тетракис(трифенилфосфин)палладия и 3.55 г (33.4 ммоль) карбоната натрия в 133 мл толуола нагревают до кипения. Затем по каплям добавляют раствор 5.07 г (32.7 ммоль) 3-(гидроксиметил) безолбороновой кислоты в 133 мл толуола и реакционную смесь кипятят в течение 18 ч. К реакционной смеси добавляют воду. Органическую фазу отделяют, а водную экстрагируют несколько раз толуолом. Объединенные органические фазы сушат над сульфатом натрия и упаривают. Остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол: [3-(5-нитропиридин-2-ил)фенил]метанол в виде жлтых кристаллов; ESI 231. 5.2. К раствору 3.37 г (14.7 ммоль) [3-(5-нитропиридин-2-ил)фенил]метанола, 4.58 г (22.0 ммоль) 6(3,5-дифторфенил)-2 Н-пиридазин-3-она и 5.77 г (22.0 ммоль) трифенилфосфина в 120 мл ТГФ по каплям добавляют 4.46 г (22.0 ммоль) диизопропилазодикарбоксилата и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают ТГФ и сушат в вакууме: 6-(3,5-дифторфенил)-2-[3-(5-нитропиридин-2-ил)бензил]2 Н-пиридазин-3-он в виде желтоватых кристаллов; ESI 421. 5.3. Суспензии 420 мг (1.00 ммоль) 6-(3,5-дифторфенил)-2-[3-(5-нитропиридин-2-ил)бензил]-2 Нпиридазин-3-она в 4 мл этанола добавляют 220 мкл 2 н. соляной кислоты и смесь нагревают до 95 С и охлаждают до комнатной температуры. Добавляют 402 мг (7.2 ммоль) железного порошка и реакционную смесь перемешивают при 85 С в течение 1 ч и при 60 С в течение 17 ч. Реакционную смесь отфильтровывают и фильтрат распределяют между водой и этилацетатом. Органическую фазу промывают последовательно раствором гидрокарбоната натрия, раствором карбоната натрия и раствором хлорида натрия, сушат над сульфатом натрия и упаривают: 2-[3-(5-аминопиридин-2-ил)бензил]-6-(3,5 дифторфенил)-2 Н-пиридазин-3-он ("А 11") в виде коричневатой пены; ESI 391. 5.4. Последнюю стадию проводят аналогично примеру 9.3, получая 6-(3,5-дифторфенил)-2-3-[5-(4 метилпиперазин-1-ил)пиридин 2-ил]бензил-2 Н-пиридазин-3-он ("А 12"). Пример 6. Получение 6-(3,5-дифторфенил)-2-[3-(4-пиперазин-1-илпиримидин-2-ил)бензил]-2 Нпиридазин-3-она ("А 13") проводят согласно следующей схеме: 6.1. Раствор катализатора, полученный путем реакции 56 мг (0.08 ммоль) хлорида бис(трифенилфосфин)палладия(II) и 3.0 мг (0.08 ммоль) борогидрида натрия, в 0.4 мл ТГФ при 55 С добавляют к суспензии, находящейся под азотом, 849 мг (4.0 ммоль) трикалий фосфата, 598 мг (2.0 ммоль) трет-бутил 4- 26016782(2-хлорпиримидин-4-ил)пиперазин-1-карбоксилата (полученного в соответствии с WO 03104225) и 304 мг (2.0 ммоль) 3-гидроксиметилбензолбороновой кислоты в 12 мл диоксана и 1 мл воды. Реакционную смесь перемешивают при 97 С в течение 18 ч. Реакционную смесь охлаждают и распределяют между водой и этилацетатом. Органическую фазу сушат над сульфатом натрия и упаривают и остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: третбутил 4-[2-(3-гидроксиметилфенил)пиримидин-4-ил]пиперазин-1-карбоксилат в виде желтоватого твердого вещества; ESI 371. 6.2. К раствору 144 мг (0.388 ммоль) трет-бутил 4-[2-(3-гидроксиметилфенил)пиримидин-4 ил]пиперазин-1-карбоксилата, 122 мг (0.582 ммоль) 6-(3,5-дифторфенил)-2 Н-пиридазин-3-она и 153 мг(0.582 ммоль) трифенилфосфина в 3 мл ТГФ добавляют 118 мг (0.582 ммоль) диизопропилазодикарбоксилата. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Смесь упаривают и остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: трет-бутил 4-(2-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилпиримидин-4-ил)пиперазин-1-карбоксилат в виде желтоватого масла; ESI 561. 6.3. К раствору 81 мг (0.14 ммоль) трет-бутил 4-(2-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1 илметил]фенилпиримидин-4-ил)пиперазин-1-карбоксилата в 1 мл диоксана добавляют 1.3 мл 4 н. HCl в диоксане, и смесь оставляют стоять при комнатной температуре в течение 18 ч. Реакционную смесь распределяют между водой и этилацетатом. Значение рН водной фазы устанавливают на 14, используя 1 н.NaOH, и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия и упаривают: гидрохлорид 6-(3,5-дифторфенил)-2-[3-(4-пиперазин-1-илпиримидин-2-ил)бензил]-2 Н-пиридазин-3-он("А 13") в виде бесцветного аморфного твердого вещества; ESI 461. Следующее соединение получают аналогично 6-(3,5-дифторфенил)-2-3-[4-(метилпиперидин-4 иламино)пиримидин-2-ил]бензил-2 Н-пиридазин-3-он. Пример 7. Получение 6-(3,5-дифторфенил)-2-3-[5-(4-метилпиперазин-1-илметил)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она ("А 14") проводят согласно следующей схеме 7.1. К суспензии, находящейся под азотом, 4.00 г (10.0 ммоль) ацетата 3-[6-оксо-3-(3,5 дифторфенил)-6 Н-пиридазин-1-илметил]бензамидиния и 4.64 г (13.0 ммоль) бистетрафторбората 2 диметиламинометилен-1,3-бис-(диметилиммонио)пропана (получен с помощью метода, описанного в работе Р. J. Coleman и др., J. Med. Chem. 2004, 47, 4829-4837) в 280 мл этанола добавляют 12.0 мл (31.5 ммоль) 20%-ного раствора этилата натрия в этаноле и смесь кипятят в течение 2 ч. Реакционную смесь охлаждают, упаривают вакууме и обрабатывают водой. Получающийся в результате осадок отфильтровывают с отсасыванием и промывают водой. Остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол: 2-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилпиримидин-5-карбальдегид в виде бесцветных кристаллов; ESI 405. 7.2. Суспензию 472 мг (1.17 ммоль) 2-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил] фенилпиримидин-5-карбальдегида в 5 мл дихлорметана последовательно смешивают с 166 мкл 1 метилпиперазина, 495 мг (2.34 ммоль) триацетоксиборогидрида натрия и 67 мкл уксусной кислоты и реакционную смесь перемешивают при комнатной температуре в течение 42 ч. Реакционную смесь распределяют между дихлорметаном и 1 н. NaOH. Органическую фазу отделяют, сушат над сульфатом натрия и упаривают. Остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: 6-(3,5-дифторфенил)-2-3-[5-(4-метилпиперазин-1-илметил)пиримидин 2-ил]бензил-2 Н-пиридазин-3-он ("А 14") в виде бесцветных кристаллов; ESI 489; 1 Н-ЯМР (CDCl3):[м.д.] = 2.29 (s, 3 Н), 2.48 (m, 8H), 3.54 (s, 2H), 5.50 (s, 2H), 6.86 (tt, J1 = 8.8 Гц, J2 = 2.3 Гц, 1H), 7.04 (d, J = 9.5 Гц, 1H), 7.34 (m, 2H), 7.47 (t, J = 7.8 Гц, 1H), 7.58 (d, J = 9.5 Гц, 1H), 7.58 (m,- 27016782 1H), 8.38 (dt, J1 = 7.8 Гц, J2 = 1 Гц, 1 Н), 8.64 (t, J = 1 Гц, 1H), 8.74 (s, 2H). Следующее соединение получают аналогично 6-(3,5-дифторфенил)-2-[3-(5-диметиламинометилпиримидин-2-ил)бензил]-2 Н-пиридазин-3-он. Пример 8. Получение 3-1-[3-(5-метилпиримидин-2-ил)бензил]-6-оксо-1,6-дигидропиридазин-3 илбензонитрила ("А 15") проводят согласно следующей схеме 8.1. К суспензии 2.41 г (10.0 ммоль) ацетата метил 3-карбамимидоилбензоата (получение см. пример 37) в 40 мл метанола добавляют 1.31 мл (11.0 ммоль) 3-этоксиметакролеина и 2.04 мл (11.0 ммоль) 30%-ного раствора этилата натрия в метаноле и получающийся в результате раствор перемешивают при 50 С в течение 18 ч. Реакционную смесь упаривают в вакууме и добавляют воду. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают водой и сушат в вакууме: метил 3-(5 метилпиримидин-2-ил)бензоат в виде бесцветных кристаллов; ESI 229. 8.2. К суспензии 400 мг (10.6 ммоль) борогидрида натрия в 20 мл ТГФ добавляют 600 мг (5.41 ммоль) порошкообразного хлорида кальция и смесь перемешивают при комнатной температуре в течение 1.5 ч. К этой суспензии по каплям при перемешивании добавляют раствор 751 мг (3.29 ммоль) метил 3-(5-метилпиримидин-2-ил)бензоата в 10 мл ТГФ и смесь перемешивают при комнатной температуре в течение 18 ч. К реакционной смеси добавляют 10 мл 1 н. NaOH, воду и дихлорметан и смесь затем фильтруют. Органическую фазу фильтрата отделяют, сушат над сульфатом натрия и упаривают. Остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента:[3-(5-метилпиримидин-2-ил)фенил]метанол в виде бесцветного твердого вещества; ESI 201. 8.3. К суспензии 98.6 мг (0.50 ммоль) 3-(6-оксо-1,6-дигидропиридазин-3-ил)бензонитрила, 100 мг(0.50 ммоль) [3-(5-метилпиримидин-2-ил)фенил]метанола и 197 мг (0.75 ммоль) трифенилфосфина в 3 мл ТГФ добавляют по каплям 147 мкл (0.75 ммоль) диизопропилдиазодикарбоксилата и получающийся в результате раствор перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь упаривают в вакууме и к остатку добавляют 2-пропанол. Получающийся в результате осадок отфильтровывают с отсасыванием и хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол в качестве элюента: 3-1-[3-(5-метилпиримидин-2-ил)бензил]-6-оксо-1,6-дигидропиридазин 3-илбензонитрил ("А 15") в виде желтоватого твердого вещества; ESI 380; 1 Н-ЯМР (ДМСО-d6):[м.д.] = 2.31 (s, 3 Н), 5.46 (s, 2 Н), 7.16 (d, J = 9.7 Гц, 1 Н), 7.51 (m, 2 Н), 7.72 (t, J= 8.0 Гц, 1 Н), 7.93 (dt, J1 = 7.5 Гц, J2 = 1 Гц, 1 Н), 8.17 (d, J = 9.7 Гц, 1 Н), 8.25 (dt, J1 = 7.8 Гц, J2= 1 Гц, 1 Н),8.30 (dt, J1 = 6.8 Гц, J2 = 1.6 Гц, 1 Н), 8.37 (t, J = 1.6 Гц, 1 Н), 8.46 (bs, 1H), 8.75 (s, 2H). Следующие соединения получают аналогично 6-бензо-1,2,5-тиадиазол-5-ил-2-[3-(5 метилпиримидин-2-ил)бензил]-2 Н-пиридазин-3-он, ESI 413.("А 16"),2-[3-(5-аминопиримидин-2-ил)бензил]-6-(3,5 дифторфенил)-2 Н-пиридазин-3-она ("А 17") и 6-(3,5-дифторфенил)-2-3-[5-(4-метилпиперазин-1-ил)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она ("А 18") проводят согласно следующей схеме: 9.1. Раствор метилата натрия, полученный путем растворения 3.45 г (150 ммоль) натрия в 35 мл метанола, по каплям добавляют к суспензии, находящейся под азотом, 20.0 г (50.0 ммоль) ацетата 3-[6 оксо-3-(3,5-дифторфенил)-6 Н-пиридазин-1-илметил]бензамидиния и 24.4 г (50.0 ммоль) дигексафторфосфата (2-диметиламино-1-[диметилиммониометил]виниламинометилен)диметиламмония в 20 мл метанола. Реакционную смесь медленно нагревают до 60 С и перемешивают при этой температуре в течение 20 мин. Реакционную смесь охлаждают до комнатной температуры и распределяют между водой и дихлорметаном. Органическую фазу сушат над сульфатом натрия и упаривают. Остаток вносят в метанол, отфильтровывают с отсасыванием, остаток промывают эфиром и сушат в вакууме: N'-(2-3-[3-(3,5 дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилпиримидин-5-ил)-N,N-диметилформамидин("А 16") в виде бесцветных кристаллов; ESI 447. 9.2. К раствору 19.1 г (137 ммоль) карбоната калия в 380 мл воды добавляют 190 мл диоксана и 17.4 г (39.0 ммоль) N'-(2-3-[3-(3,5-дифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилпиримидин-5-ил)N,N-диметилформамидина. Реакционную смесь кипятят в течение 3 дней и затем охлаждают до комнатной температуры. Получающийся в результате осадок отфильтровывают с отсасыванием, промывают водой и сушат в вакууме: 2-[3-(5-аминопиримидин-2-ил)бензил]-6-(3,5-дифторфенил)-2 Н-пиридазин-3 он ("А 17") в виде бесцветных кристаллов; ESI 392. 9.3. К раствору, находящемуся под азотом, 587 мг (1.5 ммоль) 2-[3-(5-аминопиримидин-2 ил)бензил]-6-(3,5-дифторфенил)-2 Н-пиридазин-3-она в 2 мл 1-метилпирролидона добавляют 501 мг (2.55 ммоль) хлорида бис(2-хлорэтил)метиламмония и реакционную смесь нагревают при 130 С в течение 32 ч. Реакционную смесь охлаждают, добавляют дихлорметан и смесь отфильтровывают. Фильтрат упаривают в вакууме, и остаток хроматографируют на силикагелевой колонке с помощью смеси дихлорметан/метанол. Содержащие продукт фракции объединяют и упаривают и остаток перекристаллизовывают из метанола. Это вещество суспендируют в метаноле и превращают в гидрохлорид, используя хлороводород в диэтиловом эфире, и гидрохлорид осаждают, используя диэтиловый эфир: гидрохлорид 6-(3,5 дифторфенил)-2-3-[5-(4-метилпиперазин-1-ил)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она ("А 18") в виде бесцветных кристаллов; ESI 475; 1 Н-ЯМР (ДМСО-d6):[м.д.] = 2.81 (d, J = 3.3 Гц, 3 Н), 3.19 (m 2 Н), 3.30 (m, 2 Н), 3.50 (m, 2 Н), 4.05(m, 2 Н), 5.43 (s, 2 Н), 7.14 (d, J = 9.5 Гц, 1 Н), 7.35 (tt, J1= 8.8 Гц, J2 = 2.3 Гц, 1 Н), 7.47 (m, 2 Н), 7.66 (m, 2 Н),8.15 (d, J = 9.5 Гц, 1 Н), 8.22 (m, 1 Н) 8.34 (bs,1H), 8.65 (s, 2H), 11.0 (bs, 1H). Следующие соединения получают аналогично гидрохлорид 6-(3,5-дифторфенил)-2-[3-(5-пиперазин 1-илпиримидин-2-ил)бензил]-2 Н-пиридазин-3-она ("А 19"), ESI 461, 1 Н-ЯМР (d6-ДМСО):[м.д.] = 3.25("А 20"),ESI 493; 2-3-[5-(пиперазин-1-ил)пиримидин-2-ил]бензил-6-(3,4,5-трифторфенил)-2 Нпиридазин-3-он ("А 65"); N'-(2-3-[3-(3,4,5-трифторфенил)-6-оксо-6 Н-пиридазин-1-илметил]фенилпиримидин-5-ил)-N,N-диметилформамидин ("А 76"), ESI 465; 2-[3-(5-аминопиримидин-2-ил)бензил]-6(3,4,5-трифторфенил)-2 Н-пиридазин-3-он("А 82"), ESI410. Пример 10. Получение 6-(3,5-дифторфенил)-2-[3-(5-гидроксипиримидин-2-ил)бензил]-2 Нпиридазин-3-она ("А 21") и 6-(3,5-дифторфенил)-2-3-[5-(3-диметиламинопропокси)пиримидин-2-ил] бензил-2 Н-пиридазин-3-она ("А 22") проводят согласно следующей схеме:
МПК / Метки
МПК: C07D 417/10, C07D 413/14, C07D 413/10, C07D 403/14
Метки: производные, пиридазинона
Код ссылки
<a href="https://eas.patents.su/30-16782-proizvodnye-piridazinona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридазинона</a>
Предыдущий патент: Триазолиламинопиримидиновые соединения
Следующий патент: Антигенсвязывающие белки для il-18 рецептора и их применение
Случайный патент: Регулирующий клапан для газовых сред












