Азольные соединения для применения в качестве fxr модуляторов
Номер патента: 16475
Опубликовано: 30.05.2012
Авторы: Маннинен Питер Рудольф, Генин Майкл Джеймс, Буэно Мелендо Ана Белен, Ахехас-Чичарро Франсиско Хавьер, Варшавски Алан М.
Формула / Реферат
1. Соединение формулы I
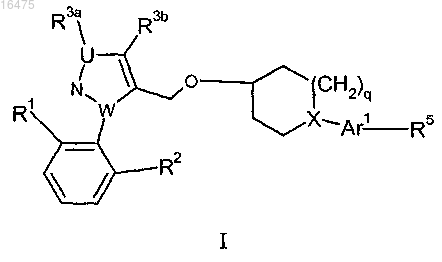
где q равен 1 или 2 при условии, что, если X представляет собой С, q равен 1;
U представляет собой О, N или С при условии, что если U представляет собой О или N, то R3a отсутствует; и при условии, что, если U представляет собой N или С, UN-связь представляет собой двойную связь; и при условии, что, если W представляет собой С, WN-связь представляет собой двойную связь;
W представляет собой С или N;
X представляет собой С или N;
R1 представляет собой хлор, фтор или трифторметокси;
R2 представляет собой водород, хлор, фтор или трифторметокси;
R3a представляет собой водород или отсутствует;
R3b представляет собой трифторметил, циклопропил или изопропил;
Ar1 выбирают из группы, включающей 6-индолил, 6-бензотиенил, 4-нафтил, 4-фенил и 2-пиридинил, каждый из которых необязательно содержит в качестве заместителей одну или две группы, независимо выбранных из метила, этила и фенила; и
R5 представляет собой СООН;
или фармацевтически приемлемая соль, энантиомер или диастереомер указанного соединения, или их смесь.
2. Соединение по п.1, представляющее собой соединение формулы
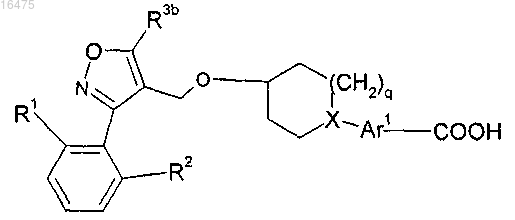
где q равен 1 или 2;
R1 представляет собой хлор, фтор или трифторметокси;
R2 представляет собой водород, хлор, фтор или трифторметокси;
R3b представляет собой трифторметил, циклопропил или изопропил;
X представляет собой С или N при условии, что, если X представляет собой С, q равен 1;
Ar1 выбирают из группы, состоящей из бензоизотиазолила, бензотиенила, индазолила, индолила, нафтила, фенила и пиридинила, каждый из которых необязательно содержит метил или фенил;
или фармацевтически приемлемая соль или энантиомер указанного соединения.
3. Соединение по п.2, отличающееся тем, что R1 представляет собой хлор или трифторметокси и R2 представляет собой водород или хлор; или фармацевтически приемлемая соль или энантиомер указанного соединения.
4. Соединение по п.2, отличающееся тем, что Ar1 представляет собой 6-бензоизотиазолил, 5-бензотиенил, 6-бензотиенил, 6-индазолил, 5-индолил, 6-индолил или 4-фенил, каждый из которых необязательно содержит в качестве заместителя метил; или фармацевтически приемлемая соль или энантиомер указанного соединения.
5. Соединение по п.2, отличающееся тем, что R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3b представляет собой циклопропил; X представляет собой С или N, и группа Ar1 представляет собой 4-фенил, 2-пиридинил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителя метил.
6. Соединение по п.2, выбранное из группы, включающей
5-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}бифенил-2-карбоновую кислоту,
5-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]пиперидин-1-ил}бифенил-2-карбоновую кислоту,
5-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}бифенил-2-карбоновую кислоту,
4-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}нафталин-1-карбоновую кислоту,
4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}-3-метилбензойную кислоту,
4-{4-[5-изопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]пиперидин-1-ил}бензойную кислоту,
4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}бензойную кислоту,
4-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]пиперидин-1-ил}-2-метилбензойную кислоту,
4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}-2-метилбензойную кислоту,
4-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}-2-метилбензойную кислоту,
4-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}бензойную кислоту,
6-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}-1-метил-1Н-индол-3-карбоновую кислоту,
6-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}бензо[b]тиофен-3-карбоновую кислоту,
6-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]пиперидин-1-ил}-1-метил-1Н-индол-3-карбоновую кислоту,
6-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}-1-метил-1Н-индол-3-карбоновую кислоту,
6-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}бензо[b]тиофен-3-карбоновую кислоту,
4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-карбоновую кислоту,
4-{4-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил}-3-метилбензойную кислоту,
4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил}бензойную кислоту,
6-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил}-1-метил-1Н-индол-3-карбоновую кислоту,
6-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил}бензо[b]тиофен-3-карбоновую кислоту,
транс-4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексил}бензойную кислоту,
транс-4-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил}бензойную кислоту,
транс-6-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил}-1-метил-1Н-индол-3-карбоновую кислоту и
цис-6-{4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил}-1-метил-1Н-индол-3-карбоновую кислоту;
или фармацевтически приемлемая соль или энантиомер указанного соединения.
7. Соединение, представляющее собой 4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил}бензойную кислоту
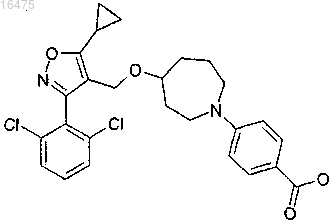
или фармацевтически приемлемая соль или энантиомер указанного соединения.
8. Соединение, представляющее собой транс-4-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексил}бензойную кислоту
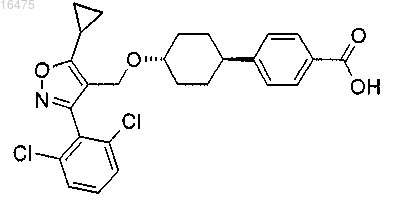
или фармацевтически приемлемая соль или энантиомер указанного соединения.
9. Соединение, представляющее собой 6-{4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил}-1-метил-1Н-индол-3-карбоновую кислоту
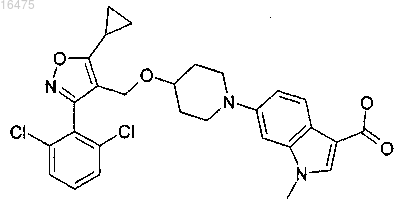
или фармацевтически приемлемая соль или энантиомер указанного соединения.
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 и носитель, разбавитель или наполнитель.
11. Применение соединения по любому из пп.1-9 для приготовления лекарственного средства для лечения дислипидемии.
Текст
АЗОЛЬНЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ FXR МОДУЛЯТОРОВ В изобретении предложены соединения формулы Генин Майкл Джеймс (US), АхехасЧичарро Франсиско Хавьер, Буэно Мелендо Ана Белен (ES), Маннинен Питер Рудольф, Варшавски Алан М. в которых значения переменных определены в описании, а также фармацевтические композиции на основе указанных соединений и способы применения указанных соединений, подходящие для лечения дислипидемии и заболеваний, связанных с дислипидемией.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 016475 Область изобретения Изобретение относится к области медицинской химии, фармакологии и медицины. В частности,изобретение относится к новым соединениям, подходящим для лечения дислипидемии и заболеваний,связанных с дислипидемией. Дислипидемия и заболевания, связанные с дислипидемией, например атеросклероз, ишемическая болезнь сердца, удар и т.п., являются основными причинами смертности, заболеваемости и экономического ущерба. Было обнаружено, что липиды плазмы, в частности холестериновые фракции, оказывают значительное влияние на общее состояние сердечно-сосудистой системы. Желательна положительная модуляция липидов плазмы, таких как триглицериды, холестерин липопротеинов высокой плотности(ХЛВП) и холестерин липопротеинов низкой плотности (ХЛНП). В настоящее время предпринимается множество попыток, направленных на разработку безопасных и эффективных соединений, подходящих для лечения заболеваний, связанных с дислипидемией. Например в заявке на патент WO 2004/048349 А 1 предложены соединения, предположительно подходящие для применения в качестве агонистов фарнезоидного рецептора X (FXR). В международной заявке РСТWO2007/092751 A3 предложены изоксазолы, подходящие для применения для модуляции FXR. В международной заявке РСТ WO 2007/140174 А 2 предложены арилтриазольные производные в качестве модуляторов FXR и их получение, фармацевтические композиции и применение при лечении дислипидемии и связанных с ней заболеваний. Агонисты FXR представляют собой лиганды ядерного рецептора, регулирующего транскрипцию генов, контролирующих метаболизм триглицеридов, холестерина и углеводов. Поскольку вышеуказанные и другие попытки разработки таких соединений пока не привели к успеху, в настоящее время попрежнему существует потребность в обнаружении и разработке соединений, предположительно являющихся высокоактивными и эффективными (на основании результатов исследований in vitro и in vivo) агонистами FXR. Такие соединения могли бы найти применение для лечения заболеваний, характеризующихся или обусловленных нежелательным липидным профилем, включая дислипидемию и связанные с ней заболевания, например, атеросклероз. В настоящем изобретении предложено соединение формулы IU представляет собой О, N или С при условии, что если U представляет собой О или N, то R3a отсутствует; и при условии, что, если U представляет собой N или С, UN-связь представляет собой двойную связь; и при условии, что, если W представляет собой С, WN-связь представляет собой двойную связь;R3a представляет собой водород или отсутствует;R3b представляет собой трифторметил, циклопропил или изопропил; Ar1 выбирают из группы,включающей 6-индолил, 6-бензотиенил, 4-нафтил, 4-фенил и 2-пиридинил, каждый из которых необязательно содержит в качестве заместителей одну или две группы, независимо выбранных из метила, этила и фенила; иR5 представляет собой СООН; или фармацевтически приемлемая соль, энантиомер или диастереомер указанного соединения, или их смесь. Соединения согласно настоящему изобретению являются агонистами FXR. Соединения согласно настоящему изобретению можно применять для обеспечения желательных изменений липидных профилей, в том числе, но не ограничиваясь ими, понижения уровней общего холестерина, понижения уровней холестерина липопротеинов низкой плотности (ЛНП), понижения уровней холестерина липопротеинов очень низкой плотности (ЛОНП), повышения уровней холестерина липопротеинов высокой плотности(ЛВП) и/или понижения уровней триглицерида. Таким образом, в настоящем изобретении предложен способ лечения состояний, опосредуемых FXR, таких как дислипидемия и заболевания, связанные с дислипидемией, включающий введение терапевтически эффективного количества соединения согласно настоящему изобретению пациенту, нуждающемуся в таком лечении. В настоящем изобретении также предложен способ лечения атеросклероза, включающий введение-1 016475 терапевтически эффективного количества соединения согласно настоящему изобретению пациенту, нуждающемуся в таком лечении. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также относится к применению соединений согласно настоящему изобретению в терапевтических целях, в частности, для лечения дислипидемии и связанных с ней заболеваний. Настоящее изобретение также относится к соединениям согласно настоящему изобретению, применяемым при лечении атеросклероза. Настоящее изобретение также относится к применению соединения согласно настоящему изобретению для получения лекарственного средства для лечения дислипидемии или связанных с ней заболеваний. Настоящее изобретение также относится к применению соединения согласно настоящему изобретению для получения лекарственного средства для лечения атеросклероза. В настоящем описании термин "дислипидемия" относится к отклонениям, связанным с липидами и липопротеинами крови, или отклонению от нормы содержания липидов и липопротеинов в крови и болезненным состояниям, возникающим, обусловленным, обостряющимся или сопровождающимся такими отклонениями (см. Borland's Illustrated Medical Dictionary, 29th edition, W.B Saunders publishing Company,New York, NY). В настоящем описании болезненные состояния, подпадающие под определение дислипидемии, включают гиперлипидемию, гипертриглицеридемию, низкое содержание ЛВП в плазме, высокое содержание ЛНП в плазме, высокое содержание ЛОНП в плазме, холестаз печени и гиперхолестеринемию. В настоящем описании термин "заболевания, связанные с дислипидемией" относится к заболеваниям, включающим, помимо прочего, атеросклероз, тромбоз, ишемическую болезнь сердца, удар и гипертензию. Заболевания, связанные с дислипидемией, также включают нарушения обмена веществ, такие как ожирение, диабет, резистентность к инсулину, и осложнения, связанные с указанными заболеваниями. Осложнения при диабете включают, помимо прочего, диабетическую ретинопатию. В настоящем описании термин "терапевтически эффективное количество" означает количество соединения согласно изобретению, которое предусмотрено одобренной схемой лечения или определяется квалифицированным специалистом и при применении в соответствии с показаниями является достаточным для лечения указанного в настоящем описании состояния. Соединения согласно изобретению могут содержать один или более хиральных центров и, таким образом, могут существовать в виде оптически активных форм. Все такие оптически активные формы или стереоизомеры находятся в рамках настоящего изобретения. Если необходим конкретный стереоизомер, его можно получить способами, хорошо известными в данной области техники. Предпочтительно, если R1 представляет собой хлор или трифторметокси. Предпочтительно, если R2 представляет собой хлор или Н. Предпочтительно, если R3b представляет собой циклопропил или изопропил. Предпочтительная группа Ar1 представляет собой необязательно замещенный 4-фенил, 2 пиридинил, 6-бензотиенил или 6-индолил. Более предпочтительно, группа Ar1 представляет собой необязательно замещенный 4-фенил, 6-индолил или 6-бензотиенил. Наиболее предпочтительная группа Ar1 представляет собой необязательно замещенный 4-фенил или 6-индолил. Предпочтительно, Ar1 необязательно содержит в качестве заместителей группу, выбранную из метила, этила и фенила. Более предпочтительным необязательным заместителем является метил. Также предпочтительным является соединение формулы I, в котором R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a представляет собой водород или отсутствует; R3b представляет собой циклопропил или изопропил, и группа Ar1 представляет собой 4 фенил, 2-пиридинил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителей группу, выбранную из метила, трифторметила или фенила. Также предпочтительным является соединение формулы I, в котором q равен 1; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3b представляет собой циклопропил, и группа Ar1 представляет собой 4-фенил, 2-пиридинил или 6-индолил, каждый из которых необязательно содержит в качестве заместителя метил. Также предпочтительным является соединение формулы I, в котором q равен 2; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3b представляет собой циклопропил; X представляет собой N, и группа Ar1 представляет собой 4-фенил, 2-пиридинил или 6-индолил,каждый из которых необязательно содержит в качестве заместителя метил. Также предпочтительным является соединение формулы I, в котором U представляет собой кислород, и W представляет собой углерод, образующие изоксазольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a отсутствует, и R3b представляет собой циклопропил, при этом группа Ar1 представляет собой 4-фенил, 2-пиридинил, 6-индолил или 6 бензотиенил, каждый из которых необязательно содержит в качестве заместителя метил. Также предпочтительным является соединение формулы I, в котором оба U и W представляют собой атомы азота, образующие триазольное кольцо; R1 представляет собой хлор или трифторметокси; R2-2 016475 представляет собой водород или хлор; R3a отсутствует, и R3b представляет собой циклопропил или изопропил, и группа Ar1 представляет собой 4-фенил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Также предпочтительным является соединение формулы I, в котором U представляет собой углерод, W представляет собой азот, образующие пиразольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a представляет собой водород, и R3b представляет собой циклопропил или изопропил, и группа Ar1 представляет собой 4-фенил, 6-индолил или 6 бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Также предпочтительным является соединение формулы I, в котором q равен 1; U представляет собой кислород, и W представляет собой углерод, образующие изоксазольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a отсутствует и R3b представляет собой циклопропил; X представляет собой С и группа Ar1 представляет собой 4-фенил, 2 пиридинил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителя метил. Также предпочтительным является соединение формулы I, в котором q равен 1; оба U и W представляют собой атомы азота с образованием триазольного кольца; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a отсутствует, и R3b представляет собой циклопропил или изопропил; X представляет собой С, и группа Ar1 представляет собой 4-фенил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Также предпочтительным является соединение формулы I, в котором q равен 1; U представляет собой углерод, W представляет собой азот, образующие пиразольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a представляет собой водород, и R3b представляет собой циклопропил или изопропил; X представляет собой С, и группа Ar1 представляет собой 4-фенил, 6-индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Также предпочтительным является соединение формулы I, в котором U представляет собой кислород, и W представляет собой углерод, образующие изоксазольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a отсутствует, и R3b представляет собой циклопропил; X представляет собой N, и группа Ar1 представляет собой 4-фенил, 2-пиридинил, 6 индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителя метил. Также предпочтительным является соединение формулы I, в котором каждый из U и W представляет собой азот, образуя триазольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a представляет собой водород, и R3b представляет собой циклопропил или изопропил; X представляет собой N, и группа Ar1 представляет собой 4-фенил, 6-индолил или 6 бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Также предпочтительным является соединение формулы I, в котором U представляет собой углерод, W представляет собой азот, образуя пиразольное кольцо; R1 представляет собой хлор или трифторметокси; R2 представляет собой водород или хлор; R3a представляет собой водород, и R3b представляет собой циклопропил или изопропил; X представляет собой N, и группа Ar1 представляет собой 4-фенил, 6 индолил или 6-бензотиенил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. В настоящем изобретении также предложено соединение формулы IaU представляет собой О, N или С; при условии, что, если U представляет собой О или N, R3a отсутствует; и при условии, что, если U представляет собой N или С, UN связь представляет собой двойную связь; при условии, что U и W не являются одновременно С; и при условии, что, если W представляет собой С, WN связь представляет собой двойную связь; и при этом UN и WN не являются одновременно двойными связями;R3a представляет собой водород или отсутствует;Ar1 выбирают из группы, включающей индолил, бензотиенил, нафтил, фенил, бензоизотиазолил,-3 016475 индазолил и пиридинил, каждый из которых необязательно содержит в качестве заместителя группу,выбранную из метила, этила и фенила; иR5 представляет собой -СООН; или его фармацевтически приемлемая соль или энантиомер указанного соединения. Предпочтительным является соединение формулы I или Ia, в котором U представляет собой О, и W представляет собой С, образующие изоксазольное кольцо В настоящем изобретении также предложено соединение формулы IIAr1 выбирают из группы, включающей индолил, бензотиенил, нафтил, фенил, бензоизотиазолил,индазолил и пиридинил, каждый из которых необязательно содержит в качестве заместителей метил или фенил; или фармацевтически приемлемая соль или энантиомер указанного соединения. Предпочтительное соединение согласно изобретению представляет собой соединение формулы I, Ia или II, в котором R1 представляет собой хлор или трифторметокси, и R2 представляет собой водород или хлор. Предпочтительно, если оба R1 и R2 представляют собой хлор, или R1 представляет собой трифторметокси и R2 представляет собой водород. Предпочтительное соединение согласно изобретению представляет собой соединение формулы I, Ia или II, в котором R3b представляет собой циклопропил или изопропил. Предпочтительно, если R3b представляет собой циклопропил. Предпочтительное соединение согласно изобретению представляет собой соединение формулы Ia или II, в котором Ar1 представляет собой 6-бензоизотиазолил, 5-бензотиенил, 6-бензотиенил, 6 индазолил, 5-индолил или 6-индолил, 4-фенил и 2-пиридинил, каждый из которых необязательно содержит в качестве заместителей метил или фенил. Предпочтительно, если Ar1 представляет собой 6-бензоизотиазолил, 5-бензотиенил, 6-бензотиенил,6-индазолил, 5-индолил, 6-индолил или 4-фенил, каждый из которых необязательно содержит в качестве заместителя метил. Наиболее предпочтительно, если группа Ar1 представляет собой 5-бензотиенил, 6 бензотиенил, 5-индолил, 6-индолил или 4-фенил, каждый из которых необязательно содержит в качестве заместителя метил. Предпочтительное соединение согласно изобретению представляет собой соединение формулы I, Ia или II, в котором q равен 1 и X представляет собой N. Предпочтительное соединение согласно изобретению представляет собой соединение формулы I, Ia или II, в котором q равен 1 и X представляет собой С. Предпочтительное соединение согласно изобретению представляет собой соединение формулы I, Ia или II, в котором q равен 2 и X представляет собой N. Соединения согласно изобретению (формулы I, Ia или II) можно получить путем комбинирования-4 016475 различных стадий, известных в данной области техники, в том числе способами, описанными ниже. Соединения формулы II получают согласно схемам, представленным ниже, где U =O, R3a отсутствует и W представляет собой С; или обеспечивается получение изоксазольного кольца. Продукты, полученные на каждой из стадий приведенных ниже схем, можно выделить с помощью традиционных способов, в том числе экстракцией, выпариванием, осаждением, хроматографией, фильтрованием, растиранием в порошок, кристаллизацией и тому подобным. На схеме, представленной ниже, все заместители, если не указано иное, являются такими, как определено ранее, а подходящие реагенты хорошо известны и применяются в данной области техники. Схема 1 На схеме 1 представлено взаимодействие подходящего соединения формулы (1) с подходящим соединением формулы (2) с получением соединения формулы I или II, где X представляет собой N. Таким образом, подходящее соединение формулы (1), в котором R1, R2, R3a, R3b, q и R5 определены при описании формулы I, и Y представляет собой уходящую группу, и подходящее соединение формулы(2), которое представляет собой соединение, в котором R5 и Ar1 определены при описании формулы (I) или представляют собой группу, которая" образует R5, как определено при описании формулы (I), например, путем образования сложного эфира, амида, сульфонамида или кислоты, реагируют с образованием соединения формулы (I) с проведением подходящих стадий введения и/или удаления защитной группы или других технологических стадий, известных специалистам в данной области техники или описанных в настоящем документе. Подходящие уходящие группы хорошо известны в данной области техники и включают галогениды, в частности хлор, бром и йод; и сульфоэфиры, такие как брозил, тозил,метансульфонил и трифторметансульфонил. Например, соединение формулы (1) реагирует с соединением формулы (2) в подходящем растворителе, таком как ацетонитрил, диметилформамид, диметилсульфоксид, тетрагидрофуран, пиридин, метилэтилкетон и т.п. Очевидно, что для проведения реакции обычно применяют избыток подходящего основания, такого как гидрид натрия, карбонат калия, трет-бутилат калия, карбонат натрия, карбонат цезия,бикарбонат натрия, триэтиламин, диизопропиэтиламин. Как правило, такие реакции проводят при температурах в диапазоне от примерно комнатной температуры до примерно температуры кипения выбранного растворителя и обычно применяют от примерно 1 до 2 эквивалентов соединения формулы (2). Кроме того, для интенсификации реакции можно добавить примерно до 2 эквивалентов краун-эфира, например,18-краун-6, а в качестве нагревательного устройства предпочтительной является микроволновая печь,когда R3b = iPr. Соединения, в которых R5 представляет собой эфир, можно превратить в соединения формулы (I), в которых R5 представляет собой кислоту, с помощью способов, хорошо известных среднему специалисту в данной области техники. Например, можно использовать гидролиз отдельных алкильных сложных эфиров в подходящих растворителях, таких как ТГФ, ацетонитрил, метанол, этанол, их водные смеси, при температурах примерно 25-100 С с подходящими основаниями, в том числе, например, NaOH, LiOH и КОН. При модификации указанного способа гидролиза в качестве источника энергии/тепла можно применять микроволновое устройство, особенно когда сложный эфир является стерически, затрудненным. Например, при использовании смесей растворителей, описанных выше, можно применять лабораторную микроволновую печь при самом низком режиме мощности и температуре примерно 125 С в течение примерно 20 мин. Если R5 представляет собой трет-бутиловый эфир, соответствующую кислоту можно получить в кислой среде, как хорошо известно специалистам в данной области техники. В ходе дополнительной необязательной стадии получают фармацевтически приемлемую соль соединения формулы (I) или (II). Образование фармацевтически приемлемых солей хорошо известно и применяется в данной области техники. См., например, P. Stahl, et al., Handbook of Pharmaceutical Salts:Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. Как очевидно, соединения формулы (1) и (2) можно легко получить с помощью способов, которые являются хорошо известными и широко применяются в данной области техники, в том числе с помощью способов и методик, аналогичных описанным в настоящем документе. Например, изоксазольные соединения формулы (1), в которых U=О и W=С, получают в ходе реакции необязательно замещенных бензальдегидов с гидроксиламином в присутствии подходящего основания, такого как триэтиламин, с последующим хлорированием с помощью подходящего хлорирующего реагента, такого как Nхлорсукцинимид, с получением хлороксимов (см., например, J. Med. Chet. 2000, 43 (16), 2971-2974). Ре-5 016475 акция хлороксимов и подходящего бета-кетоэфира в щелочной среде с подходящим основанием, таким как триэтиламин или метоксид натрия, позволяет получить изоксазольные сложные эфиры, предшествующие конечному продукту. Изоксазольные сложные эфиры можно восстановить до спиртов формулы(1) с помощью хорошо известных способов (например, DIBAL-H, LAH) и затем превратить в уходящую группу, такую как, например, галогенидная уходящая группа. Триазольные соединения формулы (1), в которых U=W=N, получают посредством реакции необязательно замещенного фенилазида с ацетиленовым сложным эфиром с последующим восстановлением до защищенного гидроксиацетилена и, необязательно, превращением в уходящую группу. Пиразольные соединения формулы (1), в которых U=СН и W= N, получают посредством реакции необязательно замещенного фенилгидразина с 1,3-дикетоэфиром (или его эквивалентом) с последующим восстановлением и, необязательно, превращением в уходящую группу. Соединения формулы (2) получают по реакции образования связи углерод-азот/реакции сочетания. Например, реакция подходящего пиперидинового производного с фторбензолом в условиях нуклеофильного ароматического замещения в подходящих растворителях, таких как ацетонитрил, с применением основания, такого как карбонат калия, при температурах, варьируемых от комнатной температуры до температуры кипения растворителя,позволяет получить соединение формулы 2, в котором X представляет собой N; q равен 1; и Ar1 представляет собой фенил. Альтернативным образом, подходящие пиперидины могут реагировать с арилгалогенидами в условиях реакций сочетания, катализируемых палладием, в растворителях, таких как диоксан, при температурах, варьирующихся от комнатной температуры до 120 С, с образованием соединений формулы (2). Альтернативным образом, подходящие пиперидины могут реагировать с арилгалогенидами в условиях реакций сочетания, катализируемых медью, в растворителях, таких как диметилсульфоксид,при температурах, варьирующихся от 85 до 120 С, с образованием соединений формулы (2). Кроме того,очевидно, что стадии, необходимые для получения соединения формулы (I), можно проводить в любом порядке, включая, например, взаимодействие части соединения формулы (2) с соединением формулы (1),при условии, что указанное взаимодействие представляет собой реакцию образования связи углеродазот/реакцию сочетания и обеспечивает получение соединения формулы I. Более конкретно, соединение формулы (3) может реагировать с соединением формулы (1), как описано выше, с образованием соединений формулы (4), которые после снятия защиты можно превратить в соединения формулы (I) посредством реакций образования связи углерод-азот с соединениями формулы (5) (схема 2). Соединения формулы (5) можно купить или синтезировать из приобретенных промежуточных соединений. Например, 6 броминдол-3-карбоновую кислоту можно приобрести и превратить в производное метилового или третбутилового эфира. Производное метилового эфира 6-броминдол-3-карбоновой кислоты можно применять непосредственно в реакции сочетания с амином, как описано в настоящем документе. Производное трет-бутилового эфира 6-броминдол-3-карбоновой кислоты можно применять в реакции сочетания C-N,описанной в настоящем документе, или предпочтительно, превратить в производное йода с применением, например, NaI и CuI, в присутствии подходящего основания и растворителя, с помощью процедур,известных специалисту в данной области техники. Альтернативным образом метилэфирное производное 6-броминдол-3-карбоновой кислоты можно применять в качестве бромсодержащего соединения. Специалисту в данной области техники известны другие защитные группы и/или другие уходящие группы,которые могут лучше подходить для конкретных групп Ar1. Таким образом, для специалиста в данной области техники очевидно, что существует много способов проведения реакций образования связи углерод-азот, в том числе, например, применение иодида меди (I) и подходящего органического основания, применение палладиевого катализатора, такого какPd2(dba)3, в присутствии лигандов, таких как S-Phos, X-Phos или BINAP, применение неорганического основания, такого как карбонат цезия, и подходящего растворителя, такого как ксилол, для получения соединений формулы (I). Схема 2 Соединения формулы 3, в которых q равен 2, обычно получают из коммерчески доступного азепан 4-она или его защищенного производного. Азепан-4-он защищают, например, в виде трет-6 016475 бутилкарбамата посредством реакции с ди-трет-бутилдикарбонатом с образованием Вос-защищенного производного. Затем защищенное промежуточное соединение восстанавливают до спирта в условиях,хорошо известных в данной области техники, с получением соединения формулы 3, в котором q равен 2. Специалист в данной области техники способен получить соединения формулы 3 согласно методикам,описанным в настоящем документе, и/или доступным в соответствующих справочных материалах. На схеме 3 представлена реакция подходящего соединения формулы (1) с подходящим соединением формулы (6) с получением соединений формулы (I), где X = СН. Схема 3 Таким образом, подходящее соединение формулы (1), в котором R1, R2, R3a, R3b, q и R5 определены при описании формулы (I), и Y представляет собой уходящую группу, и подходящее соединение формулы (6), которое представляет собой соединение, в котором R5, X представляет собой СН, и Ar1 определены при описании формулы (I) или представляют собой группу, которая образует R5, как определено при описании формулы (I), например, путем образования эфира или кислоты, реагируют с образованием соединения формулы (I) при применении подходящих стадий введения и/или удаления защитных групп или других технологических стадий, известных специалисту в данной области техники или описанных в настоящем документе. Подходящие уходящие группы хорошо известны в данной области техники и включают галогениды, в частности хлор, бром и йод; и сульфоэфиры, такие как брозил, тозил, метансульфонил и трифторметансульфонил. Например, соединение формулы (1) реагирует с соединением формулы (6) в подходящем растворителе, таком как ацетонитрил, диметилформамид, диметилсульфоксид, тетрагидрофуран, пиридин, метилэтилкетон и т.п. Как очевидно, обычно при проведении реакции применяют избыток подходящего основания, в том числе гидрида натрия, карбоната калия, трет-бутилата калия, карбоната натрия, карбоната цезия, бикарбоната натрия, триэтиламина, диизопропиэтиламина. Такие реакции обычно проводят при температурах от примерно комнатной температуры до примерно температуры кипения выбранного растворителя и, как правило, применяют от примерно 1 до 2 эквивалентов соединения формулы (1). Кроме того, соединения формулы (7) превращают в соединения формулы (I), в которых R5 представляет собой сложный эфир. Таким образом, снятие защиты с соединений формулы (7) с получением промежуточных фенольных соединений с последующей реакцией с трифторметансульфоновым ангидридом позволяет получить промежуточные трифлаты. Такой синтез трифлатов обычно проводят в дихлорметане с применением пиридина в качестве основания при температурах от -20C до КТ. Затем трифлаты могут реагировать с моноксидом углерода в присутствии ацетата палладия и 1,4 бис(дифенилфосфино)бутана с получением карбонилированных продуктов формулы (I), в которых R5 представляет собой сложный эфир. Кроме того, соединения, предшествующие конечным соединениям формулы (I), в которых R5 представляет собой сложный эфир, можно превратить в соединения формулы (I), в которых R5 представляет собой кислоту, или соединения формулы (II), как указано выше. В ходе необязательной дополнительной стадии получают фармацевтически приемлемую соль соединения формулы (I). Получение солей хорошо известно и широко применяется в данной области техники. Как очевидно, соединения формулы (6) можно получить с помощью способов, которые хорошо известны и широко применяются в данной области техники, в том числе с помощью способов и методик,аналогичных описанным в настоящем документе. Соединения формулы (6) получают с помощью реакций образования связи углерод-углерод/реакций сочетания. Например, подходящим образом замещенный циклогексанон и спирт можно превратить в винилтрифлат в хорошо известных условиях и затем превратить в винилборонат. Затем боронат может вступать в реакцию с арилбромидами, например, в условиях реакции Сузуки, с получением целевых арилциклогексенов, которые можно восстановить с применением водорода и палладия-на-угле в качестве катализатора с получением соединений формулы (6). Таким образом, очевидно, что стадии, необходимые для получения соединения формулы (I), можно проводить в любом порядке, включая, например, реакцию соединения формулы (8) с соединением формулы(1). Более конкретно, соединение формулы (8) может реагировать с соединением формулы (1), как описано выше, с получением соединений формулы (I), где X = СН (схема 4). Соединения формулы (8) можно превратить аналогичным способом в соединения формулы (6), описанные выше. Схема 4 Как очевидно, стадии, применяемые для получения соединений согласно изобретению, зависят от конкретного синтезируемого соединения, исходного соединения и сравнительной стабильности замещенных групп. Также при проведении указанных выше реакций может быть необходимо или желательно проведение различных стадий введения и удаления защитных групп. Выбор и применение подходящих защитных групп хорошо известны и применяются в данной области техники (см., например, ProtectingGroups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Некоторые соединения согласно изобретению существуют в виде твердых аморфных или кристаллических форм. Соединение согласно изобретению также может существовать в виде многочисленных кристаллических форм, при этом одна или более кристаллических форм являются предпочтительными по сравнению с другими благодаря наличию более желательных свойств, таких как, например, улучшенная растворимость, улучшенная биодоступность и/или улучшенная стабильность. Все эти кристаллические формы находятся в рамках настоящего изобретения. Исследования Нижеследующие методики и результаты исследований демонстрируют применимость и эффективность in vitro и in vivo соединений и/или способов, предложенных в настоящем изобретении. Указанные сведения приведены в иллюстративных целях и никоим образом не ограничивают настоящее изобретение. В настоящем описании применяют следующие сокращения. "ЛНП" обозначает липопротеины низкой плотности; "ЛВП" обозначает липопротеины высокой плотности; "ЛОНП" обозначает липопротеины очень низкой плотности; "LDLR-/-" обозначает рецептор липопротеинов низкой плотности; "DMEM" обозначает среду Игла, модифицированную Дульбекко (Dulbecco's Modified Eagle's Medium); "GAPDH" обозначает глицеральдегид-3-фосфатдегидрогеназу; "NaCMC" обозначает натрийкарбоксиметилцеллюлозу; "SLS" обозначает лаурилсульфат натрия; "FPLC" обозначает быструю жидкостную хроматографию белков; "PBS" физиологический раствор с фосфатным буфером; "VLDL-C" обозначает холестерин липопротеинов очень низкой плотности; "HDL-C" обозначает холестерин липопротеинов высокой плотности;"CMV" обозначает цитомегаловирус. "КТ" или "кт" указывает на комнатную температуру. Исследование котрансфекции человеческим FXR/FXR-чувставительным элементом и репортером-люциферазой Соединения согласно настоящему изобретению тестировали в ходе исследования ко-трансфекции репортера люциферазы человеческого FXR/FXR-чувствительного фрагмента. Исследование проводили по существу как описано в J. Biological Chem. 2006, 281 (52), 39831-39838, за исключением того, что применяли 10 мкг суммарно ДНК на миллион клеток. Специалист в данной области техники способен осуществить такой анализ без излишнего экспериментирования. Как было обнаружено, приведенные в качестве примера соединения согласно изобретению, проявляли эффективность в ходе данного исследования, демонстрируя ЕС 50 в диапазоне примерно от 75 до примерно 2590 нМ. Например, соединение примера 7 имело ЕС 50 220 нМ. Исследование рекрутинга кофактора FXR-SRC-1 Соединения тестировали путем исследования рекрутинга кофактора FXR-SRC-1, применяя технологию скрининга Alpha (Amplified Luminescent Proximity Homogeneous Assay) в соответствии с инструкциями производителя (Perkin Elmer Corporation, Norwalk, CT, USA) при различных концентрациях. Смешивали вместе очищенный 6-HIS-меченный домен, связывающий человеческий FXR лиганд (аминокислоты 242-472), очищенный GST-меченный домен, взаимодействующий с ядерным рецептором человеческого SRC-1 (аминокислоты 220-394), гранулы хелатного донора никеля (Perkin Elmer Corporation) и гранулы акцептора антитела к GST (Perkin Elmer Corporation) и отбирали аликвоты 12 мкл на лунку в 384 луночные планшеты. Добавляли соединения по 3 мкл на лунку для получения суммарного анализируемого объема 15 мкл и инкубировали при комнатной температуре в темноте в течение 4 ч. После инкубирования соединения, которые связывают FXR и вызывают взаимодействие между FXR и SRC-1 (можно приобрести в компании Invitrogen Corporation Carlsbad, Калифорния, США), сближали два типа гранул,генерируя люминесценцию, которую измеряют количественно. Рассчитывали значения EC50. Как было обнаружено, приведенные в качестве примера соединения согласно изобретению являются эффективными при исследовании взаимодействия SRC-1 FXR, демонстрируя значения ЕС 50 примерно 38-5200 нМ.-8 016475 Например, соединение примера 7 имело ЕС 50 примерно 325 нМ. Модуляция LDLR-/- липидов в сыворотке Животных акклиматизируют в течение двух недель до начала исследования. Мышей содержат при 12:12 часовом цикле чередования света и темноты при 21 С. Животным обеспечивают свободный доступ к деионизированной воде и содержат в течение двух недель на 'вестерн диете' TD 88137 Diet (42% жира,0,15% холестерина, Harlan Teklad, Мэдисон, Висконсин, США) при свободном доступе к еде. Оптимизируют группы из пяти десятинедельных самцов LDLR-/- мышей на основе уровней триглицерида и холестерина в сыворотке. В течение семи дней через желудочный зонд один раз в день группам вводят различные дозы тестируемого соединения, растворенного в 5% EtOH/5% полиэтиленгликоль 660 12 гидроксистеарате (Solutol HS 15 (можно приобрести в компании Univar, Соединенное Королевство и(0,085%). После удушения в СО 2 камере отбирают кровь путем пункции сердца. Измеряют уровни триглицеридов, глюкозы и общего холестерина в сыворотке, используя применяемые в клинической биохимии стандартную измерительную аппаратуру и реактивы. Исследуют смешанные пробы сыворотки способом жидкостной экспресс-хроматографии белков для определения содержания фракций холестерина липопротеинов (ЛОНП, ЛНП и ЛВП) путем разделения на эксклюзионной колонке с поточным определением холестерина. Отделяют липопротеиновые фракции способом жидкостной экспрессхроматографии белков и определяют количество холестерина с применением поточной системы обнаружения. Вводят 35 мкл пробы плазмы/50 мкл объединенной пробы в эксклюзионную колонку Superose 6HR 10/30 (Amersham Pharmacia Biotech, Piscataway, Нью-Джерси, США) и элюируют фосфатно-солевым буферным раствором, рН 7,4 (разбавленным 1:10), содержащим 5 мМ EDTA, при скорости 0,5 мл/мин. Холестериновый реактив (можно приобрести в компании Roche Diagnostics, Индианаполис, Индиана,США) со скоростью 0,16 мл/мин смешивают с колоночным эффлюентом через Т-образное соединение; затем смесь пропускают через 15 м 0,5 мм плетеный трубчатый реактор (Aura Industries, Нью-Йорк,Нью-Йорк, США), погруженный в 37C водную баню. Осуществляют мониторинг окрашенного продукта, образующегося в присутствии холестерина, в потоке при 505 нм и конвертируют аналоговое напряжение от монитора в цифровой сигнал для улавливания и анализа. Изменение напряжения, соответствующее изменению концентрации холестерина, наносят на график относительно времени и рассчитывают площадь под кривой, соответствующую элюированию ХЛОНП и ХЛВП, применяя программное обеспечение Turbo chrome version 4.12F12 software (PerkinElmer Corporation). В этом исследовании тестируемые соединения согласно изобретению снижают общий холестерин вплоть до примерно 87% и триглицериды вплоть до примерно 86% при дозировании 10 мг/кг. Более конкретно, соединение примера 9 понижает общий холестерин примерно на 76% и триглицериды примерно на 75% при дозировании 10 мг/кг. Индивидуальная доза вводимого соединения согласно этому изобретению будет, конечно, определена с учетом конкретных обстоятельств, связанных с данным случаем, в том числе, например, вводимым соединением, способом введения, общим состоянием пациента и патологическим состоянием, подвергаемым лечению. Предпочтительно, если соединения согласно настоящему изобретению приготавливают в виде фармацевтических композиций, вводимых различными путями. Наиболее предпочтительно, если такие композиции предназначены для перорального введения. Фармацевтические композиции и способы их получения хорошо известны в данной области. См., например, Remington: The Science и Practice of Pharmacy(A. Gennaro, et al. , eds., 20th ed., Lippincott, Williams и Wilkins Publishers, 2003). Далее настоящее изобретение проиллюстрировано примерами и способами синтеза, описанными в настоящем документе. Эти примеры и описания синтеза являются только иллюстративными и не предполагают каким-либо образом ограничить изобретение. Термины, применяемые в примерах и при описании синтеза, имеют свои обычные значения, если не указано иначе. Все хроматографические исследования выполнены с применением силикагеля, если не указано иначе. Последующие сокращения, применяемые в настоящем описании, определены согласно AldrichimicaN-бромсукцинимид; ТГФ" обозначает тетрагидрофуран; "ОАс" обозначает ацетат. Все соединения названы с применением ChemDraw Ultra 7.0 и 10.0, которые можно приобрести в компании CambridgeSoft Corporation, Кембридж, Массачусетс. Промежуточный синтез 1. [3-(2,6-Дихлорфенил)-5-изопропилизоксазол-4-ил]метанол. Вышеназванное соединение получают, по существу, как описано в J. Med. Chem. 2000, 43 (16),2971-2974.-9 016475 Промежуточный синтез 2. 2,6-Дихлорбензальдегидоксим. 2,6-Дихлорбензальдегид (7,0 г, 40 ммоль) и гидрохлорид гидроксиламина (2,16 г, 44 ммоль) добавляют к 10 мл воды и 30 мл метанола. Гидроксид натрия (4,0 г, 100 ммоль) медленно растворяют в 8 мл воды. К раствору бензальдегида добавляют раствор гидроксида натрия. Реакцию перемешивают в течение ночи. Реакционная смесь распределяется между этилацетатом и водой. Органическую фазу промывают соляным раствором и высушивают над твердым сульфатом натрия. Органическую фазу фильтруют и удаляют растворитель при пониженном давлении с получением указанного в заголовке соединения. Следующее соединение получают из подходящего исходного вещества по существу, как описано в синтезе 2,6-дихлорбензальдегидоксима. Промежуточный синтез 2 А. 2-Трифторметоксибензальдегидоксим. Промежуточный синтез 3. 2,5-Дихлорбензальдегидхлороксим. 2,6-Дихлорбензальдегидоксим (7,6 г, 40 ммоль) растворяют в 56 мл ДМФ и добавляют Nхлорсукцинимид (5,9 г, 4 4,0 ммоль), а затем каталитическое количество газа HCl. Реакционную смесь перемешивают в течение ночи. Реакционная смесь распределяется между простым эфиром и водой. Фазы разделяют и эфирную фазу промывают соляным раствором и высушивают над сульфатом натрия. Эфирную фазу фильтруют и растворитель удаляют при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищают хроматографией с применением градиента от 10% этилацетата в гексане до 15% этилацетата в гексане с получением указанного в заголовке соединения. 1 Н-ЯМР(400 МГц, CDCl3)8,76 (ушир., 1H), 7,38-7,26 (м, 3 Н). Следующее соединение получают из подходящего исходного вещества, по существу, как описано в синтезе 2,5-дихлорбензальдегидхлороксима. Промежуточный синтез 3 А: 2-Трифторметоксибензальдегид хлороксим. 1 Н-ЯМР (400 МГц, CDCl3)8,09 (с, 1 Н), 7,58 (д, 1 Н), 7,48 (т, 1H), 7,36-7,31 (м, 2 Н) Промежуточный синтез 4. 2-Азидо-1,3-дихлорбензол. К раствору с температурой 0 С 2,6-дихлоранилина (2,00 г) в этилацетате (40 мл) добавляют концентрированную соляную кислоту (12 мл). Реакцию перемешивают в течение 10 мин. К этому раствору в течение 3 мин добавляют раствор нитрита натрия (2,55 г) в воде (7,5 мл). После завершения добавления реакцию перемешивают в течение дополнительных 30 мин. Добавляют раствор азида натрия (2,41 г) в воде (8 мл) в течение 5 мин. Через 30 мин добавляют буфер (50 мл) с рН 7 и реакцию переносят в разделительную воронку. Фазы разделяют и водную фазу экстрагируют этилацетатом. Органические фазы объединяют и промывают соляным раствором, высушивают над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (2,11 г). 1H ЯМР(9,33 мл) и реакционную смесь перемешивают в течение дополнительных 1,5 ч. Реакционную смесь оставляют нагреваться до комнатной температуры и гасят насыщенным раствором хлорида аммония. Реакцию два раза экстрагируют этилацетатом. Органические фазы объединяют, промывают соляным раствором, высушивают над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (11,5 г). 1 Н ЯМР (400 МГц, CDCl3)3,75 (с, 3 Н), 2,8-2,65(м, 1H), 1,25-1,23 (д, 6 Н). Следующее соединение получают, по существу, как описано в синтезе этилового эфира 4 метилпент-2-иновой кислоты, применяя подходящее исходное вещество. Промежуточный синтез 5 А. Метиловый эфир циклопропилпропиновой кислоты. Промежуточный синтез 6. Метиловый эфир 4-метил-2-оксопентановой кислоты. К раствору 4-метил-2-оксопентановой кислоты (3,4 г, 26 ммоль) в метаноле (12 мл) и 2,2 диметоксипропану (48 мл) добавляют хлортриметилсилан (0,38 мл), Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде масла, (3,8 г, количеств.). 1H ЯМР(400 МГц, CDCl3) :3,86 (с, 3 Н), 2,72 (д, 2 Н), 2,16 (м, 1 Н), 0,96 (д, 6 Н). Промежуточный синтез 7. Этиловый эфир 2-циклопропилметил-[1,3]дитиан-2-карбоновой кислоты. В колбу, высушенную в пламени, добавляют сухой толуол (80 мл) и гидрид натрия (60%, 33,5 ммоль, 1,34 г). Реакцию охлаждают в ледяной бане и по каплям в течение 10 мин добавляют раствор этил-1,3-дитианкарбоксилата (52 ммоль, 10 г) и бромметилциклопропана (62,4 ммоль, 8,42 г) в ДМФ (24 мл). Ледяную баню удаляют и реакцию перемешивают в течение 18 ч. Добавляют воду (50 мл) и отделяют органическую фазу. Органическую фазу промывают соляным раствором, высушивают (Na2SO4) и концентрируют до образования желтого масла (12 г, 92%). LC-ES/MS: 247,0 (M+1). Промежуточный синтез 8. Этиловый эфир 3-циклопропил-2-оксопропионовой кислоты. К суспензии с температурой 0 С N-бромсукцинимида (NBS) (439 ммоль, 79 г) в смеси ацетонитрила(400 мл) и воды (100 мл) добавляют раствор этилового эфира 2-циклопропилметил-[1,3]дитиан-2 карбоновой кислоты (73,2 ммоль, 18,05 г) в ацетонитриле (50 мл) в течение 15 мин. Реакцию нагревают и перемешивают при комнатной температуре. Через 45 мин добавляют 500 мл смеси 1:1 гексан/ДХМ. Фазы разделяют. Органическую фазу промывают насыщенным Na2SO3 (2225 мл) и соляным раствором(2225 мл), высушивают посредством Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток разбавляют в CCl4 и фильтруют. Фильтрат концентрируют с получением указанного в заголовке соединения (7 г, 61%). LC-ES/MS: 157,0 (M+1). Промежуточный синтез 9. Этиловый эфир 3-циклопропил-4-диметиламино-2-оксо-бут-3-еновой кислоты. Объединяют смесь этилового эфира 3-циклопропил-2-оксопропионовой кислоты (6,4 ммоль, 1,0 г) и диметилформамиддиметилацеталь (12,8 ммоль, 2,0 мл) и перемешивают при комнатной температуре в течение 18 ч. Реакцию концентрируют при пониженном давлении с получением указанного в заголовке соединения (1,38 г, 100%). LC-MS: 212,0 (М+1). Промежуточный синтез 10. Метиловый эфир 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4 карбоновой кислоты. Метиловый эфир 3-циклопропил-2-оксопропионовой кислоты (0,55 г, 3,9 ммоль) смешивают с триэтиламином (0,393 г, 3,9 ммоль) и перемешивают в течение пяти минут. Добавляют 2,5-дихлорбензальдегид хлороксим (0,88 г, 3,9 ммоль) и реакцию перемешивают в течение ночи. Удаляют при пониженном давлении растворитель и очищают флэш-хроматографией с применением градиента от 1% этилацетата в гексане до 10% этилацетата в гексане с получением указанного в заголовке соединения (0,80 г,66%). 1 Н-ЯМР (400 МГц, CDCl3)7,37 (д, 2 Н), 7,31 (т, 1 Н), 3,66 (с, 3 Н), 2,88 (м, 1 Н), 1,38 (м, 2 Н), 1,25 (м,2 Н). Следующее соединение получают из подходящего исходного вещества, по существу, как описано в синтезе метилового эфира 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоновой кислоты. Промежуточный синтез 10 А. Метиловый эфир 5-циклопропил-3-(2-трифторметоксифенил) изоксазол-4-карбоновой кислоты, ES/MS m/z: 32 8,0 (М+1). Промежуточный синтез 11. Этиловый эфир 3-(2,6-дихлорфенил)-5-изопропил-3 Н-[1,2,3]триазол-4 карбоновой кислоты. Раствор 2-азидо-1,3-дихлорбензола (1,0 г) и этилового эфира 4-метилпент-2-иновой кислоты (1,8 г) в толуоле (5 мл) нагревают до 120 С в течение ночи. Регистрируют два региоизомера в диапазоне от 1:1 до 3:1, соответствующие требуемому продукту. Реакцию концентрируют при пониженном давлении и остаток очищают флэш-хроматографией, элюируя 5% этилацетатом в гексанах. 1H ЯМР (400 МГц,CDCl3)7,48 (д, 2 Н), 7,42 (т, 1 Н), 4,22 (кв., 2 Н), 3,64 (м, 1 Н), 1,46 (д, 6 Н), 1,15 (т, 3 Н). Следующее соединение получают из подходящего исходного вещества, по существу, как описано в синтезе этилового эфира 3-(2,6-дихлорфенил)-5-изопропил-3 Н-[1,2,3]триазол-4-карбоновой кислоты. Промежуточный синтез 11 А. Метиловый эфир 5-циклопропил-3-(2,6-дихлорфенил)-3 Н-[1,2,3]триазол-4-карбоновой кислоты. Промежуточный синтез 12. Этиловый эфир 3-(2,6-дихлорфенил)-5-трифторметил-3 Н-[1,2,3]триазол-4-карбоновой кислоты. Смесь 2-азидо-1,3-дихлорбензола (25,0 г, 132,9 ммоль) и этилового эфира 4,4,4-трифторбут-2 иновой кислоты (26,5 г, 159,6 ммоль) в толуоле (30 мл) нагревают при 80 С в течение 18 ч. Через 25 мин наблюдают сильный экзотермический эффект. Реакцию прекращают нагревать до тех пор, пока экзотермический эффект не уменьшится. Регистрируют два региоизомера в диапазоне от 1:1 до 3:1, соответствующие требуемому продукту. Реакционную смесь концентрируют при пониженном давлении до получения 51 г неочищенного вещества и очищают колоночной хроматографией, применяя градиент 35-60% ДХМ в гексанах, с получением указанного в заголовке соединения (28 г, 59%). ES/MS m/z 353,0 (М+1). Промежуточный синтез 13. Метиловый эфир 2-(2,6-дихлорфенил)-4-изопропил-2 Н-пиразол-3 карбоновой кислоты. К раствору метилового эфира 4-метил-2-оксопентановой кислоты (3,8 г, 26 ммоль) в N,Nдиметилформамиддиметилацетале (7 мл, 52 ммоль) добавляют моногидрат пара-толуолсульфоновой кислоты (30 мг). Смесь перемешивают при 80 С в течение ночи.- 11016475 Реакционную смесь концентрируют при пониженном давлении с получением этилового эфира 3 изопропил-4-диметиламино-2-оксобут-3-еновой кислоты в виде оранжевого масла. К раствору этилового эфира 3-изопропил-4-диметиламино-2-оксобут-3-еновой кислоты и гидрохлорида 2,6 дихлорфенилгидразина (2,8 г, 13 ммоль) в EtOH (40 мл) добавляют концентрированную HCl (0,5 мл). Смесь перемешивают при температуре окружающей среды в течение 2 ч, а затем орошают в течение ночи. Реакционную смесь концентрируют и остаток распределяют между EtOAc и 1N HCl. Органическую фазу высушивают (Na2SO4) и концентрируют до получения остатка. Остаток очищают колоночной хроматографией (0-15% EtOAc в гексанах) с получением указанного в заголовке соединения в виде масла(2,2 г, 52%). 1 Н ЯМР (CDCl3) :7,76 (с, 1 Н), 7,43 (д, 2 Н), 7,34 (дд, 1 Н), 3,75 (с, 3 Н), 3,48 (м, 1 Н), 1,32 (д,6 Н). Промежуточный синтез 14. Этиловый эфир 4-циклопропил-2-(2,6-дихлорфенил)-2 Н-пиразол-3 карбоновой кислоты. К раствору этилового эфира 3-циклопропил-4-диметиламино-2-оксобут-3-еновой кислоты (6,5 ммоль, 1,4 г) в этаноле (25 мл) добавляют гидрохлорид 2,6-дихлорфенилгидразина (7,2 ммоль, 1,5 г), а затем концентрированную HCl (100 мкл). Реакцию перемешивают в течение 4 ч при комнатной температуре с последующим нагреванием при 85 С в течение 18 ч. Реакционную смесь адсорбируют на силикагель и очищают, применяя градиент 0-20% EtOAc/гексаны, с получением указанного в заголовке соединения (0,8 г, 34%). LC-ES/MS m/e 325,0 (М+1). Промежуточный синтез 15. (5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанол. Метиловый эфир 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоновой кислоты (0,80 г, 2,6 ммоль) растворяют в 8 мл ТГФ и охлаждают в ледяной бане. К раствору добавляют 1 М раствор DIBAL в толуоле (5,66 мл) и реакцию перемешивают один час. Добавляют дополнительное количество 1 М раствора DIBAL в толуоле (5,66 мл) и реакцию перемешивают в течение дополнительного часа. После завершения, реакцию гасят метанолом и подкисляют водным раствором HCl (1 М). Реакционную смесь экстрагируют этилацетатом и промывают соляным раствором. Органическую фазу высушивают над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (0,68 г, 93%). MS m/z: 284,0 (М+ +1). Следующие соединения получают из подходящего исходного вещества, по существу, как описано в синтезе (5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанола. Промежуточный синтез 15 А. (5-Циклопропил-3-(2-трифторметоксифенил)изоксазол-4-ил)метанол. 1 Н ЯМР (400 МГц, CDCl3)7,56-7,49 (2 Н), 7,38 (т, 2H), 4,60 (с, 2 Н), 2,15 (м, 1 Н), 1,23 (м, 2 Н), 1,14 (м,2 Н). Промежуточный синтез 15 В. (5-Изопропил-3-(2-трифторметоксифенил)изоксазол-4-ил)метанол. 1 Н ЯМР (400 МГц, CDCl3)7,56-7,49 (2H), 7,38 (т, 2 Н), 4,60 (с, 2 Н), 2,15 (м, 1 Н), 1,23 (м, 2H), 1,14 (м, 2 Н). Промежуточный синтез 15 С. [3-(2,6-Дихлорфенил)-5-изопропил-3 Н-[1,2,3]триазол-4-ил]метанол.(400 МГц, CDCl3):7,67 (с, 1 Н), 7,44 (д, 2 Н), 7,34 (дд, 1 Н), 4,45 (с, 2 Н), 3,00 (м, 1 Н), 1,32 (д, 6 Н). Промежуточный синтез 16. [4-Циклопропил-2-(2,6-дихлорфенил)-2 Н-пиразол-3-ил]метанол. К смеси при температуре 0 С порошка LAH в ТГФ (20 мл) добавляют раствор этилового эфира 4 циклопропил-2-(2,6-дихлорфенил)-2 Н-пиразол-3-карбоновой кислоты (2,4 ммоль, 0,8 г) в ТГФ (10 мл). Реакцию перемешивают в течение 2 ч при 0 С. Реакцию гасят последовательно водой (0,26 мл), 5NNaOH (0,26 мл) и водой (0,78 мл). Реакционную смесь перемешивают в течение 1 ч при 0 С. Реакционную смесь фильтруют и фильтрат адсорбируют на силикагель и очищают, применяя градиент 30-50%(20 мл) добавляют PBr3 (0,76 мл, 8 ммоль). Реакционную смесь перемешивают при кипении в течение 30 мин. Реакционную смесь разбавляют EtOAc и промывают 0,2N HCl. Органическую фазу отделяют, высушивают (MgSO4), фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде масла. Промежуточный синтез 18. 4-Бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол. К раствору с температурой 0 С (5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанола (0,124 г, 0,44 ммоль) в дихлорметане (4 мл) добавляют трибромид фосфора (0,261 г, 0,963 ммоль). Ледяную баню удаляют через 20 мин и реакцию оставляют перемешиваться в течение дополнительных двадцати минут при комнатной температуре. Реакцию гасят буфером с рН 7 и несколько раз экстрагируют ди- 12016475 хлорметаном. Органические фазы объединяют, промывают соляным раствором и высушивают над сульфатом натрия. Реакцию фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (0,124 г, 82%). 1 Н-ЯМР (400 МГц, CDCl3)7,45-7,33 (м, 3 Н), 4,20 (с, 2 Н), 2,09(м, 1H), 1,27 (м, 2H), 1,16 (м, 2 Н). Промежуточный синтез 19. 4-Бромметил-5-циклопропил-3-(2-трифторметоксифенил)изоксазол. К раствору (5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-ил)метанола (2,19 г, 7,32 ммоль) в безводном метиленхлориде (50 мл) при 0 С добавляют PBr3 (0,83 мл, 8,7 ммоль) и смесь перемешивают в течение 3 ч. Затем смесь выливают в 100 мл ледяной воды и экстрагируют ДХМ (2). Объединенные ДХМ фазы промывают соляным раствором, высушивают (MgSO4) и концентрируют при пониженном давлении с получением неочищенного остатка. Остаток очищают флэш-хроматографией (120 г кварца), элюируя градиентом от 0 до 60% этилацетата в гептане с получением указанного в заголовке соединения (2,1 г, 7 9%) в виде масла. Промежуточный синтез 19 а. 5-Бромметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-пиразол. К раствору (1-(2,6-дихлорфенил)-4-изопропил-1 Н-пиразол-5-ил)метанола (4,0 г, 0,014 моль) вCH2Cl2 (50 мл) добавляли трибромид фосфора (5,69 г, 0,021 моль) при 0 С. Смесь перемешивали в течение 3 ч при комнатной температуре. Разбавляли смесь водой и экстрагировали этилацетатом. Проводили концентрирование при пониженном давлении с образованием сырого продукта, который очищали методом колоночной хроматографии на силикагеле с применением в качестве элюента смеси гексан/этилацетат - 7:3, и получали 0,50 г (10%) указанного в заголовке соединения. ЭС/МС т/е (81Br) 348,93[М+Н]+. Промежуточный синтез 20. 4-Бромметил-5-изопропил-3-(2-трифторметоксифенил)изоксазол. К раствору [5-изопропил-3-(2-трифторметоксифенил)изоксазол-4-ил]метанола (3,0 г, 10,0 ммоль) в метиленхлориде (20 мл) добавляют трифенилфосфин (4,0 г, 15,6 ммоль), а затем N-бромсукцинимид (2,8 г, 15,6 ммоль). Реакцию перемешивают в течение 2 ч при комнатной температуре. Реакцию концентрируют при пониженном давлении и остаток очищают флэш-хроматографией с применением градиента 2040% EtOAc в гексанах. Следующие соединения получают, по существу, как описано в синтезе 4-бромметил-5-изопропил-3(2-трифторметоксифенил)изоксазола, применяя подходящее исходное вещество. Промежуточный синтез 20 А. 5-Бромметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-[1,2,3]триазол. Промежуточный синтез 20 В. 5-Бромметил-4-циклопропил-1-(2,6-дихлорфенил)-1 Н-[1,2,3]триазол. Промежуточный синтез 20 С. 5-Бромметил-1-(2,6-дихлорфенил)-4-трифторметил-1 Н-[1,2,3]триазолES/MS m/z 373,0 (М+1). Промежуточный синтез 20D. 5-Бромметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-пиразол. Промежуточный синтез 20 Е. 5-Бромметил-4-циклопропил-1-(2,6-дихлорфенил)-1 Н-пиразол. Промежуточный синтез 20F. 5-Бромметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-[1,2,3]триазол. К раствору (1-(2,6-дихлорфенил)-4-изопропил-1H-1,2,3-триазол-5-ил)метанола (3,0 г, 0,01048 моль) и CBr4 в CH2Cl2 (15 мл) добавляют раствор трифенилфосфина (3,50 г, 0,01334 моль) в CH2Cl2 (10 мл) при 0 С. Раствор перемешивают в течение 4 ч при комнатной температуре и концентрируют в вакууме с получением неочищенного продукта. Очищают колоночной хроматографией с применением силикагеля,элюируя смесью 7:3 гексан/этилацетат, с получением 3,0 г (82%) указанного в заголовке соединения.ES/MS m/е (79Br/81Br) 348/350 [М+Н]+. Промежуточный синтез 21. Метиловый эфир 2-бром-4-фторбензойной кислоты. К раствору тионилхлорида (2,6 мл, 35,7 ммоль) в метаноле (500 мл) при 0 С добавляют 4-фтор-2 бромбензойную кислоту (5,18 г, 23,6 ммоль). Смесь нагревают до температуры кипения с обратным холодильником в течение 19 ч. Смесь концентрируют и очищают флэш-хроматографией на кварце (120 г),применяя градиент от 0 до 80% этилацетата в гептане, с получением указанного в заголовке соединения(2,06 г, 37%) в виде масла. MS m/z 233,0 (М+1). Следующие соединения получают, по существу, как описано в синтезе метилового эфира 2-бром-4 фторбензойной кислоты, применяя подходящее исходное вещество. Промежуточный синтез 21 А. Метиловый эфир 4-фторнафталин-1-карбоновой кислоты, 1H ЯМР(400 МГц, CDCl3)9,00 (д, 1 Н), 8,17 (м, 2 Н), 7,60 (м, 2 Н), 7,12 (м, 1 Н), 3,98 (с, 3 Н); Промежуточный синтез 21 В. Метиловый эфир 4-фтор-2-метилбензойной кислоты, 1H ЯМР (400 МГц, CDCl3)7,92 (м, 1 Н), 6,90 (м, 2 Н), 3,84 (с, 3 Н), 2,59 (с, 3 Н). Промежуточный синтез 22. Метиловый эфир 2-бром-4-(4-гидроксипиперидин-1-ил)бензойной кислоты. Смесь метилового эфира 2-бром-4-фторбензойной кислоты (2,06 г, 8,84 ммоль), 4 гидроксипиперидина (1,86 г, 18,4 ммоль) и карбоната калия (1,33 г, 9,62 ммоль) в ацетонитриле (25 мл) нагревают до 90 С в течение 17 ч. Смесь концентрируют и распределяют между этилацетатом и водой. Сольвентные фазы разделяют и водную фазу экстрагируют этилацетатом (3). Объединенные этилацетатные фазы высушивают (MgSO4), фильтруют и концентрируют при пониженном давлении. Остаток очищают на кварце (120 г), применяя градиент от 0% до 90% этилацетата в гептане, с получением ука- 13016475 занного в заголовке соединения (2,10 г, 76%) LC-ES/MS m/z 314,0 (М+1). Следующие соединения получают, по существу, как описано в синтезе метилового эфира 2-бром-4(4-гидроксипиперидин-1-ил)бензойной кислоты, применяя подходящее исходное вещество. Промежуточный синтез 22 А. Этиловый эфир 4-(4-гидроксипиперидин-1-ил)бензойной кислоты.LC-ES/MS m/z 236,2 (М+1). Промежуточный синтез 22 С. 4-(4-Гидроксипиперидин-1-ил)нафталин-1-карбоновая кислота. LCES/MS m/z 286,0 (М+1). Промежуточный синтез 22D. Метиловый эфир 4-(4-гидроксипиперидин-1-ил)-2-метилбензойной кислоты, LC-ES/MS m/z 250,2 (М+1). Промежуточный синтез 23. Метиловый эфир 5-(4-гидроксипиперидин-1-ил)бифенил-2-карбоновой кислоты. Смесь метилового эфира 2-бром-4-(4-гидроксипиперидин-1-ил)бензойной кислоты (1,2 г, 3,82 ммоль), фенилбороновой кислоты (800 мг; 6,56 ммоль), фосфата калия, трехосновного, моногидрата (1,3 г, 10,7 ммоль) и тетракис(трифенилфосфин)палладия (500 мг, 0,433 ммоль) в 1,2-диметоксиэтане (25 мл) и воде (1 мл) нагревают до 90 С в атмосфере азота в течение 24 ч. Смесь концентрируют и распределяют между этилацетатом и водой. Сольвентные фазы разделяют и водную фазу экстрагируют этилацетатом(3). Объединенные этилацетатные фазы высушивают (MgSO4), фильтруют и концентрируют при пониженном давлении. Остаток очищают на кварце (120 г), элюируя градиентом от 0% до 100% этилацетата в гептане, с получением требуемого продукта (1,09 г, 92%) в виде вязкого остатка. LC-ES/MS m/z 312,0(М+1) Промежуточный синтез 24. Метиловый эфир 4-(4-гидроксипиперидин-1-ил)-3-метилбензойной кислоты. Смесь 4-гидроксипиперидина (2,65 г, 25,4 ммоль), метил-4-бром-3-метилбензоата (5,00 г, 21,8 ммоль), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,37 г, 2,17 ммоль), ацетата палладия (0,247 г,1,10 ммоль), карбоната цезия (21,5 г, 65,3 ммоль) в 1,4-диоксане (100 мл) нагревают в 350-мл сосуде высокого давления в течение 18 ч при 80 С в атмосфере азота и затем при 120 С в течение 4 ч. Смесь фильтруют и концентрируют при пониженном давлении. Остаток очищают на кварце (120 г) с применением градиента от 0 до 90% этилацетата в гептане с получением указанного в заголовке соединения (2,4 г, 44%). LC-ES/MS m/z 250,2 (М+1). Промежуточный синтез 25. Метиловый эфир 6-(4-гидроксипиперидин-1-ил)-1-метил-1 Н-индол-3 карбоновой кислоты. Повторно запаиваемую трубку загружают метиловым эфиром 6-бром-1-метил-1 Н-индол-3 карбоновой кислоты (850 мг, 1,00 экв., 3,17 ммоль), 4-гидроксипиперидином (491 мг, 1,5 экв., 4,76 ммоль), иодидом меди(I) (60,37 9 мг, 0,1 экв., 0,32 ммоль), пролином (73 мг, 0,2 экв., 0,64 ммоль) и карбонатом калия (885 мг, 2 зкв., 6,34 ммоль) и продувают азотом. Добавляют безводный диметилсульфоксид (2 мл). Трубку закрывают и смесь перемешивают при 110 С в течение 22 ч. Смесь оставляют охлаждаться до комнатной температуры и добавляют водный насыщенный NH4Cl. Смесь экстрагируют EtOAc(2). Органические фазы объединяют, промывают водой, высушивают над безводным сульфатом натрия,фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией (40 г кварц),элюируя градиентом от 20 до 100% этилацетат/гексан, с получением указанного в заголовке соединения(540 мг, 59%) в виде белого твердого вещества. ES/MS m/z 289,0 (M+1). Соединения из нижеследующего списка получают, по существу, как описано в синтезе метилового эфира 6-(4-гидроксипиперидин-1-ил)-1-метил-1 Н-индол-3-карбоновой кислоты, применяя подходящее исходное вещество. Промежуточный синтез 25 А. Этиловый эфир 6-(4-гидроксипиперидин-1-ил)бензо[b]тиофен-3 карбоновой кислоты. ES/MS m/z 306,0 (М+1). Промежуточный синтез 25 В. Этиловый эфир 4-(4-гидроксиазепан-1-ил)бензойной кислоты, ES/MSm/z 264,0 (М+1). Промежуточный синтез 26. Метиловый эфир 4-гидрокси-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил 5'-карбоновой кислоты. К раствору метил-6-хлорникотината (890 мг, 1,00 экв.; 5,03 ммоль) в сухом ДМФ (30 мл) добавляют 4-гидроксипиперидин (1,5 экв.; 7,55 ммоль; 778,95 мг) и триэтиламин (1,05 мл; 1,5 экв.; 7,55 ммоль). Систему промывают струей N2 и нагревают при 80 С в течение 4,5 ч. Реакцию оставляют охлаждаться до комнатной температуры и разбавляют водой/EtOAc. Водную фазу экстрагируют этилацетатом (3). Органическую фазу промывают соляным раствором, высушивают над MgSO4, фильтруют и концентрируют при пониженном давлении. Неочищенный остаток очищают хроматографией, элюируя смесью гексан/EtOAc 2:1-1:2, с получением оранжевого твердого вещества. Твердое вещество тритурируют со смесью гексан/EtOAc, 4:1 и фильтруют с получением указанного в заголовке соединения (1,023 г, 86%) в виде белого твердого вещества. ES/MS m/z 237,0 (М+1).- 14016475 Промежуточный синтез 27. Трет-бутиловый эфир 4-оксоазепан-1-карбоновой кислоты. К раствору азепан-4-она (9,57 г, 64 ммоль) в 1,4-диоксане (70 мл) добавляют ди-третбутилдикарбонат (15,8 г, 70,4 ммоль). Смесь перемешивают при комнатной температуре и добавляют суспензию карбоната натрия (4,11 г, 38,4 ммоль) в 40 мл воды. Смесь нагревают до 80 С в течение 2 ч. Смесь концентрируют и экстрагируют этилацетатом (3). Объединенные этилацетатные фазы высушивают (Na2SO4) и концентрируют при пониженном давлении. Остаток очищают на кварце, применяя градиент этилацетата в гексанах (25-50%), с получением указанного в заголовке соединения (13,6 г, 99,7%). Промежуточный синтез 28. Трет-бутиловый эфир 4-гидроксиазепан-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-оксоазепан-1-карбоновой кислоты (13,6 г, 63,8 ммоль) в метаноле (10 мл) и тетрагидрофуране (30 мл) при 0 С дрбавляют боргидрид лития (1,40 г, 63,8 ммоль). Смесь перемешивают при 0 С в течение 60 мин. Добавляют соляную кислоту (1,0 М, 40 мл). Смесь концентрируют при пониженном давлении и экстрагируют этилацетатом (2). Объединенные этилацетатные фазы высушивают (Na2SO4) и концентрируют с получением остатка. Остаток очищают на кварце, применяя градиент этилацетата в гексанах (40-80%), с получением указанного в заголовке соединения (13,6 г,99,1%). Промежуточный синтез 29. Трет-бутиловый эфир 4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол 4-илметокси]азепан-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-гидроксиазепан-1-карбоновой кислоты (1,88 г, 8,73 ммоль) в безводном ТГФ (15 мл) при 0 С добавляют 18-краун-6 (2,3 г, 8,70 ммоль) и трет-бутиловый спирт, калиевое производное (8,8 мл, 1,0 М, 8,80 ммоль). Смесь перемешивают при комнатной температуре в течение 20 минут, после чего в течение 2 мин добавляют 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил) изоксазол (1,8 г, 5,19 ммоль) в ТГФ. Смесь перемешивают в течение 2 ч и добавляют воду (10 мл). Смесь концентрируют при пониженном давлении и экстрагируют этилацетатом (3). Объединенные этилацетатные фазы высушивают (MgSO4), концентрируют и очищают флэш-хроматографией (120 г кварц),элюируя градиентом этилацетата в гептане (0-60%), с получением указанного в заголовке соединения(420 мг, 17%). Следующие соединения получают, по существу, как описано в синтезе 29. Промежуточный синтез 29 А. трет-Бутил-4-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)азепан-1-карбоксилат. Для получения этого соединения реакционную смесь перемешивают в течение 12 ч после, добавления всех реагентов. ES/MS m/z 497,24 (М+1). Промежуточный синтез 29 В. трет-Бутил-4-1-(2,6-дихлорфенил)-4-изопропил-1 Н-1,2,3-триазол-5 ил)метокси)азепан-1-карбоксилат. Для получения этого соединения после добавления всех реагентов смесь нагревают до 40 С в микроволновой печи в течение одного часа. ES/MS m/z 483,12 (М+1). Промежуточный синтез 29 С. трет-Бутил-4-1-(2,6-дихлорфенил)-4-изопропил-1H-пиразол-5 ил)метокси)азепан-1-карбоксилат. Для получения этого соединения после добавления всех реагентов смесь нагревают до 40 С в микроволновой печи в течение одного часа. ES/MS m/z 482,17 (М+1). Промежуточный синтез 30. 4-[3-(2,6-Дихлорфенил)-5-этилизоксазол-4-илметокси]азепаниумхлорид. Холодный 4 М водный хлористый водород в диоксане добавляют к трет-бутиловому эфиру 4-[5 циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-карбоновой кислоты (370 мг, 0,769 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь концентрируют при пониженном давлении с получением указанного в заголовке соединения (350 мг, 109%). ES/MS m/z 381,0(М+1, свободное основание). Промежуточный синтез 30 А. 4-Азепан-4-илокси)метил)-5-циклопропил-3-(2,6-дихлорфенил) изоксазол. К раствору трет-бутилового эфира 4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси] азепан-1-карбоновой кислоты (2,0 г, 0,00416 моль) в CH2Cl2 (20 мл) добавляют трифторуксусную кислоту (1,42 г, 0,01248 моль) при 0 С в атмосфере N2. Смесь перемешивают в течение 3 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме с получением неочищенного продукта. Очищают колоночной хроматографией над оксидом алюминия (нейтрального), элюируя смесью 8:2 дихлорметан/метанол, с получением 1,4 г указанного в заголовке соединения (88%). ES/MS m/z 381,1 (М+1). Следующие соединения получают, по существу, как описано в промежуточном синтезе 30 а. Промежуточный синтез 30 В. 4-Азепан-4-илокси)метил)-5-циклопропил-3-(2-(трифторметокси) фенил)изоксазол, ES/MS m/z 397,20 (М+1). Промежуточный синтез 30 С. 4-1-(2,6-Дихлорфенил)-4-изопропил-1H-1,2,3-триазол-5-ил)метокси) азепан, ES/MS m/z 383,14 (М+1). Промежуточный синтез 30D. 4-1-(2,6-Дихлорфенил)-4-изопропил-1H-пиразол-5-ил)метокси)азепан, ES/MS m/z 382,13 (М+1).- 15016475 Промежуточный синтез 31. Транс-4-[4-(4-метоксибензилокси)фенил]циклогексанол. К суспензии пара(транс-4-гидроксициклогексил)фенола (67,62 ммоль, 13,00 г) в ацетоне (400 мл) добавляют 1-бромметил-4-метоксибензол (74,38 ммоль, 10,57 мл) и карбонат калия (81,14 ммоль, 11,33 г). Смесь перемешивают в течение 64 ч при комнатной температуре и фильтруют. Фильтрат концентрируют и повторно перекристаллизовывают из CH2Cl2 (100 мл) с получением указанного в заголовке соединения (15,1 г, 71%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)1,34-1,49 (м, 4H),1,87-1,90 (м, 2 Н), 2,02-2,07 (м, 2 Н), 2,38-2,45 (м, 1 Н), 3,61-3,68 (м, 1 Н), 3,79 (с, 3 Н), 4,93 (с, 2H), 6,88 (д,2 Н, J=8,8 Гц), 6,89 (д, 2H, J=8,8 Гц), 7,09 (д, 2H, J=8,8 Гц), 7,32 (д, 2H, J=8,8 Гц). Промежуточный синтез 32. 4-(Трет-бутилдиметилсиланилокси)циклогекс-1-ениловый эфир трифторметансульфоновой кислоты. К раствору 4-(трет-бутилдиметилсиланилокси)циклогексанона (2,63 г, 11,5 ммоль) и Nфенилбис(трифторметансульфонимида) (6,26 г, 17,3 ммоль) в ТГФ (50 мл) при -78 С в течение 10 мин по каплям добавляют бис(триметилсилил)амид лития (16,1 мл, 1,0 М). Смесь перемешивают и оставляют нагреваться до комнатной температуры в течение 60 мин. Реакцию гасят соляным раствором (25 мл) и концентрируют при пониженном давлении. Остаток экстрагируют EtOAc (250 мл). Объединенные органические фазы высушивают над Na2SO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией, элюируя смесью 10% EtOAc/гексаны, с получением указанного в заголовке соединения (3,82 г, 92%). MS m/z 361,0 (M+1). Промежуточный синтез 33. 2-[4-(трет-Бутилдиметилсиланилокси)циклогекс-1-енил]-4,4,5,5 тетраметил-[1,3,2]диоксаборолан. Колбу, содержащую раствор 4-(трет-бутилдиметилсиланилокси)циклогекс-1-енилового эфира трифторметансульфоновой кислоты (3,82 г, 10,6 ммоль) и бис(пинаколато)дибор (3,02 г; 11,7 ммоль) в 1,4-диоксане (50 мл), вакуумируют и три раза заполняют N2. Добавляют хлорид (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) (177 мг), 1,1'-бис(дифенилфосфино)ферроцен (606 мг) и ацетат калия(2,101 г). Смесь перемешивают в течение 18 ч при 85 С. Смесь охлаждают до комнатной температуры,фильтруют через слой диатомовой земли и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя градиентом 5-10% EtOAc/гексаны, с получением указанного в заголовке соединения (2,21 г, 61,6%). 1 Н ЯМР (400 МГц, CDCl3)6,40 (т, 1H), 4,12-4,07 (м, 1 Н), 2,35-2,27(с, 3 Н). Промежуточный синтез 34. Метиловый эфир 6-[4-(трет-бутилдиметилсиланилокси)циклогекс-1 енил]-1-метил-1 Н-индол-3-карбоновой кислоты. Колбу, содержащую раствор 2-[4-(трет-бутилдиметилсиланилокси)циклогекс-1-енил]-4,4,5,5 тетраметил-[1,3,2]диоксаборолана (1,40 г, 4,14 ммоль) и метилового эфира 6-бром-1-метил-1 Н-индол-3 карбоновой кислоты (1,22 г, 4,55 ммоль) в толуоле (50 мл), вакуумируют и три раза заполняют N2. Добавляют фосфат калия (1,79 г, 8,27 ммоль), Pd(OAc)2 (46 мг) и 2-дициклогексилфосфино-2',6'-диметокси 1,1' -бифенил (S-Phos, 50 мг). Смесь перемешивают при 100 С в течение 16 ч и охлаждают до комнатной температуры. Смесь фильтруют через слой диатомовой земли и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя смесью 25% EtOAc/гексаны, с получением указанного в заголовке соединения (0,71 г, 43%). MS m/z 400,3 (M+1). Промежуточный синтез 35. Метиловый эфир 6-(4-гидроксициклогекс-1-енил)-1-метил-1 Н-индол-3-карбоновой кислоты. Раствор метилового эфира 6-[4-(трет-бутилдиметилсиланилокси)циклогекс-1-енил]-1-метил-1 Ниндол-3-карбоновой кислоты (0,710 г, 1,78 ммоль) в ТГФ (10 мл) обрабатывают Bu4NF (2,22 мл, 1,0 М в ТГФ). Смесь перемешивают при комнатной температуре в течение 5 ч и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя градиентом 25-80%EtOAc/гексаны, с получением метилового эфира 6-(4-гидроксициклогекс-1-енил)-1-метил-1 Н-индол-3 карбоновой кислоты (0,320 г, 63%). MS m/z 286,3 (M+1). Промежуточный синтез 36. Метиловый эфир 6-(4-гидроксициклогексил)-1-метил-1 Н-индол-3-карбоновой кислоты. Раствор метилового эфира 6-(4-гидроксициклогекс-1-енил)-1-метил-1 Н-индол-3-карбоновой кислоты (0,251 г, 0,880 ммоль) в тетрагидрофуране (10 мл) добавляют к суспензии палладия (0,200 г, 5% в углероде) в ТГФ (2 мл). Смесь перемешивают в атмосфере водорода (баллон) при комнатной температуре в течение 12 ч. Смесь фильтруют через слой диатомовой земли и концентрируют при пониженном давлении с получением указанного в заголовке соединения (0,202 г, 80%). MS m/z 288,3 (M+1). Промежуточный синтез 37. Транс-5-циклопропил-3-(2,6-дихлорфенил)-4-4-[4-(4-метоксибензилокси)фенил]циклогексилоксиметилизоксазол. 4-[4-(4-Метоксибензилокси)фенил]циклогексанол (2,24 ммоль, 700,00 мг) и 18-краун-6 (2,69 ммоль,710,70 мг) в тетрагидрофуране (10 мл) обрабатывают трет-бутиловым спиртом, калиевым производным(2,69 ммоль, 2,69 мл; 1 М в ТГФ). Смесь перемешивают в течение 30 минут и добавляют 4-бромметил-5 циклопропил-3-(2,6-дихлорфенил)изоксазол (3,36 ммоль, 1,17 г). Смесь перемешивают при комнатной- 16016475 температуре в течение 5 мин и нагревают до 40 С в течение 1,5 ч. Добавляют силикагель и реакционную смесь концентрируют при пониженном давлении. Неочищенную смесь очищают флэш-хроматографией на силикагеле, элюируя градиентом 10-60% EtOAc в гексанах. Вторичное применение хроматографии осуществляют на силикагеле, элюируя смесью 0,5% EtOAc в ДХМ, с получением указанного в заголовке соединения (960 мг, 74%). MS m/z 577,9 (M+1). Следующее соединение получают, по существу, как описано в синтезе транс-5-циклопропил-3-(2,6 дихлорфенил)-4-4-[4-(4-метоксибензилокси)фенил]циклогексилоксиметилизоксазола, применяя подходящее исходное вещество. Промежуточный синтез 37 А. 5-Циклопропил-4-4-[4-(4-метоксибензилокси)фенил]циклогексилоксиметил-3-(2-трифторметоксифенил)изоксазол, ES/MS m/z 594,0 (М+1). Промежуточный синтез 38. Транс-4-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4 илметокси]циклогексилфенол. Транс-5-циклопропил-3-(2,6-дихлорфенил)-4-4-[4-(4-метоксибензилокси)фенил]циклогексилоксиметилизоксазол (1,33 ммоль, 770,00 мг) в дихлорметане (17 мл) обрабатывают при комнатной температуре метоксибензолом (13,3 ммоль, 1,45 мл) и трифторуксусной кислотой (8,5 мл). Раствор перемешивают в течение 2 ч и концентрируют при пониженном давлении. Остаток испаряют совместно с CCl4 (2) и тритурируют с гексаном. Неочищенный продукт наносят на силикагель и очищают флэшхроматографией (120 г кварц), элюируя градиентом 20-50% EtOAc в гексане, с получением указанного в заголовке соединения (544 мг, 89%) в виде белого твердого вещества. MS m/z 458,0 (M+1). Следующее соединение получают, по существу, как описано в синтезе транс-4-4-[5-циклопропил 3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилфенола, применяя подходящее исходное вещество. Промежуточный синтез 38 А. 4-4-[5-Циклопропил-3-(2-трифторметоксифенил)изоксазол-4 илметокси]циклогексилфенол, ES/MS m/z 474,3 (М+1). Промежуточный синтез 39. 4-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилфениловый эфир транс-трифторметансульфоновой кислоты. Транс-4-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилфенол (1,16 ммоль, 534,00 мг) растворяют в дихлорметане (15 мл) и пиридине (5,82 ммоль, 471,02 мкл). Раствор охлаждают в ледяной бане и добавляют трифторметансульфоновый ангидрид (1,46 ммоль, 245,43 мкл). Смесь перемешивают в течение 1,5 ч и концентрируют при пониженном давлении. Остаток разбавляютEtOAc (75 мл) и промывают последовательно 1N NaOH (25 мл), соляным раствором (15 мл), 10% водной лимонной кислотой (230 мл) и соляным раствором (25 мл). Органическую фазу высушивают (Na2SO4),фильтруют и концентрируют при пониженном давлении. Неочищенную смесь очищают флэшхроматографией (120 г кварц), элюируя градиентом 15-40% EtOAc/гексан, с получением указанного в заголовке соединения (616 мг, 90%) в виде бесцветного масла. MS m/z 589, 8 (M+1). Следующее соединение получают, по существу, как описано в синтезе 4-4-[5-циклопропил-3-(2,6 дихлорфенил)изоксазол-4-илметокси]циклогексилфенилового эфира транс-трифторметансульфоновой кислоты, применяя подходящее исходное вещество. Промежуточный синтез 39 А. 4-4-[5-Циклопропил-3-(2-трифторметоксифенил)изоксазол-4 илметокси]циклогексилфениловый эфир трифторметансульфоновой кислоты, 1 Н ЯМР (400 МГц,CDCl3)7,58-7,55 (дд, 1H, J=1,8 Гц, 8 Гц), 7,49-7,46 (дд, 1 Н, J=1,8 Гц, 8 Гц), 7,38-7,34 (м, 2 Н), 7,21-7,19(д, 2 Н, J=8,8 Гц), 7,15-7,13 (д, 2 Н, J=8,8 Гц), 4,38 (с, 2 Н), 3,24-3,19 (м, 1 Н), 2,49-2,44 (м, 1 Н), 2,17-2,10 (м,1 Н), 1,99-1,96 (м, 2 Н), 1,87-1,84 (м, 2 Н), 1,41-1,20 (м, 6 Н), 1,10-1,07 (м, 2 Н). Промежуточный синтез 40. Метиловый эфир 6-бром-1 Н-индол-3-карбоновой кислоты. К раствору 6-броминдол-3-карбоновой кислоты (960 мг, 4,00 ммоль) в метаноле (9,5 мл) при комнатной температуре добавляют в течение двух минут (триметилсилил)диазометан (2,0 М раствор в гексане, примерно 9 мл). Желтую смесь концентрируют при пониженном давлении. Остаток повторно растворяют в метаноле и концентрируют при пониженном давлении. Этот процесс повторяют несколько раз с получением указанного в заголовке соединения в виде твердого вещества (100%). ES/MS m/e 256,0 (М+ 2). Промежуточный синтез 40 А-1. Метил 6-бромбензо[d]изотиазол-3-карбоксилат. К раствору 6-бромбензо[d]изотиазол-3-карбоновой кислоты (1,0 г, 3,89 ммоль) в метаноле (15 мл) при комнатной температуре медленно добавляют тионилхлорид (0,92 г, 7,74 ммоль) и раствор перемешивают при 80 С в течение 14 ч. Смесь охлаждают до комнатной температуры и концентрируют с получением 1,0 г (95%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. 1H ЯМР (400 МГц, MeOD)4,04 (с, 3 Н), 7,73 (дд, J=8,8, 1,6 Гц, 1H), 8,41 (с, 1 Н), 8,61 (д, J=8,8 Гц, 1 Н). Следующие соединения получают, по существу, как описано в промежуточном синтезе 40 А-1 метил 6-бромбензо[d]изотиазол-3-карбоксилата. Промежуточный синтез 41. Метиловый эфир 6-бром-1-метил-1H-индол-3-карбоновой кислоты. К смеси метилового эфира 6-бром-1 Н-индол-3-карбоновой кислоты (100 мг, 0,394 ммоль), карбоната калия (163 мг, 1,18 ммоль) в ДМФ добавляют йодметан (30 мкл, 0,47 ммоль). Реакционную смесь перемешивают в течение 1,5 ч. Добавляют дополнительное количество йодметана (10 мкл) и реакцию перемешивают в течение 30 мин. Реакционную смесь разбавляют дихлорметаном и фильтруют. Фильтрат концентрируют в высоком вакууме, разбавляют этилацетатом и концентрируют с получением указанного в заголовке соединения (105 мг, 99%). ES/MS m/e 270,0 (М + 2). Промежуточный синтез 41 А-1. Этил 5-бром-1-метил-1H-индол-2-карбоксилат. В диметилформамиде (5 мл) смешивают этил 5-бром-1H-индол-2-карбоксилат (1,00 г, 13,7 ммоль),карбонат калия (1,4 г, 10 ммоль) и метилиодид (280 мкл, 4,50 ммоль). Смесь нагревают до 50 С в течение 18 часов. Охлаждают до комнатной температуры и распределяют между EtOAc и водой. ЭкстрагируютEtOAc (3), промывают соляным раствором (3), высушивают (MgSO4) и концентрируют с получением неочищенного вещества. Неочищенное вещество очищают на 120 г силикагеля, применяя 0-50% EtOAc в гептане, с получением 850 мг (81%) указанного в заголовке соединения. ES/MS m/е (81Br) 284,0 (М+Н)+. Промежуточный синтез 41 В. Метил 6-бром-1-метил-1H-индазол-3-карбоксилат. К смеси метил 6-бром-1H-индазол-3-карбоксилата (0,50 г, 1,96 ммоль) и карбоната калия (1,28 г,9,29 ммоль) в ацетонитриле (15 мл) при комнатной температуре добавляют метилиодид (1,31 г, 9,29 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Растворитель удаляют в вакууме, разбавляют водой и экстрагируют этилацетатом (3 х 10 мл). Объединенные органические вещества высушивают над сульфатом натрия и концентрируют при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией, элюируя смесью 8:2 гексан/этилацетат, с получением 0,35 г (70%) указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР(400 МГц, CDCl3)4,03 (с, 3 Н), 4,14 (с, 3 Н), 7,42 (дд, J=8,4, 1,2 Гц, 1 Н), 7,66 (с, 1 Н), 8,08 (д, J=8,8 Гц,1 Н). Следующее соединение получают, по существу, как описано в промежуточном синтезе 41 В, метил 6-бром-1-метил-1H-индазол-3-карбоксилата. Промежуточный синтез 41 С. Метил 5-бром-1-метил-1H-индол-2-карбоксилат (400 МГц, CDCl3)3,91 (с, 3 Н), 4,06 (с, 3 Н), 7,21 (д, J=0,8 Гц, 1 Н), 7,27 (с, 1 Н), 7,42 (дд, J=8,8, 1,6 Гц, 1 Н), 7,80 (д, J=1,6 Гц,1 Н). Промежуточный синтез 42. 6-Бромбензо[b]тиофен-3-карбоновая кислота. Вышеназванное соединение получают, по существу, как описано в J. Med. Chem. 2003, 46, 24462455. Синтез 43. Этиловый эфир 6-Бромбензо[b]тиофен-3-карбоновой кислоты. Метод 1. Раствор 6-бромбензо[b]тиофен-3-карбоновой кислоты (65 г, 252,8 ммоль) и серной кислоты (0,10 экв.; 25,3 ммоль, 1,35 мл; 2,48 г) в этаноле (1,0 л) нагревают при 65 С в течение 3 дней. Раствор охлаждают до комнатной температуры. Фильтруют образовавшийся светло-коричневый осадок. Осадок с фильтра промывают метанолом с получением указанного в заголовке соединения (32 г, 44%). Метод 2. Оксалилхлорид (717,2 г, 5,65 моль, 3,5 экв.) добавляют к суспензии с температурой 0-5 С дихлорметана (3,44 л) и хлорида алюминия (753,4 г, 5,65 моль, 3,5 экв.). Образовавшуюся суспензию перемешивают в течение 30-60 мин при 0-5 С и охлаждают до -20 - -25 С. Раствор 6-бромбензо[b]тиофена-20 до -25 С. Реакционную смесь перемешивают в течение 30 мин при -20 - -25 С и нагревают до 1820 С, применяя теплую водяную баню. Реакционную смесь перемешивают в течение 1,5 ч при этой температуре. Реакционную смесь фильтруют и осадок с фильтра промывают дихлорметаном (3300 мл).- 18016475 Объединенный фильтрат концентрируют с получением в колбе густого черного масла (600 г). Этот остаток растворяют в дихлорметане (1 л) и добавляют порциями к этанолу (3,5 л) при -10-0 С с такой скоростью, чтобы поддержать температуру от 10 до 20 С. После завершения добавления реакционную смесь частично концентрируют исключительно для удаления дихлорметана и затем отключают вакуум. Реакционную смесь нагревают до 60-70 С и перемешивают при этой температуре в течение 1 ч. После завершения реакции раствор декантируют от образовавшихся смол. Смолы отбрасывают. Раствор этанола испаряют с получением остатка. Остаток разбавляют EtOAc (2 л). На этой стадии данную реакционную смесь смешивают с реакционной смесью из еще одной партии реакции с целью дальнейшей обработки (начинают с 330 г 6-бромбензо[b]тиофена, 1,549 моль). Объединенную реакционную смесь выливают при перемешивании в смесь EtOAc (1 л) и соляного раствора (10 л). Фазы разделяют и органическую фазу промывают соляным раствором (2 л). Объединенную водную фазу экстрагируют EtOAc (4 л). Органическую фазу промывают соляным раствором (1 л). Объединенные органические фазы высушивают над сульфатом магния и древесным углем, фильтруют и концентрируют при пониженном давлении. Образовавшееся масло дополнительно концентрируют в вакуумной печи в течение 15 ч при комнатной температуре с получением после высушивания воскообразного твердого вещества (750 г). Твердое вещество суспендируют при перемешивании в гептане (5 л) и суспензию нагревают до 70 С. Добавляют сульфат магния (300 г) и образовавшуюся суспензию перемешивают в течение 10 мин при 70 С. Суспензию фильтруют. Твердое вещество суспендируют в гептане (5 л) и нагревают до 70 С. Суспензию перемешивают в течение 10-20 мин при этой температуре и фильтруют. Осадок с фильтра промывают гептаном (1 л). Гептановые фильтраты собирают и концентрируют при пониженном давлении с получением светло-коричневого твердого вещества (550 г). Твердое вещество растворяют в гептане (4 л) при 60 С. Образовавшийся раствор охлаждают до 35-50 С. Раствор равномерно наливают на две прокладки из силикагеля (1,5 кг каждая), элюируя смесью 0,5% EtOAc в гептане. Чистые фракции продукта объединяют и концентрируют при пониженном давлении. Загрязненные фракции объединяют,концентрируют и очищают, как описано выше. Выделяют суммарный очищенный продукт (500 г) и кристаллизуют из гептана (1,2 л). Твердое вещество собирают посредством фильтрации, промывают холодным гептаном (200 мл, -20 С) и высушивают в вакуумной печи при комнатной температуре в течение 15 ч с получением указанного в заголовке соединения (460 г, 51%). ГХ анализ 98,8%; 1 Н ЯМР (ДМСО-d6,500 МГц):8,65 (с, 1 Н), 8,36 (д, 1 Н, J=1,5), 8,33 (д, 1 Н, J=8,5), 7,63 (дд, 1 Н, J=2, 8,5), 4,33 (кв., 2 Н, J=7),1,33 (т, 3 Н, J=6,5). Примеры Пример 1. 5-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-илбифенил-2-карбоновая кислота Смесь метилового эфира 5-(4-гидроксипиперидин-1-ил)бифенил-2-карбоновой кислоты (318 мг,1,02 ммоль), 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (375 мг, 1,08 ммоль) и гидрида натрия (52 мг, 1,30 ммоль) в диметилформамиде (4 мл) перемешивают при комнатной температуре в течение 2,5 ч. Смесь распределяют между насыщенным водным хлоридом аммония и этилацетатом. Фазы разделяют и водную фазу экстрагируют этилацетатом (3), Этилацетатные фазы промывают соляным раствором (3), высушивают (MgSO4) и концентрируют при пониженном давлении. Неочищенное вещество очищают на кварце (40 г), элюируя градиентом этилацетата в гептане (0-60%), с получением указанного в заголовке соединения (245 мг, 42%) в виде стеклообразной пленки. LC-ES/MS m/z 579,2 (М+1). Стадия 2. 5-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-илбифенил-2-карбоновая кислота. Смесь метилового эфира 5-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пипери- 19016475 дин-1-ил-бифенил-2-карбоновой кислоты (240 мг, 416 мкмоль) в ТГФ (4 мл), MeOH (4 мл) и 5,0 МNaOH (2,0 мл) нагревают при 70 С в течение 4 ч. Смесь охлаждают до комнатной температуры и добавляют 5 М HCl (2,0 мл). Смесь концентрируют до сухости. Добавляют небольшое количество МеОН и осаждают продукт путем добавления воды. Вышеназванное соединение (200 мг, 85%) собирают посредством вакуумной фильтрации. LC-ES/MS m/z 564,0 (М+1). Соединения, перечисленные в табл. 1, получают, по существу, как описано в синтезе 5-4-[5 циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-илбифенил-2-карбоновой кислоты, применяя подходящее исходное вещество. Таблица 1 Пример 14 включает применение LiOH вместо NaOH при осуществлении гидролиза на стадии 2. Гидрид натрия (60%, 93 мг, 1,2 экв., 2,3 ммоль) добавляют при комнатной температуре в атмосфере азота к раствору метилового эфира 6-(4-гидроксипиперидин-1-ил)-1-метил-1 Н-индол-3-карбоновой кислоты (557 мг, 1,00 экв., 1,93 ммоль), иодиду тетра-н-бутиламмония (73 мг, 0,1 экв., 193 мкмоль) и 4 бромметил-3-(2,6-дихлорфенил)-5-изопропилизоксазола (674 мг, 1 экв., 1,93 ммоль) в безводном тетрагидрофуране (6 мл). Реакционную смесь перемешивают в течение 6 ч. Добавляют водный насыщенныйNH4Cl и образовавшийся водный раствор экстрагируют этилацетатом. Органические фазы объединяют,высушивают над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (40 г кварц), элюируя градиентом этилацетат:гексан (10%100%) с получением указанного в заголовке соединения в виде белого твердого вещества (205 мг, 19%).ES/MS m/z 556,0 (M+1) Стадия 2. 6-4-[3-(2,6-Дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил-1-метил 1 Ниндол-3-карбоновая кислота. Раствор 2N гидроксида лития (0,9 мл, 5 экв., 1,8 ммоль) добавляют к раствору метилового эфира 64-[3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил-1-метил-1 Н-индол-3 карбоновой кислоты (200 мг, 1,00 экв., 0,36 ммоль) в 1,4-диоксане (4 мл). Смесь перемешивают при 90 С в течение 24 ч. Удаляют органический растворитель, добавляют НС 1 (1 М) для установления рН 3-4 и образовавшийся водный раствор экстрагируют дихлорметаном. Органические фазы объединяют, высушивают над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (12 г кварц), элюируя градиентом этилацетата в гексане (10%100%), с получением указанного в заголовке соединения в виде бледно-коричневого твердого вещества(168 мг, 86%). ES/MS m/z 542,0 (М+1). Соединения, перечисленные в табл. 2, получают, по существу, как описано в синтезе 6-4-[3-(2,6 дихлорфенил)-5-изопропилизоксазол-4-илметокси]пиперидин-1-ил-1-метил-1 Н-индол-3-карбоновой кислоты, применяя подходящее исходное вещество. Таблица 2 Тетрагидрофуран (4 мл) добавляют при комнатной температуре к смеси 18-краун-6 (306 мг, 1,14 ммоль), трет-бутилового спирта, калиевого производного (134 мг, 1,14 ммоль) и метилового эфира 6-(4 гидроксипиперидин-1-ил)-1-метил-1 Н-индол-3-карбоновой кислоты (300 мг, 1,040 ммоль). Смесь перемешивают в течение 15 мин и затем добавляют 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (361 мг, 1,04 ммоль). Через 1,5 ч добавляют насыщенный раствор NH4Cl и экстрагируют этилацетатом. Органические фазы объединяют, высушивают над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток очищают флэш-хроматографией (12 г кварц),элюируя градиентом гексан:этилацетат от 20 до 100%, с получением указанного в заголовке соединения(196 мг, 34%) в виде белого твердого вещества. ES/MS m/z 554,0 (M+1). Стадия 2. 6-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1 метил-1 Н-индол-3-карбоновая кислота. Раствор 2 М гидроксида лития (1,2 мл, 2,46 ммоль) добавляют к раствору метилового эфира 6-4-[5 циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1-метил-1H-индол-3-карбоновой кислоты (195 мг, 351,7 мк моль) в 1,4-диоксане (5 мл) и смесь перемешивают при 80 С в течение ночи. Удаляют органический растворитель и добавляют HCl (1 М) до тех пор, пока рН раствора не достигнет 3-4. Твердое вещество фильтруют и промывают водой и ацетонитрилом с получением указанного в заголовке соединения (165 мг, 87%) в виде белого твердого вещества. ES/MS m/z 540,0 (М+1). Пример 24. 4-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-илбензойная кислота, изомер А Безводный тетрагидрофуран (5 мл) добавляют при комнатной температуре к смеси этилового эфира 4-(4-гидроксиазепан-1-ил)бензойной кислоты (364 мг, 1,38 ммоль), 18-краун-6 (407 мг, 1,52 ммоль) и трет-бутилового спирта, калиевого производного (178 мг, 1,52 ммоль). Смесь перемешивают в течение 5 минут и затем добавляют 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (480 мг, 1,38 ммоль). Через 1,5 ч растворитель удаляют и добавляют воду. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, высушивают над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток очищают флэш-хроматографией (40 г кварц), элюируя градиентом этилацетат/гексан (0-30%), с получением указанного в заголовке соединения в виде бесцветного воскообразного твердого вещества (203 мг, 28%). ES/MS m/z 529,0 (М+1). Хиральное разделение методом ВЭЖХ: Chiralpak AD (2504,6 мм, 10 мкм): 6:4 гексан/изопропиловый спирт (0,2% диметилэтаноламин) (скорость потока: 12 мл/мин). Получают 60 мг изомера А. Получают 75 мг изомера В. Раствор 2 М гидроксида лития (283 мкл, 566 мкмоль) добавляют к раствору этилового эфира 4-4[5-циклолропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-илбензойной кислоты (изомер А,60 мг, 113 мкмоль) в 1,4-диоксане (2 мл) и смесь перемешивают при 90 С в течение ночи. Органический растворитель удаляют и добавляют HCl (1 М) до тех пор, пока рН раствора не достигнет 3-4. Твердое вещество фильтруют и очищают флэш-хроматографией (12 г кварц), элюируя градиентом дихлорметан:этилацетат от 10% до 20%, с получением указанного в заголовке соединения (50 мг, 88%) в виде белого твердого вещества. ES/MS m/z 501,0 (M+1). Пример 25. 4-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-илбензойная кислота, изомер В Смесь гидрохлорида 4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепана (298 мг,0,713 ммоль), метилового эфира 6-бром-1-метил-1 Н-индол-3-карбоновой кислоты (195 мг, 0,727 ммоль),иодида меди (I) (40 мг, 0,208 ммоль), DL-пролина (60 мг, 0,516 ммоль) и карбоната калия (385 мг, 2,79 ммоль) в диметилсульфоксиде (3 мл) нагревают до 100 С в течение 18 ч в атмосфере азота. Добавляют насыщенный водный хлорид аммония и смесь экстрагируют этилацетатом (3). Объединенные этилацетатные фазы промывают водой (2), соляным раствором (3), высушивают (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (40 г кварц), применяя градиент этилацетата в гептане (0-70%), с получением указанного в заголовке соединения (47 мг, 12%). LC-ES/MSm/z 569,0 (М+1). Стадия 2. 6-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил-1-метил 1 Н-индол-3-карбоновая кислота. Следуя процедуре, по существу, описанной в примере 1, стадия 2 получения 5-4-[5-циклопропил 3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-илбифенил-2-карбоновой кислоты, с помощью метилового эфира 6-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил-1 метил-1 Н-индол-3-карбоновой кислоты (47 мг, 0,083 ммоль) получают 28 мг (61%) указанного в заголовке соединения. LC-ES/MS m/z 554,0 (М+1). Пример 27, представленный в табл. 3, получают, по существу, как описано в синтезе примера 26, 6- 23016475 4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]азепан-1-ил-1-метил-1H-индол-3 карбоновой кислоты, применяя подходящие исходные вещества. Для получения примеров 27A-27D, перечисленных в таблице 3, следуют процедуре, по существу, описанной при получении примера 26, стадия 1, за исключением того, что реакции выполняют в запаянной трубке при нагревании до 110C. Для получения примеров 27C-27D, на стадии 2 заменяют приблизительно 10 экв. NaOH на LiOH, в количестве, достаточном для доведения реакции до завершения, и в тетрагидрофуран и метанол добавляют воду в равном (по объему) количестве. Реакционную смесь перемешивают в течение ночи при комнатной температуре, нейтрализуют до рН 6 посредством 1N HCl и концентрируют до сухости. Вещество разбавляют водой, экстрагируют этилацетатом, высушивают Na2SO4 и концентрируют с получением вышеназванных соединений. Таблица 3 Смешивают 4-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилфениловый эфир транс-трифторметансульфоновой кислоты (1,03 ммоль, 606,00 мг), метанол (10 мл), ацетонитрил (15 мл), триэтиламин (5,17 ммоль, 720,00 мкл), Pd(OAc)2 (52,56 мкмоль; 11,80 мг) и 1,4 бис(дифенилфосфино)бутан (61,90 мкмоль; 26,40 мг) и нагревают до 100 С в атмосфере газа СО (100 psi) в течение 4 ч. Реакционную смесь охлаждают, фильтруют и концентрируют при пониженном давлении. Неочищенную смесь очищают способом радиальной хроматографии (4 мм тарелка), элюируя градиентом гексаны/EtOAc (85:15-80:20), с получением указанного в заголовке соединения (422 мг, 82%) в виде белого твердого вещества. MS m/z 501,8 (M+1). Стадия 2. Транс-4-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексил бензойная кислота. Метиловый эфир транс-4-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилбензойной кислоты (823,31 мкмоль; 412,00 мг) растворяют в тетрагидрофуране (8 мл) и метаноле(10 мл). Добавляют 2N водный NaOH (2,5 мл, 5 ммоль) и смесь нагревают до 52 С в течение 2 ч. Реакционную смесь охлаждают и концентрируют при пониженном давлении. Остаток разбавляют водой (10 мл) и подкисляют 5N HCl (1 мл). Твердое вещество собирают посредством фильтрации, промывают водой и- 24016475 высушивают в вакууме с получением указанного в заголовке соединения (313 мг, 78%) в виде белого твердого вещества. MS m/z 487,8 (M+l). Пример 29. 4-4-[5-Циклопропил-З-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил бензойная кислота Вышеназванное соединение получают, по существу, в соответствии с синтезом транс-4-4-[5 циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилбензойной кислоты, применяя подходящее исходное вещество. ES/MS m/z 502,0 (М+1). Пример 30. Цис-6-4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил-1-метил-1 Н-индол-3-карбоновая кислота Вышеназванное соединение в виде цис/транс-смеси получают, по существу, как описано в синтезе транс-5-циклопропил-3-(2,6-дихлорфенил)-4-4-[4-(4-метоксибензилокси)фенил]циклогексилоксиметил изоксазола, применяя в качестве исходных веществ метиловый эфир 1,6-(4-гидроксициклогексил)-1 метил-1 Н-индол-3-карбоновой кислоты (202 мг, 0,703 ммоль) и 4-бромметил-5-циклопропил-3-(2 трифторметоксифенил)изоксазол (382 мг, 1,05 ммоль). Изомеры разделяют хроматографией на силикагеле, элюируя градиентом 25-40% EtOAc/гексаны, с получением цис-изомера [62 мг, 15,5%; MS m/z 569,0(M+1)] и транс-изомера [52 мг, 13%; MS m/z 569,0 (M+1)]. Стадия 2. Цис-6-4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил-1-метил-1 Н-индол-3-карбоновая кислота. Вышеназванное соединение (42 мг, 69%) получают, по существу, как описано в стадии 2 получения транс-4-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]циклогексилбензойной кислоты, применяя метиловый эфир цис-6-(4-гидроксициклогексил)-1-метил-1 Н-индол-3-карбоновой кислоты(62 мг, 0,11 ммоль), выделенный на стадии 1, описанной выше. MS m/z 555,2 (M+1). Пример 31. Транс-6-4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил-1-метил-1 Н-индол-3-карбоновая кислота Вышеназванное соединение (32 мг, 63%) получают, по существу, как описано в стадии 2 получения цис-6-4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил-1-метил-1 Ниндол-3-карбоновой кислоты, применяя транс-изомер, выделенный на стадии 1 синтеза метилового эфира цис-6-4-[5-циклопропил-3-(2-трифторметоксифенил)изоксазол-4-илметокси]циклогексил-1-метил 1 Н-индол-3-карбоновой кислоты. ES/MS m/z 555,2 (М+1). Пример 32. 6-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1 метил-1 Н-индол-3-карбоновая кислота 3N гидроксид натрия (3,14 л, 9,43 моль) добавляют по каплям при перемешивании к суспензии гидрохлорида гидроксиламина (675,55 г, 9,43 моль) в 0,5 л воды при 0 С. К этой смеси добавляют по каплям суспензию 2,6-дихлорбензальдегида (1500 г, 8,57 моль) в 7,5 л этанола и реакцию нагревают при 90 С в течение ночи. Смесь охлаждают до комнатной температуры и затем концентрируют до сухости. Твердое вещество тритурируют в смеси Н 2 О/EtOH, 10:1 (4,4 л), фильтруют и высушивают в высоком вакууме при 45 С в течение ночи. 1621,78 г указанного в заголовке соединения (9 9% выход) получают в виде белого твердого вещества. MS (m/e): 190 (M+1). Альтернативный способ. Триэтиламин (23,1 г, 229 ммоль) добавляют по каплям к раствору 2,6 дихлорбензальдегида (20,0 г, 114 ммоль) и гидрохлорида гидроксиламина (10,3 г, 149 ммоль) в дихлорметане (200 мл). Реакционную смесь перемешивают в течение 8 ч. Добавляют воду (200 мл). Фазы разделяют и водную фазу экстрагируют дихлорметаном (100 мл). Объединенные органические фазы промывают водой (100 мл). Объединенные органические фазы концентрируют с получением 28,8 г (94%) указанного в заголовке соединения. Стадия 2. 2,6-Дихлорбензальдегид хлороксимN-Хлорсукцинимид (1162 г, 8,53 моль) в ДМФ (4,5 л) добавляют по каплям поверх раствора 2,6 дихлорбензальд.егид оксима (1621,78 г, 8,53 моль) в ДМФ (5,3 л), нагреваемого при 40 С (добавление завершают через примерно 6 ч). Смесь перемешивают в течение 1 ч при этой температуре. Реакцию охлаждают при комнатной температуре, выливают в H2O (30 л) при 0 С и экстрагируют посредством МТВЕ (36 л) и водную фазу отбрасывают. Органическую фазу промывают соляным раствором, высушивают над Na2SO4, фильтруют и испаряют до сухости (при 30 С). Неочищенный продукт в виде твердого масла тритурируют в 1 л гексана и образовавшееся твердое вещество фильтруют и высушивают в вакууме, получая требуемое соединение (144 0,9 г, 75% выход). MS (m/e): 224 (M+1). Альтернативный способ: Раствор N-хлорсукцинимида (8,4 г, 62,8 ммоль) в ДМФ (33 мл) добавляют к раствору с температурой 42 С 2,6-дихлорбензальдегид оксима (217 г, 1,14 моль) в ДМФ (700 мл). Перемешивают в течение 30 мин и затем добавляют раствор N-хлорсукцинимида (159 г, 1,19 моль) в ДМФ(617 мл), поддерживая температуру между 40 и 45 С. Перемешивают в течение 1 ч. Охлаждают до комнатной температуры и перемешивают в течение 2 ч. Образовавшийся раствор указанного в заголовке соединения применяют непосредственно на стадии 3. Стадия 3. Метиловый эфир 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоновой кислоты Триэтиламин (1,82 л, 12,84 моль) добавляют к метиловому эфиру 3-циклопропил-3 оксопропионовой кислоты (913 г, 6,42 моль) и смесь перемешивают при комнатной температуре в течение 30 мин. Затем смесь охлаждают до примерно 10 С и медленно добавляют суспензию 2,6 дихлорбензальдегид хлороксима (1440,9 г, 6,42 моль) в EtOH (3,2 л) (внутренняя температура не превышает 24 С). После добавления реакцию перемешивают в течение ночи при комнатной температуре. Реакцию разбавляют EtOAc (5,3 л) и промывают водой (1,7 л). Фазы разделяют и водную фазу экстрагируют EtOAc (3 л). Объединенные органические вещества промывают соляным раствором, высушивают надNa2SO4 (безв.), фильтруют и концентрируют до примерно 10% от их суммарного объема. Образовавшийся осадок фильтруют, тритурируют с эфиром (2 л) и высушивают в вакууме, получая указанное в заголовке соединение (1275,36 г, 64% выход) в виде белого твердого вещества. MS (m/e): 312, (М+1). Альтернативный способ. Триэтиламин (20,2 г, 0,2 моль) добавляют к метиловому эфиру 3-циклопропил-2-оксопропионовой кислоты (18,5 г, 0,13 моль) и перемешивают при комнатной температуре в течение 30 мин. Полученный раствор добавляют к предварительно приготовленному 1/10 ДМФ раствору 2,5 дихлорбензальдегидхлороксима (альтернативный способ, стадия 2) при температуре между 10 и 20 С. Нагревают до 25-30 С и перемешивают в течение 20 ч. Добавляют воду (285 мл). Перемешивают в течение 1 ч и фильтруют с Гидрид диизобутилалюминия 1 М/толуол (4,62 л, 4,62 моль) по каплям добавляют при перемешивании к раствору метилового эфира 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоновой кислоты(687,14 г, 2,20 моль) в ТГФ (4,4 л) при 0 С. Реакцию перемешивают при комнатной температуре в течение 2 ч. Поверх смеси добавляют метанол (150 мл) при 0 С и перемешивают в течение 10 мин. Затем добавляют воду (2,2 л) и EtOAc (4,3 л). Образовавшийся осадок фильтруют через слой целита, и все растворители удаляют в вакууме. Твердое вещество тритурируют в 1 л гексана и высушивают способом вакуумной фильтрации, получая указанное в заголовке соединение (534,7 г, 85% выход) в виде белого твердого вещества. MS (m/e): 312 (M+1). Альтернативный способ: Охлаждают раствор метилового эфира 5-циклопропил-3-(2,6 дихлорфенил)изоксазол-4-карбоновой кислоты (62,4 г, 200 ммоль) в дихлорметане (400 мл) до 0 С. Добавляют гидрид диизобутилалюминия (440 мл, 1,0 М, 440 ммоль), поддерживая температуру между -5 и 0 С. Образовавшуюся смесь перемешивают в течение 30 мин. Нагревают до 15-25 С и перемешивают в течение 3 ч. Реакционный раствор добавляют к 2,0 М HCl (800 мл) при 8 С-10 С. Перемешивают в течение 30 мин. Фазы разделяют и водную фазу экстрагируют дихлорметаном (200 мл). Объединенные органические фазы промывают водой (3100 мл). Органическую фазу концентрируют до суммарного объема 180 мл. Добавляют гептан (350 мл). Образовавшееся твердое вещество фильтруют с получением 51,5 г (90%) указанного в заголовке соединения. Стадия 5. 4-Бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол К раствору 30 г (105,58 ммоль) [5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил]метанола в 210 мл дихлорметана добавляют 41,96 г (158 ммоль) трифенилфосфина. Образовавшуюся смесь охлаждают в ледяной бане (примерно 0-10 С) и добавляют порциями к тетрабромиду углерода (53 г, 158,37 ммоль). Реакцию перемешивают при комнатной температуре в течение 2 ч. Растворитель испаряют и получают оранжевое масло, которое очищают колоночной хроматографией на силикагеле, применяя гексан - гексаны/EtOAc 8:2 в качестве элюента, с получением 33 г указанного в заголовке соединения в виде белого твердого вещества (90%). MS (m/e): 346 (M+1). Альтернативный способ. Раствор (5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанола(100 г, 0,35 моль) в дихлорметане (1200 мл) охлаждают до -10 С. Добавляют по каплям трибромид фосфора (105 г, 0,39 моль), поддерживая внутреннюю температуру между -5C и 0 С. Перемешивают при-5 - 0 С в течение 30 мин. Оставляют нагреваться до температуры между 20 и 25 С и перемешивают при 20-35 С в течение 2 ч. Реакционную смесь охлаждают до 0-5 С. По каплям добавляют водный раствор бикарбоната натрия (775 мл). Фазы разделяют. Водную фазу экстрагируют дихлорметаном (2350 мл). Промывают объединенные органические фазы водой (3500 мл). Органическую фазу концентрируют с получением 115 г (94%) указанного в заголовке соединения в виде твердого вещества. Стадия 6. Трет-бутиловый эфир 4-[5-циклопропил-3-(2,6-дихлорфенил) изоксазол-4-илметокси] пиперидин-1-карбоновой кислоты К раствору 13,05 г (64,83 ммоль) трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты в ТГФ (120 мл) добавляют при 0 С (ледяная баня) 18-краун-6 (19,6 г, 73,48 ммоль) и третичный бутилат калия (8,68 г, 73,48 ммоль). Образовавшуюся смесь перемешивают в течение 20 мин при комнатной температуре и по каплям добавляют к раствору 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (15 г, 43,22 ммоль) в 75 мл ТГФ. Образовавшуюся смесь перемешивают при комнатной темпера- 27016475 туре в течение 14 ч. К реакционной смеси добавляют воду (500 мл) и смесь экстрагируют EtOAc (3200 мл). Органические вещества промывают соляным раствором (2250 мл), высушивают (Na2SO4), фильтруют и концентрируют с получением неочищенного продукта, который очищают флэш-хроматографией,элюируя смесью гексаны/EtOAc 8:2, с получением указанного в заголовке соединения в виде бледножелтого масла (16 г (79%. MS (m/e): 467 (M+1). Стадия 7. 4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин В охлажденную (ледяная баня) 500-мл колбу в атмосфере азота помещают раствор трет-бутилового эфира 4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-карбоновой кислоты(16 г, 34,3 ммоль) в дихлорметане (80 мл). Процедуру сопровождают добавлением по каплям трифторуксусной кислоты (80 мл) (добавляют в течение 30 мин). Реакцию перемешивают при комнатной температуре в течение 90 мин. Растворитель удаляют в вакууме, добавляют EtOAc (400 мл) и смесь промывают 2N NaOH (2250 мл) и соляным раствором. Органическую фазу высушивают над MgSO4, фильтруют и испаряют, получая указанное в заголовке соединение в виде коричневого масла (11,78 г, 93%). MS (m/e): 367 (M+1). Альтернативный способ. Стадию 6 и 7 комбинируют с получением гидрохлорида 5-циклолропил-3(2,6-дихлорфенил)-4-пиперидин-4-илокси)метил)изоксазола Раствор трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (352 г, 1,75 моль) и 18-краун-6 (463 г, 1,75 моль) в ТГФ охлаждают до температуры между 0 С и 5 С. Добавляют третбутилат калия (268 г, 2,39 моль), поддерживая температуру между 0 и 10 С. Образовавшуюся смесь охлаждают до -10 - -5 С. Добавляют 40 вес.% раствор 4-бромметил-5-циклопропил-3-(2,6-дихлорфенил) изоксазола в ТГФ (1,38 кг, 1,59 моль), поддерживая температуру между -5 и 0 С. Оставляют смесь нагреваться до 15-25 С и перемешивают в течение 2 ч. Охлаждают до 0-5 С и по каплям добавляют воду, поддерживая температуру между 0 и 10 С. Добавляют этилацетат (3,5 л) и соляной раствор (5,5 л). Фазы разделяют и водную фазу экстрагируют этилацетатом (22,5 л). Объединенные органические фазы промывают соляным раствором (35,5 л). Органическую фазу концентрируют в вакууме до суммарного объема приблизительно 1,5 л с получением раствора неочищенного трет-бутилового эфира 4-[5 циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-карбоновой кислоты. Добавляют дополнительное количество этилацетата (3,0 л). Раствор охлаждают до 0 С-5 С. Добавляют HCl (газообразный) (319 г, 8,75 моль), поддерживая температуру между 0 и 5 С. Оставляют нагреваться до 15-25 С и перемешивают в течение 4 ч. Смесь концентрируют в вакууме до суммарного объема приблизительно 1,2 л. Образовавшееся твердое вещество фильтруют и промывают холодным этилацетатом (20,6 л). Высушивают с получением 506 г (79%) указанного в заголовке соединения в виде грязно-белого твердого вещества. Т. пл. 200-202 С (определена способом дифференциальной сканирующей калориметрии). Стадия 8. 6-Броминдол-3-карбоновая кислота(50 г, 310 ммоль) в 500 мл уксусной кислоты при комнатной температуре и смесь перемешивают при комнатной температуре в течение ночи. Образовавшееся твердое вещество фильтруют и высушивают в вакууме в течение 3 ч с получением 45 г указанного в заголовке соединения в виде серого твердого вещества (60%). MS (m/e) : 240 (M+1). Стадия 9. Метиловый эфир 6-бром-1 Н-индол-3-карбоновой кислоты Ацетилхлорид (29,43 г, 374 ммоль) медленно при комнатной температуре добавляют к раствору 6- 28016475 бром-индол-3-карбоновой кислоты (45 г, 187,46 ммоль) в 500 мл метанола и образовавшийся раствор перемешивают при 65 С в течение ночи. Реакцию охлаждают до комнатной температуры. При охлаждении появляется белый осадок. После перемешивания 2 ч при комнатной температуре твердое вещество отфильтровывают и высушивают в вакууме. 34,4 г (72%) указанного в заголовке соединения получают в виде светло-коричневого твердого вещества. MS (m/e): 254 (M+1). Стадия 10. Метиловый эфир 6-бром-1-метил-1 Н-индол-3-карбоновой кислоты(196 ммоль) карбоната калия в 300 мл ацетонитрила добавляют при комнатной температуре метилиодид(20,95 г, 147,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 дней. Растворитель испаряют, добавляют 500 мл воды и органическую фазу экстрагируют (3300 мл) этилацетатом. Органические вещества объединяют, высушивают над сульфатом магния и испаряют. Неочищенное вещество очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc 8:2. Вышеназванное соединение (23,3 г (88% получают в виде коричневого твердого вещества. MS (m/e): 268 (M+1). Альтернативный способ. Диметилкарбонат добавляют (1,3 л, 12,4 моль) к смеси метилового эфира 6-бром-1H-индол-3-карбоновой кислоты (1,3 кг, 5,1 моль) и карбоната калия (1,41 кг, 10,2 моль) в ДМФ(6,0 л) при комнатной температуре. Смесь нагревают до 130 С и перемешивают в течение ночи. Реакционную смесь охлаждают до 3 С и добавляют ледяную воду (6 л). Образовавшееся твердое вещество фильтруют, промывают метанолом (2 л) и высушивают в вакуумной печи с получением 1,1 кг (82%) указанного в заголовке соединения. Стадия 11. Метиловый эфир 6-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1-метил-1 Н-индол-3-карбоновой кислоты 250-мл запаянную круглодонную колбу загружают в атмосфере азота 4-[5-циклопропил-3-(2,6 дихлорфенил)изоксазол-4-илметокси]пиперидином (15 г, 40,84 ммоль), метиловым эфиром 6-бром-1 метил-1 Н-индол-3-карбоновой кислоты (15,33 г, 57,18 ммоль); карбонатом калия (11,29 г, 81,68 ммоль),иодидом меди(I) (3,11 г, 16,34 ммоль) и пролином (1,88 г, 16,34 ммоль) в 80 мл диметилсульфоксида. Реакционную смесь нагревают при 120 С в течение 16 ч. Затем смесь охлаждают до комнатной температуры, гасят водой (200 мл) и экстрагируют EtOAc (3150 мл). Органические вещества промывают водой и соляным раствором, высушивают над MgSO4, фильтруют и выпаривают. Неочищенный продукт очищают способом испарительной силикагелевой хроматографии, применяя смесь гексан/EtOAc 8:2 - 1:1 в качестве элюирующей системы, и получают 9,8 г указанного в заголовке соединения в виде белого твердого вещества (43%). MS (m/e): 554 (M+1). Стадия 12. 6-4-[5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1 метил-1 Н-индол-3-карбоновая кислота В 500-мл круглодонную колбу в атмосфере азота, содержащую раствор 9 г (16,23 ммоль) метилового эфира 6-4-[5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-илметокси]пиперидин-1-ил-1-метил-1 Ниндол-3-карбоновой кислоты в 80 мл метанола, 80 мл ТГФ и 30 мл диоксана, добавляют 2N КОН (40 мл,81,16 ммоль). Реакционную смесь перемешивают при 70 С в течение ночи. Затем реакционную смесь охлаждают до комнатной температуры и удаляют растворитель в вакууме. Остаток разбавляют 100 мл воды и промывают МТВЕ. Водную фазу подкисляют (рН 5) путем добавления 2N HCl, затем ее экстрагируют CH2Cl2 (3150 мл). Органические вещества высушивают над MgSO4, фильтруют и испаряют с получением светло-зеленого твердого вещества, которое повторно перекристаллизовывают из
МПК / Метки
МПК: A61P 3/06, C07D 261/08, A61K 31/42, C07D 413/12
Метки: применения, соединения, азольные, модуляторов, качестве
Код ссылки
<a href="https://eas.patents.su/30-16475-azolnye-soedineniya-dlya-primeneniya-v-kachestve-fxr-modulyatorov.html" rel="bookmark" title="База патентов Евразийского Союза">Азольные соединения для применения в качестве fxr модуляторов</a>
Предыдущий патент: Устройство управления положением горизонтальных жалюзи
Следующий патент: Ароматизирующая добавка и изделия
Случайный патент: Способ увеличения производительности существующей технологической установки и технологическая установка












