Трициклические соединения и их применение в качестве модуляторов глюкокортикоидного рецептора
Номер патента: 16001
Опубликовано: 30.01.2012
Авторы: Рукер Пол Винсент, Ху Сяо, Джером Кевин Диуэйн, Олсон Лиза, Обукович Марк Джерард, Чэн Хэнмяо, Веббер Рональд Кит
Формула / Реферат
1. Соединение формулы (I)
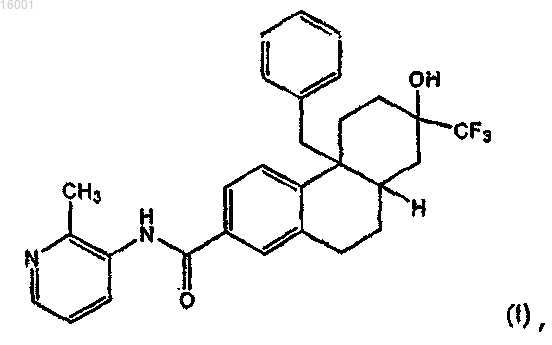
или его соль.
2. Соединение по п.1, представляющее собой соединение формулы
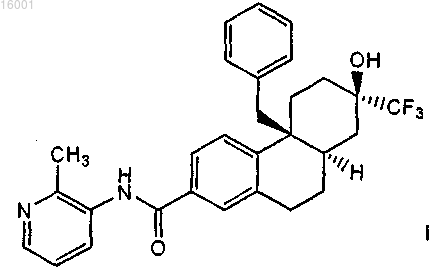
или его соль.
3. Соединение по п.2, представляющее собой соединение формулы
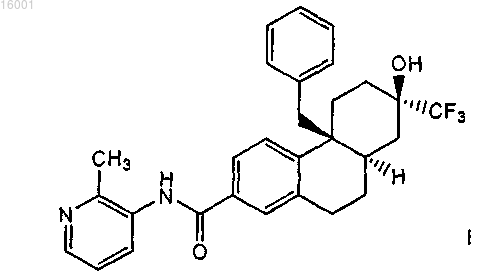
4. Хлористо-водородная соль соединения по п.1.
5. Фармацевтическая композиция, включающая соединение по п.1 или его соль и носитель.
6. Способ модулирования глюкокортикоидного рецептора, включающий контактирование глюкокортикоидного рецептора с соединением по п.1 или с его солью в условиях in vivo, ex vivo или in vitro.
7. Способ лечения состояния, опосредованного активностью глюкокортикоидного рецептора у индивидуума, включающий введение индивидууму соединения формулы (I)
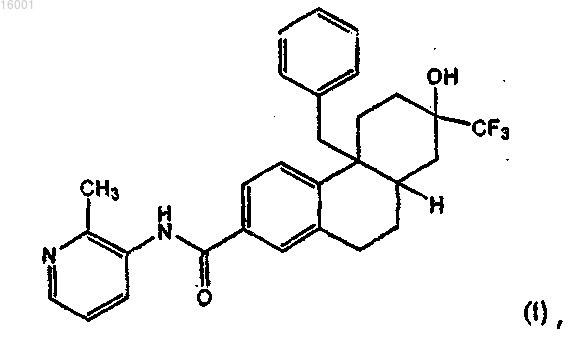
или его соли.
8. Способ по п.7, в котором состояние представляет собой состояние, обусловленное воспалением.
9. Способ по п.7, в котором состояние представляет собой астму, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, психотическую глубокую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническое обструктивное заболевание легких.
10. Способ по п.7, в котором состояние представляет собой ревматоидный артрит.
11. Способ по п.7, в котором состояние представляет собой дерматит.
12. Способ по п.7, в котором состояние представляет собой астму.
13. Способ по п.7, в котором состояние представляет собой болезнь Альцгеймера.
14. Способ по п.7, в котором состояние представляет собой воспалительное заболевание кишечника.
15. Способ смягчения побочных эффектов, ассоциированных с модуляцией глюкокортикоидного рецептора, включающий введение индивидууму соединения по п.1.
Текст
Дата публикации и выдачи патента Номер заявки ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА Настоящее изобретение относится к соединениям формулы (I) или к их солям, которые представляют собой модуляторы глюкокортикоидного рецептора. Соединения по изобретению и их соли могут быть применены для лечения состояний,опосредованных активностью глюкокортикоидного рецептора. 016001 Область техники Настоящее изобретение относится к соединениям, которые представляют собой модуляторы глюкокортикоидного рецептора. Настоящее изобретение также включает композиции и способы применения соединений и композиций. Уровень техники Модуляторы глюкокортикоидного рецептора представляют собой лиганды глюкокортикоидного рецептора, которые применяются для лечения разнообразных состояний, благодаря их мощной противовоспалительной, антипролиферативной и иммуномодуляторной активности, J. Miner, et al., Expert Opin.Investig. Drugs (2005) 14(12):1527-1545. Примеры модуляторов глюкокортикоидного рецептора включают дексаметазон, преднизон, преднизолон, RU-486 и соединения, описанные в WO 2000/66522 и WO 2004/005229. Лечение модуляторами глюкокортикоидного рецептора часто связано с побочными эффектами, такими как повреждение костей и остеопороз. Существует необходимость в разработке модулятора глюкокортикоидного рецептора, который бы являлся эффективным, мощным средством и смягчал побочные эффекты, отвечая тем самым современным медицинским требованиям. Сущность изобретения В одном варианте осуществления изобретение относится к соединению формулы (I) где R1 представляет собой -Н или -Р(O)(ОН)2,или к его соли. В другом варианте осуществления изобретение относится к композициям, включающим соединение формулы (I) и носитель. В другом варианте осуществления изобретение относится к способу, включающему контактирование глюкокортикоидного рецептора с соединением формулы (I). Дополнительный вариант осуществления включает способы лечения состояния у индивидуума, опосредованного активностью глюкокортикоидного рецептора, путем введения индивидууму соединения формулы (I). Подробное описание предпочтительных вариантов осуществления Это подробное описание вариантов осуществления предназначено только для ознакомления других специалистов в данной области техники с изобретением, принципами и практическими применениями,так что другие специалисты в области техники могут адаптировать и применять изобретение в его многочисленных формах, в которых изобретение может быть наилучшим образом приспособлено к требованиям конкретного применения. Эти варианты изобретения, следовательно, не ограничены вариантами осуществления, описанными в этом описании, и могут быть модифицированы.A. Определения. Для следующих определенных терминов, пока явно не утверждается иное, будут применяться данные определения, в формуле изобретения или где-либо еще в этом описании. Термин "носитель" описывает компонент, отличный от соединения. Носители могут представлять собой фармацевтически приемлемый материал или разбавитель. Примеры включают жидкий или твердый наполнитель, разбавитель, уплотнитель, растворитель или инкапсулирующий материал. Фраза "контактирование глюкокортикоидного рецептора" обозначает контакт in vivo, ex vivo или invitro, осуществляемый с глюкокортикоидным рецептором, и включает введение соединения или соли по настоящему изобретению индивидууму, имеющему глюкокортикоидный рецептор, также как, например,введение соединения или соли по изобретению в образец, содержащий клеточный, неочищенный или очищенный препарат, содержащий глюкокортикоидный рецептор. Например, контактирование включает взаимодействие между соединением и рецептором, такое как связывание. Фраза "состояние, обусловленное воспалением" включает артрит, фибромиалгию, анкилозирующий спондилит, псориаз, системную красную волчанку, подагру, недифференцированную спондилоатрофию,юношеский спондилоартрит, болезнь Крона, язвенный колит, синдром раздраженного кишечника, воспалительное заболевание кишечника и боль, ассоциированную с вышеупомянутыми состояниями. Специфические примеры артрита включают ревматоидный артрит, остеоартрит, реактивный артрит, инфекционный артрит, псориатический артрит, полиартрит, юношеский артрит, юношеский ревматоидный артрит, юношеский реактивный артрит и юношеский псориатический артрит.-1 016001 Термины "модуляция" или "модуляторы" включают антагонист, агонист, частичные антагонисты и частичные агонисты. Термин "индивидуум" относится к любому животному, включая млекопитающих, такому как мыши, крысы, другие грызуны, кролики, собаки, кошки, свиньи, корова, овца, лошади, приматы или человек. Термин "лечение" (и соответствующие термины "лечить" и "обработка") включает паллиативное,восстановительное и предупреждающее ("профилактическое") лечение индивидуума. Термин "паллиативное лечение" относится к лечению, которое облегчает или уменьшает симптом или тяжесть состояния у индивидуума без излечения состояния. Термин "предупреждающее лечение" (и соответствующий термин "профилактическое лечение") относится к лечению, которое предотвращает появление состояния у индивидуума. Термин "восстанавливающее лечение" ("излечивающее") относится к лечению, которое останавливает прогрессирование, уменьшает патологические проявления или полностью устраняет болезненное состояние у индивидуума. Лечение может быть проведено с терапевтически эффективным количеством соединения, соли или композиции, которые вызывают биологический или медицинский отклик в ткани, системе или индивидууме, что является искомым для врача, такого как исследователь,врач в больнице, ветеринар или практикующий врач.B. Соединения. Настоящее изобретение в одном аспекте включает трициклические соединения формулы (I). Эти соединения могут быть применены в качестве модуляторов глюкокортикоидного рецептора. Настоящее изобретение включает соединение формулы (I) в котором R1 представляет собой -Н или -Р(O)(ОН)2,или его соль. Настоящее изобретение включает соединение формулы (II) где R1 представляет собой -Н или -Р(O)(ОН)2,или его соль. Настоящее изобретение включает соединения формул (I) или (II), где R1 представляет собой -Н, или их соли. Настоящее изобретение включает соединения формул (I) или (II), где R1 представляет собой-P(O)(OH)2, или их соли. Настоящее изобретение включает (4S,7R,8R)-4-бензил-7-гидрокси-N-(2-метилпиридин-3-ил)-7(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид или его соль; и дигидрофосфат(2R,4S,10R)-4-бензил-7-2-метилпиридин-3-ил)карбомоил)-2-(трифторметил)-1,2,3,4,4,9,10,10 октагидрофенантрен-2-ила, или его соль. Соли соединений по настоящему изобретению включают их соли присоединения кислоты и основания (включая дисоли). В одном варианте осуществления настоящее изобретение включает хлористоводородную соль соединения формулы (I). В другом варианте осуществления настоящее изобретение включает кальциевую соль соединения формулы (I). В другом варианте осуществления настоящее изобретение включает натриевую соль соединения формулы (I). Пригодные соли присоединения кислоты образуются из кислот, которые образуют нетоксичные соли. Примеры включают соли, такие как ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, эдисилат, эсилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, исетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат,-2 016001 оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидронфосфат, сахарат, стеарат, сукцинат,тартрат, тозилат и трифторацетат. Пригодные соли с основанием образуются из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина,глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Для обзора по пригодным солям см. "Handbook of Pharmaceutical Salts: Properties, Selection, and Use"by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Соль может быть легко получена путем совместного смешивания растворов соединений по настоящему изобретению и желаемой соответствующей кислоты или основания. Соль может выпадать в осадок из раствора и собираться фильтрованием или может быть выделена упариванием растворителя. Степень ионизации соли может варьировать от полностью ионизированной до почти не ионизированной. Соединения по настоящему изобретению могут быть введены в виде пролекарств. Так, определенные производные, которые сами по себе могут иметь маленькую фармакологическую активность или не иметь ее, могут при введении в организм или нанесении на тело превращаться в соединения по настоящему изобретению, имеющие желаемую активность, например, путем гидролитического расщепления. Такие производные обозначаются как "пролекарства". Дополнительная информация по применению пролекарств может быть было найдена в "Pro-drugs as Novel Delivery Systems", vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) and "Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (ed. E.В.Roche, American Pharmaceutical Association). Пролекарства могут, например, быть получены путем замещения соответствующих функциональных групп, присутствующих в соединениях по настоящему изобретению, на определенные фрагменты,известные для специалистов в данной области как "профрагменты", как описано, например, в "Design ofProdrugs", Н. Bundgaard (Elsevier, 1985). Некоторые примеры таких пролекарств включают:(i), где соединение содержит спиртовую группу (-ОН), ее простой эфир, например, с заменой водорода на (C1-С 6)алканоилоксиметил; и(ii), где соединение содержит вторичную аминофункциональную группу, ее амиды, например, с заменой водорода на (C1-C10)алканоил. В конечном итоге определенные соединения по настоящему изобретению могут сами действовать как пролекарства других соединений по настоящему изобретению. Например, определенные соединения формул (I) или (II) могут рассматриваться как пролекарства других соединений, включаемых в формулы(I) или (II). Все изомеры, такие как стереоизомеры, геометрические (цис/транс или Z/E) изомеры и таутомерные формы соединений или солей, являются включенными в объем настоящего изобретения, включая соединения или соли, имеющие более чем один тип изомерии, и смеси одного или нескольких изомеров. Например, на следующей схеме изображено соединение формулы (I) и таутомер. Также включенными являются соли присоединения кислоты или основания, в которых противоион является оптически активным, например D-лактат или L-лизин, или рацемическим, например DL-тартрат или DL-аргинин. Изомеры могут быть разделены традиционными методиками, хорошо известными специалистам в данной области. Настоящее изобретение включает изотопно-меченые соединения по изобретению, где один или несколько атомов заменены на атомы, имеющие тот же атомный номер, но атомная масса или массовое число отличается от атомной массы или массового числа, обычно находящихся в природе. Изотопно-меченые соединения по изобретению обычно могут быть получены традиционными методиками, известными специалистам в данной области, или способами, аналогичными тем, что описаны в прилагаемых примерах и примерах получения с применением соответствующего изотопно-меченого реагента вместо ранее применявшегося немеченого реагента. Для лечения состояний, описываемых ниже, могут быть введены соединения по настоящему изобретению. Также могут быть применены соли соединений по настоящему изобретению.C. Композиции. Соединения или соли по настоящему изобретению могут представлять собой часть композиции. Композиции могут также включать одно или несколько соединений или солей по настоящему изобретению. Композиция также может включать энантиомерный избыток одного или нескольких соединений по-3 016001 настоящему изобретению. Другие фармакологически активные вещества и носители могут быть включены в композицию. Один вариант осуществления представляет собой композицию, включающую соединение формулы(I) или его соль. Другой вариант осуществления представляет собой композицию, включающую соединение формулы (I) или его соль, и носитель. Например, носитель может представлять собой наполнитель. Выбор наполнителя будет в большой степени зависеть от факторов, таких как конкретный режим введения, влияние наполнителя на растворимость и стабильность, и природы дозированной формы. Композиция может являться твердой, жидкой, или и тем, и другим, и может быть рецептурирована с соединением в виде композиции отдельной дозы, например таблетки, которая может содержать от 0,05 до 95 мас.% активных соединений. Соединения или соли по настоящему изобретению могут быть соединены с пригодными полимерами для получения носителей лекарства направленного действия.D. Способы. Настоящее изобретение включает способ контактирования глюкокортикоидного рецептора с соединением или с солью по настоящему изобретению. Настоящее изобретение также включает способ лечения состояния, опосредованного активностью глюкокортикоидного рецептора у индивидуума, включающего введение индивидууму соединения или соли по настоящему изобретению. Состояние, опосредованное активностью глюкокортикоидного рецептора, включает:a) эндокринные расстройства, такие как первичная или вторичная адренокортикальная недостаточность, врожденная гиперплазия надпочечников, болезнь де Карвена и гиперкальциемия, ассоциированная с раком;b) ревматические расстройства, такие как псориатический артрит, ревматоидный артрит, включая юношеский ревматоидный артрит, анкилозирующий спондилит, острый и подострый бурсит, острый неспецифический теносиновит, острый подагрический артрит, посттравматический остеоартрит, остеоартритный синовит и эпикондилит;c) коллагеновые болезни, такие как системная красная волчанка и острый ревматический кардит;d) дерматозные состояния, такие как пемфигус, буллезный герпетиформный дерматит, тяжелая экссудативная многоформная эритема (синдром Стевена-Джонсона), эксфолиативный дерматит, грибовидный микоз, псориаз и себорейный дерматит;e) аллергические состояния, такие как сезонная или круглогодичная аллергии, аллергический ринит, бронхиальная астма, контактный дерматит, атопический дерматит, сывороточная болезнь и реакции гиперчувствительности к лекарственному средству;f) глазные заболевания и состояния, такие как аллергические роговичные маргинальные язвы, глазной опоясывающий лишай, воспаление переднего сегмента, диффузный задний увеит и хороидит, хронический увеит, симпатическая офтальмия, аллергический конъюнктивит, кератит, хориоретинит, ретробульбарный неврит, воспаление радужной оболочки глаза и иридоциклит;g) респираторные заболевания, такие как симптоматический саркоидоз, синдром дифтерийной палочки, бериллиоз, скоротечный или диссеминированный легочный туберкулез и аспирационный пневмонит;h) гематологические расстройства, такие как болезнь Верльгофа, вторичная тромбоцитопения, приобретенная (аутоиммунная) гемолитическая анемия, эритробластопения (RBC анемия) и наследственнаяi) неопластические заболевания, такие как лейкемия и лимфома;j) отечные состояния, такие как индуцированный диурез или протеинурия при нефротическом синдроме, без уремии, идиопатического типа или возникающая благодаря красной волчанке;k) желудочно-кишечные заболевания, такие как язвенный колит, регионарный энтерит, воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженной толстой кишки;l) разнообразные состояния, такие как туберкулезный менингит и трихинеллез; иm) неврологические состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, повреждение спинного мозга, психотическая глубокая депрессия и периферическая невропатия. Состояние, опосредованное активностью глюкокортикоидного рецептора, также включает отторжение трансплантата (например, почки, печени, сердца, легкого, поджелудочной железы (например, островных клеток), костного мозга, роговицы, тонкой кишки), кожных аллогенных трансплантатов, кожных гомотрансплантатов (таких как употребляемые при лечении ожогов), ксенотрансплантатов сердечного клапана), сывороточную болезнь, реакцию "трансплантат против хозяина", аутоиммунные заболевания,такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, диабет типа I и типа II,юношеский диабет, ожирение, астму, воспалительное заболевание кишечника (такое как болезнь Крона и язвенный колит), гнойничковую болезнь кожи, туберкулез кожи (системная красная волчанка), тяжелую миастению, псориаз, дерматит, дерматомиозит; экзему, себорею, воспаление легких, глазной увеит, гепатит, болезнь Грейва (Grave), хронический лимфоматозный тиреоидит Хасимото (Hashimoto), аутоиммун-4 016001 ный лимфоматозный тиреоидит, синдром Бехчета или синдром Шенгрена (Sjorgen) (сухих глаз/рта), злокачественную или иммуногемолитическую анемию, атеросклероз, заболевание Аддисона (аутоиммунное заболевание надпочечников), идиопатическую недостаточность надпочников, аутоиммунное полигландулярное заболевание (также известное как аутоиммунный полигландулярный синдром), гломерулонефрит, склеродерму, кольцевидную склеродермию, красный плоский лишай, витилиго (депигментация кожи), гнездную алопецию, аутоиммунную алопецию, аутоиммунный гипопитуатаризм, синдром ГийенаБарре и альвеолит; болезни, опосредованные гиперчувствительностью Т-клеток, включая контактную гиперчувствительность, гиперчувствительность отсроченного типа, контактный дерматит (включая дерматит, вызываемый сумахом Rhus radicans), крапивницу, кожные аллергии, респираторные аллергии(сенная лихорадка, аллергический ринит) и глютензависимая энтеропатия (глютенчувствительная целиакия); воспалительные заболевания, такие как остеоартрит, острый пенкреатит, хронический панкреатит,синдром острой дыхательной недостаточности, синдром Сезара (Sezary) и сосудистые заболевания, которые имеют воспалительный и/или злокачественный компонент, такие как рестеноз, стеноз и артеросклероз. Состояние, опосредованное активностью глюкокортикоидного рецептора, также включает: а) астму любого типа, этиологии или патогенеза, в частности астму, которая является выбранной из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопический бронхиальной IgE-опосредованной астмы, бронхиальной астмы, наследственной астмы, истинной астмы,вызываемой патофизиологическими нарушениями внутренней астмы, внешней астмы, вызываемой факторами окружающей среды, идиопатической астмы неизвестного или неочевидного происхождения, неатопической астмы, бронхиальной астмы, эмфизематозной астмы, вызванной тренировками астмы, вызванной аллергеном астмы, вызванной холодным воздухом астмы, профессиональной астмы, инфекционной астмы, вызываемой бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, астмы в начальной стадии, астматического синдрома у новорожденных и капиллярного бронхита;b) хроническую или острую бронхоконстрикцию, хронический бронхит, блокаду небольших дыхательных путей и эмфизему;c) обструктивное или воспалительное заболевание дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивное или воспалительное заболевание дыхательных путей, которое является выбранным из группы, состоящей из хронической эозинофильной пневмонии, хронического обструктивного заболевания легких (COPD, ХОЗЛ), ХОЗЛ, которое включает хронический бронхит, легочную эмфизему или одышку, ассоциированную или не ассоциированную с ХОЗЛ, ХОЗЛ, которое характеризуется необратимой, прогрессирующей закупоркой дыхательных путей, респираторный дистресссиндром у взрослых (ARDS), обострение гиперчувствительности дыхательных путей, являющееся следствием другой лекарственной терапии и заболевания дыхательных путей, которое ассоциировано с легочной гипертензией;d) бронхит любого типа, этиологии или патогенеза, в частности бронхит, который является выбранным из группы, состоящей из острого бронхита, острого ларинготрахеального бронхита, арахиновокислотного бронхита, катарального бронхита, фибринозного бронхита, сухого бронхита, инфекционного астматического бронхита, первичного бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита, острую травму легкого; иe) бронхоэктазию любого типа, этиологии или патогенеза, в частности бронхоэктазию, выбранную из группы, состоящей из цилиндрической бронхоэктазии, мешотчатой бронхоэктазии, веретенообразной бронхоэктазии, капиллярной бронхоэктазии, кистозной бронхоэктазии, сухой бронхоэктазии и фолликулярной бронхоэктазии. Другой вариант осуществления включает применение соединения или соли по настоящему изобретению для применения при лечении обструктивного или воспалительного заболевания дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивного или воспалительного заболевания дыхательных путей, которое выбрано из группы, состоящей из хронической эозинофильной пневмонии, хронического обструктивного заболевания легких (ХОЗЛ), которое включает хронический бронхит,легочную эмфизему или одышку, ассоциированную или не ассоциированную с ХОЗЛ, ХОЗЛ, которое характеризуется необратимой, прогрессирующей закупоркой дыхательных путей, респираторного дистресс-синдрома у взрослых (ARDS), обострения гиперчувствительности дыхательных путей, являющейся следствием другой лекарственной терапии, и заболевания дыхательных путей, которое ассоциировано с легочной гипертензией, или астмы любого типа, этиологии или патогенеза, в частности астмы, которая выбрана из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной IgE-опосредованной астмы, бронхиальной астмы, идиопатической астмы, истинной астмы, вызываемой патофизиологическими нарушениями врожденной астмы, внешней астмы,вызываемой факторами окружающей среды, идиопатической астмы неизвестной или неочевидного происхождения, неатопической астмы, бронхиальной астмы, эмфизематозной астмы, астмы, вызванной физическими нагрузками, вызванной аллергеном астмы, вызываемой холодным воздухом астмы, профессиональной астмы, инфекционной астмы, вызываемой бактериальной, грибковой, протозойной или ви-5 016001 русной инфекцией, неаллергической астмы, астмы в начальной стадии, астматического синдрома у новорожденных и капиллярного бронхита. Настоящее изобретение включает способ лечения состояния, обусловленного воспалением у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения состояний, таких как астма, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, психотическую глубокую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническое обструктивное заболевание легких у индивидуума, включающий введение индивидууму соединения или его соли по настоящему изобретению. Настоящее изобретение включает способ лечения ревматоидного артрита у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Ревматоидный артрит считается хроническим аутоиммунным и воспалительным заболеванием, характеризующимся воспалением суставов, которые со временем опухают, становятся болезненными, и имеет место деградация хряща, кости и связки сустава. Результатом ревматоидного артрита является деформация, нестабильность, негибкость сустава и рубцевание в пределах сустава. Суставы повреждаются с значительно различающейся скоростью. Многочисленные факторы, включая генетическую предрасположенность, могут оказывать влияние на конкретный пример протекания заболевания. Люди с ревматоидным артритом могут иметь мягкое течение болезни, со случайными обострениями с долгими периодами ремиссиями без заболевания или неуклонным прогрессированием заболевания, которое может быть медленным или быстрым. Ревматоидный артрит может начинаться внезапно, когда много суставов воспаляются одновременно. Более часто он начинается вяло, постепенно поражая различные суставы. Обычно воспаление является симметричным, повреждаются суставы с обеих сторон тела. Типично, небольшие суставы пальцев, пальцев на ногах, руки, ноги, запястья, локти и лодыжки воспаляются первыми, затем воспаляются колени и бедра. Боль, ассоциированная с ревматоидным артритом, типично представляет собой соматическую ноцицептивную суставную боль. Опухание запястьев может защемлять нерв и приводить к онемению или покалыванию благодаря синдрому канала запястья. После повреждения коленей могут развиваться кисты, они могут разрываться, вызывая боль и опухание в голени. Настоящее изобретение включает способ лечения дерматита у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения хронического обструктивного заболевания легких у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения астмы у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения болезни Альцгеймера у индивидуума, включающий введение индивидууму соединения или соли по настоящему изобретению. Настоящее изобретение включает способ смягчения побочных эффектов, ассоциированных с модуляцией глюкокортикоидного рецептора, включающий введение индивидууму соединения формулы (I). Настоящее изобретение включает способ смягчения побочных эффектов, ассоциированных с лечением преднизолоном, включающим введение индивидууму соединения формулы (I). Далее, настоящее изобретение включает способы лечения вышеупомянутых состояний, заболеваний и расстройств у индивидуума или предрасположенного к такому состоянию индивидуума путем введения индивидууму одного или нескольких соединений или солей по настоящему изобретению. В одном варианте осуществления вышеупомянутое лечение представляет собой предупреждающее лечение. В другом варианте осуществления вышеупомянутое лечение представляет собой паллиативное лечение. В следующем варианте осуществления вышеупомянутое лечение представляет собой восстанавливающее лечение. Е. Дозировка и введение. Для выбора наиболее приемлемой лекарственной формы и путей введения для лечения указанных заболеваний соединения или соли по изобретению могут быть исследованы на их биофармацевтические свойства, такие как растворимость и стабильность раствора (при разных значениях рН) и проницаемость. Дозы для соединений или солей по изобретению варьируют в диапазоне от 0,1 до 100 мг в случае перорального введения и дозы варьируют в диапазоне от 2 мг или менее в случае введения путем ингаляции. Доза может быть введена в виде одиночной или в виде разделенных доз и может находиться вне предела типичного диапазона, приведенного здесь. Дозировки отнесены к типовому индивидууму (человеку), имеющем массу от приблизительно 60 до 70 кг. Дозирование и режим дозирования зависят от индивидуума и разнообразных условий, которые могут влиять на дозирование (возраст, пол, масса тела и т.д.). Врач будет способен легко определить дозировку для индивидуумов, чья масса находится вне этого диапазона, таких как дети и пожилые люди.-6 016001 Пероральное введение. Соединения по изобретению и их соли могут быть введены перорально. Пероральное введение может включать глотание, так что соединение или соль попадают в желудочно-кишечный тракт, и/или буккальное, лингвальное или сублингвальное введения, посредством которых соединение или соль попадают в поток крови прямо изо рта. Препараты, пригодные для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или жесткие капсулы, содержащие мульти- или наночастицы, жидкости или порошки; ромбы (включая заполненные жидкостью); жевательные таблетки; гели; быстродиспергируемые дозированные формы; пленки; суппозитории; спреи и буккальные/мукоадгезивные пластыри. Далее, соединение или соли по изобретению могут быть введены в виде высушенной распылением дисперсии. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие рецептуры могут применяться как наполнители в мягких или жестких капсулах (приготовленных, например, из желатина или гидроксипропилметилцеллюлозы) и типично включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или приемлемое масло, и один или несколько эмульсифицирующих агентов и/или суспендирующих агентов. Жидкие рецептуры также могут быть приготовлены восстановлением влагосодержания путем добавления воды к твердому веществу, например, из пакета-саше. Соединения по изобретению и их соли также могут применяться в быстрорастворимых, быстро дезинтегрируемых дозированных формах, таких как те, что описаны в Expert Opinion in Therapeutic Patents,11 (6), 981-986, by Liang and Chen (2001). Для таблетированных дозированных форм в зависимости от дозы лекарственное средство может составлять от 1 до 80 мас.% дозированной формы, более типично от 5 до 60 мас.% дозированной формы. В добавление к лекарственному средству таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают крахмал-гликолят натрия, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармелозу натрия, кроссповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, пептизированный крахмал и альгинат натрия. В целом, разрыхлитель будет составлять от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% дозированной формы. Связующие обычно применяются для сообщения связующих качеств таблетированному препарату. Пригодные связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, пептизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводный и подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат диосновного фосфата кальция. Таблетки также могут необязательно включать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, усилители прохождения, такие как диоксид кремния и тальк. Если присутствуют, поверхностно-активные агенты могут составлять от 0,2 до 5 мас.% от таблетки, усилители прохождения могут составлять от 0,2 до 1 мас.% таблетки. Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазки обычно включают от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки. Другие возможные компоненты включают антиоксиданты, красители, ароматизирующие вещества,консерванты и вкусомаскирующие агенты. Типичные таблетки содержат до приблизительно 80% лекарственного средства, от приблизительно 10 до приблизительно 90 мас.% связующего, от приблизительно 0 до приблизительно 85 мас.% разбавителя, от приблизительно 2 до приблизительно 10 мас.% разрыхлителя и от приблизительно 0,25 до приблизительно 10 мас.% смазки. Твердые препараты для перорального введения могут быть рецептурированы для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и запрограммированное высвобождение. Пригодные препараты с модифицированным высвобождением для целей изобретения описаны в патенте США 6106864. Подробности других пригодных технологий высвобождения, таких как высокоэнергетические дисперсии, осмотические и покрытые частицы, могут быть найдены в PharmaceuticalTechnology On-line, 25(2), 1-14, Verma et al. (2001). Диапазоны дозы для перорального введения также находятся в пределах от 0,1 до 80 мг, от 15 до 80 мг, от 0,1 до 25 мг. Парентеральное введение. Соединения или соли по изобретению также могут вводиться прямо в поток крови, в мышцу или во внутренний орган. Пример 2 может быть введен в поток крови. Пригодные способы для парентерального-7 016001 введения включают внутривенный, внутриартериальный, внутрибрюшинный, интратекальный, внутрижелудочковый, внутриуретральный, интрастернальный, внутричерепной, внутримышечный, внутрисуставной и подкожный. Пригодные устройства для парентерального введения включают методики с применением иглы (включая микроиглу), впрыскивателей, безыгольных впрыскивателей и инфузии. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, углеводороды и буферирующие агенты (предпочтительно до значений рН 3-9), но для некоторых применений они могут быть более удобно рецептурированы в виде стерильного неводного раствора или в виде высушенной формы, применяемой в соединении с пригодным носителем, таким как стерильная, апирогенная вода. Получение парентеральных препаратов в стерильных условиях, например путем лиофилизации,может быть легко проведено с применением стандартных фармацевтических методик, хорошо известных специалистам в данной области. Растворимость соединений по настоящему изобретению и их солей, применяемых для приготовления парентеральных растворов, может быть повышена путем применения соответствующих методик рецептурирования, таких как включение усиливающих растворимость агентов. Препараты для парентерального введения могут быть рецептурированы для немедленного и/или модифицированного высвобождения. Препараты для модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, направленное и запрограммированное высвобождение. Таким образом, соединения по изобретению могут быть рецептурированы в виде суспензии или твердого вещества, полутвердого, или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают покрытые лекарственным средством стенты, полутвердые вещества и суспензии,включающие насыщенные лекарственным средством микросферы сополимера поли(dl-молочнойгликолевой)кислот (PGLA). Местное введение. Соединения или соли по изобретению также могут быть введены местно, (внутри)кожно или чрескожно на кожу или слизистую оболочку. Пример 1 может быть нанесен на кожу. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази,присыпки, перевязочные материалы, пены, пленки, кожные пластыри, пластины, имплантаты, губки,волокна, бинты и микроэмульсии. Также могут быть применены липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усиливающие проникновение агенты - см., например, J. Pharm.Sci., 88 (10), 955-958, by Finnin and Morgan (октябрь 1999). Другие методы местного введения включают доставку методом электропорации, ионтофореза, фонофореза, сонофореза и инъекций микроиглой или безыгольной иньекцией (например, Powderject, Bioject и т.д.). Препараты для местного введения могут быть рецептурированы для немедленного и/или модифицированного высвобождения. Рецептуры модифицированного высвобождения включают отсроченное,замедленное, импульсное, контролируемое, направленное и запрограммированное высвобождение. Ингаляционное/интраназальное введение. Соединения или соли по изобретению также могут быть введены интраназально или путем ингаляции, типично в форме сухого порошка (или отдельно, в виде смеси, например в виде сухой смеси с лактозой, или в виде частиц со смешанными компонентами, например смешанных с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка, в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, пульверизатора (предпочтительно пульверизатора, использующего электрогидродинамику для генерации тонкого тумана), или распылителя, с или без применения приемлемого пропелланта, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде назальных капель. Для интраназального применения порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин. Аэрозольная тара, насос, спрей, пульверизатор или распылитель содержат раствор или суспензию соединения(й) по изобретению, включающий, например, этанол, водный этанол или пригодный альтернативный агент для диспергирования, повышения растворимости или растягивания во времени высвобождения активного соединения, пропеллант(ы) в качестве растворителя и необязательное поверхностно-активное вещество, такое как триолеат сорбитана, олеиновую кислоту или олигомолочную кислоту. Перед применением в рецептуре сухого порошка или суспензии препарат лекарственного средства измельчали до размера, пригодного для доставки путем ингаляции (типично менее чем 5 мкм). Это может быть осуществлено любым соответствующим способом измельчения, таким как мельница со спиральной фрезой, мельница с измельчением в псевдоожиженном слое, переработка в условиях закритического потока для образования наночастиц, гомогенизация высокого давления или распылительной сушкой. Капсулы (произведенные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры-8 016001 и картриджи для применения в ингаляторе или аппарате для вдувания могут быть рецептурированы для обеспечения содержания порошкообразной смеси соединения по изобретению, пригодного основания порошка, такого как лактоза или крахмал, и модификатора характеристик, такого как L-лейцин, маннит,или стеарат магния. Лактоза может находиться в безводной форме или в форме моногидрата, предпочтительно последнее. Другие пригодные наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Препарат в виде раствора, пригодный для применения в пульверизаторе, использующем электрогидродинамику, может содержать соединение по настоящему изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть применены вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Препараты для ингаляционного/интраназального введения могут быть рецептурированы для немедленного и/или модифицированного высвобождения с применением, например, PGLA. Препараты модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, направленное и запрограммированное высвобождение. В случае ингаляторов сухого порошка и аэрозолей величина единичной дозы определяется посредством вентиля, который высвобождает отмеренное количество. Отдельные дозы по изобретению типично регулируются с тем, чтобы вводить отмеренную дозу или "выдох", который может быть введен как единичная доза или, более обычно, как разделенные дозы в течение дня. Дозы для ингаляционного введения находятся в диапазоне от 2 мг или менее или 1 мг или менее. Сочетание. Соединения или соли по изобретению могут быть введены в сочетании с одним или несколькими другими терапевтическими препаратами, такими как лекарственное средство. Соединение по настоящему изобретению или его соль могут быть введены одновременно или в различные моменты времени с одним или несколькими другими терапевтическими препаратами. Например, термин "в сочетании" включает одновременное введение комбинации соединения или соли по изобретению и терапевтического препарата индивидууму, причем когда такие компоненты рецептурированы совместно в отдельной дозированной форме, которая высвобождает упомянутые компоненты в, по существу, те же моменты времени в организме упомянутого индивидуума; по существу, одновременное введение комбинации соединения или соли по изобретению и терапевтического препарата индивидууму, имеющему необходимость такого лечения, когда такие компоненты рецептурированы отдельно друг от друга в отдельных дозированных формах, которые принимаются в, по существу, те же моменты времени упомянутым индивидуумом, и упомянутые компоненты высвобождаются в, по существу, те же моменты времени в организме упомянутого индивидуума; последовательное введение комбинации соединения или соли по изобретению и терапевтического препарата индивидууму, когда такие компоненты рецептурируются отдельно друг от друга в раздельных дозированных формах, которые принимаются в следующие друг за другом моменты времени упомянутым индивидуумом со значительным интервалом времени между каждым введением, где упомянутые компоненты высвобождаются в, по существу, различные моменты времени в организме упомянутого индивидуума; и последовательное введение такой комбинации соединения или соли по изобретению и терапевтического препарата индивидууму, когда такие компоненты рецептурируются совместно в отдельной дозированной форме, которая высвобождает упомянутые компоненты контролируемым способом, и они одновременно, последовательно и/или с перекрыванием по времени вводятся в те же и/или различные моменты времени упомянутому индивидууму, где каждая часть может быть введена или тем же, или различными путями. Например, соединения или соли по настоящему изобретению могут быть применены в сочетании,частично или полностью, в добавление к другим противовоспалительным средствам. Пригодные противовоспалительные средства включают циклоспорин, золедроновую кислоту, эфализумаб, алефацепт,этодолак, лорноксикам, ОМ-89, валдекоксиб, тоцилизумаб, абатацепт, мелоксикам, этанерцепт, намбуметон, римексолон, 153Sm-EDTMP, просорба, салицилат имидазола, опрелвекин, гиалуроновую кислоту,напроксен, пироксикам, диацереин, лумерикоксиб, такролимус, ацеклофенак, ацтарит, теноксикам, росиглитазон, дефлазакорт, адалимумаб, лефлуномид, риседронат натрия, мизопростол и диклофенак, SK1306X, инфликсимаб, анакинра, целекоксиб, диклофенак, эторикоксиб и фелбинак, реумакон, голимумаб, деносумаб, офатумумаб, антитела 10rT1, пелубипрофен, ликофелон, темсиролимус, эцулизумаб,игуратимод и преднизон. Другие пригодные противовоспалительные средства включают СР-481715,ABN-912, MLN-3897, HuMax-IL-15, RA-1, паклитаксель, Org-37663, Org 39141, AED-9056, AMG-108,фонтолизумаб, пегсунерцепт, пралнакасан, апилимод, GW-274150, АТ-001, 681323 (GSK) K-832, R-1503,окрелизумаб, DE-096, Cpn10, THC+CBD (GW Pharma), 856553 (GSK), ReN-1869, иммуноглобулин, mm093, амелубант, SCIO-469, ABT-874, LenkoVAX, LY-2127399, TRU-015, KC-706, дипиридамол, амоксапинет и дипиридамол, TAK-715, PG 760564, VX-702, преднизолон и дипиридамол, РМХ-53, белимумаб,принаберел, CF-101, tgAAV-TNFR:Fc, R-788, преднизолон и SSRI, дексаметазон, СР-690550 и PMI-001. Специалист в данной области техники также высоко оценит, что при применении соединений по изобретению или их солей при лечении специфического заболевания указанные соединения по изобретению могут быть объединены с различными существующими терапевтическими препаратами, приме-9 016001 няемыми при этом заболевании. Например, соединения или соли по изобретению могут быть объединены со средствами, которые модулируют одну или несколько из следующих мишеней: циклооксигеназа 2 (простагландиновая эндопероксидная синтаза 2); TNF-R (рецептор фактора некроза опухоли 1 типа); циклооксигеназа (СОХ-1 и 2; неспецифические); МАР-киназа р 38 (неспецифическая); Il1 рецептор (типа I и II, неспецифический); арахидонат-5-липоксигеназа; глюкокортикоидный рецептор (GR); NF-kB; фактор некроза опухоли (TNFальфа); CCR1-хемокиновый рецептор; рецептор лейкотриена В 4 (неспецифический); PDE4 (фосфодиэстераза 4; неспецифическая); IL6 рецептор; интегрин (неспецифический); ADAM-17 (энзим конвертирования TNF-альфа); ICE (каспаза 1/интерлейкин-1-бета-конвертаза); простагландинсинтезирующие энзимы (неспецифические); рецептор вещества Р (SPR/NK-1 рецептор); простагландиновый рецептор (неспецифический); белок адгезии сосудистых клеток 1 (VCAM 1); ММР-13 (коллагеназа 3); VEGF-рецептор(неспецифический); анафилатоксиновый хемотаксический рецептор С 5 А (C5AR); фактор подавления миграции макрофагов (MIF); фосфорилаза пуриновых нуклеозидов (PNP); бета-1-интерферон; ММР-3(стромелисин 1); CCR2-хемокиновый рецептор; ММР-2 (желатиназа А); рецептор фактора некроза опухоли 5 (CD40); антиген CD44 (функция хоминга и индийская система группы крови); CCR5 хемокиновый рецептор; простагландин-Е-синтаза; гамма рецептор активатора пролиферации пероксисомCXCR3-хемокиновый рецептор; PDGF-рецептор; FKBP (12 FK-506); Ig-надсемейство CTLA-4; белковая киназа С (PKC, неспецифическая); интегрин альфа-V/бета-5; катепсин K; 26S протеасома; минералокортикоидный рецептор (MR); бета-субъединица IkB-киназы (IKK BETA); рецептор тромбоцитактивирующего фактора (PAF-R); фарнезилпирофосфат FPP синтетаза; CXCR1-хемокиновый рецептор рецептор колониестимулирующего фактора макрофагов I (CSF-1R); IL18-рецептор 1; аденозиновый А 3 рецептор; рецептор колониестимулирующего фактора граннулоцитов-макрофагов (GMCSF); SYKтирозинкиназа; CRF-рецептор (неспецифический); альфа/бета-гетеродимер тубулина; тирозинкиназа (неспецифическая); амилоид бета; колониестимулирующий фактор макрофагов (MCSF); участник 11 надсемейства лигандов фактора некроза опухоли (активатор рецептора лиганда ядерного фактора каппа b); фосфолипаза (неспецифическая); эстрогеновый рецептор (альфа/бета; неспецифический); ММР-9 (желатиназа В); синтаза оксида азота (неспецифическая); индуцируемая синтаза оксида азота (неспецифическая); клеточный опухолевый антиген р 53; инсулиноподобный фактор роста 1 (соматомедин С); комплекс никотинового ацетилхолинового рецептора; опиоидный рецептор -типа (MOR-1); IL11;ERBB/EGF-рецепторная тирозинкиназа (неспецифическая); гистаминовый Н 2-рецептор; дипептидил пептидаза IV (DPP IV, CD26); топоизомераза II; CCR7-хемокиновый рецептор; бактериальная дигидрофолат редуктаза (неспецифическая); бета-тубулин; ДНК-полимераза (человека, в виде любой композиции субъединиц); CCR4-хемокиновый рецептор; CCR3-хемокиновый рецептор; K+ (калиевый) канал(неспецифический); митогенактивированная белковая киназа 14 (MAPK14/Р 38-альфа); кальциевые каналы L-типа (неспецифические); CCR6-хемокиновый рецептор; PDE3 (фосфодиэстераза 3; неспецифическая); цистеин-протеаза (неспецифическая); натрийзависимый норадреналиновый транспортер (NAT); МАР 2-киназа (MEK; неспецифическая); RAF-киназа (неспецифическая); индуцируемый гипоксией фактор 1 альфа; NMDA-рецептор; бета-эстрогеновый рецептор (ER-бета); человеческий ДНК; холецистокининовый рецептор типа В (CCKB); В 1-брадикининовый рецептор (BK1); Р 2 Х-пуриноцептор 7 (Р 2 Х 7); аденозиновый А 2 А рецептор; каннабиноидный рецептор 2 (СВ 2); сигма-опиоидный рецептор; каннабиноидный рецептор 1 (СВ 1); CXCR2-хемокиновый рецептор; фактор комплемента I (C3B/C4B инактиватор); протеинкиназа В (RAC-киназа) (неспецифическая); комплекс гамма-секретазы; CRTH2 (GPR44); р 53-ассоциированный ген (MDM2-убихитиновая белковая лигаза Е 3); VIP-рецептор (неспецифический);IL1-рецептор, типа I; IL6 (интерферон, бета 2); MMP (неспецифическая); инсулин; ММР-2/3/9; кальцитонин/кальцитонинзависимый полипептид, альфа; липоксигеназа (неспецифическая); фактор роста сосудистого эндотелия (VEGF); тромбин; рецептор андрогенного гормона; Мар-киназа (неспецифическая); связывающий половой гормон глобулин; хемокин CCL2 (MCP1/MCAF); фосфолипаза А 2; эритропоэтин(ЕРО); плазминоген; желудочный протонный насос (Н+ K+ АТР-фаза); каспаза (неспецифическая); FGFрецептор (неспецифический); альфа-рецептор активатора пролиферации пероксисом (PPAR-альфа);MIP1a-рецептор (неспецифический); кальцийсвязывающий белок S100 (неспецифический); PGEрецептор (неспецифический); пептидильная аргининовая дезиминаза, тип IV; комплекс PDGF (а/b); беталактамаза и РВР (биосинтез клеточной стенки); опиоидный рецептор (неспецифический); ангиотензинконвертирующий энзим 1 (АСЕ 1); урокиназного типа активатор плазминогена (UPA); фосфодиэстераза(неспецифическая, PDE); прогестероновый рецептор (PR); 5 НТ-(серотониновый) рецептор (неспецифический); надсемейство фактора некроза опухоли (лиганд), представитель 5 (CD40 лиганд); тимидилатсинтаза; комплекс интегрин альфа 4-паксиллин; интегрин альфа-4 (VLA-4/CD49D); ERK1; изомераза глюкозофосфата (аутокринный фактор подвижности); допаминовый рецептор (неспецифический); хемокин CXCL12 (SDF-1); белок микросомального переноса триглицеридов; интегрин альфа-5/бета-1; преобразователь сигнала и активатор транскрипции 3 (фактор отклика острой фазы); ингибитор-1 плазминогенного активатора (PAI-1); рецептор витамина D3 (VDR/рецептор 1,25-дигидроксивитамина D3); ароматазный комплекс (P450arom и NADPH-редуктаза цитохрома Р 450); белковая тирозинфосфатаза (неспе- 10016001 цифическая); 3-гидрокси-3-метилглутарил коэнзим A (HMG-CoA) редуктаза; интегрин бета-1 (бетасубъединица фибронектинового рецептора); интегрин бета-1/альфа-11; Р селектин(GMP140/гранулярный мембранный белок-140); белок, активирующий 5-липоксигеназу (FLAP); Н+/K+АТР-фаза (неспецифическая); Na+ (натриевый) канал (неспецифический); пероксидаза щитовидной железы; мозговой ионный воротный натриевый канал альфа-1; адренергический рецептор бета-2; BCL1(Cyclin D1); рецептор гормон щитовидной железы (неспецифический); рецептор сосудистого эндотелиального фактора роста 2 (VEGFR-2/FLK1); альфа-V/бета-6 интегрин; интегрин альфа-V (альфасубъединица витронектинового рецептора/CD51); SRC-киназа; плеиотрофин (гепаринсвязывающий фактор роста 8), промотирующий рост невритов фактор 1; остеопонтин (скрытый фосфобелок 1); tollподобный рецептор 4 (TLR4); ваниллоидный рецептор (неспецифический); Pi3-киназа (неспецифическая); поли(ADP-рибоза)полимераза (PARP); PPAR рецептор (неспецифический); бета-адренергический рецептор (неспецифический); рецепторный катионный канал переходного потенциала, подсемейство V,представитель 1 (TRPV1); топоизомераза I; гистаминовый H1 рецептор; кининоген; IKK-киназа (неспецифическая); ТАТ-белок ВИЧ; toll-подобный рецептор 2; растворенный носитель семейство 22 (транспортер органического катиона), представитель 4 (SLC22A4); RXR-рецептор (неспецифический); ренин(ангиотензиногеназа); рецептор гормона, высвобождающего гонадотропин (GNRH-R); пенициллинсвязывающие белки (пептидазы клеточной стенки); кальмодулин; митогенактивированная белковая киназа 1(MAPK1/ERK2); кальциевый канал (неспецифический); аггреканаза (неспецифическая); JNK-киназа (неспецифическая); транстиретин (TTR); CX3CR1-рецептор; фактор коагуляции III (тромбопластин, тканевый фактор); натрийзависимый серотониновый транспортер (5 НТТ); колониестимулирующий фактор 1(макрофагов); тканевая трансглутаминаза (трансглутаминаза 2/TGM2); специфический рецептор продвинутого конечного продукта гликозилирования; моноаминоксидаза (А и В; неспецифические); гистаминовый рецептор (неспецифический); натрийзависимый допаминовый транспортер (DAT); тромбопоэтин(вирусный онкогенный лиганд миелопролиферативной лейкемии, фактор роста и развития мегакариоцитов); молекулярный сигнал лимфоцитарной активации; нейтральная эндопептидаза (NEP/неприлисин); эндотелиновый-1 рецептор (ETA); тирозиназа; митогенактивированная белковая киназа 8(MAPK8/JNK1); IAP (ингибитор апоптоза) неспецифический; фосфоинозитид-3-киназа; рецептор простагландина F2-альфа (простагландиновый FP-рецептор); человеческий гормон роста; вазопрессиновый рецептор (неспецифический); рецептор фактора роста тучных клеток и стволовых клеток (C-KIT); CDK(неспецифическая); D4/5HT1a (допаминовый D4-рецептор, серотониновый рецептор 1 а); ангиопоэтиновый рецептор 1 (TIE-2) (TEK); эстрогеновый рецептор альфа (ER-альфа); рецептор фактора роста эпидермиса; киназа фокальной адгезии (неспецифическая); периферический бензодиазепиновый рецептор(альфа субъединица фибронектинового рецептора/VLA-5/CD49E); мускариновый ацетилхолиновый рецептор (неспецифический); тирозин-белковая киназа JAK3 (JANUS киназа 3); odc1-орнитин декарбоксилаза; 5 НТ 3-рецептор; адреномедуллин; гомолог фосфатидилинозитол 3-киназы (мутированный ген атаксия-телеангиэктазия/АТМ); эритропоэтиновый рецептор; фактор роста соединительной ткани; серин/треонин киназа RAC-альфа (белковая киназа В); Toll-подобный рецептор 9; нейронная синтаза оксида азота (NOS1); опиоидный рецептор каппа-типа (KOR-1); комплекс сердечного Na+ канала; ERBB-2 рецепторная белковая тирозинкиназа (поверхностно-клеточный рецептор HER2 тирозинкиназного типа); тромбиновый рецептор (PAR-1); PDE4B (сАМР-специфическая фосфодиэстераза 4B/HSPDE4B); бетаполипептидный тромбоцитарный фактор роста; ассоциированный с рапамицином белок FKBP (FRAP,mTOR); тромбомодулин; протеаза ВИЧ (ретропепсин); PDE4D (сАМР-специфическая фосфодиэстераза 4D/HSPDE4D); аденозинкиназа; гистонная деацетилаза (неспецифическая); Е 2-простагландиновый рецептор подтипа ЕР 4 (простагландиновый рецептор ЕР 4); митогенактивированная протеинкиназная киназа 3 (MAP2K3); ММР-12 (металлоэластаза); OX40-рецептор; неспецифическая убихитинлигаза человека; сульфонилмочевинный рецептор (SUR1 (панкреатический) и SUR2 (сердечная мышца/гладкие мышцы; фактор коагуляции X (фактор Стюарта); активированная МАР-киназой белковая киназа 2 (MAPKAPK-2); неизменяемый доменD2+5HT2A рецепторы; 5 гидрокситриптаминовый 4 рецептор (5 НТ 4); ангиотензиновый II рецептор 1 типа (AT1); цитохром Р 450 3 А 4; Т-клеточный циклофилин (циклофилин А); нейромединовый K-рецептор (NKR/NK-3 рецептор); лейкотриеновый В 4 рецептор; тирозинкиназа Брутона (Bruton, BTK); митогенактивированная протеинкиназная киназа 6 (MAP2K6); эндоглин; M1/D2/5HT2; натрийзависимый норадреналиновый транспортер+ допаминовый D4 рецептор; митогенактивированная протеинкиназная киназа 4 (MAP2K4); хитшоковый белок Hsp90 А/В; декарбоксилаза гистидина; растворимый носитель семейства 22 (транспортер органического катиона), представитель 5 (SLC22A5); CSK-тирозинкиназа; пролилэндопептидаза; цистеинильный лейкотриеновый рецептор (CYSLT1); ядерный рецептор NURR1 (белок ранней мобилизации отклика NOT); Toll-подобный рецептор 3; активированный протеиназой рецептор 2 (PAR-2); простациклиновый рецептор (простагландиновый IP-рецептор); ингибитор серин (или цистеин) протеиназы, представитель 1 монофилетического таксона F (альфа-2 антиплазмин, зависимый от пигмента эпителиальный фактор); гипофизарный активирующий аденилатциклазу полипептидный рецептор, тип i (PACAP-R-1);- 11016001 представитель 10 надсемейства фактора некроза опухоли (лиганд); C-MAF (короткая форма); ацетилхолинэстераза (ACHE); адренергический альфа-1 рецептор (неспецифический); Bz-связывающий GABA Арецептор; лизосфинголипидный рецептор EDG-1; соединение 1 клеточной аддрессиновой адгезии в слизистой оболочке (MAdCam); адренергический альфа-1L рецептор; рецептор фактора роста гепатоцитов(МЕТ протоонкогенная тирозинкиназа); мускариновый ацетилхолиновый рецептор М 3; MEK1; инсулиновый рецептор; GABA рецептор (А+В; неспецифический); фосфатидилинозитол 3-киназная каталитическая субъединица гамма (PI3-киназа гамма); костный морфогенетический белок 2 (ВМР 2); SKYтирозинкиназный белковый рецептор (TYRO3) (RSE); представитель 2 семейства дискоидинового доменного рецептора (DDR2); ионный воротный калиевый канал KV (неспецифический); сфингозиновая киназа (неспецифическая); рецептор высокого сродства фактора роста нерва (TRK-A); углеродные ангидразы (все); тромбопоэтиновый рецептор; сосудистый эндотелиальный фактор роста С; ангиотензиноген; ATP-связывающий кассета, подсемейство В (MDR/TAP), представитель 1 (АВСВ 1) (Р-гликопротеин мультилекарственной устойчивости (MDR1); митогенактивированная протеинкиназная киназа 7(MAP2K7); мускариновый ацетилхолиновый рецептор M1; обратная траскриптаза ВИЧ; PDE5A (cGMPсвязывающая, cGMP-специфическая фосфодиэстераза 5A/HSPDE5A); альфа-адренергический рецептор(неспецифический); связанный с липопротеином ингибитор коагуляции; карбоксипептидаза В 2 (TAFI); холинэстераза (неспецифическая); брадикининовый В 2 рецептор (BK2); альдозредуктаза; фактор коагуляции XI (предшественник плазматического тромбопластина); серин/треонин-протеинкиназа Р 78; метионин аминопептидаза 2; растворимая гуанилатциклаза (неспецифическая); рибосомальная протеинкиназа S6; метаботроповый глутаматный рецептор 1; нерецепторная тирозин-протеинкиназа TYK2; метаботропный глутаматный рецептор (неспецифический); рецептор сосудистого эндотелиального фактора роста 3 (VEGFR-3/FLT4); митогенактивированная протеинкиназа 13 (MAPK13/Р 38 дельта); белок активация фибробластов (сепраза); рецептор кортикотропина 1 (CRF1); митогенактивированная протеинкиназа 11 (MAPK11/Р 38 бета); комплемент компонента 5; цитокиновый FL-рецептор (FLT3); АМРА рецептор (глутаматные рецепторы 1-4); рецептор фактора роста нерва; ацил-СоА: холестерин ацилтрансфераза 1 (АСАТ 1); гомолог трансмембранного рецептора Smoothened (SMO); спаренный с G-белком рецепторBONZO (STRL33, CXCR6); IKCa-белки; TGF-бета рецептор типа II (TGFR-2); vif-белок ВИЧ; 5 гидрокситриптаминовый 2 В рецептор (5 НТ 2 В); связывающий жирные кислоты белок (неспецифический); Toll-подобный рецептор 7 (TLR7); грелин; CD36 антиген (коллагеновый рецептор типа I, тромбоспондиновый рецептор); митогенактивированная протеинкиназная киназа киназы 3(MAPK12/ERK6/P38 гамма); альфа-2 дельта кальциевый канал; комплекс тканевый фактор/фактор VIIa; анкилостомный нейтрофильный подавляющий фактор; IKr-калиевый канал; гистаминовый Н 4 рецептор(JAR3) (PFI-13); 5-гидрокситриптамин 2 А рецептор (5 НТ 2 А); холецистокининовый рецептор типа А(CCKA); 11-бета-гидроксистероид-дегидрогеназа 1; фактор, стимулирующий выделение гормона роста; никотиновый ацетилхолиновый рецепторный белок альфа-7; 5 НТ 2-рецептор (неспецифический); изоформа обмена натрий/водород 1 (NHE1); рецептор вещества K (SKR/NK-2 рецептор); 5 гидрокситриптаминовый 1D рецептор (5HT1D); 5 НТ 1 В/11-рецепторы; инвертаза изомальтазы; бета-3 адренергический рецептор; рецептор связанного с кальцитониновым геном пептида (GGRP) типа 1; циклинзависимая киназа 4 (CDK4); адренергический альфа-1 А рецептор; P2Y12 тромбоцитарный ADP рецептор; митогенактивированная протеинкиназная киназа киназы 5 (MAP3K5) (MEKK5); регулятор передачи сигнала G-белком 2; киназа, ассоциированная с интерлейкиновым 1 рецептором (IRAK); неорганическая пирофосфатаза (ф-фаза); ITK/TSK тирозинкиназа; RAR-гамма; тирозинпротеин AXL киназа(UFO, GAS6 рецептор); киназа, аналогичная активиновому рецептору 1 (ALK-1); ответственный за карликовость фактор транскрипции 2; АМР-дезаминаза (неспецифическая); CGR8-хемокиновый рецептор;CCR11-хемокиновый рецептор; ноцицептиновый рецептор; рецептор инсулиноподобного фактора ростаI; Р 2Y-рецептор (неспецифический); протеинкиназа С-тета типа (NPKC-тета); неспецифическая ДНКметилтрансфераза; киназа фосфорилазы (неспецифическая); С 3 А анафилатоксиновый хемотаксический рецептор (C3AR); сфингозиновая киназа 2 (SPHK2); неспецифическая казеиновая киназа II; фосфоглицератная киназа 1; UDP-Gal:beatGlcNAc-бета 1,4-галактозилтрансфераза 2 (B4GALT2); представитель 5 семейства 7 растворимого переносчика человека (транспортер катионных аминокислот, y+ система),(SLC7A5); ММР-17 (МТ-ММР 4); альфа-цепь казеиновой киназы II (CK II); специфический ингибитор роста 6 (GAS6); активируемая МАР-киназой протеинкиназа 3 (MAPKAPK-3); митоген и стрессактивируемая протеинкиназа-1 (MSK1); простагландин D2 синтаза (21 kD, мозговая); панкреатический K+канал (неспецифический); TGF-бета рецептор типа I (TGFR-1/киназа 5 типа активинового рецептора/ALK-5); циклинозависимая киназа 2 (CDK2); АСАТ (АСАТ ферменты 1 и 2; неспецифические); опиоидный рецептор дельта-типа (DOR-1); 5-гидрокситриптаминовый 6 рецептор (5 НТ 6); 5 гидрокситриптаминовый 1 А рецептор (5 НТ 1 А); 5 НТ 1-рецептор (неспецифический); рецептор гормона(простагландиновый DP-рецептор); компонент комплемента C1S; гистонная деацетилаза 5; предшественник гомолога dickkopf-1; Р 2 Х пуриновый рецептор 4 (Р 2 Х 4); лектинподобный окисленный LDLрецептор (LOX-1); эпоксидирующая гидролаза 2 (гидролаза транс-стиролоксида) (растворимая эпоксидгидролаза) (sEH); дигидродипиколинат синтаза (dhdps) (DapA); комплекс CaM-киназы II; альфа/бетаLXR (неспецифическая LXR); второй митохондриальный активатор каспазы; интегринсвязанная киназа(ILK); киназа фокальной адгезии 2 (FADK 2); аденозиновый А 2 В рецептор; аналогичная WEE1 протеинкиназа; киназа контрольной точки клеточного цикла (CHK2); бактериальный SecA белок; никотиновый ацетилхолиновый рецепторный белок бета-2; митогенактивированная протеинкиназная киназа киназы 1(MAP3K1/MEKK1); протеинкиназа С дзета-типа (NPKC-zeta); PDK1 (3-фосфоинозитидзависимая протеинкиназа-1); 5-гидрокситриптаминовый 5 А рецептор (5 НТ 5 А); стероид-5-альфа-редуктаза; митогенактивированная протеинкиназная киназа киназы 8 (MAP3K8/COT); протеинтирозинфосфатаза 1B; Р 2Yпуриновый рецептор 1 (P2Y1); альфа-1D адренергический рецептор; казеиновая киназа I эпсилон (CKIэпсилон); 5-гидрокситриптаминовый 7 рецептор (5 НТ 7); фактор коагуляции VII (эптаког альфа); киназа пируват-дегидрогеназы (PDHK; неспецифическая); PDE7A (сАМР-специфическая фосфодиэстераза 7A/HSPDE7A); рецептор глюкагоноподобного пептида 1 (GLP-1R); субъединица р 3 полимеразы РНК гриппа (pb2 эндонуклеаза); вирусная протеаза (неспецифическая); топоизомераза IV; рецептор гормона околощитовидной железы (РТН 2 рецептор); протеинкиназа типа С-бета-I (РКС-бета-1); допамин-бетагидроксилаза; галактозилтрансфераза, ассоциированная с протеинкиназой P58/gTA; пресинаптический белок SAP97; ингибитор 1 синовиального апоптоза, синовиолин (SYVN1) (HRD1) (HRD-1); эпоксидаза сквалена (ERG1); протеинкиназа типа С-эпсилон (NPKC-epsilon); кортикотропный рецептор 2 (CRF2); активируемый кальцием калиевый канал промежуточной проводимости (IK1); нуклеозиддифосфаткиназа A (NDKA) (NM23-H1); киназа 4, ассоциированная с рецептором интерлейкина-1 (IRAK-4); киназа-3 альфа гликогенсинтазы (GSK-3 альфа); представитель 2 (SLC22A2) семейства 22 растворимый переносчик (транспортер органического катиона); киназа 1 пируватдегидрогеназы (PDK1); киназа PAK-альфа(РССМТ); CKLF1 и NAALADаза II. Дополнительно соединения или соли по изобретению могут быть введены в сочетании с одним или несколькими средствами, такими как SSRI, ингибиторы матричной металлопротеиназы (ММР), ингибиторы аггреканазы, ингибиторы индуцируемого оксида азота (iNOS), ингибиторы экспрессии или активности инсулиноподобного фактора роста (IGF), ингибиторы экспрессии или активности фактора роста фибробластов (FGF), ингибиторы экспрессии или активности CD44, ингибиторы экспрессии или активности интерлейкина (IL), ингибиторы экспрессии или активности фактора некроза опухоли альфа (TNFальфа), ингибиторы экспрессии или активности индуцируемого фактором некроза опухоли белка 6 (TSG6), ингибиторы экспрессии или активности бикунина, ингибиторы бета-секретазы (ВАСЕ), ингибиторы РАСЕ-4, агенты, осуществляющие ингибирование экспрессии или активности ядерного рецептора revErbA-альфа (NR1D1), ингибирование экспрессии или активности эндотелиальной дифференциации сфинголипидного спаренного с G-белком рецептора 1 (EDG-1), ингибирование экспрессии или активности активированной протеиназой рецептора (PAR), ингибирование экспрессии или активности хрящевого ретиночувствительного белка (CD-RAP), ингибирование белковой киназы С дзета (PKCz), ингибирование экспрессии или активности ресистина, ингибирование дисинтегрина и металлопротеиназы 8(ADAM8), ингибирование экспрессии или активности 1s-субкомпонента компонента комплемента (C1s),ингибирование экспрессии или активности формилпептидного рецептора 1 (FPRL1). Дополнительные примеры средств, которые могут быть применены в сочетании с соединениями или солями по изобретению, включают ингибиторы MMP-2, -3, -9 или -13; ингибиторы аггреканазы-1 или -2; ингибиторы экспрессии или активности IGF-1 или -2; ингибиторы экспрессии или активностиFGF-2, -18 или -9 и ингибиторы экспрессии или активности IL-1, -4 или -6. Следующие примеры средств, которые могут быть применены в сочетании с соединениями или солями по изобретению, включают антитела к IGF-1 или -2; антагонисты FGF рецептора -2 или -3, антитела к CD 44, антитела к IL-1, -4 или -6, антитела к TNF-альфа; антитела к TSG-6; антитела к бикунину; антагонисты NR1D1; антагонисты EDG-1; антагонисты PAR, антитела к CD-RAP, антитела к ресистину, антитела к C1s и антитела к FPRL1. Дополнительные примеры соединений, которые могут быть введены с соединениями или солями по настоящему изобретению, включают селективные ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб, рофекоксиб, парекоксиб, валдекоксиб, деракоксиб, эторикоксиб и лумиракоксиб; опиоидные анальгетики, такие как морфин, гидроморфин, оксиморфин, фентанил, кодеин, дигидрокодеин, оксикодон, гидрокодон, бупренорфин, трамадол и налбуфин; нестероидные противовоспалительные средства- 13016001 Примеры соединений других типов и классов, которые могут быть применены в сочетании с соединениями или солями по настоящему изобретению, включают анальгетики, барбитуратные успокаивающие; бензодиазепины; H1-гистаминовые антагонисты, имеющие седативное действие; успокаивающие; мышечные релаксанты; антагонисты рецептора N-метил-D-аспаргиновой кислоты (NMDA); альфаадренергетики; трициклические антидепрессанты; антиконвульсанты, такие как карбамазепин; антагонисты тахикинина (NK), особенно антагонисты NK-3, NK-2 или NK-1; мускариновые антагонисты; нейролептики; агонисты или антагонисты ваниллоидного рецептора; бета-адренергические средства; кортикостероиды; агонисты или антагонисты серотонинового (5-НТ) рецептора, такие как антагонисты 5-HT1B/1D,5-HT2A и 5-НТ 3-рецептора; холинергические (никотиновые) анальгетики; каннабиноиды; антагонисты метаботропного глутаматного рецептора 1 подтипа (mGluR1); ингибиторы обратного захвата серотонина, такие как сертралин; ингибиторы обратного захвата норадреналина (норэпинефрина), такие как ребоксетин, в частности (S,S)-ребоксетин; серотониннорадреналиновые ингибиторы двойного действия,такие как дулоксетин; ингибиторы индуцибельной синтазы оксида азота (iNOS), такие как S-[2-[(1 иминоэтил)амино]этил]-L-гомоцистеин, S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1 иминоэтил)амино]этил]-2-метил-L-цистеин,(2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5 гептеновая кислота, 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлор-3-пиридинкарбонитрил; 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил,(2S,4R)-2 амино-4-2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол,2-(lR,3S)-3-амино-4-гидрокси-1-(5 тиазолил)бутил]тио]-6-(трифторметил)-3-пиридинкарбонитрил,2-(1R,3S)-3-амино-4-гидрокси-1-(5 тиазолил)бутил]тио]-5-хлорбензонитрил,N-[4-[2-(3-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин и гуанидиноэтилдисульфид; ингибиторы ацетилхолинэстеразы; антагонисты простагландинового Е 2 рецептора подтипа 4 (ЕР 4), такие как N-[(2[4-(2-этил-4,6-диметил-1 Н-имидазо[4,5-с]пиридин-1 ил)фенил]этиламино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1-([5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбониламино)этил]бензойная кислота; антагонисты лейкотриена В 4, такие как 1-(3 бифенил-4-илметил-4-гидроксихроман-7-ил)циклопентанкарбоновая кислота; ингибиторы 5-липоксигеназы; и блокаторы натриевого канала. Комбинации с соединениями или солями по настоящему изобретению также включают анальгетики, такие как ацетаминофен, напроксен натрий, ибупрофен, трамадол, тразодон; циклобензаприн; аспирин, целекоксиб, валдекоксиб, индометацин, и другие нестероидные противовоспалительные средства(NSAID); антидепрессанты, такие как трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина, например антидепрессанты, такие как амитриптилин, имипрамин, нортриптилин, доксепин, флуоксетин, сертралин и пароксетин; миорелаксанты, такие как циклобензаприн; снотворные средства, такие как золпидем. Комбинации с соединениями или солями по настоящему изобретению также включают анальгетики, такие как ацетаминофен, напроксен натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб,индометацин, и другие нестероидные противовоспалительные средства (NSAID); изменяющие состояние заболевания антиревматические лекарственные средства (DMARD), такие как сулфасалазин или метотрексат; кортикостероиды; и блокаторы фактора некроза опухоли (TNF), такие как этанерцепт и инфликсимаб. Комбинации с соединениями или солями по настоящему изобретению включают местные кортикостероиды; аналоги витамина D, такие как кальципотриен; антралин; местные ретиноиды (то есть производные витамина А), такие как ацитретин и тазаротен; пропионат клобетазола; метотрексат; азатиоприн; циклоспорин; гидроксимочевина; и иммунномодулирующие лекарственные средства, такие как алефацепт, эфализумаб и этанерцепт. Лечение фототерапией, включая терапию ультрафиолетом А в присутствии псоралена (псораленовый UVA- или PUVA-метод), терапию ближним ультрафиолетом В (UVB), и сочетание световых терапий могут быть применены для соединений или солей по настоящему изобретению и вышеупомянутых сочетаний. Комбинации с соединениями или солями по настоящему изобретению включают нестероидные противовоспалительные средства (NSAID), такие как ацетаминофен, напроксен натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб и индометацин; и кортикостероиды, такие как преднизон. Комбинации с соединениями или солями по настоящему изобретению включают сочетания с анальгетиками, такими как ацетаминофен, напроксен натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб, индометацин, и другие нестероидные противовоспалительные средства (NSAID); противовоспалительные лекарственные средства; сулфасалазин, месаламин, балсалазид и олсалазин; кортикостероиды; преднизон; будезонид; иммуносупрессанты, такие как азатиоприн, меркаптопурин, блокаторыTNF, такие как инфликсимаб и адалимумаб, метотрексат и циклоспорин; антибиотики, такие как метронидазол и ципрофлоксацин; противодиарейные препараты, такие как лоперамид; слабительные; антихолинергические лекарственные средства, антидепрессанты, такие как трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина, например антидепрессанты, такие как амитриптилин, имипрамин, нортриптилин, доксепин, флуоксетин, сертралин и пароксетин; алосетрон и тегасерод. Соединения или соли по настоящему изобретению также могут вводиться с продолжительно дейст- 14016001 вующим бета-агонистом. Пригодные примеры других терапевтических препаратов, которые могут быть применены в сочетании с соединениями или солями по изобретению, включают ингибиторы 5-липоксигеназы (5-LO) или антагонисты активирующего 5-липоксигеназу белка (FLAP), антагонисты лейкотриена (LTRA), включая антагонисты LTB4, LTC4, LTD4 и LTE4, антагонисты гистаминового рецептора, включая H1- и Н 3 антагонисты, 1- и 2-адреноцепторные агонисты, сосудосуживающие симпатомиметические средства для противоотечного применения, антагонисты мускаринового M3-рецептора или антихолинергические агенты, PDE ингибиторы, например ингибиторы PDE3, PDE4 и PDE5, теофиллин, кромогликат натрия,ингибиторы СОХ, как неселективные, так и селективные ингибиторы СОХ-1 или СОХ-2 (NSAID), пероральные и ингалируемые глюкокортикостероиды, моноклональные антитела, активные к эндогенным воспалительным объектам, 2-агонисты, включая продолжительно действующие 2-агонисты, ингибиторы молекулярной адгезии, включая антагонисты VLA-4, антагонисты кининовых B1- и В 2-рецепторов,иммуноподавляющие средства, ингибиторы матричной металлопротеазы (ММР), антагонисты тахикининовых NK1, NK2 и NK3-рецепторов, ингибиторы эластазы, агонисты аденозинового А 2 а рецептора, ингибиторы урокиназы, соединения, которые действуют на допаминовые рецепторы, например D2-агонисты,модуляторы NFB пути, например IKK-ингибиторы, модуляторы цитокиновых путей передачи сигнала,такие как syk-киназа, или ингибиторы JAK-киназы, агенты, которые могут быть классифицированы как муколитики или противокашлевые средства и антибиотики. Согласно настоящему изобретению соединения или соли по изобретению могут быть объединены с Н 3-антагонистами, антагонистами мускаринового М 3-рецептора, ингибиторами PDE4, глюкокортикостероидами, агонистами аденозинового А 2 а рецептора, 2-агонистами, модуляторами цитокиновых путей передачи сигнала, такими как syk-киназа, или антагонистами лейкотриена (LTRA), включая антагонистыLTB4, LTC4, LTD4 и LTE4. Согласно настоящему изобретению соединения или соли по изобретению также могут быть объединены с глюкокортикостероидами, такими как ингалируемые глюкокортикостероиды с уменьшенными системными побочными эффектами, включая преднизон, преднизолон, флунизолид, ацетонид триамцинолона, дипропионат беклометазона, будезонид, пропионат флутиказона, циклезонид, фуроат мометазона и моногидрат фуроата мометазона; антагонистами мускаринового М 3-рецептора или антихолинергическими агентами, включая, в частности, соли ипратропиума, такие как бромид ипратропиума, соли тиотропиума, такие как бромид тиотропиума, соли окситропиума, такие как бромид окситропиума, перензепин, телензепин, или 2 агонисты, такие как продолжительно действующие 2 агонисты, включая салметерол, формотерол, QAB-149 и CHF-4226.F. Применение для приготовления композиции или лекарственного средства. В одном варианте осуществления настоящее изобретение включает способы приготовления композиции или лекарственного средства, содержащие соединения или соли по настоящему изобретению для применения при лечении состояния, опосредованного активностью глюкокортикоидного рецептора. В другом варианте осуществления изобретение включает применение одного или нескольких соединений или солей по настоящему изобретению при приготовлении композиции или лекарственного средства для лечения воспаления, состояния, обусловленного воспалением, ревматоидного артрита, дерматита, болезни Альцгеймера. Настоящее изобретение также включает применение одного или нескольких соединений или солей по настоящему изобретению для приготовления композиции или лекарственного средства для лечения одного или нескольких состояний, подробно описанных в разделе "Способы".G. Схемы. Соединения по настоящему изобретению могут быть получены с применением способов, иллюстрированных на общих синтетических схемах и в экспериментальных методиках, подробно описанных ниже. Реакции по описанным здесь синтетическим способам проводили в приемлемых растворителях,которые могут быть легко выбраны специалистом в технике органического синтеза; упомянутые приемлемые растворители обычно представляют собой любой растворитель, который является, по существу,нереакционноспособным в отношении исходных веществ (реактантов), промежуточных соединений или продуктов при температурах, при которых проводятся реакции. Данная реакция может быть проведена в индивидуальном растворителе или в смеси, содержащей более чем один растворитель. В зависимости от конкретной стадии реакции могут выбираться приемлемые растворители для конкретной стадии реакции. Получение соединений по изобретению может включать защиту и снятие защиты с различных химических групп. Необходимость защиты и снятия защиты и выбор соответствующих защитных групп могут быть легко определены специалистом в области техники. Химия защитных групп может быть найдена, например, в T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd. Ed., WileySons, Inc., New York (1999), которая включена в данное описание в качестве справочного материала. Реакции могут контролироваться любым приемлемым способом, известным в области техники. Например, образование продукта может контролироваться методами спектроскопии, такой как спектроско- 15016001 пия ядерного магнитного резонанса (например, 1H или 13 С), инфракрасной спектроскопией, спектрофотометрией (например, в видимой и ультрафиолетовой областях света), или масс-спектрометрией, или хроматографией, такой как жидкостная хроматография высокого разрешения (HPLC) или тонкослойная хроматография. Исходные вещества, применяемые здесь, являются или коммерчески доступными, или могут быть получены стандартными способами синтеза. Общие синтетические схемы представлены с целью иллюстрации и не предназначены ограничивать объем изобретения. Схема А 1(R)-Бензил-5-бром-9(S)-гидро-10(R)-гидрокси-10(R)-метилтрицикло[7.3.1.02,7]тридека-2,4,6-триен 13-он формулы А-8 получали с применением методики, описанной на схеме А, которая в целом впервые описана в WO 00/66522. Ph обозначает фенил. Bn обозначает бензил. Соединение А-1 коммерчески доступно (например, VOUS и Riverside; CAS No. 4133-35-1). Соединение А-2 может быть получено, как описано в Org. Syn., 1971, 51, 109-112. Схема В(4S,7R,8R)-4-Бензил-7-гидрокси-N-(2-метилпиридин-3-ил)-7-(трифторметил)-4b,5,6,7,8,8,9,10 октагидрофенантрен-2-карбоксамид получали, как описано на схеме В.(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбомоил)-2-(трифторметил)-1,2,3,4,4,9,10,10 октагидрофенантрен-2-ил дигидрофосфат С-3 получали, как описано на схеме С. Bn обозначает бензил. Схема D(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбомоил)-2-(трифторметил)-1,2,3,4,4,9,10,10 октагидрофенантрен-2-ил дигидрофосфат С-3 получали, как описано на схеме D. Bn обозначает бензил. Ph обозначает фенил. Схема Е(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбомоил)-2-(трифторметил)-1,2,3,4,4,9,10,10 октагидрофенантрен-2-ил дигидрофосфат С-3 получали, как описано на схеме Е. Bn обозначает бензил. Ph обозначает фенил. Н. Примеры получения и примеры. Исходное вещество А-8 представляет собой 1(R)-бензил-5-бром-9(S)-гидро-10(R)-гидрокси-10(R)метилтрицикло[7.3.1.02,7]тридека-2,4,6-триен-13-он, который представлен следующей формулой: Исходное вещество А-8 (450 г; 1,17 моль) растворяли в этаноле (4,5 л) при температуре окружающей среды. Добавляли 21% раствор этоксид натрия в этаноле (44 мл; 0,12 моль) и смесь нагревали до кипения с обратным холодильником в течение 3 ч. Когда исходное вещество А-8 полностью прореагировало, реакционную смесь охлаждали до -25 С. К смеси медленно добавляли ацетилхлорид (250 мл; 3,51 моль) при удержании температуры около -25 С. После завершения прибавления смесь отогревали до 0 С и удерживали до полного исчерпания промежуточного енона. В этот момент смесь превращалась в суспензию. К смеси добавляли 21% раствор этоксид натрия в этаноле (1,31 л; 3,51 моль) при удержании температуры в интервале от -5 до 5 С. Если смесь не имела основной реакции, добавляли дополнительное количество этоксида натрия. Температура смеси увеличивалась до 25 С и затем смесь разбавляли водой (5,9 л). Смесь фильтровали и твердое вещество промывали водой (3 раза). Соединение, обозначенное в заголовке примера (440 г; по хроматограмме 85% чистоты), получали в виде бежевого твердого вещества. 1 Н ЯМР (ДМСО)м.д.: 1,27 (т, 3 Н), 1,65 (дт, 1 Н), 2,06 (д, 1 Н), 2,21 (дд, 1 Н), 2,49 (м, 1 Н), 2,65(S)-4-Бензил-7-бром-2-этокси-3,4,4,9-тетрагидрофенантрен (1270 г; 3,2 моль; с чистотой по хромтограмме 85%, который может быть получен, как описано в примере получения 1), растворяли в толуоле(6,45 л). Добавляли этиленгликоль (898 мл; 16,1 моль) и паратолуолсульфокислоту (6,1 г; 0,03 моль), затем реакционную смесь кипятили с обратным холодильником. Растворитель (1 л) отгоняли из смеси и добавляли чистый толуол (1 л). Этот способ перегонки и добавления повторяли еще дважды. Добавляли дополнительное количество паратолуолсульфокислоты (6,1 г) каждый раз при добавлении чистого толуола. Во время реакции образовывались два промежуточных соединения (обнаруживаемых по LC), которые конвертировались в продукт. Конец реакции представляет собой точку равновесия между двумя промежуточными соединениями и продуктом. При достижении конечной точки смесь охлаждали до температуры окружающей среды. Смесь промывали 0,5 М NaOH (2 л). Фазы быстро разделяли, обе были темными, с небольшим слоем с хлопьевидным осадком. Смесь промывали водой (2 л). Фазы разделяли очень медленно. Смесь сушили азеотропной отгонкой. К смеси добавляли метанол (4 л) и растворитель(4 л) отгоняли из смеси. Добавление метанола и отгонку растворителя повторяли еще дважды. К смеси добавляли метанол и выпадение в осадок начиналось несколькими минутами позже. К смеси добавляли дополнительное количество метанола (4 л) и затем нагревали до кипения с обратным холодильником. Через 30 мин смесь охлаждали до 0 С. Смесь фильтровали и твердое вещество промывали охлажденным метанолом (22 л). Твердое вещество сушили в вакуумной печи при 65 С. Соединение, обозначенное в заголовке примера (882 г; по хроматограмме 98% чистоты), получали в виде бежевого твердого вещества. 1 Н ЯМР (ДМСО)м.д.: 1,71 (м, 2 Н), 2,06 (м, 2 Н), 2,31 (дд, 1 Н), 2,39 (м, 1 Н), 2,68 (д, 1 Н), 2,77 (м, 1 Н),2,86 (дд, 1 Н), 3,36 (д, 1 Н), 3,86 (м, 4 Н), 5,45 (м, 1 Н), 6,50 (м, 2 Н), 7,00 (м, 4 Н), 7,37 (дд, 1 Н), 7,44 (д, 1 Н). Пример получения 3.(S)-4-Бензил-7-бром-2,2-(1,2-этилендиокси)-1,2,3,4,4,9-гексагидрофенантрен (719 г; 1,75 моль,который может быть получен, как описано в примере получения 2) растворяли в тетрагидрофуране (7,19 л) и охлаждали до -70 С. 1,6 M н-бутиллития в гексане (2270 мл; 2,27 моль) добавляли с такой скоростью, чтобы температура удерживалась ниже -60 С. Смесь выдерживали еще 15 мин после добавления. Добавляли диоксид углерода (108 г; 2,45 моль) при удержании температуры ниже -60 С. Смесь выдерживали еще 15 мин после добавления. Смесь отогревали до температуры окружающей среды. Растворитель (7 л) отгоняли из смеси при атмосферном давлении. К смеси добавляли DMF (7 л). Смесь охлаждали до температуры окружающей среды. Добавляли метилиодид (152 мл; 2,45 моль) и смесь выдерживали до завершения реакции (1 ч). Смесь нагревали до 70 С и растворитель перегоняли путем постепенного уменьшения давления до 70 мм Hg. Когда отгонка завершалась, смесь охлаждали до комнатной температуры. К смеси медленно добавляли воду (6,5 л) для осаждения продукта. Смесь фильтровали и твердое вещество промывали водой (3 раза). Твердое вещество сушили на фильтре. Неочищенный продукт (736 г; по хроматограмме 74% чистоты) получали в виде бежевого твердого вещества. Продукт очищали методом хроматографии. 463 г продукта было получено из хроматографической очистки. Это вещество отделяли из н-гептана (6130 мл). Было выделено 394 г соединения, обозначенного в заголовке примера. Еще 70 г соединения, обозначенного в заголовке примера, выделяли из маточника хроматографией. 1 Н ЯМР (ДМСО)м.д.: 1,74 (м, 2 Н), 2,10 (м, 2 Н), 2,33 (дд, 1 Н), 2,45 (м, 1 Н), 2,72 (д, 1 Н), 2,79 (м, 1 Н), 2,94(S)-Метил 4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,10-гексагидрофенантрен-2-карбоксилат (201 г; 0,515 моль, который может быть получен, как описано в примере получения 3) и 50 мл этиленгликоля растворяли в толуоле (2,0 л) в автоклаве. К этой смеси добавляли 10 г 5% Pd/C (сухой катализатор). Затем автоклав закрывали и продували азотом (три раза), затем продували водородом (три раза). Реакция проводилась в течение 18 ч при давлении 80 psig и температуре 50 С. Анализ на завершение и селективность проводили методом HPLC (типичные селективности составляли от 95 до 5, транс к цис). Суспензию фильтровали через Celite для удаления катализатора и толуольный раствор концентрировали при 50 С, в вакууме, до приблизительно 200 мл. При 50 С добавляли 1 л 1-бутанола и раствор нагревали до 60 С, до полной прозрачности. При охлаждении полученное твердое соединение, обозначенное в заголовке примера, выделяли фильтрованием в вакууме (196 г; 97%; транс:цис 95,75:4,24). 1H ЯМР (300 МГц,CDCl3)м.д.: 7,79 (ушир. с, 1H, Ar-Н), 7,47 (д, J=9 Гц, 1H, Ar-Н), 7,13-7,05 (3 Н, Ar-Н), 6,56-6,53 (2 Н, ArН), 6,43 (д, J=9 Гц, 1 Н, Ar-Н), 4,04-3,93 (4 Н, 2-СН 2), 3,89 (с, 3 Н, СН 3), 3,08-3,03 (3 Н, СН 2, СН-Н), 2,63 (д,J=15 Гц, СН-Н), 2,22-1,72 (8 Н, 4-СН 2), 1,57 (1 Н, СН-Н); 13 С ЯМР (CDCl3, ): 167,7, 149,2, 137,7, 136,4,131,1, 130,5, 127,8, 127,7, 127,4, 126,3, 125,5, 108,9, 64,6, 64,5, 52,1, 40,5, 39,8, 38,3, 35,8, 31,6, 30,3, 27,9,24,6. Пример получения 5.(4S,8R)-Метил 4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (150 г, 382 ммоль, который может быть получен, как описано в примере получения 4) растворяли в дихлорметане (630 мл). При перемешивании добавляли воду (270 мл), затем добавляли трифторуксусную кислоту (73 мл, 1150 ммоль) через капельную воронку за 30 мин, удерживая внутреннюю температуру ниже 30 С. После завершения добавления реакцию нагревали до 40 С в течение 2 ч. В процессе реакции контроль показывает неполноту завершения реакции с содержанием приблизительно 9% (процент по хроматографическому пику) исходного вещества. Слои разделяли и добавляли чистую воду (270 мл) и трифторуксусную кислоту (31 мл). Реакционную смесь нагревали при 40 С в течение 1 ч. Это процесс продолжали до полного исчерпания исходного вещества. Органическую фазу промывали 5% водным бикарбонатом натрия (300 мл), водой (300 мл), высушивали над MgSO4 и упаривали досуха, что дает 126,4 г соединения, обозначенного в заголовке примера (что составляет выход 95%). 1 Н ЯМР (ДМСО)м.д.: 7,70 (с, 1 Н), 7,37 (д, J=8,4 Гц, 1 Н), 7,11 (м, 3 Н), 6,6 (д, J=5,70 Гц, 2 Н), 6,45 (д, J=8,4 Гц, 1 Н), 3,80 (с,3 Н), 3,80 (м, 2 Н), 3,04-1,48 (м, 11 Н). Пример получения 6.(4S,8R)-Метил 4-бензил-7-оксо-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (118 г,0,339 моль, который может быть получен, как описано в примере получения 5) растворяли в дихлорметане и охлаждали до -50 С. Раствор становился мутным. Добавляли 1,0 M раствор фторида тетрабутиламмония в THF (3,4 мл, 0,003 моль) без ощутимого изменения температуры. Добавляли трифтортриметилсилан (79 мл, 0,51 моль) за 20 мин с изменением цвета на цвет от ярко-оранжевого до слегка красного. Реакционную смесь выдерживали при -50 С в течение приблизительно 2 ч и затем позволяли отогреваться до 0 С. Очень медленно добавляли фторид тетрабутиламмония (340 мл, 0,34 моль) при 0 С к реакционной смеси в течение 45 мин. Наблюдалась экзотермия с выделением газа. Реакционную смесь перемешивали 10 мин и HPLC-анализ показал полное десилилирование. К реакционной смеси добавляли воду (1 л) с интенсивным перемешиванием и позволяли отогреться до комнатной температуры. Органический слой промывали водой (1 л). Затем органический слой концентрировали и хроматографировали для получения 72 г (51%) соединения, обозначенного в заголовке примера, и дополнительно 32 г продукта с примесью. 1H ЯМР (ДМСО)м. д.: 7,70 (с, 1 Н), 7,37 (д, J=8,1 Гц, 1 Н), 7,09 (м, 3 Н), 6,5 (дд, J=1,2, 6,6 Гц, 2 Н), 6,38 (д, J=8,4 Гц, 1 Н), 3,80 (с, 3 Н), 3,80 (м, 2 Н), 3,09-1,21 (м, 13 Н). Пример получения 7.(4S,7R,8R)-Метил 4-бензил-7-гидрокси-7-(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (5,0 г; 11,9 ммоль, который может быть получен, как описано в примере получения 6) и 5-метилтетразол (3,6 г; 43,0 ммоль) смешивали одновременно в дихлорметане (50 мл) при температуре окружающей среды. Добавляли дибензилфосфорамидит (8,3 мл; 25,1 ммоль) и смесь перемешивали до- 20016001 завершения реакции (1 ч). Смесь охлаждали до 0 С и добавляли 30% перекись водорода (10 мл). Реакционную смесь перемешивали до завершения окисления (30 мин). Водную фазу отделяли от органической фазы. Органическую фазу промывали 10% метабисульфитом натрия (50 мл). Органическую фазу сушили безводным сульфатом магния и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле смесью 15% этилацетат в гексане. Очищенное соединение, обозначенное в заголовке примера(4S,7R,8R)-Метил 4-бензил-7-(бис-(бензилокси)фосфорилокси)-7-(трифторметил)-4,5,6,7,8,8,9,10 октагидрофенантрен-2-карбоксилат (7,9 г; 11,6 ммоль, который может быть получен, как в примере получения 7) и 3-амино-2-пиколин (1,3 г; 12,2 ммоль) смешивали в тетрагидрофуране (80 мл) и охлаждали до 0 С. 1 М раствор бис-(триметилсилил)амида лития в тетрагидрофуране (24 мл; 24,4 ммоль) добавляли при удержании температуры ниже 10 С. Смесь перемешивали в течение 30 мин. К реакционной смеси добавляли воду (50 мл). Смесь экстрагировали этилацетатом. Органический экстракт промывали водой. Органическую фазу сушили безводным сульфатом магния и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле со смесью 70% этилацетата в гексанах. Очищенное соединение,обозначенное в заголовке примера (6,79 г; выход 68%), получали в виде желтой смолы, которая содержала 6% этилацетата по массе. 1 Н ЯМР (ДМСО):1,33 (т, 1 Н), 1,66-1,93 (м, 3 Н), 2,08-2,34 (м, 3 Н), 2,41 (с,3 Н), 2,68 (д, 1 Н), 2,76-3,19 (м, 4 Н), 5,14 (м, 4 Н), 6,47 (д, 1 Н), 6,56 (м, 2 Н), 7,07-7,19 (м, 3 Н), 7,20-7,53 (м,12 Н), 7,71 (д, 1 Н), 7,76 (с, 1 Н), 8,32 (д, 1 Н), 9,93 (с, 1 Н). Пример 1.(4S,7R,8R)-Метил 4 -бензил-7-гидрокси-7-(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (10 г; 23,9 ммоль, который может быть получен, как описано в примере получения 6),и 3-амино-2-пиколин (2,71 г; 25,1 ммоль) растворяли в толуоле (200 мл). Добавляли 1 M бис(триметилсилил)амид лития в тетрагидрофуране (74,1 мл; 74,1 ммоль) с такой скоростью, чтобы температура удерживалась ниже 35 С. Во время добавления имела место небольшая экзотермия и выпадение в осадок твердого вещества. Смесь выдерживалась еще 30 мин после добавления. К смеси добавляли воду(250 мл). Имела место небольшая экзотермия и твердое вещество растворялось. К смеси добавляли этилацетат (50 мл), чтобы гарантировать, что продукт не будет выпадать в осадок. Перемешивание останавливали с тем, чтобы позволить фазам разделиться. Водную фазу удаляли. Органическую фазу промывали водой (250 мл). Растворитель (230 мл) отгоняли при атмосферном давлении из органической фазы. Смесь охлаждали до температуры окружающей среды. Смесь фильтровали и твердое вещество промывали толуолом (2 раза), затем гептаном (2 раза). Твердое вещество сушили в вакуумной печи при 70 С. Соединение, обозначенное в заголовке настоящего примера (10 г), получали в виде бежевого твердого вещества. 1 Н ЯМР (ДМСО)м.д.: 1,32 (м, 1 Н), 1,82 (м, 4 Н), 2,10 (м, 4 Н), 2,41 (с, 3 Н), 2,68 (д, 1 Н), 3,08 (м, 3 Н),6,00 (с, 1 Н), 6,43 (д, 1 Н), 6,59 (м, 2 Н), 7,12 (м, 3 Н), 7,25 (дд, 1 Н), 7,44 (дд, 1 Н), 7,71 (дд, 1 Н), 7,75 (д, 1 Н),8,31 (дд, 1 Н), 9,91 (с, 1 Н). Пример 2.(2R,4S,10R)-4-бензил-7-2-метилпиридин-3-ил)карбомоил)-2-(трифторметил)1,2,3,4,4,9,10,10-октагидрофенантрен-2-ил фосфат (6 г; 7,9 ммоль, который может быть получен, как описано в примере получения 8) растворяли в метаноле (120 мл). К смеси добавляли 5% палладий-наугле (63% воды) (1,3 г; 0,4 ммоль). Смесь обрабатывали водородом (50 psi) при комнатной температуре. Реакция самопроизвольно останавливалась при содержании 12% монобензильного промежуточного соединения. Смесь фильтровали через слой Celite. В раствор добавляли чистый катализатор (1,3 г) и повторно помещали в условия гидрирования. Когда реакция завершалась, смесь фильтровали через слойCelite. Раствор концентрировали до приблизительно 60 мл отгонкой без использования роторного испарителя. Во время отгонки в осадок выпадало белое твердое вещество. Смесь охлаждали до температуры окружающей среды. Смесь фильтровали и твердое вещество промывали метанолом. Твердое вещество сушили в вакуумной печи при 70 С. Соединение данного примера (3,36 г; выход 75%) получали в виде белого твердого вещества, которое имело чистоту по жидкостной хроматографии (LC) 98%. 1 Н ЯМРI. Биологические данные. В последующем описании соединения сравнения представляют собой трициклические соединения(см., например, WO 2000/66522). Пример и соединения сравнения получали от Pfizer. В качестве клинически важного соединения сравнения применяли преднизолон (Р-6004; Sigma-Aldrich, St. Louis). Соединение сравнения А представляет собой (4S,7S,8R)-4-бензил-7-гидрокси-N-2 метилпиридин-3-ил)метил)-7-(3,3,3-трифторпропил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид, который имеет следующую структуру:- 23016001 Превращение примера 2 в пример 1. Монослой клеток Сасо-2 представляет собой модель тканевой культуры эпителия кишечника in vitro. Эти клетки происходят из колоний клеток человека, претерпевают поляризацию и становятся полностью дифференцированными энтероцитами за 2-3 недели. После дифференциации эти клетки имеют плотные соединения и осуществляют различные биохимические процессы, такие как активное выделение транспортеров, включая Р-гликопротеин (Р-gp). В этой модели возможно измерить кажущуюся проницаемость (Рарр) соединения через поляризованный монослой клеток Сасо-2. Исследование АB проводили с монослоями клеток Сасо-2 для определения перемещения соединения Рарр из полости А в полость В. Это значение Рарр является репрезентативным для переноса соединения из люминальной (кишечной) в серозную (кровь) полость через эпителий кишечника, который может наблюдаться во время абсорбции в кишечнике. Пример 2 не преодолевает в значительной степени монослой клеток Сасо-2 (АВ, Papp=1,15 е-6 см/с), применение примера 2 до апикального отделения приводит к значительному повышению примера 1 как в апикальном, так и базолатеральном сегментах. Данные указывают на то, что механизм включает дефосфорилирование соединения примера 2 до соединения примера 1 действием мембраносвязанных щелочных фосфатаз, локализованных в кишечном эпителии, с последующей абсорбцией примера 1 через монослой клеток Сасо-2 (АВ, Papp=37,5 е-6 см/с). Пероральное введение примера 2 (30 и 200 мг/кг) крысам с введенным в воротную вену катетером приводило к регистрации в образцах плазмы воротной вены, в течение четырехчасового периода времени, примера 1, но не примера 2. Эти результаты указывают на наличие кишечного гидролиза примера 2 до примера 1 при первом прохождении и селективную кишечную абсорбцию примера 1. Пример 2 демонстрирует повышенную растворимость и значительно меньший нерастворимый остаток, что приводит к улучшенной пероральной абсорбции у крыс путем увеличения биодоступной дозы(1,61 мкгч/мл [по сравнению с 0,46 мкгч/мл для примера 1]) и Cmax (0,59 мкг/мл [по сравнению с 0,13 мкг/мл для примера 1]), а также уменьшенному времени Cmax (0,8 ч [по сравнению с 1,5 ч для примера 1]) у собак. Биодоступность примера 2 была выше, по сравнению с примером 1, у крыс (F=59% для примера 2; F=17% для примера 1). Данные in vitro. Приведены дополнительные экспериментальные результаты.GRFP: связывание глюкокортикоидного рецептора. Исследование поляризации флуоресценции глюкокортикоидного рецептора связанного лиганда(GRFP) применяется для исследования прямого связывания тестируемых соединений полномерным глюкокортикоидным белком (GR). Реагенты для этого исследования покупались в Invitrogen в виде исследовательского набора. Флуоресцентно меченный GR-лиганд применялся в качестве флуоресцентного радиоактивного индикатора, и тестовые соединения участвовали одновременно с флуоресцентным радиоактивным индикатором в GR-связывании. Изменение величины поляризации в присутствии тестовых соединений, вызванное связыванием тестовых соединений с GR, применялось для определения IC50 и относительного сродства связывания тестовых соединений с GR. Величины IL-6 IC50 и процент ингибирования. Клетки А 549 эпителия легкого человека (American Type Culture Collection, Rockville, MD) культивировали в среде F-12K по Kaighn с пенициллин-стрептомициновой средой (10 U/мл) и 10% теплоинактивированной эмбриональной бычьей сывороткой (все от Invitrogen, Grand Island, NY). Клетки А 549 помещали в планшет при плотности 30000 клеток/лунка в 96-луночные планшеты и инкубировали в течение ночи при 37 С с 5% СО 2. Клетки выдерживали на минимальной по сыворотке среде после замещения среды роста на свободную от сыворотки среду F-12K по Kaighn с пенициллин-стрептомициновой средой(10 U/мл) и повторно инкубировали в течение ночи при 37 С в присутствии 5% CO2. На третий день среду заменяли на чистую свободную от сыворотки среду и клетки инкубировали с соединением или без соединения (носитель представляет собой ДМСО, с максимальной концентрацией 0,1%) в течение приблизительно 1 ч и затем стимулировали 1 нг/мл рекомбинантного человеческого IL-1 (RD Systems,Minneapolis, MN) в течение 20 ч при 37 С и 5% CO2. Клеточные супернатанты собирали для определения уровней IL-6 с применением MSD (Meso Scale Discovery, Gaithersburg, MD) 96-луночного планшета единичного пятна в соответствии с инструкциями производителя. Планшеты считывали на MSD SectorImager 6000. Преднизолон (1 мкМ) применяли в качестве максимального ингибитора для измерения контрольной точки 100% ингибирования. Носитель применяли для определения контрольной точки 0% ингибирования. Процент ингибирования для каждой концентрации соединения относительно этих контрольных точек вычисляли с применением пакета Excel (Microsoft, Redmond, WA). Величины IC50 получали с применением программного приложения для анализа данных GraFit 5.0 (Erithacus Software Ltd.,Surrey, UK). Величины IC50 и процент ингибирования для TNF. Премоноцитные клетки человека U937 (American Type Culture Collection, Rockville, MD) культивировали в среде RPMI 1640 с глутамином (2 мМ), пенициллин-стрептомициновой средой (10 U/мл) и 10% теплоинактивированной эмбриональной бычьей сывороткой (все от Invitrogen, Grand Island, NY). Клетки дифференцировали до фенотипа моноцит/макрофаг с 13-ацетатом форбол-12-миристата (Sigma-Aldrich,St. Louis, МО), 20 нг/мл в течение ночи. Затем клетки центрифугировали, среду удаляли отсасыванием,клетки повторно суспендировали в равном объеме чистой среды RPMI 1640 с глутамином и пенициллинстрептомициновым раствором и эмбриональной бычьей сывороткой; и, как описано выше, инкубировали в течение 48 ч при 37 С и с 5% СО 2. После восстановления клетки соскребали, подсчитывали и размещали в планшетах согласно плану эксперимента перед стимуляцией действием LPS, как описано ниже. Клетки U937 дифференцировали и их размещали в планшетах при плотности 200000 клеток/лунка в 96-луночные планшеты. Клетки инкубировали с соединением или без соединения (носитель представлял собой ДМСО с максимальной концентрацией 1%) в течение приблизительно 1 ч и затем стимулировали действием 100 нг/мл липополисахарида (LPS), серотипа Е. coli 0111:В 4 (Sigma-Aldrich, St. Louis, МО) в течение 4 ч при 37 С и с 5% СО 2. Клеточные супернатанты собирали для измерения уровней FTN с применением многослойного теста ELISA собственной разработки. Мышиные TNF моноклональные антитела к человеку (клон 28401.111) и биотинилированные козьи антитела TNF к человеку (RD Systems, Minneapolis, MN) применяли соответственно для захвата и определения соответствующих антител.- 25016001 В качестве системы определения применяли стрептавидин и пероксидазу хрена (HRP) (RD Systems,Minneapolis, MN) и комплекс субстрат голубой K/глушитель красный (Neogen, Lexington, KY). Оптическую плотность измеряли при 650 нм. Концентрации TNF получали интерполяцией по стандартной кривой TNF рекомбинантного белка человека (RD Systems, Minneapolis, MN) с применением четырехпараметрической логистической модели с применением приложения для анализа данных Magellan 4.11 (Tecan, Durham, NC). Преднизолон (1 мкМ) применяли в качестве максимального ингибитора и измерения контрольной точки 100% ингибирования. Носитель применяли для определения контрольной точки 0% ингибирования. Процент ингибирования для каждой концентрации соединения относительно этих контрольных точек вычисляли с применением пакета Excel (Microsoft, Redmond, WA). ВеличиныIC50 получали с применением приложения LabStats Fit Curve V4.R7.MO для анализа данных (Pfizer Sandwich Laboratories, UK и Tessella Support Services plc, Abingdon UK). Цельная кровь человека ex vivo. Это исследование проводило сравнение ингибирования IL-1, IFN, IL-6 и продукции TNF в LPSстимулированной цельной крови человека ex vivo под действием лигандов глюкокортикоидного рецептора (GR), таких как соединение сравнения А, пример 1 и преднизолон. Венозную кровь от доноров собирали в виде аликвот 10 мл в пробирки, содержащие гепарин натрия(BD Vacutainer от Becton Dickinson и Company, Franklin Lakes, NY). Кровь добавляли на стерильные полистирольные круглодонные 96-луночные планшеты для тканевых культур (Corning Costar) при 100 мкл/лунка, пропуская наружные лунки. Среды (RPMI среда 1640 с L-глутамином, Invitrogen Corporation,Carlsbad, CA) добавляли к крови в аликвотах объемом 90 мкл до общего объема 190 мкл. Наружные лунки заполняли 200 мкл сред. Кровь помещали в увлажняемый 37 С инкубатор с 5% СО 2 во время получения соединений (приблизительно 60 мин). Растворы соединения получали из 10-мМ базовых растворов в диметилсульфоксиде (ДМСО, SigmaAldrich). Базовый раствор соединения разбавляли последовательно как 1/3 с ДМСО (то есть 5 мкл соединения + 10 мкл ДМСО) с последующим разбавлением, каждое последовательное разбавление как 1/167 в растворе носителя (2% ДМСО, 30% этанола (AAPER Alcohol and Chemical Company) и 68% буферированного фосфатом физиологического раствора (фосфатный буферный физиологический раствор по Дульбекко без хлорида кальция, без хлорида магния, Invitrogen Corporation, Carlsbad CA). Раствор соединения или носитель добавляли к крови в виде 10-мкл аликвот в виде трех экспериментов. Конечная концентрация каждого из растворов, преднизолона и примера 1 для исследования находилась в диапазоне от 1000 до 0,457 нМ. Концентрации соединения сравнения А находились в диапазоне от 3000 до 1,4 нМ. Конечные концентрации ДМСО и этанола в исследовании составляли 0,1 и 1,5%. Образцы для смешивания дважды осторожно растирали и помещали в инкубатор. Базовый раствор LPS (серотипа Е. coli 0111:B4, Sigma-Aldrich) хранили в аликвотах с концентрацией 100 мкг/мл в RPMI при -20 С, разбавляли как 1/50 в RPMI для получения рабочего базового раствора. Через 60 мин инкубации 10 мкл полученногоLPS рабочего базового раствора добавляли к крови до конечной концентрации 100 нг/мл, пропуская лунки, используемые в качестве отрицательного контроля. Образцы снова осторожно растирали и планшеты инкубировали в течение ночи в течение 22 ч. После инкубации кровь центрифугировали при 1500g в течение 5 мин и плазму или отделяли для замораживания при -20 С, или исследовали на высвобождение цитокина. Уровни IL-1, IFN, IL-6 и белка FTN измеряли с применением комплектов для исследованияMeso Scale (Meso Scale Discovery, Gaithersburg, MD). Реагентам позволяли достигать комнатной температуры. Планшеты Meso Scale блокировали действием 30 мкл разбавителя для исследования человеческой плазмы/сыворотки с осторожным потряхиванием в течение 60 мин при комнатной температуре. Планшеты промывали 3 раза буфером для промывки (PBS, Invitrogen Corporation, с 0,05% Tween-20, SigmaAldrich). Калибровки для стандартных кривых получали в разбавителе для исследования человеческой плазмы/сыворотки в виде серийного разбавления 1/5 до конечных концентраций в диапазоне от 50000 до 3,2 пг/мл. Образцы и калибраторы добавляли в количествах 20 мкл/лунка, затем инкубировали при комнатной температуре с осторожным потряхиванием в течение 90 мин. Планшеты повторно промывали 3 раза буфером для промывки. Антитела для определения разбавляли в разбавителе для антител плазмы/сыворотки человека до 1 мкг/мл и добавляли в планшет в количествах 20 мкл/лунка. Планшеты инкубировали, как ранее, в течение 60 мин и промывали повторно. Т-буфер для считывания (4) разбавляли 1:1 mq-Н 2 О до концентрации (2) и добавляли по 150 мкл к каждой лунке. Планшеты анализировали на SECTOR Imager 6000 (Meso Scale Discovery) для получения величин необработанного сигнала. Величины для образцов IL-1, IFN, IL-6 и TNF, как было подтверждено, находятся в пределах калибровочных стандартных кривых. Индивидуальные величины сравнивали с положительным и отрицательным контролем (обработанная носителем кровь LPS и обработанная носителем кровь без LPS соответственно) для получения процента ингибирования. Утроенные величины усредняли для каждого донора. Величины для двух доноров усредняли (только одного донора использовали для IL-1) и представляли в виде графика с применением соответствующих четырехпараметрических кривых с помощью приложения GraFit 5.0.11.- 26016001 Средние величины ингибирования преднизолоном Средние величины ингибирования примером 1 Средние величины ингибирования соединением сравнения А Пример 1 является высокоэффективнным соединением на моделях заболевания. Индуцируемый коллагеном артрит на мышах (mCIA). Индуцируемый коллагеном артрит на мышах представляет собой обычно применяемую преклиническую модель хронического ревматоидного артрита, в которой после иммунизации коллагеном типа II имеет место опухание сустава и деструкция кости. Уменьшение частоты и тяжести заболевания, как бы- 27016001 ло показано ранее, может являться прогнозом для модификации заболевания и смягчения признаков и симптомов соответственно в клинической обстановке. В традиционной mCIA-модели самца DBA/J-мыши иммунизировали действием 50 мкг коллагена цыпленка типа II (cCII) в полном адъюванте по Фрейнду, затем форсировали через 21 день инъекцией 50 мкг cCII в неполном адъюванте по Фрейнду. Обработку соединениями инициировали утром после форсирования и продолжали в течение 56 дней. Эффективность лечения измеряли по частоте заболевания(то есть число мышей, обнаруживающих любой признак заболевания) и тяжестью заболевания, обе величины измеряли дважды в неделю. В терапевтической модели mCIA развитие частоты заболеваний и тяжести синхронизировали путем стимуляции LPS. Самца DBA/J-мыши иммунизировали 100 мкг бычьим коллагеном типа II (bCII) в день 0. Все мыши получали внутрибрюшинную инъекцию 20 мкг LPS в день 28 и заболеванию позволяли развиваться до 34 дня. На 34 день все мыши имели заболевание (частота = 100%) со средним показателем тяжести семь. Дозирование соединений начинали в терапевтическом режиме на 34 день и продолжали до дня 49. Различные лечения сравнивались путем измерения уменьшения частоты (то есть смягчение заболевания) и уменьшения тяжести опухоли лапы с течением времени. Определение баллов тяжести mCIA (максимальный балл 12/мышь) Пример 1 имел балл менее чем 2 для mCIA (ED80) и менее чем 1 для mCIA (ED50). Подавление TNF и остеокальцина (ОС). Соединения взвешивали и суспендировали в носителе, представляющем собой смесь 0,5% метилцеллюлозы/0,025% tween 20 (Sigma-Aldrich, St. Louis, МО). Суспензии соединения гомогенизировали с применением тканевого гомогенизатора Polytron PT-3100 для создания очень тонкой суспензии и затем облучали ультразвуком в течение 10 мин с использованием ультразвуковой водяной бани. Аликвоты каждой суспензии приготавливали для ежедневного дозирования с дозой 0,2 мл/доза. Самки мыши SwissInstitutional Animal Care and Use Committee и согласно рекомендациям NIH по содержанию лабораторных животных. Мышей акклиматизировали в установке для животных от фирмы Pfizer в течение от 3 до 7 дней перед использованием в исследовании. Преднизолон и соединения вводились кормлением через пероральный желудочный зонд в течение всех 28 дней. Каждая группа содержала 5-10 мышей. Для установления режима дозирования для исследований проводили пилотный эксперимент фармакодинамического течения во времени для измерения величины подавления TNF после отдельной ED80-дозы. Соединения, которые подавляли TNF, дозировали QD, в то время как соединения, который не подавлялиTNF 50% в течение 24 ч, дозировали дважды в день (BID). Массы тела измеряли в первый и последний день каждого эксперимента. Образцы крови получали через три недели дозирования для фармакокинетического анализа устойчивого состояния (PK). Для оценки влияния соединения на LPS-индуцируемый TNF все мыши получали внутрибрюшинную инъекцию LPS (Salmonella typhosa, L-7895; Sigma-Aldrich, St. Louis) через 2,5 ч после последней дозы на 28 день. Мыши умерщвлялись через 90 мин после введения LPS. Для образцов сыворотки проводили количественное определение остеокальцина и TNF с применением множественных исследований (LincoResearch, Inc., St. Charles, MO; Luminex 100, Austin, TX). Образцы разбавляли 1:20 и исследование проводили согласно инструкциям производителя. Стандарт остеокальцина был куплен отдельно (BiomedicalTechnologies Inc., Stoughton, MA). Мышей не кормили в течение 4 ч перед отбором сыворотки на TNF и уровни остеокальцина. Для каждого эксперимента резко отклоняющиеся значения определяли путем вычисления величин стандартных отклонений от среднего для группы. Если полученное значение имело отклонение более чем 2,5 от стандартного отклонения от среднего, его исключали из дальнейших вычислений. Затем величины процента ингибирования вычисляли для каждой мыши с применением среднего от контрольной группы носителя и группы 10 мг/кг преднизолона. Величины процента ингибирования индивидуальной мыши аппроксимировали по четырехпараметрической логистической модели с применением средней дозы для каждой группы. Впоследствии все четыре параметра оценивали и меньшее плато не фиксировали при 0% и верхнее плато не фиксировали при 100%; ED50 и ED80 величины вычисляли с применением инвертированной формулы калибровки для отклика, равного 50 или 80% ингибирования или активации. Величины ED50 и ED80 представляют собой дозы (мг/кг), требующиеся для достижения 50 или 80% эффекта соответственно, в конкретной конечной точке. Величины ED50 и ED80 получали для различных конечных точек с применением четырехпараметрической логистической модели. Для соединений, которые тестировали много раз, величины ED50 и ED80 получали с применением четырехпараметрических логистических аппроксимаций объединенных данных из множества экспериментов. Для соединений,- 28016001 которые не достигали 80% эффекта, ED80 величина обозначалась как 10 или 20 мг/кг в зависимости от наивысшей тестируемой дозы. Астматическая модель клещевого аллергена домашней пыли. Мышей обрабатывали тремя дозами примера 1 (0,1, 1 и 10 мг/кг, перорально (р.о.), дважды в день(b.i.d. или преднизолона (0,1, 1 и 10 мг/кг, p.о., b.i.d.). Отдельные группы животных обрабатывали соответствующими носителями, было продемонстрировано отсутствие эффекта прилива BAL воспалительных клеток в модели прилива воспалительных клеток, индуцируемой клещевым аллергеном домашней пыли. Пример 1 смягчает зависимым от дозы образом просачивание клеток в BAL жидкость. Оценка клеточных типов BAL жидкости с использованием цитометрии показала значительное уменьшение эозинофилов, нейтрофилов, лимфоцитов и Т-клеток. В сравнении с примером 1 преднизолон обеспечивает аналогичные уменьшения просачивания клеток в BAL жидкость при аналогичных дозах (данные не показаны). Индекс диссоциации. Индекс диссоциации (DI) был выбран как способ количественного измерения диссоциации соединений относительно диссоциации преднизолона в биомаркерах противовоспалительной эффективности и побочных эффектов. Индексы диссоциации вычисляли с применением клинически значимых биомаркеров, которые могут применяться при раннем клиническом обследовании. Сывороточный остеокальцин иLPS-индуцируемый сывороточный TNF клинически приняты как прогностические показатели для соответственно образования кости и противовоспалительной эффективности. Индекс диссоциации основан на следующих принципах: 1) диссоциация требует разницы дозы между биомаркерами воспаления и побочных эффектов и определяется формулой 2) DI соединения может считаться относительным к индексу диссоциации, наблюдаемому в случае преднизолона, клинического соединения сравнения. Корректированный или нормализованный DI определяется как DI соединения, деленный на DI преднизолона. Индекс диссоциации (ED50 и ED80)
МПК / Метки
МПК: A61P 25/28, A61P 19/02, A61P 11/06, C07D 213/75, A61P 1/00, A61P 29/00, A61K 31/44
Метки: рецептора, модуляторов, качестве, трициклические, соединения, применение, глюкокортикоидного
Код ссылки
<a href="https://eas.patents.su/30-16001-triciklicheskie-soedineniya-i-ih-primenenie-v-kachestve-modulyatorov-glyukokortikoidnogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические соединения и их применение в качестве модуляторов глюкокортикоидного рецептора</a>
Предыдущий патент: Способ и устройство для подключения мобильных устройств связи к беспроводным сетям в подземных сооружениях
Следующий патент: Способ и устройство для получения минеральных волокон
Случайный патент: Производные фталазинонпирролопиримидинкарбоксамида












