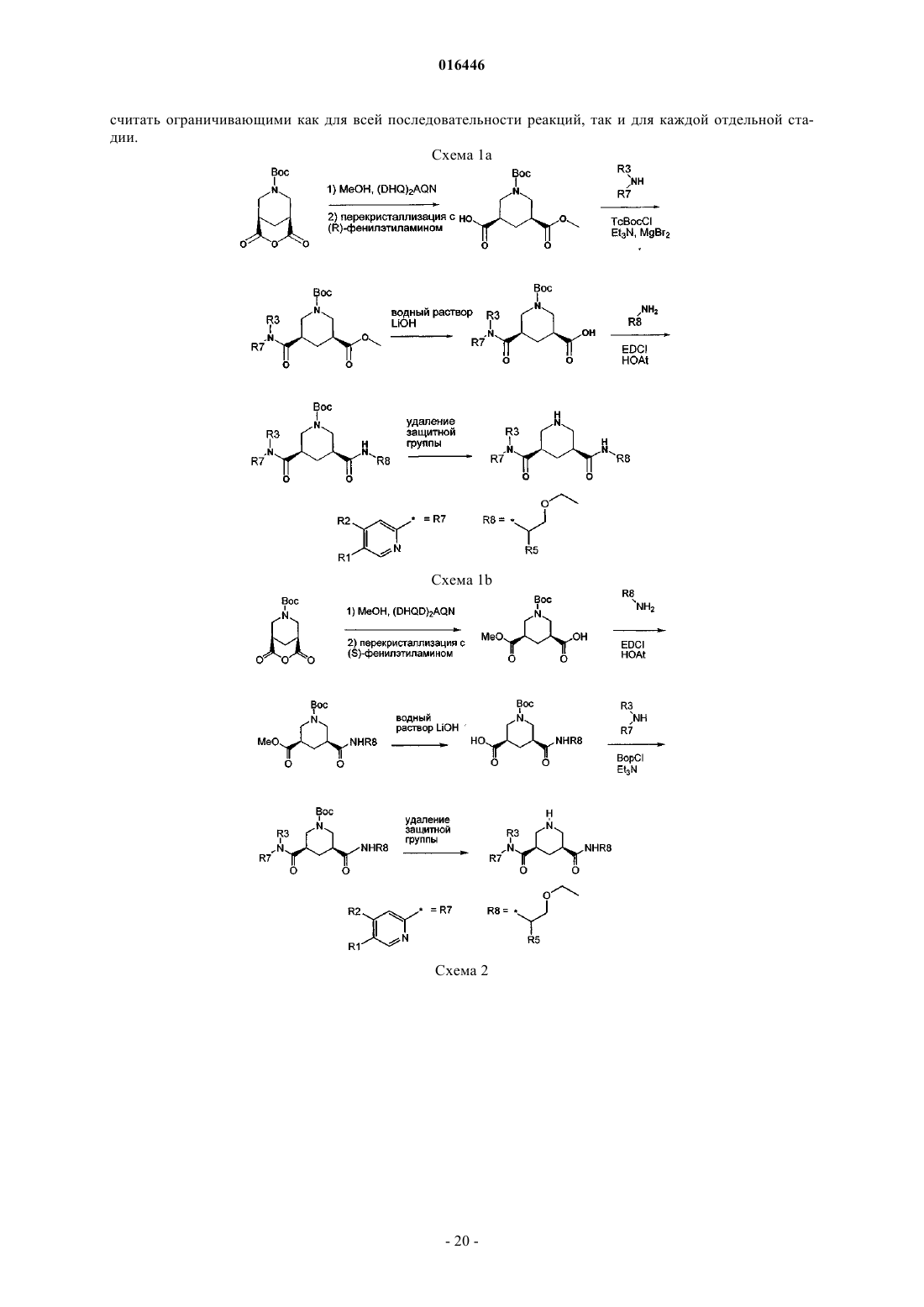
Производные n5-(2-этоксиэтил)-n3-(2-пиридинил)-3,5-пиперидиндикарбоксамида, предназначенные для применения в качестве ингибиторов ренина
Номер патента: 16446
Опубликовано: 30.05.2012
Авторы: Эхара Такеру, Хитоми Юко, Каваками Шимпей, Тояо Атсуши, Ирие Осаму, Сузуки Масаки, Йококава Фумиаки
Формула / Реферат
1. Соединение формулы (I)
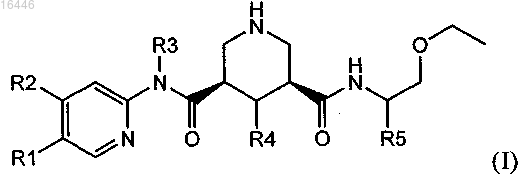
в которой R1 обозначает С1-С7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С7-алкоксигруппу;
R2 обозначает водород, С1-С7-алкил, С1-С7-алкокси, галоген-С1-С7-алкил, галоген-С1-С7-алкоксигруппу или С1-С7-алкокси-С1-С7-алкоксигруппу;
R3 обозначает С1-С7-алкил или С3-С8-циклоалкил;
R4 обозначает водород или гидроксигруппу и
R5 обозначает С1-С7-алкил или С3-С8-циклоалкил;
или его соль, при условии, что исключены соединения формулы (I), в которой R1 обозначает метил или изопропил, R2 обозначает 3-метоксипропоксил, R3 обозначает циклопропил, R4 обозначает водород и R5 обозначает 2-метилпропил.
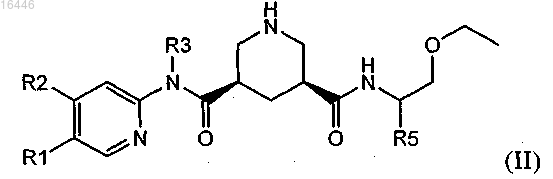
2. Соединение по п.1, обладающее структурой формулы (II)
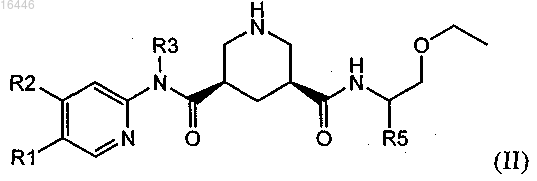
в которой R1 обозначает С1-С7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С7-алкоксигруппу;
R2 обозначает водород, С1-С7-алкил, С1-С7-алкокси, галоген-С1-С7-алкил, галоген-С1-С7-алкоксигруппу или С1-С7-алкокси-С1-С7-алкоксигруппу;
R3 обозначает С1-С7-алкил или С3-С8-циклоалкил;
R4 обозначает водород или гидроксигруппу и
R5 обозначает С1-С7-алкил или С3-С8-циклоалкил;
или его соль.
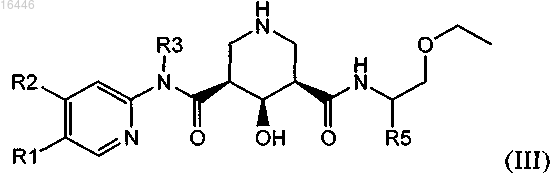
3. Соединение по п.1, обладающее структурой формулы (III)
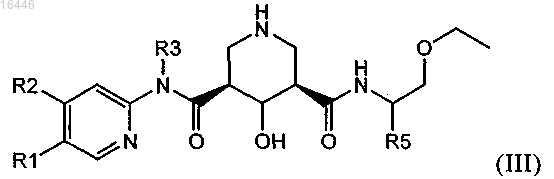
в которой R1 обозначает С1-С7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С7-алкоксигруппу;
R2 обозначает водород, С1-С7-алкил, С1-С7-алкокси, галоген-С1-С7-алкил, галоген-С1-С7-алкоксигруппу или С1-С7-алкокси-С1-С7-алкоксигруппу;
R3 обозначает С1-С7-алкил или С3-С8-циклоалкил;
R4 обозначает водород или гидроксигруппу и
R5 обозначает С1-С7-алкил или С3-С8-циклоалкил;
или его соль.
4. Соединение по п.1 или 3, обладающее структурой формулы (III')
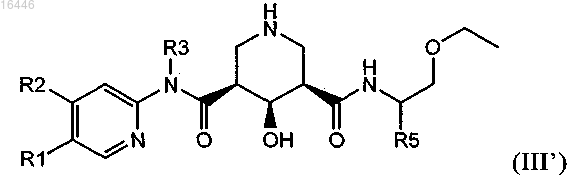
R1 обозначает С1-С7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С7-алкоксигруппу;
R2 обозначает водород, С1-С7-алкил, С1-С7-алкокси, галоген-С1-С7-алкил, галоген-С1-С7-алкоксигруппу или С1-С7-алкокси-С1-С7-алкоксигруппу;
R3 обозначает С1-С7-алкил или С3-С8-циклоалкил;
R4 обозначает водород или гидроксигруппу и
R5 обозначает С1-С7-алкил или С3-С8-циклоалкил;
или его соль.
5. Соединение по любому из предыдущих пунктов, в котором R1 обозначает С1-С7-алкил, который необязательно замещен С1-С7-алкоксигруппой.
6. Соединение по любому из предыдущих пунктов, в котором R2 обозначает водород или С1-С7-алкоксигруппу.
7. Соединение по любому из предыдущих пунктов, в котором R3 обозначает разветвленный С4-С6-алкил или циклопропил.
8. Соединение по любому из предыдущих пунктов, в котором R5 обозначает С1-С4-алкил или циклогексил.
9. Соединение по любому из пп.1, или 2, или 5-8, выбранное из группы, включающей соединения формулы
приведенные в представленной ниже таблице

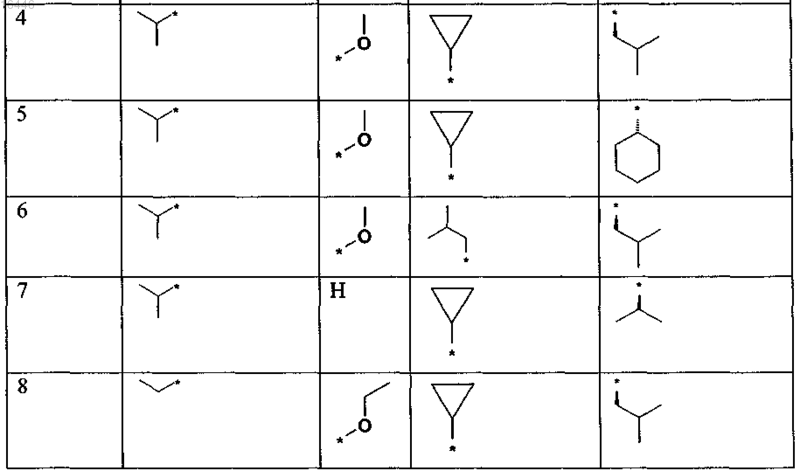
или его (предпочтительно фармацевтически приемлемая) соль соответственно.
10. Соединение по любому из пп.1 или 4-8, выбранное из группы, включающей соединения формулы
приведенные в представленной ниже таблице
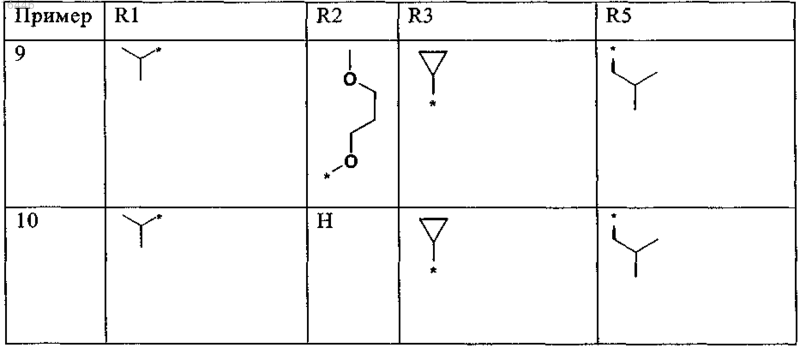
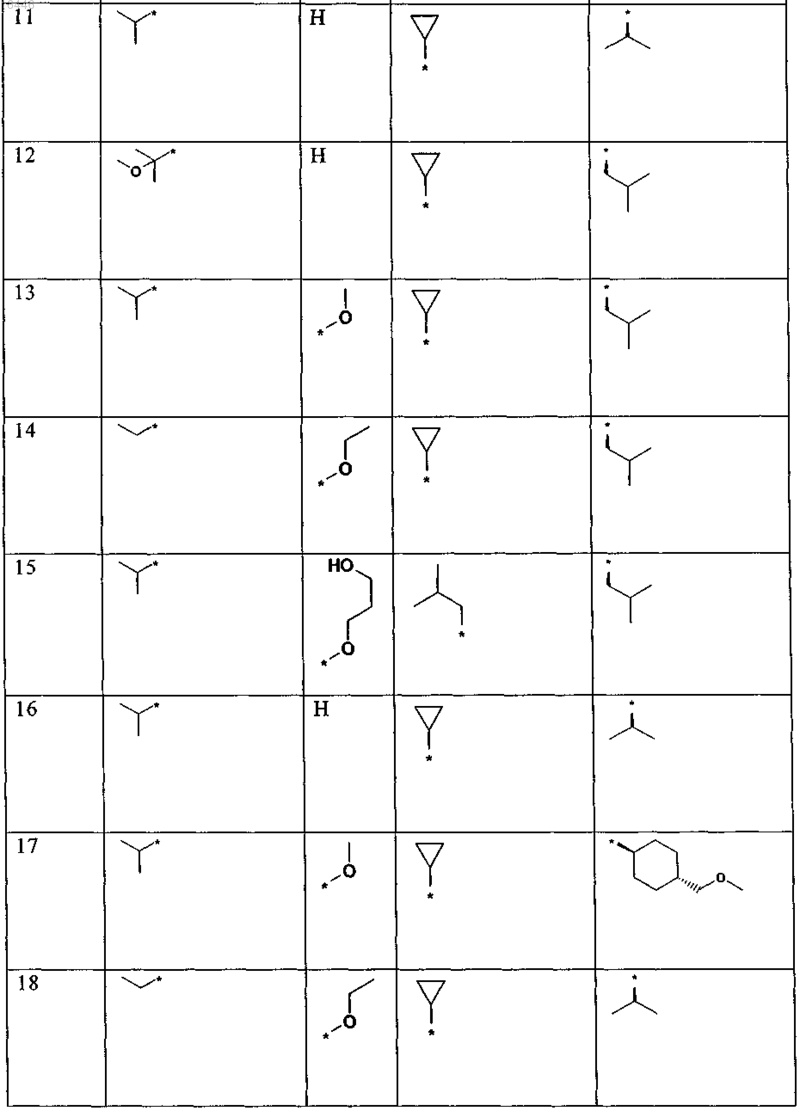
или его (предпочтительно фармацевтически приемлемая) соль соответственно.
11. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-10 для приготовления фармацевтической композиции, предназначенной для лечения заболевания, которое зависит от активности ренина, предпочтительно гипертензии.
12. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-10 для лечения заболевания, которое зависит от активности ренина, предпочтительно гипертензии.
13. Фармацевтический препарат, включающий соединение или его фармацевтически приемлемую соль по любому из пп.1-10 и по меньшей мере один фармацевтически приемлемый носитель.
14. Способ лечения заболевания, которое зависит от активности ренина, включающий введение теплокровному животному, предпочтительно человеку, нуждающемуся в таком лечении, соединения или его фармацевтически приемлемой соли по любому из пп.1-10 в фармацевтически эффективном количестве.
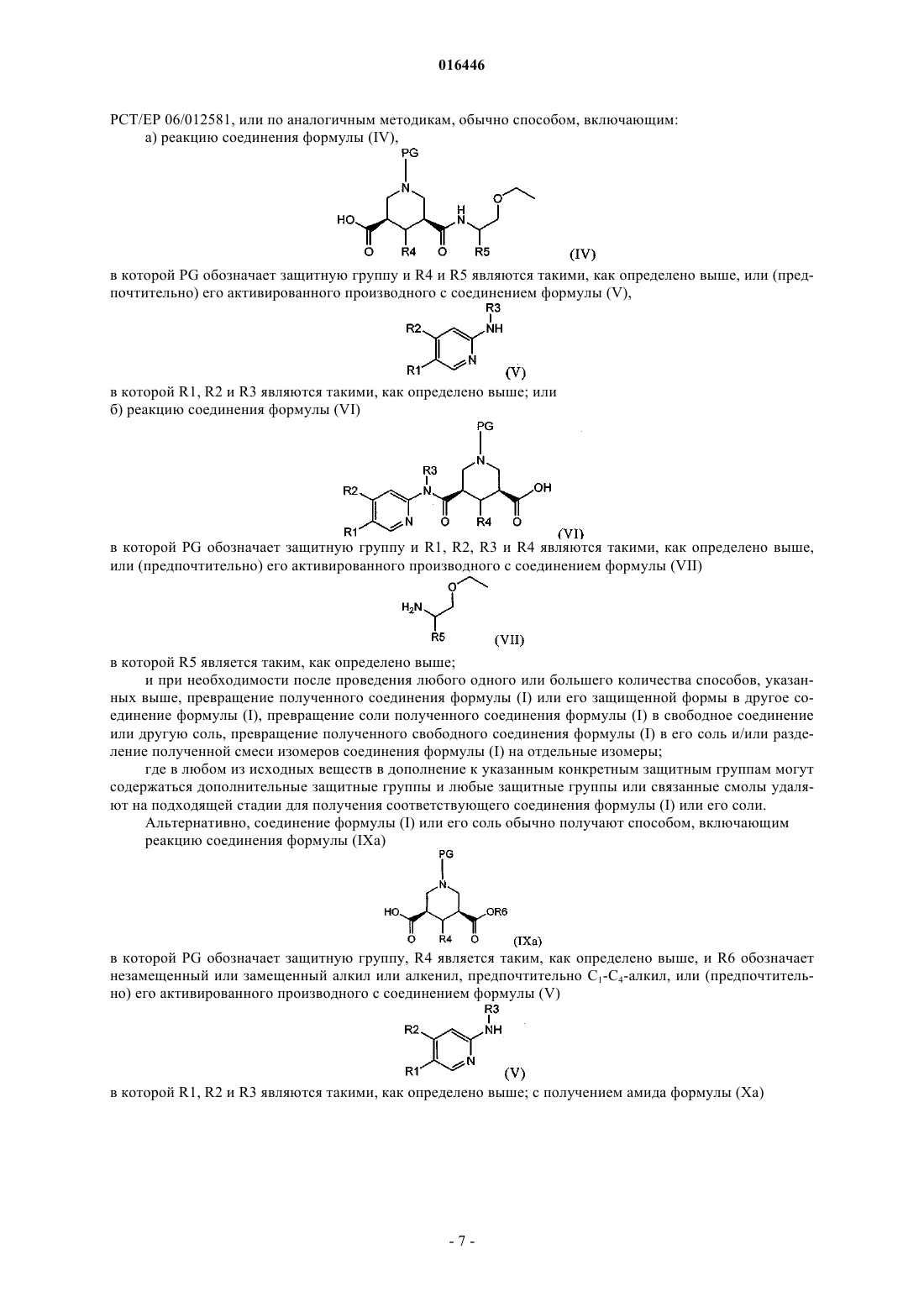
15. Способ получения соединения по любому из пп.1-10, включающий реакцию соединения формулы (IV)
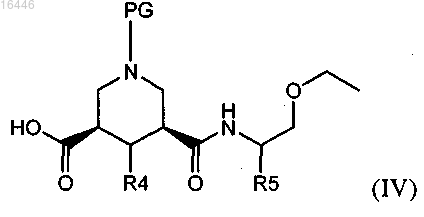
где PG обозначает защитную группу и R4 и R5 являются такими, как определено в любом из предыдущих пунктов, или (предпочтительно) его активированного производного,
с соединением формулы (V)
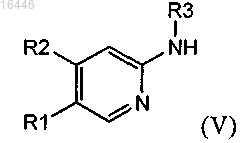
где R1, R2 и R3 являются такими, как определено в любом из предыдущих пунктов;
и при необходимости затем превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры;
где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли.
16. Способ получения соединения по любому из пп.1-10, включающий реакцию соединения формулы (VI)
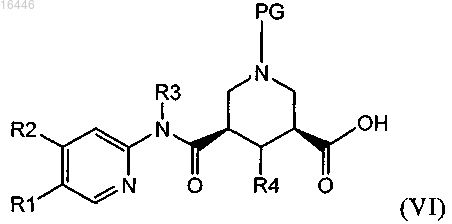
где PG обозначает защитную группу и R1, R2, R3 и R4 являются такими, как определено в любом из предыдущих пунктов, или (предпочтительно) его активированного производного,
с соединением формулы (VII)
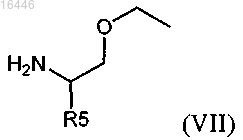
где R5 является таким, как определено в любом из предыдущих пунктов;
и при необходимости затем превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры;
где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли.
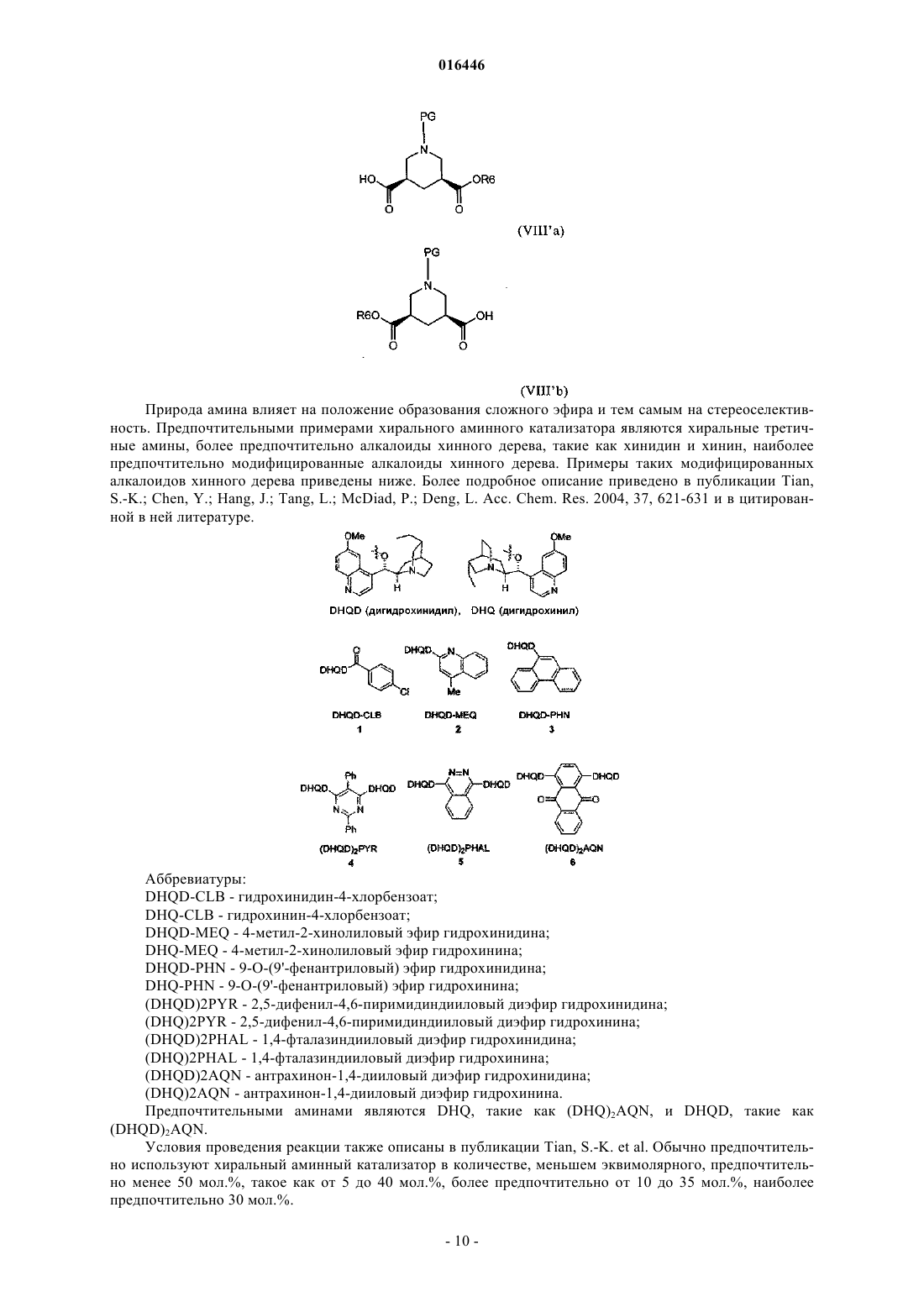
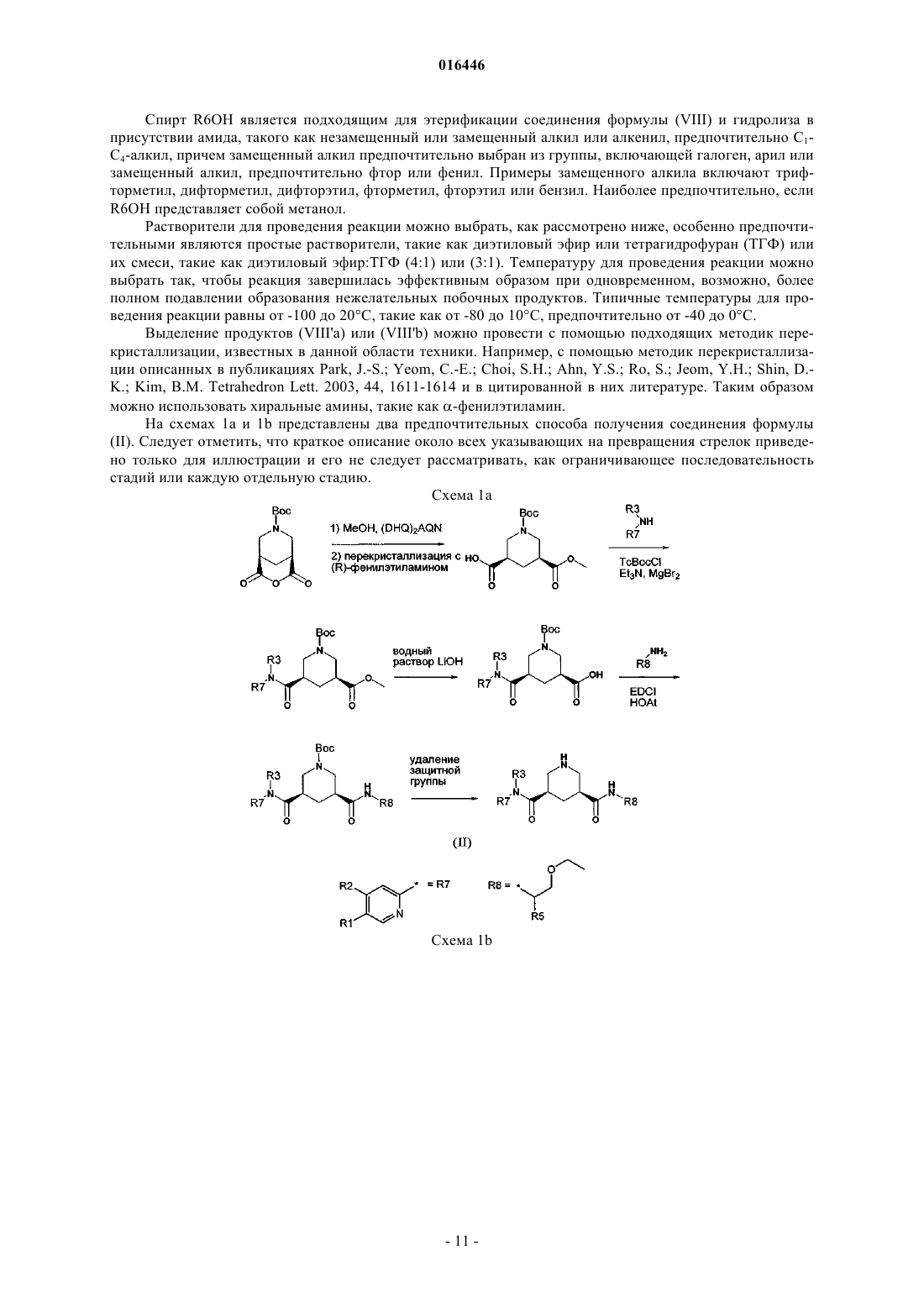
17. Способ получения соединения формулы
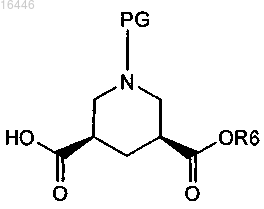
включающий реакцию соединения формулы (VIII)
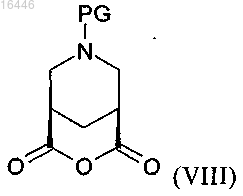
где PG обозначает защитную группу,
со спиртом R6OH, где R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно С1-С4-алкил, в присутствии хирального аминного катализатора.
18. Способ получения соединения по любому из пп.1-10, включающий реакцию соединения формулы (IXa)
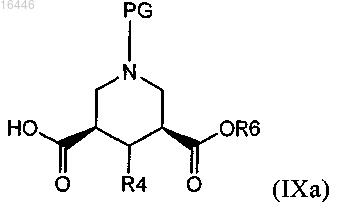
где PG обозначает защитную группу, R4 является таким, как определено в любом из предыдущих пунктов, и R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно С1-С4-алкил, или (предпочтительно) его активированного производного,
с соединением формулы (V)
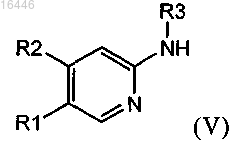
где R1, R2 и R3 являются такими, как определено в любом из предыдущих пунктов;
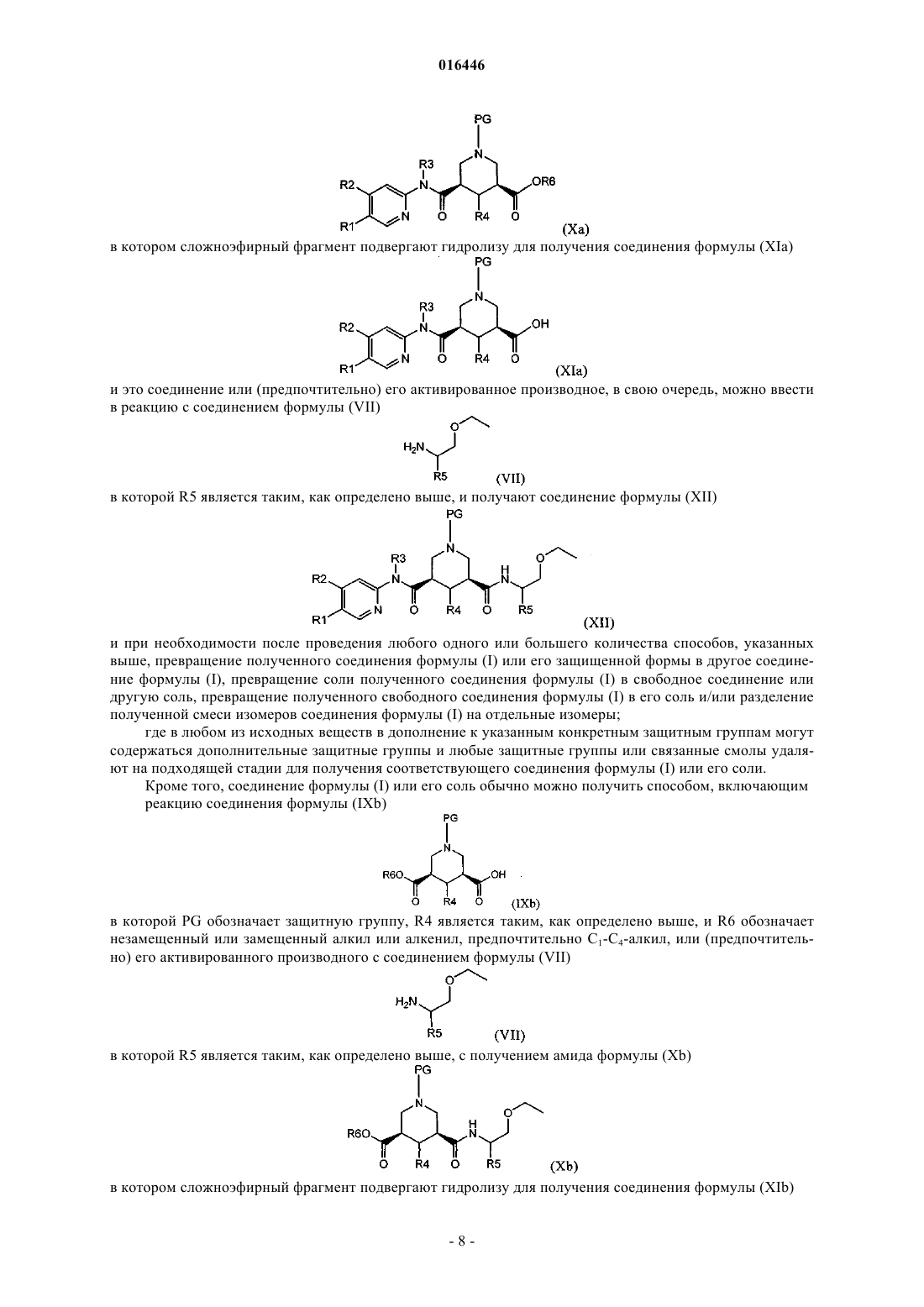
с получением амида формулы (Ха)
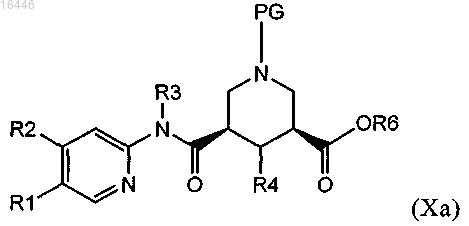
где сложноэфирный фрагмент подвергают гидролизу для получения соединения формулы (XIa)
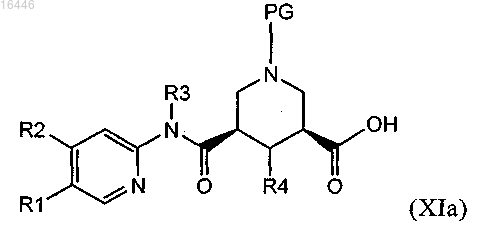
и это соединение или (предпочтительно) его активированное производное, в свою очередь, можно ввести в реакцию с соединением формулы (VII)

где R5 является таким, как определено в любом из предыдущих пунктов,
с получением соединения формулы (XII)

и при необходимости после проведения любого одного или более способов, указанных выше, превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры;
где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли.
19. Способ получения соединения по любому из пп.1-10, включающий реакцию соединения формулы (IXb)
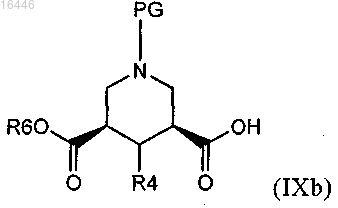
где PG обозначает защитную группу, R4 является таким, как определено в любом из предыдущих пунктов, и R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно С1-С4-алкил, или (предпочтительно) его активированного производного,
с соединением формулы (VII)
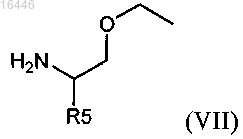
где R5 является таким, как определено в любом из предыдущих пунктов, с получением амида формулы (Xb)
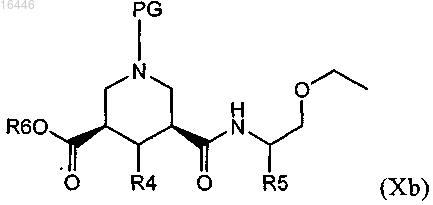
где сложноэфирный фрагмент подвергают гидролизу для получения соединения формулы (XIb)
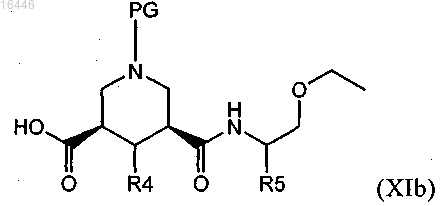
и это соединение или (предпочтительно) его активированное производное, в свою очередь, можно ввести в реакцию с соединением формулы (V)
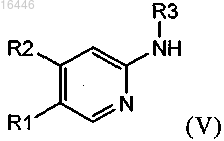
где R1, R2 и R3 являются такими, как определено в любом из предыдущих пунктов,
с получением соединения формулы (XII)

и при необходимости после проведения любого одного или более способов, указанных выше, превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры;
где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли.
Текст
ПРОИЗВОДНЫЕ N5-(2-ЭТОКСИЭТИЛ)-N3-(2-ПИРИДИНИЛ)-3,5 ПИПЕРИДИНДИКАРБОКСАМИДА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕНИНА В изобретении описаны соединение формулы (I) в которой R1, R2, R3, R4 и R5 являются такими, как определено в описании, предназначенное для применения для диагностики и лечения теплокровного животного, предпочтительно для лечения заболевания (нарушения), которое зависит от активности ренина; применение соединения этого класса для приготовления фармацевтической композиции, предназначенной для лечения заболевания, которое зависит от активности ренина; применение соединения этого класса для лечения заболевания, которое зависит от активности ренина; фармацевтические композиции соединения этого класса; способ лечения, включающий введение соединения этого класса, и способ его получения. 016446 Настоящее изобретение относится к 3,5-замещенным пиперидинам формулы (I), к применению этих соединений для диагностики и лечения теплокровного животного, предпочтительно для лечения заболевания (нарушения), которое зависит от активности ренина; к применению соединения этого класса для приготовления фармацевтической композиции, предназначенной для лечения заболевания, которое зависит от активности ренина; к применению соединения этого класса для лечения заболевания, которое зависит от активности ренина; к фармацевтическим композициям, включающим указанный 3,5 замещенный пиперидин; к способу лечения, включающему введение указанного 3,5-замещенного пиперидина и к способу получения указанных 3,5-замещенных пиперидинов. Мы ранее описали новые 3,5-замещенные пиперидины, которые применимы в качестве ингибиторов ренина (см. РСТ/ЕР 06/012581). Хотя эти соединения применимы и эффективны для этой цели, постоянно необходима разработка ингибиторов ренина, обладающих улучшенным фармакокинетическим профилем при одновременном обеспечении хорошей активности и безопасности. В частности, для терапии важно получение ингибиторов ренина, обладающих улучшенной биологической доступностью. Биологическая доступность является важным фактором, ограничивающим терапевтическое применение биологически активных соединений. Поэтому в основу настоящего изобретения была положена задача получения новых активных ингибиторов ренина, обладающих улучшенной биологической доступностью. Настоящее изобретение относится к соединению формулы (I) в которой R1 обозначает C1-C7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С 7-алкоксигруппу;R4 обозначает водород или гидроксигруппу иR5 обозначает C1-C7-алкил или С 3-С 8-циклоалкил; или к его соли. В одном предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы (I), в которойR1 обозначает С 1-С 7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С 7-алкоксигруппу;R4 обозначает водород или гидроксигруппу иR5 обозначает C1-C7-алкил или С 3-С 8-циклоалкил; или к его соли. Настоящее изобретение также относится к соединению формулы (II) в которой R1 обозначает С 1-С 7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С 7-алкоксигруппу;R4 обозначает водород или гидроксигруппу иR5 обозначает C1-C7-алкил или С 3-С 8-циклоалкил; или к его соли. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы (II), в которой R1 обозначает С 1-С 7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С 7-алкоксигруппу;R4 обозначает водород или гидроксигруппу иR5 обозначает C1-C7-алкил или С 3-С 8-циклоалкил; или к его соли. Соединения формулы (II) являются предпочтительными вариантами формулы (I), в которой R4 обозначает водород. Настоящее изобретение также относится к соединению формулы (III) в которой R1 обозначает С 1-С 7-алкил, который необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген и C1-С 7-алкоксигруппу;R4 обозначает водород или гидроксигруппу иR5 обозначает C1-C7-алкил или С 3-С 8-циклоалкил; или к его соли. Соединения формулы (III) являются предпочтительными вариантами формулы (I), в которой R4 обозначает гидроксигруппу. Соединения, предлагаемые в настоящем изобретении, обладают способностью ингибировать активность природного фермента ренина. Таким образом, соединения формулы (I) можно использовать для лечения (этот термин также включает профилактику) одного или большего количества нарушений и заболеваний, предпочтительно выбранных из числа заболеваний, подробно указанных ниже, в особенности если эти заболевания можно модулировать (более предпочтительно оказывать на них благоприятное влияние) путем ингибирования ренина. Ниже приведены определения различных терминов, использующихся для описания соединений,предлагаемых в настоящем изобретении, а также их применения и синтеза исходных веществ и промежуточных продуктов и т.п. Эти определения, которые путем замены одной, более чем одной, или всех структур или символов, использующихся в настоящем описании, тем самым приводящие к предпочтительным вариантам осуществления настоящего изобретения, предпочтительно применять к терминам в таком виде, в котором они используются в настоящем описании, если иное не указано в конкретных случаях по отдельности или в качестве части большей группы. Алкил означает С 1-С 7-алкил, более предпочтительно С 1-С 4-алкил, т.е. линейный или разветвленный(один или, если это является подходящим, большее количество раз). Термин С 1-С 7-алкил означает фрагмент, содержащий до и включительно максимально 7, предпочтительно до и включительно максимально 4 атома углерода, указанный фрагмент является разветвленным (один или большее количество раз) или линейным и присоединен к концевому или неконцевому атому углерода. С 1-С 7-алкил, например, представляет собой н-пентил, н-гексил или н-гептил или предпочтительно С 1-С 4-алкил, более предпочтительно метил, этил, н-пропил, втор-пропил, н-бутил, изобутил, втор-бутил или трет-бутил. Галоген предпочтительно означает фтор, хлор, бром или йод, наиболее предпочтительно фтор, хлор или бром; если указан галоген, то это может означать, что содержится один или большее количество (например, до 3) атомов галогенов в таких фрагментах, как галоген-С 1-С 7-алкил, галоген-С 1-С 7 алкоксигруппа и т.п. (например, трифторметил). С 3-С 8-Циклоалкил предпочтительно означает моно- или бициклический, более предпочтительно моноциклический циклоалкил, который может содержать одну или большее количество двойных и/или тройных связей. С 3-С 6-Циклоалкил является предпочтительным. С 1-С 7-Алкоксигруппа означает, например, С 1-С 4-алкоксигруппу и она может быть линейной или разветвленной. Примерами являются метокси-, этокси-, н- и изо-пропилокси-, н-, изо- и трет-бутилокси-,пентилокси- и гексилоксигруппы. C1-С 4-Алкоксигруппа является предпочтительной. Арил предпочтительно означает моно- или бициклический арил, содержащий от 6 до 22 атомов углерода, более предпочтительно фенил, инденил, инданил или нафтил, еще более предпочтительно фенил. Алкенил может представлять собой линейный или разветвленный алкил, содержащий двойную связь и предпочтительно содержащий от 2 до 12 атомов С, особенно предпочтительно от 2 до 8 атомов С. Особенно предпочтительным является линейный С 2-С 4-алкенил. Особенно предпочтительным является аллил. Связи, отмеченные звездочкой , указывают положение присоединения остальной части молекулы. Во всех приведенных выше определениях специалист в данной области техники без чрезмерного-2 016446 экспериментирования или обсуждения может выявить подходящие (например, такие, которые являются достаточно стабильными для приготовления лекарственных средств, например, обладающие периодом полуразложения, превышающим 30 с, предпочтительно более недели), и они предпочтительно входят в объем формулы изобретения и в ее объем входят только химически возможные связи и заместители (например, в случае двойных или тройных связей, содержащие водород амино- или гидроксигруппы и т.п. можно исключить, чтобы избежать таутомерии), а также таутомерные формы, если они содержатся, особенно в равновесии. Например, для стабильности и возможности существования соединения с химический точки зрения предпочтительно, чтобы соседние группы цепей одновременно не представляли собой две оксигруппы, две тиогруппы или оксигруппу и тиогруппу, за исключением наличия кольцевых систем и т.п., которые достаточно стабильны. Предпочтительно, чтобы заместители, присоединенные через являющиеся частями этих групп атомы О (например, в С 1-С 7-алкоксигруппе) или S, не были связаны с атомом азота, например, содержащимся в кольцах. Солями предпочтительно являются фармацевтически приемлемые соли соединений формулы (I). Их можно получить, если содержатся солеобразующие группы, такие как основные или кислотные группы, которые, по меньшей мере, частично могут находиться в диссоциированном виде, например, в диапазоне рН от 4 до 10 в водных растворах, или они могут быть выделены в твердой, предпочтительно кристаллической форме. Такие соли получают, например, в виде солей присоединения с органическими или неорганическими кислотами, из соединений формулы (I), содержащих основной атом азота (например, имино- или аминопроизводных), в особенности фармацевтически приемлемые соли. Подходящими неорганическими кислотами являются, например, галогенводородные кислоты, такие как хлористо-водородная кислота,серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например,карбоновые, фосфоновые, сульфоновые или сульфаминовые кислоты, например уксусная кислота, пропионовая кислота, молочная кислота, фумаровая кислота, янтарная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, бензойная кислота, метан- или этансульфоновая кислота,этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5 нафталиндисульфоновая кислота, N-циклогексансульфаминовая кислота, N-метил-, N-этил- или Nпропилсульфаминовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота. В присутствии отрицательно заряженных радикалов, таких как карбоксигруппа или сульфонил,также можно получить соли с основаниями, например соли металлов или аммония, такие как соли щелочного металла или щелочно-земельного металла, например соли натрия, калия, магния или кальция,или соли аммония с аммиаком или подходящими органическими аминами, такими как третичные моноамины, например триэтиламин или три(2-гидроксиэтил)амин, или с гетероциклическими основаниями,например N-этилпиперидином или N,N'-диметилпиперазином. Если в одной и той же молекуле содержится основная группа и кислотная группа, то соединение формулы (I) также может образовывать внутренние соли. Для выделения и очистки также можно использовать фармацевтически неприемлемые соли, например пикраты или перхлораты. Для терапевтического применения используют только фармацевтически приемлемые соли или свободные основания (если их можно включать в фармацевтические препараты) и поэтому они являются предпочтительными. Вследствие близкого родства соединений в форме свободных оснований и в форме их солей, включая соли, которые можно использовать в качестве промежуточных продуктов, например, при очистке или идентификации соединений или их солей, любое указание на "соединения", "исходные вещества" и"промежуточные продукты" выше и ниже в настоящем изобретении, в особенности на соединение (соединения) формулы (I) или их предшественники, следует понимать также и как указание на одну или большее количество их солей или смесь соответствующего свободного соединения и одной или большего количества его солей, каждое из которых считают включающим и любой сольват, метаболический предшественник, такой как сложный эфир или амид соединения формулы (I), или соль любого из этих соединений, если это является подходящим или целесообразным и если явно не указано иное. Можно получить различные кристаллические формы, и они также включены в объем настоящего изобретения. Если для соединений, исходных веществ, промежуточных продуктов, солей, фармацевтических препаратов, заболеваний, нарушений и т.п. используется форма множественного числа, это означает одно (предпочтительно) или большее количество соединений, солей, фармацевтических препаратов, заболеваний, нарушений и т.п., если используется форма единственного числа, это означает включение множественного числа (например, также разных конфигурационных изомеров одного и того же соединения,например энантиомеров в рацематах и т.п.) или предпочтительно единственное число. Соединения, предлагаемые в настоящем изобретении, в зависимости от выбора заместителей могут содержать два или большее количество асимметрических центров. Предпочтительные абсолютные конфигурации являются такими, как специально указано в настоящем изобретении. Однако в объем настоящего изобретения входят их любые возможные выделенные или чистые диастереоизомеры, энантиомеры-3 016446 и геометрические изомеры и их смеси, например смеси энантиомеров, такие как рацематы. Как описано выше, соединения, предлагаемые в настоящем изобретении, являются ингибиторами активности ренина и поэтому могут быть использованы для лечения гипертензии, атеросклероза, нестабильного коронарного синдрома, застойной сердечной недостаточности, гипертрофии сердца, фиброза сердца, послеинфарктной кардиомиопатии, нестабильного коронарного синдрома, диастолической дисфункции, хронического заболевания почек, фиброза печени, осложнений после диабета, таких как нефропатия, васкулопатия и нейропатия, заболеваний коронарных сосудов, рестеноза после ангиопластики,повышенного внутриглазного давления, глаукомы, аномального роста сосудов и/или гиперальдостеронизма, и/или также ухудшения познавательной способности, болезни Альцгеймера, слабоумия, тревожных состояний и нарушения познавательной способности и т.п., в особенности, если необходимо ингибирование (в особенности неподходящей) активности ренина."Неподходящая" активность ренина предпочтительно относится к состоянию теплокровного животного, предпочтительно человека, при котором активность ренина слишком высока для данной ситуации (например, вследствие одного или большего количества следующих проявлений: нарушения регуляции, сверхэкспрессирования, например, вследствие амплификации гена или перестройки хромосомы, или инфицирования микроорганизмами, такими как вирусы, которые экспрессируют аберрантный ген, аномальной активности, например, приводящей к ошибочной специфичности субстрата, или гиперактивности ренина, например, продуцируемого в нормальных количествах, слишком низкой активности на путях удаления ренина, высокой концентрации субстрата и/или т.п.) и/или приводит к проявлению или поддерживает зависимое от ренина заболевание или нарушение, указанное выше и ниже, например, вследствие слишком высокой активности ренина. Такая неподходящая активность ренина может, например,включать активность, превышающую нормальную, или даже активность, находящуюся в нормальном диапазоне или даже ниже нормального диапазона, однако которая вследствие предыдущих, одновременных и/или последующих процессов, например сигнального, регуляторного воздействия на другие процессы, большей концентрации субстрата или продукта и т.п., приводит к прямому или косвенному поддержанию заболевания или нарушения, и/или активность, которая способствует возникновению и/или наличию заболевания или нарушения любым другим путем. Неподходящая активность ренина может зависеть или не зависеть от параллельных других механизмов, поддерживающих заболевание или нарушение, и/или профилактическое или терапевтическое воздействие в дополнение к ингибированию ренина может включать или не включать другие механизмы. Поэтому "зависящее от" следует понимать как"зависящее в том числе от" (в особенности в случаях, когда заболевание или нарушение в действительности зависит только от ренина), предпочтительно как "преимущественно зависящее от", более предпочтительно как "в основном зависящее от". Заболевание, зависящее от (в особенности неподходящей) активности ренина также может быть заболеванием, которое просто реагирует на модуляцию активности ренина, предпочтительно благоприятно реагирует (например, путем снижения артериального давления) в случае ингибирования ренина. Если указано заболевание или нарушение, зависящее от (в особенности неподходящей) активности ренина (как в определении "применения" в следующем абзаце) и в особенности, если указано соединение формулы (I) для применения для диагностики или лечения, которым предпочтительно является лечение заболевания или нарушения, зависящего от неподходящей активности ренина, это предпочтительно относится к любому одному или большему количеству заболеваний или нарушений, которые зависят от неподходящей активности натурального ренина и/или одной или большего количества его измененных или мутированных форм. Если ниже или выше используется термин "применение" (в виде глагола или существительного)(относящийся к применению соединения формулы (I) или его фармацевтически приемлемой соли, или к способу его применения), это (если не указано иное или иное не следует из контекста) включает один или большее количество следующих вариантов осуществления настоящего изобретения соответственно(если не указано иное): применение для лечения заболевания или нарушения, которое зависит от (в особенности неподходящей) активности ренина, применение для приготовления фармацевтических композиций, предназначенных для применения для лечения заболевания или нарушения, которое зависит от (в особенности неподходящей) активности ренина; способ применения одного или большего количества соединений формулы (I) для лечения заболевания или нарушения, которое зависит от (в особенности неподходящей) активности ренина; фармацевтический препарат, включающий одно или большее количество соединений формулы (I), предназначенных для лечения заболевания или нарушения, которое зависит от (в особенности неподходящей) активности ренина; и одно или большее количество соединений формулы (I), предназначенных для применения для лечения заболевания или нарушения теплокровного животного, предпочтительно человека, предпочтительно заболевания, которое зависит от (в особенности неподходящей) активности ренина; в зависимости от того, что является подходящим и целесообразным,если не указано иное. Термины "лечить", "лечение" или "терапия" относятся к профилактике (например, задержке или предупреждению возникновения заболевания или нарушения) или предпочтительно (включая, но не ограничиваясь только ими, предупреждение, задержку возникновения и/или прогрессирования, паллиатив-4 016446 ное лечение, излечивание, облегчение симптомов, ослабление симптомов, улучшение состояния пациента, модулирование ренина и/или ингибирование ренина) к лечению указанного заболевания (заболеваний) или нарушения (нарушений), предпочтительно одного или большего количества заболеваний или нарушений, указанных выше или ниже. Предпочтительные варианты осуществления настоящего изобретения Группы предпочтительных вариантов осуществления настоящего изобретения, указанные ниже, не следует рассматривать как ограничивающие, напротив, например, для замены общих структур или символов соответствующими более предпочтительным определениям, части этих групп соединений можно заменять или изменять с использованием приведенных выше определений или исключать, в зависимости от того, что целесообразнее, и каждое из этих более предпочтительных определений независимо от любого другого можно вводить независимо от одного или большего количества других более предпочтительных определений или совместно с ними для других более общих структур или символов. Настоящее изобретение предпочтительно относится к соединению формул (I), (II) или (III), в которых фрагмент R5 присоединен в R-конфигурации или, альтернативно, в которых этот фрагмент присоединен в S-конфигурации. Таким образом, настоящее изобретение более предпочтительно относится к соединению формул (I),(II) или (III), определенному выше или ниже в настоящем изобретении, которое обладает конфигурацией,представленной в приведенных ниже формулах (IIA) или (IIB) или (предпочтительно фармацевтически приемлемой) его соли, или, альтернативно, конфигурацией,представленной в приведенных ниже формулах (IIIA) или (IIIB) или (предпочтительно фармацевтически приемлемой) его соли, где в формулах (IIA), (IIB), (IIIA) и (IIIB),R1, R2, R3 и R5 являются такими, как определено выше или ниже для соединения формулы (I). Альтернативно и также более предпочтительно, настоящее изобретение относится к соединению формулы (I) или (III), определенному выше или ниже в настоящем изобретении, которое обладает конфигурацией, представленной в приведенной ниже формуле (III') или (предпочтительно фармацевтически приемлемой) его соли, где в формуле (III') R1, R2, R3 и R5 являются такими, как определено выше или ниже для соединения формулы (I). Альтернативно и также более предпочтительно, настоящее изобретение относится к соединению формулы (I) или (III), определенному выше или ниже в настоящем изобретении, которое обладает конфигурацией, представленной в приведенных ниже формулах (III'А) или (III'В) или (предпочтительно фармацевтически приемлемой) его соли, где в формулах (III'А) и (III'В) R1, R2, R3 и R5 являются такими, как определено выше или ниже для соединения формулы (I). В первом предпочтительном варианте осуществления настоящее изобретение, в частности, относится к соединению формул (I), (II), (III), (III'), (IIA), (IIB), (IIIA), (IIIB), (III'А) или (III'В), в которых R1 обозначает С 1-С 7-алкил, более предпочтительно С 1-С 4-алкил, который необязательно замещен С 1-С 7 алкоксигруппой, более предпочтительно С 1-С 4-алкоксигруппой. В одном варианте осуществления R1 обозначает С 1-С 7-алкил, который является незамещенным. Особенно предпочтительные примеры R1 выбраны из группы, включающей В другом предпочтительном варианте осуществления настоящее изобретение, в частности, относится к соединению формул (I), (II), (III), (III'), (IIA), (IIB), (IIIA), (IIIB), (III'А) или (III'В), в которых R2 обозначает водород, С 1-С 7-алкоксигруппу или С 1-С 7-алкокси-С 1-С 7-алкоксигруппу; более предпочтительно водород, С 1-С 4-алкоксигруппу или С 1-С 4-алкокси-С 1-С 4-алкоксигруппу. Особенно предпочтительные примеры R2 выбраны из группы, включающей водород, В одном предпочтительном варианте осуществления настоящее изобретение, в частности, относится к соединению формул (I), (II), (III), (III'), (IIA), (IIB), (IIIA), (IIIB), (III'А) или (III'В), в которых R2 обозначает водород или С 1-С 7-алкоксигруппу; более предпочтительно водород или С 1-С 4-алкоксигруппу. Особенно предпочтительные примеры R2 выбраны из группы, включающей водород, В другом предпочтительном варианте осуществления настоящее изобретение, в частности, относится к соединению формул (I), (II), (III), (III'), (IIA), (IIB), (IIIA), (IIIB), (III'А) или (III'В), в которых R3 обозначает С 3-С 7-алкил или С 3-С 6-циклоалкил; более предпочтительно разветвленный С 4-С 6-алкил или циклопропил. Особенно предпочтительными примерами R3 являются В одном варианте осуществления R3 обозначает циклопропил. В другом предпочтительном варианте осуществления настоящее изобретение, в частности, относится к соединению формул (I), (II), (III), (III'), (IIA), (IIB), (IIIA), (IIIB), (III'А) или (III'В), в которых R5 обозначает C1-C5-алкил или С 3-С 6-циклоалкил; более предпочтительно C1-C4-алкил или циклогексил. Алкил может быть разветвленным или присоединен через неконцевой С. Особенно предпочтительными примерами R5 являются Особенно предпочтительные варианты осуществления настоящего изобретения приведены в примерах, таким образом, в особенно предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы (I) или его соли, выбранному из числа соединений, приведенных в примерах, а также к их применению в контексте настоящего изобретения. Способ получения Соединение формулы (I) или его соль предпочтительно получают по методикам, описанным в-6 016446 РСТ/ЕР 06/012581, или по аналогичным методикам, обычно способом, включающим: а) реакцию соединения формулы (IV), в которой PG обозначает защитную группу и R4 и R5 являются такими, как определено выше, или (предпочтительно) его активированного производного с соединением формулы (V), в которой R1, R2 и R3 являются такими, как определено выше; или б) реакцию соединения формулы (VI) в которой PG обозначает защитную группу и R1, R2, R3 и R4 являются такими, как определено выше,или (предпочтительно) его активированного производного с соединением формулы (VII) в которой R5 является таким, как определено выше; и при необходимости после проведения любого одного или большего количества способов, указанных выше, превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры; где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли. Альтернативно, соединение формулы (I) или его соль обычно получают способом, включающим реакцию соединения формулы (IXa) в которой PG обозначает защитную группу, R4 является таким, как определено выше, и R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно C1-C4-алкил, или (предпочтительно) его активированного производного с соединением формулы (V) в которой R1, R2 и R3 являются такими, как определено выше; с получением амида формулы (Ха) в котором сложноэфирный фрагмент подвергают гидролизу для получения соединения формулы (XIa) и это соединение или (предпочтительно) его активированное производное, в свою очередь, можно ввести в реакцию с соединением формулы (VII) в которой R5 является таким, как определено выше, и получают соединение формулы (XII) и при необходимости после проведения любого одного или большего количества способов, указанных выше, превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры; где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли. Кроме того, соединение формулы (I) или его соль обычно можно получить способом, включающим реакцию соединения формулы (IXb) в которой PG обозначает защитную группу, R4 является таким, как определено выше, и R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно С 1-С 4-алкил, или (предпочтительно) его активированного производного с соединением формулы (VII) в которой R5 является таким, как определено выше, с получением амида формулы (Xb) в котором сложноэфирный фрагмент подвергают гидролизу для получения соединения формулы (XIb) и это соединение или (предпочтительно) его активированное производное, в свою очередь, можно ввести в реакцию с соединением формулы (V) в которой R1, R2 и R3 являются такими, как определено выше, и получить соединение формулы (XII) и при необходимости после проведения любого одного или большего количества способов, указанных выше, превращение полученного соединения формулы (I) или его защищенной формы в другое соединение формулы (I), превращение соли полученного соединения формулы (I) в свободное соединение или другую соль, превращение полученного свободного соединения формулы (I) в его соль, и/или разделение полученной смеси изомеров соединения формулы (I) на отдельные изомеры; где в любом из исходных веществ в дополнение к указанным конкретным защитным группам могут содержаться дополнительные защитные группы и любые защитные группы или связанные смолы удаляют на подходящей стадии для получения соответствующего соединения формулы (I) или его соли. В случае соединения формул (IV), (VI), (IXa), (IXb), (XIa) или (XIb) его активированное производное представляет собой соответствующее соединение, в котором группа ОН карбоксигруппы предпочтительно заменена отщепляющейся группой, такой как галоген, например хлор, бром или йод, или органической сульфонилоксигруппой, такой как тозилоксигруппа или метансульфонилоксигруппа. Затем реакцию такого его активированного производного с соединением формул (V) или (VII) предпочтительно проводят при стандартных условиях нуклеофильного замещения. В предпочтительном варианте осуществления активированные производные включают, например, ацилгалогениды, ангидриды и активированные сложные эфиры. Активированным сложным эфиром является такой, который известен специалисту в данной области техники, например N-сукцинимид. Активированным производным карбоновой кислоты формул (IV), (VI), (IXa) или (IXb) является, например, соответствующее промежуточное соединение, образовавшееся по реакции указанной кислоты с EDCl, BopCl или TcBocCl. В другом предпочтительном варианте осуществления активированным производным соединений формул (IV), (VI), (IXa),(IXb), (XIa) или (XIb) является соответствующее производное, полученное при условиях реакции Вильсмайера. Кроме того, способ получения соединения формулы (I) или его фармацевтически приемлемой соли может включать реакцию соединения формулы (VIII) в которой PG обозначает защитную группу, со спиртом R6OH, в котором R6 обозначает незамещенный или замещенный алкил или алкенил, предпочтительно C1-C4-алкил, в присутствии хирального аминного катализатора с получением соединения формулы (VIII'a) или (VIII'b) Природа амина влияет на положение образования сложного эфира и тем самым на стереоселективность. Предпочтительными примерами хирального аминного катализатора являются хиральные третичные амины, более предпочтительно алкалоиды хинного дерева, такие как хинидин и хинин, наиболее предпочтительно модифицированные алкалоиды хинного дерева. Примеры таких модифицированных алкалоидов хинного дерева приведены ниже. Более подробное описание приведено в публикации Tian,S.-K.; Chen, Y.; Hang, J.; Tang, L.; McDiad, P.; Deng, L. Acc. Chem. Res. 2004, 37, 621-631 и в цитированной в ней литературе.(DHQ)2AQN - антрахинон-1,4-дииловый диэфир гидрохинина. Предпочтительными аминами являются DHQ, такие как (DHQ)2AQN, и DHQD, такие как(DHQD)2AQN. Условия проведения реакции также описаны в публикации Tian, S.-K. et al. Обычно предпочтительно используют хиральный аминный катализатор в количестве, меньшем эквимолярного, предпочтительно менее 50 мол.%, такое как от 5 до 40 мол.%, более предпочтительно от 10 до 35 мол.%, наиболее предпочтительно 30 мол.%.- 10016446 Спирт R6OH является подходящим для этерификации соединения формулы (VIII) и гидролиза в присутствии амида, такого как незамещенный или замещенный алкил или алкенил, предпочтительно С 1 С 4-алкил, причем замещенный алкил предпочтительно выбран из группы, включающей галоген, арил или замещенный алкил, предпочтительно фтор или фенил. Примеры замещенного алкила включают трифторметил, дифторметил, дифторэтил, фторметил, фторэтил или бензил. Наиболее предпочтительно, еслиR6OH представляет собой метанол. Растворители для проведения реакции можно выбрать, как рассмотрено ниже, особенно предпочтительными являются простые растворители, такие как диэтиловый эфир или тетрагидрофуран (ТГФ) или их смеси, такие как диэтиловый эфир:ТГФ (4:1) или (3:1). Температуру для проведения реакции можно выбрать так, чтобы реакция завершилась эффективным образом при одновременном, возможно, более полном подавлении образования нежелательных побочных продуктов. Типичные температуры для проведения реакции равны от -100 до 20 С, такие как от -80 до 10 С, предпочтительно от -40 до 0 С. Выделение продуктов (VIII'a) или (VIII'b) можно провести с помощью подходящих методик перекристаллизации, известных в данной области техники. Например, с помощью методик перекристаллизации описанных в публикациях Park, J.-S.; Yeom, C.-E.; Choi, S.H.; Ahn, Y.S.; Ro, S.; Jeom, Y.H.; Shin, D.K.; Kim, B.M. Tetrahedron Lett. 2003, 44, 1611-1614 и в цитированной в них литературе. Таким образом можно использовать хиральные амины, такие как -фенилэтиламин. На схемах 1 а и 1b представлены два предпочтительных способа получения соединения формулы(II). Следует отметить, что краткое описание около всех указывающих на превращения стрелок приведено только для иллюстрации и его не следует рассматривать, как ограничивающее последовательность стадий или каждую отдельную стадию. Схема 1 а Гидролиз сложных эфиров и удаление защитных групп можно провести по методикам, хорошо известным в данной области техники, например, как описано в справочниках, таких как Richard С. Larock,"Comprehensive Organic Transformations: A Guide to Functional Group Preparations", Second Edition, WileyVCH Verlag GmbH, 2000 или в Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis",Third edition, Wiley, New York 1999; см. также приведенные ниже ссылки, относящиеся к методикам введения и удаления защитных групп. В объем настоящего изобретения входят все фармацевтически приемлемые изотопно-меченые соединения формулы (I), в которой один или большее количество атомов заменены атомами, обладающими таким же атомным номером, но атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, подходящих для включения в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15 О,17 О и 18 О, фосфора, такие как 32 Р, и серы, такие как 35S. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может привести к некоторым терапевтическим преимуществам, обусловленным большей метаболической стабильностью, например увеличенным периодом полувыведения in vivo или возможностью использования меньших доз, и, следовательно, при некоторых обстоятельствах может быть предпочтительным. Изотопно-меченые соединения формулы (I) обычно можно получить по обычным методикам, известным специалистам в данной области техники, или по методикам, аналогичным описанным в прилагающихся примерах и разделах, посвященных синтезу, с использованием подходящего изотопномеченого реагента вместо использовавшегося ранее немеченого реагента. Исходные вещества В последующем описании исходных веществ (этот термин также включает промежуточные продукты) и их синтеза R1, R2, R3, R4, R5, R6, R7, R8 и PG обладают значениями, указанными выше или в примерах для соответствующих исходных веществ либо промежуточных продуктов, если явно не указано или из контекста не следует иное. Защитные группы, если специально не указано иное, можно вводить и удалять на подходящих стадиях для защиты функциональных групп, для которых нежелательно вступление в реакции на соответствующей стадии или стадиях, использование защитных групп, методики их введения и удаления описаны выше или ниже. Специалист в данной области техники должен без труда решить, когда и какие защитные группы полезны или необходимы. Если для любого из исходных веществ содержатся изомеры (например, диастереоизомеры, энантиомеры), их можно отделить по стандартным методикам на соответствующих стадиях. Другие исходные вещества известны в данной области техники, имеются в продаже и/или описаны или могут быть получены аналогично описаниям в примерах. Общие условия осуществления способа Приведенное ниже в целом относится ко всем способам, указанным выше и ниже в настоящем изобретении, и предпочтительными являются условия проведения реакций, специально отмеченные выше или ниже.- 12016446 В любой из реакций, отмеченных выше и ниже в настоящем изобретении, защитные группы можно использовать, когда это является подходящим или желательным, даже если это не отмечено специально,для защиты функциональных групп, которые не должны участвовать в данной реакции, и их можно вводить и/или удалять на подходящих или желательных стадиях. Поэтому реакции, включающие использование защитных групп, считаются возможными везде, где в настоящем описании описаны реакции без специального указания на введение и/или удаление защитных групп. В объеме настоящего изобретения "защитными группами", или PG, являются только легко удаляемые группы, которые не являются частью конкретного необходимого конечного продукта формулы (I),если в контексте не указано иное. Защита функциональных групп с помощью таких защитных групп,сами защитные группы и реакции, пригодные для их введения и удаления, описаны, например, в стандартных руководствах, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press,London and New York 1973, in T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", Third(Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974. Особенностью защитных групп является то, что их можно легко удалять (т.е. без протекания нежелательных вторичных реакций), например, путем сольволиза, восстановления, фотолиза или, альтернативно, при физиологических условиях (например, путем ферментативного отщепления). Примерами защитной группы, или PG, в частности, для атома азота, такого как пиперидиновый атом азота, соединений, описанных в настоящем изобретении, являются алкоксикарбонильная, сульфонильная и ацильная группы. Предпочтительные защитные группы включают, например, (i) C1-С 2-алкил,который является моно-, ди- или тризамещенным фенилом, такой как бензил, или бензгидрил, или тритил, где фенильное кольцо является незамещенным или замещенным одним или большим количеством,например двумя или тремя, остатков, например, выбранных из группы, включающей С 1-С 7-алкил, гидроксигруппу, С 1-С 7-алкоксигруппу, галоген, нитрогруппу, цианогруппу и CF3; фенил-С 1-С 2 алкоксикарбонил и аллил или циннамил. Особенно предпочтительными являются низш. (например, С 1 С 7) алкоксикарбонил, такой как трет-бутоксикарбонил или бензилоксикарбонил; бензилоксикарбонил(Cbz), 9-флуоренилметилоксикарбонил (Fmoc), бензилоксиметил (ВОМ), пивалоилоксиметил (РОМ),трихлорэтоксикарбонил (Troc), 1-адамантилоксикарбонил (Adoc), а также бензил, кумил, бензгидрил,тритил, аллил, alloc (аллилоксикарбонил). Защитной группой также может являться силил, такой как триалкилсилил, предпочтительно триметилсилил, трет-бутилдиметилсилил, триэтилсилил, триизопропилсилил, триметилсилилэтоксиметил (SEM), а также замещенный сульфонил или замещенный сульфенил. Наиболее предпочтительным является низш. (например, С 1-С 7) алкоксикарбонил, такой как третбутоксикарбонил. Защитной группой также может являться сульфонильная группа, предпочтительно арилсульфонильная группа, такая как замещенная или незамещенная фенилсульфонильная группа. В этом случае фенил, если он является замещенным, может быть моно-, ди- или тризамещенным, предпочтительно моно- или дизамещенным подходящим заместителем, таким как С 1-С 7-алкил, С 1-С 7 алкоксигруппа, галоген-С 1-С 7-алкил, галоген-С 1-С 7-алкоксигруппа, галоген, гидроксигруппа, нитрогруппа, цианогруппа, более предпочтительно нитрогруппа или метил. Особенно предпочтительными примерами сульфонильных защитных групп являются 2,4-динитрофенилсульфонил, 4-нитрофенилсульфонил,2-нитрофенилсульфонил и 4-метилфенилсульфонил. Все указанные выше стадии способа можно выполнять при условиях проведения реакции, которые сами по себе известны, предпочтительно при специально указанных, при отсутствии или обычно в присутствии растворителей или разбавителей, предпочтительно растворителей или разбавителей, которые являются инертными по отношению к использующимся реагентам и растворяют их, при отсутствии или в присутствии катализаторов, конденсирующих или нейтрализующих реагентов, например ионообменных веществ, таких как катионообменные вещества, например, в Н+-форме, в зависимости от характера реакции и/или реагентов - при пониженной, нормальной или повышенной температуре, например при температуре в диапазоне от примерно -100 до примерно 190 С, предпочтительно от примерно -80 до примерно 150 С, например, от -80 до -60 С, при комнатной температуре, от -20 до 40 С или при температуре кипения, при атмосферном давлении или в герметичном сосуде, если это целесообразно, то под давлением, и/или в инертной атмосфере, например в атмосфере аргона или азота. Растворители, из числа которых можно выбрать растворители, которые пригодны для любой конкретной реакции, включают указанные специально или, например, воду, сложные эфиры, такие как низш. алкил-низш. алканоаты, например этилацетат, простые эфиры, такие как алифатические простые эфиры, например диэтиловый эфир, или циклические простые эфиры, например тетрагидрофуран или диоксан, жидкие ароматические углеводороды, такие как бензол или толуол, спирты, такие как метанол,этанол или 1- или 2-пропанол, нитрилы, такие как ацетонитрил, галогенированные углеводороды, например метиленхлорид или хлороформ, амиды кислот, такие как диметилформамид или диметилацета- 13016446 мид, основания, такие как гетероциклические азотистые основания, например пиридин или Nметилпирролидин-2-он, ангидриды карбоновых кислот, такие как ангидриды низш. алкановых кислот,например уксусный ангидрид, циклические, линейные или разветвленные углеводороды, такие как циклогексан, гексан или изопентан, или их смеси, например, водные растворы, если в описаниях способов не указано иное. Смеси таких растворителей также можно использовать для обработки, например, с помощью хроматографии или распределения. Настоящее изобретение также относится к таким формам способа, в которых соединение, получаемое в качестве промежуточного продукта на любой стадии способа, используется в качестве исходного вещества на остальных стадиях способа, или в которых исходное вещество образуется при условиях проведения реакции или используется в виде производного, например, в защищенной форме или в форме соли, или соединение, получаемое способом, предлагаемым в настоящем изобретении, образуется при условиях проведения способа и далее обрабатывается in situ. В способах, предлагаемых в настоящем изобретении, предпочтительно использовать такие исходные вещества, которые приводят к соединениям формулы (I), описанным как предпочтительные. Особое предпочтение отдается условиям проведения реакции, которые являются такими же или аналогичными тем, которые описаны в примерах. Настоящее изобретение также относится к новым исходным соединениям и промежуточным продуктам, описанным в настоящем изобретении, в особенности к тем, которые приводят к новым соединениям формулы (I) или соединениям формулы (I), описанным, как предпочтительные в настоящем изобретении. Применение в фармацевтике, фармацевтические препараты и методики Как описано выше, соединения формулы (I) являются ингибиторами активности ренина и поэтому могут использоваться для лечения гипертензии, атеросклероза, нестабильного коронарного синдрома,застойной сердечной недостаточности, гипертрофии сердца, фиброза сердца, послеинфарктной кардиомиопатии, нестабильного коронарного синдрома, диастолической дисфункции, хронического заболевания почек, фиброза печени, осложнений после диабета, таких как нефропатия, васкулопатия и нейропатия, заболеваний коронарных сосудов, рестеноза после ангиопластики, повышенного внутриглазного давления, глаукомы, аномального роста сосудов и/или гиперальдостеронизма, и/или другого ухудшения познавательной способности, болезни Альцгеймера, слабоумия, тревожных состояний и нарушений познавательной способности и т.п. Гипертензия, являющаяся по меньшей мере одним компонентом подвергающегося лечению заболевания, является особенно предпочтительной и это означает, что можно лечить (профилактически и/или терапевтически) гипертензию по отдельности или в сочетании с одним или большим количеством (в особенности указанных) других заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, включающим терапевтически эффективное количество фармакологически активного соединения формулы (I) по отдельности или в комбинации с одним или большим количеством фармацевтически приемлемых носителей. Фармацевтическими композициями, предлагаемыми в настоящем изобретении, являются пригодные для энтерального, такого как пероральное или ректальное, чрескожное, или парентерального введения млекопитающим, включая человека, для ингибирования активности ренина и для лечения патологических состояний, связанных с (в особенности неподходящей) активностью ренина. Такие патологические состояния включают гипертензию, атеросклероз, нестабильный коронарный синдром, застойную сердечную недостаточность, гипертрофию сердца, фиброз сердца, послеинфарктную кардиомиопатию,нестабильный коронарный синдром, диастолическую дисфункцию, хроническое заболевание почек,фиброз печени, осложнения после диабета, такие как нефропатия, васкулопатия и нейропатия, заболевания коронарных сосудов, рестеноз после ангиопластики, повышенное внутриглазное давление, глаукому,аномальный рост сосудов и/или гиперальдостеронизм, и/или также ухудшение познавательной способности, болезнь Альцгеймера, слабоумие, тревожные состояния и нарушения познавательной способности и т.п. Особенно предпочтительным является заболевание, которое включает гипертензию, более предпочтительно сама гипертензия, когда лечение фармацевтической композицией или применение соединения формулы (I) для ее синтеза применимо профилактически и/или (предпочтительно) терапевтически. Таким образом, фармакологически активные соединения формулы (I) можно использовать для приготовления фармацевтических композиций, включающих эффективное количество этих соединений совместно или в смеси с инертными наполнителями или носителями, пригодными для энтерального или парентерального введения. Предпочтительными являются таблетки и желатиновые капсулы, включающие активный ингредиент совместно с:b) смазывающими веществами, например диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; для таблеток также сc) связующими, например алюмосиликатом магния, крахмальной пастой, желатином, трагакантовой камедью, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и/или поливинилпирролидоном; при необходимости сd) разрыхлителями, например крахмалами, агаром, альгиновой кислотой или ее натриевой солью или шипучими смесями; и/илиe) абсорбентами, красителями, ароматизаторами и подсластителями. Композиции для инъекций предпочтительно представляют собой изотонические водные растворы или суспензии, а суппозитории предпочтительно готовить из эмульсий или суспензий жиров. Указанные композиции можно стерилизовать и/или включать вспомогательные вещества, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, стимуляторы растворения, соли для регулирования осмотического давления и/или буферы. Кроме того, они также могут содержать другие терапевтически ценные вещества. Указанные композиции готовят по обычным методикам смешивания, гранулирования или нанесения покрытий соответственно и они содержат примерно 0,175%, предпочтительно примерно 1-50% активного ингредиента. Композиции, подходящие для чрескожного введения, включают терапевтически эффективное количество соединения, предлагаемого в настоящем изобретении, с носителем. Предпочтительные носители включают впитывающиеся фармакологически приемлемые растворители, содействующие проникновению через кожу пациента. Чрескожные устройства обычно представляют собой повязки, включающие защитный элемент, резервуар, содержащий соединение, необязательно с носителями, необязательно регулирующий скорость барьерный элемент для доставки соединения через кожу пациента с регулируемой и заранее заданной скоростью в течение продолжительного периода времени, и средства закрепления устройства на коже. Соответственно настоящее изобретение относится к фармацевтическим композициям, описанным выше, предназначенным для лечения патологических состояний, опосредуемых активностью ренина,предпочтительно гипертензии, атеросклероза, нестабильного коронарного синдрома, застойной сердечной недостаточности, гипертрофии сердца, фиброза сердца, послеинфарктной кардиомиопатии, нестабильного коронарного синдрома, диастолической дисфункции, хронического заболевания почек, фиброза печени, осложнений после диабета, таких как нефропатия, васкулопатия и нейропатия, заболеваний коронарных сосудов, рестеноза после ангиопластики, повышенного внутриглазного давления, глаукомы,аномального роста сосудов и/или гиперальдостеронизма, и/или также ухудшения познавательной способности, болезни Альцгеймера, слабоумия, тревожных состояний и нарушений познавательной способности, а также к способам их применения. Фармацевтические композиции могут содержать терапевтически эффективное количество соединения формулы (I), определенного в настоящем изобретении, по отдельности или в комбинации с другим терапевтическим средством, например, каждое в терапевтически эффективной дозе, которую указывают в данной области техники. Такие терапевтические средства включают:a) противодиабетические средства, такие как инсулин, производные и миметики инсулина; средства, усиливающие секрецию инсулина, такие как сульфонилмочевины, например глипизид, глибурид и амарил; лиганды инсулинотропного сульфонилмочевинового рецептора, такие как меглитиниды, например, натеглинид и репаглинид; лиганды активированного рецептора пролифератора пероксисом (PPAR); ингибиторы протеинтирозинфосфатазы-1 В (РТР-1 В), такие как РТР-112; ингибиторы GSK3 (гликогенсинтазыкиназы-3), такие как SB-517955, SB-4195052, SB-216763, NN-57-05441 и NN-57-05445; лигандыRXR, такие как GW-0791 и AGN-194204; ингибиторы натрийзависимого сопереносчика глюкозы, такие как Т-1095; ингибиторы гликогенфосфорилазы А, такие как BAY R3401; бигуаниды, такие как метформин; ингибиторы альфа-глюкозидазы, такие как акарбоза; GLP-1 (глюкагоноподобный пептид-1), аналоги GLP-1, такие как миметики эксендина-4 и GLP-1; и ингибиторы DPPIV (дипептидилпептидазы IV),такие как LAF237;b) гиполипидемические средства, такие как ингибиторы редуктазы 3-гидрокси-3-метилглутарилкофермента A (HMG-COA), например ловастатин, питавастатин, симвастатин, правастатин, церивастатин, мевастатин, велостатин, флувастатин, далвастатин, аторвастатин, росувастатин и ривастатин; ингибиторы скваленсинтазы; лиганды FXR (фарнезоидного рецептора X) и LXR (рецептора печени X); холестирамин; фибраты; никотиновая кислота и аспирин;d) гипотензивные средства, например петлевые диуретики, такие как этакриновая кислота, фуросемид и торсемид; ингибиторы агиотензинконвертирующего фермента (АСЕ), такие как беназеприл, каптоприл, эналаприл, фосиноприл, лизиноприл, моэксиприл, периндоприл, хинаприл, рамиприл и трандолаприл; ингибиторы Na-K-АТФазного мембранного насоса, такие как дигоксин; ингибиторы нейтральной эндопептидазы (NEP); ингибиторы ACE/NEP, такие как омапатрилат, сампатрилат и фасидотрил; антагонисты ангиотензина II, такие как кандесартан, эпросартан, ирбесартан, лосартан, телмисартан и валсартан, предпочтительно валсартан; блокаторы -адренергического рецептора, такие как ацебутолол,атенолол, бетаксолол, бисопролол, метопролол, надолол, пропранолол, соталол и тимолол; инотропные средства, такие как дигоксин, добутамин и мирлинон; блокаторы кальциевых каналов, такие как амлодипин, бепридил, дилтиазем, фелодипин, никардипин, нимодипин, нифедимин, нисолдипин и верапамил; антагонисты альдостеронового рецептора и ингибиторы альдостеронсинтазы. Другие специфические противодиабетические соединения описаны в публикации Patel Mona in Expert Opin Investig Drugs, 2003, 12(4), 623-633, на фиг. 1-7, которые включены в настоящее изобретение в качестве ссылки. Соединение формулы (I) можно вводить одновременно с другим активным ингредиен- 15016446 том, до или после него, отдельно с помощью того же или другого пути введения или совместно в той же фармацевтической композиции. Структуры терапевтических средств, указанных с помощью кодовых номеров, родовых или торговых названий, приведены в последнем издании справочника "The Merck Index" или в базах данных, например, Patents International (например, IMS World Publications). Соответственно настоящее изобретение относится к фармацевтическим композициям, включающим терапевтически эффективное количество соединения формулы (I) по отдельности или в комбинации с терапевтически эффективным количеством другого терапевтического средства, предпочтительно выбранного из группы, включающей противодиабетические средства, гиполипидемические средства, средства против ожирения и гипотензивные средства, наиболее предпочтительно из группы, включающей противодиабетические средства, гипотензивные средства и гиполипидемические средства, описанные выше. Настоящее изобретение также относится к фармацевтическим композициям, описанным выше,предназначенным для применения в качестве лекарственного средства. Настоящее изобретение также относится к применению фармацевтических композиций или комбинаций, описанных выше, для приготовления лекарственного средства, предназначенного для лечения патологических состояний, опосредуемых (в особенности неподходящей) активностью ренина, предпочтительно гипертензии, атеросклероза, нестабильного коронарного синдрома, застойной сердечной недостаточности, гипертрофии сердца, фиброза сердца, послеинфарктной кардиомиопатии, нестабильного коронарного синдрома, диастолической дисфункции, хронического заболевания почек, фиброза печени,осложнений после диабета, таких как нефропатия, васкулопатия и нейропатия, заболеваний коронарных сосудов, рестеноза после ангиопластики, повышенного внутриглазного давления, глаукомы, аномального роста сосудов и/или гиперальдостеронизма, и/или также ухудшения познавательной способности, болезни Альцгеймера, слабоумия, тревожных состояний и нарушений познавательной способности и т.п. Таким образом, настоящее изобретение также относится к соединению формулы (I), предназначенному для применения в качестве лекарственного средства, к применению соединения формулы (I) для приготовления фармацевтической композиции, предназначенной для предупреждения и/или лечения патологических состояний, опосредуемых (в особенности неподходящей) активностью ренина, и к фармацевтической композиции, предназначенной для применения при патологических состояниях, опосредуемых (в особенности неподходящей) активностью ренина, включающей соединение формулы (I) или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым разбавителем или носителем. Настоящее изобретение также относится к способу предупреждения и/или лечения патологических состояний, опосредуемых (в особенности неподходящей) активностью ренина, который включает введение терапевтически эффективного количества соединения формулы (I) теплокровному животному, предпочтительно человеку, нуждающемуся в таком лечении. Разовая доза для млекопитающего массой примерно 50-70 кг может содержать примерно от 1 до 1000 мг, предпочтительно примерно 5-600 мг активного ингредиента. Терапевтически эффективная доза активного соединения зависит от вида теплокровного животного (предпочтительно млекопитающего,более предпочтительно человека), массы тела, возраста и индивидуального состояния, от формы введения и от использующегося соединения. В соответствии с вышеизложенным настоящее изобретение также относится к терапевтической комбинации, например набору, набору средств, например, предназначенному для применения в любом способе, определенном в настоящем изобретении, включающему соединение формулы (I) или его фармацевтически приемлемую соль, предназначенному для применения одновременно или последовательно по меньшей мере с одной фармацевтической композицией, включающей по меньшей мере другое терапевтическое средство, предпочтительно выбранное из группы, включающей противодиабетические средства, гиполипидемические средства, средства против ожирения и гипотензивные средства. Набор может содержать инструкции для его введения. Аналогичным образом, настоящее изобретение относится к набору средств, включающему: (i) фармацевтическую композицию, включающую соединение формулы (I), предлагаемое в настоящем изобретении; и (ii) фармацевтическую композицию, включающую соединение, выбранное из группы, включающей противодиабетическое средство, гиполипидемическое средство, средство против ожирения, гипотензивное средство, или его фармацевтически приемлемую соль, в виде двух отдельных лекарственных форм компонентов (i), (ii). Аналогичным образом, настоящее изобретение также относится к способу, определенному выше,включающую совместное ведение, например одновременное или последовательное, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и, по меньшей мере, второго лекарственного вещества, указанное второе лекарственное вещество предпочтительно представляет собой противодиабетическое средство, гиполипидемическое средство, средство против ожирения или гипотензивное средство, например, указанное выше. Соединение, предлагаемое в настоящем изобретении, предпочтительно вводить нуждающемуся в- 16016446 нем млекопитающему. Соединение, предлагаемое в настоящем изобретении, предпочтительно применять для лечения заболевания, при котором обнаруживается реакция на модуляцию (в особенности неподходящей) активности ренина, предпочтительно одного или большего количества конкретных заболеваний, указанных выше. В заключение отметим, что настоящее изобретение относится к способу или применению, которое включает введение соединения формулы (I) в комбинации с терапевтически эффективным количеством противодиабетического средства, гиполипидемического средства, средства против ожирения или гипотензивного средства. В конечном счете настоящее изобретение относится к способу или применению, которое включает введение соединения формулы (I) в виде фармацевтической композиции, как это описано в настоящем изобретении. Указанные выше характеристики можно продемонстрировать с помощью исследований in vitro и invivo, предпочтительно с использованием млекопитающих, например мышей, крыс, кроликов, собак,обезьян, или изолированных органов, тканей и приготовленных из них препаратов. Указанные соединения можно использовать in vitro в виде растворов, например предпочтительно водных растворов, и invivo, энтерально, парентерально, предпочтительно внутривенно, например, в виде суспензии или в водном растворе. Концентрация in vitro может меняться примерно от 10-3 до 10-10 М. Терапевтически эффективное количество in vivo в зависимости от пути введения может меняться примерно от 0,001 до 500 мг/кг, предпочтительно примерно от 0,1 до 100 мг/кг. Как описано выше, соединения, предлагаемые в настоящем изобретении, обладают способностью ингибировать ферменты. В частности, они ингибируют воздействие природного фермента ренина. Ренин поступает из почек в кровь, где он влияет на расщепление ангиотензиногена, выделяющего декапептид ангиотензин I, который затем расщепляется в легких, почках и других органах с образованием октапептида ангиотензина II. Этот октапептид повышает артериальное давление как непосредственно путем сужения сосудов, так и косвенно, путем высвобождения удерживающего ионы натрия гормона альдостерона из надпочечников с одновременным увеличением объема внеклеточной жидкости, и это увеличение можно приписать воздействию ангиотензина II. Ингибиторы ферментативной активности ренина приводят к уменьшению образования ангиотензина I, вследствие чего продуцируется меньшее количество ангиотензина II. Снижение концентрации этого активного пептидного гормона является непосредственной причиной гипотензивного воздействия ингибиторов ренина. Воздействие ингибиторов ренина, в частности, можно продемонстрировать экспериментально с помощью исследований in vitro, при которых определяют уменьшение образования ангиотензина I в различных системах (плазме человека с использованием очищенного ренина человека совместно с синтетическим или натуральным субстратом ренина). В частности, можно использовать описанные ниже исследования in vitro. 1. Рекомбинантный ренин человека (экспрессированный в клетках яичников китайского хомячка и очищенный по стандартным методикам) при концентрации 7,5 нМ инкубируют с исследуемым соединением при различных концентрациях в течение 1 ч при КТ в буфере 0,1 М Tris-HCl(Tris=[трис(гидроксиметиламинометан)]) рН 7,4, содержащем 0,05 М NaCl, 0,5 мМ ЭДТК (этилентетрауксусная кислота) и 0,05% ХЛАПС [3-3-холамидопропил)диметиламмоний)-1-пропансульфоновая кислота]. Синтетический пептидный субстрат Arg-Glu(EDANS)-Ile-His-Pro-Phe-His-Leu-Val-IleHisThrLys(DABCYL)-Arg9 прибавляют до конечной концентрации, равной 2 мкМ, и с помощью спектрофлуориметра для планшетов для микротитрования регистрируют усиление флуоресценции при длине волны возбуждения, равной 350 нм, и длине волны испускания, равной 500 нм. Значения IC50 рассчитывают по зависимости выраженного в процентах ингибирования активности ренина от концентрации исследуемого соединения (исследование резонансного переноса энергии флуоресценции, FRET). В этом исследовании соединения формулы (I) предпочтительно могут обладать значениями IC50 в диапазоне от 1 нМ до 20 мкМ. 2. Альтернативно, рекомбинантный ренин человека (экспрессированный в клетках яичников китайского хомячка и очищенный по стандартным методикам) при концентрации 0,5 нМ инкубируют с исследуемым соединением при различных концентрациях в течение 2 ч при 37 С в буфере 0,1 М Tris-HCl, pH 7,4, содержащем 0,05 М NaCl, 0,5 мМ ЭДТК и 0,05% ХЛАПС. Синтетический пептидный субстрат ArgGlu(EDANS)-Ile-His-Pro-Phe-His-Leu-Val-IleHisThr-Lys(DABCYL)-Arg9 прибавляют до конечной концентрации, равной 4 мкМ, и с помощью спектрофлуориметра для планшетов для микротитрования регистрируют усиление флуоресценции при длине волны возбуждения, равной 340 нм, и длине волны испускания, равной 485 нм. Значения IC50 рассчитывают по зависимости выраженного в процентах ингибирования активности ренина от концентрации исследуемого соединения (исследование резонансного переноса энергии флуоресценции, FRET). В этом исследовании соединения формулы (I) предпочтительно могут обладать значениями IC50 в диапазоне от 1 нМ до 20 мкМ. 3. В другом исследовании плазму человека, к которой прибавлен рекомбинантный ренин человека(экспрессированный в клетках яичников китайского хомячка и очищенный по стандартным методикам)- 17016446 при концентрации 0,8 нМ инкубируют с исследуемым соединением при различных концентрациях в течение 2 ч при 37 С в 0,1 М Tris/HCl pH 7,4, содержащем 0,05 М NaCl, 0,5 мМ ЭДТК и 0,025% (мас./об.) ХЛАПС. Синтетический пептидный субстрат Ac-Ile-His-Pro-Phe-His-Leu-Val-Ile-His-Asn-Lys-[DY-505X5] прибавляют до конечной концентрации, равной 2,5 мкМ. Ферментативную реакцию останавливают путем прибавления избытка блокирующего ингибитора. Продукт реакции отделяют с помощью капиллярного электрофореза и количественно определяют с помощью спектрофотометрии при длине волны,равной 505 нм. Значения IC50 рассчитывают по зависимости выраженного в процентах ингибирования активности ренина от концентрации исследуемого соединения. В этом исследовании соединения формулы (I) предпочтительно могут обладать значениями IC50 в диапазоне от 1 нМ до 20 мкМ. 4. В другом исследовании рекомбинантный ренин человека (экспрессированный в клетках яичников китайского хомячка и очищенный по стандартным методикам) при концентрации 0,8 нМ инкубируют с исследуемым соединением при различных концентрациях в течение 2 ч при 37 С в 0,1 М Tris/HClpH 7,4, содержащем 0,05 М NaCl, 0,5 мМ ЭДТК и 0,025% (мас./об.) ХЛАПС. Синтетический пептидный субстрат Ac-Ile-His-Pro-Phe-His-Leu-Val-Ile-His-Asn-Lys-[DY-505-X5] прибавляют до конечной концентрации, равной 2,5 мкМ. Ферментативную реакцию останавливают путем прибавления избытка блокирующего ингибитора. Продукт реакции отделяют с помощью капиллярного электрофореза и количественно определяют с помощью спектрофотометрии при длине волны, равной 505 нм. Значения IC50 рассчитывают по зависимости выраженного в процентах ингибирования активности ренина от концентрации исследуемого соединения. В этом исследовании соединения формулы (I) предпочтительно могут обладать значениями IC50 в диапазоне от 1 нМ до 20 мкМ. У животных с дефицитом хлорида натрия ингибиторы ренина снижают артериальное давление. Ренин человека может отличаться от ренина других видов. Для проверки ингибиторов ренина человека можно использовать приматов, например обезьян (Callithrix jacchus), поскольку ренин человека и ренин приматов в основном гомологичны в ферментативно активной области. В частности, можно использовать следующие исследования in vivo. Соединения формулы (I) можно исследовать in vivo на приматах, как описано в литературе (см., например, Schnell C.R. et al. Measurement of blood pressure и heart rate by telemetry in conscious, unrestrainedProceedings of the fifth FELASA symposium: Welfare and Science. Eds BRIGHTON, 1993. Согласно изобретению было установлено, что новые соединения, кроме того, что они являются активными ингибиторами ренина, обладают улучшенной биологической доступностью. Биологическая доступность предпочтительно равна или больше 20%, более предпочтительно равна или больше 30%. Биологическую доступность можно определить следующим образом. Фармакокинетические профили исследуют с использованием самцов крыс Sprague-Dawley, в яремную вену которых вставлены катетеры. Соединения вводят перорально в 0,5% водном растворе метилцеллюлозы или внутривенно в N-метилпирролидинон-PEG200 (10:90, об./об.). Типичные дозы равны 6 мг/кг перорально и 2 мг/кг внутривенно соответственно. Пробы крови периодически отбирают через вставленные в вену катетеры в гепаринизированные пробирки в разные моменты времени вплоть до 32 ч после введения дозы и плазму отделяют центрифугированием. Концентрации в плазме соединений, описанных в настоящем изобретении, определяют с помощью жидкостной хроматографии - тандемной массспектрометрии после экстракции ацетонитрилом. Фармакокинетические параметры рассчитывают по неблочной методике. Аббревиатуры. Температуры приведены в градусах Цельсия. Если не указано иное, то реакции протекают при КТ. Если не указано иное, то реакции гидрирования в присутствии Н 2 протекают при атмосферном давлении. Обработку с помощью микроволнового излучения проводят с использованием прибора "Biotage Initiator 60". Условия проведения ВЭЖХ А. Колонка: CombiScreen ODS-AM, 504,6 мм. Скорость потока: 2,0 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: сначала линейный градиентный режим от 5 до 100% В в течение 5 мин, затем 100% В в течение 2 мин. Детектирование: УФ при 215 нм. Условия проведения ВЭЖХ В. Колонка: ACQUITY UPLC ВЕН С 18 1,7 мкм, 502,1 мм. Скорость потока: 0,5 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: сначала 5% В в течение 0,5 мин, затем линейный градиентный режим от 5 до 100% В в течение 1,5 мин, затем 100% В в течение 1,0 мин. Детектирование: УФ при 215 нм. Условия проведения ВЭЖХ С. Колонка: ACQUITY UPLC ВЕН С 18 1,7 мкм, 502,1 мм. Скорость потока: 0,5 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: 5% В в течение 0,5 мин, затем линейный градиентный режим от 5 до 100% В в течение 5,0 мин, затем 100% В в течение 1,5 мин. Детектирование: УФ при 215 нм. Условия проведения ТСХ: значения Rf для ТСХ измеряют с использованием пластин для ТСХ размером 510 см с силикагелем F254, Merck, Darmstadt, Germany. Методики получения соединений формулы (I) подробно описаны ниже. Следует отметить, что краткие описания около стрелок для каждого превращения приведены с целью иллюстрации и их не следует- 19016446 считать ограничивающими как для всей последовательности реакций, так и для каждой отдельной стадии. Схема 1 а Схема 3 (получение циклического ангидрида, указанного в качестве исходного вещества на схемах 1 а и 1b)(15 мл) нагревают в микроволновой печи при 120 С в течение 2 ч. Растворитель выпаривают и получают остаток, который подвергают распределению между этилацетатом и насыщенным водным растворомNaHCO3. Органическую фазу промывают рассолом, сушат над Na2SO4, фильтруют, выпаривают и получают светло-желтое твердое вещество. МС (ЖХ-МС): 196 [М+Н]+. ТСХ, Rf (этилацетат/гексан 1:1)=0,56. В. Диметиловый эфир пиперидин-3,5-дикарбоновой кислоты Раствор диметилового эфира пиперидин-3,5-дикарбоновой кислоты (5,4 г, 26,8 ммоль) в CH2Cl2 (55 мл) обрабатывают с помощью Вос 2 О (6,4 г, 29,5 ммоль) и реакционную смесь перемешивают при КТ в течение ночи. Реакцию останавливают 0,1 н. водным раствором HCl и органическую фазу промывают 0,1 н. водным раствором HCl. Объединенные водные фазы 2 раза экстрагируют смесью CH2Cl2/МеОН(9/1), затем объединенные органические фазы сушат над Na2SO4, фильтруют и выпаривают. Полученный остаток очищают с помощью флэш-хроматографии на силикагеле (элюент: CH2Cl2/МеОН 95:5) и получают искомое соединение в виде желтого твердого вещества. МС (ЖХ-МС): 302 [М+Н]+. ТСХ, Rf(6,8 г, 22,5 ммоль) в смеси МеОН/вода (4:1, 120 мл) добавляют K2CO3 (9,4 г, 68 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение ночи. МеОН выпаривают и остаток экстрагируют дихлорметаном и 1 н. водным раствором HCl. Органическую фазу сушат над Суспензию 1-трет-бутилового эфира пиперидин-1,3,5-трикарбоновой кислоты (1 г, 3,6 ммоль) в уксусном ангидриде (20 мл) кипятят с обратным холодильником в течение 2 ч. Реакционную смесь 3 раза выпаривают с толуолом, затем сушат в высоком вакууме при КТ в течение ночи и получают желтое твердое вещество. МС (ЖХ-МС): 278 [M+Na]+. К раствору (3S,5R)-изомера исходного вещества F (ЭИ (энантиомерный избыток) 67%) (47 г, 162 ммоль) в горячем EtOH (162 мл) при 80 С добавляют (S)-(-)-1-фенилэтиламин (20,6 мл, 162 ммоль). Раствор охлаждают до КТ и выдерживают в течение ночи, в результате чего соль выпадает в осадок. Соль собирают фильтрованием. Перекристаллизацию из EtOH таким же образом повторяют 3 раза, затем полученную соль растворяют в воде, подкисляют 5 н. и 1 н. растворами HCl и экстрагируют с помощьюAcOEt. Объединенные органические фазы промывают рассолом и сушат над MgSO4. Концентрирование при пониженном давлении дает (3S,5R)-изомер исходного вещества F: бесцветные кристаллы; ЭР-МС: М+Н=288: BtRet=2,67 мин. Хиральная ВЭЖХ (колонка: CHIRALPAH AD-H (0,4625 см), элюент: гексан/iPrOH/0,1% ТФК=95/5, скорость потока: 0,5 мл/мин, детектирование: УФ 210 нм, температура: КТ) tR=37 мин. К раствору исходного вещества Е (401,5 мг, 1,57 ммоль) и имеющегося в продаже (DHQD)2AQN(423,6 мг, 0,47 ммоль, чистота 95%)а в Et2O (60 мл) и ТГФ (20 мл) в атмосфере N2 при -40 С добавляют МеОН (0,64 мл, 15,67 ммоль). После перемешивания при такой же температуре в течение 24 ч добавляют насыщенный водный раствор лимонной кислоты. Реакционную смесь экстрагируют этилацетатом (ЭА). Органическую фазу промывают рассолом, сушат над Na2SO4 и очищают с помощью хроматографии на диоксиде кремния и получают (3S,5R)-изомер исходного вещества F с ЭИ 98% в виде белого аморфного вещества ЭР-МС: M+H-tBu=232; ВЭЖХ: CtRet=2,73 мин. Хиральная ВЭЖХ (колонка: CHIRALPAH AD-H К раствору (3R,5S)-изомера исходного вещества F (ЭИ 72%) (4,2 г, 14,6 ммоль) в горячем EtOH (20 мл) при 70 С добавляют (R)-1-фенилэтиламин (1,79 г, 14,76 ммоль). Раствор охлаждают до КТ и выдерживают в течение 1 ч, в результате чего соль выпадает в осадок. Соль собирают фильтрованием. Перекристаллизацию из EtOH таким же образом повторяют 3 раза, затем полученную соль растворяют в воде,подкисляют 1 М водным раствором HCl и 5 раз экстрагируют эфиром. Объединенные органические фазы промывают рассолом и сушат над MgSO4. Концентрирование при пониженном давлении дает (3R,5S)изомер исходного вещества F: бесцветные кристаллы; ЭР-МС: М+Н=288: BtRet=2,67 мин. Хиральная ВЭЖХ: AD-H, 5% i-PrOH/гексан, скорость потока 0,5 мл/мин, 210 нм, tRet=33 мин (для изомера, присутствующего в наибольшем количестве), 36 мин (для изомера, присутствующего в наименьшем количестве). К раствору исходного вещества Е (200 мг, 0,78 ммоль) в ТГФ (10 мл) и эфире (30 мл) в атмосфереN2 при 0 С добавляют (DHQ)2AQN (67 мг, 0,08 ммоль) и МеОН (0,32 мл). Полученную смесь перемешивают при 0 С в течение 5 ч. После добавления 1 М водного раствора HCl смесь экстрагируют с помощьюEtOAc. Органические фазы промывают рассолом и сушат над MgSO4. Концентрирование при пониженном давлении и очистка с помощью хроматографии на силикагеле дает (3R,5S)-изомер исходного вещества F; ЭР-МС: М+Н=288: CtRet=2,67 мин. Хиральная ВЭЖХ: ЭИ 72%, AD-H, 5% i-PrOH/гексан, скорость потока 0,5 мл/мин, 210 нм, tRet=33 мин (для изомера, присутствующего в наибольшем количестве), 36 мин (для изомера, присутствующего в наименьшем количестве).(3S,4R,5R)-N-трет-бутоксикарбонил-4 гидроксипиперидин-3,5-дикарбоновой кислоты (ЭИ 96%) (78 г, 0,26 моль) растворяют в МеОН (500 мл) и при комнатной температуре добавляют (S)-(-)1-фенилэтиламин (33 мл, 0,26 моль). Смесь перемешива- 23016446 ют при комнатной температуре в течение 30 мин и концентрируют при пониженном давлении, получают соль в виде бесцветного аморфного вещества. Полученный остаток при 70 С растворяют в CH3CN (1,3 л) и интенсивно перемешивают при комнатной температуре в течение 20 ч. Белую кристаллическую соль собирают фильтрованием и промывают с помощью Et2O. Перекристаллизацию таким же образом (растворение в CH3CN и перемешивание при комнатной температуре) повторяют 2 или 3 раза, затем полученную соль растворяют в воде, подкисляют до рН 3 5 н. и 1 н. растворами HCl и экстрагируют с помощью AcOEt. Объединенные органические фазы сушат над Na2SO4. Концентрирование при пониженном давлении дает энантиомерно чистый (3R,4S,5S)-изомер исходного вещества G в виде белого твердого вещества; ЭР-МС: М+Н=304: CtRet=2,37 мин. Хиральная ВЭЖХ: ЭИ 99,9%, AD-H, 7,5% iPrOH/гексан/0,1% ТФК, скорость потока 0,75 мл/мин, 210 нм, tRet=24 мин. К раствору 3-метилового эфира 1-трет-бутилового эфира (3R,4S,5S)-4-гидроксипиперидин-1,3,5 трикарбоновой кислоты (18 г, Liang, X.; Lohse, A.; Bols, M.J. Org. Chem. 2000, 65, 7432.) в фосфатном буфере (0,2 М, рН 7,5, 540 мл) при комнатной температуре добавляют Lipase M (Mucor javanicus) (5,4 г). Реакционную смесь перемешивают при 35 С в течение 6 дней и затем подкисляют до рН 3 5 н. и 1 н. растворами HCl. Смесь экстрагируют с помощью EtOAc и органические фазы сушат над Na2SO4. Концентрирование при пониженном давлении дает (3R,4S,5S)-изомер исходного вещества G в виде белого твердого вещества; ЭР-МС: М+Н=304: CtRet=2,37 мин. Хиральная ВЭЖХ: ЭИ 95,8%, AD-H, 7,5% iPrOH/гексан/0,1% ТФК, скорость потока 0,75 мл/мин, 210 нм, tRet=24 мин для (3R,4S,5S)-изомера, 26 мин для (3S,4R,5R)-изомера. Пример 1 Смесь промежуточного продукта 1.1 (70 мг, 0,125 ммоль) и 4 н. раствора HCl в диоксане (2 мл) перемешивают при комнатной температуре. После перемешивания в течение 1 ч реакционную смесь концентрируют в вакууме и получают соединение примера 1; ЭР-МС: М+Н=459: CtRet=3,26 мин. Промежуточный продукт 1.1 К раствору промежуточного продукта 1.4 (27 мг, 0,150 ммоль) и промежуточного продукта 1.2 (50 мг, 0,125 ммоль) в CH2Cl2 добавляют BopCl (47 мг, 0,188) и Et3N (19 мг, 0,188 ммоль). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь разбавляют с помощью Н 2 О (10 мл) и экстрагируют с помощью EtOAc (50 мл). Органическую фазу последовательно промывают 5% водным раствором NaHCO3 с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 1.1 в виде белого аморфного вещества; ЭР-МС: М+Н=559; ВЭЖХ: CtRet=4,23 мин. Промежуточный продукт 1.2 К раствору промежуточного продукта 1.3 (450 мг, 1,09 ммоль) в смеси ТГФ/Н 2 О (5/5 мл) при 0 С добавляют LiOHH2O (84 мг, 2 ммоль). После перемешивания при такой же температуре в течение 1 ч реакцию останавливают 5% водным раствором KHSO4 (20 мл) и смесь экстрагируют с помощью EtOAc(200 мл). Органическую фазу промывают с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают промежуточный продукт 1.2 в виде белого аморфного вещества; ЭР-МС: М+Н=401: CtRet=3,30 мин. Промежуточный продукт 1.3 Промежуточный продукт 1.3 синтезируют по реакции сочетания промежуточного продукта 1.7 с(3S,5R)-изомером исходного вещества F аналогично получению промежуточного продукта 1.1; ЭР-МС: М+Н=415: CtRet=3,69 мин. Промежуточный продукт 1.4 К раствору промежуточного продукта 1.5 (230 мг, 1,20 ммоль) в CH2Cl2 (10 мл) при 0 С добавляютEt3SiH (728 мг, 6,26 ммоль) и ТФК (1,48 г, 12,9 ммоль), затем смесь перемешивают при комнатной температуре. После перемешивания в течение 15 ч реакционную смесь концентрируют в вакууме. Остаток суспендируют в 5% водном растворе NaHCO3 и экстрагируют с помощью CH2Cl2. Органическую фазу промывают с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и полученный остаток очищают с помощью колоночной хроматографии на SiO2 и получают промежуточный продукт 1.4 в виде белого аморфного вещества; ЭР-МС: М+Н=177; ВЭЖХ: CtRet=2,24 мин. Промежуточный продукт 1.5 К раствору промежуточного продукта 1.6 (300 мг, 1,45 ммоль) в ТГФ (10 мл) при 0 С добавляютMeLi (1 M раствор в Et2O, 7,25 ммоль), затем смесь перемешивают при комнатной температуре. После перемешивания в течение 1 ч реакционную смесь охлаждают до 0 С и реакцию останавливают 5% водным раствором NaHCO3 (50 мл). Затем реакционную смесь экстрагируют с помощью EtOAc (200 мл). Органическую фазу промывают с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме, получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 1.5 в виде белого аморфного вещества; ЭР-МС: М+Н=193; ВЭЖХ: CtRet=1,74 мин. Промежуточный продукт 1.6 К раствору этилового эфира 6-хлорникотиновой кислоты (1 г, 5,4 ммоль) в NMP (10 мл) при комнатной температуре добавляют циклопропиламин (4,12 г, 72,2 ммоль) и K2CO3 (2,2 г, 16 ммоль), затем смесь перемешивают при 70 С. После перемешивания в течение 12 ч реакционную смесь охлаждают до комнатной температуры и реакцию останавливают с помощью Н 2 О (100 мл). Реакционную смесь экстрагируют с помощью EtOAc (200 мл). Органическую фазу промывают с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который перекристаллизовывают из смеси н-гексан/Et2O, и получают промежуточный продукт 1.6 в виде белого аморфного вещества; ЭР-МС: М+Н=207; ВЭЖХ: CtRet=1,98 мин. Промежуточный продукт 1.7 Промежуточный продукт 1.7 синтезируют путем удаления защитной группы из промежуточного продукта 1.8 аналогично получению соединения примера 1; ЭР-МС: М+Н=146: BtRet=1,32 мин. Промежуточный продукт 1.8 К раствору Boc-D-лейцинола (277,9 мг, 1,278 ммоль) в ДМФ (5 мл) в атмосфере N2 при 0 С добавляют NaH (80,3 мг 60 мас.% в минеральном масле, 2,00 ммоль). После перемешивания при такой же температуре в течение нескольких минут добавляют EtI (0,122 мл, 1,53 ммоль). Полученный раствор перемешивают при КТ в течение 2 ч. Реакцию останавливают с помощью Н 2 О, смесь экстрагируют с помощью EtOAc и сушат над Na2SO4. Концентрирование при пониженном давлении дает неочищенный продукт. Неочищенный продукт очищают с помощью хроматографии на силикагеле и получают промежуточный продукт 1.8; ЭР-МС: М+Н-Вос=146: BtRet=2,11 мин. Пример 2 Раствор промежуточного продукта 2.1 (194,2 мг, 0,33 ммоль) в 4 н. растворе HCl в EtOAc (3 мл) в атмосфере N2 перемешивают при КТ в течение 35 мин. Концентрирование при пониженном давлении дает соединение примера 2 в виде белого аморфного вещества; ЭР-МС: М+Н=485: CtRet=3,08 мин. Промежуточный продукт 2.1 К раствору промежуточного продукта 2.2 (153,8 мг, 0,356 ммоль) в CH2Cl2 (5 мл) в атмосфере N2 при КТ добавляют EDClHCl (95 мг, 0,42 ммоль) и HOAt (70 мг, 0,51 ммоль). Полученный раствор перемешивают при такой же температуре в течение 15 мин. Затем при 0 С медленно добавляют раствор промежуточного продукта 2.4 (73 мг, 0,35 ммоль) и триэтиламина (0,25 мл, 1,78 ммоль) в CH2Cl2 (3 мл). Раствор перемешивают при КТ в течение 60 мин. Концентрирование при пониженном давлении дает неочищенный остаток, который очищают с помощью хроматографии на силикагеле, и получают промежуточный продукт 2.1 в виде белого аморфного вещества; ЭР-МС: М=585; ВЭЖХ: CtRet=4,78 мин. К раствору промежуточного продукта 2.3 (160 мг, 0,359 ммоль) в смеси ТГФ/Н 2 О (5/5 мл) при 0 С добавляют LiOHH2O (29 мг, 0,691 ммоль). После перемешивания при такой же температуре в течение 1 ч реакцию останавливают 5% водным раствором KHSO4 (20 мл) и смесь экстрагируют с помощьюCH2Cl2 (50 мл). Органическую фазу промывают с помощью Н 2 О и рассолом, затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают промежуточный продукт 2.2 в виде белого аморфного вещества; ЭР-МС: М+Н=432; ВЭЖХ: CtRet=3,50 мин. Промежуточный продукт 2.3 К раствору (3R,5S)-изомера исходного вещества F (293 мг, 1,02 ммоль) в ТГФ (10 мл) при 0 С добавляют Et3N (206 мг, 2,04 ммоль) и TcBocCl (488 мг, 2,04 ммоль). После перемешивания при такой же температуре в течение 1 ч при 0 С добавляют MgBr2Et2O (527 мг, 2,04 ммоль) и промежуточный продукт 1.4 (180 мг, 1,02 ммоль), затем смесь перемешивают при комнатной температуре. После перемешивания в течение 3 ч реакцию останавливают 5% водным раствором KHSO4 (50 мл) и смесь экстрагируют с помощью EtOAc (100 мл). Органическую фазу промывают с помощью Н 2 О и рассолом и затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и полученный остаток очищают с помощью колоночной хроматографии на SiO2, получают промежуточный продукт 2.3 в виде белого аморфного вещества; ЭР-МС: М+Н=446; ВЭЖХ: CtRet=3,86 мин. Промежуточный продукт 2.4 Промежуточный продукт 2.4 синтезируют путем удаления защитной группы из промежуточного продукта 2.5 аналогично получению соединения примера 1; ЭР-МС: М+Н=172: BtRet=1,55 мин. Промежуточный продукт 2.5 К раствору имеющегося в продаже N-Boc-L-циклогексилглицинола (499 мг, 2,05 ммоль) в ДМФ (8 мл) в атмосфере N2 при КТ добавляют NaH (164 мг, 4,10 ммоль) и при 0 С EtI (179 мкл, 2,26 ммоль). Реакционную смесь перемешивают при КТ в течение 2 ч. Затем к полученному раствору добавляют Н 2 О. Водную фазу экстрагируют с помощью CH2Cl2. Объединенные органические фазы сушат над Na2SO4. Концентрирование при пониженном давлении с последующей очисткой с помощью колоночной хроматографии на силикагеле дает промежуточный продукт 2.5: белое аморфное вещество; ЭР-МС: М+Н=272: Смесь промежуточного продукта 3.1 (65 мг, 0,098 ммоль) и 4 М раствора HCl в диоксане (2 мл) перемешивают при комнатной температуре. После перемешивания в течение 1 ч реакционную смесь концентрируют в вакууме и получают соединение примера 3; ЭР-МС: М+Н=563: CtRet=4,21 мин. Промежуточный продукт 3.1 К раствору промежуточного продукта 3.2 (60 мг, 0,112 ммоль) и промежуточного продукта 1.7 (24 мг, 0,132 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавляют EDClHCl (32 мг, 0,168 ммоль),HOAt (23 мг, 0,168 ммоль) и Et3N (17 мг, 0,168 ммоль); затем смесь перемешивают при комнатной температуре. После перемешивания в течение 16 ч при такой же температуре реакционную смесь разбавляют с помощью Н 2 О (10 мл) и экстрагируют с помощью EtOAc (50 мл). Органическую фазу последовательно промывают 5% водным раствором NaHCO3 с помощью Н 2 О и рассолом и затем сушат надNa2SO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 3.1 в виде белого аморфного вещества; ЭР-МС: М+Н=663; ВЭЖХ: CtRet=4,83 мин. Промежуточный продукт 3.2 К раствору промежуточного продукта 3.3 (85 мг, 0,155 ммоль) в смеси ТГФ/Н 2 О (5/5 мл) при 0 С добавляют LiOHH2O (14 мг, 0,330 ммоль). После перемешивания при такой же температуре в течение 1 ч реакцию останавливают 5% водным раствором KHSO4 (20 мл) и смесь экстрагируют с помощью Et2O(100 мл). Органическую фазу промывают с помощью Н 2 О и рассолом и затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают промежуточный продукт 3.2 в виде белого аморфного вещества; ЭР-МС: М+Н=536; ВЭЖХ: CtRet=4,32 мин. Промежуточный продукт 3.3 К раствору (3R,5S)-изомера исходного вещества F (103 мг, 0,36 ммоль) в CH3CN (1 мл) при 0 С добавляют Et3N (43 мг, 0,43 ммоль) и TcBocCl (86 мг, 0,36 ммоль). После перемешивания при такой же температуре в течение 1 ч при 0 С добавляют MgBr2Et2O (112 мг, 0,43 ммоль) и промежуточный продукт 3.4 (100 мг, 0,36 ммоль), затем смесь перемешивают при комнатной температуре. После перемешивания в течение 24 ч реакцию останавливают 5% водным раствором KHSO4 и смесь экстрагируют с помощью EtOAc. Органическую фазу промывают с помощью Н 2 О и рассолом и затем сушат над Na2SO4.- 28016446 Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 3.3 в виде белого аморфного вещества; ЭР-МС: М+Н=550; ВЭЖХ: CtRet=4,65 мин. Промежуточный продукт 3.4 К раствору промежуточного продукта 3.5 (550 мг, 1,85 ммоль) в CH2Cl2 (20 мл) при 0 С добавляютEt3SiH (2,3 г, 10,8 ммоль) и ТФК (7,4 г, 64,5 ммоль). Полученную смесь перемешивают при комнатной температуре. После перемешивания в течение 15 ч реакционную смесь концентрируют в вакууме. Остаток суспендируют в 5% водном растворе NaHCO3 и экстрагируют с помощью CH2Cl2. Органическую фазу промывают с помощью Н 2 О и рассолом и затем сушат над Na2SO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 3.4 в виде белого аморфного вещества; ЭР-МС: М+Н=281; ВЭЖХ: CtRet=3,61 мин. Промежуточный продукт 3.5 К раствору промежуточного продукта 3.6 (574 мг, 1,7 ммоль) в ТГФ (18 мл) при 0 С добавляютMeMgBr (0,96 М раствор в эфире, 8,83 мл, 8,48 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 1 ч. После добавления воды смесь экстрагируют с помощью EtOAc, промывают водным раствором NaHCO3 и рассолом и сушат над MgSO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии наSiO2, и получают промежуточный продукт 3.5 в виде бесцветного масла; ЭР-МС: М+Н=297; ВЭЖХ: К раствору промежуточного продукта 3.7 (737 мг, 2,44 ммоль) в NMP (17 мл) добавляют K2CO3(1,69 г, 12,2 ммоль) и изобутиламин (535 мг, 7,32 ммоль) и полученную смесь перемешивают при 120 С в течение ночи. После добавления воды смесь экстрагируют с помощью EtOAc, промывают водой и рассолом и сушат над MgSO4. Органическую фазу концентрируют в вакууме и получают неочищенный остаток, который очищают с помощью колоночной хроматографии на SiO2, и получают промежуточный продукт 3.6 в виде бесцветных кристаллов; ЭР-МС: М+Н=339; ВЭЖХ: CtRet=3,94 мин. Промежуточный продукт 3.7 К раствору промежуточного продукта 3.8 (1 г, 4,07 ммоль) в ДМФ (15 мл) добавляют K2CO3 (1,69 г,12,2 ммоль) и изобутилйодид (1,5 г, 8,14 ммоль) и полученную смесь перемешивают при 60 С в течение 2 ч. Затем смесь разбавляют с помощью EtOAc, промывают водой, насыщенным водным растворомKHSO4, насыщенным водным раствором NaHCO3 и рассолом и сушат над MgSO4. Органическую фазу
МПК / Метки
МПК: C07D 401/12, A61K 31/4545, A61P 9/12
Метки: n5-(2-этоксиэтил)-n3-(2-пиридинил)-3,5-пиперидиндикарбоксамида, ингибиторов, применения, ренина, качестве, предназначенные, производные
Код ссылки
<a href="https://eas.patents.su/30-16446-proizvodnye-n5-2-etoksietil-n3-2-piridinil-35-piperidindikarboksamida-prednaznachennye-dlya-primeneniya-v-kachestve-ingibitorov-renina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные n5-(2-этоксиэтил)-n3-(2-пиридинил)-3,5-пиперидиндикарбоксамида, предназначенные для применения в качестве ингибиторов ренина</a>
Предыдущий патент: Ингибиторы p70 s6 киназы
Следующий патент: Соединение альфа-(n-сульфонамидо) ацетамида в качестве ингибитора продуцирования бета-амилоидного пептида
Случайный патент: Производные бензотиазинона и их применение в качестве антибактериальных средств