Производные бензотиазинона и их применение в качестве антибактериальных средств
Номер патента: 15910
Опубликовано: 30.12.2011
Авторы: Макаров Вадим А., Мелльманн Уте, Коул Стюарт Т.
Формула / Реферат
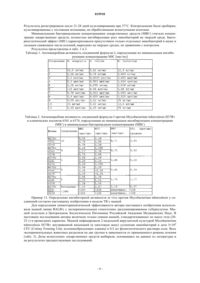
1. Соединение формулы (I)
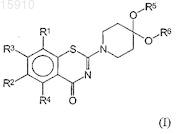
или его соль,
где R1и R2 являются, независимо друг от друга, NO2, CN, трифторметилом, галогеном, CONR7R8, COOR9, CHO, SO2NR7R8 или OCF3;
R3 и R4являются независимо друг от друга Н или метильной группой;
R5 и R6являются, независимо друг от друга, линейным или разветвленным алифатическим радикалом, имеющим 1-8 членов цепи, или R5и R6 вместе представляют собой двухвалентный радикал -(CR92)m-, где m равно 1-4, или R5 и R6вместе представляют собой двухвалентный радикал
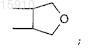
R7, R8и R9 являются независимо друг от друга Н или линейным или разветвленным алифатическим радикалом, имеющим 1-7 членов цепи, или фенилом.
2. Соединение формулы (I) по п.1, где R1 представляет собой NO2, R2 является CF3, R3 и R4являются Н, и R5 и R6 имеют значения, данные в п.1.
3. Соединение формулы (I) по п.1, где R1 представляет собой NO2, R2 является CN, R3и R4 являются Н, и R5и R6 имеют значения, данные в п.1.
4. Соединение формулы (I) по п.1, где R1 и R2представляют собой NO2, R3 и R4являются Н, и R5 и R6 имеют значения, данные в п.1.
5. Соединение формулы (I) по п.1, где R5 и R6являются независимо C1-8алкильными группами.
6. Соединение формулы (I) по п.1, выбранное из группы, состоящей из
2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,
2-(7,12-диокса-3-азаспиро[5,6]додец-3-ил)-6,8-динитро-1,3-бензотиазин-4-она,
2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-7-метил-6,8-динитро-1,3-бензотиазин-4-она,
2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,
2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6, 8-динитро-1,3-бензотиазин-4-она,
2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,
2-(4,4-диэтоксипиперидин-1-ил)-6,8-динитро-1,3-бензотиазин-4-она,
7-метил-2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,
2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,
2-(2,3-диметил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,
2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,
2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,
2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила.
7. 2-(2-Метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-он.
8. Применение соединения формулы I или его соли по любому из предшествующих пунктов для получения фармацевтической композиции.
9. Применение соединения по любому из пп.1-7 для получения лекарственного средства для терапевтического или профилактического лечения туберкулезной инфекции или инфекции проказы у млекопитающих.
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-7 и традиционный эксципиент.
11. Применение соединения по любому из пп.1-7 в способе терапевтического или профилактического лечения туберкулезной инфекции или инфекции проказы у млекопитающих.
12. Способ получения соединения формулы (I), включающий следующую стадию взаимодействия соединения формулы

где заместители R1, R2, R5 и R6имеют значения, определенные в п.1, и R3и R4 являются атомами водорода, с H2O/EtOH.
Текст
Дата публикации и выдачи патента Номер заявки Новые производные бензотиазина формулы (I) и их применение в качестве антибактериальных средств при инфекционных заболеваниях, вызванных бактериями, особенно туберкулеза (ТВ) и проказы, вызванных микобактериями, где R1 и R2 являются независимо друг от друга NO2,CN, трифторметилом, галогеном, CONRV, COOR9, CHO, SO2NR7R8 или OCF3; R3 и R4 являются независимо друг от друга Н или метильной группой; R5 и R6 являются независимо друг от друга линейным или разветвленным алифатическим радикалом, имеющим 1-8 членов цепи, или R5 иR6 вместе представляют собой двухвалентный радикал -(CR92)m-, где m равно 1-4, или R5 и R6 вместе представляют собой двухвалентный радикал, указанный в формуле изобретения; R7, R8 и R9 являются независимо друг от друга Н или линейным, или разветвленным алифатическим радикалом, имеющим 1-7 членов цепи, или фенилом.(71)(73) Заявитель и патентовладелец: ЛЯЙБНИЦ ИНСТИТЬЮТ ФОР НЭЧЕРАЛ ПРОДАКТ РЕСЕРЧ ЭНД ИНФЕКШН БАЙОЛОДЖИ Э. Ф. ХАНС-КНЕЛЛЬ-ИНСТИТУТ (ХКИ) 015910 Настоящее изобретение относится к новым производным бензотиазина и их применению в качестве антибактериальных средств при инфекционных заболеваниях млекопитающих (людей и животных), вызванных бактериями, особенно таких заболеваний как туберкулез (ТВ) и проказа, вызванные микобактериями. Тиазиноны, их производные и их применение в качестве антибактериальных средств, особенно против микобактерий (ТВ), выложено для публики, например, в AR 242567 A1, AU 3704400 А 1, СА 1322551 С 1 или ЕР 0245901 В 1. Как известно, наблюдается всемирный угрожающий рост инфекций туберкулеза микобактериями,развившими резистентность к доступным терапевтическим средствам (В.R.Bloom, J.L.Murray, Tuberculosis: commentary on a reemergent killer. Science 257, 1992, 1055-1064). Исключительно опасным является развитие микобактерий с множественной лекарственной резистентностью (MDR). Это микобактерий,резистентные к двум или более из наиболее активных противотуберкулезных лекарственных средств,изониазиду и рифампицину, но также и к стрептомицину, пиразинамиду и этамбутолу. В некоторых странах доля MDR-TB уже составляет более 20%. Вместе с увеличением общего числа заболеваний ТВ во всем мире это является причиной смерти приблизительно 3000000 человек в год. Для лечения таких заболеваний как ТВ или проказа настоятельно требуются новые лекарственные средства с новыми механизмами действия, особенно для преодоления лекарственной резистентности и для преодоления известных тяжелых побочных эффектов доступных лекарственных средств. Цель изобретения Настоящее изобретение имеет целью создание новых соединений с активностью против микобактерий в качестве новых сильных противотуберкулезных лекарственных средств для преодоления проблем,связанных с резистентностью и непереносимостью лекарственных средств. Решение технической проблемы Эту цель достигают предоставлением соединений формулы I или их соли,где R1 и R2 являются, независимо друг от друга, NO2, CN, трифторметилом, галогеном, CONR7R8,COOR9, CHO, SO2NR7R8 или OCF3;R3 и R4 являются, независимо друг от друга, Н или метильной группой;R5 и R6 являются, независимо друг от друга, линейным или разветвленным алифатическим радикалом, имеющим 1-8 членов цепи, или R5 и R6 вместе представляют собой двухвалентный радикал-(CR92)m-, где m равно 1-4, или R5 и R6 вместе представляют собой двухвалентный радикал:R7, R8 и R9 являются, независимо друг от друга, Н или линейным или разветвленным алифатическим радикалом, имеющим 1-7 членов цепи, или фенилом. В предпочтительном варианте осуществления настоящее изобретение относится к соединениям формулы (I), выбранным из группы, состоящей из 2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(4,4-диэтоксипиперидин-1-ил)-6,8-динитро-1,3-бензотиазин-4-она,7-метил-2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(2,3-диметил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,8-амино-2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-4-оксо-1,3-бензотиазин-6-карбонитрила и 8-амино-2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6-(трифторметил)-1,3-бензотиазин-4-она. Для синтеза соединений, являющихся целью настоящего изобретения, авторы разработали оригинальный способ синтеза 1,3-бензотиазин-4-она с применением дитиокарбаматных производных в качестве промежуточного соединения (способ А). Можно также применять классический способ синтеза 1,3 бензотиазин-4-она с применением тиоцианатных солей (способ В). Оба способа представлены на схеме,-1 015910 приведенной ниже. Неожиданно, соединения согласно изобретению проявляют сильную антибактериальную активность, особенно против микобактерий с минимальными концентрациями ингибирования (MIC) в диапазоне от 0,23 пг/мл до 10 мкг/мл для быстро растущих микобактерий, 0,195-1,56 мкг/мл для М. tuberculosis, включая штаммы с множественной резистентностью, определенными классическим способом, и 0,030 мкг/мл для М. tuberculosis H37Rv, определенной способом и использованием Alamar Blue. Неожиданно соединения согласно настоящему изобретению демонстрируют высокий уровень селективности только для микобактерий, что очень сильно уменьшает вероятность неблагоприятных побочных эффектов. В SOS-хромотесте было установлено, что соединения согласно настоящему изобретению являются немутагенными при 5 мг/мл. В модели туберкулезной инфекции у мышей in vivo соединения согласно настоящему изобретению были более терапевтически активными, чем главное противотуберкулезное лекарственное средство изониазид, примененный в качестве положительного контроля. Выжило 100% мышей. Все контрольные животные умерли до 33-го дня. Соединение согласно настоящему изобретению (особенно соединение 2 - пример 1 в описании вариантов осуществления), нетоксично после введения per os в дозах до 2000 мг/кг; оно хорошо переносилось животными в первые часы после введения и в течение последующих 24 ч. В течение 7 дней исследования соединение 2 не вызывало изменений в общем состоянии и поведении мышей, оно не влияло на двигательную и рефлекторную активность, циклы активности и покоя, груминг, потребление пищи, не было случаев смерти животных. Для соединения 2 величина LD50 составляет более 2000 мг/кг. Таким образом, соединения согласно настоящему изобретению можно применять для лечения туберкулезной инфекции и других микобактериальных инфекций у людей и животных. Соответственно, настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I. Кроме того, настоящее изобретение относится к соединению формулы I для применения в способе лечения бактериальных инфекций у животных. Предпочтительными соединениями формулы I для применения в таком способе являются соединения, конкретно названные выше. Соединения настоящего изобретения получают в применяемых лекарственных формах, приготавливая разбавленный раствор или суспензию в фармацевтически приемлемой водной, органической или водно-органической среде для местного или парентерального введения внутривенной, подкожной или внутримышечной инъекцией; или получают в форме таблетки, капсулы или водной суспензии с традиционными эксципиентами для перорального введения или в качестве суппозитория. Соединения можно применять в дозах от 0,001 до 1000 мг на кг массы тела. Примеры, которые следуют ниже в экспериментальной части, служат для иллюстрирования настоящего изобретения, но их не следует рассматривать как его ограничение. Структуры соединений согласно настоящему изобретению были установлены с помощью синтеза и элементного анализа, ядерного магнитного резонанса и/или масс-спектров, а также с помощью рентгеноструктурного анализа.-2 015910 Варианты осуществления Исходные материалы Химические реагенты и растворители приобретали у Lancaster Synthesis (Lancashire, Англия) или уAldrich (Sigma-Aldrich Company, St-Louis, США) и использовали в синтезе без дополнительной очистки. Температуры плавления не скорректированы, их определяли согласно процедуре Британской фармакопеи (Electrothermal 9001, Великобритания). Если в результатах анализов указаны только символы элементов, то такие результаты анализа находятся в пределах 0,3% теоретических значений (Carlo-Erba 5500, Италия). Спектры ЯМР определяли с помощью прибора Varian Unity Plus 400 (USA). Сдвиги для 1 Н-ЯМР приведены в ч./млн, по полю от TMS . Масс-спектры получали с использованием прибораFinnigan SSQ-700 (USA) с прямым впрыском. Реакции и чистоту соединений контролировали с помощью ТСХ с использованием алюминиевых пластинок Silicagel 60 F254 (Merck Co, Германия). Пример 1. 2-(1,4-Диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-он,(соединение 1) Способ А. К перемешиваемым 50 мл раствора 25% водного аммиака по каплям добавляли раствор 5 г 2-хлор 3-нитро-5-трифторметилбензоилхлорида (D.E.Welch, R.R.Baron, В.A.Burton, J. Med. Chem. 12; 2; 1969; 299-303) в ацетонитриле (10 мл) при -20 С. Спустя 10 мин добавляли 50 мл этилацетата. Органическую фазу отделяли, дважды промывали водой, сушили над Na2SO4, обрабатывали активированным углем,фильтровали и концентрировали в вакууме. Неочищенный продукт очищали кристаллизацией из этанола. Выход 2-хлор-3-нитро-5-(трифторметил)бензамида составлял 92%. Т.пл. 195-197 С (метанол). Анализ: Рассчитано для C8H4ClF3N2O3: С, 35,78; Н, 1,50; N, 10,43 Найдено: С, 36,01; Н, 1,53; N, 10,39 0,5 г 2-хлор-3-нитро-5-(трифторметил)бензамида растворяли в 25 мл этанола. Реакционную смесь обрабатывали 0,5 г дигидрата натриевой соли 1,4-диокса-8-азаспиро[4.5]декан-8-карбодитионовой кислоты (Z. Ge, R. Li, T. Cheng, Synth. Commun., 29, 18, 1999, 3191-3196) и хранили в течение 18 ч при комнатной температуре. Затем ее выливали в 50 мл холодной воды и отфильтровывали образовавшийся желтый осадок. Чистый конечный продукт получали после двукратной перекристаллизации из этанола. 2(Аминокарбонил)-6-нитро-4-(трифторметил)фенил-1,4-диокса-8-азаспиро[4.5]декан-8-карбодитиоат является желтым кристаллическим твердым веществом. Выход 0,47 г-%. Т.пл. 138-140 С. Анализ: Рассчитано для C11H12N4O2S2: С, 42,57; Н, 3,57; N, 9,31; S, 14,21 Найдено: С, 42,61; Н, 3,67; N, 9,22; S, 14,30 0,4 г 2-(аминокарбонил)-6-нитро-4-(трифторметил)фенил-1,4-диокса-8-азаспиро[4.5]декан-8 карбодитиоата растворяли в 25 мл этанола. Реакционную смесь обрабатывали 0,32 г Na2HPO412H2O и кипятили с обратным холодильником в течение 6 ч. Затем ее охлаждали и светло-желтый осадок отфильтровывали и промывали 30 мл метанола. Чистый конечный продукт получали после двукратной перекристаллизации из этанола. 2-(1,4-Диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-трифторметил)-1,3 бензотиазин-4-он является светло-желтым кристаллическим твердым веществом. Выход 0,47 г-%. Т.пл. 211-212 С.Rf (гексан-ацетон; 2/1) - 0,35 МС m/z 417 (М+). 1 Н ЯМР (DMSO-d6)8,83 и 8,77 (два 1 Н, два с, 2 СН), 3,80 (8 Н, широкий с, N(CH2CH2)2C), 2,02 (4 Н,широкий с, OCH2CH2O) ч./млн. Анализ: Рассчитано для C16H14F3N3O5S: С, 4 6,04; Н, 3,38; N, 10,07; S, 7,68 Найдено: С, 45,94; Н, 3,37; N, 10,09; S, 7,76 Способ В. Процедура в деталях была такой же, как описано в J. Imrich, P. Kristian, Coll. Czech. Chem. Commun., 47, 1982, 3268-3282; D. Koscik, P. Kristian, J. Gonda, E. Dandarova, Coll. Czech. Chem. Commun., 48,1983, 3315-3328; D. Koscik, P. Kristian, O. Forgac, Coll. Czech. Chem. Commun., 48, 1983, 3427-3432; Т. H.Cronin, H.-J.E. Hess, Патент США 3522247. Выход 2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6 трифторметил)-1,3-бензотиазин-4-она составлял 0,21%. По спектроскопическим данным это соединение было идентичным соединению, синтезированному способом А. Пример 2. 2-(2-Метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3 бензотиазин-4-он (соединение 2) Следуя процедуре примера 1. Светло-желтое кристаллическое твердое вещество. Выход 54%. Т.пл. 192-3 С.-3 015910 Найдено: С, 47,36; Н, 3,80; N, 9,87; S, 7,51 Пример 3. 2-(1,4-Диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-он (соединение 3) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Светло-желтое кристаллическое твердое вещество. Выход 43%. Т.пл. 271-3 СH ЯМР (DMSO-d6)9,15 и 9,12 (два 1 Н, два с, 2 СН), 3,86 (8 Н, широкий с, N (СН 2 СН 2)2 С), 2,97 (4 Н,широкий с, ОСН 2 СН 2 О) ч./млн. Анализ: Рассчитано для C15H14N4O7S: С, 45,68; Н, 3,58; N, 14,21; S, 8,13 Найдено: С, 45,34; Н, 3,56; N, 14,30; S, 7,98 Пример 4. 2-(2-Метил-1,4-диокса-8-азаспиро[4.5]децил-8-ил)-6,8-динитро-1,3-бензотиазин-4-он (соединение 4) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Желтое кристаллическое твердое вещество. Выход 57%. Т.пл. 139-142 СRf (гексан-ацетон; 2/1) - 0,50. МС m/z 408 (М+). 1 Н ЯМР (DMSO-d6)9,08 и 9,11 (два 1 Н, два с, 2 СН), 4,23 (1 Н, м, СН), 4,10 (1 Н, м, СН), 4,06 (4 Н,широкий с, N(CH2)2), 3,43 (1 Н, т, СН), 3,27 (1 Н, с, СН), 1,80 (4 Н, широкий д, С(СН 2)2), 1,20 (3 Н, д, СН 3) ч./млн. Анализ: Рассчитано для C16H16N4O7S: С, 47,06; Н, 3,95; N, 13,72; S, 7,85 Найдено: С, 46,87; Н, 3,91; N, 13,57; S, 7,83 Пример 5. 2-(2,3-Диметил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3 бензотиазин-4-он (соединение 5) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Светло-желтое кристаллическое твердое вещество. Выход 58%. Т.пл. 205207 С (EtOH/DMF).Rf (гексан-ацетон; 2/1) - 0,55. МС m/z 44522 (М+) . 1 Н ЯМР (DMSO-d6)8,82 и 8,77 (два 1 Н, два с, 2 СН), 3,86 (4 Н, широкий с, N(CH2)2), 3,45-3,53 (2 Н,м, 2 СН), 2,41 (4 Н, широкий д, С(СН 2)2), 1,13-1,17 (6 Н, м, 2 СН 3) ч./млн. Анализ: Рассчитано для C18H18F3N3O5S: С, 48,54; Н, 4,07; N, 9,43; S, 7,20 Найдено: С, 48,66; Н, 4,12; N, 9,32; S, 7,46 Пример 6. 2-(4,4-Диэтоксипиперидин-1-ил)-6,8-динитро-1, 3-бензотиазин-4-он (соединение 6) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Желтое кристаллическое твердое вещество. Выход 32%. Т.пл. 179-181 С (изоPrOH).H ЯМР (DMSO-d6)9,08 и 9,11 (два 1 Н, два с, 2 СН), 3,60-3,67 (4 Н, м, N(CH2)2), 2,11-2,08 (4 Н, м,С(СН 2)2), 3,47 и 3,57 (два 2 Н, кв., 2 ОСН 2), 1,16 (6 Н, т, 2 СН 3), ч./млн. Анализ: Рассчитано для C17H20N4O7S: С, 48,11; Н, 4,75; N, 13,20; S, 7,56 Найдено: С, 48,12; Н, 4,73; N, 13,41; S, 7,67 Пример 7. 2-(7,12-Диокса-3-азаспиро[5,6]додец-3-ил)-6,8-динитро-1, 3-бензотиазин-4-он (соединение 7) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Желтое кристаллическое твердое вещество. Выход 51%. Т.пл. 193-195 С (изоPrOH/DMF).H ЯМР (DMSO-d6)8,97 и 9,16 (два 1 Н, два с, 2 СН), 3,57-3,74 (8 Н, м, 4 СН 2), 1,93-2,35 (8 Н, м,4 СН 2) ч/млн. Анализ: Рассчитано для C17H18N4O7S: С, 48,34; Н, 4,30; N, 13,2 6; S, 7,56 Найдено: С, 48,21; Н, 4,43; N, 13,30; S, 7,66 Пример 8. 2-(1,4-Диокса-8-азаспиро[4.5]дец-8-ил)-7-метил-6,8-динитро-1,3-бензотиазин-4-он (соединение 8) Следуя процедуре примера 1 с использованием 2-гидрокси-3,5-динитробензойной кислоты в качестве исходного материала. Желтое кристаллическое твердое вещество. Выход 51%. Т.пл. 207-210 С (изоPrOH/DMF).(соединение 9) К перемешиваемому раствору 5 г (19 ммоль) 2-гидрокси-5-иодбензойной кислоты в 50 мл DMF небольшими порциями добавляли 5 г (22 ммоль) сухого CuCN (I) . Реакционную смесь кипятили с обратным холодильником в течение 5 ч и добавляли 100 мл воды и 50 мл этилацетата. После этого очень осторожно, в условиях хорошей вентиляции, добавляли концентрированную хлористо-водородную кислоту до рН 3. Органическую фазу отделяли, дважды промывали в воде, сушили над Na2SO4, обрабатывали активированным углем, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали кристаллизацией из воды. Выход 5-циано-2-гидроксибензойной кислоты составлял 71%. Затем следовала процедура примера 1. Выход 44%. Т.пл. 217-220 С (EtOH/DMF).H ЯМР (DMSO-d6)8,74 и 8,67 (два 1 Н, два с, 2 СН), 3,41 (8 Н, широкий с, N(CH2CH2)2C), 2,93 (4H,широкий с, ОСН 2 СН 2 О) ч./млн. Анализ: Рассчитано для C16H14N4O5S: С, 51,33; Н, 3,77; N, 14,97; S, 8,57 Найдено: С, 51,30; Н, 3,84; N, 14,89; S, 8,62 Пример 10. 2-(2-Метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6 карбонитрил (соединение 10) Следуя процедуре примера 9. Желтое кристаллическое твердое вещество. Выход 34%. Т.пл. 251253 С (EtOH/DMF).H ЯМР (DMSO-d6)8,73 и 8,61 (два 1 Н, два с, 2 СН) , 4,23 (1 Н, м, CH), 4,11 (1 Н, м, СН), 4,07 (4 Н,широкий с, N(CH2)2), 3,51 (1 Н, т, СН), 3,27 (1 Н, с, СН), 1,81 (4 Н, широкий д, С(СН 2)2), 1,22 (3 Н, д, СН 3) ч/млн. Анализ: Рассчитано для C17H16N4O5S: С, 52,57; Н, 4,15; N, 14,43; S, 8,26 Найдено: С, 52,42; Н, 4,08; N, 14,50; S, 8,27 Пример 11. 2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-4-оксо-1,3-бензотиазин-6 карбонитрил (соединение 11) Следуя процедуре примера 9. Желтое кристаллическое твердое вещество. Выход 40%. Т.пл. 230-232 С (EtOH/DMF).H ЯМР (DMSO-d6)8,74 и 8,61 (два 1 Н, два с, 2 СН), 3,29-3,65 (6 Н, м, 3 СН 2), 2,38 (4 Н, широкий с,2 СН 2) , 1,82-1,93 (4 Н, м, 2 СН 2) ч./млн. Анализ: Рассчитано для C17H16N4O5S: С, 52,57; Н, 4,15; N, 14,43; S, 8,26 Найдено: С, 52,52; Н, 4,11; N, 14,59; S, 8,13 Пример 12. Определение ингибиторной активности in vitro против микобактерий у соединений согласно настоящему изобретению Антибактериальную активность соединений против Mycobacterium smegmatis SG 987, М. aureumSB66, М. vaccae IMET 1010670 и М, fortuitum В испытывали посредством определения минимальных ингибирующих концентраций (MIC) способом микроразведений среды в среде Mueller-Hinton (Difco) согласно рекомендациям NCCLS [National Committee for Clinical Laboratory Standards: Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; 5th Ed.; Villanova, Ed.; Approved standard Document M7-A5. NCCLS, (2000)]. Активность против М. tuberculosis H37Rv испытывали следующим способом определения минимальных ингибирующих концентраций (MIC) и минимальных бактерицидных концентраций (МВС). Штаммы высевали на твердую среду Lowenstein-Jensen. Спустя 21 день выросшие культуры применяли для получения суспензии инокулята (посевного материала), соответствующей 5108 микробиальных клеток в мл. 0,2 мл этой суспензии инокулировали в пробирки с 2 мл жидкой среды Школьниковой, содержащей соответствующие концентрации испытуемых соединений, от 100,0 до 0,195 мг/мл. После 14 дней инкубации при 37 С пробирки с жидкой средой центрифугировали в течение 15 мин при 3000 об/мин. После отбрасывания супернатанта осадок ресуспендировали в 0,8 мл стерильного 0,9% NaCl. 0,1 мл суспензии использовали для получения мазков, которые затем окрашивали способом Циля-Нильсена. Оставшийся осадок высевали в 0,2-мл объемы в три пробирки с твердой средой Lowenstein-Jensen, свободной от лекарственных средств для определения минимальных бактерицидных концентраций (МВС). 1-5 015910 Результаты регистрировали после 21-28 дней культивирования при 37 С. Контрольными были пробирки,культивированные с тестовыми штаммами, не обработанными испытуемыми агентами. Минимальными бактерицидными концентрациями лекарственных средств (МВС) считали концентрации лекарственных средств, полностью ингибирующие рост микобактерий на твердой среде. Бактериостатический эффект (MIC) характеризовался присутствием только отдельных микобактерий в мазке и сильным снижением числа колоний, выросших на твердых средах, по сравнению с контролем. Результаты представлены в табл. 1 и 2. Таблица 1. Антимикробная активность соединений формулы I, определенная по минимальным ингибирующим концентрациям MIC [мкг/мл] Таблица 2. Антимикробная активность соединений формулы I против Mycobacterium tuberculosis H37Rv и клинических изолятов 6341 и 6374, определенная по минимальным ингибирующим концентрациям(MIC) и минимальным бактерицидным концентрациям (МВС) Пример 13. Определение ингибиторной активности in vivo против Mycobacterium tuberculosis у соединений согласно настоящему изобретению в модели ТВ у мышей Для определения химиотерапевтической эффективности авторы настоящего изобретения использовали мышей линии BALB/c с экспериментальным гематогенно диссеминированным туберкулезом. Мышей получали в Центральном Зоологическом Питомнике Российской Академии Медицинских Наук. В настоящее исследовании авторы включали только самцов мышей, стандартизованных по массе тела (2025 г) и прошедших карантин. Мышей инфицировали 2-недельной вирулентной культурой MycobacteriumCFU (Colony Forming Unit, колониеобразующих единиц) в 0,5 мл физиологического раствора соли. Всех экспериментальных животных разделяли на две группы в зависимости от примененного режима лечения(табл. 3). Дозы испытуемых лекарственных средств выбирали, основываясь на данных из литературы и на результатах предшествующих исследований. Лечение начинали на следующий день после инфицирования. Лекарственные средства вводили перорально в форме суспензии с карбоксиметилцеллюлозой в воде с небольшим количеством PEG-400. Химиотерапию применяли ежедневно 6 раз в неделю (кроме воскресенья). Животных забивали под эфирным наркозом. Для определения эффективности каждого режима лечения авторы регистрировали макроскопические изменения в паренхиматозных органах мышей, рост микобактерий из патологического материала на твердых средах, а также бактериоскопический индекс поражения органа. Авторы проводили качественный и количественный анализ макроскопических изменений в печени, селезенке и легких и рассчитывали индекс поражения (применяя четырехбалльную шкалу). Макроскопическую оценку эффективности каждого режима лечения выражали индексом эффективности, рассчитанным по формуле Индекс эффективности=100%-[(Индекс поражения в исследуемой группе)/(Индекс поражения в контрольной группе) ]100 Микробиологическое исследование включало культуру для определения CFU в паренхиматозных органах. Для этой цели авторы гомогенизировали правое легкое и отдельно селезенку с 6%-ной серной кислотой, центрифугировали, промывали водой и физиологическим раствором соли. Полученный материал (примерно 0,5 мл) разбавляли 1 мл физиологического раствора соли и гомогенизировали. Эту суспензию (0,5 мл) исследуемых органов разбавляли в 100 и 1000 раз физиологическим раствором соли и распределяли на твердой среде Finn-2. Культуры инкубировали при 37 С в течение 1 месяца при еженедельной регистрации, начиная с десятого дня. Колониеобразующие единицы (CFU's) подсчитывали после 28 дней. Данные макроскопических и микробиологических исследований паренхиматозных органов мышей,умерших во время эксперимента, также учитывали в общей оценке экспериментальных результатов,представленных в табл. 4-6. Таблица 4. Индексы поражения органов у мышей и эффективность лечения-7 015910 Таблица 5. Результаты микробиологического исследования правого легкого и селезенки экспериментальных мышей Все контрольные животные умерли до 33-го дня. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его соль,где R1 и R2 являются, независимо друг от друга, NO2, CN, трифторметилом, галогеном, CONR7R8,COOR9, CHO, SO2NR7R8 или OCF3;R3 и R4 являются независимо друг от друга Н или метильной группой;R5 и R6 являются, независимо друг от друга, линейным или разветвленным алифатическим радикалом, имеющим 1-8 членов цепи, или R5 и R6 вместе представляют собой двухвалентный радикал -8 015910(CR92)m-, где m равно 1-4, или R5 и R6 вместе представляют собой двухвалентный радикалR7, R8 и R9 являются независимо друг от друга Н или линейным или разветвленным алифатическим радикалом, имеющим 1-7 членов цепи, или фенилом. 2. Соединение формулы (I) по п.1, где R1 представляет собой NO2, R2 является CF3, R3 и R4 являются Н, и R5 и R6 имеют значения, данные в п.1. 3. Соединение формулы (I) по п.1, где R1 представляет собой NO2, R2 является CN, R3 и R4 являются Н, и R5 и R6 имеют значения, данные в п.1. 4. Соединение формулы (I) по п.1, где R1 и R2 представляют собой NO2, R3 и R4 являются Н, и R5 иR6 имеют значения, данные в п.1. 5. Соединение формулы (I) по п.1, где R5 и R6 являются независимо C1-8 алкильными группами. 6. Соединение формулы (I) по п.1, выбранное из группы, состоящей из 2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(7,12-диокса-3-азаспиро[5,6]додец-3-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-7-метил-6,8-динитро-1,3-бензотиазин-4-она,2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,2-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6, 8-динитро-1,3-бензотиазин-4-она,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(4,4-диэтоксипиперидин-1-ил)-6,8-динитро-1,3-бензотиазин-4-она,7-метил-2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6,8-динитро-1,3-бензотиазин-4-она,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(2,3-диметил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-она,2-(1,5-диокса-9-азаспиро[5.5]ундец-9-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила,2-(2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-4-оксо-1,3-бензотиазин-6-карбонитрила. 7. 2-(2-Метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил)-8-нитро-6-(трифторметил)-1,3-бензотиазин-4-он. 8. Применение соединения формулы I или его соли по любому из предшествующих пунктов для получения фармацевтической композиции. 9. Применение соединения по любому из пп.1-7 для получения лекарственного средства для терапевтического или профилактического лечения туберкулезной инфекции или инфекции проказы у млекопитающих. 10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-7 и традиционный эксципиент. 11. Применение соединения по любому из пп.1-7 в способе терапевтического или профилактического лечения туберкулезной инфекции или инфекции проказы у млекопитающих. 12. Способ получения соединения формулы (I), включающий следующую стадию взаимодействия соединения формулы
МПК / Метки
МПК: C07D 491/10, A61K 31/5415, A61P 31/04, C07D 417/04
Метки: бензотиазинона, качестве, применение, производные, антибактериальных, средств
Код ссылки
<a href="https://eas.patents.su/10-15910-proizvodnye-benzotiazinona-i-ih-primenenie-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензотиазинона и их применение в качестве антибактериальных средств</a>